Производные 1-[алкил]-, 1-[(гетероарил)алкил]- и 1-[(арил)алкил]-7-(пиримидин-4-ил)имидазо[1, 2-a]пиримидин-5(1н)-она
Формула / Реферат
1. Производное имидазо[1,2-а]пиримидона, представленное формулой (I), или его соль, или сольват, или гидрат

где X представляет собой связь, метиленовую группу, возможно замещенную одной или двумя группами, выбранными из С1-6алкильной группы, гидроксильной группы и С1-4алкоксильной группы; карбонильную группу;
R1 представляет собой 2, 4 или 5-пиримидинил, возможно замещенный С1-4алкильной группой, С1-4 алкоксильной группой или атомом галогена;
R2 представляет собой C1-6алкильную группу, С1-2пергалогенированную алкильную группу, С1-3галогенированную алкильную группу, бензильную группу, бензольное кольцо, нафталиновое кольцо, 5,6,7,8-тетрагидронафталиновое кольцо, причем бензильная группа и кольца возможно замещены заместителями, выбранными из С1-6алкильной группы, атома галогена, С1-2пергалогенированной алкильной группы, C1-3галогенированной алкильной группы, гидроксильной группы, С1-4алкоксильной группы, нитро, циано, амино, взятыми в количестве от 1 до 4 и
n представляет собой 0-3.
2. Производное имидазо[1,2-а]пиримидона, представленное формулой (I), или его соль, или сольват, или гидрат по п.1, где R1 представляет собой незамещенное 4-пиримидиновое кольцо.
3. Производное имидазо[1,2-а]пиримидона, представленное формулой (I), или его соль, или сольват, или гидрат по п.1 или 2, где R2 представляет собой бензольное кольцо, нафталиновое кольцо или 5,6,7,8-тетрагидронафталиновое кольцо, причем кольца возможно замещены.
4. Производное имидазо[1,2-а]пиримидона, которое выбрано из группы, состоящей из
1-(3-фенилпропил)-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-она;
1-[3-(2-фторфенил)пропил]-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-она;
1-[2-(4-фтор-2-метоксифенил)этил]-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она;
1-[2-(4-метоксифенил)этил]-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она;
1-[2-(4-метилфенил)этил]-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она;
1-(2-нафталин-1-илэтил)-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она;
1-[2-(3-фторфенил)этил]-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она;
1-[2-(3-хлорфенил)этил]-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она;
1-[2-(2-метоксифенил)этил]-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она;
4-[2-(5-оксо-7-(пиримидин-4-ил)-5Н-имидазо[1,2-а]пиримидин-1-ил)этил]бензонитрила;
1-(2-гидрокси-2-фенилэтил)-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она;
1-(2-оксо-2-фенилэтил)-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она;
1-[2-(4-фторфенил)этил]-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-она;
1-[2-(4-этоксифенил)этил]-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она или
1-[2-(2,5-диметоксифенил)этил]-7-(пиримидин-4-ил)-1Н-имидазо[1,2-а]пиримидин-5-она,
или их соли, сольвата или гидрата.
5. Производное 7-(пиримидинил)имидазо[1,2-а]пиримидин-5(1H)-она формулы (III)
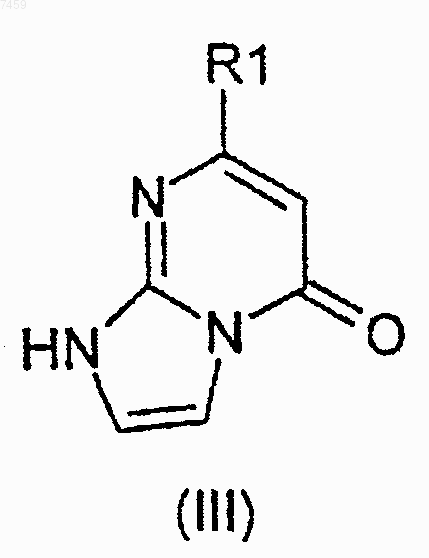
где R1 представляет собой 2-, 4- или 5-пиримидиновое кольцо, возможно замещенное С1-4алкильной группой, С1-4алкоксильной группой или атомом галогена.
6. Лекарственное средство, включающее в себя в качестве активного ингредиента вещество, выбранное из группы, состоящей из производного имидазо[1,2-а]пиримидона, представленного формулой (I), или его солей, или его сольватов, или его гидратов по пп.1-4.
7. Ингибитор киназы синтетазы гликогена 3b (КСГ3b), выбранный из группы производного имидазо[1,2-а]пиримидона, представленного формулой (I), или его солей, или его сольватов, или его гидратов по пп.1-4.
8. Применение соединения по пп.1-4 для приготовления лекарственного средства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью КСГ3b.
9. Применение соединения по пп.1-4 для приготовления лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративного заболевания.
10. Применение соединения по п.9, где нейродегенеративное заболевание выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, тауопатий, васкулярной деменции; острого паралича, травматических повреждений; цереброваскулярных случаев, травмы головного мозга, травмы позвоночника; периферических нейропатий; ретинопатии или глаукомы.
11. Применение соединения по пп.1-4 для приготовления лекарственного средства для профилактического и/или терапевтического лечения инсулиннезависимых диабетов, ожирения, маниакально-депрессивного заболевания, шизофрении, алопеции или злокачественных новообразований.
12. Применение по п.11, где злокачественное новообразование представляет собой рак груди, немелкоклеточную карциному легких, рак щитовидной железы, Т- или В-клеточную лейкемию или опухоли, вызванные вирусами.
Текст
007459 Область техники Настоящее изобретение относится к соединениям, которые полезны в качестве активного ингредиента лекарства для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, вызванных аномальной активностью GSK3. Предшествующий уровень техники Гликоген-синтаза-киназа 3 (glycogen synthase kinase 3, GSK3) представляет собой контролируемую пролином серин-треонинкиназу, которая играет важную роль в контроле метаболизма, дифференцировки и жизнеспособности. Изначально ее идентифицировали как фермент, способный фосфорилировать и, следовательно, ингибировать гликоген-синтазу. Позже ее идентифицировали как GSK3, которая идентична киназе тау-белка 1 (tau protein kinase 1, ТРК 1), представляющему собой фермент, который фосфорилирует тау-белок в эпитопах, которые, как также было обнаружено, гиперфосфорилируются при болезни Альцгеймера и при отдельных таупатиях. Интересно, что фосфорилирование GSK3 протеинкиназой В (АКТ) приводит в результате к потере ее киназной активности, и было выдвинуто предположение, что такое ингибирование может опосредовать некоторые действия нейротрофических факторов. Кроме того, фосфорилирование -катенинаGSK3, представляющего собой белок, вовлеченный в выживание клетки, приводит в результате к его разрушению посредством протеосомного пути, зависимого от убиквитинилирования. Таким образом, по-видимому это ингибирование активности GSK3 может приводить в результате к нейротрофической активности. Действительно, существует доказательство того, что литий, представляющий собой неконкурентный ингибитор GSK3, усиливает нейритогенез в некоторых моделях и также увеличивает выживание нейронов путем индукции факторов выживания, таких как Всl-2, и ингибирования экспрессии проапоптотических факторов, таких как Р 53 и Вах. Недавние исследования продемонстрировали, что -амилоид усиливает активность GSK3 и фосфорилирование тау-белка. Кроме того, такое гиперфосфорилирование, а также нейротоксические действия -амилоида блокируются хлоридом лития и антисмысловой мРНК GSK3. Эти наблюдения четко свидетельствуют о том, что GSK3 может представлять собой связующее звено между двумя основными патологическими процессами при болезни Альцгеймера: аномальным процессингом белка предшественника амилоидного пептида (АРР) и гиперфосфорилированием тау-белка. Хотя гиперфосфорилирование тау-белка приводит в результате к дестабилизации нейронального цитоскелета, патологические последствия аномальной активности GSK3, наиболее вероятно, являются не только следствием патологического фосфорилирования тау-белка, поскольку, как упомянуто выше,избыточная активность этой киназы может оказывать влияние на выживание посредством модулирования экспрессии апоптотических и антиапоптотических факторов. Кроме того, было показано, что индуцируемое -амилоидом увеличение активности GSK3 приводит в результате к фосфорилированию и,следовательно, ингибированию пируватдегидрогеназы, представляющей собой основной фермент в производстве энергии и синтезе ацетилхолина. В целом, эти экспериментальные наблюдения указывают на то, что GSK3 может найти применение при лечении нейропатологических последствий и нарушений познавательной способности и дефиците внимания, ассоциированных с болезнью Альцгеймера, а также другими острыми и хроническими нейродегенеративными заболеваниями. Последние включают в себя болезнь Паркинсона, тауопатии (например лобно-височная деменция, кортикобазальная дегенерация, болезнь Пика, прогрессирующий супрануклеарный паралич) и другую деменцию, включая сосудистую деменцию; острый паралич и другие травматические повреждения; цереброваскулярные случаи (например, возрастная дегенерация желтого пятна); травму головного мозга и позвоночника; периферические нейропатии; ретинопатии и глаукому. В дополнение, GSK3 может найти применение при лечении других заболеваний, таких как инсулиннезависимый диабет (такой как диабет II типа) и ожирение; маниакально-депрессивный психоз; шизофрения; алопеция; злокачественные новообразования, такие как рак груди, немелкоклеточная карцинома легких, рак щитовидной железы, Т- или В-клеточная лейкемия и некоторые опухоли, вызванные вирусами. Описание изобретения Задача настоящего изобретения заключается в том, чтобы предложить соединения, полезные в качестве активного ингредиента лекарства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3, в частности нейродегенеративных заболеваний. Более конкретно, задача заключается в том, чтобы предложить новые соединения, полезные в качестве активного ингредиента лекарства, которые дают возможность для профилактики и/или лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Таким образом, авторы настоящего изобретения идентифицировали соединения, обладающие ингибирующей GSK3 активностью. Как результат, авторы обнаружили, что соединения, представленные следующей формулой (I), обладают желаемой активностью и полезны в качестве активного ингредиента лекарства для профилактического и/или терапевтического лечения вышеупомянутых заболеваний.-1 007459 Таким образом, в настоящем изобретении предложены производные имидазо[1,2-а]пиримидона,представленные формулой (I), или их соли, их сольваты или их гидраты где X представляет собой связь, этениленовую группу, этиниленовую группу, метиленовую группу, возможно замещенную одной или двумя группами, выбранными из С 1-6 алкильной группы, гидроксильной группы и C1-4 алкоксильной группы; карбонильную группу, атом киcлорода, атом серы, сульфонильную группу, сульфоксидную группу или атом азота, возможно замещенный С 1-6 алкильной группой;R1 представляет собой 2-, 4- или 5-пиримидиновое кольцо, возможно замещенное С 1-4 алкильной группой, С 1-4 алкоксильной группой или атомом галогена;R2 представляет собой С 1-6 алкильную группу, С 1-2 пергалогенированную алкильную группу, C1-3 галогенированную алкильную группу, бензильную группу, бензольное кольцо, нафталиновое кольцо, 5,6,7,8 тетрагидронафталиновое кольцо, пиридиновое кольцо, индольное кольцо, пиррольное кольцо, тиофеновое кольцо, фурановое кольцо или имидазольное кольцо, причем бензильная группа и кольца возможно замещены заместителями в количестве от 1 до 4, выбранными из С 1-6 алкильной группы, бензольного кольца, атома галогена, С 1-2 пергалогенированной алкильной группы, C1-3 галогенированной алкильной группы, гидроксильной группы, С 1-4 алкоксильной группы, нитро, циано, амино, C1-6 моноалкиламиногруппы или С 2-10 диалкиламиногруппы иn равен от 0 до 3. В соответствии с еще одним аспектом настоящего изобретения, предложено лекарство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из производных пиримидона, представленных формулой (I), и их физиологически приемлемых солей, и их сольватов и их гидратов. В качестве предпочтительных воплощений лекарства предложено вышеупомянутое лекарство, которое применяют для профилактического и/или терапевтического лечения заболеваний, вызванных аномальной активностью GSK3, и вышеупомянутое лекарство, которое применяют для профилактического и/или терапевтического лечения нейродегенеративных заболеваний и, кроме того, других заболеваний,таких как: инсулиннезависимый диабет (такой как диабет II типа) и ожирение; маниакальнодепрессивный психоз; шизофрения; алопеция; злокачественные новообразования, такие как рак груди,немелкоклеточная карцинома легких, рак щитовидной железы, Т- или В-клеточная лейкемия и некоторые опухоли, вызванные вирусами. В качестве других предпочтительных воплощений настоящего изобретения, предложено вышеупомянутое лекарство, где заболевания представляют собой нейродегенеративные заболевания и выбраны из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, тауопатий (например лобно-височной деменции, кортикобазальной дегенерации, болезни Пика, прогрессирующего супрануклеарного паралича) и другой деменции, включая васкулярную деменцию; острого паралича и других травматических повреждений; цереброваскулярных случаев (например, возрастной дегенерации желтого пятна); травмы головного мозга и позвоночника; периферических нейропатий; ретинопатии и глаукомы, и вышеупомянутое лекарство в форме фармацевтической композиции, содержащей вышеуказанное вещество в качестве активного ингредиента вместе с одним или более чем одним фармацевтическим вспомогательным веществом. В настоящем изобретении, кроме того, предложен ингибитор активности GSK3, включающий в себя в качестве активного ингредиента вещество, выбранное из группы, состоящей из производных имидазо[1,2-а]пиримидона формулы (I), и его солей, и их сольватов, и их гидратов. В соответствии с дополнительными аспектами настоящего изобретения, предложен способ профилактического и/или терапевтического лечения нейродегенеративных заболеваний, вызванных аномальной активностьюGSK3, при котором осуществляют стадию введения пациенту профилактически и/или терапевтически эффективного количества вещества, выбранного из группы, состоящей из производных имидазо[1,2-а]пиримидона формулы (I), и их физиологически приемлемых солей, и их сольватов, и их гидратов; и применение вещества,выбранного из группы, состоящей из производных имидазо[1,2-а]пиримидона формулы (I), и их физиологически приемлемых солей, и их сольватов, и их гидратов, для приготовления вышеупомянутого лекарства. Как они использованы здесь, C1-6 алкильная группа, представляет собой линейную или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода, например метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу,втор-бутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, неопен-2 007459 тильную группу, 1,1-диметилпропильную группу, н-гексильную группу, изогексильную группу и тому подобное; С 1-4 алкоксильная группа представляет собой алкоксильную группу, имеющую от 1 до 4 атомов углерода, например, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу,изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу и тому подобное; атом галогена представляет собой атом фтора, хлора, брома или йода; С 1-2 пергалогенированная алкильная группа представляет собой алкильную группу, где все атомы водорода замещены атомом галогена, например, CF3 или C2F5;C1-3 галогенированная алкильная группа представляет собой алкильную группу, где по меньшей мере один атом водорода не замещен атомом галогена;C1-6 моноалкиламиногруппа представляет собой аминогруппу, замещенную одной С 1-6 алкильной группой, например, метиламиногруппу, этиламиногруппу, пропиламиногруппу, изопропиламиногруппу,бутиламиногруппу, изобутиламиногруппу, трет-бутиламиногруппу, пентиламиногруппу и изопентиламиногруппу; С 2-10 диалкиламиногруппа представляет собой аминогруппу, замещенную двумя С 1-5 алкильными группами, например диметиламиногруппу, этилметиламиногруппу, диэтиламиногруппу, метилпропиламиногруппу и диизопропиламиногруппу; метиленовая группа представляет собой двухвалентную группу формулы -СН 2-; этениленовая группа представляет собой двухвалентную группу формулы этиниленовая группа представляет собой двухвалентную группу формулы уходящая группа представляет собой группу, которая может быть легко отщеплена и замещена, такая группа может представлять собой, например, тозилокси, мезилокси, бромид и тому подобное. Соединения, представленные вышеупомянутой формулой (I), могут образовывать соль. Примеры соли включают в себя, когда существует кислотная группа, соли щелочных металлов и щелочноземельных металлов, таких как литий, натрий, калий, магний и кальций; соли аммония и аминов, таких как метиламин, диметиламин, триметиламин, дициклогексиламин, трис(гидроксиметил)аминометан,N,N-бис(гидроксиэтил)пиперазин, 2-амино-2-метил-1-пропанол, этаноламин, N-метилглюкамин и Lглюкамин; или соли основных аминокислот, таких как лизин, 6-гидроксилизин и аргинин. Соли присоединения основания кислотных соединений получают с использованием стандартных способов, хорошо известных из уровня техники. Когда присутствует основная группа, примеры включают в себя соли с неорганическими кислотами, такими как соляная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота; соли с органическими кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, пара-толуолсульфоновая кислота, уксусная кислота, пропионовая кислота, винная кислота, фумаровая кислота, малеиновая кислота, яблочная кислота, щавелевая кислота, янтарная кислота, лимонная кислота, бензойная кислота, миндальная кислота, коричная кислота, молочная кислота, гликолевая кислота, глюкуроновая кислота, аскорбиновая кислота, никотиновая кислота и салициловая кислота; или соли с кислыми аминокислотами, такими как аспарагиновая кислота и глутаминовая кислота. Соли присоединения кислоты основных соединений получают с использованием стандартных способов, хорошо известных из области техники, но не ограничены ими, при которых растворяют свободное основание в водном спиртовом растворе, содержащем соответствующую кислоту, и выделяют соль путем упаривания раствора или путем осуществления взаимодействия свободного основания и кислоты в органическом растворителе, при этом соль выделяют непосредственно, либо ее осаждают вторым органическим растворителем, либо она может быть получена путем концентрирования раствора. Кислоты,которые могут быть использованы для получения солей присоединения кислоты, включают в себя, предпочтительно, те кислоты, которые при объединении со свободным, основанием дают фармацевтически приемлемые соли, то есть соли, анионы которых относительно безвредны для организма животного в фармацевтических дозах солей, так что полезные свойства, присущие свободному основанию, не нарушаются побочными действиями, которые могут быть приписаны анионам. Хотя предпочтительными являются приемлемые для медицины соли основных соединений, все соли присоединения кислоты входят в объем настоящего изобретения. В дополнение к производным имидазо[1,2-а]пиримидона, представленным вышеупомянутой формулой (I), и их солям, в объем настоящего изобретения также входят их сольваты и гидраты. Производные имидазо[1,2-а]пиримидона, представленные вышеупомянутой формулой (I), могут иметь один или-3 007459 более чем один асимметрический атом углерода. Относительно стереохимии таких асимметрических атомов углерода, она может независимо представлять собой или (R)-, или (S)-конфигурацию, и производное имидазо[1,2-а]пиримидона может существовать в виде стереоизомеров, таких как оптические изомеры или диастереоизомеры. Любые стереоизомеры в чистой форме, любые смеси стереоизомеров,рацематы и тому подобное находятся в объеме настоящего изобретения. Примеры предпочтительных соединений по настоящему изобретению представлены в табл. 1, приведенной ниже. Тем не менее, объем настоящего изобретения не ограничивается этими соединениями. Предпочтительные соединения по настоящему изобретению, представленные формулой (I), также включают в себя:(1) соединения, где R1 представляет собой 4- или 5-пиримидиновое кольцо и, более предпочтительно 4-пиримидиновое кольцо, которое может быть замещено С 1-2 алкильной группой, С 1-2 алко-ксильной группой или атомом галогена; и/или(2) X представляет собой связь, метиленовую группу, возможно замещенную карбонильной группой. Более предпочтительные соединения по настоящему изобретению, представленные формулой (I),также включают в себя:(1) соединения, где R1 представляет собой незамещенное 4-пиримидиновое кольцо; и/или(2) соединения, где R2 представляет собой бензольное кольцо, нафталиновое кольцо или 5,6,7,8 тетрагидронафталиновое кольцо; более предпочтительно, бензольное кольцо или нафталиновое кольцо; причем кольца возможно замещены; и/или(3) соединения, где X представляет собой незамещенную метиленовую группу или карбонильную группу. Особенно предпочтительные соединения по настоящему изобретению, представленные формулой(I), включают в себя: 1. 1-(3-фенилпропил)-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-он; 2. 1-[3-(2-фторфенил)пропил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-он; 3. 1-[2-(4-фтор-2-метоксифенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-он; 4. 1-[2-(4-метоксифенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-он; 5. 1-[2-(4-метилфенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-он; 6. 1-(2-нафталин-1-ил-этил)-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-он; 7. 1-[2-(3-фторфенил)этил]-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-он; 8. 1-[2-(3-хлорфенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-он; 9. 1-[2-(2-метоксифенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-он; 10. 4-[2-(5-оксо-7-(пиримидин-4-ил)-5H-имидазо[1,2-а]пиримидин-1-ил)этил]бензонитрил; 11. 1-(2-гидрокси-2-фенилэтил]-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-он; 12. 1-(2-оксо-2-фенилэтил)-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-он; 13. 1-[2-(4-фторфенил)этил]-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-он; 14. 1-[2-(4-этоксифенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-он; 15. 1-[2-(2,5-диметоксифенил)этил]-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-он. В качестве еще одного объекта, настоящее изобретение также относится к способам получения имидазо[1,2-а]пиримидоновых соединений, представленных вышеупомянутой формулой (I). Эти соединения могут быть получены, например, в соответствии со способами, изложенными ниже. Способ получения Имидазо[1,2-а]пиримидоновые соединения, представленные вышеупомянутой формулой (I), могут быть получены в соответствии со схемой 1. Схема 1(В вышеприведенной схеме определение R1, R2, X и n является таким же, как уже описано для соединения формулы (I. 7-(Пиримидинил)имидазо[1,2-а]пиримидин-5(1H)-оновому производному, представленному вышеприведенной формулой (III), где R1 является таким, как определено для соединения формулы (I), дают возможность вступать в реакцию с основанием, таким как гидрид натрия, карбонат натрия или карбонат калия в растворителе, таком как N,N-диметилформамид, N-метилпирролидин, N,N-диметилацетамид или хлороформ, при подходящей температуре, изменяющейся в диапазоне от 0 до 130 С, в обычной атмосфере, затем с соединением формулы (II), где R2, X и n являются такими, как определено для соединения-4 007459 формулы (I), и L представляет собой уходящую группу, предпочтительно группу бромид или мезилокси,для получения соединения вышеупомянутой формулы (I). Соединение формулы (II) имеется в продаже или может быть синтезировано в соответствии со способами, хорошо известными специалистам в данной области техники. Соединение формулы (III) может быть получено в соответствии со способом, охарактеризованным на схеме 2. Схема 2(На приведенной выше схеме определение R1 является таким же, как уже было описано). В соответствии с этим способом, 3-кетоэфиру формулы (V), где R представляет собой алкильную группу, такую как, например, метильная или этильная группа, дают возможность вступать в реакцию с 2 аминоимидазолом формулы (IV). Данное взаимодействие может быть осуществлено в присутствии соли аммония, такой как ацетат аммония, в спиртовом растворителе, таком как метанол, этанол и тому подобное, или без него, при подходящей температуре, изменяющейся в диапазоне 25-140 С, в обычной атмосфере. Соединение формулы (IV) имеется в продаже, соединение формулы (V) может быть синтезировано по аналогии со способом, описанном в патенте DE2705582. Например, соединения формулы (V), где R1 представляет собой пиримидиновое кольцо, возможно замещенное С 1-4 алкильной группой, C1-4 алкоксильной группой или атомом галогена, могут быть получены путем осуществления взаимодействия пиримидинил-4-карбоновой кислоты, возможно замещенной С 1-4 алкильной группой, С 1-4 алкоксильной группой или атомом галогена, с моноэфиром малоновой кислоты. Это взаимодействие может быть осуществлено с использованием способов, хорошо известных специалистам в данной области техники, таких как, например, в присутствии агента сочетания, такого как 1,1'-карбонилбис-1 Н-имидазол, в растворителе, таком как тетрагидрофуран, при температуре, изменяющейся в диапазоне от 20 до 70 С. В приведенных выше реакциях иногда может быть необходимо введение защиты или удаление защиты с функциональной группы. Подходящая защитная группа Pg может быть выбрана в зависимости от типа функциональной группы, и может быть использован способ, описанный в литературе. Примеры защитных групп, способов введения и удаления защиты приведены, например, в Protective groups in Organic Synthesis Greene et al., 2nd Ed. (John WileySons, Inc., New York). Соединения по настоящему изобретению обладают ингибирующей GSK3 активностью. Соответственно, соединения по настоящему изобретению полезны в качестве активного ингредиента для приготовления лекарства, которое дает возможность для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3, и, более конкретно, нейродегенеративных заболеваний, таких как болезнь Альцгеймера. В дополнение, соединения по настоящему изобретению также полезны в качестве активного ингредиента для приготовления лекарства для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, таких как болезнь Паркинсона, тауопатии (например, лобно-височная деменция, кортикобазальная дегенерация, болезнь Пика, прогрессирующий супрануклеарный паралич) и другая деменция, включая сосудистую деменцию; острый паралич и другие травматические повреждения; цереброваскулярные случаи (например, возрастная дегенерация желтого пятна); травма головного мозга и позвоночника; периферические нейропатии; ретинопатии и глаукома; и других заболеваний, таких как инсулиннезависимый диабет (такие как диабет II типа) и ожирение; маниакально-депрессивный психоз; шизофрения; алопеция; злокачественные новообразования, такие как рак груди, немелкоклеточная карцинома легких, рак щитовидной железы, Т- или Вклеточная лейкемия и некоторые опухоли, вызванные вирусами. Настоящее изобретение, кроме того, относится к способу лечения нейродегенеративных заболеваний, вызванных аномальной активностью GSK3, и вышеупомянутых заболеваний, при котором в организм млекопитающего, нуждающегося в этом, вводят эффективное количество соединения формулы (I). В качестве активного ингредиента лекарства по настоящему изобретению может быть использовано вещество, которое выбрано из группы, состоящей из соединения, представленного вышеупомянутой формулой (I), и его фармацевтически приемлемых солей, и их сольватов, и их гидратов. Вещество само по себе может быть введено в качестве лекарства по настоящему изобретению, однако желательно вводить лекарство в форме фармацевтической композиции, которая содержит вышеупомянутое вещество в качестве активного ингредиента и одно или более чем одно фармацевтическое вспомогательное вещество. В качестве активного ингредиента лекарства по настоящему изобретению могут быть использованы в комбинации два или более чем два вышеупомянутых вещества. Указанная выше фармацевтическая ком-5 007459 позиция может быть дополнена активным ингредиентом другого лекарства для лечения вышеупомянутых заболеваний. Тип фармацевтической композиции конкретно не ограничен, и композиция может быть предложена в виде любого препарата для перорального или парентерального введения. Например, фармацевтическая композиция может быть приготовлена, например, в форме фармацевтических композиций для перорального введения, таких как гранулы, мелкие гранулы, порошки, твердые капсулы, мягкие капсулы, сиропы, эмульсии, суспензии, растворы и тому подобное, или в форме фармацевтических композиций для парентерального введения, таких как инъекции для внутривенного, внутримышечного или подкожного введения, капельных инфузий, препаратов для трансдермального введения, препаратов для введения через слизистую оболочку, капель в нос, ингаляций, суппозиториев и тому подобное. Инъекции или капельные инфузий могут быть приготовлены в виде порошковых препаратов, таких как в форме лиофилизированных препаратов, и могут быть использованы путем растворения непосредственно перед применением в подходящей водной среде, такой как физиологический раствор. Препараты с длительным высвобождением, такие как препараты, покрытые полимером, могут быть непосредственно введены интрацеребрально. Типы фармацевтических вспомогательных веществ, используемых для приготовления фармацевтической композиции, количественные отношения фармацевтических вспомогательных веществ к активному ингредиенту и способы приготовления фармацевтических композиций могут подходящим образом быть выбраны специалистами в данной области техники. В качестве фармацевтических вспомогательных веществ могут быть использованы неорганические или органические вещества либо твердые или жидкие вещества. Как правило, фармацевтические вспомогательные вещества могут быть включены в соотношении, изменяющемся в диапазоне от 1 до 90 мас.%, исходя из массы активного ингредиента. Примеры эксципиентов, применяемых для приготовления твердых фармацевтических композиций,включают в себя, например, лактозу, сахарозу, крахмал, тальк, целлюлозу, декстрин, каолин, карбонат кальция и тому подобное. Для приготовления жидких композиций для перорального введения может быть использован обычный инертный разбавитель, такой как вода или растительное масло. Жидкая композиция может содержать, в дополнение к инертному разбавителю, дополнительные агенты, такие как увлажнители, агенты, способствующие суспендированию, подсластители, корригенты, красители и консерванты. Жидкая композиция может быть заполнена в капсулы, приготовленные из абсорбируемого материала, такого как желатин. Примеры растворителей или суспендирующих сред, применяемых для приготовления композиций для парентерального введения, например, инъекций, суппозиториев, включают в себя воду, пропиленгликоль, полиэтиленгликоль, бензиловый спирт, этилолеат, лецитин и тому подобное. Примеры основных материалов, применяемых для суппозиториев, включают в себя, например,масло какао, эмульгированное масло какао, лауриновую кислоту, витепсол. Доза и частота введения лекарства по настоящему изобретению конкретно не ограничены и могут подходящим образом быть выбраны в зависимости от условий, таких как цель профилактического и/или терапевтического лечения, тип заболевания, масса тела или возраст пациента, тяжесть заболевания и тому подобное. Как правило, суточная доза для перорального введения взрослому может составлять от 0,01 до 1,000 мг (масса активного ингредиента), и доза может быть введена один раз в сутки или несколько раз в сутки в виде разделенных частей, или один раз в несколько суток. Когда лекарственное средство применяют в виде инъекции, такое введение взрослому может быть предпочтительно осуществлено непрерывно или с перерывами при суточной дозе от 0,001 до 100 мг (масса активного ингредиента). Химические примеры Настоящее изобретение более детально поясняется ссылкой на следующие общие примеры, однако,объем настоящего изобретения не ограничивается этими примерами. Пример 1 (соединение 2 в табл. 1). Гидрохлорид 1-[3-(2-фторфенил)пропил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она(1:1) 1.1. 7-(Пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-он Смесь, содержащую 2,9 г (15 ммоль) этилового эфира 3-оксо-3-(пиримидин-4-ил)пропионовой кислоты (полученного по аналогии со способом, описанном в патенте DE 2705582), 2 г (15 ммоль) гемисульфата 2-аминоимидазола и 1,2 г (15 ммоль) ацетата аммония нагревали при 140 С в течение 18 ч. Охлажденную смесь обрабатывали 30 мл ацетонитрила и фильтровали, и осадок добавляли к воде и кипятили с обратным холодильником в течение 30 мин. Получающийся в результате раствор охлаждали и осадок отделяли путем фильтрации. Неочищенный продукт, полученный таким образом, перекристаллизовывали из этанола с получением 1,75 г чистого продукта в виде серого твердого вещества. Температура плавления (т.п.): 345-346 С. 1.2 Гидрохлорид 1-[3-(2-фторфенил)пропил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5 она (1:1) Суспензию 0,433 г (2,03 ммоль) 7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она в 4 мл безводного N,N-диметилформамида обрабатывали 365 мг (2,64 ммоль) карбоната калия и получающуюся в-6 007459 результате смесь нагревали при 70 С в течение 30 мин. Добавляли 530 мг (2,44 ммоль) 3-(2-фторфенил)пропилбромида и реакционную смесь нагревали при 130 С в течение 1 ч. Охлажденный раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и упаривали с получением неочищенного продукта, который очищали путем хроматографии на силикагеле, элюируя смесью дихлорметан/метанол в соотношении от 100/0 до 95/5. Получено 0,248 г чистого продукта в форме свободного основания, которое превращали в соль гидрохлорид. Т.п.: 192-194 С. Пример 2 (Соединение 3 в табл. 1). 1-[2-(4-Фтор-2-метоксифенил)этил]-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-он 2.1. Метиловый эфир (4-фтор-2-метоксифенил)уксусной кислоты К суспензии 14,34 г (32,47 ммоль) ацетата свинца (IV) в 100 мл безводного толуола добавляли смесь 5,2 г (30,92 ммоль) 1-(4-фтор-2-метоксифенил)этанона и 15,02 мл (123,13 ммоль) эфирата трифторида бора в 9 мл метанола. Реакционную смесь дополнительно перемешивали при комнатной температуре в течение 16 ч. К охлажденной смеси добавляли воду и получающийся в результате раствор экстрагировали толуолом. Экстракты промывали насыщенным раствором гидрокарбоната натрия, насыщенным раствором хлорида натрия и сушили, используя сульфат натрия. Растворитель выпаривали досуха с получением 6 г продукта в виде масла, которое использовали на следующей стадии без дополнительной очистки. 2.2. 2-(4-Фтор-2-метоксифенил)этанол К суспензии 1,72 г (45,41 ммоль) алюмогидрида лития в 120 мл тетрагидрофурана при 0 С по каплям добавляли 6 г (30,27 ммоль), растворенного в 120 мл метилового эфира (4-фтор-2 метоксифенил)уксусной кислоты, и получающуюся в результате смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли 100 мл диэтилового эфира при 0 С и обрабатывали избытком насыщенного водного раствора сульфата натрия. Добавляли дополнительное количество твердого сульфата натрия и органическую фазу фильтровали для удаления солей. Растворитель выпаривали досуха с получением 5,1 г (99%) продукта в виде масла. 2.3. 2-(4-Фтор-2-метоксифенил)этиловый эфир метансульфоновой кислоты К раствору 5,1 г (29,97 ммоль) 2-(4-фтор-2-метоксифенил)этанола в 30 мл безводного дихлорметана добавляли при 0 С 6,26 мл (44,95 ммоль) триэтиламина и 3,5 мл (44,95 ммоль) метансульфонилхлорида. Получающуюся в результате смесь перемешивали при 0 С в течение 1 ч. Смесь затем разбавляли водой и дихлорметаном и экстрагировали дихлорметаном. Органический слой сушили и упаривали с получением 7 г (100%) 2-(4-фтор-2-метоксифенил)этилового эфира метансульфоновой кислоты. 2.4. 1-[2-(4-Фтор-2-метоксифенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-он Суспензию 0,4 г (1,88 ммоль) 7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она в 10 мл безводного N,N-диметилформамида обрабатывали 337 мг (2,44 ммоль) карбоната калия и получающуюся в результате смесь нагревали при 70 С в течение 30 мин. Добавляли 605 мг (2,44 ммоль) 2-(4-фтор-2 метоксифенил)этилового эфира метансульфоновой кислоты и реакционную смесь нагревали при 80 С в течение 16 ч. Охлажденный раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и упаривали с получением неочищенного продукта, который очищали путем хроматографии на силикагеле, элюируя смесью дихлорметан/метанол в соотношении от 100/0 до 95/5. Получено 0,12 г чистого продукта в форме свободного основания. Т.п.: 196-198 С. Перечень химических структур и физические данные для соединений вышеупомянутой формулы(I), иллюстрирующие настоящее изобретение, приведены в табл. 1. Соединения получены в соответствии со способами приведенного примера. В таблице R1 представляет собой незамещенное 4-пиримидиновое кольцо, Ph представляет собой фенильную группу, (S) указывает на стереохимию атома углерода, и в структуре R2 представляет собой связь, присоединенную к X.-8 007459 Пример теста: Ингибирующая активность лекарства по настоящему изобретению в отношенииGSK3 Могут быть использованы два различных протокола. В первом протоколе: 7,5 мкМ префосфорилированного пептида GS1 и 10 мкМ АТФ (содержащего 300000 ppm (частей на миллион) 33P-АТФ) инкубировали в 25 мМ Трис-HCl, рН 7,5, 0,6 мМ дитиотрейтола (ДТТ), 6 мМ MgCl2, 0,6 мМ этиленгликолевой тетрауксусной кислоты (ЭГТА), 0,05 мг/мл BSA буфера в течение 1 ч при комнатной температуре в присутствии GSK3 (общий объем реакционной смеси : 100 мкл). Во втором протоколе: 4,1 мкМ префосфорилированного пептида GS1 и 42 мкМ АТФ (содержащего 260000 cpm 33P-АТФ) инкубировали в 80 мМ Mes-NaOH, рН 6,5, 1 мМ ацетата Mg, 0,5 мМ ЭГТА, 5 мМ 2-меркаптоэтанола, 0,02% Твин 20 (Tween 20), 10% глицеринового буфера в течение 2 ч при комнатной температуре в присутствии GSK3. Ингибиторы растворяли в диметилсульфоксиде (ДМСО) (конечная концентрация растворителя в реакционной среде 1%). Реакцию останавливали 100 микролитрами раствора, приготовленного из 25 г полифосфорной кислоты (85% Р 2O5), 126 мл 85% Н 3 РO4, Н 2O до 500 мл, и затем разбавляли до 1:100 перед использованием. Аликвоту реакционной смеси затем переносили на катионообменные фильтры Whatman P81 и ополаскивали описанным выше раствором. Включенную 33P радиоактивность определяли путем жидкостной сцинтилляционной спектрометрии. Фосфорилированный пептид GS-1 имеет следующую последовательность:NH2-YRRAAVPPSPSLSRHSSPHQS(P)EDEE-COOH Ингибирующая GSK3 активность соединений по настоящему изобретению выражена в виде 50%ной ингибирующей концентрации (ИК 50), и в качестве иллюстрации диапазон ИК 50 соединений табл. 1 составляет от концентрации 20 наномоль до концентрации 1 микромоль. Например, соединение 6 в табл. 1 демонстрирует ИК 50, равное 21 нМ. Пример препарата(1) Таблетки Приведенные ниже ингредиенты смешивали обычным способом и прессовали, используя обычный аппарат. Соединение примера 1 30 мг Кристаллическая целлюлоза 60 мг Кукурузный крахмал 100 мг Лактоза 200 мг Стеарат магния 4 мг(2) Мягкие капсулы Приведенные ниже ингредиенты смешивали обычным способом и заполняли ими мягкие капсулы. Соединение примера 1 30 мг Оливковое масло 300 мг Лецитин 20 мг(1) Препараты для парентерального введения Приведенные ниже ингредиенты смешивали обычным способом для приготовления инъекций, содержащихся в ампуле на 1 мл. Соединение примера 1 3 мг Хлорид натрия 4 мг Дистиллированная вода для инъекций 1 мл Промышленная применимость Соединения по настоящему изобретению обладают ингибирующей GSK3 активностью и полезны в качестве активного ингредиента лекарства для профилактического и/или терапевтического лечения заболеваний, вызванных аномальной активностью GSK3 и, более конкретно, нейродегенеративных заболеваний. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное имидазо[1,2-а]пиримидона, представленное формулой (I), или его соль, или сольват,или гидрат-9 007459 где X представляет собой связь, метиленовую группу, возможно замещенную одной или двумя группами, выбранными из С 1-6 алкильной группы, гидроксильной группы и С 1-4 алкоксильной группы; карбонильную группу;R1 представляет собой 2, 4 или 5-пиримидинил, возможно замещенный С 1-4 алкильной группой, С 1-4 алкоксильной группой или атомом галогена;R2 представляет собой C1-6 алкильную группу, С 1-2 пергалогенированную алкильную группу, С 13 галогенированную алкильную группу, бензильную группу, бензольное кольцо, нафталиновое кольцо,5,6,7,8-тетрагидронафталиновое кольцо, причем бензильная группа и кольца возможно замещены заместителями, выбранными из С 1-6 алкильной группы, атома галогена, С 1-2 пергалогенированной алкильной группы, C1-3 галогенированной алкильной группы, гидроксильной группы, С 1-4 алкоксильной группы, нитро, циано, амино, взятыми в количестве от 1 до 4 иn представляет собой 0-3. 2. Производное имидазо[1,2-а]пиримидона, представленное формулой (I), или его соль, или сольват,или гидрат по п.1, где R1 представляет собой незамещенное 4-пиримидиновое кольцо. 3. Производное имидазо[1,2-а]пиримидона, представленное формулой (I), или его соль, или сольват,или гидрат по п.1 или 2, где R2 представляет собой бензольное кольцо, нафталиновое кольцо или 5,6,7,8 тетрагидронафталиновое кольцо, причем кольца возможно замещены. 4. Производное имидазо[1,2-а]пиримидона, которое выбрано из группы, состоящей из 1-(3-фенилпропил)-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-она; 1-[3-(2-фторфенил)пропил]-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-она; 1-[2-(4-фтор-2-метоксифенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она; 1-[2-(4-метоксифенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она; 1-[2-(4-метилфенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она; 1-(2-нафталин-1-илэтил)-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она; 1-[2-(3-фторфенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она; 1-[2-(3-хлорфенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она; 1-[2-(2-метоксифенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она; 4-[2-(5-оксо-7-(пиримидин-4-ил)-5 Н-имидазо[1,2-а]пиримидин-1-ил)этил]бензонитрила; 1-(2-гидрокси-2-фенилэтил)-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она; 1-(2-оксо-2-фенилэтил)-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она; 1-[2-(4-фторфенил)этил]-7-(пиримидин-4-ил)-1H-имидазо[1,2-а]пиримидин-5-она; 1-[2-(4-этоксифенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она или 1-[2-(2,5-диметоксифенил)этил]-7-(пиримидин-4-ил)-1 Н-имидазо[1,2-а]пиримидин-5-она,или их соли, сольвата или гидрата. 5. Производное 7-(пиримидинил)имидазо[1,2-а]пиримидин-5(1H)-она формулы (III) где R1 представляет собой 2-, 4- или 5-пиримидиновое кольцо, возможно замещенное С 1-4 алкильной группой, С 1-4 алкоксильной группой или атомом галогена. 6. Лекарственное средство, включающее в себя в качестве активного ингредиента вещество, выбранное из группы, состоящей из производного имидазо[1,2-а]пиримидона, представленного формулой(I), или его солей, или его сольватов, или его гидратов по пп.1-4. 7. Ингибитор киназы синтетазы гликогена 3 (КСГ 3), выбранный из группы производного имидазо[1,2-а]пиримидона, представленного формулой (I), или его солей, или его сольватов, или его гидратов по пп.1-4. 8. Применение соединения по пп.1-4 для приготовления лекарственного средства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью КСГ 3. 9. Применение соединения по пп.1-4 для приготовления лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративного заболевания. 10. Применение соединения по п.9, где нейродегенеративное заболевание выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, тауопатий, васкулярной деменции; острого паралича, травматических повреждений; цереброваскулярных случаев, травмы головного мозга, травмы позвоночника; периферических нейропатий; ретинопатии или глаукомы. 11. Применение соединения по пп.1-4 для приготовления лекарственного средства для профилактического и/или терапевтического лечения инсулиннезависимых диабетов, ожирения, маниакальнодепрессивного заболевания, шизофрении, алопеции или злокачественных новообразований.- 10007459 12. Применение по п.11, где злокачественное новообразование представляет собой рак груди, немелкоклеточную карциному легких, рак щитовидной железы, Т- или В-клеточную лейкемию или опухоли, вызванные вирусами.
МПК / Метки
МПК: C07D 487/04, A61K 31/437, A61P 25/28
Метки: 1-[(арил)алкил]-7-(пиримидин-4-ил)имидазо[1, 1-[(гетероарил)алкил, производные, 2-a]пиримидин-5(1н)-она, 1-[алкил
Код ссылки
<a href="https://eas.patents.su/12-7459-proizvodnye-1-alkil-1-geteroarilalkil-i-1-arilalkil-7-pirimidin-4-ilimidazo1-2-apirimidin-51n-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1-[алкил]-, 1-[(гетероарил)алкил]- и 1-[(арил)алкил]-7-(пиримидин-4-ил)имидазо[1, 2-a]пиримидин-5(1н)-она</a>
Предыдущий патент: Аппликатор
Следующий патент: Промотор для il-18bp, его получение и применение
Случайный патент: Способ получения ароматических углеводородов












