Производные 1н-имидазо[4,5-b]пиразина
Номер патента: 17925
Опубликовано: 30.04.2013
Авторы: Русселл Алан Джеймс, Файнер Джеффри Т., Лю Пу-Пинг, Муци Алекс, Морган Брэдли П., Морганс Дэвид Джей
Формула / Реферат
1. Химическое соединение, выбранное из соединений формулы I и соединений формулы II:
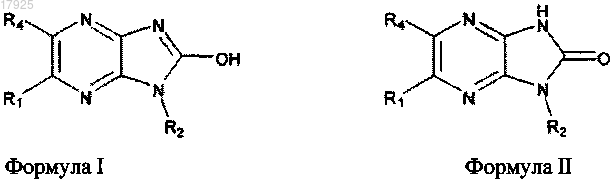
и их фармацевтически приемлемых солей,
отличающееся тем, что
R1 выбран из C2-6алкенила и C2-6алкинила;
R4 является водородом и
R2 выбран из группы, включающей 3-пентил, циклогексил, изопропил и 1-морфолинобутан-2-ил; при условии, что R1 не является гекс-1-енилом.
2. Химическое соединение по п.1, отличающееся тем, что R1 выбран из группы, включающей бутенил, пропенил, винил и этинил.
3. Химическое соединение по п.2, отличающееся тем, что R1 выбран из группы, включающей изобутен-1-ил, (Z)-пропен-1-ил, (Е)-пропен-1-ил, пропен-2-ил, винил и этинил.
4. Химическое соединение по п.1, отличающееся тем, что R1 является этинилом.
5. Химическое соединение по п.1, отличающееся тем, что R2 выбран из группы, включающей 3-пентил и изопропил.
6. Химическое соединение по п.1, отличающееся тем, что R2 является 3-пентилом.
7. Химическое соединение, выбранное из группы, включающей
1-[(1R)-1-(морфолин-4-илметил)пропил]-6-этинилимидазо[4,5-b]пиразин-2-ол;
1-(пентан-3-ил)-6-(проп-1-инил)-1Н-имидазо[4,5-b]пиразин-2-ол и
6-этинил-1-(пентан-3-ил)-1Н-имидазо[4,5-b]пиразин-2-ол
или их фармацевтически приемлемые соли.
8. Химическое соединение, выбранное из группы, включающей
(Е)-1-(пентан-3-ил)-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2-ол;
(Е)-1-циклогексил-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2-ол;
(Е)-1-изопропил-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2-ол;
(Z)-1-(пентан-3-ил)-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2-ол;
(Z)-1-циклогексил-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2-ол;
(Z)-1-изопропил-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2-ол;
1-(этилпропил)-6-винилимидазо[4,5-b]пиразин-2-ол;
1-(этилпропил)-6-(1-метилвинил)имидазо[4,5-b]пиразин-2-ол
или их фармацевтически приемлемые соли.
9. Химическое соединение, выбранное из группы, включающей
1-(пентан-3-ил)-6-(проп-1-инил)-1H-имидазо[4,5-b]пиразин-2(3H)-он и
6-этинил-1-(пентан-3-ил)-1Н-имидазо[4,5-b]пиразин-2(3H)-он
или их фармацевтически приемлемые соли.
10. Химическое соединение, выбранное из группы, включающей
(Е)-1-(пентан-3-ил)-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2(3H)-он;
(Е)-1-циклогексил-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2(3H)-он;
(Е)-1-изопропил-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2(3H)-он;
(Z)-1-(пентан-3-ил)-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2(3H)-он;
(Z)-1-циклогексил-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2(3Н)-он;
(Z)-1-изопропил-6-(проп-1-енил)-1Н-имидазо[4,5-b]пиразин-2(3H)-он
или их фармацевтически приемлемые соли.
11. Фармацевтически приемлемая композиция для лечения нервно-мышечного заболевания, включающая фармацевтически приемлемый носитель и химическое соединение по п.1.
12. Способ лечения пациента, страдающего нервно-мышечным заболеванием, включающий введение пациенту терапевтически эффективного количества химического соединения по п.1.
13. Способ по п.12, отличающийся тем, что нервно-мышечным заболеванием является боковой амиотрофический склероз.
14. Способ по п.12, отличающийся тем, что нервно-мышечным заболеванием является тяжелая псевдопаралитическая миастения.
Текст
Изобретение относится к химическому соединению, выбранному из соединений формулы I и соединений формулы II: и их фармацевтически приемлемых солей,гдеC2-6 алкинила; R4 является водородом и R2 выбран из группы, включающей 3-пентил,циклогексил, изопропил и 1-морфолинобутан-2-ил, при условии, что R1 не является гекс-1 енилом; химическому соединению, выбранному из группы, включающей 1-[(1R)-1-(морфолин-4 илметил)пропил]-6-этинилимидазо[4,5-b]пиразин-2-ол,1-(пентан-3-ил)-6-(проп-1-инил)-1 Н-имидазо[4,5b]пиразин-2-ол и 6-этинил-1-(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2-ол; химическому соединению,выбранному из группы, включающей (Е)-1-(пентан-3-ил)-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2 ол,(Е)-1-циклогексил-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2-ол,(Е)-1-изопропил-6-(проп-1 енил)-1 Н-имидазо[4,5-b]пиразин-2-ол, (Z)-1-(пентан-3-ил)-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2-ол,(Z)-1-циклогексил-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2-ол,(Z)-1-изопропил-6-(проп-1-енил)-1 Нимидазо[4,5-b]пиразин-2-ол, 1-(этилпропил)-6-винилимидазо[4,5-b]пиразин-2-ол и 1-(этилпропил)-6(1-метилвинил)имидазо[4,5-b]пиразин-2-ол; химическому соединению, выбранному из группы,включающей 1-(пентан-3-ил)-6-(проп-1-инил)-1 Н-имидазо[4,5-b]пиразин-2(3 Н)-он и 6-этинил-1(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2(3H)-он; химическому соединению,выбранному из группы, включающей (Е)-1-(пентан-3-ил)-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2(3H)-он, (Е)-1 циклогексил-6-(проп-1-енил)-1H-имидазо[4,5-b]-пиразин-2(3H)-он,(E)-1-изопропил-6-(проп-1-енил)-1 Нимидазо[4,5-b]пиразин-2(3H)-он,(Z)-1-(пентан-3-ил)-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2(3H)он, (Z)-1-циклогексил-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2(3H)-он, (Z)-1-изопропил-6-(проп-1 енил)-1 Н-имидазо[4,5-b]пиразин-2(3H)-он или их фармацевтически приемлемых солей. Кроме того,предлагается фармацевтически приемлемая композиция для лечения нервно-мышечного заболевания,включающая фармацевтически приемлемый носитель и химическое соединение. Также заявлен способ лечения пациента, страдающего нервно-мышечным заболеванием, включающий введение пациенту терапевтически эффективного количества химического соединения. При этом нервно-мышечным заболеванием могут являться как боковой амиотрофический склероз, так и тяжелая псевдопаралитическая миастения. Заявка на данное изобретение утверждает преимущество предварительной заявки на патент США 60/835272, поданной 2 августа 2006 г., и предварительной заявки на патент США 60/921054, поданной 30 марта 2007 г, каждая из которых включена в данное описание путем ссылки для всех целей. Настоящее изобретение относится к некоторым химическим соединениям, которые модулируют миозин скелетных мышц, актин скелетных мышц, тропомиозин скелетных мышц, тропонин С скелетных мышц, тропонин I скелетных мышц, тропонин Т скелетных мышц и скелетные мышцы, включая их фрагменты и изоформы, а также саркомеры скелетных мышц. Кроме того, изобретение относится к некоторым химическим соединениям, фармацевтическим композициям и способам лечения одного или более из следующих патологических состояний: ожирения, саркопении, синдрома атрофии, синдрома слабости,кахексии, мышечного спазма, послеоперационной и посттравматической мышечной слабости, нервномышечного заболевания. Цитоскелет клеток скелетных мышц и сердечной мышцы отличается от цитоскелета всех других клеток. Он состоит из кристаллической структуры плотно упакованных цитоскелетных белков, называемой саркомером. Саркомер тонко организован как переплетающаяся структура тонких и толстых филаментов. Толстые филаменты состоят из миозина, двигательного белка, ответственного за преобразование химической энергии гидролиза АТФ в направленное движение. Тонкие филаменты состоят из мономеров актина, упакованных в спиралевидную структуру. Четыре регуляторных белка связываются с актиновыми филаментами, благодаря этому процесс сокращения регулируется ионами кальция. Приток внутриклеточного кальция стимулирует мышечное сокращение; толстые и тонкие филаменты скользят друг по другу, управляемые повторяющимися взаимодействиями моторного фрагмента миозина с тонкими актиновыми филаментами. Миозин - это наиболее хорошо изученный белок из всех двигательных белков. Из 13 различных классов миозина человеческих клеток миозин класса II ответственен за сокращение скелетной, сердечной и гладкой мускулатуры. Этот класс миозина значительно отличается по аминокислотному составу и общей структуре от миозина других 12 классов. Миозин II состоит из двух глобулярных головок, связанных вместе альфа-спиральным участком - хвостом, эти хвосты взаимодействуют между собой и собирают отдельные молекулы миозина в филамент. Глобулярные головки имеют каталитический центр, где происходит связывание актина и где проявляется АТФазная активность миозина. При связывании актина с миозином происходит высвобождение фосфата (гидролиз АТФ до АДФ), в результате чего меняется структурная конформация каталитического центра, что, в свою очередь, влияет на ориентацию так называемого рычага, который начинается с глобулярной головки; это движение называется рабочим ходом. Это изменение в ориентации головки миозина в отношении к актину заставляет толстый филамент, частью которого он является, двигаться относительно тонкого актинового филамента, с которым он связан. Отсоединение головки миозина от актина (также регулируемое ионами Са 2+), связанное с возвращением каталитического центра и легкой цепи к их исходной конформации/ориентации, завершает сокращение и цикл расслабления, ответственный за внутриклеточное движение и мышечное сокращение. Тропомиозин и тропонин опосредуют регуляторное действие ионов кальция на взаимодействие актина и миозина. Тропониновый комплекс регулирует действие нескольких единиц актина сразу и состоит из трех полипептидных цепей: тропонин С, который связывает ионы кальция, тропонин I, который связывается с актином, и тропонин Т, который связывается с тропомиозином. Патологическое сокращение скелетной мускулатуры является патогенетической причиной некоторых нарушений, включая ожирение, саркопению, синдром атрофии, синдром слабости, кахексию, мышечный спазм, послеоперационную и посттравматическую мышечную слабость, нервно-мышечное заболевание, которые представляют серьезную проблему для здоровья. Сокращение и расслабление скелетной мускулатуры контролируются, главным образом, повышением и понижением уровня внутриклеточного кальция. Соответственно, существует необходимость в создании новых соединений, влияющих на скелетную мускулатуру. Остается необходимость в создании веществ с новыми механизмами действия, имеющих улучшенные характеристики в отношении симптомов, безопасности, смертности пациентов, краткосрочного и длительного эффектов и терапевтического индекса. Настоящее изобретение относится по меньшей мере к одному химическому соединению, выбранному из соединений формулы I и соединений формулы II: и их фармацевтически приемлемым солям,где R1 выбран из C2-6 алкенила и C2-6 алкинила; при условии, что R1 не является гекс-1-енилом. Настоящее изобретение относится также к фармацевтически приемлемой композиции, включающей фармацевтически приемлемый носитель и по меньшей мере одно химическое соединение, описанное в настоящем изобретении. Настоящее изобретение относится также к способам лечения пациентов, страдающих заболеванием,выбранным из группы: ожирение, саркопения, синдром атрофии, синдром слабости, кахексия, мышечный спазм, послеоперационная и посттравматическая мышечная слабость, нервно-мышечное заболевание, эти способы включают применение у пациентов терапевтически эффективного количества по меньшей мере одного химического соединения, описанного в настоящем изобретении. Настоящее изобретение относится также к способу лечения одного или более патологических состояний: ожирение, саркопения, синдром атрофии, синдром слабости, кахексия, мышечный спазм,постхирургическая и посттравматическая мышечная слабость, нервно-мышечное заболевание и другие патологические состояния у млекопитающего, этот способ включает введение млекопитающему терапевтически эффективного количества по меньшей мере одного химического соединения, описанного в настоящем изобретении, или фармацевтической композиции, содержащей фармацевтически приемлемый наполнитель, носитель или вспомогательное вещество и по меньшей мере одно химическое соединение,описанное в настоящем изобретении. Настоящее изобретение относится также к способу лечения пациента, страдающего заболеванием,поддающимся лечению с помощью модуляции одного или более белков или структур: миозин скелетных мышц, актин скелетных мышц, тропомиозин скелетных мышц, тропонин С скелетных мышц, тропонин I скелетных мышц, тропонин Т скелетных мышц и скелетные мышцы, включая их фрагменты и изоформы,а также саркомеры скелетных мышц у млекопитающих, этот способ включает введение млекопитающему терапевтически эффективного количества по меньшей мере одного химического соединения, описанного в настоящем изобретении, или фармацевтической композиции, содержащей фармацевтически приемлемый наполнитель, носитель или вспомогательное вещество и по меньшей мере одно химическое соединение, описанное в настоящем изобретении. Настоящее изобретение относится также к способу лечения пациента,страдающего заболеванием,поддающимся лечению с помощью потенцирования одного или более белков или структур: миозин скелетных мышц, актин скелетных мышц, тропомиозин скелетных мышц, тропонин С скелетных мышц,тропонин I скелетных мышц, тропонин Т скелетных мышц и скелетные мышцы, включая их фрагменты и изоформы, а также саркомеры скелетных мышц у млекопитающих, этот способ включает введение млекопитающему терапевтически эффективного количества по меньшей мере одного химического соединения, описанного в настоящем изобретении, или фармацевтической композиции, содержащей фармацевтически приемлемый наполнитель, носитель или вспомогательное вещество и по меньшей мере одно химическое соединение, описанное в настоящем изобретении. Настоящее изобретение относится также к способу лечения пациента, страдающего заболеванием,поддающимся лечению с помощью ингибирования одного или более белков или структур: миозин скелетных мышц, актин скелетных мышц, тропомиозин скелетных мышц, тропонин С скелетных мышц,тропонин I скелетных мышц, тропонин Т скелетных мышц и скелетные мышцы, включая их фрагменты и изоформы, а также саркомеры скелетных мышц у млекопитающих, этот способ включает введение млекопитающему терапевтически эффективного количества по меньшей мере одного химического соединения, описанного в настоящем изобретении, или фармацевтической композиции, содержащей фармацевтически приемлемый наполнитель, носитель или вспомогательное вещество и по меньшей мере одно химическое соединение, описанное в настоящем изобретении. Другие аспекты и варианты осуществления будут очевидны специалистам в данной области техники из следующего подробного описания. Предполагается, что в настоящем описании изобретения следующие слова и фразы имеют те значения, которые указаны ниже, за исключением тех случаев, когда контекст, в котором они используются,указывает на обратное. Для следующих аббревиатур и терминов указаны следующие сокращения: Ас - ацетил;APCI - химическая ионизация при атмосферном давлении; атм - атмосфера;MPLC - жидкостная хроматография среднего давления; мин - минута; мг - миллиграмм; мл - миллилитр;vol - эквивалентный объем в мл/г или л/кг для лимитирующего реагента, если не указано иначе. Термин "алкенил" означает ненасыщенную алкильную группу с прямой или разветвленной цепью,которая содержит по меньшей мере одну двойную связь углерод-углерод, полученную отщеплением одной молекулы водорода от смежных атомов углерода исходного алкила. Двойная связь может быть как цис-, так и транс-конфигурации. Типичные алкенильные группы включают, но не ограничиваются только ими, этенил; пропенилы, такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-2-ен 2-ил; бутенилы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метил-проп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен 1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил и т.п. В некоторых вариантах осуществления алкенильная группа имеет от 2 до 20 атомов углерода и в других вариантах осуществления от 2 до 6 атомов углерода. "Низший алкенил" означает алкенильные группы, имеющие от 2 до 6 атомов углерода. Термин "алкинил" означает ненасыщенную алкильную группу с прямой или разветвленной цепью,которая содержит по меньшей мере одну тройную связь углерод-углерод, полученную отщеплением двух молекул водорода от смежных атомов углерода исходного алкила. Типичные алкинильные группы включают, но не ограничиваются только ими, этинил; пропинилы, такие как проп-1-ин-1-ил, проп-2-ин 1-ил; бутинилы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.п. В некоторых вариантах осуществления алкинильная группа имеет от 2 до 20 атомов углерода и в других вариантах осуществления от 3 до 6 атомов углерода. Термин "низший алкинил" означает алкинильные группы, содержащие от 2 до 6 атомов углерода. Термин "изомеры" обозначает различные соединения, которые имеют одинаковую молекулярную формулу. "Стереоизомеры" являются изомерами, которые отличаются только расположением атомов в пространстве. "Энантиомеры" являются стереоизомерами, которые представляют собой взаимные зеркальные отражения. Смесь пары энантиомеров 1:1 является "рацемической" смесью. Термин используется при необходимости для обозначения рацемической смеси. "Диастереоизомеры" являются стереоизомерами, которые имеют по меньшей мере два асимметричных атома, но которые не являются зеркальными отражениями друг друга. Абсолютная стереохимия определяется согласно системе CahnIngold-Prelog R-S. Если вещество является чистым энантиомером, стереохимическая конфигурация каждого хирального атома углерода может быть указана как R или S. Разделенные соединения, чья абсолютная конфигурация является неизвестной, обозначаются как (+) или как (-) в зависимости от направления(правовращающий или левовращающий энантиомер) вращения плоскости поляризации света при длине волны, называемой D-линия натрия. Некоторые соединения, описанные в настоящем изобретении, содержат один или более асимметричных центров и могут, таким образом, давать энантиомеры, диастереомеры и другие стероизомерные формы, которые могут быть определены в терминах абсолютной стерохимии как (R)- или (S)-. Настоящее изобретение включает все такие возможные изомеры, включая рацемические смеси, оптически чистые формы и промежуточные смеси. Оптически активные (R)- и (S)изомеры могут быть получены при использовании хиральных синтонов или хиральных реагентов или разделены с помощью общепринятых техник. Когда соединения, описанные в настоящем изобретении,содержат двойные связи или другие центры геометрической асимметрии, и, если не указано иначе, предполагается, что соединения включают как Е, так и Z геометрические изомеры."Таутомеры" являются структурно различными изомерами, которые взаимопревращаются посредством таутомеризации. "Таутомеризация" является формой изомеризации и включает прототропную таутомеризацию, которая относится к кислотно-основной химии. "Прототропная таутомеризация" включает в себя миграцию протона, сопровождаемую изменениями в природе связи, часто происходит обмен одинарной связи со смежной двойной. Где таутомеризация является возможной (например, в растворе), может быть достигнуто химическое равновесие таутомеров. Примером таутомеризации является кетоенольная таутомеризация. Специфическим примером кетоенольной таутомеризации является интерконверсия таутомеров пентан-2,4-дион и 4-гидроксипент-3-ен-2-он. Другим примером таутомеризации является фенолкето таутомеризация. Специфическим примером фенолкето таутомеризации является интерконверсия таутомеров пиридин-4-ол и пиридин-4(1 Н)-он. Соединения формулы I и соединения формулы II являются таутомерными. Уходящая группа или атом является группой или атомом, которые в условиях реакции отщепляются от исходного материала, таким образом активируя реакцию в определенном месте. Подходящие примеры таких групп, если не указано иначе, включают атомы галогена, мезилокси-, пнитробензенсульфонилокси- и тозилоксигрупп. Термин "фармацевтически приемлемый носитель" или "фармацевтически приемлемый наполнитель" включает любой или все растворители, дисперсионные среды, покрывающие вещества, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию агенты и т.п. Использование подобных сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. За исключением тех случаев и настолько, насколько любая обычная среда или агент несовместимы с активным ингредиентом, рассматривается возможность е (его) использования в терапевтических композициях. Также в композиции могут быть включены дополнительные активные ингредиенты. Защитная группа имеет значение, условно связанное с органическим синтезом, т.е. группа избирательно блокирует один или более реактивных участков в мультифункциональном соединении таким образом, что химическая реакция может быть проведена избирательно на другом незащищенном реактивном участке, и таким образом, что группа может быть быстро удалена после окончания избирательной реакции. Разнообразные защитные группы описываются, например, в Т.Н. Greene and P.G.M. Wuts,Protective Groups in Organic Synthesis, Third Edition, John WileySons, New York (1999). Например, гидроксизащищенная форма - это форма, где по меньшей мере одна из гидроксигрупп, присутствующих в соединении, является защищенной гидроксизащитной группой. Амины и другие реактивные группы могут быть защищены подобным образом. Термин "фармацевтически приемлемая соль" означает соли, которые сохраняют биологическую эффективность и свойства соединений, описанных в настоящем изобретении, и которые не являются биологически и в других отношениях нежелательными. Во многих случаях соединения, описанные в настоящем изобретении, способны образовывать кислые и/или основные соли благодаря наличию амино и/или карбоксильных групп или подобных групп. Фармацевтически приемлемые кислотно-аддитивные соли могут быть образованы с неорганической и органической кислотами. Неорганические кислоты, которые могут быть использованы для получения солей, включают, например, соляную, бромистоводородную, серную, азотную, фосфорную кислоты и т.п. Органические кислоты, которые могут быть использованы для получения солей, включают, например, уксусную, пропионовую, гликолевую, пировиноградную, щавелевую, малеиновую, янтарную, фумаровую, винную, лимонную, бензойную, коричную,миндальную, метансульфокислоту, этансульфокислоту, р-толуолсульфокислоту, салициловую кислоты и т.п. Фармацевтически приемлемые основно-аддитивные соли могут быть образованы с неорганическими и органическими основаниями. Неорганические основания, которые могут быть использованы для получения солей, включают, например, натрий, калий, литий, аммоний, кальций, магний, железо, цинк, медь,марганец, алюминий и т.п. Органические основания, которые могут быть использованы для получения солей, включают, например, первичные, вторичные и третичные амины, замещенные амины, включая природные замещенные амины, циклические амины, катионы ионообменных смол и т.п., особенно такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. В некоторых вариантах осуществления фармацевтически приемлемаяосновно-аддитивная соль выбрана из группы, включающей соли аммония, калия, натрия, кальция и магния. Термин "эффективное количество" для лечения заболевания служит для обозначения того количества, которое при введении в организм, нуждающегося в нем животного или человека, достаточно для лечения, как это определено выше, такого заболевания. Терапевтически эффективное количество будет в значительной степени зависеть от субъекта и самого заболевания, веса и возраста субъекта, тяжести заболевания, специфическое соединение, выбранное из формулы I и формулы II, режим дозирования, выбор времени введения, способ введения и т.п., все эти параметры достаточно легко могут быть определены специалистом в данной области техники. Термин "АТФаза" означает фермент, который гидролизует АТФ. АТФазы включают белки, содержащие молекулярные моторы, такие как миозины. Использующийся в настоящем изобретении термин "синдром слабости" является синдромом, который характеризуется тремя признаками из пяти: непреднамеренная потеря веса, мышечная слабость,медленная скорость ходьбы, ощущение изнеможения и низкая физическая активность. Использующийся в настоящем изобретении термин "кахексия" обозначает метаболический дефект,часто ассоциированный с раковым заболеванием, который характеризуется прогрессивной потерей веса из-за потери жировой ткани и скелетной мускулатуры. Использующийся в настоящем изобретении термин "мышечный спазм" обозначает непроизвольное сокращение мышц. Мышечные спазмы могут вести к судорогам. Использующийся в настоящем изобретении термин "постхирургическая мышечная слабость" означает снижение силы одного или более мускулов вследствие хирургической процедуры. Слабость может быть генерализованной (т.е. слабость всего тела) или локализованной, т.е. слабость затрагивает определенную область тела, одну сторону тела, конечность или мышцу. Использующийся в настоящем изобретении термин "посттравматическая мышечная слабость" означает снижение силы одного или более мускулов вследствие травматического эпизода (например, телесное повреждение). Слабость может быть генерализованной (т.е. слабость всего тела) или локализованной, т.е. слабость затрагивает определенную область тела, одну сторону тела, конечность или мышцу. Использующийся в настоящем изобретении термин "нервно-мышечное заболевание" обозначает любое заболевание, которое затрагивает любую часть нерва и мышцы. Нервно-мышечное заболевание включает полиневропатию критического состояния, пролонгированную нервно-мышечную блокаду, острую миопатию, а также острую демиелинизирующую полирадикулоневропатию, боковой амиотрофический склероз (ALS), автономную нейропатию, мышечную атрофию Шарко-Мари и другие наследственные моторные и сенсорные невропатии, хроническую демиелинизирующую полирадикулоневропатию,дерматомиозит/полимиозит, диабетическую невропатию, дистрофинопатии, эндокринные миопатии, локализованные мышечные атрофии, гемифациальный спазм, наследственные невропатии типа мышечной атрофии Шарко-Мари, миозит с включнными тельцами, болезнь Кеннеди, миастенический синдром Ламберта-Итона, мышечную дистрофию (например, конечностно-поясная, Дюшена, Бекера, миотоническая, плече-лопаточно-лицевая и т.д.), метаболические миопатии, метаболическую нейропатию, мультифокальную моторную нейропатию с блоками проводимости, тяжелую псевдопаралитическую миастению, атаксию Фридрейха, нейропатию при проказе, алиментарную нейропатию, периодический паралич,боковой амиотрофический склероз, рестриктивное заболевание легких, саркоидоз и нейропатию, синдром Шварца-Джампела, мышечную атрофию спинного мозга, синдром мышечной скованности, заболевание щитовидной железы, травматические повреждения периферических нервов, васкулярную нейропатию, а также другие заболевания. При использовании в настоящем изобретении термин "ожирение" означает индекс массы тела(BMI), равный 30 кг/м 2 или более. BMI - число, показывающее отношение веса тела (кг) к росту (м 2). Термин "ожирение" включает гиперпластическое ожирение, т.е. повышение количества жировых клеток и гипертрофическое ожирение, т.е. повышение размера жировых клеток. BMI при избыточной массе тела составляет 25-30 кг/м 2; BMI при ожирении составляет 30 кг/м 2 или более, BMI при тяжелом (патологическом) ожирении составляет 40 кг/м 2 и более. Термин "саркопения", использующийся в настоящем изобретении, означает потерю мышечной массы, качества и силы мышц. Часто саркопения развивается при старении, но может быть связана также с ВИЧ-инфекцией. Саркопения может вести к синдрому слабости, например, у пожилых. Термин "синдром атрофии", использующийся в настоящем изобретении, означает патологическое состояние, при котором непреднамеренная потеря веса связана с хронической лихорадкой и диареей. В некоторых случаях пациенты с синдромом атрофии теряют 10% от исходного веса тела в течение месяца. Соединения формулы I и соединения формулы II также включают кристаллические и аморфные формы этих соединений, в том числе, например, полиморфы, псевдополиморфы, сольваты, гидраты, несольватированные полиморфы (в том числе ангидраты), конформационные полиморфы и аморфные формы соединений, а также их смеси. Термины "кристаллическая форма", "полиморф" и "новая форма" в настоящем изобретении могут быть использованы взаимозаменяемо и включают все кристаллические и аморфные формы соединения, в том числе, например, полиморфы, псевдополиморфы, сольваты, гидраты, несольватированные полиморфы (в том числе ангидраты), конформационные полиморфы и аморфные формы соединений, а также их смеси, если речь не идет о какой-либо конкретной кристаллической или аморфной форме. Химические соединения включают, но не ограничиваются только ими, соединения формулы I, соединения формулы II и все их фармацевтически приемлемые формы. Фармацевтически приемлемые формы соединений, перечисленных в настоящем изобретении, включают фармацевтически приемлемые соли, хелаты, нековалентные комплексы, пролекарства и их смеси. В некоторых вариантах осуществления соединения, описанные в настоящем изобретении, находятся в форме фармацевтически приемлемых солей. Поэтому термины "химическое соединение" и "химические соединения" также включают фармацевтически приемлемые соли, хелаты, нековалентные комплексы, пролекарства и их смеси."Фармацевтически приемлемые соли" включают, но не ограничиваются только ими, соли неорганических кислот, такие как гидрохлорат, фосфат, дифосфат, гидробромат, сульфат, сульфинат, нитрат и подобные соли; а также соли органических кислот, такие как малат, малеат, фумарат, тартрат, сукцинат,цитрат, ацетат, лактат, метансульфонат, р-толуолсульфонат, 2-гидроксиэтилсульфонат, бензоат, салицилат, стеарат и алканоат, такой как ацетат, НООС-(CH2)n-СООН, где n варьирует от 0 до 4, и подобные соли. Подобным образом, фармацевтически приемлемые катионы включают, но не ограничиваются только ими, натрий, калий, кальций, алюминий, литий и аммоний. Кроме того, если соединение формулы I или соединение формулы II получено как кислотноаддитивная соль, свободное основание может быть получено путем повышения основности раствора кислой соли. Наоборот, если продукт является свободным основанием, аддитивная соль, особенно фармацевтически приемлемая аддитивная соль, может быть получена путем растворения свободного основания в подходящем органическом растворителе и добавления в раствор кислоты в соответствии с обычными процедурами получения кислотно-аддитивных солей из основных соединений. Специалистам в данной области техники известны различные синтетические способы, которые могут использоваться для получения нетоксических фармацевтически приемлемых солей присоединения. Термин "активный агент" используется для обозначения химического соединения, обладающего биологической активностью. В некоторых вариантах осуществления "активный агент" является соединением, имеющим фармацевтическое значение. Термин "терапевтически эффективное количество" химического соединения означает его эффективное количество при назначении пациенту, человеку или животному для лечения заболевания, например терапевтически эффективное количество может быть количеством, достаточным для лечения заболевания или нарушения, поддающихся лечению путем активации миозина. Терапевтически эффективное количество может быть установлено экспериментально, например путем определения концентрации химического соединения или теоретически, путем расчета биодоступности. Под термином "значительный" подразумевается любое обнаруживаемое изменение, которое является статистически значимым в стандартном параметрическом тесте статистической значимости, таком как Т-тест Стьюдента, где р 0,05. Термин "пациент" означает млекопитающего животного или человека, который был или будет объектом лечения, наблюдения или эксперимента. Способы, описанные в настоящем изобретении, могут использоваться как в медицине, так и в ветеринарии. В некоторых вариантах осуществления пациент является млекопитающим животным, и в некоторых вариантах осуществления пациент является человеком. Термин "лечение" или "терапия" обозначает любое лечение заболевания у пациента, включая:(а) предупреждение заболевания, в результате чего клинические симптомы заболевания не развиваются;(в) замедление или остановка развития клинических симптомов и/или(г) облегчение заболевания, в результате чего наблюдается регрессия клинических симптомов. Термин "модуляция", использующийся в настоящем изобретении, означает изменение одного или более белков или структур: миозин скелетных мышц, актин скелетных мышц, тропомиозин скелетных мышц, тропонин С скелетных мышц, тропонин I скелетных мышц, тропонин Т скелетных мышц и скелетные мышцы, включая их фрагменты и изоформы, а также саркомеры скелетных мышц, как прямой или непрямой ответ на присутствие по меньшей мере одного химического соединения, описанного в настоящем изобретении, относительно активности миозина или саркомеров в отсутствие соединения. Изменение может заключаться в повышении активности (потенцирование) или понижении активности (ингибирование) и может происходить благодаря прямому взаимодействию соединения с миозином или саркомером или благодаря взаимодействию соединения с одним или более другими факторами, которые,в свою очередь, действуют на один или более белков или структуру: миозин скелетных мышц, актин скелетных мышц, тропомиозин скелетных мышц, тропонин С скелетных мышц, тропонин I скелетных мышц, тропонин Т скелетных мышц и скелетные мышцы, включая их фрагменты и изоформы, а также саркомеры скелетных мышц. Настоящее изобретение относится по меньшей мере к одному химическому соединенению, выбранному из соединений формулы I и соединений формулы II: и их фармацевтически приемлемых солей,где R1 выбран из C2-6 алкенила и C2-6 алкинила;R2 выбран из группы, включающей 3-пентил, циклогексил, изопропил и 1-морфолинобутан-2-ил,при условии, что R1 не является гекс-1-енилом. В некоторых вариантах осуществления R1 выбран из группы, включающей бутенил, пропенил, винил и этинил. В некоторых вариантах осуществления R1 выбран из группы, включающей изобутен-1-ил, (Z)пропен-1-ил, (Е)-пропен-1-ил, пропен-2-ил, винил и этинил. В некоторых вариантах осуществления R1 является этинилом. В некоторых вариантах осуществления R2 выбран из группы, включающей 3-пентил и изопропил. В некоторых вариантах осуществления R2 является 3-пентилом. В некоторых вариантах осуществления химическое соединение выбрано из группы, включающей 1-[(1R)-1-(морфолин-4-илметил)пропил]-6-этинилимидазо[4,5-b]пиразин-2-ол; 1-(пентан-3-ил)-6-(проп-1-инил)-1 Н-имидазо[4,5-b]пиразин-2-ол и 6-этинил-1-(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2-ол или их фармацевтически приемлемые соли. В некоторых вариантах осуществления химическое соединение выбрано из группы, включающей:(Z)-1-изопропил-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2-ол; 1-(этилпропил)-6-винилимидазо[4,5-b]пиразин-2-ол,1-(этилпропил)-6-(1-метилвинил)имидазо[4,5-b]пиразин-2-ол или их фармацевтически приемлемые соли. В некоторых вариантах осуществления химическое соединение выбрано из группы, включающей 1-(пентан-3-ил)-6-(проп-1-инил)-1 Н-имидазо[4,5-b]пиразин-2(3H)-он и 6-этинил-1-(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2(3H)-он или их фармацевтически приемлемые соли. В некоторых вариантах осуществления химическое соединение выбрано из группы, включающей(Z)-1-изопропил-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2(3H)-он или их фармацевтически приемлемые соли. Соединения формулы I могут быть названы и обозначены номером (например, при использованииNamExpert, разработчик Cheminnovation, или путем автоматического расчета названия вещества ChemDraw Ultra version 10,0, Cambridge Soft Corporation), как описано ниже. Например, соединение Подобным образом, соединения формулы II могут быть названы и обозначены номером (например,при использовании NamExpert, разработчик Cheminnovation, или путем автоматического расчета названия вещества - ChemDraw Ultra version 10,0, Cambridge Soft Corporation), как описано ниже. Например, соединениеR4 является Н,может быть названо (Z)-1-(пентан-3-ил)-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2(3H)-оном. Химические соединения, описанные в настоящем изобретении, могут быть синтезированы при использовании технологий, хорошо известных в данной области техники, например, как показано ниже относительно схем реакции. Если не оговорено иное, реакции, описанные в настоящем изобретении, протекают при атмосферном давлении, как правило, в температурном интервале от -10 до 200 С. Далее во всех случаях, за исключением специально оговоренных, параметры продолжительности реакции и условий ее проведения принимаются как приближенные, например, ее проводят примерно при атмосферном давлении и в температурном интервале от примерно от -10 до примерно 110 С в течение от примерно 1 до примерно 24 ч,когда реакционные смеси оставляют на ночь, реакции длятся приблизительно 16 ч. Термины "растворитель", "органический растворитель" и "инертный растворитель" означают инертный растворитель в условиях реакции, описываемой в связи с этим [включая, например, бензол,толуол, ацетонитрил, тетрагидрофуран ("THF"), диметилформамид ("DMF"), хлороформ, метиленхлорид(или дихлорметан), диэтилэфир, метанол, N-метилпирролидон ("NMP"), пиридин и т.п.]. Если не оговорено иное, растворители, использующиеся в реакциях, описанных в настоящем изобретении, являются инертными органическими растворителями. Если не оговорено иное, для каждого грамма лимитирующего реагента, 1 см 3 (или 1 мл) растворителя составляет эквивалентный объем. Выделение и очистку соединений и промежуточных продуктов, описанных в настоящем изобретении, при желании, можно проводить осуществлением любой пригодной процедуры разделения или очистки, как фильтрование, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография или толстослойная хроматография или сочетание этих методов. Конкретные пригодные техники разделения и выделения могут быть проиллюстрированы со ссылкой на нижеприведенные примеры в настоящем изобретении. Однако можно также прибегать к применению других эквивалентных способов разделения или выделения. Когда необходимо, (R)- и (S)-изомеры могут быть отделены с помощью способов, хорошо известных в данной области техники, например путем образования диастереоизомерных солей или комплексов,которые могут быть разделены, например, путем кристаллизации; путем образования диастереоизомерных производных, которые могут быть разделены, например, путем кристаллизации, газожидкостной хроматографии и жидкостной хроматографии; путем избирательной реакции одного энантиомера с энантиомер-специфичным реагентом, например ферментативное окисление или восстановление с последующим разделением модифицированного и немодифицированного энантиомеров; или газо-жидкостной или жидкостной хроматографии в хиральной среде, например с хиральной неподвижной фазой, например на силикагеле с присоединенным хиральным лигандом, или в присутствии хирального растворителя. Альтернативно, отдельные энантиомеры могут быть синтезированы путем асимметрического синтеза с применением оптически активных реагентов, субстратов, катализаторов или растворителей или путем преобразования одного энантиомера в другой с помощью асимметрической трансформации. Многие необязательно замещенные исходные соединения и другие реактанты доступны для приобретения, например их производит Aldrich Chemical Company (Milwaukee, WI), или могут быть легко получены специалистами в данной области техники, использующими обычно применяемые методики синтеза. Схема реакции 1 В том, что касается схемы реакции 1, этап 1, к соединению формулы 101, где X является галогеном,добавляется избыток (например, приблизительно от 2 до 20 экв.) соединения формулы R2-NH2. Сосуд, в котором происходит реакция, нагревается приблизительно до температуры от 110 до 190 С от 20 до 40 мин, необязательно при использовании микроволнового излучения. Продукт, соединение формулы 102, является выделенным и необязательно очищенным. Схемы реакции 1, этап 2, к раствору соединения формулы 102 в подходящем растворителе (как например, THF) добавляется эквивалент диактивированного карбонила, такой как карбонилдиимидазол Схема реакции 2 иллюстрирует реакции для последующего преобразования соединений формулы 201, где X является уходящей группой, в соединения формулы 104 через один из этапов 3(а-е). В некоторых вариантах осуществления X является галогеном, например бромом. В том, что касается схемы реакции 2, этап 3(а), соединение формулы 201 и около от 0,05 до 0,15 экв. подходящего катализатора, такого как (Ph3P)4Pd в подходящем растворителе, таком как NMP или диоксан, подходящее основание и избыток (как, например, около от 1,5 до 32 мол.экв.) реагента, содержащего олово, такого как R1Sn(бутил)3, перемешиваются при температуре от приблизительно 0 до приблизительно 200 С в течение приблизительно от 6 до 48 ч. Продукт, соединение формулы 104, где R1 выбран из группы, включающей необязательно замещенный алкил, необязательно замещенный алкенил,необязательно замещенный алкинил и необязательно замещенный циклоалкил, является выделенным и необязательно очищенным. В том, что касается схемы реакции 2, этап 3(b), соединение формулы 201 и избыток (например,около 4-5 экв.) соединения формулы NaSRx, где SRx является R1, и подходящий растворитель (например,NMP) нагреваются приблизительно до 50-200 С в течение приблизительно от 10 мин до 24 ч, необязательно с микроволновым излучением. Продукт, соединение формулы 104, где R1 является сульфанилом,является выделенным и необязательно очищенным. В том, что касается схемы реакции 2, этап 3(с), соединение формулы 201, избыток (например, около 1,9-2,3 экв.) соединения формулы R1B(OH)2, около 0,10-0,15 экв. (DPPF)PdCl2, подходящий растворитель(например, диоксан) и около 2-3 экв. подходящего основания (например, 2 н. K2CO3) нагреваются приблизительно до 90 С в течение приблизительно от 6 до 24 ч. Продукт, соединение формулы 104, где R1 выбран из группы, включающей необязательно замещенный алкил, необязательно замещенный алкенил,необязательно замещенный алкинил и необязательно замещенный циклоалкил, является выделенным и необязательно очищенным. В том, что касается схемы реакции 2, этап 3(d), около 2 экв. подходящего основания (например,NaH) добавляется к около 2 экв. RxOH, где ORx является R1, и подходящему растворителю (например,NMP), затем добавляется соединение формулы 201. Смесь нагревается приблизительно от 50 до приблизительно 200 С в течение от приблизительно 10 мин до приблизительно 48 ч. В некоторых вариантах осуществления реакционная смесь нагревается в течение приблизительно 30 мин, необязательно с микроволновым излучением. Продукт, соединение формулы 104, где R1 является необязательно замещенной алкоксигруппой, является выделенным и необязательно очищенным. В том, что касается схемы реакции 2, этап 3(е), соединение формулы 201, избыток (например, около 2,0 экв.) соединения формулы KR1BF3, избыток (например, около 3 экв.) подходящего основания (например, Cs2CO3), подходящее количество (DPPF)PdCl2 (например, около 0,2 экв.), подходящий растворитель (например, диоксан и вода) перемешиваются при температурах от приблизительно комнатной до приблизительно 100 С в течение приблизительно от 8 до 48 ч, и продукт, соединение формулы 104, гдеR1 выбран из группы, включающей необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил и необязательно замещенный циклоалкил, является выделенным и необязательно очищенным. Рацемическая смесь необязательно вносится на хроматографическую колонку и разделяется на (R)и (S)-энантиомеры. Соединения, описанные в настоящем изобретении, необязательно контактируют с фармацевтически приемлемой кислотой для образования соответствующих кислотно-аддитивных солей. Фармацевтически приемлемые кислотно-аддитивные соли соединения формулы I или соединения формулы II необязательно контактируют с основанием для образования соответствующего свободного основания. Химические соединения, описанные в настоящем изобретении, модулируют один или более белков или структуру: миозин скелетных мышц, актин скелетных мышц, тропомиозин скелетных мышц, тропонин С скелетных мышц, тропонин I скелетных мышц, тропонин Т скелетных мышц и скелетные мышцы,включая их фрагменты и изоформы, а также саркомеры скелетных мышц, и способны связываться с ними, ингибировать и/или потенцировать их активность. Использующийся в этом контексте термин "модулировать" обозначает как повышение, так и понижение активности миозина, тогда как термин "потенцировать" обозначает повышение активности и термин "ингибировать" обозначает понижение активности. Химические соединения, фармацевтические композиции и способы, описанные в настоящем изо-9 017925 бретении, используются для лечения ожирения, саркопении, синдрома атрофии, синдрома слабости, кахексии, мышечного спазма, постхирургической и посттравматической мышечной слабости, нервномышечного заболевания и других патологических состояний у млекопитающих. Способы определения химических соединений по способности связываться с белком или как модуляторов характеристик связывания, или модуляторов биологической активности белка описаны, например, в патенте США 6410254 и заявке на патент США 10/987165. Например, тестируемые соединения могут быть исследованы при использовании многолуночных планшетов, соединения могут быть помещены в лунки отдельно или в составе смесей. Компоненты анализа, включая исследуемый белковый комплекс, присоединяющие ферменты и субстраты и АТФ, могут быть добавлены в лунки и с помощью планшет-ридера могут быть измерены оптическая плотность и флуоресценция каждой лунки. В некоторых вариантах осуществления используются 384-луночных планшета, и объм реакционной смеси составляет 25 мкл. Двойная ферментная система пируваткиназа/лактатдегидрогеназа (HuangT.G. and Hackney D.D. (1994), J. Biol. Chem. 269(23):16493-501) может использоваться для измерения скорости гидролиза АТФ в каждой лунке. Как будет оценено специалистами в данной области техники,компоненты анализа добавляются в буферных растворах и реагентах. Периоды инкубирования могут быть оптимизированы, чтобы получить сигналы выше исходного уровня. Исследование может проводиться в реальном времени, показывающее кинетику гидролиза АТФ, которая выше сигнала шумов. Соединения могут в дальнейшем быть тестированы при использовании препаратов мышечных волокон. Такие исследования хорошо известны в данной области техники. См., например, Cheung et al.(2002), Nature Cell. Biol. 4:83 и публикацию патента США 20020006962. Химические соединения, описанные в настоящем изобретении, применяются в терапевтически эффективной дозировке, например в дозировке, достаточной для лечения ранее описанных болезненных состояний. Помимо того что уровни дозировок для человека были оптимизированы для химических соединений, описанных в настоящем изобретении, как правило, дневная доза составляет от приблизительно 0,05 до 100 мг/кг веса тела; в некоторых вариантах осуществления от приблизительно 0,10 до 10,0 мг/кг веса тела и в некоторых вариантах осуществления от приблизительно 0,15 до 1,0 мг/кг веса тела. Таким образом, для человека весом 70 кг в некоторых вариантах осуществления дневная дозировка будет варьировать приблизительно от 3,5 до 7000 мг в день; в некоторых вариантах осуществления приблизительно от 7,0 до 700,0 мг в день и в некоторых вариантах осуществления приблизительно от 10,0 до 100,0 мг в день. Количество вводимого химического соединения будет, вне всяких сомнений, зависеть от субъекта и состояния заболевания, по поводу которого и применяется данное соединение, тяжести патологии,способа и схемы применения соединения и от оценки назначающего врача; например, вероятная доза для перорального введения будет составлять от приблизительно 70 до 700 мг в день, для внутривенного ведения вероятная доза будет составлять от приблизительно 70 до 700 мг в день в зависимости от фармакокинетики соединения. Применение химических соединений, описанных в настоящем изобретении, может осуществляться любым способом, принятым для агентов со схожими свойствами, включая, но не ограничиваясь только ими, следующие способы применения: перорально, сублингвально, подкожно, внутривенно, интраназально, местно, трансдермально, внутрибрюшинно, внутримышечно, внутрилегочно, интравагинально,ректально или интраокулярно. В некоторых вариантах осуществления используются пероральный или парентеральный путь введения. Фармацевтически приемлемые композиции могут быть твердыми, полутвердыми, жидкими и газообразными, т.е. эти композиции могут иметь форму таблеток, капсул, порошков, растворов, суспензий,суппозиториев, аэрозолей и т.п. Химические соединения могут также вводиться в формах с замедленным высвобождением, включая инъекции веществ замедленного всасывания, осмотические насосы, пилюли,трансдермальные (включая электротранспортные) пластыри и т.п. для пролонгированного и/или рассчитанного по времени, импульсного введения при заданной скорости. В некоторых вариантах осуществления композиции представлены в виде дозированных форм, пригодных для однократного введения точной дозы. Химические соединения, описанные в настоящем изобретении, могут вводиться отдельно или, что более типично, в сочетании с общепринятым фармацевтическим носителем, наполнителем и т.п. (например, маннит, лактоза, крахмал, стеарат магния, сахарин натрия, тальк, целлюлоза, кроскармелоза натрия,глюкоза, желатин, сахароза, карбонат магния и т.п.). При желании, фармацевтическая композиция может также содержать незначительные количества нетоксичных вспомогательных веществ, таких как смазывающие агенты, эмульгирующие агенты, солюбилизирующие агенты, регуляторы рН и т.п. (например,ацетат натрия, цитрат натрия, производные циклодекстрина, сорбитан монолаурат, триэтаноламина ацетат, триэтаноламина олеат и т.п.). Как правило, в зависимости от способа введения фармацевтическая композиция будет содержать приблизительно от 0,005 до 95%, в некоторых вариантах осуществления приблизительно от 0,5 до 50% химической композиции по весу. Способы приготовления таких дозировок хорошо известны специалистам в данной области техники; например, см. Remington's Pharmaceutical Кроме того, химические соединения, описанные в настоящем изобретении, могут применяться совместно с другими медицинскими агентами, фармацевтическими агентами и вспомогательными веществами и т.п., и фармацевтические композиции могут включать другие медицинские агенты, фармацевтические агенты и вспомогательные вещества и т.п. Применимые медицинские и фармацевтические агенты включают модуляторы одного или более белков или структур: миозин скелетных мышц, актин скелетных мышц, тропомиозин скелетных мышц, тропонин С скелетных мышц, тропонин I скелетных мышц,тропонин Т скелетных мышц и скелетные мышцы, включая их фрагменты и изоформы, а также саркомеры скелетных мышц и другие применимые терапевтические агенты, использующиеся в лечении вышеупомянутых нарушений, включая средства против ожирения, средства против саркопении, средства против синдрома атрофии, средства против синдрома слабости, средства против кахексии, средства против мышечного спазма, средства против постхирургической и посттравматической мышечной слабости и средства против нервно-мышечного заболевания, а также средства, описанные в заявке на патент США 2005/0197367. Применимые дополнительные медицинские и фармацевтические агенты включают, например, орлистат, сибрамин, диэтилпропион, фентермин, бензафетамин, фендиметразин, эстроген, эстрадиол, левоноргестрел, норэтиндрон ацетат, эстрадиола валерат, этинилэстрадиол, норгестимат, конъюгированные эстрогены, эстерифицированные эстрогены, медроксипрогестерон ацетат, тестостерон, инсулиноподобный фактор роста, гормон роста человека, рилузол, каннабидиол, преднизолон, албутерол, нестероидные противовоспалительные препараты и ботулинический токсин. Другие применимые медицинские и фармацевтические агенты включают тиролиберин, диэтилстилбестерол, теофиллин, энкефалины, простагландины серии Е, соединения указаны в патенте США 3239345 (например, зеранол), соединения указаны в патенте США 4036979 (например, сулбенокс),пептиды указаны в патенте США 4411890, стимуляторы секреции гормона роста, такие как GHRP-6,GHRP-1 (указаны в патенте США 4411890 и публикациях WO 89/07110 и WO 89/07111), GHRP-2B-HT920, гипоталамический фактор, высвобождающий гормон роста и его аналоги, гормон роста и его аналоги и соматомедины, включая IGF-1 и IGF-2, альфа-адренергические агонисты, такие как агонисты серотониновых 5HTD-рецепторов или агонисты клонидина, такие как суматриптан, агенты, которые ингибируют соматостатин и его высвобождение, такие как физостигмин, пиридостигмин, паратиреоидный гормон, РТН(1-34) и бисфосфонаты, такие как MK-217 (алендронат). Все еще применимые медицинские и фармацевтические агенты включают эстроген, тестостерон,селективные модуляторы рецепторов эстрогена, такие как тамоксифен или ралоксифен, модуляторы андрогеновых рецепторов, как те, которые указаны у Edwards, J.Р. et. al., Bio. Med. Chem. Let., 9, 1003-1008("PRA"), такие как левоноргестрел, медроксипрогестерона ацетат (МРА). Все еще применимые медицинские и фармацевтические агенты включают аР 2 ингибиторы, как те,которые указаны в патенте США 09/519079, поданном 6 марта 2000 г., антагонисты рецепторов PPARгамма, агонисты PPAR-дельта рецепторов, агонисты бета-3-адренергических рецепторов, такие какAJ9677 (Takeda/Dainippon), L750355 (Merck) или СР 331648 (Pfizer), другие агонисты бета-3 адренергических рецепторов, которые указаны в патентах США 5541204, 5770615, 5491134, 5776983 и 5488064, ингибитор липазы, такой как орлистат или ATL-962 (Alizyme), ингибиторы обратного захвата серотонина (и дофамина), такие как сибутрамин, топирамат (JohnsonJohnson) или аксокин (Regeneron), препарат, влияющий на тиреоидные бета-рецепторы, такой как лиганд тиреоидного рецептора, как указано в WO 97/21993, WO 99/00353 и GB98/284425 и анорексигенные средства, такие как дексамфетамин, фентермин, фенилпропаноламин или мазиндол. Все еще применимые медицинские и фармацевтические агенты включают препараты, использующиеся в терапии ВИЧ и СПИД, такие как индинавира сульфат, сакинавир, сакинавира мезилат, ритонавир, ламивудин, зидовудин, комбинации ламивудин/зидовудин, зальцитабин, диданозин, ставудин и мегестрола ацетат. Все еще применимые медицинские и фармацевтические агенты включают антирезорбтивные агенты, гормонозамещающую терапию, аналоги витамина D, элементарный кальций и добавки кальция, ингибиторы катепсина K, ингибиторы матриксных металлопротеиназ (ММР), антагонисты рецептора витронектина, антагонисты Src SH.sub.2, ингибиторы вакуолярной H+-АТФазы, иприфлавон, флюорид, тиболон, простаноиды, ингибиторы 17-бета гидроксистероидной дегидрогеназы и Src киназы. Упомянутые выше другие терапевтические агенты при применении в комбинации с химическими соединениями, описанными в настоящем изобретении, могут быть использованы, например, в количествах, указанных в Physicians' Desk Reference (PDR) или же определены специалистом в данной области техники. В некоторых вариантах осуществления композиции могут быть представлены в форме пилюлей или таблеток, и, таким образом, в этом случае композиции будут содержать, помимо активного ингредиента,растворитель, такой как лактоза, сахароза, дикальция фосфат или т.п.; смазочное вещество, такое как стеарат магния или т.п.; и связующее вещество, такое как крахмал, аравийская камедь, поливинилпирро- 11017925 лидин, желатин, целлюлоза, производные целлюлозы и т.п. Что касается другой твердой лекарственной формы, порошок, marume, раствор или суспензия (например, в пропиленкарбонате, растительных маслах или триглицеридах) являются инкапсулированными в желатиновую капсулу. Фармацевтические композиции в жидкой лекарственной форме могут быть приготовлены, например, путем растворения, диспергирования и т.д. по меньшей мере одного химического соединения и необязательного вспомогательного вещества в носителе (например, вода, солевой раствор, водная декстроза, глицерин, гликоли, этанол или т.п.), в результате такого растворения или диспергирования будут получены раствор или суспензия. Инъекционные лекарственные формы могут быть приготовлены как в форме жидких растворов, так и в форме суспензий, как в форме эмульсий, так и в твердых формах, пригодных для разведения и суспендирования в жидкости непосредственно перед инъекцией. Процентное содержание химических соединений, содержащихся в таких композициях, предназначенных для парентерального введения, в значительной степени зависит от их природы, а также активности химических соединений и потребностей в этих соединениях субъекта. Однако применимыми являются растворы с процентным содержанием активного ингредиента от 0,01 до 10%, процентное содержание активного ингредиента будет выше, если композиция представлена в виде твердой формы, которую нужно разводить до вышеупомянутых концентраций. В некоторых вариантах осуществления композиция будет содержать приблизительно от 0,2 до 2% активного агента в растворе. Фармацевтические композиции химических соединений, описанные в настоящем изобретении, могут также вводиться в респираторный тракт в виде аэрозолей или раствора для распылителя или в виде ультратонкого порошка для вдувания по отдельности или в сочетании с инертным носителем, таким как лактоза. В этом случае частицы фармацевтической композиции имеют диаметр менее 50 мкм, в некоторых вариантах осуществления менее 10 мкм. Следующие примеры служат для того, чтобы более полно описать способы использования вышеописанного изобретения. Является очевидным, что эти примеры иллюстрируют, но не ограничивают изобретение. Пример 1. Синтез соединения (S)-6-бром-1-(1-фенилэтил)-1 Н-имидазо[4,5-b]пиразин-2-ол Этап 1. (S)-6-Бром-N2-(1-фенилэтил)пиразин-2,3-диамин. Толстостенная колба для использования в микроволновой печи, оснащенная стержнем магнитной мешалки, была заполнена 1,0 экв. 3,5-дибромпиразин-2-амина и 6,6 экв. (S)-втор-фенэтиламина. Колба была накрыта мембраной и крышкой и нагревалась при температуре 180 С в микроволновой печи в течение 30 мин. Продукт был очищен с помощью флэш-хроматографии (10-50% EtOAc/гексан) на 20 г силикагеля и было получено названное соединение (60%) в виде грязно-белой пены. ЖХ/МС m/z (APCI) = 293,0, 295,0 (М+Н). Этап 2. (S)-6-Бром-1-(1-фенилэтил)-1 Н-имидазо[4,5-b]пиразин-2-ол. К раствору (S)-6-бром-N2-(1-фенилэтил)пиразин-2,3-диамина (1,0 экв.) в безводном THF (5 экв.об.) был добавлен карбонилдиимидазол (CDI). Последующие части CDI добавлялись до тех пор, пока исходный материал не был поглощен (в целом около 3,6 экв.), как было показано с помощью тонкослойной хроматографии (50% EtOAc/гексан). После полной реакции смесь была охлаждена до комнатной температуры и загашена осторожным добавлением воды, пока не перестал выделяться газ. Смесь была разведена 25 экв.об. EtOAc и отмыта 37,5 экв.об. воды и 17,5 экв.об. соляного раствора. Органический слой был высушен над Na2SO4, отфильтрован и выпарен в вакууме. С помощью флэш-хроматографии (BiotageMPLC 5-40% EtOAc/гексан) было получено названное соединение (66%) в виде белого сухого вещества. ЖХ/МС m/z (APCI) = 319,0, 321,0 (М+Н). Пример 1(а). (S)-1-(2-Гидрокси-1-(1-фенилэтил)-1 Н-имидазо[4,5-b]пиразин-6-ил)этанон. В высушенный в сушильном шкафу сцинтилляционный флакон, оснащенный стержнем магнитной мешалки, были внесены (S)-6-бром-1-(1-фенилэтил)-1 Н-имидазо[4,5-b]пиразин-2-ол (1,0 экв.) и (Ph3P)4Pd(0,07 экв.). Колба была закрыта парафильмом и проводилась очистка азотом в течение 5 мин, с помощью шприца были внесены безводный диоксан (13 экв.об.), триэтиламин (3,0 экв.) и трибутил(1 этоксивинил)станнан (1,5 экв.). Полученная смесь нагревалась при 80 С в течение ночи. Реакция была остановлена с помощью 1 н. KHSO4, смесь подвергалась перемешиванию в течение 30 мин. Смесь затем была разведена EtOAc, дважды отмыта NaHCO3 и один раз соляным раствором. Органический слой был высушен над Na2SO4, отфильтрован и выпарен в вакууме. С помощью флэш-хроматографии (BiotageMPLC 10-66% EtOAc/гексан) было получено названное соединение (33%) в виде белого сухого вещества. ЖХ/МС m/z (APCI) = 283,1 (М+Н). Пример 1(b). (S,Е)-1-(1-Фенилэтил)-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2-ол В толстостенную колбу для использования в микроволновой печи, оснащенную стержнем магнитной мешалки, были внесены (S)-6-бром-1-(1-фенилэтил)-1 Н-имидазо[4,5-b]пиразин-2-ол (1,0 экв.) и(Ph3P)4Pd (0,12 экв.). Колба была закрыта парафильмом и проводилась очистка азотом в течение 5 мин, с помощью шприца были внесены N-метилпирролидин (14 экв.об.), триэтиламин (2,0 экв.) и(Е)-трибутил(проп-1-енил)станнан (3,0 экв.). Полученная смесь была немедленно накрыта мембраной и крышкой и нагревалась при температуре 120 С в микроволновой печи в течение 20 мин. Затем смесь была разведена EtOAc, отмыта 4 раза насыщенным водным NaHCO3 и один раз соляным раствором. Органический слой был высушен над Na2SO4, отфильтрован и выпарен в вакууме. С помощью высокоэффективной жидкостной хроматографии с обращенными фазами было получено названное соединение В толстостенную колбу для использования в микроволновой печи, оснащенную стержнем магнитной мешалки, были внесены (S)-6-бром-1-(1-фенилэтил)-1 Н-имидазо[4,5-b]пиразин-2-ол (1,0 экв.), натрия тиометоксид (4,5 экв.) и N-метилпирролидин (10 экв.об.). Колба была накрыта мембраной и крышкой и нагревалась при температуре 180 С в микроволновой печи в течение 30 мин. Реакционная смесь затем была разведена 100 экв.об. EtOAc и отмыта 4 раза в 100 экв.об. воды и 1 раз в 100 экв.об. соляного раствора. Органический слой был высушен над Na2SO4, отфильтрован и выпарен в вакууме. С помощью высокоэффективной жидкостной хроматографии с обращенными фазами (20-80% MeCN/H2O) было получено названное соединение (24%) в виде сухого вещества белого цвета. ЖХ/МС m/z (APCI) = 287,1 (М+Н). Пример 1(d). (S,Z)-1-(1-Фенилэтил)-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2-ол В сцинтилляционный флакон, оснащенный стержнем магнитной мешалки, были внесены(2,0 экв.) и (DPPF)PdCl2 (0,10 экв.). Флакон был закрыт колпачком и в течение 5-10 мин проводилась очистка азотом. К этой смеси с помощью шприца были добавлены диоксан (16,6 экв.об.) и дегазированный 2 н. K2CO3 (4,2 экв.об.). Полученную смесь нагревали в течение ночи до 90 С. Смесь была охлаждена до комнатной температуры, разведена EtOAc, отмыта дважды насыщенным водным NaHCO3 и один раз соляным раствором. Органический слой был высушен над Na2SO4, отфильтрован и выпарен в вакууме. С помощью флэш-хроматографии (Biotage MPLC 5-40% EtOAc/гексан) было получено названное соединение (63%) в виде грязно-белой пены. ЖХ/МС m/z (APCI) = 281,1 (М+Н). Пример 1(е). (S)-1-(1-Фенилэтил)-6-винил-1 Н-имидазо[4,5-b]пиразин-2-ол В сцинтилляционный флакон, оснащенный стержнем магнитной мешалки, были внесены(S)-6-бром-1-(1-фенилэтил)-1 Н-имидазо[4,5-b]пиразин-2-ол (1,0 экв.), винил бориновая кислота (2,2 экв.) и (DPPF)PdCl2 (0,10 экв.). Флакон был закрыт колпачком и в течение 5-10 мин проводилась очистка азотом. С помощью шприца к этой смеси были добавлены диоксан (16,6 экв.об.) и дегазированный 2 н.K2CO3 (4,2 экв.об.). Полученную смесь нагревали в течение ночи до 90 С. Смесь была охлаждена до комнатной температуры, разведена 12 экв.об. EtOAc, отмыта дважды насыщенным водным NaHCO3 и один раз соляным раствором. Органический слой был высушен над Na2SO4, отфильтрован и выпарен в вакууме. С помощью флэш-хроматографии (Biotage MPLC 5-40% EtOAc/гексан) было получено названное соединение в виде сухого вещества грязно-белого цвета (54%). В толстостенную колбу для использования в микроволновой печи, оснащенную стержнем магнитной мешалки, были внесены МеОН (2,0 экв.) и NMP (20 экв.об.). К полученному раствору был добавленNaH (2,0 экв.), что привело к образованию газа. Затем к реакции был добавлен (S)-6-бром-1-(1 фенилэтил)-1 Н-имидазо[4,5-b]пиразин-2-ол (1,0 экв.) и полученная смесь была немедленно накрыта мембраной и крышкой и нагревалась при температуре 200 С в микроволновой печи в течение 30 мин. Смесь затем была разведена EtOAc, отмыта дважды насыщенным водным NaHCO3 и один раз соляным раствором. Органический слой был высушен над Na2SO4, отфильтрован и выпарен в вакууме. С помощью высокоэффективной жидкостной хроматографии с обращенными фазами было получено названное соединение (29%) в виде сухого вещества белого цвета. ЖХ/МС m/z (APCI) = 271,1(М+Н). Пример 1(g). (S)-1-(1-Фенилэтил)-6-этил-1 Н-имидазо[4,5-b]пиразин-2-ол В сцинтилляционный флакон, оснащенный стержнем магнитной мешалки, были внесены(S)-6-винил-1-(1-фенилэтил)-1 Н-имидазо[4,5-b]пиразин-2-ол (1,0 экв.), метанол (280 экв.об.) и каталитический Pd/C. Полученную смесь очищали с водородом в течение 45 мин; по результатам ЖХ/МС реакция была завершена. Смесь затем была профильтрована через фильтр из диатомовой земли и отмыта дважды МеОН. Раствор был выпарен под вакуумом. С помощью флэш-хроматографии (Biotage MPLC 5-40%EtOAc/гексан) было получено названное соединение (86%) в виде пены. ЖХ/МС m/z (APCI) = 269,1 (М+Н). Пример 2. Синтез 6-бром-1-(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2-ола Этап 1. 6-Бром-N2-(пентан-3-ил)пиразин-2,3-диамин. Названное соединение было получено способом, аналогичным указанному в примере 1, этап 1, за исключением того, что 3-аминопентан (2,6 экв.об.) заменил (S)-втор-фенэтиламин. ЖХ/МС m/z (APCI) = 259,0, 260,0 (М+Н). Этап 2. 6-Бром-1-(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2-ол. Названное соединение было получено путем обработки 6-бром-N2-(пентан-3-ил)пиразин-2,3 диамина способом, аналогичным указанному в примере 1, этап 2. ЖХ/МС m/z (APCI) = 285,0, 287,0 (М+Н). Пример 2(а). (Е)-1-(Пентан-3-ил)-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2-ол В толстостенную колбу для использования в микроволновой печи, оснащенную стержнем магнитной мешалки, были внесены 6-бром-1-(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2-ол (1,0 экв.) и (Ph3P)4Pd(0,15 экв.). Колба была закрыта парафильмом и в течение 5-10 мин проводилась очистка азотом, затем с помощью шприца были добавлены N-метилпирролидин (11,7 экв.об.), триэтиламин (2,0 экв.) и(Е)-трибутил(проп-1-енил)станнан (2,0 экв.). Полученная смесь была немедленно накрыта мембраной и крышкой и нагревалась при температуре 120 С в микроволновой печи в течение 20 мин. Смесь затем разбавляли EtOAc, отмывали три раза водой и один раз соляным раствором. Органический слой был высушен над Na2SO4, отфильтрован и выпарен в вакууме. С помощью высокоэффективной жидкостной хроматографии с обращенными фазами было получено названное соединение (15%) в виде пены. ЖХ/МС m/z (APCI) = 247,1 (М+Н). Пример 2(b). (Z)-1-(Пентан-3-ил)-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2-ол Названное соединение было получено путем взаимодействия 6-бром-1-(пентан-3-ил)-1 Нимидазо[4,5-b]пиразин-2-ола (1,0 экв.), (Z)-проп-1-енил бориновой кислоты (1,5 экв.) и (DPPF)PdCl2 Смесь 6-бром-1-(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2-ола (3,75 г, 13,2 ммоль, триметилсилилацетилена (2,8 мл, 19,8 ммоль), PdCl2(PPh)2 (0,93 г, 1,32 ммоль), CuI (0,5 г, 2,64 ммоль) и триэтиламина (5,5 мл, 39,5 ммоль) в DMF (50 мл) очищали N2 в течение 30 с, затем смесь была подвергнута перемешиванию при 80 С. Через 3 ч реакционная смесь была разведена EtOAc, отмыта раствором NH4Cl, высушена над Na2SO4 и выпарена в вакууме. Была проведена очистка на силикагеле (Biotage MPLC 10-80%EtOAc/гексан) и было получено названное соединение (3,2 г, 80%) в виде сухого вещества коричневого цвета. Пример 3(b). 6-Этинил-1-(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2-ол(3,2 г,10,6 ммоль), KF (1,6 г, 27,5 ммоль) в MeOH/THF/H2O (50 мл, 2/2/1) и перемешивали при комнатной температуре. После проведения ЖХ/МС раствор был выпарен в вакууме, разведен EtOAc, отмыт растворомNH4Cl, высушен над Na2SO4 и выпарен в вакууме. С помощью очистки на силикагеле (Biotage MPLC 10-80% EtOAc/Heaxanes) было получено сухое вещество коричневого цвета, которое было отмыто 15%EtOAc/гексаном, и было получено названное соединение в виде сухого вещества белого цвета (0,9 г,37%). Пример 4. Приготовление саркомерных белков из скелетной мускулатуры. Актин был очищен путем первого приготовления порошка сердечной мышцы, полученного с помощью эфира (Zot H.G. and Potter J.D. (1981), Preparative Biochemistry, 11:381-395), как описано ниже. Затем актин находился как в филаментном состоянии, так и в растворимом, в зависимости от проведения либо центрифугирования, либо диализа (Spudich J.A. and Watt S. (1971), J. Biol. Chem. 246:4866-4871). Актин хранили в филаментном состоянии при 4 С. Тропомиозин был экстрагирован из порошка, полученного с помощью эфира, и его отделяли от других белков путем последовательных осаждений (учитывая рН) сульфатом аммония в концентрации 53 и 65% (Smillie L.B. (1981), Methods Enzymol. 85. Pt. B:234-41). Тропонины были выделены в виде интактного комплекса TnC, TnT и TnI. Порошок, полученный с помощью эфира, экстрагируется в солевом буфере с высокой концентрацией соли. Были проведены последовательные осаждения сульфатом аммония в концентрации 30 и 45%; преципитат был растворен посредством диализа в буфер с низким содержанием соли и затем очищен на колонке DEAE Toyopearl с градиентом 25-350 мМ KCl. Не обнаруживалось АТФазы ни в одном из компонентов, за исключением миозина, который имеет очень низкую базальную АТФазу в отсутствие актина. Перед анализом актин, тропомиозин и тропониновый комплекс смешивались вместе в желаемой пропорции (например, 7:1:1) для достижения максимальной кальциевой регуляции актинового филамента. Анализ проводится при рСа=6,5. Эта концентрация кальция находится в физиологическом диапазоне во время мышечного сокращения. Для того чтобы измерить образование АДФ во время реакции, двойная ферментная система пируваткиназа/лактатдегидрогеназа добавляется к актину. Миозин сохраняют отдельно. Результаты в планшетах учитывают в реальном времени, чтобы получить кинетические кривые. Эти соединения находятся в DMSO и были внесены в 384-луночные планшеты в конечной концентрации от 10 до 40 мкг/мл. Пример 5. Приготовление актина. 1. Экстрагировать порошок (как описано в примере 4) 20 мл буфера А (см. ниже, добавить ВМЕ и АТР незадолго до применения каждого из следующих этапов) на каждый граммм порошка (200 мл на 10 г). Использовать большую 4-литровую колбу для 150 г порошка. Осторожно перемешать до растворения порошка. Перемешивать при 4 С в течение 30 мин. 2. Отделить экстракт от гидратированного порошка путем выдавливания через несколько слоев марли. Предварительно марля должна быть подвергнута стерилизации с помощью микроволнового излучения в течение 1-2 мин. 3. Реэкстрагировать остаток таким же объемом буфера А и объединить экстракты. 4. Отцентрифугировать в JLA10 роторе в течение 1 ч при 10000 об/мин (4 С). Собрать супернатант через два слоя марли. 5. Добавить АТР до 0,2 мМ и MgCl2 до 50 мМ. Подвергнуть перемешиванию на магнитной мешалке в течение 60 мин при 4 С для того, чтобы актин полимеризовался/образовал паракристаллы. 6. Медленно добавить твердый KCl до 0,6 М (45 г/л). Перемешивать при 4 С в течение 30 мин. 7. Отцентрифугировать в JLA10 роторе в течение 1 ч при 10000 об/мин. 8. Деполимеризация: Быстро промыть поверхность осадков буфером А и вылить в использованный буфер. Размягчить осадки путем преинкубации на льду с небольшим количеством буфера А в каждой пробирке (использовать менее половины общего конечного объема во всех пробирках). Ресуспендировать сначала вручную с помощью клеточного скребка и объединить осадки. Промыть пробирки экстра буфером, используя пипетку объемом 25 мл и моторизованнный пипеттор и интенсивно отделяя актин от стен пробирок. Гомогенизировать в гомогенизаторе Даунса в холодном буфере А на льду. Использовать 3 мл из расчета на 1 г первоначально экстрагированного порошка. 9. Диализировать против буфера А, 4 смены за 48-часовой период. 10. Собрать диализированный актин и отцентрифугировать в роторе 45Ti при 40000 об/мин в течение 1,5 ч (4 С). 11. Собрать супернатант (G-Актин). Оставить образец для анализа в геле и определения концентрации белка. Для полимеризации G-актина для хранения добавить KCl до 50 мМ (из 3 М стока), MgCl2 до 1 мМ иNaN3 до 0,02% (из 10% стока). Хранить при 4 С. Не замораживать. Буфер А: 2 мМ Трис/HCl, 0,2 мМ СаС 12, 0,5 мМ (36 мкл/л) 2-меркаптоэтанол, 0,2 мМ Na2 ATP (добавлять свежим) и 0,005% азид Na; pH 8,0. Пример 6. Приготовление порошка. 1. Объемы даны приблизительно на 1000 г измельченных мышц. 2. Отрезать кусок марли и прокипятить его в течение 10 мин в воде. Высушить. 3. Размельчить грудные мышцы цыпленка в предварительно охлажденной мясорубке. 4. Экстрагировать, перемешивая, в 2 л 0,1 М KCl, 0,15 М K-фосфата, рН 6,5, в течение 10 мин при 4 С. Отцентрифугировать при 5000 об/мин, 10 мин, 4 С в роторе JLA. Собрать осадок. 5. Экстрагированные осадки перемешивать с 2 л 0,05 М NaHCO3 в течение 5 мин. Отцентрифугировать при 5000 об/мин в JLA роторе 10 мин при температуре 4 С. Собрать осадок. Еще один раз повторить экстракцию. 6. Экстрагировать отфильтрованный остаток 2 л 1 мМ EDTA, рН 7,0 в течение 10 мин, перемешивая. 7. Экстрагировать 2 л H2O в течение 5 мин, перемешивая. Отцентрифугировать при 10000 об/мин,15 мин, при температуре 4 С в JLA роторе. Аккуратно собрать осадок, часть из которого будет рыхлым и гелеобразным. 8. Экстрагировать 5 раз ацетоном (2 л ацетона в течение 10 мин, перемешивая). Аккуратно выдавить через марлю. Каждое экстрагирование ацетоном осуществляется при комнатной температуре. Ацетон необходимо предварительно охладить до 4 С. 9. Высушивание: Поместить отфильтрованный остаток на марлю на большом стеклянном подносе и оставить в вытяжном шкафу на ночь. Когда остаток высохнет, поместить его в колбу с широким горлышком и хранить при температуре 20 С. Пример 7. Альтернативный способ приготовления порошка. На основании протокола ZotPotter (1981). Prep. Biochem. 11(4), p. 381-395. 1. Разрезать левые желудочки сердечной мышцы. Удалить как можно больше ткани перикарда и жира. Размельчить в предварительно охлажденной мясорубке. Взвесить. 2. Приготовить 5 объемов экстракционного буфера (см. ниже). Довести рН до 8,0. Затем гомогенизировать мясо в блендере, процедуру проводить 4 раза в течение 15 с, с перерывами в 15 с. Осуществлять эту процедуру с 1 объемом (вес./об.) буфера, взятого из 5 уже приготовленных объемов. Добавить гомогенат обратно к экстракционному буферу и перемешивать в течение 5 мин. 3. Профильтровать через один слой марли в большую пропиленовую сетку. Ресуспендировать обратно в 5 объемов экстракционного буфера, как указано выше. 4. Повторить этап 3 ещ четыре раза. В конце не ресуспендировать в экстракционном буфере, но перейти к этапу 5. Осадок должен быть желто-белого цвета. 5. Ресуспендировать в 3 объемах (соответственно исходному весу) 95% холодного этанола. Перемешивать в течение 5 мин и выдавить через марлю, как указано выше, повторить еще два раза. 6. Взвесить полученный остаток и затем ресуспендировать в 3 объемах (новый вес./об.) холодного диэтилового эфира. 7. Повторить этап 6 в общей сложности три раза. 8. Оставить на ночь на одном слое марли в стеклянном подносе. 9. После высыхания собрать порошок, взвесить его и хранить в баночке с широкой горловиной при 4 С. Экстракционный буфер: 50 мМ KCl, 5 мМ Трис рН 8,0. Приготовить как 50-кратный концентрат. Для 2 л 250 мМ Трис рН 8,0. Трис Base (121,14 г/моль,60,6 г), рН довести до 8,0 конц. HCl, затем добавить 2,5 М KCl (74,55 г/моль, 372 г) Пример 8. Очистка миозина скелетной мускулатуры. См. Margossian, S.S. and Lowey, S. (1982), Methods Enzymol. 85, 55-123 and Goldmann, W.H. andGeeves, M.A. (1991), Anal. Biochem. 192, 55-58. Раствор A: 0.3 M KC1, 0,15 M калия фосфат, 0,02 M EDTA, 0,005 M MgCl2, 0,001 M ATP, pH 6,5. Раствор В: 1 М KCl, 0,025 М EDTA, 0,06 М калия фосфат, рН 6,5. Раствор С: 0,6 М KCl, 0,025 М калия фосфат, рН 6,5. Раствор D: 0,6 М KCl, 0,05 М калия фосфат, рН 6,5. Раствор Е: 0,15 М калия фосфат, 0,01 М EDTA, рН 7,5. Раствор F: 0,04 М KCl, 0,01 М калия фосфат, 0,001 М DTT, рН 6,5. Раствор G: 3 М KCl, 0,01 М калия фосфат, рН 6,5. Все процедуры проводятся при температуре 4 С. 1. Получить 1000 г скелетной мускулатуры, например скелетной мускулатуры кролика. 2. Дважды размельчить; экстрагировать 2 л раствора А в течение 15 мин, при этом перемешивать; добавить 4 л холодной H2O, профильтровать; развести холодной H2O до ионной силы 0,04 (приблизительно в 10 раз); оставить осаждаться на 3 ч; центрифугировать 15 мин при 7,000 об/мин в GSA роторе. 3. Диспергировать осадок в 220 мл раствора В; диализировать в течение ночи против 6 л раствора С; медленно добавить 400 мл равного объема холодной дистиллированной воды H2O; перемешивать в течение 30 мин; центрифугировать 10 мин при 10,000 об/мин в GSA роторе. 4. Центрифугировать супернатант 1 ч при 19,000 об/мин. 5. Развести супернатант до ионной силы 0,04 ( в 8-раз); оставить миозин на ночь осаждаться; отцентрифугировать около 5-6 л рыхлого осадка миозина при 10,000 об/мин в течение 10 мин в GSA роторе. 6. Ресуспендировать осадок в минимальном объеме раствора G; диализировать в течение ночи против 2 л раствора D; центрифугировать 2 ч при 19,000 об/мин в нитратцеллюлозных пробирках; проколоть пробирки и отделить миозин от жира и нерастворимого осадка. 7. Развести супернатант до 5-10 мг/мл и диализировать против раствора Е, внести на колонкуDEAE-сефадекса. 8. Уравновесить с помощью раствора Е; нанести 500-600 г миозина, 30 мл/ч; отмыть 350 мл раствора Е; элюировать линейным градиентом KCl (0-0,5 М), в растворе Е (21 л); собрать 10 мл фракций; объединить миозиновые фракции (0,1 М KCl); концентрировать в течение ночи путем диализа против раствора F; центрифугировать 30 мин при 25,000 об/мин; хранить, как указано выше. 9. Миозин затем обрабатывается химотрипсином или папином в присутствии EDTA с целью получения фрагмента S1, который является растворимым при низкой концентрации соли, оптимальной для АТФазной активности (Margossian supra). Несмотря на то что некоторые варианты осуществления были показаны и описаны, могут быть сделаны различные модификации и замены, которые не будут отходить от смысла настоящего изобретения и выходить за его границы. Например, что касается целей истолкования пунктов формулы изобретения,те пункты формулы изобретения, которые изложены ниже, не предназначены для более узкого истолкования, чем их буквальная формулировка, и, таким образом, из пунктов формулы изобретения не должны выводиться типовые варианты осуществления. Соответственно, следует понимать, что настоящее изобретение описано в иллюстративных целях, а не для ограничения объема изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Химическое соединение, выбранное из соединений формулы I и соединений формулы II: и их фармацевтически приемлемых солей,отличающееся тем, чтоR2 выбран из группы, включающей 3-пентил, циклогексил, изопропил и 1-морфолинобутан-2-ил; при условии, что R1 не является гекс-1-енилом. 2. Химическое соединение по п.1, отличающееся тем, что R1 выбран из группы, включающей бутенил, пропенил, винил и этинил. 3. Химическое соединение по п.2, отличающееся тем, что R1 выбран из группы, включающей изобутен-1-ил, (Z)-пропен-1-ил, (Е)-пропен-1-ил, пропен-2-ил, винил и этинил. 4. Химическое соединение по п.1, отличающееся тем, что R1 является этинилом. 5. Химическое соединение по п.1, отличающееся тем, что R2 выбран из группы, включающей 3-пентил и изопропил. 6. Химическое соединение по п.1, отличающееся тем, что R2 является 3-пентилом. 7. Химическое соединение, выбранное из группы, включающей 1-[(1R)-1-(морфолин-4-илметил)пропил]-6-этинилимидазо[4,5-b]пиразин-2-ол; 1-(пентан-3-ил)-6-(проп-1-инил)-1 Н-имидазо[4,5-b]пиразин-2-ол и 6-этинил-1-(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2-ол или их фармацевтически приемлемые соли. 8. Химическое соединение, выбранное из группы, включающей(Z)-1-изопропил-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2-ол; 1-(этилпропил)-6-винилимидазо[4,5-b]пиразин-2-ол; 1-(этилпропил)-6-(1-метилвинил)имидазо[4,5-b]пиразин-2-ол или их фармацевтически приемлемые соли. 9. Химическое соединение, выбранное из группы, включающей 1-(пентан-3-ил)-6-(проп-1-инил)-1H-имидазо[4,5-b]пиразин-2(3H)-он и 6-этинил-1-(пентан-3-ил)-1 Н-имидазо[4,5-b]пиразин-2(3H)-он или их фармацевтически приемлемые соли. 10. Химическое соединение, выбранное из группы, включающей(Z)-1-изопропил-6-(проп-1-енил)-1 Н-имидазо[4,5-b]пиразин-2(3H)-он или их фармацевтически приемлемые соли. 11. Фармацевтически приемлемая композиция для лечения нервно-мышечного заболевания, включающая фармацевтически приемлемый носитель и химическое соединение по п.1. 12. Способ лечения пациента, страдающего нервно-мышечным заболеванием, включающий введение пациенту терапевтически эффективного количества химического соединения по п.1. 13. Способ по п.12, отличающийся тем, что нервно-мышечным заболеванием является боковой амиотрофический склероз. 14. Способ по п.12, отличающийся тем, что нервно-мышечным заболеванием является тяжелая псевдопаралитическая миастения. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 31/498, A61P 21/04, C07D 487/04, A61P 19/08
Метки: 1н-имидазо[4,5-b]пиразина, производные
Код ссылки
<a href="https://eas.patents.su/20-17925-proizvodnye-1n-imidazo45-bpirazina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1н-имидазо[4,5-b]пиразина</a>
Предыдущий патент: Узел соединения крышки и шпинделя запорного клапана
Следующий патент: Устройство температурной защиты погружного электродвигателя
Случайный патент: Способ понижения высоты и уменьшения энергии волн в глубоком водоеме, при обрушении в него оползневого массива
























