Полиморфы n-метил-n-(3-{3-[2-тиенилкарбонил]пиразол [1,5-а]пиримидин-7-ил}фенил)ацетамида и относящиеся к ним композиции и способы
Формула / Реферат
1. По существу чистый полиморф формы I N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида, показывающий преобладающую эндотерму при около 192-198шC по данным измерения с помощью дифференциального сканирующего калориметра.
2. По существу чистый полиморф формы I по п.1, который включает менее чем около 6% полиморфа формы II по массе.
3. По существу чистый полиморф формы I по п.2, который включает менее чем около 2% примесей по массе, менее чем около 1% воды по массе и менее чем около 0,5% остаточного органического растворителя по массе.
4. По существу чистый полиморф формы I по п.2, который показывает преобладающую эндотерму при около 195-197шC.
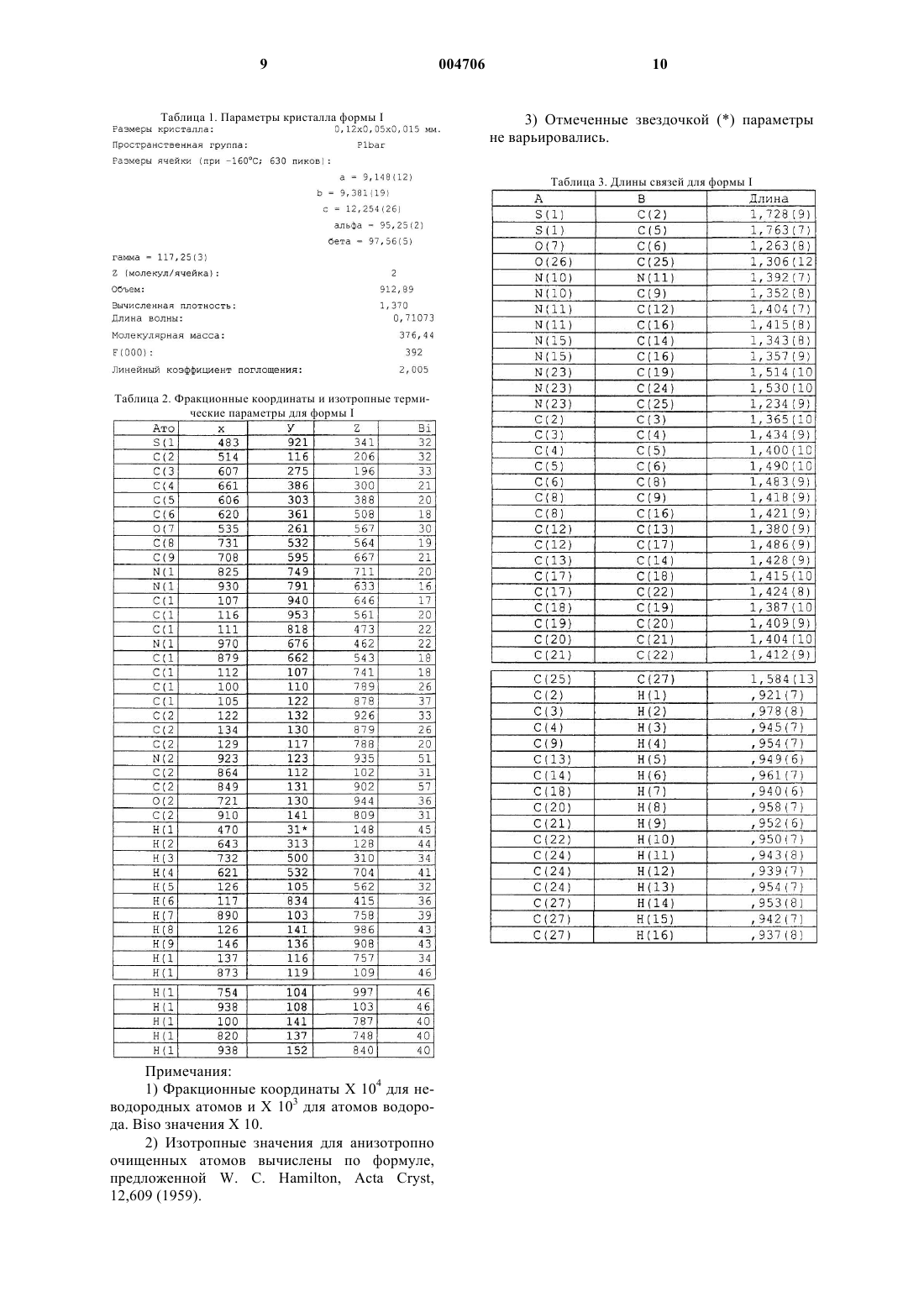
5. По существу чистый полиморф формы I по п.2, который имеет около 2 молекул на ячейку и имеет P1 bar пространственную группу по данным определения с помощью монокристаллической рентгенокристаллографии.
6. По существу чистый полиморф формы I по п.2, который имеет размеры кристалла около 0,12_ 0,05_ 0,015 мм и объем около 913 по данным определения с помощью монокристаллической рентгенокристаллографии.
7. По существу чистый полиморф формы I по п.2, который имеет вычисленную плотность около 1,37 по определению с помощью монокристаллической рентгенокристаллографии.
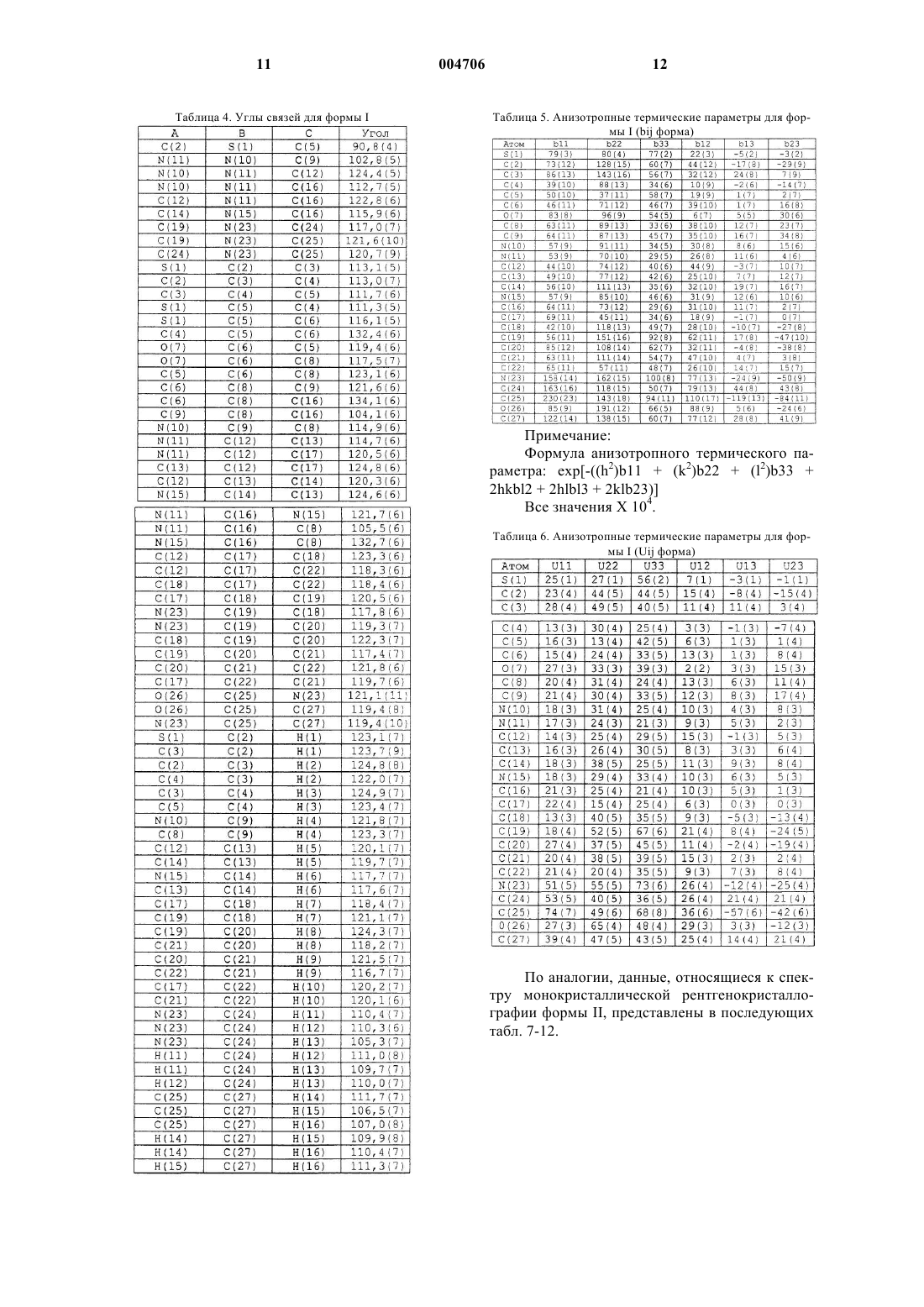
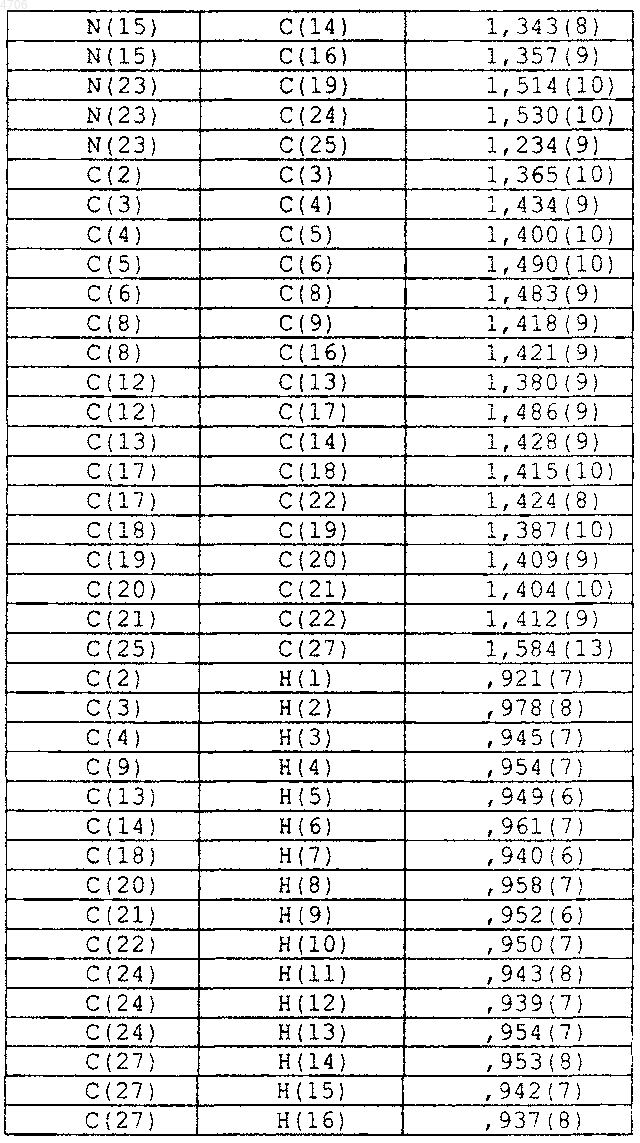
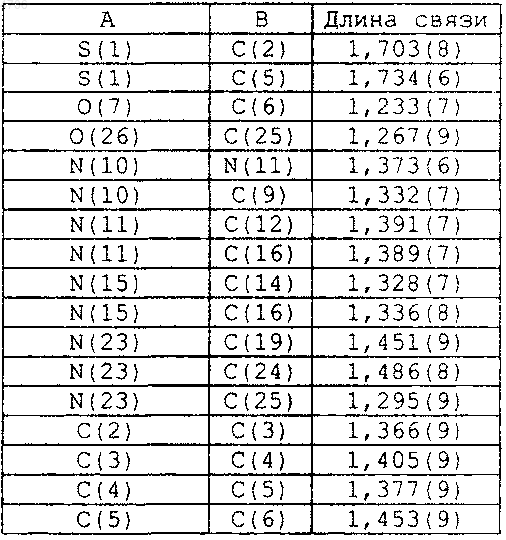
8. По существу чистый полиморф формы I по п.2, дополнительно характеризующийся следующими длинами связей по данным монокристаллической рентгенокристаллографии:
9. По существу чистый полиморф формы II N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида, показывающий преобладающую эндотерму при около 172-179шC по данным измерения с помощью дифференциального сканирующего калориметра.
10. По существу чистый полиморф формы II по п.9, который включает менее чем около 20% полиморфа формы I по массе.
11. По существу чистый полиморф формы II по п.10, который включает менее чем около 2% примесей по массе, менее чем около 1% воды по массе и менее чем около 0,5% остаточного органического растворителя по массе.
12. По существу чистый полиморф формы II по п.10, который обнаруживает преобладающую эндотерму при около 173-177шC.
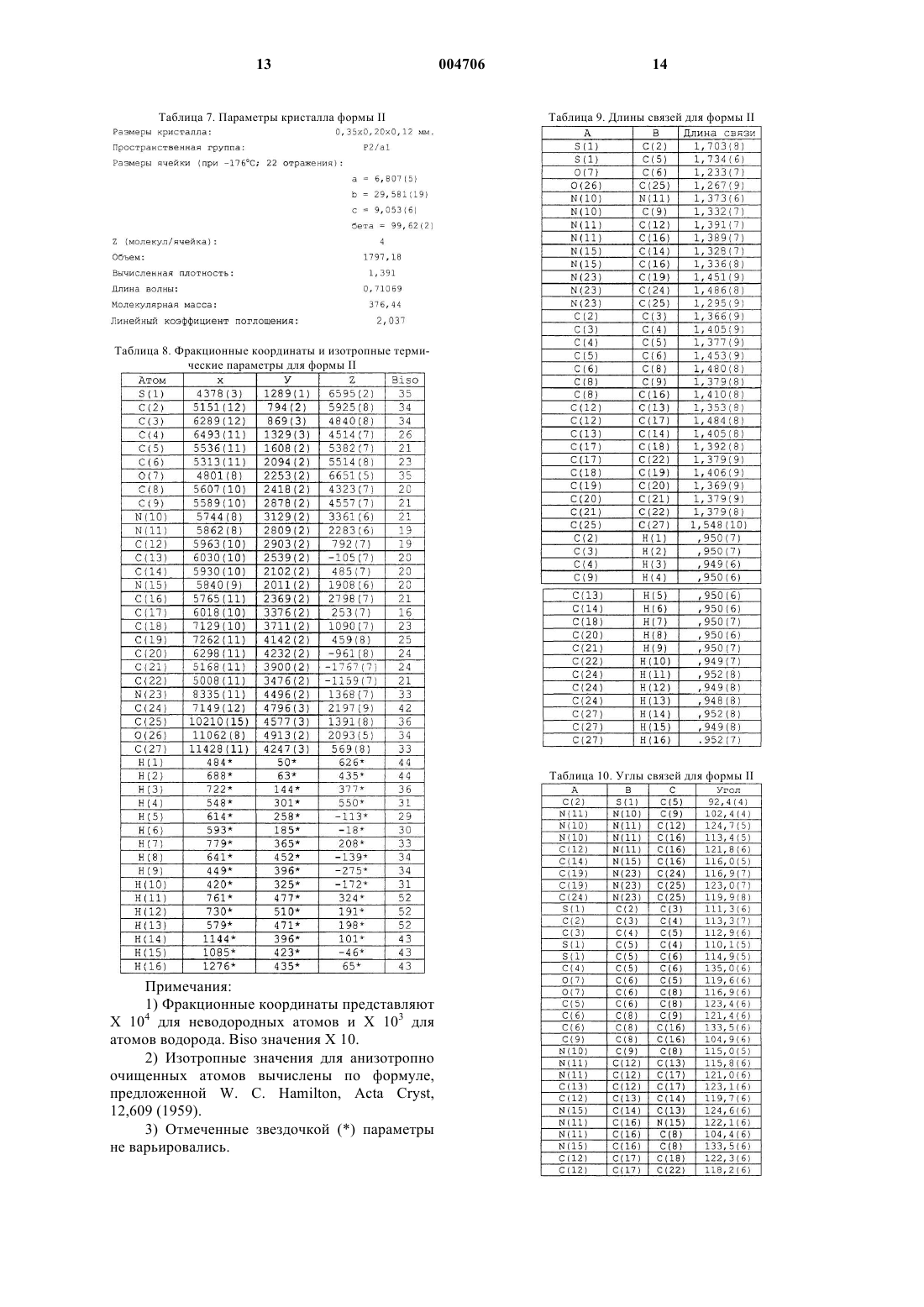
13. По существу чистый полиморф формы II по п.10, который имеет около 4 молекул на ячейку и является P2/al space группой по определению с помощью монокристаллической рентгенокристаллографии.
14. По существу чистый полиморф формы II по п.10, который имеет размеры кристалла около 0,35_ 0,20_ 0,12 мм и объем около 1797 по данным определения с помощью монокристаллической рентгенокристаллографии.
15. По существу чистый полиморф формы II по п.10, который имеет вычисленную плотность около 1,39 по данным определения с помощью монокристаллической рентгенокристаллографии.
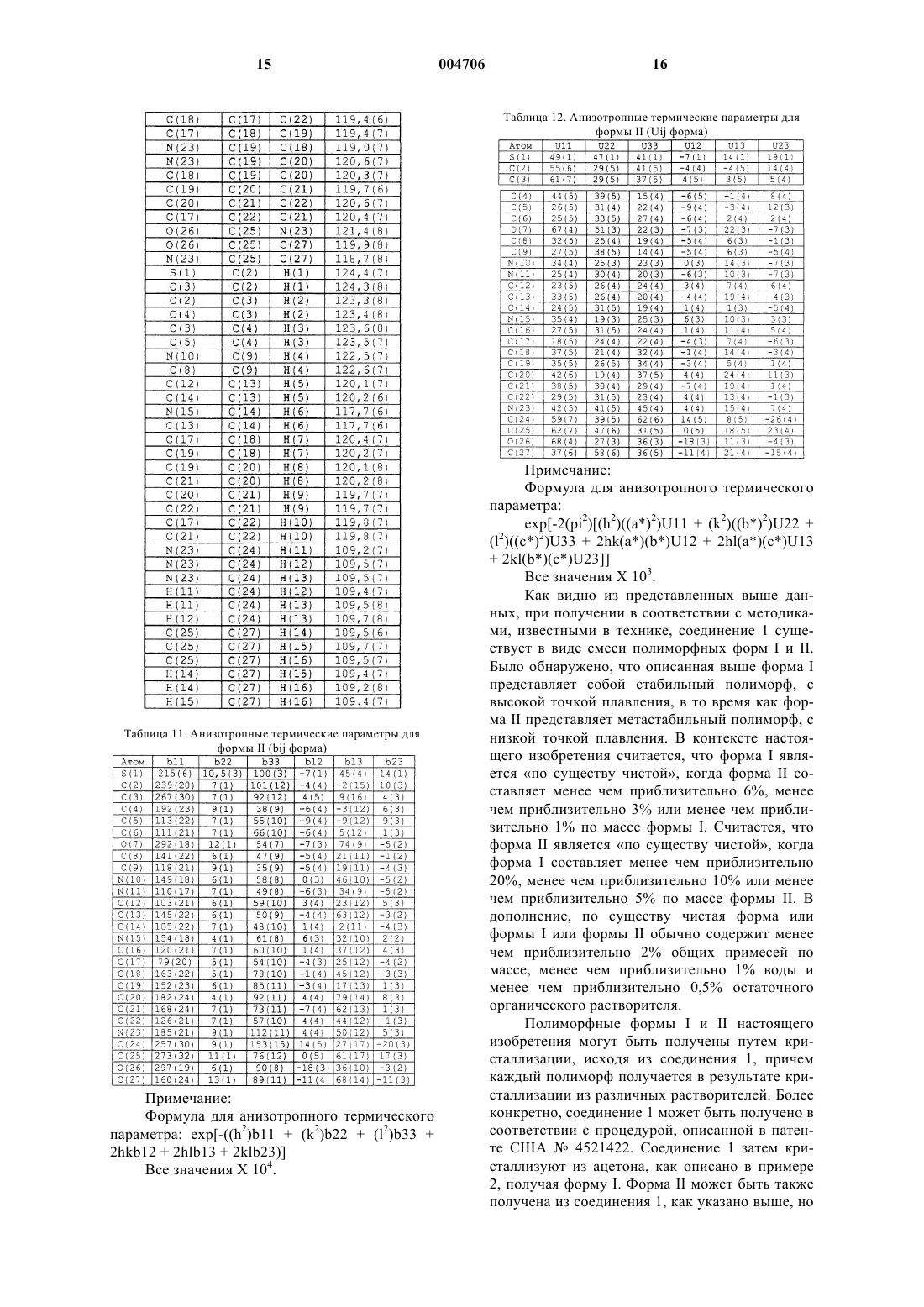
16. По существу чистый полиморф формы II по п.10, дополнительно характеризующийся следующими длинами связей по данным монокристаллической рентгенокристаллографии:

17. Способ получения по существу чистой формы I N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида, включающий стадии образования раствора кристаллизационного растворителя, включающего ацетон, и N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамида, охлаждения раствора с образованием массы кристаллов и сбор кристаллов формы I.
18. Способ по п.17, дополнительно включающий стадию сушки собранных кристаллов с получением по существу чистой формы I.
19. Способ по п.17, в котором стадия образования раствора включает стадии представления N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамида и контактирования N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида с кристаллизационным растворителем.
20. Способ по п.19, в котором N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамид берут в виде твердого вещества.
21. Способ по п.19, в котором N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамид берут в виде концентрата в органическом сорастворителе.
22. Способ по п.21, в котором сорастворитель включает метиленхлорид.
23. Способ по п.19, дополнительно включающий стадию нагревания кристаллизационного растворителя для проведения растворения N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида.
24. Полиморф формы I N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамида, полученный в соответствии со способом по любому из пп.17-23.
25. Способ получения по существу чистой формы II N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида, включающий стадии образования раствора кристаллизационного растворителя, включающего метанол, и N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамида; охлаждения раствора с образованием массы кристаллов и сбор кристаллов формы II.
26. Способ по п.25, дополнительно включающий стадию сушки собранных кристаллов с получением по существу чистой формы II.
27. Способ по п.25, в котором стадия образования раствора включает стадии предоставления N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида и контактирования N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида с кристаллизационным растворителем.
28. Способ по п.27, в котором N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамид берут в виде твердого вещества.
29. Способ по п.27, в котором N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамид берут в виде концентрата в органическом сорастворителе.
30. Способ по п.29, в котором сорастворитель включает метиленхлорид.
31. Способ по п.27, дополнительно включающий стадию нагревания кристаллизационного растворителя для растворения N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамида.
32. Способ превращения полиморфа формы II N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида в полиморф формы I, включающий стадии предоставления композиции, включающей полиморф формы II по п.9, нагревания композиции до температуры, превышающей точку плавления полиморфа формы II, и охлаждения композиции с образованием полиморфа формы I по п.1.
33. Полиморф формы I N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамида, полученный в соответствии со способом по п.32.
34. Способ превращения полиморфа формы II N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида в полиморф формы I, включающий стадии предоставления композиции, включающей полиморф формы II по п.9, и размалывания композиции один или более раз с получением полиморфа формы I по п.1.
35. Полиморф формы I N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамида, полученный в соответствии со способом по п.34.
36. Способ превращения полиморфа формы II N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида в полиморф формы I, включающий стадии предоставления композиции, включающей полиморф формы II по п.9, нагревания композиции до температуры, превышающей температуру окружающей среды, но ниже точки плавления полиморфа формы II, в течение периода времени, достаточного для превращения полиморфа формы II в полиморф формы I по п.1, и охлаждения полиморфа формы I.
37. Полиморф формы I N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида, полученный в соответствии со способом по п.36.
38. Композиция, включающая по существу чистую форму I N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида по п.2 и фармацевтически приемлемый носитель.
39. Композиция по п.38, которая составлена в форме для перорального введения.
40. Композиция по п.39, которая представлена в форме пилюли, капсулы или таблетки.
41. Композиция по п.40, в которой форма I присутствует в единичной дозированной форме в количестве около 0,1-250 мг.
42. Композиция, включающая по существу чистую форму II N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида по п.10 и фармацевтически приемлемый носитель.
43. Композиция по п.42, которая составлена в форме для перорального введения.
44. Композиция по п.43, которая представлена в форме пилюли, капсулы или таблетки.
45. Композиция по п.44, в которой форма II присутствует в единичной дозированной форме в количестве около 0,1-250 мг.
46. Способ лечения бессонницы у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы I по п.1.
47. Способ индуцирования сна у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы I по п.1.
48. Способ индуцирования седативного эффекта или гипноза у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы I по п.1.
49. Способ индуцирования расслабления скелетных мышц у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы I по п.1.
50. Способ лечения бессонницы у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы II по п.9.
51. Способ индуцирования сна у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы II по п.9.
52. Способ индуцирования седативного эффекта или гипноза у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы II по п.9.
53. Способ индуцирования расслабления скелетных мышц у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы II по п.9.
54. Способ превращения полиморфа формы II N-метил-N-{3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида в полиморф формы I, включающий стадию подвергания композиции, включающей полиморф формы II, воздействию тепловой энергии с получением тем самым полиморфа формы I.
55. Способ превращения полиморфа формы II N-метил-N-{3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида в полиморф формы I, включающий стадию подвергания композиции, включающую полиморф формы II, нагреванию при температуре ниже точки плавления полиморфа формы II с образованием тем самым полиморфа формы I.
56. Способ по п.55, дополнительно включающий стадию охлаждения композиции после нагревания с образованием полиморфа формы I.
57. Способ по п.55, в котором композицию подвергают воздействию температуры выше 15шC.
58. Способ по п.57, включающий стадию охлаждения подвергнутой воздействию композиции с образованием полиморфа формы I.
59. Способ по п.57, в котором композицию подвергают действию температуры менее чем около 172шC.
60. Способ по п.59, дополнительно включающий стадию охлаждения подвергнутой воздействию композиции с образованием полиморфа формы I.
61. Способ превращения полиморфа формы II N-метил-N-{3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида в полиморф формы I, который включает стадию нагревания композиции, включающей полиморф формы II, при температуре, равной выше точки плавления полиморфа формы II и ниже, чем точка плавления полиморфа формы I, с получением полиморфа формы I.
62. Способ по п.61, дополнительно включающий стадию охлаждения композиции после нагревания с образованием полиморфа формы I.
63. Способ по п.61, в котором композицию подвергают действию температуры около 172шC или выше.
64. Способ по п.63, дополнительно включающий стадию охлаждения композиции после нагревания с образованием полиморфа формы I.
65. Способ по п.63, в котором композицию подвергают действию температуры около 192шC или ниже.
66. Способ по п.65, дополнительно включающий стадию охлаждения композиции после нагревания с образованием полиморфа формы I.
67. Способ превращения полиморфа формы II N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида в полиморф формы I, который включает стадию нагревания композиции, включающей полиморф формы II, в течение достаточного периода времени и при температуре, достаточной для образования полиморфа формы I.
68. Способ по п.67, дополнительно включающий стадию охлаждения нагретой композиции с образованием полиморфа формы I.
69. Способ превращения полиморфа формы II N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a]пиримидин-7-ил}фенил)ацетамида в полиморф формы I, который включает стадию подвергания композиции, включающей полиморф формы II, воздействию механической энергии в течение времени, достаточного для образования полиморфа формы I.
70. Способ по п.69, в котором композицию подвергают воздействию механической энергии в аппарате, уменьшающем размер частиц.
71. Способ по п.70, в котором аппаратом, уменьшающим размер частиц, является мельница.
72. Способ по п.71, в котором мельницу выбирают из группы, состоящей из мельницы жидкостной энергии, струйной или вихревой мельницы, вальцевой мельницы и шаровой мельницы.
73. Полиформ формы I N-метил-N-(3-{3-[2-тиенилкарбонил]пиразол[1,5-a ]пиримидин-7-ил}фенил)ацетамида, полученный в соответствии со способом по любому из пп.54-72.
Текст
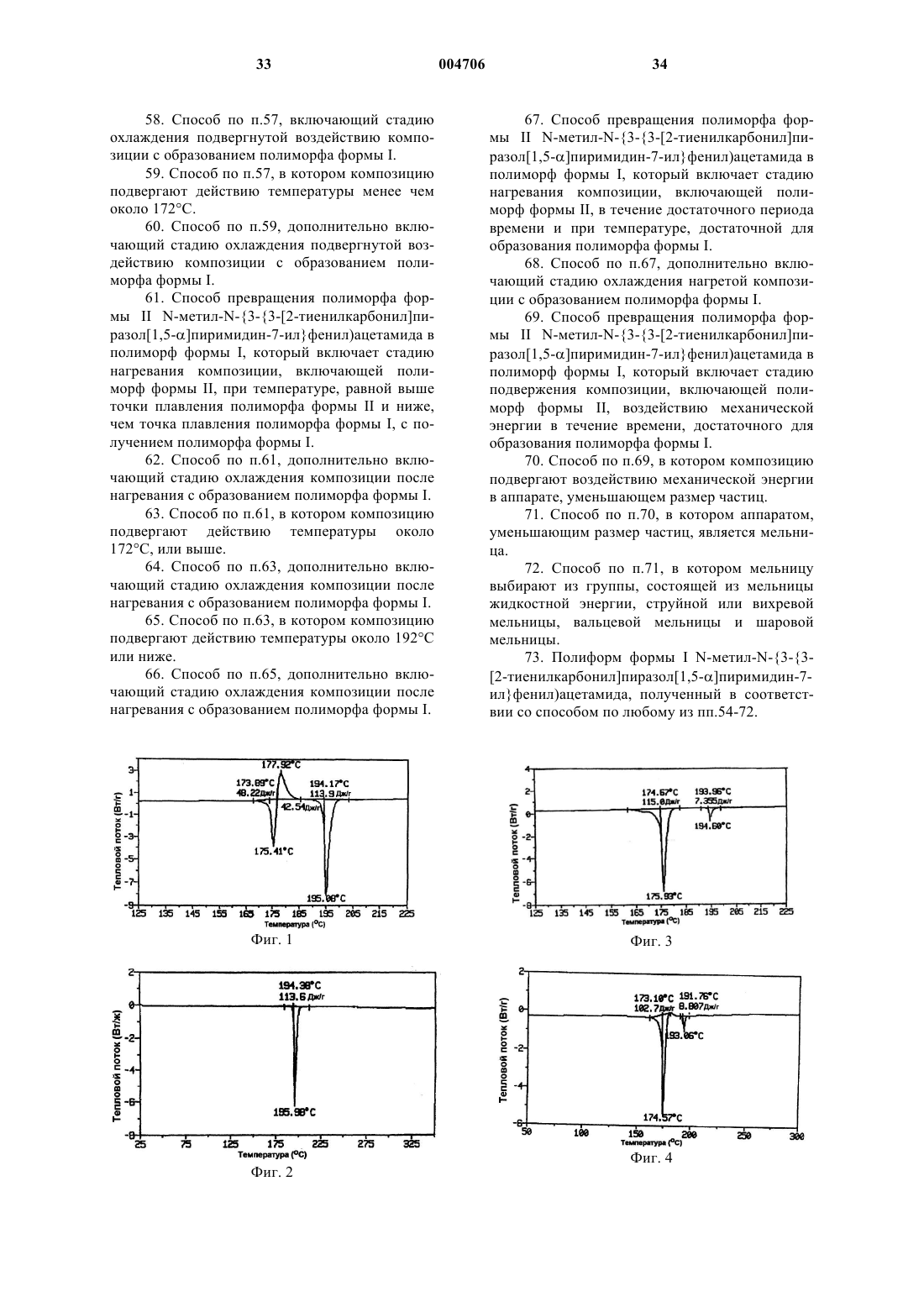
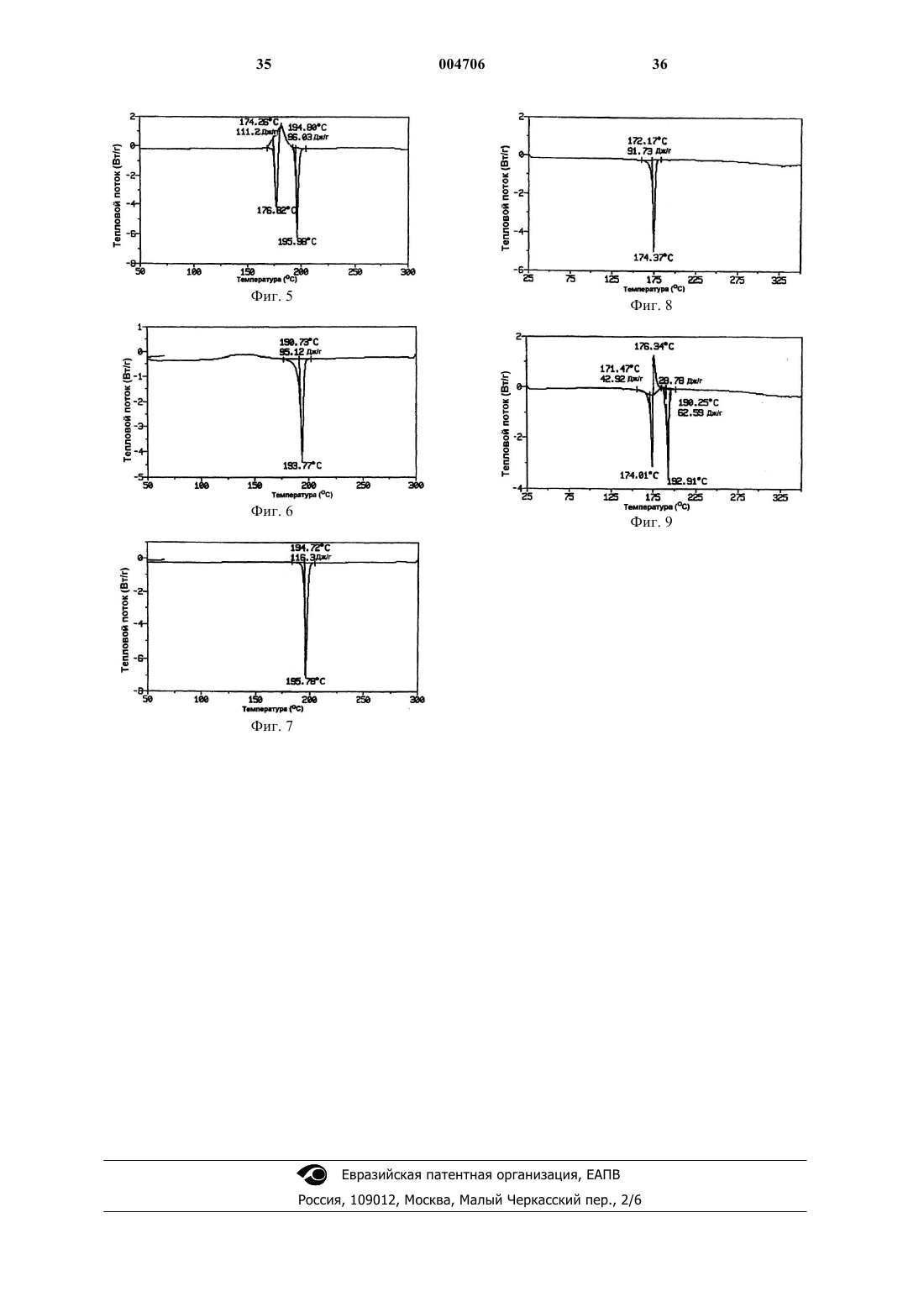
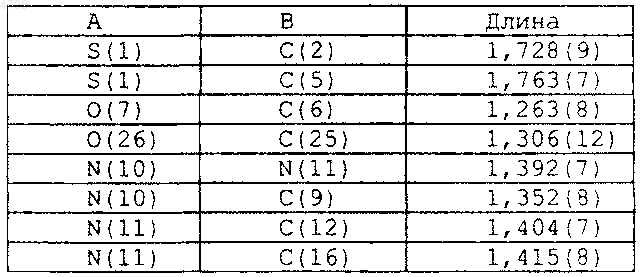
1 Настоящее изобретение относится к полиморфамN-метил-N-(3-3-[2-тиенилкарбонил] пиразол[1,5-]пиримидин-7-илфенил)ацетамида, обладающим активностью в широком интервале показаний и особенно полезным для лечения бессонницы, и к связанным с ними процессам, композициям и способам. Предпосылки изобретения Термин бессонница применяется для описания всех состояний, связанных с ощущением пациентом недостатка сна или сна, не дающего отдыха (Dement, International Pharmacopsychiatry 77:3-38, 1982). Бессонница является наиболее частой жалобой, отмечаемой у 32% взрослого населения, проживающего в окрестностях Лос-Анджелеса (Bixler et al, Amer. Journal of Psychiatry 136:1251-1262, 1979), и у 13% населения, проживающего в Сан-Марино, Италия (Lugaresi et al., Psychiatric Annals 77:446453, 1987). У 45% полностью осмотренного взрослого населения, проживающего в округеAlachua, Флорида, наблюдались проблемы с засыпанием или со сном (Karacan et al., SocialScience and Medicine 10:239-244, 1976). Также было показано, что распространенность случаев бессонницы зависит от возраста и пола пациентов, причем, она более высока у пациентов старшего возраста и у женщин. Бессонница, если ее оставить без лечения,может привести к нарушениям обмена веществ и общего функционирования организма, к пониженной работоспособности и значительным изменениям настроения, поведения и психомоторной функции. С хронической бессонницей связана более высокая частота возникновения заболеваний и смертности. Обычно лечение бессонницы включает лечение и/или смягчение воздействия этиологических факторов, улучшение гигиены сна и введение снотворных средств. Для ранних снотворных средств, таких как барбитураты, наряду с положительным эффектом был выявлен целый спектр нежелательных побочных эффектов и отдаленные осложнения. Например, в течение многих часов после приема барбитураты способны приводить как к летаргии или сонливости, спутанности сознания, депрессии и многообразию других остаточных явлений, а также к высокой степени привыкания к ним. В 1980-ые годы лечение бессонницы лекарственными препаратами сместилось от применения барбитуратов и других депрессантов центральной нервной системы (ЦНС) в сторону седативно-гипнотических средств бензодиазепинового класса. Данный класс снотворных средств успокаивающего действия показал значительную эффективность в оказании успокаивающего действия, которое выражалось у человека и животных в возникновении состояния,похожего на сон (Gee et al., Drugs in Central 2 степени безопасности по сравнению с предшествующими снотворными средствами, барбитуратами или хлоральгидратом (Cook and Sepinwall, Mechanism of Action of Benzodiazepines,Costa and Greengard (eds.), New York, RavenPress, 1975, p. 1-28). Считается, что терапевтическое действие бензодиазепинов осуществляется опосредованно через связывание комплексов бензодиазепин-гамма-аминомасляная кислота (ГАМК) со специфическим рецептором в головном мозге. В результате данного связывания, в содержащих комплекс бензодиазепинГАМК нейронах нарушается синаптическая передача (Clody et al., Benzodiazepines II, Rechtschaffen and Kales (eds.), New York, SpringerVerlag, 1989, p. 341-354). Полезность в клинике различных бензодиазепиновых снотворных средств связана, главным образом, с их фармакокинетическими различиями в отношении, в частности, данного связывания и времени полураспада исходного соединения и его активных метаболитов (Finkle, Benzodiazepines II, Rechtschaffen and Kales (eds.), New York, SpringerVerlag, 1989, p. 619-628). Однако, как и в случае с барбитуратами,многие бензодиазепины также обладают побочными эффектами, которые ограничивают их полезность в некоторых группах пациентов. Данные проблемы включают синергическое действие с другими депрессантами ЦНС (особенно алкоголем), развитием толерантности при повторном применении, следующая за прерыванием их приема рикошетная (rebound) бессонница, явление похмелья на следующий день и ухудшение психомоторной деятельности и памяти (Cook and Sepinwall, supra; Hartman,Benzodiazepines II, Rechtschaffen and Kales (eds.),New York, Springer-Verlag, 1989, p. 187-198;Linnoila and Ellinwood, Benzodiazepines II,Rechtschaffen and Kales (eds.), New York,Springer-Verlag, 1989, p. 601-618). Нарушение памяти, которое может включать амнезию в отношении произошедших до или после приема лекарства событий, касается прежде всего лиц пожилого возраста, чья познавательная деятельность уже может быть ослаблена в связи с процессом старения (Ayd, Benzodiazepines II, Rechtschaffen and Kales (eds.), New York, SpringerVerlag, 1989, p. 593-600; Finkle, supra; Linnoilaand Ellinwood, supra). Совсем недавно был разработан новый класс средств. Данные средства являются не бензодиазепиновыми соединениями, которые селективно связываются со специфичным подтипом бензодиазепиновых рецепторов. Предполагается, что избирательность данного рецептора является механизмом, через который данные соединения способны оказывать сильное снотворное действие, демонстрируя также при этом улучшенный профиль безопасности по сравнению с неселективным бензодиазепиновым классом агентов. Первым из данных средств, одоб 3 ренным United States Food and Drug Administration (FDA) для выпуска в продажу в США был амбиен (Ambien) (золпидемтартрат), основанный на имидазопиридиновом скелете (см. патенты США 4382938 и 4460592). В дополнение к амбиену недавно было одобрено FDA еще одно соединение, известное как Соната (залеплон) и являющееся соединением на основе пиразолопиримидина, (см. патент США 4626538). Ранее сообщалось также о других небензодиазепиновых соединениях и/или способах их производства и применения (см., например, патенты США 4794185, 4808594,4847256, 5714607, 4654347, 5891891). Несмотря на значительные успехи, достигнутые в данной области, до сих пор в данной области техники существует потребность в соединениях, эффективных в качестве успокаивающих или снотворных агентов, особенно в контексте лечения бессонницы. Один из таких классов соединений раскрыт в патентах США 4521422 и 4900836. В данных патентах,особенно в патенте США 4521422, описывается класс соединений, охватывающий некоторые арильные и гетероарильные [7-(арил и гетероарил)пиразоло[1,5-]пиримидин-3-ил]метаноны. Более конкретно, в патенте США 4521422 говорится, что соединения данного класса могут быть получены взаимодействием соответствующим образом замещенного пиразола (а) с соответствующим образом замещенным 3-диметиламино-2-пропен-1-оном (b). Одним из конкретных соединений, охватываемых классом соединений в соответствии с патентом США 4521422, является N-метилN-(3-3-[2-тиенинилкарбонил]пиразол[1,5-] пиримидин-7-илфенил)ацетамид,имеющий следующую структуру 1 (обозначаемую здесь как соединение 1): Соединение 1 может быть получено в соответствии с процедурами, раскрытыми в патенте США 4 521422, причем наиболее конкретно процедура раскрыта в примере 1. Кратко,соединение 1 получают по реакции соответствующим образом замещенного пиразола (а) (например, в котором R2 является водородом и R3 является 2-тиенилом) с 3-диметиламино-2 004706 4 пропен-1-оном (b) (например, в котором R5 и R6 являются водородом, a R7 является 3N(СН 3)(СОСН 3) фенилом), с последующей перекристаллизацией из смеси дихлорметан/ гексан. Как очевидно понятно любому специалисту в данной области техники, дихлорметан используется для селективной солюбилизации или экстрагирования соединения 1 для избавления от нежелательных примесей, при этом последующее добавление гексана вызывает кристаллизацию или выход соединения 1. Полученное данным образом соединение 1 существует в виде смеси полиморфов. Хотя соединение 1 оказалось особенно многообещающим соединением для лечения бессонницы, желательны улучшенные формы данного соединения, особенно, что касается улучшенной растворимости, возможности пероральной доступности и/или физической стабильности. Настоящее изобретение удовлетворяет данную потребность и обеспечивает дополнительные преимущества. Сущность изобретения Настоящее изобретение относится к по существу чистым полиморфам соединения 1(называемых здесь формой I и формой II),которые обладают особенно благоприятными свойствами. По существу, чистый полиморф формы I соединения 1 проявляет преобладающую эндотерму примерно при 196 С (192-197 С, согласно измерениям с помощью модулированного дифференциального сканирующего калориметра(ДСК) ТА 2920 при скорости сканирования 10 С в минуту), и содержит менее чем около 6% по массе формы II. Конкретные воплощения по существу чистого полиморфа формы I содержат менее чем около 2% примесей по массе, менее чем около 1% воды по массе и/или менее чем около 0,5% остаточного органического растворителя по массе. Еще одно воплощение включает по существу чистый полиморф формы I, содержащий менее чем 1% примесей по массе,менее чем около 0,75% воды по массе и менее чем 0,4% остатка органического растворителя по массе. Другие воплощения полиморфа формы I описаны ниже. По существу, чистый полиморф формы II соединения 1 обнаруживает преобладающую эндотерму примерно при 176 С (173-177 С, согласно измерениям с помощью модулированного дифференциального сканирующего калориметра ТА 2920 при скорости сканирования 10 С в минуту), и содержит менее чем около 20% формы I по массе. Конкретные воплощения по существу чистого полиморфа формы II содержат менее чем около 2% примесей по массе,менее чем около 1% воды по массе и менее чем около 0,5% остаточного органического растворителя по массе. Еще одно воплощение включает по существу чистый полиморф формы II, содержащий менее чем 1% примесей по массе, 5 менее чем около 0,75% воды по массе и менее чем 0,4% остаточного органического растворителя по массе. Другие воплощения полиморфа формы II описаны ниже. Полиморфы формы I и формы II полезны в основном в качестве успокаивающих или снотворных агентов и, более конкретно, при лечении бессонницы. Таким образом, настоящее изобретение также относится к способам лечения различных состояний путем введения эффективного количества полиморфа формы I и/или формы II нуждающемуся в этом животному или субъекту (обозначаемому здесь как пациент), обычно теплокровному животному(включая человека). Перед введением вводимый полиморф обычно приготавливается в виде фармацевтической композиции, которая содержит эффективное дозированное количество полиморфа в сочетании с одним (или несколькими) фармацевтически приемлемым (приемлемыми) носителем(носителями). Состояния, которые можно лечить с помощью полиморфов настоящего изобретения или фармацевтической композиции, содержащей полиморф настоящего изобретения, включают любое расстройство или заболевание,симптомы которого могут быть улучшены или ослаблены путем введения полиморфа в соответствии с изобретением, который обладает транквилизирующим, антианоксическим, снотворным, гипнотическим, противосудорожным и/или расслабляющими скелетные мышцы свойствами. Такие состояния включают конкретно бессонницу, а также расстройства сна и другие неврологические и психиатрические проявления; состояния тревоги; связанные с бессоницей растройства, такие как являющиеся следствием борьбы с поведенческими расстройствами, свойственными при поражении сосудов головного мозга и склерозом головного мозга,часто встречающиеся в гериатрике; ассоциированное с черепно-мозговыми травмами эпилептическое вертиго; и энцефалопатии при нарушении обмена веществ. Описываются также другие аспекты изобретения, предоставляя способы получения полиморфов формы I и формы II. Согласно одному воплощению, по существу чистую форму I вещества 1 получают путем приготовления раствора ацетона и соединения 1, охлаждения раствора с образованием кристаллизованной массы и сбора кристаллизованной массы с получением по существу чистой формы I. В другом воплощении, по существу чистую форму II соединения 1 получают путем приготовления раствора метанола и соединения 1, охлаждения гомогенного раствора с образованием кристаллизованной массы и сбора кристаллизованной массы с получением по существу чистой формы II. Конкретные воплощения изобретения включают воплощения, в которых раствор соединения 1 дополнительно содержит один или более других 6 органических растворителей, образуя, таким образом, комбинированный гомогенный раствор. Еще один аспект изобретения относится к способу превращения полиморфа формы II в полиморф формы I. Конкретные воплощения данного аспекта включают 1) подвержение полиморфа формы II действию высокой энергии,такой как тепловая энергия или механическая энергия. Такие процессы включают: 1) воздействие на полиморф формы II повышенной температурой в течение достаточного периода времени для превращения полиморфа формы II в полиморф формы I; 2) измельчение или растирание в порошок полиморфа формы II с образованием полиморфа формы I; 3) растворение полиморфа формы II в ацетоне (или в сочетании ацетона и одного или нескольких других растворителей) с получением раствора, охлаждение раствора с образованием кристаллизованной массы, и сбор кристаллизованной массы с получением по существу чистой формы I; и/или 4) нагревание полиморфа формы II выше его точки плавления, с образованием расплавленной массы и охлаждение расплавленной массы с образованием полиморфа формы I. Данный аспект изобретения может также применяться для очистки партий полиморфа формы I, содержащих неприемлимые количества полиморфа формы II,подвержением неочищенного полиморфа формы I одной или более конкретным обработкам данного аспекта изобретения описанным выше. Описываются также композиции, содержащие по существу чистую форму I или формуII в сочетании с фармацевтически приемлемым носителем. Такие композиции могут иметь различные формы, включая пилюли, таблетки и капсулы для перорального введения. Данные и другие аспекты изобретения станут очевидными при рассмотрении последующего подробного описания изобретения и прилагаемых фигур. С этой целью в данном описании приводятся некоторые патентные и другие документы для большей конкретизации различных аспектов изобретения. Каждый из данных документов включен в настоящее описание в качестве ссылки во всей своей полноте. Краткое описание фигур Фиг. 1 представляет измеренную методом дифференциальной сканирующей калориметрии(ДСК) термограмму соединения 1, полученного с помощью общепринятых приемов. Фиг. 2 представляет ДСК-термограмму полиморфа соединения 1 с высокой точкой плавления, называемого здесь формой I. Фиг. 3 представляет ДСК-термограмму полиморфа соединения 1 с низкой точкой плавления, называемого здесь формой II. Фиг. 4 представляет ДСК-термограмму по существу чистого полиморфа формы II. 7 Фиг. 5 представляет ДСК-термограмму неочищенного образца полиморфа формы II с высоким содержанием формы I. Фиг. 6 представляет ДСК-термограмму,подтверждающую полное превращение полиморфа формы II фиг. 4 в полиморф формы I в результате нагревания. Фиг. 7 представляет ДСК-термограмму,подтверждающую полное превращение полиморфа формы II фиг. 5 в полиморф формы I в результате нагревания. Фиг. 8 представляет ДСК-термограмму полиморфа формы II перед подвержением измельчению с высокой энергией. Фиг. 9 представляет ДСК-термограмму соединения 1 фиг. 8 после того, как полиморф формы II был подвергнут одному циклу измельчения с высокой энергией. Подробное описание изобретения Твердые вещества существуют или в аморфной, или в кристаллической формах. В кристаллических формах молекулы расположены в узлах трехмерной решетки. Когда соединение перекристаллизовывают из раствора или суспензии, оно может кристаллизоваться с различными пространственными перегруппировками решетки, свойство, называемое полиморфизмом, причем различные формы кристаллов называют полиморфами. Различные полиморфные формы заданного вещества могут отличаться друг от друга в отношении одного или более физических свойств, таких как растворимость и диссоциация, истинная плотность, форма кристалла, поведение при уплотнении, реологические свойства и/или стабильность в твердом состоянии. В случае химического вещества,которое существует в двух (или более) полиморфных формах, нестабильные формы обычно превращаются в более термодинамически стабильные при заданной температуре после достаточного периода времени. Когда данная трансформация не является быстрой, термодинамически нестабильную форму называют метастабильной формой. Вообще, стабильная форма имеет наиболее высокую точку плавления, наиболее низкую растворимость и максимальную химическую стабильность. Однако при нормальных условиях хранения метастабильная форма может проявлять достаточную химическую и физическую стабильность, что позволяет ее применять в коммерческой форме. В данном случае метастабильная форма хотя и менее стабильная, может проявлять желательные свойства по сравнению со свойствами стабильной формы, такие как улучшенная растворимость или более хорошая биологическая доступность при пероральном применении. В практике настоящего изобретения обнаружены два различных полиморфа соединения 1 и были разработаны способы их получения. Неожиданно было обнаружено, что по существу чистые полиморфные формы соединения 1 яв 004706 8 ляются особенно преимущественными, что касается их применения в качестве фармацевтического агента. Авторы настоящего изобретения обнаружили полиморф формы I, имеющий высокую точку плавления, порядка около 196 С, и полиморф формы II, имеющий низкую точку плавления, около 176 С, по данным измерения с помощью модулированного дифференциального сканирующего калориметра ТА 2 920 (ТА Instruments, New Castle, Delaware) при скорости сканирования 10 С в минуту. Фиг. 1 представляет термограмму дифференциальной сканирующей калориметрии(ДСК) (измеренную указанным выше прибором) соединения 1, полученного в соответствии с известным уровнем техники (см. пример 1). Как показано на фигуре 1, соединение 1 проявляет эндотермы при 175,41 С и 195,08 С, и экзотерму при 177,93 С, что подтверждает присутствие как полиморфа формы I с высокой точкой плавления, так и полиморфа формы II с низкой точкой плавления. Фиг. 2 представляет ДСК-термограмму по существу чистой полиморфной формы I, полученной в соответствии с настоящим изобретением. Фиг. 3 представляет ДСК-термограмму по существу чистой полиморфной формы II. Как показано на фиг. 2, форма I проявляет преобладающую эндотерму при 195,98 С, в то время как на фиг. 3 показано, что форма II проявляет преобладающую эндотерму при 175,93 С (второстепенная эндотерма при 194,6 С на фиг. 3 вследствие присутствия формы I в количестве около 6% по массе). В зависимости от скорости нагревания, т.е. скорости сканирования, с которой проводится ДСК-анализ, применяемого стандарта калибровки, калибровки инструмента, относительной влажности и химической чистоты, эндотермы соответствующих форм I и II могут варьировать примерно на 0,01-10 С, или примерно на 0-5 С,выше или ниже эндотерм, представленных на рисунках. Для любого заданного примера наблюдаемая эндотерма также может различаться от прибора к прибору; однако, обычно она находится в определенных здесь интервалах, при условии, что приборы откалиброваны сходным образом. Полиморфы формы I и формы II отличаются по своей кристаллической структуре, как было определено с помощью метода монокристаллической рентгенокристаллографии. Данные, относящиеся к спектру монокристаллической рентгенокристаллографии для формы I,представленые в последующих табл. 1-6, получены на четырехциклическом гониостате Picker,оснащенном монохроматором Furnas (HOGcrystal) и модифицированном добавлением шаговых двигателей (Slo-Syn) на каждой из четырех осей, и пятый мотор приводит в движение 20-позиционный барабан фильтра/аттенюатора. 9 Таблица 1. Параметры кристалла формы I 10 3) Отмеченные звездочкойпараметры не варьировались. Таблица 3. Длины связей для формы I Таблица 2. Фракционные координаты и изотропные термические параметры для формы I Примечания: 1) Фракционные координаты X 104 для неводородных атомов и X 103 для атомов водорода. Biso значения X 10. 2) Изотропные значения для анизотропно очищенных атомов вычислены по формуле,предложенной W. С. Hamilton, Acta Cryst,12,609 (1959). 11 Таблица 4. Углы связей для формы I 12 Таблица 5. Анизотропные термические параметры для формы I (bij форма) Примечание: Формула анизотропного термического параметра: exp[-h2)b11 + (k2)b22 + (l2)b33 + 2hkbl2 + 2hlbl3 + 2klb23)] Все значения X 104. Таблица 6. Анизотропные термические параметры для формы I (Uij форма) По аналогии, данные, относящиеся к спектру монокристаллической рентгенокристаллографии формы II, представлены в последующих табл. 7-12. 13 Таблица 7. Параметры кристалла формы II 14 Таблица 9. Длины связей для формы II Таблица 8. Фракционные координаты и изотропные термические параметры для формы II Таблица 10. Углы связей для формы IIX 104 для неводородных атомов и X 103 для атомов водорода. Biso значения X 10. 2) Изотропные значения для анизотропно очищенных атомов вычислены по формуле,предложенной W. С. Hamilton, Acta Cryst,12,609 (1959). 3) Отмеченные звездочкойпараметры не варьировались. 16 Таблица 12. Анизотропные термические параметры для формы II (Uij форма) Таблица 11. Анизотропные термические параметры для формы II (bij форма) Примечание: Формула для анизотропного термического параметра: ехр[-h2)b11 + (k2)b22 + (l2)b33 + 2hkb12 + 2hlb13 + 2klb23)] Все значения X 104. Примечание: Формула для анизотропного термического параметра:+ 2kl(b)(c)U23 Все значения X 103. Как видно из представленных выше данных, при получении в соответствии с методиками, известными в технике, соединение 1 существует в виде смеси полиморфных форм I и II. Было обнаружено, что описанная выше форма I представляет собой стабильный полиморф, с высокой точкой плавления, в то время как форма II представляет метастабильный полиморф, с низкой точкой плавления. В контексте настоящего изобретения считается, что форма I является по существу чистой, когда форма II составляет менее чем приблизительно 6%, менее чем приблизительно 3% или менее чем приблизительно 1% по массе формы I. Считается, что форма II является по существу чистой, когда форма I составляет менее чем приблизительно 20%, менее чем приблизительно 10% или менее чем приблизительно 5% по массе формы II. В дополнение, по существу чистая форма или формы I или формы II обычно содержит менее чем приблизительно 2% общих примесей по массе, менее чем приблизительно 1% воды и менее чем приблизительно 0,5% остаточного органического растворителя. Полиморфные формы I и II настоящего изобретения могут быть получены путем кристаллизации, исходя из соединения 1, причем каждый полиморф получается в результате кристаллизации из различных растворителей. Более конкретно, соединение 1 может быть получено в соответствии с процедурой, описанной в патенте США 4521422. Соединение 1 затем кристаллизуют из ацетона, как описано в примере 2, получая форму I. Форма II может быть также получена из соединения 1, как указано выше, но 17 путем кристаллизации из метанола, как описано в примере 3. Соответственно, согласно еще одному воплощению настоящего изобретения раскрывается процесс получения по существу чистой формы I или формы II. Процесс включает стадию получения гомогенного раствора N-метил-N-(33-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида в ацетоне (для получения формы I) или в метаноле (для получения формы II). Гомогенный раствор можно получить, например, смешиванием N-метил-N-(3-3[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7 илфенил)ацетамида с подходящим растворителем с последующим нагреванием. Гомогенный раствор затем охлаждают, что приводит к кристаллизации по существу чистой формы I (если растворителем является ацетон) или по существу чистой формы II (если растворителем является метанол), кристаллы затем собирают и сушат(например, при 40 С в течение периода времени, такого как шесть или более часов). Для того чтобы осуществить предпочтительную кристаллизацию одной формы по сравнению с другой, в кристаллизационный растворитель можно добавить затравку кристаллов требуемого полиморфа. В зависимости от способа, с помощью которого проводится кристаллизация, полиморф формы II может быть получен кристаллизацией из растворителей, таких как метанол, ацетонитрил, 1-бутанол, диэтиловый эфир, N,N-диметилформамид (ДМФ), толуол, тетрагидрофуран(ТГФ) и их сочетания. Аналогичным образом полиморф формы I может быть получен кристаллизацией из растворителей, таких как ацетон, этилацетат, толуол и их сочетания. Крупномасштабные процессы производства обычно включают перемещение концентрированного раствора, содержащего требуемое соединение. Соответственно, соединение 1 может добавляться к кристаллизационному растворителю в твердом виде или в виде раствора в сорастворителе, таком как метиленхлорид,смесь метиленхлорид/гексан или в другом органическом растворителе. Затем полиморф кристаллизуют из ацетона или метанола, в зависимости от желания, для получения полиморфа формы I или формы II, соответственно. Концентрация соединения 1, присутствующего в сорастворителе, может варьировать от 0,1% по массе до насыщения, 0,1% по массе до приблизительно 16%. Концентрация соединения 1 в сорастворителе варьирует в зависимости от температуры, при которой содержится сорастворитель. Обычно, более высокие температуры дают более насыщенные растворы соединения 1. Раствор, содержащий сорастворитель и соединение 1, может добавляться к кристаллизационному растворителю (например, метанолу 18 или ацетону) или кристаллизационный растворитель может добавляться к раствору, содержащему сорастворитель и соединение 1. В любом случае, содержащий соединение 1 раствор обычно имеет температуру окружающей среды или повышенную температуру по сравнению с температурой окружающей среды, а кристаллизационный растворитель независимо первоначально охлаждается (температура ниже температуры окружающей среды), имеет температуру окружающей среды или находится при повышенной температуре (температура выше температуры окружающей среды). Альтернативно,раствор, содержащий соединение 1 и сорастворитель, может подвергаться обмену растворителя и образовывать раствор или гетерогенную смесь кристаллизационного растворителя и соединения 1, как описано в примере 4. При проведении кристаллизации в кристаллизационный растворитель может быть добавлена затравка одного или более кристаллов конкретного полиморфа для промотирования образования данных конкретных кристаллов. Затравка кристаллизационного растворителя является необязательной. Согласно одному воплощению, соединение 1 растворяют в горячем ацетоне. После того, как началось охлаждение,кристаллизационный растворитель затравливают кристаллами полиморфа формы I. Альтернативно, затравочные кристаллы могут добавляться, как только кристаллизационный растворитель насыщен соединением 1. Используемый здесь термин кристаллизационный растворитель означает растворитель или сочетание растворителей, применяемых для кристаллизации полиморфа соединения 1 для предпочтительного образования желаемого полиморфа формы I или формы II. Согласно одному воплощению, основной составной частью кристаллизационного растворителя, применяемого для кристаллизации полиморфа формы I, является ацетон. Согласно еще одному воплощению, основной составной частью кристаллизационного растворителя, применяемого для кристаллизации полиморфа формы II, является метанол. Кристаллизационный растворитель может также содержать один или более из описанных здесь сорастворителей. Сорастворитель может присутствовать в широком интервале количеств в зависимости от применяемой системы комбинированного растворителя и получаемого полиморфа. В качестве сорастворителей при кристаллизации формы I или формы II из ацетона или метанола, соответственно, могут применяться различные органические растворители. Сорастворитель обычно применяется в достаточно малых количествах для того, чтобы гарантировать, что он не будет препятствовать образованию требуемого полиморфа. Подходящие растворители включают полярные растворители,неполярные растворители, протонные раствори 19 тели, апротонные растворители, ацетон, метанол, этанол, пропанол, бутанол, этилацетат,ТГФ, ДМФ, диэтиловый эфир, ацетонитрил,толуол, дихлорметан, воду и их сочетания. Полиморф формы I может быть получен путем нагревания формы II в течение достаточного периода времени и при температуре, достаточной для процесса превращения. На фиг. 4 представлена ДСК-термограмма по существу чистого полиморфа формы II, содержащего приблизительно 92% формы II и приблизительно 8% формы I. На фиг. 5 представлена ДСКтермограмма смеси соединения 1, содержащей около 46% полиморфа формы I и около 54% полиморфа формы II. Данные количества были определены путем расчета площади внутри пика эндотермы для каждого соответствующего полиморфа, суммированием соответствующих площадей и вычислением относительного процента каждого пика относительно общей площади. Представленные на фиг. 4 и 5 ДСКтермограммы были получены с применением следующей процедуры. Образец нагревали от 15 С до 300 С при скорости сканирования 10 С в минуту в ДСК приборе и выдерживали при 300 С в течение одной минуты. Затем образец охлаждали до 15 С понижением температуры со скоростью 50 С в минуту. Данные ДСК получали во время роста температуры. Для получения ДСК-термограммы, представленной на фиг. 6, еще одну аликвоту образца (форма II) фиг. 4 обрабатывали на ДСК следующим образом. Образец нагревали от 15 до 185 С со скоростью сканирования 10 С в минуту и затем выдерживали при 185 С в течение одной минуты. Спустя минуту образец охлаждали до 15 С понижением температуры со скоростью 50 С в минуту. После завершения данного первого цикла нагревания образец нагревали от 15 до 300 С со скоростью сканирования 10 С в минуту и затем выдерживали при 300 С в течение одной минуты. Наконец образец охлаждали до 15 С понижением температуры со скоростью 50 С в минуту. ДСК данные получали во время второго цикла нагревания ДСК. В результате нагревания образца до температуры выше точки плавления полиморфа формы II и впоследствии охлаждения образца, неочищенный полиморф формы II превращался по существу в чистый полиморф формы I. Соответственно, путем воздействия на полиморф формыII повышенной температурой, равной здесь 185 С, которая выше точки плавления полиморфа формы II, в течение достаточного периода времени, в данном случае одной минуты,полиморф формы II может превращаться в полиморф формы I. Аналогичным образом, смесь образца фиг. 5 обрабатывали, как только что описано выше. В результате неочищенный образец полиморфа формы II, содержащий приблизительно 46% формы I и приблизительно 20 54% формы II, превращался в по существу чистый образец полиморфа формы I (см. фиг. 7). По существу чистую форму I также получают путем измельчения формы II или соединения 1, которое было получено в соответствии с известными приемами. Например, размалывание формы II на мельнице жидкостной энергии,струйной или вихревой мельнице, вальцевой или шаровой мельнице, или другом механическом устройстве до среднего размера частиц приблизительно от 1 до 15 мкм обычно превращает часть или всю форму II в форму I. На фиг. 8 представлена ДСК-термограмма по существу чистого полиморфа формы II перед размалыванием с высокой энергией и содержащего недектируемые количества полиморфа формы I. Путем пропускания полиморфа формы II через 24 зубчатую мельницу Retsch с 1 мм ситом, образовывалась неочищенная смесь, содержащая значительные количества формы II (приблизительно 41%) и формы I (около 59%), как показано на фиг. 9. После пропускания неочищенной смеси повторно через мельницу высокой энергии полиморф формы II может полностью превращаться в полиморф формы I. Аналогичным образом, неочищенный образец, порция или партия полиморфа формы I, содержащая неприемлемые количества полиморфа формы II, превращается в по существу чистый полиморф формы I путем измельчения неочищенного полиморфа формы I один, два, три, четыре, пять или более раз. Описанный выше процесс может выполняться комбинированно. Соответственно, полиморф формы II превращают в полиморф формыI путем нагревания полиморфа формы II, путем измельчения полиморфа формы II и/или растворения полиморфа формы II в ацетоне, содержащем растворитель, и кристаллизации из него полиморфа формы I. В каждом случае полиморф формы II может быть чистым, по существу чистым или неочищенным перед превращением в форму I. Считается, что полиморф формы I является тепло-стабильной формой соединения 1. Под терминами тепло-стабильный или физически стабильный подразумевается, что форма I является стабильной в направлении превращения в полиморф формы II, хотя он может быть лабильным в отношении разложения на другие соединения. Являясь полиморфом с высокой точкой плавления, форма I обладает значительными преимуществами над полиморфной смесью соединения 1, полученного в соответствии с известными методами. В частности, форма I проявляет превосходную физическую стабильность,позволяя таким образом осуществлять производство твердых дозированных форм без превращения в различные полиморфные формы. Это, в свою очередь, улучшает свойства измельчения и уплотнения лекарственного средства. 21 В дополнение, полиморф формы II с низкой точкой плавления также обладает значительными преимуществами над полиморфной смесью соединения 1, полученного в соответствии с известными методиками. В частности,форма II обладает лучшей водорастворимостью по сравнению с формой I и обычно лучшей по сравнению с формой I растворимостью в ряде органических растворителей (см. табл. 13). Форма II обычно является более растворимой в полярных и протонных растворителях по сравнению с формой I. Улучшенная растворимость соединения обычно увеличивает биологическую доступность данного соединения. Когда абсорбция вещества ограничена скоростью растворения, применение более растворимой и быстрее растворяющейся формы улучшает скорость и степень биологической доступности. Таблица 13. Примерная растворимость формы I и формы II в различных растворителях С целью введения полиморф данного изобретения может быть приготовлен в виде готовой формы фармацевтической композиции. Фармацевтические композиции настоящего изобретения включают полиморф и фармацевтически приемлемый носитель, при этом полиморф представлен в композиции в количестве,эффективном для лечения состояния, представляющего интерес. Предпочтительно, в зависимости от пути введения фармацевтические композиции настоящего изобретения включают полиморф в количестве от 0,1 до 250 мг на единичную дозу и более, обычно от 1 до 60 мг. Подходящие концентрации и дозы легко могут быть определены любым специалистом в данной области техники. Фармацевтически приемлемые носители хорошо известны специалистам в данной области. Для композиций, приготовленных в виде жидких растворов, приемлемые носители включают насыщенный солевой раствор и стерильную воду, и необязательно могут включать антиоксиданты, буферные растворы, бактериостаты и другие обычные добавки. Композиции могут также быть сформированы в виде пилюль,капсул, гранул или таблеток, которые содержат- в дополнение к полиморфу - разбавители, диспергирующие и поверхностно-активные агенты,связующие и смазывающие агенты. Специалист в данной области техники может подходящим 22 образом и соответствии с общепринятой практикой дополнительно сформировать готовую форму полиморфа, как, например, описано вRemington's Pharmaceutical Sciences, Gennaro,Ed., Mack Publishing Co., Easton, PA 1990. Согласно еще одному воплощению, настоящее изобретение представляет способ лечения состояний, при которых польза достигается при введении агентов, которые обладают транквилизирующим, антианоксическим, снотворным,гипнотическим,противосудорожным и/или расслабляющим скелетные мышцы свойствами. Подобные состояния включают как собственно бессонницу, так и, главным образом,расстройства сна и другие неврологические и психиатрические жалобы; состояния тревоги; встречаемые в гериартрической практике расстройства, такие как подавление расстройств поведения, ассоциированных с поражением сосудов головного мозга и склерозом головного мозга; ассоциированное с черепно-мозговыми травмами эпилептическое вертиго; и энцефалопатии при нарушении обмена веществ. Способы данного изобретения включают системное введение раскрытого в данном описании полиморфа, предпочтительно в форме фармацевтической композиции. Используемый термин системное введение охватывает как пероральный, так и парентеральный способы введения. Подходящие для перорального введения фармацевтические композиции включают порошки, гранулы, пилюли, таблетки и капсулы,а также и жидкости, сиропы, суспензии и эмульсии. Данные композиции могут также включать ароматизаторы, консерванты, суспендирующие, загущающие и эмульгирующие агенты и другие фармацевтически приемлемые добавки. Для парентерального введения соединения настоящего изобретения могут приготавливаться в виде водных растворов для инъекций, которые могут содержать буферные растворы, антиоксиданты, бактериостаты и другие обычно используемые в подобных растворах добавки. Следующие примеры предлагаются с целью иллюстрации, но не ограничения. Пример 1. Синтез соединения 1. Данный пример иллюстрирует синтез соединения 1 с помощью известных приемов, с получением соединения 1 в виде смеси полиморфных форм I и формы II, что подтверждается ДСК-термограммой фиг. 1.-Диметиламино-1-(2-тиенил)-2-пропен-1 он (3). Смесь 2-ацетилтиофена 2 (20,0 г, 159 ммоль) и диметилформамиддиметилацеталя (39 г, 327 ммоль) нагревали с обратным холодильником в атмосфере азота в течение 3 ч. Реакционную смесь охлаждали, концентрировали с получением твердого темно-оранжевого вещества. Твердое вещество собирали фильтрованием, растирали с раствором дихлорметана и эфира (1:10, 200 мл). Соединение 3 получали в виде твердого оранжевого вещества (22,0 г, 121 ммоль, 76%). ГХ/МС, m/z = 181 при tR = 11,83 мин. (100%). ЖХ/МС, [М+Н] = 182. 5-(2-Тиенил)изоксазол (4). Смесь соединения 3 (18,1 г, 100 ммоль) и гидроксиламингидрохлорида (7,0 г, 101 ммоль) в 100 мл безводного метанола нагревали с обратным холодильником в атмосфере азота в течение 2 ч. Реакционную смесь охлаждали, концентрировали и распределяли между водой и дихлорметаном. Дихлорметановый слой сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением соединения 4 в виде темного желто-оранжевого масла (14,1 г,93,3 ммоль, 93%). ГХ/МС, m/z = 151 при tR = 8,30 мин. (100%). ЖХ/МС, [М+Н] = 152.-[(Диметиламино)метилен]оксо-2-тиофенпропаннитрил (5). Смесь соединения 4 (13,0 г, 8 6 ммоль) и диметилформамиддиметилацеталя (22,4 г, 188 ммоль) нагревали с обратным холодильником в атмосфере азота в течение 3 ч. Твердое вещество осаждали из реакционной смеси. Реакционную смесь охлаждали, разбавляли дихлорметаном и эфиром (1:10, 200 мл). Твердое вещество собирали фильтрованием, растирали с раствором дихлорметана и эфира (1:20, 100 мл). Соединение 5 получали в виде оранжевого твердого вещества (13,5 г, 65,4 ммоль, 76%). ГХ/МС,m/z = 206 при tR = 13,39 мин. (100%). ЖХ/МС,[М+Н]' = 207.(3-Амино-1H-пиразол-4-ил)-2-тиенилметанон(6). К смеси нитрата аминогуанидина (17,1,125 ммоль) и соединения 5 (20,6 г, 100 ммоль) в абсолютном этаноле (120 мл) добавляли 10 н.NaOH. Реакционную смесь нагревали с обратным холодильником в течение 6 ч и удаляли растворители при пониженном давлении на роторном испарителе. Добавляли воду (250 мл) и отфильтровывали начальный образовывающийся осадок (13,3 г, 68,8 ммоль, 69%). При дополнительном стоянии, и у водного слоя осаждалось дополнительное количество желаемого соединения 6 (3,42 г, 17,7 ммоль, 18%). Соединение 6 получали в виде рыжевато-коричневого твердого вещества (всего 16,72 г, 86,5 ммоль,87%). ГХ/МС, m/z = 193 при tR = 13,67 мин.N-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]ацетамид (8). Смесь 3-ацетамидоацетофенона 7 (20 г,112,9 ммоль), диметилформамиддиметилацеталя (40,3 г, 338,6 ммоль) нагревали с обратным холодильником в атмосфере азота в течение 1 часа. Реакционную смесь охлаждали, разбавляли этилацетатом (150 мл) и эфиром (150 мл). Твердое вещество собирали фильтрованием,растирали с раствором этилацетата и гексанаN-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]-N-метилацетамид (9). К суспензии соединения 8 (22,07 г, 95 ммоль) в безводном диметилформамиде (114 мл) в атмосфере азота на ледяной бане добавляли гидрид натрия (4,75 г, 119 ммоль, 60% в минеральном масле) и в пределах 15 мин выделение газа прекращалось. К указанной выше реакционной смеси добавляли раствор метилиодида(14,2 г, 99,8 ммоль). Реакционную смесь перемешивали на протяжении ночи и подогревали до комнатной температуры. Продукт реакции растирали с гексаном (3 х 150 мл), который отбрасывался. Реакционную смесь выливали в ледяную воду, экстрагировали дихлорметаном(3 х 200 мл), который сушили над безводным сульфатом натрия. Сухой дихлорметан концентрировали, получая твердое вещество, которое растирали с раствором этилацетата и гексана(1:1, 200 мл). Соединение 9 получали в виде оранжевого твердого вещества (16,9 г, 68,6 ммоль, 72%). ГХ/МС, m/z = 246 при tR = 14,63 мин. (100%). ЖХ/МС, [М+Н]' = 247.(соединение 1). Смесь соединения 6 (11,0 г, 56,8 ммоль) и соединения 9 (14,0 г, 56,8 ммоль) в ледяной уксусной кислоте (200 мл) нагревали с обратным холодильником в течение 6 ч. 25 Выпаривание всех летучих веществ на роторном испарителе давало остаток в виде масла,который обрабатывали дихлорметаном (50 мл) и растирали с гексаном (200 мл). Осадок собирали фильтрованием и промывали смесью дихлорметан/гексан (1:10, 100 мл). Продукт сушили в вакууме при 40 С с получением смеси формы I и формы II соединения 1 в виде бледно-желтого твердого вещества (16,28 г, 43,2 ммоль, 76%). ЖХ/МС, [М+Н]' = 377. 1 Н ЯМР (CDC13, 300 МГц),(м.д.) 2,01 (с, 3H), 3,36 (с, 3H), 7,17 (д,1 Н), 7,22 (дд, 1 Н), 7,48 (Д, 1 Н), 7,67 (д, 1 Н), 7,72(дд, 1 Н), 7,90-8,10 (м, 2 Н), 8,10 (дд, 1 Н), 8,73 (с,1 Н), 8,85 (м, 1 Н). Пример 2. Синтез по существу чистой формы I. К 1,5 г соединения 1, полученного в примере 1, добавляли 100 мл ацетона. Раствор нагревали с обратным холодильником до тех пор,пока раствор не становился гомогенным. Раствор быстро фильтровали через воронку со стеклянной фриттой. Раствор оставляли постепенно охлаждаться до комнатной температуры,приблизительно в течение 1 ч. Смесь дополнительно охлаждали до 5 С с использованием ледяной бани. Образовавшееся твердое вещество собирали фильтрованием и промывали 10 мл холодного ацетона с получением 0,4 г формы I. Маточный раствор концентрировали до приблизительно 20 мл. Раствор охлаждали до 5 С,твердое вещество собирали фильтрованием и промывали 10 мл холодного ацетона с получением дополнительно 0,5 г формы I. Пример 3. Синтез по существу чистой формы II. К 1,4 г соединения 1, полученного в примере 1, добавляли 75 мл метанола. Раствор нагревали с обратным холодильником до тех пор,пока раствор не становился гомогенным. Раствор быстро фильтровали через воронку со стеклянной фриттой. Раствор оставляли постепенно охлаждаться до комнатной температуры,приблизительно в течение 1 ч. Смесь дополнительно охлаждали до 5 С с использованием ледяной бани. Образовавшееся твердое вещество собирали фильтрованием и промывали 10 мл холодного метанола с получением 0,5 г формыII. Маточный раствор концентрировали до приблизительно 10 мл. Раствор охлаждали до 5 С,твердое вещество собирали фильтрованием и промывали 10 мл холодного метанола с получением дополнительных 0,4 г формы II. Пример 4. Кристаллизация по существу чистой формы I из смеси ацетон/сорастворитель. К 38 г соединения 1, полученного в примере 1, добавляли 200 мл дихлорметана. Смесь перемешивали при 25 С до тех пор, пока раствор не становился гомогенным. Раствор фильтровали и к фильтрату добавляли 150 мл ацетона. Прозрачный желтый раствор нагревали для удаления дихлорметанового дистиллята. Во время перегонки медленно добавляли дополнительно 26 200 мл ацетона для замены объема дихлорметана. После удаления дихлорметана, о чем свидетельствовала температура дистиллята, перегонку продолжали до тех пор, пока объем раствора не уменьшался до приблизительно 200 мл. Нагревание прекращали и теплый раствор затравливали чистыми кристаллами полиморфной формы I. Раствор постепенно охлаждали до 5 С и продолжали перемешивание в течение нескольких часов. Суспензию фильтровали, собранные кристаллы промывали ацетоном и сушили в вакууме при 40 С с получением 36 г соединения 1 в виде полиморфной формы I. Пример 5. Превращение полиморфа формы II в форму I путем размалывания. 5,5 г соединения 1, состоящего из приблизительно 100% полиморфа формы II как показано на фиг. 8, пропускали через сито 30 меш. из нержавеющей стали и затем через мельницуRetsch с 24-хзубчатым ротором и 1 мм ситом. Выделяли 4,0 г (приблизительно 73%) соединения 1. Полученный материал содержал приблизительно 59% формы I и 41% формы II, как показано на фиг. 9. Данная процедура может быть повторена для полного превращения формы II в форму I. Пример 6. Превращение полиморфа формы II в форму I путем нагревания. Аликвоту по существу чистого полиморфа формы II (имеющего ДСК-термограмму фигуры 4) обрабатывали в модулированном ДСК калориметре ТА 2920 в соответствии со следующей программой: Равновесие при 15 С; Данные без хранения; Изотермический в течение 1 мин; Повышение температуры со скоростью 10 С/мин до 185 С; Изотермический в течение 1 мин; Понижение температуры со скоростью 50 С/мин до 15 С; Изотермический в течение 1 мин; Данные при хранении; Повышение температуры со скоростью 10 С/мин до 300 С; Изотермический в течение 1 мин; Данные без хранения; Понижение температуры со скоростью 50 С/мин до 15 С. На получающейся термограмме (фиг. 6) показан по существу чистый полиморф формы I(что подтверждалось эндотермой при 193,77 С). Аликвоту соединения 1, состоящего из смеси формы I и формы II, как показано на фиг. 5, обрабатывали таким же образом, получая термограмму фиг. 7, которая показывает только форму I (эндотерма только при 195,78 С). Представленное выше является подробным описанием конкретных воплощений настоящего изобретения. Очевидно понятно, что хотя здесь описаны с иллюстративной целью конкретные воплощения настоящего изобретения, возможны различные модификации без выхода за пределы существа и объема настоящего изобретения. Соответственно, настоящее изобретение не ограничивается ничем иным, кроме как прилагаемой формулой изобретения. Все раскрытые и заявленные здесь воплощения могут быть получены и осуществлены без излишнего экспериментирования с учетом раскрытия настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. По существу чистый полиморф формы I[1,5-]пиримидин-7-илфенил)ацетамида, показывающий преобладающую эндотерму при около 192-198 С по данным измерения с помощью дифференциального сканирующего калориметра. 2. По существу чистый полиморф формы I по п.1, который включает менее чем около 6% полиморфа формы II по массе. 3. По существу чистый полиморф формы I по п.2, который включает менее чем около 2% примесей по массе, менее чем около 1% воды по массе и менее чем около 0,5% остаточного органического растворителя по массе. 4. По существу чистый полиморф формы I по п.2, который показывает преобладающую эндотерму при около 195-197 С. 5. По существу чистый полиморф формы I по п.2, который имеет около 2 молекул на ячейку и имеет P1 bar пространственную группу по данным определения с помощью монокристаллической рентгенокристаллографии. 6. По существу чистый полиморф формы I по п.2, который имеет размеры кристалла около 0,120,050,015 мм и объем около 913 по данным определения с помощью монокристаллической рентгенокристаллографии. 7. По существу чистый полиморф формы I по п.2, который имеет вычисленную плотность около 1,37 по определению с помощью монокристаллической рентгенокристаллографии. 8. По существу чистый полиморф формы I по п.2, дополнительно характеризующийся следующими длинами связей по данным монокристаллической рентгенокристаллографии: 9. По существу чистый полиморф формы II[1,5-]пиримидин-7-илфенил)ацетамида, показывающий преобладающую эндотерму при около 172-179 С по данным измерения с помощью дифференциального сканирующего калориметра. 10. По существу чистый полиморф формыII по п.9, который включает менее чем около 20% полиморфа формы I по массе. 11. По существу чистый полиморф формыII по п.10, который включает менее чем около 2% примесей по массе, менее чем около 1% воды по массе и менее чем около 0,5% остаточного органического растворителя по массе. 12. По существу чистый полиморф формыII по п.10, который обнаруживает преобладающую эндотерму при около 173-177 С. 13. По существу чистый полиморф формыII по п.10, который имеет около 4 молекул на ячейку и является P2/al space группой по определению с помощью монокристаллической рентгенокристаллографии. 14. По существу чистый полиморф формыII по п.10, который имеет размеры кристалла около 0,350,200,12 мм и объем около 1797 по данным определения с помощью монокристаллической рентгенокристаллографии. 15. По существу чистый полиморф формыII по п.10, который имеет вычисленную плотность около 1,39 по данным определения с помощью монокристаллической рентгенокристаллографии. 29 16. По существу чистый полиморф формыII по п.10, дополнительно характеризующийся следующими длинами связей по данным монокристаллической рентгенокристаллографии: 17. Способ получения по существу чистой формы I N-метил-N-(3-3-[2-тиенилкарбонил] пиразол[1,5-]пиримидин-7-илфенил)ацетамида,включающий стадии образования раствора кристаллизационного растворителя, включающего ацетон, и N-метил-N-(3-3-[2-тиенилкарбонил] пиразол[1,5-]пиримидин-7-илфенил)ацетамида; охлаждения раствора с образованием массы кристаллов и сбор кристаллов формы I. 18. Способ по п.17, дополнительно включающий стадию сушки собранных кристаллов с получением по существу чистой формы I. 19. Способ по п.17, в котором стадия образования раствора включает стадии представления N-метил-N-(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида и контактирования карбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида с кристаллизационным растворителем. 20. Способ по п.19, в котором N-метил-N(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамид берут в виде твердого вещества. 21. Способ по п.19, в котором N-метил-N(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамид берут в виде концентрата в органическом сорастворителе. 22. Способ по п.21, в котором сорастворитель включает метиленхлорид. 23. Способ по п.19, дополнительно включающий стадию нагревания кристаллизационного растворителя для проведения растворения[1,5-]пиримидин-7-илфенил)ацетамида. 24. Полиморф формы I N-метил-N-(3-3[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7 илфенил)ацетамида, полученный в соответствии со способом по любому из пп.17-23. 25. Способ получения по существу чистой формы II N-метил-N-(3-3-[2-тиенилкарбонил] пиразол[1,5-]пиримидин-7-илфенил)ацетамида, включающий стадии образования раствора кристаллизационного растворителя, включающего метанол, и N-метил-N-(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил) ацетамида; охлаждения раствора с образованием массы кристаллов и сбор кристаллов формыII. 26. Способ по п.25, дополнительно включающий стадию сушки собранных кристаллов с получением по существу чистой формы II. 27. Способ по п.25, в котором стадия образования раствора включает стадии предоставления N-метил-N-(3-3-[2-тиенилкарбонил] пиразол[1,5-]пиримидин-7-илфенил)ацетамида и контактированияN-метил-N-(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида с кристаллизационным растворителем. 28. Способ по п.27, в котором N-метил-N(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамид берут в виде твердого вещества. 29. Способ по п.27, в котором N-метил-N(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамид берут в виде концентрата в органическом сорастворителе. 30. Способ по п.29, в котором сорастворитель включает метиленхлорид. 31. Способ по п.27, дополнительно включающий стадию нагревания кристаллизационного растворителя для растворения N-метил-N(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида. 32. Способ превращения полиморфа формы II N-метил-N-(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида в 31 полиморф формы I, включающий стадии предоставления композиции, включающей полиморф формы II по п.9, нагревания композиции до температуры, превышающей точку плавления полиморфа формы II и охлаждения композиции с образованием полиморфа формы I по п.1. 33. Полиморф формы I N-метил-N-(3-3[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7 илфенил)ацетамида, полученный в соответствии со способом по п.32. 34. Способ превращения полиморфа формы II N-метил-N-(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида в полиморф формы I, включающий стадии предоставления композиции, включающей полиморф формы II по п.9, и размалывания композиции один или более раз с получением полиморфа формы I по п.1. 35. Полиморф формы I N-метил-N-(3-3[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7 илфенил)ацетамида, полученный в соответствии со способом по п.34. 36. Способ превращения полиморфа формы II N-метил-N-(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида в полиморф формы I, включающий стадии предоставления композиции, включающей полиморф формы II по п.9, нагревания композиции до температуры, превышающей температуру окружающей среды, но ниже точки плавления полиморфа формы II, в течение периода времени, достаточного для превращения полиморфа формы II в полиморф формы I по п.1, и охлаждения полиморфа формы I. 37. Полиморф формы I N-метил-N-(3-3[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7 илфенил)ацетамида, полученный в соответствии со способом по п.36. 38. Композиция, включающая по существу чистую форму I N-метил-N-(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида по п.2 и фармацевтически приемлемый носитель. 39. Композиция по п.38, которая составлена в форме для перорального введения. 40. Композиция по п.39, которая представлена в форме пилюли, капсулы или таблетки. 41. Композиция по п.40, в которой форма I присутствует в единичной дозированной форме в количестве около 0,1-250 мг. 42. Композиция, включающая по существу чистую форму II N-метил-N-(3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида по п.10 и фармацевтически приемлемый носитель. 43. Композиция по п.42, которая составлена в форме для перорального введения. 44. Композиция по п.43, которая представлена в форме пилюли, капсулы или таблетки.II присутствует в единичной дозированной форме в количестве около 0,1-250 мг. 46. Способ лечения бессонницы у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы I по п.1. 47. Способ индуцирования сна у пациента,нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы I по п.1. 48. Способ индуцирования седативного эффекта или гипноза у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формыI по п.1. 49. Способ индуцирования расслабления скелетных мышц у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формыI по п.1. 50. Способ лечения бессонницы у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы II по п.9. 51. Способ индуцирования сна у пациента,нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формы II по п.9. 52. Способ индуцирования седативного эффекта или гипноза у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формыII по п.9. 53. Способ индуцирования расслабления скелетных мышц у пациента, нуждающегося в этом, включающий введение пациенту эффективного количества по существу чистой формыII по п.9. 54. Способ превращения полиморфа формы II N-метил-N-3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида в полиморф формы I, включающий стадию подвергания композиции, включающей полиморф формы II, воздействию тепловой энергии с получением тем самым полиморфа формы I. 55. Способ превращения полиморфа формы II N-метил-N-3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида в полиморф формы I, включающий стадию подвергания композиции, включающей полиморф формы II, нагреванию при температуре ниже точки плавления полиморфа формы II, с образованием тем самым полиморфа формы I. 56. Способ по п.55, дополнительно включающий стадию охлаждения композиции после нагревания с образованием полиморфа формы I. 57. Способ по п.55, в котором композицию подвергают воздействию температуры выше 15 С. 58. Способ по п.57, включающий стадию охлаждения подвергнутой воздействию композиции с образованием полиморфа формы I. 59. Способ по п.57, в котором композицию подвергают действию температуры менее чем около 172 С. 60. Способ по п.59, дополнительно включающий стадию охлаждения подвергнутой воздействию композиции с образованием полиморфа формы I. 61. Способ превращения полиморфа формы II N-метил-N-3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида в полиморф формы I, который включает стадию нагревания композиции, включающей полиморф формы II, при температуре, равной выше точки плавления полиморфа формы II и ниже,чем точка плавления полиморфа формы I, с получением полиморфа формы I. 62. Способ по п.61, дополнительно включающий стадию охлаждения композиции после нагревания с образованием полиморфа формы I. 63. Способ по п.61, в котором композицию подвергают действию температуры около 172 С, или выше. 64. Способ по п.63, дополнительно включающий стадию охлаждения композиции после нагревания с образованием полиморфа формы I. 65. Способ по п.63, в котором композицию подвергают действию температуры около 192 С или ниже. 66. Способ по п.65, дополнительно включающий стадию охлаждения композиции после нагревания с образованием полиморфа формы I. 67. Способ превращения полиморфа формы II N-метил-N-3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида в полиморф формы I, который включает стадию нагревания композиции, включающей полиморф формы II, в течение достаточного периода времени и при температуре, достаточной для образования полиморфа формы I. 68. Способ по п.67, дополнительно включающий стадию охлаждения нагретой композиции с образованием полиморфа формы I. 69. Способ превращения полиморфа формы II N-метил-N-3-3-[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7-илфенил)ацетамида в полиморф формы I, который включает стадию подвержения композиции, включающей полиморф формы II, воздействию механической энергии в течение времени, достаточного для образования полиморфа формы I. 70. Способ по п.69, в котором композицию подвергают воздействию механической энергии в аппарате, уменьшающем размер частиц. 71. Способ по п.70, в котором аппаратом,уменьшающим размер частиц, является мельница. 72. Способ по п.71, в котором мельницу выбирают из группы, состоящей из мельницы жидкостной энергии, струйной или вихревой мельницы, вальцевой мельницы и шаровой мельницы. 73. Полиформ формы I N-метил-N-3-3[2-тиенилкарбонил]пиразол[1,5-]пиримидин-7 илфенил)ацетамида, полученный в соответствии со способом по любому из пп.54-72.
МПК / Метки
МПК: C07D 487/04, A61K 31/519, A61P 25/20
Метки: ним, композиции, 1,5-а]пиримидин-7-ил}фенил)ацетамида, полиморфы, относящиеся, способы, n-метил-n-(3-{3-[2-тиенилкарбонил]пиразол
Код ссылки
<a href="https://eas.patents.su/19-4706-polimorfy-n-metil-n-3-3-2-tienilkarbonilpirazol-15-apirimidin-7-ilfenilacetamida-i-otnosyashhiesya-k-nim-kompozicii-i-sposoby.html" rel="bookmark" title="База патентов Евразийского Союза">Полиморфы n-метил-n-(3-{3-[2-тиенилкарбонил]пиразол [1,5-а]пиримидин-7-ил}фенил)ацетамида и относящиеся к ним композиции и способы</a>
Предыдущий патент: Применение n-замещенных 1,5-дидезокси-1,5-имино-d-глюцитных производных для лечения инфекций, вызываемых вирусами гепатита
Следующий патент: Кристаллы динуклеотида
Случайный патент: Новые гетероциклические соединения - ингибиторы hsp90 и способы их получения