Новые 4-(тетразол-5-ил) хиназолиновые производные в качестве противораковых средств
Номер патента: 18716
Опубликовано: 30.10.2013
Авторы: Пулла Редди Муддасани, Анантханени Лакшми, Венкайах Човдари Наннапанени, Конаканчи Дурга Прасад, Пула Субба Рао, Адибхатла Кали Сатиа Бхуджанга Рао
Формула / Реферат
1. 4-(Тетразол-5-ил)хиназолиновое производное формулы I
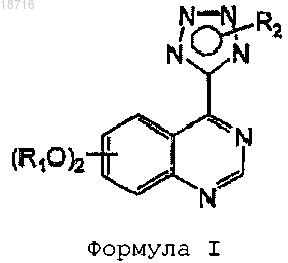
в которой каждый R1 представляет собой С1-С6алкил;
R2 представляет собой водород или его выбирают из группы, состоящей из замещенного бензила, пиридин-2-илметила и 1-метила-1Н-имидазол-2-илметила, где заместители для бензила независимо выбирают из группы, состоящей из нитро и амино;
или его фармацевтически приемлемая соль.
2. 4-(Тетразол-5-ил)хиназолиновое производное формулы I или его фармацевтически приемлемая соль по п.1, выбранное из:
a) 6,7-диметокси-4-(1-(3-нитробензил)-1Н-тетразол-5-ил)хиназолина;
b) 3-((5-(6,7-диметоксихиназолин-4-ил)-1Н-тетразол-1-ил)метил)анилина;
b') гидрохлорида 6,7-диметокси-4-(1-(3-аминобензил)-1Н-тетразол-5-ил)хиназолина;
c) 6,7-диметокси-4-(1-((1-метил-1Н-имидазол-2-ил)метил)-1Н-тетразол-5-ил)хиназолина;
d) 6,7-диметокси-4-(1-(пиридин-2-илметил)-1Н-тетразол-5-ил)хиназолина;
d') 6,7-диметокси-4-(1Н-тетразол-5-ил)хиназолина;
e) 6,7-диэтокси-4-(1Н-тетразол-5-ил)хиназолина;
f) 6,7-диэтокси-4-(1-(3-нитробензил)-1Н-тетразол-5-ил)хиназолина;
g) 3-((5-(6,7-диэтоксихиназолин-4-ил)-1Н-тетразол-1-ил)метил)анилина
h) 6,7-диэтокси-4-(1-((1-метил-1Н-имидазол-2-ил)метил)-1Н-тетразол-5-ил)хиназолина;
i) 6,7-диэтокси-4-(1-(пиридин-2-илметил)-1Н-тетразол-5-ил)хиназолина;
j) 6,7-дипропокси-4-(1Н-тетразол-5-ил)хиназолина;
k) 6,7-ди-н-пропокси-4-(1-(3-нитробензил)-1Н-тетразол-5-ил)хиназолина;
l) 3-((5-(6,7-ди-н-пропоксихиназолин-4-ил)-1Н-тетразол-1-ил)метил)анилина;
m) 4-(1-((1-метил-1Н-имидазол-2-ил)метил)-1Н-тетразол-5-ил)-6,7-ди-н-пропоксихиназолина;
n) 6,7-ди-н-пропокси-4-(1-(пиридин-2-илметил)-1Н-тетразол-5-ил)хиназолина.
3. Способ получения соединения формулы I по п.1 или его соли, который включает:
(а) обработку соединения формулы А
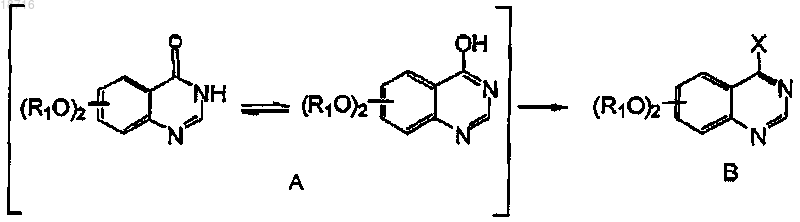
галогенирующим агентом, таким как тионилгалогенид, тригалогенид фосфора, пентагалогенид фосфора, фосфорилтригалогенид для получения 4-галогензамещенных хиназолиновых производных формулы В;
(b) обработку соединения формулы В
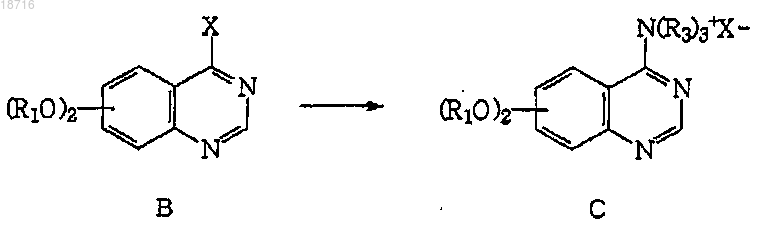
триалкиламином (N(R3)3), где R3 представляет собой C1-C6 линейную или разветвленную алкильную цепь, в подходящем растворителе, таком как толуол, ксилол или циклогексан, для получения замещенной четвертичной соли хиназолинил-4-триалкиламингалогенида формулы С;
(с) обработку соединения формулы С
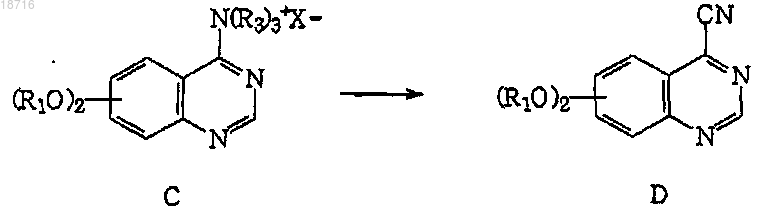
цианирующими агентами, выбранными из цианида натрия, цианида калия, цианида меди и триалкилсилилцианида, в подходящем растворителе, выбранном из толуола, ксилола, циклогексана, диметилформамида, диметилацетамида и формамида, для получения замещенных 4-аминохиназолинов формулы D;
(d) обработку соединения формулы D
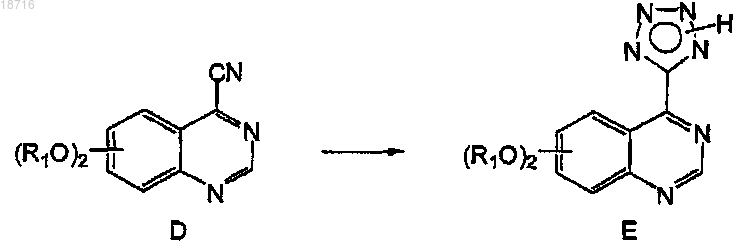
азидирующими агентами, выбранными из азида натрия и триалкилсилилазида, для получения соединений формулы Е, и затем, когда R2 не является водородом,
е) обработку соединения формулы Е алкилирующим агентом формулы F
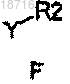
где Y означает галоген или сульфонильную уходящую группу в присутствии основания, такого как карбонаты щелочного металла, гидроксиды, гидриды металлов, алкоксиды металлов,
тетра-алкилгуанидины, алкил лития, LDA, с получением смеси соединений G и G1
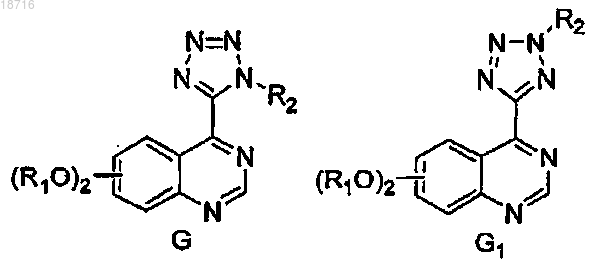
и (f) очистку смеси соединений формулы G и его изомера G1 перекристаллизацией из подходящего растворителя или препаративной хроматографией для получения требуемого соединения формулы I;
где в формулах А, В, С, D, E, F, G и G1, R1 и R2 представляют собой значения, определенные в п.1, и X представляет атом галогена или сульфонильную уходящую группу.
4. Фармацевтическая композиция для лечения гиперпролиферативного заболевания у млекопитающего, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
5. Способ лечения гиперпролиферативного заболевания у млекопитающего, который включает введение указанному млекопитающему терапевтически эффективного количества соединения по п.1.
6. Способ по п.5, в котором упомянутым гиперпролиферативным заболеванием является рак.
7. Способ по п.6, в котором указанный рак представляет собой рак легкого, плоских клеток, мочевого пузыря, желудка, поджелудочной железы, груди, головы, шеи, пищевода, мозга, гинекологический рак или рак щитовидной железы.
8. Способ по п.5, в котором гиперпролиферативное заболевание не является раком.
9. Способ ингибирования рецепторной тирозинкиназы EGF типа у субъекта, включающий введение указанному субъекту эффективного количества соединения по п.1.
Текст
I или их фармацевтически приемлемым солям, которые обладают антипролиферативной активностью, такой как противораковая активность, и, соответственно, являются пригодными в способах лечения человека и животного. Настоящее изобретение также относится к способам получения замещенных 4-(тетразол-5-ил)хиназолиновых производных, к фармацевтическим композициям, содержащим данные соединения, и к их применению для получения лекарственных средств для оказания антипролиферативного действия на теплокровного животного, такого как человек. Конаканчи Дурга Прасад, Пула Субба Рао, Анантханени Лакшми, Пулла Редди Муддасани, Адибхатла Кали Сатиа Бхуджанга Рао, Венкайах Човдари Наннапанени (IN) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: НАТКО ФАРМА ЛИМИТЕД (IN) Область техники, к которой относится настоящее изобретение Изобретение относится к замещенным 4-(тетразол-5-ил)хиназолиновым производным формулы I или их фармацевтически приемлемым солям, которые обладают антипролиферативной активностью,такой как противораковая активность и, соответственно, являются пригодными в способах лечения организма человека и животного. Настоящее изобретение также относится к способу получения замещенных 4-(тетразол-5-ил)хиназолиновых производных, к фармацевтическим композициям, содержащим данное соединение, и к их применению для получения лекарственных средств для оказания антипролиферативного действия на теплокровных животных, таких как человек. Во многих из предложенных ранее режимов лечения заболеваний, связанных с пролиферацией клеток, таких как псориаз и рак, применяют соединения, которые ингибируют синтез ДНК. Данные соединения обычно являются токсичными для клеток, но их токсический эффект на быстро делящиеся клетки,такие как клетки опухоли, может быть полезным. Альтернативные подходы к антипролиферативным средствам, которые действуют по механизмам, отличным от ингибирования синтеза ДНК, обладают способностью проявлять повышенную селективность действия. В последние годы было обнаружено, что клетка может стать раковой посредством трансформации части ее ДНК в онкоген, т.е. ген, который при активации приводит к образованию клеток злокачественной опухоли (Bradshaw, Mutagenesis, 1986, 1, 91). Несколько данных онкогенов вызывают синтез пептидов, которые являются рецепторами факторов роста. Комплекс с рецептором фактора роста впоследствии приводит к усилению клеточной пролиферации. Например, известно, что некоторые онкогены кодируют тирозинкиназные ферменты и что некоторые рецепторы факторов роста также представляют собой тирозинкиназные ферменты (Yarden et al., Ann. Rev. Biochem, 1988, 57, 443; Larsen et. al. Ann. Reports inMed. Chem. 1989, Chpt. 13). Неправильная передача сигнала является отличительной чертой канцерогенеза. Рецепторы поверхности клеток, их лиганды и белковые тирозинкиназы являются ключевыми компонентами сигнальных путей роста и являются мутированными или активированными при широком разнообразии опухолей у человека. В частности, путь с применением рецептора эпидермального фактора роста (EGFR) непосредственно связан с событиями, способствующими развитию опухоли, такими как клеточное деление, клеточная адгезия и миграция, ангиогенез и антиапоптоз. Сверхэкспрессия EGFR, обнаруженная, в целом, в одной трети случаях эпителиального рака, может изменяться от 20 до 80% в зависимости от гистологического типа и связана с устойчивостью к гормональной терапии, цитотоксическим агентам и радиации.EGFR относится к erbB семейству структурно связанных рецепторов, включающему EGFR (HER-1,erbBl), HER-2/neu (erbB2), HER-3 (erbB3) и HER-4 (erbB4). Данные трансмембранные гликопротеины содержат внешний лиганд-связывающий домен, цитоплазматический тирозинкиназный (ТК) домен и домен Src гомологичности 2 (SH2) для связывания субстрата. EGF, трансформирующий фактор роста-а и амфирегулин связываются исключительно с EGFR, тогда как гепаринсвязывающий EGF, бета-целлулин и эпирегулин связываются с EGFR и HER-4, и герегулины и нейрорегулины связываются с HER-3 иHER-4. Центральная роль EGFR в развитии рака вызвала напряженные усилия по разработке EGFR антагонистов. Две стратегии, которые наиболее удалены от клинических испытаний, представляют собой моноклональные антитела, которые блокируют связывание лиганда и активацию рецептора, и низкомолекулярные ингибиторы EGFR TK. Низкомолекулярные ингибиторы первого поколения действуют в качестве АТР аналогов, обратимо конкурирующих за ТК каталитический сайт. Более новые ингибиторы, которые находятся в разработке, проявляют необратимый антагонизм и/или нацелены на многочисленныеerbB рецепторы. Рецепторные тирозинкиназы играют важную роль в передаче биохимических сигналов, которые вызывают репликацию в клетке. Они представляют собой большие ферменты, которые связываются с клеточными мембранами и содержат внеклеточный связывающий домен для факторов роста, таких как эпидермальный фактор роста (EGF), и внутриклеточную часть, которая функционирует, как киназа для фосфорилирования тирозиновых аминокислот в белках и, следовательно, влияют на клеточную пролиферацию. Известны различные классы рецепторных тирозинкиназ (Wilks, Advances in Cancer Research,1993, 60, 43-73), исходя из семейств факторов роста, которые связывают различные рецепторные тирозинкиназы. Классификация включает рецепторные тирозинкиназы класса I, включающие EGF семейство рецепторных тирозинкиназ, таких как EGF, TGF, NEU, erbB, Xmrk, HER и Iet23 рецепторы, рецепторные тирозинкиназы класса II, включающие инсулиновое семейство рецепторных тирозинкиназ, таких как инсулиновый рецептор, IGFI и рецепторы, связанные с инсулином (IRR), и рецепторные тирозинкиназы класса III, включающие семейство факторов роста тромбоцитов (PDGF) рецепторных тирозинкиназ, такие как PDGF, PDGF и рецепторы колониестимулирующего фактора 1 (CDFl). Известно, что киназы класса I, такие как EGF семейство рецепторных тирозинкиназ, часто присутствуют при широко распространенных видах рака у человека, таких как рак молочной железы (SainsburyTreat., 19 94, 29, 73), немелкоклеточный рак легкого (NSCLC), включая аденокарциному (Cerny et., Brit. J.Cancer, 1986, 54, 265; Reubi et al., Int. J. Cancer, 1990, 45, 269; и Rusch et al., Cancer Research, 1993, 53,2379) и плоскоклеточный рак легкого (Hendler et al., Cancer Cells, 1989, 7, 347), рак мочевого пузыря(Neal et al., Lancet, 1985, 366), рак пищевода (Mukaida et al., Cancer, 1991, 68, 142), гастроинтестинальный рак, такой как рак толстой кишки, рак прямой кишки или рак желудка (Bolen et al., Oncogene Res., 1987,1, 149), рак простаты (Visakorpi et al., Histochem. J., 1992, 24, 481), лейкемия (Konaka et al., Cell, 1984, 31,1035) и рак яичников, бронхиальный рак или рак поджелудочной железы (European Patent SpecificationNo. 0400586). Поскольку следующие опухолевые ткани человека испытывали на наличие EGF семейства рецепторных тирозинкиназ, ожидают, что их обширная распространенность будет установлена в следующих видах рака, таких как рак щитовидной железы и рак матки. Также известно, что активность тирозинкиназы EGF типа редко обнаруживают в нормальных клетках, тогда как данную активность более часто обнаруживают в злокачественных клетках (Hunter, Cell., 1987, 50, 823). Совсем недавно было показано (W J Gullick, Brit. Med. Bull., 1991, 47, 87), что EGF рецепторы, которые обладают тирозинкиназной активностью, сверхэкспрессируются при многих видах рака человека, таких как опухоли мозга, плоских клеток легкого, мочевого пузыря, желудка, молочной железы, головы и шеи, пищевода, гинекологические опухоли и опухоли щитовидной железы. Соответственно, было признано, что ингибитор рецепторных тирозинкиназ должен обладать ценностью в качестве селективного ингибитора роста раковых клеток у млекопитающего (Yaish et al. Science,1988, 242, 933). Данная точка зрения подтверждается демонстрацией того, что эрбстатин, ингибитор EGF рецепторных тирозинкиназ, специфически ослабляет рост трансплантированной человеческой карциномы молочной железы у "голых" мышей, которая экспрессирует EGF рецепторную тирозинкиназу, но без влияния на рост другой карциномы, которая не экспрессирует EGF рецепторную тирозинкиназу (Toi etal., Eur. J. Cancer Clin. Oncol., 1990, 26, 722.) Также установлено, что различные производные стирола обладают свойствами ингибитора тирозинкиназы (Патентные европейские заявки 0211363, 0304493 и 0322738) и являются пригодными в качестве противоопухолевых средств. Ингибирующий эффект in vivo двух данных производных стирола, которые являются ингибиторами EGF рецепторной тирозинкиназы,был продемонстрирован в отношении роста плоскоклеточной карциномы человека, введенной "голым" мышам (Yoneda et al., Cancer Research, 1991, 51, 4430). Различные известные ингибиторы тирозинкиназ описываются в недавнем обзоре Т R Burke Jr. (Drugs of the Future, 1992, 17, 119). Известно из патентных заявокЕР 0520722, ЕР 0566226 и ЕР 0635498, что определенные хиназолиновые производные, которые содержат анилиновый заместитель в 4-положении, обладают ингибирующей активностью рецепторных тирозинкиназ. Кроме того, известно из патентной заявкиЕР 0602851,что определенные хиназолиновые производные, которые содержат гетероариламинозаместитель в 4 положении, также обладают ингибирующей активностью рецепторной тирозинкиназы. Кроме того, известно из патентной заявкиWO 92/20642, что определенные арильные и гетероарильные соединения ингибируют EGF и/или PDGF рецепторную тирозинкиназу. В ней имеется описание некоторых хиназолиновых производных, но не упоминаются 4-анилинохиназолиновые производные. Антипролиферативный эффект in vitro 4-анилинохиназолинового производного описывают Fry etal., Science, 1994, 265, 1093. Установлено, что соединение 4-(3'-броманилино)-6,7-диметоксихиназолин является чрезвычайно мощным ингибитором EGF рецепторной тирозинкиназы. Также ожидают, что ингибиторы рецепторных тирозинкиназ EGF типа будут пригодны для лечения других заболеваний избыточной клеточной пролиферации, таких как псориаз. AstraZeneca разработала и выпустила гефитиниб (US 5770599) формулы II перорально активный, селективный ингибитор тирозинкиназы рецептора эпидермального фактора роста(EGFR-TK1). Его назначают в качестве монотерапии для продолжительного лечения пациентов с локальным раком на поздней стадии или метастатическим немелкоклеточным раком легкого после неудачного лечения химиотерапией на основе платины и доцетаксела, которая является полезной или оказывает благоприятный эффект, связанный с гефитинибом. Торговым названием является Iressa. перорально активный, АТР-конкурентный низкомолекулярный ингибитор EGFR ТК. В настоящее время его используют для стандартного лечения немелкоклеточного рака легкого (NSCLC) и рака поджелудочной железы. Ожидается, что его активность будет большей при комбинировании со стандартными цитотоксическими противораковыми лекарственными средствами на основе антибиотиков. Торговым названием является Tarceva. Кроме того, оказалось, что ингибирующие антитела против EGFR и erbB2 (эрбитукс (с 225/цетуксимаб) и герцептин (трастузумаб), соответственно) оказывают положительный эффект в клинике для лечения некоторых солидных опухолей (обсуждено в Mendelsohn et al, 2000, 5 Oncogene, 19,6550-6565). Недавно в определенных разновидностях немелкоклеточного рака легкого (NSCLC) обнаружены мутации в АТР-связывающем кармане внутриклеточного каталитического домена EGF рецептора. Оказалось, что наличие мутаций в рецепторе связано с ответом на ингибиторы EGFR тирозинкиназы, такие как гефитиниб (Lynch et al., N Engl J Med 2004; 350: 2129-2139; Paez et al., Science 2004; 304: 1497-1500),хотя становится понятно, что полезный клинический эффект соединений, таких как гефитиниб и эрлотиниб, по всей вероятности не опосредован только EGFR мутациями. Было показано, что лигандная стимуляция приводит в результате к различной картине фосфорилирования в мутированных рецепторах по сравнению с тем, что наблюдается в рецепторах дикого типа, и считают, что мутантные EGF рецепторы селективно преобразуют жизненно важные сигналы, при которых NSCLC становятся зависимыми. Ингибирование данных сигналов соединениями, такими как гефитиниб, может вносить вклад в эффективность данных лекарственных средств (Sordella et al. Science 2004; 305: 1163-1167). Аналогично, в определенных первичных опухолях, таких как NSCLC, глиобластома и опухоли желудка и яичников, недавно обнаружены мутации внутри erbB2 киназного домена (Stephens et al., Nature 2004; 431; 525-526). Соответственно, ингибирование EGF и/или erbB2 тирозинкиназы и в мутированных рецепторах и в рецепторах дикого типа является важной мишенью, которая, как ожидается, будет оказывать противораковый эффект. Была обнаружена амплификация и/или активность членов рецепторных тирозинкиназ erbB типа и,следовательно, подразумевается, что они участвуют в ряде доброкачественных пролиферативных заболеваний, таких как псориаз (Ben-Bassat, Curr. Pharm. Pes., 2000, 6, 933; Elder et al., Science, 1989, 243,811), доброкачественная гиперплазия предстательной железы (BPH) (Kumar et al., Int. Urol. Nephrol.,2000, 32,73), атеросклероз и рестеноз (Bokemeyer et al., Kidney Int., 2000, 58, 549). Следовательно, ожидают, что ингибиторы рецепторных тирозинкиназ erbB типа будут полезны в лечении этих и других доброкачественных заболеваний с избыточной клеточной пролиферацией. В каждом из WO 96/09294, WO 96/15118, WO 96/16960, WO 96/30347, WO 96/33977, WO96/33978, WO 96/33979, WO 96/33980, WO 96/33981, WO 97/03069, WO 97/13771, WO 97/30034, WO 97/30035, WO 97/38983, WO 98/02437, WO 98/02434, WO 98/02438, WO 98/13354, WO 99/35146, WO 01/21596, WO 01/55141 и WO 02/18372 описывают, что определенные хиназолиновые производные, которые содержат анилиновый заместитель в 4 положении, обладают ингибирующей активностью рецепторных тирозинкиназ. В WO 99/35132 описывают определенные 4-(индазол-5-иламино)хиназолиновые производные. Однако не одно из данных хиназолиновых производных не содержит заместитель в 5-положении хиназолинового кольца. В WO 01/94341 описывают, что определенные хиназолиновые производные, которые содержат 5 заместитель, являются ингибиторами Src семейства нерецепторных тирозинкиназ, таких как c-Src, c-Yes и c-Fyn. Также в WO 01/94341 нет описания 4-(индазол-5-иламино)хиназолиновых производных, в которых атом азота индазолильной группы замещают заместителем, содержащим арильную или гетероарильную группу. В каждом из WO 03/040108 и WO 03/040109 описывают, что определенные хиназолиновые производные, которые содержат 5-заместитель, являются ингибиторами erbB семейства тирозинкиназных ингибиторов, в частности EGF и erbB2 рецепторные тирозинкиназы. В каждом из WO 03/040108 и WO 03/040109 описывают определенные 4-(индазол-5-иламино)хиназолиновые производные. Не одно из описанных хиназолиновых производных не содержит ациламиноэтоксигруппу в 5-положении хиназолинового кольца. В US-2004/0048880 описывают определенные 4-анилинохиназолиновые производные и их применение для лечения опухолевых заболеваний. Данные хиназолиновые производные не содержат заместителя в 5-положении хиназолинового кольца. В WO 2004/46101 описывают определенные 4-(индазол-5 иламино)хиназолиновые производные и их применение в качестве ингибиторов EGF и erbB2 рецепторных тирозинкиназ. Данные хиназолиновые производные не содержат заместителя в 5-положении хина-3 018716 золинового кольца. В каждом из WO 2004/093880 и WO 2005/051923 описывают определенные 4-анилинохиназолиновые производные и их применение в качестве ингибиторов erbB2 рецепторной тирозинкиназы. Ни в одном из данных документов не описывают 4-(индазол-5-иламино)хиназолиновое производное. Сохраняется необходимость в разработке новых соединений с высокой активностью in vivo вместе с улучшенными фармакологическими характеристиками по сравнению с известными erbB тирозинкиназными ингибиторами, в частности соединений, которые являются селективными erbB2 тирозинкиназными ингибиторами. Например, существует необходимость в новых соединениях с полезными и/или улучшенными характеристиками, такими как, но не ограничиваясь ими, например, (i) физические свойства; (ii) полезные DMPK свойства, такие как высокая биодоступность, и/или подходящее время полужизни, и/или подходящий объем распределения, и/или высокая абсорбция; (iii) факторы, которые снижают недостаток клинического взаимодействия лекарственных средств между собой (например, ингибирование или возбуждение фермента цитохром Р 450); и (iv) соединения с ослабленным недостатком удлинения QT интервала у пациентов, например, соединения, которые являются неактивными или слабо активными в HERG анализе. В настоящее время авторы изобретения неожиданно обнаружили, что отобранная группа замещенных 4-(тетразол-5-ил)хиназолиновых производных по настоящему изобретению или их фармацевтически приемлемые соли обладают мощной противоопухолевой активностью. Данные способы при применении для получения хиназолинового производного по настоящему изобретению или его фармацевтически приемлемой соли предоставляют в качестве дополнительного признака настоящего изобретения и иллюстрируют следующими представленными примерами. Необходимые исходные соединения можно получить стандартными методиками органической химии. Получение данных исходных соединений описывают в приводимых неограничивающих примерах. Альтернативно, необходимые исходные соединения получают методиками, аналогичными данным, которые являются известными специалистам в данной области органической химии. Краткое описание настоящего изобретения Иобретение относится к замещенным 4-(тетразол-5-ил)хиназолиновым производным формулы IR2 представляет собой водород или его выбирают из группы, состоящей из замещенного бензила,пиридин-2-илметила и 1-метила-1 Н-имидазол-2-илметила, где заместители для бензила независимо выбирают из группы, состоящей из нитро и амино; или его фармацевтически приемлемая соль. Подробное описание настоящего изобретения Соединения формулы I и их фармацевтически приемлемые соли можно получить любым способом,о котором известно, что он применим к химически родственным соединениям. Обычно активные соединения можно получить из подходящих замещенных 4-галогенхиназолиновых соединений, полученных из предшественников, являющихся замещенными 4 Н-хиназолин-4-онами. Активные соединения настоящего изобретения получают в соответствии со следующей схемой I синтеза. Схема IR1 и R2 такие, как определено выше. Где X представляет собой галоген или сульфонильную уходящую группу. Где Y представляет собой галоген или сульфонильную уходящую группу. Различные соединения формулы I получают:(а) обработкой соединения формулы А галогенирующим агентом, таким как тионилгалогенид, тригалогенид фосфора, пентагалогенид фосфора,фосфорилтригалогенид для получения 4-галогензамещенных хиназолиновых производных формулы В, в которой R1 такой, как определено выше. Реакцию можно проводить или в чистом виде без растворителя или с растворителями, такими как хлористый метилен, дихлорид этилена, толуол, ксилол, циклогексан и т.д. Температуру реакции поддерживают в диапазоне от 25 до 150 С, предпочтительно при температуре кипения с обратным холодильником галогенирующего реагента.(b) Обработкой соединения формулы В триалкиламином N(R3)3 (где R3 такой, как определено выше) в подходящем растворителе, таком как толуол, ксилол или циклогексан, для получения замещенных хиназолинил-4-триалкиламингалогенидных четвертичных солей. Температуру реакции поддерживают в диапазоне от 25 до 150 С, предпочтительно при комнатной температуре.(с) Обработкой соединения формулы С цианирующим агентом, таким как цианид натрия, цианид калия, цианид меди, триалкилсилицианид и т.д., в подходящем растворителе, таком как толуол, ксилол, циклогексан или диметилформамид, диметилацетамид, формамид и т.д., для получения замещенных 4-аминохиназолинов формулы D, где R1 такой, как определено выше. Температуру реакции поддерживают в диапазоне от 25 до 150 С, предпочтительно от 100 до 125 С.(d) Обработкой соединения формулы D азидирующими агентами, такими как азид натрия, триалкилсилилазид и т.д., для получения соединений формулы Е, где R1 такой, как определено выше. Реакцию предпочтительно проводят в присутствии подходящего растворителя или разбавителя, например спирта, такого как метанол, этанол, изопропанол, эфирного растворителя, такого как этилацетат,галогенированного растворителя, такого как хлористый метилен, хлороформ или тетрахлорид углерода,эфирного растворителя, такого как тетрагидрофуран, 1,4-диоксан, ароматического углеводородного растворителя, такого как толуол, или диполярного апротонного растворителя, такого как N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидин-2-он или диметилсульфоксид. Реакцию удобно проводить при температуре в диапазоне, например 10-150 С, предпочтительно в диапазоне 50-120 С.(е) Обработкой соединения формулы Е алкилирующим агентом формулы F (Y и R2 такие, как определено выше), применяя основание, такое как карбонаты щелочного металла, гидроксиды, гидриды металлов, алкоксиды металлов, тетраалкилгуанидины, алкил лития, LDA и т.д. Применяемыми растворителями являются ацетонитрил, диметилформамид, диметилацетамид, тетрагидрофуран, толуол и т.д. Реакция удобно проводить при температуре в диапазоне, например 10-150 С, предпочтительно в диапазоне 20-80 С.(f) Очисткой смеси соединения формулы G (и его изомера G1) перекристаллизацией из подходящего растворителя или препаративной хроматографией для получения требуемого 1 Н-тетразолильного производного. Соединения формулы I с замещениями по 6,7-положениям с кислородной связью и их фармацевтически приемлемые соли можно получить любым способом, о котором известно, что он является пригодным для химически родственных соединений. Обычно активные соединения можно получить из подходящих замещенных 4-хлор-6,7-O-защищенных хиназолиновых соединений, полученных из предшественников, замещенных 4 Н-хиназолин-4-онов. Активные соединения формулы I получают в соответствии со следующей схемой II синтеза. Схема II где R5 независимо представляет собой водород или R4, и Y представляет собой подходящую защитную группу, такую как ацил, бензил, бензоил, силил, алкилсульфонил, арилсульфонил, аралкилсульфонил и т.д.; Z представляет собой галоген или подходящую уходящую группу, содержащую сульфон. Основание, применяемое на стадии О-алкилирования, получают из карбонатов щелочных металлов,гидроксидов щелочных металлов, алкоксидов металлов, гидридов щелочных металлов, алкиллития, тетраметилгуанидина и т.д.(а) Обработка соединения формулы Н (или его таутомера формулы H1) галогенирующим агентом, таким как тионилгалогенид, тригалогенид фосфора, пентагалогенид фосфора,фосфорилтригалогенид, для получения 4-галогензамещенных хиназолиновых производных формулы В,где R4 и X такие, как определено выше. Реакцию можно проводить или в чистом виде без растворителя или с растворителями, такими как хлористый метилен, дихлорид этилена, толуол, ксилол, циклогексан и т.д. Температуру реакции поддерживают в диапазоне от 25 до 150C, предпочтительно при температуре кипения галогенирующего реагента.(b) Обработка соединения формулы I триалкиламином N(R3)3, где R3 такой, как определено выше). Реакцию проводят в подходящем растворителе, таком как толуол, ксилол или циклогексан, для получения замещенных хиназолинил-4-6 018716 триалкиламингалогенидных четвертичных солей. Температуру реакции поддерживают в диапазоне от 25 до 150 С, предпочтительно при комнатной температуре.(с) Обработка соединения формулы J цианирующим агентом, таким как цианид натрия, цианид калия, цианид меди, триалкилсилицианид и т.д., в подходящем растворителе, таком как толуол, ксилол, циклогексан или диметилформамид, диметилацетамид, формамид и т.д., для получения, замещенных 4-цианохиназолинов формулы K, где R3, R4 иX такие, как определено выше. Температуру реакции поддерживают в диапазоне от 25 до 150 С, предпочтительно от 100 до 125 С.(d) Обработка соединения формулы K азидирующими агентами, такими как азид натрия, азид калия, триалкилсилилазид и т.д. Реакцию предпочтительно проводят в присутствии подходящего растворителя или разбавителя, например, спирта, такого как метанол, этанол, изопропанол, или эфирного растворителя, такого как этилацетат, галогенированного растворителя, такого как хлористый метилен, хлороформ или тетрахлорид углерода, эфирного растворителя, такого как тетрагидрофуран, 1,4-диоксан, ароматического углеводородного растворителя, такого как толуол, или диполярного апротонного растворителя, такого как N,Nдиметилформамид, N,N-диметилацетамид, N-метилпирролидин-2-он или диметилсульфоксид. Реакцию удобно проводить при температуре в диапазоне, например, 10-150 С, предпочтительно в диапазоне 50-120 С.(е) Обработка соединения формулы L алкилирующим агентом формулы F (Y и R2 такие, как определено выше), применяя основание, такое как карбонаты щелочного металла, гидроксиды, гидриды металлов, тетраалкилгуанидины, алкил лития, LDA и т.д. Применяемыми растворителями являются ацетонитрил, диметилформамид, диметилацетамид, тетрагидрофуран, толуол и т.д. Реакцию удобно проводить при температуре в диапазоне, например, 10150 С, предпочтительно в диапазоне 20-80 С.(f) Очистка смеси соединения формулы M (и его изомера M1) перекристаллизацией из подходящего растворителя или препаративной хроматографией для получения 1 Н-тетразолильного производного формулы N(g) реакция соединений формулы N с аликилирующими агентами формулы R5Z (где Z и R5 такие,как определено выше), применяя основание, такое как карбонаты щелочных металлов, гидроксиды, гидриды металлов, тетраалкилгуанидины, алкил лития, LDA и т.д. Применяемыми растворителями являются ацетонитрил, диметилформамид, диметилацетамид, тетрагидрофуран, толуол и т.д. Реакцию удобно проводить при температуре в диапазоне, например, 10-150 С, предпочтительно в диапазоне 20-80 С. Также должно быть ясно, что определенные хиназолиновые производные формулы I могут сущест-7 018716 вовать в сольватированной форме, также как в несольватированной форме, такой как, например, гидратная форма. Должно быть ясно, что настоящее изобретение включает все данные сольватированные формы, которые обладают антипролиферативной активностью. Подходящими фармацевтически приемлемыми солями хиназолинового производного настоящего изобретения являются, например, аддитивные соли моно- или дикислоты хиназолинового производного по настоящему изобретенияю, которые являются достаточно основными, например, кислотноаддитивная соль, например, неорганической или органической кислоты, например, хлороводородной,бромоводородной, серной, фосфорной, трифторуксусной, лимонной, малеиновой, винной, фумаровой,метансульфоновой или 4-толуолсульфоновой кислоты. Настоящее изобретение в конкретном вополощении относится к соединениям, выбранным из группы, состоящей из 6,7-диметоксизамещенных 4-(тетразол-5-ил)хиназолиновых производных формулы IVVII В настоящем изобретении должно быть ясно, что, поскольку определенные соединения формулы I могут существовать в оптически активной или рацемической формах за счет одного или более заместителей, содержащих асимметрический атом углерода, настоящее изобретение включает любую данную оптически активную или рацемическую форму, которая обладает антипролиферативной активностью. Синтез оптически активных форм можно осуществлять стандартными методиками органической химии,хорошо известными в данной области техники, например синтезом из оптически активных исходных соединений или разделением рацемической формы. Испытания in vitro МТТ анализ пролиферации МТТ [3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромид] анализ, впервые описанныйMosmann в 1983, основан на способности митохондриального дегидрогеназного фермента из жизнеспособных клеток расщеплять тетразолийные кольца бледно-желтого МТТ и образовывать темно-синие формазановые кристаллы, в основном непроницаемые для клеточных мембран, таким образом, приводя к их накоплению в здоровой клетке. Солюбилизация данных клеток добавлением детергента приводит в результате к высвобождению кристаллов, которые растворяются. Число выживших клеток прямо про- 10018716 порционально концентрации образовавшегося формазанового продукта. Затем, цвет можно количественно измерить, применяя простой колориметрический анализ. Данный анализ выполняют, применяя 0-1000 нг/мл концентрации эрлотиниба и его производных в А 549 и Н 1299 клетках. Протокол основывается на АТСС и на инструкциях производителей (Catalog Number 30-1010K). Вестерн-блоттинг Идеальную концентрацию лекарственного средства, определенную из МТТ анализа пролиферации,применяли для обработки 1106 A549 или Н 1299 клеток в подходящей среде в течение 72 ч, после чего клеточные лизаты экстрагировали и разделяли на 10% SDS PAGE геле при восстановительных условиях. С гелей получали промоканием реплику на обработанных нейлоновых мембранах (Bio-Rad) и иммунотестировали на EGFR, PI3K и АКТ. Инвазивный тест с применением матригеля Инвазивность in vitro H1299 или А 549 клеток в присутствии различных концентраций NRC соединений (как определено МТТ анализом) оценивали, применяя тест с модифицированной камерой Бойдена. Клетки обрабатывали данными соединениями в течение 48 ч. 1106 клеток суспендировали в 600 мкл бессывороточной среды, снабженной 0,2% BSA и помещали в верхний отдел камер системы Transwell(Corning Costar Fischer Scientific Cat 07-200-158, Pittsburgh PA), покрытых матригелем (0,7 мг/мл). Нижний отдел камеры заполняли 200 мкл среды, содержащей сыворотку, и клеткам позволяли мигрировать в течение 24 ч. После инкубирования, клетки фиксировали и окрашивали Нета-3 и количественно определяли, как описано ранее (Mohanam, et al. 1993). Мигрированные клетки определяли количественно в виде процентной инвазии. Ангиогенный анализ in vitro Для определения антиангиогенных свойств эрлотиниба и его производных, применяли идеальные концентрации лекарственных средств для обработки А 549 клеток в течение 72 ч, как описано ранее, после чего полную среду заменяли бессывороточной средой в течение 12 ч. Бессывороточную среду называют кондиционированной средой, и ее применяют для ангиогенной индукции НМЕС клеток, выращенных до 80% слияния, как в стандартных протоколах. Вестерн-блоттинг Как описано ранее, идеальные концентрации лекарственного средства, определенные из МТТ анализа пролиферации, применяли для обработки 1106 A549 или Н 1299 клеток в подходящей среде в течение 72 часов, с последующим вестерн-блоттингом. Применяя А 549 клетки, вышеупомянутые соединения вызывали дозозависимое снижение уровней экспрессии EGFR. Клетки Н 1299 показали аналогичное снижение уровней экспрессии EGFR при обработке вышеуказанными соединениями, но они были менее чувствительны, чем А 549 клетки. Инвазивный тест с применением матригеля Инвазию с применением матригеля проводили, как описано в материалах и методах. Применяя А 549 клетки, контрольное соединение, являющееся эрлотинибом, уменьшало инвазивность зависящим от дозы способом от 100 до 800 нг/мл. Вышеупомянутые соединения вызывали замедление инвазии, аналогичное эрлотинибу при 1/10 концентрации (10-80 нг/мл). Применяя Н 1299 клетки, наблюдали аналогичную картину замедления инвазии. Исследования in vivo Действие вышеупомянутых соединений на подкожные опухоли легкого у "голых" мышей Способ"Голым" мышам имплантировали 2106 А 549 клеток в правую сторону задней конечности. При наблюдении опухоли ( 2 мм), мышам давали перорально или внутрибрюшино эрлотиниб, и вышеупомянутые соединения при 1/10 дозы эрлотиниба. На основании литературных данных 100 мг/кг эрлотиниба устанавливали в качестве базисной дозы. Вышеуказанные соединения вызывали замедление роста опухоли, аналогичное эрлотинибу, при 1/10 концентрации (10-80 нг/мл). Преимущества настоящего изобретения: 1. Вышеупомянутые новые соединения превосходят существующие стандартные соединения для лечения немелкоклеточного рака легкого, такие как гефитиниб и эрлотиниб, и являются потенциально пригодными в лечении рака легкого. 2. Вышеупомянутые новые соединения также действуют в других областях, таких как, в случае рака поджелудочной железы, и являются потенциально пригодными в лечении рака поджелудочной железы. 3. Вышеупомянутые новые соединения также действуют в других областях, таких как, в случаях рака горла и полости рта, и являются потенциально пригодными в лечении рака горла и полости рта. Настоящее изобретение будет более полно описано в соответствии со следующими конкретными примерами, которые не расцениваются в качестве ограничивающих объем настоящего изобретения. Экспериментальная методика Пример 1. 1 а) Получение 4-хлор-6,7-диметоксихиназолина 720,0 г (6,05 моль) тионилхлорида и 50,0 г (0,243 моль) 6,7-диметокси-3H-хиназолин-4-она загружали в 2,0 л 4-горлую круглодонную колбу, соединенную с механической мешалкой, гнездом термометра и обратным холодильником с двумя поверхностями. Температуру реакционной массы повышали до температуры кипения с обратным холодильником (78-80 С). Медленно добавляли при температуре кипения с обратным холодильником 20,0 мл диметилформамида. Поддерживали температуру реакционной массы, равной температуре кипения с обратным холодильником в течение 7-8 ч при перемешивании. Тионилхлорид отгоняли полностью в вакууме при температуре ниже 70 С. Охладив реакционную массу до 40-45 С в атмосфере азота загружали при перемешивании 1000,0 мл гексана. Поддерживали температуру реакционной массы, равной 40-45 С, в течение 30-45 мин. Понижали температуру реакционной массы до 25-30 С. Поддерживали температуру реакционной массы, равной 25-30 С, в течение 45-60 мин в атмосфере азота. Отфильтровывали твердое вещество в атмосфере азота. Твердое вещество промывали 250,0 мл гексана. Соединение сушили в полочной вакуумной сушилке, содержащей пентаоксид фосфора,при 30-35 С до того, как потери при сушке были не более чем 0,50% вес./вес. Получали 52,50 г (выход составляет 96,33% теоретически) продукта желтого цвета. Диапазон температур плавления 214-220 С. ВЭЖХ чистота составляет 96,5%. Спектральные данные: FT-IR (KBr): 3060, 3041, 2951, 2838, 1618, 1562, 1505, 1429, 1360, 1336, 1232,1163, 966, 878, 853, 806, 656, 615, 493, 471. 1 Н-ЯМР (ДМСО-d6):величина (ppm): 3,89-3,91(м)2(O-CH3)(6 Н), 7,37(c)Ar-Ha(1H), 7,46(с)ArHb91H), 9,01(с)Hc(1 Н). 13 С-ЯМР:величина (ppm): 56,55(2 С), 101,69(1 С), 105,95(1 С), 113,39(1 С), 134,28(1 С), 148,01(1 С),150,15(1 С), 155,68(1 С), 157,30(1 С), 157,80(1 С). Масс: 225,6[М+1], 224,6 [М]. 1b) Получение хлорида (6,7-диметокси-4-хиназолинил)триметиламмония Экспериментальная методика: 6,50 л триметиламина в толуольном растворе переносили в 10,0 л 4 горлую круглодонную колбу, соединенную с механической мешалкой, гнездом термометра и обратным холодильником. Охлаждали реакционную смесь до 15-20 С. Загружали 50,0 г (0,22 моль) 4-хлор-6,7 диметоксихиназолина при перемешивании при 15-20 С. Перемешивали реакционную смесь в течение 6090 мин при 15-20 С. Нерастворимое соединение отфильтровывали, и фильтрат собирали в 10,0 л 4 горлую круглодонную колбу. Колбу закрывали пробкой. Раствор хранили при 25-35 С в течение 7 дней без перемешивания. Твердое вещество фильтровали и промывали 100,0 мл толуола в атмосфере азота. Соединение сушили в полочной вакуумной сушилке, содержащей пентоксид фосфора при 30-35 С до того, как потери при сушке были не более чем 1,0% вес./вес. Получали 38,80 г (выход составляет 61,45% теоретически) продукта светло-желтого цвета. Диапазон температур плавления 218-224 С. ВЭЖХ чистота 94,8%. Спектральные данные: FT-IR (KBr): 3416, 3027, 1615, 1509, 1479, 1447, 1413, 1361, 1350, 1276, 1239,1205, 1168, 975, 884, 830, 662, 572. 1 Н-ЯМР (ДМСО-d6):величина (ppm): 2,27(с)N-(СН 3)3(9 Н), 3,83(с)2(О-СН 3)(6 Н), 7,24(с)Ar-На(1 Н),7,41(с)Ar-Hb(1H), 8,49(Нс)(1 Н). 13 С-ЯМРвеличина (ppm): 51,1(3 С), 56,1(2 С), 103,5(1 С), 108,9(1 С), 119,2(1 С), 148,1(1 С), 152,3(1C),154,9(1 С), 159,2(1 С), 178,1(1 С). Масс: 284,5[М+1], 283,4[М]. 1 с) Получение 4-циано-6,7-диметоксихиназолина ли температуру реакционной массы в азеотропных условиях до температуры кипения с обратным холодильником. Поддерживали температуру реакционной массы, равной температуре кипения с обратным холодильником до отделения теоретического количества воды. После завершения отделения воды, отгоняли 400,0 мл толуола. Понижали температуру реакционной массы до 95-100 С. Загружали при 95-100 С 46,0 г (0,78 моль) ацетамида. Поддерживали температуру реакционной массы, равной 95-100 С, в течение 20-30 мин. Загружали при 95-100 С 19,80 г (0,40 моль) цианида натрия. Поддерживали температуру реакционной массы равной 95-100 С в течение 20-30 мин. Температуру реакционной массы повышали до температуры кипения с обратным холодильником в азеотропных условиях. Поддерживали температуру реакционной массы, равной температуре кипения с обратным холодильником, до завершения азеотропного отделения воды. После завершения отделения воды, понижали температуру реакционной массы до 95-100 С. Поддерживали температура реакционной массы, равной 90-95 С, в течение 6-7 ч в атмосфере азота. Понижали температуру реакционной массы до 25-30 С. Загружали 200,0 мл DM воды. Перемешивали реакционную смесь в течение 20-30 мин, и выдерживали реакционную смесь в течение 15-20 мин. Отделяли верхний органический слой и хранили отдельно. Помещали водный слой в экстракционную воронку. Соединение экстрагировали 3300 мл толуола. Объединенные органические слои загружали в коническую воронку. Органический слой сушили с 50 г сульфата натрия. Загружали 10,0 г активированного угля. Повышали температуру реакционной массы до 50-55 С. Поддерживали температура реакционной массы, равной 50-55 С, в течение 30-45 мин. Отфильтровывали сульфат натрия и уголь через слой"хайфлоу" и промывали сульфат натрия и уголь 250,0 мл толуола. Фильтрат загружали в колбу, и полностью отгоняли толуол при высоком вакууме, при температуре реакционной смеси, не превышающей 65 С. Понижали температуру реакционной массы до 25-30 С. Загружали 100,0 мл изопропилового эфира. Перемешивали при температуре реакционной массы, равной 25-30 С, в течение 45-60 мин. Фильтровали твердое вещество и промывали 25,0 мл изопропилового эфира. Соединение сушили при 50-55 С. Получали 22,40 г (79,85% выход теоретически) продукта светло-желтого цвета. Диапазон температур плавления: 218,1 С-219,2 С. ВЭЖХ чистота 96,5%. Спектральные данные: FT-IR (KBr): 3408, 2927, 2233, 1614, 1578, 1549, 1502, 1357, 1290, 1230, 1175,981, 882, 843, 822, 663, 569, 494. 1 Экспериментальная методика: 400,0 мл диметилформамида и 20,0 г (0,09 моль) 4-циано-6,7 диметоксихиназолина загружали в 1,0 л 4-горлую круглодонную колбу, соединенную с механической мешалкой, гнездом термометра, обратным холодильником в атмосфере азота. Загружали при 25-35 С 6,80 г (0,10 моль) азида натрия и 5,50 г (0,10 моль) хлорида аммония. Перемешивали реакционную смесь в течение 15-20 мин при 25-35 С. Перемешивали реакционную смесь в течение 15-20 мин при 25-35 С. Температуру реакционной массы повышали до 110-115 С. Поддерживали температуру реакционной массы, равной 110-115 С, в течение 8-9 ч. Неорганическое твердое вещество отфильтровывали при 110115 С, и фильтрат собирали в коническую колбу. Охлаждали фильтрат до 25-30 С. Загружали в 5,0 л 4 горлую круглодонную колбу, соединенную с механической мешалкой, гнездом термометра и дополнительной колбой 4000,0 мл этилацетата. Реакционную массу диметилформамидного раствора добавляли к этилацетатному раствору при перемешивании. Поддерживали температуру реакционной массы, равной 25-30 С, в течение 60-90 мин. Понижали температуру реакционной массы до 0-5 С. Поддерживали температура реакционной массы, равной 0-5 С, в течение 150-180 мин. Отфильтровывали твердое вещество,и твердое вещество промывали 100,0 мл этилацетата. Соединение сушили при 25-30 С в вакууме. Получали 14,20 г (выход составляет 59,16% теоретически) продукта. Температура плавления 207,2 С. ВЭЖХ чистота: 98,6%. Спектральные данные: FT-IR (KBr): 3421, 2986, 1615, 1552, 1507, 1478, 1431, 1342, 1242, 998, 965,799, 659, 450. 1 Н-ЯМР (ДМСО-d6)величина (ppm): 3,92(с)2(О-СН 3)(6 Н), 7,34(c)Ar-Ha(1H), 8,20 (уширенный)NH Экспериментальная методика: 150,0 мл N,N-диметилацетамида и 10,0 г (0,038 моль) 6,7-диметокси 4-(1 Н-тетразол-5-ил)хиназолина загружали в 500 мл 4-горлую круглодонную колбу, соединенную с механической мешалкой, гнездом термометра, обратным холодильником и дополнительной колбой при среднем давлении азота. Добавляли при 25-30 С 6,0 г (0,06 моль) триэтиламина. Перемешивали реакционную смесь в течение 15-20 мин при 25-30 С. Температуру реакционной массы повышали до 50-55 С. Поддерживали температуру реакционной массы, равной 50-55 С, в течение 15-20 мин. 3-Нитробензилхлоридный раствор 4,50 г (0,026 моль) 3-нитробензилхлорида растворяли в 37,50 мл N,N-диметилацетамида медленно добавляли при 50-55 С в течение 30-45 мин. Поддерживали температура реакционной массы, равной 50-55 С, в течение 15-20 мин. Повышали температуру реакционной массы до 8085 С. Поддерживали температуру реакционной массы, равной 80-85 С, в течение 7-8 ч. Понижали температуру реакционной массы до 25-30 С. Загружали в 3,0 л 4-горлую круглодонную колбу, соединенную с механической мешалкой, гнездом термометра, обратным холодильником и дополнительной колбой,при 25-30 С 1875,0 мл метанола. Реакционную смесь диметилацетамидного раствора добавляли к метанольному раствору при 25-30 С в течение 60-90 мин при перемешивании. Поддерживали температура реакционной массы, равной 25-30 С, в течение 60-90 мин. Понижали температуру реакционной массы до 0-5 С. Поддерживали температуру реакционной массы, равной 0-5 С, в течение 150-180 мин. Твердое вещество отфильтровывали и промывали 50,0 мл метанола. Соединение сушили при 25-30 С. Получали 11,80 г (выход 77,6% теоретически) высушенного соединения I. Диапазон температур плавления: 221,2-222,2 С. ВЭЖХ чистота: 97,24%. Спектральные данные: FT-IR (KBr): 3428, 3105, 2940, 1615, 1519, 1504, 1427, 1359, 1324, 1241, 1151,1118, 1001, 966, 868, 851, 728, 658, 631, 561, 470. 1 Н-ЯМР (ДМСО-d6)величина (ppm): 3,92(s)2(О-СН 3)(6 Н), 6,22(с)(СН 2)(2 Н), 7,51(с)Ar-Ha(1H),7,64-7,7,67(т)Ar-Hb(1H), 7,87-7,89(д)(1 Н), 8,14-8,18(т) Ar-He(1H), 8,32(с)Ar-Hf(1H), 9,28(с)Hg(1 Н). 13 С-ЯМРвеличина (ppm): 51,56(1 С), 56,45(2 С), 103,27(1 С), 106,80(1C), 118,51(1C), 123,16(1C),123,32(1C), 130,23(1C), 135,15(1C), 136,92(1 С), 147,55(1 С), 147,73(1 С), 149,63(1C), 151,10(1C),151,40(1C), 152,21(1C), 156,68(1 С). Масс: 395,2[M+2], 394,2[М+1]. Пример 2. 2. Получение 6,7-диметокси-4-(1-(3-аминобензил)-1 Н-тетразол-5-ил)хиназолина (соединение V) Экспериментальная методика: 400,0 мл диметилформамида и 10,0 г (0,025 моль) 6,7-диметокси-4(1-(3-нитробензил)-1 Н-тетразол-5-ил)хиназолиновой суспензии загружали в 1,0 л котел автоклава для гидрирования при 25-30 С. Загружали в атмосфере азота 5,0 г 5% палладия на угле (50 вес.%). Гидрирование осуществляли при 35-40 фунтов на кв. дюйм при качании при 25-30 С. Поддерживали давление газообразного водорода (35-40 пси) до прекращения поглощения водорода. Отфильтровывали катализатор через слой "хайфлоу" в атмосфере азота. Катализатор промывали 50,0 мл диметилформамида в атмосфере азота. Фильтрат собирали в одногорлую RB колбу, и полностью отгоняли диметилформамид при высоком вакууме и при температуре ниже 60 С. Понижали температуру реакционной массы до 25-30 С и сбрасывали вакуум, загружали 50,0 мл гексана, и перемешивали реакционную смесь в течение 45-60 мин при 25-30 С. Фильтровали твердое вещество, промывали 25,0 мл гексана. Соединение сушили при 2530 С. Получали 8,40 г неочищенного продукта. Неочищенный продукт очищали колоночной хроматографией на силикагеле, применяя мобильную фазу в виде смеси этилацетата и гексана. Получали 5,20 гII. HCl: получение хлороводородной соли 6,7-диметокси-4-(1-(3-аминобензил)-1 Н-тетразол-5 ил)хиназолина Экспериментальная методика Загружали 200,0 мл хлористого метилена и 5,0 г (0,013 моль) 6,7-диметокси-4-(1-(3-аминобензил)1 Н-тетразол-5-ил)хиназолина в 500 мл 4-горлую круглодонную колбу, соединенную с механической мешалкой, гнездом термометра и обратным холодильником при 25-30 С. Перемешивали реакционную смесь в течение 15 мин. После того как раствор становился прозрачным, добавляли 6,0 г IPA HCl. Перемешивали реакционную смесь в течение 1 ч. Хлористый метилен отгоняли до суммарного объема, равного 30,0 мл. Добавляли 200 мл гексана. Перемешивали реакционную смесь в течение 1 ч. Фильтровали твердое вещество и промывали 30,0 мл гексана. Соединение сушили при 55-60 С. Получали сухое соединение 4,80 г светло-желтого цвета (выход составляет 87,2% теоретически). Диапазон температур плавления: 234,8-236,3 С. Чистота продукта: 99,5% по ВЭЖХ. Спектральные данные: FT-IR (KBr): 3424, 3227, 3094, 3052, 2978, 2878, 2746, 1665, 1595, 1508, 1471,1435, 1411, 1352, 1312, 1286, 1260, 1239, 1205, 1131, 1110, 1065, 1050, 917, 885, 854, 827, 778, 721, 684,534, 476. 1 Н-ЯМР (ДМСО-d6)величина (ppm) 3,94(с)(О-СН 3)(3 Н), 4,03(с)(О-СН 3)(3 Н), 5,07(с)СН 2(2 Н),6,09(с)NH2(2 Н), 6,34-6,43(м)Ar-На,Hb,Hc(3 Н), 6,86-6,89(т)Ar-Hd(1H), 7,50(с)Ar-Не(1 Н), 8,04(c)Ar-Hf(1H),9,31(с)Hg(1H). 13 С-ЯМРвеличина(ppm): 51,95(1 С), 56,43(1 С), 103,26(1 С), 106,75(1C), 118,35(1 С), 122,77(1 С),127,54(1 С), 130,01(1 С), 132,79(1 С), 136,68(1 С), 147,68(1 С), 150,93(1 С), 151,37(1 С), 152,28(1 С),156,60(1 С). Масс: 400,3[М+1], 398,3[M-1]. Пример 3. Получение 6,7-диметокси-4-[1-(1-метил-1 Н-имидазол-2-илметил)-1 Н-тетразол-5-ил]хиназолина (формула-VI) Экспериментальная методика 50,0 мл N,N-диметилацетамида и 5,0 г (0,019 моль) 6,7-диметокси-4-(1 Н-тетразол-5-ил)хиназолина загружали в 250 мл 4-горлую круглодонную колбу, соединенную с механической мешалкой, гнездом термометра, обратным холодильником и дополнительной колбой при среднем давлении азота. Добавляли при 25-30 С 3,80 г (0,038 моль) триэтиламина. Перемешивали реакционную смесь в течение 15-20 мин при 25-30 С. Температуру реакционной массы повышали до 50-55 С. Поддерживали температуру реакционной массы, равной 50-55 С, в течение 15-20 мин. 2-Хлорметил-1-метилимидазольный раствор [2,50 г (0,019 моль) 2-хлорметил-1-метилимидазола растворяли в 25,0 мл N,N-диметилацетамида] медленно добавляли при 50-55 С в течение 30-45 мин. Поддерживали температуру реакционной массы, равной 5055 С, в течение 15-20 мин. Повышали температуру реакционной массы до 80-85 С. Поддерживали температуру реакционной массы, равной 80-85 С, в течение 7-8 ч. Полностью отгоняли в вакууме N,Nдиметилацетамид. Неочищенное соединение очищали колоночной хроматографией, применяя гексан и этилацетат. Получали чистое соединение с весом 2,40 г (выход 35,2% теоретически). Спектральные данные: Масс: 353[М+1], 352,0[М]. Пример 4. Получение 6,7-диметокси-4-[1-(пиридин-2-илметил)-1 Н-тетразол-5-ил]хиназолина Экспериментальная методика: 50,0 мл N,N-диметилацетамида и 5,0 г (0,019 моль) 6,7-диметокси-4(1 Н-тетразол-5-ил)хиназолина загружали в 250 мл 4-горлую круглодонную колбу, соединенную с механической мешалкой, гнездом термометра, обратным холодильником и дополнительной колбой при среднем давлении азота. Добавляли при 25-30 С 3,80 г (0,038 моль) триэтиламина. Перемешивали реакционную смесь в течение 15-20 мин при 25-30 С. Температуру реакционной массы повышали до 50-55 С. Поддерживали температуру реакционной массы, равной 50-55 С, в течение 15-20 минут. Раствор гидрохлорида 2-хлорметилпиридина [3,20 г (0,019 моль) гидрохлорид 2-хлорметилпиридина растворяли в 25,0 мл N,N-диметилацетамида] медленно добавляли при 50-55 С в течение 30-45 минут. Поддерживали температуру реакционной массы, равной 50-55 С, в течение 15-20 мин. Повышали температуру реакционной массы до 80-85 С. Поддерживали температуру реакционной массы, равной 80-85 С, в течение 7-8 ч. N,NДиметилацетамид полностью отгоняли в вакууме. Неочищенное соединение очищали колоночной хроматографией, применяя гексан и этилацетат. Получали 1,90 г (выход 28,0% по теории) чистого соединения. Спектральные данные: масс: 350 [М+1], 349,0 [M]. Пример 5-8. Аналогичные соединения 3,4-диэтоксипроизводных хиназолиновых соединений VIII-XI и их промежуточные соединения VIIIa-VIIId получали, следуя методике, приведенной в примерах получения IaId следующих соединений IV-VII. Пример 9-12. Аналогичные соединения 3,4-дипропоксипроизводных хиназолиновых соединений XII-XV и их промежуточные соединения XIIa-XIId получали, следуя методике, приведенной в примерах получения 1a-1d следующих соединений IV-VII.R2 представляет собой водород или его выбирают из группы, состоящей из замещенного бензила,пиридин-2-илметила и 1-метила-1 Н-имидазол-2-илметила, где заместители для бензила независимо выбирают из группы, состоящей из нитро и амино; или его фармацевтически приемлемая соль. 2. 4-(Тетразол-5-ил)хиназолиновое производное формулы I или его фармацевтически приемлемая соль по п.1, выбранное из:n) 6,7-ди-н-пропокси-4-(1-(пиридин-2-илметил)-1 Н-тетразол-5-ил)хиназолина. 3. Способ получения соединения формулы I по п.1 или его соли, который включает:(а) обработку соединения формулы А галогенирующим агентом, таким как тионилгалогенид, тригалогенид фосфора, пентагалогенид фосфора,фосфорилтригалогенид для получения 4-галогензамещенных хиназолиновых производных формулы В;(b) обработку соединения формулы В триалкиламином (N(R3)3), где R3 представляет собой C1-C6 линейную или разветвленную алкильную цепь, в подходящем растворителе, таком как толуол, ксилол или циклогексан, для получения замещенной четвертичной соли хиназолинил-4-триалкиламингалогенида формулы С;(с) обработку соединения формулы С цианирующими агентами, выбранными из цианида натрия, цианида калия, цианида меди и триалкилсилилцианида, в подходящем растворителе, выбранном из толуола, ксилола, циклогексана, диметилформамида, диметилацетамида и формамида, для получения замещенных 4-аминохиназолинов формулы D;(d) обработку соединения формулы D азидирующими агентами, выбранными из азида натрия и триалкилсилилазида, для получения соединений формулы Е, и затем, когда R2 не является водородом,е) обработку соединения формулы Е алкилирующим агентом формулы F где Y означает галоген или сульфонильную уходящую группу в присутствии основания, такого как карбонаты щелочного металла, гидроксиды, гидриды металлов, алкоксиды металлов,тетра-алкилгуанидины, алкил лития, LDA, с получением смеси соединений G и G1 и (f) очистку смеси соединений формулы G и его изомера G1 перекристаллизацией из подходящего растворителя или препаративной хроматографией для получения требуемого соединения формулы I; где в формулах А, В, С, D, E, F, G и G1, R1 и R2 представляют собой значения, определенные в п.1, иX представляет атом галогена или сульфонильную уходящую группу. 4. Фармацевтическая композиция для лечения гиперпролиферативного заболевания у млекопитающего, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель. 5. Способ лечения гиперпролиферативного заболевания у млекопитающего, который включает введение указанному млекопитающему терапевтически эффективного количества соединения по п.1. 6. Способ по п.5, в котором упомянутым гиперпролиферативным заболеванием является рак. 7. Способ по п.6, в котором указанный рак представляет собой рак легкого, плоских клеток, мочевого пузыря, желудка, поджелудочной железы, груди, головы, шеи, пищевода, мозга, гинекологический рак или рак щитовидной железы. 8. Способ по п.5, в котором гиперпролиферативное заболевание не является раком. 9. Способ ингибирования рецепторной тирозинкиназы EGF типа у субъекта, включающий введение указанному субъекту эффективного количества соединения по п.1.
МПК / Метки
МПК: C07D 401/14, A61K 31/498, A61P 35/00, C07D 239/86, C07D 239/94, C07D 403/14, C07D 239/72, C07D 403/04
Метки: новые, хиназолиновые, противораковых, качестве, 4-(тетразол-5-ил, производные, средств
Код ссылки
<a href="https://eas.patents.su/19-18716-novye-4-tetrazol-5-il-hinazolinovye-proizvodnye-v-kachestve-protivorakovyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Новые 4-(тетразол-5-ил) хиназолиновые производные в качестве противораковых средств</a>
Предыдущий патент: Количественное определение белков с использованием сухого веса внутриклеточных телец
Следующий патент: Антитело или фрагмент антитела, которое связывается с белком ron человека, и его применение
Случайный патент: Стоматологическое анестезирующее средство для интраназального введения, содержащее тетракаин и вазоконстриктор












