Новые 7-замещенные производные 3-карбоксиоксадиазинохинолонов, способ их получения и применение в качестве антибактериальных средств
Номер патента: 18348
Опубликовано: 30.07.2013
Авторы: Ропп Сандрин, Шери-Моцциконаччи Флоранс, Леблан Франсуаз, Чиапетти Паола, Житлен Брюно, Морис Кристоф, Вермют Камилль Ж., Шнейдер Марк
Формула / Реферат
1. Соединения формулы (I)
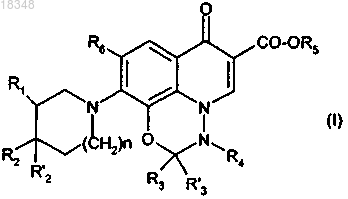
в которой либо R1 означает Н, ОН, NH2, -(CH2)m-NRaRb, где
m=0, 1 или 2;
Ra и Rb, одинаковые или разные, означают Н, линейный или разветвленный алкил(1-6с);
или означают Rc, С(О)Rc, S(O)2Rd или C(O)Rd;
или Ra и Rb образуют вместе с атомом азота радикал Rc;
Rc означает насыщенный, ненасыщенный или ароматический цикл с 5 или 6 атомами С, содержащий 1-4 гетероатома, выбираемых из N, О и S, необязательно замещенный 1-3 алкильными(1-6с) радикалами, причем указанный цикл при необходимости соединен с атомом азота NRaRb посредством атома углерода;
Rd означает линейный или разветвленный алкильный(1-6с) радикал, в случае необходимости замещенный 1-4 галогенами;
или R1 означает CHReRc или CHReRd;
Rc и Rd имеют значения, указанные выше;
Re означает Н, ОН, NH2, NH-алк(1-6с) или N-алк2(1-6с) или NH-ацил(1-7с) или NHRc, где Rc имеет значения, указанные выше;
R2 означает Н, (CH2)m-NRaRb, Rc, CHReRc или CHReRd, где Ra, Rb, Rc, Rd и Re имеют указанные выше значения;
R'2 означает Н;
при условии, что R1 и R2 не могут одновременно означать Н или что R1 и R2 или R2 и R1 не могут означать один (CH2)m-NRaRb или Rc или Н, а другой ОН, или один Н, а другой Rc или NH2, или один Н, а другой (СН2)m-NRaRb, при этом Ra и Rb означают Н, алкил(1-6с) или C(O)Rd, где Rd означает алкил(1-6с) или незамещенный циклоалкил(3-6с);
либо R2 и R'2 означают гем-диалкил(1-6с);
либо R2 и R'2 означают вместе алкил(1-6с)оксим или означают один Rc, а другой ОН;
n означает 0 или 1;
R3 и R'3, одинаковые или разные, означают Н или алкил(1-6с), необязательно замещенный 1-3 галогенами, или R3 означает алкокси(1-6с)карбонильную группу и R'3 означает Н;
R4 означает метил, необязательно замещенный атомами галогена в количестве от одного до трех;
R5 означает Н, алкил(1-6с) или арилалкил(7-12с);
R6 означает Н, фтор;
в виде смесей энантиомеров или отдельных энантиомеров, а также их аддитивные соли с минеральными или органическими кислотами и их соли с минеральными или органическими основаниями.
2. Соединения формулы (I) по п.1, в которой R3 и R'3 означают Н, a R4 означает метил.
3. Соединения формулы (I) по п.1 или 2, в которой R6 означает фтор.
4. Соединения формулы (I) по любому из пп.1-3, в которой один из заместителей R1 или R2 означает (СН2)m-NRaRb, где m равен 0 или 1, CHReRc или CHReRd, а другой означает Н.
5. Соединения формулы (I) по любому из пп.1-4, в которой один из заместителей R1 или R2 означает (СН2)m-NRaRb, где m равен 0, а другой означает Н.
6. Соединения формулы (I) по п.5, в которой m=0, один из заместителей Ra или Rb означает ароматический цикл с 5 или 6 атомами С, содержащий 1-4 гетероатома, выбираемых из N, О и S, необязательно замещенный 1-3 алкильными(1-6с) радикалами, причем указанный цикл, при необходимости, соединен с атомом азота NRaRb посредством атома азота или атома углерода, а другой означает Н.
7. Соединения формулы (I) по п.5, в которой m=0, один из заместителей Ra или Rb означает радикал C(O)Rd, а другой означает Н.
8. Соединения формулы (I) по любому из пп.1-4, в которой один из заместителей R1 или R2 означает CHReRc или CHReRd, а другой означает Н.
9. Соединения формулы (I) по любому из пп.1-3, в которой R1 означает ОН или NH2, R2 и R'2 означают гем-диалкил(1-6с).
10. Соединения формулы (I) по любому из пп.1-3, в которой R1 означает Н или -(СН2)m-NRaRb, R2 и R'2 означают алкил(1-6с)оксим.
11. Соединения формулы (I) по любому из пп.1-10, в которой n=0.
12. Соединение формулы (I) по п.1, выбранное из группы, включающей следующие соединения:
8-фтор-3-метил-6-оксо-9-[3-(пиразин-2-иламинометил)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
8-фтор-3-метил-6-оксо-9-[3-(пиразин-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
8-фтор-3-метил-6-оксо-9-[3-([1,3,4]тиадиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
8-фтор-3-метил-6-оксо-9-[(S)-3-(тиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
8-фтор-3-метил-6-оксо-9-[3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
8-фтор-3-метил-6-оксо-9-[(R)-3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
9-((R,S)-4-амино-3,3-диметилпирролидин-1-ил)-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
9-((R)-4-амино-3,3-диметилпирролидин-1-ил)-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
9-[3-(аминотиазол-2-илметил)пирролидин-1-ил]-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
8-фтор-9-{3-[(Z/E)-метоксиимино]пирролидин-1-ил}-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
8-фтор-9-[3-(аминометил)-4-метоксииминопирролидин-1-ил]-3-метил-6-оксо-2,3-дигидро-6Н-1-окса-3,3a-диазафенален-5-карбоновая кислота,
8-фтор-3-метил-6-оксо-9-[(R)-3-(тиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
8-фтор-3-метил-6-оксо-9-[(S)-3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
9-((S)-4-амино-3,3-диметилпирролидин-1-ил)-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3а-диазафенален-5-карбоновая кислота,
а также их соли.
13. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (II)
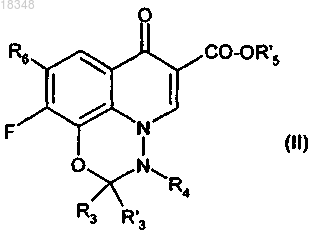
в которой R3, R'3, R4 и R6 имеют значения, указанные в п.1;
R'5 имеет значения R5, указанные выше, или означает другую защитную группу карбоксильной функциональной группы,
обрабатывают соединением формулы (III)
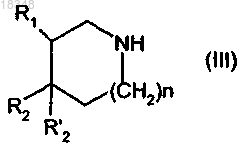
в которой R1, R2, R'2 и n имеют значения, указанные в п.1,
в присутствии основания, затем, при необходимости, удаляют присутствующую или присутствующие защитные группы и, при необходимости, этерифицируют спиртом или другим подходящим производным и переводят в соль.
14. Способ получения соединений формулы (I) по п.1, в которой R2 и R'2 означают алкил(1-6с)оксим, отличающийся тем, что соединение формулы (IV)
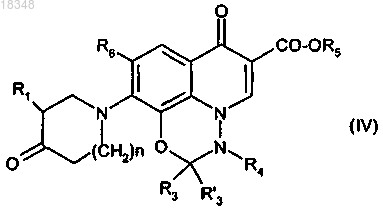
обрабатывают алкоксиамином или его солью.
15. Применение соединений по любому из пп.1-11, а также их солей с фармацевтически приемлемыми кислотами и основаниями в качестве лекарственных средств.
16. Применение соединений по п.12, а также их солей с фармацевтически приемлемыми кислотами или основаниями в качестве лекарственных средств.
17. Фармацевтическая композиция, обладающая антибактериальной активностью, содержащая в качестве действующего начала соединения формулы (I) по любому из пп.1-11.
Текст
НОВЫЕ 7-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 3-КАРБОКСИОКСАДИАЗИНОХИНОЛОНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИБАКТЕРИАЛЬНЫХ СРЕДСТВ в которой либо R1 означает Н, ОН, NH2, -(CH2)m-NRaRb, в которой m=0, 1 или 2; Ra и Rb, одинаковые или разные, означают Н, линейный или разветвленный алкил(1-6 с); или означают Rc, С(О)Rc, S(O)2Rd илиC(O)Rd; или Ra и Rb образуют вместе с атомом азота радикал Rc; Rc означает насыщенный, ненасыщенный или ароматический цикл с 5 или 6 атомами С, содержащий 1-4 гетероатома, выбираемых из N, О и S,необязательно замещенный 1-3 алкильными(1-6 с) радикалами, причем указанный цикл при необходимости соединен с атомом азота NRaRb посредством атома углерода; Rd означает линейный или разветвленный алкильный(1-6 с) радикал, в случае необходимости замещенный 1-4 галогенами; или R1 означает CHReRc или CHReRd; Rc и Rd имеют значения, указанные выше, Re означает Н, ОН, NH2, NH-алк(1-6 с) или Nалк 2(1-6 с) или NH-ацил(1-7 с) или NHRc, где Rc имеет значения, указанные выше; R2 означает Н, (СН 2)mNRaRb, Rc, CHReRc или CHReRd, где Ra, Rb, Rc, Rd и Re имеют указанные выше значения; и R'2 означает Н; при условии, что R1 и R2 не могут одновременно означать Н, или что R1 и R2 или R2 и R1 не могут означать один (СН 2)m-NRaRb или Rc или Н, а другой ОН, или один Н, а другой Rc или NH2, или один Н, а другой (СН 2)m-NRaRb, при этом Ra и Rb означают Н, алкил(1-6 с) или C(O)Rd, где Rd означает алкил(1-6 с) или незамещенный циклоалкил (3-6 с); либо R2 и R'2 означают гем-диалкил(1-6 с); либо R2 и R'2 означают вместе алкил(1-6 с)оксим или означают один Rc и другой ОН; n означает 0 или 1; R3 и R'3, одинаковые или разные, означают Н или алкил(1-6 с), необязательно замещенный 1-3 галогенами, или R3 означает алкокси(16 с)карбонильную группу, и R'3 означает Н; R4 означает метил, необязательно замещенный атомами галогена в количестве от одного до трех; R5 означает Н, алкил(1-6 с) или арилалкил(7-12 с); R6 означает Н, фтор; в виде энантиомеров или смесей, а также к их аддитивным солям с кислотами и основаниями; к получению указанных соединений и к их применению в качестве антибактериальных средств как в медицине, так и ветеринарии. Изобретение относится к новым 7-замещенным производным 3-карбоксиоксадиазинохинолонов, к способу их получения и к их применению в качестве антибактериальных средств. 7-Замещенные производные 3-карбоксиоксадиазинохинолонов описаны в многочисленных патентах, заявках на патент или в публикациях, например, можно назвать патенты ЕР 0259804, ЕР 0343524,ЕР 0688722, US 5480879, US 5679675 или публикации в J. Med. Chem. 1996, 39, 3070-3088, J. Med. Chem. 2002, 45, 5564-5575, или J. Med. Chem. 2004, 47, 2097-2109, а также публикацию S.L. Dax и сотр. в J. Org.Chem. 1992, 57, 744-746, в которой описан способ получения пиридо[3.2.1-ij]-1,3,4-бензоксадиазинов,замещенных в положении 8 азотсодержащим циклом. Изобретение относится к соединениям формулы (I)Ra и Rb, одинаковые или различные, означают Н, линейный, разветвленный или циклический алкил(1-6 с), циклоалкил(3-6 с)-алкил(1-6 с); или означают Rc, S(O)2Rc, С(О)Rc, S(O)2Rd или C(O)Rd; или Ra и Rb образуют вместе с атомом азота радикал Rc;Rc означает насыщенный, ненасыщенный или ароматический цикл с 5 или 6 вершинами, содержащий 1-4 гетероатома, выбранных из N, О и S, необязательно замещенный 1-3 алкильными(1-6 с) радикалами, причем указанный цикл при необходимости соединен с атомом азота NRaRb посредством атома азота или атома углерода;Rd означает линейный или разветвленный алкильный(1-6c) радикал, или циклический(3-6 с) радикал, необязательно замещенный 1-4 галогенами; или R1 означает Rc, или CHReRc, или CHReRd;R2 означает Н, (CH2)m-NRaRb, Rc, CHReRc или CHReRd, где Ra, Rb, Rc, Rd и Rc имеют указанные выше значения;R'2 означает Н; при условии, что R1 и R2 не могут одновременно означать Н или что R1 и R2 или R2 и R1 не могут означать один (CH2)m-NRaRb или Rc или Н, а другой ОН, или один Н, а другой NH2, или один Н, а другой (CH2)m-NRaRb, при этом Ra и Rb означают Н, алкил(1-6 с) или C(O)Rd, где Rd означает алкил(1-6 с) или незамещенный циклоалкил(3-6 с); либо R1 имеет значения, указанные выше, за исключением водорода, a R2 и R'2 означают гемдиалкил(1-6 с) или алкил(1-6 с)оксим, или R2 и R'2 означают соответственно Rc или Rd и ОН, NH2, NHRc или NHRf, причем Rc и Rd имеют значения, указанные выше, а Rf означает ацил(1-7 с); либо R1 означает атом водорода, a R2 и R'2 означают вместе алкил(1-6 с)оксим или означают одинRc, а другой ОН, NH2, NHRc или NHRf, где Rc и Rf имеют указанные выше значения;R4 означает метил, необязательно замещенный от одного до трех атомами галогена;R6 означает Н, фтор, NO2, CF3 или CN; в виде смеси энантиомеров или отдельных энантиомеров, а также к их аддитивным солям с минеральными или органическими кислотами и к солям с минеральными или органическими основаниями. Соединения согласно изобретению обладают замечательными антибактериальными свойствами,которые делают соединения особенно ценными для использования в качестве лекарственных средств как в медицине, так и в ветеринарии. В формуле (I) и далее под линейным или разветвленным алкильным(1-6 с) радикалом понимают любой возможный радикал, в частности метил, этил, пропил или изопропил, бутил, изобутил или трет-бутил; под циклическим(3-6 с)алкильным радикалом понимают циклопропил, циклобутил, циклопентил или циклогексил; под арилалкильным радикалом понимают предпочтительно бензил или фенетил; под галогеном понимают фтор, хлор, бром или йод, предпочтительно фтор; под ацильным(1-7 с) радикалом понимают любой возможный радикал, в частности ацетилпропионил, ацетилбутирил или ацетилбензоил. Когда Rc означает насыщенный цикл, то этим циклом может быть, например, пирролидиновый, пиперидиновый, пиперазиновый или морфолиновый цикл. Когда Rc означает ненасыщенный или ароматический цикл, то этим циклом может быть, например,пиррольный, фурановый, тиофеновый, пиразольный, триазольный, тетразольный, тиазольный, изотиазольный, тиадиазольный, имидазольный, изоксазольный, фуразановый, пиридиновый, пиразиновый, пиримидиновый или пиридазиновый цикл. Когда Rc замещен, то он замещен одним, при необходимости, двумя метильными радикалами. Среди солей продуктов формулы (I) с кислотами можно назвать, наряду с другими, соли, образованные с минеральными кислотами, такими как соляная, бромисто-водородная, иодисто-водородная,серная или фосфорная кислоты, или с органическими кислотами, таким как муравьиная, уксусная, трифторуксусная, пропионовая, бензойная, малеиновая, фумаровая, сукциновая, винная, лимонная, оксалиновая, глиоксиловая, аспартамовая кислота, алкансульфоновые кислоты, такие как метан- и этансульфоновая кислота, арилсульфоновые кислоты, такие как бензол- и паратолуолсульфоновая кислота. Среди солей продуктов формулы (I) с основаниями можно назвать, наряду с другими, соли, образованные с минеральными основаниями, такими как, например, гидроксид натрия, калия, лития, кальция,магния или алюминия, или с органическими основаниями, такими как, например, метиламин, пропиламин,триметиламин,диэтиламин,триэтиламин,N,N-диметилэтаноламин,трис(гидроксиметил)аминометан, этаноламин, пиридин, пиперидин, пиперазин, пиколин, дициклогексиламин, морфолин, бензиламин, прокаин, лизин, аргинин, гистидин, N-метилглюкамин. Изобретение относится, в частности, к соединениям формулы (I), описанной выше, в которой R3 иR'3 означают Н, и R4 означает метил, а также к соединениям, в которых R6 означает фтор. Изобретение относится также, в частности, к соединениям формулы (I), описанной выше, в которой один из заместителей R1 и R2 означает (CH2)m-NRaRb, где m означает 0 или 1, Rc, CHReRc или CHReRd,а другой означает Н. Среди указанных соединений можно, в частности, назвать соединения, в которых один из заместителей R1 и R2 означает (CH2)m-NRaRb, где m означает 0, а другой означает Н, и, более конкретно, среди последних можно назвать соединения, в которых один из заместителей Ra или Rb означает ароматический цикл с 5 или 6 вершинами, содержащий 1-4 гетероатома, выбираемых из N, О и S, необязательно замещенный 1-3 алкильными(1-6 с) радикалами, причем указанный цикл, при необходимости, соединен с атомом азотаNRaRb посредством атома азота или атом углерода, а другой означает Н; и соединения, в которых один из заместителей Ra или Rb означает радикал C(O)Rd, другой означает Н. Более конкретно, изобретение относится к соединениям формулы (I), описанной выше, в которой один из заместителей R1 и R2 означает CHReRc или CHReRd, а другой означает Н. Более конкретно, изобретение относится к соединениям формулы (I), описанной выше, в которой R1 означает ОН или NH2, a R2 и R'2 означают гем-диалкил(1-6 с), а также к соединениям, в которых R1 означает водород или - (CH2)m-NRaRb, a R2 и R'2 означают алкил(1-6 с)оксим. Предпочтительными соединениями формулы (I) согласно изобретению являются соединения, в которых n=0. Среди соединений согласно изобретению можно назвать соединения, описанные в экспериментальной части, в частности следующие соединения: 8-фтор-3-метил-6-оксо-9-[3-(пиразин-2-иламинометил)пирролидин-1-ил]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[3-(пиразин-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[3-([1,3,4]тиадиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[(S)-3-(тиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[(R)-3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота,9-R,S)-4-амино-3,3-диметилпирролидин-1-ил)-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,9-R)-4-амино-3,3-диметилпирролидин-1-ил)-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,-2 018348 9-[3-(аминотиазол-2-илметил)пирролидин-1-ил]-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,8-фтор-9-3-[(Z/E)-метоксиимино]пирролидин-1-ил-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,8-фтор-9-[3-(аминометил)-4-метоксииминопирролидин-1-ил]-3-метил-6-оксо-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[(R)-3-(тиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[(S)-3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота,9-S)-4-амино-3,3-диметилпирролидин-1-ил)-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,а также их соли. Соединения согласно изобретению могут быть получены способом, отличающимся тем, что соединение формулы (II)R'5 имеет значения R5, указанные выше, или означает другую защитную группу карбоксильной функциональной группы,обрабатывают соединением формулы (III) в которой R1, R2, R'2 и n имеют указанные выше значения,в присутствии основания, потом, при необходимости, удаляют присутствующую или присутствующие защитные группы. Проводят реакцию предпочтительно в герметично закрытой емкости в растворе пиридина, при температуре кипения последнего с обратным холодильником. Используемым основанием является предпочтительно третичный амин, например триэтиламин, Nметилморфолин или DBU. Когда R'5 означает защитную группу, то этой группой может быть, в частности, алкильная(1-6 с) группа, алкенильная(2-6c) группа или арилалкильная(7-14 с) группа. После конечного удаления защитной группы R'5 полученную кислоту при желании можно переэтерифицировать с образованием соединения, в котором R5 отличается от водорода. Соединения согласно изобретению, в которых R2 и R'2 означают алкил(1-6 с)оксим, могут быть получены также способом, отличающимся тем, что соединение формулы (IV) обрабатывают алкоксиамином или его солью. Реакцию осуществляют, например, путем взаимодействия алкоксиаминохлорида в присутствии основания, в частности щелочного карбоната или бикарбоната, в растворе алканола или в смеси алканолтетрагидрофуран-вода. Соединение формулы (IV) может быть получено из соответствующего спирта, например, осуществляя реакцию окисления типа реакции Сверна, в присутствии оксалилхлорида, диметилсульфоксида и основания, например амина, такого как триэтиламин. Некоторые соединения формулы (III) известны или находятся в продаже, или же они могут быть получены способами, известными специалисту. Способы их получения представлены ниже, а также описаны в экспериментальной части. Соединение формулы (III), в которой R1 или R2 означает радикал -(СН 2)m-NRaRb, в котором Ra и/или Rb означают Rc или Rd, может быть получено исходя из соединения формулы (V) в которой Р означает защитную группу циклического азота и m и n имеют значения, указанные выше,при взаимодействии его с соединением формулы (VI) в которой Rc и Rd определены выше; Гал означает галоген,в присутствии сильного основания с последующим снятием защитной группы у циклического азота. Реакцию проводят, например, в присутствии алкоголята щелочного металла, растворенного в растворителе, таком как толуол. Галогеном предпочтительно является хлор или бром. Соединение формулы (III), в которой R1 или R2 означает радикал -(СН 2)m-NRaRb, в котором Ra илиRb или Ra и Rb означают Rc, может быть также получено исходя из соединения формулы (VII) в которой m, n и Р определены выше,взаимодействием с соединением формулы (VIII) в которой Rc и Р определены выше,в присутствии трифенилфосфина и диэтилдиазадикарбоксилата в тетрагидрофуране с последующим снятием защитной группы у атома или с атомов азота. Соединение формулы (III), в которой R1 или R2 означает радикал -(СН 2)m-NRaRb, в котором Ra илиRb или Ra и Rb означают С(О)Rc или C(O)Rd, может быть получено исходя из соединения формулы (V),описанной выше, при взаимодействии его с соединением формулы (IX) путем реакции пептидного сочетания в присутствии EDCI/HOBt в растворе растворителя, такого как ДМФ, или при взаимодействии его с галогенангидридом соответствующей кислоты или с соответствующим ангидридом кислоты в присутствии основания, например амина, такого как триэтиламин, в среде растворителя, такого как дихлорметан, с последующим снятием защитной группы циклического азота. Соединение формулы (III), в которой R1 или R2 означает радикал -(CH2)m-NRaRb, в котором Ra илиRb или Ra и Rb означают S(O)2Rc или S(O)2Rd, может быть получено исходя из соединения формулы(V), описанной выше, при взаимодействии его с ангидридом соответствующей алкилсульфоновой кислоты в присутствии основания, например амина, такого как триэтиламин, в среде растворителя, такого как дихлорметан, с последующим снятием защитной группы циклического азота. Соединение формулы (III), в которой R1 или R2 означает радикал -(CH2)m-NRaRb, в котором один из Ra и Rb означает Н, а другой означает радикал Rc типа 4,5-дигидротиазол-2-ил, может быть получено исходя из соединения формулы (V), описанной выше, путем взаимодействия с тиокарбонилимидазолом с получением соответствующего тиоцианата, который обрабатывают 2-хлорэтиламином или его гидрохлоридом в присутствии основания, например триэтиламина, с последующим снятием защитной группы циклического азота. Соединение формулы (III), в которой R1 или R2 означает радикал -(CH2)m-NRaRb, в котором Ra иRb вместе образуют радикал Rc, может быть получено либо исходя из соединения формулы (VI), описанной выше, путем взаимодействия его с соединением H-Rc, в котором Н связан с атомом азота циклаRc, в присутствии диэтилазадикарбоксилата и трифенилфосфина в среде ТГФ, либо исходя из реакционного производного гидроксильной группы соединения формулы (VI), в частности мезилата, взаимодействием его с тем же соединением H-Rc в присутствии гидрида натрия в среде ДМФ с последующим снятием защитной группы циклического азота. Соединение формулы (III), в которой R1 или R2 означает радикал -(CH2)m-NRaRb, в котором m равен 0, a Ra и Rb вместе образуют радикал Rc типа [1,2,3]-триазол-1-ил, может быть получено исходя из соединения формулы (X) в которой Р и n имеют указанное выше значение,взаимодействием с бицикло[2,2,1]гепта-2,5-диеном с последующим снятием защитной группы цик-4 018348 лического азота. Соединение формулы (III), в которой R1 или R2 означает радикал Rc типа 1 Н-тетразол-5-ил, может быть получено исходя из реакционного производного гидроксильной группы соединения формулы (VII),в частности мезилата, взаимодействием его с цианидом тетрабутиламмония в среде ацетонитрила с получением соответствующего цианопроизводного, которое обрабатывают азидом натрия в присутствии основания, например амина, такого как триэтиламин, в среде растворителя, такого как толуол, с последующим снятием защитной группы циклического азота. Соединение формулы (III), при необходимости в защищенной форме, в которой R1 означает ОН илиNH2, и R2 и R'2 означают гем-диалкил, может быть получено способами, известными специалисту, в частности способом, описанным Di Cesare et al., J. Med. Chem. 1992, 35, (22), 4205-13. Соединение формулы (III), при необходимости в защищенной форме, в которой R1 означает Н и R2 и R'2 означают соответственно Rd и ОН, NH2 или NHRf, может быть получено способами, известными специалисту, в частности способом, описанным Britton et al., WO 0644454, или Matsumoto et al., US 4649144, или Giordanetto et al., WO 0711284 или же Hossain et al., WO 04/5295. Соединение формулы (III), при необходимости в защищенной форме, в которой R1 означает Н и R2 и R'2 означают соответственно Rc и ОН, может быть получено исходя из соответствующего кетосоединения, при взаимодействии его с соединением Rc-Гал, в частности Rc-Br, в присутствии сильного основания, в частности бутиллития, в растворе тетрагидрофурана, с последующим, при необходимости, снятием защитной группы циклического азота. Соединение формулы (III) в защищенной на уровне циклического азота форме, в которой R1 означает CHReRc или CHReRd, где Re означает ОН, может быть получено исходя из соответствующего 2 кетосоединения при взаимодействии его с соединением типа сложного эфира формулы RcCOO-алк илиRdCOO-алк, где Rc и Rd определены выше, в присутствии диизопропиламида лития в ТГФ с получением соединения формулы (XI) в которой Rc, Rd, n и Р имеют указанные выше значения,которое восстанавливают боргидридом калия в метаноле с получением соединения формулы (XII) которое восстанавливают с помощью LiAlH4 в присутствии хлорида алюминия в ТГФ. Затем у соединения снимают защитную группу циклического азота. Способ этого типа описан в заявке WO 2005/026154 и в экспериментальной части. Соединение формулы (III) в защищенной форме, в которой R1 означает CHReRc или CHReRd, гдеRe означает ОН, может быть получено также исходя из соединения формулы (XIII) в которой Р и n определены выше,при взаимодействии его с оксалилхлоридом в ДМСО в присутствии основания, такого как триэтиламин, с получением соединения формулы (XIV) где Р и n определены выше,которое обрабатывают соединением типа Rc-Гал или Rd-Гал, где Гал означает, в частности, бром, в присутствии основания, такого как бутиллитий. Затем у соединения снимают защитную группу. Способ этого типа описан в заявке WO 2005/026154 и далее в экспериментальной части. Соединение формулы (III) в защищенной форме, в которой R1 означает CHReRc или CHReRd, гдеRe означает NH2 или NHRf, может быть получено исходя из полученного выше соединения, у которого активируют ОН-группу с помощью метансульфонилхлорида в присутствии основания, например триэтиламина, в среде дихлорметана, и затем обрабатывают азидом натрия в ДМФ с получением соединения формулы (XV) которое восстанавливают водородом в присутствии палладия на угле в среде алканола. Соединение выделяли в защищенной на уровне циклического азота форме. Затем удаляют защитную группу. Способ этого типа описан в заявке ЕР 1182202 и далее в экспериментальной части. Защиту гетероциклического азота и аминов осуществляют, в частности, в зависимости от ситуации,в форме бензил- или тритилпроизводных, в форме карбаматов, в частности аллил-, бензил-, фенил- или трет-бутилкарбамата, или в форме силилпроизводных, таких как диметил-трет-бутил-, триметил-, трифенилсилил или же дифенил-трет-бутилсилил. Снятие защитной группы осуществляют, в зависимости от типа защитной группы, обработкой натрия или лития в жидком аммиаке, гидрогенолизом или с помощью растворимых комплексов палладия 0 или обработкой кислотой, или фторидом тетрабутиламмония, или сильными основаниями, такими как гидрид натрия или трет-бутилат калия. Эти реакции хорошо известны специалисту и представлены в примерах экспериментальной части. Соединение формулы (II), как правило, известно и может быть получено способами, описанными в патенте US 4801584. Соединение формулы (II), в которой R3 и/или R'3 означает(ют) алкильный радикал, необязательно замещенный 1-3 галогенами, может быть получено исходя из соединения формулы (II), в которой R3 иR'3 означают водород, которое обрабатывают горячим водным раствором щелочного основания, затем нейтрализуют для получения соединения формулы (XVI) в которой R4, R'5 и R6 имеют указанные выше значения, которое обрабатывают в диоксане и при кипячении, соединением формулы (XVII) в которой R3 и R'3 имеют указанные выше значения. Соединение формулы (II), в которой R4 означает метильный радикал, замещенный 1-3 галогенами,может быть получено аналогично способу, описанному в патенте US 4801584. Как указано выше, соединения формулы (I) могут находиться в форме энантиомеров или их смесей,главным образом на уровне цикла в положении 9. Получение соединений формулы (I) осуществляется без рацемизации, следовательно, получение энантиомеров возможно при использовании энантиомера,соответствующего соединению формулы (III) или (IV). Соединения согласно изобретению обладают выраженными антибактериальными свойствами и эти свойства проявляются в отношении широкого спектра как Грам(-), так и широкого спектра Грам(+) бактерий. Такой баланс антибактериальной активности отличает их от близких к ним соединений известного уровня техники, например марбофлоксацина или офлоксацина, и делает их очень ценными для использования в качестве лекарственных средств как в медицине, так и в ветеринарии, где существует потребность в соединениях, особенно активных в отношении названных бактерий. Так, соединения активны, в частности, против Грам(+) бактерий, таких как Streptococcus uberis илиStaphylococcus aureus, а также к Mycoplasma bovis или bovirhinis или Clostridium perfringens или Enterococcus faecalis, при этом отмечается ярко выраженная активность против Грам(-) бактерий, таких какManheimia haemolytica, Bordetella bronchiseptica, Escherichia coli или Pseudomonas aeruginosa. Эти свойства указанных соединений, а также их солей с фармацевтически приемлемыми кислотами и основаниями обусловливают их полезность для применения в качестве лекарственных средств для лечения заболеваний, вызванных микробами, чувствительными к лекарственным средствам, в частности для лечения стафилококковых инфекций, таких как стафилококковый сепсис, злокачественные стафилококковые инфекции лица или кожи, пиодермиты, септические или гнойные раны, корбункулы, флегмоны, рожистые воспаления, острые первичные или постгриппозные стафилококковые инфекции, бронхопневмонии, легочные нагноения. Эти продукты могут быть также использованы в качестве лекарственных средств для лечения колибацилзов и ассоциированных инфекций, инфекций, вызванных протеей, клебсиэлле, псевдомонас или сальмонеллой, и других заболеваний, вызванных Грам(-) бактериями. Таким образом, настоящее изобретение относится к продуктам формулы (I), описанной выше, а также к их солям с фармацевтически приемлемыми кислотами и основаниями в качестве лекарственных средств, в частности в качестве антибиотических лекарственных средств. Более конкретно, изобретение относится к предпочтительным продуктам формулы (I), упомянутым выше, среди которых, в частности, соединения, которые имеют следующие наименования: 8-фтор-3-метил-6-оксо-9-[3-(пиразин-2-иламинометил)пирролидин-1-ил]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[3-(пиразин-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[3-([1,3,4]тиадиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[(S)-3-(тиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[(R)-3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота,9-R,S)-4-амино-3,3-диметилпирролидин-1-ил)-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,9-R)-4-амино-3,3-диметилпирролидин-1-ил)-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,9-[3-(аминотиазол-2-илметил)пирролидин-1-ил]-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,8-фтор-9-3-[(Z/E)-метоксиимино]пирролидин-1-ил-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,8-фтор-9-[3-(аминометил)-4-метоксииминопирролидин-1-ил]-3-метил-6-оксо-2,3-дигидро-6 Н-1 окса-3,3 а-диазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[(R)-3-(тиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,8-фтор-3-метил-6-оксо-9-[(S)-3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота,9-S)-4-амино-3,3-диметилпирролидин-1-ил)-8-фтор-3-метил-6-оксо-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота,а также их соли,в качестве лекарственных средств. Изобретение относится также к фармацевтическим композициям, содержащим в качестве действующего начала по меньшей мере одно из лекарственных средств согласно изобретению, которые определены выше. Эти композиции могут вводиться пероральным, ректальным, парентеральным способом, в частности внутримышечно или путем вдыхания или локальным способом путем топического нанесения на кожу или слизистые. Композиции согласно изобретению могут быть твердыми или жидкими и находиться в фармацевтических формах, широко используемых в медицине, таких, например, как обычные таблетки или драже,желатиновые капсулы, гранулы, суппозитории, препараты для инъекций, мази, кремы, гели; эти формы получали традиционными способами. Действующие начала могут быть введены в эти формы со вспомогательными веществами, обычно используемыми в этих фармацевтических композициях, такими как тальк, гуммиарабик, лактоза, крахмал, стеарат магния, масло какао, водные или неводные носители, жировые вещества животного или растительного происхождения, производные парафинов, гликоли, различные смазывающие агенты, диспергаторы или эмульгаторы, консерванты. Эти композиции могут находиться, в частности, в виде порошка, предназначенного для экстемпорального растворения перед употреблением в соответствующем носителе, например в стерильной апирогенной воде. Вводимая доза варьируется в зависимости от конкретного заболевания, пациента, способа введения и рассматриваемого продукта. Эта доза может составлять для человека от 0,25 до 10 г в сутки, при приеме внутрь продукта, описанного в примере 1, или от 0,25 до 10 г в сутки при внутримышечном или внутривенном введении. Следующие примеры иллюстрируют изобретение. В представленных ниже примерах и, при необходимости, в дальнейшем описании используется аббревиатура химических наименований, которая имеет следующие значения:ESI+: положительная ионизация электроспреем; ЯМР: Спектры снимали на спектрометрах с частотой 300 или 400 МГц, при этом спектры протона и углерода регистрировали соответственно при 300 и 75 МГц или 400 и 100 МГц в растворе CDCl3 или ДМСО-d6, МеОН-d4. Полученные значения выражены в(ч./млн) и означают с, д, т, квадр., дд и м. Константа JAB выражена в Гц. Реакции осуществляли, за исключением обратного указания, в атмосфере инертного газа и при комнатной температуре."Общий способ А" (сочетание) заключается во взаимодействии в герметически закрытой колбе продукта "UBE-4" (1,0 экв.) и аминопроизводного, суспендированного в пиридине (0,2 М), в течение ночи при 120 С и при перемешивании. Выпаривали растворитель и добавляли толуол и/или метанол. После концентрирования досуха сырой продукт растирали в метаноле, центрифугировали и сушили.TFA к раствору в дихлорметане защищенного аминопроизводного (N-Boc). Реакцию осуществляли при комнатной температуре с последующей хроматографией на диоксиде кремния. Раствор концентрировали досуха и добавляли толуол и/или метанол. Полученный сырой продукт получали в форме трифторацетата.N-Boc или N-CBz-защищенному аминопроизводному (пиперидину). Смесь выдерживали при перемешивании при комнатной температуре в течение 16-18 ч, затем разбавляли этилацетатом и промывали водой. Затем раствор сушили и концентрировали досуха при пониженном давлении, затем остаток очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат. Пример 1. 8-Фтор-3-метил-6-оксо-9-[3-(пиридин-2-иламинометил)пирролидин-1-ил]-2,3-дигидро 6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (5 а) В герметично закрытую колбу, в которой 40 мл сухого толуола дегазированы аргоном в течение 15 мин, добавляли ацетат палладия (165 мг, 0,24 ммоль, 0,04 экв.) и рацемический 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (152 мг, 0,24 ммоль, 0,04 экв.) и смесь дегазировали аргоном в течение 10 мин. Добавляли 700 мг 2-хлорпиразина (6,11 ммоль, 1,0 экв.), 1,5 г трет-бутилового эфира 3 аминометилпирролидин-1-карбоновой кислоты (7,33 ммоль, 1,2 экв.) и 822 мг трет-бутилата натрия(8,55 ммоль, 1,4 экв.) и смесь перемешивали при 70 С в течение ночи. Концентрировали реакционную смесь и очищали полученный сырой продукт хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (от 1:1 до 0:1), с получением 900 мг 3 а и 3b (2:1, 38%). Полученные 900 мг смеси соединений 3a и 3b растворяли в 25 мл дихлорметана и добавляли 3 мл трифторуксусной кислоты. Смесь перемешивали при комнатной температуре в течение 6 ч. Реакционную смесь концентрировали при пониженном давлении и выпаривали вместе с толуолом и метанолом. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле(в градиенте 7 н. NH3 в метаноле от 5 до 100%), выделяли 4 а и 4b в процессе хроматографического разделения и получали 4 а и 4b в значимом количестве в виде бесцветного масла. 4 а: МС (ESI+) (+0,1%, НСООН): 179,21 [C9H14N4+H]+ (m/z); 4b: МС (ESI+) (+0,1%, НСООН): 257,14 [C13H16N6+H]+ (m/z). Стадия C. 8-Фтор-3-метил-6-оксо-9-[3-(пиридин-2-иламинометил)пирролидин-1-ил]-2,3-дигидро 6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота. В герметически закрытой колбе суспендировали 200 мг 8,9-дифтор-3-метил-6-оксо-2,3,3 а,6 тетрагидронафто[1,8-de][1,3]оксазин-5-карбоновой кислоты "UBE-4" (0,71 ммоль, 1,0 экв.) и 447 мг продукта 4 а, полученного на стадии D (2,51 ммоль, 3,53 экв.), в 3 мл пиридина и 1 мл N-метилморфолина. Реакционную смесь выдерживали при перемешивании в течение 16 ч при температуре 120 С. Реакцию охлаждали до комнатной температуры и осадок отфильтровывали. Полученный продукт растирали в дихлорметане и метаноле, затем выпаривали использованный растворитель. Остаток поглощали этанолом,доводили до температуры кипения с обратным холодильником, фильтровали с получением целевого продукта в виде твердого вещества желтого цвета (275 мг, 74%). ВЭЖХ (градиент 20-80% ACN в Н 2 О): 95%. МС (ESI+) (+0,1%, НСООН): 441,2 [C21H21FN6O4+H]+ (m/z). Т.пл.=238-240 С. Пример 2. 9-3-[(Дипиразин-2-иламино)метил]пирролидин-1-ил-8-фтор-3-метил-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (5b) Соединение 5b получали из 180 мг (1,0 экв.) продукта "UBE-4" и 330 мг соединения 4b, полученного в примере 1 (1,29 ммоль, 2,02 экв.), согласно процедуре, описанной в синтезе соединения 5 а. Смесь выпаривали, затем выпаривали смесь совместно с толуолом, остаток поглощали этанолом, смесь доводили до температуры кипения с обратным холодильником, фильтровали с получением целевого продукта в виде твердого вещества желтого цвета (145 мг, 43%). ВЭЖХ (градиент 20-80% ACN в H2O): 95%. МС (ESI+) (+0,1%, НСООН): 519,0 [C25H23FN8O4+H]+ (m/z). Т.пл.=213-215 С. Пример 3. 9-3-[(Дипиридин-2-иламино)метил]пирролидин-1-ил-8-фтор-3-метил-6-оксо-2,3 дигидро-6 Н-1-окса-3,3 а-диазафенален-5-карбоновая кислота (5 с) Использовали способ, описанный в синтез соединения 3b, но заменяли 2-хлорпиразин на 2 хлорпиридин (4,4 ммоль) с получением целевого продукта, который очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (от 1:1 до 2:8), с получением целевого продукта в виде бесцветного масла (0,5 г, 32%). Стадия В. Синтез соединения 4 с. Растворяли 1,4 г (3,9 ммоль) продукта 3c в 40 мл дихлорметана и добавляли 10 мл 4 н. раствора HCl в диоксане. Смесь выдерживали при перемешивании в течение 4 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле (градиент 7 н. NH3 в метаноле от 5 до 20%). Целевой продукт получали в виде бесцветного масла (0,7 г, 70%). МС (ESI+) (+0,1%, НСООН): 255,15 [C15H18N4+H]+ (m/z). Стадия С. 9-3-[(Дипиридин-2-иламино)метил]пирролидин-1-ил-8-фтор-3-метил-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота. Соединение 5 с получали из 259 мг (0,92 ммоль, 1,0 экв.) продукта "UBE-4" и 700 мг продукта 4 с(2,76 ммоль, 3,0 экв.) в 5 мл пиридина и 0,2 мл (1,84 ммоль, 2,0 экв.) N-метилморфолина, используя тот же способ, которым был получен продукт 5b. Реакционную смесь выпаривали, остаток растирали в воде и образовавшийся осадок отфильтровывали. Отфильтрованное твердое вещество растирали в этаноле и отфильтровывали. Сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (95/5), с получением целевого соединения в виде твердого вещества желтого цвета К раствору трет-бутилового эфира 3-гидроксиметилпирролидин-1-карбоновой кислоты 6 (1,5 г,7,19 ммоль, 2,2 экв.) в 25 мл безводного ТГФ добавляли при 0 С 2,4 г (8,88 ммоль, 1,5 экв.) трифенилфосфина. После растворения добавляли по каплям 4 мл раствора диэтилазодикарбоксилата в толуоле(5,99 ммоль, 1,0 экв.). Реакционную смесь выдерживали при перемешивании в течение 18 ч при комнатной температуре. Затем реакционную смесь выпаривали при пониженном давлении и остаток очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (от 9:1 до 8:2), с получением соединения 8 а в виде бесцветной смолы (1,95 г, 85%). Растворяли 1,95 г продукта 8 а (5,08 ммоль, 1,0 экв.) в 10 мл этилацетата и добавляли 10 мл 4 н. раствора HCl в диоксане. Реакционную смесь выдерживали при перемешивании в течение 6 ч при комнатной температуре. Концентрировали при пониженном давлении и остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (градиент метанола от 5 до 10%), затем смесью дихлорметан-7 н. NH3 в метаноле (градиент 7 н. NH3 в метаноле от 4 до 70%). Получали целевое соединение в виде бесцветного масла (915 мг, 95%). МС (ESI+) (+0,1%, НСООН): 184,23 [C8H13N3S+H]+ (m/z). Стадия C. 8-Фтор-3-метил-6-оксо-9-[3-(тиазол-2-иламинометил)пирролидин-1-ил]-2,3-дигидро-6H1-окса-3,3 а-диазафенален-5-карбоновая кислота. Работали так, как указано в синтезе соединения 5 а, с получением целевого соединения 10 а из 450 мг продукта "UBE-4" (1,59 ммоль, 1,0 экв.) и 915 мг (5,0 ммоль, 3,1 экв.) продукта 9 а с получением целевого соединения в виде твердого вещества желтого цвета (421 мг, 60%). Образец для анализа получали очисткой продукта на диоксиде кремния, элюируя смесью дихлорметан-метанол (градиент % метанола от 2,5 до 5%). ВЭЖХ (градиент 5-80% ACN в Н 2 О): 95%. МС (ESI+) (+0,1%, НСООН): 446,1 [C20H20FN5O4S+H]+ (m/z). Т.пл.=268-270 С. Пример 5. 8-Фтор-3-метил-9-3-[(5-метил[1.3.4]оксадиазол-2-иламино)метил]пирролидин-1-ил-6 оксо-2,3-дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (10b) Растворяли 500 мг 5-метил[1.3.4]оксадиазол-2-иламина (500 мг, 5,04 ммоль, 1,0 экв.) в 5 мл безводного пиридина и добавляли 1,1 г ди-трет-бутилдикарбоната (5,04 ммоль, 1,0 экв.). Реакционную смесь перемешивали 16 ч при температуре 70 С. Выпаривали реакционную среду, затем выпаривали среду совместно с толуолом. Сырой остаток очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (от 9:1 до 0:1), с получением целевого продукта 7b в виде твердого вещества белого цвета (513 мг, 51%). Стадия В. Синтез соединения 8b Соединение 8b получали в соответствии со способом, описанным в синтезе соединения 8 а, но заменяя продукт 7 а на продукт 7b. Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (от 9:1 до 1:1), с получением продукта 8b в виде густого масла (1,7 г) Использовали способ, описанный в синтезе соединений 4 а-4b, но заменяли продукт 3a, 3b на продукт 8b. Соединение получали в виде бесцветного масла (180 мг, 21%). МС (ESI+) (+0,1%, НСООН): 183,27 [C8H14N4+H]+ (m/z). Стадия D. 8-Фтор-3-метил-9-3-[(5-метил[1.3.4]оксадиазол-2-иламино)метил]пирролидин-1-ил-6 оксо-2,3-дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5b, и получали продукт 10b из 140 мг продукта "UBE-4" (0,49 ммоль, 1,0 экв.) и продукта 9b (180 мг, 0,98 ммоль, 2,0 экв.). Образец для анализа получали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (градиент метанола от 2,5 до 5%). Получали целевой продукт в виде твердого вещества желтого цвета (76 мг, 34%). ВЭЖХ (градиент 5-80% ACN в H2O): 95%. МС (ESI+) (+0,1%, НСООН): 446,9 [C20H21FN6O5+H]+ (m/z). Т.пл.=240 С. Пример 6. 8-Фтор-9-(3-[(фуран-2-карбонил)амино]метилпирролидин-1-ил)-3-метил-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (13) К раствору 1,1 г фуран-2-карбоновой кислоты (9,81 ммоль, 1,3 экв.) в 20 мл ДМФ добавляли при 0 С 1,88 г EDCI (9,81 ммоль, 1,3 экв.) и 1,32 г (9,81 ммоль, 1,3 экв.) HOBt. Смесь перемешивали при комнатной температуре в течение 20 мин и добавляли 1,1 г (9,89 ммоль, 1,0 экв.) трет-бутилового эфира 3 амино-метилпиролидин-1-карбоновой кислоты. Реакционную смесь выдерживали при перемешивании в течение 16 ч при комнатной температуре. Затем смесь разбавляли этилацетатом, промывали водой, затем насыщенным водным раствором бикарбоната натрия. Выделенные органические экстракты сушили, затем выпаривали растворитель при пониженном давлении. Получали сырой целевой продукт, который очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (от 8:2 до 1:1) с получением целевого продукта 11 в виде бесцветной смолы (1,8 г, 81%). Стадия В. Синтез соединения 12 Использовали способ, описанный в синтез соединений 4a, 4b, но заменяя продукты 3a, 3b на продукт 11 с получением целевого продукта в виде бесцветного масла (1,0 г, 85%). МС (ESI+) (+0,1%, НСООН): 195,19 [C10H14N2O2+Н]+ (m/z). Стадия С. 8-Фтор-9-(3-[(фуран-2-карбонил)амино]метилпирролидин-1-ил)-3-метил-6-оксо-2,3 дигидро-6 Н-1-окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтез соединения 5 а, и получали продукт 13 исходя из 520 мг продукта "UBE-4" (1,84 ммоль, 1,0 экв.) и 1,0 г продукта 12 (5,55 ммоль, 3,0 экв.). Смесь выпаривали,затем выпаривали смесь совместно с толуолом, растирали в метаноле, доводили до температуры кипения с обратным холодильником и фильтровали. Получали целевой продукт в виде твердого вещества желто- 12018348 Использовали способ, описанный в синтезе соединений 3a, 3b, но заменяли трет-бутиловый эфир 3 аминометилпирролидин-1-карбоновой кислоты на трет-бутиловый эфир 3-аминопирролидин-1 карбоновой кислоты 14. Получали целевое соединение в виде бесцветного масла (800 мг, 89%). Стадия В. Синтез соединения 16 Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 3 с на продукт 15, и остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле (градиент 7 н. NH3 в метаноле от 5 до 20%), с получением целевого соединения в виде бесцветного масла (500 мг, 100%). МС (ESI+) (+0,1%, НСООН): 165,18 [C8H12N4+H]+ (m/z). Стадия С. 8-Фтор-3-метил-6-оксо-9-[3-(пиразин-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 4 с на продукт 16(500 мг, 3,05 ммоль, 3,0 экв.) с получением целевого соединения в виде твердого вещества желтого цвета Добавляли при -78 С 23 мл (22,57 ммоль, 2,0 экв.) 1 М раствора LiHMDS в ТГФ к раствору 1,0 мл 2-фторпиридина (11,29 ммоль, 1,0 экв.) и 2,0 г (11,29 ммоль, 1,0 экв.) 1-бензилпирролидин-3-иламина в 5 мл безводного ТГФ. Реакционную среду выдерживали при перемешивании в течение 1 ч при комнатной температуре, затем при 90 С в течение ночи. Реакционную среду разбавляли водой и экстрагировали этилацетатом. Органический слой сушили, концентрировали досуха при пониженном давлении. Полученный остаток очищали хроматографией на диоксиде кремния, элюируя этилацетатом, с получением целевого продукта в виде бесцветной смолы (2,08 г, 72%). МС (ESI+) (+0,1%, НСООН): 254,06 [C16H19N3+H]+ (m/z). Стадия В. Синтез соединения 21 К раствору 2,08 г продукта 20 (8,22 ммоль) в 25 мл метанола добавляли 2 капли трифторуксусной кислоты и 500 мг палладия на угле. Реакционную среду гидрировали при атмосферном давлении и при температуре 40 С в течение 36 ч. Затем реакционную среду фильтровали и концентрировали досуха при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (градиент метанола от 5 до 10%), затем смесью дихлорметан-7 н. NH3 в метаноле(градиент 7 н. NH3 в метаноле от 10 до 20%). Получали целевое соединение в виде масла оранжевого цвета (1,3 г, 97%). МС (ESI+) (+0,1%, НСООН): 164,16 [C9H13N3+H]+ (m/z). Стадия С. 8-Фтор-3-метил-6-оксо-9-[3-(пиразин-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 а, но заменяли продукт 4 а на продукт 21(1,3 г, 7,96 ммоль, 3,2 экв.). Получали целевое соединение в виде твердого вещества желтого цвета Использовали способ, описанный в синтезе соединения 8b, но заменяли продукт 6 на третбутиловый эфир 3-гидроксипирролидин-1-карбоновой кислоты (1,1 г, 5,87 ммоль). Полученный сырой продукт хроматографировали на диоксиде кремния, элюируя смесью циклогексан-этилацетат (от 9:1 до 1:1), и получали продукт 24b в виде густого масла (2,5 г) Использовали способ, описанный в синтезе соединений 4a, 4b, но заменяли продукты 3a, 3b на продукт 24b. Целевой продукт получали в виде бесцветного масла (200 мг, 20%). МС (ESI+) (+0,1%, НСООН): 164,16 [C9H13N3+H]+ (m/z). Стадия С. 8-Фтор-3-метил-9-[3-(5-метил[1.3.4]оксадиазол-2-иламино)пирролидин-1-ил]-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ получения соединения 10b, но заменяли продукт 9b на продукт 24 с (200 мг,1,19 ммоль, 2,0 экв.). Осадок отфильтровывали и промывали водой, затем этиловым эфиром с получением целевого соединения в виде твердого вещества желтого цвета (62 мг, 25%). ВЭЖХ (градиент 5-95% ACN в Н 2 О): 95%. МС (ESI+) (+0,1%, НСООН): 431,2 [C19H19FN6O5+H]+ (m/z). Т.пл.=285 С. Пример 10. 8-Фтор-3-метил-6-оксо-9-[3-([1.3.4]тиадиазол-2-иламино)пирролидин-1-ил]-2,3 дигидро-6 Н-1-окса-3,3 а-диазафенален-5-карбоновая кислота (25d) Использовали способ, описанный в синтезе соединения 8 а, но заменяли продукт 6 на третбутиловый эфир 3-гидроксипирролидин-1-карбоновой кислоты (1,88 г, 10,0 ммоль, 1,0 экв.) и продукт 7 а на трет-бутиловый эфир [1.3.4]тиадиазол-2-илкарбаминовой кислоты (1,62 г, 8,06 ммоль, 0,8 экв.). Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексанэтилацетат (от 9:1 до 8:2), и получали продукт 25b в виде густого масла (1,63 г, 54%). Стадия В. Синтез соединения 25 с Использовали способ, описанный в синтезе соединений 4a, 4b, но заменяли продукты 3a, 3b на продукт 25b (2,7 г, 7,29 ммоль). Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (градиент метанола от 5 до 10%), затем смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 10 до 40%). Получали целевой продукт в виде бесцветного масла(961 мг, 76%). Стадия С. 8-Фтор-3-метил-6-оксо-9-[3-([1.3.4]тиадиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро 6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 а, но заменяли продукт 4 а на продукт 25 с(950 мг, 5,59 ммоль, 3,0 экв.). Осадок отфильтровывали и промывали водой. Остаток растирали в горячем метаноле и после фильтрации получали целевой продукт в виде твердого вещества желтого цвета Использовали способ, описанный в синтезе соединения 8 а, но заменяли продукт 6 на третбутиловый эфир 3-гидроксипирролидин-1-карбоновой кислоты (1,2 г, 6,41 ммоль, 1,0 экв.) и продукт 7 а на трет-бутиловый эфир [1.2.4]тиадиазол-5-илкарбаминовой кислоты (1,03 г, 5,13 ммоль, 0,8 экв.). Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексанэтилацетат (от 9:1 до 8:2), и получали продукт 26b в виде густого масла (2,03 г, 85%). Стадия В. Синтез соединения 26 с Использовали способ, описанный в синтезе соединений 4a, 4b, но заменяли продукт 3a, 3b на продукт 26b (2,0 г, 5,40 ммоль). Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (градиент метанола от 5 до 20%), затем смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 5 до 40%). Получали целевой продукт в виде бесцветного масла (1,0 г,количественный выход). Стадия С. 8-Фтор-3-метил-6-оксо-9-[3-([1.3.4]тиадиазол-5-иламино)пирролидин-1-ил]-2,3-дигидро 6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 25d, но заменяли продукт 25 с на продукт 26 с (1,0 г, 5,98 ммоль, 2,5 экв.). Остаток растирали в горячем метаноле, затем фильтровали. Целевой продукт получали в виде твердого вещества желтого цвета (614 мг, 61%). ВЭЖХ (градиент 5-95% ACN в Н 2 О): 95%. МС (ESI+) (+0,1%, НСООН): 433,2 [C18H17FN6O4S+H]+ (m/z). Т.пл.=285 С (с разложением). Пример 12. 9-[3-(4,5-Диметилтиазол-2-иламино)пирролидин-1-ил]-8-фтор-3-метил-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (27d) Осуществляя способ, использованный для получения продукта 7 а, но заменяя 2-аминотиазол на 2 амино-4,5-диметилтиазол в форме гидрохлорида (2,5 г, 15,2 ммоль, 1,0 экв.), получали целевой продукт в виде твердого вещества белого цвета (1,07 г, 31%). Использовали способ, описанный в синтезе соединения 8 а, но заменяли соединение 6 на третбутиловый эфир 3-гидроксипирролидин-1-карбоновой кислоты (1,1 г, 5,83 ммоль, 1,0 экв.) и соединение 7 а на соединение 27 а. Полученный сырой продукт выделяли хроматографией на диоксиде кремния,элюируя смесью циклогексан-этилацетат (от 1:0 до 8:2), с получением целевого продукта 27b в виде бесцветного масла (1,45 г, 78%). Стадия С. Синтез соединения 27 с Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 3 с на продукт 27b(1,45 г, 3,65 ммоль) при добавлении 15 мл 4 н. раствора соляной кислоты в диоксане. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н.NH3 в метаноле от 5 до 20%). Целевое соединение получали в виде бесцветного масла (940 мг, 100%). МС (ESI+) (+0,1%, НСООН): 198,21 [C9H15N3S+H]+ (m/z). СтадияD. 9-[3-(4,5-Диметилтиазол-2-иламино)пирролидин-1-ил]-8-фтор-3-метил-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (27d). Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 4 с на продукт 27 с(940 мг, 4,76 ммоль, 4,0 экв.). Реакционную смесь выпаривали при пониженном давлении. Остаток растирали в воде и фильтровали. Полученный твердый продукт растирали сначала в метаноле и фильтровали, затем в дихлорметане и снова в метаноле и получали твердый продукт желтого цвета (143 мг, 26%). ВЭЖХ (градиент 5-95% ACN в Н 2 О): 95%. МС (ESI+) (+0,1%, НСООН): 460,4 [C21H22FN5O4S+H]+ (m/z). Т.пл.=266 С (с разложением). Пример 13. 8-Фтор-3-метил-9-[3-(4-метилтиазол-2-иламино)пирролидин-1-ил]-6-оксо-2,3-дигидро 6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (28d) Использовали способ, описанный в синтезе соединения 8 а, но заменяли соединение 6 на третбутиловый эфир 3-гидроксипирролидин-1-карбоновой кислоты (1,1 г, 5,83 ммоль, 1,0 экв.) и продукт 7 а на трет-бутиловый эфир 4-метилтиазол-2-илкарбаминовой кислоты (1,0 г, 4,67 ммоль, 0,8 экв.). Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексанэтилацетат (от 1:0 до 8:2), с получением целевого продукта 28b в виде бесцветного масла (1,45 г, 87%). Стадия В. Синтез соединения 28 с Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 3 с на продукт 28b(1,55 г, 4,04 ммоль) при прибавлении 7 мл 4 н. раствора соляной кислоты в диоксане. Полученный оста- 17018348 ток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле(в градиенте 7 н. NH3 в метаноле от 5 до 10%). Целевое соединение получали в виде твердого вещества белого цвета (1,0 г, 100%). МС (ESI+) (+0,1%, НСООН): 184,15 [C8H13N3S+H]+ (m/z). Стадия С. 8-Фтор-3-метил-9-[3-(4-метилтиазол-2-иламино)пирролидин-1-ил]-6-оксо-2,3-дигидро 6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (28d). Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 4 с на продукт 28 с(1,0 г, 5,46 ммоль, 4,0 экв.). Продукт выпаривали при пониженном давлении и остаток растирали в эфире,затем фильтровали и сушили. Образец для анализа получали путем хроматографии на диоксиде кремния,элюируя смесью дихлорметан-метанол (в градиенте метанола от 2,5 до 5%), с получением целевого продукта в виде твердого вещества желтого цвета (100 мг, 33%). ВЭЖХ (градиент 5-95% ACN в Н 2 О): 99%. МС (ESI+) (+0,1%, НСООН): 446,2 [C20H20FN5O4S+H]+ (m/z). Т.пл.=260 С (с разложением). Пример 14. 8-Фтор-3-метил-9-[3-(5-метилтиазол-2-иламино)пирролидин-1-ил]-6-оксо-2,3-дигидро 6 Н-1-окса-3,3 а-диазафенален-5-карбоновая кислота (29d) Использовали способ, описанный в синтезе продукта 7 а, но заменяли 2-аминотиазол на 2-амино-5 метилтиазол (2,0 г, 17,5 ммоль, 1,0 экв.) с получением целевого соединения в виде твердого вещества белого цвета (1,07 г, 45%). Стадия В. Синтез соединения 29b Использовали способ, описанный в синтезе соединения 8 а, но заменяли соединение 6 на третбутиловый эфир 3-гидроксипирролидин-1-карбоновой кислоты (1,86 г, 9,92 ммоль, 1,0 экв.) и соединение 7 а на продукт 29 а (1,7 г, 7,93 ммоль, 0,8 экв.). Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (от 1:0 до 1:1) с получением целевого продукта 29b в виде масла желтого цвета (2,1 г, 69%). Стадия С. Синтез соединения 29 с Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 3c на продукт 29b(2,1 г, 5,48 ммоль, 1,0 экв.) при добавлении 15 мл 4 н. раствора соляной кислоты в диоксане. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 5 до 20%). Целевое соединение получали в виде твердого вещества белого цвета (930 мг, 93%). МС (ESI+) (+0,1%, НСООН): 184,15 [C8H13N3S+H]+ (m/z). Стадия D. 8-Фтор-3-метил-9-[3-(5-метилтиазол-2-иламино)пирролидин-1-ил]-6-оксо-2,3-дигидро 6 Н-1-окса-3,3 а-диазафенален-5-карбоновая кислота (29d). Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 4 с на продукт 29 с(930 мг, 5,13 ммоль, 4,0 экв.). Реакционную среду выпаривали при пониженном давлении. Полученный остаток растирали в воде, затем фильтровали и сушили. Образец для анализа получали путем хромато- 18018348 графии на диоксиде кремния, элюируя смесью дихлорметан-метанол (в градиенте метанола от 2,5 до 5%), с получением целевого продукта в виде твердого вещества желтого цвета (72 мг, 25%). ВЭЖХ (градиент 5-95% ACN в Н 2 О): 95%. МС (ESI+) (+0,1%, НСООН): 448,1 [C20H20FN5O4S+H]+ (m/z). Т.пл.=2 65 С (с разложением). Пример 15. 8-Фтор-3-метил-9-[3-(3-метилизотиазол-5-иламино)пирролидин-1-ил]-6-оксо-2,3 дигидро-6 Н-1-окса-3,3 а-диазафенален-5-карбоновая кислота (30d) Использовали способ, описанный в синтезе соединения 8 а, но заменяли соединение 6 на третбутиловый эфир 3-гидроксипирролидин-1-карбоновой кислоты (1,7 г, 9,08 ммоль, 1,0 экв.) и продукт 7 а на трет-бутиловый эфир 3-метилизотиазол-5-илкарбаминовой кислоты (1,94 г, 0,08 ммоль, 1,0 экв.). Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексанэтилацетат (от 0:1 до 7:3) с получением целевого продукта 30b в виде масла желтого цвета (2,9 г, 84%). Стадия В. Синтез соединения 30 с Использовали способ, описанный в синтезе соединений 4a, 4b, но заменяли продукты 3a, 3b на продукт 30b (2,9 г, 7,57 ммоль, 1,0 экв.). Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (в градиенте метанола от 5 до 10%), затем смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 10 до 30%). Целевое соединение получали в виде бесцветного масла (1,0 г, 72%). СтадияC. 8-Фтор-3-метил-9-[3-(3-метилизотиазол-5-иламино)пирролидин-1-ил]-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (30d). Использовали способ получения соединения 10b, но заменяли продукт 9b на продукт 30 с (1,0 мг,5,46 ммоль, 3,0 экв.). Реакционную смесь выпаривали при пониженном давлении. Остаток растирали в этаноле и фильтровали. Получали 251 мг сырого продукта. Образец для анализа получали путем хроматографии на диоксиде кремния, элюируя смесью дихлорметан-метанол (в градиенте метанола от 2,5 до 7,5%), с получением целевого соединения в виде масла желтого цвета (42 мг, 10%). ВЭЖХ (градиент 5-95% ACN в Н 2 О): 95%. МС (ESI+) (+0,1%, НСООН): 446,26 [C20H20FN5O6S+H]+ (m/z). Т.пл.=265 С. Пример 16. 8-Фтор-3-метил-9-[3-(3-метилизоксазол-5-иламино)пирролидин-1-ил]-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (31d) Использовали способ, описанный в синтезе соединения 8 а, но заменяли соединение 6 на третбутиловый эфир 3-гидроксипирролидин-1-карбоновой кислоты (0,47 г, 2,52 ммоль, 1,0 экв.) и продукт 7 а на трет-бутиловый эфир 3-метилизоксазол-5-илкарбаминовой кислоты (0,4 г, 2,02 ммоль, 0,8 экв.). Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексанэтилацетат (от 95:5 до 6:4), и получали продукт 31b в виде твердого вещества белого цвета (0,5 г, 67%). Стадия В. Синтез соединения 31 с Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 3 с на продукт 31b(0,6 г, 1,63 ммоль, 1,0 экв.) при добавлении 10 мл 4 н. раствора HCl в диоксане. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 5 до 20%). Целевое соединение получали в виде твердого вещества белого цвета (230 мг,84%). МС (ESI+) (+0,1%, НСООН): 168,43 [C8H13N3+H]+ (m/z). Стадия С. 8-Фтор-3-метил-9-[3-(3-метилизоксазол-5-иламино)пирролидин-1-ил]-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 4 с на продукт 31 с(230 мг, 1,38 ммоль, 2,0 экв.). Реакционную среду выпаривали при пониженном давлении, остаток растирали в воде, затем фильтровали. Образец для анализа получали путем хроматографии на диоксиде кремния, элюируя смесью дихлорметан-метанол (в градиенте метанола от 2,5 до 5%), с получением целевого продукта в виде твердого вещества желтого цвета (50 мг, 17%). ВЭЖХ (градиент 5-95% ACN в Н 2 О): 95%. МС (ESI+) (+0,1%, НСООН): 430,2 [C20H20FN5O5+H]+ (m/z). Т.пл.=244 С (с разложением). Пример 17. 8-Фтор-3-метил-9-[3-(5-метилизоксазол-3-иламино)пирролидин-1-ил]-6-оксо-2,3 дигидро-6 Н-1-окса-3,3 а-диазафенален-5-карбоновая кислота (32d) Использовали способ, описанный в синтезе соединения 8 а, но заменяли продукт 6 на третбутиловый эфир 3-гидроксипирролидин-1-карбоновой кислоты (4,25 г, 22,7 ммоль, 1,0 экв.) и продукт 7 а на трет-бутиловый эфир 5-метилизоксазол-3-илкарбаминовой кислоты (3,6 г, 18,2 ммоль, 0,8 экв.). Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексанэтилацетат (от 1:0 до 8:2), с получением целевого продукта 32b в виде бесцветного масла (1,8 г, 27%). Стадия В. Синтез соединения 32 с Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 3 с на продукт 32b(1,8 г, 4,9 ммоль, 1,0 экв.) при добавлении 10 мл 4 н. раствора HCl в диоксане. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 5 до 20%). Целевое соединение получали в виде твердого вещества белого цвета (1,0 г,100%). МС (ESI+) (+0,1%, НСООН): 168,22 [C8H13N3O+H]+ (m/z). Стадия С. 8-Фтор-3-метил-9-[3-(5-метилизоксазол-3-иламино)пирролидин-1-ил]-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 4 с на продукт 32 с(1,0 г, 5,98 ммоль, 4,0 экв.). Реакционную среду концентрировали досуха при пониженном давлении. Остаток растирали сначала в метаноле и фильтровали, затем в этаноле с получением целевого продукта в виде твердого вещества желтого цвета (532 мг, 83%). ВЭЖХ (градиент 5-95% ACN в H2O): 99%. МС (ESI+) (+0,1%, НСООН): 430,2 [C20H20FN5O5+H]+ (m/z). Т.пл.=263 С (с разложением). Пример 18. 8-Фтор-3-метил-6-оксо-9-[(S)-3-(тиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота (36 а) Использовали способ, описанный в синтезе соединения 8 а, но заменяли продукт 6 на третбутиловый эфир (R)-3-гидроксипирролидин-1-карбоновой кислоты (1,0 г, 5,34 ммоль, 1,1 экв.). Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексанэтилацетат (от 95:5 до 85:15), и получали продукт 34 а в виде бесцветного масла (1,8 г, 97%). Стадия В. Синтез соединения 35 а Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 4 с на продукт 34 а(1,8 г, 4,87 ммоль, 1,0 экв.) и дихлорметан на этилацетат с 20 мл 4 н. раствора HCl в диоксане. Реакционную смесь перемешивали в течение 1 ч при 60 С, затем концентрировали досуха при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (в градиенте метанола от 5 до 10%), затем смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 20 до 50%). Целевой продукт получали в виде твердого вещества белого цвета (780 мг, 94%). МС (ESI+) (+0,1%, НСООН): 170,15 [C7H11N3S+H]+ (m/z). Стадия С. 8-Фтор-3-метил-6-оксо-9-[(S)-3-(тиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ получения соединения 10b, но заменяли продукт 9 а на продукт 35 а (780 мг,4,61 ммоль, 3,0 экв.). Реакционную среду концентрировали досуха при пониженном давлении. Остаток растирали в метаноле и фильтровали. Получали 462 мг сырого продукта. Образец для анализа получали путем хроматографии на диоксиде кремния, элюируя смесью дихлорметан-метанол (в градиенте метанола от 2,5 до 5%). Получали целевой продукт в виде твердого вещества желтого цвета (30 мг, 17%). ВЭЖХ (градиент 5-95% ACN в Н 2 О): 99%. МС (ESI+) (+0,1%, НСООН): 432,18 [C19H18FN5O4S+H]+ (m/z). Т.пл.=275 С. Использовали способ, описанный в синтезе продукта 8 а, но заменяли продукт 6 на трет-бутиловый эфир (S)-3-гидроксипирролидин-1-карбоновой кислоты (1,0 г, 5,34 ммоль, 1,0 экв.). Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (от 1:0 до 8:2). Получали продукт 34b в виде бесцветного масла (1,8 г, 100%). Спектр 1H ЯМР (CDCl3):7,60 (д, 1 Н, J=3,7), 7,02 (д, 1 Н, J=3,6), 5,73-5,62 (м, 1 Н), 3,40-3,31 (м, 1 Н),3,74-3,67 (м, 3H), 2,52-2,39 (м, 1 Н), 2,22-2,13 (м, 1 Н), 1,57 (с, 9 Н), 1,46 (с, 9 Н). Стадия В. Синтез соединения 35b Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 3 с на продукт 34b(1,8 г, 4,87 ммоль) при добавлении 15 мл 4 н. раствора HCl в диоксане. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 5 до 20%). Целевой продукт получали в виде твердого вещества белого цвета (900 мг, 100%). МС (ESI+) (+0,1%, НСООН): 170,17 [C7H11N3S+H]+ (m/z). Стадия С. 8-Фтор-3-метил-6-оксо-9-[(R)-3-(тиазол-2-иламино)пирролидин-1-ил]-2,3-дигидро-6 Н-1 окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 4 с на продукт 35b(900 мг, 5,32 ммоль, 4,0 экв.). Реакционную среду концентрировали досуха при пониженном давлении. Остаток растирали в воде, затем фильтровали. Полученный остаток растирали в метаноле, затем фильтровали и сушили. Получали целевой продукт в виде твердого вещества желтого цвета (440 мг, 77%). ВЭЖХ (градиент 5-80% ACN в Н 2 О): 95%. МС (ESI+) (+0,1%, НСООН): 432,12 [C19H18FN5O4S+H]+ (m/z). Т.пл.=245-250 С (с разложением). Пример 20. 9-[3-(4,5-Дигидротиазол-2-иламино)пирролидин-1-ил]-8-фтор-3-метил-6-оксо-2,3 дигидро-6 Н-1-окса-3,3 а-диазафенален-5-карбоновая кислота (40)-78 С 1,81 г тиокарбонилимидазола (9,66 ммоль, 1,2 экв.). Реакционную среду выдерживали при перемешивании в течение ночи, оставляя температуру повышаться. Реакционную среду промывали водой,органический слой сушили и концентрировали при пониженном давлении. Остаток очищали хромато- 22018348 графией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (9:1-7:3), с получением целевого продукта 37 в виде бесцветного масла (1,29 г, 70%). Стадия В. Синтез соединения 38 К раствору 1,87 г продукта 37 (8,18 ммоль, 1,0 экв.) в 30 мл безводного ТГФ добавляли 2,3 г триэтиламина (16,38 ммоль, 2,0 экв.) и 1,14 г гидрохлорида 2-хлорэтиламина (9,33 ммоль, 1,14 экв.). Спустя 18 ч выдерживания при комнатной температуре реакционную среду кипятили с обратным холодильником в течение суток. После охлаждения выпадали соли, которые отфильтровывали и фильтрат очищали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя этилацетатом, затем смесью дихлорметан-метанол (в градиенте метанола от 5 до 15%), и получали продукт 38 в виде бесцветного масла (1,9 г, 85%). Стадия С. Синтез соединения 39 Использовали способ, описанный в синтезе продуктов 4a, 4b, но заменяли продукты 3a, 3b на продукт 38 (1,9 г, 7,00 ммоль). Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (в градиенте метанола от 5 до 10%), затем смесью дихлорметан-7 н. NH3 в метаноле(в градиенте 7 н. NH3 в метаноле от 10 до 30%). Получали целевой продукт в виде бесцветного маслаD. 9-[3-(4,5-Дигидротиазол-2-иламино)пирролидин-1-ил]-8-фтор-3-метил-6-оксо-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ получения соединения 10b, но заменяли продукт 9b на продукт 39 (500 мг,2,92 ммоль, 2,7 экв.). Реакционную среду фильтровали (125 мг сырого продукта). Образец для анализа получали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (в градиенте метанола от 2,5 до 5%). Получали целевой продукт в виде масла желтого цвета (30 мг, 6,5%). ВЭЖХ (в градиенте ACN в Н 2 О 5-80%): 99%. МС (ESI+) (+0,1%, НСООН): 434,0 [C19H20FN5O4S+H]+ (m/z). Т.пл.=265-267 С (с разложением). Пример 21. 8-Фтор-3-метил-6-оксо-9-[3-([1.2.4]триазол-1-ил)пирролидин]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота и 8-фтор-3-метил-6-оксо-9-[3-([1.3.4]триазол-1-ил)пирролидин]-2,3-дигидро-6 Н-1-окса-3,3 адиазафенален-5-карбоновая кислота (44 а, 44b) Продукты получали согласно способу, описанному в заявке US 2003/0225107, но заменяли 5-(R)-3[4-(1-цианоциклопропан-1-ил)-5-гидроксиметил]оксазолидин-2-он на трет-бутиловый эфир 3 гидроксипирролидин-1-ил-карбаминовой кислоты (1,6 г, 8,54 ммоль, 1,0 экв.), тетраметилазодикарбоксамид на диэтилазодикарбоксилат, бутилфосфин на трифенилфосфин и бензол на тетрагидрофуран. Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексанэтилацетат (7:3-0:1), и получали смесь продуктов 42a, 42b в виде бесцветного масла (845 мг, 42%). Использовали способ, описанный в синтезе продуктов 4a, 4b, но заменяли смесь продуктов 3a, 3b на смесь продуктов 42a, 42b (950 мг, 3,98 ммоль). Остаток очищали хроматографией на диоксиде кремния,элюируя смесью дихлорметан-метанол (в градиенте метанола от 5 до 10%), затем смесью дихлорметан 7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 10 до 30%). Получали смесь продуктов 43a-43b в виде масла желтого цвета (555 мг, 100%). МС (ESI+) (+0,1%, НСООН): 139,22 [C6H10N4+H]+ (m/z). Стадия С. 8-Фтор-3-метил-6-оксо-9-[3-([1.2.4]триазол-1-ил)пирролидин]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота и 8-фтор-3-метил-6-оксо-9-[3-([1.3.4]триазол-1-ил)пирролидин]-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота. Целевые продукты получали с использованием способа получения соединения 5 а, но заменяли продукт 4 а на смесь продуктов 43a, 43b (555 мг, 4,02 ммоль, 2,8 экв.). Осадок отфильтровывали и промывали водой. Остаток растирали в горячем метаноле и после фильтрации с получением целевого продукта в виде твердого вещества желтого цвета (371 мг, 65%). ВЭЖХ (в градиенте ACN в Н 2 О 5-95%): 99%. МС (ESI+) (+0,1%, НСООН): 401,2 [C18H17FN6O4+H]+ (m/z). Т.пл.=277-279 С (с разложением). Пример 22. 8-Фтор-3-метил-6-оксо-9-[3-([1.2.3]триазол-1-ил)пирролидин]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота и 8-фтор-3-метил-6-оксо-9-[3-([1.2.5]триазол-1-ил)пирролидин]-2,3-дигидро-6H-1-окса-3,3 адиазафенален-5-карбоновая кислота (49a, 49b) Продукт получали согласно способу, описанному в заявке US 2003/0225107, но заменяли 5-(R)-3-[4(1-цианоциклопропан-1-ил)-5-метансульфонилоксиметил]оксазолидин-2-он на трет-бутиловый эфир 3 метансульфонилгидроксипирролидин-1-ил-карбаминовой кислоты (1,6 г, 8,53 ммоль, 1,0 экв.). Сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (1:01:1), и получали смесь продуктов 47a, 47b в виде твердого вещества белого цвета (1,4 г, 69%). Стадия В. Синтез соединений 48a, 48b Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 3 с на продукты 47a, 47b (1,9 г, 7,97 ммоль, 1,0 экв.) прибавляя 10 мл 4 н. HCl в диоксане. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 0 до 10%). Получали целевой продукт в виде вещества белого цвета (807 мг, 73%). МС (ESI+) (+0,1%, НСООН): 139,05 [C6H10N4+H]+ (m/z). Стадия С. 8-Фтор-3-метил-6-оксо-9-[3-([1.2.3]триазол-1-ил)пирролидин]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота и 8-фтор-3-метил-6-оксо-9-[3-([1.2.5]триазол-1-ил)пирролидин]-2,3-дигидро-6 Н-1-окса-3,3 адиазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 4 с на продукты 48a, 48b (800 мг, 5,79 ммоль, 3,0 экв.). Реакционную среду вливали в этанол. Осадок отфильтровывали,затем промывали метанолом с получением целевого продукта в виде твердого вещества желтого цвета Целевой продукт получали согласно способу, описанному в заявке US 2003/0225107, но заменяли 5(R)-азидометил-3-[4-(1-цианоциклопропан-1-ил)фенил]оксазолидин-2-он на трет-бутиловый эфир 3 азидопирролидин-1-илкарбаминовой кислоты (1,5 г, 7,07 ммоль, 1,0 экв.). Реакционную среду концентрировали досуха при пониженном давлении и получали продукт 47 а в виде желтого масла (1,7 г, 100%). Стадия В. Синтез соединения 48 а Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 3 с на продукт 47 а(1,7 г, 7,07 ммоль) и использовали 10 мл 4 н. HCl в диоксане. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 0 до 5%). Получали целевой продукт в виде твердого вещества белого цвета (900 мг, 92%). Стадия С. 8-Фтор-3-метил-6-оксо-9-[3-([1.2.3]триазол-1-ил)пирролидин-1-ил]-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 4 с на продукт 48 а(1,03 г, 7,45 ммоль, 4,0 экв.). Реакционную среду вливают в этанол, осадок отфильтровывали и промывали метанолом. Получали целевой продукт в виде твердого вещества желтого цвета (580 мг, 78%). ВЭЖХ (в градиенте ACN в Н 2 О 5-95%): 99%. МС (ESI+) (+0,1%, НСООН): 401,19 [C18H17FN6O4+H]+ (m/z). Т.пл.=265 С (с разложением). Пример 24. 8-Фтор-3-метил-6-оксо-9-[3-(1 Н-тетразол-5-ил)пирролидин-1-ил]-2,3-дигидро-6H-1 окса-3,3 а-диазафенален-5-карбоновая кислота (54) К раствору 4,66 г трет-бутилового эфира 3-метансульфонилгидроксипирролидин-1-илкарбаминовой кислоты (18,7 ммоль, 1,0 экв.) в 10 мл ацетонитрила добавляли 10 г тетрабутиламмонийцианида(37,4 ммоль, 2,0 экв.). Реакционную среду выдерживали при перемешивании в течение ночи при 65 С. После охлаждения смесь разбавляли этилацетатом и промывали водным раствором бикарбоната натрия. Органические экстракты сушили, затем концентрировали досуха при пониженном давлении. Полученный сырой продукт хроматографировали на диоксиде кремния, элюируя смесью циклогексан-этилацетат(1:0-1:1) и получали продукт 51 в виде масла желтого цвета (2,9 г, 79%). Стадия В. Синтез соединения 52 К раствору 1,0 г продукта 51 (5,1 ммоль, 1.0 экв.) в 10 мл толуола добавляли 0,497 г азида натрия(7,64 ммоль, 1,5 экв.) и гидрохлорид триэтиламина, затем реакционную смесь поддерживали при перемешивании в течение 24 ч при 100 С. После охлаждения среду разбавляли этилацетатом, затем разбавляли водой. Органические экстракты сушили, затем концентрировали при пониженном давлении. Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя дихлорметаном, содержащим 5% метанола, с получением целевого продукта в виде масла желтого цвета (1,0 г, 82%). Стадия С. Синтез соединения 53 Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 3 с на продукт 52(1,09 г, 4,56 ммоль, 1,0 экв.) и использовали 10 мл 4 н. HCl в диоксане. Остаток растирали в дихлорметане, затем фильтровали. Полученный продукт снова растирали с 7 н.NH3 в метаноле, затем выпаривали при пониженном давлении. Получали целевой продукт в виде твердого вещества бежевого цвета (780 мг,100%). Стадия D. 8-Фтор-3-метил-6-оксо-9-[3-(1 Н-тетразол-5-ил)пирролидин-1-ил]-2,3-дигидро-6H-1-окса 3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 с, но заменяли продукт 4 с на продукт 53(780 мг, 5,61 ммоль, 4,0 экв.). Реакционную среду вливают в этанол и осадок отфильтровывали. Остаток растирали в воде, фильтровали, затем в метаноле и, наконец, в дихлорметане с получением целевого продукта в виде твердого вещества желтого цвета (60 мг, 11%). ВЭЖХ (в градиенте ACN в Н 2 О 5-95%): 90%. МС (ESI+) (+0,1%, НСООН): 402,28 [C17H16FN7O4+H]+ (m/z). Т.пл.=250 С (с разложением). Пример 25. 8-Фтор-9-3-[(фуран-2-карбонил)амино]пирролидин-1-ил-3-метил-6-оксо-2,3-дигидро 6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (57 а) Использовали способ, описанный в синтезе продукта 11, но заменяли продукт 1 на продукт 14(1,0 г, 4,97 ммоль, 1,0 экв.). Полученный сырой продукт очищали хроматографией на диоксиде кремния,элюируя смесью циклогексан-этилацетат (8:2-0:1), и получали продукт 55 а (1,29 г, 92%) в виде твердого белого вещества. Стадия В. Синтез соединения 56 а Использовали способ, описанный в синтезе соединения 4 с, но заменяли продукт 3 с на продукт 55 а(1,29 г, 4,60 ммоль, 1,0 экв.), прибавляя 10 мл 4 н. HCl в изопропаноле, и заменяли дихлорметан на этилацетат. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметана с 10% метанола, затем смесью дихлорметан-7 н. NH3 в метаноле (в градиенте 7 н. NH3 в метаноле от 0 до 10%). Получали целевой продукт в виде смолы белого цвета (725 мг, 87%). МС (ESI+) (+0,1%, НСООН): 181,33 [C9H12N2O2+H]+ (m/z). Стадия C. 8-Фтор-9-3-[(фуран-2-карбонил)амино]пирролидин-1-ил-3-метил-6-оксо-2,3-дигидро 6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе продукта 5 а, но заменяли продукт 4 а на продукт 56 а(725 мг, 4,02 ммоль, 3,0 экв.), после охлаждения реакционную среду фильтровали. Сырой продукт растирали в кипящем этаноле, затем фильтровали с получением целевого продукта в виде твердого вещества бежевого цвета (497 мг, 84%). ВЭЖХ (в градиенте ACN в H2O 5-95%): 95%. МС (ESI+) (+0,1%, НСООН): 443,1 [C21H19FN4O6+H]+ (m/z). Т.пл.=306-308 С (с разложением). Пример 26. 8-Фтор-3-метил-6-оксо-9-[3-(3,3,3-трифторпропиониламино)пирролидин-1-ил]-2,3 дигидро-6H-1-окса-3,3a-диазафенален-5-карбоновая кислота (57 с) Использовали способ получения соединения 55b, но заменяли циклопентанкарбонилхлорид на 3,3,3-трифторпропионилхлорид (2,3 г, 15,30 ммоль, 1,5 экв.), целевой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (8:2-1:1), и получали продукт 55 с в виде масла бледно-желтого цвета 91,4 г, 46%). Стадия В. Синтез соединения 56 с Использовали способ, описанный в синтезе соединений 4a, 4b, но заменяя продукты 3a, 3b на про- 27018348 дукт 50 с (1,4 г, 4,72 ммоль, 1,0 экв.). Остаток очищали хроматографией на диоксиде кремния, элюируя смесью дихлорметан-метанол (в градиенте метанола от 5 до 15%), с получением продукта 56 с в форме трифторацетатной соли в виде масла бледно-желтого цвета (1,4 г, 100%). МС (ESI+) (+0,1%, НСООН): 197,13 [C7H11F3N2O+H]+ (m/z). СтадияC. 8-Фтор-3-метил-6-оксо-9-[3-(3,3,3-трифторпропиониламино)пирролидин-1-ил]-2,3 дигидро-6H-1-окса-3,3a-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 а, но заменяли продукт 4 а на продукт 56 с(1,4 г, 4,51 ммоль, 4,0 экв.), и после выпаривания досуха при пониженном давлении получали сырой продукт, который растирали в метаноле, затем в кипящем метаноле, и, после фильтрации и высушивания,получали целевой продукт в виде твердого вещества желтого цвета (277 мг, 57%). ВЭЖХ (в градиенте ACN в Н 2 О 5-95%): 90%. МС (ESI+) (+0,1%, НСООН): 459,0 [C19H18N4O5+H]+ (m/z). Т.пл.=2 92 С (с разложением). Пример 27. 8-Фтор-3-метил-6-оксо-9-[3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро 6H-1-окса-3,3a-диазафенален-5-карбоновая кислота (57d) К раствору 1,67 г продукта 14 (8,96 ммоль, 1,0 экв.) в 25 мл дихлорметана добавляли при 0 С 2,5 мл триэтиламина (17,93 ммоль, 2,0 экв.). Спустя 30 мин медленно добавляли 1,9 мл трифторуксусного ангидрида (13,45 ммоль, 1,5 экв.) с 20 мг DMAP и реакционную среду перемешивали при комнатной температуре в течение ночи. Затем среду разбавляли дихлорметаном и промывали водой. Органические экстракты сушили, затем концентрировали досуха при пониженном давлении и полученный остаток очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат (9:1-7:3). Получали продукт 55d в виде масла (2,03 г, 80%). Стадия В. Синтез соединения 56d Использовали способ, описанный в синтезе продуктов 4a, 4b, но заменяли продукты 3a, 3b на продукт 55d (2,03 г, 7,21 ммоль, 1,0 экв.). Остаток использовали без очистки. Продукт 56d получали в форме трифторуксусной соли в виде желтого масла (2,44 г, 100%). МС (ESI+) (+0,1%, НСООН): 182,91 [C6H9F3N2O+H]+ (m/z). Стадия C. 8-Фтор-3-метил-6-оксо-9-[3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3-дигидро 6H-1-окса-3,3a-диазафенален-5-карбоновая кислота. Использовали способ, описанный в синтезе соединения 5 а, но заменяли продукт 4 а на продукт 56d(1,2 г, 4,05 ммоль, 3,0 экв.). Реакционную смесь фильтровали и продукт растирали в кипящем метаноле,затем фильтровали с получением целевого продукта в виде твердого вещества желтого цвета (263 мг,42%). ВЭЖХ (в градиенте ACN в H2O 5-95%): 95%. МС (ESI+) (+0,1%, НСООН): 444,9 [C18H16F4N4O5+H]+ (m/z). Т.пл.=281-283 С. Использовали способ, описанный в синтезе соединения 5 а, но заменяли продукт 4 а на 3-(S)-(2,2,2)трифторацетиламинопирролидин (1 г, 3,38 ммоль, 3,0 экв.). Реакционную среду фильтровали и осадок растирали в горячем метаноле, затем фильтровали. Получали целевой продукт в виде твердого вещества желтого цвета (64 мг, 13%). ВЭЖХ (в градиенте ACN в Н 2 О 5-95%): 99%. МС (ESI+) (+0,1%, НСООН): 445,3 [C18H16F4N4O5+H]+ (m/z). Т.пл.=273-275 С. Пример 29. 8-Фтор-3-метил-6-оксо-9-[(R)-3-(2,2,2-трифторацетиламино)пирролидин-1-ил]-2,3 дигидро-6H-1-окса-3,3a-диазафенален-5-карбоновая кислота (57f) Использовали способ, описанный в синтезе соединения 5 а, но заменяли продукт 4 а на 3-(R)-(2,2,2)трифторацетиламинопирролидин (1,5 г, 5,06 ммоль, 3,0 экв.). Реакционную среду фильтровали и осадок растирали в горячем метаноле, затем фильтровали с получением целевого продукта в виде твердого вещества желтого цвета (375 мг, 50%). ВЭЖХ (в градиенте ACN в Н 2 О 5-95%): 99%. МС (ESI+) (+0,1%, НСООН): 445,3 [C18H16F4N4O5+H]+ (m/z). Т.пл.=273-275 С. Пример 30. 8-Фтор-3-метил-6-оксо-9-[(S)-3-(трифторметансульфониламино)пирролидин-1-ил]-2,3 дигидро-6H-1-окса-3,3 а-диазафенален-5-карбоновая кислота (60 а) К раствору 1,5 г продукта 14 (8,05 ммоль, 1,0 экв.) в дихлорметане (30 мл) добавляли при 0 С 3,4 мл триэтиламина (24,16 ммоль, 3,0 экв.). Спустя 15 мин медленно добавляли 1,7 мл трифторметансульфонового ангидрида и реакционную среду перемешивали при комнатной температуре в течение 6 ч. Затем среду разбавляли дихлорметаном и промывали насыщенным водным раствором бикарбоната натрия. Органический экстракт сушили, затем концентрировали досуха при пониженном давлении. Полученный сырой продукт очищали хроматографией на диоксиде кремния, элюируя смесью циклогексан-этилацетат(9:1-6:4), с получением целевого продукта 58 а в виде масла желтого цвета (1,1 г, 42%). Стадия В. Синтез соединения 59 а
МПК / Метки
МПК: A61K 31/5395, C07D 498/06, A61P 31/04
Метки: качестве, средств, 3-карбоксиоксадиазинохинолонов, производные, антибактериальных, получения, применение, способ, новые, 7-замещенные
Код ссылки
<a href="https://eas.patents.su/30-18348-novye-7-zameshhennye-proizvodnye-3-karboksioksadiazinohinolonov-sposob-ih-polucheniya-i-primenenie-v-kachestve-antibakterialnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Новые 7-замещенные производные 3-карбоксиоксадиазинохинолонов, способ их получения и применение в качестве антибактериальных средств</a>
Предыдущий патент: Способ изготовления сита вибросита
Следующий патент: Способ видеоанализа
Случайный патент: Способ переработки сульфидных руд, содержащих драгоценные металлы












