Фармацевтическая композиция, набор и способ лечения гематологического злокачественного новообразования
Номер патента: 18415
Опубликовано: 30.07.2013
Авторы: Брейтфелд Филип, Бабу Ярлагадда С., Бантиа Шанта
Формула / Реферат
1. Способ лечения гематологического злокачественного новообразования у субъекта, включающий следующие этапы:
(a) введение указанному субъекту эффективного количества ингибитора фосфорилазы пуриновых нуклеозидов (PNP) и
(b) введение указанному субъекту эффективного количества анти-CD20 агента.
2. Способ по п.1, отличающийся тем, что указанный ингибитор PNP представляет собой фородезин.
3. Способ по любому из пп.1, 2, отличающийся тем, что указанный анти-CD20 агент представляет собой ритуксимаб.
4. Способ по любому из пп.1-3, отличающийся тем, что указанные ингибитор PNP и анти-CD20 агент вводят одновременно.
5. Способ по любому из пп.1-3, отличающийся тем, что указанные ингибитор PNP и анти-CD20 агент вводят последовательно.
6. Способ по п.5, отличающийся тем, что указанный анти-CD20 агент вводят один или несколько раз до введения ингибитора PNP.
7. Фармацевтическая композиция, содержащая ингибитор PNP и анти-CD20 агент.
8. Композиция по п.7, отличающаяся тем, что указанный ингибитор PNP представляет собой фородезин.
9. Композиция по п.7, содержащая фородезин и ритуксимаб.
10. Набор, включающий ингибитор PNP и анти-CD20 агент.
11. Набор по п.10, дополнительно включающий систему доставки ингибитора PNP, анти-CD20 агента или их комбинацию.
12. Набор по п.10 или 11, дополнительно включающий инструкции по лечению субъекта.
13. Набор по любому из пп.10-12, отличающийся тем, что указанный ингибитор PNP представляет собой фородезин.
14. Набор по любому из пп.10-13, включающий фородезин и ритуксимаб.
Текст
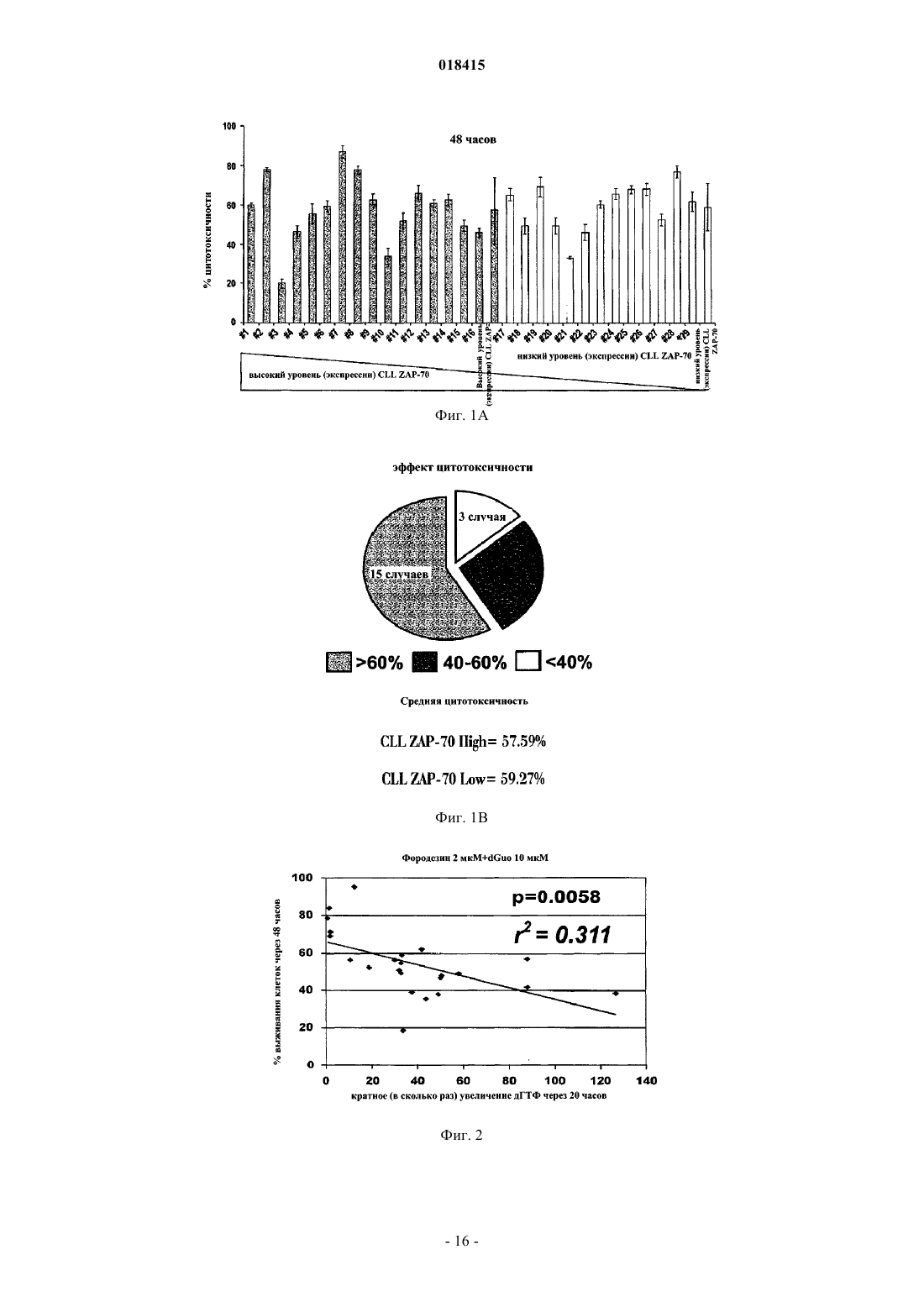
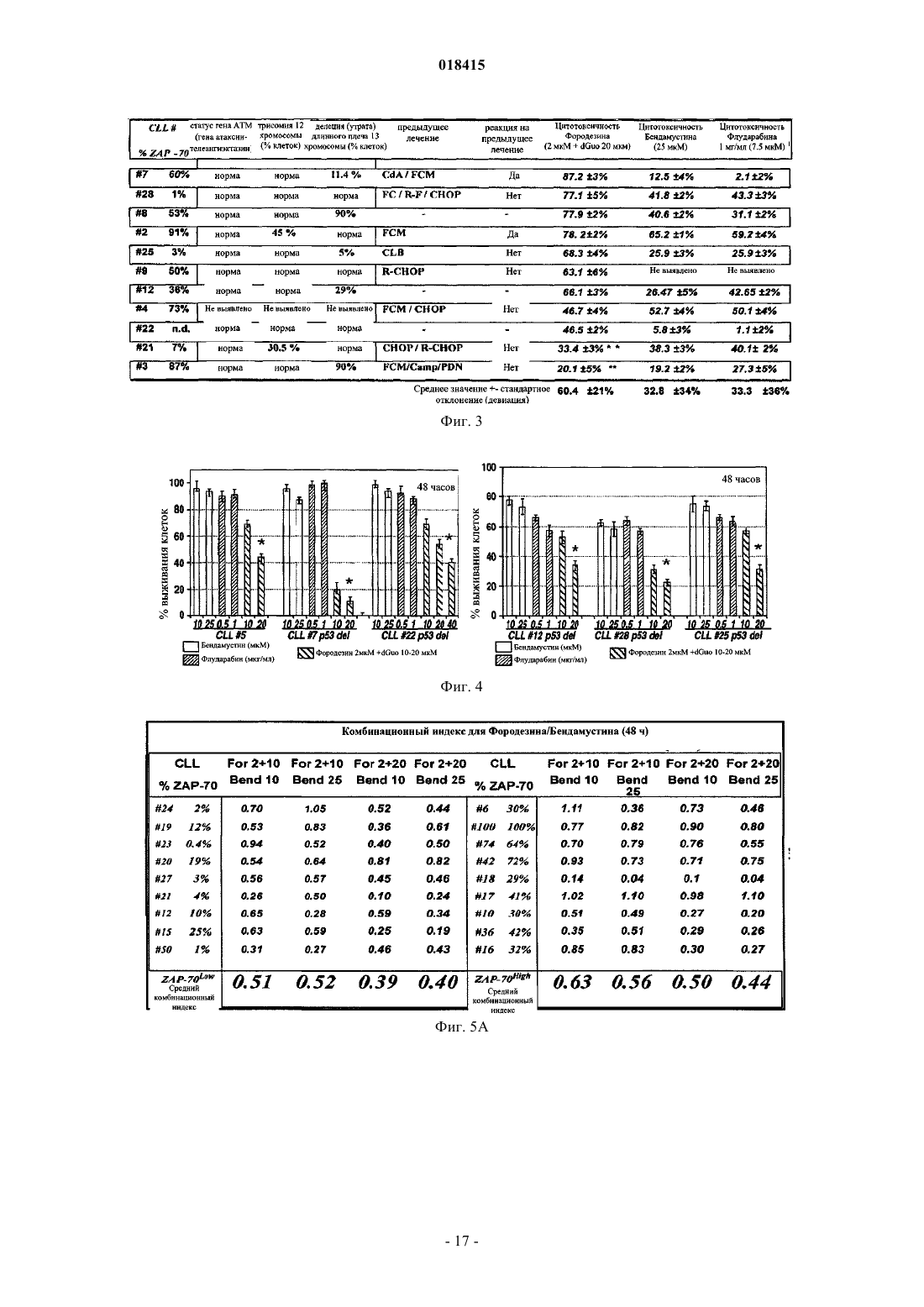
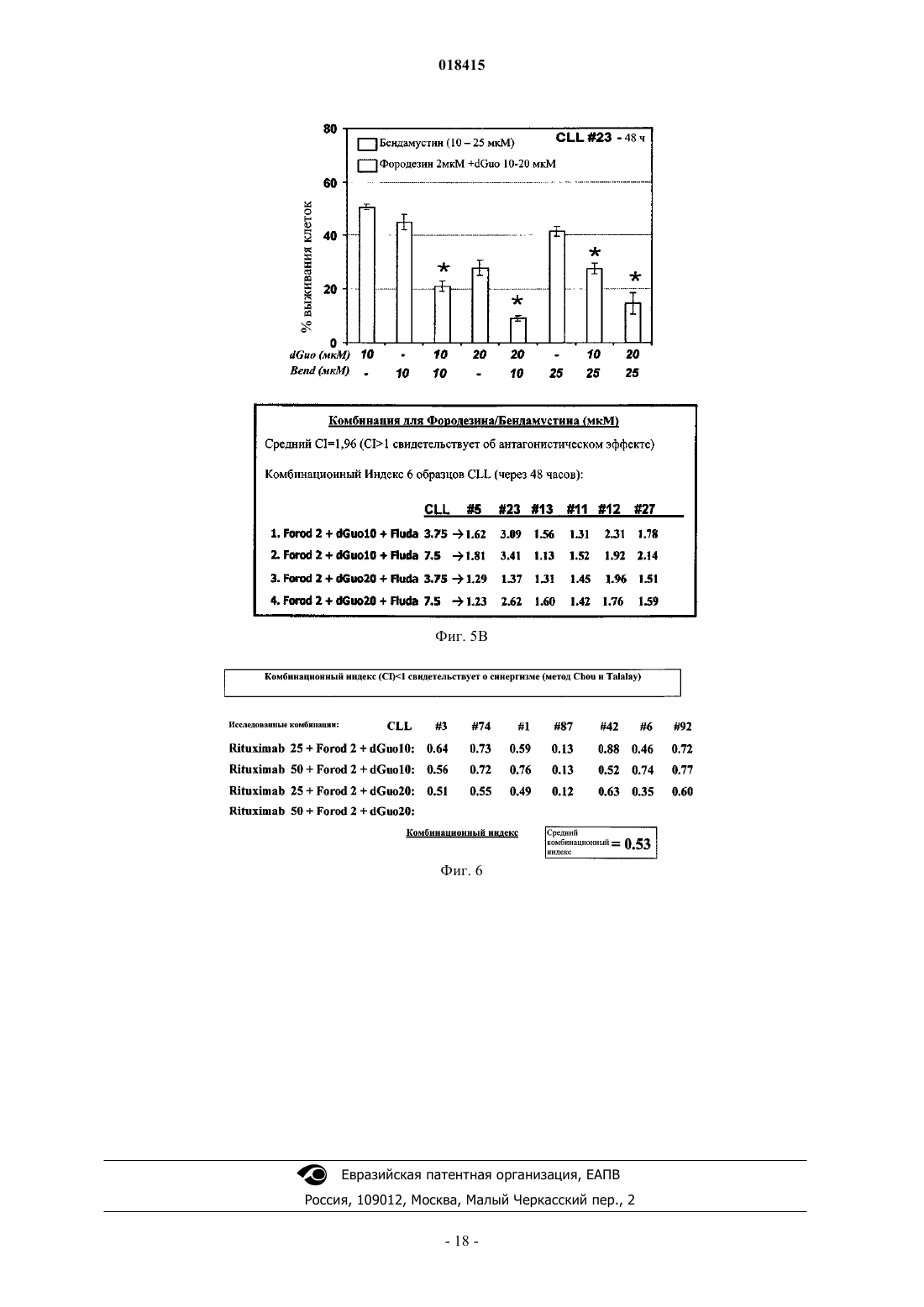
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, НАБОР И СПОСОБ ЛЕЧЕНИЯ ГЕМАТОЛОГИЧЕСКОГО ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ Настоящее изобретение относится к способу лечения гематологического злокачественного новообразования, причм указанный способ включает введение ингибитора фосфорилазы пуриновых нуклеозидов (PNP) и анти-CD20 агента, а также к соответствующей фармацевтической композиции и набору. Область техники Данное изобретение относится к лечению гематологических злокачественных новообразований, таких как, например, злокачественные новообразования крови, способом, который включает введение ингибитора фосфорилазы пуриновых нуклеозидов (PNP). В частности, описывается способ лечения хронической лимфоцитарной лейкемии (CLL) и острой лимфоцитарной лейкемии (ALL). Родственные заявки Данное изобретение испрашивает приоритет на основании заявки США 61/012762, от 10 декабря 2007 г., ссылка на которую приведена в настоящем описании. Уровень техники В настоящее время злокачественные опухоли являются второй основной причиной смерти в Соединнных Штатах, где более чем 8 млн граждан поставлен диагноз рак (злокачественной опухоли). В 1995 году злокачественные новообразования послужили причиной 23,3% всех смертей в США (см.,например, статистику Департамента общественного здоровья при Правительстве Соединнных Штатов,Национальный центр статистики здоровья, Здоровье Соединнных Штатов, 1996-97 и Справочник травм,117 (Injury Chartbook 117, 1997. В настоящее время злокачественные опухоли лечат в основном одним из нижеперечисленных способов или их комбинацией: хирургически, облучением или химиотерапией. Хирургическое лечение включает в себя удаление массы поражнной ткани. В то время как хирургическое вмешательство часто эффективно при удалении определнно локализованных опухолей, например опухолей груди, толстой кишки и кожи, этот способ не может быть применн при лечении опухолей, поражающих другие области, такие как позвоночник, или при лечении диссеминированных неопластических состояний, таких как лейкемия. Облучение включает ионизирующее облучение живой ткани, вызывающее гибель или повреждение обработанных клеток. Побочные эффекты облучения могут быть острыми и преходящими, однако некоторые могут быть необратимыми. Химиотерапия включает нарушение клеточной репликации или метаболизма. Чаще всего е применяют при лечении злокачественных опухолей груди, лгких или яичек. Одна из главных причин неудачи такого лечения злокачественных опухолей - это выработка опухолевыми клетками устойчивости к препаратам - серьзная проблема, которая может привести к рецидиву заболевания или даже к смерти. Таким образом, нужны более эффективные способы лечения злокачественных новообразований. Сущность изобретения В данном изобретении описан способ лечения гематологических злокачественных новообразований(например, CLL и ALL) у субъекта. Указанный способ включает следующие стадии: (а) введение указанному субъекту эффективного количества ингибитора фосфорилазы пуриновых нуклеозидов (PNP) и(b) введение указанному субъекту эффективного количества анти-CD20 агента, специфичного к CD20(анти-CD20 агента). Согласно некоторым вариантам реализации ингибитор PNP представляет собой фородезин. Согласно определнным вариантам реализации анти-CD20 агент представляет собой ритуксимаб. Согласно некоторым вариантам реализации ингибитор PNP и анти-CD20 агент вводят одновременно, в то время как согласно другим вариантам реализации ингибитор PNP и анти-CD20 агент вводят последовательно. Согласно последнему варианту реализации анти-CD20 агент можно вводить однократно или несколько раз до введения ингибитора PNP. Далее, в данном изобретении описана фармацевтическая композиция, которая содержит ингибиторPNP и анти-CD20 агент. Также данное изобретение обеспечивает набор ("кит"), который включает ингибитор PNP и антиCD20 агент. Согласно некоторым вариантам реализации набор согласно настоящему изобретению может дополнительно включать систему доставки ингибитора PNP, анти-CD20 агента или их комбинации. Согласно другому варианту реализации набор согласно настоящему изобретению может дополнительно включать инструкции по лечению субъекта. Подробное описание одного или нескольких вариантов реализации согласно настоящему изобретению приведено ниже с сопутствующими иллюстрациями и пояснениями. Другие характеристики, цели и преимущества настоящего изобретения будут очевидны из описания, иллюстраций и формулы изобретения. Описание иллюстраций Фиг. 1A и 1B детально иллюстрируют цитотоксический эффект фородезина в клетках CLL, характеризующихся как высоким, так и низким уровнем ZAP-70. На фиг. 2 показана корреляция между повышением внутриклеточного уровня дГТФ после лечения фородезином и количеством вызванных смертей клеток. На фиг. 3 показаны значения, детально описывающие случаи клеток CLL с делецией p53, сильно реагирующих на фородезин. Фиг. 4 иллюстрирует данные по лечению фородезином для случаев CLL с низкой или отсутствующей чувствительностью к бендамустину или флударабину. Фиг. 5 А и 5 В иллюстрируют данные комбинационного индекса для комбинаций фороде-1 018415 зин/бендамустин и фородезин/флударабин. Фиг. 6 иллюстрирует данные комбинационного индекса для комбинации фородезин/ритуксимаб. Подробное описание изобретения Как описано в настоящем патенте, лечение фородезином вызывает зависимую от продолжительности и дозы клеточную гибель в клетках первичной CLL. С 2 мкМ фородезином и 20 мкМ dGuo был выявлен более чем 60%-ный цитотоксический эффект в 48% случаев и лишь в 9% случаев цитотоксичность была ниже чем 40%. Не были выявлены различия в отношении реакции на лечение для генетических аномалий, таких как делеции в 17 р 13 (ТР 53) и 11q22-q23 (ATM), генетические аномалии, возникшие при прогрессировании заболевания и связанные с устойчивостью к препарату и ухудшению выживаемости пациентов с CLL. Случаи CLL с изменениями в p53 или 11q характеризовались высокой чувствительностью к фородезину (средняя цитотоксичность 60,1% через 48 ч) с хорошим цитотоксическим эффектом,наблюдаемым у устойчивых к химиотерапии пациентов с CLL. Комбинирование фородезина с клиническими антилейкемическими режимами усилило цитотоксическую реакцию in vitro, с сильным синергетическим эффектом, проявляющимся при комбинировании фородезина и малых доз бендамустина, моноклонального анти-CD20 антитела ритуксимаба или циклофосфамида. С флударабином, напротив, наблюдали антагонистический эффект. Поэтому фородезин предоставляет новый химиотерапевтический подход, который может вызывать апоптоз клеток, у которых не действует путь АТМ/p53. Соответственно, определнные варианты реализации настоящего изобретения обеспечивают способ лечения гематологического злокачественного новообразования у субъекта, включающий стадии введения указанному субъекту эффективного количества ингибитора фосфорилазы пуриновых нуклеозидов(PNP) и введения указанному субъекту эффективного количества анти-CD20 агента. Согласно определнным вариантам реализации настоящего изобретения ингибитор PNP представляет собой фородезин. Согласно определнным вариантам реализации анти-CD20 агент представляет собой ритуксимаб. Согласно определнным вариантам реализации настоящего изобретения ингибиторPNP и анти-CD20 агент вводят одновременно, в то время как согласно другим вариантам реализации настоящего изобретения ингибитор PNP и анти-CD20 агент вводят последовательно. Согласно определнным вариантам реализации анти-CD20 агент можно вводить однократно или несколько раз до введения ингибитора PNP. Согласно определнным вариантам реализации гематологическое злокачественное новообразование представляет собой хроническую лимфоцитарную лейкемию или острую лимфобластную лейкемию. Согласно определнным вариантам реализации настоящего изобретения гематологическое злокачественное новообразование представляет собой хроническую лимфоцитарную лейкемию. Согласно определнным вариантам реализации гематологическое злокачественное новообразование представляет собой острую лимфобластную лейкемию. Согласно определнным вариантам реализации вводят эффективное количество анти-CD20 агента. Согласно определнным вариантам реализации способов согласно настоящему изобретению указанные способы включают введение субъекту эффективного количества ингибитора PNP и эффективного количества анти-CD20 агента. Согласно определнным вариантам реализации ингибитор PNP и анти-CD20 агент вводят одновременно. Согласно определнным вариантам реализации ингибитор PNP и анти-CD20 агент вводят последовательно. Согласно определнным вариантам реализации настоящего изобретения анти-CD20 агент можно вводить однократно или несколько раз до введения ингибитора PNP. Согласно определнным вариантам реализации аналог пуриновых нуклеозидов представляет собой флударабин. Определнные варианты реализации обеспечивают фармацевтические композиции, содержащие ингибитор PNP и анти-CD20 агент. Согласно определнным вариантам реализации композиция согласно настоящему изобретению содержит фородезин и ритуксимаб. Согласно определнным вариантам реализации композиция согласно настоящему изобретению содержит ингибитор PNP и анти-CD20 агент. Согласно определнным вариантам реализации указанная композиция содержит фородезин и ритуксимаб. Определнные варианты реализации обеспечивают наборы, включающие ингибитор PNP и антиCD20 агент. Согласно определнным вариантам реализации наборы дополнительно включают систему доставки ингибитора PNP, анти-CD20 агента или их комбинации. Согласно определнным вариантам реализации наборы также могут включать инструкции по лечению субъектов. Согласно определнным вариантам реализации наборы включают фородезин и ритуксимаб. В отличие от других аналогов нуклеозидов фородезин не внедряется в ДНК. Лечение фородезином приводит к увеличению уровня дГТФ в клетках CLL, притом что это увеличение связано с клеточной цитотоксичностью, что свидетельствует о том, что увеличенный уровень дГТФ, вызванный лечением фородезином, будет суррогатным маркером, показывающим цитотоксическую реакцию. Чувствительность клеток CLL к фородезину может быть обусловлена высокой активностью dCK, наблюдаемой в этих клетках, позитивно регулируемой фосфорилированием dCK в Сер-74. Выявлена значительная положительная корреляция между соотношением фосфо-dCK/dCK и индуцированным фородезином апоптозом. dCK также катализирует фосфорилирование, необходимое для активации многих противолейкемических аналогов нуклеозидов, как флударабин, гемцитабин или кладрибин. Антагонистический эффект, наблюдаемый между фородезином и флударабином, может быть объяснн понижением уровня дГТФ, отмеченным после комбинирования флударабина с фородезином. Полученные результаты свидетельствуют о том, что фосфорилирование dCK и последующее увеличение уровня дГТФ играет важную роль на начальном этапе стимулирования апоптоза фородезином в клетках CLL. Предложено несколько механизмов дГТФ-опосредованной клеточной гибели. Например, аккумулированные дезоксинуклеозиды могут быть фосфорилированы в митохондриях дезоксигуанозин киназой и тимидин киназой и вызывать аномальное накопление дНТФов, которые могут нарушать митохондриальный синтез и репарацию ДНК, приводя к повышенной чувствительности к повреждениям митохондрий,активации p53 и апоптозу. Дисбаланс митохондриального дГТФ также может влиять на митохондриальный синтез АТФ и/или инактивацию антиоксидантных ферментов электрон-транспортной цепи митохондрий, приводя к выработке активных форм кислорода (ROS). Митохондриальный геном высокочувствителен к повреждениям от окислительного стресса, которые могут сразу вызвать апоптоз. Как описано в данном изобретении, фородезин активировал митохондриальный путь апоптоза, вызванный выработкой активных форм кислорода и снижением m (митохондриального потенциала), приводящий к каспазо-зависимому и -независимому апоптозу. Активные формы кислорода генерируются при митохондриальном транспорте электронов и в условиях серьзного оксидантного стресса повышения уровня О 2-, ОН- или Н 2 О 2 вызывают снижение m и гибель клеток. Эти явления, вызванные фородезином, предотвращала предварительная инкубация клеток CLL с бренцкатехин:3,5-дисульфанатом (Tiron) и NAC,специфическими утилизаторами О 2-, что подтверждает роль окислительного стресса, предшествующего активации митохондриального пути апоптоза. Фосфорилирование и активация p53 вызываются при ответе на повреждения ДНК, а также различными стрессовыми сигналами. Перепроизводство супероксидов и вызванное им повреждение ДНК могут привести к апоптозу через активацию опосредованного активными формами кислорода митохондриального пути и активацию p53. В этом смысле, выработка активных форм кислорода, вызванная фородезином, может выступать как регулятор активации p53, действующий выше по цепи передачи сигналов. В данном изобретении описаны результаты, демонстрирующие стабилизацию p53 в случае с p53 дикого типа клеток CLL, а также тот факт, что фородезин активировал митохондриальный путь апоптоза и в случаях с мутированным p53, что указывает на то, что фородезин включает другой и/или дополнительный механизм, независимый от p53. Окислительный стресс и выработка активных форм кислорода также приводит к активации фактора транскрипции E2F-1, который регулирует как зависимый, так и независимый от p53 апоптоз через различные пути передачи сигналов. E2F-1 увеличивает фосфорилирование p53 по разным остаткам, которые также фосфорилируются в ответ на повреждение ДНК, но он также способен вызывать клеточную смерть путм активации гомолога p53 белка p73, используя p-53 независимый апоптотический путь. Как выработка активных форм кислорода может регулировать активацию E2F-1, p53 и/или p73 и клеточную смерть, изучено недостаточно. Ранним событием в митохондриальном пути апоптоза является формирование апоптосомы и активация каспазы-9, расщепляющей и активирующей каспазу-3 и каспазу-8. Фородезин вызвал зависимую от времени активацию каспазы-9 и -3, а также прокаспазы-8, одновременно с активацией каспазы-9. В свою очередь, каспаза-8 вызвает расщепление белка BID с образованием его укороченной проапоптотической формы, которая активирует митохондриальный апоптотический путь. Селективное ингибирование каспазы-8 уменьшило снижение m, вызванное фородезином, но эффект на клеточную смерть позже был ослаблен, что означало, что комплекс каспаза-8/BID включил циклическую амплификацию митохондриального апоптотического пути. Активация каспазы-9 могла быть недостаточной per se для запуска апоптоза, поэтому активация каспазы-8/BID вместе со снижением уровня ингибиторов апоптоза XIAP и сюрвивина бы увеличила активность каспазы-9 и -3, таким образом, усиливая апоптоз, вызванный фородезином. Семейство белков BCL-2 контролирует способность (готовность) клеток к апоптотической смерти. Баланс между антиапоптотическими членами, как BCL-2 и MCL-I, и проапоптотическими членами семейства BCL-2 (BAX, BAK и BH3- белки BIM, PUMA, NOXA, BAD, BID, BMF, BIK и HRK) контролирует исход многих сигнальных путей клеточной смерти. У пациентов с CLL высокий уровень BCL-2 иMCL-I связан с прогрессированием заболевания, низкой выживаемостью и невозможностью получить полноценную реакцию на лечение алкилирующими агентами, аналогами нуклеозидов и ритуксимабом. Фородезин вызвал накопление белка BIM и понижение уровня MCL-I, не вызвав изменений в уровнеBCL-2. В клетках CLL, BIM связан с MCL-I, поэтому понижение уровня MCL-I сделает клетки CLL восприимчивыми к этому BH3-белку. BIM, как и укороченный Bid, несут двойную функцию, как ингибирования антиапоптотических членов семейства BCL-2, так и прямых активаторов проапоптотических бел-3 018415BAK, что вместе с понижением уровня MCL-I приведт к тому, что оставшаяся антиапоптотическая активность BCL-2 окажется недостаточной. Приведнные в данном изобретении данные показывают, что степень снижения уровня MCL-I и повышения уровня BIM, вызванных фородезином, в значительной степени коррелировала с индукцией апоптоза, а базовые уровни MCL-I и BIM могли показать чувствительность клеток CLL к фородезину. Была продемонстрирована активация митохондриального апоптотического пути, не зависящая от статуса p53. По имеющимся сведениям, индукция p73 - транскрипционной мишени p53, может преодолеть устойчивость клеток CLL, не имеющих функциональный p53, к апоптозу. Реагируя на некоторые химиотерапевтические препараты, проапоптотическая форма p73-Tap73 трансактивирует различные гены-мишени белка p53, которые контролируют блокировку клеточного цикла и апоптоз как зависимо от статуса p53, так и независимо от него. Оказалось, что фородезин индуцировал p53 и TAp73 в клеткахCLL с функциональным p53, однако любопытно, что уровень иРНК p73 и самого белка также повысился в клетках CLL с делецией p53. Окислительный стресс и выработка активных форм кислорода вызывают активацию TAp73 и E2F1, которые участвуют в активации митохондриального апоптотического пути посредством p53-зависимого и p53-независимого механизма. Поэтому повышение уровня активных форм кислорода, вызванное фородезином, может обеспечить сигнал, активирующий E2F-1 и/или повышающим образом регулирующий TAp73. Члены семейства факторов транскрипции FOXO регулируют экспрессию многих генов, участвующих в апоптозе, и могут быть активированы усилившимся окислительным стрессом. FOXO1 и FOXO3a являются транскрипционными мишенями E2F-1, очевидно, необходимыми для вызванного активными формами кислорода апоптоза, в то же время являясь факторами транскрипции при экспрессии BIM в кроветворных клетках. Кроме того, под действием различных апоптотических стимулов утилизаторы активных форм кислорода блокируют индукцию FOXO3a и BIM. Было показано, что экспрессия как FOXO1a, так и BIM и последующий апоптоз регулируется белком p73 к опухолевых клетках с дефектным p53. После лечения фородезином выявлена повышающая регуляция белка и иРНК белков p73 и BIM, независимая от статуса p53, а также на ранних этапах было выявлено повышение уровня FOXO1 и FOXO3a. Экспрессия регулируемых FOXO генов-мишеней может находиться под контролем любого члена семейства FOXO, что подразумевает избыточный (дублирующий) механизм действия, как показано регуляцией транскрипции BIM, осуществляемой как FOXO1 А, так иFOXO3A. Таким образом, результаты, описанные в данном изобретении, обеспечивают доказательство существования механизма, участвующего в вызванной фородезином смерти клеток CLL, независимого от статуса p53, что свидетельствует о возможности сосуществования различных путей программируемой клеточной смерти в одной клетке, которые могут быть селективно запущены различными стимулами. Эти результаты показывают, что фородезин как одиночный агент, так и в комбинации с бендамустином или ритуксимабом является высокоэффективным при лечении CLL. Поэтому фородезин, доступный, например, в оральной или внутривенной форме с профилем низкой токсичности, является одной из возможностей для лечения пациентов с плохим прогнозом (например, 17p-), пациентов с рефракторным заболеванием и/или опцией лечения пожилых пациентов. Инициирована фаза 1 мультицентрального клинического курса фородезина пациентов CLL в стадии рецидива без контроля плацебо. А. Способы лечения гематологических злокачественных новообразований. В настоящем изобретении обеспечены способы лечения гематологических злокачественных новообразований, например злокачественных новообразований крови у субъектов. К примерам этого типа новообразований относятся, например, острая миелоидная лейкемия, хроническая миелоидная лейкемия,острая лимфобластная лейкемия (ALL), хроническая лимфоцитарная лейкемия (CLL), миелопролиферативные заболевания, множественная миелома, миелодиспластический синдром, лимфома Ходжкина, неходжкинская лимфома (злокачественная лимфома) и макроглобулинемия Вальденстрема. Согласно некоторым вариантам реализации гематологической злокачественной опухолью является CLL. Согласно другим вариантам реализации гематологической злокачественной опухолью является ALL. Субъект может представлять собой млекопитающее или отличное от млекопитающего животное. Млекопитающим может являться, к примеру, человек; другие приматы, например высшие и низшие обезьяны; крупный рогатый скот; лошади; овцы; крысы; мыши; свиньи и козы. Отличные от млекопитающих виды могут включать в себя, к примеру, рыб и птиц. Согласно одному из вариантов реализации способ согласно настоящему изобретению включает в себя введение субъекту ингибитора фосфорилазы пуриновых нуклеозидов (PNP) и алкилирующего агента или анти-CD20 агента. Согласно определнным вариантам реализации вводят ингибитор PNP и алкилирующий агент. Согласно другому варианту реализации вводят ингибитор PNP и анти-CD20 агент. Согласно другому варианту реализации ингибитор PNP вводят после выявления устойчивости субъекта к одному или нескольким химиотерапевтическим агентам (например, бендамустину или флуарабину). Согласно следующему варианту реализации ингибитор PNP вводят после выявления у субъекта делецииp53. Без какого-либо ограничения теорией ингибитор PNP может вызывать повышение уровня плазменного 2'-дезоксигуанозина (dGuo) и накапливание внутриклеточного дезоксигуанозин трифосфата (дГТФ),-4 018415 что приводит к гибели клетки. Не ограничивающие каким-либо образом примеры ингибиторов PNP могут включать в себя упомянутые в патентах США 4985433; 4985434, 5008265; 5008270; 5565463 и 5721240, принадлежащих BioCryst Pharmaceuticals, Inc., содержание которых включено в настоящее изобретение посредством ссылки. Согласно определнным вариантам реализации ингибитором PNP является фородезин или его соль, включая соль хлороводородной кислоты Не ограничиваясь как-либо теорией, термин алкилирующий агент относится к химиотерапевтическому соединению, которое химически модифицирует ДНК и нарушает е функцию. Некоторые алкилирующие агенты вызывают образование сшивок между нуклеотидами одной и той же цепи либо комплементарных цепей двухцепочечной молекулы ДНК, в то время как другие вызывают ошибочное спаривание оснований между цепями ДНК. Алкилирующий агент может быть производным иприта, производным нитрозомочевины, соединением платины, либо соединением имидазол-карбоксамида. Примеры алкилирующих агентов включают в себя бендамустин, бусульфан, карбоплатин, кармустин, цисплатин,хлорамбуцил, циклофосфамид, дакарбазин, гексаметилмеламин, ифосфамид, ломустин, мехлорэтамин,мефалан, митотан, митомицин, пипоброман, прокарбазин, стрептозацин, тиотепа и триэтиленмеламин. В некоторых случаях алкилирующим агентом может быть бендамустин либо его соль, включая соль хлороводородной кислоты Анти-CD20 агентом может быть любой агент, мишенью которого (например, для селективного присоединения) является белок CD20 на поверхности В-клеток. Согласно некоторым вариантам реализации анти-CD20 агент представляет собой антитело, специфичное к CD20. Не ограничиваясь как-либо теорией, считается, что такие агенты могут действовать через один из трх механизмов: (1) комплементопосредованную цитотоксичность; (2) антитело-зависимую клеточно-опосредованную цитотоксичность и (3) индукцию апоптоза. Примеры анти-CD20 агентов включают в себя ритуксимаб, ибритумомаб, трастузумаб, гемтузумаб и алемтузумаб. Согласно некоторым вариантам реализации анти-CD20 агент представляет собой ритуксимаб. Ингибитор PNP, алкилирующий агент и/или анти-CD20 агент можно вводить любым путм, например интраоперативно, интратекально, интрадискально, перидискально, эпидурально (включая перирадикулярное и трансфораминальное введение), любой комбинацией интрадискального, эпидурального, перидурального, периспинального, внутривенного, внутримышечного, подкожного, орального, интраназального, ингаляционного, трансдермального и парентерального способов введения. Ингибитор PNP, алкилирующий агент и/или анти-CD20 агент могут находиться в рецептуре с фармацевтически приемлемым носителем, выбранным с учтом желаемого пути введения и стандартной фармацевтической практикой. Ингибитор PNP, алкилирующий агент и/или анти-CD20 агент могут быть сформулированы в дозированные формы, в соответствии со стандартной практикой в области приготовления фармацевтических препаратов. См. Alphonso Gennaro, Ed., Remington's Pharmaceutical Sciences,18th Edition (1990), Mack Publishing Co., Easton, PA. Приемлемые дозированные формы могут включать в себя, например, таблетки, капсулы, растворы, парентеральные растворы, пастилки, свечи или суспензии. Для парентерального введения ингибитор PNP, алкилирующий агент и/или анти-CD20 агент можно смешивать с приемлемым носителем или растворителем, таким как вода, масло (в частности, растительного происхождения), этанол, солевой раствор, водный раствор декстрозы (глюкозы) и родственные растворы сахаров, глицерин или гликоль, как пропиленгликоль или полиэтиленгликоль. Растворы для парентерального введения предпочитаемо содержат растворимую в воде соль ингибитора PNP, алкилирующего агента и/или анти-CD20 агента. Также могут быть добавлены стабилизирующие агенты, антиоксидантные агенты и консерванты. К приемлемым антиоксидантным агентам относятся сульфиты, аскорбиновая кислота, лимонная кислота и е соли, а также натриевая соль этилендиаминтетрауксусной кислоты (EDTA). К приемлемым консервантам относятся хлорид бензалкония, метил- или пропилпарабен и хлорбутанол. Композиция для парентерального введения может быть в форме водного или неводного раствора, дисперсии, суспензии или эмульсии. Для орального введения ингибитор PNP, алкилирующий агент и/или анти-CD20 агент могут быть получены в виде комбинации с одним или несколькими тврдыми неактивными ингредиентами для приготовления таблеток, капсул, пилюль, порошков, гранул или других приемлемых оральных форм. Например, ингибитор PNP, алкилирующий агент и/или анти-CD20 агент могут быть получены в виде комбинации по меньшей мере с одним вспомогательным веществом, таким как наполнитель, связующее вещество, смачивающее вещество (гумектант), дезинтегрирующий агент, замедлитель растворения, ускоритель абсорбции, абсорбент увлажняющего агента или лубрикант. Специфическая доза ингибитора PNP, алкилирующего агента и/или анти-CD20 агента, естественно,определяется конкретными условиями для каждого отдельного пациента, включая телосложение, массу,возраст и пол пациента, природу и стадию лечимого заболевания, агрессивность вызванных заболеванием нарушений и путь введения вещества. Дозировка и режим применения препаратов, например фородезина, бендамустина и ритуксимаба, могут быть установлены по отдельности, либо в комбинации, в соответствии, например, с дозировкой и режимом, указанными в одобренных Управлением по лекарственным средствам и пищевым продуктам США (FDA) рекомендациях. Согласно некоторым вариантам реализации настоящего изобретения ингибитор PNP и алкилирующий агент или анти-CD20 агент вводят одновременно, в то время как согласно другим вариантам реализации ингибитор PNP и алкилирующий агент или анти-CD20 агент вводят последовательно. Согласно одному из вариантов реализации алкилирующий агент или анти-CD20 агент можно вводить однократно или несколько раз до введения ингибитора PNP (например, 2 раза, 3 раза, 4 раза, 5 раз, 10 раз или 20 раз). Согласно дополнительным вариантам реализации ингибитор PNP можно вводить один или несколько раз до введения алкилирующего агента или анти-CD20 агента (например, 2 раза, 3 раза, 4 раза, 5 раз, 10 раз или 20 раз). Согласно некоторым вариантам реализации настоящего изобретения лечение гематологической злокачественной опухоли субъекта может включать в себя выявления субъекта, устойчивого к одному или нескольким химиотерапевтическим агентам. Одной из главных причин неудачного лечения злокачественных новообразований является выработка устойчивости к препаратам опухолевыми клетками. Это весьма серьзная проблема, которая может привести к рецидиву заболевания или даже смерти. Согласно одному из вариантов реализации устойчивого к одному или нескольким химиотерапевтическим агентам субъекта можно выявить способами, известными в данной области знаний. Субъект может быть устойчивым ко всем известным химиотерапевтическим агентам. Согласно определнным вариантам реализации субъект может быть устойчивым к алкилирующему агенту (например, бендамустину) и/или аналогу пуриновых нуклеозидов (например, флударабину). После выявления устойчивого к химиотерапии субъекта ему может быть введн ингибитор PNP. Согласно некоторым вариантам реализации ингибитором PNP является фородезин-HCl. Согласно другому варианту реализации лечение гематологического злокачественного новообразования может включать в себя выявление наличия делеции p53, например делеции 17p в одной или нескольких клетках образца, полученного от субъекта. Делеция 17p является маркером, который может помочь выявить субъекта с гематологической злокачественной опухолью, характеризующегося необычными биологическими и клиническими проявлениями. К примеру, изменения p53 могут свидетельствовать об устойчивости к препаратам и пониженной выживаемости. Согласно одному из вариантов реализации настоящего изобретения субъекту с делецией p53 можно ввести ингибитор PNP. Согласно предпочтительным вариантам реализации ингибитором PNP является фородезин-HCl. Способы лечения, описанные выше, включают в себя как монотерапию, так и комбинированную терапию. В контексте комбинированной терапии данное описание подразумевает введение двух и более химиотерапевтических агентов, в частности ингибитора PNP и алкилирующего агента, либо ингибитора PNP и анти-CD20 агента. Некоторые из данных соединений уже одобрены к применению для лечения одного или нескольких признаков злокачественных новообразований. Остальные находятся на различных стадиях преклинических и клинических разработок. Согласно некоторым вариантам реализации введение ингибитора PNP и алкилирующего агента или анти-CD20 агента может привести к синергетическому эффекту. Данный эффект может быть продемонстрирован путм определения комбинационного индекса (CI). Согласно определнным вариантам реализации индекс может быть вычислен как функция фракции клеток, подвергшихся воздействию в соответствии с процедурой Chou et al., Advance Enz. Regul., 22, 27-55 (1985). Это хорошо известный тест, оценивающий взаимодействия коэффициентов и спектра пропорций клеточных смертей. Например, если лечение препаратом А приводит к 30%-ной клеточной гибели, а лечение препаратом В приводит к 50%-ной клеточной гибели, ожидается, что комбинирование этих двух препаратов приведт к 65%-ной клеточной гибели. Соответственно, если отношение значения предсказанной клеточной смерти к значению фактической клеточной смерти при комбинировании препаратов меньше единицы, можно говорить о наличии синергетического эффекта. Напротив, если это значение больше единицы, имеет место антагонистический эффект. Согласно одному из вариантов реализации комбинирование фородезина и бендамустина характеризуется синергетическим эффектом, в то время как комбинирование фородезина и флударабина характеризуется антагонистическим эффектом (см. пример 5). В. Фармацевтические композиции. В настоящем патенте описаны фармацевтические композиции, которые содержат ингибитор PNP и алкилирующий агент или ингибитор PNP и анти-CD20 агент. Согласно некоторым вариантам реализации настоящего изобретения ингибитор PNP может включать в себя фородезин (ВСХ-1777). Согласно определнным вариантам реализации алкилирующий агент может включать в себя бендамустин. Согласно другим вариантам реализации анти-CD20 агентом является ритуксимаб. Фармацевтические композиции, описанные в данном изобретении, содержат ингибитор PNP и алкилирующий агент или ингибитор PNP и анти-CD20 агент в количествах, применимых для лечения гематологических злокачественных новообразований, и приемлемый носитель. Фармацевтические носители,применимые для введения соединений, описанных в данном изобретении, включают в себя любые такие носители, известные специалистам в данной области знаний, пригодные для определнных способов введения. Согласно одному из вариантов реализации настоящего изобретения композиции могут быть сформулированы в применимые фармацевтические препараты, как растворы, суспензии, таблетки, диспергируемые таблетки, пилюли, капсулы, порошки, формы с замедленным высвобождением или эликсиры,для орального применения, либо в форме стерильных растворов или суспензий для парентерального введения, а также трансдермальные пластыри и ингаляционные сухие порошки (см., например, Ansel Introduction to Pharmaceutical Dosage Forms, Fourth Edition 1985, 126). Концентрация ингибитора PNP и алкилирующего агента или ингибитора PNP и анти-CD20 агента в фармацевтических композициях зависит от скорости всасывания, инактивации и выведения соединений,физико-химических характеристик соединений, режима дозировки и вводимого количества, наряду с другими факторами, известными специалистам в данной области знаний. Например, вводимое количество является достаточным для лечения хронической лимфоцитарной лейкемии, как описано в данном изобретении. Фармацевтическая композиция может быть введена за один раз, либо может быть разделена на несколько меньших доз, вводимых через временные интервалы. Очевидно, что точная доза и продолжительность лечения являются функциями заболевания, которое лечат, и могут быть определены эмпирически с применением известных тестовых протоколов, либо экстраполяцией данных тестов in vivo или invitro. Необходимо помнить, что концентрации и величина доз могут также варьировать в зависимости от серьзности состояния, которое подвергают лечению. Кроме того, необходимо понимать, что для каждого отдельного субъекта нужно устанавливать специфические режимы дозировки в соответствии с его индивидуальными потребностями и на основании профессиональных решений лица, проводящего лечение или руководящего процессом введения композиций, и что приведнные ниже в данном изобретении диапазоны концентраций являются исключительно иллюстративными и не ограничивают спектр применения описанных композиций каким-либо образом. Фармацевтические композиции обеспечиваются для введения людям и животным в стандартных лекарственных формах, как таблетки, капсулы, пилюли, порошки, гранулы, стерильные парентеральные растворы или суспензии и водно-масляные эмульсии, содержащие приемлемое количество соединений,либо их фармацевтически применимых производных. Фармацевтически терапевтически активные вещества и их производные согласно одному из вариантов реализации настоящего изобретения формулируют и вводят в лекарственных формах единичного дозирования или в лекарственных формах, содержащих множественные дозы. Лекарственные формы единичного дозирования согласно настоящему изобретению относятся к физически отдельным единицам дозы, подходящим для людей и животных и упакованным отдельно, как известно в данной области знаний. Каждая единичная доза содержит заранее определнное количество терапевтически активного вещества, достаточное для того, чтобы вызвать желаемый терапевтический эффект, в совокупности с необходимым фармацевтическим носителем, средством доставки или растворителем. Примеры лекарственных форм единичного дозирования включают в себя ампулы, шприцы-тюбики, а также отдельно упакованные таблетки или капсулы. Лекарственные формы единичного дозирования можно вводить по фракциям либо по несколько штук. Лекарственная форма,содержащая множественные дозы, - это множество идентичных лекарственных форм единичного дозирования, помещнных в контейнер для введения отдельными стандартными дозами. К примерам составных лекарственных форм относятся пузырьки, баночки таблеток или капсул, либо бутылки большого объма. Таким образом, лекарственная форма, содержащая множественные дозы, является множеством лекарственных форм единичного дозирования, не изолированных друг от друга при упаковке. Жидкие фармацевтические вводимые композиции могут, например, быть приготовлены растворением, диспергированием или каким-либо другим методом смешивания активного вещества, как определено выше, и произвольного фармацевтического адъюванта в носителе, таком как, например, вода, солевой раствор, водный раствор декстрозы, глицерин, этанол и т.п., таким образом, получая раствор или суспензию. При желании, вводимая фармацевтическая композиция может дополнительно содержать незначительные количества нетоксичных вспомогательных веществ, таких как увлажняющие вещества,эмульгаторы, растворяющие агенты, буферные агенты и т.п., например, ацетат, цитрат натрия, производные циклодекстрина, монолаурата сорбитан, ацетат триэтаноламина натрия, олеат триэтаноламина и другие подобные агенты. Фактические способы получения таких лекарственных форм известны либо будут очевидными для специалистов в данной области знаний, например, см. Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., 15th Edition, 1975. Могут быть получены лекарственные формы композиций, содержащих ингибитор PNP и алкилирующий агент либо ингибитор PNP и анти-CD20 агент в интервале от 0,005 до 100%, сбалансированные с нетоксичным носителем. Способы получения таких композиций известны специалистам в данной области знаний. Предполагаемые композиции могут содержать 0,001-100% активного ингредиента, согласно одному из вариантов реализации - 0,1-95%, согласно другому варианту реализации - 75-85%.C. Наборы. Также в настоящем патенте описаны наборы. Как правило, набор включает в себя ингибитор PNP и алкилирующий агент либо ингибитор PNP и анти-CD20 агент. Согласно определнным вариантам реализации набор может включать в себя одну или несколько систем доставки, например, для ингибитораPNP, для алкилирующего агента, для анти-CD20 либо для любой их комбинации, а также инструкцию по применению набора (например, инструкции по лечению субъекта). Согласно определнным вариантам реализации набор может включать в себя ингибитор PNP и/или алкилирующий агент. Согласно другому варианту реализации набор может включать в себя ингибитор PNP и/или анти-CD20 агент. Согласно некоторым вариантам реализации набор может включать в себя ингибитор PNP и этикетку, указывающую,что содержимое вводится субъекту, устойчивому к алкилирующим агентам, как бендамустин. Согласно другому варианту реализации набор может включать в себя ингибитор PNP и этикетку, указывающую,что содержимое вводится субъекту с делецией p53 (например, делецией 17p). Согласно следующему варианту реализации набор может включать в себя ингибитор PNP и этикетку, указывающую, что содержимое вводится с алкилирующим агентом или анти-CD20 агентом.D. Определения. В настоящем патенте формы, использованные в единственном числе, относятся к множественным формам, если контекст ясно не подразумевает противное. Выражение "эффективное количество", применяемое в описании количества вещества в способе, относится к количеству вещества, позволяющему достигнуть желаемый фармакологический эффект либо иной эффект, например к количеству, ингибирующему аномальный рост или пролиферацию, либо вызывает апоптоз опухолевых клеток, что приводит к полезному эффекту. Термины "лечение" и "излечение" означают оказание терапевтически благотворного эффекта, как облегчение имеющихся симптомов, предотвращение возникновения новых симптомов,облегчение или предотвращение метаболических причин, вызвавших и лежащих в основе симптомов,отсрочивание либо предотвращение дальнейшего развития нарушения и/или уменьшение тяжести симптомов, которые возникнут или могут возникнуть. Примеры Пример 1. Цитотоксичность фородезина в CLL - ZAP-70 высок. в сравнении с ZAP-70 низк. Клетки от 16 пациентов с CLL с высоким уровнем ZAP-70 (20%) и от 13 пациентов CLL с низким уровнем ZAP-70 (20%) обрабатывали 2 мкМ фородезином + 20 мкМ dGuo в течение 48 ч. Цитотоксичность оценили с помощью окрашивания AnnexinV-FITC (ФИТЦ, флуоресцеин изотиоцианат) (выражена в виде процента от контрольных, необработанных клеток). Результаты показали, что средняя цитотоксичность как для высокого, так и для низкого уровня ZAP-70 превысила 50% (см. фиг. 1A и 1B). Пример 2. Повышение уровня внутриклеточного дГТФ. Клетки от 26 пациентов с CLL обрабатывали фородезином в течение 20 ч. Совокупные нуклеотиды подвергли экстракции (60% метанол), после чего уровень дГТФ количественно оценили с помощью теста с ДНК-полимеразой. Жизнеспособность клеток по сравнению с контрольным образцом (необработанными клетками) оценили через 48 ч окрашиванием AnnexinV-FITC. Повышение уровня внутриклеточного дГТФ после обработки фородезином хорошо коррелирует с вызванной клеточной смертью (см. фиг. 2). Пример 3. Реакция клеток CLL с делецией p53 на фородезин. Клетки от 11 пациентов с CLL с делецией 17p (g=85% клеток, флуоресцентная гибридизация insitu, FISH) обрабатывали 2 мкМ фородезином + 20 мкМ dGuo, 25 мкМ бендамустином или 1 мкг/мл флударабином в течение 48 ч. Результаты показали, что клетки CLL с делецией p53 обладают высокой чувствительностью к фородезину (см. фиг. 3). Пример 4. Эффект фородезина в случаях CLL с химиотерапевтической устойчивостью. Клетки от пациентов с CLL, характеризовавшиеся низкой чувствительностью к бендамустину или флударабину, либо характеризовавшиеся отсутствием чувствительности, обработали 2 мкМ фородезином и 10-20 мкМ dGuo. Результаты показали, что эти клетки хорошо реагируют на лечение фородезином(см. фиг. 4). Пример 5. Эффект от комбинаций фородезин/бендамустин и фородезин/флударабин. Клетки от пациентов с CLL обрабатывали 2 мкМ фородезином + 10-20 мкМ dGuo и 10-25 мкМ бендамустином или 3,75-7,5 мкМ флударабином в течение 48 ч. Затем, оценили комбинационный индекс(CI). Значение индекса ниже единицы говорит о синергичном эффекте (алгоритм Chour и Talalay), в то время как превышающее единицу значение индекса свидетельствует об антагонистическом эффекте. Результаты показали, что комбинация фородезин/бендамустин характеризуется синергетическим эффек-8 018415 том, а комбинация фородезин/флударабин характеризуется антагонистическим эффектом (см. фиг. 5 А и 5 В). Пример 6. Эффект от комбинации фородезин/ритуксимаб. Клетки от 7 пациентов с CLL (3 с высоким уровнем ZAP-70 (35%) и 4 с делецией p53) обрабатывали 2 мкМ фородезин-HCl + 10-20 мкМ dGuo и 25-50 мкМ ритуксимабом в течение 24-48 ч. Через 48 ч оценили комбинационный индекс (CI). Клетки исследовали способом поточной цитометрии с окрашиванием AnnexinV-FITC и тестом проницаемости PI. Значение индекса ниже единицы говорит о синергетическом эффекте (алгоритм Chou и Talalay), в то время как превышающее единицу значение индекса свидетельствует об антагонистическом эффекте. Результаты показали, что комбинация фородезин/ритуксимаб характеризуется синергетическим эффектом (см. фиг. 6). Пример 7. Фородезин вызывает p53-независимый митохондриальный апоптоз. Как описано в настоящем патенте, ингибитор фосфорилазы пуриновых нуклеозидов фородезин вызывает p53-независимый митохондриальный апоптоз в клетках хронической лимфоцитарной лейкемии путм отрицательной регуляции Mcl-I, а также индукции p73 и BIM. Хроническая лимфоцитарная лейкемия (CLL) - это клиническое гетерогенное образование, происходящее от моноклональной экспансии долгоживущих CD5+ В-лимфоцитов с аномальной регуляцией апоптоза и низкой скоростью пролиферации. Несмотря на недавние достижения, новые способы леченияCLL в целом не улучшили выживаемость пациентов, и многие из последних, в конце концов, выработали устойчивость к препаратам. Немутированный профиль генов иммуноглобулина, высокий уровень экспрессии белка ZAP-70 и высокий уровень экпрессии CD38, а также наличие определнных цитогенных аномалий (особенно делеции 17p13 (ТР 53) и 11q22-q23 (ATM связаны с худшей общей выживаемостью и быстрым прогрессированием заболевания у пациентов с CLL. Химиотерапевтические противоопухолевые препараты вызывают апоптоз, как правило, либо в виде реакции на повреждение ДНК и последующей активации p53 и/или напрямую в результате расстройства митохондриальной функции. Путь ответа на повреждение ДНК, по-видимому, играет ключевую роль в вызываемом препаратом апоптозе клетокCLL, в то время как клетки пациентов с CLL с аномалиями ТР 53 обладают устойчивостью к традиционной химиотерапии и характеризуются коротким сроком выживания. Потеря функции p53 в результате делеции и мутация оставшегося аллеля увеличивают устойчивость пациента с CLL к химиотерапии, нанося своего рода "двойной удар" во время приобретения устойчивости за счт выключения транскрипционной и митохондриальной апоптотической активности p53. Поэтому новые эффективные способы должны вызывать апоптоз с помощью независимых от повреждения ДНК путей и/или прямой активации апоптотических путей, независимых от p53. Отличительной чертой клеток CLL является их устойчивость к индукции апоптоза, причм белки семейства Bcl-2 являются критическими регуляторами апоптоза и выживания клеток CLL. Высокий уровень антиапоптотических белков Bcl-2 Mcl-I связан с агрессивностью заболевания и устойчивости к химиотерапии при CLL. MCL-I также играет важную роль в продлении выживания клеток CLL, так как уровень MCL-I обратно коррелирует с in vitro и клинической реакцией на многие препараты. Фосфорилаза пуриновых нуклеозидов (PNP) - это фермент пути реутилизации пуринов, фосфорилирующий аналоги пуринов с формированием соответствующих оснований и фосфата дезоксирибозы. Фородезин, или иммуциллин Н (ВСХ-1777), является эффективным аналоговым ингибитором переходного состояния PNP, подавляющим пролиферацию Т-клеток in vitro и in vivo (Bantia et al., Int Immunopharmacol, 1(6), 1199-210 (2001); Kicska et al., PNAS, 98(8), 4593-4598 (2001); Bantia et al., Int Immunopharmacol, 3(6), 879-887 (2003); Gandhi et al., Semin Oncol, 34(6 Suppl 5), S8-12 (2007. Фородезин характеризуется низкотоксичным профилем (Gandhi et al., Blood, 106(13), 4253-4260 (2005); Korycka et al., Minivivo цитотоксический эффект на клетки CLL (Balakrishnan et al., Blood, 108(7), 2392-2398 (2006. Ингибирование PNP приводит к повышению уровня плазменного 2'-дезоксигуанозина (dGuo) и последующему накоплению внутриклеточного дезоксигуанозин трифосфата (дГТФ) в клетках с высоким уровнем активности дезоксинуклеозид киназы, что вызывает индукцию апоптоза в Т-лимфоцитах. Клетки CLL обладают высокой (dCK) активностью, притом что dCK является основным ферментом при преобразовании dGuo в дГМФ, который затем фосфорилируется до дГТФ, делая клетки CLL восприимчивыми к ингибированию PNP. В отличие от других аналогов пуриновых нуклеозидов, как флударабин или бендамустин, фородезин не внедряется в ДНК и представляет собой новый класс селективных противоопухолевых агентов с ранее неизвестным и не изученным до конца механизмом действия. Как описано в настоящем патенте, произвели оценку цитотоксического эффекта фородезина в первичных лейкемических клетках, взятых от 43 пациентов с CLL, а также цитотоксического эффекта in vitro комбинации фородезина с препаратами, применяемыми в клинической практике, такими как флударабин, бендамустин и ритуксимаб. Основываясь на полученных результатах, можно заключить, что фородезин является весьма эффективным терапевтическим средством при лечении пациентов с CLL вне зависимости от их статусаZAP-70, CD38 и p53, либо цитогенетических аномалий. Более того, фородезин вызывает активацию ми-9 018415 тохондриального апоптотического пути, понижая уровень белка Mcl-I и индуцируя p73 и проапоптотический белок BIM. Любопытно, что не обнаружено значительной разницы в уровне этих апоптотических маркеров, зависимой от статуса p53, что дат основания предположить существование общего апоптотического пути независимого от p53-опосредованной клеточной смерти. Апоптоз, вызываемый фородезином в первичных клетках, взятых от пациентов с CLL, вне зависимости от статуса ZAP-70, CD38 и цитогенетического статуса. Для оценки цитотоксичности фородезина in vitro в первичных лейкемических лимфоцитах пациентов с CLL провели исследование с повышением дозы. Для цитотоксического эффекта получения in vitro вместе с фородезином добавили внешний источник dGuo. Инкубация клеток CLL с фармакологически доступным уровнем фородезина (2-5-10 мкМ) и повышаемыми дозами dGuo (10-20 или 30 мкМ) в течение 48 ч вызвала гибель клеток (под контролем AnnexinV+окрашивающего вещества), в то время как фородезин или dGuo поодиночке не проявили цитотоксический эффект. Повышение дозы фородезина(даже до 15 мкМ) не вызвало изменений интенсивности гибели клеток. В свою очередь, повышение дозыdGuo привело к более выраженной индукции клеточной смерти, поэтому последующие исследования проводились с применением неизменной дозы фородезина (2 мкМ) вместе с 10 или 20 мкМ dGuo. Затем, оценили цитотоксический эффект фородезина и dGuo в первичных лейкемических клетках,взятых от 43 пациентов с CLL. Относительно контроля определили среднюю цитотоксичность, равную 44,2%11,4 и 57,4%13,1 через 24 и 48 ч соответственно. В 21 случае цитотоксический эффект превысил 60% (48,8% от общего количества образцов), 40-60% в 18 случаях (41,8% от общего количества образцов) и ниже 40% всего в 4 случаях (9,4% от общего количества образцов). Не обнаружено разницы в случае с криопрезервированными первичными образцами CLL (n=32, 58,3%11 через 48 ч) и свежими образцами CLL (n=10, 56,6%6,4 через 48 ч). Цитотоксичность 2 мкМ фородезина и dGuo (10-20 мкМ) в мононуклеарных клетках периферической крови (РВМС), взятых от здоровых доноров, была относительно ниже по сравнению с цитотоксичностью в клетках CLL как в Т-лимфоцитах (CD3+ клетках), так и в В-лимфоцитах (CD19+ клетках). У пациентов с CLL уровень экспрессии белка ZAP-70 и/или CD38 связан с худшей общей выживаемостью и более кратким временем, необходимым для прогрессирования заболевания (Hus et al., AnnOncol, 17(4), 683-690 (2006. He обнаружено существенной разницы между вызванной фородезином гибелью клеток в случае CLL с низким уровнем ZAP-70 (17 пациентов с CLL; 58,1%11 средней цитотоксичности относительно контроля) и CLL с высоким уровнем ZAP-70 (22 пациентов с CLL; 57,9%12 средней цитотоксичности относительно контроля), ту же ситуацию наблюдали в отношении уровня экспрессии CD38 (низкий CD38 52,3%12 и высокий CD38 62,1%12 средней цитотоксичности относительно контроля). Более того, наиболее часто встречающиеся цитогенетические нарушения клеток CLL, как делеции 13q, 11q и 17p, связанные с устойчивостью к препаратам in vitro и in vivo, а также короткой продолжительностью жизни пациентов с CLL, не коррелировали с вызванной фородезином цитотоксичностью, поскольку хорошую реакцию на препарат наблюдали и в этих случаях. Также сравнили цитотоксическую реакцию клеток CLL, обработанных фородезином, с реакцией клеток, обработанных флударабином или бендамустином - двух основных химиотерапевтических агентов, применяемых при CLL (Aivado et al., Semin Oncol, 29, (4 Suppl 13), 19-22 (2002); and Montserrat, Hematol J., 5, Suppl 1, S2-S9 (2004. Первичные клетки CLL от 32 пациентов, 11 из которых несли делецииp53, 48 ч инкубировали с 2 мкМ фородезином и 20 мкМ dGuo, 10-25 мкМ бендамустином и 1 мкг/мл флударабином поодиночке или в комбинации. При отдельном применении препаратов средняя цитотоксичность в клетках CLL без делеции 17p составила 55,38, 50,611 и 49,218 для фородезина, флударабина и бендамустина соответственно. Делеция 17p, приводящая к альтерации p53, связана с in vitro и invivo устойчивости к флударабину у пациентов с CLL (Dohner et al., Blood, 85(6), 1580-1589 (1995); и Turgut et al., Leuk Lymphoma, 48(2), 311-320 (2007. Примечательно, что большая часть пациентов с CLL с делецией 17p характеризовалась высокой чувствительностью к фородезину, со средней цитотоксичностью через 48 ч, равной 60,1%21 (2 мкМ фородезин и 20 мкМ dGuo). Напротив, чувствительность к флударабину и бендамустину в этих случаях была существенно ниже (средняя цитотоксичность 25,113) и (средняя цитотоксичность 36,2%17) соответственно. Более того, в 12 из 32 образцов, взятых от пациентов с CLL, in vitro цитотоксическая реакция на 25 мкМ бендамустин и/или 1 мкг/мл флударабин не проявилась, либо была низкой (ниже 35% относительно контроля), в то время как клетки этих образцов показали высокую чувствительность к фородезину. Три случая с делецией 17p и отсутствием либо очень низкой чувствительностью к бендамустину или флударабину оказались высокочувствительными к фородезину (средняя цитотоксичность 67%+20), и лишь 2 пациента с CLL показали слабую реакцию на фородезин. Комбинации фородезина с флударабином, бендамустином и ритуксимабом. Провели оценку лечебного эффекта комбинации флударабина с фородезином. Также оценили комбинацию фородезин с бендамустином - алкилирующим агентом и также пуриновым аналогом. Комбинации 2 мкМ фородезина и dGuo (10-20 мкМ) с флударабином (0,5-1 мкг/мл) не усилили цитотоксический эффект по сравнению с таковым, проявляемым отдельными препаратами, напротив, наблюдался нега- 10018415 тивный эффект на индукцию клеточной гибели. Для оценки комбинационного эффекта этих двух препаратов с помощью алгоритма Chou и Talalay (Chou et al., Adv Enzyme Regul, 22, 27-55 (1984 в качестве маркера антагонистического или синергичного эффекта вычислили комбинационный индекс (CI). Вкратце, значение CI выше 1 является показателем антагонистического эффекта, а значение CI ниже 1 говорит о синергетическом эффекте. Комбинационные исследования, проведнные с флударабином и фородезином, дали значения CI, превышающие 1, во всех исследованных образцах CLL (48 ч), свидетельствуя об антагонистическом эффекте, проявляемом этими препаратами. Средняя цитотоксичность, вызванная комбинацией фородезина и флударабина, оказалась ниже таковой каждого отдельного препарата. Фородезин был эффективным также в отношении CLL с низкой чувствительностью к бендамустину, но, в отличие от флударабина, в случае с комбинацией бендамустина и фородезина наблюдали сильное повышение уровня клеточной гибели и сильный синергичный эффект (CI1). Очевидно, что фородезин усиливает цитотоксический эффект малых доз бендамустина (10 мкМ, средняя цитотоксичность 32,95%), достигая средней цитотоксичности комбинации этих препаратов, равной 70,5%. Также оценили комбинацию фородезина и ритуксимаба, гуманизированного моноклонального антитела, специфичного к CD20. Через 24 ч уровень клеточной гибели при лечении только ритуксимабом(25-50 мкг/мл) был низким, а комбинирование с фородезином явно усилило цитотоксический эффект обоих препаратов. Ритуксимаб и фородезин показали выраженный синергичный эффект со значением CI,близким 0,5. Взаимосвязь между повышением уровня внутриклеточного дГТФ и фосфорилированием dCK по Сер-74 с вызванной фородезином смертью клеток. Произвели оценку уровня внутриклеточного дГТФ в первичных клетках, взятых от 26 пациентов сCLL, которым ввели 2 мкМ фородезина и 10 мкМ dGuo. Обнаружили значительную прямую корреляцию(р 0,05) между кратным увеличением уровня дГТФ, обнаруженным через 18 ч, и вызванной фородезином цитотоксичностью, выявленной через 48 ч. Фородезин вызвал резкое повышение уровня внутриклеточного дГТФ (увеличение почти в 96 раз по сравнению с контрольным базовым уровнем, достигая значений 6-129 пмоль дГТФ/106 миллионов клеток). В четырх случаях повышения уровня дГТФ обнаружено не было либо оно было незначительным, в этих случаях цитотоксическая реакция на фородезин была незначительной. Чтобы подтвердить,что повышение уровня дГТФ после обработки фородезином было вызвано фосфорилированием dGuo ферментом dCK, исследовали индукцию клеточной гибели в присутствии дезоксицитидина. Будучи основным субстратом dCK, дезоксицитидин должен ингибировать фосфорилирование dGuo белком dCK,подавляя повышения уровня внутриклеточного дГТФ и последующий вызванный фородезином апоптоз. Преинкубация клеток с дезоксицитидином (5-10 мкМ) ингибировала вызываемую фородезином смерть клеток. Некоторые аналоги нуклеозидов, применяемые в противоопухолевой терапии, в частности аналог пуринов флударабин и аналог дезоксицитидина гемцитабин, должны фосфорилироваться ферментомdCK, чтобы перейти в активную форму. Дезоксицитидин также устранял потерю клеточной жизнеспособности, вызванную флударабином, в то время как эффект в отношении клеточной гибели, индуцируемой бендамустином (препарат, который может действовать независимо dCK), не наблюдали. Статус фосфорилирования dCK проконтролировали с помощью Вестерн-блоттинга после обработки фородезином, так как согласно недавним исследованиям активность dCK в клетках CLL положительно регулируется фосфорилированием по Сер-74 (Smal et al., J. Biol. Chem., 281 (8), 4887-4893 (2006);Smal et al., Nucleosides Nucleotides Nucleic Acids, 25(9-11), 1141-1146 (2006); Smal et al., Cancer Lett,253(1), 68-73(2007. Обнаружили повышение уровня фосфорилированной формы (по Сер-74) dCK в клетках CLL, которое не было вызвано бендамустином. Денситометрический анализ отношения фосфоdCK/dCK после лечения фородезином показал взаимосвязь с цитотоксичностью как через 24 (р=0,05,дополнительные данные), так и через 48 ч (р=0,05). Для исследования антагонистического эффекта между флударабином и фородезином произвели наблюдения повышения уровня внутриклеточного дГТФ после инкубации клеток CLL с флударабином (1 мкг/мл) и фородезином (2 мкМ и dGuo 10 мкМ). Флударабин в одиночку не вызвал повышения уровня дГТФ, в то время как комбинация флударабина с фородезином (серые полоски) ослабило кратное повышение уровня дГТФ по сравнению с наблюдаемым в случае с одним фородезином (чрные полоски). Поэтому ослабление повышения уровня дГТФ, наблюдаемое с комбинацией флударабина и фородезина, может объяснить антагонистический эффект, проявляемый комбинацией этих двух препаратов. Так как флударабин должен быть фосфорилирован dCK,чтобы стать активным, и dGuo также фосфорилируется этим ферментом, оба вещества конкурируют за фермент, а поэтому формирование дГТФ или активной формы флударабина замедляется. Фородезин запустил митохондриальный путь апоптоза, независимый от p53. Для выявления механизма индукции фородезином апоптоза в клетках CLL исследовали различные отличительные характеристики митохондриального апоптотического пути. Фородезин вызвал понижение митохондриального трансмембранного потенциала (m) на ранних стадиях. После повреждения митохондрий возможна выработка активных форм кислорода, которые впоследствии могут опосредовать апоптоз (Villamor et al., Curr Pharm Des, 10(8), 841-853 (2004. Фородезин также вызвал выработку активных форм кислорода в первичных клетках CLL. Деполяризация митохондрий и выработка активных форм кислорода были ранними явлениями, так как проявились уже через 10 ч после обработки фородезином. Так как окислительный стресс играет роль в регуляции программируемой клеточной смерти, проанализировали эффект различных реутилизаторов активных форм кислорода. Предварительная инкубация клеток CLL с восстановленным глутатионом (GSH), N-ацетил цистеином (NAC) или Tiron уменьшили понижение m и выработку активных форм кислорода, вызванные фородезином. NAC и Tiron (специфичные реутилизаторы O2) практически подавили выработку активных форм кислорода, в то время как эффект глутатиона, селективного к Н 2 О 2, был менее выраженным. По результатам предыдущих исследований в клетках CLL in vitro, фородезин приводит к стабилизации p53 и запуску апоптоза (Balakrishnan et al., Blood, 108(7), 2392-2398 (2006, что согласуется с действием других противоопухолевых препаратов, вызывающих повреждение ДНК и p53-опосредованный апоптоз. Однако в отличие от других аналогов пуриновых нуклеозидов фородезин не внедряется в ДНК. Что примечательно, ранние признаки исследуемого митохондриального апоптотического пути также наблюдали у пациентов с CLL с делециями 17p (p53) или 11q (ATM), свидетельствуя о наличии механизма запуска апоптоза, независимого от p53-опосредованной реакции на повреждение ДНК. Фородезин запустил механизм цепной активации каспазы-9 и -8 и процессинг BID, что предполагает его роль в амплификационном цикле митохондриального апоптотического пути, опосредованного каспазой-8. Для анализа нижерасположенных сигнальных путей, ведущих к митохондриальному апоптозу, исследовали схему активации каспаз после обработки фородезином. Зависимую от дозы и времени активацию каспазы-9, -8 и -3 наблюдали и проанализировали путм процессинга их проактивных форм. Продукты расщепления каспазы-9 и -8 появились практически одновременно, уже через 10 ч после обработки фородезином. Сначала появилась расщеплнная форма про-каспазы-9, р 37, а затем повысился уровень расщеплнной формы каспазы-8 - р 43/41. Позже, обнаружили активный продукт расщепления прокаспазы-3. В корреляции с активацией каспазы-8 фородезин также вызвал понижение уровня BH3-белкаBID, являющегося основным субстратом каспазы-8, с возникновением его расщеплнной проапоптотической формы, также активирующей митохондриальный апоптотический путь. Также обнаружили понижение уровня ингибиторов апоптоза XIAP и сюрвивина и протеолитическое расщепление белка репарации PARP - субстрата каспазы-3, что тоже связано с запуском апоптоза. Затем, исследовали роль активации каспаз в вызываемом фородезином апоптозе, так как активация митохондриального апоптотического пути приводит как к зависимой от каспаз, так и независимой от них клеточной гибели. Обработка клеток ингибитором каспаз широкого спектра z-VAD.fmk частично понизила воздействие фосфатидилсерина через 24 ч после обработки фородезином, предполагая роль как зависимых от каспаз, так и независимых от них механизмов действия. Активация каспазы-8/BID может играть ключевую роль во время запуска апоптоза фородезина, либо быть вторичным побочным эффектом, вызванным активацией каспазы-9, и потому следовать за митохондриальными процессами. Любопытно, что запуск апоптоза, контролируемый окрашиванием AnnexinV, частично блокировался специфичным ингибитором каспазы-8 белком z-EETD.fmk, в то время как обнаруженное обращение понижения m было выражено сильнее. В совокупности, эти результаты говорят о том, что активация каспазы-8 и BID играют роль в ранней амплификации в процессе митохондриального апоптотического пути, запускаемого фородезином. Анализ проапоптотических и антиапоптотических регуляторов опосредованной митохондриями клеточной гибели. Митохондриальный путь апоптоза регулируется с помощью плотного баланса между про- и антиапоптотическими членами семейства белков BCL-2, такими как антиапоптотические белки BCL-2 иMCL-I, и проапоптотические белки BAX, BAK, BID и BIM, среди всех прочих. Клетки CLL вырабатывают высокие уровни антиапоптотических белков MCL-I и BCL-2, что обратно коррелирует с in vitro и клинической реакцией на химиотерапию. Исследовали эффект инкубации с фородезином на уровень этих антиапоптотических белков. После обработки фородезином уровень антиапоптотического белкаMCL-I существенно снизился, в то время как уровень белка BCL-2 не изменился. Для индукции апоптозаBH3-белок BIM взаимодействует с BCL-2 и другими антиапоптотическими белками семейства BCL-2. Фородезин вызвал повышение уровня проапоптотического белка BIM. Денситометрический анализ семи пациентов с CLL, подвергнутых лечению фородезином, подтвердил изменения в уровне белков BIM иMCL-I. Между повышением уровня проапоптотического белка BIM EL или понижением уровня MCL-I и цитотоксической реакцией на фородезин обнаружили прямую взаимосвязь, значимую в случае с понижением MCL-I (р=0,04). Кроме того, когда составили график (относительно контроля) соотношения понижения MCL-I и индукции BIM EL; и цитотоксичности, наблюдаемых после лечения фородезином, была выявлена существенная корреляция (р=0,04).BCL-2 и MCL-I защищают митохондриальную мембрану, сохраняя е целостность от действия эффекторных проапоптотических белков, как BAX и BAK. BIM и расщеплнный BID являются единственными BH3-белками, способными активировать BAX и BAK напрямую. Поточной цитометрией исследовали активацию BAX и BAK после инкубации CLL клеток с фородезином. Фородезин вызвал конформа- 12018415 ционные изменения BAX и BAK, позволившие этим белкам внедриться в наружную митохондриальную мембрану, е олигомеризацию, последующую индукцию повышения проницаемости митохондриальной мембраны и активацию аппарата клеточной смерти. Лечение фородезином вызвало повышение уровня иРНК и белка p73, а также индукцию FOXO1 иFOXO3A. Несмотря на то что фородезин проявил цитотоксический эффект во всех случаях CLL вне зависимости от статуса p53, фородезин смог индуцировать стабилизацию белка p53 в случаях CLL, не несущих делецию 17p. Индукция белка TAp73, родственного p53 и необходимого для p53-опосредованного апоптоза, может преодолеть устойчивость p53-дефицитных клеток CLL к апоптозу (Dicker et al., Blood,108(10), 3450-3457 (2006. Лечение фородезином вызвало чткую повышающую регуляцию уровня иРНК p73 и белка Tap73 во всех исследованных случаях. p73 регулирует индукцию проапоптотического белка BIM путм повышающей регуляции факторов транскрипции FOXO1 и FOXO3a в опухолевых клетках частично p53-зависимым, но также и p53-независимым способом (Amin et al., Cancer Res, 67(12),5617-5621 (2007, хоть механизм индукции FOXO пока неизвестен. Оценили уровень FOXO1 и FOXO3a в клетках CLL, обработанных фородезином. Фородезин вызвал повышение уровня обоих белков FOXO1 и FOXO3a, в корреляции с повышением уровня белков в p73 и BIM. Материалы и способы Препараты и химические вещества. Фородезин (ВСХ-1777/иммуциллин Н) для лабораторного применения предоставили BioCrystPharmaceuticals Inc. (Birmingham, USA), дезоксигуанозин (dGuo) приобрели у Sigma. дНТФы и [3H] дАТФ для количественного анализа дезоксигуанозин трифосфата (дГТФ) приобрели у Amersham Biosciences. Флударабин (Shering, Berlin, Germany), бендамустина гидрохлорид (Treanda, предоставленныйCephalon, Inc., Frazer, PA), ритуксимаб (Roche, Basel, Switzerland) и 2'-дезоксицитидин (Sigma) применили в процедурах определения цитотоксичности. Изоляция и культивация первичных клеток CLL и мононуклеарных клеток периферической крови,взятых у здоровых доноров. Настоящее in vitro исследование проводилось в первичных лейкемических лимфоцитах, взятых у 43 пациентов с диагностированной CLL, согласно классификации Всемирной организации здравоохранения. От каждого пациента получили осознанное согласие. Мононуклеарные клетки периферической крови (PBMCs) изолировали седиментацией Ficoll/Hypaque (Seromed, Berlin, Germany). Клетки либо использовали сразу, либо криопрезервировали в жидком азоте в присутствии 10% диметилсульфоксида и 90% инактивированной нагреванием фетальной коровьей сыворотки (ФКС, Gibco Paisley, Scotland, UK). После разморозки мононуклеарные клетки, взятые у пациентов с CLL (2106 клеток/мл), культивировали в питательной среде RPMI 1640 (Gibco), добавив 10% ФКС, 2 мМ глутамин и 50 мкг/мл пенициллин-стрептомицин, в увлажннной атмосфере при 37 С, содержащей 5% углекислого газа. Процентное количество опухолевых клеток (CD19+, CD5+), уровень экспрессии ZAP-70 и CD38 определили с помощью поточной цитометрии и провели количественный анализ, как описано ранее (Crespo et al., N Engl. J. Med., 348(18), 1764-1775 (2003. Предельная точка для высокого уровня экспрессии ZAP-70 была 20%, а для CD38 30% (Hus et al., Ann Oncol, 17(4),683-690 (2006. Все образцы CLL, использованные в данном исследовании, содержали более чем 95% опухолевых клеток. Цитогенетические изменения оценили флуоресцентной in situ гибридизацией (FISH) с применением многозондового коммерческого набора от Vysis (Downers Grove, IL), содержащего локусспецифические зонды для выявления делеций 17p13.1 (p53), 11q22.3 (ATM) и 13q14.3 (D13S319), а также центромерный зонд для выявления трисомии 12. Мутации гена p53 являются обычно миссенс мутациями, и мутированный белок характеризуется пролонгированным временем полужизни, позволяющим выявить его Вестерн-блоттингом. Кроме того, наличие мутаций p53 подтвердили прямым секвенированием согласно базе данных IARC ТР 53 Международного агентства исследования рака. Индукция (запуск) апоптоза. Клетки инкубировали в течение разных временных интервалов с разными дозами фородезина от 1 до 12 мкМ в присутствии или в отсутствие 10-20-30 мкМ дезоксигуанозина (dGuo). При необходимости,клетки преинкубировали в течение 1 ч с 80 мкМ панкаспазным ингибитором z-VAD.fmk (бензилоксикарбонил-Вал-Ала-Асп-фтор-метилкетон; Bachem, Bubendorf, Switzerland), 50 мкМ ингибитором каспазы-8 z-IETD.fink (Z-Иле-Глу(оксиметил)Тре-DL-Асп(оксиметил)-фторметилкетон, Bachem), 2'дезоксицитидином (5-10-20 мкМ, Sigma), N-ацетил-L-цистеином (NAC, 25 мМ), Tiron (5 мМ, 4,5 дигидрокси-1,3-бензол-дисульфоновой кислотой, Sigma) или восстановленным глутатионом (GSH, 2 мМ;Sigma). Для комбинационных исследований клетки предварительно обрабатывали 4, 12 или 24 ч флударабином или бендамустином либо 1 ч моноклональным анти-CD20 антителом ритуксимабом до добавления фородезина (2 мкМ) плюс dGuo (10-20 мкМ). Жизнеспособность клеток и запуск апоптоза оценивали, исследуя сложность клеток с помощью проточной цитометрии (FSC/SSC), количественный анализ воздействия фосфатидил серина (PS) - с помощью двойного окрашивания AnnexinV, конъюгированного с изотиоцианатом флуоресцеина (FITC) и иодидом пропидия (PI) (BenderMedsystems, Vienna, Austria).- 13018415 Для исследования апоптоза в популяциях CD3+ и CD19+ мононуклеарные клетки периферической кровиDickinson) и AnnexinV-APC. Графики жизнеспособности и цитотоксичности создали в виде процентного соотношения с контрольными клетками. Снижение митохондриального трансмембранного потенциала(m) оценили окрашиванием клеток 20 нМ OfDiOC6 (3,3-диэтилоксакарбоцианина иодид, MolecularProbes), a выработка активных форм кислорода определили окрашиванием клеток 2 мкМ дигидроэтидином (DHE; Molecular Probes) и поточной цитометрией. Происходящую благодаря конформационным изменениям активацию проапоптотических белков BAX и BAK определили иммуноцитометрией, мечением клеток антителами, обладающими сродством к NH2-концу белков BAX и BAK, как описано ранее(Bellosillo et al., Blood, 100(5), 1810-1816 (2002. В базовых условиях этот участок закрыт (заблокирован) и недоступен для присоединения антител, специфичных к эпитопу NH2-конца. После апоптотического стимула конформационные изменения в данных белках высвобождают NH2-конец и гидрофобный СООН-конец, нацеленный на митохондрии, играя важную роль в индукции аппарата клеточной гибели,опосредованного митохондриями. Вкратце, клетки один раз промыли поли(бутен-1-сульфоном) (PBS) и зафиксировали в 4% параформальдегиде, проницаемость мембраны увеличили 0,1% сапонином и 0,5% коровьим сывороточным альбумином (KCA). Клетки окрасили 1 мкг/мл первичными антителами, специфичными к антителам против конформационно активного BAK (Oncogene Research) или BAX (клон 6 А 7, BD Pharmingen) при комнатной температуре. После нескольких промываний в пермеабилизационном (улучшающем проницаемость) буфере клетки инкубировали с вторичным козьим антимышинымFITC (DAKO) или козьим антикроличьим FITC (Supertechs) антителом и вновь промыли пермеабилизационным буфером. Затем, десять тысяч окрашенных клеток каждого образца исследовали поточной цитометрией. Измерение уровня внутриклеточного дГТФ. 15106 первичных клеток CLL инкубировали с или без фородезина (2 мкМ) и dGuo (10 мкМ) или флударабином (1 мкг/мл) в течение 18 ч, затем нуклеотиды подвергли экстракцией 60% метанолом. Количественный анализ внутриклеточного дГТФ провели с помощью ДНК полимеразной процедуры, модифицированной Sherman и Fyfe (Sherman et al., Anal Biochem, 180(2), 222-226 (1989. Данные представили как кратное увеличение уровня внутриклеточного дГТФ относительно контрольных клеток. В то же время через 24 и 48 ч оценили жизнеспособность клеток. Иммуноблоттинг. Клетки разрушали 15 мин в буфере RIPA (150 мМ хлорида натрия, 1% Нонидета П 40 [Nonidet P40],0,5% дезоксихолата, 0,1% додецилсульфата натрия, 50 мМ Трис-HCl, рН 8,0), добавив протеазу и ингибиторы фосфатазы (10 мкг/мл леупептин, 10 мкг/мл апопротинин (apoprotinine), 1 мкМ фенилметилсульфонилфторид (PMSF), 1 мкМ ортованадат натрия, 1 мкМ NaF, 2 мкМ натрия пирофосфат декагидрат(Sigma. Совокупные клеточные белки разделили с помощью СДС-ПАГЭ в восстановительной среде и перенесли на мембраны Иммобилона-Р (Millipore). Для выявления белка мембраны зондировали следующими первичными антителами: анти-BIM, анти-BAK (AbI), анти-каспаза-8 (Ab-3), анти-p53 (Ab-2)(Roche); анти-каспаза-3 и анти-BAX (clone 6A7) (BD-Pharmingen); анти-сюрвивин (Abeam); антиактин и антитубулин (Sigma) и анти-FoxO3A (Upstate). Кроличья анти-фосфо-dCK (Сер 79) и кроличья антиdCK были любезно предоставлены Caroline Smal and Francoise Bontemps (Universite Catholique deLouvain, Belgium). После инкубации с соответствующим первичным антителом с помощью реагентов усиленной хемолюминесценции (ECL) (Pierce) получили блоты с меченными пероксидазой хрена (HRP) антимышиными (Sigma), антикроличьими (Sigma) или антикозьими (Dako) антителами. Каждую зарядку белком подтвердили выявлением экспрессии -актина или -тубулина, а относительный количественный анализ белка провели с помощью программного обеспечения Image Gauge Fujifilm (Fuji). Количественный анализ иРНК с помощью ОТ-ПЦР в реальном времени. Совокупную РНК выделили из 107 клеток с помощью реагента TRIZOL (Invitrogen, Carlsbad, CA) в соответствии с инструкциями производителя. Затем, 1 мкг совокупной РНК обратно транскрибировали в кДНК, используя произвольные праймеры и обратную транскриптазу M-MLV (Invitrogen). Уровень экспрессии p73 и Mcl-I определили с помощью системы обнаружения последовательности ABI Prism 7900HT (Applied Biosystems, Foster City, CA) и стандартного набора Assay-on-demand (Applied Biosystems). Количественный анализ относительной экспрессии каждого гена провели по методу Ct, используя глюкуронидазу (GUS) в качестве эндогенного контроля. Уровни экспрессии иРНК задали как произвольные количественные единицы ПЦР, в каждом случае используя контрольный (необработанный) образец для калибровки. Статистический анализ. Данные представлены в виде среднего значениястандартное отклонение (SD) трх независимых экспериментов. Все статистические анализы провели с применением программного обеспечения Graphpad Prism 3.0 (GraphPad Software Inc., San Diego, CA). Оценку различий между двумя группами образцов проводили с применением непараметрического критерия Манна-Уитни, а коэффициенты корреляции получали с помощью теста Спирмана. Результаты считали статистически значимыми, когда значениеp0,05 ( p0,05,p0,01,p0,0001). Для оценки комбинационного эффекта двух различных препаратов оценивали значение комбинационного индекса (CI), вычисляемого по алгоритму Chou и Talalay(Calcusyn software v2.0, Biosoft, Cambridge, UK) (Chou et al., Adv Enzyme Regul, 22, 27-55 (1984. Данное значение CI является показательным маркером, является ли комбинационный эффект для двух различных препаратов антагонистическим или синергетическим эффектом. Взаимодействие двух препаратов считалось синергетическим, если значение CI было ниже 1, аддитивным, если оно было равно 1, и антагонистическим, если значение CI превышало 1. В данном изобретении описан ряд вариантов реализации согласно изобретению. Тем не менее, необходимо иметь в виду, что можно разработать различные модификации данного патента, принципиально не отходя от объма и сущности изобретения. С учтом этого другие варианты реализации входят в объм нижеперечисленных пунктов. Все публикации, патенты и патентные заявки, упомянутые в данном изобретении, включены в настоящее описание посредством ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения гематологического злокачественного новообразования у субъекта, включающий следующие этапы:(a) введение указанному субъекту эффективного количества ингибитора фосфорилазы пуриновых нуклеозидов (PNP) и(b) введение указанному субъекту эффективного количества анти-CD20 агента. 2. Способ по п.1, отличающийся тем, что указанный ингибитор PNP представляет собой фородезин. 3. Способ по любому из пп.1, 2, отличающийся тем, что указанный анти-CD20 агент представляет собой ритуксимаб. 4. Способ по любому из пп.1-3, отличающийся тем, что указанные ингибитор PNP и анти-CD20 агент вводят одновременно. 5. Способ по любому из пп.1-3, отличающийся тем, что указанные ингибитор PNP и анти-CD20 агент вводят последовательно. 6. Способ по п.5, отличающийся тем, что указанный анти-CD20 агент вводят один или несколько раз до введения ингибитора PNP. 7. Фармацевтическая композиция, содержащая ингибитор PNP и анти-CD20 агент. 8. Композиция по п.7, отличающаяся тем, что указанный ингибитор PNP представляет собой фородезин. 9. Композиция по п.7, содержащая фородезин и ритуксимаб. 10. Набор, включающий ингибитор PNP и анти-CD20 агент. 11. Набор по п.10, дополнительно включающий систему доставки ингибитора PNP, анти-CD20 агента или их комбинацию. 12. Набор по п.10 или 11, дополнительно включающий инструкции по лечению субъекта. 13. Набор по любому из пп.10-12, отличающийся тем, что указанный ингибитор PNP представляет собой фородезин. 14. Набор по любому из пп.10-13, включающий фородезин и ритуксимаб.
МПК / Метки
МПК: A61K 45/06, A61K 31/4184, A61K 39/395, A61K 31/4745, A61P 35/02, A61K 35/00
Метки: набор, злокачественного, композиция, гематологического, способ, новообразования, фармацевтическая, лечения
Код ссылки
<a href="https://eas.patents.su/19-18415-farmacevticheskaya-kompoziciya-nabor-i-sposob-lecheniya-gematologicheskogo-zlokachestvennogo-novoobrazovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция, набор и способ лечения гематологического злокачественного новообразования</a>
Предыдущий патент: Ингибиторы seh и их применение
Следующий патент: Композиция для ухода за волосами и/или волосистой частью головы
Случайный патент: Устройство для компенсации скачков давления в закрытых системах, таких как элеваторы или тому подобные