Ингибиторы seh и их применение
Формула / Реферат
1. Соединение, отвечающее формуле I
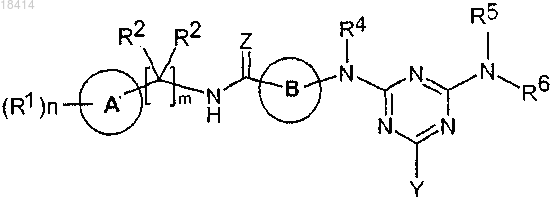
Формула I
где А представляет фенил или пиридил;
R1 представляет собой CF3, галоген, OCF3, CN, O-C1-C6-алкил, морфолино, СО2Н или N(CH3)2;
R2 означает Н;
m равно 1;
n означает 1, 2 или 3;
В означает циклогексил;
R4 означает Н;
Z означает О;
Y означает C1-С3-алкил, фенил, тиофенил или пиридил; где указанные фенил, тиофенил или пиридил могут быть замещены -СО2Н, SO2Me, CF3, галогеном или CN;
R5 означает Н или C1-С6-алкил и
R6 означает Н или C1-С6-алкил,
или его фармацевтически приемлемая соль.
2. Соединение, отвечающее формуле I

Формула I
где А представляет фенил;
R1 представляет собой CF3, галоген, OCF3, CN, O-C1-C6-алкил или морфолино;
R2 означает Н;
m равно 1;
n означает 1 или 2;
В означает циклогексил;
R4 означает Н;
Z означает О;
Y означает метил;
R5 означает Н и
R6 означает метил,
или его фармацевтически приемлемая соль.
3. Соединение, выбранное из следующих соединений:
цис-4-{[4-(метиламино)-6-(3-пиридинил)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{[4-(метиламино)-6-(3-тиенил)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{[4-[4-(1,1-диметилэтил)фенил]-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{[4-(2-фторфенил)-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{[4-(4-цианофенил)-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-({4-(метиламино)-6-[4-(метилсульфонил)фенил]-1,3,5-триазин-2-ил}амино)-N-({2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
цис-4-{[4-(метиламино)-6-(3-пиридинил)-1,3,5-триазин-2-ил]амино}-N-({2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
цис-4-({4-(метиламино)-6-[4-(трифторметил)фенил]-1,3,5-триазин-2-ил}амино)-N-({2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
3-{4-(метиламино)-6-[(цис-4-{[({2-[(трифторметил)окси]фенил}метил)амино]карбонил}циклогексил)амино]-1,3,5-триазин-2-ил}бензойная кислота;
3-[4-(метиламино)-6-({цис-4-[({[4-(метилокси)-2-(трифторметил)фенил]метил}амино)карбонил]циклогексил}амино)-1,3,5-триазин-2-ил]бензойная кислота;
цис-4-({4-(метиламино)-6-[4-(трифторметил)фенил]-1,3,5-триазин-2-ил}амино)-N-{[4-(метилокси)-2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{[4-(метиламино)-6-(3-пиридинил)-1,3,5-триазин-2-ил]амино}-N-{[4-(метилокси)-2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-({4-(метиламино)-6-[4-(метилсульфонил)фенил]-1,3,5-триазин-2-ил}амино)-N-{[4-(метилокси)-2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
3-[4-(метиламино)-6-({цис-4-[({[4-(трифторметил)-3-пиридинил]метил}амино)карбонил]циклогексил}амино)-1,3,5-триазин-2-ил]бензойная кислота;
цис-4-({4-(метиламино)-6-[4-(трифторметил)фенил]-1,3,5-триазин-2-ил}амино)-N-{[4-(трифторметил)-3-пиридинил]метил}циклогексанкарбоксамид;
цис-4-{[4-(метиламино)-6-(3-пиридинил)-1,3,5-триазин-2-ил]амино}-N-{[4-(трифторметил)-3-пиридинил]метил}циклогексанкарбоксамид;
цис-4-({4-(метиламино)-6-[4-(метилсульфонил)фенил]-1,3,5-триазин-2-ил}амино)-N-{[4-(трифторметил)-3-пиридинил]метил}циклогексанкарбоксамид;
3-[4-{[цис-4-({[(2-хлор-4-цианофенил)метил]амино}карбонил)циклогексил]амино}-6-(метиламино)-1,3,5-триазин-2-ил]бензойная кислота;
цис-N-[(2-хлор-4-цианофенил)метил]-4-{[4-(метиламино)-6-(3-пиридинил)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
цис-4-({4-[(2-гидроксиэтил)амино]-6-метил-1,3,5-триазин-2-ил}амино)-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{[4-метил-6-(4-метил-1-пиперазинил)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-({4-метил-6-[(фенилметил)амино]-1,3,5-триазин-2-ил}амино)-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-[(4-метил-6-{[2-(метилокси)этил]амино}-1,3,5-триазин-2-ил)амино]-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{[4-(диметиламино)-6-метил-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{[4-метил-6-(1-пиперидинил)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-[(4-амино-6-метил-1,3,5-триазин-2-ил)амино]-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
N-[(2,4-дихлорфенил)метил]-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
цис-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-({2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
цис-N-{[4-хлор-2-(трифторметил)фенил]метил}-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
(цис)-N-({2-хлор-4-[(метилсульфонил)амино]фенил}метил)-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
(цис)-N-{[2-хлор-4-(диметиламино)фенил]метил}-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
(цис)-N-[(2-хлор-4-цианофенил)метил]-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
(цис)-N-{[2-хлор-4-(1Н-тетразол-5-ил)фенил]метил}-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
(цис)-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[3-(трифторметил)-4-пиридинил]метил}циклогексанкарбоксамид;
(цис)-3-{[4-(2-фторфенил)-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
(цис)-3-{[4-(4-фторфенил)-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
(цис)-3-{[4-(4-цианофенил)-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
(цис)-4-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-({2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
цис-N-[(2,4-дихлорфенил)метил]-4-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
цис-N-{[4-хлор-2-(трифторметил)фенил]метил}-4-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
цис-4-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-({2-[(трифторметил)тио]фенил}метил)циклогексанкарбоксамид;
транс-4-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
транс-4-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-({2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
цис-4-{метил[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{метил[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-({2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
цис-N-[(2,4-дихлорфенил)метил]-4-{метил[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
цис-N-{[4-хлор-2-(трифторметил)фенил]метил}-4-{метил[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
транс-4-{[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
транс-4-{[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}-N-({2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
транс-N-[(2,4-дихлорфенил)метил]-4-{[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
транс-N-{[4-хлор-2-(трифторметил)фенил]метил}-4-{[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
цис-4-{метил[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
цис-4-{метил[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}-N-({2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
цис-N-[(2,4-дихлорфенил)метил]-4-{метил[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
цис-N-{[4-хлор-2-(трифторметил)фенил]метил}-4-{метил[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
3-{[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}-N-{[2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
3-{[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}-N-({2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
N-[(2,4-дихлорфенил)метил]-3-{[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
N-{[4-хлор-2-(трифторметил)фенил]метил}-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
цис-N-[(2,4-дихлорфенил)метил]-4-{[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
4-{[({цис-4-[(4-(метилтио)-6-{[(2R)-2-фенилпропил]амино}-1,3,5-триазин-2-ил)амино]циклогексил}карбонил)амино]метил}бензойная кислота;
цис-N-({4-бром-2-[(трифторметил)окси]фенил}метил)-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
цис-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-({4-(4-морфолинил)-2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
цис-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-({4-(1-пиперидинил)-2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
цис-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-({4-(1-пирролидинил)-2-[(трифторметил)окси]фенил}метил)циклогексанкарбоксамид;
цис-N-{[2-хлор-4-(1-пиперидинил)фенил]метил}-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид;
(цис)-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}-N-{[4-(метилокси)-2-(трифторметил)фенил]метил}циклогексанкарбоксамид;
(цис)-N-{[4-фтор-2-(трифторметил)фенил]метил}-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид и
(цис)-N-{[4-циано-2-(трифторметил)фенил]метил}-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид,
или его фармацевтически приемлемая соль.
4. Соединение, представляющее собой (N-{[4-циано-2-(трифторметил)фенил]метил}-3-{[4-метил-6-(метиламино)-1,3,5-триазин-2-ил]амино}циклогексанкарбоксамид, или его фармацевтически приемлемая соль.
5. Фармацевтическая композиция для лечения болезней, опосредуемых ферментом sEH, содержащая соединение или соль по любому из пп.1-4 и один или несколько фармацевтически приемлемых наполнителей.
Текст
Изобретение относится к новым ингибиторам sEH и их применению для лечения болезней,опосредуемых ферментом sEH. Конкретно, изобретение относится к соединениям, отвечающим формуле I в которой R1, R2, R4, R5, R6, А, В, Y, Z, n и m имеют указанные в описании значения, и к их фармацевтически приемлемым солям. Соединения по изобретению являются ингибиторамиsEH и могут быть применены для лечения болезней, опосредуемых ферментом sEH, таких как гипертензия. Соответственно, изобретение дополнительно относится к фармацевтическим композициям, содержащим соединение по изобретению. Изобретение еще дополнительно относится к способам ингибирования sEH и лечения состояний, связанных с этим, с использованием соединения по изобретению или фармацевтической композиции, содержащей соединение по изобретению. Область техники, к которой относится изобретение Изобретение относится к новым ингибиторам sEH и их применению при лечении болезней, опосредуемых ферментом sEH. Уровень техники Эпоксидные функциональные группы могут быть обнаружены в лекарствах, ксенобиотических материалах и эндогенных биомолекулах. Эпоксид-гидролазы, найденные и в растениях, и у животных, являются ферментами, которые превращают эпоксиды в диолы путем гидролиза. У млекопитающих растворимая эпоксид-гидролаза ("sEH") является, главным образом, ответственной за метаболизм производных арахидоновой кислоты, известных как эпоксиэйкозатриеновые кислоты ("EET"). sEH превращаетEET в дигидроксиэйкозатриеновые кислоты ("DHET"). В нескольких публикациях сообщается о полезных сосудорасширяющих, противовоспалительных и антитромботических эффектах EET. См., например,Spector et al., Prog. Lipid Res., 43, 55-90, 2004; Imig, Cardiovasc. Drug Rev., 24, 169-188, 2006. DHET, как правило, неактивны и поэтому не проявляют полезных эффектов EET. Наоборот, микросомальная эпоксид-гидролаза ("mEH") катализирует гидролиз широкого диапазона эпоксид-субстратов, включая канцерогенные полициклические ароматические углеводороды и реакционноспособные эпоксиды, таким образом, она обеспечивает важный путь детоксификации. Полиморфизмы в mEH могут приводить к различиям в биоактивации прокарциногенов, и отдельные эпидемиологические исследования людей подтверждают, что генотип mEH ассоциируется с измененным риском рака. FretlandOmiecinski, Chemico-Biol. Int., 129, 41-59, 2000. Фармакологические исследования фенотипа мышей с выбитым геном и генетического полиморфизма подтверждают, что повышенные уровни EET являются защитными во многих сердечнососудистых расстройствах, включая гипертензию [Sinal et al., J. Biol. Chem., 275, 40504-40510, 2000; ImigVasc. Biol., 24, 595-600, 2004] и воспаление [Inceoglu et al., Life Sci., 79, 2311-2319, 2006]. Один из подходов к лечению таких состояний предусматривает использование преимущества и полезного эффекта EET для ингибирования действия sEH, тем самым предотвращение деградации EET. В свете роли, которую sEH играет в деградации EET, желательно получить соединения, которые ингибируют его активность. Таким образом, существует потребность в идентификации соединений, которые ингибируют sEH, которые могут быть применены для лечения разнообразных состояний, опосредуемых ферментом sEH. Сущность изобретения Изобретение относится к новым ингибиторам sEH и их применению при лечении болезней, опосредуемых ферментом sEH. Конкретно, изобретение относится к соединениям, отвечающим формуле I Формула I где R1, R2, R4, R5, R6, А, В, Y, n и m имеют указанные ниже значения,и к их фармацевтически приемлемым солям. Соединения по изобретению являются ингибиторами sEH и могут быть применимы при лечении болезней, опосредуемых ферментом sEH, таких как гипертензия. Соответственно, изобретение дополнительно относится к фармацевтическим композициям, содержащим соединение по изобретению. Подробное описание изобретения В описании изобретения химические элементы идентифицированы в соответствии с Периодической системой элементов. Используемые здесь сокращения и символы находятся в соответствии с общим применением таких сокращений и символов специалистами в области химии и биологии. Например, в описании использованы следующие сокращения:"HPLC" - жидкостная хроматография высокого давления;"н." - нормальность и относится к числу эквивалентов реагента на 1 л раствора;"Алкил" относится к одновалентной насыщенной углеводородной цепи, имеющей оговоренное число членов-атомов. Например, C1-C8-алкил относится к алкильной группе, имеющей от 1 до 8 членоватомов. Алкильные группы могут быть необязательно замещенными одним или несколькими заместителями, которые оговорены здесь. Алкильные группы могут быть прямыми или разветвленными. Типичные разветвленные алкильные группы имеют одно, два или три ответвления. Алкил включает метил,этил, пропил (н-пропил и изопропил), бутил (н-бутил, изобутил и трет-бутил), пентил (н-пентил, изопентил и неопентил) и гексил."Циклоалкил" относится к одновалентному насыщенному или ненасыщенному углеводородному кольцу, имеющему указанное число членов-атомов. Например, C3-C6-циклоалкил относится к циклоалкильной группе, имеющей от 3 до 6 членов-атомов. Ненасыщенные циклоалкильные группы имеют одну или несколько углерод-углеродных двойных связей в кольце. Циклоалкильные группы не являются ароматическими. Циклоалкильные группы, имеющие от 3 до 7 членов-атомов или менее, являются моноциклическими кольцевыми системами. Циклоалкильные группы, имеющие по меньшей мере 7 членоватомов, могут быть моноциклическими, связанными мостиками или конденсированными бициклическими кольцевыми системами. Циклоалкильные группы могут быть необязательно замещенными одним или несколькими заместителями, которые оговорены здесь. Циклоалкил включает циклопропил, циклопропенил, циклобутил, циклобутенил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептанил и циклогептенил."Энантиомерно обогащенный" относится к продуктам, энантиомерный избыток которых более чем ноль. Например, энантиомерно обогащенный относится к продуктам, энантиомерный избыток которых более чем 50% ее, более чем 75% ее и более чем 90% ее."Энантиомерный избыток" или "ее" означает избыток одного энантиомера по сравнению с другим,выраженный в процентах. Как результат, когда оба энантиомера присутствуют в равных количествах в рацемической смеси, энантиомерный избыток равен нолю (0% ее). Однако если один энантиомер обогащен так, что составляет 95% продукта, тогда энантиомерный избыток будет 90% ее (количество обогащенного энантиомера, 95%, минус количество другого энантиомера, 5%)."Энантиомерно чистый" относится к продуктам, энантиомерный избыток которых равен 99% ее или более."Полупериод выведения" относится к времени, необходимому для превращения половины количества вещества в другую химически отличимую разновидность in vitro или in vivo."Галогеналкил" относится к алкильной группе, которая является замещенной одним или несколькими галоген-заместителями. Галогеналкил включает трифторметил."Гетероарил" относится к одновалентному ароматическому кольцу, содержащему от 1 до 4 гетероатомов как членов-атомов в кольце. Гетероарильные группы, содержащие более чем один гетероатом, могут содержать различные гетероатомы. Гетероарильные группы могут быть необязательно замещенными одним или несколькими заместителями, которые оговорены здесь. Если не обусловлено иное,гетероарильные группы являются моноциклическими кольцевыми системами или конденсированными,спиро или связанными мостиками бициклическими кольцевыми системами. Моноциклические гетероарильные кольца имеют 5 или 6 членов-атомов. Бициклические гетероарильные кольца имеют от 7 до 11 членов-атомов. Бициклические гетероарильные кольца включают такие кольца, где фенил и моноциклическое гетероциклоалкильное кольцо присоединены, образуя конденсированную, спиро или связанную мостиком бициклическую кольцевую систему, и такие кольца, где моноциклическое гетероарильное кольцо и моноциклическое циклоалкильное, циклоалкенильное, гетероциклоалкильное или гетероарильное кольцо связаны, образуя конденсированную, спиро или связанную мостиком бициклическую кольцевую систему. Гетероарил включает пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, фуранил, фуразанил, тиенил, триазолил, пиридинил, пири-2 018414"Гетероциклоалкил" относится к насыщенному или ненасыщенному кольцу, содержащему от 1 до 4 гетероатомов как членов-атомов в кольце. Однако гетероциклоалкильные кольца не являются ароматическими. Гетероциклоалкильные группы, содержащие более чем один гетероатом, могут содержать различные гетероатомы. Гетероциклоалкильные группы могут быть необязательно замещенными одним или несколькими заместителями, которые оговорены здесь. Если не обусловлено иное, гетероциклоалкильные группы являются моноциклическими, связанными мостиками или конденсированными кольцевыми системами. Моноциклические гетероциклоалкильные кольца имеют от 4 до 7 членов-атомов. Связанные мостиками или бициклические гетероциклоалкильные кольца имеют от 7 до 11 членов-атомов. В некоторых вариантах осуществления гетероциклоалкил является насыщенным. В других вариантах осуществления гетероциклоалкил является ненасыщенным, но не ароматическим. Гетероциклоалкил включает пирролидинил, тетрагидрофуранил, дигидрофуранил, пиранил, тетрагидропиранил, дигидропиранил,тетрагидротиенил, пиразолидинил, оксазолидинил, тиазолидинил, пиперидинил, гомопиперидинил, пиперазинил, морфолинил, тиаморфолинил, азепинил, 1,3-диоксоланил, 1,3-диоксанил, 1,4-диоксанил,1,3-оксатиоланил, 1,3-оксатианилил, 1,3-дитианил, азетидинил, азабицикло[3,2,1]октил, азабицикло[3,3,1]нонил, азабицикло[4,3,0]нонил, оксабицикло[2,2,1]гептил и фталимидил."Члены-атомы" относятся к атому или атомам, которые образуют цепь или кольцо. Когда присутствует более чем один член-атом в цепи и в кольце, каждый член-атом ковалентно связан с соседним членом-атомом в цепи или кольце. Атомы, которые образуют замещающую группу на цепи или кольце, не являются членами-атомами в цепи или кольце."Необязательно замещенная" указывает на то, что группа, такая как алкил, алкенил, алкинил, арил,циклоалкил, циклоалкенил, гетероциклоалкил или гетероарил, может быть незамещенной или замещенной одним или несколькими заместителями, которые оговорены здесь. "Замещенная" по отношению к группе указывает на то, что атом водорода, присоединенный к члену-атому в группе, замещен. Должно быть понятно, что термин "замещенная" включает само собой разумеющееся условие, что такое замещение происходит в соответствии с допустимой валентностью замещенного атома и заместителя и что замещение имеет результатом стабильное соединение (т.е. соединение, которое спонтанно не подвергается трансформации, такой как перегруппировка, циклизация или элиминирование). В некоторых вариантах осуществления один атом может быть замещен более чем одним заместителем постольку, поскольку такое замещение находится в соответствии с разрешенной валентностью атома. Соответствующие заместители указаны здесь для каждой замещенной или необязательно замещенной группы."Фармацевтически приемлемый" относится к тем соединениям, материалам, композициям и дозированным формам, которые в соответствии с официальным медицинским заключением являются подходящими для применения в контакте с тканями человека и животных без излишней токсичности, раздражения или других проблем или осложнений в соответствии с рациональным отношением польза/риск. Соединения. Изобретение относится к соединениям, отвечающим формуле I Формула I где А представляет фенил или пиридил;Y означает C1-С 3-алкил, фенил, тиофенил или пиридил; где указанные фенил, тиофенил или пиридил могут быть замещены -СО 2 Н, SO2Me, CF3, галогеном или CN;R6 означает Н или C1-С 6-алкил,или их фармацевтически приемлемым солям. Значение любой функциональной группы или заместителя на ней в любом случае в формуле I или любой ее субформуле является независимым от их значения или значения любой другой функциональной группы или заместителя в любом другом случае, если не обусловлено иное. Соединения, отвечающие формуле I, могут содержать один или несколько асимметричных центров(упоминаемых также как хиральные центры) и поэтому могут существовать как отдельные энантиомеры,диастереомеры или другие стереоизомерные формы или как их смеси. Хиральные центры, такие как хиральные атомы углероды, могут также присутствовать в заместителе, таком как алкильная группа. Когда стереохимия хирального центра, присутствующего в формуле I или в какой-либо химической структуре,иллюстрируемой здесь, точно не определена, структура предназначена для того, чтобы охватывать любой стереоизомер и все их смеси. Так, соединения, отвечающие формуле I, содержащие один или несколько хиральных центров, могут быть использованы как рацемические смеси, энантиомерно обогащенные смеси или как энантиомерно чистые отдельные стереоизомеры. Отдельные стереоизомеры соединения, отвечающего формуле I, которые содержат один или несколько асимметричных центров, могут быть разделены способами, известными специалистам в этой области. Например, такое разделение может быть осуществлено (1) путем образования диастереоизомерных солей, комплексов или других производных; (2) путем селективной реакции со стереоизомерспецифическим реагентом, например ферментативным окислением или восстановлением, или (3) газожидкостной или жидкостной хроматографией в хиральной среде, например на хиральном носителе, таком как диоксид кремния со связанным хиральным лигандом, или в присутствии хирального растворителя. Опытный специалист будет учитывать, что, когда желательный стереоизомер превращают в другую хиральную разновидность путем одной из указанных процедур разделения, требуется дополнительная стадия для высвобождения желательной формы. В качестве варианта, конкретные стереоизомеры могут быть синтезированы путем асимметричного синтеза с использованием оптически активных реагентов,субстратов, катализаторов или растворителей или путем превращения одного энантиомера в другой путем асимметричного преобразования. Соединения, отвечающие формуле I, могут также содержать двойные связи или другие центры геометрической асимметрии. Когда стереохимия центра геометрической асимметрии, присутствующего в формуле I или в какой-либо химической структуре, иллюстрируемой здесь, точно не определена, структура предназначена для того,чтобы охватывать транс-(Е)-геометрический изомер,цис-(Z)-геометрический изомер и все их смеси. Подобным образом, все таутомерные формы также включены в формулу I, существуют ли такие таутомеры в равновесии или преимущественно в одной форме. В некоторых вариантах осуществления соединения, отвечающие формуле I, могут содержать кислотную функциональную группу и поэтому быть способными к образованию фармацевтически приемлемых аддитивных солей с основаниями путем обработки соответствующим основанием. В некоторых других вариантах осуществления соединения, отвечающие формуле I, могут содержать функциональную группу основного характера и поэтому быть способными к образованию фармацевтически приемлемых аддитивных солей с кислотами путем обработки соответствующей кислотой. Таким образом, опытный специалист будет иметь в виду, что могут быть получены фармацевтически приемлемые соли соединений, отвечающих формуле I. Действительно, в некоторых вариантах осуществления изобретения фармацевтически приемлемые соли соединений, отвечающих формуле I, могут быть предпочтительнее соответствующего свободного основания или свободной кислоты, потому что такие соли придают более высокую стабильность или растворимость молекуле, тем самым облегчая введение в состав дозированной формы. Соответственно, изобретение дополнительно относится к фармацевтически приемлемым солям соединений, отвечающих формуле. Используемый здесь термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют желательную биологическую активность соответствующего соединения и проявляют минимальные нежелательные токсикологические эффекты. Такие фармацевтически приемлемые соли могут быть получены in situ во время окончательной изоляции и очистки соединения или путем отдельного взаимодействия очищенного соединения в форме его свободной кислоты или свободного основания с подходящим основанием или кислотой соответственно. По причине их потенциального применения в медицине соли соединений формулы (I) являются предпочтительно фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли включают аддитивные соли с кислотами или основаниями. Фармацевтически приемлемая аддитивная соль с кислотой можетбыть образована при взаимодействии соединения формулы (I) с подходящей неорганической или органической кислотой (такой как бромоводородная, хлороводородная, серная, азотная, фосфорная, янтарная, малеиновая, муравьиная, уксусная, пропионовая, фумаровая, лимонная, виннокаменная, молочная, бензойная, салициловая, глутаминовая, аспарагиновая, п-толуолсульфоновая, бензолсульфоновая, метансульфоновая, этансульфоновая, нафталинсульфоновая, такая как 2-нафталинсульфоновая, или гексановая кислоты) необязательно в подходящем растворителе, таком как органический растворитель, чтобы получить соль, которую обычно изолируют, например, кристаллизацией и фильтрованием. Фармацевтически приемлемая аддитивная соль с кислотой соединения формулы (I) может содержать или быть, например, такой как гидробромид,гидрохлорид, сульфат, нитрат, фосфат, сукцинат, малеат, формиат, ацетат, пропионат, фумарат, цитрат,тартрат, лактат, бензоат, салицилат, глутамат, аспартат, п-толуолсульфонат, бензолсульфонат, метансульфонат, этансульфонат, нафталинсульфонат (например, 2-нафталинсульфонат) или гексаноат. Фармацевтически приемлемая аддитивная соль с основанием может быть образована при взаимодействии соединения формулы (I) с подходящим неорганическим или органическим основанием (например, таким как триэтиламин, этаноламин, триэтаноламин, холин, аргинин, лизин или гистидин) необязательно в подходящем растворителе, таком как органический растворитель, чтобы получить аддитивную соль с основанием, которую обычно изолируют, например, кристаллизацией и фильтрованием. Другие подходящие фармацевтически приемлемые соли включают фармацевтически приемлемые соли металлов, например фармацевтически приемлемые соли щелочных или щелочно-земельных металлов, такие как соли натрия, калия, кальция или магния, в особенности фармацевтически приемлемые соли металлов с частями молекул одной или нескольких карбоновых кислот, которые могут присутствовать в соединении формулы (I). Другие фармацевтически неприемлемые соли, например оксалаты, могут быть использованы, например, при изоляции соединения по изобретению, и они включены в сферу действия изобретения. Изобретение включает в сферу своего действия все возможные стехиометрические и нестехиометрические формы солей соединения формулы (I). Используемый здесь термин "соединения по изобретению" означает как соединения, отвечающие формуле I, так и их фармацевтически приемлемые соли. Термин "соединение по изобретению" также встречается здесь и относится как к соединению, отвечающему формуле I, так и к его фармацевтически приемлемым солям. В твердом состоянии соединения по изобретению могут существовать в кристаллической, полукристаллической и аморфной формах, а также как их смеси. Специалист будет учитывать, что могут быть получены фармацевтически приемлемые сольваты соединения по изобретению, когда молекулы растворителя объединяются со структурой твердого состояния во время кристаллизации. Сольваты могут вовлекать воду или неводные растворители или их смеси. В дополнение, содержание растворителя в таких сольватах может изменяться в ответ на окружающую среду и при хранении. Например, вода может вытеснять другой растворитель со временем в зависимости от относительной влажности и температуры. Сольваты, в которых вода является растворителем, который объединен со структурой твердого состояния, обычно называют "гидратами". Сольваты, в которых более чем один растворитель объединен со структурой твердого состояния, обычно называют как "смешанные сольваты". Сольваты включают "стехиометрические сольваты", а также композиции, содержащие переменные количества растворителя (так называемые "нестехиометрические сольваты"). Стехиометрические сольваты, в которых вода является растворителем, который объединен со структурой твердого состояния, обычно называют "стехиометрическими гидратами". Изобретение включает стехиометрические и нестехиометрические сольваты. В дополнение, кристаллические формы соединения по изобретению, включая их сольваты, могут содержать молекулы растворителя, которые не объединены со структурой твердого состояния. Например, молекулы растворителя могут быть захвачены кристаллами при изоляции. В дополнение, молекулы растворителя могут удерживаться на поверхности кристаллов. Изобретение включает такие формы. Специалист дополнительно должен принимать во внимание, что соединения по изобретению,включая их сольваты, могут проявлять полиморфизм (т.е. способность встречаться в различных формах порядка кристаллической упаковки). Эти различные кристаллические формы обычно известны как "полиморфы". Изобретение включает все такие полиморфы. Полиморфы имеют тот же химический состав,но отличаются по упаковке, геометрическому порядку и другим наглядным свойствам кристаллического твердого состояния. Полиморфы, следовательно, могут иметь отличающиеся физические свойства, такие как форма, плотность, твердость, деформируемость, стабильность и свойства растворения. Полиморфы обычно обнаруживают различные ИК-спектры и диаграммы, которые могут быть использованы для идентификации. Полиморфы также обнаруживают различные температуры плавления, которые могут быть использованы для идентификации. Специалист будет учитывать, что различные полиморфы могут быть получены, например, путем изменения или приспособления условий реакции или реагентов, используемых при получении соединения. Например, изменения температуры, давления или растворителя могут приводить к получению различных полиморфов. В дополнение, один полиморф может спонтанно превратиться в другой полиморф в конкретных условиях. Типичные варианты осуществления В одном варианте осуществления: А представляет фенил или пиридил;Y означает C1-С 3-алкил, фенил, тиофенил или пиридил; где указанные фенил, тиофенил или пиридил могут быть замещены СО 2 Н, SO2Me, CF3, галогеном или CN;R6 означает Н или C1-С 6-алкил. Конкретные примеры соединений по данному изобретению включают следующие: цис-4-[4-(метиламино)-6-(3-пиридинил)-1,3,5-триазин-2-ил]амино-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[4-(метиламино)-6-фенил-1,3,5-триазин-2-ил]амино-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[4-(метиламино)-6-(3-тиенил)-1,3,5-триазин-2-ил]амино-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[4-[4-(1,1-диметилэтил)фенил]-6-(метиламино)-1,3,5-триазин-2-ил]амино-N-[2(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[4-(2-фторфенил)-6-(метиламино)-1,3,5-триазин-2-ил]амино-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[4-(4-цианофенил)-6-(метиламино)-1,3,5-триазин-2-ил]амино-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-(4-(метиламино)-6-[4-(метилсульфонил)фенил]-1,3,5-триазин-2-иламино)-N-(2[(трифторметил)окси]фенилметил)циклогексанкарбоксамид; цис-4-[4-(метиламино)-6-(3-пиридинил)-1,3,5-триазин-2-ил]амино-N-(2-[(трифторметил)окси]фенилметил)циклогексанкарбоксамид; цис-4-(4-(метиламино)-6-[4-(трифторметил)фенил]-1,3,5-триазин-2-иламино)-N-(2[(трифторметил)окси]фенилметил)циклогексанкарбоксамид; 3-4-(метиламино)-6-[(цис-4-[(2-[(трифторметил)окси]фенилметил)амино]карбонилциклогексил)амино]-1,3,5-триазин-2-илбензойная кислота; 3-[4-(метиламино)-6-(цис-4-[([4-(метилокси)-2-(трифторметил)фенил]метиламино)карбонил]циклогексиламино)-1,3,5-триазин-2-ил]бензойная кислота; цис-4-(4-(метиламино)-6-[4-(трифторметил)фенил]-1,3,5-триазин-2-иламино)-N-[4-(метилокси)2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[4-(метиламино)-6-(3-пиридинил)-1,3,5-триазин-2-ил]амино-N-[4-(метилокси)-2(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-(4-(метиламино)-6-[4-(метилсульфонил)фенил]-1,3,5-триазин-2-иламино)-N-[4(метилокси)-2-(трифторметил)фенил]метилциклогексанкарбоксамид; 3-[4-(метиламино)-6-(цис-4-[([4-(трифторметил)-3-пиридинил]метиламино)карбонил]циклогексиламино)-1,3,5-триазин-2-ил]бензойная кислота; цис-4-(4-(метиламино)-6-[4-(трифторметил)фенил]-1,3,5-триазин-2-иламино)-N-[4(трифторметил)-3-пиридинил]метилциклогексанкарбоксамид; цис-4-[4-(метиламино)-6-(3-пиридинил)-1,3,5-триазин-2-ил]амино-N-[4-(трифторметил)-3 пиридинил]метилциклогексанкарбоксамид; цис-4-(4-(метиламино)-6-[4-(метилсульфонил)фенил]-1,3,5-триазин-2-иламино)-N-[4(трифторметил)-3-пиридинил]метилциклогексанкарбоксамид; 3-[4-[цис-4-([(2-хлор-4-цианофенил)метил]аминокарбонил)циклогексил]амино-6-(метиламино)1,3,5-триазин-2-ил]бензойная кислота; цис-N-[(2-хлор-4-цианофенил)метил]-4-[4-(метиламино)-6-(3-пиридинил)-1,3,5-триазин-2 ил]аминоциклогексанкарбоксамид; цис-4-(4-[(2-гидроксиэтил)амино]-6-метил-1,3,5-триазин-2-иламино)-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[4-метил-6-(4-метил-1-пиперазинил)-1,3,5-триазин-2-ил]амино-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-(4-метил-6-[(фенилметил)амино]-1,3,5-триазин-2-иламино)-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[(4-метил-6-[2-(метилокси)этил]амино-1,3,5-триазин-2-ил)амино]-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[4-(диметиламино)-6-метил-1,3,5-триазин-2-ил]амино-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[4-метил-6-(1-пиперидинил)-1,3,5-триазин-2-ил]амино-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид; цис-4-[(4-амино-6-метил-1,3,5-триазин-2-ил)амино]-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамид;(цис)-N-[4-циано-2-(трифторметил)фенил]метил-3-[4-метил-6-(метиламино)-1,3,5-триазин-2 ил]аминоциклогексанкарбоксамид. Получение соединения. Соединения, отвечающие формуле I, получают путем традиционных органических синтезов. Подходящие пути синтеза описаны ниже на следующих общих схемах реакции. Все функциональные группы имеют значения, указанные в формуле I, если не обусловлено иначе. Исходные материалы и реагенты,указанные ниже, коммерчески доступны или могут быть получены из коммерчески доступных исходных материалов с применением известных специалистам способов. Специалист должен учитывать, что, если указанный здесь заместитель несовместим с описанными здесь способами синтеза, заместитель может быть защищен подходящей защитной группой, которая является стабильной в условиях реакции. Защитная группа может быть удалена в подходящий момент в реакционной последовательности, чтобы обеспечить желательное промежуточное соединение или целевое соединение. Соответствующие защитные группы и способы защиты и устранения защиты различных заместителей, для защиты которых использованы соответствующие защитные группы, хорошо известны специалистам, примеры групп можно найти в Т. Greene and P. Wuts, Protecting Groups in Chemical Synthesis (3rd ed.) John WileySons, NY (1999). В некоторых случаях заместитель может быть специфически выбран, чтобы он был реакционноспособен в используемых условиях реакции. При таких обстоятельствах условия реакции превращают выбранный заместитель в другой заместитель, который или применим в качестве промежуточного соединения, или является желательным заместителем в целевом соединении. Схема 1 представляет общую схему реакции получения промежуточного соединения 1.7. Bocзащищенная аминокислота 1.1 может быть получена обработкой соответствующей аминокислоты (коммерчески доступной или полученной из коммерчески доступных исходных материалов с применением способов, известных специалистам) Boc2O и основанием (таким как NaOH) в растворителе (таком как 1,4-диоксан и вода) при температурах между 0 и 50C. Когда нужно, чтобы R4 был R41 или R42, алкилирование Boc-защищенной аминокислоты 1.1 с использованием R4-галогенида (коммерчески доступного или полученного из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) и основания (такого как NaH) в растворителе (таком как DMF) при температурах между 0 и 50C обеспечивает Boc-защищенную аминокислоту 1.2. Амидное промежуточное соединение 1.4 может быть получено обработкой промежуточных соединений 1.1 или 1.2 амином 1.3 (коммерчески доступным или полученным из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) и амидным реагентом сочетания (таким как EDCl или ВОР) в растворителе (таком как DMF) при комнатной температуре. Гидролиз Boc-защитной группы промежуточного соединения 1.4 может быть осуществлен с применением TFA, чтобы обеспечить промежуточное соединение 1.5. Дихлортриазиновое промежуточное соединение 1.6 может быть синтезировано путем обработки цианурхлорида (коммерчески доступный) 1 экв. промежуточного соединения 1.5 и основанием (таким как NaOH или основание Хюнига) в растворителе (таком как MeCN и вода) при 0C. Последующее добавление 1 экв. HNR5R6 (коммерчески доступного или полученного из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) и основания (такого как NaOH или основание Хюнига) в растворителе (таком как MeCN и вода) при температурах между 25 и 50C обеспечивает монохлортриазин 1.7. Схема 2 Схема 2 представляет общую схему реакции получения некоторых соединений, отвечающих формуле I. Монохлортриазин 2.1 (указанный выше как промежуточное соединение 1.7) может быть обработан YB(OH)2 (коммерчески доступным или полученным из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области), источником палладия (таким какPdCl2 (dppf)2) и основанием (таким как K2CO3) в растворителе (таком как THF) при температурах между 80 и 170C (термическое или микроволновое нагревание), чтобы обеспечить соединения, отвечающие формуле I, где Y означает R7, R8, R9, R10 или R11. Схема 3 представляет общую схему реакции получения некоторых соединений, отвечающих формуле I. Boc-защищенная аминокислота 3.1 может быть получена обработкой соответствующей аминокислоты (коммерчески доступной или полученной из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) Boc2O и основанием (таким как NaOH) в растворителе (таком как 1,4-диоксан и вода) при температурах между 0 и 50C. Когда нужно, чтобы R4 был R41 или R42, алкилирование Boc-защищенной аминокислоты 3.1 с применением R4-галогенида (коммерчески доступного или полученного из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) и основания (такого как NaH) в растворителе (таком как DMF) при температурах между 0 и 50C обеспечивает Boc-защищенную аминокислоту 3.2. Последующий гидролиз Boc-защищенной группы промежуточного соединения 3.2 может быть осуществлен с применением TFA с образованием аминокислоты 3.3. 2,4-Дихлортриазин 3.4 может быть синтезирован при добавлении 1 экв. соответствующего реагента Гриньяра (коммерчески доступного или полученного из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) к цианурхлориду (коммерчески доступный) в растворителе (таком как THF) при 0C. Промежуточное соединение 3.4 может быть обработано 1 экв. HNR5R6 (коммерчески доступным или полученным из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) и основанием (таким как NaOH или основание Хюнига) в растворителе (таком какMeCN и вода) при температурах между 25 и 50C. Полученное промежуточное соединение 3.5 может быть подвергнуто взаимодействию с избытком аминокислоты 3.3 при повышенной температуре (6090C) в растворителе (таком как MeCN и вода) до получения карбоновой кислоты 3.6. Промежуточное соединение 3.6 может быть обработано амином 3.7 (коммерчески доступным или полученным из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) и реагентом сочетания (таким как EDCl или ВОР) в растворителе (таком как DMF) при комнатной температуре до получения соединений, отвечающих формуле I, где Y означает R7, R8, R9, R10 или R11. Схема 4 представляет общую схему реакции получения некоторых соединений, отвечающих формуле I. 2,4-Дихлортриазин 4.1 может быть синтезирован при добавлении 1 экв. соответствующего реагента Гриньяра (коммерчески доступного или полученного из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) к цианурхлориду (коммерчески доступный) при 0C в растворителе (таком как THF). Промежуточные соединения 4.1 могут быть обработаны 1 экв. амида 4.3 (указанного выше как промежуточное соединение 1.5) и основанием (таким как NaOH или основание Хюнига) в растворителе (таком как MeCN и вода) при температурах между 25 и 50C, чтобы получить монохлортриазин 4.4. Промежуточное соединение 4.4 может быть обработано избытком HNR5R6 (коммерчески доступный или полученный из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) и основанием (таким как(60-80C), чтобы обеспечить соединения, отвечающие формуле I, где Y означает R7, R8, R9, R10 или R11. В качестве варианта, промежуточное соединение 4.1 может быть обработано 1 экв. HNR5R6 (коммерчески доступный или полученный из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области,) и основанием (таким как NaOH или основание Хюнига) в растворителе (таком как MeCN и вода) при температурах между 25 и 50C, до получения монохлортриазина 4.2. Промежуточное соединение 4.2 может быть обработано избытком амида 4.3 и основанием (таким как NaOH или основание Хюнига) в растворителе (таком как MeCN и вода) при повышенной температуре (60-80C), чтобы обеспечить соединения, отвечающие формуле I, где Y означает R7, R8,R9, R10 или R11. Схема 5 Схема 5 представляет общую схему реакции получения некоторых соединений, отвечающих формуле I. Дихлортриазин 5.1 может быть синтезирован обработкой цианурхлорида (коммерчески доступный) 1 экв. HNR5R6 (коммерчески доступный или полученный из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области) и основанием (таким какNaOH или основание Хюнига) в растворителе (таком как MeCN и вода) при 0C. Последующее добавление 1 экв. амида 5.2 (указанного выше как промежуточное соединение 1.5) и основания (такого какNaOH или основание Хюнига) в растворителе (таком как MeCN и вода) при температурах между 25 и 50C дает монохлортриазин 5.3. Промежуточное соединение 5.3 может быть затем обработано избыткомNaY (коммерчески доступный или полученный из коммерчески доступных исходных материалов с применением способов, известных специалистам в этой области), чтобы обеспечить соединения, отвечающие формуле I, где Y означает R12. Примеры Следующие примеры поясняют изобретение. Эти примеры предназначены не для того, чтобы ограничивать сферу действия данного изобретения, но, скорее, чтобы обеспечить руководство для специалиста для получения и применения соединений, композиций и способов по данному изобретению. Хотя и описаны конкретные варианты осуществления данного изобретения, специалист должен иметь в виду,что различные изменения и модификации могут быть сделаны, не выходя за пределы сущности и сферы действия изобретения. Промежуточное соединение 1. цис-4-Амино-N[2-(трифторметил)фенил]метилциклогексанкарбоксамид В колбу с цис-4-аминоциклогексанкарбоновой кислотой (4,3 г, 30 ммоль, 1,0 экв.) добавляли 1,4-диоксан (36 мл). Суспензию охлаждали до 0C и 1,0 н. гидроксид натрия (72 мл, 72 ммоль, 2,4 экв.) добавляли в течение 5 мин. Раствор перемешивали в течение 20 мин при 0C. Раствор бис-(1,1-диметилэтил)дикарбоната (7,87 г, 36,0 ммоль, 1,1 экв.) в 1,4-диоксане (36 мл) добавляли в течение 5 мин. Реакционной смеси давали возможность нагреться до комнатной температуры и перемешивание продолжали в течение ночи. Реакционную смесь охлаждали до 0C и подкисляли (до рН 4) 1,5 М гидросульфатом калия. Желательный продукт экстрагировали этилацетатом (3), сушили с сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 6,55 г (90%) указанного в заголовке соединения.(82 мл) при комнатной температуре добавляли DMAP (301 мг, 2,47 ммоль, 0,2 экв.). Добавляли EDC(2,95 г, 15,4 ммоль, 1,25 экв.) и диизопропилэтиламин (DIEA, 2,7 мл, 15 ммоль, 1,25 экв.). Перемешивание продолжали в течение ночи при комнатной температуре. Раствор разбавляли CH2Cl2 (100 мл), промывали насыщенным бикарбонатом натрия (200 мл), водой (200 мл) и насыщенным раствором соли(200 мл). Экстракты в CH2Cl2 сушили с MgSO4, фильтровали и концентрировали при пониженном давлении, получая указанное в заголовке соединение. К раствору 1,1-диметилэтил цис-4-[([2-(трифторметил)фенил]метиламино)карбонил]циклогексилкарбамата в CH2Cl2 (40 мл) при 0C добавляли предварительно смешанный раствор CH2Cl2(10 мл) и TFA (10 мл). Реакционную смесь перемешивали при 0C в течение 10 мин. Реакционную смесь нагревали до комнатной температуры и перемешивание продолжали в течение 2 ч. Растворитель затем удаляли при пониженном давлении, получая 2,83 г (69% за 2 стадии) указанного в заголовке соединения.MS (ES+): m/e 301,1 [М+Н]+. В качестве варианта, промежуточное соединение 1 может быть синтезировано с применением следующей процедуры. 250 мл круглодонную колбу, заполненную аргоном, снабжали магнитной стержневой мешалкой. В колбу добавляли цис-4-аминоциклогексанкарбоновую кислоту (9,27 г, 64,7 ммоль), изопропанол (83 мл) и 1 н. NaOH (70,6 мл, 70,6 ммоль) при комнатной температуре. После растворения всего твердого вещества добавляли бис-(трет-бутил)дикарбонат (15,54 г, 71,2 ммоль), смесь выдерживали при комнатной температуре в течение 21 ч. Сырую смесь промывали гексанами (3100 мл). После этого 100 мл 1 н. HCl добавляли к водному слою и смесь экстрагировали этилацетатом (300 мл). Органическую фазу сушили надNa2SO4, фильтровали и концентрировали, получая 12,85 г цис-4-([(1,1-диметилэтил)окси]карбониламино)циклогексанкарбоновой кислоты (82%) в виде не совсем белого твердого вещества. Стадия 2. 1,1-Диметилэтилцис-4-[([2-(трифторметил)фенил]метиламино)карбонил]циклогексилкарбамат В 250 мл круглодонную колбу, заполненную аргоном, добавляли цис-4-([(1,1 диметилэтил)окси]карбониламино)циклогексанкарбоновую кислоту (15,54 г,63,9 ммоль),2-(трифторметил) бензиламин (8,95 мл, 63,9 ммоль) и 100 мл DMF. Триэтиламин (26,7 мл, 192 ммоль) добавляли и раствору давали возможность перемешиваться в течение нескольких минут. Затем отдельный раствор гексафторфосфата 1 Н-1,2,3-бензотриазол-1-илокси-трис-(диметиламино)фосфония (ВОР реагент, 28,3 г, 63,9 ммоль), растворенного в 60 мл DMF, добавляли к смеси при комнатной температуре. Реакционную смесь перемешивали в течение 2 ч и затем выливали в энергично перемешиваемую смесь насыщенного бикарбоната натрия и воды (1:1, 1,6 л). В результате этого происходило осаждение желательного продукта в виде не совсем белого твердого вещества. Твердое вещество извлекали вакуумным фильтрованием и сушили в течение 24 ч в вакууме, получая 24,88 г 1,1-диметилэтилцис-4-[([2(трифторметил)фенил]метиламино)карбонил]циклогексилкарбамата (62,1 ммоль, 97%). В 500-миллилитровую круглодонную колбу, снабженную магнитной стержневой мешалкой, загружали 1,1-диметилэтилцис-4-[([2-(трифторметил)фенил]метиламино)карбонил]циклогексилкарбамат(24,88 г, 62,1 ммоль) и дихлорметан (100 мл). Трифторуксусную кислоту (100 мл) добавляли медленно и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Летучие компоненты удаляли в роторном испарителе и сырое масло растворяли в этилацетате и промывали насыщенным раствором бикарбоната натрия (3200 мл). Органическую фазу сушили над Na2SO4, фильтровали и концентрировали, получая 18,3 г указанного в заголовке соединения (98%) в виде не совсем белого твердого вещества. Промежуточное соединение 2 получали, используя общую процедуру, описанную выше в синтезе промежуточного соединения 1, заменяя 2-[(трифторметил)окси]бензиламином 2-(трифторметил)бензиламин. К раствору 4-амино-2-хлорбензонитрила (5 г, 32,8 ммоль) и пиридина (3,18 мл, 39,3 ммоль) в дихлорметане (DCM) (75 мл) добавляли метансульфонилхлорид (4,50 г, 39,3 ммоль) медленно при 0C в атмосфере N2. После добавления смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь обрабатывали 50 мл 2 н. NaOH. Слои разделяли. Водный слой подкисляли конц. до рН 2, что имело результатом осаждение продукта. Твердые вещества отфильтровывали, промывали водой и сушили, получая желательный продукт в виде белого твердого вещества (7,0 г, 93%). В трехгорлую круглодонную колбу, содержащую при 0C раствор LiAlH4 (2 M в THF) (26,0 мл,52,0 ммоль), добавляли йод (6,60 г, 26,0 ммоль) в THF (20 мл) по каплям в атмосфере N2. После добавления смесь перемешивали в течение 30 мин при 0C. Затем N-(3-хлор-4-цианофенил)метансульфонамид(4 г, 17,34 ммоль) в THF (20 мл) добавляли по каплям. После добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч, в это время осадок выпадал из раствора. Реакционную смесь фильтровали и осадок промывали холодным THF. Осадок осторожно переносили в стакан, который содержал 60 мл THF. Смесь подкисляли до рН 2 6 н. HCl при постоянном перемешивании при 0C. Слои разделяли и водный слой промывали DCM (30 мл). Водный слой концентрировали в роторном испарителе. Полученные твердые вещества промывали холодным МеОН, получая желтое твердое вещество. Маточную жидкость подвергали такой же переработке (2). Объединенные переработанные фракции собирали и сушили, получая указанное в заголовке соединение в виде соли с HCl (4,2 г,89%). Смесь 4-амино-2-хлорбензонитрила (1 г, 6,55 ммоль), йодметана (7,44 г, 52,4 ммоль) и карбоната цезия (4,27 г, 13,11 ммоль) в ацетонитриле (10 мл) нагревали до 100C в герметичной пробирке. После перемешивания в течение ночи к смеси добавляли воду (15 мл), затем EtOAc (25 мл). Органический слой разделяли и водный повторно экстрагировали EtOAc (25 мл). Органические вещества сушили над Na2SO4 и удаляли. Колоночная хроматография (EtOAc/гексаны=0-40%) давала желательный продукт в виде белого твердого вещества (0,76 г, 64%).LiAlH4/I2 в THF (8,41 мл, 8,41 ммоль, который готовили на стадии 2 получения промежуточного соединения 3). Смесь перемешивали в течение 10 мин, в это время LCMS показывала образование желательного продукта. К смеси добавляли воду (15 мл) и подкисляли до рН 2 6 н. HCl. Водный слой разделяли и промывали Et2O (225 мл). Водный слой затем подщелачивали 6 н. NaOH и экстрагировали Et2O(330 мл). Органические вещества сушили над Na2SO4. Слой простого эфира удаляли до 1/3 объема, в это время 8 мл 1 М HCl добавляли в раствор простого эфира. После перемешивания в течение 10 мин твердые вещества осаждались из раствора. Твердые вещества отфильтровывали, промывали простым эфиром и сушили, получая указанное в заголовке соединение (1,0 г, 92%) в виде светло-желтого твердого вещества.(25-28%, 370 мл, 5,20 моль, 80 экв.) и МеОН (300 мл) добавляли Ni Ренея (3,8 г, 65 ммоль, 1,0 экв.). Колбу подсоединяли к водородному баллону и смесь перемешивали в течение 7 суток при комнатной температуре. Реакционную смесь фильтровали через слой целлита и фильтрат концентрировали. Остаток очищали HPLC, получая 9 г (64%) указанного в заголовке соединения в виде трифторацетатной соли. Смесь 3-хлор-4-метилбензонитрила (7,5 г, 50 ммоль, 1,0 экв.), N-бромсукцинимида (9,14 г,52 ммоль, 1,1 экв.) и азо-бис-изобутиронитрила (AIBN, 0,82 г, 5 ммоль, 0,1 экв.) в тетрахлориде углерода нагревали до температуры кипения с возвращением флегмы в течение 25 ч. Добавляли воду (50 мл) и продукт экстрагировали CH2Cl2. Органические слои промывали водой, сушили с MgSO4 и выпаривали,получая 11,3 г указанного в заголовке соединения. Этот материал использовали на следующей стадии без очистки. Стадия 2. 4-(Аминометил)-3-хлорбензонитрил К смеси 4-(бромметил)-3-хлорбензонитрила (11 г, 49 ммоль, 1,0 экв.) и 6 М NH3 в метаноле (200 мл) перемешивали при 18C в течение 17 ч. Водную HCl (1 М, 200 мл) добавляли и водный слой промывали этилацетатом. Водную фазу доводили до рН 9-10 1 М NaOH и экстрагировали этилацетатом. Органический слой промывали водой, сушили с сульфатом магния и концентрировали. Остаток очищали на силикагеле, получая 2,71 г указанного в заголовке соединения.(600 мл, 3,0 моль, 54 экв.) добавляли Ni Ренея (3,0 г, 52 ммоль, 0,95 экв.). Колбу подсоединяли к водородному баллону и смесь перемешивали в течение 16 ч. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток очищали HPLC, получая 10,5 г (47%) указанного в заголовке соединения в виде бис-трифторацетатной соли. Промежуточное соединение 8 получали, используя общую процедуру, описанную выше в синтезе промежуточного соединения 1, заменяя N-[4-(аминометил)-3-хлорфенил]метансульфонамидом 2-(трифторметил)бензиламин. Промежуточное соединение 9 получали, используя общую процедуру, описанную выше в синтезе промежуточного соединения 1, заменяя 1-[4-(метилокси)-2-(трифторметил)фенил]метанамином Промежуточное соединение 10 получали, используя общую процедуру, описанную выше в синтезе промежуточного соединения 1, заменяя 4-(аминометил)-3-хлорбензонитрилом 2-(трифторметил)бензиламин. Промежуточное соединение 11 получали, используя общую процедуру, описанную выше в синтезе промежуточного соединения 1, заменяя 1-[4-(трифторметил)-3-пиридинил]метанамином 2-(трифторметил)бензиламин. К раствору 2,4,6-хлор-1,3,5-триазина (307 мг, 1,66 ммоль, 1,00 экв.) в CH2Cl2 (6 мл) при -50C добавляли предварительно смешанный раствор диизопропилэтиламина (DIEA, 1,45 мл, 8,30 ммоль,5,00 экв.) и промежуточного соединения 1 (500 мг, 1,66 ммоль, 1,00 экв.) в CH2Cl2 (3 мл). Реакционной смеси давали возможность нагреться до комнатной температуры и перемешивали в течение 3 ч. Указанное в заголовке соединение получали и переносили далее по ходу процесса без дополнительной переработки или очистки. Предварительно смешанный раствор диизопропилэтиламина (DIEA, 0,872 мл, 4,98 ммоль, 3 экв.) и метиламина (0,830 мл, 1,66 ммоль, 1 экв.) в CH2Cl2 (3 мл) добавляли по каплям к сырой реакционной смеси, полученной на стадии 1. Смесь перемешивали в течение 3 ч. Летучие компоненты удаляли при пониженном давлении, получая 695 мг (94%) указанного в заголовке соединения. Часть этого материала подвергали очистке путем HPLC с обращенной фазой и остальное использовали без очистки. К раствору 2,4,6-трихлор-1,3,5-триазина (20 г, 108 ммоль, 1,0 экв.) в THF (8 мл) при -10 C добавляли по каплям бромид метилмагния (45 мл, 135 ммоль, 1,25 экв.). Реакционной смеси давали возможность нагреться до комнатной температуры и перемешивали в течение 2 ч. Смесь выливали в воду со льдом и перемешивали в течение дополнительного 1 ч. Продукт экстрагировали этилацетатом, промывали насы- 16018414 щенным раствором соли, сушили с сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 14 г указанного в заголовке соединения. Сырой продукт переносили на следующую стадию. К раствору промежуточного соединения 6 (0,1 г, 0,600 ммоль) и триметилсилилазида (0,159 мл,1,200 ммоль) в толуоле (5 мл) добавляли оксид дибутилолова (0,015 г, 0,060 ммоль). Смесь перемешивали в течение ночи при 100C, в это время LCMS показывала, что реакция завершена. Реакционную смесь подвергали вакуумному фильтрованию. Осадок на фильтре промывали холодным МеОН и сушили, получая указанное в заголовке соединение в виде светло-коричневого твердого вещества (0,08 г, 63,6%). К суспензии NaH (1,0 г, 41 ммоль, 2,5 экв.) в DMF (30 мл) при -10C добавляли цис-4-([(1,1 диметилэтил)окси]карбониламино)циклогексанкарбоновую кислоту (4,0 г, 16 ммоль, 1,0 экв.). Реакционной смеси давали возможность нагреться до комнатной температуры и затем перемешивали в течение 1 ч. Смесь снова охлаждали до -10C и добавляли по каплям MeI (25 г, 260 ммоль, 16 экв.). Холодную баню удаляли и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Смесь выливали на лед и затем добавляли NaOH (1,5 г), чтобы гидролизовать нежелательный метиловый сложный эфир, который образовался. Этот раствор перемешивали в течение еще 4 ч. Водный слой промывали этилацетатом и концентрировали при пониженном давлении, чтобы удалить DMF. Полученный остаток разбавляли водой и рН доводили до 3-4. Желательный продукт, осажденный в виде белого твердого вещества, собирали фильтрованием (2,5 г). Стадия 3. цис-4-(Метиламино)циклогексанкарбоновая кислота(2,5 г, 16 ммоль, 1,0 экв.) и 1 М HCl в диоксане (15 мл) нагревали до кипения с возвращением флегмы в течение 4 ч. Растворитель удаляли при пониженном давлении, получая 1,3 г указанного в заголовке соединения. Этот материал использовали без очистки. Промежуточное соединение 17. цис-4-Амино-N-[(2,4-дихлорфенил)метил]циклогексанкарбоксамид Промежуточное соединение 17 получали, используя общую процедуру, описанную выше в синтезе промежуточного соединения 1, заменяя [(2,4-дихлорфенил)метил]амином 2-(трифторметил)бензиламин. Промежуточное соединение 18 получали, используя общую процедуру, описанную выше в синтезе промежуточного соединения 15, заменяя 2-[(трифторметил)окси]бензиламином 2-(трифторметил)бензиламин. К смеси 2,4-дихлор-6-метил-1,3,5-триазина (2,291 г, 13,97 ммоль) и метиламина (6,98 мл,13,97 ммоль) добавляли 1 н. NaOH по каплям, чтобы поддерживать рН 10. Реакционную смесь перемешивали в течение 30 мин. Затем 3-аминоциклогексанкарбоновую кислоту (2,0 г, 13,97 ммоль) добавляли одной порцией и 1 н. NaOH добавляли по каплям, чтобы поддерживать рН 10. Реакционную смесь нагревали до 70C в течение ночи. Реакционную смесь охлаждали и очищали непосредственно препаративной 5-Бром-2-йодфенил трифторметиловый простой эфир (500 мг, 1,37 ммоль) растворяли в 10 мл безводного THF и охлаждали до -70C. Затем н-бутиллитий (0,55 мл 2,5 М раствора, 1,37 ммоль) добавляли по каплям в течение 30 мин. DMF (0,19 мл, 2,74 ммоль) добавляли и реакционную смесь перемешивали в течение 30 мин при -70C и затем давали возможность ей нагреться до 0C и перемешивали в течение 3 ч. Реакцию гасили 5 мл насыщенного раствора хлорида аммония и экстрагировали этилацетатом. Органический слой промывали водой, сушили над сульфатом магния, фильтровали и концентрировали, получая 4-бром-2-[(трифторметил)окси]бензальдегид (100 мг, 0,37 ммоль, 27%) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-D6):10,1 (с, 1 Н), 7,9 (с, 3 Н). Стадия 2. 1-4-Бром-2-[(трифторметил)окси]фенилметанамин 4-Бром-2-[(трифторметил)окси]бензальдегид (3 г, 11,2 ммоль) растворяли в 100 мл 5 М раствора аммиака в метаноле и перемешивали в течение ночи, после чего реакционную смесь обрабатывали боргидридом натрия (858 мг, 22,5 ммоль) и перемешивали при комнатной температуре в течение четырех суток. Реакцию гасили добавлением 20 мл воды и перемешивали в течение 30 мин. Летучие вещества удаляли и остаток экстрагировали метиленхлоридом (320 мл). Метиленхлорид выпаривали, получая желтое масло, которое очищали препаративной HPLC, получая соль TFA 1-4-бром-2[(трифторметил)окси]фенилметанамина (900 мг, 3,3 ммоль, 29%) в виде белого твердого вещества. 4-Метил-3-(трифторметил)бензонитрил (10 г, 54 ммоль) растворяли в 200 мл тетрахлорида углерода и обрабатывали N-бромсукцинимидом (10,5 г, 59 ммоль) и бензоилпероксидом (1,3 г, 0,54 ммоль). Реакционную смесь нагревали до температуры кипения с возвращением флегмы и перемешивали в течение одной недели. Затем 80 мл воды добавляли и слои разделяли. Водный слой экстрагировали метиленхлоридом (250 мл). Объединенные органические слои промывали водой (250 мл), сушили над сульфатом магния и концентрировали, получая 4-(бромметил)-3-(трифторметил)бензонитрил (14 г, 53 ммоль) в виде желтого масла, которое использовали на следующей стадии без дополнительной очистки. Стадия 2. 4-(Аминометил)-3-(трифторметил)бензонитрил 4-(Бромметил)-3-(трифторметил)бензонитрил (14 г) растворяли в 500 мл 5 М раствора аммиака в метаноле и перемешивали в течение 24 ч при комнатной температуре. Растворитель удаляли в вакууме, получая желтое твердое вещество, которое растворяли в 1 М HCl и экстрагировали диэтиловым простым эфиром (330 мл). Водный слой затем доводили до рН 9-10 1 М(380 мл). Это давало 4-(аминометил)-3(трифторметил)бензонитрил (4,7 г, 23 ммоль, 43%) в виде желтого твердого вещества. В сосуд для микроволновой обработки загружали PdCl2(dppf)2 (27,7 мг, 0,0339 ммоль, 0,2 экв.) и 3-пиридинилбороновую кислоту (52,0 мг, 0,423 ммоль, 2,5 экв.). Добавляли предварительно смешанный раствор THF (2,1 мл) и промежуточного соединения 13 (75 мг, 0,17 ммоль, 1,0 экв.) с последующим добавлением 0,6 М водного карбоната калия (2,8 мл, 1,7 ммоль, 10 экв.). Реакционную смесь нагревали с помощью микроволнового реактора в течение 20 мин при 150C. Реакционную смесь разбавляли водойNa2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали HPLC с обращенной фазой, получая 7,2 мг (8,8%) указанного в заголовке соединения. В сосуд для микроволновой обработки загружали ацетат палладия(II) (0,38 мг, 0,0017 ммоль,0,01 экв.), трициклогексилфосфин (0,95 мг, 0,0034 ммоль, 0,02 экв.) и фенилбороновую кислоту (30,9 мг,0,253 ммоль, 1,5 экв.). Раствор 1,4-диоксана (0,86 мл) и промежуточного соединения 1 (75 мг, 0,17 ммоль,1 экв.) добавляли с последующим добавлением раствора воды (0,13 мл) и трехосновного фосфата калия(71,7 мг, 0,338 ммоль, 2 экв.). Реакционную смесь нагревали с помощью микроволнового реактора в те- 19018414 чение 20 мин при 150C. Реакционную смесь разбавляли водой (5 мл) и экстрагировали 3 раза этилацетатом (5 мл). Экстракты в этилацетате объединяли, сушили с Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали HPLC с обращенной фазой, получая 4,3 мг (5,3%) указанного в заголовке соединения.MS (ES+): m/e 485,1 [М+Н]+. В качестве варианта, пример 2 может быть получен согласно процедуре ниже. Стадия 1. 2,4-Дихлор-6-фенил-1,3,5-триазин Бромид фенилмагния (97,6 мл 1,0 М раствора в THF, 97,6 ммоль, 1,0 экв.) добавляли по каплям к раствору в THF (8 мл) цианурхлорида (18,0 г, 97,6 ммоль, 1,0 экв.) при 0C. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, выливали на лед и перемешивали в течение 30 мин. Продукт экстрагировали этилацетатом и объединенные органические слои промывали (насыщ.) хлоридом натрия, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении, получая 16 г указанного в заголовке соединения. Сырой продукт переносили вперед по процессу без очистки. Стадия 2. 4-Хлор-N-метил-6-фенил-1,3,5-триазин-2-амин К охлажденному (0C) раствору 2,4-дихлор-6-фенил-1,3,5-триазина (16,0 г, 70,8 ммоль, 1,00 экв.),растворенного в смеси 1:1 CH3CN:H2O (80 мл), добавляли NH2Me (8,00 г, 27,5% раствор в Н 2 О,70,8 ммоль, 1,00 экв.). Раствор обрабатывали 1 н. NaOH для поддержания рН 9-10 и перемешивали в течение 15 мин. Полученную суспензию разбавляли водой и фильтровали, получая 12 г сырого продукта. Часть этого материала (8 г) очищали HPLC с обращенной фазой, получая 3,6 г указанного в заголовке соединения. К смеси промежуточного соединения 1 (2,04 г, 6,80 ммоль) и диизопропилэтиламина (3,55 мл,20,4 ммоль) в ацетонитриле (100 мл) добавляли 4-хлор-N-метил-6-фенил-1,3,5-триазин-2-амин (1,5 г,6,8 ммоль). Смесь нагревали при температуре кипения с возвращением флегмы в течение 18 ч. Растворитель выпаривали и остаток растворяли в DMF, подкисляли TFA и очищали HPLC с обращенной фазойMS (ES+): m/e 485,1 [М+Н]+. Загрязненные фракции HPLC объединяли и повторно очищали HPLC, получая дополнительный продукт (0,6 г, чистота 99%, выход 14,8%). Пример 5 получали, используя общую процедуру, описанную выше в примере 2, заменяя 2 фторфенилбороновой кислотой фенилбороновую кислоту. Пример 7 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 2 промежуточное соединение 1 и [4-(метилсульфонил)фенил]бороновой кислотой фенилбороновую кислоту. Пример 8 получали, используя общую процедуру, описанную выше в примере 1, заменяя промежуточным соединением 2 промежуточное соединение 1. Пример 9 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 2 промежуточное соединение 1 и [4-(трифторметил)фенил]бороновой кислотой фенилбороновую кислоту. Пример 10 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 2 промежуточное соединение 1 и 3-(дигидроксиборанил)бензойной кислотой фенилбороновую кислоту. Пример 11 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 9 промежуточное соединение 1 и 3-(дигидроксиборанил)бензойной кислотой фенилбороновую кислоту. Пример 12 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 9 промежуточное соединение 1 и [4-(трифторметил)фенил]бороновой кислотой фенилбороновую кислоту. Пример 13 получали, используя общую процедуру, описанную выше в примере 1, заменяя промежуточным соединением 9 промежуточное соединение 1. Пример 14 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 9 промежуточное соединение 1 и [4-(метилсульфонил)фенил]бороновой кислотой фенилбороновую кислоту. Пример 15 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 11 промежуточное соединение 1 и 3-(дигидроксиборанил)бензойной кислотой фенилбороновую кислоту. Пример 16 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 11 промежуточное соединение 1 и [4-(трифторметил)фенил]бороновой кислотой фенилбороновую кислоту. Пример 17 получали, используя общую процедуру, описанную выше в примере 1, заменяя промежуточным соединением 11 промежуточное соединение 1. Пример 18 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 11 промежуточное соединение 1 и [4-(метилсульфонил)фенил]бороновой кислотой фенилбороновую кислоту. Пример 19 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 10 промежуточное соединение 1 и 3-(дигидроксиборанил)бензойной кислотой фенилбороновую кислоту. Пример 20 получали, используя общую процедуру, описанную выше в примере 1, заменяя промежуточным соединением 10 промежуточное соединение 1. К раствору цис-4-амино-N-[2-(трифторметил)фенил]метилциклогексанкарбоксамида (90 мг,0,30 ммоль, 1,0 экв.) в ацетонитриле (12 мл) при комнатной температуре добавляли промежуточное соединение 13 (49 мг, 0,30 ммоль, 1,0 экв.) и диизопропилэтиламин (DIEA, 35 мг, 0,30 ммоль, 1,0 экв.). Реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Растворитель удаляли при пониженном давлении и остаток очищали на силикагеле, используя 25% этилацетат/петролейный простой эфир, получая 100 мг желтого твердого вещества (выход 78%).(15 мг, 0,25 ммоль, 1,5 экв.) и карбоната калия (34 мг, 0,25 ммоль, 1,0 экв.) в ацетонитриле (3 мл) нагревали до кипения с возвращением флегмы в течение 16 ч. Растворитель удаляли при пониженном давлении и остаток экстрагировали CH2Cl2 и промывали водой. Органический слой сушили над сульфатом натрия и концентрировали. Остаток очищали HPLC с обращенной фазой, получая указанное в заголовке соединение. К раствору промежуточного соединения 13 (500 мг, 3,07 ммоль) в CH3CN/H2O (15 мл) добавляли 25-30% раствор метиламина (300 мкл, 3,07 ммоль) в воде. Смесь охлаждали до 0C и рН доводили до 9-10 1 М NaOH. рН поддерживали при 9-10 в течение 0,5 ч. Течение реакции отслеживали путем LCMS и смесь использовали на следующей стадии без переработки. К смеси 4-хлор-N-6-диметил-1,3,5-триазин-2-амина (485 мг, 3,07 ммоль) добавляли 3-аминоциклогексанкарбоновую кислоту (527 мг, 3,68 ммоль) при 0C. Смеси давали возможность нагреться до к.т. рН поддерживали между 9 и 10 в течение 3 ч. Смесь концентрировали и продукт очищалиHPLC, получая 0,6 г (2,26 ммоль, выход 74%) желательного продукта в виде белого твердого вещества.(100 мг, 0,377 ммоль) добавляли [(2,4-дихлорфенил)метил]амин (82 мг, 0,47 ммоль), DMAP (10 мг,0,08 ммоль) и EDCl (108 мг, 0,56 ммоль). Смесь перемешивали при комнатной температуре в течение 4 ч. Смесь фильтровали и фильтрат концентрировали. Сырой продукт очищали HPLC, получая 55 мг(0,13 ммоль, выход 35%) желательного материала в виде единственного главного рацемического диастереомера.MS (ES+): m/e 423,0 [М+Н]+. В качестве варианта, пример 28 может быть получен следующим способом. Стадия l. 3-([(1,1-Диметилэтил)окси]карбониламин)циклогексанкарбоновая кислота К суспензии 3-аминоциклогексанкарбоновой кислоты (10 г, 69,8 ммоль) в 1,4-диоксане (100,0 мл) добавляли 1 н. NaOH (41,9 мл, 105 ммоль). После перемешивания в течение 10 мин смесь превращалась в прозрачный раствор и к реакционной смеси добавляли бис-(1,1-диметилэтил)дикарбонат (21,08 мл,91 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Полученные твердые вещества подвергали вакуумному фильтрованию и затем повторно растворяли в воде (150 мл). Водный материал подкисляли (рН 4) 3 н. HCl и затем экстрагировали (2100 мл) DCM. Органические вещества сушили над Na2SO4 и удаляли, получая указанное в заголовке соединение в виде белого порошка (17,0 г, 100%). Стадия 2. 3-Амино-N-[(2,4-дихлорфенил)метил]циклогексанкарбоксамид(5,53 мл, 41,1 ммоль) и ВОР (18,18 г, 41,1 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Насыщенный раствор NaHCO3 (300 мл) добавляли к реакционной смеси, что вызывало образование белого осадка через 10 мин. Осадок подвергали вакуумному фильтрованию, промывали водой и сушили. Твердые вещества суспендировали в DCM (50 мл) и обрабатывали TFA (10 мл). После перемешивания в течение 2 ч реакционную смесь охлаждали до 0C, подщелачивали 6 н. NaOH до рН 10 и затем экстрагировали DCM (3100 мл). Органические вещества сушили (Na2SO4) и удаляли, получая промежуточное соединение 14 (6,2 г, 50%) в виде белого твердого вещества. К смеси 3-амино-N-[(2,4-дихлорфенил)метил]циклогексанкарбоксамида (5,00 г, 16,60 ммоль) в тетрагидрофуране (THF) (207 мл) добавляли промежуточное соединение 13 (2,72 г, 16,60 ммоль). DIEA(3,62 мл, 20,75 ммоль) затем добавляли по каплям. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, в этот момент LCMS показывала желательное промежуточное соединение. Затем метиламин (41,5 мл, 83 ммоль) добавляли к реакционной смеси, которую нагревали до 45C и перемешивали в течение ночи. LCMS показывала превращение в желательный продукт. Реакционную смесь выпаривали в вакууме и затем гранулировали в ацетонитриле (100 мл). Твердые вещества отфильтровывали и сушили, получая свободное основание в виде белого твердого вещества. Твердые вещества растворяли в ДМСО и TFA и подвергали очистке путем HPLC с обращенной фазой, получая указанное в заголовке соединение (2,0 г, 22%) в виде белого твердого вещества. Относительную стереохимию главного изомера определяли как цис путем 2D ЯМР. Пример 32 получали, используя общую процедуру, описанную выше в примере 28, заменяя промежуточным соединением 3 [(2,4-дихлорфенил)метил]амин на стадии 3. Пример 33 получали, используя общую процедуру, описанную выше в примере 28, заменяя промежуточным соединением 4 [(2,4-дихлорфенил)метил]амин на стадии 3. Пример 34 получали, используя общую процедуру, описанную выше в примере 28, заменяя промежуточным соединением 6 [(2,4-дихлорфенил)метил]амин на стадии 3. Пример 35 получали, используя общую процедуру, описанную выше в примере 28, заменяя промежуточным соединением 14 [(2,4-дихлорфенил)метил]амин на стадии 3. Пример 36 получали, используя общую процедуру, описанную выше в примере 28, заменяя промежуточным соединением 7 [(2,4-дихлорфенил)метил]амин на стадии 3. Пример 37 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 15 промежуточное соединение 1 и 2-фторфенилбороновой кислотой фенилбороновую кислоту. Пример 38 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 15 промежуточное соединение 1 и 4-фторфенилбороновой кислотой фенилбороновую кислоту. Пример 39 получали, используя общую процедуру, описанную выше в примере 2, заменяя промежуточным соединением 15 промежуточное соединение 1 и 4-цианофенилбороновой кислотой фенилбороновую кислоту. Пример 40 получали, используя общую процедуру, описанную выше в примере 28, заменяя цис-4-аминоциклогексанкарбоновой кислотой 3-аминоциклогексанкарбоновую кислоту на стадии 2 и 1-[2-(трифторметил)фенил]метанамином [(2,4-дихлорфенил)метил]амин на стадии 3. Пример 41 получали, используя общую процедуру, описанную выше в примере 28, заменяя цис-4-аминоциклогексанкарбоновой кислотой 3-аминоциклогексанкарбоновую кислоту на стадии 2 и 1-2-[(трифторметил)окси]фенилметанамином [(2,4-дихлорфенил)метил]амин на стадии 3. Пример 42 получали, используя общую процедуру, описанную выше в примере 28, заменяя цис-4-аминоциклогексанкарбоновой кислотой 3-аминоциклогексанкарбоновую кислоту на стадии 2. Пример 43 получали, используя общую процедуру, описанную выше в примере 28, заменяя цис-4-аминоциклогексанкарбоновой кислотой 3-аминоциклогексанкарбоновую кислоту на стадии 2 и 1-[4-хлор-2-(трифторметил)фенил]метанамином [(2,4-дихлорфенил)метил]амин на стадии 3. Пример 44 получали, используя общую процедуру, описанную выше в примере 28, заменяя цис-4-аминоциклогексанкарбоновой кислотой 3-аминоциклогексанкарбоновую кислоту на стадии 2 и 1-2-[(трифторметил)тио]фенилметанамином [(2,4-дихлорфенил)метил]амин на стадии 3.
МПК / Метки
МПК: A61K 31/53, A01N 43/66
Метки: ингибиторы, применение
Код ссылки
<a href="https://eas.patents.su/30-18414-ingibitory-seh-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы seh и их применение</a>
Предыдущий патент: Фармацевтические композиции на основе катехоламиновых производных и их применение
Следующий патент: Фармацевтическая композиция, набор и способ лечения гематологического злокачественного новообразования
Случайный патент: Микрополосковый диплексер












