Производные пиридо[2,3-d]пиримидина, их получение, их применение в терапии
Номер патента: 14312
Опубликовано: 29.10.2010
Авторы: Мюно Клод, Казелла Пьер, Перро Пьер, Бурри Бернар, Жегам Самир
Формула / Реферат
1. Соединение формулы (1)
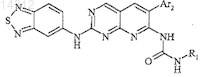
отличающееся тем, что Ar2 и R1 обозначают соответственно
2,6-дихлорфенил и трет-бутил, или
2-бром-6-хлорфенил и трет-бутил, или
2,6-дихлорфенил и этил, или
2,6-дибромфенил и трет-бутил, или
2,6-дибромфенил и этил, или
2,6-дихлорфенил и фенил, или
3,5-диметоксифенил и трет-бутил, или
фенил и трет-бутил, или
2,6-диметилфенил и трет-бутил, или
2,6-дифторфенил и трет-бутил, или
2,6-дихлорфенил и изопропил.
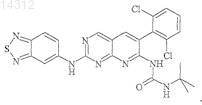
2. Соединение по п.1, отличающееся тем, что им является
3. Соединение по любому из пп.1 или 2, отличающееся тем, что оно находится в форме нехиральной, или рацемической, или обогащенной стереоизомером, или обогащенной энантиомером; тем, что оно возможно превращено в соль и тем, что оно возможно является гидратированным или сольватированным.
4. Фармацевтическая композиция для профилактики или лечения нарушений, вызванных или обостренных пролиферацией клеток, отличающаяся тем, что она содержит соединение по любому из пп.1-3, а также по меньшей мере один фармацевически приемлемый эксципиент.
5. Фармацевтическая композиция по п.4, отличающаяся тем, что она дополнительно содержит по меньшей мере одно противораковое активное соединение.
6. Лекарственное средство для профилактики или лечения нарушений, вызванных или обостренных пролиферацией клеток, отличающееся тем, что оно содержит соединение по любому из пп.1-3, или соль присоединения этого соединения с фармацевтически приемлемой кислотой, или гидрат или сольват указанного соединения.
7. Применение соединения формулы (1) по любому из пп.1-3 в качестве противоракового агента.
8. Применение соединения по любому из пп.1-3 для производства лекарственного средства для профилактики или лечения нарушений, вызванных или обостренных пролиферацией клеток.
9. Применение по п.8 для лечения или профилактики лейкемий, солидных опухолей, первичных или метастатических карцином и рака.
10. Способ получения соединения формулы (1) по п.1, отличающийся тем, что вводят во взаимодействие соединение формулы

в которой R1 и Ar2, такие как определены в п.1, с амином формулы
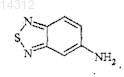
11. Способ получения соединения по п.1, отличающийся тем, что вводят во взаимодействие:
(i) соединение формулы

в которой R10 обозначает исходную группу, такую как: (а) галоген или (b) алкил-S(О)m-, где m=0, 1 или 2; и R11 обозначает NHC(О)-NH-R1; и
(ii) амин формулы
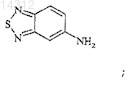
в котором:
a) если R10 обозначает галоген или алкил-S(О)m-, где m=2, взаимодействие проводят в растворителе, предпочтительно полярном, при температуре от комнатной температуры до температуры кипения растворителя;
b) если R10 обозначает алкил-S(O)m-, где m=0 или 1, взаимодействие осуществляют с расплавом соединения
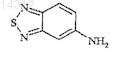
или с соединением формулы

в котором аминогруппа предварительно превращена в соль или защищена.
12. Способ по п.11, отличающийся тем, что в формуле IIb R10 представляет собой галоген.
Текст
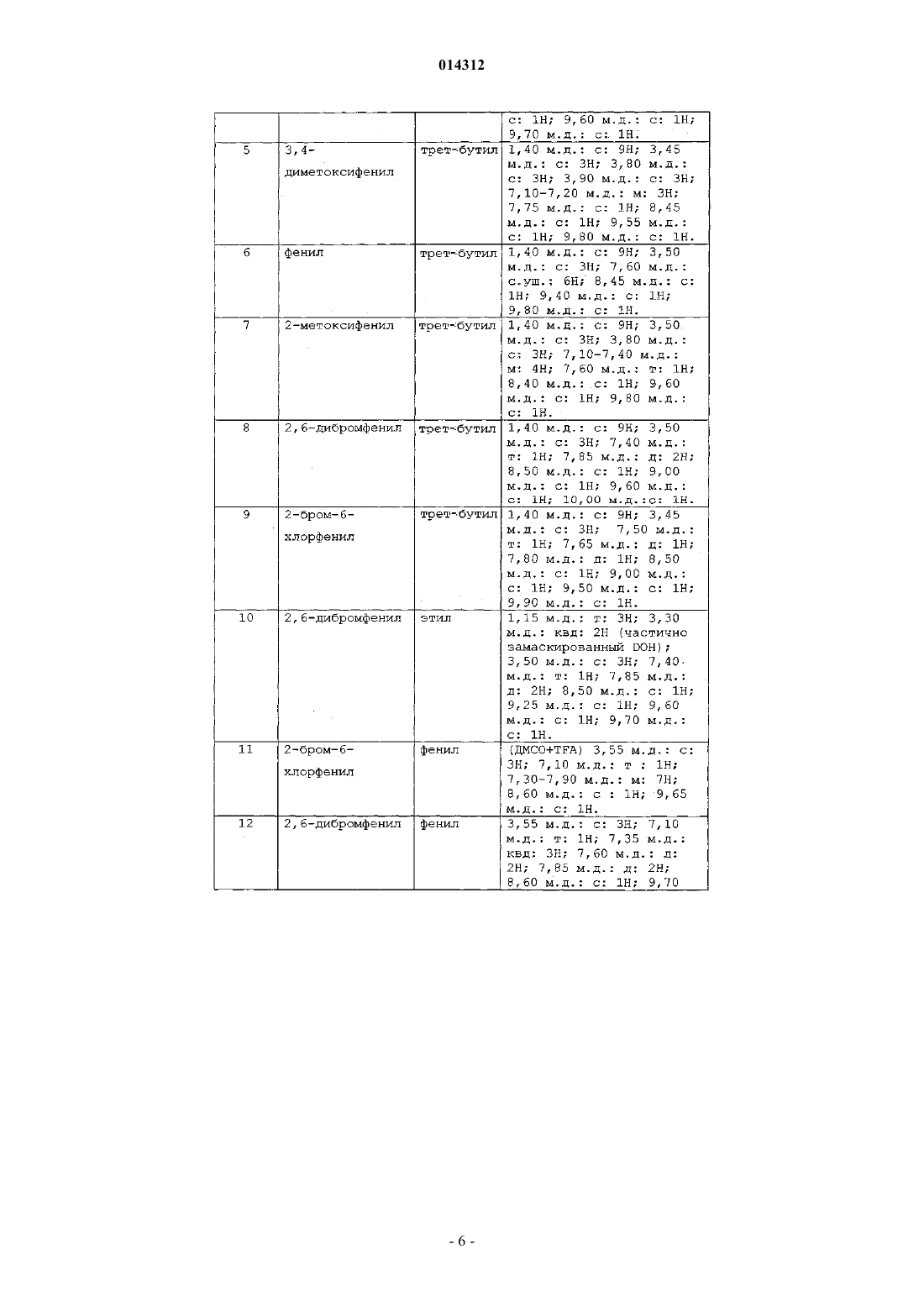
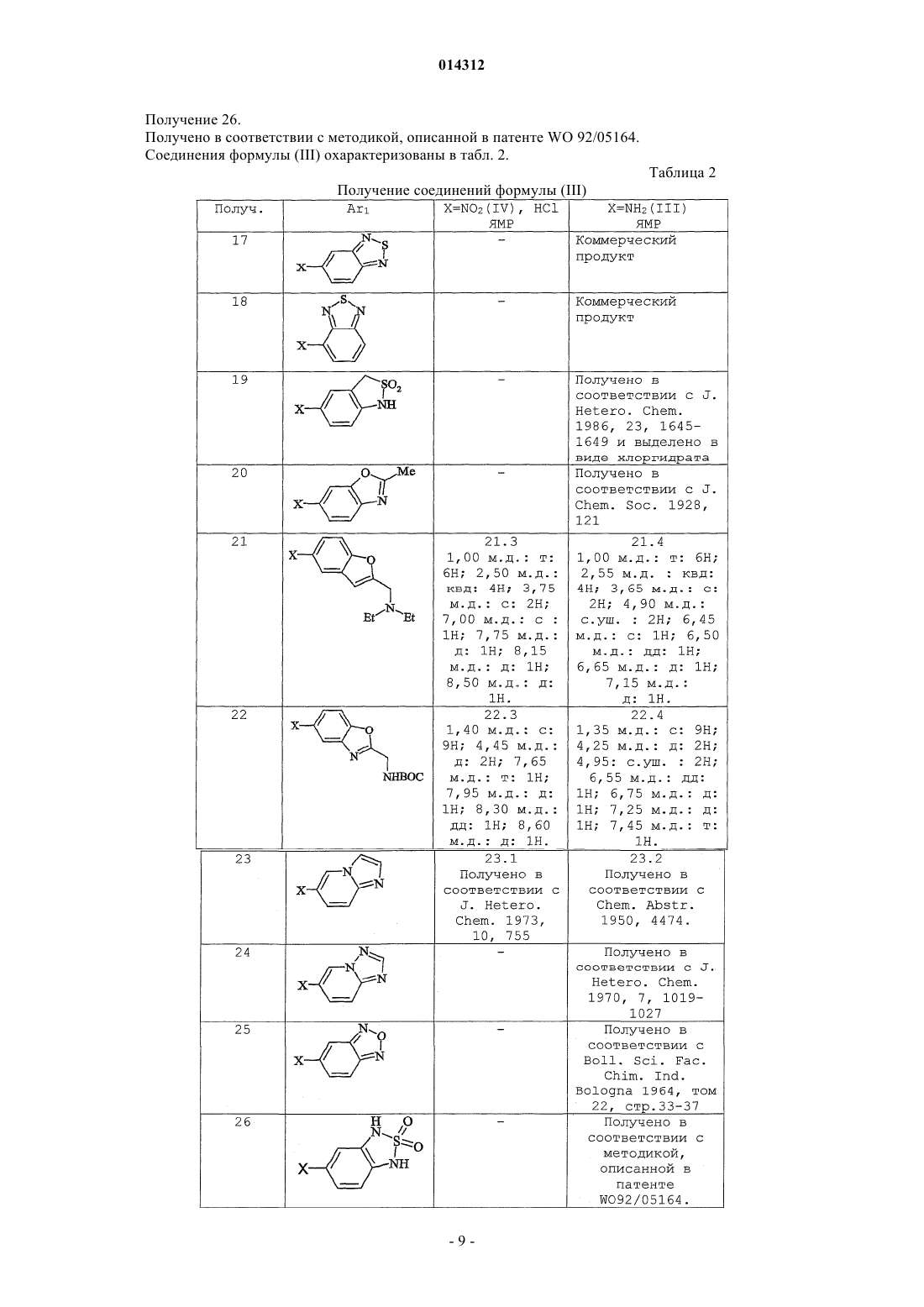
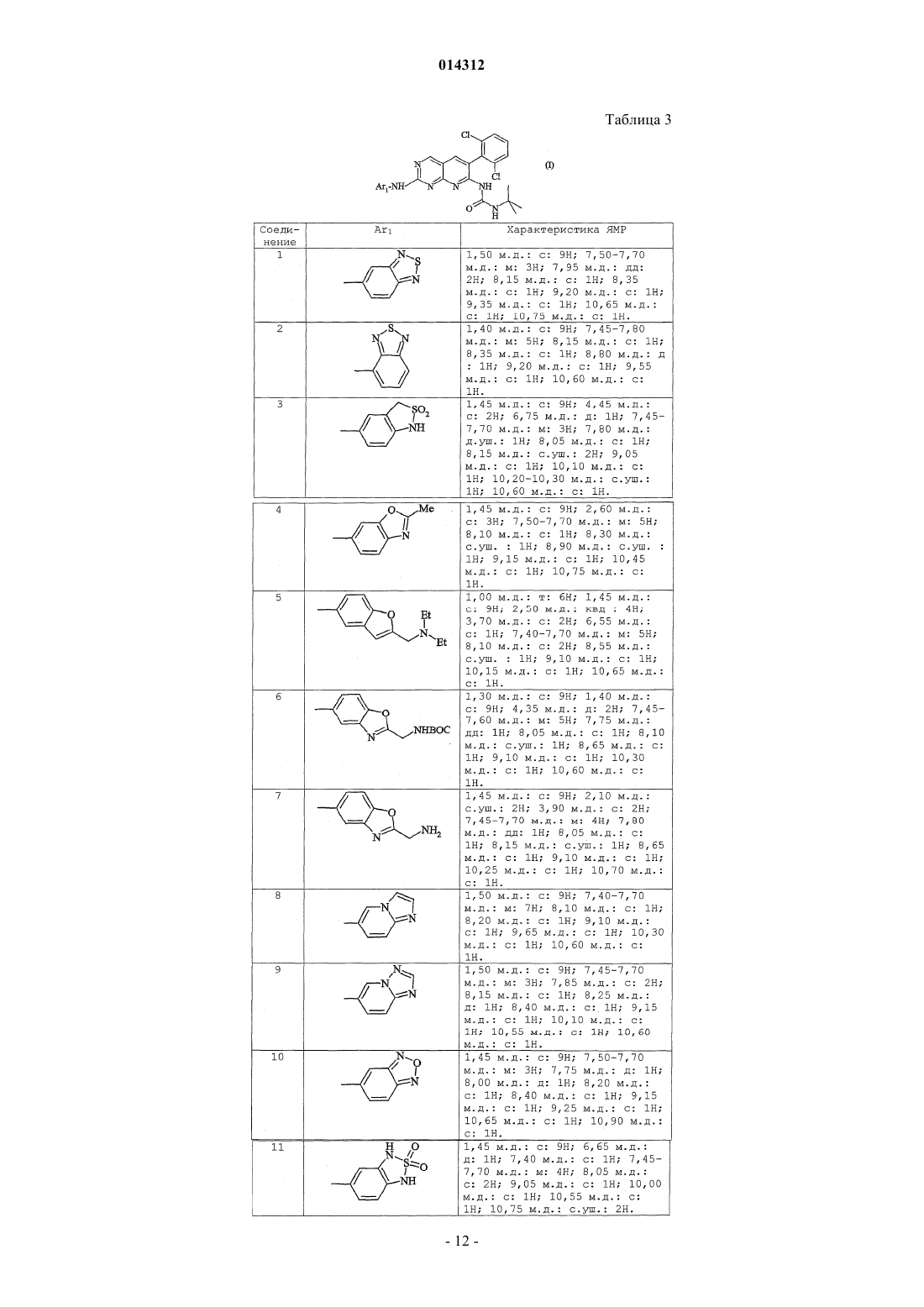
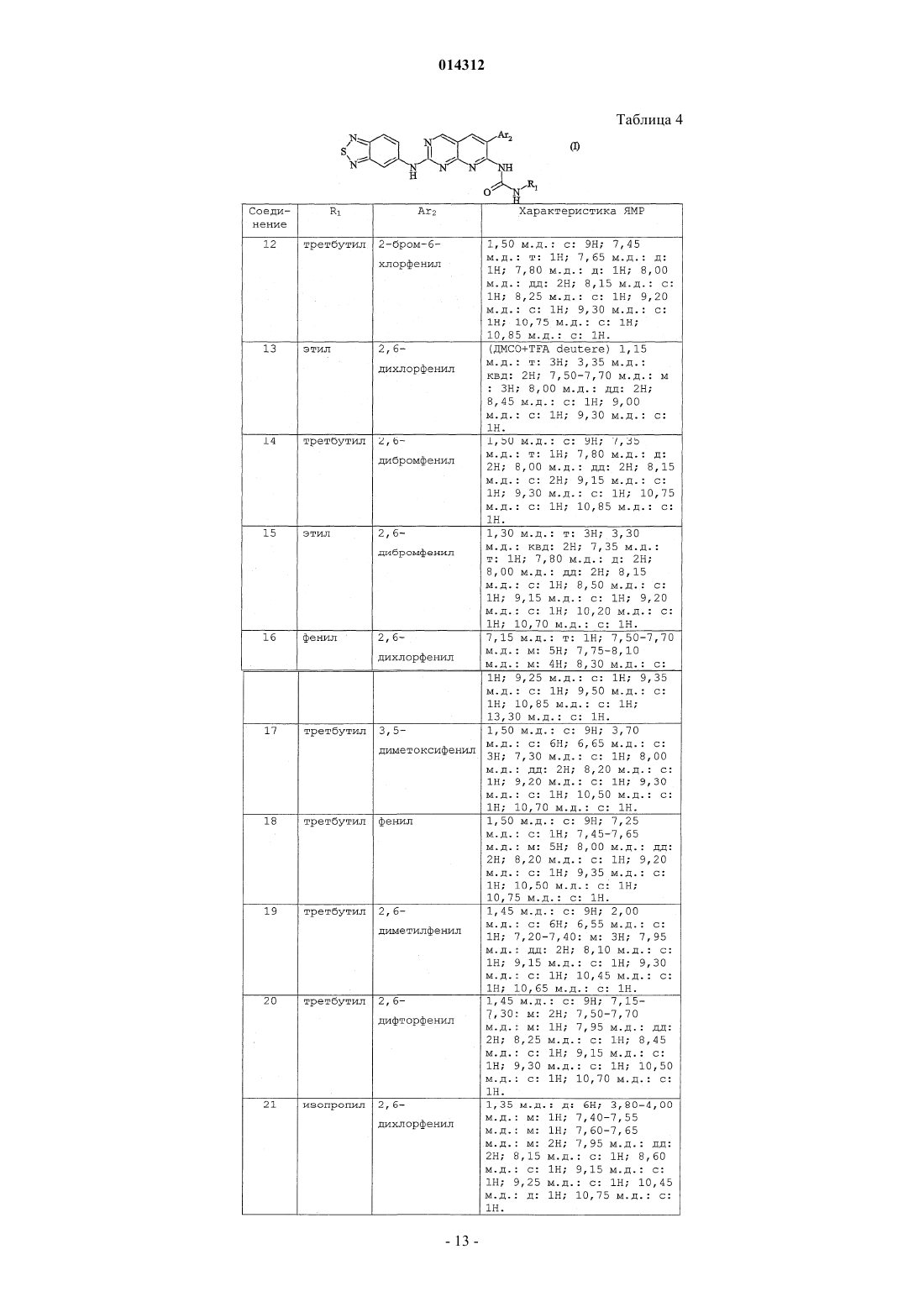
Объектом изобретения являются производные пиридо[2,3-d]пиримидина формулы (I), их получение и их применение в терапии. Эти соединения являются потенциально пригодными для лечения нарушений пролиферации клеток 014312 Настоящее изобретение относится к производным пиридо[2,3-d]пиримидина, их получению и их применению в терапии. Соединения, являющиеся производными пиридо[2,3-d]пиримидина, описаны в патентных заявкахWO 01/55147 и WO 03/000011 и в патентах ЕР-В-1790997 и US 5733913. Эти соединения являются потенциально пригодными для лечения нарушений пролиферации клеток. Так, в соответствии с первым аспектом объектом настоящего изобретения является соединение формулы (I) отличающееся тем, что Ar2 и R1 обозначают соответственно 2,6-дихлорфенил и трет-бутил, или 2-бром-6-хлорфенил и трет-бутил, или 2,6-дихлорфенил и этил, или 2,6-дибромфенил и трет-бутил, или 2,6-дибромфенил и этил, или 2,6-дихлорфенил и фенил, или 3,5-диметоксифенил и трет-бутил, или фенил и трет-бутил, или 2,6-диметилфенил и трет-бутил, или 2,6-дифторфенил и трет-бутил, или 2,6-дихлорфенил и изопропил. Продукты по изобретению преимущественно имеют заместитель Ar2, обозначающий радикал в котором каждый R6, R7 независимо выбран из группы, состоящей из H, CH3, OCH3, F, Cl, Br;R6 и R7 преимущественно находятся в положении 2 и 6. Продукты по изобретению преимущественно имеют заместитель Ar2, выбранный из фенила,2-метоксифенила, 2,6-дихлорфенила, 3,5-диметоксифенила, 3,4-диметоксифенила, 2,6-дибромфенила,2-бром-6-хлорфенила, 2,4-дихлорфенила, 3,5-дихлорфенила, 2,6-диметилфенила и 2,6-дифторфенила. В соответствии с предпочтительным вариантом соединения формулы (I) имеют заместитель Ar1,обозначающий радикал, выбранный из Наиболее предпочтительным соединением по изобретению является (N-[2-(2,1,3-бензотиадиазол-5 иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)карбамид Соединения из нижеследующих примеров являются объектом настоящего изобретения. Соединение по изобретению может быть (i) в нехиральной или рацемицеской форме либо обогащенным стереоизомером или обогащенным энантиомером; (ii) в виде соли и (iii) возможно быть гидратированным или сольватированным. Соединения формулы (i) могут содержать один или несколько асимметрических атомов углерода. Таким образом, они могут быть в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, включая рацемические смеси, относятся к изобретению. Соединения формулы (I) могут существовать в виде оснований или солей присоединения с кислотой. Если соединения формулы (I) содержат свободные кислотные группы, например карбоксильную,сульфоновую, фосфоновую, эти кислотные группы могут быть превращены в соли при помощи оснований для получения солей присоединения. Такие соли присоединения относятся к изобретению. Соли присоединения с кислотой или основанием предпочтительно получают соответственно при помощи фармацевтически приемлемых кислот или оснований, но соли с другими кислотами или основаниями, пригодные, например, для очистки или выделения соединений формулы (I) также относятся к изобретению.-1 014312 Соединения формулы (I) могут также быть в виде гидратов или сольватов, а именно в виде ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты или сольваты также относятся к изобретению. В рамках настоящего изобретения понимают под атомом галогена: фтор, хлор, бром или йод; под алкильной группой: алифатическую насыщенную группу, линейную или разветвленную. В качестве примера можно назвать метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил,1-метилэтил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, 1-метилбутил, 2-метилбутил,3-метилбутил,1,1-диметилпропил,1,2-диметилпропил,2,2-диметилпропил,1-метилпентил,2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметибутил, 1,2-диметибутил, 1,3-диметибутил,2,2-диметибутил, 2,3-диметибутил, 3,3-диметибутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил,1-этил,1-метилпропил, 1-этил,2-метилпропил, 1-этилбутил, 2-этилбутил, 1-метилгексил, 2-метилгексил,3-метилгексил,4-метилгексил,5-метилгексил,1,1-диметилпентил,1,2-диметилпентил,1,3-диметилпентил, 1,4-диметилпентил, 2,2-диметилпентил, 2,3-диметилпентил, 2,4-диметилпентил,3,3-диметилпентил, 3,4-диметилпентил, 4,4-диметилпентил, 1,1,2-триметилбутил, 1,1,3-триметилбутил,1,2,2-триметилбутил,1,2,3-триметилбутил,1,3,3-триметилбутил,2,2,3-триметилбутил,2,3,3-триметилбутил,1,1,2,2-тетраметилпропил,1-этилпентил,2-этилпентил,3-этилпентил,1-этил,1-метилбутил,1-этил,2-метилбутил,1-этил,3-метилбутил,2-этил,1-метилбутил,2-этил,2-метилбутил, 2-этил,3-метилбутил, 1-пропилбутил, 1-(1-метилэтил)бутил, 1-(1-метилэтил),2 метилпропил; под циклоалкильной группой: циклоцропил, циклобутил, циклопентил, циклогексил, циклогептил,бицикло[2.2.1]гептил, циклооктил, бицикло[2.2.1]октил, бицикло[3.2.1]октил, адамантил. Соединения формулы (I) получают путем взаимодействия соединения формулы (II) в которой R1 и Ar2 такие, как определены для (I),и амина формулыAr'1NH2,в которой Ar'1 обозначает Ar1 такой, как определен для (I) или предшественник Ar1; в случае необходимости группу Ar'1 полученного таким образом соединения преобразуют в группу Ar1. Согласно изобретению можно получить соединения формулы (I) способом, отличающимся тем, что вводят во взаимодействие:(ii) амин формулы (III), в которой Ar'1 обозначает Ar1 такой, как определен для (I) или предшественник Ar1; в случае необходимости группу Ar'1 полученного таким образом соединения преобразуют в группу Ar1. Если R10 обозначает галоген или алкил-S(О)m-, где m=2, взаимодействие проводят в растворителе,предпочтительно полярном:(i) например, тетрагидрофуране, диметилсульфоксиде или этаноле, возможно, в присутствии следа кислоты, такой как соляная кислота; или(ii) в диметилсульфоксиде в присутствии сильного основания, такого как tBuOk; при температуре от комнатной температуры до температуры кипения растворителя. Если R10 обозначает алкил-S(О)m-, где m=0 или 1, можно осуществлять взаимодействие с расплавомAr'1NH2 (III), предпочтительно при температуре примерно 200 С без катализатора. В случае необходимости аминогруппы, присутствующие в группе Ar'1 соединения (III), предварительно превращены в соль или защищены. Соединения формулы (II) получают методом, описанным в европейском патенте 790997 и патентеUS 5733913, как показано на схеме 1.mCPBA: метахлорпербензойная кислота. Амины формулы (III) Ar'1NH2 известны или могут быть получены известными методами из соответствующих нитропроизводныхAr'1NO2 путем восстановления или (i) в кислой среде в присутствии металла, такого как порошкообразное железо или цинк, или (ii) при помощи водорода в присутствии катализатора, такого как Pd/C; Ar' обозначает Ar или предшественник Ar. Соединения формулы (IV) известны или могут быть получены известными способами. Соединения по изобретению получают в рацемической форме; затем можно получить оптически чистые изомеры, используя методы расщепления, известные специалисту, такие как кристаллизация путем образования солей с хиральными агентами. Можно также получать соединения по изобретению в оптически чистой форме, используя методы асимметрического или стереоспецифического синтеза, хроматографических технологий с использованием хиральной фазы. К тому же продукты по изобретению можно выделять путем образования диастереоизомеров, их разделения, с последующим разложением фармакологически пригодного диастереоизомера и получением его активного энантиомерно чистого продукта. Можно также применять ферментативные технологии. Можно дополнительно использовать известные технологии разделения. К ним относятся раскрытые в Enantiomers, Racemates and Resolutions,John WilleySons, New York (1981). Соединения по изобретению можно также получить в форме, обогащенной стереоизомером, при получении промежуточных продуктов синтеза. Таким образом, расщепление энантиомеров аминов формулы (III) или нитрованных предшественников (IV) можно осуществлять указанными способами. Следующие примеры описывают получение некоторых промежуточных продуктов и соединений по изобретению. Эти примеры не ограничивают, а только иллюстрируют изобретение. В примерах использованы следующие аббревиатуры:KHSO4/K2SO4: 5%-ный раствор KHSO4/K2SO4. Спектры ядерного магнитного резонанса (ЯМР) протона регистрируют при 200 или 250 МГц в ДМСО-d6, если не указано иное. Сигнал ДМСО-d6 регистрируется в 2,5 м.д. и служит контрольным. Для интерпретации спектров используют следующие обозначения: с: синглет,д: дублет,т: триплет,м: массив,мт: мультиплет,с.уш.: уширенный синглет,дд: дублет дублета,кд: квадруплет,-3 014312 кт: квинтет,F: точка плавления (в градусах Цельсия), такая как измерена на аппарате Buchi B545 с градиентом температуры 1 С/мин,МН+: масс-спектр. Соединения анализируют путем соединения ВЭЖХ-УФ-МС (жидкостная хроматография-УФдетекция-масс-спектрометрия). Используемое устройство, выпускаемое Agilent, состоит из хроматографа НР 1100, снабженного детектором с диодами Agilent и спектрометром квадриполярной массы MSD Quad. Условия анализа следующие. Колонна: Symmetry C18 (502,1 мм; 3,5 мкм). Элюент A: H2O+TFA 0,005% при рН 3,15. Элюент В: CH3CN+TFA 0,005%. Градиент.v: объем. Получение соединения формулы (II). Получение 1. 1.1. Этил-4-амино-2-(метилтио)пиримидин-5-карбоксилат. В суспензию 50,7 г этил-4-хлор-2-(метилтио)пиримидин-5-карбоксилата в 400 мл EtOH вводят в течение 20 мин, поддерживая температуру около 20 С, 140 мл 20%-ного раствора NH4OH. После перемешивания в течение 20 ч при комнатной температуре реакционную среду концентрируют в вакууме почти досуха, затем осадок обрабатывают в 350 мл воды, перемешивают в течение 20 мин, фильтруют, промывают 360 мл воды, затем сушат в вакууме в присутствии Р 2 О 5. Получают твердое вещество белого цвета, F=134-135C, m=39,9 г. 1.2. [4-Амино-2-(метилтио)пиримидин-5-ил]метанол. В 39,68 г сложного эфира, полученного на предыдущей стадии, растворенного в 1 л ТГФ, в течение 45 мин вводят 210 мл раствора 1 М LiAlH4 в ТГФ, поддерживая температуру ниже 30 С. Перемешивают еще в течение 1 ч, затем понижают температуру до 5 С и последовательно вводят по каплям 9 мл воды,6,5 мл гидроксида натрия 5N, затем 32 мл воды. Перемешивают в течение 10 мин, твердое вещество фильтруют, затем промывают ТГФ. Фильтрат концентрируют в вакууме досуха, затем осадок повторно растворяют в 600 мл толуола при кипении, быстро фильтруют в горячем состоянии для удаления небольшого количества нерастворившегося вещества и охлаждают фильтрат в течение ночи. Полученные белые кристаллы фильтруют, промывают небольшим количеством толуола, затем простого эфира и сушат, F=124-127C, m=23,9 г. 1.3. 4-Амино-2-(метилтио)пиримидин-5-карбальдегид. В суспензию 23,8 г спирта, полученного на предыдущей стадии, в 1600 мл хлороформа вводят в течение 2 мин 79,5 г активного MnO2 и перемешивают в течение 1 ночи при комнатной температуре; твердое вещество фильтруют, промывают 375 мл CHCl3 и фильтрат концентрируют в вакууме досуха; белый твердый осадок обрабатывают простым эфиром, фильтруют, сушат, F=184-186 С, m=21,05 г.-4 014312 1.4. 6-(2,6-Дихлорфенил)-2-(метилтио)пиридо[2,3-d]пиримидин-7-амин. В 21 г альдегида, полученного на предыдущей стадии, растворенного в 240 мл ДМФ и охлажденного до 5 С в течение 5 мин, вводят 5,47 г 60%-ного NaH, затем в течение 20 мин небольшими фракциями вводят 29,05 г 2,6-дихлорфенилацетонитрила. Перемешивают в течение 30 мин при 5 С, затем в течение ночи при комнатной температуре. Реакционную среду охлаждают до 5 С и вводят 65 мл насыщенного раствора NH4Cl, затем 500 мл смеси вода/лед; образуется красный осадок, который фильтруют, дважды промывают водой, максимально отжимают, промывают простым эфиром, 100 мл хлороформа, затем снова простым эфиром; сушат и получают твердое вещество бежевого цвета, F=250-253C, m=29,92 г. Фазы простого эфира и хлороформа после промывки концентрируют досуха, обрабатывают небольшим количеством хлороформа с добавлением простого эфира, получают вторую струю 3,15 г, общееm=33,07 г. 1.5. N-(трет-Бутил)-N'-[6-(2,6-дихлорфенил)-2-(метилтио)пиридо[2,3-d]пиримидин-7-ил]карбамид. В 29,9 г амина, полученного выше, в растворе в 300 мл ДМФ вводят в течение 10 мин и поддерживая температуру ниже 25 С, 4,6 г 60%-ного NaH; перемешивают еще в течение 20 мин, затем в течение 20 мин вводят 12,2 мл изоцианата терциобутила, затем перемешивают в течение ночи. Реакционную среду медленно выливают на 800 мл смеси вода/лед + 100 мл HCl 6 н.; образовавшийся осадок фильтруют,промывают водой, отжимают, затем перемешивают в течение 1 ч в 300 мл простого эфира, затем фильтруют, промывают простым эфиром и сушат. Получают твердое вещество бежевого цвета, F=195-196CN-(трет-Бутил)-N'-[6-(2,6-дихлорфенил)-2-(метилсульфонил)пиридо[2,3-d]пиримидин-7 ил]карбамид. В 21,95 г карбамида, полученного выше, в растворе в 300 мл хлороформа вводят в течение 25 мин и поддерживая температуру ниже 25 С, 27 г метахлорпербензойной кислоты (77%). Образуется осадок. Через 2 ч реакционную среду разбавляют 1 л дихлорметана и вводят Na2SO4, затем 14 г Са(ОН)2. После перемешивания в течение 30 мин твердое вещество фильтруют, промывают дихлорметаном, затем фильтрат концентрируют досуха. Осадок обрабатывают 80 мл простого эфира в горячем состоянии; охлаждают, затем белое твердое вещество фильтруют, промывают простым эфиром и сушат. F=138-140C,m=20,5 г. Соединения следующей общей формулы (II) можно получить так же, как соединение, описанное в получении 1. Таблица 1 Получение соединений формулы (III). Номера примеров получения соответствуют номерам соединений из табл. 2. Получение 17 и 18. Коммерческий продукт. Получение 19. Получено в соответствии с J. Hetero. Chem. 1986, 23, 1645-1649 и выделено в виде хлоргидрата. Получение 20. Получено в соответствии с J. Chem. Soc. 1928, 121. Получение 21. 21.1. В 1,12 г этил-5-нитро-бензо[b]фуран-2-карбоксилата в 50 мл ТГФ вводят небольшими порциями 2,27 г NaBH4 в течение 8 ч, затем перемешивают в течение 40 ч. Добавляют 5 мл метанола, затем 5 мл воды. Реакционную среду экстрагируют при помощи AcOEt, органическую фазу промывают водой,5%-ным раствором KHSO4/K2SO4, водой, затем насыщенным раствором NaCl. Сушат и концентрируют при пониженном давлении и получают 0,74 г целевого продукта в твердой форме. 21.2. 730 мг продукта, полученного на стадии 21.1, растворяют в 9 мл DCM и выдерживают при 5 С. 1 мл триэтиламина добавляют при 5 С, затем вводят в течение 15 мин 536 мг метансульфонилхлорида. Поддерживают температуру 5 С в течение 15 мин, затем реакционную среду оставляют на 55 мин до нагревания до комнатной температуры. Затем реакционную среду разбавляют DCM и водой. Органическую фазу декантируют, промывают водой, насыщенным раствором NaCl, сушат и выпаривают при пониженном давлении. Получают 0,98 г масла, содержащего смесь мезилата (целевой продукт) и хлорид 0,97 г продукта, полученного на стадии 21.2, в 10 мл ДМФ обрабатывают при помощи 1,05 г диэтиламина в течение 18 ч. Реакционную среду экстрагируют при помощи AcOEt, органическую фазу про-7 014312 мывают водой, насыщенным раствором NaCl, сушат, затем растворители выпаривают при пониженном давлении. Получают 0,93 г масла. 21.4. В 1,16 г продукта, полученного на стадии 21.3, в 40 мл ТГФ вводят 4,48 г порошкообразного Zn, затем при -5 С, 5 мл уксусной кислоты в течение 25 мин. Через 1 ч 15 мин с начала реакции твердый осадок отфильтровывают из реакционной среды, твердое вещество промывают небольшим количеством ТГФ, органические фазы собирают, разбавляют при помощи AcOEt и воды, затем доводят до рН 9 при помощи NaOH 10 н. После декантации органическую фазу выделяют и промывают 15%-ным раствором В 1,64 г 2-хлорметил-5-нитробензоксазола (полученного в соответствии с Synth. Communications 1989, 19, 2921-2924) в 25 мл ДМФ вводят 1,26 г азида натрия и перемешивают в течение ночи при комнатной температуре. Реакционную среду выливают в 150 мл AcOEt и дважды промывают ледяной водой,затем насыщенным раствором NaCl. Органическую фазу сушат и концентрируют при пониженном давлении. Получают 1,42 г масла черного цвета. 22.2. В 1,40 г продукта, полученного на стадии 22.1, в 30 мл AcOEt вводят 2,84 г трифенилфосфина в течение 10 мин, затем через 10 мин 1,16 мл воды вводят в течение 2 мин. После 24 ч перемешивания при 60 С с последующим охлаждением реакционную среду разбавляют AcOEt, органическую фазу промывают водой, затем насыщенным раствором NaCl. Органическую фазу сушат и концентрируют при пониженном давлении. Осадок обрабатывают в Et2O и дважды экстрагируют при помощи HCl 1 н. Кислые фазы собирают, вводят в контакт с AcOEt и доводят до рН 10 при помощи NaOH 10 н. После декантации органическую фазу промывают водой, затем насыщенным раствором NaCl. Органическую фазу сушат и концентрируют при пониженном давлении для получения 468 мг целевого продукта в виде масла желтого цвета. 22.3. Продукт, полученный на стадии 22.2, растворяют в 10 мл DCM, затем вводят 0,4 экв. триэтиламина,затем 1,1 экв. ВОС 2 О. Через 5 ч реакционную среду разбавляют CH2Cl2, затем последовательно промывают 5%-ным раствором KHSO4/K2SO4, водой, затем насыщенным раствором NaCl. Неочищенный продукт сушат и выпаривают при пониженном давлении для получения 388 мг целевого продукта. 22.4. Продукт, полученный на стадии 19.3, количественно восстанавливают при помощи Zn/AcOH методом, описанным в примере получения 18.4. Получение 23. 23.1. Получено в соответствии с J. Hetero. Chem. 1973, 10, 755. 23.2. Восстановление продукта, полученного на стадии 23.1 при помощи Sn/HBr в воде в соответствии с-8 014312 Получение 26. Получено в соответствии с методикой, описанной в патенте WO 92/05164. Соединения формулы (III) охарактеризованы в табл. 2. Таблица 2 Получение соединений формулы (III)-9 014312 Номера соединений в примерах соответствуют номерам, приведенным в табл. 3, которая иллюстрирует химические структуры и физические свойства нескольких соединений по изобретению. Если они содержат асимметричный углерод, эти соединения получают в рацемической форме. Пример 1. N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7 ил]-N'-(1,1-диметилэтил)карбамид (соединение 1). В 3,32 г (20 ммоль) амина из примера получения 17 по табл. 2 в 45 мл ДМСО вводят 3,21 г(28,6 ммоль) t-BuOK в течение 15 мин, затем вводят в течение 20 мин 7,71 г (16,5 ммоль) карбамида из примера получения 1 из табл. 1. Через 2 ч вводят 1 г t-BuOK, затем еще через 2 ч вводят 1 г t-BuOK. Через 6 ч с начала реакции реакционную среду разбавляют ледяной водой, затем экстрагируют при помощиAcOEt. Органическую фазу промывают дважды водой, один раз насыщенным раствором NaCl, сушат,концентрируют при пониженном давлении. Неочищенный продукт обрабатывают в смеси Et2O/гептан,осадок фильтруют, затем подвергают хроматографии на силикагеле, элюируя CHCl3/AcOEt 88/12 (об./об.). Получают 5 г целевого продукта. МН+: 539. Пример 2. N-[2-(2,1,3-Бензотиадиазол-4-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7 ил]-N'-(1,1-диметилэтил)карбамид (соединение 2). Соединение 2 получают так же, как соединение 1, исходя из амина из примера получения 18 по табл. 2. Пример 3. N-[6-(2,6-Дихлорфенил)-2-[(1,3-дигидро-2,2-диоксидо-2,1-бензизотиазол-5-ил)амино]пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)карбамид (соединение 3). Смесь 437 мг амина из примера получения 19 по табл. 2 в виде хлоргидрата и 750 мг карбамида из примера получения 1 по табл. 1 нагревают в 15 мл этанола в течение 5 ч. Реакционную среду выпаривают досуха, затем обрабатывают в 50 мл CHCl3 и 20 мл насыщенного раствора NaHCO3. Органическую фазу декантируют, промывают водой, затем насыщенным раствором NaCl. Органическую фазу сушат и выпаривают при пониженном давлении. Осадок очищают флэш-хроматографией с градиентом от 0 до 20% (об./об.) AcOEt в хлороформе. Получают 275 мг твердого вещества желтого цвета. МН+: 572. Пример 4. (соединение 4) N-[6-(2,6-дихлорфенил)-2-[(2-метил-6-бензоксазолил)амино]пиридо[2,3d]пиримидин-7-ил]-N'-(1,1-диметилэтил)карбамид. 210 мг амина из примера получения 20 по табл. 2 и 562 мг карбамида из примера получения 1 по табл. 1 нагревают в течение 8 ч до 45 С в 20 мл этанола, содержащего 0,02 мл концентрированного HCl. После концентрирования при пониженном давлении осадок подвергают хроматографии на силикагеле,элюируя CHCl3/MeOH:98/2 (об./об.). Получают 300 мг продукта в виде твердого вещества желтого цвета. МН+: 536. Пример 5. N-[6-(2,6-Дихлорфенил)-2-2-[(диэтиламино)метил]-5-бензофуранил]амино]пиридо[2,3d]пиримидин-7-ил]-N'-(1,1-диметилэтил)карбамид (соединение 5). Соединение 5 получают так же, как соединение 4, исходя из амина 21.4 из примера получения 21 по табл. 2. Пример 6. 1,1-Диметилэтил 5-6-(2,6-дихлорфенил)-7-(1,1-диметилэтил)амино]карбонил]амино]пиридо[2,3-d]пиримидин-2-ил]амино]-2-бензоксазолил]метил]карбамат (соединение 6). Соединение 6 получают так же, как соединение 4, исходя из амина 22.4 из примера получения 22 по табл. 2. Пример 7. N-[2-2-(Аминометил)-5-бензоксазолил]амино]-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)карбамид (соединение 7). 190 мг соединения 6 обрабатывают в течение 1 ч 3 мл ТГФ в 2 мл DCM. Концентрируют при пониженном давлении, осадок обрабатывают в смеси DCM/вода, затем рН доводят до 9 путем добавления 15%-ного раствора Na2CO3. После декантации органическую фазу промывают водой, затем насыщенным раствором NaCl, сушат, концентрируют при пониженном давлении. Неочищенный продукт обрабатывают путем флэш-хроматографии на силикагеле, элюируя от 0 до 10% (об./об.) метанола в DCM. 100 мг твердого белого вещества выделяют. МН+: 551. Пример 8. N-[6-(2,6-Дихлорфенил)-2-(имидазо[1,2-а]пиридин-6-иламино)пиридо[2,3-d]пиримидин 7-ил]-N'-(1,1-диметилэтил)карбамид (соединение 8). Соединение 8 получают так же, как соединение 4, исходя из амина 23.2 из примера получения 23 по табл. 2. Пример 9. N-[6-(2,6-Дихлорфенил)-2-([1,2,4]триазол[1,5-а]пиридин-6-иламино)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)карбамид (соединение 9). Соединение 9 получают так же, как соединение 4 исходя из амина из примера получения 24 по табл. 2.- 10014312 Пример 10. N-[2-(2,1,3-Бензоксадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7 ил]-N'-(1,1-диметилэтил)карбамид (соединение 10). В смесь 0,468 г продукта получения 1 и 0,202 г амина (III) из примера получения 25 по табл. 2 в 6 мл ДМСО вводят 0,168 г tBuOk в течение 25 мин, затем еще 0,168 г в течение 1 ч. Реакционную среду перемешивают в течение 2 ч, затем экстрагируют этилацетатом и последовательно промывают водой и насыщенным раствором NaCl. После сушки над Na2SO4 и выпаривания этилацетата неочищенный продукт обрабатывают путем флэш-хроматографии на силикагеле, элюируя с градиентом от 0 до 8%(об./об.) этилацетата в дихлорметане. Получают порошок белого цвета, m=0,22 г. МН+: 523. Пример 11. N-[2-(1,3-Дигидро-2,2-диоксидо-2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)карбамид (соединение 11). Соединение 11 получают так же, как соединение 4, исходя из амина из примера получения 26 по табл. 2. Примеры 12-21 (соединения 12-21). Соединения 12-21 получают так же, как соединение 1, исходя из амина (III) из примера получения 17 по табл. 2 и соответствующего карбамата, выбранного из продуктов формулы (II) из примеров получения по табл. 1. Пример 12.N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-(2-бром-6-хлорфенил)пиридо[2,3d]пиримидин-7-ил]-N'-(1,1-диметилэтил)карбамид (соединение 12). Пример 13. N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7 ил]-N'-этилкарбамид (соединение 13). Пример 14. N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-(2,6-дибромфенил)пиридо[2,3-d]пиримидин-7 ил]-N'-(1,1-диметилэтил)карбамид (соединение 14). Пример 15. N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-(2,6-дибромфенил)пиридо[2,3-d]пиримидин-7 ил]-N'-этилкарбамид (соединение 15). Пример 16. N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7 ил]-N'-фенилкарбамид (соединение 16). Пример 17. N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-(3,5-диметоксифенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)карбамид (соединение 17). Пример 18. N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-фенилпиридо[2,3-d]пиримидин-7-ил]-N'-(1,1 диметилэтил)карбамид (соединение 18). Пример 19. N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-(2,6-диметилфенил)пиридо[2,3-d]пиримидин 7-ил]-N'-(1,1-диметилэтил)карбамид (соединение 19). Пример 20. N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-(2,6-дифторфенил)пиридо[2,3-d]пиримидин-7 ил]-N'-(1,1-диметилэтил)карбамид (соединение 20). Пример 21. N-[2-(2,1,3-Бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7 ил]-N'-(1-метилэтил)карбамид (соединение 21). Табл. 3 и 4 иллюстрируют химические структуры и физические свойства нескольких примеров по изобретению. На этих таблицах Me, Et, iPr и tBu обозначают соответственно метил, этил, изопропил и трет-бутил, а Вос (или ВОС) обозначает трет-бутоксикарбонил.- 13014312 Соединения по изобретению являлись объектом фармакологических исследований, позволяющих определить противораковую активность. Соединения формулы (I) по настоящему изобретению тестировали in vitro на панели линий человеческих опухолевых клеток: рака груди: MDA-MB231 (American Type culture collection, Rockville, Maryland, USA,ATCC-HTB26), MDA-A1 или MDA-ADR (называемая линия multi-drug resistant MDR и описаннаяBraunschweig, Germany), K-562 (описана Lozzio et al., J. Natl. Cancer. Inst. 50: 535 (1973), Lozzio et al.,Blood 45: 321 (1975), выдается DSMZ n ACC 10), KG-1a (описана Koeffler et al., Blood 56: 265 (1980), выдается DSMZ n ACC421) и Kasumi-1 (описана Asou et al., Blood 77: 2031 (1991,) выдается DSMZ n ACC 220). Клеточную пролиферацию и жизнеспособность определяли тестом с использованием 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2 Н-тетразолия (MTS) по методу Fujishita Т. et al., Oncology, 2003, 64(4), 399-406. В этом тесте измеряют митохондриальную способность живых клеток трансформировать MTS в окрашенное соединение после 72 ч инкубирования соединения формулы (I) по изобретению. Концентрации соединения по изобретению, которые приводят к 50%-ной потере пролиферации клеток и жизнеспособности (CI50) составляют от 1 нМ до 10 мкМ в зависимости от линии опухолевых клеток и тестируемого соединения. Например, соединение n1 приводит к CI50 при 40 нМ линии K-562,CI50 при 50 нМ линии KG-1 а и CI50 при 40 нМ линии Kasumi-1. Соединение n5 приводит к CI50 при 5 нМ,соединение n9 приводит к CI50 при 19 нМ, соединение n13 приводит к CI50 при 74 нМ линии K-562. Соединение n7 приводит к CI50 при 43 нМ линии SF268. Таким образом, согласно изобретению оказалось, что соединения формулы (I) вызывают снижение пролиферации и жизнеспособности опухолевых клеток. Таким образом, оказалось, что соединения по изобретению обладают противораковой активностью и активностью в лечении других пролиферативных заболеваний, таких как псориаз, рестеноз, артериосклероз, СПИД, например, а также заболеваний, вызванных пролиферацией клеток гладких сосудистых мышц и ревматоидного полиартрита. Таким образом, в соответствии с другим из аспектов объектом изобретения являются лекарственные средства, которые содержат соединение формулы (I) или соль присоединения последнего с фармацевтически приемлемой кислотой либо гидрат или сольват соединения формулы (I). Эти лекарственные средства используются в терапии, в частности в лечении или профилактике заболеваний, вызванных или обостренных пролиферацией клеток, и в частности опухолевых клеток. Продукт по изобретению можно использовать для получения лекарственного средства, пригодного для лечения патологического состояния, в частности рака. В качестве ингибитора пролиферации опухолевых клеток эти соединения пригодны для профилактики и лечения лейкемий, твердых опухолей, как первичных, так и метастатических, карцином и рака, в частности рака груди; рака легких; рака тонкой кишки, рака ободочной кишки и прямой кишки; рака дыхательных путей, ротоглотки и нижнего отдела глотки, рака пищевода, рака печени, рака желудка, рака желчных протоков, рака желчного пузыря, рака поджелудочной железы; рака мочевыводящих путей,включая почки, уротелий, и мочевой пузырь; рака женского половой системы, включая рак матки, шейки матки, яичников, хориокарциному и трофобластому; рака мужской половой системы, включая рак простаты, семенных пузырьков, яичек, опухолей зародышевых клеток; рака эндокринных желез, включая рак щитовидной железы, гипофиза, надпочечников; рака кожи, включая гемангиомы, меланомы, саркомы, включая саркому Капоши; опухолей мозга, нервов, глаз, оболочки головного мозга, включая астроцитомы, глиомы, глиобластомы, ретинобластомы, нейриномы, нейробластомы, невриномы, менингиомы; злокачественные гемопоэтические опухоли; лейкемии (Acute Lymphocytic Leukemia (ALL), AcuteMyeloid Leukemia (AML), Chronic Myeloid Leukemia (CML), Chronic lymphocytic leukemia (CLL, хлоромы, плазмоцитомы, лейкемии клеток Т или В, лимфомы неходжкинские или ходжскинские, миеломы,различные злокачественные болезни крови. В соответствии с другим из своих аспектов настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного вещества соединение по изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения по изобретению- 14014312 или фамацевтически приемлемую соль, гидрат или сольват указанного соединения, а также по меньшей мере один фамацевтически приемлемый эксципиент. Фармацевтическая композиция может также дополнительно содержать другое активное противораковое соединение. Указанные эксципиенты выбирают в зависимости от фармацевтической формы и требуемого способа введения из традиционных эксципиентов, известных специалисту. В фармацевтических композициях по изобретению для введения перорального, сублингвального,подкожного, внутримышечного, внутривенного, местного, локального, интратрахеального, через нос,чрескожного или ректального активное вещество указанной выше формулы (I) или возможно его соль,сольват или гидрат можно вводить в виде разовой формы введения в смеси с традиционными фармацевтическими эксципиентами животным и людям для профилактики или лечения нарушений или заболеваний, указанных выше. К соответствующим разовым формам введения относятся пероральные формы, такие как таблетки,мягкие или твердые желатиновые капсулы, порошки, гранулы и растворы или суспензии для перорального введения, формы для введения сублингвального, орального, интратрахеального, через глаза, через нос, путем ингаляции, формы введения местного, чрескожного, подкожного, внутримышечного или внутривенного, формы ректального введения или имплантаты. Для местного применения можно использовать соединения по изобретению в кремах, гелях, мазях или лосьонах. В качестве примера стандартная лекарственная форма соединения по изобретению в форме таблетки может содержать следующие компоненты: соединение по изобретению 50,0 мг манит 223,75 мг натриевая кроскармеллоза 6,0 мг кукурузный крахмал 15,0 мг гидроксипропилметилцеллюлоза 2,25 мг стеарат магния 3,0 мг Соединения формулы (I), указанные выше, можно использовать в суточных дозах от 0,002 до 2000 мг на 1 кг массы тела млекопитающего, подлежащего лечению, предпочтительно суточная доза составляет от 0,1 до 300 мг/кг. Доза, вводимая человеку, может варьировать предпочтительно от 0,02 до 10000 мг в сутки, более конкретно от 1 до 3000 мг в зависимости от возраста пациента или цели приема: для профилактики или лечения. Существуют отдельные случаи, когда дозы должны быть увеличены или уменьшены; такие дозы не выходят за рамки изобретения. В соответствии с традиционной практикой дозировку для каждого пациента подбирает врач в зависимости от способа введения, массы тела или индивидуальной реакции пациента. Настоящее изобретение в соответствии с другим своим аспектом относится также к способу лечения патологий, указанных выше, который включает в себя введение пациенту эффективной дозы соединения по изобретению или одной из его фармацевтически приемлемых солей или гидратов, или сольватов. В соответствии с настоящим изобретением одно или несколько соединений формулы (I) можно вводить в комбинации с одним или несколькими противораковыми активными веществами, в частности такими противоопухолевыми соединениями, как алкилирующие агенты, такие как алкилсульфонаты (бусульфан), дакарбазин, прокарбазин, азотсодержащие горчицы (хлорметин, мелфалан, хлорамбуцил),циклофосфамид, изосфамид, соединения нитромочевины, такие как кармустин, ломустин, семустин,стрептозоцин; противоопухолевые алкалоиды, такие как винкристин, винбластин; таксаны, такие как паклитаксел или таксотер; противоопухолевые антибиотики, такие как актиномицин; вещества, образующие соединение внедрения; противоопухолевые антиметаболиты, антагонисты фолатов, метотрексат,ингибиторы синтеза пуринов; аналоги пурина, такие как меркаптопурин, 6-тиогуанин; ингибиторы синтеза пиримидинов, ингибиторы ароматазы, капецитабин, аналоги пиримидина, такие как фторурацил,гемцитабин, цитарабин и цитозин арабинозид; брекинар; ингибиторы топоизомераз, такие как камтотецин или этопозид; гормональные противораковые агонисты и антагонисты, включая тамоксифен; ингибиторы киназы, имтиниб; ингибиторы факторов роста; противовоспалительные, такие как пентозан полисульфат, кортикостероиды, преднизон, дексаметазон; антитопоизомеразы, такие как этопозид, антрациклины, включая доксорубицин, блеомицин, митомицин и метрамицин; противораковые металлические комплексы, комплексы платины, цисплатин, карбоплатин, оксолиплатин; интерферон альфа, трифенилтиофосфорамид, алтретамин; антиангеогенные агенты; талидомид; иммунотерапевтические добавки; вакцины. В соответствии с настоящим изобретением соединения формулы (I) можно также вводить в комбинации с одним или несколькими другими активными веществами, пригодными в отношении одной из указанных патологий, например противорвотным, обезболивающим, противовоспалительным средством,средством от похудения.- 15014312 Можно также совмещать применение соединений по настоящему изобретению с лучевой терапией. Эти виды лечения могут использоваться одновременно, отдельно, последовательно. Лечение назначается врачом в зависимости от заболевания. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (1) 3. Соединение по любому из пп.1 или 2, отличающееся тем, что оно находится в форме нехиральной, или рацемической, или обогащенной стереоизомером, или обогащенной энантиомером; тем, что оно возможно превращено в соль и тем, что оно возможно является гидратированным или сольватированным. 4. Фармацевтическая композиция для профилактики или лечения нарушений, вызванных или обостренных пролиферацией клеток, отличающаяся тем, что она содержит соединение по любому из пп.1-3,а также по меньшей мере один фармацевически приемлемый эксципиент. 5. Фармацевтическая композиция по п.4, отличающаяся тем, что она дополнительно содержит по меньшей мере одно противораковое активное соединение. 6. Лекарственное средство для профилактики или лечения нарушений, вызванных или обостренных пролиферацией клеток, отличающееся тем, что оно содержит соединение по любому из пп.1-3, или соль присоединения этого соединения с фармацевтически приемлемой кислотой, или гидрат или сольват указанного соединения. 7. Применение соединения формулы (I) по любому из пп.1-3 в качестве противоракового агента. 8. Применение соединения по любому из пп.1-3 для производства лекарственного средства для профилактики или лечения нарушений, вызванных или обостренных пролиферацией клеток. 9. Применение по п.8 для лечения или профилактики лейкемий, солидных опухолей, первичных или метастатических карцином и рака. 10. Способ получения соединения формулы (I) по п.1, отличающийся тем, что вводят во взаимодействие соединение формулы- 16014312 11. Способ получения соединения по п.1, отличающийся тем, что вводят во взаимодействие:a) если R10 обозначает галоген или алкил-S(О)m-, где m=2, взаимодействие проводят в растворителе,предпочтительно полярном, при температуре от комнатной температуры до температуры кипения растворителя; в котором аминогруппа предварительно превращена в соль или защищена. 12. Способ по п.11, отличающийся тем, что в формуле (IIb) R10 представляет собой галоген.
МПК / Метки
МПК: A61K 31/519, C07D 471/04, A61P 35/00
Метки: производные, получение, пиридо[2,3-d]пиримидина, терапии, применение
Код ссылки
<a href="https://eas.patents.su/18-14312-proizvodnye-pirido23-dpirimidina-ih-poluchenie-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиридо[2,3-d]пиримидина, их получение, их применение в терапии</a>
Предыдущий патент: Бициклические [3.1.0] гетероариламиды в качестве ингибиторов переноса глицина типа i
Следующий патент: Гербицидные средства и способ борьбы с ростом нежелательных растений
Случайный патент: Способ удаления металлов из водного раствора путем осаждения известью