Производные индола и 2,3-дигидроиндола, их применение, фармацевтическая композиция и способ лечения
Номер патента: 1890
Опубликовано: 22.10.2001
Авторы: Мольтсен Айнер Кнуд, Перрегор Енс Кристиан, Смит Гаррик Пол, Миккельсен Иван
Формула / Реферат
1. Производное индола или 2,3-дигидроиндола, имеющее формулу
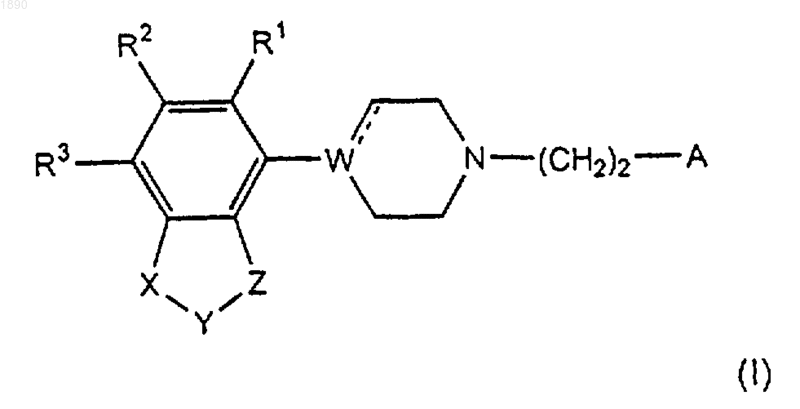
любой из его энантиомеров, или любая смесь их, или его кислотно-аддитивная соль,
где Х представляет -О-, -S- или -CR4R5-, и
Y представляет -CR6R7-, -CR6R7-CR8R9- или -CR6=CR7- или
Х и Y вместе образуют группу -CR4=CR5- или -СR4=СR5-СR6R7-;
Z представляет -О- или -S-;
W представляет N, С или СН;
А представляет группу, выбранную из группы формул (II), (III) и (IV)
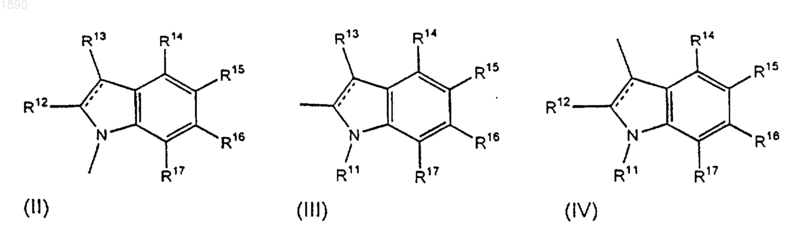
где пунктирные линии означают необязательную связь;
R1, R2, R3, R12, R13, R14, R15, R16 и R17, каждый независимо, выбран из водорода, галогена, трифторметила, С1-С4 алкила, С2-С4 алкенила, С2-С4 алкинила, С3-7 циклоалкила, С1-С4 алкокси, гидрокси, формила, СО-С1-4 алкила, амино, C1-4 алкиламино, (C1-4)2-диалкиламино, СО-С1-4 алкиламино, алкоксикарбониламино, аминокарбониламино, алкиламинокарбониламино, диалкиламинокарбониламино, нитро и циано;
R4, R5, R6, R7, R8 и R9, каждый независимо, выбран из водорода и C1-4 алкила и
R11 выбран из водорода, С1-4 алкила, С2-4 алкенила, С2-4 алкинила, С3-7 циклоалкила, арила, арил-С1-4 алкила, СО-С1-4 алкила и формила.
2. Соединения по п.1, где Z представляет -О-.
3. Соединения по п.1, где Z представляет -S-.
4. Соединения по п.1, где А представляет группу формулы (II).
5. Соединения по п.1, где А представляет группу формулы (III).
6. Соединения по п.1, где А представляет группу формулы (IV).
7. Соединения по п.2, где А представляет группу формулы (II).
8. Соединения по п.2, где А представляет группу формулы (III).
9. Соединения по п.2, где А представляет группу формулы (IV).
10. Соединения по п.3, где А представляет группу формулы (II).
11. Соединения по п.3, где А представляет группу формулы (III).
12. Соединения по п.3, где А представляет группу формулы (IV).
13. Соединения по пп.1-12, где R4, R5, R6, R7, R8 и R9 выбран из водорода или метила.
14. Соединение по п.1, которое представляет собой
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-5-хлор-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-5-бром-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-2-метил-1Н-индол,
6-хлор-3-[2-[4-(2,2,5-триметил-2,3-дигидробензофуран-7-ил)пиперидин-1-ил]этил]-1H-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-4-хлор-1Н-индол,
6-хлор-3-[2-[4-(2,2-диметил-2,3-дигидробензофуран-7-ил)пиперидин-1-ил]этил]-1H-индол,
6-хлор-3-[2-[4-(2,2-диметил-2,3-дигидробензофуран-7-ил)-1,2,3,6-тетрагидро-1-пиридил]этил]-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-5-фтор-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-5-метокси-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-1H-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-6-хлор-1H-индол,
3-[2-[4-(5-хлор-2,2-диметил-2,3-дигидробензофуран-7-ил)пиперазин-1-ил]этил]-1H-индол,
6-хлор-3-[2-[4-(5-хлор-3,3-диметил-2,3-дигидробензофуран-7-ил)-пиперазин-1-ил]этил]-1H-индол,
6-хлор-3-[2-[4-(6-хлор-2,2-диметил-3,4-дигидро-2Н-1-бензопиран-8-ил)пиперазин-1-ил]этил]-1H-индол,
6-хлор-3-[2-[4-(2,2-диметил-2,3-дигидробензофуран-7-ил)пиперазин-1-ил]этил]-1H-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-5-метил-1Н-индол или
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-6-метил-1H-индол,
6-хлор-3-[2-[4-(6-хлор-1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-1H-индол,
5-хлор-3-[2-[4-(2,3-дигидробензофуран-7-ил)пиперазин-1-ил]этил]-1H-индол,
3-[2-[4-(2,3-дигидробензофуран-7-ил)пиперазин-1-ил]этил]-5-фтор-1Н-индол,
3-[2-[4-(бензотиофен-7-ил)пиперазин-1-ил]этил]-5-хлор-1Н-индол,
3-[2-[4-(бензотиопиран-8-ил)пиперазин-1-ил]этил]-5-хлор-1Н-индол,
3-[2-[4-(бензотиопиран-8-ил)пиперазин-1-ил]этил]-5-бром-1Н-индол,
3-[2-[4-(бензотиопиран-8-ил)пиперазин-1-ил]этил]-6-хлор-1H-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)-1,2,3,6-тетрагидропиридин-1-ил]этил]-5-хлор-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)-1,2,3,6-тетрагидропиридан-1-ил]этил]-5-фтор-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперидин-1-ил]этил]-6-хлор-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперидин-1-ил]этил]-5-хлор-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперидин-1-ил]этил]-5-фтор-1Н-индол,
6-хлор-3-[2-[4-(2,3-дигидробензофуран-7-ил)-1,2,3,6-тетрагидропиридин-1-ил]этил]-1H-индол,
3-[2-[4-(бензофуран-7-ил)-1,2,3,6-тетрагидропиридин-1-ил]этил]-6-хлор-1Н-индол,
3-[2-[4-(бензофуран-7-ил)-1,2,3,6-тетрагидропиридин-1-ил]этил]-5-бром-1Н-индол,
3-[2-[4-(бензофуран-7-ил)-1,2,3,6-тетрагидропиридин-1-ил]этил]-5-фтор-1Н-индол,
3-[2-[4-(бензофуран-7-ил)пиперидин-1-ил]этил]-6-хлор-1Н-индол,
3-[2-[4-(бензофуран-7-ил)пиперидин-1-ил]этил]-5-фтор-1Н-индол,
3-[2-[4-(бензофуран-7-ил)пиперидин-1-ил]этил]-5-бром-1Н-тндол,
1-ацетил-3-[2-[4-(1,4-бензодиоксан-4-ил)пиперазин-1-ил]этил]-2,3-дигидро-1Н-индол,
1-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-5-фтор-1Н-индол,
1-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-6-хлор-1H-индол,
1-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-1H-индол,
1-[2-[4-(2,3-дигидробензофуран-7-ил)пиперазин-1-ил]этил]-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-2,3-дигид-po-1H-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-2,3-дигидро-5-фтор-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-5-хлор-2,3-дигидро-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-1-бутил-1Н-индол,
1-аллил-3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-1-пропаргил-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-2,3-дигидро-1-метил-1Н-индол,
3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-1-бензил-2,3-дигидро-1Н-индол,
1-аллил-3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-2,3-дигидро-1Н-индол,
1-ацетил-3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-1Н-индол,
3-[2-[4-(бензо-1,4-дитиан-5-ил)пиперазин-1-ил]этил]-5-хлор-1Н-индол,
3-[2-[4-(бензо-1,4-дитиан-5-ил)пиперазин-1-ил]этил]-6-хлор-1H-индол,
3-[2-[4-(бензо-1,4-дитиан-5-ил)пиперазин-1-ил]этил]-5-фтор-1Н-индол,
3-[2-[4-(бензо-1-тиа-4-оксан-5-ил)пиперазин-1-ил]этил]-5-хлор-1Н-индол,
3-[2-[4-(бензо-1-тиа-4-оксан-5-ил)пиперазин-1-ил]этил]-6-хлор-1Н-индол и
3-[2-[4-(бензо-1-тиа-4-оксан-5-ил)пиперазин-1-ил]этил]-5-фтор-1H-индол или его кислотно-аддитивную соль.
15. Фармацевтическая композиция, включающая соединение по пп.1-14 или его фармацевтически приемлемую кислотно-аддитивную соль и, по меньшей мере, один фармацевтически приемлемый носитель или разбавитель.
16. Применение соединения по пп.1-14 или его фармацевтически приемлемой кислотно-аддитивной соли для приготовления лекарственного средства для лечения нарушения или болезни, восприимчивых к ингибированию повторного поглощения серотонина и антагонизму 5-НТ1А-рецепторов.
17. Применение соединения по п.16, где лекарственное средство предназначается фыя лечения аффективных нарушений, включая депрессию, психоз, тревожные нарушения, включая общее тревожное нарушение, паническое нарушение и навязчивое компульсивное нарушение.
18. Способ лечения нарушения или болезни животного, включая человека, восприимчивой к ингибированию повторного поглощения серотонина и антагонизму 5-НТ1А-рецепторов, включающий введение такому животному, включая человека, терапевтически эффективного количества соединения по пп.1-14 или его фармацевтически приемлемой кислотно-аддитивной соли.
19. Способ лечения по п.18, где нарушение или болезнь представляет собой аффективное нарушение, включая депрессию, психоз, тревожные нарушения, включая общее тревожное нарушение, паническое нарушение и навязчивое компульсивное нарушение.
Текст
1 Данное изобретение относится к новым производным индола и 2,3-дигидроиндола, которые являются сильнодействующими ингибиторами повторного поглощения серотонина,фармацевтическим препаратам, содержащим эти соединения, и использованию их для лечения нарушений или болезней, восприимчивых к ингибированию повторного поглощения серотонина. Соединения изобретения обладают также антагонистической активностью 5-НТ 1Aрецепторов и считаются особенно полезными для лечения депрессии. Предшествующий уровень Селективные ингибиторы повторного поглощения серотонина (или 5-НТ, 5-гидрокситриптамин) (SSRI), такие как флуоксетин, пароксетин, сертралин, флувоксамин и циталопрам,представляют собой основную стадию в лечении депрессии, поскольку они имеют меньшие и менее серьезные побочные действия по сравнению с антидепрессантами первого поколения(трициклические соединения и неселективные ингибиторы моноаминоксидазы (МАО. Побочные действия, связанные с антидепрессантами первого поколения, такие, что они заставляют некоторых пациентов отказаться от лечения.SSRI и все другие антидепрессанты, доступные в настоящее время, проявляют серьезный недостаток, заключающийся в том, что для достижения терапевтического эффекта необходимы несколько недель лечения. Позднее начало действия представляет собой значительную проблему, особенно при лечении пациентов с серьезной депрессией и суицидным потенциалом. Кроме того, каждый третий пациент не восприимчив к SSRI. Электрофизиологическими экспериментами на крысах было показано, что срочное введение SSRI снижает сжигание 5-НТ-нейронов(серотонинергические нейроны) ядра дорсального шва в головном мозге грызунов, тогда как длительное лечение SSRI ведет к нормализации сжигающей активности 5-НТ-нейронов (Arborelius, L. Et al., Naunyn-Schmiedeberg's Arch.J. Pharmacol. 1995, 115, 1064; Chaput, Y. Et al,Naunyn-Schimiedeberg's Arch. Pharmacol. 1986,33, 342). Кроме того, было обнаружено, что восстановление сжигающей активности 5-НТнейронов связано с десенсибилизацией соматодендритных 5-НТ 1A-ауторецепторов (Le Poul, Е.et al, Naunyn-Schimiedeberg's Arch. Pharmacol. 1995, 352, 141; Invernizzi, R. Et al, Eur. J. Pharmacol. 1944, 260, 243). Было также предположено, что одновременное введение SSRI's и агента, вызывающего быструю десенсибилизацию или ингибирование 5-НТ 1 А-рецептор-медиированного механизма обратной связи, приведет к быстрому началу антидепрессивного действия (Artigas, F. et al,Trends Neurosci. 1966, 19, 378; De Vry, J., et al,Drug News Perspec. 1996, 9, 270). 2 Действие комбинированного введения соединения, которое ингибирует повторное поглощение серотонина, и антагониста 5-HT1Aрецептора было оценено в нескольких исследованиях (Innis, R.B. et al., Eur. J. Pharmacol., 1987,143, р 195-204 and Gartside S.E., Br. J. Pharmacol. 1995, 115, р 1064-1070, Blier, P. et al, TrendsPharmacol. Sci. 1994, 15, 220). В этих исследованиях было обнаружено, что антагонисты 5 НТ 1A-рецептора ингибируют снижение в сгорании, вызванном экстренным введением ингибиторов повторного поглощения серотонина. Кроме того, лечение комбинацией пиндолола (хорошо известный антагонист 5-НТ 1Aрецептора и -адренорецептора) и SSRI's было оценено в клинических испытаниях. Сообщалось о замечательном улучшении в настроении пациентов в пределах одной недели. Кроме того, было показано, что комбинированное введение пиндолола и SSRI оказывает хорошее действие на пациентов, которые были невосприимчивы к лечению доступными в настоящее время антидепрессантами. (Artigas F. et al., Arch. Gen.Psychiatry, 1994, 51, р 248-251 and Blier, P. et al.,J. Clin. Psychopharmacol. 1995, 15, р 217-2220). Было зарегистрировано несколько заявок на патенты, которые включают использование комбинации 5-НТ 1 А-антагониста и ингибитоpa повторного поглощения, серотонина для лечения депрессии (см. Европейские патенты ЕР-А 2687472 и ЕР-А 2-714663). В европейском патенте ЕР-А 1-529462 описаны некоторые производные 1,4-бензодиоксана, имеющие общую формулу где В представляет необязательно замещенную индол-3-ильную группу и Q представляет CnH2n,где n равно 1, 2, 3, 4, 5 или 6. Указывается, что эти соединения обладают серотонинагонистической и серотонин-антагонистической активностью, а также ингибирующей повторное поглощение серотонина активностью, их можно использовать в качестве анксиолитииков, антидепрессантов, антипсихотических, гипотензивных и цереброзащитных агентов. В патенте США 5200943, Perregaard et где Y представляет О или S, Z представляет О, S или -СН 2- и n равно 1, 2 или 3. Указанные соединения являются ценными лигандами 5-НТ 1A-рецептора. Цель изобретения Целью данного изобретения является предоставление соединений с сильной ингибирующей повторное поглощение серотонина активностью, а также с антагонистическими свойствами у 5-HT1A-рецепторов. Такие соединения можно использовать в качестве лекарственных средств с быстрым началом действия для лечения аффективных расстройств, таких как депрессия. Следующей целью данного изобретения является предложение фармацевтической композиции, включающей вышеуказанные соединения в качестве активных ингредиентов. Краткое изложение изобретения Изобретение затем, между прочим, включает следующие соединения, отдельно или в комбинации. Производное индола или 2,3-дигидроиндола, имеющее формулу любой из его энантиомеров или любая их смесь,или его кислотно-аддитивная соль,где Х представляет -О-, -S- или -CR4R5-, иY представляет -CR6R7-, -CR6R7-CR8R9 или -CR6=CR7- или Х и Y вместе образуют группу -CR4=CR5 или -CR4=CR5-CR6R7-;W представляет N, С или СН; А представляет группу, выбранную из группы формул (II), (III) и (IV) где пунктирная линия означает необязательную связь; 4 ла, амино, алкиламино, диалкиламино, ациламино, алкоксикарбониламино, аминокарбониламино, алкиламинокарбониламино, диалкиламинокарбониламино, нитро, циано и арила или арилалкила, где арил может быть замещен галогеном, трифторметилом, алкокси, гидрокси,амино, алкиламино, нитро и циано;R11 выбран из водорода, алкила, алкенила,алкинила, циклоалкила, арила, арилалкила, ацила и формила. В одном варианте изобретения Z представляет -О- и другие заместители такие, как определено выше. В другом варианте изобретения Z представляет -S- и другие заместители такие, как определено выше. В третьем варианте изобретения А представляет группу формулы (II) и другие заместители такие, как определено выше. В четвертом варианте изобретения А представляет группу формулы (III) и другие заместители такие, как определено выше. В пятом варианте изобретения А представляет группу формулы (IV) и другие заместители такие, как определено выше. Таким образом, в специальном варианте изобретения А представляет группу формулы(II) и Z представляет -О-, А представляет группу формулы (III) и Z представляет -О-, А представляет группу формулы (IV) и Z представляет -О-,А представляет группу формулы (II) и Z представляет -S-, А представляет группу формулы(III) и Z представляет -S- или А представляет группу формулы (IV) и Z представляет -S-. В следующем варианте изобретения R4, R5,6 7R , R , R8 и R9 выбран из водорода или метила. Примеры соединений по данному изобретению представляют 3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-5-хлор-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-5-бром-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-2-метил-1 Н-индол,6-хлор-3-[2-[4-(2,2,5-триметил-2,3-дигидробензофуран-7-ил)пиперидин-1-ил]этил]-1Hиндол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-4-хлор-1 Н-индол,6-хлор-3-[2-[4-(2,2-диметил-2,3-дигидробензофуран-7-ил)пиперидин-1-ил]этил]-1Hиндол,6-хлор-3-[2-[4-(2,2-диметил-2,3-дигидробензофуран-7-ил)-1,2,3,6-тетрагидро-1-пиридил] этил]-1H-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-5-фтор-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-5-метокси-1 Н-индол, 5 3-[2-[4-(бензо-1-тиа-4-оксан-5-ил)пиперазин-1-ил]этил]-5-фтор-1 Н-индол,или их кислотно-аддитивные соли. Изобретение относится также к фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль и, по меньшей мере, один фармацевтически приемлемый носитель или разбавитель. В следующем варианте изобретение относится к использованию соединения формулы (I) или его фармацевтически приемлемой кислотно-аддитивной соли для приготовления лекарственного средства для лечения нарушения или болезни, восприимчивой к ингибированию повторного поглощения серотонина и антагонизму 5-НТ 1 А-рецепторов. В частности, изобретение относится к использованию соединения по данному изобретению или его фармацевтически приемлемой кислотно-аддитивной соли для приготовления лекарственного средства для лечения аффективных нарушений, таких как депрессия, психоз,тревожные нарушения, включая общее тревожное нарушение, паническое нарушение и навязчивое компульсивное нарушение. Еще в одном варианте данное изобретение относится к способу лечения нарушения или болезни живого животного организма, включая человека, восприимчивых к ингибированию повторного поглощения серотонина и антагонизму 5-НТ 1 А-рецепторов, включающий введение в такой животный организм, включая человека, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой кислотно-аддитивной соли. В частности, изобретение относится к способу лечения аффективных нарушений, таких как депрессия, психоз, тревожные нарушения,включая общее тревожное нарушение, паническое нарушение и навязчивое компульсивное нарушение, включающему введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой кислотно-аддитивной соли живому животному организму, включая человека, нуждающемуся в этом. Благодаря их комбинированному действию, антагонизму 5-НТ 1 А-рецепторов и ингибированию повторного поглощения серотонина,считают, что соединения изобретения особенно можно использовать в качестве лекарственных средств с быстрым началом действия для лечения депрессии. Соединения могут быть также полезны для лечения депрессии у пациентов,которые невосприимчивы к лечению доступными в настоящее время антидепрессантами. Считается, что соединения, заявленные здесь, можно использовать для лечения депрессии, требующей быстрого начала действия, или депрессии, которая невосприимчива к другим антидепрессантам. 8 Галоген означает фтор, хлор, бром или иод. Алкил означает неразветвленную или разветвленную цепь, содержащую от одного до четырех атомов углерода, включая, например,метил, этил, пропил, изопропил и бутил. Алкенил означает цепь из атомов углерода от двух до четырех, содержащую одну двойную связь, включая, например, этенил, 1,2-пропенил,2,3-пропенил и т.д. Алкинил означает цепь из атомов углерода от двух до четырех, содержащую одну тройную связь, включая, например, этинил, 1,2 пропинил, 2,3-пропинил и т.д. Циклоалкил означает циклический алкил,содержащий от трех до семи атомов углерода,включая циклопропил, циклобутил и т.д. Алкокси означает -О-алкил, где алкил такой, как определено выше. Ацил означает -СО-алкил, где алкил такой,как определено выше. Алкиламино означает -NH-алкил и диалкиламино означает N-(алкил)2, где алкил такой,как определено выше. Ациламино означает -NН-ацил, где ацил такой, как определено выше. Алкоксикарбониламино означает алкил-OCO-NH-, где алкил такой, как определено выше. Алкиламинокарбониламино означает алкил-NH-CO-NH-, где алкил такой, как определено выше. Диалкиламинокарбониламино означает(алкил)2-NH-CO-NH-, где алкил такой как определено выше. Арил означает ароматическое кольцо, такое как фенил или нафтил. Арилалкил означает арилалкил, где арил и алкил такие, как определено выше. Примерами органических кислотноаддитивных солей по изобретению являются соли с малеиновой, фумаровой, бензойной, аскорбиновой,янтарной,щавелевой,бисметиленсалициловой, метансульфоновой, этансульфоновой, уксусной, пропионовой, винной,салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой, аспарагиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой, бензолсульфоновой и теофиллинуксусной кислотами, а также 8 галогентеофиллинами, например, 8-бромтеофиллином. Примерами неорганических кислотно-аддитивных солей по данному изобретению являются соли с хлористо-водородной, бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислотами. Кислотноаддитивными солями изобретения предпочтительно являются фармацевтически приемлемые соли, образованные с нетоксичными кислотами. Кроме того, соединения данного изобретения могут существовать в несольватированных,а также в сольватированных формах с фарма 9 цевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. В общем, для целей данного изобретения сольватированные формы рассматриваются как эквивалентные несольватированным формам. Некоторые соединения данного изобретения содержат хиральные центры, и такие соединения существуют в форме изомеров (т.е. энантиомеров). Изобретение включает все такие изомеры и любые их смеси, включая рацемические смеси. Рацемические формы можно расщепить на оптические антиподы известными способами,например, разделением их диастереоизомерных солей оптически активной кислотой, и выделением оптически активного соединения-амина обработкой основанием. Другой способ расщепления рацематов на оптические антиподы основан на хроматографии на оптически-активной матрице. Рацемические соединения данного изобретения можно, таким образом, расщепить на их оптические антиподы, например, фракционной кристаллизацией, например, d- или 1(тартратных, манделатных или камфорасульфонатных) солей. Соединения данного изобретения можно также расщепить путем образования диастереомерных производных. Можно использовать дополнительные способы расщепления оптических изомеров, известные специалистам в данной области. Такие способы включают способы, обсуждаемые J.Jaques, A. Collet and S. Wilen in "Enantiomers,Racemates and Resolutions', John Wiley and Sons,New York (1981). Оптически активные соединения можно также получить из оптически активных исходных материалов. Соединения изобретения можно получить одним из следующих способов, включающих а) восстановление карбонильных групп соединения формулыG представляет подходящую отщепляемую группу, такую как галоген, мезилат или тозилат; с) восстановительное алкилирование амина формулы где R1-R3, X, Y, Z, W и пунктирная линия такие,как определено выше, реагентом формулы BCH2-A, где А такой, как определено выше, и В представляет группу либо альдегида, либо карбоновой кислоты;d) восстановление двойной связи индолов формулы где R1-R3, X, Y, Z, W и пунктирная линия такие,как определено выше, и А' представляет группу формулы (II), (III) или (IV), как указано выше, в которой пунктирная линия представляет связь,для получения соответствующих производных 2,3-дигидроиндола; е) восстановление двойной связи тетрагидропиридинов формулы где R1- R3, А, X, Y и Z такие, как определено выше, для получения соответствующих производных пиперидина;f) обработку соединения общей формулы(I), где Y представляет -CR6=CR7- или где Х и Y вместе образуют группу -CR4=CR5- или-CR4=CR5-CR6R7, восстанавливающим агентом для восстановления двойной связи, получая таким образом, соответствующую восстановленную циклическую систему;g) восстановительное удаление одного или нескольких заместителей R1-R3 или R12-R17 у соединения общей формулы (I), у которого один или несколько из указанных заместителей выбраны из хлора, брома или иода; где А такой, как определено выше, и G представляет подходящую отщепляемую группу,такую как галоген, мезилат или тозилат; где R1- R3, X, Y, Z и W такие, как определено выше, и G представляет подходящую отщепляемую группу, такую как галоген, мезилат или тозилат; илиj) алкилирование или ацилирование атома азота индола соединений формулы где R1- R3, X, Y, Z, W и пунктирная линия такие,как определено выше, и А" представляет группу, выбранную из группы формулы (III) или(IV), как показано выше, в которых R11 представляет водород, алкилирующими или ацилирующими реагентами формулы R11-G, где G представляет подходящую отщепляемую группу, такую как галоген, мезилат или тозилат, иR11 такой, как определено выше, но не водород; после чего соединения формулы (I) выделяют как свободное основание или в форме его кислотно-аддитивной соли. Восстановление по способу а) предпочтительно проводят в инертном органическом рас 001890 12 творителе, таком как диэтиловый простой эфир или тетрагидрофуран, в присутствии литийалюминийгидрида при температуре дефлегмации. Исходные соединения формулы (V) обычно получают из реагентов формулы (VI), 1,3 незамещенных индолов и оксалилхлоридов, как описано в приведенных ниже примерах. Алкилирование по способу b) удобно проводят в инертном органическом растворителе,таком как спирт или кетон с подходящей температурой кипения предпочтительно в присутствии основания (карбонат калия или триэтиламин) при температуре дефлегмации. Производные арилпиперазинов формулы(VI) удобно получают из соответствующего ариламина по способу, описанному Martin et al,J. Med. Chem., 1989, 32, 1052, или способу, описанному Kruse et al, Rec. Trav. Chim. Pays-Bas,1988, 107, 303. Исходные ариламины либо коммерчески доступны, либо хорошо описаны в литературе. Производные арилтетрагидропиридинов формулы (VI) хорошо известны из литературы,ср. патент США 2891066; McElvain et al, J.Amer. Chem. Soc. 1959, 72, 3134. Удобно, когда соответствующий арилбромид литиируют BuLi с последующим добавлением 1-бензил-4 пиперидона. Последующая обработка кислотой дает N-бензиларилтетрагидропиридин. Бензильную группу можно затем удалить каталитическим гидрированием или обработкой, например, этилхлорформиатом с получением соответствующего этилкарбамата с последующим кислотным или щелочным гидролизом. Исходные арилбромиды либо коммерчески доступны, либо хорошо описаны в литературе. Реагенты формулы G-CH2CH2-A либо коммерчески доступны, либо могут быть получены литературными способами, например, из соответствующего производного уксусной кислоты восстановлением в 2-гидроксиэтилпроизводное и превращением гидроксигруппы в группу G общепринятыми способами. Восстановительное алкилирование по способу с) проводят стандартными литературными способами. Реакцию можно проводить в две стадии, т.е. сочетанием (VI) и реагента формулыB-CH2-A стандартными способами через образование хлорангидрида карбоновой кислоты или путем использования сочетающих реагентов,таких как, например, дициклогексилкарбодиимид, с последующим восстановлением получаемого амида литийалюминийгидридом. Реакцию можно также проводить стандартной методикой в одном сосуде. Карбоновые кислоты или альдегиды формулы B-CH2-A, либо коммерчески доступны, либо описаны в литературе. Восстановление двойной связи индола по способу d) удобно проводят обработкой дибораном или предшественником диборана, таким как комплекс с триметиламином или диметилсульфидом, в инертном растворителе, таком как 13 тетрагидрофуран или диоксан, при температуре от 0 С до температуры дефлегмации с последующим катализируемым кислотой гидролизом промежуточного производного борана. Восстановление можно альтернативно проводить обработкой цианоборогидридом натрия в трифторуксусной кислоте. Восстановление двойных связей по способам е) и f) очень удобно проводят путем гидрирования в спирте в присутствии катализатора типа благородного металла, такого как, например, платина или палладий. Удаление галогеновых заместителей по способу g) удобно проводят каталитическим гидрированием в спирте в присутствии палладиевого катализатора или обработкой формиатом аммония в спирте при повышенных температурах в присутствии палладиевого катализатора. Диалкилирование аминов по способам h) иi) очень удобно проводят при повышенных температурах в инертном растворителе, таком как хлорбензол, толуол, N-метилпирролидон, диметилформамид или ацетонитрил. Реакцию можно проводить в присутствии основания, такого как,например, карбонат калия или триэтиламин. Исходные материалы для способов h) и i) коммерчески доступны или их можно получить из коммерчески доступных материалов с использованием общепринятых способов.N-Алкилирование по способу j) проводят в инертном растворителе, таком как, например,спирт или кетон, при повышенных температурах в присутствии основания, например, карбоната калия или триэтиламина, при температуре дефлегмации. Альтернативно, можно использовать реагент переноса фаз. Следующие примеры будут далее иллюстрировать изобретение. Они, однако, не должны толковаться как ограничение изобретения. Примеры Галоген-, метил- или метоксизамещенные индолы, использованные, как описано в примере 1, являются коммерчески доступными. Замещенные 2-(1-индолил)уксусные кислоты, использованные, как описано в примере 3, получают из соответствующего замещенного индола и этилбромацетата общепринятыми способами. Замещенные 3-(2-бромэтил)индолы, использованные, как описано в примере 2, получают из соответствующего сложного эфира 2(1-индолил)уксусной кислоты восстановлением в спирт литийалюминийгидридом и последующей обработкой системой тетрабромметан/трифенилфосфин по стандартным литературным методам. Арилпиперазины, использованные, как описано в примерах 1, 2 и 3, получают из соответствующего ариламина по способу, описанному Martin et al, J. Med. Chem. 32 (1989) 1052, 001890Trav. Chim. Pays-Bas 107 (1988) 303. Исходные ариламины либо коммерчески доступны, либо описаны в литературе следующим образом. Синтез 5-амино-1,4-бензодиоксана описанDauksas et al, Zh. Org. Khim. 3 (1967) 1121. Соответствующие хлорированные производные получают аналогичным способом. Синтез 7-амино-2,3-дигидробензофурана описан в заявке на патент США 4302592. Синтез 7-аминобензофурана описан VanBoswell et al, J. Heterocycl. Chem. 5 (1968) 69. 7-Амино-2,3-диметилбензофуран и соответствующие 5-хлор- и 5-метилпроизводные получают по выложенному описанию (Ger. Offen) патента Германии 3526510. 4-Аминобензотиопиран получают по заявке на Европейский патент 79683. 8-Амино-6-хлор-2,2-диметилбензопиран был получен общепринятым нитрованием 6 хлор-2,2-диметилбензопирана (получен по способу Bolzoni et al, Angew. Chem. 90 (1978) 727) с последующим восстановлением полученного 8 нитропроизводного. Аналогичным способом 7-амино-5-хлор 3,3-диметилбензофуран был получен из 5-хлор 3,3-диметилбензофурана (получен по заявке на Европейский патент 7719 800206). Соответствующие дехлорпроизводные были получены обработкой газообразным водородом в присутствии катализатора типа благородного металла по стандартным методикам. Производные арилтетрагидропиридинов известны из литературы (ср. патент США 2891066 или McElvain et al, J. Amer. Chem. Soc. 72 (1959) 3134). Более удобно, соответствующий арилбромид литиируют BuLi с последующим добавлением 1-бензил-4-пиперидона. Последующая обработка минеральной кислотой или трифторуксусной кислотой дает Nбензиларилтетрагидропиридин. Бензильную группу можно удалить каталитическим гидрированием или обработкой, например, этилхлорформиатом с образованием соответствующего этилкарбамата с последующим кислотным или щелочным гидролизом. Соответствующие производные пиперидина можно получить восстановительным удалением двойной связи тетрагидропиридинового кольца. Все указанные методики хорошо известны специалистам в данной области. Исходные арилбромиды хорошо описаны в литературе. Аналогичным способом были получены 4-(1,4-бензодиоксан-5-ил)-1,1,3,6-тетрагидропиридин,4-(2,3-дигидро-2,2 диметилбензофуран-7-ил)-1,2,3,6-тетрагидропиридин,4-(2,3-дигидробензофуран-7-ил)1,2,3,6-тетрагидропиридин,4-(бензофуран-7 ил)-1,2,3,6-тетрагидропиридин и соответствующие пиперидины. 15 Точки плавления были определены на приборе Buchi SMP-20 и не корректированы. Масс-спектры получали на системе Quattro MSMS от VG Biotech, Fisons Instrument. MS-MSсистема была соединена с модулярной системой ВЭЖХ HP 1050. Образец в объеме 20-50 мкл (10 мкл/мл), растворенный в смеси 1% уксусной кислоты в смеси 1:1 ацетонитрил/вода, вводили через автоприбор для ввода проб при истечении 30 мкл/мин в источник электрораспыления. Спектры были получены при двух стандартных сериях условий операции. Одну серию проводили для получения информации о молекулярной массе (МН+) (21 эВ) и вторую серию проводили для получения картин фрагментации (70 эВ). Фон вычитали. Относительные интенсивности ионов получали из картины фрагментации. Когда интенсивность не обнаруживается для молекулярного иона (МН+), этот ион присутствовал только в первой серии условий операции. 1 Н ЯМР-спектры регистрировали для всех новых соединений при 250 МГц на Bruker AC 250 или при 500 МГц на Bruker DRX 500. В качестве растворителей использовали дейтерированный хлороформ (99,8% D) или диметилсульфоксид(99,9% D). ТМС (тетраметилсилан) использовали в качестве внутреннего эталонного стандарта. Химические сдвиги выражали в величинах м.д. Для мультиплетности сигналов ЯМР используются следующие аббревиатуры: с = синглет, д = дублет, т = триплет, к = квартет, кви = квинтет, г = гептет, дд = двойной дублет, дт = двойной триплет, дк = двойной квартет, тт = триплет триплетов, м = мультиплет. ЯМРсигналы, соответствующие кислотным протонам, обычно не включают. Содержание воды в кристаллических соединениях определяли титрованием по Карлу Фишеру. Стандартные рабочие процедуры относятся к экстракции указанным органическим растворителем из подходящих водных растворов, сушке объединенных органических экстрактов (безводным MgSO4 или Na2SO4), фильтрованию и испарению растворителя в вакууме. Для колоночной хроматографии использовали силикагель типа Kieselgel 60, 230-400 меш по ASTM. Пример 1. Оксалат 3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-5-хлор-1Hиндола, 1a. Раствор 5-хлориндола (5,0 г) в диэтиловом простом эфире (130 мл) охлаждают до 0 С в атмосфере азота, затем по каплям добавляют раствор оксалилхлорида (4,6 г) в диэтиловом простом эфире (20 мл). После перемешивания в течение 16 ч кристаллический продукт, 2-(5 хлор-1 Н-индол-3-ил)-2-оксоацетилхлорид, собирают фильтрованием (7,2 г). Раствор полученного продукта (2,0 г) в тетрагидрофуране (25 мл) по каплям добавляют к смеси 1-(1,4 бензодиоксан-5-ил)пиперазина (1,2 г) и триэтиламина (7,5 мл) в тетрагидрофуране (75 мл) при комнатной температуре. Смесь перемешивают в 16 течение 16 ч с последующим фильтрованием и удалением растворителя в вакууме, получая 3[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]1,2-диоксоэтил]-5-хлор-1 Н-индол в виде твердого продукта. Указанный продукт растворяют в тетрагидрофуране (25 мл) и добавляют по каплям к суспензии литийалюминийгидрида (2,1 г) в тетрагидрофуране при комнатной температуре в атмосфере азота. После кипячения в колбе с обратным холодильником в течение 3,5 ч реакционную смесь гасят водным гидроксидом натрия и затем стандартным образом обрабатывают этилацетатом. Получаемое масло очищают флэш-хроматографией (элюент: гептан/этанол/ этилацетат/триэтиламин, 15:2:2:1). Оксалатную соль получают из раствора в ацетоне добавлением щавелевой кислоты и перекристаллизовывают из смеси метанол/тетрагидрофуран (1:5),получая 0,8 г 1 а, т.пл.: 224-28 С. 1 Н ЯМР (ДMCO-d6): 3,05 (т, 2 Н); 3,10-3,50(д, 1 Н); 7,65 (с, 1 Н); 11,15 (с, 1 Н). МС m/z (%): 398 (МН+, 9%), 233 (100%),221 (29%), 218 (19%), 178 (59%). Аналогично получают следующие соединения: Оксалат 3-[2-[4-(1,4-бензодиоксан-5-ил) пиперазин-1-ил]этил]-5-бром-1 Н-индола,1b,т.пл. 236-40 С. 1(10%), 143 (24%). Оксалат 3-[2-[4-(бензофуран-7-ил)пиперидин-1-ил]этил]-5-бром-1H-индола, 1dd, т.кип. 153-57 С. 1 Н ЯМР (ДМСО-d6): 2,05-2,20 (м, 4 Н); 3,05-3,20 (м, 4 Н); 3,20-3,40 (м, 3 Н); 3,70 (д, 2 Н); 6,95 (с, 1 Н); 7,15-7,25 (м, 3 Н); 7,30-7,40 (м, 2 Н); 7,55 (д, 1 Н); 7,80 (с, 1 Н); 8,00 (с, 1 Н); 11,20 (с,1 Н). МС m/z (%): 423 (МН+, 36%), 224 (27%),202 (45%), 143 (27%), 117 (18%). Пример 2. Полуфумарат 3-[2-[4-(1,4 бензодиоксан-5-ил)пиперазин-1-ил]этил]-1 Ниндола, 2 а. Смесь 3-(2-бромэтил)-1H-индола (1,5 г), 1(1,4-бензодиоксан-5-ил)пиперазина (1,2 г), карбоната калия (1,9 г) и иодида калия (0,1 г) в метилизобутилкетоне (100 мл) кипятят с обратным холодильником в течение 16 ч. Стандартная обработка этилацетатом дает масло, которое очищают флэш-хроматографией (элюент: гептан/этанол/этилацетат/триэтиламин, 15:2:2:1). Фумаратную соль получают из раствора в этаноле добавлением фумаратовой кислоты. Перекристаллизация из этанола дает полуфумарат 2 а(дд, 1 Н); 6,75 (т, 1 Н); 7,00 (т, 1 Н); 7,20 (т, 1 Н); 7,30 (д, 1 Н); 8,0 (д, 1 Н). МС m/z (%): 408 (МН+, 54%), 233 (17%),178 (100%). 119 (20%). Пример 3. Полуфумарат 3-[2-[4-(1,4 бензодиоксан-5-ил)пиперазин-1-ил]этил]-6 хлор-1 Н-индола, 3 а. Смесь 2-(6-хлор-1 Н-индол-3-ил)уксусной кислоты (2,0 г), 1-(1,4-бензодиоксан-5-ил) пиперазина (3,6 г), N,N-дициклогексилкарбодиимида (2,4 г) и 4-диметиламинопиридина (0,2 г) в сухом тетрагидрофуране (100 мл) перемешивают в течение 16 ч при комнатной температуре в атмосфере азота. Фильтрование и стандартная обработка метиленхлоридом дают масло, которое очищают флэш-хроматографией(элюент: этилацетат/гептан/метанол, 16:3:1),получая 3-[2-[4-(1,4-бензодиоксан-5-ил)пиперидин-1-ил]-2-оксоэтил]-6-хлор-1 Н-индол в виде масла (2,0 г). Масло растворяют в тетрагидрофуране (25 мл) и добавляют по каплям к суспензии литийалюминийгидрида (0,9 г) в сухом тетрагидрофуране (50 мл) при комнатной температуре с последующим кипячением с обратным холодильником в течение 3 ч. Гашение 2 М водным гидроксидом натрия и стандартная обработка дают свободное основание 3 а в виде масла (1,9 г). Полуфумаратную соль, 3 а (1,0 г), получают из раствора в этаноле добавлением фумаровой кислоты. Т.пл. 215-16 С. 1(т, 1 Н); 7,00 (дд, 1 Н); 7,25 (д, 1 Н); 7,40 (д, 1 Н); 7,55 (д, 1 Н); 10,95 (с, 1 Н). МС m/z (%): 398 (МН+, 10%), 234 (13%),233 (100%), 178 (12%). Аналогично получали следующие соединения: Полуфумарат 3-[2-[4-(5-хлор-2,2-диметил 2,3-дигидробензофуран-7-ил)пиперазин-1-ил] этил]-1 Н-индола, 3b, т.пл. 210-12 С. 1 Н ЯМР (ДMCO-d6): 1,40 (с, 6 Н); 2,55-2,75(дд, 2 Н). МС m/z (%): 348 (МН+, 38%), 231 (50%),201 (100%), 174 (25%), 162 (41%), 146 (98%). Пример 4. Сесквиоксалат 3-[2-[4-(1,4 бензодиоксан-5-ил)пиперазин-1-ил]этил]-2,3 дигидро-1H-индола, 4 а. Раствор 2 а (16 г) в трифторуксусной кислоте (200 мл) обрабатывают по порциям борогидридом натрия (22,9 г, интервал 1,5 ч) при комнатной температуре с последующим перемешиванием в течение 2,5 ч при комнатной температуре. Реакционную смесь выливают на лед и делают щелочной водным гидроксидом натрия с последующей стандартной обработкой. Получаемое масло очищают флэш-хроматографией (элюент: гептан/этилацетат/этанол/ триэтиламин, 15:2:2:1), получая указанное в заголовке основание в качестве желтого масла(13,8 г). Указанный в заголовке оксалат получают из свободного основания (1,4 г) в виде кристаллического материала из этанола добавлением щавелевой кислоты (0,9 г). Т.пл. 14550 С. ЯМР (ДМСО-d6): 1,75-1,85 (м, 1 Н); 2,052,15 (м, 1 Н); 2,95-3,30 (м, 12 Н); 3,60 (т, 1 Н); 4,20(д, 4 Н); 6,50 (д, 2 Н); 6,60 (д, 2 Н); 6,75 (т, 1 Н); 6,95 (т, 1 Н); 7,10 (д, 1 Н). МС m/z (%): 366 (МН+, 10%), 221 (10%),178 (14%), 150 (20%), 118 (100%). Аналогично получали следующие соединения: Полуоксалат 3-[2-[4-(1,4-бензодиоксан-5 ил)пиперазин-1-ил]этил]-2,3-дигидро-5-фтор 1 Н-индола, 4b, т.пл. 201-5 С. 1(т, 2 Н); 6,75 (т, 1 Н); 7,05 (д, 1 Н). МС m/z (%): 400 (МН+, 14%), 221 (52%),180 (22%), 152 (100%). Пример 5. Оксалат 3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-1-бутил-1 Ниндола, 5 а. Раствор 2 а (1,0 г) в сухом тетрагидрофуране (50 мл) по каплям добавляют к суспензии гидрида натрия (60% в минеральном масле, 0,14 г) в тетрагидрофуране (25 мл) при комнатной температуре. После перемешивания в течение 30 мин по каплям добавляют раствор 1 бромбутана (0,85 г) в сухом тетрагидрофуране(10 мл). Перемешивание в течение 1 ч с последующей стандартной обработкой дает масло,которое очищают флэш-хроматографией (элюент: гептан/этилацетат/триэтиламин, 15:3:2). Получаемое масло превращают в оксалатную соль (0,7 г) из ацетона добавлением щавелевой кислоты. Т.пл. 168-74 С. ЯМР (ДMCO-d6): 0,90 (т, 3 Н); 1,25 (квин,2 Н); 1,70 (квин, 2 Н); 3,05 (т, 2 Н); 3,15-3,40 (м,8 Н); 4,10 (т, 2 Н); 4,15-4,30 (м, 4 Н); 6,55 (д, 1 Н); 6,60 (д, 1 Н); 6,75 (т, 1 Н); 7,05 (т, 1 Н); 7,15 (т,1 Н); 7,25 (с, 1 Н); 7,45 (д, 1 Н); 7,60 (д, 1 Н). МС m/z (%): 420 (МН+, 33%), 233 (39%),200 (100%), 158 (36%). Аналогично получали следующие соединения: Оксалат 1-аллил-3-[2-[4-(1,4-бензодиоксан 5-ил)пиперааин-1-ил]этил]1 Н-индола, 5b, т.пл. 187-90 С. 1(с, 1 Н); 7,50 (д, 1 Н); 7,65 (д, 1 Н). МС m/z (%): 402 (МН+, 52%), 233 (50%),182 (57%), 167 (100%). Пример 6. Оксалат 3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин-1-ил]этил]-2,3-дигидро-1-метил-1 Н-индола, 6 а. Раствор 4 а (1,5 г) в сухом тетрагидрофуране (50 мл) добавляют по каплям к суспензии гидрида натрия (60% в минеральном масле, 0,21 г) в тетрагидрофуране (25 мл) при комнатной температуре. После перемешивания в течение 25 30 мин по каплям добавляют раствор иодметана(0,75 г) в сухом тетрагидрофуране (25 мл). Перемешивание в течение 1 ч с последующей стандартной обработкой этилацетатом дает масло, которое очищают флэш-хроматографией(элюент: гептан/этилацетат/триэтиламин,15:3:2). Получаемое масло превращают в указанную в заголовке оксалатную соль (0,3 г) из ацетона добавлением щавелевой кислоты. Т.пл. 155-65 С. 1(53%). Аналогично получали следующие соединения: Оксалат 3-[2-[4-(1,4-бензодиоксан-5-ил) пиперазин-1-ил]этил]-1-бензил-2,3-дигидро-1 Ниндола, 6b, т.пл. 158-65 С. 1H ЯМР (ДMCO-d6): 1,75-1,85 (м, 1 Н); 2,10-2,20 (м, 1 Н); 2,95-3,35 (м, 12 Н); 3,50 (т, 1 Н); 3,65(дд, 1 Н); 3,75 (дд, 1 Н); 4,25 (д, 4 Н); 5,15 (д,1 Н); 5,30 (д, 1 Н); 5,85-5,95 (м, 1 Н); 6,50 (д, 1 Н); 6,55 (д, 2 Н); 6,65 (т, 1 Н); 6,75 (т, 1 Н); 7,00 (т,1 Н); 7,10 (д, 1 Н). МС m/z (%): 406 (МН+, 15%), 178 (178%),158 (24%), 130 (31%), 117 (20%). Пример 7. Оксалат 1-ацетил-3-[2-[4-(1,4 бензодиоксан-5-ил)пиперазин-1-ил]этил]-1Hиндола, 7 а. Смесь 2 а (2,0 г) гидросульфата тетрабутиламмония (0,2 г), гидроксида натрия (1,0 г) и метиленхлорида (40 мл) перемешивают в течение 10 мин, затем добавляют по каплям раствор ацетилхлорида (0,97 г) в метиленхлориде при комнатной температуре. После перемешивания в течение 1 ч добавляют воду с последующей стандартной обработкой. Получаемое масло очищают флэш-хроматографией (элюент: гептан/этилацетат/триэтиламин, 17:1:1) получают желтое масло, которое превращают в указанную в заголовке оксалатную соль (0,75 г) из ацетона добавлением щавелевой кислоты. Т.пл. 199202 С. ЯМР (ДМСО-d6): 2,65 (с, 3 Н); 3,05 (т, 2 Н); 3,15 (с, 10 Н); 4,20 (д, 2 Н); 4,25 (д, 2 Н); 6,50 (д,1 Н); 6,55 (д, 1 Н); 6,75 (т, 1 Н); 7,30-7,40 (м, 2 Н); 7,70 (д, 1 Н); 7,80 (с, 1 Н); 8,35 (д, 1 Н). 26 МС m/z (%): 406 (МН+, 28%), 233 (44%); 218 (39%), 144 (100%). Фармакологическое испытание Аффинность соединений изобретения к 5 НТ 1A-рецепторам определяют путем измерения ингибирования связывания радиоактивного лиганда при 5-HT1A-рецептopax, как описано в следующем испытании. Ингибирование связывания 3 Н-5-Стиптицина с 5-НТ 1A-рецепторами человека Данным способом in vitro определяют ингибирование лекарственными средствами связывания 5-НТ 1 А-агониста, 3H-5-карбоксамидотриптамина (3H-5-Стиптицина), с клонированными 5-HT1A-рецепторами человека, стабильно экспрессированными в трансфецированных клетках HeLa (HA7) (Fargin, A. et al, J. Biol.Chem., 1989, 264, 14848). Анализ проводят как модификацию способа, описанного Harrington,М.A. et al, J. Pharmacol. Exp. Ther., 1994, 268,1098. 5-НТ 1A-рецепторы человека (40 мкг гомогената клеток) инкубируют в течение 15 мин при 37 С в буфере 50 мМ Трис при рН 7,7 в присутствии 3 Н-5-Стиптицина. Неспецифическое связывание определяют путем включения 10 мкМ метерголина. Реакцию завершают быстрым фильтрованием через фильтры UnifilterGF/B на харвестер клеток Tomtec. Радиоактивность фильтров подсчитывают в счетном устройстве Packard Top. Полученные результаты представлены в табл. 1. Таблица 1 Ингибирование 3H-5-Стиптицинасвязывания IC50 (нМ) 1a 17 1b 7.2 1 с 2.5 1d 55 1e 11 1f 6.1 1g 2.8 1h 4.6 1i 6.9 1j 14 1k 2.0 1l 12 1m 99 1n 8.2 2a 2.9 2b 13 1v 0.81 3 а 1.2 3b 3.6 3d 21 4d 14 Пиндолол 100 Эталонное соединение Соединения изобретения были также испытаны на их действие на повторное поглощение серотонина в следующем испытании: 27 Ингибирование поглощения 3 Н-5-НТ в синаптосомы головного мозга крыс С использованием указанного способа invitro определяют способность лекарственных средств ингибировать аккумуляцию 3 Н-5-НТ в целых синаптосомах головного мозга крыс. Анализ проводят, как описано Hyllet, J. Psychopharmacology, 1978, 60, 13. Полученные результаты представлены в табл. 2. Таблица 2 Ингибирование повторного поглощения серотонина IC50 (нМ) 1a 5.0 1b 2.8 1 с 45 1d 36 1e 0.25 1f 5.9 1g 3.8 1h 1.7 1i 6.8 1j 3.5 1k 18 1l 7.7 1m 57 1n 2.1 1v 0.85 2a 3.5 2b 12 3 а 5.3 3b 8.3 3d 15 4d 4.3 Пароксетин 0.29 Эталонное соединение 5-НТ 1 А-Антагонистическая активность некоторых соединений изобретения была оцененаin vitro у клонированных 5-HT1A-рецепторов,стабильно экспрессированных в трансфекцированных клетках HeLa (HA7). В указанном испытании 5-НТ 1A-антагонистическую активность оценивают путем измерения способности данных соединений противодействовать 5-НТиндуцированному ингибированию индуцированной форсколином аккумуляции цАМФ. Настоящий анализ проводят, как модификацию способа, описанного Pauwels, P.J. et al., Biochem.Pharmacol. 1993, 45, 375. Полученные результаты представлены в табл. 3. Таблица 3 соединения 1a 1b 1e 1f 1g 1h 1i 1j 1k 1n Антагонизм ингибирования индуцированного форсколином аккумуляции цАМФ IC50 (нМ) 2900 5000 2400 1800 1800 280 620 980 580 1900 Некоторые из соединений изобретения были испытаны также на их действие in vivo на 5 НТ 1 А-рецепторы в анализе, описанном Sanchez,С. et al., Eur. J. Pharmacol., 1996, 315, р 245. В данном испытании антагонистическое действие испытуемых соединений определяли путем измерения способности испытуемых соединений ингибировать 5-МеО-DТМ-индуцированный 5 НТ-синдром. Соединения данного изобретения обладают ценной активностью в качестве ингибиторов повторного поглощения серотонина и имеют антагонистическое действие у 5-НТ 1Aрецепторов. Поэтому соединения изобретения считаются полезными для лечения болезней и нарушений, восприимчивых к ингибированию повторного поглощения серотонина и антагонистической активности у 5-НТ 1A-рецепторов. Болезни, восприимчивые к ингибированию повторного поглощения серотонина, хорошо известны в данной области и включают аффективные нарушения, такие как депрессия, психоз,тревожные нарушения, включая общее тревожное нарушение, паническое нарушение и навязчивое компульсивное нарушение и т.д. Как объяснялось выше, антагонистическая активность у 5-НТ 1A-рецепторов соединений изобретения будет противодействовать механизму негативной обратной связи, индуцированному ингибированием повторного поглощения серотонина и вследствие этого, как ожидается, повысит эффект соединений изобретения по ингибирующей активности повторного поглощения серотонина. Соединения, заявляемые здесь, следовательно, рассматриваются как особенно полезные в качестве лекарственных средств с быстрым началом действия для лечения депрессии. Данные соединения могут быть также полезны для лечения депрессий, которые невосприимчивы к доступным в настоящее время SSRI's. Фармацевтическая готовая препаративная форма Фармацевтические готовые препаративные формы изобретения можно приготовить общепринятыми в данной области способами. Например, таблетки можно получить смешивани 29 ем активного ингредиента с обычными адъювантами и/или разбавителями и последующим прессованием смеси в обычной таблетирующей машине. Примеры адъювантов или разбавителей включают кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин,лактозу, камеди и тому подобное. Можно использовать любые другие адъюванты или добавки, обычно используемые для такой цели,такие как красители, корригенты, консерванты и т.д., при условии, что они совместимы с активными ингредиентами. Растворы для инъекций можно приготовить растворением активного ингредиента и,возможно, добавок в части растворителя для инъекции, предпочтительно стерильной воде,регулированием раствора до требуемого объема,стерилизацией раствора и заполнением им подходящих ампул или пузырьков. Можно добавить любую подходящую добавку, обычно используемую в данной области, такую как агенты тоничности, консерванты, антиоксиданты и так далее. Фармацевтические композиции данного изобретения или композиции, которые изготавливают по настоящему изобретению, можно вводить любым подходящим путем, например,перорально в форме таблеток, капсул, порошков, сиропов и т.д., или парентерально в форме растворов для инъекций. Для получения таких композиций можно использовать способы, хорошо известные в данной области, и можно использовать любые фармацевтически приемлемые носители, разбавители, наполнители или другие добавки, обычно используемые в данной области. Соединения изобретения удобно вводят в виде унифицированной лекарственной формы,содержащей упомянутые соединения в количестве около от 0,01 до 1000 мг. Общая суточная доза обычно находится в диапазоне около 0,05500 мг и очень предпочтительно, около от 1 до 50 мг активного соединения изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное индола дигидроиндола, имеющее формулу 2,3 любой из его энантиомеров, или любая смесь их, или его кислотно-аддитивная соль,где Х представляет -О-, -S- или -CR4R5-, иY представляет -CR6R7-, -CR6R7-CR8R9 или -CR6=CR7- или Х и Y вместе образуют группу -CR4=CR5 или -СR4=СR5-СR6R7-;W представляет N, С или СН; А представляет группу, выбранную из группы формул (II), (III) и (IV) где пунктирные линии означают необязательную связь;-S-. 4. Соединения по п.1, где А представляет группу формулы (II). 5. Соединения по п.1, где А представляет группу формулы (III). 6. Соединения по п.1, где А представляет группу формулы (IV). 7. Соединения по п.2, где А представляет группу формулы (II). 8. Соединения по п.2, где А представляет группу формулы (III). 9. Соединения по п.2, где А представляет группу формулы (IV). 10. Соединения по п.3, где А представляет группу формулы (II). 11. Соединения по п.3, где А представляет группу формулы (III). 12. Соединения по п.3, где А представляет группу формулы (IV). 13. Соединения по пп.1-12, где R4, R5, R6,7 8R , R и R9 выбран из водорода или метила. 14. Соединение по п.1, которое представляет собой 3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-5-хлор-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-5-бром-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-2-метил-1 Н-индол,6-хлор-3-[2-[4-(2,2,5-триметил-2,3-дигидробензофуран-7-ил)пиперидин-1-ил]этил]-1Hиндол, 31 3-[2-[4-(бензофуран-7-ил)-1,2,3,6-тетрагидропиридин-1-ил]этил]-6-хлор-1 Н-индол,3-[2-[4-(бензофуран-7-ил)-1,2,3,6-тетрагидропиридин-1-ил]этил]-5-бром-1 Н-индол,3-[2-[4-(бензофуран-7-ил)-1,2,3,6-тетрагидропиридин-1-ил]этил]-5-фтор-1 Н-индол,3-[2-[4-(бензофуран-7-ил)пиперидин-1-ил] этил]-6-хлор-1 Н-индол,3-[2-[4-(бензофуран-7-ил)пиперидин-1-ил] этил]-5-фтор-1 Н-индол,3-[2-[4-(бензофуран-7-ил)пиперидин-1-ил] этил]-5-бром-1 Н-тндол,1-ацетил-3-[2-[4-(1,4-бензодиоксан-4-ил) пиперазин-1-ил]этил]-2,3-дигидро-1 Н-индол,1-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-5-фтор-1 Н-индол,1-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-6-хлор-1H-индол,1-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-1H-индол,1-[2-[4-(2,3-дигидробензофуран-7-ил) пиперазин-1-ил]этил]-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-2,3-дигид-po-1H-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-2,3-дигидро-5-фтор-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-5-хлор-2,3-дигидро-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-1-бутил-1 Н-индол,1-аллил-3-[2-[4-(1,4-бензодиоксан-5 ил)пиперазин-1-ил]этил]-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-1-пропаргил-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-2,3-дигидро-1-метил-1 Н-индол,3-[2-[4-(1,4-бензодиоксан-5-ил)пиперазин 1-ил]этил]-1-бензил-2,3-дигидро-1 Н-индол,1-аллил-3-[2-[4-(1,4-бензодиоксан-5-ил) пиперазин-1-ил]этил]-2,3-дигидро-1 Н-индол,1-ацетил-3-[2-[4-(1,4-бензодиоксан-5-ил) пиперазин-1-ил]этил]-1 Н-индол,3-[2-[4-(бензо-1,4-дитиан-5-ил)пиперазин 1-ил]этил]-5-хлор-1 Н-индол,3-[2-[4-(бензо-1,4-дитиан-5-ил)пиперазин 1-ил]этил]-6-хлор-1H-индол,3-[2-[4-(бензо-1,4-дитиан-5-ил)пиперазин 1-ил]этил]-5-фтор-1 Н-индол,3-[2-[4-(бензо-1-тиа-4-оксан-5-ил)пиперазин-1-ил]этил]-5-хлор-1 Н-индол,3-[2-[4-(бензо-1-тиа-4-оксан-5-ил)пиперазин-1-ил]этил]-6-хлор-1 Н-индол и 3-[2-[4-(бензо-1-тиа-4-оксан-5-ил)пиперазин-1-ил]этил]-5-фтор-1H-индол или его кислотно-аддитивную соль. 15. Фармацевтическая композиция, включающая соединение по пп.1-14 или его фармацевтически приемлемую кислотно-аддитивную соль и, по меньшей мере, один фармацевтически приемлемый носитель или разбавитель. 16. Применение соединения по пп.1-14 или его фармацевтически приемлемой кислотно 33 аддитивной соли для приготовления лекарственного средства для лечения нарушения или болезни, восприимчивых к ингибированию повторного поглощения серотонина и антагонизму 5-НТ 1 А-рецепторов. 17. Применение соединения по п.16, где лекарственное средство предназначается для лечения аффективных нарушений, включая депрессию, психоз, тревожные нарушения, включая общее тревожное нарушение, паническое нарушение и навязчивое компульсивное нарушение. 18. Способ лечения нарушения или болезни животного, включая человека, восприимчи 34 вой к ингибированию повторного поглощения серотонина и антагонизму 5-НТ 1 А-рецепторов,включающий введение такому животному,включая человека, терапевтически эффективного количества соединения по пп.1-14 или его фармацевтически приемлемой кислотноаддитивной соли. 19. Способ лечения по п.18, где нарушение или болезнь представляет собой аффективное нарушение, включая депрессию, психоз, тревожные нарушения, включая общее тревожное нарушение, паническое нарушение и навязчивое компульсивное нарушение.
МПК / Метки
МПК: A61K 31/451, A61P 25/24, C07D 405/12
Метки: фармацевтическая, производные, применение, 2,3-дигидроиндола, индола, лечения, композиция, способ
Код ссылки
<a href="https://eas.patents.su/18-1890-proizvodnye-indola-i-23-digidroindola-ih-primenenie-farmacevticheskaya-kompoziciya-i-sposob-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индола и 2,3-дигидроиндола, их применение, фармацевтическая композиция и способ лечения</a>
Предыдущий патент: Косметическое средство для удаления ороговевших пробок
Следующий патент: Способ замедленного коксования
Случайный патент: Приводное устройство для буровой штанги












