Производные камптотецина, обладающие противоопухолевой активностью
Номер патента: 3605
Опубликовано: 26.06.2003
Авторы: Карминати Паоло, Пенко Серджо, Цунино Франко, Мерлини Лючио
Формула / Реферат
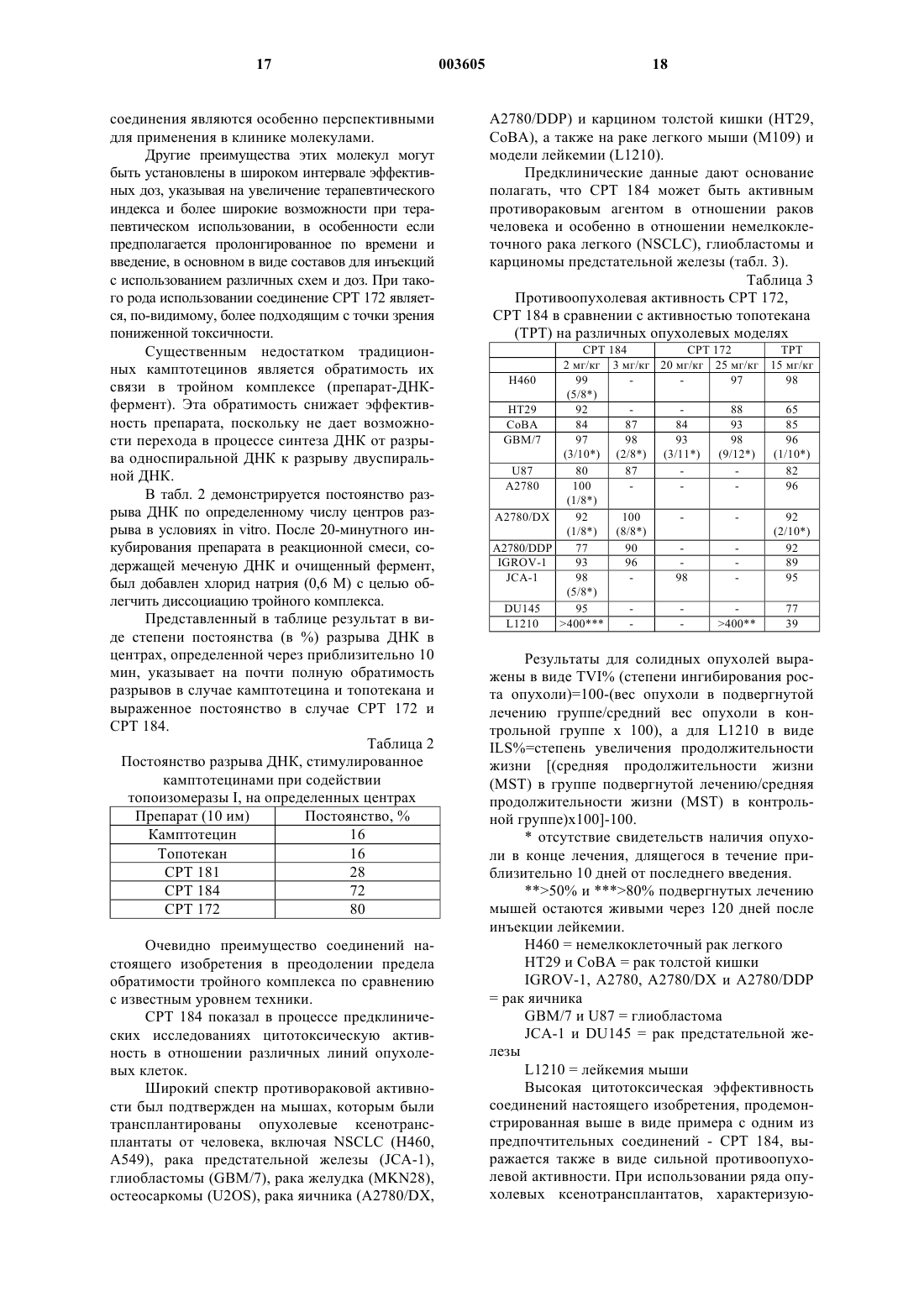
1. Соединения формулы I
в которой R1 обозначает группу -C(R5)=N-O(n)R4, в которой R4 обозначает нормальный или разветвленный C1-C8алкил, нормальную или разветвленную C1-C8алкенильную группу, C3-C10циклоалкил, (C3-C10)циклоалкилнормальный или разветвленный (C1-C8)алкил, (C6-C14)арил, (C6-C14)арилнормальный или разветвленный (C1-C6)алкил, гетероциклическую группу или гетероциклонормальный или разветвленный-(C1-C8)алкил, где гетероциклическая группа содержит, по меньшей мере, один гетероатом, выбранный из группы, содержащей атом азота, который необязательно замещен (C1-C8)алкильной группой, и/или атом кислорода, и/или атом серы;
причем указанные выше алкил, алкенил, циклоалкил, циклоалкилалкил, арил, арилалкил, гетероциклическая группа или гетероциклоалкильная группа необязательно замещены одной или более группами, выбранными из группы, в которую входят: галоген, гидрокси, кето, C1-C8алкил, C1-C8алкокси, фенил, циано, нитро, группа -NR6R7, в которой R6 и R7, одинаковые или различные, обозначают водород, нормальный или разветвленный (C1-C8)алкил;
группа -COOH или ее фармацевтически приемлемый сложный эфир; или группа -CONR8R9, в которой R8 и R9, одинаковые или различные, обозначают водород, нормальный или разветвленный (C1-C8)алкил, фенил или
R4 обозначает (C6-C10)ароил или (C6-C10)арилсульфонильную группу, необязательно замещенную одной или более группами, выбранными из группы, в которую входят: галоген, гидрокси, нормальный или разветвленный C1-C8алкил, нормальный или разветвленный C1-C8алкокси, фенил, циано, нитро, группа -NR10R11, в которой R10 и R11, одинаковые или различные, обозначают водород или нормальный или разветвленный C1-C8алкил;
R4 обозначает полиаминоалкильную группу формулы -(CH2)m-NR12-(CH2)p-NR13-(CH2)q-NH2, в которой m и p представляют собой целые числа от 2 до 6 и q - целое число от 0 до 6 включительно, a R12 и R13 являются нормальной или разветвленной (C1-C8)алкильной группой, или
R4 обозначает гликозильную группу, выбранную из 6-D-галактозила, 6-D-глюкозила и D-галактопиранозила, причем гликозильная группа необязательно защищена подходящей кетальной группой;
n равно 1;
R5 обозначает водород, нормальный или разветвленный C1-C8алкил, нормальный или разветвленный C1-C8алкенил, C3-C10циклоалкил, (C3-C10)циклоалкил-(нормальный или разветвленный(C1-C8)алкил), (C6-C14)арил, C6-C14-арил-(нормальный или разветвленный (C1-C8)алкил);
R2 и R3, одинаковые или различные, обозначают водород, гидрокси, нормальный или разветвленный C1-C8алкокси;
их N1-оксиды, их индивидуальные изомеры, в частности син- и антиизомеры группы -C(R5)=N-O(n)R4, их возможные энантиомеры, диастереоизомеры и их соответствующие смеси и их фармацевтически приемлемые соли.
2. Соединения по п.1, выбранные из группы, в которую входят
7-метоксииминометилкамптотецин;
7-метоксииминометил-10-гидроксикамптотецин;
7-(трет-бутоксикарбонил-2-пропокси)иминометилкамптотецин;
7-этоксииминометилкамптотецин;
7-изопропоксииминометилкамптотецин;
7-(2-метилбутокси)иминометилкамптотецин;
7-трет-бутоксииминометилкамптотецин;
7-трет-бутоксииминометил-10-гидроксикамптотецин;
7-трет-бутоксииминометил-10-метоксикамптотецин;
7-(4-гидроксибутокси)иминометилкамптотецин;
7-трифенилметоксииминометилкамптотецин;
7-карбоксиметоксииминометилкамптотецин;
7-(2-амино)этоксииминометилкамптотецин;
7-(2-N,N-диметиламино)этоксииминометилкамптотецин;
7-аллилоксииминометилкамптотецин;
7-циклогексилоксииминометилкамптотецин;
7-циклогексилметоксииминометилкамптотецин;
7-циклооктилоксииминометилкамптотецин;
7-циклооктилметоксииминометилкамптотецин;
7-бензилоксииминометилкамптотецин;
7-[(1-бензилоксиимино)-2-фенилэтил]камптотецин;
7-(1-бензилоксиимино)этилкамптотецин;
7-феноксииминометилкамптотецин;
7-(1-трет-бутоксиимино)этилкамптотецин;
7-п-нитробензилоксииминометилкамптотецин;
7-п-метилбензилоксииминометилкамптотецин;
7-пентафторбензилоксииминометилкамптотецин;
7-п-фенилбензилоксииминометилкамптотецин;
7-[2-(2,4-дифторфенил)этокси]иминометилкамптотецин;
7-(4-трет-бутилбензилокси)иминометилкамптотецин;
7-(1-адамантилокси)иминометилкамптотецин;
7-(1-адамантилметокси)иминометилкамптотецин;
7-(2-нафтилокси)иминометилкамптотецин;
7-(9-антрилметокси)иминометилкамптотецин;
7-оксиранилметоксииминометилкамптотецин;
7-(6-урацил)метоксииминометилкамптотецин;
7-[2-(1-урацил)этокси]иминометилкамптотецин;
7-(4-пиридил)метоксииминометилкамптотецин;
7-(2-тиенил)метоксииминометилкамптотецин;
7-[(N-метил)-4-пиперидинил]метоксииминометилкамптотецин;
7-[2-(4-морфолинил)этокси]иминометилкамптотецин;
7-(бензоилоксииминометил)камптотецин;
7-[(1-гидроксиимино)-2-фенилэтил]камптотецин;
7-трет-бутилоксииминометилкамптотецин-N-оксид;
7-метоксииминометилкамптотецин-N-оксид.
3. Соединения по п.1, выбранные из группы, в которую входят
7-[N-(4-аминобутил)-2-аминоэтокси]иминометилкамптотецин;
7-[N-[N-(3-амино-1-пропил)-4-амино-1-бутил]-3-аминопропил]иминометилкамптотецин.
4. Соединения по п.1, выбранные из группы, в которую входят
7-(1,2,3,4-ди-O-изопропилиден-D-галактопиранозилокси)иминометилкамптотецин;
(6-D-галактозилокси)иминометилкамптотецин;
7-(6-D-глюкозилокси)иминометилкамптотецин.
5. Соединение по п.2, которым является 7-(трет-бутокси)иминометилкамптотецин .
6. Соединение по п.2, которым является 7-бензилоксииминометилкамптотецин.
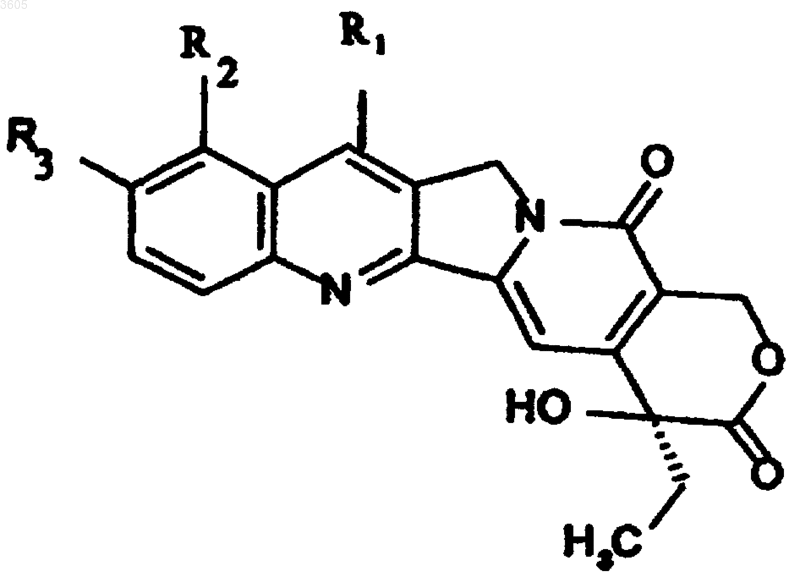
7. Способ получения соединений по п.1, в которых n=1 и R4 такой, как определен выше, за исключением ароила и арилсульфонила, включающий взаимодействие соединения формулы Iа
в которой R1 обозначает группу -C(R5)=O, где R5 такой, как определен для формулы (I), и R2 и R3 такие, как определены для формулы (I), с соединением формулы IIa: R4O-NH2, где R4 такой, как определен выше, с получением соединений формулы I, в которой R1 обозначает группу -C(R5)=N-OR4, где R4 как определен для формулы (I), за исключением ароила и арилсульфонила.
8. Способ по п.1, в котором мольное отношение соединения формулы Ia и соединения формулы IIa составляет от 1:3 до 3:1.
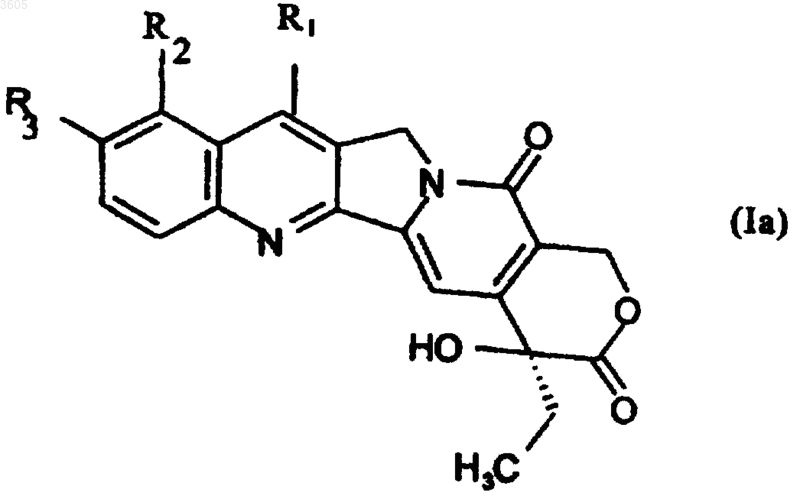
9. Способ получения соединений по п.1, в которых n=1 и R4 такой, как определено выше, за исключением ароила и арилсульфонила, включающий взаимодействие соединений формулы Ia

в которой R1 обозначает группу -C(R5)=N-OH, где R5 такой, как определен для формулы (I), и R2 и R3 такие, как определены для формулы (I), с галогенидом R4-X, где X обозначает галоген, а R4 определен выше, с получением соединений формулы (I), в которой R1 обозначает группу -C(R5)=N-OR4, где R4 как определен выше для формулы (I), за исключением ароила и арилсульфонила.
10. Способ получения соединений по п.1, в которых n=1 и R4 обозначает ароил или арилсульфонил, включающий взаимодействие соединений формулы Ia
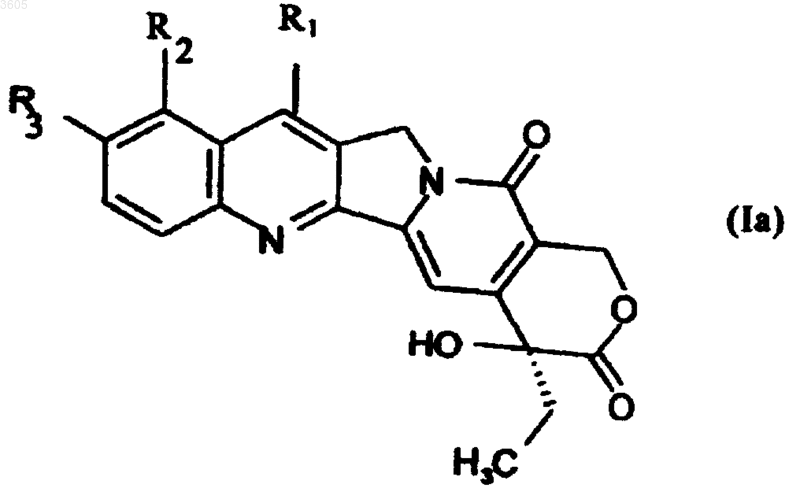
в которой R1 обозначает группу -C(R5)=N-OH, где R5 такой, как определен для формулы (I), и R2 и R3 такие, как определены для формулы (I), с ацилхлоридом R4-COCl, где R4 обозначает определенные выше ароил или арилсульфонил, с получением соединений формулы (I), в которой R1 обозначает группу -C(R5)=N-OR4, где R4 обозначает ароил или арилсульфонил.
11. Соединения по любому из пп.1-6 в качестве лекарственных средств.
12. Фармацевтическая композиция, включающее терапевтически эффективное количество, по меньшей мере, одного соединения по пп.1-6 в смеси с фармацевтически приемлемыми носителями и эксципиентами.
13. Фармацевтическая композиция, включающая терапевтически эффективное количество, по меньшей мере, одного соединения по пп.1-6 в смеси с фармацевтически приемлемыми носителями и и эксципиентами и, необязательно, в комбинации с другими активными ингредиентами.
14. Фармацевтическая композиция по п.13, в которой указанным другим активным ингредиентом является противоопухолевый агент.
15. Применение соединений по пп.1-6 для приготовления лекарственных препаратов, полезных для лечения опухолей.
16. Применение соединений по пп.1-6 для приготовления лекарственных препаратов, полезных для лечения вирусных инфекций.
17. Применение соединений по пп.1-6 для приготовления лекарственных препаратов, обладающих активностью против Plasmodium falciparum.
18. Применение соединений формулы Ia
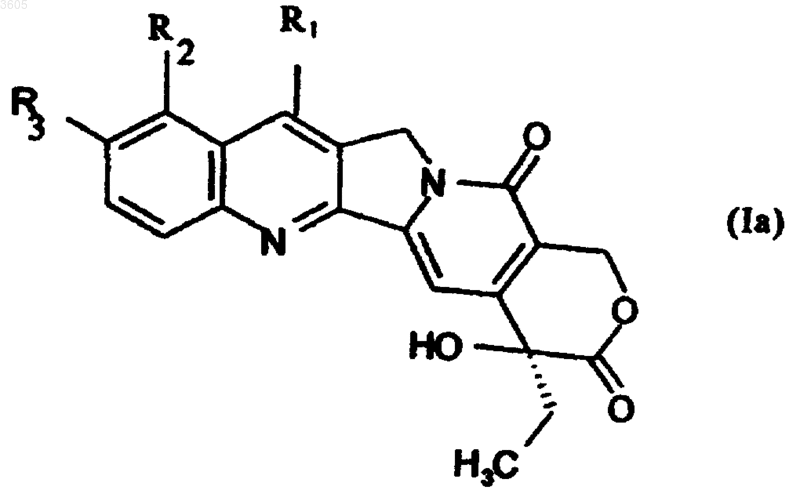
в которой R1 обозначает группу -C(R5)=N-OR4, где R4 обозначает водород, группу (C6-C10)ароил или арилсульфонил, необязательно замещенные одной или более группами, выбранными из группы, в которую входят галоген, гидрокси, нормальный или разветвленный C1-C8алкил, нормальный или разветвленный C1-C8алкокси, фенил, циано, нитро, группа -NR10R11, в которой R10 и R11, одинаковые или различные, обозначают водород или нормальный или разветвленный C1-C8алкил;
R2 и R3, одинаковые или различные, обозначают водород, гидрокси, нормальный или разветвленный C1-C8алкокси;
в качестве промежуточных продуктов в способе по п.10.
19. Применение соединений формулы Ia
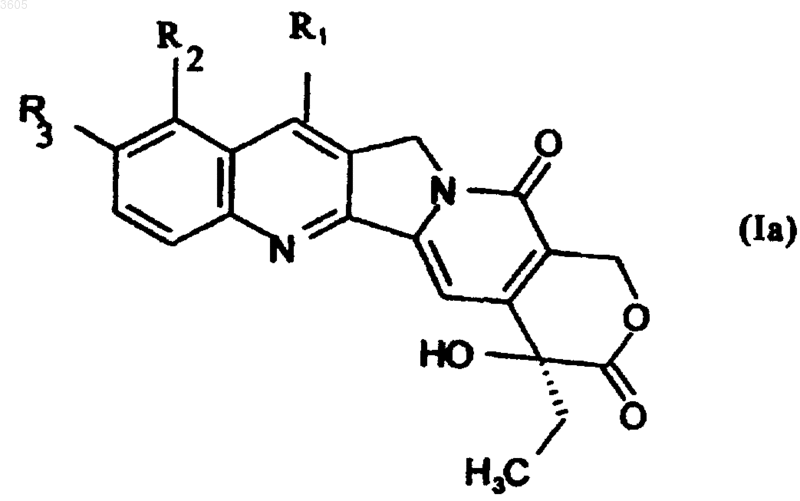
в которой R1 обозначает группу -C(R5)=O, R5 такой, как определен для формулы (I), a R2 и R3 такие, как определены для формулы I, в качестве промежуточных продуктов в способе по п.7.
Текст
1 Настоящее изобретение относится к соединениям, обладающим противоопухолевой активностью, а именно к новым производным камптотецинов, к способам их получения, к их применению в качестве противоопухолевых препаратов и к фармацевтическим композициям, содержащим их в качестве активных ингредиентов. Предпосылки изобретения Камптотецин является алкалоидом, впервые выделенным Wall с сотр. (J. Am. Chem. Soc.,88, 3888-3890 (1960 из дерева Camptoteca acuminata - растения родом из Китая, принадлежащего к семейству Nyssaceae. Молекула включает в себя пентациклическую структуру, имеющую в кольце Е лактон,который является важным для цитотоксичности. Препарат обладает широким спектром противоопухолевой активности, в частности в отношении опухолей толстой кишки, других солидных опухолей и лейкемий. Первые клинические испытания были проведены в начале семидесятых годов. Поскольку Камптотецин(далее сокращенно называемый СРТ) обладает низкой растворимостью в воде и для проведения клинических испытаний в Национальном Раковом институте (NCI) была получена натриевая соль (NSC100880), которая является водорастворимой. Фазы I и II клинических испытаний не были завершены из-за проявленной соединением высокой токсичности (геморрагический цистит, желудочно-кишечная токсичность типа тошноты, рвоты, диареи и миелосупрессии, в особенности лейкопения и тромбоцитопения). В любом случае натриевая соль проявляла более низкую активность по сравнению с СРТ,поскольку при рН 7,4 неактивная форма (открытое кольцо) преобладает над лактоно-активной формой (закрытое кольцо), преобладающей при рН 4,0. Позднее, с целью получения соединений с более низкой токсичностью и более высокой растворимостью в воде было синтезировано много аналогов СРТ. Из них два препарата являются коммерческими: Irinotecan (Иринотекан)(СРТ-11), продаваемый под торговой маркойCamptosar фирмой Upjohn, и Topotecan (Топотекан), продаваемый под торговой маркой Hymcamptamin или Thycantin фирмой Smith KlineBeecham. Другие производные находятся на различных этапах клинической разработки в фазе II, такие как NSC-603071 (9-аминокамптотецин, 9-NC или 9-нитрокамптотецин), пероральное пролекарство, превращающееся в 9 аминокамптотецин, GG-211 (GI 147211) и DX8591f, из которых последний является водорастворимым. Все идентифицированные на сегодняшний день производные содержат исходную структуру из 5 колец, которая необходима для цитотоксичности. Было показано, что произведенные в первом кольце модификации, как это имеет место в случае упомянутых выше препа 003605 2 ратов, повышают растворимость в воде и делают препарат более переносимым. Водорастворимый иринотекан был разрешен для лечения многих солидных опухолей и асцитов (толстой кишки, прямой кишки, кожи,желудка, груди, мелко клеточного и немелкоклеточного рака легкого, рака шеи и яичников и не-ходжкинской лимфомы). Наряду с этим Иринотекан проявил активность в отношении солидных опухолей, устойчивых к Топотекану,винкристину (vincristine) или мелфалану (melphalan), в то время как клетки MDR-1 оказались лишь в минимальной степени устойчивыми к препарату. В качестве активного метаболита были идентифицированы 10-гидроксипроизводные (SN-38), образующиеся под действием карбоксилэстераз. СРТ-11 проявил высокую активность при разных путях введения, таких как внутрибрюшинное, внутривенное, пероральное (Costin D., Potmhexyl M. Advances inPharmacol. 29B, 51-72, 1994). СРТ-11 применяли также вместе с цисплатином или этопозидом, получая при этом синергический эффект благодаря способности препарата тормозить репарацию ДНК. Однако в этом случае возникали также лейкопения 3-ей и 4-ой степени и диарея (Sinha В.К. (1995) Topoisomerase inhibitors. Drugs 49, 11-19, 1995). Топотекан обладает значительной пероральной биодоступностью. Пероральное введение оказалось удобным для пролонгированного действия препарата без необходимости прибегать к использованию временных катетеров(Rothenberg M.L. Annals of Oncology 8, 837-855,1997). Этот водорастворимый аналог СРТ обнаружил также активность в отношении различных типов опухолей при разных способах введения: внутрибрюшинном, внутривенном, подкожном, пероральном. Более обещающие результаты были получены с гидрохлоридом Топотекана при внутривенном вливании в течение 5 суток в случае различных опухолей, таких как мелкоклеточный и немелкоклеточный рак легкого, опухоли яичников, груди, желудка, печени, предстательной железы, саркома мягкой ткани, головы и шеи, пищевода, резистентные опухоли толстой кишки и прямой кишки, множественная глиобластома, хроническая и острая миелоцитные лейкемии. Однако, в этом случае имеют место также и тяжелые побочные эффекты, такие как нейтропения и тромбоцитопения,в то время как желудочно-кишечная токсичность, такого типа как тошнота, рвота и диарея,были более мягкими. Было показано, что основные пути превращения и выведения препарата включают гидролиз лактона и выделение с мочой: действительно, лактонная форма гидролизуется на 50% с образованием открытого кольца через 30 мин после вливания. Топотекан преодолевает гематоэнцефалический барьер через 10 мин после вливания (30% в спинномозговой жидкости 3 в сравнении с плазмой). Напротив, камптотецин не преодолевает гематоэнцефалического барьера в значительной степени, вероятно благодаря его связыванию с белками. Клиническая разработка 9-аминокамптотецина была задержана из-за его слабой растворимости в воде. Недавно была приготовлена коллоидная дисперсия, которая позволила осуществить переход клинических испытаний препарата в фазу II. Из-за короткого периода полураспада препарата для демонстрации его противоопухолевой активности оказалось необходимым увеличить экспозицию: от 72 ч до 21 суток(Dahut et al., 1994). Были отмечены результаты у больных, страдающих неизлечимым раком толстой прямой кишки и груди и резистентной лимфомы. Продемонстрирована активность в отношении Рgр-положительных опухолей, что наводит на мысль об отсутствии перекрестной резистентности в отношении резистентных клеток MDR-1. В этом случае также наблюдалась костно-мозговая и желудочно-кишечная токсичность.Lurtotecan (Луртотекан) является самым водорастворимым аналогом с активностью invitro, сопоставимой с активностью Топотекана. Были изучены два режима: в одном применяли одно 30-минутное вливание в день в течение 5 дней каждые 3 недели, а в другом одно вливание в течение 72 ч 1 раз каждые 3 недели. Наблюдались результаты у больных, страдающих опухолями шеи, яичников, груди и печени. В этом случае отмечали также гемитоксичность. Молекула является следующей: 9-Нитрокамптотецин является пероральным пролекарством, превращающимся после приема в 9-аминокамптотецин. Результаты наблюдали у больных, страдающих раком поджелудочной железы, яичников и груди. Несмотря на то, что большая часть опухолевых клеток очень чувствительна к ингибиторам топоизомеразы I из-за высоких уровней ферментов, некоторые опухолевые линии оказались резистентными. Это обусловлено механизмами отличными от сверхэкспрессии геновMRP, соответственно, для которых Топотекан или СРТ-11 не являются очень хорошими субстратами (Kawato Y. et al., J. Pharm. Pharmacol. 45, 444-448, (1993. Действительно, было замечено, что некоторые резистентные опухолевые клетки содержат мутантные формы topo I, в результате чего 4 нарушается образование комплекса topo I-ДНК или же в некоторых клетках отсутствует карбоксилэстеразная активность, необходимая для превращения СРТ-11 в активный метаболит SN38, вследствие чего клетки приобретают резистентность по отношению к этому препарату(Rothenberg, 1997, там же). Среди лекарственных препаратов, используемых в опухолевой терапии, интерес к ингибиторам ферментов топоизомеразы I обусловлен следующими соображениями: а) эффективность в отношении опухолей, являющихся обычно резистентными к традиционным лекарственным препаратам, включая ингибиторы топоизомеразы II; b) уровни фермента topo I остаются повышенными во всех фазах цикла; с) многие опухоли являются следствием высоких уровней фермента-мишени; d) отсутствие узнавания белками, участвующими в феномене резистентности к множеству лекарственных средств (Рgр или MRP), и отсутствие детоксифицирующего ферментативного метаболизма, связанного с глутатион-зависимой системой (глутатионпероксидазой или глутатион-3-трансферазой)(Gerrits CJH., et al., Brit. J. Cancer 76, 952-962). С учетом потенциальных клинических преимуществ ингибиторов топоизомеразы I как с точки зрения противоопухолевой активности,определенной на широком круге опухолей, так и благодаря тому, что они вызывают малую фармакорезистентность, в настоящем исследовании поставлено целью идентифицировать ингибиторы topo I с пониженной токсичностью по сравнению с токсичностью коммерческих лекарственных препаратов или лекарственных препаратов, находящихся в клинической фазе. Факторы,определяющие сравнительную эффективность аналогов камптотецина, включают в себя: а) характеристическую активность ингибирования топоизомеразы I; b) среднюю продолжительность жизни препарата; с) взаимодействие с белками плазмы; d) соотношение между циркулирующей активной формой (лактоном) и неактивной формой (карбоксилатом); е) сравнительную чувствительность препарата к оттоку клеток под действием гликопротеина Р или MRP; f) устойчивость связи с топоизомеразой I (Rothenberg, 1997, там же). Из основных неблагоприятных эффектов иринотекана и других производных камптотецинов наблюдались миелосуппрессия и желудочно-кишечная токсичность, такая как диарея или рвота. Диарея может иметь раннее или позднее возникновение и может быть лимитирующим дозу фактором. Рвота и поздняя диарея провоцируются многими противоопухолевыми препаратами, в то время как ранняя диарея, возникающая во время или непосредственно после вливания, является почти специфичной для Иринотекана и некоторых производных камптотецинов. 5 Токсические эффекты проявляются главным образом в пищеварительном тракте. С целью ослабить диарею при некоторых клинических испытаниях применяли СРТ-11 в сочетании с лоперамидом - синтетическим опиоидом, являющимся агонистом кишечных рецепторов мю-опиоида (Abigerges, 1994; Abigerges, 1995), а также с ингибитором энкефалиназ (ацеторфаном) или ондансетроном антагонистом рецепторов 5-НТЗ, или с дифенидрамином антагонистом рецепторов HI. Имеющиеся к настоящему времени проблемы, связанные с использованием производных камптотецина в качестве противоопухолевых препаратов, могут быть суммированы в следующих пунктах: камптотецин (СРТ) и многие из его активных производных имеют низкую растворимость в воде; более поздние производные проявляют тяжелые побочные эффекты на желудочнокишечном и костно-мозговом уровне; некоторые линии опухолей проявляют резистентность в отношении ингибиторов топоизомеразы I; идет постоянный поиск более высокого терапевтического индекса. Введенная в настоящую заявку в качестве ссылочного материала, патентная заявкаWO97/31003 раскрывает производные камптотецинов, замещенных в положениях 7, 9 и 10. В положении 7 находятся следующие заместители: -CN, -CH(CN)-R4, -CH=C(CN)-R4, -CH2CH=C(CN)-R4, -C(=NOH)-NH2, -CH=C(NO2)-R4,-CH(CN)-R5, -CH(CH2NO2)-R5, 5-тетразолил, 2(4,5-дигидроксазолил), 1,2,4-оксадиазолидин-3 ил-5-он, в которых R4 обозначает водород, нормальный или разветвленный алкил с 1-6 атомами углерода, нитрил или карбоксиалкоксигруппа. Из этих возможных соединений WO97/31003 раскрывает только производные камптотецина,имеющие в положении 7 группу -CN или-CH=C(CN)2 при незамещенных положениях 9 и 10. Наилучшим из этих соединений оказалось соединение, замещенное в положении 7 цианогруппой (R4=-CN), в дальнейшем называемое СРТ 83, которое обладает цитотоксической активностью по отношению к немелкоклеточной карциноме легкого (non-SCLC, Н-460). Эта опухолевая линия по своей сути резистентна к цитотоксической терапии и только в небольшой степени подвержена влиянию ингибиторов топоизомеразы I, несмотря на сверхэкспрессию фермента-мишени. СРТ 83 более активен по сравнению с принятым в качестве эталонного соединения Топотеканом и обладает в целом лучшим фармакологическим профилем, даже в том, что касается переносимости, а также обладает лучшим терапевтическим индексом. СРТ 83 получают методом синтеза, включающим окисление 7-гидроксиметилкампто 003605 6 тецина в камптотецин-7-альдегид, превращение последнего в оксим и превращение оксима в нитрил. Исходное соединение и промежуточные продукты описаны в статье Sawada et al., Chem.Pharm. Bull. 39 (10) 2574 (1991). В этой статье имеется ссылка на группу патентов-аналогов с приоритетом от 1981 г., например на заявкуeвропейского патента ЕР 0056692, опубликованную в 1982 г. и введенную в настоящую заявку в качестве ссылочного материала. В этих публикациях среди прочих соединений раскрыты камптотецин-7-альдегид и его оксим. Ценность этих производных состоит в возможности получения, исходя из 7-гидроксиметилкамптотецина, низкотоксичных соединений с противоопухолевой активностью. Авторы статьи, опубликованной в Chem. Pharm. Bull. 39 (10) 2574(1991), показали, что 7-алкил- и 7-ацилоксиметилпроизводные, которые не были предусмотрены в упомянутой выше патентной заявке, являются соединениями более активными по сравнению с камптотецином на линиях лейкемии мыши L1210, в то время как более низкую активность (также по сравнению с камптотецином) наблюдали для соединений, имеющих 7 заместители с более высоким полярным характером, таких как гидразоны и оксим (CH=NOH). Краткое описание изобретения В настоящей работе было неожиданным образом обнаружено, что камптотецины, имеющие в положении 7 O-замещенную алкилоксимную группу, обладают более высокой противоопухолевой активностью по сравнению с эталонным соединением - топотеканом. Еще более неожиданным оказалось обнаружение того, что камптотецины, имеющие в положении 7 енаминовую группу, также обладают противоопухолевой активностью. Эти соединения имеют более высокий терапевтический индекс. Таким образом, предметом настоящего изобретения являются соединения общей формулы I в которой R1 обозначает группу -C(R5)=N-O(n)R4,где R4 обозначает водород или нормальный или разветвленный C1-С 8 алкил, нормальную или разветвленную C1-С 8 алкенильную группу, C3 С 10 циклоалкил, (C3-С 10)циклоалкилнормальный или разветвленный(C1-С 8)алкил, C6-С 14 арил,(C6-С 14)арилнормальный или разветвленный(C1-С 8)алкил, гетероциклическую группу или гетероциклонормальный или разветвленный(C1-С 8)алкил, где гетероциклическая группа содержит, по меньшей мере, один гетероатом, выбранный из группы, в которую входят атом азо 7 та, который не обязательно замещен (C1 С 8)алкильной группой, и/или кислород, и/или сера; причем указанные выше группы алкил,алкенил, циклоалкил, циклоалкилалкил, арил,арилалкил, гетероциклическая группа или гетероциклоалкильная группа не обязательно замещены одной или более группами, выбранными из группы, в которую входят галоген, гидрокси,кето, C1-С 8 алкил, C1-С 8 алкокси, фенил, циано,нитро, группа -NR6R7, в которой R6 и R7, одинаковые или разные, обозначают водород или нормальный или разветвленный (C1-С 8)алкил; группа -СООН или ее фармацевтически приемлемый сложный эфир; группа -CONR8R9, в которой R8 и R9, одинаковые или разные, обозначают водород, нормальный или разветвленныйR4 обозначает (C6-С 10)ароил или (C6 С 10)арилсульфонильную группу, необязательно замещенную одной или более группами, выбранными из группы, в которую входят: галоген, гидрокси, нормальный или разветвленныйC1-С 8 алкил, нормальный или разветвленный C1 С 8 алкокси, фенил, циано, нитро, группа-NR10R11, в которой R10 и R11, одинаковые или различные, обозначают водород или нормальный или разветвленный C1-С 8 алкил;R4 обозначает полиаминоалкильную группу илиR5 обозначает водород, нормальный или разветвленный C1-С 8 алкил, нормальный или разветвленный C1-С 8 алкенил, C3-С 10 циклоалкил,(C3-С 10)циклоалкилнормальный или разветвленный(C1-С 8)алкил, (C6-С 14)арил, C6-С 14-арилнормальный или разветвленный (C1-С 8)алкил;R2 и R3, одинаковые или различные, обозначают водород, гидрокси, нормальный или разветвленный C1-С 8 алкокси; их N1-оксиды, их индивидуальные изомеры, в частности син- и анти-изомеры группы-C(R5)=N-O(n)R4, их возможные энантиомеры,диастереоизомеры и их соответствующие смеси,их фармацевтически приемлемые соли и их активные метаболиты; при условии, что когда R5, R2 и R3 являются атомами водорода и n равно 1, то R4 не является водородом. Настоящее изобретение включает применение соединений приведенной выше формулы(I) в качестве активных ингредиентов лекарственных средств, в частности лекарственных средств, полезных для лечения опухолей. Другим предметом настоящего изобретения является также применение соединений приведенной выше формулы (I) в качестве активных ингредиентов лекарственных средств, полезных для лечения вирусных инфекций. Еще одним предметом настоящего изобретения является применение соединений приведенной выше формулы(I) в качестве активных ингредиентов лекарст 003605 8 венных средств, обладающих активностью против Plasmodium falciparum. Настоящее изобретение включает фармацевтические композиции, содержащие соединения формулы (I) в качестве активных ингредиентов в смеси с фармацевтически приемлемыми носителями и наполнителями. Настоящее изобретение включает также способы получения соединений формулы (I) и соответствующих ключевых промежуточных продуктов. Подробное описание изобретения В качестве примеров нормальной или разветвленной C1-С 8 алкильной группы в объеме настоящего изобретения предполагаются метил,этил, пропил, бутил, пентил и октил, а также их возможные изомеры такие, например, как изопропил, изобутил, трет-бутил. Примерами нормальной или разветвленнойC1-С 8 алкенильной группы являются метилен,этилиден, винил, аллил, пропаргил, бутилен и пентилен, в которых двойная углеродуглеродная связь, необязательно при наличии других ненасыщенных углерод-углеродных связей, может находиться в различных возможных положениях алкильной цепи, которая может быть разветвленной в рамках разрешенной изомерии. Примерами C3-С 10 циклоалкильной группы являются циклопропил, циклобутил, циклопентил, циклогексил, циклооктил и полициклические группы такие, например, как адамантил. Примерами группы (C3-С 10)циклоалкилнормальный или разветвленный (C1-С 8)алкил являются циклопропилметил,2-циклопропилэтил, 1-циклопропилэтил, 3-циклопропилпропил, 2-циклопропилпропил, 1-циклопропилпропил, циклобутилметил, 2-циклобутилэтил, 1-циклобутилэтил, 3-циклобутилпропил,2-циклобутилпропил,1-циклобутилпропил,циклогексилметил, 2-циклогексилэтил, 1-циклогексилэтил, 3-циклогексилпропил, 2-циклогексилпропил, 1-циклогексилпропил, 5-циклогексилпентил, 3-циклогексилпентил, 3-метил-2 циклогексилбутил, 1-адамантилэтил, 2-адамантилэтил, адамантилметил. Примерами (С 6-С 14)арила или группы (C6 С 14)арилнормальный или разветвленный (C1 С 8)алкил являются фенил, 1- или 2-нафтил, антрил, бензил, 2-фенилэтил, 1-фенилэтил, 3 фенилпропил, 2-антрилпропил, 1-антрилпропил,нафтилметил, 2-нафтилэтил, 1-нафтилэтил, 3 нафтилпропил, 2-нафтилпропил, 1-нафтилпропил, циклогексилметил, 5-фенилпентил, 3-фенилпентил, 2-фенил-3-метилбутил. Примерами гетероциклической группы или группы гетероциклонормальный или разветвленный (C1-С 8)алкил являются тиенил, хинолил, пиридил, N-метилпиперидинил, 5-тетразолил, 2-(4,5-дигидроксазолил), 1,2,4-оксадиазолидин-3-ил-5-он, пуриновые и пиримидиновые основания, например урацил, которые не 9 обязательно замещены так, как указано в приведенных выше общих определениях. Примерами (C6-С 10)ароильных групп являются бензоил и нафтоил. Примерами(C6-С 10)арилсульфонильных групп, необязательно замещенных алкильной группой, являются тозил и бензолсульфонил. Под галогенами подразумеваются фтор,хлор, бром и йод. Примерами замещенных групп являются пентафторфенил, 4-фенилбензил, 2,4-дифторбензил, 4-аминобутил, 4-гидроксибутил, диметиламиноэтил, п-нитробензоил и п-цианобензоил. Примерами полиаминоалкильной группы являются группы формулы -(CH2)m-NR12-(CH2)pNR13-(CH2)q-NH2, в которой m и р представляют собой целые числа от 2 до 6 и q - целое число от 0 до 6 включительно, a R12 и R13 являются нормальной или разветвленной (C1-С 8)алкильной группой,например N-(4-аминобутил)-2-аминоэтил, N-(3 аминопропил)-4-аминобутил и N-[N-(3-аминопропил)-N-(4-аминобутил)]-3-аминопропил. Примерами гликозильной группы являются 6-D-галоктозил, 6-D-глюкозил и D-галактопиранозил, причем гликозильная группа необязательно защищена подходящей кетальной группой, например изопропилиденовой. Примерами фармацевтически приемлемых солей в случае наличия атомов азота с основным характером являются соли с фармацевтически приемлемыми кислотами, как неорганическими, так и органическими, такими, например,как хлористоводородная кислота, серная кислота и уксусная кислота, а в случае наличия кислотной группы, такой как карбоксильная группа, соли с фармацевтически приемлемыми основаниями, как неорганическими, так и органическими, такими, например, как гидроксиды щелочных и щелочно-земельных металлов, гидроксид аммония, амин, а также гетероциклические основания. Первая группа предпочтительных соединений включает соединения формулы (I), в которой n равно 1. Вторая группа предпочтительных соединений включает соединения формулы (I), в которой n равно 0. Из двух названных выше предпочтительных групп предпочтительными соединениями формулы (I) являются те, в которых R4 отличен от водорода, в частности, является нормальной или разветвленной C1-С 8 алкильной или нормальной или разветвленной C1-С 8 алкенильной группой, или C3 С 10 циклоалкилом, или группой (C3-С 10)циклоалкилнормальный или разветвленный(C1-С 8)алкил,C6-С 14 арилом, группой (C6-С 14)арилнормальный или разветвленный (C1-С 8)алкил, гетероциклической группой или группой гетероциклонормальный или разветвленный (C1-С 8)алкил, где гетероциклическая группа содержит, по меньшей мере,один гетероатом, выбранный из группы, в которую входят атом азота, который необязательно 10 замещен (C1-С 8)алкильной группой, и/или кислород, и/или сера; причем указанные выше группы алкил, алкенил, циклоалкил, арил, арилалкил, гетероциклическая группа или гетероциклоалкил необязательно замещены одной или более группами, выбранными из группы, в которую входят галоген, гидрокси, C1-С 8 алкил, C1-С 8 алкокси, фенил, циано, нитро, группа -NR6R7, в которой R6 иR7, одинаковые или различные, обозначают водород или нормальный или разветвленный (C1 С 8)алкил; группа -СООН или ее фармацевтически приемлемый сложный эфир; группа -CONR8R9, в которой R8 и R9, одинаковые или различные, обозначают водород, нормальный или разветвленный(C1-С 8)алкил, в соответствии с определениями,данными выше в виде примера. Первая группа особо предпочтительных соединений включает 7-метоксииминометилкамптотецин (СРТ 179); 7-метоксииминометил-10-гидроксикамптотецин (СРТ 211); 7-(трет-бутоксикарбонил-2-пропокси)иминометилкамптотецин (СРТ 224); 7-этоксииминометилкамптотецин; 7-изопропоксииминометилкамптотецин; 7-(2-метилбутокси)иминометилкамптотецин; 7-трет-бутоксииминометилкамптотецин(СРТ 191); 7-[(1-гидроксиимино)-2-фенилэтил]камптотецин (СРТ 185); 7-трет-бутилоксииминометилкамптотецинN-оксид (СРТ 198); 7-метоксииминометилкамптотецин-N-оксид (СРТ 208). Вторая группа особо предпочтительных соединений включает 7-[N-(4-аминобутил)-2-аминоэтокси]иминометилкамптотецин; 7-[N-[N-(3-амино-1-пропил)-4-амино-1-бутил]-3-аминопропокси]иминометилкамптотецин; 7-(6-D-галактозилокси)иминометилкамптотецин; 7-(1,2,3,4-ди-О-изопропилиден-D-галактопиранозилокси)иминометилкамптотецин (СРТ 215); 7-(6-D-глюкозилокси)иминометилкамптотецин (СРТ 216). Третья группа особо предпочтительных соединений включает 7-трет-бутилиминометилкамптотецин; 7-(4-амино)бутилиминометилкамптотецин; 7-(4-гидрокси)бутилиминометилкамптотецин(СРТ 160); 7-бензилиминометилкамптотецин (СРТ 175); 7-(2-антрилметил)иминометилкамптотецин; 7-(2-хинолилметил)иминометилкамптотецин; 7-(2-тиенил)иминометилкамптотецин; 7-[N-[N-(3-амино-1-пропил)-4-амино-1-бутил]-3-аминопропил]иминометилкамптотецин; 7-(6-D-галактозил)иминометилкамптотецин. В первой предпочтительном варианте изобретения предложены соединения общей формулы (I), в которой n равно 1, т.е. 7-оксимные производные камптотецинов, и R4 является алкильной или арилалкильной группой, как определено выше. Из этих соединений наиболее предпочтительными являются 7-(трет-бутокси)иминометилкамптотецин Соединения формулы I могут быть получены различными способами в зависимости от природы группы R4 и присутствия атома кислорода, связанного с азотом 7-иминометильной группы. Что касается соединений формулы I, в которой n равно 1 и R4 является таким, как определено выше, за исключением ароила и арилсульфонила, эти соединения могут быть получены, исходя из камптотецин-7-альдегида (формула Ia, R5=водород) или 7-кетокамптотецинаR5 является таким, как определен для формулы(I), и R2 и R3 являются такими, как определены для формулы (I). Соединение формулы (Iа) вво 13 дят во взаимодействие с соединением формулы(IIa): R4O-NH2, где R4 определен выше, с образованием соединений формулы (I), в которойR1 обозначает группу -C(R5)=N-OR4, R4 определен для формулы (I), за исключением ароила и арилсульфонила. Реакция может быть проведена с использованием традиционных, хорошо известных специалистам методов и представляет собой обычное образование оксима. Мольное отношение 7 альдегида или 7-кетокамптотецина к гидроксиламину составляет преимущественно от 1:3 до 3:1. Могут быть также использованы соли гидроксиламина. Реакцию проводят в присутствии основания,например неорганического основания, такого как карбонат калия, или органического основания, такого как триэтиламин или диазабициклононен, с использованием полярных растворителей, преимущественно метанола или этанола, поддерживая температуру реакции в пределах от комнатной до температуры кипения используемого растворителя,необязательно в присутствии дегидратирующих агентов, например сульфата натрия или магния и молекулярных сит. При необходимости реакция может быть также проведена в присутствии катализатора, например кислоты Льюиса. Альтернативно названные выше соединения могут быть также получены из оксима камптотецин-7-альдегида (полученного как описано(1991 или 7-кетокамптотецина путем взаимодействия с галогенидом R1-X, в котором Х является преимущественно йодом, в полярном растворителе, например тетрагидрофуране или спиртах, в присутствии основания, например гидрида натрия или карбоната калия. Что касается соединений формулы I, в которой n равно 1 и R4 является ароилом или арилсульфонилом, как определено для формулы (I),эти соединения могут быть получены, исходя из камптотецин-7-оксима, получение которого описано в предыдущем абзаце, с использованием ацилхлоридов R4-COCl, в полярных растворителях, в присутствии основания, предпочтительно пиридина, или непосредственно в пиридине, как описано Cho et al. J. Оrg. Chem. 62,2230 (1997). Что касается соединений формулы I, в которой n равно 0 и R4 является таким, как определено выше, за исключением ароила, эти соединения могут быть получены, исходя из камптотецин-7-альдегида (формула Ia, R5=водород) или 7-кетокамптотецина (формула Ia, R5 отличен от водорода): в которой R1 обозначает группу -C(R5)=O, где R5 является таким, как определен для формулы (I), иR2 и R3 являются такими, как определены для формулы (I). Соединение формулы (Iа) вводят во взаимодействие с соединением формулы (IIb): R4-NH2,где R4 определен выше, с образованием соединений формулы I, в которой R1 обозначает группу-C(R5)=N-R4, где R4 определен, как для формулы I,за исключением ароила. Реакция может быть проведена с использованием традиционных, хорошо известных специалистам методов и представляет собой обычное образование имина. Мольное отношение 7-альдегида или 7-кетокамптотецина к амину составляет преимущественно от 1:3 до 3:1. Могут быть также использованы соли амина. Реакцию проводят в присутствии основания, например неорганического основания, такого как карбонат калия,или органического основания, такого как триэтиламин или диазабициклононен, с использованием полярных растворителей, преимущественно метанола или этанола, поддерживая температуру реакции в пределах от комнатной до температуры кипения используемого растворителя, необязательно в присутствии дегидратирующих агентов, например сульфата натрия или магния и молекулярных сит. При необходимости реакция может быть также проведена в присутствии катализатора, например кислоты Льюиса (как, например, описано Moretti иTorre, Synthesis, 1970, 141; или Kobayashi et al.,Synlett, 1977, 115). Камптотецин-7-альдегид и камптотецин-7 оксим описаны в патентной заявке ЕР 0056692 и упомянутой выше работе Sawada et al., Chem.N1-Оксиды соединений формулы (I) получают с помощью хорошо известных методов окисления гетероароматического азота, преимущественно окислением смесью уксусной или трифторуксусной кислоты с перекисью водорода или реакцией с органическими надкислотами (A. Albini and S. Pietra, Heterocyclic Noxides, CRC, 1991). В зависимости от значений R4 в разных реактивах формулы II эти реактивы либо могут быть доступными на рынке, либо могут быть получены с использованием хорошо известных в литературе методов, к которым может прибегнуть специалист, дополнив их своим собственным знанием предмета. Фармацевтически приемлемые соли получают традиционными, описанными в литературе способами и не требуют дополнительных объяснений. Раскрытые в настоящем изобретении соединения проявляют антипролиферативную активность, представляя таким образом ценность с точки зрения их терапевтической активности, и обладают физико-химическими свойствами, делающими их подходящими в качестве компонентов фармацевтических композиций. Фармацевтические композиции содержат,по меньшей мере, одно соединение формулы (I) в таком количестве, которое обеспечивает значительный терапевтический, в частности противоопухолевый, эффект. Входящие в настоящее 15 изобретение композиции являются традиционными и приготовляются с помощью способов,обычно применяемых в фармацевтической промышленности. В зависимости от требуемого пути введения композиция может быть либо в твердой, либо в жидкой форме, подходящей для перорального, парентерального и внутривенного введения. Композиции настоящего изобретения содержат наряду с активными ингредиентами, по крайней мере, фармацевтически приемлемый носитель или эксципиент. Особенно полезны соадъюванты, являющиеся, например,солюбилизирующими, диспергирующими, суспендирующими и эмульгирующими агентами. Соединения формулы (I) могут быть также использованы в сочетании с другими активными ингредиентами, например с другими противоопухолевыми препаратами, как в виде отдельных форм, так и в форме единичной дозы. Соединения настоящего изобретения могут быть использованы в качестве лекарственных средств с противоопухолевой активностью,например в случае опухолей легкого, таких как немелкоклеточная опухоль легкого, опухоли толстой-прямой кишки, предстательной железы и глиом. Цитотоксическую активность соединений настоящего изобретения определяли в клеточных системах опухолевых клеток человека, используя тест на антипролиферативную активность в качестве способа определения цитотоксического потенциала. Использованная линия клеток представляет собой немелкоклеточную карциному легкого,которая принадлежит к гистотипу немелких клеток, называемому NCI H460. Предпочтительные соединения 7-третбутоксииминометилкамптотецин (СРТ 184) и 7 бензилоксииминометилкамптотецин (СРТ 172) испытывали в сравнении с топотеканом (ТРТ), являющимся стандартом, принятым специалистами в данной области, и с 7-гидроксииминометилкамптотецином (СРТ 181), описанным Sawada et аl. вChem. Pharm. Bull. 39 (10) 2574-2580 (1991) и представляющим собой ближайший структурный аналог соединений формулы (I) по настоящему изобретению. При исследованиях in vivo производили растворение в 10%-ном растворе ДМСО в бидистиллированной воде, поскольку растворение в солевом растворе было невозможно, а пероральный ввод осуществляли в объеме 10 мл/кг. Противоопухолевая активность. Использовали мышей Swiss-типа ню/ню(Charles River, Calco, Италия) в возрасте 10-12 недель. Животных держали в помещениях с ламинарным потоком в соответствии с инструкциями Координационного комитета по раковым исследованиям Соединенного Королевства. Описания экспериментов были одобрены Комитетом по этике экспериментирования с животными Национального Института по изучению и 16 лечению опухолей (Istituto Nazionale per lo Studio e Cura dei Tumori). Фрагменты опухоли размером приблизительно 2 х 2 х 2 мм, полученные от мышей, которым были привиты подкожно (s.с.) приблизительно 106 клеток NCI H460/topo, были имплантированы s.с. двусторонне в группах по 5 мышей каждая. Животных подвергали лечению соединениями, когда опухоль начинала прощупываться,в соответствии со следующей схемой: СРТ 172 (8 мг/кг, р.о.(перорально q4dx4 СРТ 172 (16 мг/кг, р.о.) q4dx4 СРТ 172 (24 мг/кг, р.о.) q4dx4 СРТ 172 (2 мг/кг, р.о.) qdx5x10wCPT184 (5 мг/кг, р.о.) q10dx6 Топотекан (15 мг/кг, р.о.) q4dx4 Топотекан (10 мг/кг, р.о.) q4dx4 Дважды в неделю с помощью штангенциркуля с нониусом производили измерения (в мм) ширины, минимального диаметра (1), длины и максимального диаметра (L) опухолей. Объем опухоли (в мм 3) рассчитывали по формуле 12xL/2. Эффективность молекулы оценивали в процентах ингибирования опухоли (TVI) группы, подвергнутой лечению против контрольной группы по формуле TVI%=100-(Т/Сх 100), где Т - среднее значение объема опухоли в группе, подвергнутой лечению, и С - в контрольной группе. Соединение считается активным, когда TVI% 50. Результаты экспериментов представлены в приведенной ниже табл. 1. Таблица 1 Противоопухолевая активность аналогов камптотецинов при лечении карциномы легкогоTVI% оценивали спустя 5-10 дней после последнего применения препарата. СРТ 172 проявил противоопухолевую активность при различных дозах и различных схемах лечения. СРТ 184 оказался очень активным соединением при низких дозах при различных схемах лечения. Таким образом, оба эти 17 соединения являются особенно перспективными для применения в клинике молекулами. Другие преимущества этих молекул могут быть установлены в широком интервале эффективных доз, указывая на увеличение терапевтического индекса и более широкие возможности при терапевтическом использовании, в особенности если предполагается пролонгированное по времени и введение, в основном в виде составов для инъекций с использованием различных схем и доз. При такого рода использовании соединение СРТ 172 является, по-видимому, более подходящим с точки зрения пониженной токсичности. Существенным недостатком традиционных камптотецинов является обратимость их связи в тройном комплексе (препарат-ДНКфермент). Эта обратимость снижает эффективность препарата, поскольку не дает возможности перехода в процессе синтеза ДНК от разрыва односпиральной ДНК к разрыву двуспиральной ДНК. В табл. 2 демонстрируется постоянство разрыва ДНК по определенному числу центров разрыва в условиях in vitro. После 20-минутного инкубирования препарата в реакционной смеси, содержащей меченую ДНК и очищенный фермент,был добавлен хлорид натрия (0,6 М) с целью облегчить диссоциацию тройного комплекса. Представленный в таблице результат в виде степени постоянства (в %) разрыва ДНК в центрах, определенной через приблизительно 10 мин, указывает на почти полную обратимость разрывов в случае камптотецина и топотекана и выраженное постоянство в случае СРТ 172 и СРТ 184. Таблица 2 Постоянство разрыва ДНК, стимулированное камптотецинами при содействии топоизомеразы I, на определенных центрах Препарат (10 им) Постоянство, % Камптотецин 16 Топотекан 16 СРТ 181 28 СРТ 184 72 СРТ 172 80 Очевидно преимущество соединений настоящего изобретения в преодолении предела обратимости тройного комплекса по сравнению с известным уровнем техники. СРТ 184 показал в процессе предклинических исследованиях цитотоксическую активность в отношении различных линий опухолевых клеток. Широкий спектр противораковой активности был подтвержден на мышах, которым были трансплантированы опухолевые ксенотрансплантаты от человека, включая NSCLC (H460,А 549), рака предстательной железы (JCA-1),глиобластомы (GBM/7), рака желудка (MKN28),остеосаркомы (U2 ОS), рака яичника (A2780/DХ, 003605A2780/DDP) и карцином толстой кишки (НТ 29,СоВА), а также на раке легкого мыши (M109) и модели лейкемии (L1210). Предклинические данные дают основание полагать, что СРТ 184 может быть активным противораковым агентом в отношении раков человека и особенно в отношении немелкоклеточного рака легкого (NSCLC), глиобластомы и карциномы предстательной железы (табл. 3). Таблица 3 Противоопухолевая активность СРТ 172,СРТ 184 в сравнении с активностью топотекана(ТРТ) на различных опухолевых моделях СРТ 184 СРТ 172 ТРТ 2 мг/кг 3 мг/кг 20 мг/кг 25 мг/кг 15 мг/кг Н 460 99 97 98 Результаты для солидных опухолей выражены в виде TVI% (степени ингибирования роста опухоли)=100-(вес опухоли в подвергнутой лечению группе/средний вес опухоли в контрольной группе х 100), а для L1210 в видеILS%=степень увеличения продолжительности жизни [(средняя продолжительности жизни(MST) в группе подвергнутой лечению/средняя продолжительности жизни (MST) в контрольной группе)х 100]-100.отсутствие свидетельств наличия опухоли в конце лечения, длящегося в течение приблизительно 10 дней от последнего введения. 50% и 80% подвергнутых лечению мышей остаются живыми через 120 дней после инъекции лейкемии. Н 460 = немелкоклеточный рак легкого НТ 29 и СоВА = рак толстой кишкиL1210 = лейкемия мыши Высокая цитотоксическая эффективность соединений настоящего изобретения, продемонстрированная выше в виде примера с одним из предпочтительных соединений - СРТ 184, выражается также в виде сильной противоопухолевой активности. При использовании ряда опухолевых ксенотрансплантатов, характеризую 19 щихся значительной чувствительностью к Топотекану (ТРТ) (т.е. TVI 80%), спектр противоопухолевой активности СРТ 184 и, в более широком смысле, соединений настоящего изобретения в отношении значительного числа опухолевых моделей человека был существенно улучшен. В частности, впечатляющая противоопухолевая эффективность была обнаружена при лечении многих опухолевых моделей, в результате которого у значительного числа подвергнутых лечению животных была достигнута полная регрессия. Более того, соединения настоящего изобретения, в особенности СРТ 184,были способны привести к 100%-ной регрессии в случае опухоли A2780/DX, характеризующейся MDR-фенотипом. Это наблюдение имеет высокую значимость, указывая на то, что соединения настоящего изобретения не являются субстратами Р-гликопротеина. Дополнительные терапевтические преимущества соединений настоящего изобретения состоят в а) улучшении терапевтического индекса, б) лекарственной эффективности в широком диапазоне доз и в) выявленной эффективности при использовании совершенно различных режимов, что делает соединения настоящего изобретения менее зависимыми от режима лечения по сравнению с топотеканом. Далее изобретение иллюстрируют следующие примеры. Пример 1. 7-бензилоксииминометилкамптотецин (СРТ 172). 500 мг (1,33 ммоль) 7-формилкамптотецина растворяют в 100 мл этанола, добавляют 15 мл пиридина и 638 мг (4 ммоль) Обензилгидроксиламингидрохлорида и кипятят смесь с обратным холодильником в течение 5 ч. После этого растворитель отгоняют в вакууме и полученный остаток очищают с помощью флэш-хроматографии на силикагеле с использованием в качестве элюента смеси гексан/этилацетат (4/6). Выход 65%. Т.пл. 200-205 С (разл.). Полученный продукт представляет собой смесь син- и антиизомеров с соотношением приблизительно 8:2 (изомер A: Rf 0,32; изомер В: Rf 0,19 на силикагеле Merck 60 F254, элюент гексан/этилацетат 3/7). ВЭЖХ: были проведены анализы на приборе, оборудованном четырехцилиндровым насосом (HP 1050) с гидродинамическим инжектором (Rheodyne, петля хода 20 мкл) и диодным матричным детектором (Нр 1050), регулируемым компьютерной программойHPLCChemStation. Регистрацию спектров производили в области от 200 до 600 нм, а хроматограммы регистрировали при 360 и 400 нм. Использовали колонку с обращенной фазой типа С 18 (Rainin С 18, 25 х 0,4 см, Varian) с предколонкой RP18. Анализ проводили в режиме линейного градиента элюции, начиная от 20 смеси ацетонитрил/вода 30/70 и кончая 100%ным ацетонитрилом в течение 20 мин со скоростью потока 1 мл/мин. Времена удерживания: 12,51 мин для изомера В и 14,48 мин для изомера А. 1 Н-ЯМР (300 МГц; ДМСО-d6): : 0,88 (т,Н 3-18 А+Н 3-18 В), 1,87 (м, Н 2-19 А+Н 2-19 В),5,18 (с, Н 2-5 В), 5,21 (с, H2-PhB), 5,30 (H2-PhA),5,40 (с, Н 2-5 А), 5,45 (с, Н 2-17 А+Н 2-17 В), 6,53(70) 300 (30) 273 (20) 243 (20) 91 (34). Пример 2. 7-трет-бутоксииминометилкамптотецин (СРТ 184). 400 мг (1,06 ммоль) 7-формилкамптотецина растворяют в 80 мл этанола, добавляют 12 мл пиридина и 400 мг (3,18 ммоль) О-третбутилгидроксиламингидрохло-рида и кипятят смесь с обратным холодиль-ником в течение 4 ч. Растворитель отгоняют в вакууме и полученный остаток очищают с помощью флэшхроматографии на силикагеле с использованием в качестве элюента смеси гексан/этилацетат(4/6). Получают 322 мг (0,72 ммоль) желтого твердого вещества. Выход 68%. Т.пл. 250 С (разл.). Полученный продукт представляет собой смесь приблизительно 8:2 син- и антиизомеров(изомер A: Rf 0,31; изомер В: Rf 0,24 на силикагеле Merck 60 F254, элюент гексан/этилацетат 3/7). ВЭЖХ: были проведены анализы на приборе, оборудованном четырехцилиндровым насосом (HP 1050) с гидродинамическим инжектором (Rheodyne, петля хода 20 л) и диодным матричным детектором (Нр 1050), регулируемым компьютерной программойHPLCChemStation. Регистрацию спектров производили в области от 200 до 600 нм, а хроматограммы регистрировали при 360 и 400 нм. Использовали колонку с обращенной фазой типа С 18 (Rainin С 18, 25 х 0,4 см, Varian) с предколонкой RP18. Анализ проводили в режиме линейного градиента элюции, начиная от смеси ацетонитрил/вода 30/70 и кончая 100%ным ацетонитрилом в течение 20 мин со скоростью потока 1 мл/мин. Времена удерживания: 12,92 мин для изомера В и 14,61 мин для изомера А. 1(100) 362 (40) 333 (34) 57 (17). Используя ту же процедуру, получили следующие соединения: 7-трет-бутоксииминометил-10-гидроксикамптотецин (СРТ 212); т.пл. 195 С (разл.). 1(СРТ 186); 7-[1-(трет-бутоксиимино)этил]камптотецин. Пример 3. 7-бемзоилкамптотецин (СРТ 170). Концентрированную серную кислоту (0,17 мл) и бензальдегид (304 мг, 2,87 ммоль) прибавляют по каплям к суспензии камптотецина (200 мг, 0,57 ммоль) в СН 3 СООН (0,8 мл) и воде (0,8 мл). Реакционную смесь охлаждают до 0 С и последовательно добавляют 80% трет-бутилпероксид (128 мг, 1,14 ммоль) и раствор FeSO4(317 мг, 1,14 ммоль) в воде (0,56 мл). После перемешивания при комнатной температуре в течение ночи добавляют воду, получая осадок, который отфильтровывают под вакуумом. Маточные жидкости экстрагируют хлористым метиленом (3 раза), органические фазы высушивают над Na2SO4, фильтруют и упаривают в вакууме. Полученное таким образом твердое вещество объединяют с ранее отделенными осадками. Продукт очищают с помощью флэш-хроматографии на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол (98/2), получая 90 мг (0,2 ммоль) продукта. Выход 35%. 1(50 мг, 0,11 ммоль), гидроксиламингидрохлорида (24 мг, 0,33 ммоль) и пиридина (1,4 мл) в 10 мл этанола, кипятят раствор с обратным холодильником в течение 24 ч и удаляют растворитель в вакууме. Продукт очищают с помощью флэш-хроматографии на силикагеле с использованием в качестве элюента смеси хлористый 25 метилен/метанол (98/2), получая желтое твердое вещество (25 мг). Выход 48%. Полученный продукт представляет собой смесь син- и антиизомеров (изомер A: Rf 0,35; изомер В: Rf 0,31 на силикагеле Merck 60 F254,элюент хлористый метилен/метанол 95/5). 1 Н-ЯМР (300 МГц; ДМСО-d6): =0,9 (т,Н 3-18 А+Н 3-18 В), 1,86 (м, Н 2-19 А+Н 2-19 В), 4,8H-10A+H-10B+Н-11 А+Н-11 В+Н 14 А+Н-14 В), 7,6-7,7 (м, Н-12 А+Н-12 В). Пример 5. 7-фенилиминометилкамптотецин (СРТ 154). 100 мг (0,26 ммоль) 7-формилкамптотецина, растворенного в 20 мл хлористого метилена,и 25 мкл (0,26 ммоль) анилина, растворенного в 0,5 мл хлористого метилена, добавляют к суспензии трифлата иттербия (16,5 мг, 0,026 ммоль,10 мол.%) в 5 мл хлористого метилена, содержащего молекулярные сита MS 4A, перемешивают смесь 3,5 ч при комнатной температуре, и упаривают растворитель в вакууме. Продукт очищают с помощью флэш-хроматографии на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол (98/2),получая 60 мг желтого твердого вещества. Выход 51%,т.пл. 255-258 С (разл.). 1H-ЯМР (300 МГц; ДМСО-d6): =0,8 (т, 3 Н Н 3-18), 1,75 (м, 2 Н, Н 2-19), 5,35 (с, 2 Н, Н 2-5),5,5 (с, 2 Н Н 2-17), 6,45 (с, -1 Н ОН), 7,25-7,35 (м,2 Н H1-Ar+H-14), 7,4-7,5 (м, 4 Н Аr), 7,75 (1 Н,ддд, Н-11), 7,85 (ддд, 1 Н-Н 10), 8,2 (дд, 1 Н-Н-12) 8,9 (дд, 1 Н, Н-9), 9,6 (с, 1 Н CH=N). Используя ту же процедуру, получили следующие соединения: 7-циклогексилиминометилкамптотецин 26 Пример 6. 7-(бензоилоксииминометил) камптотецин (СРТ 191). Готовят раствор бензоилхлорида (0,16 мл,1,4 ммоль) в 5 мл пиридина, добавляют 500 мг(1,3 ммоль) 7-гидроксииминометилкамптотецина и перемешивают в течение ночи при комнатной температуре. После упаривания в вакууме пиридина добавляют раствор бикарбоната натрия и трижды экстрагируют хлористым метиленом. После высушивания над сульфатом натрия и фильтрования растворитель отгоняют и очищают продукт с помощью флэшхроматографии на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол (98/2), получая 200 мг (0,04 ммоль) желтого твердого вещества. Выход 32%,т.пл. 210 С (разл.). 1H-ЯМР (300 МГц; ДМСО-d6): =0,8 (т,Н 3-), 1,8 (м, Н 2), 5,45 (с, Н 2-5), 5,55 (с, Н 2-17),6,6 (с, 1 Н -ОН), 7,3 (с, 1 Н, Н-14), 7,75-8 (м, 5 Н Н-10+Н-11+3 Аr), 8,25 (м, 2 Н, 2 Аr), 8,3 (дд, 1 Н,Н-12), 8,75 (дд, 1 Н, Н-9), 10,05 (с, 1 Н, CH=N). Используя ту же процедуру, получили следующие соединения: 7-п-нитробензоилоксииминометилкамптотецин,7-п-цианобензоилоксииминометилкамптотецин,7-п-толилсульфонилоксииминометилкамптотецин. Пример 7. 7-трет-бутоксииминометилкамптотецин-N-оксид (СРТ 198). 7-трет-Бутоксииминометилкамптотецин(30 мг, 0,067 ммоль) растворяют в уксусной кислоте (5,2 мл) и добавляют 30%-ную перекись водорода. Нагревают смесь в течение 9 ч при 70-80 С, концентрируют до приблизительно одной трети и вливают остаток в ледяную воду. Выпавший в осадок материал отсасывают и очищают с помощью флэш-хроматографии на силикагеле с использованием в качестве элюента смеси гексан/этилацетат (1/1), получая 7 трет-бутоксииминометилкамптотецин-N-оксид в виде желтого порошка (15,5 мг). Выход 50%. Т.пл. 185-190 С (разл.). 1H-ЯМР (ДМСО-d6) : 0,87 (т, J=7 Гц, Н 318), 1,48 (с, 3 -СН 3), 1,76-1,95 (м, H2-19), 5,37 (с,Н 2-5), 5,42 (с, Н 2-17), 6,60 (с, -ОН), 7,85-8,00 (м,Н-10; Н-11), 8,15 (с, Н-14), 8,65-8,75 (м,Н-9; Н 12), 9,2 (с, -CH=N) . Используя ту же процедуру, получили следующие соединения: 7-метоксииминометилкамптотецин-Nоксид (СРТ 208) 1H-ЯМР (ДМСО-d6) =0,87 (т,J=7,35 Гц, Н 3-18), 1,78-1,93 (м, H2-19), 4,12 (с,-ОСН 3), 5,35 (с, Н 2-5), 5,43 (с, H2-17), 6,54 (с,-ОН), 7,84-8,00 (м, Н-10; Н-11), 8,11 (с, Н-14),8,68-8,73 (м, Н-9; Н-12), 9,21 (с, -CH=N) ; 7-(карбоксидиметилметокси)иминометилкамптотецин-N-оксид; 27 7-(гидроксиметилдиметилметокси)иминометилкамптотецин-N-оксид. Пример 8. 7-п-нитробензилоксииминометилкамптотецин (СРТ 177). К суспензии 7-гидроксииминометилкамптотецина (40 мг, 0,102 ммоль) и карбоната натрия (10,9 мг, 0,102 ммоль) в этаноле (4 мл) добавляют 4-нитробензилбромид (22 мг, 0,102 ммоль) и кипятят смесь с обратным холодильником в течение 2,5 ч. Упаривают при пониженном давлении растворитель и очищают остаток с помощью флэш-хроматографии с использованием в качестве элюента смеси гексан/этилацетат (3/7), получая 10,5 мг 7-пнитробензилоксииминометилкамптотецина. Выход 20% 1H-ЯМР (ДМСО-d6) : 0,88 (т, J=7 Гц, Н 318), 1,80-1,92 (м, Н 2-19), 5,23 (с, СН 2-O), 5,45 (с,H2-5), 5,57 (с, H2-17), 6,55 (с, -ОН), 7,35 (с, Н 14), 7,75-7,95 (м, 2 Аr; Н-10; Н-11), 8,2-8,4 (м,2 Аr; Н-12), 8,65 (дд, J=8,46 Гц, J=1,47 Гц, Н-9),9,50 (с, -CH=N). Используя ту же процедуру, получили следующие соединения: 7-п-метилбензилоксииминометилкамптотецин (СРТ 178), т.пл 203 С (разл.); 7-пентафторбензилоксииминометилкамптотецин (СРТ 182), т.пл 200 С (разл.). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы I в которой R1 обозначает группу -C(R5)=N-O(n)R4,в которой R4 обозначает нормальный или разветвленный C1-С 8 алкил, нормальную или разветвленную C1-С 8 алкенильную группу, C3 С 10 циклоалкил, (C3-С 10)циклоалкилнормальный или разветвленный (C1-С 8)алкил, (C6-С 14)арил,(C6-С 14)арилнормальный или разветвленный(C1-С 8)алкил, гетероциклическую группу или гетероциклонормальный или разветвленный(C1-С 8)алкил, где гетероциклическая группа содержит, по меньшей мере, один гетероатом, выбранный из группы, содержащей атом азота,который необязательно замещен (C1-С 8)алкильной группой, и/или атом кислорода, и/или атом серы; причем указанные выше алкил, алкенил,циклоалкил, циклоалкилалкил, арил, арилалкил,гетероциклическая группа или гетероциклоалкильная группа необязательно замещены одной или более группами, выбранными из группы, в которую входят: галоген, гидрокси, кето, C1-С 8 алкил, C1-С 8 алкокси, фенил, циано, нитро, группа -NR6R7, в которой R6 и R7, одинаковые или различные, обозначают водород, нормальный 28 или разветвленный (C1-С 8)алкил; группа -СООН или ее фармацевтически приемлемый сложный эфир; или группа -CONR8R9, в которой R8 и R9,одинаковые или различные, обозначают водород, нормальный или разветвленный (C1 С 8)алкил, фенил илиR4 обозначает (C6-С 10)ароил или (C6-С 10) арилсульфонильную группу, необязательно замещенную одной или более группами, выбранными из группы, в которую входят: галоген,гидрокси, нормальный или разветвленный C1-С 8 алкил, нормальный или разветвленный C1-С 8 алкокси, фенил, циано, нитро, группа -NR10R11,в которой R10 и R11, одинаковые или различные,обозначают водород или нормальный или разветвленный C1-С 8 алкил;R4 обозначает полиаминоалкильную группу формулы -(СН 2)m-NR12-(CH2)p-NR13-(CH2)qNH2, в которой m и р представляют собой целые числа от 2 до 6 и q - целое число от 0 до 6 включительно, a R12 и R13 являются нормальной или разветвленной (C1-С 8)алкильной группой, илиD-галактопиранозила, причем гликозильная группа необязательно защищена подходящей кетальной группой;R5 обозначает водород, нормальный или разветвленный C1-С 8 алкил, нормальный или разветвленный C1-С 8 алкенил, C3-С 10 циклоалкил,(C3-С 10)циклоалкил-(нормальный или разветвленный(C1-С 8)алкил), (C6-С 14)арил, С 6-С 14-арил(нормальный или разветвленный (C1-С 8)алкил);R2 и R3, одинаковые или различные, обозначают водород, гидрокси, нормальный или разветвленный C1-С 8 алкокси; их N1-оксиды, их индивидуальные изомеры, в частности син- и антиизомеры группы-C(R5)=N-O(n)R4, их возможные энантиомеры,диастереоизомеры и их соответствующие смеси и их фармацевтически приемлемые соли. 2. Соединения по п.1, выбранные из группы, в которую входят 7-метоксииминометилкамптотецин; 7-метоксииминометил-10-гидроксикамптотецин; 7-(трет-бутоксикарбонил-2-пропокси)иминометилкамптотецин; 7-этоксииминометилкамптотецин; 7-изопропоксииминометилкамптотецин; 7-(2-метилбутокси)иминометилкамптотецин; 7-трет-бутоксииминометилкамптотецин; 7-трет-бутоксииминометил-10-гидроксикамптотецин; 7-трет-бутоксииминометил-10-метоксикамптотецин; 7-(4-гидроксибутокси)иминометилкамптотецин; 7-трифенилметоксииминометилкамптотецин; 7-карбоксиметоксииминометилкамптотецин; 7-(2-амино)этоксииминометилкамптотецин; 30 7-(1,2,3,4-ди-О-изопропилиден-D-галактопиранозилокси)иминометилкамптотецин; 7-(6-D-галактозилокси)иминометилкамптотецин; 7-(6-D-глюкозилокси)иминометилкамптотецин. 5. Соединение по п.2, которым является 7(трет-бутокси)иминометилкамптотецин. 6. Соединение по п.2, которым является 7 бензилоксииминометилкамптотецин. 7. Способ получения соединений по п.1, в которых n=1 и R4 такой, как определен выше, за исключением ароила и арилсульфонила, включающий взаимодействие соединения формулыR5 такой, как определен для формулы (I), и R2 иR3 такие, как определены для формулы (I), с соединением формулы IIa: R4O-NH2, где R4 такой, как определен выше, с получением соединений формулы I, в которой R1 обозначает группу -C(R5)=N-OR4, где R4 как определен для формулы (I), за исключением ароила и арилсульфонила. 8. Способ по п.7, в котором мольное отношение соединения формулы Iа и соединения формулы IIа составляет от 1:3 до 3:1. 9. Способ получения соединений по п.1, в которых n=1 и R4 такой, как определено выше,за исключением ароила и арилсульфонила,включающий взаимодействие соединений формулы Iа в которой R1 обозначает группу -C(R5)=N-OH,где R5 такой, как определен для формулы (I), иR2 и R3 такие, как определены для формулы (I),с галогенидом R4-X, где Х обозначает галоген, аR4 определен выше, с получением соединений формулы (I), в которой R1 обозначает группу-C(R5)=N-OR4, где R4 как определен выше для формулы (I), за исключением ароила и арилсульфонила. 10. Способ получения соединений по п.1, в которых n=1 и R4 обозначает ароил или арилсульфонил, включающий взаимодействие соединений формулы Iа 32 ладающих активностью против Plasmodium falciparum. 18. Применение соединений формулы Iа в которой R1 обозначает группу -C(R5)=N-OH,где R5 такой, как определен для формулы (I), иR2 и R3 такие, как определены для формулы (I),с ацилхлоридом R4-COCl, где R4 обозначает определенные выше ароил или арилсульфонил, с получением соединений формулы (I), в которойR1 обозначает группу -C(R5)=N-OR4, где R4 обозначает ароил или арилсульфонил. 11. Соединения по любому из пп.1-6 в качестве лекарственных средств. 12. Фармацевтическая композиция, включающее терапевтически эффективное количество, по меньшей мере, одного соединения по пп.1-6 в смеси с фармацевтически приемлемыми носителями и эксципиентами. 13. Фармацевтическая композиция, включающая терапевтически эффективное количество, по меньшей мере, одного соединения по пп.1-6 в смеси с фармацевтически приемлемыми носителями и и эксципиентами и, необязательно, в комбинации с другими активными ингредиентами. 14. Фармацевтическая композиция по п.13,в которой указанным другим активным ингредиентом является противоопухолевый агент. 15. Применение соединений по пп.1-6 для приготовления лекарственных препаратов, полезных для лечения опухолей. 16. Применение соединений по пп.1-6 для приготовления лекарственных препаратов, полезных для лечения вирусных инфекций. 17. Применение соединений по пп.1-6 для приготовления лекарственных препаратов, об в которой R1 обозначает группу -C(R5)=N-OR4,где R4 обозначает водород, группу (C6-С 10)ароил или арилсульфонил, необязательно замещенные одной или более группами, выбранными из группы, в которую входят галоген, гидрокси,нормальный или разветвленный C1-С 8 алкил,нормальный или разветвленный C1-С 8 алкокси,фенил, циано, нитро, группа -NR10R11, в которойR10 и R11, одинаковые или различные, обозначают водород или нормальный или разветвленныйR2 и R3, одинаковые или различные, обозначают водород, гидрокси, нормальный или разветвленный C1-С 8 алкокси; в качестве промежуточных продуктов в способе по п.10. 19. Применение соединений формулы Iа в которой R1 обозначает группу -C(R5)=O, R5 такой, как определен для формулы (I), a R2 и R3 такие, как определены для формулы I, в качестве промежуточных продуктов в способе по п.7.
МПК / Метки
МПК: C07D 491/22, A61K 31/435
Метки: обладающие, активностью, камптотецина, противоопухолевой, производные
Код ссылки
<a href="https://eas.patents.su/17-3605-proizvodnye-kamptotecina-obladayushhie-protivoopuholevojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Производные камптотецина, обладающие противоопухолевой активностью</a>
Предыдущий патент: Композиции на основе пирроло [2,3d] пиримидинов и их применение
Следующий патент: 1,5-пентандиилзамещенные 1,2,3,4 – тетрагидробензо (фуро, азо и тио) [3,2 - c] пиридиновые производные в качестве &alpha2 – антагонистов
Случайный патент: Устройство для многорежимного управления трехфазным шаговым двигателем