Производные дигидро- и тетрагидрохинолина, способ их получения и содержащие их фармацевтические составы
Номер патента: 3272
Опубликовано: 27.02.2003
Авторы: Локар Бриан, Лестаж Пьер, Казара Патрик, Дорей Жильбер
Формула / Реферат
1. Соединения общей формулы (I)
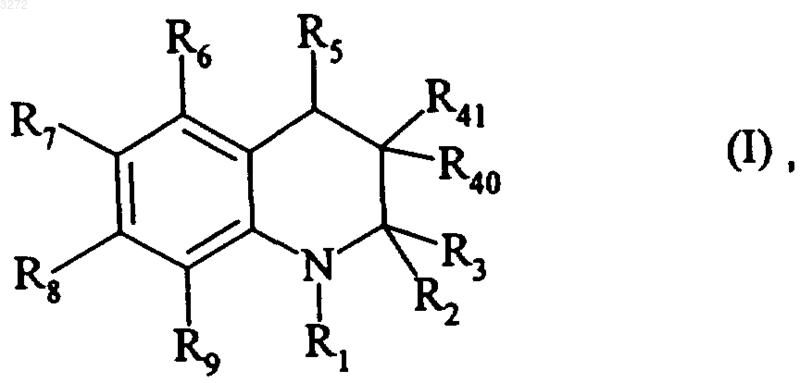
где R1 представляет собой атом водорода или группу
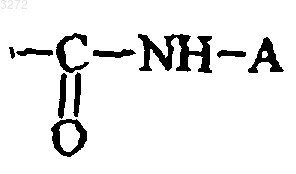
где A представляет собой атом водорода или группу -BNZ1Z2, в которой B представляет собой линейную или разветвленную (C1-C6)алкиленовую группу и Z1 и Z2 независимо представляют собой атом водорода или алкильную, (C3-C8)циклоалкильную или необязательно замещенную арильную группу или вместе с соединяющим их атомом азота образуют необязательно замещенную гетероциклоалкильную или гетероарильную группу;
R2 и R3, каждый независимо, представляет собой алкильную группу, (C3-C8)циклоалкильную группу, гетероциклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную гетероарильную группу, циклоалкилалкильную группу, гетероциклоалкилалкильную группу, необязательно замещенную арилалкильную группу, необязательно замещенную гетероарилалкильную группу или аминоалкильную группу (необязательно замещенную на атоме азота одной или двумя группами, выбранными из алкила, циклоалкила, арила и арилалкила) или
R2 и R3 вместе с соединяющим их атомом углерода образуют (C3-C8)циклоалкильную группу или моноциклическую гетероциклоалкильную группу, незамещенную или замещенную алкильной, циклоалкильной, циклоалкилалкильной, арильной или арилалкильной группой;
R40 представляет собой атом водорода или группу, выбранную из необязательно замещенного алкила, необязательно замещенного алкенила и необязательно замещенного алкинила, или группу Q или -V-Q-, где V представляет собой группу алкилена, алкенилена или алкинилена, и Q представляет собой необязательно замещенную (C3-C8)циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную гетероциклоалкиль-ную группу или необязательно замещенную гетероарильную группу;
R41 и R5 образуют вместе связь или каждый представляет собой атом водорода;
R6, R7, R8 и R9, каждый независимо, представляет собой атом водорода, атом галогена, алкильную группу, (C3-C8)циклоалкильную группу или группу -OW, где W представляет собой атом водорода или алкильную группу, ацильную группу, (C3-C8)циклоалкильную группу, гетероциклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную гетероарильную группу, необязательно замещенную арилалкильную группу или необязательно замещенную гетероарилалкильную группу (при условии, что R6, R7, R8 и R9 не могут все одновременно представлять собой атом водорода, и что, по крайней мере, один из них представляет собой группу -OW, как определено выше),
с условием, что
когда R2 и R3 представляют собой алкильную группу,
если каждый заместитель от R6 до R9 независимо представляет собой атом водорода, алкильную группу или группу -OW, где W представляет собой алкильную группу, и R41 и R5 вместе образуют связь, тогда R40 является отличным от атома водорода или алкильной группы,
если в молекуле присутствует одна группа -OW и она представляет собой гидроксигруппу, тогда R40 является отличным от атома водорода,
если в молекуле присутствует одна группа -OW и она представляет собой метоксигруппу, тогда R40 является отличным от гидроксиалкильной группы,
соединение формулы (I) является отличным от 7-метокси-2,2-дифенил-1,2-дигидрохинолина, причем подразумевается, что
термин "алкил" означает линейную или разветвленную цепь от 1 до 6 атомов углерода,
термин "ацил" означает алкилкарбонильную группу, причем алкил является таким, как определено выше,
термин "алкенил" означает линейную или разветвленную цепь от 2 до 6 атомов углерода, содержащую от 1 до 3 двойных связей,
термин "алкинил" означает линейную или разветвленную цепь от 2 до 6 атомов углерода, содержащую от 1 до 3 тройных связей,
термин "алкилен" означает линейную или разветвленную двухвалентную группу, содержащую от 1 до 6 атомов углерода,
термин "алкенилен" означает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 двойных связей,
термин "алкинилен" означает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 тройных связей,
термин "арил" означает фенильную, нафтильную или бифенильную группу,
термин "гетероциклоалкил" означает моно- или бициклическую, от 4- до 11-членную группу, содержащую от 1 до 6 гетероатомов, выбранных из азота, кислорода и серы, причем эта группа может содержать одну или более ненасыщенных связей, не являясь при этом ароматической,
термин "гетероарил" означает ароматическую или частично ароматическую, моно- или бициклическую, 4-11-членную группу, содержащую от 1 до 6 гетероатомов, выбранных из азота, кислорода и серы,
термин "замещенный", используемый в отношении арила или арилалкила, показывает, что имеющие отношение группы замещены одним или более атомами галогена или алкильной, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)пергалогеналкильной, амино (необязательно замещенной 1 или 2 алкильными группами), циано, карбокси, линейной или разветвленной (C1-C6)алкоксикарбонильной, аминокарбонильной (необязательно замещенной на атоме азота 1 или 2 алкильными группами), нитро или гидроксигруппами,
термин "замещенный", используемый в отношении выражений алкила, алкенила, алкинила и циклоалкила, показывает, что такие группы являются замещенными одной или более группами, выбранными из гидрокси, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)алкилтио, амино (необязательно замещенной одной или двумя алкильными группами), карбокси, нитро, циано, линейным или разветвленным (C1-C6)алкоксикарбонилом и аминокарбонилом (необязательно замещенным на атоме азота одной или двумя алкильными группами),
термин "замещенный", используемый в отношении гетероциклоалкила, гетероарила и гетероарилалкила, показывает, что имеющие отношение группы являются замещенными одним или более атомами галогена или алкильной, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)пергалогеналкильной, амино (необязательно замещенной 1 или 2 алкильными группами), циано, карбокси, линейной или разветвленной (C1-C6)алкоксикарбонильной, аминокарбонильной (необязательно замещенной на атоме азота 1 или 2 алкильными группами), нитро, гидрокси или оксогруппами,
их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований.
2. Соединения формулы (I) по п.1, где R1 представляет собой атом водорода, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований.
3. Соединения формулы (I) по п.1, где R6, R7, R8 и R9, каждый независимо, представляет собой атом водорода, алкильную группу или группу -OW, где W представляет собой алкильную, ацильную или фенильную группу, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований.
4. Соединения формулы (I) по п.1, где R2 и R3 каждый представляет алкильную группу, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот шыш оснований.
5. Соединения формулы (I) по п.1, где R2 и R3 вместе образуют необязательно замещенную циклоалкильную или гетероциклоалкильную группу, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований.
6. Соединения формулы (I) по п.1, где R40 представляет атом водорода или группу V-Q, причем V является алкиленовой группой и Q является гетероциклоалкильной группой, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований.
7. Соединения формулы (I) по п.1, где R1 представляет собой атом водорода, R2 и R3 представляют алкильную группу или вместе образуют циклоалкильную группу, R40 представляет атом водорода или группу V-Q, где V представляет алкиленовую группу и Q представляет гетероциклоалкильную группу, и R6, R7, R8 и R9, каждый независимо, представляет атом водорода, алкильную группу или группу -OW, где W представляет алкильную, ацильную или фенильную группу, причем подразумевается, что R6, R7, R8 и R9 не могут все представлять собой атом водорода и что, по крайней мере, один из них представляет собой -OW, как определено выше, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований.
8. Соединения формулы (I) по п.7, где R2 и R3 вместе образуют циклоалкильную группу, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований.
9. Соединения формулы (I) по п.7, где R2 и R3 представляют собой алкильную группу, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований.
10. Соединение формулы (I) по п.1, которое представляет собой 6-этокси-2,2,5,7,8-пентаметил-1,2,3,4-тетрагидрохинолин и его соли присоединения фармацевтически приемлемой кислоты.
11. Соединение формулы (I) по п.1, которое представляет собой 6-этокси-1,2-дигидрохинолин-2-спироциклогексан и его соли присоединения фармацевтически приемлемой кислоты.
12. Способ получения соединений формулы (I), отличающийся тем, что замещенный анилин формулы (II)
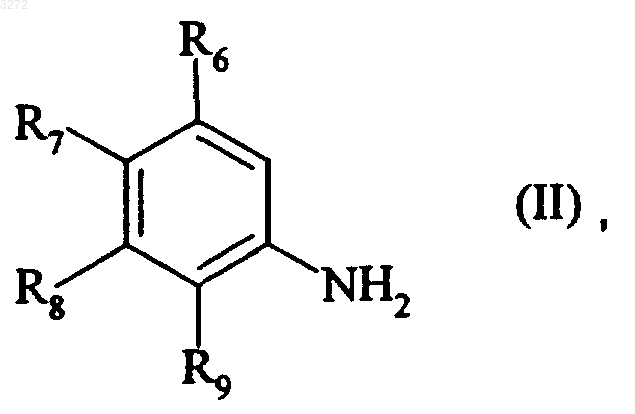
где R6, R7, R8 и R9 являются такими, как определено для формулы (I), в качестве исходного продукта подвергают
либо действию в щелочной среде и необязательно в присутствии катализатора, галогенированного ацетилида формулы (III)

где R2 и R3 являются такими, как определено для формулы (I), G представляет собой атом водорода или триалкилсилильную группу и Hal представляет собой атом галогена,
с получением соединения формулы (IV)
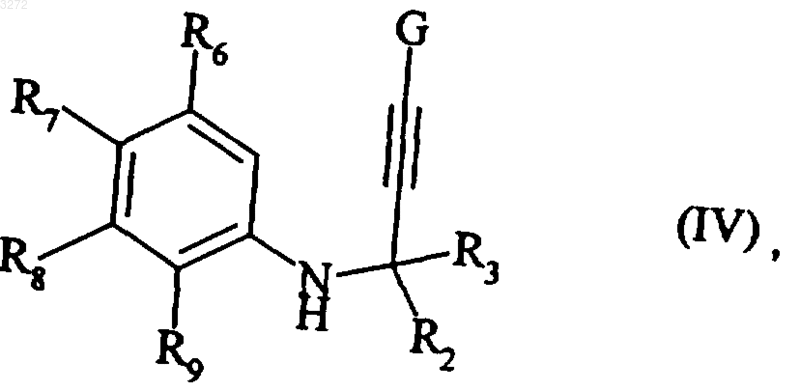
где R2, R3, R6, R7, R8, R9 и G являются такими, как определено выше,
или действию карбонильного соединения формулы (V)
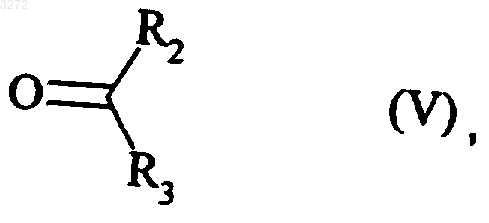
где R2 и R3 являются такими, как определено для формулы (I),
с получением соединения формулы (VI)
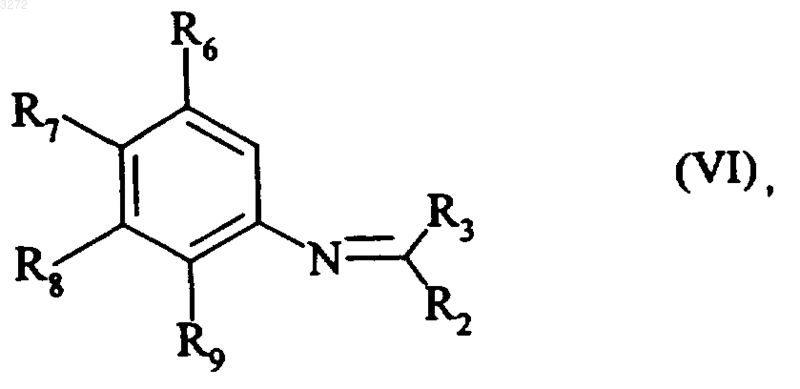
где R2, R3, R6, R7, R8 и R9 являются такими, как определено выше,
соединение формулы (VI) подвергают в щелочной среде действию ацетилида формулы (III), как определено выше,
с получением соединения формулы (IV), как определено выше, которое (соединение формулы (IV)), где это применимо после расщепления триалкилсилильной группы, подвергают реакции замыкания цикла посредством нагрева в присутствии соответствующего катализатора,
с получением соединения формулы (I/a)

частный случай соединений формулы (I), где R2, R3, R6, R7, R8 и R9 являются такими, как определено выше,
которое после защиты атома азота кольца может быть последовательно подвергнуто реакции гидроксигалогенирования и реакции окисления в бензильном положении, с получением соединения формулы (VIII)
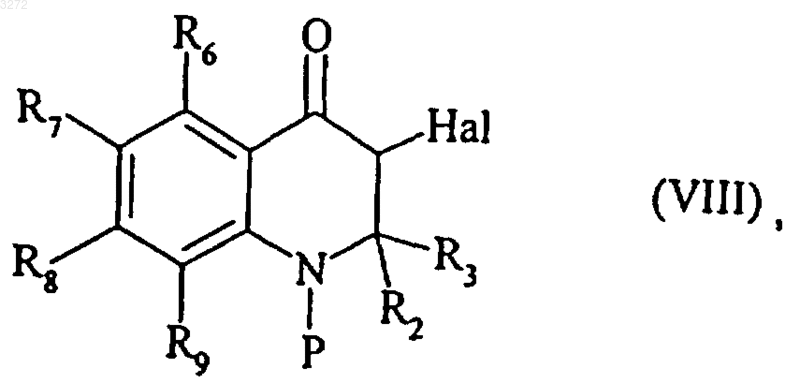
где R2, R3, R6, R7, R8 и R9 являются такими, как определено выше, Hal представляет собой атом галогена и Р является защитной группой для атома азота кольца (например, ацетильной, трифторацетильной, трет-бутоксикарбонильной или бензилоксикарбонильной группой),
которое подвергают реакции нуклеофильного замещения с получением соединения формулы (IX)

где R2, R3, R6, R7, R8, R9 и P являются такими, как определено выше, и Y представляет собой либо группу R40, которая является такой, как определено для формулы (I), но отлична от атома водорода, либо предшественник такой группы,
которое после снятия защиты с атома азота кольца подвергают реакции восстановления карбонильной функции с последующим элиминированием с получением соединения формулы (X)
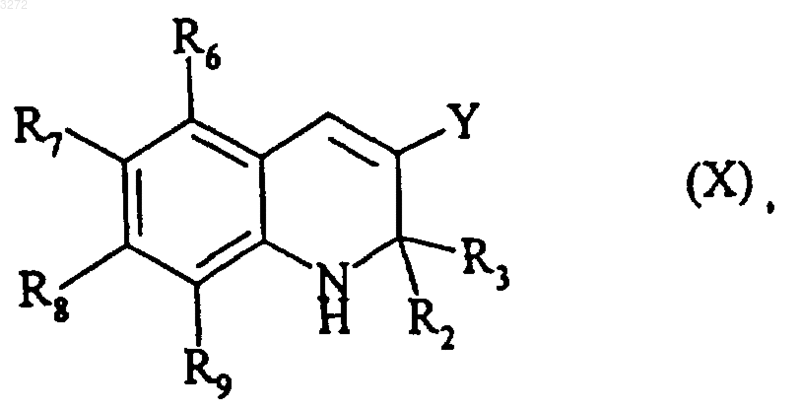
где R2, R3, R6, R7, R8, R9 и Y являются такими, как определено выше,
которое (соединение формулы (X)) может, когда Y является предшественником группы R40, как определено выше, быть подвергнуто последовательным обычным реакциям, направленным на получение соединения формулы (I/d)
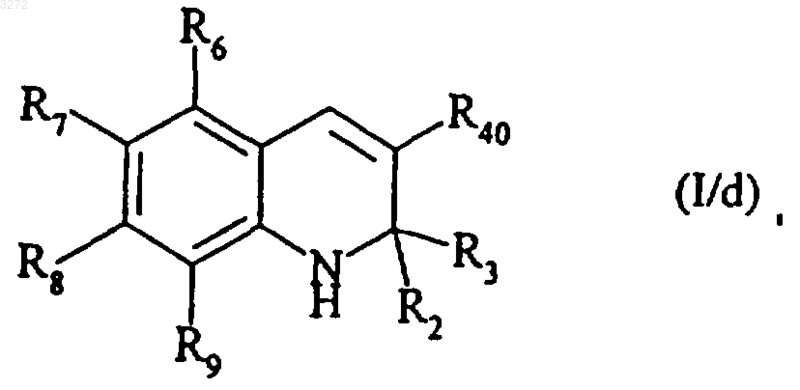
частный случай соединений формулы (I), где R2, R3, R6, R7, R8, R9 и R40 являются такими, как определено выше,
которое может быть восстановлено с получением соединения формулы (I/e)
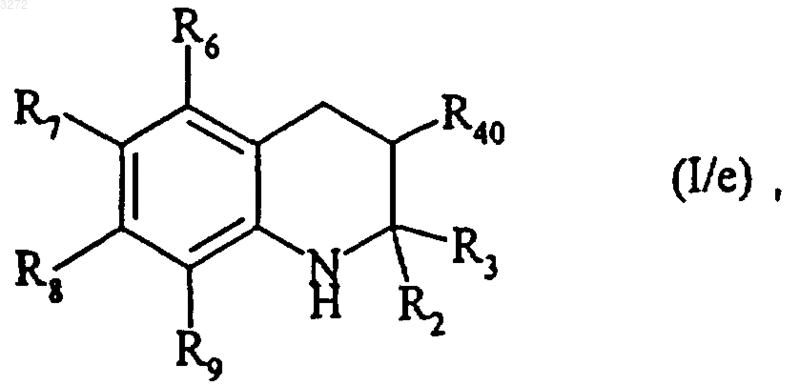
частный случай соединений формулы (I), где R2, R3, R6, R7, R8, R9 и R40 являются такими, как определено выше,
которые (соединения (I/d) и (I/e)) после хлорформилирования атома азота кольца подвергают действию амина формулы (VII), как определено выше, с получением соединения формулы (I/f)
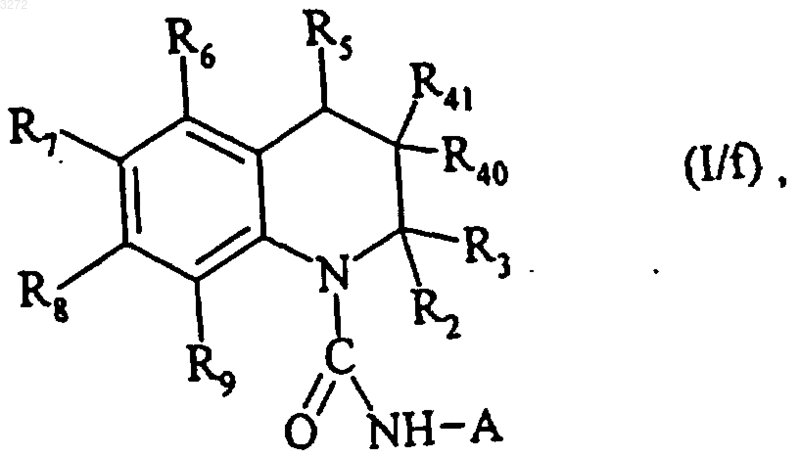
где R2, R3, R6, R7, R8, R9 и A являются такими, как определено выше, R40 имеет такие же значения, как в формуле (I), отличные от атома водорода, и R41 и R5 являются такими, как определено для формулы (I), причем соединения от (I/a), (I/d) до (I/f) составляют все количество соединений формулы (I),
которые могут быть, при необходимости, очищены в соответствии с обычными методами очистки,
стереоизомеры которых, где необходимо, разделяют в соответствии с обычными методами разделения,
которые превращают, если это желательно, в их соли присоединения с фармацевтически приемлемыми кислотами и основаниями.
13. Фармацевтические составы, включающие в себя в качестве активного ингредиента, по крайней мере, одно соединение по любому из пп.1-11, одно или в комбинации с одним или более фармацевтически приемлемыми инертными, нетоксичными наполнителями или носителями.
14. Фармацевтические составы по п.13, включающие в качестве активного ингредиента, по крайней мере, офэю соединение по любому из пп.1-11, для использования в качестве антиокислительных реагентов при лечении болезней, связанных со старением, таких как атеросклероз и катаракта, при лечении слабоумия, при лечении острых нейродегенеративных болезней, таких как церебральная ишемия и эпилепсия, и при лечении хронических нейродегенеративных болезней, таких как болезнь Альцгеймера, болезнь Пика и нейродегенераций базального ганглия (болезнь Паркинсона, болезнь Ханггингтона).
Текст
1 Настоящее изобретение относится к новым соединениям дигидро- и тетрагидрохинолина,способу их получения и содержащим их фармацевтическим составам. Получение соединений, имеющих структуру 1,2-дигидрохинолина, описано в описании к патентам DD 227 434 и DE 4 115 535. Другие соединения, имеющие такое же ядро, замещенные различным образом, были использованы при приготовлении копченого мяса (GB 1537334) или в качестве фотохимических индикаторов (WO 89 05994). Антиокислительные свойства соединений тетрагидрохинолина были использованы в области смазок (ЕР 072 349). Соединения этого типа также были описаны как ингибиторы абсорбции липидов (ЕР 028 765). Согласно свободно-радикальной теории старения Хартмана (J. Gerontol., 1956, 11, 298),последовательные окислительные атаки создают условия "окислительного стресса", которые отражают нарушение равновесия в организме между системами, которые создают свободнорадикальные соединения, и системами, которые являются защитными против таких соединений(R.E. PACIFICI, K.J.A. DAVIES, Gerontology,1991, 37, 166). Различные защитные механизмы могут действовать в синергизме, позволяя контролировать действие свободных радикалов. Эти механизмы могут быть ферментными, как в случае систем, включающих супероксиддисмутазу, каталазу и глутатионпероксидазу,или не ферментными в случаях, включающих в себя витамин Е и витамин С. С возрастом, однако, эти естественные защитные механизмы становятся все менее и менее эффективными, особенно как результат окислительного инактивирования огромного количества ферментов (A.CASTRES de PAULET, Ann. Biol. Clin., 1990, 48,323). Оказалось возможным связать условия окислительного стресса с болезнями, связанными со старением, а именно атеросклерозом, катарактой, не зависящими от инсулина диабетами и раком (М. HAYN et al., Life Science, 1996,59, 537). Центральная нервная система является особенно чувствительной к окислительному стрессу из-за своего высокого потребления кислорода, относительно низкого уровня своей антиокислительной защиты и высокого содержания железа в некоторых церебральных областях (S.A. BENKOVIC et al., J. Comp. Neurol. 1993, 338, 92; D. HARTMAN, Drugs Aging, 1993,3, 60). Последовательные окислительные атаки следовательно составляют один из главных этиологических факторов церебрального старения и связанных с ним болезней, а именно болезни Альцгеймера и хронических нейродегенеративных болезней, нейродегенераций базального ганглия (болезнь Паркинсона, болезнь Хангтингтона) (В. HALLIWELL, J. Neurochem.,1992, 59, 1609). 2 Кроме факта, что соединения по настоящему изобретению являются новыми, они показывают ценные фармакологические свойства. Их антиокислительный характер является ловушкой для реакционноспособных окисляющих соединений, особенно на уровне центральной нервной системы, это означает, что они могут рассматриваться для использования при противостоянии действию окислительного стресса,особенно на церебральном уровне. Более того,большинство из них имеют преимущество, заключающееся в том, что они не вызывают гипотермический эффект при дозировках, используемых для получения нейрозащитного действия. Следовательно, они будут полезны при лечении болезней, связанных со старением, таких как атеросклероз и катаракта, при лечении рака,при лечении слабоумия и при лечении нейродегенеративных болезней, таких как церебральная ишемия и эпилепсия, и при лечении хронических нейродегенеративных болезней, таких как болезнь Альцгеймера, болезнь Пика и нейродегенераций базального ганглия (болезнь Паркинсона, болезнь Хантингтона). Настоящее изобретение, в частности, относится к соединениям общей формулы (I) где R1 представляет собой атом водорода или группу где А представляет собой атом водорода или группу -BNZ1Z2, в которой В представляет собой линейную или разветвленную (C1-С 6)алкиленовую группу и Z1 и Z2 независимо представляют собой атом водорода или алкильную, (С 3 С 8)циклоалкильную или необязательно замещенную арильную группу или, вместе с соединяющим их атомом азота, образуют необязательно замещенную гетероциклоалкильную или гетероарильную группу.R2 и R3, каждый независимо, представляет собой алкильную группу, (С 3-С 8)циклоалкильную группу, гетероциклоалкильную группу,необязательно замещенную арильную группу,необязательно замещенную гетероарильную группу, циклоалкилалкильную группу, гетероциклоалкилалкильную группу, необязательно замещенную арилалкильную группу, необязательно замещенную гетероарилалкильную группу иди аминоалкильную группу (необязательно замещенную на атоме азота одной или двумя группами, выбранными из алкила, циклоалкила, арила и арилалкила) илиR2 и R3 вместе с соединяющим их атомом углерода образуют (С 3-С 8)циклоалкильную группу или моноциклическую гетероциклоал 3 кильную группу, незамещенную или замешенную алкильной, циклоалкильной, циклоалкилалкильной, арильной или арилалкильной группой,R40 представляет собой атом водорода или группу, выбранную из необязательно замещенного алкила, необязательно замещенного алкенила и необязательно замещенного алкинила,или группу Q или - V-Q -, где V представляет собой группу алкилена, алкенилена или алкинилена и Q представляет собой необязательно замещенную (С 3-С 8) циклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную гетероциклоалкильную группу или необязательно замещенную гетероарильную группу,R41 и R5 образуют вместе связь или каждый представляет собой атом водорода,R6, R7, R8 и R9, каждый независимо, представляет собой атом водорода, атом галогена,алкильную группу, (С 3-С 8)циклоалкильную группу или группу -OW, где W представляет собой атом водорода или алкильную группу,ацильную группу,(С 3-C8)циклоалкильную группу, гетероциклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную гетероарильную группу,необязательно замещенную арилалкильную группу или необязательно замещенную гетероарилалкильную группу (при условии, что R6, R7,R8 и R9 не могут все одновременно представлять собой атом водорода и что, по крайней мере,один из них представляет собой группу -OW,как определено выше),с условием, что когда R2 и R3 представляют собой алкильную группу: если каждый заместитель от R6 до R9 независимо представляет собой атом водорода, алкильную группу или группу -OW, где W представляет собой алкильную группу, и R41 и R5 вместе образуют связь, тогда R40 является отличным от атома водорода или алкильной группы; если в молекуле присутствует одна группа-OW и она представляет собой гидроксигруппу,тогда R40 является отличным от атома водорода; если в молекуле присутствует одна группа-OW и она представляет собой метоксигруппу,тогда R40 является отличным от гидроксиалкильной группы; соединение формулы (I) является отличным от 7-метокси-2,2-дифенил-1,2-дигидрохинолина, причем подразумевается, что термин алкил означает линейную или разветвленную цепь от 1 до 6 атомов углерода; термин"ацил" означает алкилкарбонильную группу, причем алкил является таким, как определено выше; термин "алкенил" означает линейную или разветвленную цепь от 2 до 6 атомов углерода,содержащую от 1 до 3 двойных связей; 4 термин "алкинил" означает линейную или разветвленную цепь от 2 до 6 атомов углерода,содержащую от 1 до 3 тройных связей; термин "алкилен" означает линейную или разветвленную двухвалентную группу, содержащую от 1 до 6 атомов углерода; термин "алкенилен" означает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 двойных связей; термин "алкинилен" означает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 тройных связей; термин "арил" означает фенильную, нафтильную или бифенильную группу; термин "гетероциклоалкил" означает моноили бициклическую, от 4- до 11-членную группу, содержащую от 1 до 6 гетероатомов, выбранных из азота, кислорода и серы, причем эта группа может содержать одну или более ненасыщенных связей, не являясь при этом ароматической; термин "гетероарил" означает ароматическую или частично ароматическую, моно- или бициклическую, 4-11-членную группу, содержащую от 1 до 6 гетероатомов, выбранных из азота, кислорода и серы; термин "замещенный, используемый в отношении арила или арилалкила", показывает,что они замещены одним или более атомами галогена или алкильной, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)пергалогеналкильной, амино (необязательно замещенной 1 или 2 алкильными группами), циано, карбокси, линейной или разветвленной (C1-С 6)алкоксикарбонильной, аминокарбонильной (необязательно замещенной на атоме азота 1 или 2 алкильными группами),нитро или гидроксигруппами; термин "замещенный, используемый в отношении выражений алкила, алкенила, алкинила и циклоалкила", показывает, что такие группы являются замещенными одной или более группами, выбранными из гидрокси, линейной или разветвленной (C1-C6)алкокси, линейной или разветвленной (C1-C6)алкилтио, амино (необязательно замещенной одной или двумя алкильными группами), карбокси, нитро, циано,линейным или разветвленным(C1C6)алкоксикарбонилом и аминокарбонилом (необязательно замещенным на атоме азота одной или двумя алкильными группами); термин "замещенный, используемый в отношении гетероциклоалкила, гетероарила и гетероарилалкила", показывает, что имеющие отношение группы являются замещенными одним или более атомами галогена или алкильной, линейной или разветвленной (C1-C6) алкокси, линейной или разветвленной (C1-C6) пергалогеналкильной, амино (необязательно замещенной 1 или 2 алкильными группами), циано, карбок 5 си, линейной или разветвленной (C1-C6) алкоксикарбонильной, аминокарбонильной (необязательно замещенной на атоме азота 1 или 2 алкильными группами), нитро, гидрокси или оксо группами; к их энантиомерам и диастереоизомерам, и их солям присоединения фармацевтически приемлемой кислоты или основания. Среди фармацевтически приемлемых кислот можно упомянуть, не подразумевая какиелибо ограничения, хлористо-водородную, бромисто-водородную, серную, фосфоновую, уксусную, трифторуксусную, молочную, пировиноградную, малоновую, янтарную, глутаровую,фумаровую, винную, малеиновую, лимонную,аскорбиновую, метансульфоновую, камфорную и щавелевую кислоту и т.д. Среди фармацевтически приемлемых оснований можно упомянуть, не подразумевая какие-либо ограничения, гидроксид натрия,гидроксид калия, триэтиламин, трет-бутиламин и т.д. Настоящее изобретение преимущественно,относится к соединениям формулы (I), где R1 представляет собой атом водорода. Предпочтительно в соединениях формулы(I) R6, R7, R8 и R9, каждый независимо, представляет собой атом водорода, алкильную группу или группу -OW, где W представляет собой алкильную, ацильную или фенильную группу. Более предпочтительно W представляет собой алкильную группу. Предпочтительные соединения по настоящему изобретению представляют собой соединения, в которых R2 и R3 каждый представляет собой алкильную группу, например метильную. Другие предпочтительные соединения по настоящему изобретению представляют собой соединения, в которых R1 и R2 вместе образуют необязательно замещенную циклоалкильную или гетероциклоалкильную группу и более предпочтительно циклоалкильную группу, например, циклогексильную. В соединении формулы (I) R40 предпочтительно представляет собой атом водорода или группу V-Q, причем V более предпочтительно является алкиленовой группой и Q более предпочтительно является гетероциклоалкильной группой. Предпочтительная арильная группа по настоящему изобретению представляет собой фенильную группу. Преимуществом настоящего изобретения является то, что оно относится к соединениям формулы (I), где R1 представляет собой атом водорода, R2 и R3 представляют собой алкильную группу или вместе образуют циклоалкильную группу, R40 представляет собой атом водорода или группу V-Q, где V представляет собой алкиленовую группу и Q представляет собой гетероциклоалкильную группу и R6, R7, R8 и R9 каждый независимо представляет собой атом 6 водорода, алкильную группу или группу -OW,где W представляет собой алкильную, ацильную или фенильную группу, причем подразумевается, что R6, R7, R8 и R9 не могут все представлять собой атом водорода и что, по крайней мере,один из них представляет собой -OW группу,как определено выше. Среди предпочтительных соединений по настоящему изобретению могут быть упомянуты 6-этокси-1,2-дигидрохинолин-2-спироциклогексан,6-этокси-5,7,8-триметил-1,2-дигидрохинолин-2-спироциклогексан,8-этокси-1,2-дигидрохинолин-2-спироциклогексан,5,7-диизопропил-6-этокси-1,2-дигидрохинолин-2-спироциклогексан,5,7-диметил-6-этокси-1,2-дигидрохинолин 2-спироциклогексан,6-этокси-2,2,5,7,8-пентаметил-1,2,3,4 тетрагидрохинолин,5,7-диизопропил-2,2-диметил-6-этокси 1,2,3,4-тетрагидрохинолин,6-этокси-2,2,5,7-тетраметил-1,2,3,4-тетрагидрохинолин,6-этокси-5,7,8-триметил-1,2,3,4-тетрагидрохинолин-2-спироциклогексан,6-этокси-1,2-дигидрохинолин-2-спиро-4'пиперидин,6-этокси-1,2-дигидрохинолин-2-спиро-4'(1'-циклопропилметилпиперидин),2,2-диметил-6-этокси-3-(2-морфолиноэтил)-1,2-дигидрохинолиндигидрохлорид,6-трет-бутокси-1,2-дигидрохинолин-2-спироциклогексан,6-метокси-1,2-дигидрохинолин-2-спироциклогексан,6-фенокси-1,2-дигидрохинолин-2-спироциклогексан,6-этокси-5,7-диметил-1,2,3,4-тетрагидрохинолин-2-спироциклогексан,6-этокси-2,2-диметил-3-[2-(2,6-диоксопиперазин-4-ил) этил]-1,2-дигидрохинолин,6-этокси-2,2-диметил-3-[2-(1-пиперидинил)этил]-1,2-дигидрохинолин,2-[2-(6-этокси-2,2-диметил-1,2-дигидро-3 ил)этил]-1 Н-изоиндол-1,3(2 Н)-дион,3-[2-(6-этокси-2,2-диметил-1,2-дигидро-3 хиноленил)этил]-4(3H)-хиназолинон,6-трет-бутилкарбонилокси-1,2-дигидрохинолин-2-спироциклогексан и очень предпочтительны: 6-этокси-2,2,5,7,8-пентаметил-1,2,3,4-тетрагидрохинолин,6-этокси-1,2-дигидрохинолин-2-спироциклогексан. Настоящее изобретение относится также к способу получения соединений формулы (I),который заключается в том, что в качестве исходного продукта используют различным образом замещенный анилин формулы (II)= либо может быть подвергнуто реакции восстановления с получением соединения формулы (I/b) где R6, R7, R8 и R9 являются такими, как определено для формулы (I),который подвергают либо действию в щелочной среде и необязательно в присутствии катализатора галогенированного ацетилида формулы (III) где R2 и R3 являются такими, как определено для формулы (I), G представляет собой атом водорода или триалкилсилильную группу и Hal представляет собой атом галогена с получением соединения формулы (IV) где R2, R3, R6, R7, R8, R9 и G являются такими,как определено выше,- или действию карбонильного соединения формулы (V) где R2 и R3 являются такими, как определено для формулы (I), с получением соединения формулы (VI) где R2, R3, R6, R7, R8 и R9 являются такими, как определено выше,причем далее соединение (VI) подвергают взаимодействию с ацетилидом формулы (III),как определено выше, в щелочной среде с получением соединения формулы (IV),как определено выше, которое (соединение формулы (IV, где это применимо после разрыва триалкилсилильной группы, подвергают реакции замыкания цикла посредством нагрева в присутствии соответствующего катализатора,приводя к образованию соединения формулы частный случай соединений формулы (I), где R2,R3, R6, R7, R8, R9 являются такими, как определено выше,которое частный случай соединений формулы (I), где R2,R3, R6, R7, R8 и R9 являются такими, как определено выше,далее соединения формулы (I/a) и (I/b), после хлорформилирования азота, находящегося в цикле, подвергают действию амина формулыH2N - А (VII),где А является таким, как определено для формулы (I), с получением соединения формулы где R2, R3, R6, R7, R8, R9 и А являются такими,как определено ранее, и R41 и R5 являются такими, как определено для формулы (I),= либо после защиты атома азота, находящегося в кольце, может быть последовательно подвергнуто реакции гидроксигалогенирования и реакции окисления в бензильном положении,с получением соединения формулы (VIII) где R2, R3, R6, R7, R8 и R9 являются такими, как определено выше, Hal представляет собой атом галогена и Р является защитной группой для атома азота кольца (например, ацетильной,трифторацетильной, трет-бутоксикарбонильной или бензилоксикарбонильной группой),которое подвергают реакции нуклеофильного замещения, чтобы получить соединение формулы (IX) где R2, R3, R6, R7, R8, R9 и Р являются такими,как определено выше, и Y представляет собой либо группу R40, которая является такой, как определено для формулы (I), но отлична от атома водорода, либо исходное соединение для такой группы,которое, после снятия защиты с атома азота кольца, восстанавливают по карбонильной функции с последующим элиминированием с получением соединения формулы (X): где R2, R3, R6, R7, R8, R9 и Y являются такими,как определено выше,соединение формулы (X) в случае, когда Y является исходным соединением для группыR40, как определено выше, может быть подвергнуто последовательным реакциям, направленным на получение соединения формулы (I/d): частный случай соединений формулы (I),где R2, R3, R6, R7, R8, R9 и R40 являются такими,как определено выше,которое может быть восстановлено, чтобы получить соединение формулы (1/е): частный случай соединений формулы (I), где R2,R3, R40, R6, R7, R8 и R9 являются такими, как определено выше,соединения (I/d) и (I/е) далее, после хлорформилирования атома азота кольца, подвергают действию амина формулы (VII), как определено выше, чтобы получить соединение формулы (I/f) где R2, R3, R6, R7, R8, R9 и А являются такими,как определено выше, R40 имеет такие же значения, как в формуле (I), отличающиеся от атома водорода, и R41 и R5 являются такими, как определено для формулы (I),причем соединения (l/a)-(I/f) включают все соединения формулы (I): которые могут быть, при необходимости,очищены в соответствии с обычными методами очистки; стереоизомеры которых, где это уместно,разделяют в соответствии с обычными методами разделения; которые превращают, если это желательно,в их соли присоединения с фармацевтически приемлемыми кислотами и основаниями. Настоящее изобретение также относится к фармацевтическому составу, включающему в себя в качестве активного ингредиента, по крайней мере, одно соединение формулы (I) по отдельности или в комбинации с одним или бо 003272 10 лее инертным, не токсичным наполнителем или носителем. Среди фармацевтических составов по настоящему изобретению более предпочтительны те, которые пригодны для орального, парентерального, назального приема, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, свечи, кремы, мази, кожные гели и т.д. Используемые дозировки различаются в соответствии с полом, возрастом и весом пациента, природой и серьезностью заболевания и путем приема лекарства, который может быть оральным, назальным или парентеральным. Как правило, единица дозы находится в диапазоне от 0,1 до 500 мг для лечения при 1 и до 3 приемов в течение 24 ч. Следующие примеры иллюстрируют настоящее изобретение, но ни коим образом не ограничивают его. Используемые исходные материалы являются известными продуктами или приготовлены согласно известным процедурам. Препарат А. 4-Этокси-3,5,6-триметиланилин. Стадия 1. 2-Этокси-1,3,4-триметилбензол. К раствору 367 ммоль (50 г) 2,3,6 триметилфенола в 1500 мл ацетонитрила последовательно добавляют 734 ммоль (101,5 г) карбоната калия и 917 ммоль (143,1 г) этилиодида. Всю смесь нагревают с обратным холодильником в течение 48 ч. Затем реакционную смесь охлаждают и потом фильтруют и фильтрат концентрируют. Полученный остаток растворяют в этилацетате и промывают водой и затем 10% водным раствором хлорида натрия. После осушки и последующего концентрирования органической фазы получают маслянистый остаток, который очищают посредством хроматографии на силикагеле, используя смесь 95:5 петролейный эфир: этилацетат в качестве элюента, чтобы получить ожидаемый продукт. Стадия 2. 4-Этокси-3,5,6-триметилиодбензол. К раствору 171 ммоль (28,03 г) соединения, описанного в вышеприведенной стадии, в 650 мл ацетонитрила добавляют 222 ммоль (50 г) N-иодсукцинимида, и смесь нагревают с обратным холодильником в течение 24 ч. Затем растворитель выпаривают под вакуумом, и остаток отбирают в эфир. Раствор промывают насыщенным раствором NаНСО 3 и затем 10% водным раствором хлорида натрия. Органическую фазу сушат и концентрируют. Полученный маслянистый остаток очищают хроматографией на силикагеле, используя смесь 95:5 петролейный эфир: этилацетат в качестве элюента, давая ожидаемый продукт. Стадия 3. 4-Этокси-3,5,6-триметиланилин. 0,46 ммоль (0,426 г) Pd2(dba)3 и 1,39 ммоль(0,947 г) BINAP помещают в 1-литровую круглодонную колбу под инертной атмосферой. Во 11 второй круглодонной колбе в 250 мл безводного ТГФ растворяют 46,5 ммоль (13,5 г) соединения, описанного в приведенной выше стадии,65,1 ммоль (6,26 г) трет-бутанолата натрия, 65,1 ммоль (17,21 г) 18-краун-6 и 65,8 ммоль (10,12 г) бензофенонимина. Раствор из второй круглодонной колбы помещают в круглодонную колбу, содержащую каталитическую систему с помощью канюля. Содержимое нагревают при 60 С в течение 3 ч, и затем реакционную смесь разбавляют эфиром. Образовавшийся осадок отфильтровывают на фриттованном стекле, и фильтрат затем выпаривают. Полученный остаток вновь растворяют в 300 мл ТГФ. К этому добавляют 30 мл раствора хлористоводородной кислоты (2 Н), и раствор перемешивают при комнатной температуре в течение 1 ч. Затем все разбавляют избытком хлористо-водородной кислоты (1 Н) и смесью 2:1 гептан : этилацетат. Водную фазу отделяют и затем нейтрализуют,используя 1 М раствор гидроксида натрия. После экстрагирования дихлорметаном, осушки органической фазы и выпаривания растворителя получают ожидаемый продукт. Препарат В. 3,5-Диизопропил-4-этоксианилин. Стадия 1. 2,6-Диизопропил-4-нитрофенол. 78,3 ммоль (4,93 г) дымящейся азотной кислоты по каплям добавляют к раствору 53,9 ммоль (9,62 г) 2,6-диизопропилфенола в 350 мл уксусной кислоты, охлажденному до 0 С. Реакционную смесь перемешивают при 0 С в течение 1 ч 30 мин и затем переливают в смесь этилацетата и льда. Органическую фазу отделяют и затем промывают водой. После осушки и выпаривания растворителя собирают масляный остаток, который очищают хроматографией на силикагеле, используя смесь 9:1 петролейный эфир : этилацетат в качестве элюента. Стадия 2: 2,6-Диизопропил-1-этокси-4 нитробензол. Ожидаемый продукт получают по процедуре, описанной в стадии 1 препарата А, начиная с соединения, описанного в вышеприведенной стадии. Стадия 3. 3,5-Диизопропил-4-этоксианилин. Раствор 19,9 ммоль (5,0 г) соединения,описанного в вышеприведенной стадии, в 135 мл абсолютного этанола в присутствии 1,5 г палладия на угле (10 %) помещают в среду водорода под давлением 1 атм при комнатной температуре в течение 4 ч. После этого периода времени реакционную смесь фильтруют и затем фильтрат концентрируют, приводя к получению ожидаемого соединения. Препарат С. 3,5-Диметил-4-этоксианилин. Стадия 1. 3,5-Диметил-4-этоксинитробензол. К раствору 149,5 ммоль (25 г) 2,6-диметил 4-нитрофенола в 1300 мл ацетонитрила последовательно добавляют 300 ммоль (326 г) карбо 003272 12 ната цезия и 374 ммоль (58,5 г) этилиодида. Все нагревают с обратным холодильником в инертной атмосфере в течение 15 ч. Затем реакционную смесь охлаждают и потом фильтруют, а фильтрат выпаривают. Остаток растворяют в этилацетате и промывают водой и затем 10% водным раствором хлорида натрия. Ожидаемый продукт получают осушкой органической фазы и последующим концентрированием. Стадия 2. 3,5-Диметил-4-этоксианилин. Раствор 149,5 ммоль (29,19 г) соединения,описанного в вышеприведенной стадии, в 1000 мл абсолютного этанола в присутствии 9,4 г палладия на угле (10%) помещают в среду водорода под давлением 1 атм при комнатной температуре в течение 4 ч. После этого периода времени реакционную смесь фильтруют и затем фильтрат концентрируют, приводя к получению ожидаемого соединения. Препарат D. 4-трет-Бутоксианилин. Стадия 1. 1-трет-Бутокси-4-нитробензол. К раствору 10,78 ммоль (1,5 г) 4-нитрофенола в 10 мл толуола при комнатной температуре добавляют 43,79 ммоль N,N-диметилформамид ди-трет-бутилацеталя. Реакционную смесь нагревают с обратным холодильником при энергичном перемешивании в течение 5 ч. Реакционную смесь разбавляют этилацетатом и затем промывают водой, насыщенным водным раствором бикарбоната натрия и затем 10% водным раствором хлорида натрия. Ожидаемый продукт получают осушкой органической фазы и затем концентрированием. Стадия 2. 4-трет-Бутоксианилин. Раствор 4,61 ммоль (0,90 г) соединения,описанного в вышеприведенной стадии, в 15 мл абсолютного этанола, содержащий 24,65 ммоль(10 %) нагревают с обратным холодильником при энергичном перемешивании в течение 2 ч. После этого периода времени реакционную смесь фильтруют и затем фильтрат концентрируют, приводя к получению ожидаемого соединения. Препарат Е. 4-трет-Бутилкарбонилоксианилин. Стадия 1. 1-трет-Бутилкарбонилокси-4 нитробензол. К раствору 107,8 ммоль (15 г) 4 нитрофенола в 250 мл пиридина добавляют 161,1 ммоль (19,48 г) пивалоилхлорида. Реакционную смесь перемешивают в течение 72 ч при комнатной температуре. Реакционную смесь выпаривают под вакуумом, и маслянистый остаток разбавляют этилацетатом и затем промывают водным раствором хлористо-водородной кислоты (0,1 н.) и потом 10% водным раствором хлорида натрия. Ожидаемый продукт получают осушкой органической фазы и затем концентрированием. Стадия 2. 4-трет-Бутилкарбонилоксианилин. 13 Раствор 95,41 ммоль (21,30 г) соединения,описанного в вышеприведенной стадии, в 1200 мл 4/1 смеси метанола и уксусной кислоты, содержащей 573 ммоль (32,00 г) железа, нагревают при 65 С в течение 20 ч. После этого периода времени реакционную смесь фильтруют, и фильтрат затем концентрируют, приводя к получению маслянистого остатка, который разбавляют этилацетатом и промывают 10% водным раствором бикарбоната натрия и затем 10% водным раствором хлорида натрия. Ожидаемый продукт получают осушкой органической фазы и затем концентрированием. Пример 1. 6-Этокси-1,2-дигидрохинолин 2-спироциклогексангидрохлорид. Стадия 1. N-(4-Этоксифенил)-N-[1-(1-этинил)циклогексил]амин. К охлажденному до 10 С раствору 18,2 ммоль (2,5 г) п-фенетидина в смеси эфир : вода(4:1; 30 мл), содержащему 24,5 ммоль (3,42 мл) триэтиламина, последовательно добавляют 0,25 ммоль (0,025 г) CuCl, 0,39 ммоль (0,25 г) Сu и по каплям 28,0 ммоль (4,0 г) 1-этинил-1 хлорциклогексана, приготовленного по методу,описанному в J. Am. Chem. Soc., 83, 725, 1961,используя в качестве исходного вещества 1 этинилциклогексанол. После перемешивания в течение 4 ч (позволяя температуре увеличиваться в сторону комнатной температуры) реакционную смесь разбавляют эфиром и затем промывают 1 н. раствором серной кислоты. Эфирную фазу удаляют, и водную фазу нейтрализуют (при 0 С), используя гранулы гидроксида калия, и затем проводят повторную экстракцию эфиром. Органическую фазу сушат и затем концентрируют, чтобы получить ожидаемый продукт. Стадия 2. 6-Этокси-1,2-дигидрохинолин-2 спироциклогексангидрохлорид. К раствору 14,79 ммоль (2,89 г) соединения, описанного в вышеприведенной стадии, в 20 мл толуола добавляют 3,0 ммоль (0,30 г)CuCl, и смесь нагревают с обратным холодильником в течение 40 мин. Растворитель затем выпаривают, и маслянистый остаток очищают хроматографией на силикагеле, используя дихлорметан в качестве элюента, чтобы получить ожидаемый продукт. Последний осаждают в форме гидрохлорида из смеси эфирный хлористый водород/изопропанол, чтобы получить соответствующий гидрохлорид. Температура плавления: 183-186 С (разложение; iPr2O/CH2Cl2) Элементный анализ 14 Стадия 1. N-(4-Этокси-2,3,5-триметилфенил)-N-[1-(1-этинил)циклогексил]амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1, начиная с соединения, описанного при приготовлении препарата А. Стадия 2. 6-Этокси-5,7,8-триметил-1,2 дигидрохинолин-2-спирогексангидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, начиная с соединения, описанного в вышеприведенной стадии. Соответствующий гидрохлорид получают осаждением из смеси эфир/дихлорметан, к которой добавляют эфирный хлористый водород. Температура плавления: 158-161 С (Et2O/N Сl Найдено, % 71,13 8,68 4,30 11,24 Вычислено, % 70,90 8,77 4,35 11,01 Пример 3. 8-Этокси-1,2-дигидрохинолин 2-спироциклогексангидрохлорид. Стадия 1. N-(2-Этоксифенил)-N-[1-(1-этинил)циклогексил]амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1 с заменой п-фенетидина на о-фенетидин. Стадия 2. 8-Этокси-1,2-дигидрохинолин-2 спироциклогексангидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, начиная с соединения, описанного в вышеприведенной стадии. Соответствующий гидрохлорид получают осаждением из смеси эфир/дихлорметан, к которой добавляют эфирный хлористый водород. Температура плавления: 154-155 СN Сl Найдено, % 68,62 7,65 4,84 12,59 Вычислено, % 68,68 7,92 5,01 12,67 Пример 4. 5,7-Диизопропил-6-этокси-1,2 дигидрохинолин-2-спироциклогексангидрохлорид. Стадия 1. N-(3,5-Диизопропил-4-этоксифенил)-N-[1-(1-этинил)циклогексил]амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1, используя в качестве исходного вещества соединение,описанное при приготовлении препарата В. Стадия 2. 5,7-Диизопропил-6-этокси-1,2 дигидрохинолин-2-спироциклогексангидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, начиная с соединения, описанного в вышеприведенной стадии.N Сl Найдено, % 72,87 9,28 3,87 9,76 Вычислено, % 72,60 9,42 3,85 9,74 Пример 5. 5,7-Диметил-6-этокси-1,2-дигидрохинолин-2-спироциклогексангидрохлорид. Стадия 1. N-(3,5-Диметил-4-этоксифенил)N-[1-(1-этинил) циклогексил]амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1, используя в качестве исходного вещества соединение,описанное при приготовлении препарата С. Стадия 2. 5,7-Диметил-6-этокси-1,2-дигидрохинолин-2-спироциклогексангидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, начиная с соединения, описанного в вышеприведенной стадии. Температура плавления: 175-180 С (Et2O) Элементный анализ (эмпирическая формула:N Сl Найдено, % 70,47 8,55 4,57 11,56 Вычислено, % 70,23 8,51 4,55 11,52 Пример 6. 6-Этокси-2,2,5,7,8-пентаметил 1,2,3,4-тетрагидрохинолингидрохлорид. Стадия 1. N-(1,1-Диметил-2-пропинил)-N(4-этокси-2,3,5-триметилфенил)амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1, используя в качестве исходного вещества соединение,описанное при приготовлении препарата А, и заменяя 1-этинил-1-хлорциклогексан на 2-хлор 2-метил-3-бутин (приготовленный по методу,описанному в J. Amer. Chem. Soc., 83, 725, 1961,в качестве исходного соединения используя 2 метил-3-бутин-2-ол). Стадия 2. 6-Этокси-2,2,5,7,8-пентаметил 1,2, -дигидрохинолин. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, начиная с соединения, описанного в вышеприведенной стадии. Стадия 3. 6-Этокси-2,2,5,7,8-пентаметил 1,2,3,4-тетрагидрохинолингидрохлорид. К раствору 5,99 ммоль (1,47 г) соединения,описанного в вышеприведенной стадии, в 55 мл этанола добавляют 0,9 г палладия на угле (10%). Реакционную смесь перемешивают под давлением 1 атм. водорода при комнатной температуре в течение двух часов. Реакционную смесь затем фильтруют и фильтрат концентрируют. Получают ожидаемый продукт в форме гидрохлорида посредством осаждения из эфирного хлористого водорода. Элементный анализ (эмпирическая формула: C16H25NOHCl). Пример 7. 5,7-Диизопропил-2,2-диметил-6 этокси-1,2,3,4-тетрагидрохинолингидрохлорид. Стадия 1. N(1,1-Диметил-2-пропинил)-N(3,5-диизопропил-4-этоксифенил)амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1, используя в качестве исходного вещества соединение,описанное при приготовлении препарата В, и заменяя 1-этинил-1-хлорциклогексан на 2-хлор 2-метил-3-бутин (приготовленный по методу,описанному в J. Amer. Chem. Soc., 83, 725, 1961,в качестве исходного соединения, используя 2 метил-3-бутин-2-ол). Стадия 2. 5,7-Диизопропил-2,2-диметил-6 этокси-1,2-дигидрохинолин. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, начиная с соединения, описанного в вышеприведенной стадии. Стадия 3. 5,7-Диизопропил-2,2-диметил-6 этокси-1,2,3,4-тетрагидрохинолингидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 3 примера 6, начиная с соединения, описанного в вышеприведенной стадии. Температура плавления: 227-230 С (Et2O) Элементный анализ (эмпирическая формула: C19H31NOHCl). С НN Сl Найдено, % 70,00 9,68 4,24 10,82 Вычислено, % 70,02 9,90 4,30 10,88 Пример 8. 6-Этокси-2,2,5,7-тетраметил 1,2,3,4-тетрагидрохинолингидрохлорид. Стадия 1. N-(1,1-Диметил-2-пропинил)-N(3,5-диметил-4-этоксифенил)амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1, используя в качестве исходного вещества соединение,описанное при приготовлении препарата С, и заменяя 1-этинил-1-хлорциклогексан на 2-хлор 2-метил-3-бутин (приготовленный по методу,описанному в J. Amer. Chem. Soc., 83, 725, 1961,в качестве исходного соединения, используя 2 метил-3-бутин-2-ол). Стадия 2. 6-Этокси-2,2,5,7-тетраметил-1,2 дигидрохинолин. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, начиная с соединения, описанного в вышеприведенной стадии. Стадия 3. 6-Этокси-2,2,5,7-тетраметил 1,2,3,4-тетрагидрохинолингидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 3 примера 6, начиная с соединения, описанного в вышеприведенной стадии. Температура плавления: 198-200 СN Сl Найдено, % 66,71 8,93 5,15 13,11 Вычислено, % 66,77 8,97 5,19 13,35 Пример 9. 6-Этокси-5,7,8-триметил-1,2,3,4 тетрагидрохинолин-2-спироциклогексангидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 3 примера 6, используя в качестве исходного материала соединение,описанное в примере 2. Температура плавления: 192-198 С (с разложением; C2H5OH) Элементный анализ (эмпирическая формула: С 19 Н 29NOHCl). С НN Сl Найдено, % 70,46 9,23 4,35 10,98 Вычислено, % 70,46 9,34 4,32 10,95 Пример 10. 6-Этокси-1,2-дигидрохинолин 2-спиро-4'-пиперидингидрохлорид. Стадия 1. трет-Бутил-4-[(4-этоксифенил) имино]-1-пиперидинкарбоксилат. К раствору 202,6 ммоль (27,8 г) парафенетидина и 169 ммоль (33,7 г) N-третбутоксикарбонил-4-пиперидона в 60 мл эфирадобавляют 45 г молекулярных сит (5 ). Все перемешивают при комнатной температуре в течение 15 ч. Реакционную смесь впоследствии фильтруют, и затем фильтрат концентрируют,приводя к получению ожидаемого продукта. Стадия 2. трет-Бутил-4-(4-этоксианилин)4-(2-триметилсилил-1-этинил)-1-пиперидинкарбоксилат. 66,7 ммоль (42 мл) 1,6 М раствора нбутиллития добавляют по каплям в течение 1 часа к раствору 77,8 ммоль (7,64 г) триметилсилилацетилена в 160 мл ТГФ, охлажденному до 78 С. Всю смесь перемешивают при -78 С в течение 1 ч и затем при комнатной температуре в течение дополнительного часа. Полученный таким образом триметилсилилацетилид лития затем добавляют по каплям к 155,5 ммоль (49,5 г) соединения, описанного в вышеприведенной стадии, растворенного в 500 мл ТГФ. Реакционную смесь перемешивают при -78 С в течение 1 ч и затем при комнатной температуре в течение 15 ч. Реакционную смесь затем переливают в смесь этилацетата и льда. Органическую фазу отделяют, промывают хлоридом аммония (10%),сушат и затем концентрируют. Полученный маслянистый остаток очищают хроматографией на силикагеле, используя смесь петролейный эфир/ этилацетат (4:1) в качестве элюента, чтобы получить ожидаемое соединение. Стадия 3. трет-Бутил-4-(4-этоксианилин)4-(1-этинил)-1-пиперидинкарбоксилат. К раствору 21,38 ммоль (8,91 г) соединения, описанного в вышеприведенной стадии, в 270 мл ТГФ, охлажденному до 0 С, по каплям 18 добавляют 23,7 ммоль (24 мл) 1 М раствора фторида тетрабутиламмония в ТГФ. После перемешивания в течение 1 ч при 0 С смесь разбавляют эфиром и затем промывают водой. Органическую фазу сушат и затем концентрируют, и остаток очищают хроматографией на силикагеле, используя смесь петролейный эфир/этилацетат (4:1) в качестве элюента, чтобы получить ожидаемый продукт. Стадия 4. 6-Этокси-1,2-дигидрохинолин-2 спиро-4'-(1'-трет-бутоксикарбонилпиперидин). Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, начиная с соединения, описанного в вышеприведенной стадии. Стадия 5. 6-Этокси-1,2-дигидрохинолин-2 спиро-4'-пиперидингидрохлорид. К раствору 5,99 ммоль (2,06 г) соединения,описанного в вышеприведенной стадии, в 100 мл абсолютного С 2 Н 5OН при комнатной температуре добавляют 30 мл концентрированного раствора хлористо-водородной кислоты. После перемешивания в течение 1 ч 30 мин растворители выпаривают, и остаток переносят в смесь этилацетат/вода. Двухфазный раствор приводят к рН = 11, используя 2 М раствор гидроксида натрия. Органическую фазу отделяют, затем сушат и концентрируют, чтобы получить ожидаемый продукт. Соответствующий гидрохлорид получают осаждением из смеси эфир/ дихлорметан, к которой добавляют эфирный хлористый водород. Элементный анализ (эмпирическая формула: C15H20N2OHCl). С НN Сl Найдено, % 63,47 7,58 9,66 13,58 Вычислено, % 64,16 7,54 9,98 12,63 Пример 11. 6-Этокси-1,2-дигидрохинолин 2-спиро-4'-(1'-циклопропилметилпиперидин) гидрохлорид. К раствору 2 ммоль (0,5 г) соединения,описанного в примере 10, в 30 мл ацетонитрила в присутствии 4 ммоль (0,56 г) карбоната калия,добавляют 2,45 ммоль (0,23 мл) бромметилциклопропана. Смесь перемешивают при комнатной температуре в течение 15 ч перед тем, как профильтровать. Фильтрат концентрируют, и остаток очищают хроматографией на силикагеле, используя смесь дихлорметан: этанол 9:1 в качестве элюента, чтобы получить ожидаемый продукт. Соответствующий гидрохлорид получают осаждением из смеси эфирный хлористый водород/дихлорметан. Температура плавления: 170 С (с разложением; Et2O) Элементный анализ (эмпирическая формула: C15H20N2O1,6 НСl). С Н 19 Пример 12. 2,2-Диметил-6-этокси-3-(2 морфолиноэтил)-1,2-дигидрохинолиндигидрохлорид. Стадия 1. 1-Ацетил-2,2-диметил-6-этокси 1,2-дигидрохинолин. Раствор 30,2 ммоль (6,15 г) 2,2-диметил-6 этокси-1,2-дигидрохинолина (приготовленного по процедуре, описанной в стадиях 1 и 2 примера 1, начиная с 2-хлор-2-метил-3-бутина) в 45 мл уксусного ангидрида нагревают при 100 С при инертной атмосфере в течение 3 ч. После охлаждения среду концентрируют, и остаток очищают хроматографией на силикагеле, используя в качестве элюента смесь дихлорметан/этилацетат 95:5, чтобы получить ожидаемое соединение. Стадия 2. 1-Ацетил-3-бром-2,2-диметил-6 этокси-4-гидрокси-1,2,3,4-тетрагидрохинолин. К раствору 24,7 ммоль (6,06 г) соединения,описанного в вышеприведенной стадии, в 154 мл смеси диметилсульфоксид:вода 10:1, охлажденному до 0 С, по частям добавляют 28,37 ммоль (5,05 г) N-бромсукцинимида. Реакционную смесь впоследствии разбавляют этилацетатом и затем 3 раза промывают 100 мл воды и один раз 100 мл насыщенного раствора хлорида натрия. Органическую фазу осушают и концентрируют, чтобы получить ожидаемое соединение. Стадия 3. 1-Ацетил-3-бром-2,2-диметил-6 этокси-1,2,3,4-тетрагидрохинолин-4-он. К раствору 24,51 ммоль (8,39 г) соединения, описанного в вышеприведенной стадии, в 225 мл дихлорметана добавляют 30 г активированных молекулярных сит 4 . Реакционную смесь охлаждают до 0 С и к ней добавляют по частям 31,10 ммоль (23 г) дихромата пиридиния. Реакционную смесь перемешивают при 0 С в течение 10 мин и затем при комнатной температуре в течение 2 ч. Смесь фильтруют,и осадок промывают дихлорметаном и ацетоном. Фильтрат концентрируют и очищают хроматографией на силикагеле, используя в качестве элюента смесь петролейный эфир: этилацетат 70:30, чтобы получить ожидаемое соединение. Стадия 4. 1-Ацетил-2,2-диметил-6-этокси 3-[(этоксикарбонил-трет-бутоксикарбонил) метил]-1,2,3,4-тетрагидрохинолин-4-он. К суспензии 29,75 ммоль (1,19 г) гидрида натрия 60% в масле в 85 мл ТГФ, охлажденной до 0 С, по каплям добавляют 32,35 ммоль (6,09 г) трет-бутилэтилмалоната, растворенного в 30 мл ТГФ. После перемешивания в течение 30 мин при 0 С по каплям добавляют 21,57 ммоль(7,34 г) соединения, описанного в вышеприведенной стадии, растворенного в 35 мл ТГФ. Реакционную смесь перемешивают в течение 10 мин при 0 С и затем при комнатной температуре в течение 3 ч. Реакционную смесь нейтрализуют 100 мл воды, и среду разбавляют этилацетатом. Органическую фазу промывают насыщенным раствором хлорида натрия, сушат, кон 003272 20 центрируют и очищают хроматографией на силикагеле, используя в качестве элюента смесь петролейный эфир: этилацетат 80:20, чтобы получить ожидаемое соединение. Стадия 5. 1-Ацетил-2,2-диметил-6-этокси 3-(этоксикарбонилметил)-1,2,3,4-тетрагидрохинолин-4-он. К раствору 5,9 ммоль (2,64 г) соединения,описанного в вышеприведенной стадии, в 90 мл дихлорметана, охлажденному до 0 С, добавляют 118,1 ммоль (9,1 мл) трифторуксусной кислоты. Реакционную смесь перемешивают при комнатной температуре в течение 15 ч. Реакционную среду впоследствии разбавляют этилацетатом и затем промывают насыщенным раствором NаНСО 3. Органическую фазу удаляют, и водную фазу приводят к рН = 1, используя концентрированный раствор хлористо-водородной кислоты, и затем экстрагируют этилацетатом. Органическую фазу сушат и концентрируют. Остаток переносят в 110 мл диоксана, и смесь нагревают с обратным холодильником в течение 9 ч. Растворитель выпаривают, и остаток очищают хроматографией на силикагеле, используя в качестве элюента смесь петролейный эфир: этилацетат 70:30, чтобы получить ожидаемое соединение. Стадия 6. 2,2-Диметил-6-этокси-4-гидрокси-3-(2-гидроксиэтил)-1,2,3,4-тетрагидрохинолин. К раствору 10,05 ммоль (0,96 г) соединения, описанного в вышеприведенной стадии, в 60 мл толуола добавляют 1,50 мл воды и 5,05 ммоль (0,96 г) п-толуолсульфокислоты. Все нагревают с обратным холодильником в течение 2 ч и затем растворители выпаривают. Остаток переносят в этилацетат и промывают насыщенным раствором NaHCO3. Органическую фазу осушают и концентрируют. Полученный продукт растворяют в 15 мл ТГФ и добавляют к 27,9 ммоль (1,06 г) литий алюминиевому гидриду, суспендированному в 100 мл ТГФ. После перемешивания в течение одного часа при комнатной температуре реакционную смесь охлаждают, используя ледяную баню, и добавляют 1 мл воды и 1 мл 15% раствора гидроксида натрия. Смесь затем фильтруют, и фильтрат концентрируют, чтобы получить ожидаемое соединение. Стадия 7. 2,2-Диметил-6-этокси-3-(2 гидроксиэтил)-1,2-дигидрохинолин. Раствор 1,73 ммоль (0,46 г) соединения,описанного в вышеприведенной стадии в 1 мл диметилсульфоксида, нагревают при 170 С в течение 1 ч 30 мин. Смесь охлаждают и разбавляют этилацетатом. После промывки водой органическую фазу осушают, концентрируют и очищают хроматографией на силикагеле, используя в качестве элюента смесь петролейный эфир:этилацетат 70:30, чтобы получить ожидаемое соединение. 21 Стадия 8. 3-(2-Бромэтил)-2,2-диметил-6 этокси-1,2-дигидрохинолин. К раствору 3,68 ммоль (0,91 г) соединения,описанного в вышеприведенной стадии, в 20 мл дихлорметана добавляют 5,73 ммоль (1,9 г) четырехбромистого углерода. Смесь охлаждают до 0 С и добавляют 5,71 ммоль (1,75 г) трифенилфосфина, растворенного в 15 мл дихлорметана. Реакционную смесь перемешивают при 0 С в течение 15 мин и при комнатной температуре в течение 2 ч. Растворитель выпаривают, и полученный остаток очищают хроматографией на силикагеле, используя в качестве элюента дихлорметан, чтобы получить ожидаемое соединение. Стадия 9. 2,2-Диметил-6-этокси-3-(2-морфолиноэтил)-1,2-дигидрохинолиндигидрохлорид. К раствору 0,69 ммоль (0,21 г) соединения,описанного в вышеприведенной стадии, в 1 мл ацетонитрила добавляют 2,15 ммоль (0,19 г) морфолина. Реакционную смесь перемешивают при комнатной температуре в течение 15 ч. Реакционную среду затем разбавляют этилацетатом и промывают водой. Органическую фазу осушают, концентрируют и очищают хроматографией на силикагеле, используя в качестве элюента смесь дихлорметан: этанол 95:5, чтобы получить ожидаемый продукт. Последний растворяют в этилацетате и медленно добавляют 3 М раствор хлористоводородной кислоты в этилацетате. После перемешивания в течение 15 мин растворитель выпаривают, и остаток переносят в изопропанол, промывают и фильтруют,чтобы получить ожидаемый дигидрохлорид. Элементный анализ (эмпирическая формула:N Сl Найдено, % 58,51 7,80 7,04 18,23 Вычислено, % 58,61 7,77 7,19 18,21 Пример 13. 6-трет-Бутокси-1,2-дигидрохинолин-2-спироциклогексангидрохлорид. Стадия 1. N-(4-трет-Бутоксифенил)-N-[1(1-этинил)циклогексил]амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1, используя в качестве исходного соединение, описанное при приготовлении препарата D. Стадия 2. 6-трет-Бутокси-1,2-дигидрохинолин-2-спироциклогексангидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, используя в качестве исходного соединение, описанное в вышеприведенной стадии. Соответствующий гидрохлорид получают осаждением из этилацетата после добавления НСl в этилацетате (3 М). Температура плавления: 132 С (AcOEt). Элементный анализ (эмпирическая формула: Пример 14. 6-Метокси-1,2-дигидрохинолин-2-спироциклогексангидрохлорид. Стадия 1. N(2-Метоксифенил)-N-[1-(1 этинил)циклогексил]амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1, с заменой п-фенетидина на п-анизидин. Стадия 2. 6-Метокси-1,2-дигидрохинолин 2-спироциклогексангидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, используя в качестве исходного соединение, описанное в вышеприведенной стадии. Соответствующий гидрохлорид получают осаждением из этилацетата после добавления HCl в этилацетате (3 М). Температура плавления: 191 С (AcOEt). Элементный анализ (эмпирическая формула:N Сl Найдено, % 67,31 7,59 5,11 13, 42 Вычислено, % 67,79 7,58 5,27 13,34 Пример 15. 6-Фенокси-1,2-дигидрохинолин-2-спироциклогексангидрохлорид. Стадия 1. N-(2-Феноксифенил)-N-[1-(1 этинил)циклогексил]амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1, с заменой п-фенетидина на 4-феноксианилин. Стадия 2. 6-Фенокси-1,2-дигидрохинолин 2-спироциклогексангидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, используя в качестве исходного соединение, описанное в вышеприведенной стадии. Соответствующий гидрохлорид получают осаждением из этилацетата после добавления НСl в этилацетате (3 М). Температура плавления: 176 С (AcOEt). Элементный анализ (эмпирическая формула: C20H21NOHCl). С НN Сl Найдено, % 73,36 6,84 4,43 10,75 Вычислено, % 73,27 6,76 4,27 10,81 Пример 16. 6-Этокси-5,7-диметил-1,2,3,4 тетрагидрохинолин-2-спироциклогексангидрохлорид. Ожидаемый продукт получают по процедуре, описанной в примере 6, стадия 3, используя в качестве исходного вещества соединение,описанное в примере 5. Элементный анализ (эмпирическая формула: C18H27NOHCl). С Н 23 Пример 17. 6-Этокси-2,2-диметил-3-[2(2,6-диоксопиперазин-4-ил)этил]-1,2-дигидрохинолингидрохлорид. Ожидаемый продукт получают по процедуре, описанной в примере 12, с заменой морфолина на 2,6-диоксопиперазин в стадии 9. Элементный анализ С НN Сl Найдено, % 54,81 6,54 10,09 17,03 Вычислено, % 55,26 6,49 10,07 16,46 Пример 18. 6-Этокси-2,2-диметил-3-[2-(1 пиперидинил)этил]-1,2-дигидрохинолингидрохлорид. Ожидаемый продукт получают по процедуре, описанной в примере 12, с заменой морфолина на пиперазин в стадии 9. Пример 19. 2-[2-(6-Этокси-2,2-диметил 1,2-дигидро-3-ил)этил]-1 Н-изоиндол-1,3(2 Н)дионгидрохлорид. Ожидаемый продукт получают по процедуре, описанной в примере 12, с заменой морфолина на фталимид в стадии 9. Пример 20. 3-[2-(6-Этокси-2,2-диметил 1,2-дигидро-3-хиноленил)этил]-4(3 Н)-хиназолинонгидрохлорид. Ожидаемый продукт получают по процедуре, описанной в примере 12, с заменой морфолина на 4(3 Н)-хиназолинон в стадии 9. Пример 21. 6-трет-Бутилкарбонилокси-1,2 дигидрохинолин-2-спироциклогексангидрохлорид. Стадия 1. N-(2-трет-Бутилкарбонилокси)N-[1-(1-этинил)циклогексил]амин. Ожидаемый продукт получают по процедуре, описанной в стадии 1 примера 1, начиная с соединения, описанного при приготовлении препарата Е. Стадия 2. 6-трет-Бутилкарбонилокси-1,2 дигидрохинолин-2-спироциклогексангидрохлорид. Ожидаемый продукт получают по процедуре, описанной в стадии 2 примера 1, начиная с соединения, описанного в вышеприведенной стадии. Соответствующий гидрохлорид получают осаждением из этилацетата после добавления НСl в эфире (1,3 М). Температура плавления: 180 С (с разложением; Et2O/AcOEt). Элементный анализN Сl Найдено, % 68,13 7,90 4,07 10,38 Вычислено, % 67,94 7,80 4,17 10,56 Фармакологическое исследование Пример А. Цитотоксический тест с использованием L-гомоцистеина на клетках гиппокампа мышей НТ 22. Клетки гиппокампа мышей НТ 22 в культуре (100 мкл/ячейка DMEM/F-12/25 % FCS) предварительно инкубируют в течение 1 ч в 24 присутствии 2 концентраций (0,1 и 0,5 мкМ) изучаемого соединения. Культуры клеток затем в течение 48 ч подвергают действию 2 мМ Lгомоцистеина в присутствии или в отсутствие изучаемого соединения. Цитотоксичность оценивают с помощью метода восстановления 3(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромидом (МТТ) (Mosmann Т., Immunol.Methods. 65: 55-63 (1983. Результаты выражены как % защиты по сравнению с цитотоксичностью измеренной в культурах клеток при отсутствии испытываемого соединения. Оказалось, что при 0,5 мкМ большинство соединений по настоящему изобретению имеют процент защиты, равный 100%. Пример В. Тест на летальность, используя трет-бутилгидропероксид на мышах NMRI. Интрацеребровентрикулярное (icv) введение трет-бутилгидропероксида (1 мкл 70% раствора) вызывает смерть у взрослого самца мыши NMRI (30-35 г). Летальность измеряют через 2 ч после введения трет-бутилгидропероксида и выражают как процент защиты по сравнению с летальностью в животных, которым был дан носитель изучаемых соединений. Последние вводят внутрибрюшинным путем в дозировке 150 мг/кг за 30 мин до введения третбутилгидропероксида. Оказалось, что для большинства соединений по настоящему изобретению измеренный процент защиты составляет от 70 до 100%. Пример С. Оценка влияния на температуру тела в NMRI мыши. Температуру тела у взрослых самцов мышей NMRI (25-30 г) измеряют, используя ректальный зонд (Physitemp, Bat-12) через 30, 60,90 и 120 мин после введения внутрибрюшинным путем изучаемых соединений в дозировке 150 мг/кг. Результаты выражают как среднюю максимальную разницу в температуре (С), определенную у подвергнутых лечению животных по сравнению с контрольными животными, которые получили только носитель (20 мл/кг). Результаты показывают, что при нейрозащитной дозировке соединения по настоящему изобретению не вызывают гипотермический эффект или вызывают только незначительный гипотермический эффект. Пример D. Антагонизм допаминергических стриатонигральных дисфункций, вызванный введением метаамфетамина в C57BL/6 мышах. Самцу мыши (C57BL/6, весом 20-25 г) делают четыре инъекции d-метамфетамина (5 мг/кг основы, внутрибрюшинные) через интервал 2 часа (Sonsalla and Heikkila, Prog. NeuroPsychopharmacolo.Biol. Psychiat., 12, 345-354,1988) и испытываемый антиоксидант вводят(внутрибрюшинно) за 30 мин перед первой и третьей инъекциями d-метамфетамина (Yamamoto and Zhu, J. Pharmacol. Exp. Ther. 287, 107114, 1988). В ходе эксперимента контролируют 25 ректальную температуру. Животных умерщвляют обезглавливанием через 72 ч после последней инъекции d-метамфетамина. Быстро извлекают мозг и удаляют неостриатум, замораживают в жидком азоте и взвешивают. Неостриатум гомогенизируют посредством ультразвука в 20 объемах 0,1 н. НСlO4, и гомогенный раствор центрифугируют при 15000 g в течение 20 мин при 4 С. Супернатанты собирают для проведения анализа уровней допамина в тканях неостриата посредством ВЭЖХ с кулонометрическим определением (Bonhomme et al., BrainRes., 675, 215-233, 1995). Результаты выражают как мкг допамина/г ткани. Оказалось, что соединения по настоящему изобретению противодействуют допаминергическому дефициту, вызванному введением метамфетамина. Это, в частности, справедливо для соединения примера 1, введенного при дозировке 2 х 150 мг/кг внутрибрюшинно. Пример Е. Нейрозащита в случае временной и общей церебральной ишемии у крысWistar. Эта животная модель (Pulsinelli and Brierley, Stroke 10, 267-272, 1979) обычно используется для определения центральных антиишемических агентов (Buchan et al., Neurosci. Lett.,132(2), 255-258, 1991). Под пентобарбитальной анестезией позвоночные артерии самца крыс Wistar (280-320 г,Charles River) постоянно закрывают посредством электрокоагуляции, и лигатуру сонной артерии помещают вокруг каждой общей сонной артерии. Через 24 ч вызывают ишемию в течение 10 мин посредством зажима лигатур сонной артерии. Этот ишемический приступ вызывает замедленную смерть нейронов на уровне пирамидальных клеток гиппокампа. Гибель нейронов измеряют подсчетом нейронов на срезах головного мозга (7 мкм, окрашивание: гематоксилин-эозин) крыс, умерщвленных через 7 дней после приступа ишемии. Результаты выражают как процент жизнеспособных нейронов гиппокампа по сравнению с общей численностью нейронов гиппокампа. Оказалось, что соединения по настоящему изобретению значительно уменьшают гибель нейронов гиппокампа, которая следует за ишемией. Это, в частности, справедливо для соединения примера 1, которое при введении за 30 мин до начала ишемии, приводит к уменьшению гибели нейронов в 2,7 раза. Пример F. Замедленная нейродегенерация гиппокампа, вызванная введением каиновой кислота, у крыс Wistar. Этот метод часто используют в качестве модели временной эпилепсии у человека (BenAri, Neurosci., 14, 375-403, 1985). Самцам крыс Wistar (180-220 г, CERJ) подкожно вводят каиновую кислоту (12 мг/кг). Животных умерщвляют посредством обезглавливания 7 днями позднее. Головной мозг удаляют и затем разрезают, в замороженном со 003272 26 стоянии, на фронтальные 7 мкм срезы, которые окрашивают (гематоксилин-эозин). Гибель нейронов гиппокампа оценивают посредством подсчета нейронов на уровне слоя СА 3 гиппокампа. Результаты выражают как процент жизнеспособных нейронов в слое САз по сравнению с общей численностью нейронов. Оказалось, что соединения по настоящему изобретению значительно уменьшают гибель нейронов в слое СА 3 гиппокампа. В частности,соединение примера 1 при внутрибрюшинном введении в дозировке 150 мг/кг за 30 мин перед введением каиновой кислоты вызывает уменьшение гибели нейронов в 3 раза. Пример G. Фармацевтический состав. Рецептура приготовления 1000 таблеток,каждая из которых включает в себя 10 мг активного ингредиента Соединение примера 1 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I) где R1 представляет собой атом водорода или группу где А представляет собой атом водорода или группу -BNZ1Z2, в которой В представляет собой линейную или разветвленную (С 1-С 6) алкиленовую группу и Z1 и Z2 независимо представляют собой атом водорода или алкильную, (С 3 С 8)циклоалкильную или необязательно замещенную арильную группу или вместе с соединяющим их атомом азота образуют необязательно замещенную гетероциклоалкильную или гетероарильную группу;R2 и R3, каждый независимо, представляет собой алкильную группу, (С 3-С 8)циклоалкильную группу, гетероциклоалкильную группу,необязательно замещенную арильную группу,необязательно замещенную гетероарильную группу, циклоалкилалкильную группу, гетероциклоалкилалкильную группу, необязательно замещенную арилалкильную группу, необязательно замещенную гетероарилалкильную группу или аминоалкильную группу (необязательно замещенную на атоме азота одной или двумя группами, выбранными из алкила, циклоалкила, арила и арилалкила) илиR2 и R3 вместе с соединяющим их атомом углерода образуют (С 3-С 8)циклоалкильную группу или моноциклическую гетероциклоалкильную группу, незамещенную или замещенную алкильной, циклоалкильной, циклоалкилалкильной, арильной или арилалкильной группой;R40 представляет собой атом водорода или группу, выбранную из необязательно замещенного алкила, необязательно замещенного алкенила и необязательно замещенного алкинила,или группу Q или -V-Q-, где V представляет собой группу алкилена, алкенилена или алкинилена, и Q представляет собой необязательно замещенную (С 3-С 8)циклоалкильную группу,необязательно замещенную арильную группу,необязательно замещенную гетероциклоалкильную группу или необязательно замещенную гетероарильную группу;R41 и R5 образуют вместе связь или каждый представляет собой атом водорода;R6, R7, R8 и R9, каждый независимо, представляет собой атом водорода, атом галогена,алкильную группу, (С 3-С 8)циклоалкильную группу или группу -OW, где W представляет собой атом водорода или алкильную группу,ацильную группу,(С 3-С 8)циклоалкильную группу, гетероциклоалкильную группу, необязательно замещенную арильную группу, необязательно замещенную гетероарильную группу,необязательно замещенную арилалкильную группу или необязательно замещенную гетероарилалкильную группу (при условии, что R6, R7,R8 и R9 не могут все одновременно представлять собой атом водорода, и что, по крайней мере,один из них представляет собой группу -OW,как определено выше),с условием, что когда R2 и R3 представляют собой алкильную группу,если каждый заместитель от R6 до R9 независимо представляет собой атом водорода, алкильную группу или группу -OW, где W представляет собой алкильную группу, и R41 и R5 вместе образуют связь, тогда R40 является отличным от атома водорода или алкильной группы,если в молекуле присутствует одна группа-OW и она представляет собой гидроксигруппу,тогда R40 является отличным от атома водорода,если в молекуле присутствует одна группа-OW и она представляет собой метоксигруппу,тогда R40 является отличным от гидроксиалкильной группы,соединение формулы (I) является отличным от 7-метокси-2,2-дифенил-1,2-дигидрохинолина, причем подразумевается, что термин "алкил" означает линейную или разветвленную цепь от 1 до 6 атомов углерода,термин "ацил" означает алкилкарбонильную группу, причем алкил является таким, как определено выше, 003272 28 термин "алкенил" означает линейную или разветвленную цепь от 2 до 6 атомов углерода,содержащую от 1 до 3 двойных связей,термин "алкинил" означает линейную или разветвленную цепь от 2 до 6 атомов углерода,содержащую от 1 до 3 тройных связей,термин "алкилен" означает линейную или разветвленную двухвалентную группу, содержащую от 1 до 6 атомов углерода,термин "алкенилен" означает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 двойных связей,термин "алкинилен" означает линейную или разветвленную двухвалентную группу, содержащую от 2 до 6 атомов углерода и от 1 до 3 тройных связей,термин "арил" означает фенильную, нафтильную или бифенильную группу,термин "гетероциклоалкил" означает моноили бициклическую, от 4- до 11-членную группу, содержащую от 1 до 6 гетероатомов, выбранных из азота, кислорода и серы, причем эта группа может содержать одну или более ненасыщенных связей, не являясь при этом ароматической,термин "гетероарил" означает ароматическую или частично ароматическую, моно- или бициклическую, 4-11-членную группу, содержащую от 1 до 6 гетероатомов, выбранных из азота, кислорода и серы,термин "замещенный", используемый в отношении арила или арилалкила, показывает,что имеющие отношение группы замещены одним или более атомами галогена или алкильной,линейной или разветвленной (С 1-С 6)алкокси,линейной или разветвленной (С 1-С 6)пергалогеналкильной, амино (необязательно замещенной 1 или 2 алкильными группами), пиано, карбокси, линейной или разветвленной (С 1-С 6) алкоксикарбонильной, аминокарбонильной (необязательно замещенной на атоме азота 1 или 2 алкильными группами), нитро или гидроксигруппами,термин "замещенный", используемый в отношении выражений алкила, алкенила, алкинила и циклоалкила, показывает, что такие группы являются замещенными одной или более группами, выбранными из гидрокси, линейной или разветвленной (С 1-С 6)алкокси, линейной или разветвленной (С 1-С 6)алкилтио, амино(необязательно замещенной одной или двумя алкильными группами), карбокси, нитро, циано,линейным или разветвленным (С 1-С 6)алкоксикарбонилом и аминокарбонилом (необязательно замещенным на атоме азота одной или двумя алкильными группами),термин "замещенный", используемый в отношении гетероциклоалкила, гетероарила и гетероарилалкила, показывает, что имеющие отношение группы являются замещенными одним или более атомами галогена или алкильной, 29 линейной или разветвленной (С 1-С 6)алкокси,линейной или разветвленной (С 1-С 6)пергалогеналкильной, амино (необязательно замещенной 1 или 2 алкильными группами), циано, карбокси, линейной или разветвленной (С 1-С 6) алкоксикарбонильной, аминокарбонильной (необязательно замещенной на атоме азота 1 или 2 алкильными группами), нитро, гидрокси или оксогруппами,их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 2. Соединения формулы (I) по п.1, где R1 представляет собой атом водорода, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 3. Соединения формулы (I) по п.1, где R6,R7, R8 и R9, каждый независимо, представляет собой атом водорода, алкильную группу или группу -OW, где W представляет собой алкильную, ацильную или фенильную группу, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 4. Соединения формулы (I) по п.1, где R2 иR3 каждый представляет алкильную группу, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 5. Соединения формулы (I) по п.1, где R2 иR3 вместе образуют необязательно замещенную циклоалкильную или гетероциклоалкильную группу, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 6. Соединения формулы (I) по п.1, где R40 представляет атом водорода или группу V-Q,причем V является алкиленовой группой и Q является гетероциклоалкильной группой, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 7. Соединения формулы (I) по п.1, где R1 представляет собой атом водорода, R2 и R3 представляют алкильную группу или вместе образуют циклоалкильную группу, R40 представляет атом водорода или группу V-Q, где V представляет алкиленовую группу и Q представляет гетероциклоалкильную группу, и R6,R7, R8 и R9, каждый независимо, представляет атом водорода, алкильную группу или группу OW, где W представляет алкильную, ацильную или фенильную группу, причем подразумевается, что R6, R7, R8 и R9 не могут все представлять собой атом водорода и что, по крайней мере,один из них представляет собой -OW, как определено выше, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 8. Соединения формулы (I) по п.7, где R2 иR3 вместе образуют циклоалкильную группу, их 30 энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 9. Соединения формулы (I) по п.7, где R2 иR3 представляют собой алкильную группу, их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 10. Соединение формулы (I) по п.1, которое представляет собой 6-этокси-2,2,5,7,8-пентаметил 1,2,3,4-тетрагидрохинолин и его соли присоединения фармацевтически приемлемой кислоты. 11. Соединение формулы (I) по п.1, которое представляет собой 6-этокси-1,2 дигидрохинолин-2-спироциклогексан и его соли присоединения фармацевтически приемлемой кислоты. 12. Способ получения соединений формулы (I), отличающийся тем, что замещенный анилин формулы (II) где R6, R7, R8 и R9 являются такими, как определено для формулы (I), в качестве исходного продукта подвергают либо действию в щелочной среде и необязательно в присутствии катализатора, галогенированного ацетилида формулы (III) где R2 и R3 являются такими, как определено для формулы (I), G представляет собой атом водорода или триалкилсилильную группу и Hal представляет собой атом галогена,с получением соединения формулы (IV) где R2, R3, R6, R7, R8, R9 и G являются такими,как определено выше,или действию карбонильного соединения формулы (V) где R2 и R3 являются такими, как определено для формулы (I),с получением соединения формулы (VI) где R2, R3, R6, R7, R8 и R9 являются такими, как определено выше,соединение формулы (VI) подвергают в щелочной среде действию ацетилида формулы с получением соединения формулы (IV),как определено выше, которое (соединение формулы (IV, где это применимо после расщепления триалкилсилильной группы, подвергают реакции замыкания цикла посредством нагрева в присутствии соответствующего катализатора,с получением соединения формулы (I/a) частный случай соединений формулы (I), где R2,R3, R6, R7, R8 и R9 являются такими, как определено выше,которое после защиты атома азота кольца может быть последовательно подвергнуто реакции гидроксигалогенирования и реакции окисления в бензильном положении, с получением соединения формулы (VIII) где R2, R3, R6, R7, R8 и R9 являются такими, как определено выше, Hal представляет собой атом галогена и Р является защитной группой для атома азота кольца (например, ацетильной,трифторацетильной, трет-бутоксикарбонильной или бензилоксикарбонильной группой),которое подвергают реакции нуклеофильного замещения с получением соединения формулы (IX) где R2, R3, R6, R7, R8, R9 и Р являются такими,как определено выше, и Y представляет собой либо группу R40, которая является такой, как определено для формулы (I), но отлична от атома водорода, либо предшественник такой группы,которое после снятия защиты с атома азота кольца подвергают реакции восстановления карбонильной функции с последующим элиминированием с получением соединения формулы (X)R40, как определено выше, быть подвергнуто последовательным обычным реакциям, направленным на получение соединения формулы (I/d) 32 частный случай соединений формулы (I), где R2,R3, R6, R7, R8, R9 и R40 являются такими, как определено выше,которое может быть восстановлено с получением соединения формулы (I/е) частный случай соединений формулы (I), где R2,R3, R6, R7, R8, R9 и R40 являются такими, как определено выше,которые (соединения (I/d) и (I/е после хлорформилирования атома азота кольца подвергают действию амина формулы (VII), как определено выше, с получением соединения формулы (I/f) где R2, R3, R6, R7, R8, R9 и А являются такими,как определено выше, R40 имеет такие же значения, как в формуле (I), отличные от атома водорода, и R41 и R5 являются такими, как определено для формулы (I), причем соединения от (I/a),(I/d) до (I/f) составляют все количество соединений формулы (I),которые могут быть, при необходимости,очищены в соответствии с обычными методами очистки,стереоизомеры которых, где необходимо,разделяют в соответствии с обычными методами разделения,которые превращают, если это желательно,в их соли присоединения с фармацевтически приемлемыми кислотами и основаниями. 13. Фармацевтические составы, включающие в себя в качестве активного ингредиента,по крайней мере, одно соединение по любому из пп.1-11, одно или в комбинации с одним или более фармацевтически приемлемыми инертными, нетоксичными наполнителями или носителями. 14. Фармацевтические составы по п.13,включающие в качестве активного ингредиента,по крайней мере, одно соединение по любому из пп.1-11, для использования в качестве антиокислительных реагентов при лечении болезней, связанных со старением, таких как атеросклероз и катаракта, при лечении слабоумия,при лечении острых нейродегенеративных болезней, таких как церебральная ишемия и эпилепсия, и при лечении хронических нейродегенеративных болезней, таких как болезнь Альцгеймера, болезнь Пика и нейродегенераций базального ганглия (болезнь Паркинсона, болезнь Хангтингтона).
МПК / Метки
МПК: A61K 31/4709, C07D 215/06, A61P 25/28
Метки: способ, дигидро, производные, фармацевтические, тетрагидрохинолина, получения, содержащие, составы
Код ссылки
<a href="https://eas.patents.su/17-3272-proizvodnye-digidro-i-tetragidrohinolina-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-sostavy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные дигидро- и тетрагидрохинолина, способ их получения и содержащие их фармацевтические составы</a>
Предыдущий патент: Способ производства алкогольного напитка и алкогольный напиток, полученный этим способом
Следующий патент: Производные бисоксимового эфира, способ и промежуточные продукты для их получения и их применение для борьбы с фитопатогенными грибами и вредителями
Случайный патент: Передача





















