Ингибиторы гистоновых дезацетилаз с сочетанной активностью в отношении гистоновых дезацетилаз класса i и класса ii в комбинации с ингибиторами протеасом
Номер патента: 20276
Опубликовано: 30.10.2014
Авторы: Жанико Мишель Мари Франсуа, Хеллеманс Петер Виллем Ян, Артс Янине, Пэйдж Мартин Джон
Формула / Реферат
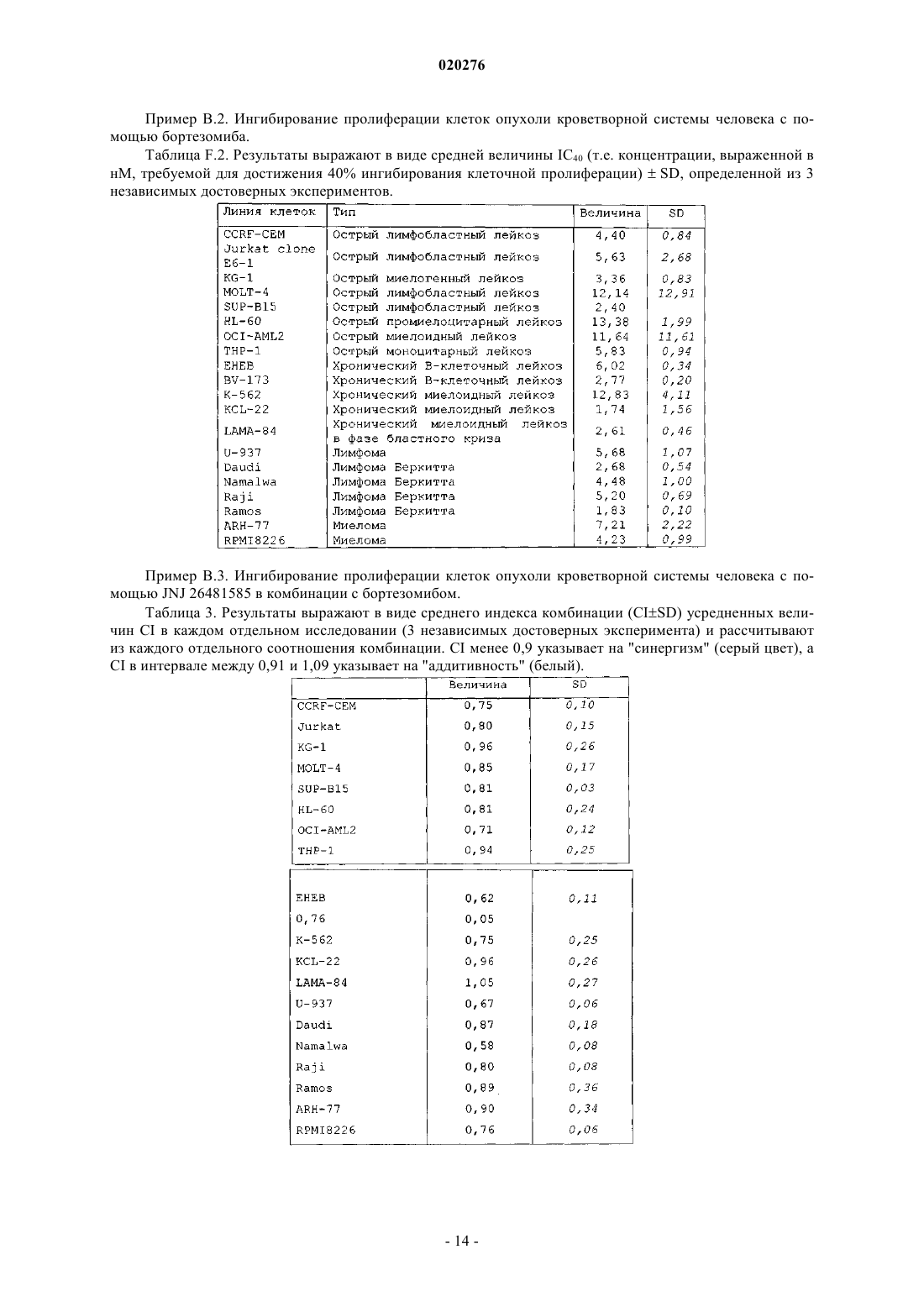
1. Комбинация ингибитора протеасомы, где указанный ингибитор протеасомы представляет собой бортезомиб, и ингибитора гистоновой дезацетилазы, где указанный ингибитор гистоновой дезацетилазы представляет собой соединение № 1a (JNJ 26481585)
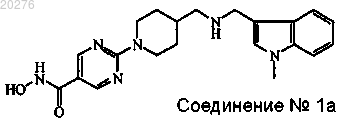
его фармацевтически приемлемые кислотно- или основно-аддитивные соли и стереохимически изомерные формы.
2. Комбинация по п.1 для одновременного, раздельного или последовательного применения.
3. Комбинация по п.1 в форме фармацевтической композиции, содержащей бортезомиб и соединение № 1а вместе с одним или несколькими фармацевтическими носителями.
4. Комбинация по любому из пп.1-3 для применения в медикаментозном лечении.
5. Применение комбинации по любому из пп.1 или 2 для производства лекарственного средства для ингибирования роста опухолевых клеток.
6. Применение ингибитора гистоновой дезацетилазы в комбинации с ингибитором протеасомы для производства лекарственного средства для лечения острого лимфобластного лейкоза, острого миелогенного лейкоза, острого промиелоцитарного лейкоза, острого миелоидного лейкоза, острого моноцитарного лейкоза, лимфомы, хронического В-клеточного лейкоза, хронического миелоидного лейкоза, хронического миелоидного лейкоза в фазе бластного криза, лимфомы Беркитта и множественной миеломы, где указанный ингибитор гистоновой дезацетилазы представляет собой соединение № 1а
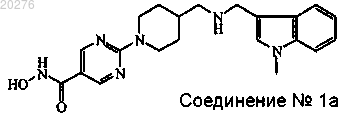
его фармацевтически приемлемые кислотно- или основно-аддитивные соли и стереохимически изомерные формы, где указанный ингибитор протеасомы представляет собой бортезомиб.
7. Применение по п.6, где указанное лекарственное средство используют для лечения лекарственно-резистентного острого лимфобластного лейкоза, лекарственно-резистентного острого миелогенного лейкоза, лекарственно-резистентного острого промиелоцитарного лейкоза, лекарственно-резистентного острого миелоидного лейкоза, лекарственно-резистентного острого моноцитарного лейкоза, лекарственно-резистентной лимфомы, лекарственно-резистентного хронического В-клеточного лейкоза, лекарственно-резистентного хронического миелоидного лейкоза, лекарственно-резистентного хронического миелоидного лейкоза в фазе бластного криза, лекарственно-резистентной лимфомы Беркитта и лекарственно-резистентной множественной миеломы.
8. Применение по п.6 или 7, где указанное лекарственное средство используют для лечения множественной миеломы, устойчивой к бортезомибу.
Текст
ИНГИБИТОРЫ ГИСТОНОВЫХ ДЕЗАЦЕТИЛАЗ С СОЧЕТАННОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ГИСТОНОВЫХ ДЕЗАЦЕТИЛАЗ КЛАССА I И КЛАССА II В КОМБИНАЦИИ С ИНГИБИТОРАМИ ПРОТЕАСОМ Артс Янине, Хеллеманс Петер Виллем Ян, Жанико Мишель Мари Франсуа,Пэйдж Мартин Джон (BE) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Изобретение относится к комбинации ингибитора протеасомы, где указанный ингибитор протеасомы представляет собой бортезомиб, и ингибитора гистоновой дезацетилазы, где указанный ингибитор гистоновой дезацетилазы представляет собой соединение 1a (JNJ 26481585), его фармацевтически приемлемые кислотно- или основно-аддитивные соли и стереохимически изомерные формы. Данная комбинация обладает сочетанной активностью в отношении гистоновых дезацетилаз класса I и класса IIB для ингибирования роста опухолевых клеток и используется при лечении рака. Изобретение относится к ингибиторам гистоновых дезацетилаз (HDAC) с сочетанной активностью в отношении гистоновых дезацетилаз класса I и класса II. Оно относится к комбинациям и композициям,содержащим их, а также к их применению в качестве лекарственного средства, например в качестве лекарственного средства для ингибирования гематопоэтических опухолей, таких как лимфомы и лейкозы. Семейство ферментов HDAC было названо после идентификации их первого субстрата, т.е. ядерных белков-гистонов. Белки-гистоны (Н 2 А, Н 2 В, Н 3 и Н 4) образуют октамерный комплекс, вокруг которого сворачивается спираль ДНК, чтобы создать структуру конденсированного хроматина. Ацетилированное состояние гистонов находится в динамическом равновесии, обусловленном гистоновыми ацетилтрансферазами (HAT), которые ацетилируют, и HDAC, которые отвечают за дезацетилирование гистоновых хвостов. Ингибирование фермента HDAC усиливает ацетилирование гистоновых хвостов нуклеосомы, благоприятствуя созданию более транскрипционно компетентной структуры хроматина, которая, в свою очередь, приводит к измененной экспрессии генов, вовлеченных в клеточные процессы, такие как клеточная пролиферация, апоптоз и дифференцировка. За последние годы было идентифицировано все возрастающее число дополнительных, отличных от гистоновых, субстратов для HDAC. При специфических формах лейкоза и лимфомы, таких как острый промиелоцитарный лейкоз(APL), неходжкинская лимфома и острый миелоидный лейкоз (AML), обнаруживают постоянное рекрутирование HDAC с нарушенной регуляцией в хроматине в сочетании с онкогенными факторами транскрипции. В клетках рака простаты было обнаружено повышение HDAC1 на уровне белков по мере прогрессирования заболевания, начиная от злокачественных патологических изменений и высоко дифференцированной андрогензависимой аденокарциномы простаты в направлении к фенотипически дифференцированному андроген-нечувствительному раку простаты. Кроме того, в большинстве эксплантатов колоректального рака человека, который вызывается потерей опухолевого супрессора аденоматозного полипоза толстого кишечника (АРС), обнаруживают повышенную экспрессию HDAC2. В соответствии с равновесием активностей HDAC/HAT при раке было показано, что ингибиторыHDAC индуцируют остановку клеточного цикла, терминальную дифференцировку и/или апоптоз в широком спектре линий клеток опухолей человека in vitro, ингибируют ангиогенез и проявляют in vivo противоопухолевую активность на моделях ксенотрансплантатов человека у "голых мышей". Семейство ферментов HDAC обычно подразделяют на 3 класса: т.е. классы I, II и III. В основном предполагали, что только классы I и II опосредуют эффекты ингибиторов HDAC, находящихся в клинической разработке. Было показано, что группа HDAC класса I, которая состоит из членов семейства HDAC 1-3 и 8, является ответственной за пролиферацию опухолевых клеток. Среди большого числа факторов транскрипции, которые для подавления специфических промоторов используют HDAC класса I, наиболее известным примером является класс ядерных рецепторов гормонов, которые в отсутствие своего лиганда связываются лишь с HDAC3 и, таким образом, поддерживают состояние сайленсинга транскрипции. Комплекс диссоциирует лигандзависимым способом, например, посредством ретиноидов, эстрогенов, андрогенов и так далее, приводя к экспрессии гена и дифференцировке. Другим важным примером является HDAC1-зависимый сайленсинг ингибитора циклинзависимой киназы p21waf1,cip1. Важная роль индукции p21waf1,cip1 в антипролиферативных эффектах ингибиторов HDAC была продемонстрирована путем исследования, показывающего 6-кратное повышение устойчивости к ингибитору HDAC трихостатину A (TSA) в клетках, дефицитных по p21waf1,cip1, по сравнению с исходными клетками НСТ-116. Кроме того, в отличие от истинных генов опухолевой супрессии,p21waf1,cip1 повсеместно присутствует в опухолевых клетках и индуцируется ингибиторами HDAC. Субстратами HDAC класса I являются не только гистоны. Например, HDAC 1-3 дезацетилирует опухолевый супрессор р 53, который в результате становится убиквитинированным и деградируемым. Поскольку р 53 представляет собой потенциальный опухолевый супрессор, включающий остановку клеточного цикла и апоптоз, поддержание низких уровней этого белка важно для жизнеспособности и неконтролируемой пролиферации опухолевых клеток.HDAC класса II могут быть разделены на 2 подкласса: класс IIа, содержащий HDAC 4, 5, 7, 9 иMITR, сплайсированный вариант гистоновой дезацетилазы HDAC 9. Класс IIb содержит HDAC6 иHDAC10, которые имеют повторяющиеся домены HDAC. HDAC класса IIа не обладают истинной активностью гистоновых дезацетилаз, но регулируют экспрессию генов, функционируя в качестве связующих факторов, поскольку они ассоциируют как с комплексами HDAC класса I, так и с комплексами фактор транскрипции/ДНК. Внимание привлек HDAC6, член класса IIb, вследствие его идентификации в качестве дезацетилазыHsp90, в то время как трапоксин и бутират натрия не индуцируют. Дезацетилирование Hsp90 приводит к деградации Hsp90-ассоциированных белков-"клиентов", способствующих выживаемости и пролиферации. Основные примеры включают Her-2, Bcr-Abl, глюкокортикоидный рецептор, мутантный FLT-3, cRaf и Akt. Помимо Hsp90, HDAC6 также опосредует дезацетилирование тубулина, которое приводит к дестабилизации микротрубочек в условиях стресса. Биологическая роль HDAC6 была дополнительно подтверждена тем фактом, что специфический низкомолекулярный ингибитор HDAC6, тубацин, вызывает гиперацетилирование -тубулина и снижает подвижность клеток, не влияя на прохождение клеточного цикла. Тубацин, который ингибирует только домен дезацетилазы -тубулина гистоновой дезацетилазы HDAC6, вызывает лишь незначительное повышение ацетилирования HSP90. Соответственно, было обнаружено, что HDAC6 важен для эстрадиол-стимулированной клеточной миграции клеток карциномы молочной железы MCF-7. В заключение HDAC6 играет важную роль в контролировании клеткой неправильно свернутых белков и удалении их из цитоплазмы. Вследствие большого числа белков-регуляторов клеточного цикла, регулируемых с помощьюHDAC в отношении уровня либо их экспрессии, либо активности, антипролиферативный эффект ингибиторов HDAC не может быть связан с единичным механизмом действия. Ингибирование HDAC имеет определенную перспективу в противораковой терапии, где совместное влияние на большое число путей,вовлеченных в ингибирование роста, дифференцировку и апоптоз, может иметь преимущества при лечении гетерогенной патологии, такой как онкогенез и опухолевый рост. В последние годы стало понятно, что HDAC играют важную роль не только в канцерогенезе, но и в большом числе незлокачественных процессов дифференцировки. Это наиболее очевидно для класса IIa 4, 5, 7 и 9. Например, было высказано предположение, что HDAC7 играет основную роль в созревании Тклеток в тимусе, тогда как HDAC4 вовлечен в регуляцию гипертрофии хондроцитов и эндохондрального окостенения. Наибольшее внимание, тем не менее, было сосредоточено вокруг роли HDAC класса IIa в дифференцировке мышечной ткани. HDAC 4, 5, 7 и 9 супрессируют дифференцировку миоцитов (мышечных клеток) в результате наличия корепрессоров транскрипции миоцит-специфичного энхансера 2(MEF2). Наиболее частой токсичностью, наблюдаемой при использовании ингибиторов HDAC, является миелосупрессия от легкой до умеренной степени. Кроме того, во многих клинических испытаниях в качестве негативных эффектов наблюдаются тошнота/рвота, утомляемость и диарея. В патенте ЕР 1485365, опубликованном 18 сентября 2003, описывается, среди прочих, ингибитор В публикации WO 2006/010750 от 2 февраля 2006 описывается получение, состав и фармацевтические свойства соединений следующей формулы Маркуша их N-оксидных форм, фармацевтически приемлемых аддитивных солей и стереохимически изомерных форм, где n, m, R1, R2, R3, X и Y имеют значения, определенные в указанном описании. Возможность лечения ингибитором HDAC, однако, выходит за пределы использования отдельного агента. Молекулярные пути, на которые влияют ингибиторы HDAC, делают его перспективным кандидатом для комбинаторных исследований. Существует потребность в ингибиторах с комбинированными действиями в отношении HDAC класса I и класса IIb, которые могут обеспечить клинические преимущества, учитывая эффективность и/или токсичность, либо самостоятельно, либо в сочетаниях с другими терапевтическими агентами. Кроме того, важной, недавно разработанной стратегией при лечении рака является ингибирование протеасомы. Протеасома представляет собой мультиферментный комплекс, присутствующий во всех клетках, который участвует в деградации белков, вовлеченных в регуляцию клеточного цикла. Большое число важных регуляторных белков, включая р 53, циклины и циклинзависимую киназу p21waf1,cip1, со временем деградируют в ходе клеточного цикла посредством убиквитин-протеасомного пути. Упорядоченная деградация этих белков требуется клетке для прохождения клеточного цикла и для осуществления митоза. Более того, убиквитин-протеасомный путь необходим для регуляции транскрипции. В патентах ЕР 788360, ЕР 1312609, ЕР 1627880, US 6066730 и US 6083903 описываются сложноэфирные и кислотные соединения бороновой кислоты и пептида, используемые в качестве ингибиторов протеасом. Одно из соединений, N-пиразинкарбонил-L-фенилаланин-L-лейцинбороновая кислота (PS-341, в настоящее время известная как бортезомиб или Velcade (продукция фирмы Millenium, обладает противоопухолевой активностью на моделях ксенотрансплантатов опухолей человека, получило разрешение на лечение пациентов с рецидивирующей рефрактерной множественной миеломой, и в настоящее время проходит клинические испытания в дополнительных показаниях, включающих другой рак крови, а также солидные опухоли. Бортезомиб индуцирует смерть клетки, вызывая накопление неправильно скрученных и иначе поврежденных белков, таким образом активируя митохондриальный путь апоптоза, например, через Вах-зависимые или зависимые от активных форм кислорода механизмы. Бортезомиб вызывает секвестрацию конъюгированных с убиквитином белков в структурах, назы-2 020276 ваемых агресомами. Агресомы представляются участвующими в цитопротекторном ответе, который активируется в ответ на ингибирование протеасомы, возможно, с помощью переноса убиквитилированных белков к лизосомам для деградации. Бортезомиб-индуцированное образование агресомы может быть прервано использованием ингибитора HDAC SAHA (субероиланилидгидроксамовой кислоты). SAHA также демонстрирует синергетические эффекты в отношении апоптоза in vitro и на модели ортотопического ксенотрансплантата рака поджелудочной железы in vivo (Cancer Research 2006; 66: (7) 3773-3781). Другой ингибитор HDAC LAQ824 при введении вместе с бортезомибом также демонстрирует синергетические уровни клеточной гибели (Journal of Biological Chemistry 2005; 280: (29) 26729-26734). Синергетический эффект SAHA и LAQ824 при введении вместе с бортезомибом был связан с их активностью ингибирования HDAC6. Существует дополнительная необходимость в повышении эффективности ингибирования ингибиторов протеасомы в отношении опухолевого роста, а также в снижении доз таких агентов для уменьшения вероятности негативных токсических побочных эффектов для пациента. В настоящее время нет прямых данных по взаимосвязи между степенью ацетилирования и ответом опухоли. Быстрые, простые и несложные в исполнении воспроизводимые способы расчета степени ацетилирования гистоновых и отличных от гистоновых субстратов, обусловленной описанными ниже ингибиторами HDAC или комбинациями, содержащими указанные ингибиторы HDAC, будут решающими для перспективы их использования. Сущность изобретения Задачей изобретения является предоставление ингибиторов HDAC и терапевтических комбинаций ингибитора протеасомы и ингибиторов HDAC типа, описанного ниже, которые могут обладать устойчивыми и типичными эффектами ацетилирования, ингибирования HDAC как класса I, так и класса IIb, преимущественным эффектом ингибирования роста опухолевых клеток и уменьшенными нежелательными побочными эффектами. Поэтому согласно изобретению авторы предлагают комбинацию ингибитора протеасомы, где указанный ингибитор протеасомы представляет собой бортезомиб, и ингибитора гистоновой дезацетилазы,где указанный ингибитор гистоновой дезацетилазы представляет собой соединение 1a (JNJ 26481585) его фармацевтически приемлемые кислотно- или основно-аддитивные соли и стереохимически изомерные формы. Данная комбинация может применяться одновременно, раздельно или последовательно. В предпочтительном варианте комбинация находится в форме фармацевтической композиции, содержащей бортезомиб и соединение 1 а вместе с одним или несколькими фармацевтическими носителями. Указанная комбинация предназначена для применения в медикаментозном лечении. Изобретение также включает применение данной комбинации для производства лекарственного средства для ингибирования роста опухолевых клеток. Далее, изобретение относится к применению ингибитора гистоновой дезацетилазы в комбинации с ингибитором протеасомы для производства лекарственного средства для лечения острого лимфобластного лейкоза, острого миелогенного лейкоза, острого промиелоцитарного лейкоза, острого миелоидного лейкоза, острого моноцитарного лейкоза, лимфомы, хронического В-клеточного лейкоза, хронического миелоидного лейкоза, хронического миелоидного лейкоза в фазе бластного криза, лимфомы Беркитта и множественной миеломы, где указанный ингибитор гистоновой дезацетилазы представляет собой соединение 1 а его фармацевтически приемлемые кислотно- или основно-аддитивные соли и стереохимически изомерные формы, где указанный ингибитор протеасомы представляет собой бортезомиб. Указанное лекарственное средство используют для лечения лекарственно-резистентного острого лимфобластного лейкоза, лекарственно-резистентного острого миелогенного лейкоза, лекарственнорезистентного острого промиелоцитарного лейкоза, лекарственно-резистентного острого миелоидного лейкоза, лекарственно-резистентного острого моноцитарного лейкоза, лекарственно-резистентной лимфомы, лекарственно-резистентного хронического В-клеточного лейкоза, лекарственно-резистентного хронического миелоидного лейкоза, лекарственно-резистентного хронического миелоидного лейкоза в фазе бластного криза, лекарственно-резистентной лимфомы Беркитта и лекарственно-резистентной множественной миеломы. В частности, указанное лекарственное средство используют для лечения множественной миеломы,-3 020276 устойчивой к бортезомибу. Подробное описание изобретения В изобретении раскрыта комбинация ингибитора протеасомы и ингибитора HDAC формулы (I) его фармацевтически приемлемой кислотно- или основно-аддитивной соли и стехиометрически изомерных форм, где R4 выбран из водорода или галогена. Интересующими соединениями являются такие соединения формулы (I), в которых R4 представляет собой фтор. Более интересующие соединения представляют собой такие соединения формулы (I), в которых R4 находится в положении 4 или 7 индола. Предпочтительными соединениями формулы (I) являются соединение 1 а, соединение 30 и соединение 39 в соответствии с нумерацией, указанной в публикации WO 2006/010750. Другими предпочтительными соединениями формулы (I) являются соединения, в которых R4 представляет собой водород. Самым предпочтительным соединением является соединение 1 а или его фармацевтически приемлемая аддитивная соль. Линии, проведенные в бициклические кольцевые системы от заместителей, указывают на то, что связи могут быть присоединены к любому из подходящих кольцевых атомов бициклической кольцевой системы. Как используется в вышеупомянутых определениях и далее в данном документе, галоген относится к фтору, хлору, брому и йоду. Как используется в данном документе, под терминами "гистоновая дезацетилаза" и "HDAC" понимают любое семейство ферментов, которые удаляют ацетильные группы с -аминогрупп лизиновых остатков на N-конце гистона. Если контекстом не указано иное, под термином "гистон" понимают любой белокгистон, включая H1, Н 2 А, Н 2 В, Н 3, Н 4 и Н 5, от любого вида. Белки или генные продукты HDAC человека включают, без ограничения перечисленным, HDAC1, HDAC2, HDAC3, HDAC4, HDAC5, HDAC6,HDAC7, HDAC8, HDAC9, HDAC10 и HDAC11. Гистоновая дезацетилаза также может быть получена из простейших или грибов. Термин "ингибитор гистоновой дезацетилазы" или "ингибитор дезацетилазы гистона" используют для идентификации соединения, которое способно взаимодействовать с гистоновой дезацетилазой и ингибировать ее активность, более конкретно, ее ферментативную активность. Под ингибированием ферментативной активности гистоновой дезацетилазы понимают снижение способности гистоновой дезацетилазы удалять ацетильную группу с гистона или другого белкового субстрата. Предпочтительно, такое ингибирование является специфичным, т.е. ингибитор гистоновой дезацетилазы снижает способность гистоновой дезацетилазы удалять ацетильную группу с гистона или другого белкового субстрата в концентрации, которая ниже, чем концентрация ингибитора, необходимая для получения другого, не связанного с этим, биологического эффекта. Термин "ингибиторы HDAC с сочетанной активностью в отношении HDAC класса I и класса IIb" или "ингибирование HDAC класса I и класса IIb" используют для идентификации соединений, которые снижают ферментативную активность как члена семейства HDAC класса I (HDAC 1-3 или 8), так и члена семейства HDAC класса IIb (HDAC 6 или 10) в концентрации, которая ниже, чем концентрация ингибитора, необходимая для ингибирования других классов ферментов HDAC, таких как, например, класс IIa,или в концентрации, которая ниже, чем концентрация ингибитора, необходимая для ингибирования другого, не связанного с этим, биологического эффекта. Как используется в данном документе, под терминами "протеасома" и "убиквитин-протеасомная система (UPS)" понимают любую структуру и функцию всех компонентов в UPS, которые включают, безSCF и подобные,h) белки семейства куллинов, например CUL1, CUL2, CUL3, CUL4, CUL5 и подобные,i) белки семейства F-box, например SKP2, белки B-TRCP, белки FBW и подобные,j) другие субстрат-специфические адапторы, например белки ВТВ, белки SOCS-box, DDB1/2, VHL и подобные,k) протеасому, ее компоненты и тому подобное,l) металлоизопептидазу RPN11, субъединицу крышки протеасомы, которая удаляет убиквитин с мишеней UPS перед их деструкцией, и подобные,m) металлоизопептидазу CSN5, субъединицу СОР 9-сигналосомного комплекса, которая отвечает за удаление NEDD8 с белков семейства куллинов, и подобные,n) стадию активации с помощью убиквитин-активирующего фермента Е 1, на которой Ub/Ulp сначала становится аденилированным на своем С-концевом глициновом остатке, а затем становится заряженным в виде сложного тиолового эфира, опять-таки на своем С-конце,о) перенос Ub/Ulp с убиквитин-активирующего фермента Е 1 на убиквитин-конъюгирующий фермент,р) распознавание убиквитин-конъюгата,q) перенос и связывание субстрат-убиквитинового комплекса с протеасомой,r) удаление убиквитина илиs) деградацию субстрата. Термин "ингибитор протеасомы" и "ингибитор убиквитин-протеасомной системы" используют для идентификации соединения, которое способно взаимодействовать с каким-либо нормальным, измененным, гиперактивным или сверхэкспрессируемым компонентом в UPS и ингибировать ее активность, более конкретно, ее ферментативную активность. Под ингибированием ферментативной активности UPS понимают снижение способности компонента UPS осуществлять свою активность. Предпочтительно,такое ингибирование является специфичным, т.е. ингибитор протеасомы снижает активность компонентаUPS в концентрации, которая ниже, чем концентрация ингибитора, необходимая для получения другого,не связанного с этим, биологического эффекта. Ингибиторы активности компонента UPS включают, без ограничения перечисленным:a) ингибиторы аденилирования Ub или Ulp, блокирующие доступ Ub/UPS к сайту аденилирования или блокирующие доступ АТФ; например, иматиниб (Gleevec; Novartis) и подобные,b) дезинтеграторы взаимодействия Е 3 или Е 3-комплекса с Е 2,c) разобщители взаимодействия между субстратом и доменом Е 3 или Е 3-комплекса, взаимодействующим с субстратом, такие как блокирующие взаимодействие между р 53 (субстрат) и MDM2 (RINGfinger Е 3), например белки семейства натлинов (связывающиеся с MDM2), RITA (связывающиеся с Nконцом р 53) и подобные,d) разобщители лигазного комплекса Е 3,e) факторы, искусственно рекрутирующие субстраты для убиквитин-лигаз, например белки семейства протак и подобные,f) ингибиторы протеасомы и ее компонентов, например бортезомиб, карфилзомиб, NPI-0052,Bsc2128 и подобные,g) ингибиторы удаления убиквитина/Ulp, такие как ингибиторы металлоизопептидаз RPN11 иh) модификаторы полиубиквитиновой цепи, например убистатины и подобные. Под фармацевтически приемлемыми кислотно-аддитивными солями, упомянутыми в данном документе выше, понимают содержание терапевтически активных нетоксичных кислотно-аддитивных солевых форм, которые способны образовывать соединения формулы (I). Соединения формулы (I), которые обладают основными свойствами, могут быть преобразованы в их фармацевтически приемлемые кислотно-аддитивные соли путем обработки указанной основной формы подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородная или бромисто-водородная кислота; серная; азотная; фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, трифторуксусная, пропановая, гид-5 020276 роксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная (т.е. бутандикислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты. Соединения формулы (I), которые обладают кислотными свойствами, могут быть преобразованы в их фармацевтически приемлемые основно-аддитивные соли путем обработки указанной кислотной формы подходящим органическим или неорганическим основанием. Подходящие основные солевые формы включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и подобные, соли с органическими основаниями, например бензатин,N-метил-D-глюкамин, соли гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и подобные. Термины "кислотно- или основно-аддитивная соль" также включают гидраты и аддитивные формы с растворителем, которые способны образовывать соединения формулы (I). Примерами таких форм являются, например, гидраты, алкоголяты и тому подобное. Термин "стереохимически изомерные формы" соединений формулы (I), используемый в данном документе выше, определяет все возможные соединения, состоящие из тех же атомов, связанных той же последовательностью связей, но имеющие различные трехмерные структуры, не являющиеся взаимозаменяемыми, которыми могут обладать соединения формулы (I). Если не упоминается или не указывается иное, химическое название соединения охватывает смесь всех возможных стереохимически изомерных форм, которыми может обладать указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений формулы (I), как в чистом виде, так и в смеси друг с другом, включены в объем настоящего изобретения. Некоторые соединения формулы (I) могут также существовать в их таутомерных формах. Хотя такие формы явно не указаны в приведенной выше формуле, они должны быть включены в объем настоящего изобретения. Используемый здесь и далее во всем описании термин "соединения формулы (I)" включает также фармацевтически приемлемые кислотно- или основно-аддитивные соли и все стереоизомерные формы. Особенно предпочтительным ингибитором протеасомы, используемым в соответствии с изобретением, является бортезомиб. Бортезомиб коммерчески доступен от фирмы Millennium под торговым наименованием Velcade и может быть получен, например, как описано в патентах ЕР 788360, ЕР 1312609,ЕР 1627880, US 6066730 и US 6083903 или способами, аналогичными этим. Настоящее изобретение также относится к комбинациям по изобретению для применения в консервативной терапии, например, для ингибирования роста опухолевых клеток. Настоящее изобретение также относится к применению комбинаций по изобретению для получения фармацевтической композиции для ингибирования роста опухолевых клеток. Настоящее изобретение также относится к способу ингибирования роста опухолевых клеток у индивидуума, который включает введение индивидууму эффективного количества комбинации по изобретению. Настоящее изобретение дополнительно относится к способу ингибирования аномального роста клеток, включая трансформированные клетки, путем введения эффективного количества комбинации по изобретению. Аномальный рост клеток относится к клеточному росту, не зависящему от нормальных механизмов регуляции (например, потеря контактного ингибирования). Этот способ включает ингибирование роста опухоли как непосредственно, вызывая остановку роста, терминальную дифференцировку и/или апоптоз раковых клеток, так и косвенно, путем ингибирования миграции, инвазии и жизнеспособности опухолевых клеток или неоваскуляризации опухолей. Настоящее изобретение также относится к способу ингибирования роста опухоли путем введения эффективного количества комбинации по настоящему изобретению индивидууму, например млекопитающему (а более конкретно, человеку), нуждающемуся в таком лечении. В частности, настоящее изобретение относится к способу ингибирования роста опухолей путем введения эффективного количества комбинации по настоящему изобретению. Настоящее изобретение особенно применимо для лечения рака поджелудочной железы, гематопоэтических опухолей лимфоидного ряда, например острого лимфобластного лейкоза, острого миелогенного лейкоза, острого промиелоцитарного лейкоза, острого миелоидного лейкоза, острого моноцитарного лейкоза, лимфомы, хронического В-клеточного лейкоза, хронического миелоидного лейкоза, хронического миелоидного лейкоза в фазе властного криза, лимфомы Беркитта,множественной миеломы, немелкоклеточного рака легких, мелкоклеточного рака легких, неходжкинской лимфомы, меланомы, рака простаты, рака молочной железы и колоректального рака. Примеры других опухолей, которые могут быть ингибированы, включают, без ограничения перечисленным, фолликулярный рак щитовидной железы, миелодиспластический синдром (MDS), опухоли мезенхимального происхождения (например, фибросаркомы и рабдомиосаркомы), тератокарциномы, нейробластомы, глиомы,доброкачественную опухоль кожи (например, кератоакантомы), почечную карциному, карциному яичников, карциному мочевого пузыря и эпидермальную карциному. Настоящее изобретение также относится к способу лечения острого лимфобластного лейкоза, острого миелогенного лейкоза, острого промиелоцитарного лейкоза, острого миелоидного лейкоза, острого моноцитарного лейкоза, лимфомы, хронического В-клеточного лейкоза, хронического миелоидного лейкоза, хронического миелоидного лейкоза в фазе бластного криза, лимфомы Беркитта и множественной миеломы путем введения эффективного количества ингибитора гистоновой дезацетилазы формулы (I) индивидууму, например, млекопитающему (а более конкретно, человеку), нуждающемуся в таком лечении. Настоящее изобретение также относится к способу лечения лекарственнорезистентных опухолей,таких как, без ограничения перечисленным, гематопоэтические опухоли лимфоидного ряда, например,лекарственно-резистентный острый лимфобластный лейкоз, лекарственно-резистентный острый миелогенный лейкоз, лекарственно-резистентный острый промиелоцитарный лейкоз, лекарственнорезистентный острый миелоидный лейкоз, лекарственно-резистентный острый моноцитарный лейкоз,лекарственно-резистентная лимфома, лекарственно-резистентный хронический В-клеточный лейкоз, лекарственно-резистентный хронический миелоидный лейкоз, лекарственно-резистентный хронический миелоидный лейкоз в фазе бластного криза, лекарственно-резистентная лимфома Беркитта и лекарственно-резистентная множественная миелома, путем введения эффективного количества ингибитора гистоновой дезацетилазы формулы (I), либо индивидуально, либо в сочетании с ингибитором протеасомы,индивидууму, например млекопитающему (а более конкретно, человеку), нуждающемуся в таком лечении. Настоящее изобретение особенно применимо для лечения лекарственно-резистентной множественной миеломы, более конкретно, для лечения множественной миеломы, резистентной к ингибиторам протеасом, еще более конкретно, для лечения множественной миеломы, устойчивой к бортезомибу. Термин "лекарственно-резистентная множественная миелома" включает, без ограничения перечисленным, множественную миелому, устойчивую к одному или нескольким лекарственным средствам, выбранным из группы, состоящей из талидомида, дексаметазона, ревлимида, доксорубицина, винкристина,циклофосфамида, памидроната, мелфалана, дефибротида, преднизона, даринапарсина, белиностата, вориностата, PD 0332991, LBH589, LAQ824, MGCD0103, HuLuc63, AZD 6244, пазопаниба, Р 276-00, плитидепсина, бендамустина, танеспимицина, энзастаурина, перифозина, АВТ-737 или RAD001. Термин "лекарственно-резистентная множественная миелома" также включает рецидивирующую или рефрактерную множественную миелому. Под термином "лекарственно-резистентный" понимают состояние, при котором наблюдается исходная или приобретенная устойчивость. Под "исходной резистентностью" понимают характерный профиль экспрессии в раковых клетках основных генов соответствующих путей, включающих, без ограничения перечисленным, апоптоз, развитие клеток и восстановление ДНК, который приводит к способности более быстрого роста канцерогенных клеток по сравнению с их нормальными аналогами. Под "приобретенной резистентностью" понимают многофакторный признак, возникающий при образовании и прогрессировании опухоли, который может влиять на чувствительность раковых клеток к лекарственному средству. Приобретенная резистентность может быть обусловлена несколькими механизмами, такими как, без ограничения перечисленным, изменения в комплексах лекарственное средство-мишень, сниженная аккумуляция лекарственного средства, изменение внутриклеточного распределения лекарственного средства, сниженное взаимодействие лекарственного средства с мишенью, повышенная реакция детоксификации, нарушение регуляции клеточного цикла, повышенное восстановление поврежденной ДНК и сниженная реакция апоптоза. Некоторые из указанных механизмов могут возникать одновременно и/или могут взаимодействовать друг с другом. Их активация и/или инактивация может быть вызвана генетическими или эпигенетическими явлениями или наличием онковирусных белков. Приобретенная резистентность может возникать к отдельным лекарственным средствам, но также может наблюдаться более широко в отношении различных лекарственных средств, обладающих различными химическими структурами и различными механизмами действия. Эту форму резистентности называют множественной лекарственной резистентностью. Комбинацию по изобретению можно использовать для других терапевтических целей, например:a) повышение чувствительности опухолей к радиотерапии путем введения соединения по изобретению перед, во время или после облучения опухоли с целью лечения рака;b) лечение артропатий и остеопатических заболеваний, таких как ревматоидный артрит, остеоартрит, ювенильный артрит, подагра, полиартрит, псориатический артрит, анкилозирующий спондилит и системная красная волчанка;c) ингибирование пролиферации гладкомышечных клеток, включая пролиферативные расстройства сосудов, атеросклероз и рестеноз;d) лечение воспалительных заболеваний и заболеваний кожи, таких как язвенный колит, болезнь Крона, аллергический ринит, заболевание "трансплантат против хозяина", конъюнктивит, астма, ARDS,болезнь Бехчета, отторжение трансплантата, крапивница, аллергический дерматит, гнездная алопеция,склеродерма, экзантема, экзема, дерматомиозит, акне, диабет, системная красная волчанка, болезнь Кавасаки, рассеянный склероз, эмфизема, кистозный фиброз и хронический бронхит;e) лечение эндометриоза, фиброза матки, дисфункционального маточного кровотечения и гиперпла-7 020276f) лечение избыточной васкуляризации глаза, включая васкулопатию, затрагивающую сосуды сетчатки и сосудистое сплетение;g) лечение нарушения сердечной деятельности;h) ингибирование иммуносупрессирующих заболеваний, такое как лечение ВИЧ-инфекции;l) лечение нейропатологии, например болезни Паркинсона или нейропатологии, которая приводит к когнитивному расстройству, например болезни Альцгеймера или нейрональных заболеваний, связанных с полиглутамином;n) ингибирование нейромышечной патологии, например бокового амиотрофического склероза; о) лечение спинальной мышечной атрофии; р) лечение других патологических состояний, подлежащих лечению путем потенцирования экспрессии гена;s) лечение паразитарного заболевания, такого как малярия. Следовательно, настоящее изобретение относится к описанным выше комбинациям для применения в качестве лекарственного средства, а также к применению ингибитора HDAC формулы (I) с сочетанной активностью в отношении HDAC класса I и класса IIb, либо самостоятельно, либо в сочетании с ингибитором протеасомы, для получения лекарственного средства для лечения одного или нескольких из вышеупомянутых заболеваний. Таким образом, настоящее изобретение относится к применению ингибитора HDAC формулы (I) с сочетанной активностью в отношении HDAC класса I и класса IIb, либо самостоятельно, либо в комбинации, для получения лекарственного средства для лечения острого лимфобластного лейкоза, острого миелогенного лейкоза, острого промиелоцитарного лейкоза, острого миелоидного лейкоза, острого моноцитарного лейкоза, лимфомы, хронического В-клеточного лейкоза, хронического миелоидного лейкоза, хронического миелоидного лейкоза в фазе бластного криза, лимфомы Беркитта и множественной миеломы. Настоящее изобретение также относится к применению ингибитора HDAC формулы (I) с сочетанной активностью в отношении HDAC класса I и класса IIb, либо самостоятельно, либо в комбинации, для получения лекарственного средства для лечения лекарственно-резистентных опухолей, таких как, без ограничения перечисленным, гематопоэтические опухоли лимфоидного ряда, например, лекарственнорезистентный острый лимфобластный лейкоз, лекарственно-резистентный острый миелогенный лейкоз,лекарственно-резистентный острый промиелоцитарный лейкоз, лекарственно-резистентный острый миелоидный лейкоз, лекарственно-резистентный острый моноцитарный лейкоз, лекарственно-резистентная лимфома, лекарственно-резистентный хронический В-клеточный лейкоз, лекарственно-резистентный хронический миелоидный лейкоз, лекарственно-резистентный хронический миелоидный лейкоз в фазе бластного криза, лекарственно-резистентная лимфома Беркитта и лекарственно-резистентная множественная миелома. Настоящее изобретение дополнительно относится к применению ингибитора HDAC формулы (I) с сочетанной активностью в отношении HDAC класса I и класса IIb, либо самостоятельно, либо в комбинации, для получения лекарственного средства для лечения лекарственно-резистентной множественной миеломы, более конкретно, множественной миеломы, устойчивой к ингибиторам протеасомы, еще более конкретно, множественной миеломы, устойчивой к бортезомибу. Ингибитор протеасомы и ингибитор HDAC формулы (I) можно вводить одновременно (например, в раздельных или единых композициях) или последовательно в любом порядке. В последнем случае два соединения должны быть введены в период и в количестве и способом, которые достаточны для достижения благоприятного или синергетического эффекта. Должно быть понятно, что предпочтительный способ и порядок введения и соответствующие дозировки и схемы лечения для каждого компонента комбинации будут зависеть от конкретного вводимого ингибитора протеасомы и ингибитора HDAC,способа введения комбинации, конкретной обрабатываемой опухоли и конкретного хозяина, подлежащего лечению. Оптимальные способ и порядок введения и дозировки и схема лечения могут быть без труда определены специалистом в данной области, используя принятые способы и в свете информации, представленной в данном документе. Настоящее изобретение дополнительно относится к продукту, содержащему в качестве первого активного ингредиента ингибитор HDAC формулы (I) и в качестве второго активного ингредиента ингибитор протеасомы в виде комбинированного препарата для одновременного, раздельного или последовательного применения при лечении онкологических больных. Специалист в данной области может без труда определить эффективное количество, основываясь на результатах испытаний, представленных в данном документе ниже. Как правило, предполагается, что терапевтически эффективное количество соединения формулы (I) и ингибитора протеасомы будет составлять от 0,005 до 100 мг/кг массы тела и, в частности, от 0,005 до 10 мг/кг массы тела. Может подходить введение требуемой дозы в виде двух, трех, четырех или более субдоз с подходящими интервалами в течение дня. Указанные субдозы могут быть составлены в виде стандартных лекарственных форм, например, содержащих от 0,5 до 500 мг и, в частности, от 10 до 500 мг активного ингредиента на стандартную лекарственную форму. Принимая во внимание их используемые фармакологические свойства, компоненты комбинаций по изобретению, т.е. ингибитор протеасомы и ингибитор HDAC, могут быть составлены в различные фармацевтические формы в зависимости от целей введения. Компоненты могут быть составлены раздельно в отдельных фармацевтических композициях или в единой фармацевтической композиции, содержащей оба компонента. Ингибиторы HDAC могут быть получены и составлены в фармацевтические композиции способами, известными в данной области, и, в частности, в соответствии со способами, описанными в опубликованном патентном описании, упомянутом в данном документе и приведенном в качестве ссылки. Настоящее изобретение, следовательно, также относится к фармацевтической композиции, содержащей ингибитор протеасомы и ингибитор HDAC формулы (I) вместе с одним или несколькими фармацевтическими носителями. Для получения фармацевтических композиций для применения по изобретению эффективное количество определенного соединения, в форме основно- или кислотно-аддитивной соли в качестве активного ингредиента объединяют в тщательно перемешанной смеси с фармацевтически приемлемым носителем, который можно выбрать из большого числа форм в зависимости от формы препарата, намеченной для введения. Эти фармацевтические композиции желательны в стандартной лекарственной форме, подходящей предпочтительно для перорального, ректального, чрескожного введения или введения путем парентеральной инъекции. Например, при получении композиций в лекарственной форме для перорального введения можно использовать, в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы, любую общепринятую фармацевтическую среду, такую как, например, вода, гликоли, масла, спирты и тому подобное; или, в случае порошков, пилюль, капсул и таблеток, твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества,связующие вещества, дезинтегрирующие агенты и тому подобное. Благодаря простоте их введения самой преимущественной стандартной лекарственной формой для перорального введения являются таблетки и капсулы, в случае которых, очевидно, используют твердые фармацевтические носители. В случае парентеральных композиций носитель, как правило, будет содержать стерильную воду, по меньшей мере в значительной степени, хотя могут быть включены другие ингредиенты, способствующие, например,растворимости. Могут быть получены, например, инъекционные растворы, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть получены инъекционные суспензии, в случае которых можно использовать подходящие жидкие носители, суспендирующие агенты и тому подобное. В композициях, подходящих для чрескожного введения, носитель, необязательно, содержит усилитель пенетрации и/или подходящий увлажнитель, необязательно, в сочетании с подходящими добавками любой природы в незначительных количествах, причем добавки не оказывают существенного отрицательного влияния на кожу. Указанные добавки могут облегчать введение через кожу и/или могут способствовать получению желаемых композиций. Эти композиции можно вводить различными способами, например, в виде трансдермального пластыря, в виде диска, в виде мази. Особенно предпочтительно для простоты введения и единообразия дозировки составлять вышеупомянутые фармацевтические композиции в стандартную лекарственную форму. Стандартная лекарственная форма, как используется в описании и формуле изобретения данного документа, относится к физически дискретным единицам, подходящим в качестве единичных доз, причем каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное для получения желаемого терапевтического эффекта, в ассоциации с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с риской или покрытые таблетки), капсулы, пилюли, пакетики с порошком, облатки, инъецируемые растворы или суспензии,чайные ложки, столовые ложки и тому подобное и их раздельные кратные количества. Это может быть подходящим для введения требуемой дозы каждого компонента комбинации в виде двух, трех, четырех или более субдоз с подходящими интервалами на протяжении курса лечения. Субдозы могут быть составлены в виде стандартных лекарственных форм, например, в каждом случае содержащих независимо от 0,01 до 500 мг, например от 0,1 до 200 мг и, в частности, от 1 до 100 мг каждого активного ингредиента на стандартную лекарственную форму.Под термином "индукция ацетилирования гистонов или других белков" понимают индукцию ацетилированного состояния субстратов HDAC, таких как, без ограничения перечисленным, гистоны, например гистон 3, гистон 4 и подобные; тубулин, например альфа-тубулин и подобные; белки теплового шока, например Hsp 90 и подобные. Под термином "индукция белков, функционально регулируемых указанным ацетилированием", понимают вторичные эффекты, такие как, без ограничения перечисленным, индукция Hsp 70, индукция р 21 и тому подобное. Изобретение также относится к способу характеризации ингибитора HDAC формулы (I), либо самостоятельно, либо в комбинации с ингибитором протеасомы, включающему определение в образце величины индукции ацетилирования гистонов или других белков или индукции белков, функционально регулируемых указанным ацетилированием. Более конкретно, изобретение относится к способу характеризации ингибитора HDAC формулы (I), либо самостоятельно, либо в комбинации с ингибитором протеасомы, включающему определение в образце величиныa) индукции ацетилирования гистона 3, индукции ацетилирования гистона 4 или индукции р 21 иb) индукции ацетилирования альфа-тубулина, индукции ацетилирования Hsp 90 или индукции Hsp 70. В самом конкретном варианте изобретение относится к вышеуказанному способу, в котором концентрация, необходимая для получения индукции согласно пункту а), находится в том же диапазоне, что и концентрация для получения индукции согласно пункту b). Определение в образце величины индукции ацетилирования гистонов или других белков или индукции белков, функционально регулируемых указанным ацетилированием, может включать идентификацию пациентов, которые отвечают на лечение и, таким образом, может иметь благоприятный эффект в отношении лечения рака человека. Определение в образце величины индукции ацетилирования гистонов или других белков или индукции белков, функционально регулируемых указанным ацетилированием, может включать мониторинг эффективности лечения пациентов и, таким образом, может иметь положительный эффект в отношении лечения рака человека. Определение в образце величины индукции ацетилирования гистонов или других белков или индукции белков, функционально регулируемых указанным ацетилированием, может включать прогнозирование терапевтических ответов на лечение и, таким образом, может иметь благоприятный эффект в отношении лечения рака человека. Следовательно, настоящее изобретение также относится к применению ингибитора HDAC формулы (I) с сочетанной активностью в отношении HDAC класса I и класса IIb, либо самостоятельно, либо в комбинации с ингибитором протеасомы, где индукция гиперацетилирования гистонов или других белков или индукция белков, функционально регулируемых указанным ацетилированием, имеет положительный эффект в отношении лечения рака человека. Образец может быть получен из клеток, которые были обработаны указанным ингибитором HDAC или указанной комбинацией. Образец также может быть получен из ткани, затронутой расстройством,и/или от индивидуумов, подвергнутых воздействию ингибитора HDAC формулы (I) или комбинации ингибитора протеасомы и ингибитора HDAC формулы (I). Клетки могут представлять собой культивированные клетки, которые приводили в контакт с указанным ингибитором HDAC или указанной комбинацией. Указанный ингибитор или указанная комбинация могут быть добавлены в среду для роста клеток. Клетки также могут быть получены из ткани и/или от индивидуума, подвергнутых воздействию указанного ингибитора или указанной комбинации. Предпочтительно, способ характеризации включает только стадии, которые осуществляют in vitro. Поэтому согласно данному варианту осуществления стадия получения тканевого материала из тела человека или животного не охватывается настоящим изобретением. Для определения индукции ацетилирования гистонов или других белков или индукции белков,функционально регулируемых указанным ацетилированием, клетки, как правило, обрабатывают до состояния, которое подходит для используемого способа. Обработка может включать гомогенизацию, экстракцию, фиксацию, отмывку и/или пермеабилизацию. Способ обработки, в основном, зависит от способа, используемого для определения индукции ацетилирования гистонов или других белков или индукции белков, функционально регулируемых указанным ацетилированием. Образец может быть получен из биопсийного материала пациента. Биопсийный материал может быть дополнительно обработан для получения образца, который находится в состоянии, подходящем для способа, используемого для определения индукции ацетилирования гистонов или других белков или индукции белков, функционально регулируемых указанным ацетилированием. Величину ацетилирования белков или количество индуцированного белка можно определить, используя антитело. Как используется в данном документе, под термином "антитело" понимают иммуноглобулин или его производное, обладающее той же специфичностью связывания. Антитело, используемое по изобретению, может представлять собой моноклональное антитело или антитело, полученное из или содержащееся в поликлональной антисыворотке. Под термином "антитело" дополнительно понимают производные, такие как фрагменты Fab, F(ab')2, Fv или scFv. Антитело или его производное может быть природным или может быть получено (полу)синтетически. Можно использовать вестерн-блоттинг, который, как правило, известен в данной области. Для получения образцов клеточный материал или ткань могут быть гомогенизированы и обработаны денатурирующими и/или восстанавливающими агентами. Образец можно нанести на полиакриламидный гель для разделения белков с последующим переносом на мембрану или непосредственно поместить на твердую фазу. Антитело затем приводят в контакт с образцом. После одной или нескольких стадий отмывки связавшееся антитело определяют, используя методики, которые известны в данной области. После фиксации и пермеабилизации тканевого материала, например срезов солидных опухолей,можно использовать иммуногистохимическое исследование, антитело затем инкубируют с образцом и после одной или нескольких стадий отмывки определяют связавшееся антитело. С помощью ELISA можно определить величину индукции ацетилирования гистонов или других белков, или индукции белков, функционально регулируемых указанным ацетилированием. Может быть рассмотрено большое число вариантов ELISA. В одном из вариантов антитело иммобилизуют на твердой фазе, такой как планшет для микротитрования, с последующей блокадой сайтов неспецифического связывания и инкубацией с образцом. В другом варианте образец сначала приводят в контакт с твердой фазой для иммобилизации ацетилированных и/или индуцированных белков, содержащихся в образце. После блокирования и, необязательно, отмывки антитело приводят в контакт с иммобилизованным образцом. Величину индукции ацетилирования гистонов или других белков или индукции белков, функционально регулируемых указанным ацетилированием, можно определить проточной цитометрией. Клетки,например клетки культуры клеток или клетки крови, или клетки костного мозга фиксируют и повышают их проницаемость, позволяя антителу достичь ацетилированных и/или индуцированных белков. После необязательной отмывки и стадий блокирования антитело приводят в контакт с клетками. Для определения клеток, имеющих антитело, связанное с ацетилированными и/или индуцированными белками, затем осуществляют проточную цитометрию в соответствии с методиками, известными в данной области. Для определения, обладает ли ингибитор HDAC или комбинация ингибитора протеасомы и ингибитора HDAC формулы (I) своей активностью, можно определить величину ацетилирования белка или индукции белка в контрольном образце, где контрольный образец получают из клеток, которые не обрабатывали указанным ингибитором HDAC или указанной комбинацией. Определение величины ацетилирования белка и/или количества индуцированного белка в образце и контрольном образце можно осуществить параллельно. В случае клеток из культуры клеток получают две композиции клеток, одну из которых обрабатывают указанным ингибитором HDAC или указанной комбинацией, тогда как другую оставляют необработанной. Затем обе композиции дополнительно обрабатывают и определяют относительные величины ацетилирования белков и/или количество индуцированного белка. Альтернативно, для определения, обладает ли ингибитор HDAC или комбинация ингибитора протеасомы и ингибитора HDAC формулы (I) своей активностью, можно определить ингибирование клеточной пролиферации. В случае пациентов образец получают от пациента, которого подвергали воздействию ингибиторомHDAC формулы (I) или комбинацией ингибитора протеасомы и ингибитора HDAC формулы (I). Контрольный образец получают от другого пациента, страдающего тем же расстройством, которого не подвергали воздействию указанным ингибитором HDAC или указанной комбинацией, или от здорового индивидуума. Ткань, из которой получают контрольный образец, соответствует ткани, из которой получают образец. Например, если образец получают из ткани опухоли от пациента, страдающего раком молочной железы, то контрольный образец также получают из ткани опухоли от пациента, страдающего раком молочной железы, или из ткани молочной железы здорового индивидуума. Также можно предусмотреть то, что образец и контрольный образец получают от одного и того же индивидуума. В этом случае ткань, из которой получают контрольный образец, получена от индивидуума до или после лечения индивидуума указанным ингибитором HDAC или указанной комбинацией. Предпочтительно, ткань получают до лечения, чтобы исключить возможные последствия лечения ингибитором после прекращения лечения. Экспериментальная часть А. Фармакологический пример. В отношении активности соединений формулы (I) в плане воздействия на клетки, которую определяли на клетках опухоли А 2780, используя колориметрический анализ для определения токсичности для клеток или жизнеспособности клеток (Mosmann Tim, Journal of Immunological Methods 65: 55-63, 1983),ссылаются на экспериментальную часть публикации WO 2006/010750. Антипролиферативные эффекты ингибиторов HDAC были связаны с ингибированием HDAC классаI, который состоит из членов семейства HDAC 1-3 и 8. Активность JNJ 26481585 в отношении HDAC1,иммунопреципитированного из клеток А 2780, и его потенциальные возможности по сравнению сR306465, SAHA, LBH-589 и LAQ-824 можно найти в примере А.1. Активность JNJ 26481585 в отношении HDAC8, рекомбинантного фермента человека, и его потенциальные возможности по сравнению сR306465, SAHA, LBH-589 и LAQ-824 можно найти в примере А.2. Дополнительно изучали, модулирует ли R306465 состояние ацетилирования субстратов HDAC1 гистона 3 (Н 3) и гистона 4 (Н 4). Также изучали индукцию ингибитора циклинзависимых киназ p21waf1,cip1 в- 11020276 клетках карциномы яичника А 2780. p21waf1,cip1 репрессируется в результате ацетилирования гистонов и играет важную роль в индукции остановки клеточного цикла в ответ на ингибиторы HDAC (см. пример А.3.). Для оценки ингибирования HDAC6 и относительной активности соединений в отношении HDAC 1 по сравнению с HDAC6 наблюдали ацетилирование ее субстрата тубулина и индукцию Hsp 70, которая является следствием ацетилирования Hsp 90 (см. пример А.4.). Пример А. Специфичность класса I и эффекты ацетилирования соединений формулы (I). Пример А. 1: ингибирование фермента HDAC1, иммунопреципитированного из клеток А 2780. Для исследований активности HDAC1 осуществляли иммунопреципитацию HDAC1 из клеточных лизатов А 2780 и инкубировали с указанным ингибитором HDAC, взятым в количествах, соответствующих кривой изменения концентрации, и с [3 Н]ацетил-меченным фрагментом пептида Н 4 (50,000 имп/мин) [биотин-(6-аминогексановый)Gly-Ala-(ацетил[3 Н]Lys-Arg-His-Arg-Lys-Val-NH2] (AmershamPharmacia Biotech, Piscataway, NJ). Активность HDAC оценивали, измеряя высвобождение свободных ацетильных групп. Результаты выражают в виде средних величин IC50SD для трех независимых экспериментов. Пример А.2. Ингибирование рекомбинантного фермента человека HDAC 8. Для ингибирования рекомбинантного HDAC8 человека использовали набор для колориметрического/флуорометрического исследования активности HDAC8/доставки лекарственного средства (Biomol;Cat. nr. AK-508). Результаты выражали в виде средних величин IC50 (нМ)SD для трех независимых экспериментов. Анализы осуществляли в двух повторах и, используя программу Graphpad Prism (Graphpad Software), рассчитывали стандартное отклонение IC50. Пример А.3. Ацетилирование клеточных субстратов HDAC1 и индукция p21waf1,cip1. Клетки карциномы яичника человека А 2780 инкубировали в течение 24 ч с соединениями в концентрациях 0, 1, 3, 10, 30, 100, 300, 1000 и 3000 нМ. Получали суммарные клеточные лизаты и анализировали с помощью SDS-PAGE. Определяли уровни ацетилированных гистонов Н 3 и Н 4, общий уровень белков Н 3 и уровни белка p21waf1,cip1, используя кроличьи поликлональные и мышиные моноклональные антитела с последующим определением усиленной хемилюминесценции (ECL). Уровни ацетилированных Н 3 и Н 4 определяли с помощью антител от Upstate Biotechnology (Cat. nr. 06-299 и 06-866), суммарный уровень белков Н 3 определяли с помощью антител от Abcam (Cat. nr.Ab1791) и уровень белка p21waf1,cip1 определяли с помощью антител от Transduction Laboratories (Cat. nr.C24420). Антитела в соответствующих разведениях инкубировали в течение либо 1-2 ч при комнатной температуре, либо в течение ночи при 4 С. Чтобы проконтролировать эквивалентную загрузку, блоты вырезали и повторно зондировали мышиными моноклональными IgM против актина (Ab-1, OncogeneResearch Products). Для контроля эффективности экстракции ядерных белков блоты вырезали и повторно зондировали антителами против ламина B1 (Zymed; Cat. nr. 33.2000). Комплексы белок-антитело затем визуализировали путем хемилюминесценции (Pierce Chemical Co) или флуоресценции (Odyssey) согласно инструкциям производителя. Эксперименты осуществляли в трех повторах. Пример А.4. Ацетилирование тубулина и индукция Hsp 70. Клетки карциномы яичника человека А 2780 инкубировали с соединениями в концентрациях 0, 1, 3, 10, 30, 100, 300, 1000 и 3000 нМ в течение 24 ч. Получали суммарные клеточные лизаты и анализировали с помощью SDS-PAGE. Уровни общего и ацетилированного тубулина определяли, используя антитела от Sigma: клоны DM1A (Cat. nr. Т 9026) и 6111 В (Cat. nr. T6793). Белок Hsp 70 определяли с помощью антитела от Stressgen (Cat. nr. SPA-810) с последующим определением с помощью ECL. Антитела в соответствующих разведениях инкубировали в течение либо 1-2 ч при комнатной температуре, либо в течение ночи при 4 С. Чтобы проконтролировать эквивалентную загрузку, блоты вырезали и повторно зондировали мышиными моноклональными IgM против актина (Ab-1, Oncogene Research Products). Для контролирования эффективности экстракции ядерных белков блоты вырезали и повторно зондировали антителами против ламина B1 (Zymed; Cat. nr. 33.2000). Комплексы белок-антитело затем визуализировали путем хемилюминесценции (Pierce Chemical Пример В. Ингибирование пролиферации клеток опухоли кроветворной системы человека. Осуществление оценки антипролиферативной активности JNJ 26481585 в панели линий клеток опухоли кроветворной системы человека передавали фирме Oncodesign (Dijon, France). Клетки опухоли выращивали в виде клеточной суспензии в соответствующей подходящей культуральной среде при 37 С в инкубаторе 5% CO2 с системой увлажнения. Свободные от микоплазмы клетки опухоли засевали в 96 луночные плоскодонные планшеты для микротитрования и инкубировали при 37 С в течение 24 ч в культуральной среде, содержащей 10% FCS. Опухолевые клетки затем экспонировали с носителем (контроль) или JNJ 26481585 в повышенных концентрациях (5 разных концентраций), бортезомибом (5 разных концентраций) или комбинацией обоих лекарственных средств в различных соотношениях. Клетки затем инкубировали в течение дополнительных 72 ч. Цитотоксическую активность соединения(й) показывали с помощью стандартного анализа MTS, измеряя оптическую плотность при 490 нм. Взаимодействия соединений (синергизм, аддитивность или антагонизм) рассчитывали путем множественного анализа эффектов лекарственных средств и осуществляли посредством уравнения медианы согласно методике,описанной ChouTalalay [CHOU et al. (1984) Adv. Enzyme Regul. 22: 27-55; CHOU et al. (1991) в Encyclopaedia of human Biology. Academic Press. 2: 371-379; CHOU et al. (1991) в Synergism and antagonism in: на основании предварительного определения антипролиферативной активности каждого лекарственного средства, используемого в качестве самостоятельного агента, выбирали концентрации, не превышающие 50% ингибирования в каждой из выбранных линий клеток. Пример В.1. Ингибирование пролиферации клеток опухоли кроветворной системы человека с помощью JNJ 26481585. Таблица F.1. Результаты выражают в виде средней величины IC40 (т.е. концентрации, выраженной в нМ, требуемой для достижения 40% ингибирования клеточной пролиферации)SD, определенной из 3 независимых достоверных экспериментов. Пример В.2. Ингибирование пролиферации клеток опухоли кроветворной системы человека с помощью бортезомиба. Таблица F.2. Результаты выражают в виде средней величины IC40 (т.е. концентрации, выраженной в нМ, требуемой для достижения 40% ингибирования клеточной пролиферации)SD, определенной из 3 независимых достоверных экспериментов. Пример В.3. Ингибирование пролиферации клеток опухоли кроветворной системы человека с помощью JNJ 26481585 в комбинации с бортезомибом. Таблица 3. Результаты выражают в виде среднего индекса комбинации (CISD) усредненных величин CI в каждом отдельном исследовании (3 независимых достоверных эксперимента) и рассчитывают из каждого отдельного соотношения комбинации. CI менее 0,9 указывает на "синергизм" (серый цвет), a ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Комбинация ингибитора протеасомы, где указанный ингибитор протеасомы представляет собой бортезомиб, и ингибитора гистоновой дезацетилазы, где указанный ингибитор гистоновой дезацетилазы представляет собой соединение 1a (JNJ 26481585) его фармацевтически приемлемые кислотно- или основно-аддитивные соли и стереохимически изомерные формы. 2. Комбинация по п.1 для одновременного, раздельного или последовательного применения. 3. Комбинация по п.1 в форме фармацевтической композиции, содержащей бортезомиб и соединение 1 а вместе с одним или несколькими фармацевтическими носителями. 4. Комбинация по любому из пп.1-3 для применения в медикаментозном лечении. 5. Применение комбинации по любому из пп.1 или 2 для производства лекарственного средства для ингибирования роста опухолевых клеток. 6. Применение ингибитора гистоновой дезацетилазы в комбинации с ингибитором протеасомы для производства лекарственного средства для лечения острого лимфобластного лейкоза, острого миелогенного лейкоза, острого промиелоцитарного лейкоза, острого миелоидного лейкоза, острого моноцитарного лейкоза, лимфомы, хронического В-клеточного лейкоза, хронического миелоидного лейкоза, хронического миелоидного лейкоза в фазе бластного криза, лимфомы Беркитта и множественной миеломы, где указанный ингибитор гистоновой дезацетилазы представляет собой соединение 1 а его фармацевтически приемлемые кислотно- или основно-аддитивные соли и стереохимически изомерные формы, где указанный ингибитор протеасомы представляет собой бортезомиб. 7. Применение по п.6, где указанное лекарственное средство используют для лечения лекарственнорезистентного острого лимфобластного лейкоза, лекарственно-резистентного острого миелогенного лейкоза, лекарственно-резистентного острого промиелоцитарного лейкоза, лекарственно-резистентного острого миелоидного лейкоза, лекарственно-резистентного острого моноцитарного лейкоза, лекарственнорезистентной лимфомы, лекарственно-резистентного хронического В-клеточного лейкоза, лекарственнорезистентного хронического миелоидного лейкоза, лекарственно-резистентного хронического миелоидного лейкоза в фазе бластного криза, лекарственно-резистентной лимфомы Беркитта и лекарственнорезистентной множественной миеломы. 8. Применение по п.6 или 7, где указанное лекарственное средство используют для лечения множественной миеломы, устойчивой к бортезомибу.
МПК / Метки
МПК: A61K 45/06, A61P 35/00, A61K 38/05, A61K 31/506
Метки: отношении, сочетанной, активностью, протеасом, дезацетилаз, ингибиторы, гистоновых, ингибиторами, класса, комбинации
Код ссылки
<a href="https://eas.patents.su/17-20276-ingibitory-gistonovyh-dezacetilaz-s-sochetannojj-aktivnostyu-v-otnoshenii-gistonovyh-dezacetilaz-klassa-i-i-klassa-ii-v-kombinacii-s-ingibitorami-proteasom.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы гистоновых дезацетилаз с сочетанной активностью в отношении гистоновых дезацетилаз класса i и класса ii в комбинации с ингибиторами протеасом</a>
Предыдущий патент: Морфолинотиазолы в качестве позитивных аллостерических модуляторов альфа 7
Следующий патент: Остекление с защитными слоями
Случайный патент: Поршневой двигатель