Трициклические соединения, обладающие активностью в отношении интегринов, в частности, в отношении интегрина альфаvбета 3, способ их получения и промежуточные соединения, используемые в этом способе,их применение в качестве медикаментов и содержащие их фармацевтические композиции.
Номер патента: 2271
Опубликовано: 28.02.2002
Авторы: Бодари Сара С., Гурвест Жан-Франсуа, Карниато Дени, Бернар Серж, Гадек Томас Р., Питти Роберт М., Штильц Ханс-Ульрих, Венер Фолькмар, Кнолле Йохен, Макдауэлл Роберт С., Тетш Жан-Жорж
Формула / Реферат
1. Соединения общей формулы (I)
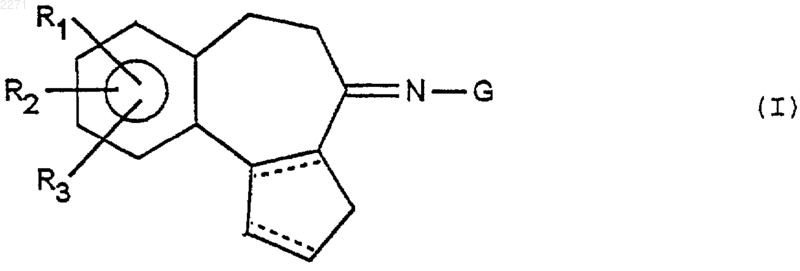
в которой R1 обозначает группу -О-[А]-[В]-COR6, в которой R6 обозначает -ОН, C1-С6алкокси, -О-СН2-СН(ОН)-СН2OН,
[A] обозначает группу C1-С6алкилен, возможно замещенный оксогруппой,
[B] обозначает радикал -CH(Z)- или простую связь,
Z обозначает группу -NHCO2Rc, или -NHSO2Rc, где Rc обозначает радикал фенил(C1-С4)алкил-, хинолинил или пиридинилимидазолил(C1-С4)алкил-,
R2 и R3, одинаковые или разные, обозначают атом водорода, радикал гидроксил, радикал C1-С6алкокси или R2 и R3 образуют вместе группу -O-(C1-С3-алкилен)-O- или -O-C(Ph)2-O,
G обозначает радикал -NH-C-(=X)-NH2, в котором Х обозначает S, О или NH, или радикал -NH-Het', где Het' обозначает имидазол, возможно замещенный группой оксо, пиримидин, диазепин или бензимидазол формул
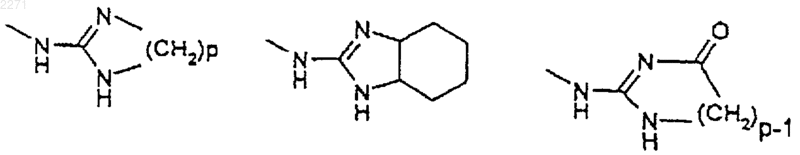
где р равно 2, 3 или 4,
пунктирные линии представляют собой возможную вторую связь, а также соли присоединения с кислотами и основаниями и сложные эфиры,
R1, R2 и R3 могут находиться в положении 8, 9 или 10 трицикла.
2. Соединения общей формулы (I) по п.1, соответствующие общей формуле (I')
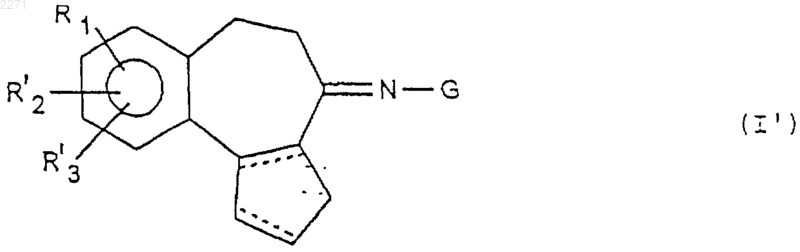
в которой R' обозначает группу -О-[А']-[В]-COR6, где [А'] обозначает двухвалентную группу C1-С6алкилен, а [В] и R6 имеют значения, указанные в п.1, G имеет значение, указанное в п.1, R'2 и R'3 обозначают атом водорода или метоксирадикал; пунктирные линии представляют собой возможную вторую связь, а также соли присоединения с кислотами и основаниями и сложные эфиры.
3. Соединения общей формулы (I) по п.1 или 2, в которой R6 представляет собой группу -ОН, -ОСН3, -ОСН2СН3, -О(СН2)-СН(ОН)-СН2ОН, а также соли присоединения с кислотами и основаниями и сложные эфиры.
4. Соединения общей формулы (I) по пп.1, 2 или 3, в которой R1 представляет собой группу -O-СН(Z)-СООН, а также соли присоединения с кислотами и основаниями и сложные эфиры.
5. Соединения общей формулы (I) по пп.1-4, в которой (Z) является группой -NH-CO2-Rc, где Rc имеет значения по п.1, а также соли присоединения с кислотами и основаниями и сложные эфиры.
6. Соединения общей формулы (I) по одному из пп.1-5, отличающейся тем, что G является группой NH-(Het'), причем (Het') имеет значения, указанные в п.1.
7. Соединения общей формулы (I) по п.6, в которой G означает следующие гетероциклы:
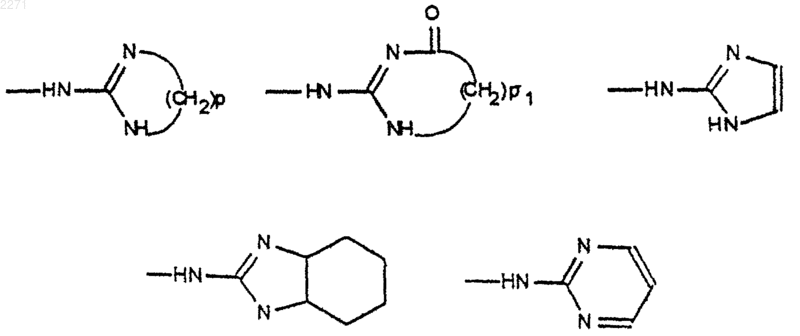
где р является целым числом, равным 2, 3 или 4, а также соли присоединения с кислотами и основаниями и сложные эфиры.
8. Соединения общей формулы (I) по п.6 или 7, в которой G является группой
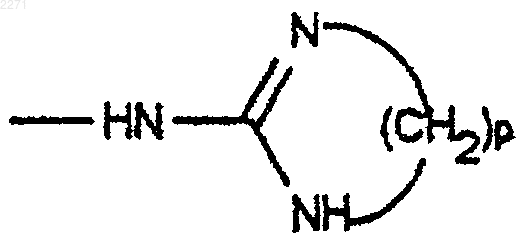
при этом р является целым числом, равным 2, 3 или 4, а также соли присоединения с кислотами и основаниями и сложные эфиры.
9. Соединения формулы (I), как она определена в п.1, со следующими названиями:
-4-((4-((аминоиминометил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)масляная кислота,
-5-((4-((аминоиминометил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)пентановая кислота,
-5-((4-((аминоиминометил)гидразоно)-8,10-диметокси-1,2,3,4,5,6-гексагидро-9-бенз(е)азуленил)окси)пентановая кислота,
-6-((4-((аминоиминометил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)гексановая кислота,
-7-((4-((аминоиминометил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)гептановая кислота,
-5-((9,10-диметокси-1,2,3,4,5,6-гексагидро-4-((4,5-дигидро-1Н-имидазол-2-ил)гидразоно)-8-бенз(е)азуленил)окси)пентановая кислота,
-хлоргидрат 5-((4-((аминоиминометил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)пентаноата этила,
-4-((4-((аминоиминометил)гидразоно)-8,9-диметокси-1,2,3,4,5,6-гексагидро-10-бенз(е)азуленил)окси)масляная кислота,
-5-((4-((аминоиминометил)гидразоно)-8,9-диметокси-1,2,3,4,5,6-гексагидро-10-бенз(е)азуленил)окси)пентановая кислота,
-5-((4-(((амино)карбонил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)пентановая кислота,
-5-((4-(((амино)тиокарбонил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)пентановая кислота,
-4-((4-((аминоиминометил)гидразоно)-8,10-диметокси-1,2,3,4,5,6-гексагидро-9-бенз(е)азуленил)окси)масляная кислота,
-6-((4-((4,5-дигидро-1Н-имидазол-2-ил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)гексановая кислота,
-5-((4-((аминоиминометил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)-3,3-диметил-4-оксопентановая кислота,
-5-((4-((4,5-дигидро-1Н-имидазол-2-ил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)-3,3-диметил-4-оксопентановая кислота,
-хлоргидрат 5-((4-((аминоиминометил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)пентановой кислоты,
-4-((4-((4,5-дигидро-1Н-имидазол-2-ил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)масляная кислота,
-5-((8-((аминоиминометил)гидразоно)-6,7,8,9,10,11-гексагидроазулено(5,6-d)-1,3-бензодиоксол-4-ил)окси)пентановая кислота,
-5-((8-((аминоиминометил)гидразоно)-2,2-дифенил-6,7,8,9,10,11-гексагидроазулено(4,5-е)-(1,3)-бензодиоксол-4-ил)окси)пентановая кислота,
-4-((9,10-диметокси-4-((1,4,5,6-тетрагидро-2-пиримидинил)гидразоно)-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)масляная кислота,
-2-((4-((4,5-дигидро-1Н-имидазол-2-ил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)этановая кислота,
-3-((4-((4,5-дигидро-1Н-имидазол-2-ил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)пропановая кислота,
-4-((4-((4,5-дигидро-1Н-имидазол-2-ил)гидразоно)-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)масляная кислота,
-О-[4-[(4,5-дигидро-1Н-имидазол-2-ил)гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз[е]азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин,
-О-[4-[(4,5-дигидро-1Н-имидазол-2-ил)гидразоно]-1,2,3,4,5,6-гексагидро-8-бенз[е]азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин,
-О-[4-[(1,2,3,4-тетрагидро-6-пиримидинил)гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз[е]азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин,
-(2,3-дигидроксипропиловый) сложный эфир О-(9,10-диметокси-1,2,3,4,5,6-гексагидро-4-[ (1,4,5,6-тетрагидро-2-пиримидинил)гидразоно]-8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерина,
-О-[4-[(4,5-дигидро-1Н-имидазол-2-ил)гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]-N-[(8-хинолинил)сульфонил]-DL-гомосерин,
-монохлоргидрат О-[4-[(4,5-дигидро-1Н-имидазол-2-ил)гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]-N-[[3-[4-(3-пиридинил)-1Н-имидазол-1-ил]пропокси]карбонил]-DL-гомосерина,
-5-[[4-[(4,5-дигидро-4-оксо-1Н-имидазол-2-ил)гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]окси]пентановая кислота,
-О-[9,10-диметокси-1,2,3,4,5,6-гексагидро-4-[(4,5,6,7-тетрагидро-1Н-1,3-диазепин-2-ил)гидразоно]-8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин,
-О-[9,10-диметокси-1,2,3,4,5,6-гексагидро-4-[(3а,4,5,6,7,7а-гексагидро-1Н-бензимидазол-2-ил)гидразоно]-8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин.
10. Способ получения соединений формулы (I), определенной в п.1, отличающийся тем, что соединение формулы (II)
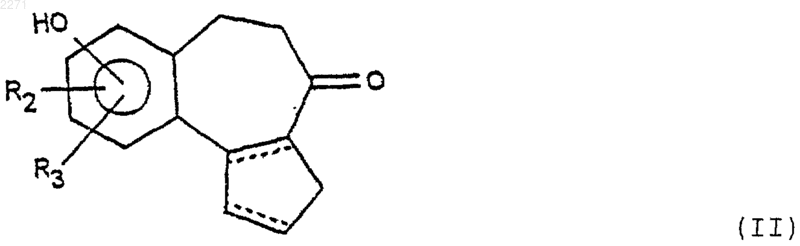
в которой R2 и R3 имеют значения, определенные в п.1, за исключением гидроксила, подвергают или действию соединения формулы (F1) в присутствии основания
Наl-[А]-[В]-СОR6 (F1)
или действию соединения формулы (F'1) в присутствии фосфина и диэтилазодикарбоксилата
ОН-[А] -[В] -СОR6 (F'1)
в которых Hal является атомом галогена, [А], [В] и R6 имеют значения, указанные выше, причем [В] может также представлять собой группу

где Р является защитной группой аминофункции, чтобы получить соединение формулы (IIIa)
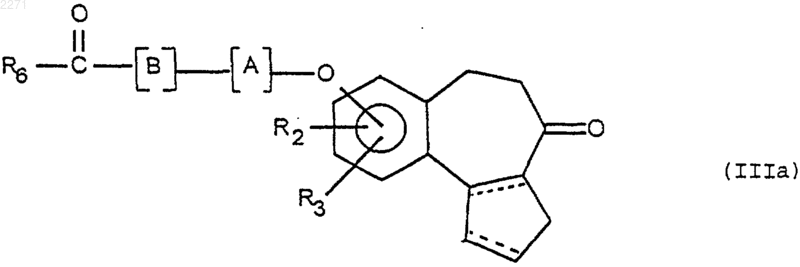
полученное соединение формулы (IIIa) подвергают действию соединения формулы (F3)
H2N-G (F3)
в которой G имеет значения, указанные в п.1, чтобы получить соединения формулы (IVa), соответствующие некоторым продуктам формулы (I)
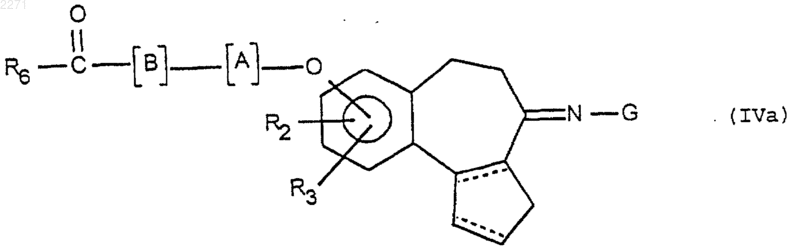
которые подвергают при необходимости в соответствующем порядке одной или нескольким из следующих реакций:
- действию основания или кислоты для расщепления сложного эфира и получения соответствующей кислоты,
- действию агента восстановления, способного восстановить, полностью или частично, ненасыщенные связи,
- действию дезалкилирующего реактива,
- действию агента снятия защитной группы с функции NH-P в бета-положении к COR6, если [В] представляет собой группу CH-NHP,
- реакции образования группы NH-SO2Rc, NH-CO2Rc из соответствующего амина в бета-положении к COR6 для получения соответствующих соединений формулы (I), которые в случае необходимости подвергают действию кислоты или основания, чтобы получить соответствующие соли, или действию агента образования сложных эфиров, чтобы получить соответствующие сложные эфиры.
11. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (II) предварительно подвергают действию соединения формулы (F3) для получения соединения формулы (IIIс)
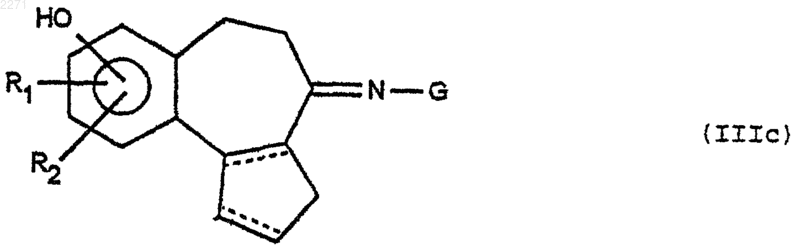
которое затем, после возможной защиты группы G, подвергают действию соединения формулы (F1), (F'1) затем, в случае необходимости, реакции снятия защитной группы с G для получения соответствующего соединения формулы (IVa), которое затем подвергают, в случае необходимости, различным реакциям, указанным в п.10, при этом соединения формул (II), (F1), (F'1), (F3), (IVa) такие, как определено в п.10.
12. Способ получения продуктов формулы (II), описанной в п.10, в которой R2 и R3 являются атомами водорода, а ОН находится в положении 8, 9 или 10, отличающийся тем, что
(i) Соединение формулы (а)
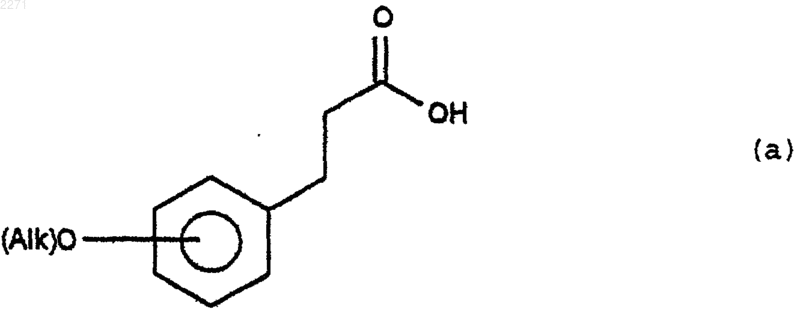
в которой О-(Alk) находится в положении мета- или пара- к алкилкарбоксильной группе, причем (Alk) имеет значения, указанные в п.1, подвергают действию агента галогенирования для получения соответствующего галогенидацила,
(ii) который подвергают действию реактива формулы (b)
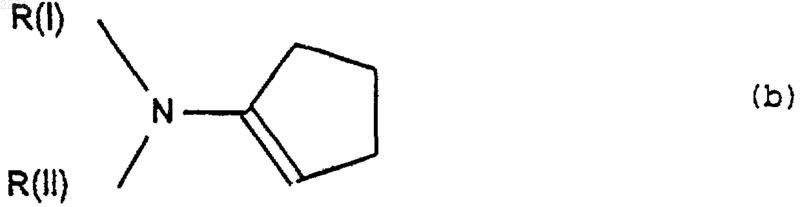
в которой R(I) и R(II), одинаковые или разные, представляют собой алкил, включающий от 1 до 6 атомов углерода, или R(I) и R(II), вместе с атомом азота, с которым они связаны, представляют собой гетероцикл с 5 или 6 звеньями, насыщенный или ненасыщенный, который может содержать другой гетероатом, выбранный из О и N, чтобы получить соединение формулы (с)
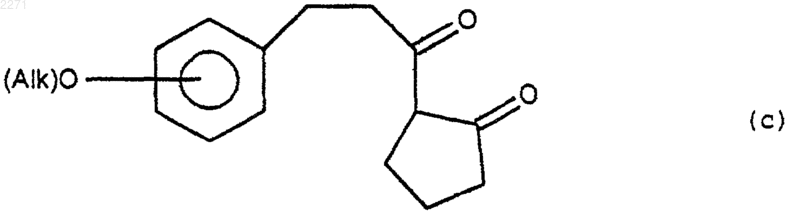
(iii) которое подвергают действию агента галогенирования, чтобы получить соединение формулы (d)
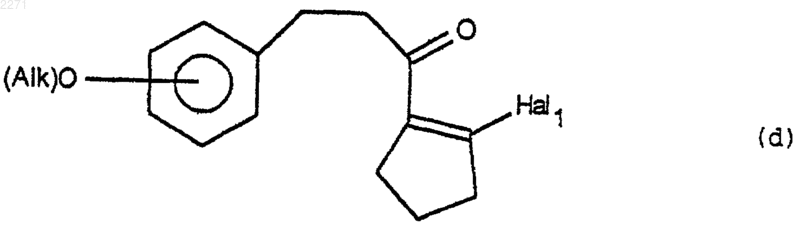
в которой Hal1 представляет собой атом галогена,
(iv) которое подвергают действию кислоты Льюиса, чтобы получить соединение формулы (е)
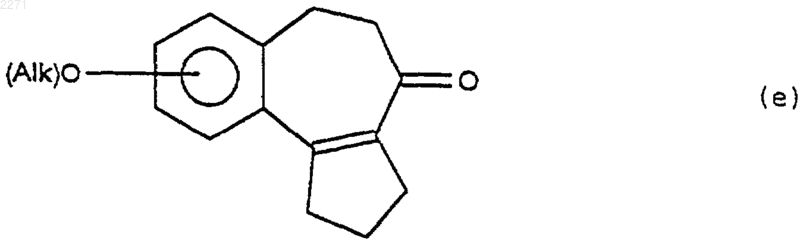
(v) которое подвергают действию дезалкилирующего реактива, чтобы получить продукт формулы (IIF), соответствующий целевому монозамещенному продукту формулы (II)

13. Способ получения соединений общей формулы (II), определенной в п.10 и в которой R2 является группой OAlk, a R3 является атомом водорода, ОН и R2 находятся в положении 8, 9 или 10, отличающийся тем, что соединение общей формулы (а')
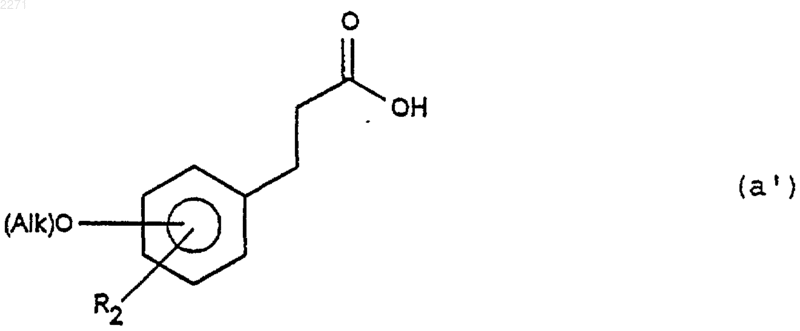
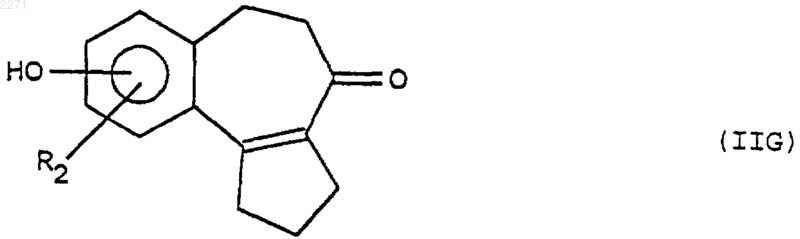
в которой R2 и O-(Alk) находятся в положении мета- или пара- к алкилкарбоксильной группе, подвергают последовательно реакциям (i), (ii), (iii), (iv) и (v), чтобы получить продукт формулы (IIG), соответствующий целевому двузамещенному продукту формулы (II)
14. Способ получения соединений общей формулы (II), определенной в п.10 и в которой R2 и R3 представляют собой группу OAlk, причем ОН находится в положении 9, отличающийся тем, что соединение формулы (IIА)
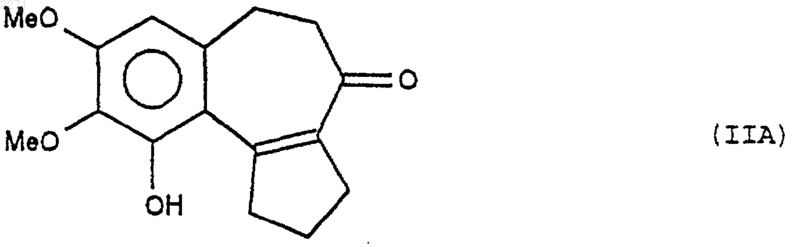
подвергают действию дезалкилирующего реактива, чтобы получить соединение формулы (IIB)
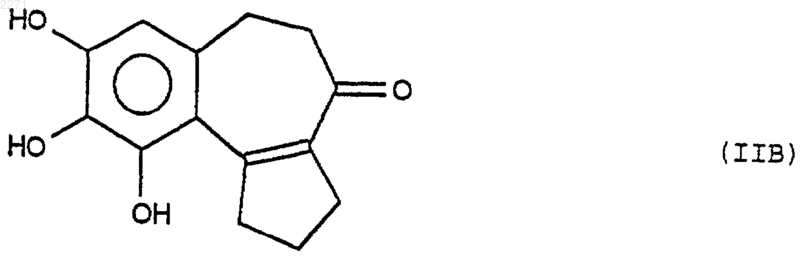
которое подвергают или действию реактива защиты диолов в основной среде, чтобы избирательно получить продукт формулы (IIС)
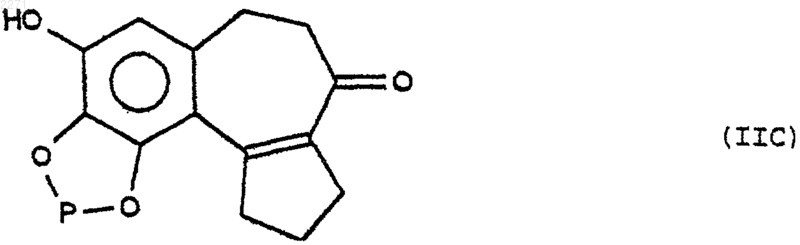
в которой Р представляет собой остаток реактива защиты диолов, который последовательно подвергают действию реактива защиты фенола, реактива снятия защиты диолов, агента алкилирования, затем агента снятия защиты фенола, чтобы получить соединение формулы (IID), соответствующее тризамещенному с ОН в положении 8 продукту формулы (II)

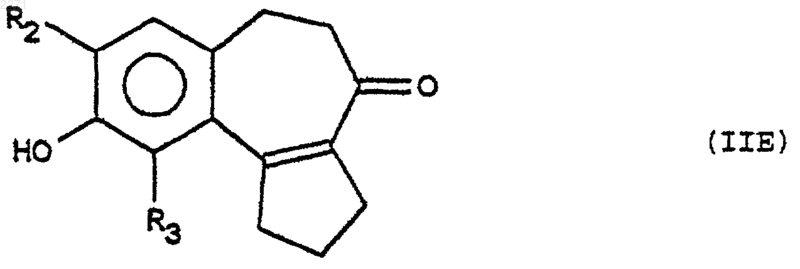
или последовательному действию агента защиты фенола, агента алкилирования, затем агента снятия защиты, чтобы получить соединение формулы (IIЕ), соответствующее тризамещенному с ОН в положении 9 продукту формулы (II)
15. Применение соединений формулы (I), описанных в одном из пп.1-9, а также их фармацевтически приемлемых солей присоединения и сложных эфиров в качестве медикамента.
16. Применение соединения формулы (I) по п.9 в качестве медикамента.
17. Фармацевтические композиции, содержащие в качестве действующего начала, по меньшей мере, один из медикаментов, определенных в п.15 или 16.
18. Соединения общих формул (IIIa), (IIIc) и (II), описанные в одном из пп.10-14, за исключением соединения формулы (IIс) и соединений
2,3,5,6-тетрагидро-9,10-диметокси-8-гидроксибенз(е)азулен-4(1Н)-он и 2,3,5,6-тетрагидро-8,9-диметокси-10-гидроксибенз(е)азулен-4(1Н)-он, в качестве промежуточных продуктов.
Текст
Настоящее изобретение касается новых трициклических соединений, способа их получения и промежуточных соединений этого способа, их применения в качестве медикаментов и фармацевтических композиций, которые их содержат. Объектом настоящего изобретения являются соединения общей формулы (I) п.1, R'2 и R'3 обозначают атом водорода или метоксирадикал; пунктирные линии представляют собой возможную вторую связь, а также соли присоединения с кислотами и основаниями и сложные эфиры. Во второй группе в порядке предпочтения объектом изобретения являются соединения общей формулы (I), как она определена выше, в которой R6 представляет собой группу -ОН,-ОСН 3, -ОСН 2 СН 3, в которой R1 обозначает группу -О-[А]-[B]COR6, в которой R6 обозначает -ОН, C1 С 6 алкокси, -O-СН 2-СН (ОН)-СН 2 ОН,[A] обозначает группу C1-С 6 алкилен, возможно замещенный оксогруппой,[B] обозначает радикал -CH(Z)- или простую связь,Z обозначает группу -NHCO2Rc, или-NHSO2Rc, где Rc обозначает радикал фенил(C1-C4)алкил-, хинолинил или пиридинилимидазолил-(C1-C4)алкил-,R2 и R3, одинаковые или разные, обозначают атом водорода, радикал гидроксил, радикал C1-C6 алкокси или R2 и R3 образуют вместе группу -O-(C1-C3 алкилен)-O- или -O-C(Ph)2-O,G обозначает радикал -NH-C-(=X)-NH2, в котором Х обозначает S, О или NH, или радикал-NH-Het', где Het' обозначает имидазол, возможно замещенный группой оксо, пиримидин,диазепин или бензимидазол формулы а также соли присоединения с кислотами и основаниями и сложные эфиры. В третьей группе в порядке предпочтения объектом изобретения являются соединения общей формулы (I), как она определена выше, в которой R1 представляет собой группу -OCH(Z)-COOH, а также соли присоединения с кислотами и основаниями и сложные эфиры. В четвертой группе в порядке предпочтения объектом изобретения являются соединения общей формулы (I), как она определена выше, в которой (Z) является группой -NH-CO2-Rc, гдеRc имеет определенные выше значения, а также соли присоединения с кислотами и основаниями и сложные эфиры. В пятой группе в порядке предпочтения объектом изобретения являются соединения общей формулы (I), как она определена выше, в которой G является группой -NH-(Het'), как она определена выше, и в частности где р равно 2, 3 или 4,пунктирные линии представляют собой возможную вторую связь, а также соли присоединения с кислотами и основаниями и сложные эфиры,R1, R2 и R3 могут находиться в положении 8, 9 или 10 трицикла. Под соединением формулы (I) понимают все возможные геометрические изомеры и стереоизомеры, взятые отдельно или в смеси. Изобретение также распространяется на сложные эфиры соединений формулы (I). В первой группе в порядке предпочтения объектом изобретения являются соединения общей формулы (I), как она определена выше,отвечающие общей формулы (I') причем р является целым числом, равным 2, 3 или 4, а также соли присоединения с кислотами и основаниями и сложные эфиры. В шестой группе в порядке предпочтения объектом изобретения являются соединения общей формулы (I), как она определена выше, в которой G является группой в которой R'1 обозначает группу -О-[А']-[В]COR6, где [А'] обозначает двухвалентную группу C1-C6 алкилен, а [В] и R6 имеют значения,указанные в п.1, G имеет значение, указанное в причем р является целым числом, равным 2, 3 или 4, а также соли присоединения с кислотами и основаниями и сложные эфиры. В одиннадцатой группе в порядке предпочтения объектом изобретения являются соединения общей формулы (I), как она определена выше, со следующими названиями:-4-9,10-диметокси-4-1,4,5,6-тетрагидро 2-пиримидинил)гидразоно)-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)масляная кислота,-2-4-4,5-дигидро-1 Н-имидазол-2-ил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)этановая кислота,-3-4-4,5-дигидро-1 Н-имидазол-2-ил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)пропановая кислота,-4-4-4,5-дигидро-1 Н-имидазол-2-ил) гидразоно)-1,2,3,4,5,6-гексагидро-8-бенз(е) азуленил)окси)масляная кислота,-О-[4-[(4,5-дигидро-1 Н-имидазол-2-ил) гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз[е]азуленил]-N-[(фенилметокси) карбонил]-DL-гомосерин,-O-[4-[(4,5-дигидро-1 Н-имидазол-2-ил) гидразоно]-1,2,3,4,5,6-гексагидро-8-бенз[е] азуленил]-N-[(фенилметокси)карбонил]-DLгомосерин,-О-[4-[(1,2,3,4-тетрагидро-6-пиримидинил) гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз[е]азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин,-(2,3-дигидроксипропиловый сложный эфир) О-(9,10-диметокси-1,2,3,4,5,6-гексагидро 4-[(1,4,5,6-тетрагидро-2-пиримидинил)гидразоно]-8-бенз(е)азуленил]-N-[(фенилметокси) карбонил]-DL-гомосерина,-О-[4-[(4,5-дигидро-1 Н-имидазол-2-ил) гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]-N-[(8-хинолинил) сульфонил]-DL-гомосерин,-О-[4-[(4,5-дигидро-1 Н-имидазол-2-ил) гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]-N-3-[4-(3-пиридинил)-1 Н-имидазол-1-ил]пропокси]карбонил]DL-гомосерин-монохлоргидрат,-5-4-[(4,5-дигидро-4-оксо-1 Н-имидазол-2 ил)гидразоно]-9,10-диметокси-1,2,3,4,5,6 гексагидро-8-бенз(е)азуленил]окси]пентановая кислота,-О-[9,10-диметокси-1,2,3,4,5,6-гексагидро 4-[(4,5,6,7-тетрагидро-1H-1,3-диазепин-2-ил) гидразоно]-8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин,-О-[9,10-диметокси-1,2,3,4,5,6-гексагидро 4-[(3 а,4,5,6,7,7 а-гексагидро-1 Н-бензимидазол-2 ил)гидразоно]-8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин. Объектом изобретения также является способ получения соединений общей формулы(I), заключающийся в том, что соединение формулы (II) в которой R2 и R3 такие, как описано выше, за исключением гидроксила, подвергают или дей 5 ствию соединения формулы (F1) в присутствии основания,Наl-[А]-[В]-СОR6(F1) или соединения формулы (F'1) в присутствии фосфина и диэтилазодикарбоксилата НО-[А]-[В]-СОR6(F'1) в которых Hal является атомом галогена, [А],[В] и R6 такие, как описано выше, причем [В] также может представлять собой группу где Р является защитной группой аминной функции, чтобы получить соединение формулы затем соединение формулы (IIIa) подвергают действию соединения формулы (F3)(F3) в которой G такой, как описано выше, чтобы получить соединение формулы (IVa), соответствующее некоторым соединениям формулы (I) которое в случае необходимости подвергают в соответствующем порядке- действию основания или кислоты, чтобы расщепить сложный эфир и получить соответствующую кислоту,- действию восстановителя, способного восстановить частично или полностью ненасыщенные связи,- действию агента дезалкилирования,- действию агента удаления защитной группы с функции NH-P в бета-положении кCOR6, если [В] представляет собой группу СНNHP,- образованию группы NH-SO2Rc, NHCO2Rc из соответствующего амина в бетаположении к COR6, чтобы получить соответствующее соединение формулы (I), которое в случае необходимости подвергают действию кислоты или основания, чтобы получить соответствующие соли, или действию агента этерификации, чтобы получить соответствующие сложные эфиры. Реакцию с соединением формулы(F1) осуществляют предпочтительно в присутствии минерального основания, такого как карбонат калия или карбонат натрия, в присутствии апротонного диполярного растворителя, такого как диметилформамид. Hal является предпочтительно атомом хлора или брома.(F3) осуществляют либо без растворителя, либо в спиртовом растворителе, таком как этанол или бутанол. Синтон NH2-G может быть использован в виде соли, такой как хлоргидрат или бромгидрат. Реакцию омыления сложноэфирной функции проводят, например, действуя щелочным основанием, таким как гидроксид натрия или гидроксид калия, в тетрагидрофуране или в низшем спирте, таком как метанол или этанол. Сложный эфир также можно расщепить в кислой среде согласно известным специалистам методам. Восстановление ненасыщенных связей можно осуществлять или полностью, действуя водородом в присутствии катализатора, такого как палладий на угле, или родиевого катализатора, такого как реактив Wilkinson'a, или частично (алкинилен становится алкениленом),действуя отравленным катализатором, таким как палладий на сульфате бария, отравленный пиридином или триэтиламином. Реакцию дезалкилирования, позволяющую получить продукты формулы (I) с R2, R3, R4 илиR5, представляющими собой гидроксилы, осуществляют в присутствии хлорида алюминия или трибромида бора. Функционализацию группы NH2 в альфаположении к COR6, когда [В] представляет собой CH-NH2 или CH-NH2, HCl, осуществляют в соответствии с обычными известными в органической химии методами. Образование группы NHSO2Rc из соответствующего амина происходит преимущественно под действием RcSO2Hal в присутствии основания, например, триэтиламина. Образование группы NHCO2Rc из соответствующего амина происходит преимущественно под действием RcOH, согласно методу, описанному в J. Org. Chem., 61, 3929-3934, после предварительной обработки трифосгеном в присутствии бикарбоната натрия с получением промежуточного изоцианата. Реакции образования солей могут быть проведены в обычных условиях. Например, чтобы получить соль с концевой группой СО 2 Н радикала R1, работают в присутствии соли натрия, такой как карбонат натрия или кислый карбонат натрия или калия. Точно так же получают соль с группой амина или аминогуанидина, которыми может являться G, обрабатывая кислотой в обычных условиях. Например, действуют соляной кислотой в эфирном растворе. 7 В случае осуществления этерификации соединений ее проводят в обычных известных специалистам условиях. В этом случае обычно проводят реакцию кислоты формулы (I) или ее функционального производного с реактивом, способным вводить одну из сложноэфирных групп, неполный список которых фигурирует выше в определенииR6. Продукты общей формулы (F1), (F'1), (F2),(F3) являются известными или могут быть получены согласно известным специалистам методам. Можно также изменить порядок введения различных реактивов, а именно, соединение формулы (II) подвергают действию соединения формулы (F3), чтобы получить промежуточный продукт формулы (IIIс) который подвергают действию соединения формулы (F1) или (F'1), чтобы получить соответствующие продукты формулы (IVa). В этом случае нужно, при необходимости,предусмотреть защиту группы G соединения формулы (IIIс), затем, после введения соединения (F1) или (F'1), удаляют защитную группу в соответствии с известными специалистам методами (T.W. GREENE Protective Groups in Organic Synthesis. John Wiley and Sons Inc. 1991). Реакцию снятия защиты с группы NH-P в бета-положении к COR6, если [В] представляет собой группу CH-NHP, также осуществляют согласно известным специалистам методам, в частности, если Р представляет собой группуCO2tBu, то проводят реакцию декарбоксилирования, например, действуя соляной кислотой. В кости непрерывно происходит динамический процесс, включающий костную резорбцию и образование костной ткани. Эти процессы протекают с помощью специализированных клеток. Образование костной ткани является результатом депонирования минеральной матрицы остеобластами, а костная резорбция - результатом растворения этой костной матрицы остеокластами. Остеопороз характеризуется потерей этой костной матрицы. Зрелый активированный остеокласт резорбирует костную ткань, присоединяясь путем адгезии к костной матрице и выделяя протеолитические ферменты и протоны внутрь зоны контакта, что приводит к появлению депрессий и полостей на поверхности кости в момент отделения остеокласта от кости. Соединения формулы (I), а также их фармацевтически приемлемые соли присоединения,обладают интересными фармакологическими свойствами. Эти соединения ингибируют кост 002271 8 ную резорбцию, осуществляемую остеокластами. Соединения по изобретению являются,следовательно, полезными в лечении заболеваний, вызванных потерей костной матрицы, в частности, остеопороза, злокачественной гиперкальцемии, остеопении, вызванной костными метастазами, пародонтитов, гиперларатироидизма, периартикулярных эрозий при ревматическом артрите, болезни Педжета, остеопении,вызванной неподвижностью, при лечении глюкокортикоидами или лечении дефицита мужских или женских половых гормонов. Они также могут быть использованы в лечении воспалительных, раковых и сердечнососудистых нарушений, включая атеросклероз,рестеноз. Наконец, они могут быть использованы как ингибиторы ангиогенеза и значит, в лечении опухолей путем ингибирования их неоваскуляризации, диабетических ретинопатий и нефропатий. Недавние исследования показали, что закрепление остеокласта на кости происходит с участием рецепторов-интегринов. Интегрины представляют собой надсемейство рецепторов, осуществляющих процесс адгезии клетка/клетка и в особенности, клетка/матрица, включая, в частности, 2b3 в качестве рецептора кровяных пластинок (фибриноген) и v3 в качестве рецептора витронектина,костных сиалопротеинов, таких как остеопонтин и тромбоспондин. Эти рецепторы, которые являются белковыми гетеродимерами, состоят из двух субъединици , обладают сайтами фиксации двухвалентных ионов, таких как, в частности, Са 2+, и сайтом узнавания лиганда, определяемого качеством их субъединиц. Рецептор v3 является трансмембранным гликопротеином, который вырабатывается многими клетками, включая эндотелиальные клетки, гладкие мышечные клетки, остеокласты и раковые клетки, что определяет широкий потенциал соединений согласно изобретению. Рецепторы v3, экспрессируемые на мембране остеокластов, лежат в основе процесса адгезии/резорбции, способствуют организации клеточного цитоскелета и играют роль в развитии остеопороза (Ross et al., J. Biol. Chem.,1987, 262, 7703). Рецепторы v3, экспрессируемые на клетках гладкой мускулатуры аорты, стимулируют их миграцию к неоинтиме, что приводит к развитию атеросклероза и появлению постангиопластического рестеноза (Brown et al., Cardiovascular Res. (1994), 28, 1815). Эндотелиальные клетки секретируют факторы роста, которые являются митогенами для эндотелия и могут способствовать формированию новых кровеносных сосудов (ангиогенез). 9 Ангиогенная стимуляция провоцирует формирование новых кровеносных сосудов. Антагонисты интегрина v3 могут вызывать, таким образом, регрессию раковых опухолей, способствуя апоптозу ангиогенных кровеносных сосудов (Brook et al., Cell (1994) 79,1157). Естественные лиганды интегрина v3 содержат звено RGD (Arg-Gly-Asp). Пептиды, содержащие это звено RGD, а также антитела кv3, известны из-за их способности к ингибированию резорбции дентина, к затруднению прикрепления остеокластов к минерализованным матрицам (Horton et al., Exp. Cell. Res.(1991), 195, 368). Пептид Эхистатин, выделенный из змеиного яда и также содержащий звено RGD, описан как ингибитор прикрепления остеокластов к кости и является, следовательно, мощным ингибитором костной резорбции в тканях в культуре(1993), 132, 1441). Соединения формулы (I), а также их фармацевтически приемлемые соли присоединения и сложные эфиры могут обладать, в частности,сродством к рецептору витронектина v3 или к другим интегринам, лигандом которых является витронектин (v1, v5, 2b3), ингибируя их связывание с их естественным лигандом. Это свойство делает, таким образом, соединения по изобретению полезными для предупреждения или лечения заболеваний, глубинная патология которых вызывается лигандами или клетками, взаимодействующими с рецептором витронектина. Эти соединения могут также проявлять активность в отношении других интегринов, которые взаимодействуют с лигандом через триплетRGD, что сообщает им фармакологические свойства, которые могут быть использованы при лечении патологий, связанных с этими рецепторами. Эта активность в отношении интегринов делает соединения по изобретению полезными в лечении многочисленных заболеваний, перечисленных выше или указанных в журналеDermot Сох DNP 8 (4) май 1995, 197-205, содержание которого включено в настоящую заявку. Объектом изобретения являются, следовательно, соединения формулы (I) в качестве медикаментов, а также их фармацевтически приемлемые соли присоединения и сложные эфиры. Среди медикаментов по изобретению можно назвать, в частности, соединения, описываемые в экспериментальной части. Среди этих продуктов объектом изобретения являются, в частности, соединения формулы (I) из приведенного выше списка. 10 Дозировку варьируют в соответствии с заболеванием и в зависимости от пути введения: она может, например, меняться от 1 до 1000 мг в день у взрослых при оральном введении. Изобретение распространяется на фармацевтические композиции, содержащие в качестве действующего начала, по меньшей мере,один медикамент, как он определен выше. Соединения формулы (I) используют, вводя их через желудочно-кишечный тракт, парентерально или при местном введении, например,через кожу. Они могут быть назначены в форме таблеток, простых или дражированных, пилюль,гранул, суппозиториев, капсул, препаратов для инъекций, помад, кремов, гелей, микросфер,наносфер, форм для подкожного вживления,пластырей, которые получают обычными способами. Действующее(ие) начало(а) могут быть внесены в эти формы с обычными эксципиентами, используемыми в этих фармацевтических композициях, такими как тальк, гуммиарабик,лактоза, крахмал, стеарат магния, масло какао,водные или не водные носители, жиры животного или растительного происхождения, парафиновые производные, гликоли, различные смачивающие агенты, диспергаторы или эмульгаторы, консерванты. Соединения формулы (II), в которой гидроксирадикал находится в положении 10, R2 - в положении 8, а R3 - в положении 9, представляют собой группу О-(Alk) или O-(СН 2)0-3-Аr, R4 иR5 являются атомами водорода, получают согласно методике, описанной в европейской заявке 0729933 и в нижеследующей экспериментальной части (состав 2). Оба других позиционных изомера могут быть получены следующим образом. Соединение формулы (IIА) подвергают действию дезалкилирующего реактива, чтобы получить соединение формулы (IIB) которое подвергают или действию реактива защиты диолов в основной среде, чтобы селективно получить соединение формулы (IIC) в которой Р представляет собой остаток реактива защиты диолов, которое последовательно подвергают действию реактива защиты фенола,реактива снятия защиты диолов, агента алкилирования, затем агента снятия защиты фенола, 11 чтобы получить соединение формулы (IID), соответствующее соединению формулы (II),тризaмещенному с ОН в положении 8 или последовательному действию агента защиты фенола, агента алкилирования, затем агента снятия защиты, чтобы получить соединение формулы (IIЕ), соответствующее соединению формулы (II), тризaмещенному с ОН в положении 9 Под дезалкилирующим реактивом подразумевают преимущественно такие агенты, как трибромид бора или хлорид алюминия. Реактив защиты диолов, которым действуют на продукты формулы (IIB), может являться производным бора, таким как борная кислота, триалкилборат, например, триметилили триэтилборат, или боракс. Под агентом защиты фенола подразумевают, в частности, галогенид, такой как хлорид или бромид мезила или тозила, или бензиловое производное, такое как тозилат или мезилат бензила. Под реактивом снятия защиты диолов подразумевают, в частности, сильную кислоту, такую как соляная кислота, серная кислота или паратолуолсульфоновая кислота, или оксидант,например, пероксид водорода, в случае защиты производным бора. Под агентом алкилирования подразумевают любой классический, известный специалистам агент для алкилирования фенолов. Можно,например, назвать галогенид алкила, такой как хлорид метила или этила, сульфат алкила, такой как сульфат метила или этила, или диазометан. Под агентом снятия защиты подразумевают основание, такое как гидроксид натрия, гидроксид калия или карбонат натрия или калия. Монозамещенные продукты формулы (II),в которых R2, R3, R4 и R5 представляют собой атом водорода, получают по методике, аналогичной той, которая описана в европейской заявке 0729933: в которой О-(Alk) находится в положении мета или пара к алкилкарбоксильной группе, причем(Alk) такой, как определено выше, подвергают действию агента галогенирования, чтобы получить соответствующий галогенид ацила, 002271(ii) который подвергают действию реактива формулы (b)R(II) вместе с атомом азота, с которым они связаны, представляют собой гетероцикл из 5 или 6 звеньев, насыщенный или ненасыщенный, который может включать другой гетероатом, выбранный из О и N, чтобы получить соединение формулы (с)(iii) которое подвергают действию агента галогенирования, чтобы получить соединение формулы (d) в которой Hal1 представляет собой атом галогена,(iv) которое подвергают действию кислоты Льюиса, чтобы получить соединение формулы(v) которое подвергают действию реактива дезалкилирования, чтобы получить продукт формулы (IIF), соответствующий целевому монозaмещенному соединению формулы (II) Двузамещенные продукты формулы (II), в которой R2 представляет собой О-(Alk), а R3 является атомом водорода, ОН и R2 находятся в положении 8, 9 или 10, получают согласно методике, которая описана выше, из соединения формулы (а') в которой О-(Alk) и R2 находятся в положении мета или пара к алкилкарбоксильной цепочке,причем R2 является группой О-(Alk) путем последовательных реакций (i), (ii), (iii), (iv) и (v) с получением, в результате, продуктов формулы(IIG), соответствующих целевым двузамещенным продуктам формулы (II) Агентом галогенирования, которым действуют на соединение формулы (а) или (а'), может, например, являться тионилхлорид, оксалилхлорид или другой известный специалистам агент для получения галогенангидрида кислоты. Реактив формулы (b) получают изначально из циклопентанона и вторичного амина, например, диэтиламина, пиперидина, пиперазина или предпочтительно морфолина. Это происходит в присутствии катализатора - сильной кислоты,например паратолуолсульфоновой кислоты. Взаимодействие амина формулы (b) с галогенангидридом кислоты осуществляют преимущественно в присутствии третичного амина,такого как триэтиламин или пиридин. Агент галогенирования, которым действуют на соединение формулы (с) или на его двузамещенный эквивалент формулы (с'), может являться, например, тионилхлоридом, фосгеном,оксихлоридом фосфора или предпочтительно оксалилхлоридом. Кислота Льюиса, используемая для циклизации соединения формулы (d) или его двузамещенного эквивалента формулы (d'), является,например, хлоридом алюминия, тетрахлоридом титана или предпочтительно хлоридом железа(III) или тетрахлоридом олова. Реакция, подобная предшествующим, может быть проведена,например, в галогенированном растворителе,таком как метиленхлорид, хлороформ или дихлорэтан. Реактивом дезалкилирования соединения формулы (е) или его двузамещенного эквивалента формулы (е') для получения соответствующих фенолов, является предпочтительно хлорид алюминия или трибромид бора. Продукты формулы (II), в которой R4 отличается от атома водорода, получают обычными известными специалистам методами ароматического электрофильного и нуклеофильного замещения. Продукты формулы (II), в которой R5 отличается от атома водорода, получают известными специалистам методами и, в частности,согласно методике, описанной в европейской заявке 0729933, т.е. галогенированием с последующим действием водой или соответствующим спиртом. Продукты формулы (II), в которой R5 является атомом водорода и в которой имеется двойная связь в положении 1-2, получают известными специалистам методами и, в частности, согласно методике, описанной в европейской заявке 0729933, т.е. дегидратацией или 14 дезалкоксилированием в безводной кислой среде. Продукты формулы (II), в которой связь между 5-членным циклом и 7-членным циклом является насыщенной, получают обычными методами гидрогенирования соответствующей двойной связи, в частности, в присутствии палладия на угле. Также объектом изобретения являются продукты формулы (IIIa), (IIIb), (IIIc) и (II) в качестве промежуточных продуктов, при этом подразумевают, что соединения формулы (IIс) и следующие соединения: 2,3,5,6-тетрагидро-9,10-диметокси-8-гидроксибенз[е]азулен-4(1 Н)-он и 2,3,5,6-тетрагидро-8,9-диметокси-10 гидроксибенз[е]азулен-4(1 Н)-он в этот список не входят. Получение этих 2 соединений представлено далее в экспериментальной части. Следующие примеры являются иллюстрацией изобретения, не имеющей ограничительного характера. Получение 1. 2,3,5,6-Тетрагидро-8,9,10 тригидроксибенз[е]азулен-4(1 Н)-он. Стадия А. 3,4,5-Триметоксибензолпропановая кислота. Добавляют 6,8 г карбоната калия к раствору 21,44 г 3,4,5-триметоксифенилпропеновой кислоты и 45 мл воды, затем гидрогенируют в течение одного часа под давлением 1200-1300 мбар в присутствии 1,8 г активированного (10% палладия) угля, таким образом абсорбируют 2,1 л водорода. Фильтруют, промывают водой и подкисляют с помощью 50 мл соляной кислоты(2N). Центрифугируют, промывают водой и сушат при пониженном давлении при комнатной температуре. Таким образом, получают 19,8 г целевого продукта (т.пл.=102-103 С). Спектр ИК (СНСl3) Спектр ЯМР (CDCl3) Стадия В. Хлорид 3,4,5-триметоксибензолпропаноила. С помощью 1,5 г сульфата магния высушивают раствор 6 г продукта, полученного на стадии А, в 21 мл метиленхлорида, после фильтрации охлаждают до 5 С и добавляют 2,2 мл тионилхлорида, затем раствор взбалтывают в течение 20 ч при комнатной температуре. Выпаривают досуха при пониженном давлении,дважды проводя экстрагирование циклогексаном. Таким образом получают 6,46 г целевого продукта. (Т.пл.=60 С). 15 Стадия С. 2-[3-(3,4,5-Триметоксифенил)-1 оксопропил]циклопентанон. К охлажденному до 5 С раствору 2,4 мл 1(N-морфолинил)циклопентена, получение которого описано далее, 2,31 мл триэтиламина и 15 мл метиленхлорида добавляют за 1 ч 30 мин при 5 С раствор 4,27 г продукта, полученного на стадии В, в 15 мл метиленхлорида. Взбалтывают 1 ч при 5 С, затем, повышая температуру,добавляют 10 мл 2 н. соляной кислоты, взбалтывают 1 ч при комнатной температуре, отстаивают, промывают водой, затем насыщенным раствором бикарбоната натрия, сушат, фильтруют и выпаривают досуха при пониженном давлении. Получают 5 г целевого продукта. Неочищенный продукт очищают растворением в 10 объемах этилацетата, экстрагируют 1 н. раствором гидроксида натрия, промывают щелочную фазу этилацетатом, подкисляют до рН 1 концентрированной соляной кислотой, экстрагируют метиленхлоридом, сушат и выпаривают досуха при пониженном давлении. Получают 2,75 г очищенного продукта. Спектр ИК (СНСl3) Получение 1-(N-Морфолинил)циклопентена, используемого на стадии С. Взбалтывают в течение 4 ч 30 мин при кипячении с обратным холодильником, удаляя образующуюся воду, раствор 100 мл циклогексана, 20 мл циклопентанона, 50 мл морфолина и 100 мг паратолуолсульфоновой кислоты. После выпаривания растворителя при пониженном давлении проводят дистилляцию при давлении 12-13 мбар и получают 27,44 г целевого продукта (Т.кип.=83 С). Стадия D. 1-(2-Хлор-1-циклопентен-1-ил)3-(3,4,5-триметоксифенил)пропан-1-он. К раствору 23 г продукта, полученного на стадии С, и 230 мл хлороформа добавляют при комнатной температуре 13 мл оксалилхлорида. Взбалтывают 3 ч при комнатной температуре,концентрируют при пониженном давлении,проводя два раза экстрагирование циклогексаном. Получают 28 г неочищенного продукта,который кристаллизуют в смеси 50 мл циклогексана и 50 мл диизопропилового эфира после частичной концентрации. Центрифугируют,промывают диизопропиловым эфиром и сушат при пониженном давлении. Получают 16,24 г целевого продукта. (Т.пл.=93 С). Стадия Е. 2,3,5,6-Тетрагидро-8,9,10 триметоксибенз[е]азулен-4(1 Н)-он. Взбалтывают 20 ч при комнатной температуре 900 мг продукта, полученного на стадии D,9 мл 1,2-дихлорэтана и 0,9 мл хлорида олова. Затем добавляют 9 мл воды со льдом и отстаивают, промывают водой, реэкстрагируют один раз метиленхлоридом, сушат на сульфате магния, фильтруют и выпаривают досуха при пониженном давлении, чтобы получить 1 г целевого продукта (неочищенного), который очищают хроматографией на кремнеземе, элюируя циклогексаном с 10% этилацетата, затем с 25% этилацетата. После концентрирования получают 700 мг продукта, который кристаллизуют в 5 мл н-гексана, затем охлаждают до 0 С, центрифугируют, промывают с минимумом н-гексана,сушат при пониженном давлении при комнатной температуре, чтобы получить 630 мг целевого продукта.F. 2,3,5,6-Тетрагидро-8,9,10 тригидроксибенз[е]азулен-4(1 Н)-он. Действуя как на стадии В получения 1 бис,получают целевой деметилированный продукт. Получение 1 бис. 2,3,5,6-Тетрагидро 8,9,10-тригидроксибенз[е]азулен-4(1 Н)-он. Стадия А. 2,3,5,6-Тетрагидро-8,9,10-триметоксибенз[е]азулен-4(1 Н)-он. В течение 2 ч 30 мин при 20 С взбалтывают 60 г продукта, полученного по способу получения 2, 600 мл 1,2-дихлорэтана, 342 мл 2 н. гидроксида натрия, 1,2 г бромида тетрабутиламмония и 33 мл диметилсульфата. Вносят 39 мл триэтиламина, чтобы разрушить избыток диметилсульфата и взбалтывают в течение часа при 202 С. Добавляют 342 мл деминерализованной воды, взбалтывают 15 мин при 202 С,отстаивают, реэкстрагируют водную фазу два раза, каждый раз с помощью 120 мл 1,2 дихлорэтана. Фазы 1,2-дихлорэтана объединяют и промывают 4240 мл деминерализованной воды, затем 1300 мл 1 н. соляной кислоты, 17 затем 3240 мл деминерализованной воды (до нейтральности). Объединенные органические фазы сушат на сульфате натрия, фильтруют и концентрируют при нормальном давлении и при 83 С до остаточного объема 480 мл. Стадия В. 2,3,5,6-Тетрагидро-8,9,10 тригидроксибенз[е]азулен-4(1 Н)-он. Нагревают с обратным холодильником в течение одного часа 480 мл раствора, полученного на стадии А, с 102,3 г безводного хлорида алюминия. Среду охлаждают до 02 С, затем за 2 ч добавляют смесь 600 мл деминерализованной воды и 192 мл чистой серной кислоты (концентрированной), предварительно охлажденной до 0 С, поддерживая температуру реакционной среды ниже 20 С. Вносят за 5 мин при 202 С 300 мл деминерализованной воды и взбалтывают 16 ч при 202 С, центрифугируют, промывают два раза, каждый раз с помощью 60 мл 1,2 дихлорэтана, затем деминерализованной водой,сушат при пониженном давлении и получают 52,2 г целевого продукта. Получение 2. 8,9-Диметокси-10-гидрокси 2,3,5,6-тетрагидробенз[е]азулен-4(1 Н)-он. Стадия А. 3,4-Диметокси-5(4-метилфенил)сульфонил]окси]бензолпропановая кислота. Действуют, как на стадии А получения 1,используя 29,76 г 3,4-диметокси-5-(4-метилфенил)сульфонил]окси]фенил]коричной кислоты, получение которой представлено ниже, 43,5 г карбоната калия, 60 мл метанола и 1,48 г активированного угля (10% палладия). Таким образом получают 28,23 г целевого продукта в виде бесцветных кристаллов 18 Действуют, как на стадии С получения 1,из 2,24 г хлорида кислоты, полученного на стадии В, используя 770 мг 1-(N-морфолинил) циклопентена (полученного на стадии С способа получения 1), 6 мл метиленхлорида и 0,77 мл триэтиламина. После перекристаллизации в диизопропиловом эфире получают 1,27 г целевого продукта. (Т.пл.=84 С) Спектр ИК (СНСl3) Стадия D. 1-(2-Хлор-1-циклопентен-1-ил)3-[3,4-диметокси-5-(4-метилфенил)сульфонил] окси]фенил]пропан-1-он. Действуют, как на стадии D получения 1,используя 8,7 г продукта, полученного на стадии С, 70 мл хлороформа и 3,5 мл оксалилхлорида. После кристаллизации в диизопропиловом эфире получают 7,75 г целевого продукта.(Т.пл.=73 С). Этот продукт используют на следующей стадии. Аналитический образец получают перекристаллизацией в 2,5 объема метиленхлорида и 5 объемах диизопропилового эфира с последующей концентрацией до 3 объемов, центрифугированием, промывкой диизопропиловым эфиром и высушиванием при пониженном давлении и комнатной температуре (Т.пл.=77-78 С) Спектр ИК (СНСl3) Спектр УФ (EtOH) Стадия В. Хлорид 3,4-диметокси-5-(4 метилфенил)сульфонил]окси]бензолпропаноила. Действуют, как на стадии В получения 1,используя 1,9 г продукта, полученного на стадии А, 9,5 мл метиленхлорида и 0,7 мл тионилхлорида. Получают 2,24 г целевого продукта в таком виде, в каком его используют на следующей стадии. Стадия С. 2-[3-[3,4-Диметокси-5-(4 метилфенил)сульфонил]окси]фенил]-1-оксопропил]циклопентанон.[е]азулен-4(1 Н)-он. К раствору 2,32 г продукта, полученного на стадии С, в 50 мл 1,2-дихлорэтана добавляют при комнатной температуре 1,65 г хлорида железа (98%). Взбалтывают 48 ч при комнатной температуре, затем вливают в смесь воды и льда, энергично взбалтывают в течение 15 мин и экстрагируют метиленхлоридом, промывают водой, затем насыщенным водным раствором хлорида натрия. После высушивания и выпаривания досуха при пониженном давлении получают 2,15 г неочищенного продукта, который хроматографируют, элюируя циклогексаном,содержащим 50% этилацетата, с получением 1,8 г продукта, который опять хроматографируют и кристаллизуют в смеси хлороформ/диизопропиловый эфир, чтобы получить 720 мг целевого продукта. Стадия F. 8,9-Диметокси-10-гидрокси 2,3,5,6-тетрагидробенз[е]азулен-4(1 Н)-он. Нагревают с обратным холодильником в течение 2 ч смесь 350 г продукта, полученного на стадии Е, 1750 мл метанола, 350 мл деминерализованной воды и 350 мл чистого натрового щелока (концентрированного). Реакционную среду охлаждают до 22 С и вводят за 45 мин 467 мл концентрированной соляной кислоты,поддерживая температуру 22 С. Затем добав 002271 20 ляют 1645 мл деминерализованной воды в течение 10 мин, поддерживая температуру 22 С,после чего взбалтывают реакционную среду 30 мин при 22 С. Центрифугируют образовавшиеся кристаллы, промывают 5-кратным клерованием, каждый раз с 700 мл деминерализованной воды при 20 С, затем сушат при 40 С и пониженном давлении, чтобы получить 199,1 г целевого продукта. Получение 3,4-диметокси-5-(4-метилфенил)сульфонил]окси]коричной кислоты, используемой в качестве исходного продукта в способе получения 2. Стадия А. 3,4-Диметокси-5-(4-метилфенил)сульфонил]окси]метилбензоат. За 10 мин при комнатной температуре к взбалтываемой смеси 200 г метилгаллата и 2 л метиленхлорида добавляют 303 мл триэтиламина. После растворения состав охлаждают до 05 С, затем добавляют при данной температуре и за 1 ч 130 мл дихлордиметилсилана и взбалтывают при этой температуре еще 30 мин. Поддерживая температуру 0-5 С, добавляют за 25 мин 303,2 мл триэтиламина, затем за 15 мин 227,6 г тозилхлорида. Взбалтывают еще 1 ч при 0-5 С и добавляют за 10 мин при взбалтывании и давая температуре подняться до 20-22 С, 200 мл уксусной кислоты, затем 500 мл деминерализованной воды и взбалтывают еще 15 мин при 20 С. Отгоняют метиленхлорид при постоянном объеме (3,3 л) и при пониженном давлении, используя для замещения деминерализованную воду, взбалтывают 2 ч при 20 С, центрифугируют, промывают деминерализованной водой и получают 523 г (влажный вес) 3,4-дигидрокси 5-(4-метилфенил)сульфонил]окси]метилбензоат (метил-3-тозилгаллат)а. Полученный влажный продукт поглощают 2,17 л гидроксида натрия (2N) и 2,17 л метиленхлорида. Взбалтывают при 20 С до растворения, затем добавляют при 20 С 18 г тетрабутиламмонийбромида, затем за 15 мин при 20 С - 237 мл диметилсульфата. Реакционную среду взбалтывают 1,5 ч при 20-22 С. Добавляют при 20-22 С 78 мл триэтиламина и взбалтывают в течение ночи при 2022 С, затем отстаивают и промывают с помощью 400 мл деминерализованной воды, добавляют к органической фазе 20 мл чистой уксусной кислоты, взбалтывают 15 мин, добавляют 400 мл деминерализованной воды и отстаивают. Объединенные органические фазы концентрируют досуха, сначала при атмосферном давлении, затем при пониженном давлении (40 мм рт.ст.) и 60 С (наружная). Извлекают с 400 мл метанола, затем поглощают полученный сухой экстракт в 600 мл метанола, кипятят с обратным холодильником до полного растворения продукта, затем охлаждают до 0-5 С и взбалтывают 1 ч при данной температуре. Центрифугируют,дважды промывают с 200 мл метанола с t =-10C и сушат при 40 С при пониженном давлении; таким образом получают 330,4 г 3,4-диме 21 диметокси-5-(4-метилфенил)сульфонил]окси] метилбензоата. Неочищенный продукт очищают кристаллизацией в 330 мл толуола. После 2 ч взбалтывания при -10 С центрифугируют, промывают 2 раза в 82 мл толуола, охлажденного до -15 С, и сушат при пониженном давлении и при 40 С, чтобы получить 230,3 г целевого очищенного продукта. Стадия В. 3,4-Диметокси-5-(4-метилфенил)сульфонил]окси]коричная кислота.a) Охлаждают до 0 С 600 мл толуола и добавляют 202 мл 70%-го раствора Vitride в толуоле с t = 0C, добавляют за 1 ч 67,6 мл морфолина (t = 0-2C), дают температуре подняться до 18 С. Полученный раствор сразу используют на следующей стадии.b) Взбалтывают в течение 10 мин при 2022 С 200 г 3,4-диметокси-5-(4-метилфенил) сульфонил]окси]метилбензоата, полученного на стадии А, и 1400 мл толуола до полного растворения. Полученный раствор реактива взбалтывают 1 ч при 10 С. Взбалтывают еще 1 ч, давая температуре подняться до 18 С. За 1 ч при 10 С вводят охлажденный до 10 С раствор 200 мл концентрированной серной кислоты и 1000 мл деминерализованной воды. Взбалтывают 16 ч при 20 С, затем отстаивают органическую фазу, промывают 5200 мл деминерализованной воды, сушат, фильтруют и промывают 3100 мл метиленхлорида. Таким образом полученный раствор промежуточного альдегида используют на следующей стадии.(удаляя при нормальном давлении метиленхлорид) полученный на предыдущей стадии раствор промежуточного альдегида, 200 мл 2 пиколина, 120 г малоновой кислоты и 20 г пиперидина. Охлаждают до 20-22 С и, поддерживая заданную температуру, добавляют за 15 мин раствор 200 мл концентрированной соляной кислоты и 400 мл деминерализованной воды. Взбалтывают 2 ч при 20-22 С, затем охлаждают до 0C, центрифугируют образовавшиеся кристаллы, сушат при пониженном давлении и при 40 С, чтобы получить 171,7 г 3,4-диметокси-5(4-метилфенил)сульфонил]окси)фенил]коричной кислоты. Получение 3. 9,10-Диметокси-8-гидрокси 2,3,5,6-тетрагидробенз[е]азулен-4(1 Н)-он. Стадия А. 9,10-Дигидрокси-8-(4-метилфенил)сульфонил]окси]-2,3,5,6-тетрагидробенз[е]азулен-4(1 Н)-она, полученного по способу получения 1 или 1 бис, 300 мл тетрагидрофурана, 60 мл триэтиламина и 12,9 мл триметилбората. Добавляют 30 г тозилхлорида и взбалтывают 16 ч при 202 С, затем за 10 мин при 202 С вливают реакционную среду во взбал 002271 22 тываемую смесь 900 мл деминерализованной воды и 150 мл концентрированной соляной кислоты, затем добавляют 90 мл тетрагидрофурана и 60 мл метиленхлорида. Полученный раствор взбалтывают 1 ч при 20 С, затем вводят 150 мл метиленхлорида и взбалтывают еще 15 мин,отстаивают и экстрагируют 275 мл метиленхлорида. Объединенные органические фазы промывают 4150 мл деминерализованной воды и снова экстрагируют с 75 мл метиленхлорида после концентрирования при пониженном давлении (20 мбар) до прекращения отгонки при 50 С и получают 47,6 г целевого продукта. Стадия В. 9,10-Диметокси-8-(4-метилфенил)сульфонил]окси]-2,3,5,6-тетрагидробенз[е]азулен-4(1 Н)-он. Взбалтывают 16 ч при 20 С 47,6 г продукта, полученного на предыдущей стадии, 300 мл метиленхлорида, 300 мл гидроксида натрия(2N), 0,6 г тетрабутиламмонийбромида и 30 мл диметилсульфата. Вводят 30 мл триэтиламина,чтобы устранить избыток диметилсульфата,реакционную среду взбалтывают еще 1 ч при 202 С, затем добавляют 150 мл деминерализованной воды, взбалтывают еще 15 мин, затем отстаивают. Водную фазу экстрагируют 275 мл метиленхлорида, а объединенные органические фазы промывают 3120 мл деминерализованной воды, затем 120 мл соляной кислоты N и 3120 мл деминерализованной воды, органические фазы объединяют и сушат на сульфате натрия, затем добавляют за 1 ч 120 г силикагеля(60 Mesh) с t = 202 С при взбалтывании, взбалтывают еще 1 ч при 20 С, фильтруют, промывают метиленхлоридом и концентрируют досуха при пониженном давлении при 50 С с получением 47,4 г целевого продукта. Неочищенный продукт очищают перекристаллизацией в 390 мл этанола после отгонки 90 мл этанола, взбалтывают 3 ч при 02 С. Центрифугируют, промывают в 30 мл этанола с t = 0C, затем сушат при пониженном давлении и при 40 С, чтобы получить 41,1 г целевого продукта (Т.пл.=129 С). Стадия С. 9,10-Диметокси-8-гидрокси 2,3,5,6-тетрагидробенз[е]азулен-4(1 Н)-он. Добавляют 4,5 г гидроксида калия, затем 10 мл триэтиламина в суспензию, содержащую 10 г 9,10-диметокси-8-4-метилфенил)сульфонил)окси)-2,3,5,6-тетрагидробенз[е]азулен 4(1 Н)-она, полученного так же, как на стадии В,и 100 мл метанола. Кипятят 1 ч с обратным холодильником, подкисляют добавлением 20 мл уксусной кислоты, затем добавляют 20 мл воды. Экстрагируют дихлорметаном, промывают водой, выпаривают растворитель при 40 С при пониженном давлении и получают 5,7 г целевого продукта. Получение 4. 2,3,5,6-Тетрагидро-8-гидрокси-9-метоксибенз[е]аэулен-4(1 Н)-он и 2,3,5,6 23 тетрагидро-9-гидрокси-8-метоксибенз[е]азулен 4(1 Н)-он. Действуют таким же образом, как в получении 2 на стадиях В, С, D, Е и F, но используют в качестве исходного продукта 3-(3,4 диметоксифенил)пропионовую кислоту и получают 1,08 г неочищенного продукта, содержащего смесь моногидроксилированного продукта(8-ОН/9-ОМе и 9-ОН/8-ОМе), который разделяют хроматографией на кремнеземе, элюируя смесью циклогексан/этилацетат 7/3. Таким образом получают оба пространственных изомера: 8-ОН/9-ОМе 0,494 г Rf (циклогексан/этилацетат 6/4)=0,42 8-ОМе/9-ОН 0,041 г Rf (циклогексан/этилацетат 6/4)=0,33. Получение 5. 2,3,5,6-Тетрагидро-8-гидрокси-10-метоксибенз[е]азулен-4(1 Н)-он и 2,3,5,6 тетрагидро-10-гидрокси-8-метоксибенз[е]азулен-4(1 Н)-он. Действуют таким же образом, как в получении 2 на стадиях В, С, D, Е и F, но используют в качестве исходного продукта 3-(3,5 диметоксифенил)пропионовую кислоту и получают 1,428 г продукта, содержащего смесь моногидроксилированных продуктов (8-ОН/10 ОМе и 10-ОН/8-ОМе) и дигидроксилированных продуктов (8-ОН/10-ОН), которые разделяют хроматографией на кремнеземе, элюируя смесью циклогексан/этилацетат 7/3. Получение 6. 2,3,5,6-Тетрагидро-9-гидроксибенз[е]азулен-4(1 Н)-он. Действуют таким же образом, как в получении 2 на стадиях В, С, D, Е и F, но используют в качестве исходного продукта 3-(4 метоксифенил)пропионовую кислоту. Деметилирование осуществляют с помощью трибромида бора. (Rf=0,15 циклогексан/этилацетат 7/3). Получение 7. 2,3,5,6-Тетрагидро-8-гидроксибенз[е]азулен-4(1 Н)-он. Действуют таким же образом, как в получении 2 на стадиях В, С, D, Е и F, но используют в качестве исходного продукта 10,0 г 3-(3 метоксифенил)пропионовой кислоты и получают 2,9 г целевого продукта. Деметилирование осуществляют с помощью трибромида бора.(DL)-4-бром-2-(фенилметоксикарбониламино) масляной кислоты. Взбалтывают в течение 18 ч при 120 С в закрытом сосуде 25 г 2-амино-4-бутиролактонбромгидрата в 200 мл уксусной кислоты,содержащей 24% газообразной бромоводородной кислоты, охлаждают до комнатной температуры, приводят давление к нормальному атмосферному, концентрируют при пониженном давлении, поглощают 200 мл метанола, затем барботируют поток соляной кислоты в течение 2 ч, поддерживая температуру ниже 35 С. Выпаривают растворитель при пониженном давлении и получают метиловый сложный эфир 2 002271 24 амино-4-броммасляной кислоты, который поглощают в 250 мл ацетона и 100 мл воды, нейтрализуют с помощью гидроксида натрия 2N,затем медленно добавляют 35 мл бензилхлорформиата. Взбалтывают в течение 48 ч, фильтруют, экстрагируют этилацетатом, выпаривают растворитель, остаток хроматографируют на кремнеземе (элюент: циклогексан-этилацетат 73) и получают 27,9 г целевого продукта. Т.пл.=90 С. Получение 9. Метиловый сложный эфир 4 бром-2-(третбутоксикарбониламино)масляной кислоты. Взбалтывают в течение 48 ч при комнатной температуре 5,7 г метилового сложного эфира 2-амино-4-броммасляной кислоты, полученного как в способе получения 8, в 120 мл метанола с 24 мл триэтиламина и 9 г ди-третбутилдикарбоната. Выпаривают растворители,поглощают остаток водой и дихлорметаном,фильтруют, экстрагируют дихлорметаном, выпаривают растворители, хроматографируют остаток на кремнеземе (элюент: циклогексан AcOEt-TEA 7-3-0,5) и получают 1,575 г целевого продукта с Rf=0,52. Получение 10. 4-(3-Пиримидинил)-1 Нимидазол-1-пропанол. Смешивают 505 мг этилата натрия с 12,5 мл диметилформамида, добавляют 1 г 3-(1Hимидазол-4-ил) пиридина, затем 0,64 мл хлорпропанола и взбалтывают 16 ч при 55 С. Выпаривают растворитель при пониженном давлении, хроматографируют остаток (элюент:CH2Cl2 - МеОН 98-2) и получают 1,015 г целевого продукта. Спектр ИК (СНСl3) Получение 11. Гидразон гексагидро-2 Н 1,3-диазепин-2-она. Нагревают при 65-70 С в течение 1 ч суспензию, включающую 3,3 г нитрогуанидина, 7 мл воды, 3,47 г гидроксида калия и 5 г диаминдихлоргидрата, добавляют 10,5 г цинка, взбалтывают 30 мин при комнатной температуре,затем добавляют 2 мл уксусной кислоты, нагревают 1 ч при 40 С, фильтруют, добавляют 3 г хлорида аммония, затем 4 г бикарбоната натрия. Экстрагируют дихлорметаном, выпаривают растворитель при пониженном давлении, хроматографируют остаток на кремнеземе (элюент:CH2Cl2-МеОН-NH4OH 8-4-2) и получают 1,650 г целевого продукта. Получение 12. Монобромгидрат 3 а,4,5,6,7,7a-гексагидро-2-(пропилтио)-1 Нбензимидазола. Кипятят с обратным холодильником до полного растворения 1 г октагидро-2 Нбензимидазол-2-тиона и 1,3 мл бромпропана в 20 мл этанола. Выпаривают растворитель при пониженном давлении, остаток поглощают минимумом дихлорметана, добавляют изопропи 25 ловый эфир, выпаривают растворители при пониженном давлении, кристаллизуют в изопропиловом эфире, центрифугируют и сушат целевой продукт с выходом 95%. Т.пл.=136 С. Пример 1. 7-4-Амино)иминометил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидробенз(е)азулен-8-ил)окси)гептановая кислота. Стадия А. Метиловый сложный эфир 74-оксо)-9,10-диметокси-1,2,3,4,5,6-гексагидробенз(е)азулен-8-ил)окси)гептановой кислоты. Взбалтывают при 40 С в течение 4 ч суспензию, содержащую 0,684 г 2,3,5,6-тетрагидро 8-гидрокси-9,10-диметоксибенз[е]азулен-4(1 Н)она (получение 3), 12 мл диметилформамида(ДМФ), 12 мл тетрагидрофурана (ТГФ), 0,7 г карбоната калия и 0,835 г метил 7 бромгептаноата. После выпаривания при пониженном давлении неочищенный продукт хроматографируют на кремнеземе, элюируя смесью метиленхлорид (CH2Cl2)/ацетон 95/5. Таким образом получают 1 г очищенного продукта в виде желтого масла. Rf CH2Cl2/ацетон 95/5:0,5. ИК (СНСl3) Стадия В. Метиловый сложный эфир 7-4 амино)иминометил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидробенз(е)азулен-8-ил) окси)гептановой кислоты. Взбалтывают в течение 48 ч при комнатной температуре суспензию 0,5 г продукта, полученного на стадии А, 5 мл этанола и 0,330 г хлоргидрата аминогуанидина, выпаривают растворитель при пониженном давлении и очищают неочищенный продукт хроматографией на кремнеземе, элюируя смесью СН 2 Сl2/метанол(МеОН)/гидроксид аммония 80/20/4. Таким образом получают 0,466 г очищенного продукта в виде белой пены. Стадия С. 7-4-Амино)иминометил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидробенз(е)азулен-8-ил)окси)гептановая кислота. Взбалтывают в течение 3 ч при комнатной температуре раствор, содержащий 0,44 г продукта, полученного на предыдущей стадии, 5 мл этанола и 2 мл гидроксида натрия 1N, затем нейтрализуют с помощью 2 мл соляной кислоты 1N. После выпаривания при пониженном давлении неочищенный продукт очищают хроматографией на кремнеземе, элюируя смесью 26 СН 2 Сl2/метанол (МеОН)/гидроксид аммония 80/20/4. Таким образом получают 0,192 г очищенного продукта, который кристаллизуют в метаноле.(Rf СН 2 Сl2/метанол (МеОН)/гидроксид аммония 80/20/4:0,17) ЯМР (D2O + 1 капля гидроксида натрия 1N)% найдено С 62,9 Н 7,5 N 12,1 Действуя таким же образом, как в примере 1 на стадиях А, В и С, но используя в качестве исходного продукта 2,3,5,6-тетрагидро-8 гидрокси-9,10-диметоксибенз[е]азулен-4(1 Н)-он(получение 3) с другими алкилирующими группами и группами G-NH2, получают следующие продукты формулы (I). Пример 2. 4-4-Амино)иминометил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидробенз(е)азулен-8-ил)окси)масляная кислота. Пример 3. 5-4-Амино)иминометил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидробенз(е)азулен-8-ил)окси)пентановая кислота. Пример 4. 5-4-Амино)карбонил)гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8 бенз(е)азуленил)окси)пентановая кислота. Пример 5. 6-4-Амино)иминометил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)гексановая кислота. Пример 6. 5-9,10-Диметокси-1,2,3,4,5,6 гексагидро-4-4,5-дигидро-1 Н-имидазол-2-ил) гидразоно)-8-бенз(е)азуленил)окси)пентановая кислота. Пример 7. 5-4-Амино)тиокарбонил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)пентановая кислота. Пример 8. 6-(4-4,5-Дигидро-1 Н-имидазол-2-ил)гидразоно)-9,10-диметокси-1,2,3,4,5,6 гексагидро-8-бенз(е)азуленил)окси)гексановая кислота. Пример 9. 5-4-Амино)иминометил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)-3,3-диметил-4-оксопентановая кислота. Пример 10. 5-(4-4,5-Дигидро-1 Н-имидазол-2-ил)гидразоно)-9,10-диметокси-1,2,3,4,5,6 гексагидро-8-бенз(е)азуленил)окси)-3,3-диметил-4-оксопентановая кислота. Пример 11. 4-(4-4,5-Дигидро-1 Н-имидазол-2-ил)гидразоно)-9,10-диметокси-1,2,3,4,5,6 27 Пример 15. Хлоргидрат 5-4-амино) иминометил)гидразоно)-9,10-диметокси 1,2,3,4,5,6-гексагидробенз(е)азулен-8-ил)окси) пентановой кислоты. Смешивают 86 мг продукта, полученного в примере 3, с 2 мл воды и 4 л соляной кислоты 0,1N, затем через несколько минут лиофилизуют среду. Получают 91 мг требуемой соли. Пример 16. 4-4-Амино)иминометил) гидразоно)-8,9-диметокси-1,2,3,4,5,6-гексагидро-10-бенз(е)азуленил)окси)масляная кислота. Пример 17. 5-4-Амино)иминометил) гидразоно)-8,9-диметокси-1,2,3,4,5,6-гексагидро-10-бенз(е)азуленил)окси)пентановая кислота. Действуют, как в примере 1 на стадиях А,В и С, но используют в качестве исходного продукта 2,3,5,6-тетрагидро-10-гидрокси-8,9-диметоксибенз[е]азулен-4(1 Н)-он (получение 2). гидро-9-бенз(е)азуленил)окси)пентановая кислота. Действуют, как в примере 1 на стадиях А,В и С, но используют в качестве исходного продукта 2,3,5,6-тетрагидро-9-гидрокси-8,10-диметоксибенз[е]азулен-4(1 Н)-он. Пример 20. 4-4-4,5-Дигидро-1 Н-имидазол-2-ил)гидразоно)-1,2,3,4,5,6-гексагидро-9 бенз(е)азуленил)окси)масляная кислота. Стадия А. Этиловый сложный эфир 4-(4 оксо)-1,2,3,4,5,6-гексагидробенз(е)азулен-9-ил) окси)масляной кислоты. Взбалтывают при комнатной температуре в течение ночи суспензию, содержащую 0,6 г 2,3,5,6-тетрагидро-9-гидроксибенз[е]азулен 4(1 Н)-она (получение 6), 12 мл диметилформамида (ДМФ), 12 мл тетрагидрофурана (ТГФ),0,7 г карбоната калия и 0,7 мл бромэтилбутирата. После выпаривания при пониженном давлении неочищенный продукт хроматографируют на кремнеземе, используя в качестве элюента смесь метиленхлорида (дихлорметан/ацетон 95/5). Таким образом получают 0,608 мг очищенного продукта в виде желтого масла. ИК (СНСl3) Стадия В. Этиловый сложный эфир 4-44,5-дигидро-1 Н-имидазолин-2-ил)гидразоно)1,2,3,4,5,6-гексагидробенз(е)азулен-9-ил)окси) масляной кислоты. Взбалтывают 24 ч при температуре кипения с обратным холодильником 608 мг продукта, полученного на стадии А, 10 мл бутанола и 600 мг бромгидрата следующего циклического аминогуанидина: (4,5-дигидро-1 Н-имидазолин 2-ил)гидразина, выпаривают растворитель при пониженном давлении и очищают неочищенный продукт хроматографией на кремнеземе, используя в качестве элюента смесь СН 2 Сl2/метанол (МеОН)/гидроксид аммония 80/20/4. Таким образом получают 0,604 г целевого продукта. ИК (СНСl3) Стадия С. 7-4,5-Дигидро-1 Н-имидазол-2 ил)гидразоно)-1,2,3,4,5,6-гексагидробенз(е) азулен-9-ил)окси)масляная кислота. Взбалтывают в течение 4 ч при комнатной температуре раствор, содержащий 0,604 г продукта, полученного на предыдущей стадии, 8 мл этанола, 5 мл тетрагидрофурана и 2 мл гидроксида натрия 2N, затем нейтрализуют с помощью 2 мл соляной кислоты. После выпаривания при пониженном давлении неочищенный продукт очищают хроматографией на кремнеземе,используя в качестве элюента смесь дихлорметан (CH2Cl2)/метанол (МеОН)/гидроксид аммония 80/20/4. Таким образом получают 0,298 г очищенного продукта, который кристаллизуют в метаноле. Rf (дихлорметан/метанол/гидроксид аммония 80/20/4):0,2 ЯМР (D2O + 1 капля гидроксида натрия 1N) Пример 21. 4-(4-4,5-Дигидро-1 Нимидазол-2-ил)гидразоно)-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)масляная кислота. Действуют, как в примере 20, но используют 0,856 г 2,3,5,6-тетрагидро-8-гидроксибенз[е]азулен-4(1 Н)-она (получение 7) и получают 0,299 г целевого продукта. Rf (дихлорметан/метанол/гидроксид аммония 80/20/4):0,27. Пример 22. 5-8-Амино)иминометил) гидразоно)-6,7,8,9,10,11-гексагидроазулено(5,6d)-1,3-бензодиоксол-4-ил)окси)пентановая кислота. Стадия А. Этиловый сложный эфир 5-4 оксо)-9,10-дигидрокси-1,2,3,4,5,6-гексагидробенз(е)азулен-9-ил)окси)пентановой кислоты. 1) защита В инертной атмосфере к раствору 10 г 2,3,5,6-тетрагидро-8,9,10-тригидроксибенз[е] азулен-4(1 Н)-она (получение 1) в 100 мл тетрагидрофурана добавляют 4,42 мл триметоксибората и 20,4 мл триэтиламина, поддерживая температуру от 37 до 39 С, затем взбалтывают при комнатной температуре в течение 3 ч. 2) алкилирование и снятие защиты Добавляют 9,7 мл бром-5-этилвалерата,100 мл диметилформамида и 8,4 г карбоната калия и взбалтывают 2 дня при 60 С. Затем реакционную смесь обрабатывают 120 мл воды и 50 мл концентрированной соляной кислоты 36N, взбалтывают в течение 1 ч, добавляют этилацетат, разделяют органические и водные фазы. Затем органическую фазу промывают,сушат и выпаривают при пониженном давлении. Получают неочищенный продукт, который очищают хроматографией на кремнеземе, используя в качестве элюента смесь циклогексан/этилацетат 70/30. Получают 5,2 г целевого чистого продукта.Rf (циклогексан/этилацетат 70/30)=0,23 Стадия В. Этиловый сложный эфир 5-8 оксо)-6,7,8,9,10,11-гексагидроазулено(5,6-d)-1,3 бензодиоксол-4-ил)окси)пентановой кислоты. В инертной атмосфере при 60 С в течение 1 ч смешивают 2,5 г продукта, полученного на предыдущей стадии, 17 мл диметилформамида,3,6 г CsF и 1,4 мл дибромметана. После фильтрации и прополаскивания метанолом выпаривают при пониженном давлении и очищают неочищенный продукт хроматографией на крем 31 неземе, используя в качестве элюента смесь циклогексан/этилацетат 85/15. Получают 1,73 г целевого чистого продукта. (Т.пл.=118 С) Rf(циклогексан/этилацетат 80/20)=0,25. Стадия С. Этиловый сложный эфир 5-8 амино)иминометил)гидразоно)-6,7,8,9,10,11 гексагидроазулено(5,6-d)-1,3-бензодиоксол-4 ил)окси)пентановой кислоты. Смешивают в течение 1 ночи при 120 С 551 мг продукта, полученного на предыдущей стадии, и 467 мг хлоргидрата аминогуанидина,затем очищают хроматографией, используя в качестве элюента смесь дихлорметан/ метанол/гидроксид аммония 80/20/4. Получают 174 мг целевого продукта. Rf (дихлорметан/метанол/гидроксид аммония 80/20/4)=0,98. Стадия D. 5-8-Амино)иминометил) гидразоно)-6,7,8,9,10,11-гексагидроазулено(5,6d)-1,3-бензодиоксол-4-ил)окси)пентановая кислота. Смешивают при комнатной температуре в течение 1 ч 30 мин 274 мг продукта, полученного на предыдущей стадии, и 1,86 мл гидроксида натрия 1N, затем нейтрализуют раствором соляной кислоты 1N и выпаривают при пониженном давлении. Неочищенный продукт очищают хроматографией, используя в качестве элюента смесь дихлорметан/метанол/гидроксид аммония 80/20/4. Получают 141 мг целевого продукта. Пример 23. 5-8-Амино)иминометил) гидразоно)-2,2-дифенил-6,7,8,9,10,11-гексагидроазулено(4,5-е)-1,3-бензодиоксол-4-ил)окси) пентановая кислота. Действуют, как в предыдущем примере, но используют 374 мг продукта, полученного на стадии А предыдущего примера и 0,19 мл дифенилдихлорметана. Получают 198 мг целевого продукта. Rf (дихлорметан/метанол/гидроксид аммония 80/20/4)=0,17. Пример 24. О-[4-[(4,5-дигидро-1 Н-имидазол-2-ил)гидразоно]-9,10-диметокси-1,2,3,4,5,6 гексагидро-8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин. Стадия А. Метиловый сложный эфир О[(4-оксо)-9,10-диметокси-1,2,3,4,5,6-гексагидро 8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерина. Взбалтывают в течение ночи при комнатной температуре 0,6 г 2,3,5,6-тетрагидро-8 гидрокси-9,10-диметоксибенз[е]азулен-4(1 Н) 002271 32 она (получение 3), 10 мл диметилформамида, 10 мл тетрагидрофурана, 1 г карбоната калия и 0,867 г метилового сложного эфира (DL)-4 бром-2-(фенилметоксикарбониламино) масляной кислоты, полученной согласно способу получения 8. После выпаривания при пониженном давлении неочищенный продукт очищают хроматографией на кремнеземе, используя в качестве элюента смесь метиленхлорид(СН 2 Сl2)/ацетон 95/5. Таким образом получают 1,166 г очищенного продукта в виде желтого масла. ИК (СНСl3) Стадия В. Метиловый сложный эфир О-[4[(4,5-дигидро-1 Н-имидазол-2-ил)гидразоно]9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е) азуленил]-N-[(фенилметокси)карбонил]-DLгомосерина. Взбалтывают 24 ч при 120 С 539 мг продукта стадии А, 15 мл бутанола и 600 мг бромгидрата следующего циклического аминогуанидина: (4,5-дигидро-1 Н-имидазол-2-ил)гидразина, выпаривают растворитель при пониженном давлении и очищают неочищенный продукт хроматографией на кремнеземе, используя в качестве элюента смесь СН 2 Сl2/метанол (МеОН)/гидроксид аммония 80/20/4. Таким образом получают 0,641 г целевого продукта. ИК (СНСl3) Стадия С. О-[4-[(4,5-дигидро-1 Н-имидазол-2-ил)гидразоно]-9,10-диметокси-1,2,3,4,5,6 гексагидро-8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин. Взбалтывают в течение 2 ч при комнатной температуре раствор, содержащий 0,6 г продукта, полученного на предыдущей стадии, 10 мл этанола и 2 мл гидроксида натрия 2N, затем нейтрализуют с помощью 2 мл соляной кислоты. После выпаривания при пониженном давлении неочищенный продукт очищают хроматографией на кремнеземе, используя в качестве элюента смесь СН 2 Сl2/метанол(МеОН)/гидроксид аммония 80/20/4. Таким образом получают 0,349 г очищенного продукта, который кристаллизуют в метаноле.Rf CH2Cl2/метанол (MeОН)/гидроксид аммония 80/20/4:0,37. Пример 25. О-[4-[(4,5-дигидро-1 Н-имидазол-2-ил)гидразоно]-1,2,3,4,5,6-гексагидро-8 бенз(е)азуленил]-N-[(фенилметокси)карбонил]DL-гомосерин. Действуют таким же образом, как в примере 24, но используют 0,428 г 2,3,5,6 тетрагидро-9-гидроксибенз[е]азулен-4(1 Н)-она(получение 7). Получают 245 мг целевого про 33 дукта. Rf СН 2 Сl2/метанол (МеОН)/гидроксид аммония 80/20/4:0,5. Пример 26. O-[4-[(1,2,3,4-тетрагидро-6 пиримидинил)гидразоно]-9,10-диметокси 1,2,3,4,5,6-гексагидро-8-бенз[е]азуленил]-N[(фенилметокси)карбонил]-DL-гомосерин. Стадия А. Монобромгидрат метилового сложного эфира О-[9,10-диметокси-1,2,3,4,5,6 гексагидро-4-[(1,4,5,6-тетрагидро-2-пиримидинил)гидразоно]-8-бенз[е]азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерина. Действуют, как в примере 24 на стадии В,но используя в качестве исходного 200 мг продукта, полученного, как в примере 24 на стадии А, в 2 мл бутанола и 74,5 мг монобромгидрата гидразона тетрагидро-2(1 Н)-пиримидинона и нагревают с обратным холодильником в течение 16 ч. Дают остыть до комнатной температуры,экстрагируют дихлорметаном, сушат, выпаривают растворитель при пониженном давлении и получают 152 мг целевого продукта. Стадия В. О-[4-[(1,2,3,4-тетрагидро-6 пиримидинил)гидразоно]-9,10-диметокси 1,2,3,4,5,6-гексагидро-8-бенз[е]азуленил]-N[(фенилметокси)карбонил]-DL-гомосерин. Действуют, как в примере 24 на стадии С,но используя 131 мг продукта, полученного на стадии А, в растворе 1,3 мл этанола и 0,43 мл гидроксида натрия N. Нейтрализуют добавлением соляной кислоты N, выпаривают растворитель, фильтруют, сушат 78 мг целевого продукта. Т.пл.=172 С. Спектр ЯМР (CDCl3) 34 Взбалтывают 30 мин при комнатной температуре, вводят 0,06 мл золкеталя и продолжают взбалтывание в течение 3,5 ч. Разбавляют реакционную среду водой, экстрагируют дихлорметаном и получают 0,6 г неочищенного продукта,который очищают хроматографией на кремнеземе (элюент: СН 2 Сl2 - МеОН 90-10). Получают 0,352 г целевого продукта. Спектр ИК (СНСl3) Стадия В. (2,3-Дигидроксипропиловый) сложный эфир O-(9,10-диметокси-1,2,3,4,5,6 гексагидро-4-[(1,4,5,6-тетрагидро-2-пиримидинил)гидразоно]-8-бенз(е)азуленил]-N[(фенилметокси)карбонил]-DL-гомосерина. Взбалтывают 6 ч при комнатной температуре 0,320 г продукта, полученного на стадии А,в 3 мл этанола и 1 мл соляной кислоты 2N. После выпаривания растворителей и хроматографии на кремнеземе (элюент: CH2Cl2-MeOHNH4OH 80-20-4), получают 0,112 г целевого продукта. Спектр ЯМР (CDCl3) Пример 28. O-[4-[(4,5-дигидро-1 Н-имидазол-2-ил)гидразоно]-9,10-диметокси 1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]-N-[(8 хинолинил)сульфонил]-DL-гомосерин. Стадия А. Метиловый сложный эфир О(9,10-диметокси-1,2,3,4,5,6-гексагидро-4-оксо-8 бенз(е)азуленил]-N-[(1,1-диметилэтокси)карбонил]-DL-гомосерина. Взбалтывают при комнатной температуре в течение 65 ч 4,1 г продукта, полученного как в способе получения 3, и 5 г сложного эфира, полученного как в способе получения 9, в 50 мл диметилформамида и 50 мл тетрагидрофурана в присутствии 5 г карбоната калия и диметиламинопиридина. Выпаривают растворитель при пониженном давлении, очищают остаток хроматографией на кремнеземе (элюент: СН 2 Сl2-ацетон 95-5) и-получают 7,3 г целевого продукта. Спектр ИК (СНСl3) Стадия В. Монохлоргидрат метилового эфира О-(9,10-диметокси-1,2,3,4,5,6-гексагидро 4-оксо-8-бенз(е)азуленил)-DL-гомосерина. Трижды добавляют 10 мл соляной кислоты в этилацетате, содержащем 6 г продукта, полученного на стадии А, в 10 мл этилацетата, затем взбалтывают 16 ч при комнатной температуре. Выпаривают растворитель при пониженном давлении и получают 0,656 г целевого продукта,который используют на следующей стадии. Стадия С. О-(9,10-диметокси-1,2,3,4,5,6 гексагидро-4-оксо-8-бенз(е)азуленил)-N-[(8 хинолинил)сульфонил]-DL-гомосерин. Поглощают 0,656 г продукта, полученного на стадии В, в 5 мл дихлорметана, добавляют 1 мл триэтиламина и 0,638 г 8-хлорсульфонилхинолина и взбалтывают 2 ч при комнатной температуре. После выпаривания растворителей при пониженном давлении и хроматографии на кремнеземе (элюент: СНСl3-МеОН 95-5) получают 0,956 г целевого продукта. Стадия D. Сложный метиловый эфир О-[4[(4,5-дигидро-1 Н-имидазол-2-ил)гидразоно]9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е) азуленил]-N-[(8-хинолинил)сульфонил]-DLгомосерина. Взбалтывают 16 ч при 120 С 0,9 г продукта стадии А, 5 мл бутанола и 0,6 г бромгидрата следующего циклического аминогуанидина:(4,5-дигидро-1 Н-имидазол-2-ил)гидразина, выпаривают растворитель при пониженном давлении и получают 0,786 г целевого продукта, который используют на следующей стадии. Стадия Е. O-[4-[(4,5-дигидро-1 Н-имидазол-2-ил)гидразоно]-9,10-диметокси-1,2,3,4,5,6 гексагидро-8-бенз(е)азуленил]-N-[(8-хинолинил)сульфонил]-DL-гомосерин. Взбалтывают в течение 2 ч при комнатной температуре раствор, содержащий 0,786 г продукта, полученного на предыдущей стадии, 5 мл метанола и 2 мл гидроксида натрия 2N, затем нейтрализуют с помощью 2 мл соляной кислоты 2N и взбалтывают в течение 10 мин. После выпаривания при пониженном давлении неочищенный продукт очищают хроматографией на кремнеземе, используя в качестве элюента смесь СН 2 Сl2-метанол-гидроксид аммония 80-20-4. Получают 0,438 г целевого продукта после кристаллизации в метаноле. Rf=0,40 (CH2Cl2MeOH-NH4OH 80-20-4). Спектр ЯМР (ДМСО) Пример 29. Монохлоргидрат О-[4-[(4,5 дигидро-1 Н-имидазол-2-ил)гидразоно]-9,10 диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]-N-3-[4-(3-пиридинил)-1 Н-имидазол-1 ил]пропокси]карбонил]-DL-гомосерина. Стадия А. 4-9,10-Диметокси-1,2,3,4,5,6 гексагидро-4-оксо-8-бенз(е)азуленил]окси]-2 изоцианатметилбутаноат. Взбалтывают 10 мин при 0 С 450 мг амина, полученного на стадии В примера 28, в 10,2 мл насыщенного водного раствора бикарбоната натрия и 10,2 мл дихлорметана. Добавляют в органическую фазу реакционной среды 204 мг трифосгена, растворенных в 2 мл дихлорметана,взбалтывают 10 мин, экстрагируют дихлорметаном, сушат, выпаривают растворитель при пониженном давлении и получают 430 мг целевого продукта, который используют на следующей стадии. Стадия В. О-[9,10-диметокси-1,2,3,4,5,6 гексагидро-4-оксо-8-бенз(е)азуленил]-N-3-[4(3-пиридинил)-1 Н-имидазол-1-ил]пропокси] карбонил]-DL-гомосерин. Охлаждают до 0 С 430 мг продукта, полученного на стадии А, в 20 мл дихлорметана и добавляют 414 мг спирта, полученного как в получении 10, в 10 мл дихлорметана. Дают температуре подняться до комнатной, поддерживают взбалтывание в течение 48 ч, выпаривают растворитель при пониженном давлении, хроматографируют остаток на глиноземе (элюент: СН 2 Сl2-МеОН) и получают 298 мг целевого продукта. Стадия С. Монобромгидрат О-[4-[(4,5 дигидро-1 Н-имидазол-2-ил)гидразоно]-9,10 диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е) азуленил]-N-3-[4-(3-пиридинил)-1 Н-имидазол 1-ил]пропокси]карбонил]-DL-гомосерина. Действуют, как в примере 24 на стадии В,используя 277 мг продукта, полученного на стадии В, и 164 мг бромгидрата циклического аминогуанидина в 13 мл бутанола. После хроматографии на глиноземе (элюент: CH2Cl2-MeOH 955) получают 289 мг целевого продукта. Спектр ИК (СНСl3) Стадия D. Монохлоргидрат О-[4-[(4,5 дигидро-1 Н-имидазол-2-ил)гидразоно]-9,10 диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]-N-3-[4-(3-пиридинил)-1 Н-имидазол-1 ил]пропокси]карбонил]-DL-гомосерина. 0,3 мл гидроксида натрия N добавляют к 277 мг продукта, полученного на стадии С, в 10 мл этанола, взбалтывают 30 мин, добавляют 10 мл воды, подкисляют реакционную среду до рН=2,5 с помощью соляной кислоты N, выпаривают растворители при пониженном давлении,хроматографируют остаток на кремнеземе (элюент: CH2Cl2-MeOH-NH4OH 40-10-2), выпаривают фильтрат при пониженном давлении, поглощают остаток в изопропиловом эфире, фильтруют осадок, сушат и получают 126 мг целевого продукта. Спектр ЯМР (ДМСО) Пример 30. 5-4-[4,5-Дигидро-4-оксо-1 Нимилазол-2-ил)гидразоно]-9,10-диметокси 1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]окси] пентановая кислота. Смешивают при комнатной температуре 300 мг продукта, полученного на стадии А примера 3, в 6 мл этанола с 61 мг бикарбоната натрия и 0,7 мл этилбромацетата. Выпаривают растворители, хроматографируют остаток на кремнеземе (элюент: СН 2 Сl2-МеОН 95-5) и получают 139 мг промежуточного сложного этилового эфира. Смешивают в течение 2 ч при комнатной температуре 110 мг этого эфира в 1 мл этанола в присутствии 0,5 мл гидроксида натрия 2N. После нейтрализации реакционной среды с помощью соляной кислоты 2N, фильтруют образовавшийся осадок, сушат и получают 44 мг целевого продукта. Спектр ЯМР (ДМСО) Пример 31. О-[9,10-диметокси-1,2,3,4,5,6 гексагидро-4-[(4,5,6,7-тетрагидро-1 Н-1,3-диазепин-2-ил)гидразоно]-8-бенз(е)азуленил]-N[(фенилметокси)карбонил]-DL-гомосерин. Смешивают в течение 16 ч при 130 С 1 г соединения, полученного в примере 24 на стадии А, в 5 мл бутанола и 0,9 г циклического аминогуанидина, полученного как в получении 11. Выпаривают растворитель при пониженном давлении, хроматографируют остаток на кремнеземе (элюент: CH2Cl2-MeOH 90-10) и получают 0,8 г промежуточного сложного эфира, который взбалтывают при комнатной температуре в течение 1,5 ч в 3 мл метанола с 2 мл гидроксида натрия 2N. После нейтрализации реакционной среды с помощью соляной кислоты 2N и выпаривания растворителей при пониженном давлении остаток хроматографируют на кремнеземе(элюент: CH2Cl2-MeOH-NH4OH 90-15-2) и получают 0,22 г целевого продукта. Пример 32. О-[9,10-диметокси-1,2,3,4,5,6 гексагидро-4-[(3 а,4,5,6,7,7 а-гексагадро-1 Н-бензимидазол-2-ил)гидразоно]-8-бензэ(е)азуленил]N-[(фенилметокси)карбонил]-DL-гомосерин. Действуют, как на стадиях В и С примера 24, используя 200 мг соединения, полученного в примере 24 на стадии А, и 176 мг циклического аминогуанидина, полученного как в способе получения 12. Получают 102 мг промежуточного сложного эфира, из которых 100 мг используют в реакции омыления. Получают 59 мг целевого продукта. Rf=0,24 (CH2Cl2-MeOHNH4OH 85-15-3). Фармацевтические композиции Готовят таблетки, соответствующие формуле Продукт примера 1 50 мг Эксципиент (тальк, крахмал,стеарат магния) достаточное количество для готовой таблетки 120 мг Фармакологические исследования продуктов изобретения 1. Исследование на продуктах изобретения перемещения связи: Витронектин/рецептор Витронектина (v3) Протокол: 96-луночные плашки MaxiSorp покрывают в течение ночи при 4 С витронектином человекаfraction 13: 281-292 (1988 с концентрацией 2 мкг/мл (разбавление покрывающим буфером). На следующий день лунки освобождают и лиганды (Витронектин) фиксируют (см. буфер 39 фиксации) в течение 1 ч при комнатной температуре при слабом взбалтывании. Лунки промывают шесть раз (см. промывочный буфер), затем добавляют на каждую лунку и в данном порядке- 40 мкл инкубационного буфера,- 10 мкл разведенного тестируемого продукта (продукты разводят в смеси 50/50 ДМСОН 2O),- 50 мкл рецептора v3 человека (см.(разведение в инкубационном буфере в зависимости от количества рецептора и от лиганда). Лиганд, рецептор v3 человека и исследуемые продукты инкубируют в течение 3 ч при комнатной температуре и слабом взбалтывании. Лунки опять промывают шесть раз, затем инкубируют в течение 2 ч при комнатной температуре и слабом взбалтывании в присутствии 100 мкл антител 4B12-HRP, антирецептор, связанный с пероксидазой (антитела 4B12-HRP разводят в инкубационном буфере. Разведение адаптировано к количеству рецептора). Затем лунки промывают шесть раз перед измерением связи лиганд-рецептор, которое проводят с помощью набора субстратов пероксидазы (ТМВ Microwell Peroxidase SubstrateSystem Kirkegaard: Ref. Cat. 50-76-00). Этот набор содержит флакон А с субстратом (3,3',5,5'-тетраметилбензидин 0,4 г/л) и флакон В (Н 2 О 2 с 0,02% буфером цитрат/лимонная кислота). Один объем А смешивают с одним объемом В, после чего реакционную среду вводят в количестве 100 мкл/лунка. Ферментативная реакция протекает в течение 12' для Витронектина/v3, затем ее останавливают добавлением 100 мкл 1 М фосфорной кислоты. Оптическая плотность 450 нм. Буферы:- 100 мM NaCl Выражение результатов Проводят следующую кривую: процент связывания витронектина человека в зависимости от логарифмического выражения концентрации каждого тестируемого продукта. Для каждого продукта устанавливают IC50 в соответствии со следующей формулой: 40 ВО - максимум связывания в отсутствие всех продуктов,Bmin - минимум связывания при наибольшей концентрации продукта. 2. Тест с черепным сводом мыши Принцип Инъекция меченой 45 Са (CaCl2) дозы беременным самкам мыши для изучения костной резорбции измерением высвобождения 45 Са из черепного свода новорожденных. Цель Определения активности молекулы в отношении костной резорбции, исследование exvivo. Продукты: 1) тестируемый продукт: носитель: ДМСО, H2O/BSA (0,1%) доза: изменяемая (10 мкМ при скрининге). 2) контрольные продукты: Эхистатин (Н-9010-ВАСНЕМ) Носитель: H2O/BSA Доза: 10 мкМ. 3) радиоактивная метка: 45 Са в виде водного раствора CaCl2 ( CES3a) Получение меченого раствора: 190 мкл маточного раствора кальция 2b) Инъекция: на 17-й день вынашивания мыши получают 400 мкл этого раствора внутривенно, т.е. 25 мкCi/мышь. 2) Иссечение ткани (черепной свод (кальвариум Через 6 дней после рождения новорожденные мыши обезглавливаются, кожа на голове надрезается от затылка до лба. Черепной свод вырезают ножницами, и с помощью резака две строго одинаковые половинки свода (левую и правую) секционируют по теменным костям. Одна служит контрольным материалом, вторую используют для тестирования исследуемого продукта. 3) Фаза "полоскания" Каждую половинку свода помещают в лунку 24-луночной плашки, содержащей 1 мл среды, на подставку из полиэтилена и нейлекса толщиной 100 мкм, чтобы избежать контакта с дном лунки. Через 24 ч полиэтиленовые подставки с кальвариумами помещают в новые 24-луночные плашки, содержащие 1 мл свежей среды и тес 41 тируемые продукты или их растворы. Отбирают 200 мкл среды из каждой лунки первых плашек и проводят первый подсчет радиоактивности(значение А). Эта смена среды позволяет избежать механического стресса, связанного с взятием проб. 4) Фаза "резорбции" Через 48 ч после установления контакта между тканями и исследуемыми продуктами из каждой лунки отбирают 200 мкл среды и проводят подсчет (значение В) таким образом, чтобы определить количество 45 Са, высвободившегося в среду во время т.н. фазы резорбции. Затем кальвариум полностью деминерализуют в 1 мл трихлоруксусной кислоты (5%),после чего отбирают 200 мкл и проводят подсчет количества кальция, оставшегося в кости(значение С). Выражение результатов Подсчитывают % костной резорбции для каждого полукальвариума (каждая лунка) следующим образом: Сумма dpm (A+B+C) соответствует количеству 45 Са, включенного в каждую кость на день взятия материала. Для измерения эффекта, оказываемого продуктом, проводят для каждого пункта расчет отношения костной резорбции в материале обработанной лунки к материалу соответствующей контрольной лунки. Рассчитанная величина, называемая индексом резорбции, составляет от 0 до 1, если продукт ингибирует костную резорбцию, и 1, если продукт ей способствует. Рассчитывают среднее от 6 индексов (поскольку имеется 6 пунктов/группа) каждого продукта, в результате чего получается индекс/продукт. Если вычесть этот индекс из величины 1, получают ингибирующую способность продукта,которую можно выразить в процентах. С другой стороны, статистический тест проводили по методу Стьюдента, сравнивая по пунктам индивидуальные показатели резорбции. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I)-NHSO2Rc, где Rc обозначает радикал фенил(C1 С 4)алкил-, хинолинил или пиридинилимидазолил(C1-С 4)алкил-,R2 и R3, одинаковые или разные, обозначают атом водорода, радикал гидроксил, радикал C1-С 6 алкокси или R2 и R3 образуют вместе группу -O-(C1-С 3-алкилен)-O- или -O-C(Ph)2-O,G обозначает радикал -NH-C-(=X)-NH2, в котором Х обозначает S, О или NH, или радикал-NH-Het', где Het' обозначает имидазол, возможно замещенный группой оксо, пиримидин,диазепин или бензимидазол формул где р равно 2, 3 или 4,пунктирные линии представляют собой возможную вторую связь, а также соли присоединения с кислотами и основаниями и сложные эфиры,R1, R2 и R3 могут находиться в положении 8, 9 или 10 трицикла. 2. Соединения общей формулы (I) по п.1,соответствующие общей формуле (I') Тест на конкурирующее связывание Vn/VR (v3) Черепной свод мышей % ингибирования при 10 мкМ 19 7,5 8 7 12 14 18 11 26 30 39 в которой R' обозначает группу -О-[А']-[В]COR6, где [А'] обозначает двухвалентную группу C1-С 6 алкилен, а [В] и R6 имеют значения,указанные в п.1, G имеет значение, указанное в п.1, R'2 и R'3 обозначают атом водорода или метоксирадикал; пунктирные линии представляют собой возможную вторую связь, а также соли присоединения с кислотами и основаниями и сложные эфиры. 3. Соединения общей формулы (I) по п.1 или 2, в которой R6 представляет собой группу-ОН, -ОСН 3, -ОСН 2 СН 3, -О(СН 2)-СН(ОН) 43 СН 2 ОН, а также соли присоединения с кислотами и основаниями и сложные эфиры. 4. Соединения общей формулы (I) по пп.1,2 или 3, в которой R1 представляет собой группу-O-СН(Z)-СООН, а также соли присоединения с кислотами и основаниями и сложные эфиры. 5. Соединения общей формулы (I) по пп.14, в которой (Z) является группой -NH-CO2-Rc,где Rc имеет значения по п.1, а также соли присоединения с кислотами и основаниями и сложные эфиры. 6. Соединения общей формулы (I) по одному из пп.1-5, отличающейся тем, что G является группой NH-(Het'), причем (Het') имеет значения, указанные в п.1. 7. Соединения общей формулы (I) по п.6, в которой G означает следующие гетероциклы: где р является целым числом, равным 2, 3 или 4,а также соли присоединения с кислотами и основаниями и сложные эфиры. 8. Соединения общей формулы (I) по п.6 или 7, в которой G является группой при этом р является целым числом, равным 2, 3 или 4, а также соли присоединения с кислотами и основаниями и сложные эфиры. 9. Соединения формулы (I), как она определена в п.1, со следующими названиями:(е)азуленил)окси)-3,3-диметил-4-оксопентановая кислота,-5-4-4,5-дигидро-1 Н-имидазол-2-ил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)-3,3-диметил-4 оксопентановая кислота,-хлоргидрат 5-4-аминоиминометил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)пентановой кислоты,-4-4-4,5-дигидро-1 Н-имидазол-2-ил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)масляная кислота,-5-8-аминоиминометил)гидразоно)6,7,8,9,10,11-гексагидроазулено(5,6-d)-1,3 бензодиоксол-4-ил)окси)пентановая кислота,-5-8-аминоиминометил)гидразоно)-2,2 дифенил-6,7,8,9,10,11-гексагидроазулено(4,5-е)(1,3)-бензодиоксол-4-ил)окси)пентановая кислота,-4-9,10-диметокси-4-1,4,5,6-тетрагидро 2-пиримидинил)гидразоно)-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)масляная кислота,-2-4-4,5-дигидро-1 Н-имидазол-2-ил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)этановая кислота,-3-4-4,5-дигидро-1 Н-имидазол-2-ил) гидразоно)-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил)окси)пропановая кислота,-4-4-4,5-дигидро-1 Н-имидазол-2-ил) гидразоно)-1,2,3,4,5,6-гексагидро-8-бенз(е) азуленил)окси)масляная кислота,-О-[4-[(4,5-дигидро-1 Н-имидазол-2-ил) гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз[е]азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин,-О-[4-[(4,5-дигидро-1 Н-имидазол-2-ил) гидразоно]-1,2,3,4,5,6-гексагидро-8-бенз[е]азуленил]-N-[(фенилметокси)карбонил]-DLгомосерин,-О-[4-[(1,2,3,4-тетрагидро-6-пиримидинил) гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагид 45 ро-8-бенз[е]азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин,-(2,3-дигидроксипропиловый) сложный эфир О-(9,10-диметокси-1,2,3,4,5,6-гексагидро 4-1,4,5,6-тетрагидро-2-пиримидинил)гидразоно]-8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерина,-О-[4-[(4,5-дигидро-1 Н-имидазол-2-ил) гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]-N-[(8-хинолинил)сульфонил]-DL-гомосерин,-монохлоргидрат О-[4-[(4,5-дигидро-1 Нимидазол-2-ил)гидразоно]-9,10-диметокси 1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]-N-3[4-(3-пиридинил)-1 Н-имидазол-1-ил]пропокси] карбонил]-DL-гомосерина,-5-4-[(4,5-дигидро-4-оксо-1 Н-имидазол-2 ил)гидразоно]-9,10-диметокси-1,2,3,4,5,6-гексагидро-8-бенз(е)азуленил]окси]пентановая кислота,-О-[9,10-диметокси-1,2,3,4,5,6-гексагидро 4-[(4,5,6,7-тетрагидро-1 Н-1,3-диазепин-2-ил) гидразоно]-8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин,-О-[9,10-диметокси-1,2,3,4,5,6-гексагидро 4-[(3 а,4,5, 6,7,7 а-гексагидро-1 Н-бензимидазол-2 ил)гидразоно]-8-бенз(е)азуленил]-N-[(фенилметокси)карбонил]-DL-гомосерин. 10. Способ получения соединений формулы (I), определенной в п.1, отличающийся тем,что соединение формулы (II) в которой R2 и R3 имеют значения, определенные в п.1, за исключением гидроксила, подвергают или действию соединения формулы (F1) в присутствии основания Наl-[А]-[В]-СОR6(F1) или действию соединения формулы (F'1) в присутствии фосфина и диэтилазодикарбоксилата ОН-[А]-[В]-СОR6(F'1) в которых Hal является атомом галогена, [А],[В] и R6 имеют значения, указанные выше, причем [В] может также представлять собой группу где Р является защитной группой аминофункции, чтобы получить соединение формулы (IIIa) полученное соединение формулы (IIIa) подвергают действию соединения формулы (F3) 46 в которой G имеет значения, указанные в п.1,чтобы получить соединения формулы (IVa),соответствующие некоторым продуктам формулы (I) которые подвергают при необходимости в соответствующем порядке одной или нескольким из следующих реакций:- действию основания или кислоты для расщепления сложного эфира и получения соответствующей кислоты,- действию агента восстановления, способного восстановить, полностью или частично,ненасыщенные связи,- действию дезалкилирующего реактива,- действию агента снятия защитной группы с функции NH-P в бета-положении к COR6, если[В] представляет собой группу CH-NHP,- реакции образования группы NH-SO2Rc,NH-CO2Rc из соответствующего амина в бетаположении к COR6 для получения соответствующих соединений формулы (I), которые в случае необходимости подвергают действию кислоты или основания, чтобы получить соответствующие соли, или действию агента образования сложных эфиров, чтобы получить соответствующие сложные эфиры. 11. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (II) предварительно подвергают действию соединения формулы (F3) для получения соединения формулы (IIIс) которое затем, после возможной защиты группыG, подвергают действию соединения формулы(F1), (F'1) затем, в случае необходимости, - реакции снятия защитной группы с G для получения соответствующего соединения формулы(IVa), которое затем подвергают, в случае необходимости, различным реакциям, указанным в п.10, при этом соединения формул (II), (F1),(F'1), (F3), (IVa) такие, как определено в п.10. 12. Способ получения продуктов формулы(Alk) имеет значения, указанные в п.1, подвергают действию агента галогенирования для получения соответствующего галогенидацила,(ii) который подвергают действию реактива формулы (b)(iii), (iv) и (v), чтобы получить продукт формулы(IIG), соответствующий целевому двузамещенному продукту формулы (II) 14. Способ получения соединений общей формулы (II), определенной в п.10 и в которойR2 и R3 представляют собой группу OAlk, причем ОН находится в положении 9, отличающийся тем, что соединение формулы (IIА) в которой R(I) и R(II), одинаковые или разные,представляют собой алкил, включающий от 1 до 6 атомов углерода, или R(I) и R(II), вместе с атомом азота, с которым они связаны, представляют собой гетероцикл с 5 или 6 звеньями, насыщенный или ненасыщенный, который может содержать другой гетероатом, выбранный из О и N, чтобы получить соединение формулы (с) подвергают действию дезалкилирующего реактива, чтобы получить соединение формулы (IIB)(iii) которое подвергают действию агента галогенирования, чтобы получить соединение формулы (d) которое подвергают или действию реактива защиты диолов в основной среде, чтобы избирательно получить продукт формулы (IIС) в которой Hal1 представляет собой атом галогена,(iv) которое подвергают действию кислоты Льюиса, чтобы получить соединение формулы в которой Р представляет собой остаток реактива защиты диолов, который последовательно подвергают действию реактива защиты фенола,реактива снятия защиты диолов, агента алкилирования, затем агента снятия защиты фенола,чтобы получить соединение формулы (IID), соответствующее тризамещенному с ОН в положении 8 продукту формулы (II)(v) которое подвергают действию дезалкилирующего реактива, чтобы получить продукт формулы (IIF), соответствующий целевому монозамещенному продукту формулы (II) 13. Способ получения соединений общей формулы (II), определенной в п.10 и в которойR2 является группой OAlk, a R3 является атомом водорода, ОН и R2 находятся в положении 8, 9 или 10, отличающийся тем, что соединение общей формулы (а') в которой R2 и O-(Alk) находятся в положении мета- или пара- к алкилкарбоксильной группе,подвергают последовательно реакциям (i), (ii), или последовательному действию агента защиты фенола, агента алкилирования, затем агента снятия защиты, чтобы получить соединение формулы (IIЕ), соответствующее тризамещенному с ОН в положении 9 продукту формулы 15. Применение соединений формулы (I),описанных в одном из пп.1-9, а также их фармацевтически приемлемых солей присоединения и сложных эфиров в качестве медикамента. 16. Применение соединения формулы (I) по п.9 в качестве медикамента. 17. Фармацевтические композиции, содержащие в качестве действующего начала, по меньшей мере, один из медикаментов, определенных в п.15 или 16. 18. Соединения общих формул (IIIa), (IIIc) и (II), описанные в одном из пп.10-14, за исключением соединения формулы (IIс) и соединений
МПК / Метки
МПК: A61K 31/19, C07C 281/12, C07D 233/52, A61P 9/10
Метки: способе,их, этом, интегринов, применение, частности, используемые, качестве, интегрина, получения, промежуточные, трициклические, активностью, медикаментов, альфаvбета, содержащие, фармацевтические, соединения, обладающие, композиции, отношении, способ
Код ссылки
<a href="https://eas.patents.su/26-2271-triciklicheskie-soedineniya-obladayushhie-aktivnostyu-v-otnoshenii-integrinov-v-chastnosti-v-otnoshenii-integrina-alfavbeta-3-sposob-ih-polucheniya-i-promezhutochnye-soedineniya-is.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические соединения, обладающие активностью в отношении интегринов, в частности, в отношении интегрина альфаvбета 3, способ их получения и промежуточные соединения, используемые в этом способе,их применение в качестве медикаментов и содержащие их фармацевтические композиции.</a>
Предыдущий патент: Производные 6-фенилпиридил-2-амина
Следующий патент: Производные замешенных индазолов, их применение в качестве ингибиторов фосфодиэстеразы (фдэ) типа iv и продукции фактора некроза опухолей (фно)
Случайный патент: Способ для повышения отношения сигнала к шуму сейсмических данных путём использования частотно - зависимого ослабления шума истинных относительных амплитуд












