Производные 1-(-d-гликопиранозил)-3-(4-циклопропилфенилметил)-4-галогеноиндола и их применение в качестве ингибиторов sglt
Формула / Реферат
1. Производные 1-(β-D-гликопиранозил)-3-(4-циклопропилфенилметил)-4-галогеноиндола формулы (I) или его фармацевтически приемлемая соль
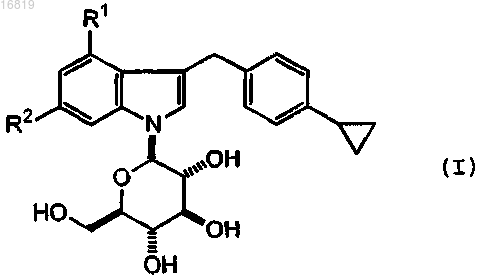
где R1 представляет собой фтор или хлор и R2 представляет собой водород или фтор.
2. Соединение по п.1, где R1 представляет собой фтор и R2 представляет собой водород, или R1 представляет собой хлор и R2 представляет собой водород, или оба R1 и R2 представляют собой фтор.
3. Соединение по п.1, где R2 представляет собой водород.
4. Соединение по п.1, где соединение выбрано из группы, состоящей из
4-хлор-3-(4-циклопропилфенилметил)-1-(β-D-глюкопиранозил)индола,
3-(4-циклопропилфенилметил)-4-фтор-1-(β-D-глюкопиранозил)индола,
4-хлор-3-(4-циклопропилфенилметил)-6-фтор-1-(β-D-глюкопиранозил)индола и
3-(4-циклопропилфенилметил)-4,6-дифтор-1-(β-D-глюкопиранозил)индола
или их фармацевтически приемлемой соли.
5. Фармацевтическая композиция для лечения, профилактики или замедления прогрессирования или возникновения нарушений, выбранных из сахарного диабета, диабетической ретинопатии, диабетической невропатии, диабетической нефропатии, замедленного заживления ран, устойчивости к инсулину, гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот в крови, повышенных уровней глицерина в крови, гиперлипидемии, ожирения, гипертриглицеридемии, синдрома X, осложнений диабета, атеросклероза и гипертензии.
6. Применение соединения по п.1 для изготовления лекарственного средства для применения в лечении нарушений, выбранных из сахарного диабета, диабетической ретинопатии, диабетической невропатии, диабетической нефропатии, замедленного заживления ран, устойчивости к инсулину, гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот в крови, повышенных уровней глицерина в крови, гиперлипидемии, ожирения, гипертриглицеридемии, синдрома X, осложнений диабета, атеросклероза и гипертензии.
7. Способ лечения или замедления прогрессирования или возникновения сахарного диабета, диабетической ретинопатии, диабетической невропатии, диабетической нефропатии, замедленного заживления ран, устойчивости к инсулину, гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот в крови, повышенных уровней глицерина в крови, гиперлипидемии, ожирения, гипертриглицеридемии, синдрома X, осложнений диабета, атеросклероза или гипертензии, который включает введение виду млекопитающего, нуждающемуся в лечении, терапевтически эффективного количества соединения, указанного в п.1.
8. Способ лечения сахарного диабета 1 типа или 2 типа, который включает введение виду млекопитающего, нуждающемуся в лечении, терапевтически эффективного количества соединения, указанного в п.1, отдельно или в сочетании с другим антидиабетическим средством, средством для лечения осложнений диабета, средством против ожирения, антигипертензивного средства, антитромбоцитарного средства, средства против атеросклероза и/или гиполипидемического средства.
9. Способ получения соединения формулы
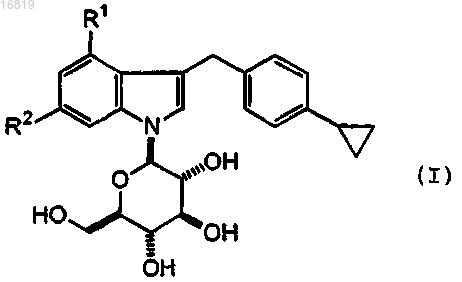
где R1 представляет собой фтор или хлор и R2 представляет собой водород, или фтор, или его фармацевтически приемлемой соли, который включает удаление защитной группы в соединении формулы (II)
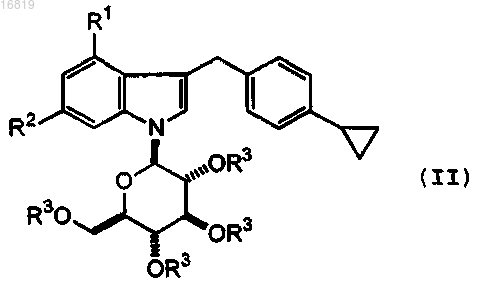
где R3 представляет собой защитную группу для гидроксильной группы, и другие символы являются такими же, как определено выше, с последующим, если желательно, превращением полученного соединения в его фармацевтически приемлемую соль.
10. Соединение формулы (II)
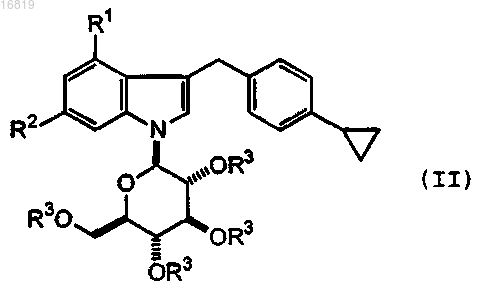
где R1 представляет собой фтор или хлор, R2 представляет собой водород или фтор и R3 представляет собой защитную группу для гидроксигруппы, или его соль.
Текст
Предложены новые производные индола формулы (I) или их фармацевтически приемлемая соль, где R1 представляет собой фтор или хлор и R2 представляет собой водород или фтор, которые представляют собой ингибиторы SGLT и пригодны для лечения или профилактики диабета и сходных состояний.(71)(73) Заявитель и патентовладелец: МИЦУБИСИ ТАНАБЕ ФАРМА КОРПОРЕЙШН (JP) 016819 Уровень техники Настоящее изобретение относится к новым производным индола, обладающим активностью в качестве ингибиторов натрийзависимых транспортеров глюкозы (SGLT), находящихся в кишечнике и почке. Уровень техники Лечение диетой и лечение физическими упражнениями являются основными при лечении сахарного диабета. Когда эти способы лечения не контролируют в достаточной степени состояние пациентов,используют инсулин или противодиабетические средства. Примеры противодиабетических средств включают в настоящее время бигуаниды, сульфонилмочевины, повышающие чувствительность к инсулину средства и ингибиторы -глюкозидазы. Однако эти противодиабетические средства обладают различными побочными эффектами. Например, бигуаниды вызывают молочный ацидоз, сульфонилмочевины вызывают значительную гипогликемию, повышающие чувствительность к инсулину средства вызывают отек и сердечную недостаточность, и ингибиторы -глюкозидазы вызывают вздутие живота и диарею. В этих обстоятельствах существует потребность в новых противодиабетических лекарственных средствах, которые устраняют эти побочные эффекты. Недавно было описано, что гипергликемия принимает участие в возникновении и прогрессировании сахарного диабета. Эту теорию называют теорией токсичности глюкозы. То есть хроническая гипергликемия приводит к снижению секреции инсулина и чувствительности к инсулину, уровень глюкозы в плазме повышается, и в результате происходит самоусиление сахарного диабета [для сравнения, Diabetologia, vol. 28, p. 119 (1985); Diabetes Care, vol. 13, p. 610 (1990) и т.д.]. Исходя из этой теории ожидается,что нормализация уровня глюкозы в плазме остановит упомянутый выше цикл самоусиления и может быть достигнута профилактика или лечение сахарного диабета. Считается, что одним способом лечения гипергликемии является экскреция избыточного количества глюкозы непосредственно в мочу так, чтобы концентрация глюкозы в крови могла нормализоваться. Например, посредством ингибирования натрийзависимых транспортеров глюкозы, находящихся в проксимальном извитом канальце почки, всасывание глюкозы в почке ингибируется, посредством чего может быть обеспечена экскреция глюкозы в мочу и уровень глюкозы в крови может быть снижен. В действительности подтверждено, что посредством непрерывного подкожного введения ингибитора SGLT,флоризина, в диабетических моделях на животных уровень глюкозы в их крови может быть нормализован и что посредством поддержания уровня глюкозы в крови в норме в течение длительного времени можно повышать секрецию инсулина и устойчивость к инсулину [для сравнения Journal of Clinical Investigation, vol. 79, p. 1510 (1987); ниже vol. 80, p. 1037 (1987); ниже vol. 87, p. 561 (1991) и т.д.]. Кроме того, посредством лечения в моделях на диабетических животных ингибитором SGLT в течение длительного времени ответ в виде секреции инсулина и чувствительности к инсулину у модельных животных повышается без возникновения каких-либо неблагоприятных действий на почку или на нарушение баланса уровней электролитов в крови, и в результате предотвращается возникновение и прогрессирование диабетической нефропатии и диабетической невропатии [для сравнения Journal of MedicinalChemistry, vol. 42, p. 5311 (1999); British Journal of Pharmacology, vol. 132, p. 578 (2001) и т.д.]. Ввиду указанного выше, ожидают, что ингибиторы SGLT повысят секрецию инсулина и устойчивость к инсулину посредством снижения уровня глюкозы в крови у диабетических пациентов и будут предотвращать возникновение и прогрессирование сахарного диабета и осложнений диабета. В WO 2006/035796 описаны ND-гликопиранозильные азотсодержащие гетеробициклические соединения следующей формулы: Указанные выше соединения описаны в качестве ингибиторов SGLT1 и/или SGLT2 и пригодны для профилактики или лечения диабета и сходных заболеваний. Описание изобретения Настоящее изобретение относится к новым производным индола формулы (I) или к их фармацевтически приемлемой соли-1 016819 где R1 представляет собой фтор или хлор и R2 представляет собой водород или фтор. Соединения формулы (I) обладают активностью в качестве ингибиторов SGLT, находящегося в кишечнике и почке млекопитающих, и пригодны для лечения или профилактики сахарного диабета и осложнений диабета, таких как диабетическая ретинопатия, диабетическая невропатия, диабетическая нефропатия, замедленное заживление ран и сходные заболевания. Фармацевтически приемлемые соли соединений формулы (I) включают, например, соль с неорганической кислотой, такой как хлористо-водородная кислота, бромисто-водородная кислота, йодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.д., или соль с органической кислотой, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота,малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, виннокаменная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота и т.д., или соль с кислой аминокислотой, такой как аспарагиновая кислота, глутаминовая кислота и т.д. Кроме того, фармацевтически приемлемые соли соединений формулы (I) включают их внутримолекулярную соль, гидрат, сольват или полиморф. В предпочтительном варианте осуществления настоящего изобретения R2 представляет собой водород. В качестве группы индола предпочтительным является 4-фториндол (т.е. R1 представляет собой фтор и R2 представляет собой водород), 4-хлориндол (т.е. R1 представляет собой хлор и R2 представляет собой водород) или 4,6-дифториндол (т.е. как R1, так и R2 представляют собой фтор). Предпочтительное соединение по настоящему изобретению выбрано из группы 4-хлор-3-(4-циклопропилфенилметил)-1-(-D-глюкопиранозил)индол,3-(4-циклопропилфенилметил)-4-фтор-1-(-D-глюкопиранозил)индол,4-хлор-3-(4-циклопропилфенилметил)-6-фтор-1-(-D-глюкопиранозил)индол и 3-(4-циклопропилфенилметил)-4,6-дифтор-1-(-D-глюкопиранозил)индол или их фармацевтически приемлемая соль. Характерным признаком настоящих соединений является сочетание п-циклопропилфенилметильной группы в 3 положении индольного кольца и атома галогена (в частности, фтора или хлора) в 4 положении. Соединения по настоящему изобретению обладают активностью в качестве ингибиторов натрийзависимых транспортеров глюкозы и показывают превосходный эффект снижения уровня глюкозы в крови. Соединения по настоящему изобретению также демонстрируют благоприятные характеристики в отношении побочных эффектов и/или коммерческой целесообразности. Ожидается, что соединения по настоящему изобретению будут пригодны для лечения, профилактики или замедления прогрессирования или возникновения сахарного диабета (сахарного диабета 1 типа и 2 типа и т.д.), осложнений диабета (таких как диабетическая ретинопатия, диабетическая невропатия,диабетическая нефропатия), гипергликемии после приема пищи, замедленного заживления ран, устойчивости к инсулину, гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот в крови,повышенных уровней глицерина в крови, гиперлипидемии, ожирения, гипертриглицеридемии, синдромаX, атеросклероза или гипертензии. Соединения по настоящему изобретению или их фармацевтически приемлемую соль можно вводить либо перорально, либо парентерально и их можно применять в форме пригодного фармацевтического препарата. Пригодные фармацевтические препараты для перорального введения включают, например, твердые препараты, такие как таблетки, гранулы, капсулы и порошки, или препараты в виде растворов, препараты в виде суспензий, препараты в виде эмульсий и т.п. Пригодные фармацевтические препараты для парентерального введения включают, например, суппозитории; препараты для инъекции или препараты для капельного внутривенного вливания, с использованием дистиллированной воды для инъекций, физиологического раствора или водного раствора глюкозы и ингаляционные препараты. Фармацевтические композиции, представленные в настоящем документе, будут содержать на дозированную единицу, например таблетку, капсулу, порошок, инъекцию, суппозиторий, форму для приема с помощью чайной ложки и т.п., от приблизительно 0,01 до приблизительно 100 мг/кг массы тела (предпочтительно от приблизительно 0,01 до приблизительно 50 мг/кг и более предпочтительно от приблизительно 0,01 до приблизительно 30 мг/кг) активного ингредиента, и их можно вводить в дозировке от приблизительно 0,01 до приблизительно 100 мг/кг/сутки (предпочтительно от приблизительно 0,01 до приблизительно 50 мг/кг/сутки и более предпочтительно от приблизительно 0,01 до приблизительно 30 мг/кг/сутки). Способ лечения нарушения, описанный в настоящем изобретении, также можно проводить с использованием фармацевтической композиции, содержащей любые из соединений, как определено в настоящем документе, и фармацевтически приемлемый носитель. Дозированная форма будет содержать от приблизительно 0,01 до приблизительно 100 мг/кг (предпочтительно от приблизительно 0,01 до приблизительно 50 мг/кг и более предпочтительно от приблизительно 0,01 до приблизительно 30 мг/кг) активного ингредиента, и она может представлять собой любую форму, пригодную для выбранного спосо-2 016819 ба введения. Однако дозировки могут варьировать в зависимости от способов введения, потребностей субъектов, тяжести состояния, подлежащего лечению, и используемого соединения. Можно применять либо суточное введение, либо последующее периодическое дозирование. Соединения формулы (I) можно применять, если необходимо, в сочетании с одним или несколькими противодиабетическими средствами, антигипергликемическими средствами и/или средствами для лечения других заболеваний. Настоящие соединения и эти другие средства можно вводить в одной дозированной форме или в отдельной пероральной дозированной форме, или посредством инъекции. Примеры других противодиабетических средств и антигипергликемических средств включают инсулин, средства, усиливающие секрецию инсулина, средства, повышающие чувствительность к инсулину, или другие противодиабетические средства, обладающие механизмом действия, отличающимся от ингибирования SGLT. Конкретно, примерами этих средств являются бигуаниды, сульфонилмочевины,ингибиторы -глюкозидазы, агонисты PPAR (например, соединения тиазолидиндиона), двойные агонисты PPAR/, агонисты PPARpan, ингибиторы дипептидилпептидазы IV (DPP4), митиглинид, натеглинид, репаглинид, инсулин, агонисты глюкагонподобного пептида-1 (GLP-1) и его рецептора, ингибиторы РТР 1 В, ингибиторы гликогенфосфорилазы, модуляторы RXR, ингибиторы глюкозо-6-фосфатазы, агонисты/антагонисты GPR40, агонисты GPR119, агонисты GPR120, активаторы глюкокиназы (GK) и ингибиторы фруктозо-1,6-бисфосфатазы (FBPase). Примеры средств для лечения других заболеваний включают средства против ожирения, антигипертензивные средства, антитромбоцитарные средства, антиатеросклеротические средства и гиполипидемические средства. Средства против ожирения, которые необязательно можно использовать в сочетании с соединением по настоящему изобретению, включают 3-адренергические агонисты, ингибиторы липазы, ингибиторы повторного захвата серотонина (и дофамина), лекарственные средства на основе тиреоидного гормона-,аноректические вещества, антагонисты NPY, аналоги лептина, агонисты МС 4 и антагонисты СВ 1. Антитромбоцитарные средства, которые необязательно можно использовать в сочетании с соединением по настоящему изобретению, включают абциксимаб, тиклопидин, эптифибатид, дипиридамол, аспирин, анагрелид, тирофибан и клопидогрел. Антигипертензивные средства, которые необязательно можно использовать в сочетании с соединением по настоящему изобретению, включают ингибиторы АСЕ, антагонисты кальция, -блокаторы, диуретики, средства с центральным действием, антагонисты ангиотензина-II, -блокаторы, ингибиторы ренина и ингибиторы вазопептидазы. Гиполипидемические средства, которые необязательно можно использовать в сочетании с соединением по настоящему изобретению, включают ингибиторы МТР, ингибиторы HMG-CoA-редуктазы, ингибиторы синтетазы сквалена, ингибиторы эпоксидазы сквалена, производные фибриновой кислоты, ингибиторы АСАТ, ингибиторы липоксигеназы, ингибиторы всасывания холестерина, ингибиторы контранспортера Na+/желчных кислот подвздошной кишки, средства, повышающие активность рецептораLDL, средства, усиливающие секрецию желчных кислот, никотиновую кислоту и ее производные, ингибиторы СЕТР и средства, активирующие ABC Al. Соединения формулы (I) можно применять в сочетании со средствами для лечения осложнений диабета, если необходимо. Эти средства включают, например, ингибиторы PKC, ингибиторы альдозоредуктазы и/или ингибиторы АСЕ. Различные средства, описанные выше, можно использовать в такой же дозированной форме, что и соединения формулы (I), или в отличающихся дозированных формах, в дозировках и схемах, как, в общем, известно в данной области. Дозировка этих средств может варьировать в соответствии, например, с возрастом, массой тела, состоянием пациентов, способами введения и дозированными формами. Эти фармацевтические композиции можно вводить перорально видам млекопитающих, включая людей, обезьян и собак, в дозированной форме, например таблеток, капсул, гранул или порошка, или вводить парентерально в форме инъекционного препарата или интраназально, или в форме чрескожного пластыря. Соединения формулы (I) по настоящему изобретению или их фармацевтически приемлемую соль можно получать удалением защитных групп из соединений формулы (II) где R3 представляет собой защитную группу для гидроксигруппы, и другие символы являются такими,-3 016819 как определено выше, с последующим превращением полученного соединения в фармацевтически приемлемую соль, если желательно. Полагают, что соединения формулы (II) являются новыми и формируют следующий аспект этого изобретения. В соединениях формулы (II) защитная группа для гидроксигруппы может быть выбрана из общепринятых защитных групп для гидроксигруппы, и примеры такой защитной группы включают бензил,алканоил, такой как ацетил, и алкилсилил, такой как триметилсилил, триэтилсилил и третбутилдиметилсилил. Кроме того, защитная группа для гидроксигруппы может образовывать ацеталь или силилацеталь совместно с соседними гидроксигруппами. Примеры такой защитной группы включают группу алкилидена, такую как изопропилиден и вторбутилиден, группу бензилидена и группу диалкилсилилена, такую как группа дитретбутилсилилена. Предпочтительно R3 представляет собой алканоил, такой как ацетил. Удаление защитной группы можно проводить в соответствии с типами защитных групп, подлежащих удалению, и для удаления защитной группы можно использовать общепринятые способы, такие как восстановление, гидролиз, обработка кислотой и обработка фторидом. Например, когда удалению подлежит бензильная группа, удаление защитной группы можно проводить посредством (1) каталитического восстановления с использованием палладиевого катализатора (например, палладий-углерод и гидроксид палладия) в атмосфере водорода в пригодном инертном растворителе (например, метаноле, этиловом спирте и этилацетате); (2) обработки дезалкилирующим средством, таким как трибромид бора, трихлорид бора, комплекс трихлорид бора-диметилсульфид или йодтриметилсилан в инертном растворителе (например, дихлорметане); или (3) обработки алкилтиолом, таким как этантиол, в присутствии кислоты Льюиса (например, комплекса трифторида бора-диэтиловый эфир) в пригодном инертном растворителе (например, дихлорметане). Когда защитную группу удаляют гидролизом, гидролиз можно проводить обработкой соединений формулы (II) основанием (например, гидроксидом натрия, гидроксидом калия, гидроксидом лития, метоксидом натрия и этоксидом натрия) в пригодном инертном растворителе (например, тетрагидрофуране, диоксане, метаноле, этиловом спирте и воде). Обработку кислотой можно проводить посредством обработки соединений формулы (II) кислотой(например, хлористо-водородной кислотой, п-толуолсульфоновой кислотой, метансульфоновой кислотой и трифторуксусной кислотой) в пригодном растворителе (например, метаноле и этиловом спирте). В случае обработки фторидом ее можно проводить посредством обработки соединений формулы(II) фторидом (например, фтористо-водородной кислотой, фтористо-водородной кислотой-пиридином,фторидом тетрабутиламмония и т.д.) в пригодном инертном растворителе (например, в уксусной кислоте, спиртах (метанол, этиловый спирт и т.д.), ацетонитриле и тетрагидрофуране). Реакцию удаления защитной группы предпочтительно можно проводить при пониженной, окружающей или повышенной температуре, например от 0 до 50 С, более предпочтительно от 0 С до комнатной температуры. Соединения по настоящему изобретению, полученные таким образом, можно выделять и очищать общепринятым способом, хорошо известным в органической синтетической химии, таким как перекристаллизация, колоночная хроматография, тонкослойная хроматография и т.п. Соединения формулы (II) можно получать в соответствии со стадиями, описанными в схеме 1 или схеме 2. В ходе любого из процессов получения соединений по настоящему изобретению может быть необходимой и/или желательной защита чувствительных или реакционноспособных групп на любой из указанных молекул. Этого можно достигать с помощью общепринятых защитных групп. Для общего описания защитных групп и их применения см. Т.W. Greene et al., "Protecting groups in Organic Synthesis", JohnWileySons, New York, 1999. Защитные группы можно удалять при последующей стадии с использованием способов, известных специалистам в данной области. Схема 1(В указанной выше схеме, символы являются такими же, как определено выше). Стадия 1. Соединения формулы (IV) можно получать формилированием соединений формулы (V) посредством реагента Вильсмейера или ,-дихлорметилметилового эфира/тетрахлорида титана. Реагент Вильсмейера можно получать общепринятым способом, хорошо известным в данной области, например, из диметилформамида или N-метилформанилида/оксихлорида фосфора, тионилхлорида или оксалилхлорида. Реакцию, как правило, проводят в пригодном растворителе, таком как диметилформамид или дихлорэтан при окружающей или повышенной температуре, например от 25 до 80 С. Стадия 2. Соединения формулы (III) можно получать присоединением к соединению формулы (IV) ArLi,ArMgBr, ArZnBr, Ar(Me)2LiZn или ArB(OH)2, где Ar представляет собой следующую формулу: Реакцию присоединения к соединениям (IV) ArLi, ArMgBr, ArZnBr или Ar(Me)2LiZn можно, главным образом, проводить в пригодном растворителе, являющимся инертным органическим растворителем, таким как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан при окружающей или пониженной температуре, например при от -78 до 25 С. Реакцию присоединения к соединениям (IV) ArB(ОН)2 можно, главным образом, проводить в присутствии катализатора, такого как (ацетилацетонато)дикарбонилродия(I) или димер гидроксил(1,5-циклооктадиен)родия(I), и лиганда, такого как 1,1'бис(дифенилфосфино)ферроцен или тритретбутилфосфин, в пригодном растворителе, являющемся инертным растворителем, таким как тетрагидрофуран, диметоксиэтан и 1,4-диоксан, при окружающей или повышенной температуре, например от 25 до 100 С. Стадия 3. Соединения формулы (II) можно получать восстановлением соединений формулы (III). Восстановление соединений (III) можно проводить посредством обработки силановым реагентом или боргидридом в присутствии кислоты в пригодном растворителе или без растворителя. Примеры кислоты включают кислоту Льюиса, такую как комплекс трифторид бора-диэтиловый эфир и тетрахлорид титана, и сильную органическую кислоту, такую как трифторуксусная кислота и метансульфоновая кислота. Примеры силановых реагентов включают триалкилсиланы, такие как триэтилсилан, триизопропилсилан. Примеры боргидридов включают боргидрид натрия и триацетоксиборгидрид натрия. Растворитель можно выбирать из любого растворителя, который не препятствует реакции, и примеры растворителя включают ацетонитрил, галогеноалканы (например, дихлорметан, хлороформ и дихлорэтан) и смесь этих растворителей. Восстановление можно проводить при пониженной температуре или температуре окружающей среды, например от -30 до 25 С. Схема 2(В указанной выше схеме R4 представляет собой бром или йод, и другие символы являются такими же, как определено выше). Стадия 1. Соединения формулы (VIII) можно получать конденсацией соединений формулы (V) с R4-C6H4COCl, где R4 является таким же, как определено выше. Конденсацию можно проводить в соответствии с ацилированием Фриделя-Крафтса, хорошо известным в данной области, в пригодном растворителе в присутствии кислоты Льюиса. Примеры кислоты Льюиса включают хлорид алюминия, комплекс трифторид бора-диэтиловый эфир, хлорид олова(IV) и тетрахлорид титана. Растворитель можно выбирать из любого растворителя, который не препятствует реакции ФриделяКрафтса, и примеры растворителя включают галогеноалканы, такие как дихлорметан, хлороформ, тетрахлорметан и дихлорэтан. Реакцию можно проводить при пониженной, окружающей или повышенной температуре, например от -30 до 60 С. Стадия 2. Соединения формулы (VII) можно получать восстановлением соединений формулы (VIII). Восстановление можно проводить посредством обработки соединения (VIII) восстановителем в пригодном растворителе. Примеры восстановителя включают боргидриды (например, боргидрид натрия с гептагидратом хлорида церия (III) или без него, триацетоксиборгидрид натрия) и гидриды алюминия (например, алюмогидрид лития и диизобутилалюмогидрид). Растворитель можно выбирать из любого растворителя, который не препятствует реакции, и примеры растворителя включают простые эфиры (например, тетрагидрофуран, диэтиловый эфир, диметоксиэтан и диоксан), спирты (например, метанол, этиловый спирт и 2-пропанол) и смесь этих растворителей. Реакцию восстановления можно проводить при пониженной или окружающей температуре, например от -30 до 25 С. Стадия 3. Соединения формулы (VI) можно получать восстановлением соединений формулы (VII). Восстановление соединений (VII) можно проводить в соответствии со схемой 1, стадия 3. Стадия 4. Соединения формулы (II) можно получать посредством присоединения к соединениям формулы(VI) циклопропил-В(ОН)2. Реакцию присоединения можно проводить традиционным способом присоединения арилов, например способом присоединения Сузуки (для информации см. Suzuki et al., Synth. Commun. 11:513 (1981);al., Tetrahedron Lett. 43:6987-6990 (2002) и Molander et al., J. Org. Chem. 68:4302-4314 (2003. Реакцию присоединения можно проводить в присутствии катализатора Pd и основания с лигандом или без него и добавкой в пригодном растворителе. Примерами катализатора Pd являются тетракис(трифенилфосфин)палладий(0), ацетат палладия(II),бис(ацетонитрил)дихлорпалладий(II),дихлорбис(трифенилфосфин)палладий(II),комплекс[1,1'бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном, аддукт трис(дибензилиденацетон) дипалладий(0)-хлороформ. Примеры основания включают карбонаты щелочных металлов (например,карбонат калия, карбонат натрия и бикарбонат натрия), фосфаты щелочных металлов (например, трехос-6 016819 новный фосфат калия, фосфат натрия и гидрофосфат натрия), органические основания (например, N,Nдиизопропилэтиламин) и фториды щелочных металлов (например, фторид цезия и фторид калия). Примеры лиганда включают трициклогексилфосфин и три(о-толил)фосфин. Примеры добавки включают йодид меди(I). Растворитель можно выбирать из любого растворителя, который не препятствует реакции присоединения, и примерами растворителя являются ароматические углеводороды (например, бензол и толуол),простые эфиры (например, тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан), амиды (например, диметилформамид, диметилацетамид, 1,3-диметил-2-имидазолидинон и N-метилпирролидон), спирты (метанол, этиловый спирт и 2-пропанол), вода и смесь этих растворителей. Реакцию присоединения можно проводить при окружающей или повышенной температуре, например от 25 до 150 С, предпочтительно от 80 до 150 С. Исходные соединения формулы (V) можно получать в соответствии со следующей схемой:(В указанной выше схеме символы являются такими же, как определено выше). Стадия 1. Соединения формулы (XI) можно получать посредством конденсации соединений формулы (XII) сD-глюкозой. Реакцию конденсации, главным образом, проводят в пригодном растворителе, таком как ацетонитрил, вода и спирты (например, метанол, этиловый спирт и 1-пропанол) с катализаторами, такими как хлорид аммония и уксусная кислота, или без них, при окружающей или повышенной температуре. Стадия 2. Соединения формулы (IX) можно получать посредством окисления соединений формулы (XI). Реакцию окисления, главным образом, проводят в присутствии окислителя, такого как палладий на активированном угле, тетрахлор-1,4-бензохинон (хлоранил), 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ) или соль этиленбис(салицилимин)кобальта(II), в пригодном растворителе, таком как простые эфиры (например, диэтиловый эфир, тетрагидрофуран и 1,4-диоксан), галогеноалканы (например, дихлорметан, хлороформ и 1,2-дихлорэтан), вода и смесь из этих растворителей, при окружающей или пониженной температуре. Стадия 3. Соединения формулы (V) можно получать посредством защиты гидроксигрупп соединений формулы (IX). Защитную группу для гидроксигрупп можно выбирать из групп, обычно используемых в качестве защитных групп для гидроксигруппы. Примеры защитной группы для гидроксигруппы включают ал-7 016819 каноильную группу (например, ацетил), арилалкильную группу (например, бензил, толил и анизил), алкилсилильную группу (например, триметилсилил, третбутилдиметилсилил и триэтилсилил). Защиту можно проводить общепринятыми способами, хорошо известными специалистам в данной области. Для общего описания защитных групп и их применения см. T.W. Greene et al., "Protecting Groups in OrganicSynthesis", John WileySons, New York, 1999. Стадия 4. Соединения формулы (X) можно получать посредством защиты гидроксигрупп соединений формулы (XI) в соответствии со стадией 3. Стадия 5. Соединения формулы (V) также можно получать посредством окисления соединений формулы (X) в соответствии со стадией 2. Соединения формулы (XII) можно получать в соответствии со следующей схемой:(В указанной выше схеме R5 представляет собой алкил, и другие символы являются такими, как определено выше). Стадия 1. Соединения формулы (XV) можно получать посредством циклизации соединений формулы (XVI). Реакцию циклизации можно проводить в соответствии с синтезом индола Фишера, хорошо известным в данной области (для сравнения: Chem. Rev., 63, 373, 1963). Эту реакцию, главным образом, проводят в пригодном растворителе, таком как спирты (например, метанол и этиловый спирт) и углеводороды (например, толуол, нитробензол), или без растворителя с кислотой, такой как кислота Льюиса (например,хлорид цинка), неорганическая кислота (например, хлористо-водородная кислота и полифосфорная кислота) и органическая кислота (например, уксусная кислота и трифторуксусная кислота), при повышенной температуре. Стадия 2. Соединения формулы (XIV) можно получать посредством гидролиза соединений формулы (XV). Реакцию гидролиза, главным образом, можно проводить в пригодном растворителе, таком как вода,спирты (например, метанол и этиловый спирт) и простые эфиры (например, диоксан и тетрагидрофуран),с основанием, таким как гидроксиды щелочных металлов (например, гидроксид лития, гидроксид калия и гидроксид натрия), при пониженной, окружающей или повышенной температуре. Стадия 3. Соединения формулы (XIII) можно получать посредством декарбоксилирования соединений формулы (XIV). Декарбоксилирование, главным образом, можно проводить в пригодном растворителе, таком как хинолин, с катализатором, таким как медь, при повышенной температуре. Стадия 4. Соединения формулы (XII) можно получать посредством восстановления соединений формулы(XIII). Реакцию восстановления, главным образом, можно проводить в пригодном растворителе, таком как ацетонитрил, галогеноалканы (например, дихлорметан и дихлорэтан) и простые эфиры (например,диэтиловый эфир, тетрагидрофуран и диоксан), с восстановителем, таким как триэтилсилан, боргидрид цинка, комплекс боран-триметиламин, комплекс боран-морфолин и цианоборгидрид натрия, в присутствии кислоты, включающей кислоту Льюиса, такую как трифторуксусная кислота, комплекс трифторид бора-диэтиловый эфир, хлористо-водородную кислоту и уксусную кислоту, при окружающей или повышенной температуре. Соединения формулы (XVI) можно получать посредством конденсации соединений формулы-8 016819 где символы являются такими же, как определено выше, с CH3COCO2R5, где R5 является таким, как определено выше. Реакцию конденсации, главным образом, можно проводить в пригодном растворителе,таком как ацетонитрил, галогеноалканы (например, дихлорметан и хлороформ) и простые эфиры (например, диоксан), вода и спирты (например, метанол, этиловый спирт и 1-пропанол), с основанием (например, ацетатом натрия и ацетатом калия) или кислотой (например, хлористо-водородной кислотой и уксусной кислотой), или без них, при окружающей или повышенной температуре. Альтернативно соединения формулы (XVI) можно получать посредством (1) проведения реакции соединений формулы (XVIII) где символы являются такими, как определено выше, с нитритом натрия в присутствии кислоты, такой как хлористо-водородная кислота, в пригодном растворителе, таком как вода и спирты (например, метанол и этиловый спирт), при окружающей или пониженной температуре, с получением соответствующей соли арилдиазония, и (2) конденсации соли арилдиазония с СН 3 СОСН (СН 3)CO2R5, где R5 является таким, как определено выше, в присутствии основания, такого как ацетат натрия, гидроксид калия, в пригодном растворителе, таком как вода и спирты (например, метанол и этиловый спирт), при пониженной или окружающей температуре. Другие исходные соединения коммерчески доступны или их можно легко получать общепринятыми способами, хорошо известными специалистам в данной области. В дальнейшем в настоящем документе настоящее изобретение будет проиллюстрировано посредством примеров и справочных примеров, но настоящее изобретение не следует истолковывать, как ограничивающееся ими. Примеры Пример 1. 3-(4-Циклопропилфенилметил)-4-фтор-1-(-D-глюкопиранозил)индол(1) Смесь 4-фториндолина (185 мг) и D-глюкозы (267 мг) в H2O (0,74 мл) - этиловом спирте (9 мл) кипятили с обратным холодильником в атмосфере аргона в течение 24 ч. Растворитель выпаривали при пониженном давлении с получением неочищенного 4-фтор-1-(-D-глюкопиранозил)индолина, который использовали в последующей стадии без дальнейшей очистки.(2) Указанное выше соединение суспендировали в хлороформе (8 мл) и к нему последовательно добавляли пиридин (0,873 мл), уксусный ангидрид (1,02 мл) и 4-(диметиламино)пиридин (каталитическое количество). После перемешивания при комнатной температуре в течение 21 ч растворитель реакционной смеси выпаривали при пониженном давлении. Осадок растворяли в этилацетате и раствор промывали 10% водным раствором сульфата меди(II) и насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом магния. Нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении. Осадок очищали колоночной хроматографией с силикагелем (гексан:этилацетат = 90:10 - 60:40) с получением 4-фтор-1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)индолина (365 мг) в виде бесцветного аморфного вещества.(3) Указанное выше соединение (348 мг) растворяли в 1,4-диоксане (14 мл) и к нему добавляли 2,3 дихлор-5,6-дициано-1,4-бензохинон (306 мг). После перемешивания при комнатной температуре в течение 33 ч к нему добавляли насыщенный водный раствор гидрокарбоната натрия (20 мл) и органический растворитель выпаривали при пониженном давлении. Осадок экстрагировали два раза этилацетатом и объединенный органический слой промывали рассолом, сушили над сульфатом магния и обрабатывали активированным углем. Нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении. Осадок очищали колоночной хроматографией с силикагелем (гексан:этилацетат = 90:10 - 60:40) и перекристаллизацией из этилового спирта с получением 4-фтор-1-(2,3,4,6-тетра-OацетилD-глюкопиранозил)индола (313 мг) в виде бесцветных кристаллов, mp 132-135C.(4) Указанное выше соединение (3,50 г) и N,N-диметилформамид (3,49 мл) растворяли в 1,2 дихлорэтане (70 мл) и к нему капельно добавляли оксихлорид фосфора (III) (2,10 мл). Смесь перемешивали при 70 С в течение 1 ч и к ней добавляли воду (100 мл) при 0 С. Полученную смесь экстрагировали этилацетатом (200 мл) два раза и объединенный органический слой промывали рассолом (40 мл) и сушили над сульфатом магния. Нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении. Осадок очищали колоночной хроматографией с силикагелем (гексан:этилацетат = 90:10 - 50:50) и перекристаллизацией из этилового спирта (20 мл) с получением 4-фтор-1-(2,3,4,6-тетраО-ацетилD-глюкопиранозил)индол-3-карбоксальдегида (2,93 г) в виде бесцветных кристаллов, mp 190-192 С.(5) К смеси магниевой стружки (664 мг) и 1,2-дибромэтана (одна капля) в тетрагидрофуране (40 мл) капельно добавляли раствор 1-бром-4-циклопропилбензола (см. WO 96/07657) (5,21 г) в тетрагидрофуране (12 мл) в течение 25 мин при энергичном перемешивании и смесь энергично перемешивали в течение 30 мин при комнатной температуре. Затем полученную смесь капельно добавляли к раствору указанного выше 4-фтор-1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)индол-3-карбоксальдегида (4,35 г) в тетрагидрофуране (130 мл) в течение 15 мин при -78 С в атмосфере аргона. Смесь перемешивали при той же температуре в течение 30 мин и к ней добавляли насыщенный водный раствор хлорида аммония (200 мл). Полученную смесь экстрагировали этилацетатом (150 мл) два раза и объединенный органический слой сушили над сульфатом магния. Нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении с получением неочищенного 4-циклопропилфенил-4-фтор-1-(2,3,4,6-тетра-ОацетилD-глюкопиранозил)индол-3-илметанола, который использовали в последующей стадии без дальнейшей очистки.(6) К перемешанному раствору указанного выше соединения и триэтилсилана (2,11 мл) в дихлорметане (44 мл) - ацетонитриле (87 мл) добавляли комплекс трифторид бора-диэтиловый эфир (1,34 мл) при 0 С в атмосфере аргона. Смесь перемешивали при той же температуре в течение 20 мин и к ней добавляли насыщенный водный раствор гидрокарбоната натрия (200 мл). Органический растворитель выпаривали при пониженном давлении и осадок экстрагировали этилацетатом (150 мл) два раза. После высушивания над сульфатом магния нерастворимые материалы отфильтровывали и фильтрат выпаривали при пониженном давлении. Осадок очищали колоночной хроматографией с силикагелем (гексан:этилацетат = 90:10 - 50:50) и растиранием с этиловым спиртом (40 мл) с получением 3-(4-циклопропилфенилметил)-4 фтор-1-(2,3,4,6-тетра-О-ацетилD-глюкопиранозил)индола (4,71 г) в виде бесцветных кристаллов, mp 190-192 С.(7) Указанное выше соединение (4,67 г) растворяли в метаноле (47 мл) - тетрагидрофуране (93 мл) и к нему добавляли метоксид натрия (28% раствор в метаноле, 1 капля). После перемешивания при комнатной температуре в течение 1 ч растворитель реакционной смеси выпаривали при пониженном давлении. Осадок очищали колоночной хроматографией с силикагелем (хлороформ:метанол = 99:1 - 90:10) с получением указанного в заголовке соединения, 3-(4-циклопропилфенилметил)-4-фтор-1-(-Dглюкопиранозил)индола (3,23 г) в виде бесцветной пены. Эту пену кристаллизовывали из этилового спирта - Н 2 О с получением гемигидрата указанного в заголовке соединения в виде бесцветных кристаллов, mp 110-112 С.(с, 1 Н), 7,35 (д, J=8,3 Гц, 1 Н). Аналитический вычисленный состав для C24H26FNO50,5H2O: С, 66,04; Н, 6,23; F, 4,35; N, 3,21. Вы- 10016819 явленный: С, 65,62; Н, 6,27; F, 4,32; N, 3,11. Пример 2. 4-Хлор-3-(4-циклопропилфенилметил)-1-(-D-глюкопиранозил)индол(1) Смесь 4-хлориндолина (2,88 г) и D-глюкозы (3,38 г) в этиловом спирте (150 мл) - H2O (10 мл) кипятили с обратным холодильником в атмосфере аргона в течение ночи. Растворитель выпаривали при пониженном давлении и осадок очищали колоночной хроматографией с силикагелем (хлороформ:метанол = 100:0 - 88:12) с получением 4-хлор-1-(-D-глюкопиранозил)индолина (3,35 г) в виде бесцветной пены.(2) Указанное выше соединение (3,3 г) растворяли в 1,4-диоксане (150 мл) и к нему добавляли 2,3 дихлор-5,6-дициано-1,4-бензохинон (2,85 г). Смесь перемешивали при комнатной температуре в течение 12 ч. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия (300 мл) и смесь экстрагировали этилацетатом 3 раза. Объединенный органический слой промывали насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом магния. Нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении. Осадок очищали колоночной хроматографией с силикагелем (хлороформ:метанол = 100:0 - 86:14) с получением 4-хлор-1-(-Dглюкопиранозил)индола (2,01 г) в виде светло-коричневых кристаллов.(3) Указанное выше соединение (2,01 г) суспендировали в дихлорметане (100 мл) и к нему последовательно добавляли уксусный ангидрид (4,24 мл), N,N-диизопропилэтиламин (7,8 мл) и 4(диметиламино)пиридин (78 мг). После перемешивания при комнатной температуре в течение 30 мин смесь промывали последовательно водным раствором лимонной кислоты, водой и насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над сульфатом магния. Нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении. Осадок очищали кристаллизацией из диэтилового эфира - гексана с получением 4-хлор-1-(2,3,4,6-тетра-О-ацетилDглюкопиранозил)индола (2,94 г) в виде бесцветных кристаллов.(4) Указанное выше соединение обрабатывали способом, сходным с примером 1-(4), с получением 4-хлор-1-(2,3,4,6-тетра-O-ацетилD-глюкопиранозил)индол-3-карбоксальдегида в виде бесцветного порошка.(5) Указанное выше соединение и 1-бром-4-циклопропилбензол (см. WO 96/07657) обрабатывали способом, сходным с примером 1-(5), с получением неочищенного 4-хлор-1-(2,3,4,6-тетра-О-ацетилDглюкопиранозил)индол-3-ил-4-циклопропилфенилметанола, который использовали в последующей стадии без дальнейшей очистки.(6) Указанное выше соединение обрабатывали способом, сходным с примером 1-(6), с получением 4-хлор-3-(4-циклопропилфенилметил)-1-(2,3,4,6-тетра-О-ацетилD-глюкопиранозил)индола в виде бесцветного твердого вещества.(7) Указанное выше соединение обрабатывали способом, сходным с примером 1-(7), с получением указанного в заголовке соединения, 4-хлор-3-(4-циклопропилфенилметил)-1-(-D-глюкопиранозил)индола в виде бесцветного порошка. Указанное в заголовке соединение получали в виде бесцветной пены способом, сходным с примером 1, из 4,6-дифториндолина. Указанное в заголовке соединение получали в виде бесцветной пены способом, сходным с примером 1, из 4-хлор-6-фториндолина.H-ЯМР (ДМСО-d6)0,59-0,62 (м, 2 Н), 0,88-0,91 (м, 2 Н), 1,83-1,87 (м, 1 Н), 3,21-3,50 (м, 4 Н), 3,573,63 (м, 1 Н), 3,65-3,71 (м, 1 Н), 4,18 (с, 2 Н), 4,54 (т, J=5,5 Гц, 1 Н), 5,10 (д, J=5,3 Гц, 1 Н), 5,16 (д, J=5,0 Гц,1 Н), 5,23 (д, J=5,8 Гц, 1 Н), 5,38 (д, J=9,0 Гц, 1 Н), 6,97 (д, J=8,2 Гц, 2 Н), 7,01 (дд, J=9,4, 2,0 Гц, 1 Н), 7,08 (д,J=8,0 Гц, 2 Н), 7,22 (с, 1 Н), 7,47 (дд, J=10,1, 2,1 Гц, 1 Н). Справочный пример 1. 4-Фториндолин. К перемешанной суспензии боргидрида натрия (560 мг) в диэтиловом эфире (6 мл) капельно добавляли хлорид цинка (1,0 М раствор в диэтиловом эфире, 7,4 мл). Смесь перемешивали при комнатной температуре в атмосфере аргона в течение 1 суток. К полученной смеси капельно добавляли раствор 4 фториндола (500 мг) в диэтиловом эфире (5 мл). После перемешивания при комнатной температуре в атмосфере аргона в течение 12 суток к нему добавляли холодный 0,5 Н. водный раствор хлористоводородной кислоты (30 мл) при 0 С. После этого смесь подщелачивали холодным 2 Н. водным раствором гидроксида натрия при 0 С и экстрагировали этилацетатом 3 раза. Объединенный органический слой сушили над сульфатом магния и нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении. Осадок очищали колоночной хроматографией с силикагелем (гексан:этилацетат = 100:0 - 80:20) с получением указанного в заголовке соединения (351 мг) в виде светложелтого масла.APCI-Mass m/Z 138 (М+Н). 1 Н-ЯМР (ДМСО-d6)2,93 (т, J=8,6 Гц, 2 Н), 3,46 (т, J=8,6 Гц, 2 Н), 5,78 (ушир.с, 1 Н), 6,24-6,31 (м,2 Н), 6,87-6, 94 (м, 1 Н). Справочный пример 2. 4-Хлориндолин. Раствор 4-хлориндола (3,15 г) и триэтилсилана (8,30 мл) в трифторуксусной кислоте (32 мл) перемешивали при 50 С в течение 30 мин. Растворитель выпаривали при пониженном давлении и осадок подщелачивали насыщенным водным раствором гидрокарбоната натрия. Смесь экстрагировали два раза этилацетатом и объединенный органический слой сушили над сульфатом магния. Нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении.- 12016819 Осадок очищали колоночной хроматографией с силикагелем (гексан:этилацетат = 100:0 - 80:20) с получением указанного в заголовке соединения (2,89 г) в виде бесцветного масла.(1) Смесь гидрохлорида 3,5-дифторфенилгидразина (5,0 г) и этилпирувата (4,6 мл) в этиловом спирте (25 мл) кипятили с обратным холодильником в течение 1 ч и растворитель выпаривали при пониженном давлении. Остаточное твердое вещество растирали с гексаном с получением этил-2-(3,5 дифторфенилгидразино)пропионата (4,65 г) в виде бесцветных кристаллов, mp 139-141C.(2) Суспензию указанного выше соединения (4,65 г) в толуоле (47 мл) добавляли к полифосфорной кислоте (23 г) и смесь кипятили с обратным холодильником в течение 3 ч в атмосфере аргона. После охлаждения до комнатной температуры к ней добавляли воду и этилацетат и полученную смесь перемешивали при комнатной температуре. Нерастворимые вещества отфильтровывали и фильтрат отделяли. Водный слой экстрагировали этилацетатом и объединенный органический слой промывали последовательно водой, насыщенным водным раствором гидрокарбоната натрия и рассолом. После высушивания над сульфатом магния и обработки активированным углем нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении. Остаточное твердое вещество растирали со смесью диизопропиловый эфир - гексан (1:1) с получением этил 4,6-дифториндол-2-карбоксилата (3,48 г) в виде светло-желтых кристаллов, mp 153-154C.(3) Смесь указанного выше соединения (3,48 г) в 4 Н. водном растворе гидроксида натрия (7,73 мл) и этиловом спирте (35 мл) кипятили с обратным холодильником в течение 15 мин и органический растворитель выпаривали при пониженном давлении. К нему добавляли воду и смесь промывали этиловым эфиром, а затем подкисляли 6 Н. водным раствором хлористо-водородной кислоты. Полученную смесь экстрагировали этилацетатом и органический слой промывали рассолом, сушили над сульфатом магния и обрабатывали активированным углем. Нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении с получением неочищенной 4,6-дифториндол-2-карбоновой кислоты(4) Смесь указанного выше соединения (3,0 г) и порошка меди (2,9 г) в хинолине (30 мл) перемешивали при 200 С в течение 5 ч в атмосфере аргона. После охлаждения до комнатной температуры нерастворимые вещества отфильтровывали и промывали этилацетатом (100 мл). Фильтрат промывали 6 Н. водным раствором хлористо-водородной кислоты два раза и рассолом. Каждый водный слой экстрагировали этилацетатом и объединенный органический слой сушили над сульфатом магния и обрабатывали активированным углем. Нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении. Остаточное масло очищали колоночной хроматографией с силикагелем (гексан:этилацетат = 10:1 - 6:1) с получением 4,6-дифториндол (2,60 г) в виде светло-желтого масла.(5) Указанное выше соединение (2,33 г) растворяли в 1,4-диоксане (30,4 мл) и к нему добавляли морфолин-боран (6,15 г) и 36% водный раствор хлористо-водородной кислоты (2,64 мл) при комнатной температуре. Смесь кипятили с обратным холодильником в течение 2 ч, а затем охлаждали до комнатной температуры. К ней добавляли 6 Н. водный раствор хлористо-водородной кислоты (12,2 мл) и полученную смесь кипятили с обратным холодильником в течение 15 мин. Смесь подщелачивали 10% водным раствором гидроксида натрия при 0 С и к ней добавляли воду и экстрагировали два раза этилацетатом. Объединенный органический слой промывали рассолом и сушили над сульфатом магния. Нерастворимые вещества отфильтровывали и фильтрат выпаривали при пониженном давлении. Остаточное масло очищали колоночной хроматографией с силикагелем (гексан:этилацетат = 10:1 - 6:1) с получением указанного в заголовке соединения, 4,6-дифториндолина (2,05 г) в виде бесцветного масла.(28 мл) добавляли раствор нитрита натрия (4,17 г) в Н 2 О (5,2 мл) при 0 С и смесь перемешивали при 0 С в течение 30 мин. Полученную смесь добавляли к раствору гидроксида калия (17,0 г), ацетата натрия(17,0 г) и этил-2-метилацетоацетата (8,72 г) в H2O (80 мл) и этиловому спирту (64 мл) при 0 С и смесь перемешивали при той же температуре в течение 2 ч. Реакционную смесь экстрагировали два раза этилацетатом и объединенный органический слой выпаривали при пониженном давлении. Осадок растворяли в воде и этилацетате и нерастворимые вещества отфильтровывали. Фильтрат отделяли и органический слой промывали рассолом и сушили над сульфатом магния. Нерастворимые вещества отфильтровывали- 13016819 и фильтрат выпаривали при пониженном давлении. Остаточное твердое вещество растирали с гексаном с получением этил-2-(3-хлор-5-фторфенилгидразино)пропионата (4,0 г) в виде светло-коричневого твердого вещества.(2) Указанное выше соединение обрабатывали способом, сходным со справочным примером 3-(2),(3), (4) и (5), с получением указанного в заголовке соединения, 4-хлор-6-фториндолина, в виде бесцветного масла.APCI-Mass m/Z 172/174 (М+Н). 1 Н-ЯМР (ДМСО-d6)2,90 (т, J=9,3 Гц, 2 Н), 3,52 (т, J=8,7 Гц, 2 Н), 6,16 (с, 1 Н), 6,19 (дд, J=10,1, 1,9 Гц, 1 Н), 6,35 (дд, J=9,5, 1,9 Гц, 1 Н). Фармакологические эксперименты 1. Анализ для ингибирования SGLT2. Тестируемые соединения. Соединения, описанные в приведенных выше примерах, использовали для анализа ингибированияSGLT2. Способ. Клетки CHOK1, экспрессирующие SGLT2 человека, высевали в 24-луночные планшеты с плотностью 400000 клеток/лунка в питательной смеси F-12 (F-12 Хэма), содержащей 10% эмбриональную телячью сыворотку, 400 мкг/мл генетицина, 50 ед./мл натрия пенициллина G (Gibco-BRL) и 50 мкг/мл сульфата стрептомицина. Через 2 суток культивирования при 37 С в увлажненной атмосфере, содержащей 5% СО 2, клетки промывали один раз буфером для анализа (137 мМ NaCl, 5 мМ KCl, 1 мМ CaCl2, 1 мМMgCl2, 50 мМ Hepes и 20 мМ Tris, pH 7,4) и инкубировали с 250 мкл буфера, содержащего тестируемые соединения, в течение 10 мин при 37 С. Тестируемые соединения растворяли в ДМСО. Конечная концентрация ДМСО составляла 0,5%. Реакцию переноса инициировали добавлением 50 мкл раствора [14 С]метилD-глюкопиранозида (14C-AMG) (конечная концентрация 0,5 мМ). После инкубации в течение 2 ч при 37 С захват останавливали аспирированием инкубируемой смеси, клетки промывали три раза ледяным PBS. Затем клетки солюбилизировали 0,3 Н. NaOH и отбирали аликвоты для определения радиоактивности с помощью жидкостного сцинтилляционного счетчика. Неспецифичный захват AMG определяли как захват, который происходил в присутствии 100 мкМ флоризина, специфичного ингибитора натрийзависимого котранспортера глюкозы. Специфичный захват нормализовывали по концентрациям белка, измеренным способом Брэдфорда. Значения 50% ингибиторной концентрации (IC50) вычисляли из кривых доза-эффект способом наименьших квадратов. Результаты. Результаты представлены в следующей таблице: 2. Тест экскреции глюкозы в мочу у крыс. Тестируемые соединения. Соединения, описанные в приведенных выше примерах, использовали для теста экскреции глюкозы в мочу у крыс. Способы. Самцов крыс Sprague-Dawley (SD) в возрасте 6 недель содержали в отдельных метаболических клетках со свободным доступом к пище и воде, начиная с 2 суток до эксперимента. Утром в день эксперимента крысам вводили носитель (0,2% раствор карбоксиметилцеллюлозы, содержащий 0,2% Tween 80) или тестируемые соединения (30 мг/кг) посредством перорального зонда в объеме 10 мл/кг. Затем мочу крыс собирали в течение 24 ч и измеряли объем мочи. После этого количественно определяли концентрацию глюкозы в моче с использованием набора для ферментного анализа и вычисляли суточное количество глюкозы, экскретируемой в мочу на индивида. Результаты. Диапазоны количеств глюкозы в моче представлены как А, В и С. Эти диапазоны являются следующими: А 2400 мг, 2400 мгВ 2000 мг, 2000 мгС.(I) или его фармацевтически приемлемая соль где R1 представляет собой фтор или хлор и R2 представляет собой водород или фтор. 2. Соединение по п.1, где R1 представляет собой фтор и R2 представляет собой водород, или R1 представляет собой хлор и R2 представляет собой водород, или оба R1 и R2 представляют собой фтор. 3. Соединение по п.1, где R2 представляет собой водород. 4. Соединение по п.1, где соединение выбрано из группы, состоящей из 4-хлор-3-(4-циклопропилфенилметил)-1-(-D-глюкопиранозил)индола,3-(4-циклопропилфенилметил)-4-фтор-1-(-D-глюкопиранозил)индола,4-хлор-3-(4-циклопропилфенилметил)-6-фтор-1-(-D-глюкопиранозил)индола и 3-(4-циклопропилфенилметил)-4,6-дифтор-1-(-D-глюкопиранозил)индола или их фармацевтически приемлемой соли. 5. Фармацевтическая композиция для лечения, профилактики или замедления прогрессирования или возникновения нарушений, выбранных из сахарного диабета, диабетической ретинопатии, диабетической невропатии, диабетической нефропатии, замедленного заживления ран, устойчивости к инсулину,гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот в крови, повышенных уровней глицерина в крови, гиперлипидемии, ожирения, гипертриглицеридемии, синдрома X, осложнений диабета, атеросклероза и гипертензии. 6. Применение соединения по п.1 для изготовления лекарственного средства для применения в лечении нарушений, выбранных из сахарного диабета, диабетической ретинопатии, диабетической невропатии, диабетической нефропатии, замедленного заживления ран, устойчивости к инсулину, гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот в крови, повышенных уровней глицерина в крови, гиперлипидемии, ожирения, гипертриглицеридемии, синдрома X, осложнений диабета,атеросклероза и гипертензии. 7. Способ лечения или замедления прогрессирования или возникновения сахарного диабета, диабетической ретинопатии, диабетической невропатии, диабетической нефропатии, замедленного заживления ран, устойчивости к инсулину, гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот в крови, повышенных уровней глицерина в крови, гиперлипидемии, ожирения, гипертриглицеридемии, синдрома X, осложнений диабета, атеросклероза или гипертензии, который включает введение виду млекопитающего, нуждающемуся в лечении, терапевтически эффективного количества соединения,указанного в п.1. 8. Способ лечения сахарного диабета 1 типа или 2 типа, который включает введение виду млекопитающего, нуждающемуся в лечении, терапевтически эффективного количества соединения, указанного в п.1, отдельно или в сочетании с другим антидиабетическим средством, средством для лечения осложнений диабета, средством против ожирения, антигипертензивного средства, антитромбоцитарного средства, средства против атеросклероза и/или гиполипидемического средства. 9. Способ получения соединения формулы где R1 представляет собой фтор или хлор и R2 представляет собой водород, или фтор, или его фармацевтически приемлемой соли, который включает удаление защитной группы в соединении формулы (II) где R3 представляет собой защитную группу для гидроксильной группы, и другие символы являются такими же, как определено выше, с последующим, если желательно, превращением полученного соединения в его фармацевтически приемлемую соль. 10. Соединение формулы (II) где R1 представляет собой фтор или хлор, R2 представляет собой водород или фтор и R3 представляет собой защитную группу для гидроксигруппы, или его соль.
МПК / Метки
МПК: A61K 31/706, C07H 19/04
Метки: ингибиторов, применение, производные, качестве, 1-(-d-гликопиранозил)-3-(4-циклопропилфенилметил)-4-галогеноиндола
Код ссылки
<a href="https://eas.patents.su/17-16819-proizvodnye-1-d-glikopiranozil-3-4-ciklopropilfenilmetil-4-galogenoindola-i-ih-primenenie-v-kachestve-ingibitorov-sglt.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1-(-d-гликопиранозил)-3-(4-циклопропилфенилметил)-4-галогеноиндола и их применение в качестве ингибиторов sglt</a>
Предыдущий патент: Слитые белки, содержащие антигены отторжения опухоли ny-eso-1 и lage-1
Следующий патент: Кристаллическое твердое основание разагилина
Случайный патент: Способ локальной магнитотерапии












