Слитые белки, содержащие антигены отторжения опухоли ny-eso-1 и lage-1
Номер патента: 16818
Опубликовано: 30.07.2012
Авторы: Блэйс Норман, Мартин Денис, Бойер Мартин, Риукс Клеман, Луаэд Жамиля, Палмантье Реми М., Бришар Винсент
Формула / Реферат
1. Слитый белок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из LVL106 (SEQ ID NO: 89), LVL030 (SEQ ID NO: 79), LVL155 (SEQ ID NO: 93), LVL068 (SEQ ID NO: 81), LVL157 (SEQ ID NO: 97) и LVL078 (SEQ ID NO: 85).
2. Молекула нуклеиновой кислоты, кодирующая слитый белок по п.1.
3. Вектор, содержащий молекулу нуклеиновой кислоты по п.2.
4. Клетка-хозяин, трансформированная вектором по п.3.
5. Иммуногенная композиция или вакцина, содержащая слитый белок по п.1.
6. Иммуногенная композиция по п.5, дополнительно содержащая адъювант и/или иммуностимулирующий цитокин или хемокин.
7. Иммуногенная композиция или вакцина по п.5 или 6, где слитый белок присутствует в эмульсионном наполнителе типа ²масло в воде² или типа ²вода в масле².
8. Иммуногенная композиция или вакцина по п.6 или 7, содержащая один или более из следующих адъювантов: 3D-MPL (3-де-О-ацилированный монофосфориллипид A), QS21 или CpG-олигонуклеотид.
9. Иммуногенная композиция или вакцина по любому из пп.5-8, дополнительно содержащая один или более других антигенов.
10. Применение слитого белка по п.1, или молекулы нуклеиновой кислоты по п.2, или вектора по п.3, или композиции или вакцины по любому из пп.5-9 в изготовлении лекарственного средства для лечения рака.
Текст
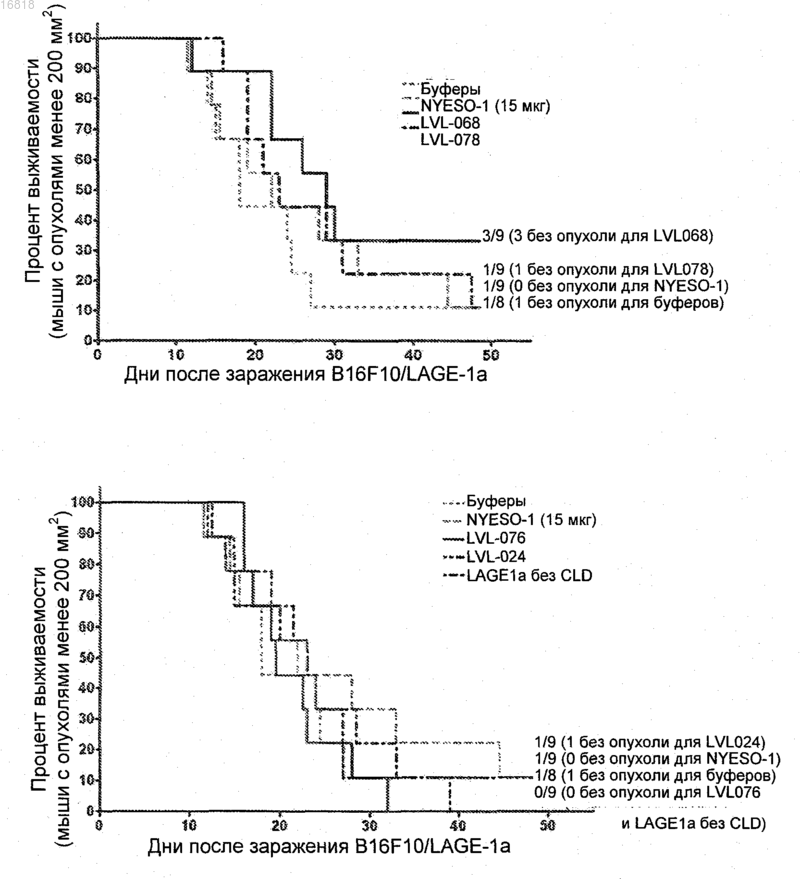
СЛИТЫЕ БЕЛКИ, СОДЕРЖАЩИЕ АНТИГЕНЫ ОТТОРЖЕНИЯ ОПУХОЛИ NY-ESO-1 И LAGE-1 Предложены слитые белки, содержащие антиген, имеющий происхождение из NY-ESO-1,связанный с антигеном, имеющим происхождение из LAGE-1, которые могут дополнительно содержать носители, партнеры по слиянию или т.п. Также предложены способы получения таких слитых белков, изготовления их в виде препарата и их применения. Такие белки полезны в качестве компонентов вакцин для индукции иммунного ответа против ряда клеток, несущих раковые антигены. 016818 Область изобретения В целом, настоящее изобретение относится к полипептидам и конструкциям, содержащим антиген,имеющий происхождение от одного или обоих из антигенов отторжения опухоли NY-ESO-1 и LAGE-1. Предшествующий уровень техники Антигены рака яичка (СТ) представляют собой класс опухольассоциированных антигенов, экспрессия которых обычно ограничена половыми клетками в яичках, яичниках или клетками трофобласта. Эти антигены обычно не экспрессированы в соматических тканях взрослых. См. Simpson, et al., Nat. Rev.Cancer, 5(8):615-625 (2005); Scanlan, et al., Immunol. Reviews, 188:22-32 (2002); Scanlan, et al., Cane. Immun., 4:1-15 (2004). Регуляция генов антигенов СТ нарушена у пациентов со злокачественными новообразованиями, что приводит к аберрантной экспрессии этих антигенов при широком спектре опухолей. Первый идентифицированный антиген СТ, MAGE-1, был идентифицирован в начале 1990-х гг. клонированием Тклеточных эпитопов (van der Bruggen et al., 1991, Science 13; 254(5038): 1643-7; van der Bruggen et al.,1999, Science 254:1643-1647; Traversari, et al., 1992, Immunogenetics, 35(3):145-152 и патент США 5342774, включенные посредством ссылки). С того времени применение методики серологического анализа экспрессионных библиотек (SEREX) (Sahin, et al., Proc. Natl. Acad. Sci. USA, 92(25): 11810-11813(1995) и патент США 5698396), экспрессии рекомбинантных антигенов на поверхности дрожжей(RAYS) (Mischo, et al., Cane. Immun., 3:5-16 (2003 и дифференциального анализа экспрессии матричной РНК (мРНК) (Gure, et al., Int. J. Cane, 85(5):726-732 (2000 привело к идентификации приблизительно 90 антигенов СТ, и ожидают, что их число увеличится в ближайшие годы. Иммуногенность некоторых антигенов СТ у пациентов со злокачественными новообразованиями делает их идеальными мишенями для разработки вакцин от опухолей.NY-ESO-1. Антигеном рака яичка, рассматриваемым в настоящее время для применения в иммунотерапии злокачественных опухолей, является NY-ESO-1. Данный антиген был впервые идентифицирован посредством SEREX при плоскоклеточном раке пищевода в конце 90-х гг. в Нью-Йоркском отделении Института Людвига по исследованию злокачественных новообразований (New York Branch of the LudwigInstitute for Cancer Research) (Chen, et al., PNAS USA, 94(5):1914-1918 (1997) и патент США 5804381,включенный посредством ссылки). Длина белка NY-ESO-1 составляет 180 аминокислот, и он может быть описан состоящим из трех областей:N-концевой области, примерно или приблизительно 1-70 аминокислоты,центральной области, примерно или приблизительно 71-134 аминокислоты и С-концевой области, примерно или приблизительно 135-180 аминокислоты. Коллагеноподобная область содержит примерно или приблизительно, или приближенно 15-73 аминокислоты N-концевой области (см. фиг. 1). Белок NY-ESO-1 был обнаружен при широком спектре опухолей, включая, без ограничения, рак яичника, рак легкого, рак молочной железы, рак предстательной железы, рак пищевода, рак мочевого пузыря и меланомы (Nicholaou T., et al., Immunol. Cel. I. Biol. 2006 Jun; 84(3):303-17 и Jungbluth, et al.,2001, Int. J. Cane, 92(6):856-860). Спонтанные гуморальные и клеточные иммунные ответы против этого антигена были описаны у пациентов с NY-ESO-1-положительными опухолями, и были идентифицированы несколько пептидов, ограниченных HLA (Human Leukocyte Antigen, человеческий лейкоцитарный антиген) I класса и II класса (Jager, et al., 1998, J. Exp. Med., 187(2):265-270; Yamaguchi, et al., 2004, Clin.Cane. Res., 10(3):890-961 и Davis, et al., 2004, Proc. Natl. Acad. Sci. USA, 101 (29):10697-10702). Примерами из патентной литературы являются патенты США 6140050; 6251603; 6242052; 6274145; 6338947; 6417165; 6525177; 6605711; 6689742; 6723832; 6756044 и 6800730, все включено посредством ссылки. В клиническом исследовании три частично перекрывающихся пептида, имеющих происхождение от NY-ESO-1, с мотивами связывания HLA-A2 (157-167, 157-165 и 155-163) были использованы в качестве вакцины для лечения двенадцати пациентов с метастатическими NY-ESO-1-экспрессирующих опухолей. В данном исследовании было показано, что синтетические пептиды NY-ESO-1 могут быть безопасно введены и могут приводить к возникновению потенциально полезных Т-клеточных ответов (Jager,et al., 2000, PNAS, USA, 97(22):12198-12203). Различными группами в белке были идентифицированы несколько эпитопов МНС (главного комплекса гистосовместимости) I и II классов, см., например, фиг. 1. Эти эпитопы являются только примером эпитопов, описанных для данного белка, и список на фиг. 1 не является исчерпывающим. Кроме того, по меньшей мере один или более из эпитопов, упомянутых и/или перечисленных на фиг. 1, не были подтверждены экспериментально. Коллагеноподобная область на N-конце содержит по меньшей мере один эпитоп МНС I класса, называемый здесь А 31. Центральная область включает несколько эпитопов МНС 2 класса, называемых здесь DR1, DR2, DR4, DR7 и DP4. Область также содержит несколько эпитопов МНС I класса, называемых здесь В 35, В 51, Cw3 и Cw6. Предполагают, что С-конец содержит по меньшей мере два эпитопа II класса (DR 4 и DP4) и один эпитоп I класса (А 2).LAGE-1. Также был идентифицирован другой антиген рака яичка, LAGE-1. Были описаны два-1 016818 транскрипта LAGE-1, LAGE-1a и LAGE-1b. LAGE-1b является продуктом незавершенного сплайсинга и кодирует предполагаемый белок длиной приблизительно 210 аминокислотных остатков, в то время как продукт гена LAGE-1a содержит 180 аминокислотных остатков (Sun et al. Cancer Immunol Immunother 2006: 55: 644-652).N-концевые области белков LAGE-1 и NY-ESO-1 высококонсервативны и, как предполагают, идентичны более чем на 97%. Однако LAGE-1 отличается от NY-ESO-1 в центральных областях, которые идентичны только на 62%. С-концы NY-ESO-1 и LAGE-1a являются высококонсервативными (идентичны более чем на 97%). Тем не менее, С-конец LAGE-1b длиннее и не консервативен и, как предполагают,идентичен той же области LAGE-1a/NY-ESO-1 менее чем на 50%. Общая информация, относящаяся к этим белкам, доступна на веб-сайте Института Людвига по исследованию злокачественных новообразований (LICR) (см. www.cancerimmunity.org/CTdatabase). Краткое изложение сущности изобретения Согласно настоящему изобретению предложен иммуногенный слитый белок, содержащий:(2) LAGE-1 или его фрагментом,в котором по меньшей мере один из NY-ESO-1 и/или LAGE-1 процессирован или частично процессирован или является фрагментом, включающим один или более эпитопов NY-ESO-1 или LAGE-1. Согласно настоящему изобретению также предложен иммуногенный слитый белок, содержащий:(2) NY-ESO-1 или его фрагментом,в котором по меньшей мере один из NY-ESO-1 и/или LAGE-1 процессирован или частично процессирован или является фрагментом, включающим один или более эпитопов NY-ESO-1 или LAGE-1. Таким образом, также предложены полипептиды и слитые белки, содержащие процессированный или частично процессированный NY-ESO-1 или его фрагмент, включающий один или более эпитоп NY-ESO-1. Также предложены полипептиды и слитые белки, содержащие процессированный или частично процессированный LAGE-1 или его фрагмент, включающий один или более эпитопы LAGE-1. Также предложены композиции и способы, включающие такие слитые белки и полипептиды. Краткое описание графических материалов На фиг. 1 показано несколько эпитопов МНС (главного комплекса гистосовместимости) I и II классов на белке NY-ESO-1, которые были идентифицированы различными группами. Эти эпитопы являются только примером эпитопов, описанных для данного белка, поэтому перечень на фиг. 1 не является исчерпывающим. Более того, по меньшей мере один или более эпитопов, упомянутых и/или перечисленных на фиг. 1, не были подтверждены экспериментально. Описанная аминокислотная последовательность NY-ESO-1 определена здесь в SEQ ID NO: 49. На фиг. 2 показана конструкция А, слитый белок, содержащий непроцессированный NY-ESO-1 и процессированный LAGE-1, такой как LAGE-1 а. В этом воплощении С-конец NY-ESO-1 соединен с Nконцом процессированного LAGE-1 вместе с гистидиновой аффинной меткой с образованием слитого белка длиной 288 аминокислот (аа). Дополнительные подробности о конструкции А представлены в табл. 1(SEQ ID NO: 1; SEQ ID NO: 3). На фиг. 3 показана конструкция Б, слитый белок, содержащий первую треть белка D без его секреторной сигнальной последовательности (например, аминокислоты с 20 по 127), непроцессированныйLAGE-1 с образованием слитого белка длиной 398 аминокислот. Дополнительные подробности о конструкции Б представлены в табл. 1 в разделе 1.6 (SEQ ID NO: 2; SEQ ID NO: 4). На фиг. 4 показана конструкция В, слитый белок, содержащий частично процессированный NYESO-1 и процессированный LAGE-1, такой как LAGE-1a. В этом воплощении С-конец частично процессированного NY-ESO-1 присоединен к N-концу процессированного LAGE-1 с образованием слитого белка длиной 242 аминокислоты. Дополнительные подробности о конструкции В представлены в табл. 1(SEQ ID NO: 5; SEQ ID NO: 7). На фиг. 5 показана конструкция Г, слитый белок, содержащий первую треть белка D без его секреторной сигнальной последовательности (например, аминокислоты с 20 до примерно или приблизительно 127), частично процессированный NY-ESO-1 и процессированный LAGE-1, такой как LAGE-1a. В этом воплощении 127 аминокислота белка D присоединена к N-концу частично процессированного NY-ESO1, С-конец которого присоединен к N-концу процессированного LAGE-1 с образованием слитого белка длиной 352 аминокислоты. Дополнительные подробности этого воплощения представлены в табл. 1(SEQ ID NO: 6; SEQ ID NO: 8). На фиг. 6 показана конструкция Д, слитый белок, содержащий процессированный NY-ESO-1 и процессированный LAGE-1, такой как LAGE-1a. В этом воплощении С-конец процессированного NY-ESO-1 присоединен к N-концу процессированного LAGE-1 с образованием слитого белка длиной 211 аминокислот. Дополнительные подробности о конструкции Д представлены в табл. 1 (SEQ ID NO: 9; SEQ ID-2 016818 На фиг. 7 показана конструкция Е, слитый белок, содержащий первую треть белка D без его секреторной сигнальной последовательности (например, аминокислоты с 20 до примерно или приблизительно 127), процессированный NY-ESO-1 и процессированный LAGE-1, такой как LAGE-1a. В этом воплощении 127 аминокислота белка D присоединена к N-концу процессированного NY-ESO-1, С-конец которого присоединен к N-концу процессированного LAGE-1 с образованием слитого белка длиной 321 аминокислота. Дополнительные подробности о конструкции Е представлены в табл. 1 (SEQ ID NO: 10; SEQ IDNO: 12). На фиг. 8 показано альтернативное воплощение конструкции Д, а именно Д', в котором С-конец процессированного LAGE-1 присоединен к N-концу процессированного NY-ESO-1 с образованием слитого белка длиной 212 аминокислот. Дополнительные подробности этого воплощения, конструкции Д',представлены в табл. 1 (SEQ ID NO: 21; SEQ ID NO: 23). На фиг. 9 показана конструкция Ж, слитый белок, содержащий процессированный NY-ESO-1, процессированный LAGE-1, такой как LAGE-1a, и коллагеноподобную область, такую как коллагеновая область из NY-ESO-1. В этом воплощении С-конец коллагеноподобной области присоединен, например, кN-концу процессированного LAGE-1. В свою очередь С-конец процессированного LAGE-1 присоединен к N-концу процессированного NY-ESO-1 с образованием слитого белка длиной 289 аминокислот. Дополнительные подробности о конструкции Ж представлены в табл. 1 (SEQ ID NO: 13; SEQ ID NO: 15). На фиг. 10 показана схема типичного рекомбинантного полипептида, содержащего NY-ESO-1 с частично процессированным коллагеноподобным доменом. Эпитопы, показанные на фиг. 10-13, являются только примерами эпитопов, описанных для данного белка, и не были подтверждены экспериментально. На фиг. 11 показана схема типичного слитого белка, содержащего первую треть белка D без его секреторной сигнальной последовательности (например, аминокислоты с 20 до примерно или приблизительно 127) и NY-ESO-1 с частично процессированным коллагеноподобным доменом. На фиг. 12 показана схема типичного рекомбинантного полипептида, содержащего NY-ESO-1 с частично процессированным коллагеноподобным доменом. На фиг. 13 показана схема типичного слитого белка, содержащего первую треть белка D без его секреторной сигнальной последовательности (например, аминокислоты с 20 до примерно или приблизительно 127) и NY-ESO-1 с процессированным коллагеноподобным доменом. Фиг. 14 представляет собой схему, показывающую несколько эпитопов, идентифицированных в процессированном белке LAGE-1a. Эти эпитопы являются просто примером эпитопов, описанных для данного белка, поэтому этот список не является исчерпывающим. Во избежание сомнений эпитопы, описанные и/или перечисленные в графических материалах, могут быть или могут не быть подтверждены экспериментально (то есть они могут быть предполагаемыми и тому подобное), если здесь не указано иное. Полная аминокислотная последовательность LAGE-1a изложена в перечне последовательностей как SEQ ID NO: 58. Полная аминокислотная последовательность LAGE-1b (LAGE-1b не изображен на данной фигуре) изложена в перечне последовательностей как SEQ ID NO: 71. На фиг. 15 показана схема обоих NY-ESO-1 и LAGE-1, так же как и количество эпитопов МНС(главного комплекса гистосовместимости) I и II классов. Эти эпитопы являются только примером эпитопов, описанных для данного белка, поэтому этот список не является исчерпывающим; один или более описанные и/или упомянутые эпитопы не были подтверждены экспериментально. На фиг. 16 показана структура слитого белка NY-ESO-1/LAGE-1. На фиг. 17 в схематической форме суммированы пятнадцать конструкций и уровни их продукции. Р = белок D; С (серый блок) = коллагеноподобный домен NY-ESO-1; С (белый блок) = процессированный коллагеноподобный домен; L = Lage 1 без коллагеноподобного домена; N = NY-ESO-1 без коллагеноподобного домена; черная стрелка = полигистидиновая метка; (-) = низкий уровень продукции; (+) = незначительная продукция;= высокий уровень продукции;= наилучший уровень продукции. Аминокислотные последовательности восьми конструкций и кодирующие их нуклеотидные последовательности суммированы в табл. 4 и списке последовательностей. На фиг. 18 суммирован скрининг 1, 76-дневное исследование с использованием мышей CB6F1 для оценки каждого из LVL076, LVL079, LVL78, LVL68, LVL020, LVL26, LVL024, LVL30, чтобы определить, обеспечивает ли внутримышечная иммунизация слитым белком с адъювантом защиту против подкожного заражения перевиваемыми опухолями (B16/NYESO1). На фиг. 19 подведен итог роста опухоли B-16-NY-ESO-1 у контрольных мышей, используемых в 76-дневном исследовании. На фиг. 20 показана выживаемость мышей, иммунизированных непроцессированным NY-ESO-1,LVL030, LVL068, LVL079 или LVL026. На фиг. 21 суммированы NY-ESO-1-специфичные иммунные ответы, как оценено твердофазным иммуноферментным анализом (ELISA), клеточным сортером с возбуждением флуоресценции (FACS) и вестерн-блоттингом, а также LAGE-1a (6e3 коллагеноподобного домена)-специфичные иммунные ответы, как оценено посредством ELISA и FACS. На фиг. 22 суммирован план эксперимента скрининга 2, 105-дневного исследования для опреде-3 016818 ления того, обеспечивает ли внутримышечная иммунизация выбранными слитыми белками с адъювантом защиту против заражения B16/NY-ESO-1 и заражения B16/LAGE-1a. Показано заражение B16/NYESO-1. На фиг. 23 суммирован скрининг 2 и показано заражение B16/LAGE-1a. На фиг. 24 показана выживаемость мышей, иммунизированных LVL078, LVL068, непроцессированным NY-ESO-1, LVL024 и LVL076 после заражения B16/NY-ESO-1. См. фиг. 24. На фиг. 25 показана выживаемость мышей, иммунизированных LVL076, LAGE-1a без коллагеноподобной области, LVL024, непроцессированным NY-ESO-1, LVL078 или LVL068 после введенияB16/LAGE-1a. Фиг. 26. В столбцах 1-8, слева направо, показаны результаты ELISA, проведенного для выявления возможных иммунных ответов против человеческого коллагена у мышей, иммунизированных одним из следующего: (1) буферов (контроль); (2) непроцессированного NY-ESO-1; (3) LAGE-1a без коллагеноподобного домена; (4) LVL068; (5) LVL078; (6) LVL024; (7) LVL076. Положительный контроль (8 столбец) содержит моноклональное антитело против человеческого коллагена 1 (mAb против человеческого коллагена 1). Подробное описание изобретения Слитые белки. Слитые белки по изобретению применимы для лечения рака и, более конкретно, для лечения меланомы; рака молочной железы; рака предстательной железы; рака мочевого пузыря, включая переходноклеточный рак; рака легких, включая немелкоклеточный рак легких (NSCLC); рака головы и шеи, включая рак пищевода; плоскоклеточного рака; рака желудочно-кишечного тракта; рака печени; опухолей головного мозга; лейкемии и различных сарком. Основываясь на профилях экспрессии LAGE-1 и NY-ESO-1, слитый белок по изобретению быть эффективным приблизительно при 37% раков молочной железы. Лечение по настоящему изобретению может быть также особенно подходяще для лечения пациентов, которым не подходит направленная терапия Her2/neu. Предполагают, что слитый белок по изобретению может быть также эффективным у приблизительно 35% больных раком предстательной железы, 35% больных раком мочевого пузыря, 40% больных меланомой и 35% больных NSCLC (немелкоклеточным раком легкого). В одном воплощении слитый белок по изобретению может сделать возможным лечение большей популяции пациентов, потому что пациентам с опухолями, экспрессирующими как NY-ESO-1, так и/или LAGE-1 (включая LAGE-1a и LAGE-1b), можно вводить слитый белок по настоящему изобретению. Слитый белок по изобретению может также быть более иммуногенным, чем его отдельные белкикомпоненты, по следующим причинам: удаление одного или более коллагеноподобных доменов может снизить потенциальную иммунотолерантность соединения, которая обусловлена его гомологией со структурой естественного эндогенного коллагена, или возможное добавление гетерологичного партнера по слиянию может дополнительно стимулироватьCD4 Т-клеточные ответы. Таким образом, слитые белки применимы для индукции иммуногенного ответа на такие раковые антигены, как NY-ESO-1, или LAGE-1, или на оба из них.NY-ESO-1, используемый в изобретении, может представлять собой непроцессированный, частично процессированный или процессированный NY-ESO-1 или любой его фрагмент, содержащий один или более эпитопов, способные вызывать иммунный ответ на NY-ESO-1. В контексте данного описания предполагают, что непроцессированный белок NY-ESO-1 обозначает белок, состоящий из около или примерно 1-180 аминокислот, и который по меньшей мере на 95, 96, 97, 98, 99 или 100% идентичен встречающемуся в природе белку (SEQ ID NO: 49). При использовании здесь термин LAGE-1 относится к одному или более членам семейства LAGE-1, таким как LAGE-1a и LAGE-1b, как описано ниже. Предполагают, что белок непроцессированный LAGE-1a обозначает белок, идентичный SEQ ID NO: 58 на 95, 96, 97, 98, 99 или 100%. Сходным образом предполагают, что белок непроцессированный LAGE1b обозначает белок, идентичный встречающемуся в природе белку (SEQ ID NO: 71) на 95, 96, 97, 98, 99 или 100%. В одном воплощении идентичность относится ко всей длине последовательности. Таким образом,изобретение также включает указанные слитые белки с консервативными заменами. Консервативные замены хорошо известны и обычно устанавливаются как стандартные счетные матрицы в компьютерных программах выравнивания последовательностей. Эти программы включают РАМ 250 (Dayhoft M.O. et al.,(1978), "A model of evolutionary changes in proteins", "Atlas of Protein sequence and structure" 5(3) M.O.Sci. USA 89 (Biochemistry): 10915-10919. В общих чертах замены в пределах следующих групп являются консервативными заменами, но замены между группами рассматривают как неконсервативные. Следующие группы представляют собой: 1) аспартат/аспарагин/глутамат/глутамин; 2) серин/треонин;-4 016818 3) лизин/аргинин; 4) фенилаланин/тирозин/триптофан; 5) лейцин/изолейцин/валин/метионин; 6) глицин/аланин. Предполагают, что частично процессированный в контексте данного описания обозначает белокNY-ESO-1 или LAGE-1 (по обстоятельствам), у которого удалено большинство коллагеноподобных областей, но который все еще содержит или состоит из эпитопа А 31, обнаруженного в этой области. В одном воплощении частично процессированный NY-ESO-1 и/или LAGE-1 содержит или состоит из ряда аминокислот с аминокислоты 44, 45, 46, 47, 48, 49, 50, 51 или 52 до аминокислоты 175, 176, 177,178, 179 или 180 или любой комбинации этих аминокислот, например с 48 аминокислоты до 180 аминокислоты или с 46 до 178 аминокислоты. В одном воплощении частично процессированный NY-ESO-1 или LAGE-1 содержит или состоит из примерно или точно аминокислот с 48 по 180 (или примерно или точно 48-210 аминокислот в случае LAGE-1b). В одном воплощении под термином примерно в данном контексте можно понимать, что до +/- 10% общего числа аминокислот последовательности, возможно,добавлены или удалены из последовательности. В одном воплощении частично процессированный NYESO-1 содержит или состоит из аминокислот с 48 по 180 NY-ESO-1. В одном воплощении частично процессированный LAGE-1b содержит или состоит из ряда аминокислот с аминокислоты 44, 45, 46, 47, 48, 49, 50, 51 или 52 до аминокислоты 205, 206, 207, 208, 209 или 210 или любой комбинации этих аминокислот, например с 48 аминоислоты до 210 аминокислоты или с 46 до 208 аминокислоты. В одном воплощении частично процессированный LAGE-1b содержит или состоит из примерно или точно аминокислот с 48 по 210. В одном воплощении под термином около в данном контексте можно понимать, что до 10% общего числа аминокислот последовательности, возможно, добавлены или удалены из последовательности. В одном воплощении частично процессированный LAGE-1b содержит или состоит из аминокислот с 48 по 210 LAGE-1b. Предполагают, что процессированный в контексте данного описания обозначает белок NY-ESO-1 или LAGE-1 (по обстоятельствам), у которого удалены коллагеноподобные области (включая удаление эпитопа А 31). В одном воплощении процессированный NY-ESO-1 и/или LAGE-1 содержит или состоит из примерно или точно аминокислот 71-180 (или примерно или точно из аминокислот 71-210 в случаеLAGE-1b). В одном воплощении процессированный NY-ESO-1 или LAGE-1 содержит или состоит из ряда аминокислот с аминокислоты 67, 68, 69, 70, 71, 72, 73, 74 или 75 до аминокислоты 175, 176, 177, 178, 179 или 180 или любой комбинации этих аминокислот, например с 71 аминокислоты до 180 аминокислоты или с 69 до 178 аминокислоты. В одном воплощении процессированный NY-ESO-1 или LAGE-1b содержит или состоит из примерно или точно аминокислот с 71 по 180 (или примерно или точно из аминокислот 71-210 в случае LAGE-1b). В одном воплощении под термином примерно в данном контексте можно понимать, что до 10% аминокислот от общего числа аминокислот последовательности, возможно, добавлены или удалены из последовательности. В одном воплощении процессированный NY-ESO-1 или LAGE-1 содержит или состоит из аминокислот с 71 по 180 NY-ESO-1 или LAGE-1. В одном воплощении процессированный LAGE-1b содержит или состоит из ряда аминокислот с аминокислоты 67, 68, 69, 70, 71, 72, 73, 74 или 75 до аминокислоты 205, 206, 207, 208, 209 или 210 или любой комбинации этих аминокислот, например с 71 аминокислоты до 210 аминокислоты или с 69 до 208 аминокислоты. В одном воплощении процессированный LAGE-1b содержит или состоит из примерно или точно аминокислот с 71 по 210. В одном воплощении под термином примерно в данном контексте можно понимать, что до 10% аминокислот от общего числа аминокислот последовательности, возможно, добавлены или удалены из последовательности. В одном воплощении процессированный LAGE1b содержит или состоит из аминокислот с 71 по 210 LAGE-1b. Под другими фрагментами подразумевают те, которые при включении в слитый белок по изобретению приводят к образованию окончательного белка с желаемыми свойствами и преимуществами слитых белков по изобретению.NY-ESO-1. В соответствии с вышеизложенным предложены модифицированные антигены, содержащие антиген, имеющий происхождение из антигена отторжения опухоли NY-ESO-1, где коллагеновая область частично процессирована или процессирована полностью. В некоторых воплощениях удалено больше, чем коллагеновая область. В некоторых воплощениях модифицированный антиген генетически модифицирован. В некоторых воплощениях модифицированный антиген является рекомбинантным. В некоторых воплощениях предложены полипептиды, содержащие антиген, как описано выше. В некоторых воплощениях типичные полипептиды содержат гетерологичный белок, такой как белок D от Haemophilus influenzae типа В или его фрагмент. В некоторых воплощениях предложены конструкции, содержащие нуклеотидную последовательность, кодирующую вышеупомянутые полипептиды. В некоторых воплощениях предложен иммуногенный полипептид, содержащий NY-ESO-1 или его фрагмент, где NY-ESO-1 не содержит коллагеноподобную область. В других NY-ESO-1 частично про-5 016818 цессирован или процессирован или содержит любой его фрагмент, включающий один или более эпитоп. В некоторых воплощениях такие полипептиды имеют консервативные замены. В некоторых воплощениях такие полипептиды и конструкции применимы в качестве профилактического средства для предотвращения или существенного облегчения рецидива рака. Таким образом, в некоторых воплощениях одна или более аминокислота удалена из коллагеновых областей. Более конкретно, в некоторых воплощениях 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17,18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47,48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73 аминокислоты удалены из части, включающей коллагеновую область, то есть примерно 1-73 аминокислоты SEQID NO: 49. Аминокислоты могут быть удалены из смежных положений в коллагеновой области или не из смежных положений. Другими словами, в некоторых воплощениях аминокислота удалена из любого из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33,34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63,64, 65, 66, 67, 68, 69, 70, 71, 72 или 73 положений или любой их комбинации в пределах данной областиSEQ ID NO: 49. Специалистам в данной области техники понятно, что в некоторых воплощениях части аминокислотной последовательности сохранены таким образом, что определенные их эпитопы сохранены в получаемом полипептиде. В некоторых воплощениях использован фрагмент центральной области или С-концевой областиNY-ESO-1. Таким образом, в некоторых воплощениях полипептиды могут содержать один или более фрагментов аминокислотной последовательности, изложенной в SEQ ID NO: 49, то есть фрагменты, содержащие одно или более из аминокислотных положений 74-75, 76-80, 81-85, 86-90, 91-95, 96-100, 101105, 106-110, 111-115, 116-120, 121-125, 126-130, 131-135, 136-140, 141-145, 146-150, 151-155, 156-160,161-165, 166-170, 171-175, 176-180 или любое их сочетание. Специалистам в данной области техники понятно, что в некоторых воплощениях аминокислотная последовательность сохранена таким образом,что определенные эпитопы сохранены в получаемом полипептиде.LAGE-1. В некоторых воплощениях предложен модифицированный антиген, содержащий антиген,имеющий происхождение от антигена отторжения опухоли LAGE-1, где коллагеновая область частично процессирована или процессирована полностью. В некоторых воплощениях удалено больше, чем коллагеновая область. В некоторых воплощениях модифицированный антиген генетически модифицирован. В некоторых воплощениях модифицированный антиген является рекомбинантным. В некоторых воплощениях предложены полипептиды, содержащие антиген, как описано выше. В некоторых воплощениях антиген имеет происхождение от антигена отторжения опухоли LAGE-1a. В некоторых воплощениях антиген имеет происхождение от антигена отторжения опухоли LAGE-1b. В других воплощениях типичные слитые белки содержат гетерологичный белок, такой как белок D от Haemophilus influenzae типа В или его фрагмент. В некоторых воплощениях предложены конструкции, содержащие нуклеотидную последовательность, кодирующую вышеупомянутые полипептиды. В некоторых воплощениях предложен иммуногенный полипептид, содержащий LAGE-1 или его фрагмент, где LAGE-1 не содержит коллагеноподобную область. В других LAGE-1 частично процессирован или процессирован или содержит любой его фрагмент, который включает один или более эпитоп. В некоторых воплощениях полипептид содержит гибрид полипептида LAGE-1 и коллагеноподобной области NY-ESO-1. В некоторых воплощениях полипептид содержит часть коллагеновой области NYESO-1 или всю эту область, соединенную с частично процессированным или процессированным LAGE1. В некоторых воплощениях такие полипептиды имеют консервативные замены. В некоторых воплощениях такие полипептиды и конструкции применимы в качестве профилактического средства для предотвращения или существенного облегчения рецидива рака. Таким образом, в некоторых воплощениях одна или более аминокислота удалена из коллагеновой области или даже из N-концевых аминокислот. Более конкретно, в некоторых воплощениях 1, 2, 3, 4, 5,6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36,37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66,67, 68, 69, 70, 71, 72 или 73 аминокислоты удалены из коллагеновой области или даже из N-концевых аминокислот, то есть примерно 1-73 аминокислоты SEQ ID NO: 58 (LAGE-1 а) или SEQ ID NO: 71(LAGE-1b). Аминокислоты могут быть удалены из смежных положений в этой области или не из смежных положений. Другими словами, в некоторых воплощениях одна или более аминокислоты удалены из любого из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30,31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60,61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73 положений, или любой их комбинации, в пределах SEQID NO: 58 (LAGE-1 а) или SEQ ID NO: 71 (LAGE-1b). Специалистам в данной области техники понятно,что в некоторых воплощениях части аминокислотной последовательности сохранены таким образом, что определенные их эпитопы сохранены в получаемом полипептиде. В некоторых воплощениях используют фрагмент центральной области или С-концевой областиLAGE-1. Таким образом, в некоторых воплощениях полипептид может содержать один или более фрагментов аминокислотной последовательности, изложенной в SEQ ID NO: 58 (LAFE-1a) или SEQ ID NO:-6 016818 71 (LAGE-1b), то есть фрагменты, содержащие одно или более из аминокислотных положений 74, 75, 76,77, 78, 79, 80, 81-85, 86-90, 91-95, 96-100, 101-105, 106-110, 111-115, 116-120, 121-125, 126-130, 131-135,136-140, 141-145, 146-150, 151-155, 156-160, 161-165, 166-170, 171-175, 176-180 или любое их сочетание. Специалистам в данной области техники понятно, что в некоторых воплощениях аминокислотная последовательность сохранена таким образом, что определенные эпитопы сохранены в получаемом полипептиде. В одном аспекте согласно изобретению предложен слитый белок, содержащий непроцессированный NY-ESO-1. В одном аспекте согласно изобретению предложен слитый белок, содержащий частично процессированный NY-ESO-1. В одном аспекте согласно изобретению предложен слитый белок, содержащий процессированныйNY-ESO-1. В одном аспекте согласно изобретению предложен слитый белок, содержащий непроцессированный LAGE-1. В одном аспекте согласно изобретению предложен слитый белок, содержащий частично процессированный LAGE-1. В одном аспекте согласно изобретению предложен слитый белок, содержащий процессированныйLAGE-1. В одном аспекте LAGE-1, используемый в изобретении, представляет собой LAGE-1a. В одном аспекте LAGE-1, используемый в изобретении, представляет собой LAGE-1b. В одном аспекте изобретения N-конец NY-ESO-1 соединен с С-концом LAGE-1. В одном аспекте в изобретении С-конец NY-ESO-1 соединен с N-концом LAGE-1. Иммуногенность слитых белков по изобретению может быть дополнительно увеличена и/или характеристики получения белка могут быть дополнительно улучшены включением фрагмента из другого гетерологичного антигена, например белка D, поверхностного белка грамотрицательной бактерии Haemophilus influenza В. Дополнительную информацию об иммунологических партнерах по слиянию,имеющих происхождение от белка D, можно получить из WO 91/18926. Белки для включения в партнера по слиянию по настоящему изобретению могут быть химически конъюгированы или могут быть экспрессированы в виде рекомбинантных слитых белков. В одном воплощении слитый белок экспрессирован в виде рекомбинантного слитого белка. Другой гетерологичный партнер по слиянию может способствовать представлению Т-хелперных эпитопов (иммунологический партнер по слиянию) или может способствовать экспрессии данного белка с высоким выходом (усилитель экспрессии). В одном воплощении другой гетерологичный партнер по слиянию может быть как иммунологическим партнером по слиянию, так и усилителем экспрессии. В одном воплощении белок D или его производное содержит примерно или точно первую 1/3 белка,например примерно или точно аминокислоты с 1 по 109 белка D. В этом воплощении аминокислоты 2Lys и/или 3-Thr последовательности нативного белка D могут быть заменены аминокислотами 2-Asp и/или 3-Рго. В другом воплощении белок D или его производное содержит или состоит из примерно или точно 20-127 аминокислот белка D. В одном воплощении белок D для использования в настоящем изобретении не содержит секреторную последовательность белка. В большинстве случаев в слитых белках по настоящему изобретению производное белка D не содержит липидов. В одном воплощении белок D дополнительно содержит аминокислоты Met, Asp и Pro, например соединенные с N-концом фрагмента белка D (т.е. конструкция может содержать или состоять из MDP 20-127 белок D). Полагают, что эти три дополнительные аминокислоты могут способствовать стабильности белка и/или увеличивать уровень экспрессии этого белка. В одном аспекте согласно изобретению предложен слитый белок, где N-концевой фрагмент (т.е. первая треть) белка D (как описано выше) соединен с N-концом слитого белка по изобретению или его иммуногенного фрагмента. Более конкретно, слияние белка D и N-конца слитого белка по изобретению может быть произведено таким образом, что в последний замещает С-концевой фрагмент белка D, который был удален. Таким образом, N-конец белка D становится N-концом слитого белка. В слитый белок по изобретению могут быть включены другие гетерологичные партнеры по слиянию или их фрагменты, вместо или в дополнение к белку D, например неструктурный белок вируса гриппа, NS1 (гемагглютинин); обычно может быть использована 81 Nконцевая аминокислота, хотя могут быть использованы другие фрагменты при условии, что они содержат Т-хелперные эпитопы;LytA, имеющий происхождение от Streptococcus pneumoniae, синтезирующего N-ацетил-Lаланинамидазу LytA, кодируемую геном LytA (Gene, 43 (1986) page 265-272), как, например, повторяющаяся часть молекулы LytA, обнаруженная на С-конце, например, начиная с 178 остатка, как, например,188-305 остатки. В одном воплощении гетерологичный партнер по слиянию представляет собой CLytA. В другом воплощении гетерологичный партнер по слиянию представляет собой СРС, слитый белок, содержащий CLytA-P2-CLytA, как описано в WO 03/104272. Очистка гибридных белков, содержащих-7 016818 фрагмент C-LytA на их N-концах, была описана в Biotechnology: 10, (1992) page 795-798. Слитые белки по изобретению могут дополнительно содержать аффинную метку, например гистидиновый хвост (также известный как his-метка), содержащий от 1 до 10, например от 6 или 10 гистидиновых остатков. Эти остатки могут быть расположены, например, в концевой части, такой как Сконцевая или N-концевая часть белка. Аффинная метка может быть включена для дополнительного улучшения очистки белка. Определенные специфичные слитые белки по изобретению могут, например, быть конструированы,как описано в графических материалах. Каждое из воплощений, изложенных в графических материалах,отражает независимые аспекты изобретения. Дополнительные примеры конструкций слитых белков по настоящему изобретению даны в табл. 1-4 и в перечне последовательностей. Нуклеиновые кислоты. Настоящее изобретение также включает нуклеиновые кислоты и полинуклеиновые кислоты, такие как ДНК, кодирующие слитые белки по изобретению. Способы по изобретению могут быть осуществлены обычными рекомбинантными методиками, такими как описанные в Maniatis etal., Molecular Cloning - A Laboratory Manual; Cold Spring Harbor, 1982-1989. В частности, способ может включать стадии: 1) изготовления реплицируемого или интегративного вектора экспрессии, способного в клеткехозяине экспрессировать ДНК-полимер, содержащий нуклеотидную последовательность, кодирующую слитый белок или его иммуногенное производное; 2) трансформации клетки-хозяина указанным вектором; 3) культивирования указанной трансформированной клетки-хозяина в условиях, делающих возможной экспрессию указанного ДНК-полимера для получения указанного белка; и 4) выделения указанного белка. Термин трансформация использован здесь для обозначения введения чужеродной ДНК в клеткухозяина. Это может быть осуществлено, например, трансформацией, трансфекцией или инфекцией подходящей плазмидой или вирусным вектором с применением, например, обычных методик, как описано вGenetic Engineering; Eds. S.M. Kingsman and A.J. Kingsman; Blackwel I Scientific Publications; Oxford, England, 1988. Термин трансформированный или трансформант будет в дальнейшем относиться к получаемой клетке-хозяину, содержащей и экспрессирующей рассматриваемый чужеродный ген. Векторы экспрессии, содержащие нуклеотидные последовательности, кодирующие слитые белки по настоящему изобретению, являются новыми и также образуют часть изобретения. Реплицируемые векторы экспрессии могут быть изготовлены по изобретению расщеплением вектора, совместимого с клеткой-хозяином, для предоставления линейного сегмента ДНК с интактным репликоном и комбинированием в условиях лигирования указанного линейного сегмента с одной или более молекулами ДНК, которые совместно с указанным линейным сегментом кодируют желаемый продукт,как, например, ДНК-полимер, кодирующий белок по изобретению или его производное. Таким образом,если желательно, ДНК-полимер может быть предварительно образован или образован в процессе конструирования вектора. Выбор вектора будет отчасти определяться клеткой-хозяином, которая может быть прокариотической или эукариотической, но в большинстве случаев представляет собой клетки Е. coli или СНО (клетки яичников китайского хомячка). Подходящие векторы включают плазмиды, например ТМСР 14 или рЕТ 21 или рЕТ 26, pcDNA3, бактериофаги, космиды и рекомбинантные вирусы. В одном воплощении, в котором экспрессия происходит в бакуловирусе, дрожжах или клетках-хозяевах СНО, может быть использован один из следующих векторов: рЕЕ 14, pPICZA, pPICZB, pPICZC, pDMT-DEST48 и pAcSG2. Изготовление реплицируемого вектора экспрессии может быть проведено обычным образом подходящими ферментами для рестрикции, полимеризации и лигирования ДНК способами, описанными, например, Maniatis et al., упомянутыми выше. Рекомбинантную клетку-хозяина получают согласно изобретению трансформацией клетки-хозяина реплицируемым вектором экспрессии по изобретению в условиях трансформации. Подходящие условия трансформации являются обычными и описаны, например, в Maniatis et al., упомянутой выше или "DNACloning" Vol. II, D.M. Glover ed., IRL Press Ltd, 1985. Выбор условий трансформации определяется клеткой-хозяином. Таким образом, бактериальный хозяин, такой как Е. coli, может быть обработан растворомCaCl2 (Cohen et al., Proc. Nat. Acad. Sci., 1973, 69, 2110) или раствором, содержащим смесь RbCl, MnCl2,ацетата калия и глицерина, и затем 3-[N-морфолино]-пропансульфоновой кислотой, RbCl и глицерином. Клетки млекопитающих в культуре могут быть трансформированы кальциевой копреципитацией векторной ДНК на клетки. Изобретение также включает клетку-хозяина, трансформированную реплицируемым вектором экспрессии по изобретению. ДНК может быть кодон-оптимизирована стандартными методиками для дополнительного облегчения экспрессии в соответствующем хозяине. Культивирование трансформированной клетки-хозяина в условиях, делающих возможной экспрессию ДНК-полимера, проводят обычным образом, как описано, например, в Maniatis et al. и "DNA-8 016818 веществами и культивируют при температуре менее 50 С. Белки по настоящему изобретению могут быть экспрессированы в прокариотах или эукариотах, таких как дрожжи, но их часто экспрессируют в Е. coli. Конкретные штаммы Е. coli включают такие какAR58: криптический Л-лизоген, имеющий происхождение из N99, представляющего собой galBLR (DE3) Novagen, WI, USA (номер по каталогу 69053-4): может быть использован BLR, представляющий собой recA- производное BL21. В большинстве случаев включают селектируемый маркер,например, устойчивости к канамицину или устойчивости к ампициллину для облегчения установления успешного встраивания рекомбинантного гена/конструкции в систему экспрессии. Продукт выделяют обычными способами в соответствии с клеткой-хозяином и в соответствии с локализацией продукта экспрессии (внутриклеточного или секретируемого в культуральную среду или в периплазму клетки). Таким образом, там, где клетка-хозяин является бактериальной, такой как Е. coli,она может, например, быть лизирована физически, химически или ферментами, и из получаемого лизата может быть выделен белковый продукт. Там, где клетка-хозяин представляет собой клетку млекопитающего, продукт может в большинстве случаев быть выделен из питательной среды или из свободных от клеток экстрактов. Обычные методики выделения белков включают селективное осаждение, адсорбционную хроматографию и аффинную хроматографию, включая колонку для аффинной хроматографии с моноклональным антителом. Белки по настоящему изобретению представлены либо в растворимой, либо в жидкой форме, либо в лиофилизированной форме. Согласно настоящему изобретению также предложена фармацевтическая композиция, такая как вакцина, содержащая слитый белок по настоящему изобретению и фармацевтически приемлемый эксципиент. При введении фармацевтические композиции по настоящему изобретению могут быть введены в фармацевтически приемлемых препаратах. Такие препараты могут обычно содержать фармацевтически приемлемые концентрации солей, буферных агентов, консервантов, совместимых носителей, дополнительных агентов, усиливающих иммунный ответ, таких как адъюванты и цитокины, и, возможно, другие терапевтические агенты. Несомненно, количества будут зависеть от конкретного состояния, подлежащего лечению, тяжести состояния, индивидуальных данных пациента, включая возраст, физическое состояние, морфометрические данные и массу тела, продолжительности лечения, характера сопутствующей терапии (если ее проводят), конкретного пути введения и подобных факторов, в объеме знаний и компетенции практикующего врача. Эти факторы хорошо известны специалистам в данной области техники и могут быть рассмотрены при обычном проведении исследования. В большинстве случаев предпочтительно использование максимальной дозы отдельных компонентов или их комбинаций, т.е. наибольшей безопасной дозы в соответствии со здравым медицинским смыслом. Тем не менее, специалистам в данной области техники будет ясно, что пациент может настаивать на меньшей дозе или переносимой дозе по медицинским причинам, физиологическим причинам или по практически любым другим причинам. Ожидают, что в большинстве случаев каждая доза для человека будет содержать от 1 до 1000 мкг белка и предпочтительно 30-300 мкг. В одном аспекте фармацевтические композиции, используемые для введения слитых белков по изобретению, будут представлять собой вакцину. Вакцина может, возможно, содержать один или более другие опухольассоциированные антигены, полипептиды и/или пептиды. Например, члены, принадлежащие семействам MAGE, LAGE и GAGE. Комбинация NY-ESO-1/LAGE-1 и MAGE. В одном воплощении настоящего изобретения предложена композиция, содержащая (а) антигенный компонент, содержащий антиген NY-ESO-1 или LAGE-1 или слитый белок, как описано здесь, и (б) антигенный компонент, содержащий антиген MAGE или слитый белок. В одном воплощении композиция может дополнительно содержать адъювант, как описано здесь. Антиген MAGE для применения в комбинации может содержать антиген MAGE полной длины. Альтернативно, антиген MAGE может содержать иммуногенную часть MAGE, где 1, 2, 3, 4, 5, 6, 7, 8, 9,10 или более аминокислот аминокислотной последовательности могут быть удалены или замещены. В одном воплощении настоящего изобретения 2 аминокислоты могут быть удалены из N-конца последовательности MAGE. В одном воплощении настоящего изобретения, где антиген представляет собойMAGE-А 3 или его иммуногенную часть, последовательность MAGE-А 3 может представлять собой последовательность от 3 до 314 аминокислоты MAGE-A3. В одном воплощении настоящего изобретения предложена композиция, содержащая антиген NYESO-1/LAGE-1 и/или слитый белок, как описано здесь, и слитый белок, содержащий антиген MAGE-А 3. В альтернативном воплощении слитый белок, содержащий антиген MAGE-А 3, содержит или состоит из антигена MAGE-А 3 и белка-партнера по слиянию, содержащего примерно, или приблизительно, или приближенно первые 109 аминокислот белка D, где одна, или две, или более аминокислоты из белка D,возможно, замещены и где, возможно, присутствует сигнальная последовательность белка D в дополне-9 016818 ние к первым 109 аминокислотам белка D. Слитые белки по настоящему изобретению могут, возможно, дополнительно содержать одну или более аминокислоту в качестве линкеров между последовательностями антигена и партнеров по слиянию, или белков-партнеров по слиянию, или между антигеном и His-хвостом, если он присутствует. Аминокислоты могут быть неродственными последовательностям антигена и/или партнера по слиянию. Слитые белки по настоящему изобретению, как описано здесь, могут дополнительно содержать аминокислоты Met-Asp-Pro на N-конце последовательности слитого белка. Аминокислота Met может иметь происхождение от исходной последовательности белка D или может иметь происхождение от неродственной последовательности. В одном воплощении последовательность слитого белка, содержащего MAGE-А 3 и белок D, для использования в комбинациях по настоящему изобретению показана в SEQ ID NO: 98. SEQ ID NO: 98 отN-конца содержит следующие характерные участки: Настоящее изобретение также включает способы изготовления указанных вакцин/композиций и слитые белки и вакцины/композиции, которые получают или которые можно получить описанными способами. Изготовление вакцин в целом описано в Vaccine Design ("The subuni t and adjuvant approach" (eds.Powel I M.F.Newman M.J). (1995) Plenum Press New York). Инкапсуляция в липосомы описана Fullerton, патент США 4235877. Слитые белки по настоящему изобретению могут быть снабжены адъювантами в вакцинной композиции по изобретению. Подходящие адъюванты включают соли алюминия, такие как гель гидрата окиси алюминия (квасцы) или фосфат алюминия, но могут также представлять собой соль кальция, железа или цинка или могут представлять собой нерастворимую суспензию ацилированного тирозина или ацилированные сахара, катионно или анионно дериватизированные полисахариды, или полифосфазены. Другие известные адъюванты включают CpG-содержащие олигонуклеотиды. Эти олигонуклеотиды характеризуются тем, что динуклеотид CpG не метилирован. Такие олигонуклеотиды хорошо известны и описаны,например, в WO 96/02555. В композиции по изобретению может быть желательным, чтобы адъювантная композиция индуцировала иммунный ответ преимущественно ТН 1-типа. В одном воплощении предложена адъювантная система, включающая, например, комбинацию монофосфориллипида А, предпочтительно 3-де-Оацилированного монофосфориллипида A (3D-MPL), совместно с солью алюминия. CpGолигонуклеотиды могут также индуцировать ТН 1-ответ и могут также быть включены. В одном воплощении предложена композиция, содержащая слитый белок, как описано здесь, и адювантную композицию, содержащую комбинацию монофосфориллипида А и производного сапонина,в частности комбинацию QS21 и 3D-MPL, как раскрыто в WO 94/00153, или менее реактогенную композицию, где QS21 блокирован холестерином, как раскрыто в WO 96/33739. Одна композиция, которая может быть использована, содержит QS21, 3D-MPL и токоферол, например, в эмульсии типа масло в воде, описана в WO 95/17210. Другая адъювантная композиция для использования в настоящем изобретении может содержать QS21, 3D-MPL и CpG или их эквивалент, например, в эмульсии типа масло в воде или в виде липосомной композиции. Соответственно, в одном воплощении настоящего изобретения предложена вакцина, содержащая слитый белок по изобретению и адъювант, например, как описано выше. Настоящее изобретение также включает способы изготовления вакцин и композиций, содержащих слитые белки, как описано здесь. В настоящем изобретении также предполагают доставку нуклеиновых кислот, полипептидов или пептидов, описанных здесь, для вакцинации. Доставка полипептидов и пептидов может быть осуществлена в соответствии со стандартными протоколами вакцинации, хорошо известными в данной области техники. В другом воплощении доставка нуклеиновых кислот может быть осуществлена ex vivo способами, т.е. удалением клетки из субъекта, генетическим конструированием клетки для включения антигена, ассоциированного с раком, и возвращением конструированной клетки в субъекта. В большинстве случаев это может включать in vitro введение функциональной копии гена в клетку(клетки) субъекта и- 10016818 возврат генетически конструированной клетки(клеток) субъекту. Функциональная копия гена находится под функциональным контролем регуляторных элементов, которые делают возможной экспрессию гена в генетически конструированной клетке(клетках). Множество методик трансфекции и трансдукции, а также подходящих векторов экспрессии хорошо известны специалисту в данной области техники, некоторые из которых описаны в заявке РСТ WO 95/00654. Согласно изобретению также предполагают доставку нуклеиновых кислот in vivo с использованием векторов, таких как вирусы и направленные липосомы. Список сокращений СО - коллагеноподобная область,W/Ocoll - без коллагеноподобной области (коллагеноподобного домена),PD1/3 - первая треть белка D. Типичные воплощения слитых белков и кодирующие их нуклеотидные последовательности представлены в табл. 1-3. Таблица 1 Представлены типичные воплощения слитых белков и кодирующие их нуклеотидные последовательности. Каждая нуклеотидная последовательность описана по существу, обозначена уникальным идентификатором нуклеотидной последовательности (SEQ ID NO:) и изложена в перечне последовательностей. Каждый слитый белок описан по существу, обозначен уникальным идентификатором аминокислотной последовательности (SEQ ID NO:) и изложен в перечне последовательностей.- 17016818 Таблица 2 Представлены дополнительные типичные воплощения слитых белков и кодирующие их нуклеотидные последовательности. Каждая нуклеотидная последовательность описана по существу, обозначена уникальным идентификатором нуклеотидной последовательности (SEQ ID NO:) и изложена в перечне последовательностей. Каждый слитый белок описан по существу, обозначен уникальным идентификатором аминокислотной последовательности (SEQ ID NO:) и изложен в перечне последовательностей.- 18016818 Таблица 3 Представлены дополнительные типичные воплощения слитых белков и кодирующие их нуклеотидные последовательности. Каждая нуклеотидная последовательность описана по существу, обозначена уникальным идентификатором нуклеотидной последовательности (SEQ ID NO:) и изложена в перечне последовательностей. Каждый слитый белок описан по существу, обозначен уникальным идентификатором аминокислотной последовательности (SEQ ID NO:) и изложен в перечне последовательностей.- 20016818 Таблица 4 Представлены слитые белки, обсуждаемые в Примерах, и кодирующие их нуклеотидные последовательности. Каждая нуклеотидная последовательность описана по существу, обозначена уникальным идентификатором нуклеотидной последовательности (SEQ ID NO:) и изложена в перечне последовательностей. Каждый слитый белок описан по существу, обозначен уникальным идентификатором аминокислотной последовательности (SEQ ID NO:) и изложен в перечне последовательностей. Как будет ясно из перечня последовательностей, многие из конструкций табл. 4 имеют сходную структуру с одним или более воплощением, изложенным в предыдущих таблицах. Например, LVL068 имеет сходную структуру с воплощением, изложенным как SEQ ID NO: 45, табл. 1. LVL076 имеет сходную структуру с воплощением, изложенным как SEQ ID NO: 25, табл. 1. LVL078 имеет сходную структуру с воплощением, изложенным как SEQ ID NO: 33, табл. 1. LVL079 имеет сходную структуру с воплощением, изложенным как SEQ ID NO: 37, табл. 1. В дополнение некоторые из конструкций слитых белков, изложенных в табл. 4, а именно LVL155,LVL106, LVL156, LVL157, LVL151, были образованы обычными модификациями других последовательностей слитых белков, изложенных в табл. 4, а именно LVL068, LVL030, LVL076, LVL078, LVL024 соответственно. Такие модификации включают удаление аминокислотных остатков между белком D и началом химерных конструкций (т.е. части, имеющей происхождение от любого из NY-ESO-1 и LAGE1) и удаление аминокислот между his-меткой и началом химерных конструкций. Таким образом, определенные слитые белки табл. 4 хорошо соответствуют другим слитым белкам табл. 4. Соответствие между этими слитыми белками изложено в табл. 5 и описано более подробно в примере 4. Таблица 5 Соответствие между LVL068, LVL030, LVL076, LVL078, LVL024 и модифицированными Примеры Пример 1. Разработка и получение химерного белка NY-LA1. Некоторые слитые белки NY-ESO-1/LAGE-1 были разработаны с и без коллагеноподобного домена и с или без концевой области белка D, как суммировано на фиг. 17. Образованные конструкции были кодон-оптимизированы для экспрессии в Escherichia coli. Синтетический ген выстраивали объединением олигонуклеотидов и/или ПЦР-продуктов. Фрагмент клонировали в каркас pGA4 (AmpR) с использованием сайтов рестрикции Kpnl и Sacl с добавлением сайтов Ndel и Xhol в 5'-конец и 3'-конец оптимизированного гена соответственно. Плазмидную ДНК очищали из трансформированных бактерий и концентрацию определяли спектрометрией в ультрафиолете (УФ-спектрометрией). Конечную конструкцию проверяли секвенировани- 21016818 ем. Оптимизированную кодирующую последовательность для различных химерных конструкцийNY/LAGE субклонировали непосредственно во множественный сайт клонирования рЕТ 19 (AmpR) с использованием сайтов рестрикции Ndel и Xhol для получения химерных экспрессионных плазмидNY/LAGE. Для клонирования в рЕТ 26 были разработаны ПЦР-праймеры для добавления N-концевого гистидинового хвоста. Эта амплификация приводила к добавлению хвоста из 6 гистидинов в фазе с кодирующей областью различных конструкций. Этот амплифицированный фрагмент ферментативно расщепляли рестриктазами Ndel/Xhol и различные химерные конструкции NY/LAGE затем клонировали во множественный сайт клонирования рЕТ 26 (KanR) для получения экспрессионной плазмиды. Конечные конструкции проверяли секвенированием. Получение во встряхиваемой колбе. Рост и индукция бактериального штамма-хозяина Культивирование Бактерии выращивали в 800 мл жидкой среды (BD) Лурия-Бертани (LB) + 1% (процентное соотношение массы и объма (w/v глюкозы (Laboratoire MAT, номер по каталогу GR-0101) + антибиотик (карбенициллин 100 мкг/мл для рЕТ 19, канамицин 40 мкг/мл для рЕТ 26) в 2,5 л встряхиваемой колбе. Культуры инкубировали при 37 С для клеток BLR (DE3) до оптической плотности при 600 нм (O.D.6oonm) приблизительно 0,8. Индукция При O.D.600nm приблизительно 0,8 культуры BLR (DE3) индуцировали 1 мМ изопропилD-1 тиогалактопиранозидом (IPTG; EMD Chemicals Inc., номер по каталогу 5815) и инкубировали в течение 16-18 ч при 16 С. С использованием конструкций LVL106, 151, 155 и 157 получали от 5 до 15 мг специфичного белка/800 мл. Образование белка для каждой конструкции суммировано на фиг. 17. Пример 2. Краткое изложение предварительной очистки и стабильности. Выделение и очистка белка Клетки собирают центрифугированием и затем разрушают физическим или химическим способом и получаемый неочищенный экстракт сохраняют для выделения рассматриваемого полипептида. Очистка Экспрессированные рекомбинантные белки солюбилизировали раствором гидрохлорида гуанидина и наносили на смолу для аффинной хроматографии с использованием иммобилизованных металлов(IMAC). Белки затем отмывали на колонке 8 М и 4 М растворами мочевины перед элюированием возрастающей концентрацией имидазола. Белки затем обессоливали в конечном буфере с 4 М мочевиной, рН 7,0 для дальнейшего применения. Очистку оценивали электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестерн-блоттингом для верификации чистоты и идентичности белков. Исследование очищенного слитого белка на стабильность Исследования стабильности проводили при 37 С и белки оценивали посредством SDS-PAGE. Предварительное исследование стабильности не выявило больших проблем. Предварительное исследование растворимости Растворимость белков оценивали и суммировали в следующей схеме. Схема 1 Растворимость слитых белков- 22016818 Пример 3. Внутримышечная иммунизация слитыми белками. Слитые белки подвергали доклинической оценке в мышиной модели, включающей серию экспериментов скрининга с внутримышечными иммунизациями, как описано ниже. Выбранная мышиная модель представляла собой модель CB6F1, первое поколение, полученное от скрещивания мышей C57BL6 и мышей Balb/c. Такие мыши имеются в продаже от Charles River Laboratories, Inc., 251 Ballardvale Street,Wilmington, MA 01887-1000. Выбранная опухолевая клеточная линия представляла собой линию В 16(клеточная линия мышиной меланомы), перевиваемую мышиную меланому, имеющуюся в продаже для исследований способов лечения рака. Скрининг 1 План эксперимента. В 76-дневном исследовании мышей CB6F1 использовали для оценки каждого из LVL076, LVL079, LVL078, LVL068, LVL020, LVL026, LVL024, LVL030 для определения того, обеспечивала ли внутримышечная иммунизация слитым белком и адъювантом защиту против подкожного заражения перевиваемыми опухолевыми клетками (B16/NYESO1). Конкретно, мышей иммунизировали внутримышечно 50 мкл инъекциями, содержащими 15 мкг белка и адъювант. Выбранный адъювант представлял собой AS15. AS15 является липосомной адъювантной композицией, содержащей QS21, 3DMPL и CpG. Исследования проводили со слитыми белками, изложенными в 1 А и 1 Б ниже. Мышей разделяли на две группы по 15 мышей на группу. Мышей иммунизировали в 0 день и повторно в 14 день следующим образом. Исследование 1 А:LAGE-1a без коллагеноподобного домена (CLD);MAGE A3. По шесть мышей на группу заражали подкожной трансплантацией опухолей B16/NY-ESO-1 в 28 день. Гуморальный ответ на непроцессированный NY-ESO-1, LAGE-1a без коллагеноподобного домена и человеческий коллаген оценивали на 0, 14, 28 и 76 день твердофазным иммуноферментным анализом(ELISA) (IgG1 и IgG2a). Клеточно-опосредованный ответ оценивали клеточным сортером с возбуждением флуоресценции (FACS) на 28 день с использованием собранных спленоцитов (повторная стимуляция 3 пулов из 3 пулами пептидов NY-ESO-1 и LAGE-1a). План эксперимента скрининга 1 кратко изложен на фиг. 18. Результаты. Из четырех контролей только непроцессированный NY-ESO-1 обеспечивал некоторую защиту по сравнению с буфером. См. фиг. 19. В группах мышей, получавших либо непроцессированныйNY-ESO-1, либо LVL030, у двух из каждой группы не было опухоли при окончании исследования. Из мышей, получавших LVL068, у четырех не было опухоли при окончании исследования. LVL068 иLVL078 обеспечивали более длительную выживаемость по сравнению с мышами, получавшими буферы. См. фиг. 20. NY-ESO-1-специфичные иммунные ответы оценивали посредством ELISA, FACS и вестернблоттинга. LAGE-1a (без коллагеноподобного домена)-специфичные иммунные ответы оценивали посредством ELISA и FACS. См. фиг. 21. Эти результаты суммированы в следующей схеме.- 23016818 Схема 2 Краткое изложение специфичного иммунитета Обозначения: (-) - наименьший ответ; (+) - средний ответ;- наибольший ответ. Скрининг 2 План эксперимента. В 105-дневном исследовании мышей CB6F1 использовали для оценки каждого из LVL076, LVL078, LVL068 и LVL024 для определения того, обеспечивала ли внутримышечная иммунизация слитым белком и адъювантом защиту против подкожного заражения трансплантированными опухолевыми клетками B16/NYESO1 (после двух иммунизаций) или опухолевыми клеткамиB16/NYESO-1a (после четырех иммунизаций). Конкретно мышей иммунизировали внутримышечно 50 мкл инъекциями, содержащими 15 мкг белка и 25 мкл адъюванта AS15. Мышей разделяли на группы по 29 мышей на группу. Мышей иммунизировали в 0, 14, 28 и 42 дни следующим образом. Исследование:LAGE-1a без коллагеноподобного домена (CLD);MAGE A3. По десять мышей на группу заражали подкожной трансплантацией опухолевых клеток B16/NYESO-1 на 28 день. По девять мышей на группу заражали подкожной трансплантацией опухолевых клетокB16/LAGE-1A на 56 день. На 0, 14, 28, 42 56, 84 и 105 дни брали сыворотку и гуморальный ответ на (1) непроцессированный NY-ESO-1, (2) LAGE-1a без коллагеноподобного домена и (3) человеческий коллаген оценивали посредством ELISA (IgG1 и IgG2a). План эксперимента скрининга 2 суммирован на фиг. 22 и 23. Результаты. Заражение опухолью B16-NYESO1. Из мышей, получавших LVL078, у двух не было опухоли в течение более чем 50 дней после заражения B16-NY-ESO-1. Из мышей, получавших либо непроцессированный NY-ESO-1, либо LVL024, у двух из каждой группы не было опухоли в течение более чем 50 дней, три были живы. Из мышей, получавших LVL068, у трех не было опухоли, и четыре были живы. Из мышей, получавших LVL076, у трех не было опухоли, и пять были живы. См. фиг. 24. Заражение опухолью В 16-LAGE1a. Все мыши, получавшие LVL076 или LAGE-1a без коллагеноподобной области, умерли ранее 40 дня после заражения. Из мышей, получавших только буфер, выжила одна, и до окончания исследования у нее не было опухоли. Из мышей, получавших LVL024, у одной не было опухоли при окончании исследования. У всех мышей, получавших непроцессированный NY-ESO-1, были опухоли, но одна была еще жива при окончании исследования. Из мышей, получавших LVL078, у одной не было опухоли. Из мышей, получавших LVL068, у трех не было опухоли. Из мышей, получавших LVL076, у трех не было опухоли при окончании исследования. См. фиг. 25. Эти результаты суммированы в следующей схеме.- 24016818 Схема 3 Защита против заражения опухолью B16-LAGE1a Обозначения: (-) - наименьший;- следующий наименьший ответ; (+) - средний ответ;- наибольший ответ. Специфичные иммунные ответы против человеческого коллагена Для изучения того, стимулировал ли коллагеноподобный домен NY-ESO-1 специфичные иммунные ответы против человеческого коллагена, на 14 день после заражения собирали и объединяли сыворотку от мышей, иммунизированных одним из следующего: (1) буферами (контроль); (2) непроцессированнымLVL076. ELISA проводили для каждого из этих семи пулов сыворотки, а также для положительного контроля, содержащего моноклональное антитело (mAb) против человеческого коллагена I типа. Коллагеноподобный домен не стимулировал выработку мышиных антител против человеческого коллагена I типа. См. фиг. 26. Сходные исследования (результаты не показаны) были проведены для коллагена III типа и коллагена VI типа; не было выявлено выработки ни мышиных антител против человеческого коллагенаIII типа, ни мышиных антител против человеческого коллагена VI типа. Пример 4. Очищенные конструкции. Модификации проводили с применением обычных методик клонирования на некоторых из конструкций, перечисленных в табл. 4. Конкретно LVL068, LVL030, LVL076, LVL078, LVL024 были модифицированы с образованием LVL155, LVL106, LVL156, LVL157, LVL151. Было два типа модификаций,первый из которых представлял собой удаление 5 аминокислотных остатков между белком D и началом химерных конструкций. Например, эту модификацию проводили с LVL024 (SEQ ID NO: 74; SEQ ID NO: 75) с образованием LVL151 (SEQ ID NO: 90; SEQ ID NO: 91). Таким образом, LVL024 соответствуетLVL151. Второй тип модификаций представлял собой удаление аминокислот между his-меткой и началом химерной конструкции. Эту модификацию проводили с LVL068 (SEQ ID NO: 80; SEQ ID NO: 81) с образованием LVL155 (SEQ ID NO: 92; SEQ ID NO: 93). Таким образом, LVL068 соответствует LVL151. Каждая конструкция слитого белка, которая была модифицирована, и конструкция слитого белка, которой она соответствует, изложена в табл. 5 описания. Следует понимать, что согласно ожиданиям описанные выше модификации не приведут к функциональным различиям между слитым белком и его соответствующим модифицированным слитым белком. Таким образом, ожидают, что каждый модифицированный слитый белок, перечисленный с правой стороны в табл. 5, можно использовать взаимозаменяемо с его соответствующим слитым белком, перечисленным с левой стороны схемы. Пример 5. План эксперимента. В 105-дневном исследовании мышей CB6F1 используют для оценки каждого изLVL068, LVL030, LVL076, LVL078, LVL024 и модифицированных LVL155, LVL106, LVL156, LVL157,LVL151 для изучения внутримышечной иммунизации слитым белком и адъювантом против подкожного заражения трансплантированными опухолевыми клетками B16/NYESO1 (после двух иммунизаций) или опухолевыми клетками B16/NYESO-1a (после четырех иммунизаций). Конкретно мышей иммунизируют внутримышечно 50 мкл инъекциями, содержащими 15 мкг белка и 25 мкл адъюванта AS 15. Мышей разделяют на группы по 29 мышей на группу. Мышей иммунизируют на 0, 14, 28 и 42 дни следующим образом. Исследование:MAGE A3. По десять мышей на группу заражают подкожной трансплантацией опухолевых клеток B16/NYESO-1 на 28 день. По девять мышей на группу заражают подкожной трансплантацией опухолевых клетокB16/LAGE-1A на 56 день. Для мониторинга специфичного иммунного ответа на 0, 14, 28, 42, 56, 84 и 105 дни можно брать сыворотку и оценивать гуморальный ответ на (1) непроцессированный NY-ESO-1, (2)LAGE-1a без коллагеноподобного домена и (3) человеческий коллаген посредством ELISA (IgG1 иIgG2a). Предшествующие примеры представлены в качестве иллюстрации, но никоим образом не являются ограничивающими. Использованные в данном описании термины, которые указывают на неопределенное количество,могут означать один или более. В качестве примера элемент обозначает один или более элементов. Предполагают, что в каждом случае при использовании здесь термины приблизительно и примерно могут быть удалены или заменены термином точно по требованию заявителя. Единицы, приставки и символы могут быть обозначены в их форме, приемлемой в Международной системе единиц (СИ). Если не указано иное, нуклеиновые кислоты пишут слева направо в 5'-3'ориентации; аминокислотные последовательности пишут слева направо в ориентации от N-конца к Сконцу соответственно. Численные интервалы включают числа, задающие интервал. Аминокислоты могут здесь быть названы либо их общеизвестными трехбуквенными символами, либо однобуквенными символами, рекомендованными IUPAC-IUB Biochemical Nomenclature Commission. Сходным образом, нуклеотиды могут быть названы их общепринятыми однобуквенными кодами. Определенные выше термины определены более полно посредством ссылки на все описание. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Слитый белок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из LVL106 (SEQ ID NO: 89), LVL030 (SEQ ID NO: 79), LVL155 (SEQ ID NO: 93), LVL068 (SEQID NO: 81), LVL157 (SEQ ID NO: 97) и LVL078 (SEQ ID NO: 85). 2. Молекула нуклеиновой кислоты, кодирующая слитый белок по п.1. 3. Вектор, содержащий молекулу нуклеиновой кислоты по п.2. 4. Клетка-хозяин, трансформированная вектором по п.3. 5. Иммуногенная композиция или вакцина, содержащая слитый белок по п.1. 6. Иммуногенная композиция по п.5, дополнительно содержащая адъювант и/или иммуностимулирующий цитокин или хемокин. 7. Иммуногенная композиция или вакцина по п.5 или 6, где слитый белок присутствует в эмульсионном наполнителе типа масло в воде или типа вода в масле. 8. Иммуногенная композиция или вакцина по п.6 или 7, содержащая один или более из следующих адъювантов: 3D-MPL (3-де-О-ацилированный монофосфориллипид A), QS21 или CpG-олигонуклеотид. 9. Иммуногенная композиция или вакцина по любому из пп.5-8, дополнительно содержащая один или более других антигенов. 10. Применение слитого белка по п.1, или молекулы нуклеиновой кислоты по п.2, или вектора по п.3, или композиции или вакцины по любому из пп.5-9 в изготовлении лекарственного средства для лечения рака.
МПК / Метки
МПК: C07K 14/47
Метки: содержащие, lage-1, опухоли, отторжения, слитые, белки, антигены, ny-eso-1
Код ссылки
<a href="https://eas.patents.su/30-16818-slitye-belki-soderzhashhie-antigeny-ottorzheniya-opuholi-ny-eso-1-i-lage-1.html" rel="bookmark" title="База патентов Евразийского Союза">Слитые белки, содержащие антигены отторжения опухоли ny-eso-1 и lage-1</a>
Предыдущий патент: Специфическая терапия, использующая интегриновые лиганды для лечения рака
Следующий патент: Производные 1-(-d-гликопиранозил)-3-(4-циклопропилфенилметил)-4-галогеноиндола и их применение в качестве ингибиторов sglt
Случайный патент: Способ инверсионно-вольтамперометрического определения палладия в нитритной среде












