Производные 2-пиперазин-1-ил-3н-имидазо[4,5-b]пиридина
Номер патента: 16422
Опубликовано: 30.04.2012
Авторы: Гийемон Жером Эмиль Жорж, Бонфанти Жан-Франсуа, Соммен Франсуа Мария, Янссенс Франс Эдуард
Формула / Реферат
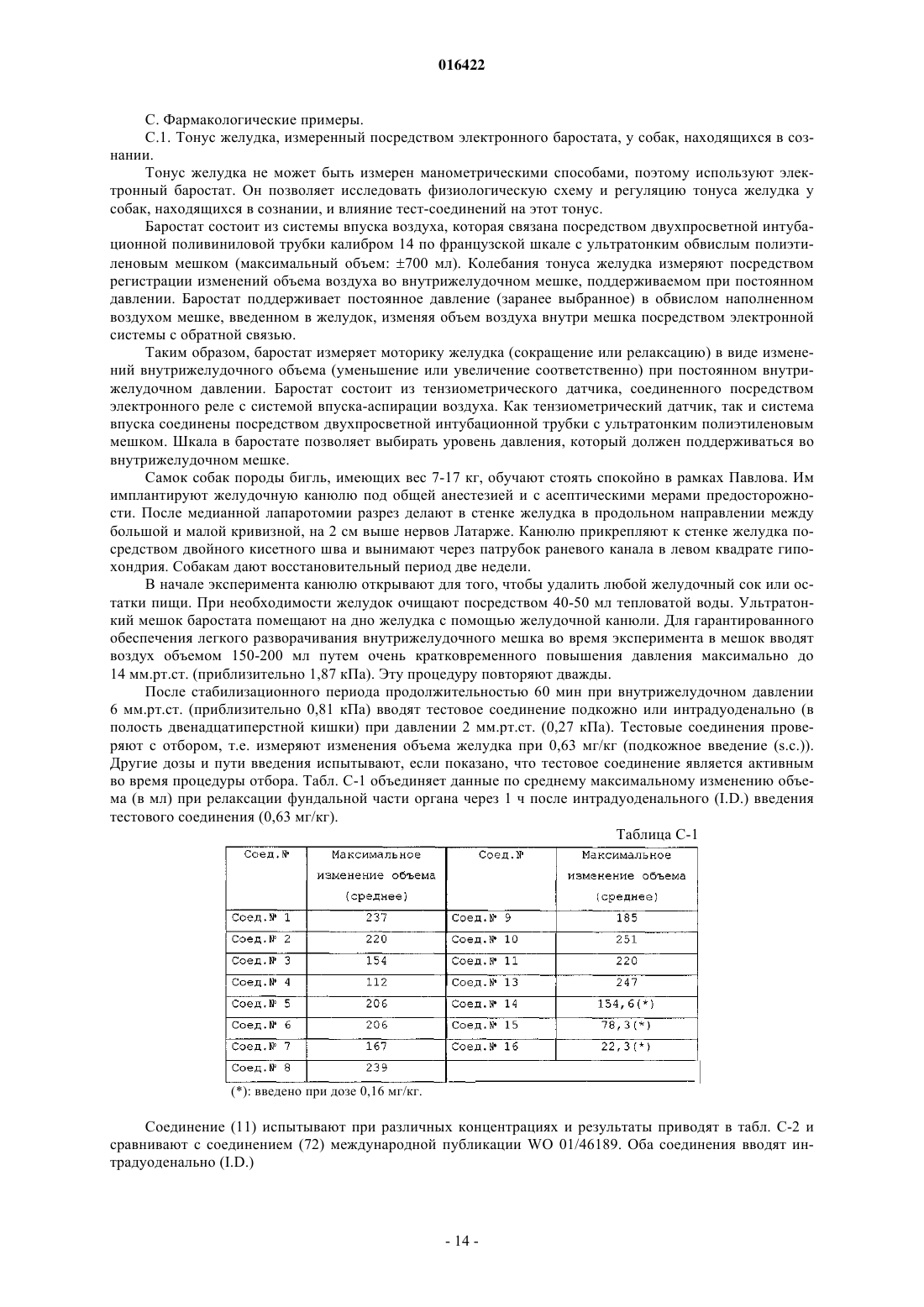
1. Соединение формулы (I)
включающей его любую стереохимически изомерную форму, где
R1 представляет собой водород, фенилметил, пиридинилметил или бензо[1,3]диоксолилметил;
R2 представляет собой C1-4алкил;
R3 представляет собой водород, галоген или C1-4алкил;
R4 представляет собой водород, галоген или C1-4алкил и
R5 представляет собой водород, аминогруппу, C1-4алкиламиногруппу или ди(C1-4алкил)аминогруппу;
или его фармацевтически приемлемые соли присоединения кислоты, или его сольват.
2. Соединение по п.1, где R1 представляет собой водород.
3. Соединение по п.1, где R1 представляет собой фенилметил.
4. Соединение по любому из пп.1-3, где R2 представляет собой метил.
5. Соединение по п.1, где соединение представляет собой 2-(4-бензилпиперазин-1-ил)-3-метил-3H-имидазо[4,5]пиридин или его фармацевтически приемлемые соли присоединения кислоты.
6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-5.
7. Способ получения фармацевтической композиции по п.6, где терапевтически активное количество соединения по любому из пп.1-5 смешивают до получения однородной массы с фармацевтически приемлемым носителем.
8. Применение соединения по любому из пп.1-5 в качестве лекарственного препарата для лечения гастроэзофагеального рефлюкса, изжоги, диспепсии, чувства быстрого насыщения, вздутия живота/метеоризма и анорексии.
9. Применение соединения по любому из пп.1-5 для производства лекарственного препарата для лечения гастроэзофагеального рефлюкса, изжоги, диспепсии, чувства быстрого насыщения, вздутия живота/метеоризма и анорексии.
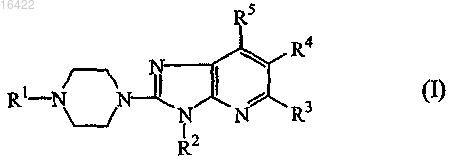
10. Способ получения соединения формулы (I), где
промежуточное соединение формулы (II) подвергают N-алкилированию с промежуточным соединением формулы (III) в реакционно инертном растворителе
где в вышеприведенной реакционной схеме радикалы R1 представляют собой фенилметил, пиридинилметил или бензо[1,3]диоксолилметил;
R2, R3, R4 и R5 являются такими же, как определены в п.1, и
W представляет собой соответствующую уходящую группу;
и, если желательно, соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты или, наоборот, соль присоединения кислоты соединения формулы (I) превращают в форму свободного основания посредством обработки щелочью; и, если желательно, получают его стереохимически изомерные формы.
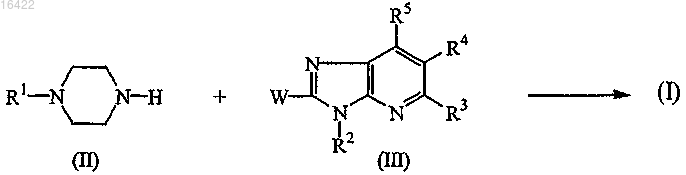
11. Способ получения соединения формулы (I), где
промежуточное соединение формулы (IV) подвергают N-алкилированию с соединением формулы (I-а) в реакционно инертном растворителе
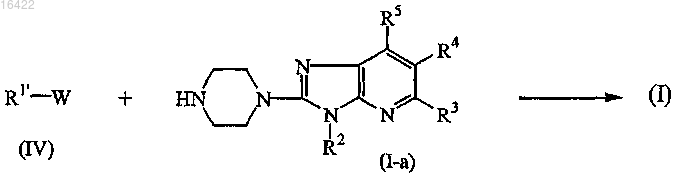
где в вышеприведенных реакционных схемах радикалы R1' представляют собой фенилметил, пиридинилметил или бензо[1,3]диоксолилметил;
R2, R3, R4 и R5 являются такими же, как определены в п.1; и
W представляет собой соответствующую уходящую группу;
и, если желательно, соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты или, наоборот, соль присоединения кислоты соединения формулы (I) превращают в форму свободного основания посредством обработки щелочью; и, если желательно, получают его стереохимически изомерные формы.
Текст
Настоящее изобретение связано с новыми соединениями формулы (I), обладающими релаксационной активностью в отношении фундальной части желудка. Изобретение дополнительно относится к способам получения таких соединений, к фармацевтическим композициям, содержащим упомянутые соединения, а также к применению упомянутых соединений в качестве лекарственного препарата. Янссенс Франс Эдуард (BE), Гийемон Жером Эмиль Жорж (FR), Соммен Франсуа Мария (BE), Бонфанти ЖанФрансуа (FR) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) 016422 Настоящее изобретение относится к новым соединениям формулы (I), обладающим фундальной релаксационной активностью. Дополнительно, изобретение относится к способам получения таких соединений, к фармацевтическим композициям, содержащим упомянутые соединения, а также к применению упомянутых соединений в качестве лекарственного средства. ЕР-А-0079545 раскрывает пиперазинилзамещенные бензимидазольные производные с антигистаминной активностью. ЕР-0397613 раскрывает аминоимидазопиридины, обладающие антигистаминной активностью, и ЕР-0512939 раскрывает 2-пиперазинилбензимидазольные производные в качестве антагонистов серотониновых 5 НТ 3 рецепторов. ЕР-1250337 раскрывает замещенные гомопиперидинильные бензимидазольные аналоги в качестве фундальных релаксантов. Настоящее изобретение касается соединений формулы (I) включающей их любую стереохимически изомерную форму, гдеR5 представляет собой водород, аминогруппу, C1-4 алкиламиногруппу или ди(C1-4 алкил)аминогруппу; или их фармацевтически приемлемой соли присоединения кислоты или их сольвата. Как использовано в вышеприведенных определениях галоген является общим термином, включающим фтор, хлор, бром и йод;C1-4 алкил определяет насыщенные углеводородные радикальные группы с неразветвленной и разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил,1-метилэтил, 2-метилпропил и т.п. Термин "стереохимически изомерные формы", использованный выше в данном документе, определяет все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не упомянуто или не указано иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, где упомянутые смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикальных группах могут иметь либо цис-, либо трансконфигурацию. Несомненно подразумевается, что стереохимически изомерные формы соединений формулы (I) включены в объем этого изобретения. Абсолютная стереохимическая конфигурация соединений формулы (I) и промежуточных соединений, использованных в их приготовлении, может быть легко определена специалистами в данной области при использовании общеизвестных способов, таких как, например, дифракция рентгеновских лучей. Кроме того, некоторые соединения формулы (I) и некоторые из промежуточных соединений, использованных в их приготовлении, могут проявлять полиморфизм. Следует понимать, что настоящее изобретение охватывает любые полиморфные формы, обладающие свойствами, полезными в лечении состояний, отмеченных в этом документе выше. Фармацевтически приемлемые соли присоединения кислоты, которые упомянуты выше в этом документе, предназначены для включения терапевтически активных нетоксичных форм на основе солей присоединения кислоты, которые способны образовывать соединения формулы (I). Такие фармацевтически приемлемые соли присоединения кислоты могут быть легко получены путем обработки основной формы соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородная или бромисто-водородная кислота, серная, азотная, фосфорная и тому подобные кислоты; или органические кислоты, такие как, например, уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная,щавелевая (т.е. этандиовая кислота), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая,фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая,п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и тому подобные кислоты. И наоборот, вышеупомянутые солевые формы могут быть превращены в форму свободного основания путем обработки соответствующим основанием. Соединения формулы (I) могут существовать как в несольватированных, так и в сольватированных формах. Термин "сольват" используют в этом документе для описания ассоциации молекул, включающей соединение изобретения и одну или более молекул фармацевтически приемлемого растворителя,например воды или этанола. Термин "гидрат" используют в том случае, когда упомянутый растворитель представляет собой воду.-1 016422 Представляют интерес соединения формулы (I), включающие одно или более из следующих ограничений:e) R3, R4 и R5 представляют собой водород. Соединения формулы (I) вообще могут быть приготовлены путем N-алкилирования промежуточного соединения формулы (II) промежуточным соединением формулы (III) В формуле (III) и в дальнейшем в этом документе присутствует группа W в качестве соответствующей уходящей группы, такая как, например, галоген, например хлор, бром и т.п.; или сульфонилоксигруппа, такая как, например, метансульфонилоксигруппа, 4-метилбензолсульфонилоксигруппа и т.п. Упомянутая реакция N-алкилирования может быть легко проведена в реакционно инертном растворителе, таком как, например, ароматический углеводород, например бензол, метилбензол, диметилбензол и т.п.; алканол (спирт), например метанол, этанол, 1-бутанол и т.п.; кетон, например 2-пропанон, 4-метил 2-пентанон и т.п.; простой эфир, например тетрагидрофуран, 1,4-диоксан, 1,1'-оксибизетан и т.п.; диполярный апротонный растворитель, например N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, нитробензол, 1-метил-2-пирролидинон и т.п.; или смесь таких растворителей. Добавление соответствующего основания, такого как, например, карбонат щелочно-земельного металла, гидрокарбонат, алкоксид, гидрид, амид, гидроксид или оксид, например карбонат натрия, гидрокарбонат натрия,карбонат калия, метоксид натрия, этоксид натрия, трет-бутоксид калия, гидрид натрия, амид натрия, гидроксид натрия, карбонат кальция, гидроксид кальция, оксид кальция и т.п.; или органического основания, такого как, например, амин, например N,N-диэтилэтанамин, N-(1-метилэтил)-2-пропанамин,4-этилморфолин, пиридин и т.п., может использоваться для связывания кислоты, которая высвобождается в ходе реакции. В некоторых случаях подходит добавление соли йодисто-водородной кислоты, предпочтительно йодида щелочного металла. Слегка повышенные температуры и перемешивание могут увеличивать скорость реакции. Альтернативно, вышеупомянутое N-алкилирование может быть проведено путем применения известных в данной области условий реакций межфазного катализа. Соединения формулы (I) также могут быть получены путем N-алкилирования соединения формулы(I-а) промежуточным соединением формулы (IV), где R1' определен так же, как радикал R1, отличный от водорода В формуле (IV) и в дальнейшем в этом документе группа W представляет собой соответствующую уходящую группу, такую как, например, галоген, например хлор, бром и т.п.; или сульфонилоксигруппу,такую как, например, метансульфонилоксигруппа, 4-метилбензолсульфонилоксигруппа и т.п. Упомянутая реакция N-алкилирования может быть легко проведена так, как описано выше. Соединения формулы (I-а), определяемые как соединения формулы (I), где R1 представляет собой водород, могут быть получены путем гидрогенизирования соединений формулы (I-b), определяемых как соединения формулы (I), где R1 представляет собой фенилметил, в присутствии подходящего катализатора, такого как палладий-на-угле Промежуточные соединения формулы (III) являются известными, такими как 2-хлор-3-этил-3Hимидазо[4,5-b]пиридин (Bollettino Chimxco Farmaceutico (1970), 109 (11), 665-73), или являются полученными так, как изложено в примерах А.1-А.6.-2 016422 Соединения формулы (I), которые получены вышеописанными способами, могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены друг от друга с использованием известных в данной области методик разделения. Такие соединения формулы (I), которые получены в рацемической форме, могут быть превращены в соответствующие диастереомерные солевые формы посредством реакции с подходящей хиральной кислотой. Вышеупомянутые диастереомерные солевые формы впоследствии разделяют, например, селективной или фракционной кристаллизацией и энантиомеры выделяют посредством щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы (носителя). Вышеупомянутые чистые стереохимически изомерные формы также могут быть получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ при условии, что реакция протекает стереоспецифично. Предпочтительно, если желателен специфический стереоизомер, упомянутое соединение будет синтезировано посредством стереоспецифических способов получения. В таких способах будут преимущественно применяться энантиомерно чистые исходные вещества. С точки зрения способности соединений настоящего изобретения вызывать релаксационный эффект в фундальной части органа, которая продемонстрирована в фармакологическом примере С.1, относящиеся к соединениям по изобретению являются полезными для лечения состояний, связанных с затрудненной или нарушенной релаксацией фундальной части органа, таких как, например, гастроэзофагеальный рефлюкс, изжога (в том числе эпизодическая изжога, ночная изжога и вызываемая приемом пищи изжога), диспепсия, чувство быстрого насыщения, вздутие живота/метеоризм и анорексия. Диспепсия может быть вызвана замедленной эвакуацией желудочного содержимого из желудка в двенадцатиперстную кишку, нарушенной релаксацией фундальной части органа при приеме пищи или гиперчувствительностью к релаксации желудка. Диспептические симптомы представляют собой, например, отсутствие аппетита, чувство переполнения, чувство быстрого насыщения, тошноту, рвоту, вздутие живота/метеоризм и отрыжку воздухом. Теплокровные животные, в том числе люди (как правило, называемые в этом документе пациенты),страдающие от диспептических симптомов в результате замедленной эвакуации желудочного содержимого из желудка в двенадцатиперстную кишку, обычно имеют нормальную релаксацию фундальной части органа и могут быть избавлены от их диспептических симптомов путем введения лекарственного препарата, нормализующего перистальтику кишечника, такого как, например, цисаприд. Пациенты могут иметь диспептические симптомы, не имея нарушенной эвакуации желудочного содержимого из желудка в двенадцатиперстную кишку. Их диспептические симптомы могут являться результатом гиперсморщенной/гиперсокращенной фундальной части органа, что приводит к сниженной растяжимости и к нарушениям адаптивной релаксации фундальной части органа. Также диспептические симптомы могут возникать вследствие гиперчувствительности фундальной части органа к релаксации. Гиперсморщенная/гиперсокращенная фундальная часть органа приводит к сниженной растяжимости желудка. "Растяжимость желудка" может быть выражена как отношение объема желудка к давлению,оказываемому стенкой желудка. Растяжимость желудка имеет взаимосвязь с тонусом желудка, который является результатом тонического сокращения мышечных волокон проксимальной части желудка. Эта проксимальная часть желудка посредством проявления регулированного тонического сокращения (тонус желудка) выполняет резервуарную функцию желудка. Пациенты, страдающие от чувства быстрого насыщения, не могут довести до завершения нормальный прием пищи, поскольку они чувствуют насыщение прежде, чем они способны довести до завершения упомянутый нормальный прием пищи. Обычно в начале приема пищи объектом желудок будет проявлять адаптивную релаксацию, т.е. желудок будет релаксировать для принятия пищи, которая проглатывается. Такая адаптивная релаксация является невозможной в том случае, когда растяжимость желудка затруднена, что приводит к нарушенной релаксации фундальной части органа. Отсюда следует, что с точки зрения полезности соединений формулы (I) настоящее изобретение также обеспечивает способ лечения теплокровных животных, в том числе людей (как правило, называемых в этом документе пациентами), страдающих нарушенной релаксацией фундальной части желудка при приеме пищи. Следовательно, обеспечивают способ лечения, позволяющий оказывать помощь пациентам, страдающим состояниями, такими как, например, гастроэзофагеальный рефлюкс, изжога (в том числе эпизодическая изжога, ночная изжога и вызываемая приемом пищи изжога), диспепсия, чувство быстрого насыщения, вздутие живота/метеоризм и анорексия. Следовательно, обеспечивают применение соединения формулы (I) в качестве лекарственного препарата и, в особенности, применение соединения формулы (I) для производства лекарственного препарата для лечения состояний, относящихся к нарушенной релаксации фундальной части органа при приеме пищи, таких как, например, гастроэзофагеальный рефлюкс, изжога (в том числе эпизодическая изжога,ночная изжога и вызываемая приемом пищи изжога), диспепсия, чувство быстрого насыщения, вздутие живота/метеоризм и анорексия. Предусматривается как профилактическое, так и терапевтическое лечение.-3 016422 Симптомы нарушенной релаксации фундальной части желудка также могут возникать вследствие приема химических веществ, например селективных ингибиторов обратного захвата серотонина (SSRI),таких как флуоксетин, пароксетин, флувоксамин, циталопрам, сертралин; или эритромицина и эритромицин-подобных обладающих антибиотическим действием макролидов, таких как, например, ЕМ-523,ЕМ-574, АВТ-229, GM-611, (8R)-4-дезокси-6,9-эпоксиэритромицин A, (8S)-4-дезокси-6,9-эпоксиэритромицин А, А-81648, А-173508, А-182061 и KC-11458. Другим функциональным гастроинтестинальным расстройством является синдром раздраженной кишки (IBS), в соответствии с чем полагают, что один из его признаков связан с гиперчувствительностью кишки к растяжению. Исходя из этого, следовательно, полагают, что модуляция упомянутой гиперчувствительности посредством соединений настоящего изобретения, обладающих релаксационными свойствами в отношении фундальной части органа, может привести к снижению проявления симптомов у объектов, страдающих IBS. Соответственно, обеспечивают применение соединения формулы (I) для производства лекарственного препарата для лечения IBS (синдром раздраженной кишки). Кроме того, соединения формулы (I) также могут уменьшить боль, сопутствующую гастроинтестинальной гиперчувствительности. Для приготовления фармацевтических композиций этого изобретения эффективное количество конкретного соединения, в форме основания или в форме присоединения кислоты, в качестве активного ингредиента комбинируют при тщательном смешивании с фармацевтически приемлемым носителем, где носитель может принимать разнообразные формы в зависимости от получаемой при приготовлении формы, желательной для введения. Эти фармацевтические композиции желательно находятся в стандартной лекарственной форме, подходящей предпочтительно для перорального введения, ректального введения или введения посредством парентеральной инъекции. Например, при получении композиций в лекарственной форме для перорального введения могут быть применены любые обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п., в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, скользящие вещества, связующие вещества, разрыхляющие вещества и т.п., в случае порошков, пилюль, капсул и таблеток. Вследствие простоты введения таблетки и капсулы представляют собой наиболее преимущественную стандартную лекарственную форму для однократного приема при пероральном введении, в этом случае, как понятно, применяются твердые фармацевтические носители. Для парентеральных композиций обычно носитель будет содержать стерильную воду, по меньшей мере большей частью, хотя другие ингредиенты, например, для улучшения растворимости, могут быть включены. Например, могут быть приготовлены растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть приготовлены суспензии для инъекций, в случае которых могут быть применены соответствующие жидкие носители, суспендирующие вещества и т.п. В композициях, подходящих для чрескожного введения, носитель необязательно содержит вещество, способствующее проникновению внутрь, и/или подходящее смачивающее вещество, необязательно скомбинированное(ые) с подходящими добавками любой природы в меньших пропорциях, где добавки не причиняют существенного вредного воздействия на кожу. Упомянутые добавки могут облегчать нанесение на кожу и/или могут быть полезными в приготовлении желательных композиций. Такие композиции могут быть введены различными путями, например в виде трансдермального пластыря, в виде точечного местного введения, в виде мази. Соли присоединения кислот соединения формулы (I) вследствие их повышенной растворимости в воде по сравнению с соответствующей формой основания, очевидно, являются более подходящими в приготовлении водных композиций. Для простоты введения и для равномерности дозировки особенно преимущественным является составление вышеупомянутых фармацевтических композиций в стандартной лекарственной форме для однократного приема. Стандартная лекарственная форма для однократного приема, использованная в описании изобретения и в пунктах формулы в этом документе, относится к физически дискретным единицам, подходящим в качестве единичных дозировок, где каждая единица содержит заданное количество активного ингредиента, рассчитанное для получения желательного терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм для однократного приема являются таблетки (включая таблетки с риской или в оболочке), капсулы, пилюли,пакеты с порошком, облатки, растворы или суспензии для инъекций, чайные ложки с фармацевтической композицией, столовые ложки с фармацевтической композицией и т.п. и их отделяемые лекарственные формы для многократного приема. Для перорального введения фармацевтические композиции могут принимать форму твердых лекарственных форм, например таблеток (как только проглатываемые, так и жевательные формы), капсул или гель-капсул, приготовленных с использованием обычного средства с помощью фармацевтически приемлемых эксципиентов, таких как связывающие вещества (например, предварительно желатинизированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнителей (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); скользящих веществ (например,стеарат магния, тальк или диоксид кремния); разрыхляющих веществ (например, картофельный крахмал-4 016422 или крахмалгликолят натрия) или смачивающих/увлажняющих веществ (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой общеизвестными в данной области способами. Жидкие препараты для перорального введения могут принимать форму, например, растворов, сиропов или суспензий или они могут быть представлены в виде сухого продукта для разведения водой или другой подходящей средой перед применением. Такие жидкие препараты могут быть приготовлены с использованием обычного средства, необязательно с помощью фармацевтически приемлемых добавок,таких как суспендирующие вещества (например, сорбитовый сироп, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрогенизированные пищевые жиры); эмульгирующие вещества (например, лецитин или камедь акации); неводные среды (например, миндальное масло, сложные эфиры жирных кислот или этиловый спирт) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подслащивающие вещества включают предпочтительно по меньшей мере одно подслащивающее вещество с интенсивным вкусом, такое как сахарин, сахарин натрия или кальция, аспартам, ацесульфам калия, цикламат натрия, алитам, подслащивающее вещество на основе дигидрохалькона, монеллин, стевиозид или сукралоза (4,1',6'-трихлор-4,1',6'-тридезоксигалактосахароза),предпочтительно сахарин, сахарин натрия или кальция, и необязательно сыпучее подслащивающее вещество, такое как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальт, глюкоза, гидрогенизированный глюкозный сироп, ксилит, карамель или мед. Подслащивающие вещества с интенсивным вкусом являются удобными в применении при низких концентрациях. Например, в случае сахарина натрия концентрация может колебаться в диапазоне от 0,04 до 0,1% (мас./об.), исходя из общего объема конечного состава, и предпочтительно составляет приблизительно 0,06% в составах с низкой дозировкой и приблизительно 0,08% в составах с высокой дозировкой. Сыпучее подслащивающее вещество может быть эффективно использовано в больших количествах, колеблющихся в диапазоне от приблизительно 10 до приблизительно 35%, предпочтительно от приблизительно 10 до 15% (мас./об.). Фармацевтически приемлемые вкусовые ароматизирующие вещества, которые могут маскировать горький привкус ингредиентов в составах с заниженной дозировкой, представляют собой фруктовые вкусовые ароматизирующие вещества, такие как вишневое, малиновое, черносмородиновое или клубничное ароматизирующее вещество. Комбинация двух вкусовых ароматизирующих веществ может давать очень хорошие результаты. В составах с высокой дозировкой могут потребоваться более сильные вкусовые ароматизирующие вещества, такие как карамельно-шоколадное ароматизирующее вещество(Caramel Chocolate), мятное охлаждающее ароматизирующее вещество (Mint Cool), фантазийное ароматизирующее вещество (Fantasy) и т.п. фармацевтически приемлемые сильные вкусовые ароматизирующие вещества. Каждое ароматизирующее вещество может присутствовать в конечной композиции в концентрации, колеблющейся в диапазоне от 0,05 до 1% (мас./об.). Преимущественно используют комбинации упомянутых сильных вкусовых ароматизирующих веществ. Предпочтительно используют вкусовое ароматизирующее вещество, которое не претерпевает никакого изменения привкуса и цвета или не претерпевает никакой потери привкуса и цвета в кислотных условиях состава. Соединения изобретения могут быть составлены для парентерального введения посредством инъекции, удобно посредством внутривенной, внутримышечной или подкожной инъекций, например посредством болюсной инъекции или непрерывного внутривенного вливания. Составы для инъекции могут быть представлены в стандартной лекарственной форме, например в ампулах или в упаковках для многократного приема, с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных средах, и могут содержать вещества, способствующие составлению композиций, такие как изотонизирующие, суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может находиться в порошковой форме для разведения подходящей средой, например стерильной апирогенной водой перед применением. Соединения изобретения также могут быть составлены в ректальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как кокосовое масло или другие глицериды. Специалисты в лечении состояний, связанных с затрудненной или нарушенной релаксацией фундальной части органа, могут легко определить эффективное суточное количество соединения из результатов испытаний, представленных в дальнейшем в этом документе. Как правило, предполагается, что терапевтически эффективная доза будет составлять от 0,001 до 5 мг/кг массы тела, более предпочтительно от 0,01 до 0,5 мг/кг массы тела. Может быть приемлемым введение терапевтически эффективной дозы в виде двух, трех, четырех или более субдоз через соответствующие интервалы на протяжении дня. Упомянутые субдозы могут быть составлены в виде стандартных лекарственных форм, например, содержащих 0,1-350 мг и в особенности 1-200 мг активного ингредиента на стандартную лекарственную форму. Точная дозировка и частота введения зависят от конкретного используемого соединения формулы(I), от конкретного состояния, подлежащего лечению, от серьезности состояния, подлежащего лечению,от возраста, веса и от общего физического состояния конкретного пациента, а также от других лекарственных препаратов, которые пациент может принимать, что хорошо известно специалистам в данной-5 016422 области. Кроме того, очевидно, что вышеупомянутое эффективное суточное количество может быть снижено или увеличено в зависимости от реакции пациента, которого лечат, и/или в зависимости от заключения лечащего врача, прописывающего соединения настоящего изобретения. Следовательно, диапазоны эффективного суточного количества, указанные выше в этом документе, являются лишь общими рекомендациями. В зависимости от способа введения фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.%, еще более предпочтительно от 0,1 до 50 мас.% активного(ых) ингредиента(ов) и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.%, еще более предпочтительно от 50 до 99,9 мас.% фармацевтически приемлемого носителя, где все процентные содержания рассчитаны, исходя из всей композиции. Экспериментальная часть. В методиках, описанных в дальнейшем в этом документе, используют следующие сокращения:DIPE - диизопропиловый эфир. Для некоторых химических соединений используют химическую формулу, например, CH2Cl2 обозначает дихлорметан; NH4OH означает гидроксид аммония; СН 3 ОН означает метанол; K2CO3 означает карбонат калия и MgSO4 означает сульфат магния. А. Синтез промежуточных соединений. Пример А.1. а) Получение промежуточного соединения (1) 3-Гексанон (1,627 моль) и этилформиат (1,79 моль) добавляют медленно при 5 С к раствору метанолята натрия (30%) (1,79 моль) в диэтиловом эфире (1500 мл). Смесь перемешивают при комнатной температуре в течение 18 ч (в результате выпадает осадок). Растворитель выпаривают досуха. Продукт используют без дополнительной очистки, с выходом 260 г промежуточного соединения (1).b) Получение промежуточного соединения (2) Смесь промежуточного соединения (1) (1,732 моль), 2-цианоацетамида (0,868 моль) и пиперидинийацетата (0,65 моль) в воде (1500 мл) перемешивают и кипятят с обратным холодильником в течение 8 ч. Добавляют уксусную кислоту (200 мл). Осадок отфильтровывают, промывают водой и сушат, что дает выход 85 г (27%) продукта. Часть (3 г) кристаллизуют из 2-пропанона и диизопропилового эфира. Осадок отфильтровывают и сушат, что дает выход 1,5 г промежуточного соединения (2) (температура плавления 220 С). с) Получение промежуточного соединения (3) Смесь промежуточного соединения (2) в соляной кислоте (1000 мл) перемешивают и кипятят с обратным холодильником в течение 6 дней, затем выливают на лед, подщелачивают посредством NH4OH и экстрагируют дихлорметаном. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают, что дает 31 г остатка. Часть (1 г) кристаллизуют из смеси 2-пропанона и диизопропилового эфира. Осадок отфильтровывают и сушат, что дает 0,3 г промежуточного соединения (3) (температура плавления 101 С).d) Получение промежуточного соединения (4) К раствору промежуточного соединения (3) (0,185 моль) в серной кислоте (280 мл) медленно добавляют азотную кислоту (0,37 моль) при 5 С. Смесь перемешивают при 5 С в течение 1 ч, затем выливают на лед и экстрагируют дихлорметаном. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают, что дает 25,6 г остатка. Часть (1 г) кристаллизуют из ацетонитрила и диизопропилового эфира. Осадок отфильтровывают и сушат, что дает 0,5 г промежуточного соединения (4)-6 016422 е) Получение промежуточного соединения (5) К раствору промежуточного соединения (4) и N,N,N-триэтилбензолметанаммонийхлорида(0,06 моль) в ацетонитриле (400 мл) медленно добавляют треххлористый фосфор (0,595 моль) при комнатной температуре. Смесь перемешивают при 80 С в течение 8 ч. Растворитель выпаривают. Остаток выливают на лед. Смесь подщелачивают посредством NH4OH и экстрагируют дихлорметаном. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Продукт используют без дополнительной очистки, с выходом 26 г промежуточного соединения (5).f) Получение промежуточного соединения (6) Смесь промежуточного соединения (5) (0,093 моль) в растворе аминометана в воде (40%) (100 мл) перемешивают при комнатной температуре в течение ночи и выливают в ледяную воду. Осадок фильтруют, промывают водой и сушат, что дает 17 г (87%) промежуточного соединения (6) (температура плавления 97 С).g) Получение промежуточного соединения (7) Смесь промежуточного соединения (6) (0,0812 моль) и никелевый катализатор Ренея (20 г) в метаноле (200 мл) перемешивают при комнатной температуре в течение 2 ч под давлением водорода 3 бар(3105 Па), затем фильтруют через целит. Целит промывают водой. Фильтрат упаривают досуха, что дает 14,5 г промежуточного соединения (7).h) Получение промежуточного соединения (8) Смесь промежуточного соединения (7) (0,082 моль) и мочевины (0,089 моль) в ксилоле (150 мл) перемешивают и кипятят с обратным холодильником в течение ночи, затем охлаждают до комнатной температуры. Осадок фильтруют, промывают водой и сушат. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH; 97/3/0,5; 15-355 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из ацетонитрила/диизопропилового эфира. Осадок отфильтровывают и сушат, что дает 0,9 г (5,5%) промежуточного соединения (8) (температура плавления 230 С).i) Получение промежуточного соединения (9) К смеси промежуточного соединения (8) (0,053 моль) в треххлористом фосфоре (100 мл) очень медленно добавляют соляную кислоту (2N) (2 мл) при 100 С. Смесь перемешивают при 120 С в течение ночи, затем охлаждают и растворитель выпаривают. Остаток смывают водным раствором K2CO3 (10%) и экстрагируют посредством CH2Cl2/CH3OH (95/5). Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха, что дает 8,5 г (72%) промежуточного соединения (9). Пример А.2. а) Получение промежуточного соединения (10) 2-Метил-3-пентанон (0,998 моль) и этилформиат (1,098 моль) добавляют медленно при 5 С к раствору метанолята натрия (30%) (1,098 моль) в диэтиловом эфире (1000 мл). Смесь перемешивают при комнатной температуре в течение 8 ч. Растворитель выпаривают. Продукт используют без дополнительной очистки с получением промежуточного соединения (10).b) Получение промежуточного соединения (11) Промежуточное соединение (10) (0,998 моль) и 2-цианоацетамид (0,998 моль) добавляют к раствору пиперидинийацетата (0,749 моль) в воде (1000 мл). Смесь перемешивают и кипятят с обратным холодильником в течение 8 ч. Добавляют уксусную кислоту (150 мл). Осадок отфильтровывают, промывают водой и сушат, что дает выход 44 г продукта в качестве фракции (1). Часть упомянутой фракции (1) (2 г) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат, что дает выход 1,3 г промежуточного соединения (11) (температура плавления 241 С). с) Получение промежуточного соединения (12) Смесь промежуточного соединения (11) (0,238 моль) в соляной кислоте (6N) (400 мл) перемешивают и кипятят с обратным холодильником в течение 6 дней, затем выливают на лед и подщелачивают посредством NH4OH. Осадок отфильтровывают, промывают водой и сушат с получением фракции (1). Фильтрат экстрагируют посредством смеси CH2Cl2/CH3OH 90/10. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток объединяют с фракцией (1) с получением 33 г продукта. Часть этого продукта (3 г) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат, что дает 2,6 г промежуточного соединения (12) (температура плавления 197 С).d) Получение промежуточного соединения (13) К раствору промежуточного соединения (12) (0,198 моль) в серной кислоте (300 мл) медленно добавляют азотную кислоту (0,391 моль) при 5 С, при этом температуру поддерживают ниже 15 С. Смесь перемешивают при 5 С в течение 1 ч и выливают на лед. Осадок отфильтровывают, промывают водой и сушат с получением фракции (1). Фильтрат экстрагируют дихлорметаном. Органический слой отделяют,сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток объединяют с фракцией (1), что дает 35 г промежуточного соединения (13). е) Получение промежуточного соединения (14) К раствору промежуточного соединения (13) (0,168 моль) и N,N,N-триэтилбензолметанаммонийхлорида (0,084 моль) в ацетонитриле (350 мл) медленно добавляют треххлористый фосфор (0,505 моль) при комнатной температуре. Смесь перемешивают при 80 С в течение 8 ч. Растворитель выпаривают досуха. Остаток смывают на лед. Смесь подщелачивают посредством NH4OH и экстрагируют дихлорметаном. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают с получением 37 г промежуточного соединения (14).f) Получение промежуточного соединения (15) К раствору промежуточного соединения (14) (0,172 моль) в метаноле (350 мл) медленно добавляют метанолят натрия (30%) (0,517 моль) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 8 ч, выливают на лед и экстрагируют дихлорметаном. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают, что дает 32 г промежуточного соединенияg) Получение промежуточного соединения (16) Смесь промежуточного соединения (15) (0,055 моль) в аминометане (200 мл) перемешивают при 100 С в течение 48 ч, затем охлаждают. Добавляют лед. Осадок фильтруют, промывают водой и сушат,что дает 11,45 г промежуточного соединения (16). Этот продукт используют непосредственно на следующей реакционной стадии.h) Получение промежуточного соединения (17) Смесь промежуточного соединения (16) (0,055 моль) и никелевого катализатора Ренея (15 г) в метаноле (150 мл) перемешивают при комнатной температуре в течение 1 ч под давлением водорода 3 бар (3105 Па), затем фильтруют через целит. Целит промывают водой. Фильтрат упаривают досуха с получением 10 г промежуточного соединения (17).i) Получение промежуточного соединения (18) Смесь промежуточного соединения (17) (0,055 моль) и мочевины (0,066 моль) в ксилоле (100 мл) перемешивают и кипятят с обратным холодильником в течение ночи, затем охлаждают. Осадок фильтруют, промывают диизопропиловым эфиром и сушат, что дает выход 7,5 г промежуточного соединенияj) Получение промежуточного соединения (19) Смесь промежуточного соединения (18) (0,0365 моль) в треххлористом фосфоре (75 мл) перемешивают при 100 С. Очень осторожно добавляют по каплям соляную кислоту (12N) (0,75 мл). Смесь перемешивают при 120 С в течение ночи. Растворитель выпаривают досуха. Остаток смывают на лед, насыщают раствором K2CO3 и экстрагируют посредством смеси CH2Cl2/CH3OH (95/5). Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха, что дает выход 9 г промежуточного соединения (19). Пример А.3. а) Получение промежуточного соединения (20)b) Получение промежуточного соединения (21) Смесь промежуточного соединения (20) (0,0764 моль) и никелевого катализатора Ренея (15 г) в метаноле (150 мл) перемешивают в течение 2 ч под давлением водорода 3 бар (3105 Па). Осадок фильтруют через целит. Фильтрат упаривают досуха с получением 10,8 г промежуточного соединения (21). с) Получение промежуточного соединения (22)-9 016422 Смесь промежуточного соединения (21) (0,07 моль) и мочевины (0,084 моль) в ксилоле (100 мл) перемешивают при 160 С в течение ночи, затем охлаждают до комнатной температуры. Осадок фильтруют,промывают диизопропиловым эфиром и сушат. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH; 97/7; 15-35 мкм). Собирают три фракции и растворитель выпаривают. Фракцию (1) (0,6 г) кристаллизуют из ацетонитрила/диизопропилового эфира. Осадок отфильтровывают и сушат, что дает выход 0,47 г промежуточного соединения (22) (температура плавления 260 С).d) Получение промежуточного соединения (23) Промежуточное соединение (22) (0,028 моль) в треххлористом фосфоре (100 мл) перемешивают при 100 С. Медленно по каплям добавляют соляную кислоту (12N) (2 мл). Смесь перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают досуха. Остаток смывают на лед, подщелачивают 10%-ным раствором K2CO3 (10%) и экстрагируют посредством смесиCH2Cl2/CH3OH. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха, что дает выход 9,9 г промежуточного соединения (23). Пример А.4. а) Получение промежуточного соединения (24)b) Получение промежуточного соединения (25) Смесь промежуточного соединения (24) (0,046 моль) и никелевого катализатора Ренея (10 г) в метаноле (100 мл) гидрогенизируют при комнатной температуре в течение 2 ч под давлением водорода 3 бар (3105 Па). Никелевый катализатор Ренея удаляют фильтрацией через целит. Фильтрат упаривают досуха с получением 7,7 г промежуточного соединения (25). с) Получение промежуточного соединения (26) Смесь промежуточного соединения (25) (0,046 моль) и мочевины (0,0552 моль) в ксилоле (80 мл) перемешивают и кипятят с обратным холодильником в течение ночи и охлаждают до комнатной температуры. Осадок фильтруют, промывают диизопропиловым эфиром и сушат. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH; 96/4; 15-35 мкм). Собирают две фракции и растворитель выпаривают. Остаток кристаллизуют из ацетонитрила/диизопропилового эфира. Осадок отфильтровывают и сушат, что дает выход 5,8 г продукта. Продукт кристаллизуют из ацетонитрила/диизопропилового эфира. Осадок отфильтровывают и сушат с получением 0,85 г промежуточного соединения (26) (температура плавления 121 С).d) Получение промежуточного соединения (27) Смесь промежуточного соединения (26) (0,027 моль) в треххлористом фосфоре (40 мл) перемешивают при 100 С. Медленно добавляют соляную кислоту (12N) (0,8 мл). Смесь перемешивают и кипятят с обратным холодильником в течение ночи, охлаждают и упаривают досуха. Остаток смывают в ледяную воду, насыщают раствором K2CO3 и экстрагируют посредством смеси CH2Cl2/CH3OH:95/5. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают, что дает 3,6 г промежуточного соединения (27).- 10016422 Пример A.5. а) Получение промежуточного соединения (28)(MgSO4), фильтруют и растворитель выпаривают досуха. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH; 98/2; 15-35 мкм). Собирают две фракции и растворитель выпаривают, что дает выход 0,5 г фракции (1) и 18 г (86%) фракции (2). Фракцию (1) кристаллизуют из 2-пропанона/ацетонитрила/диизопропилового эфира. Осадок отфильтровывают и сушат с получением 0,4 г промежуточного соединения (28).b) Получение промежуточного соединения (29) Смесь промежуточного соединения (28) (0,098 моль) в треххлористом фосфоре (180 мл) перемешивают при 100 С. Очень осторожно по каплям добавляют соляную кислоту (12N) (2 мл). Смесь перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают досуха. Остаток выливают на лед, насыщают раствором K2CO3 и экстрагируют посредством смесиCH2Cl2/CH3OH:95/5. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха, что дает 12,5 г промежуточного соединения (29). Пример А.6. Получение промежуточного соединения (30) К смеси 1,3-дигидро-3-изопропил-2H-имидазо[4,5-b]пиридин-2-она (0,0846 моль) в треххлористом фосфоре (150 мл) очень осторожно добавляют по каплям соляную кислоту (1,5 мл) при 100 С. Смесь перемешивают при 120 С в течение ночи и растворитель выпаривают досуха. Остаток выливают на лед,насыщают раствором K2CO3 и экстрагируют дихлорметаном. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают досуха с получением 14 г промежуточного соединения Смесь промежуточного соединения (9) (0,038 моль) и 1-(фенилметил)пиперазина (0,057 моль) перемешивают при 120 С в течение 3 ч, затем смывают дихлорметаном. Осадок фильтруют. Фильтрат упаривают досуха. Остаток (17 г) очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH; 95/5/0,1; 15-35 мкм). Собирают чистые фракции и растворитель выпаривают, что дает 1,3 г остатка. Остаток кристаллизуют из 2-пропанона/ацетонитрила/диизопропилового эфира. Осадок отфильтровывают и сушат с получением 1,25 г соединения (1) (температура плавления 127 С). Соединение (2) получают аналогичным образом с заменой промежуточного соединения (9) промежуточным соединением (23). Соединение (5) получают аналогичным образом с заменой промежуточного соединения (9) промежуточным соединением (30). Соединение (6) получают аналогичным образом с заменой промежуточного соединения (9) промежуточным соединением (19). Соединение (7) получают аналогичным образом с заменой промежуточного соединения (9) 2-хлор 3-этил-3H-имидазо[4,5-b]пиридином. Соединение (8) получают аналогичным образом с заменой промежуточного соединения (9) промежуточным соединением (27). Соединение (13) получают аналогичным образом с заменой промежуточного соединения (9) промежуточным соединением (29).(0,0505 моль) перемешивают при 120 С в течение 1 ч. Добавляют смесь водного раствора K2CO3 (10%) и дихлорметана. Смесь перемешивают при комнатной температуре в течение 10 мин. Органический слой отделяют, промывают дихлорметаном, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток(35 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH; 96/3/0,1; 15-35 мкм). Собирают четыре фракции и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH; 98/2/0,1; 15-40 мкм). Собирают чистые фракции и растворитель выпаривают. Остаток (1,5 г) кристаллизуют из диизопропилового эфира. Осадок отфильтровывают и сушат с получением 1 г соединения (11) (температура плавления 98 С). Пример В.3. Получение соединения (3) Смесь промежуточного соединения (31) (0,005 моль), 2-(хлорметил)пиридингидрохлорида (1:1)(0,006 моль) и N,N-диэтилэтанамина (0,0253 моль) в диметилформамиде (60 мл) перемешивают при 40 С в течение ночи. Растворитель выпаривают досуха. Остаток смывают посредством смеси DCM/СН 3 ОН. Осадок промывают водным раствором K2CO3 (10%). Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают досуха. Остаток (2,3 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH; 96/4/0,4; 15-40 мкм) с получением 1,5 г (96%). Эту фракцию растворяют в смеси 2-пропанола/HCl (5N) и превращают в соль соляной кислоты. Осадок отфильтровывают и сушат. Остаток кристаллизуют из этанола/диизопропилового эфира. Осадок отфильтровывают и сушат с получением 1,7 г соединения (3) (температура плавления 182 С). Пример В.4. Получение соединения (9) К смеси соединения (2) (0,012 моль) и формальдегида (0,12 моль) в ацетонитриле (80 мл) в токе азота добавляют по каплям цианотригидроборат натрия (0,036 моль), затем уксусную кислоту (4 мл). Смесь перемешивают при комнатной температуре в течение ночи. Добавляют уксусную кислоту (4 мл). Смесь перемешивают при 40 С в течение 12 ч, затем охлаждают до комнатной температуры. Добавляют водный раствор K2CO3 (10%). Смесь экстрагируют дихлорметаном. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают досуха. Остаток смывают метанолом (80 мл). Добавляют 2-пропанол и 5N раствор HCl (10 мл). Смесь перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают досуха. Остаток смывают дихлорметаном и промывают водным раствором K2CO3 (10%). Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха. Остаток (4 г) очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH; 97/3/0,1; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (3,1 г) кристаллизуют из 2-пропанона/ацетонитрила/диизопропилового эфира. Осадок отфильтровывают и сушат с получением 2,7 г соединения (9) (температура плавления 128 С). Пример В.5. Получение соединения (10) Смесь солянокислой соли промежуточного соединения (31) (0,0046 моль), 5-(хлорметил)-1,3 бензодиоксола (0,005 моль) и карбоната калия (0,007 моль) в ацетонитриле (80 мл) перемешивают при 80 С в течение 4 ч и растворитель выпаривают. Остаток смывают смесью воды и дихлорметана. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (2 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH; 97/3/0,1; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,95 г) кристаллизуют из 2-пропанона/диизопропилового эфира. Осадок отфильтровывают и сушат с получением 0,51 г соединения (10) (температура плавления 114 С). Смесь соединения (11) (0,0153 моль) и палладия-на-активированном угле (1,4 г) в метаноле (70 мл) перемешивают при 50 С в течение 12 ч под давлением водорода 5 бар (5105 Па), затем охлаждают,фильтруют через целит, промывают метанолом и концентрируют. Остаток (8 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH; 90/10/1; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают с получением 5 г соединения (14) (температура плавления 136 С). Соединения (15) и (16) получают с использованием аналогичной методологии, исходя из соединений (7) и (5) соответственно, однако стадию очистки посредством колоночной хроматографии заменяют растворением остатка в 2-пропаноле, насыщенном HCl, с тем, чтобы получить соль присоединения соляной кислоты упомянутых соединений (15) и (16) в виде осадка. В табл. F-1 приведен перечень соединений, которые получают в соответствии с одним из вышеупомянутых примеров. Термин ".С 2 Н 2 О 4" означает соль щавелевой кислоты (оксалат). Таблица F-1- 13016422 С. Фармакологические примеры. С.1. Тонус желудка, измеренный посредством электронного баростата, у собак, находящихся в сознании. Тонус желудка не может быть измерен манометрическими способами, поэтому используют электронный баростат. Он позволяет исследовать физиологическую схему и регуляцию тонуса желудка у собак, находящихся в сознании, и влияние тест-соединений на этот тонус. Баростат состоит из системы впуска воздуха, которая связана посредством двухпросветной интубационной поливиниловой трубки калибром 14 по французской шкале с ультратонким обвислым полиэтиленовым мешком (максимальный объем: 700 мл). Колебания тонуса желудка измеряют посредством регистрации изменений объема воздуха во внутрижелудочном мешке, поддерживаемом при постоянном давлении. Баростат поддерживает постоянное давление (заранее выбранное) в обвислом наполненном воздухом мешке, введенном в желудок, изменяя объем воздуха внутри мешка посредством электронной системы с обратной связью. Таким образом, баростат измеряет моторику желудка (сокращение или релаксацию) в виде изменений внутрижелудочного объема (уменьшение или увеличение соответственно) при постоянном внутрижелудочном давлении. Баростат состоит из тензиометрического датчика, соединенного посредством электронного реле с системой впуска-аспирации воздуха. Как тензиометрический датчик, так и система впуска соединены посредством двухпросветной интубационной трубки с ультратонким полиэтиленовым мешком. Шкала в баростате позволяет выбирать уровень давления, который должен поддерживаться во внутрижелудочном мешке. Самок собак породы бигль, имеющих вес 7-17 кг, обучают стоять спокойно в рамках Павлова. Им имплантируют желудочную канюлю под общей анестезией и с асептическими мерами предосторожности. После медианной лапаротомии разрез делают в стенке желудка в продольном направлении между большой и малой кривизной, на 2 см выше нервов Латарже. Канюлю прикрепляют к стенке желудка посредством двойного кисетного шва и вынимают через патрубок раневого канала в левом квадрате гипохондрия. Собакам дают восстановительный период две недели. В начале эксперимента канюлю открывают для того, чтобы удалить любой желудочный сок или остатки пищи. При необходимости желудок очищают посредством 40-50 мл тепловатой воды. Ультратонкий мешок баростата помещают на дно желудка с помощью желудочной канюли. Для гарантированного обеспечения легкого разворачивания внутрижелудочного мешка во время эксперимента в мешок вводят воздух объемом 150-200 мл путем очень кратковременного повышения давления максимально до 14 мм.рт.ст. (приблизительно 1,87 кПа). Эту процедуру повторяют дважды. После стабилизационного периода продолжительностью 60 мин при внутрижелудочном давлении 6 мм.рт.ст. (приблизительно 0,81 кПа) вводят тестовое соединение подкожно или интрадуоденально (в полость двенадцатиперстной кишки) при давлении 2 мм.рт.ст. (0,27 кПа). Тестовые соединения проверяют с отбором, т.е. измеряют изменения объема желудка при 0,63 мг/кг (подкожное введение (s.c Другие дозы и пути введения испытывают, если показано, что тестовое соединение является активным во время процедуры отбора. Табл. С-1 объединяет данные по среднему максимальному изменению объема (в мл) при релаксации фундальной части органа через 1 ч после интрадуоденального (I.D.) введения тестового соединения (0,63 мг/кг). Таблица С-1: введено при дозе 0,16 мг/кг. Соединение (11) испытывают при различных концентрациях и результаты приводят в табл. С-2 и сравнивают с соединением (72) международной публикации WO 01/46189. Оба соединения вводят интрадуоденально (I.D.): введено при дозе 0,16 мг/кг. включающей его любую стереохимически изомерную форму, гдеR5 представляет собой водород, аминогруппу, C1-4 алкиламиногруппу или ди(C1-4 алкил)аминогруппу; или его фармацевтически приемлемые соли присоединения кислоты, или его сольват. 2. Соединение по п.1, где R1 представляет собой водород. 3. Соединение по п.1, где R1 представляет собой фенилметил. 4. Соединение по любому из пп.1-3, где R2 представляет собой метил. 5. Соединение по п.1, где соединение представляет собой 2-(4-бензилпиперазин-1-ил)-3-метил-3Hимидазо[4,5]пиридин или его фармацевтически приемлемые соли присоединения кислоты. 6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-5. 7. Способ получения фармацевтической композиции по п.6, где терапевтически активное количество соединения по любому из пп.1-5 смешивают до получения однородной массы с фармацевтически приемлемым носителем. 8. Применение соединения по любому из пп.1-5 в качестве лекарственного препарата для лечения гастроэзофагеального рефлюкса, изжоги, диспепсии, чувства быстрого насыщения, вздутия живота/метеоризма и анорексии. 9. Применение соединения по любому из пп.1-5 для производства лекарственного препарата для лечения гастроэзофагеального рефлюкса, изжоги, диспепсии, чувства быстрого насыщения, вздутия живота/метеоризма и анорексии. 10. Способ получения соединения формулы (I), где промежуточное соединение формулы (II) подвергают N-алкилированию с промежуточным соединением формулы (III) в реакционно инертном растворителе- 15016422 где в вышеприведенной реакционной схеме радикалы R1 представляют собой фенилметил, пиридинилметил или бензо[1,3]диоксолилметил;W представляет собой соответствующую уходящую группу; и, если желательно, соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты или, наоборот, соль присоединения кислоты соединения формулы (I) превращают в форму свободного основания посредством обработки щелочью; и, если желательно, получают его стереохимически изомерные формы. 11. Способ получения соединения формулы (I), где промежуточное соединение формулы (IV) подвергают N-алкилированию с соединением формулы где в вышеприведенных реакционных схемах радикалы R1' представляют собой фенилметил, пиридинилметил или бензо[1,3]диоксолилметил;W представляет собой соответствующую уходящую группу; и, если желательно, соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты или, наоборот, соль присоединения кислоты соединения формулы (I) превращают в форму свободного основания посредством обработки щелочью; и, если желательно, получают его стереохимически изомерные формы.
МПК / Метки
МПК: A61K 31/496, A61P 1/14, C07D 471/04
Метки: 2-пиперазин-1-ил-3н-имидазо[4,5-b]пиридина, производные
Код ссылки
<a href="https://eas.patents.su/17-16422-proizvodnye-2-piperazin-1-il-3n-imidazo45-bpiridina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-пиперазин-1-ил-3н-имидазо[4,5-b]пиридина</a>