Гидрохлориды 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-аминопиперидин-1-ил)ксантина, их получение и их применение в качестве лекарственных средств
Формула / Реферат
1. Гидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-аминопиперидин-1-ил)ксантина.
2. Моно- или дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина.
3. Моно- или дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина в кристаллической безводной форме.
4. Моногидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина.
5. Дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина.
6. Моногидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина с температурой плавления 265±5°С.
7. Дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина с температурой плавления 205±5°С.
8. Моногидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина, на рентгеновской порошковой дифрактограмме которого присутствуют дифракционные максимумы, соответствующие следующим характеристическим значениям d: 10,38, 8,99, 6,80, 5,19, 4,44, 4,31, 3,98, 3,93, 3,57, 3,50 Å.
9. Дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина, на рентгеновской порошковой дифрактограмме которого присутствуют дифракционные максимумы, соответствующие следующим характеристическим значениям d: 11,24, 8,81, 7,67, 7,25, 5,61, 4,79, 4,10, 3,32, 3,03, 2,96 Å.
10. Применение соединения по одному из пп.1-9 для приготовления лекарственного средства, пригодного для лечения сахарного диабета типа I и типа II, артрита, ожирения, отторжения аллотрансплантата и вызванного кальцитонином остеопороза.
11. Применение соединения по одному из пп.1-9 для приготовления лекарственного средства, пригодного для лечения сахарного диабета типа II или ожирения.
12. Фармацевтическая композиция, содержащая соль по одному из пп.1-9 и необязательно один или несколько инертных носителей и/или разбавителей.
13. Фармацевтическая композиция, содержащая моногидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина и необязательно один или несколько инертных носителей и/или разбавителей.
14. Фармацевтическая композиция, содержащая дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина и необязательно один или несколько инертных носителей и/или разбавителей.
15. Способ приготовления фармацевтической композиции по п.12, заключающийся в том, что соль по одному из пп.1-9 объединяют с одним или несколькими инертными носителями и/или разбавителями.
16. Фармацевтическая композиция, приготовленная из моногидрохлорида по пп.4, 6 или 8 и необязательно одного или нескольких инертных носителей и/или разбавителей.
Текст
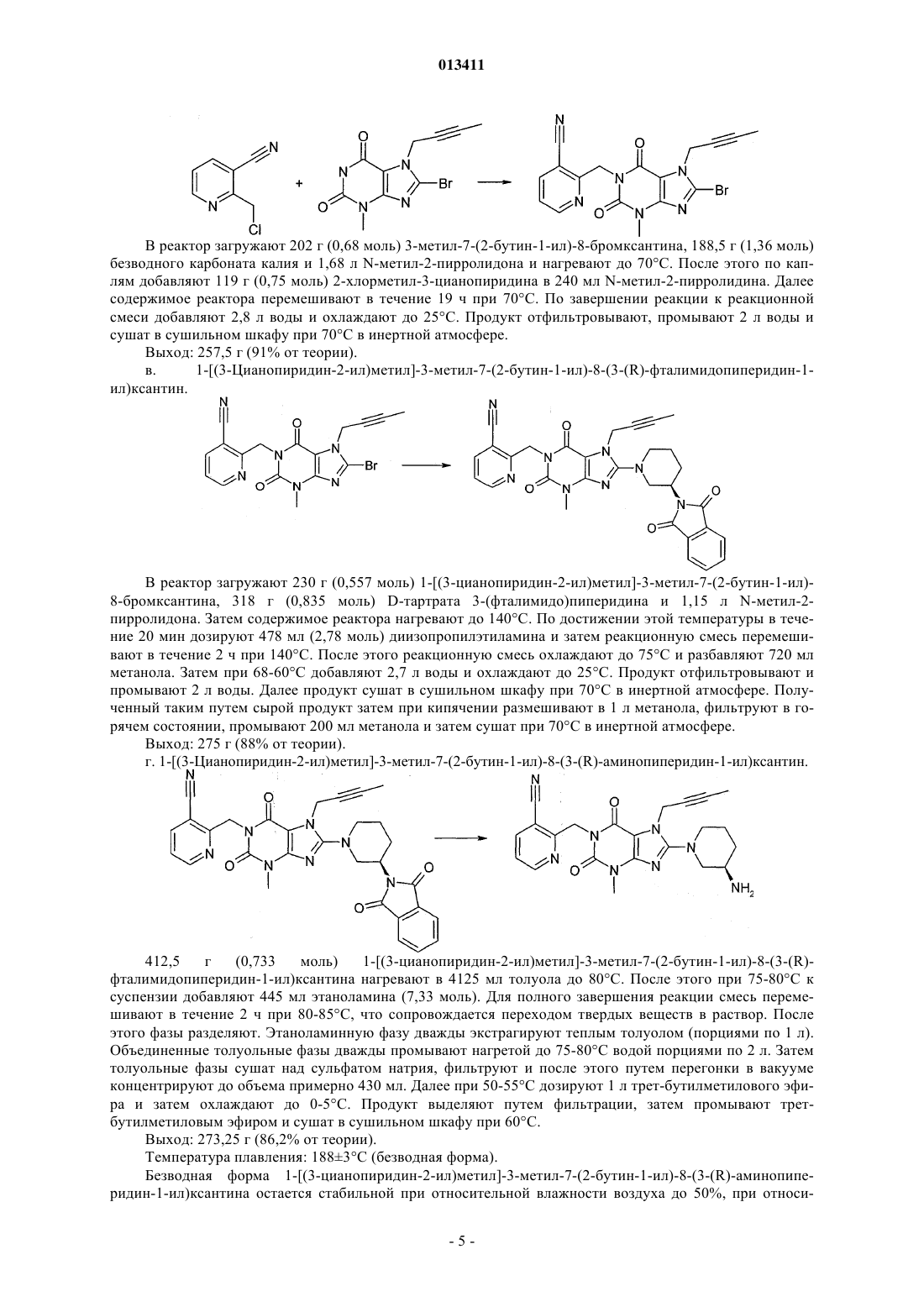
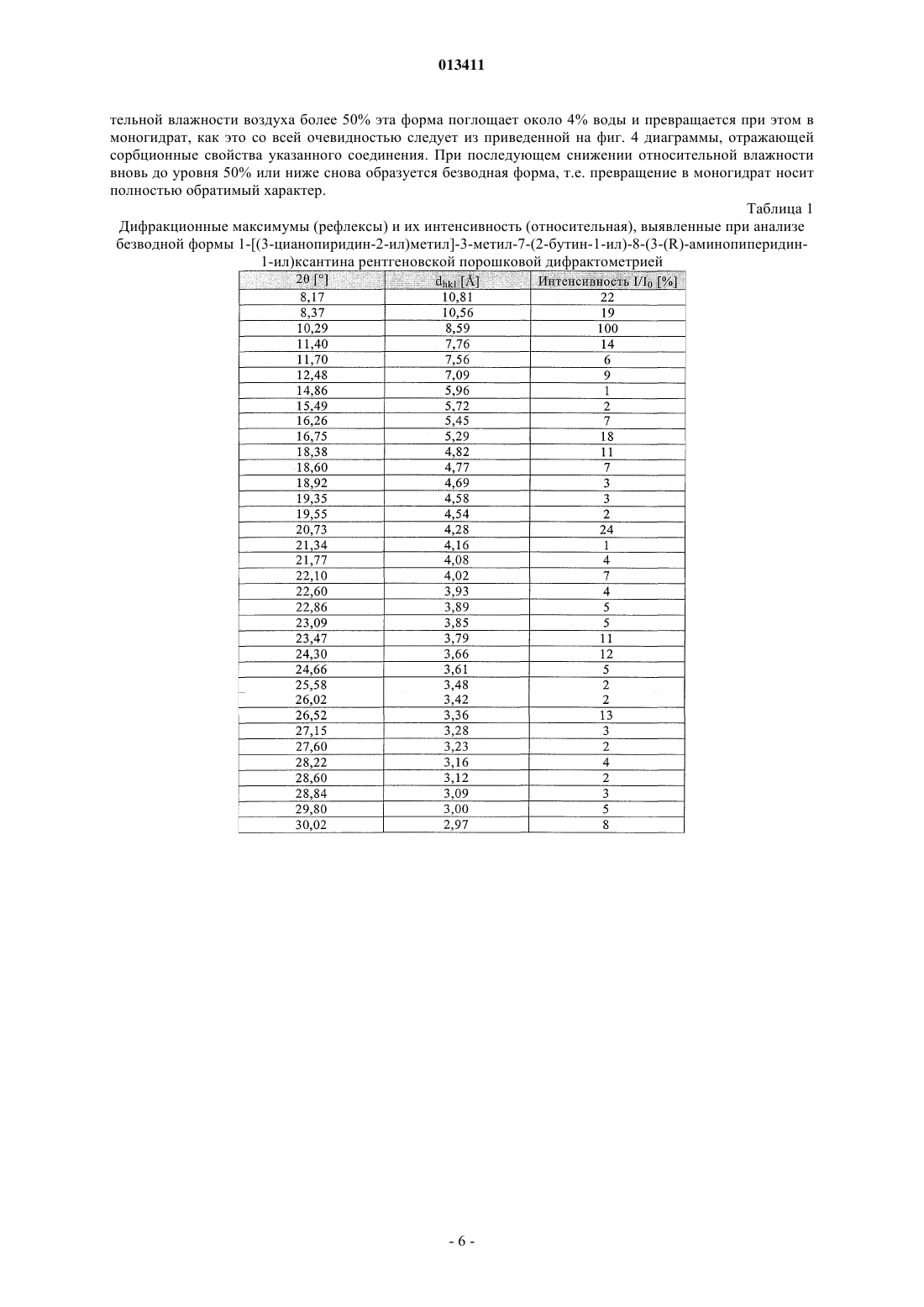
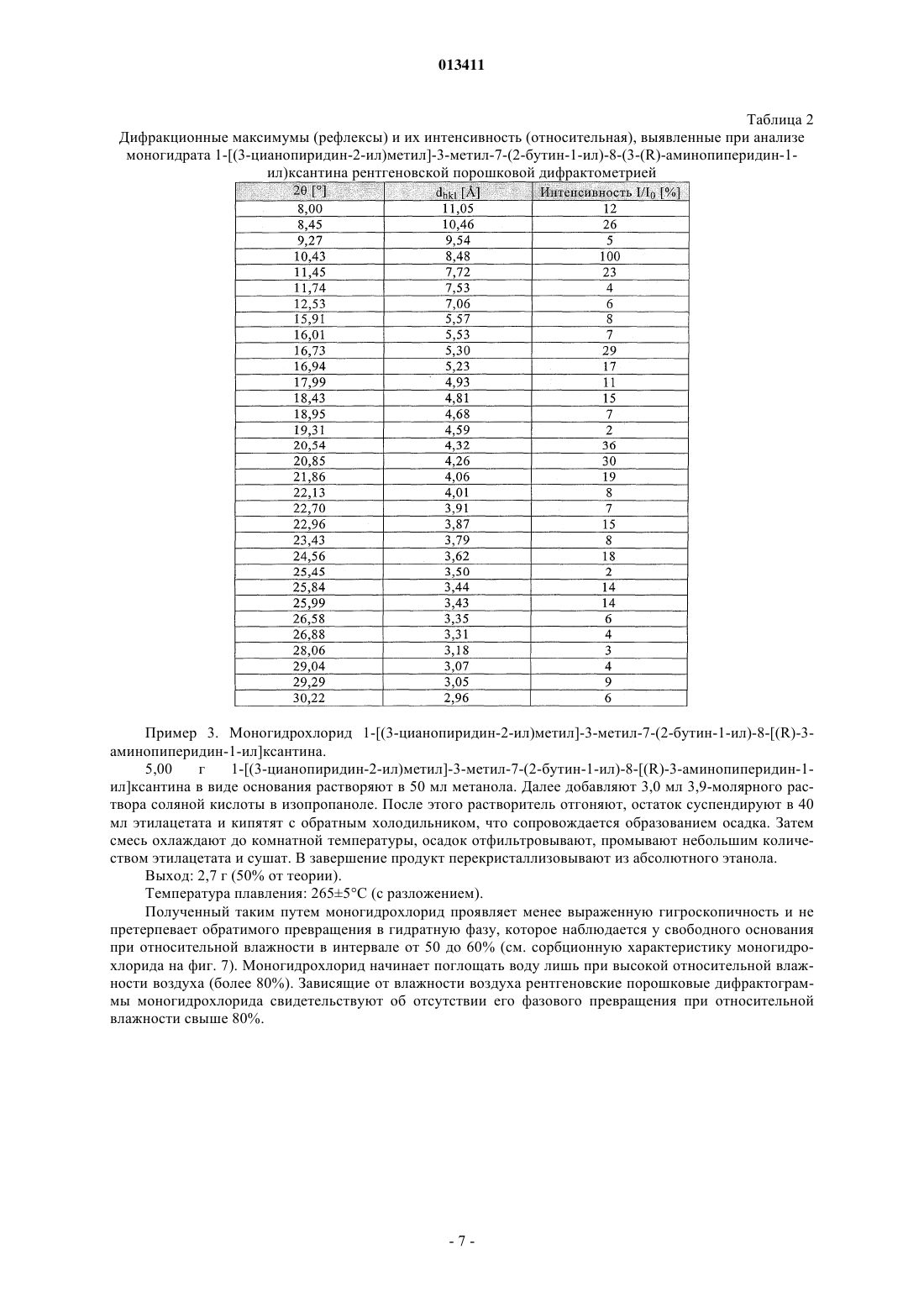
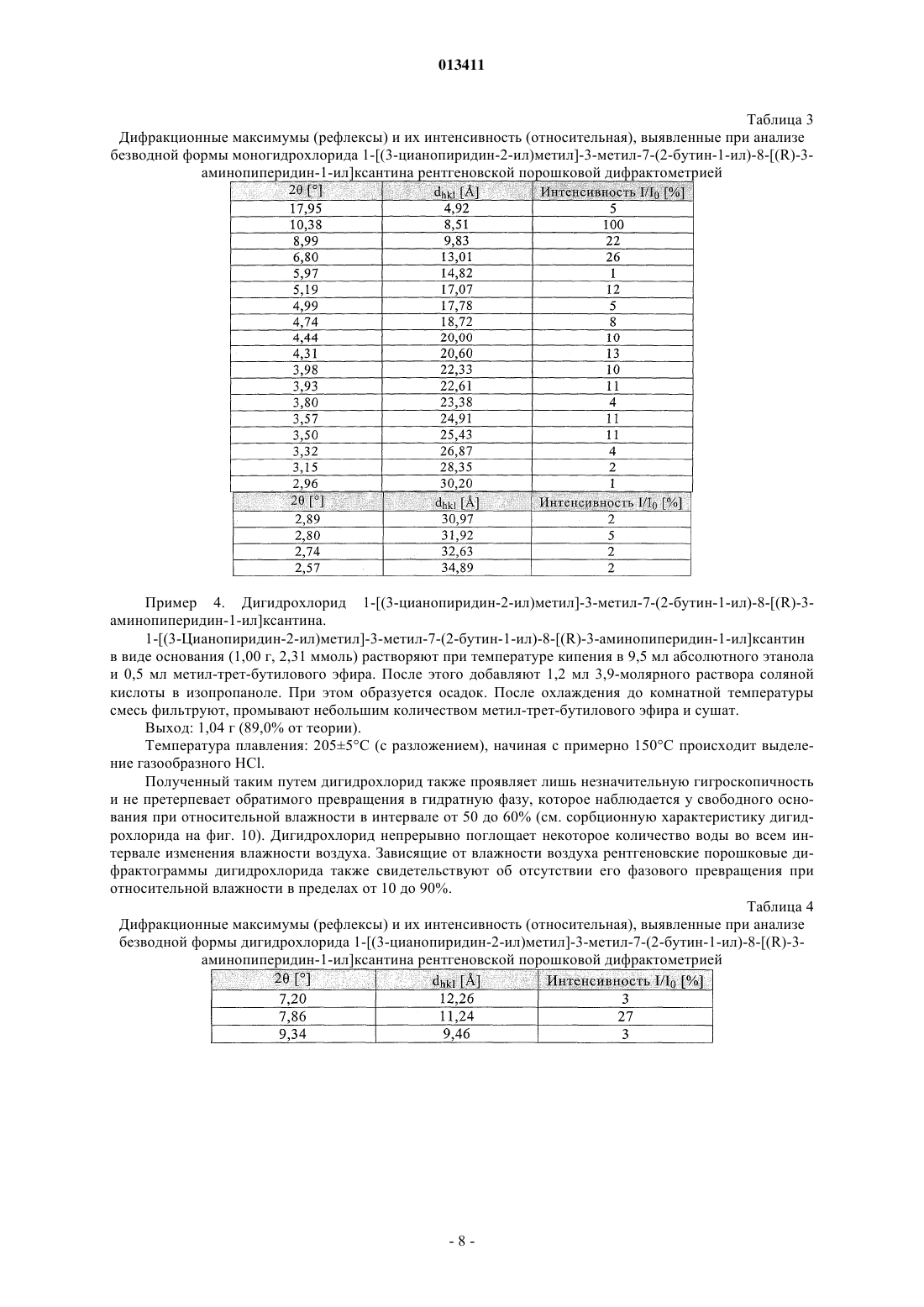
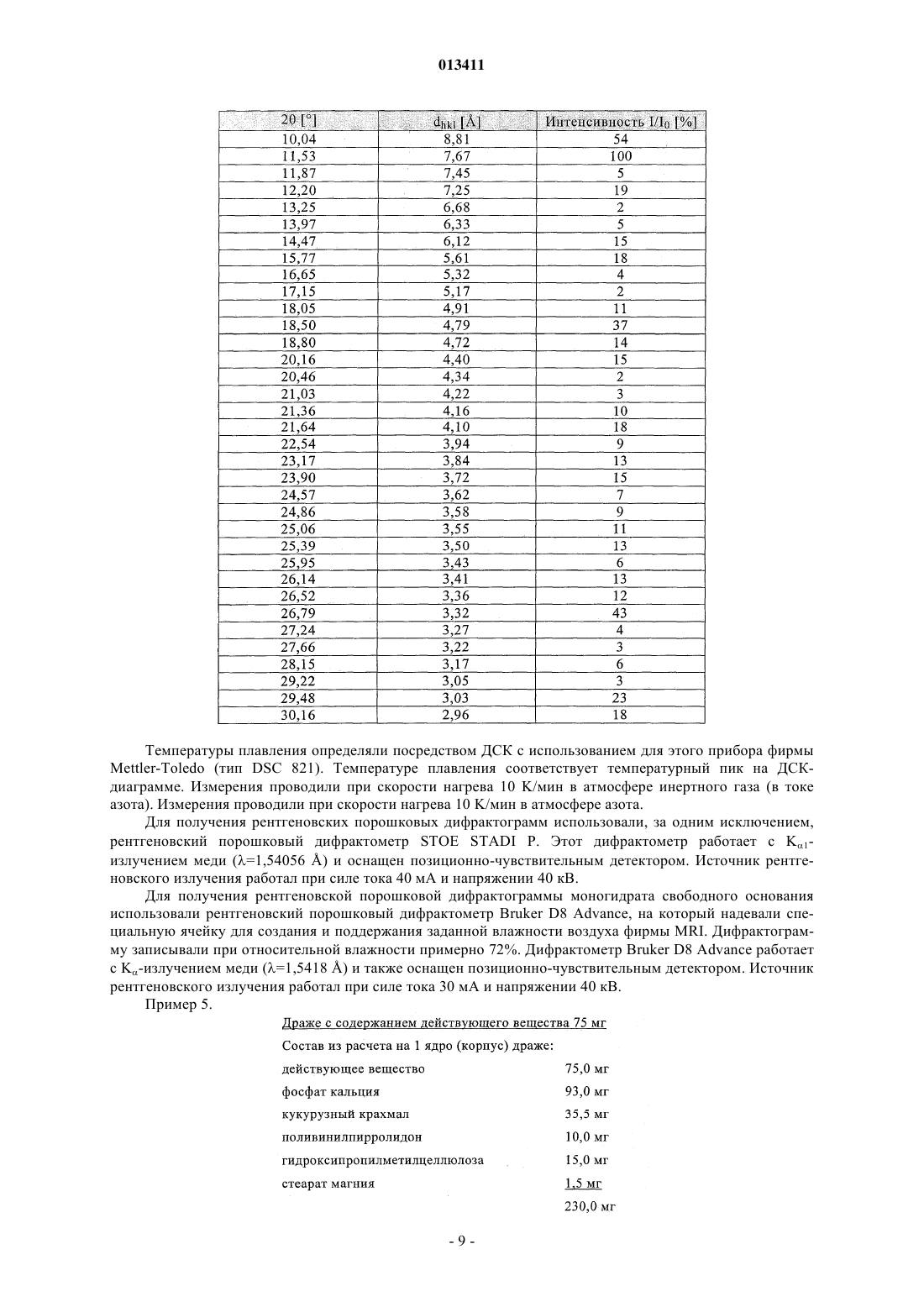
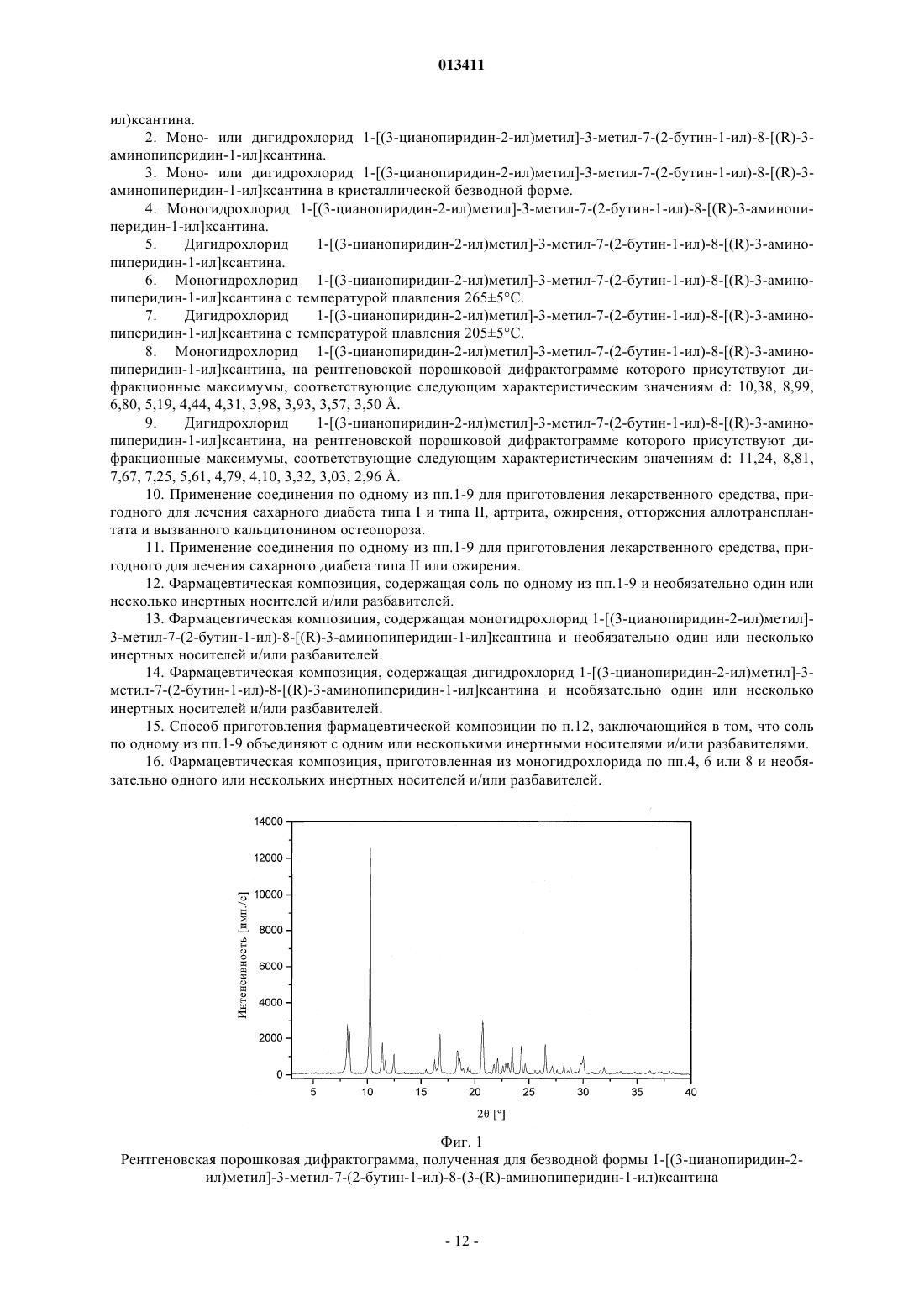
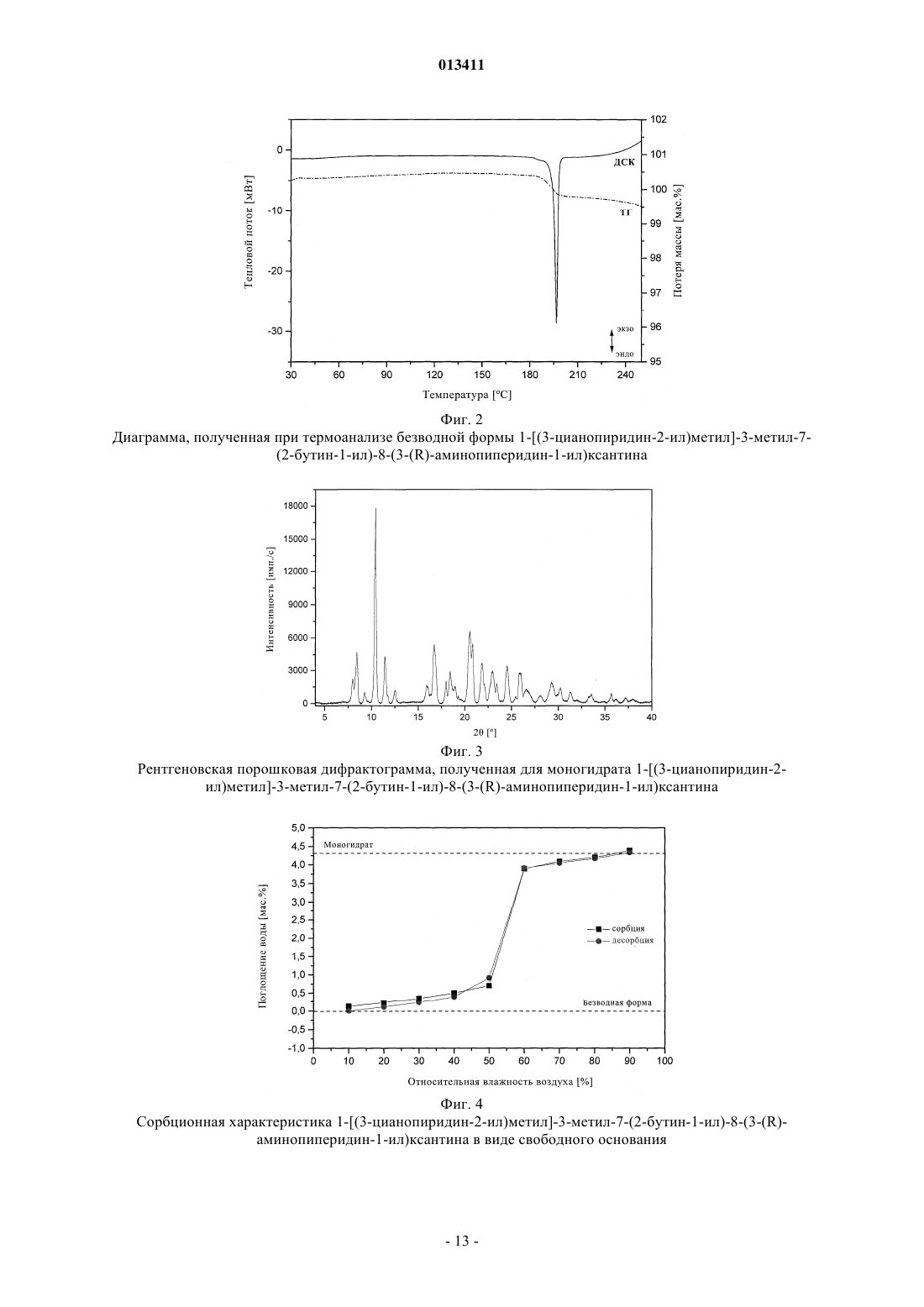
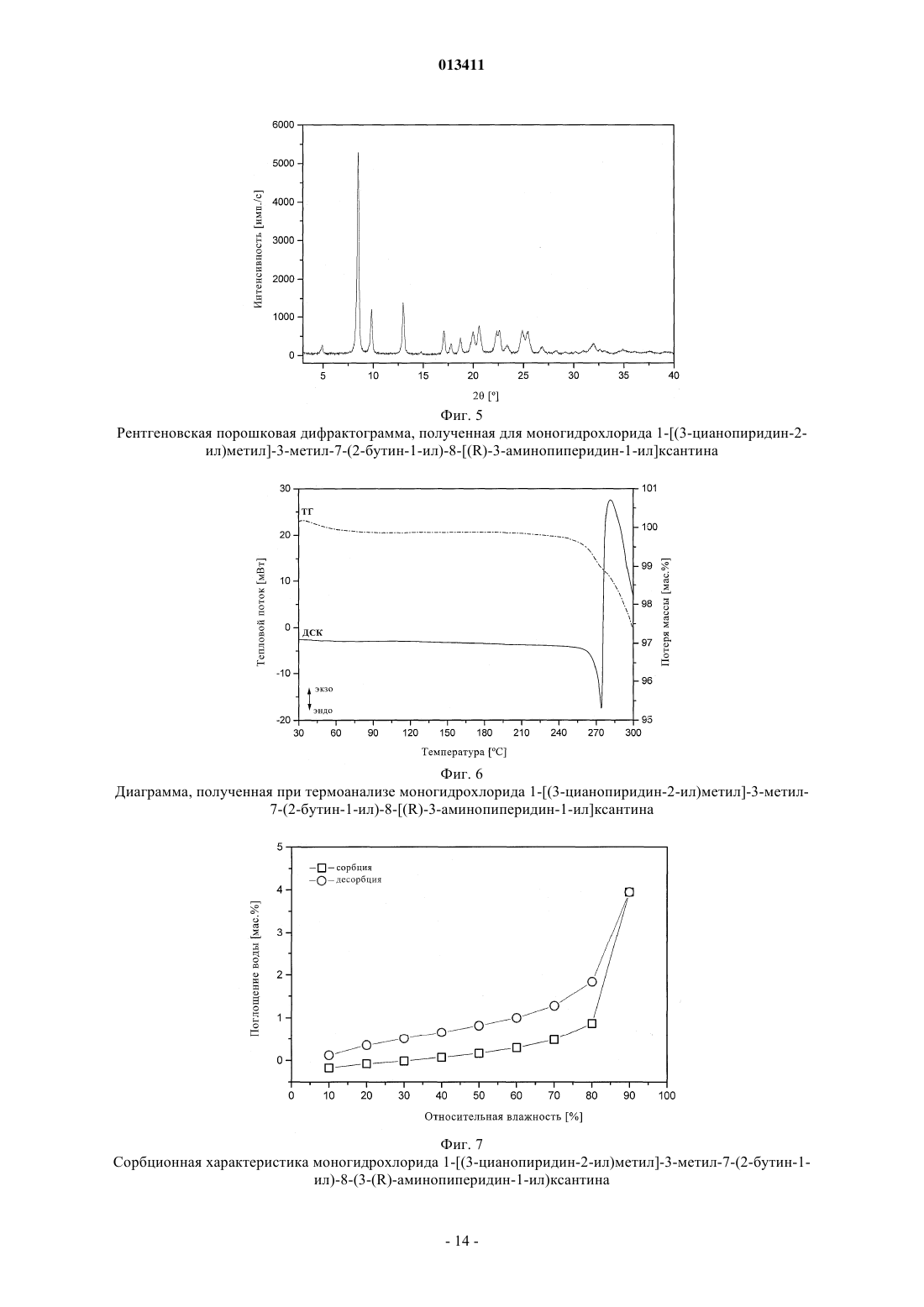
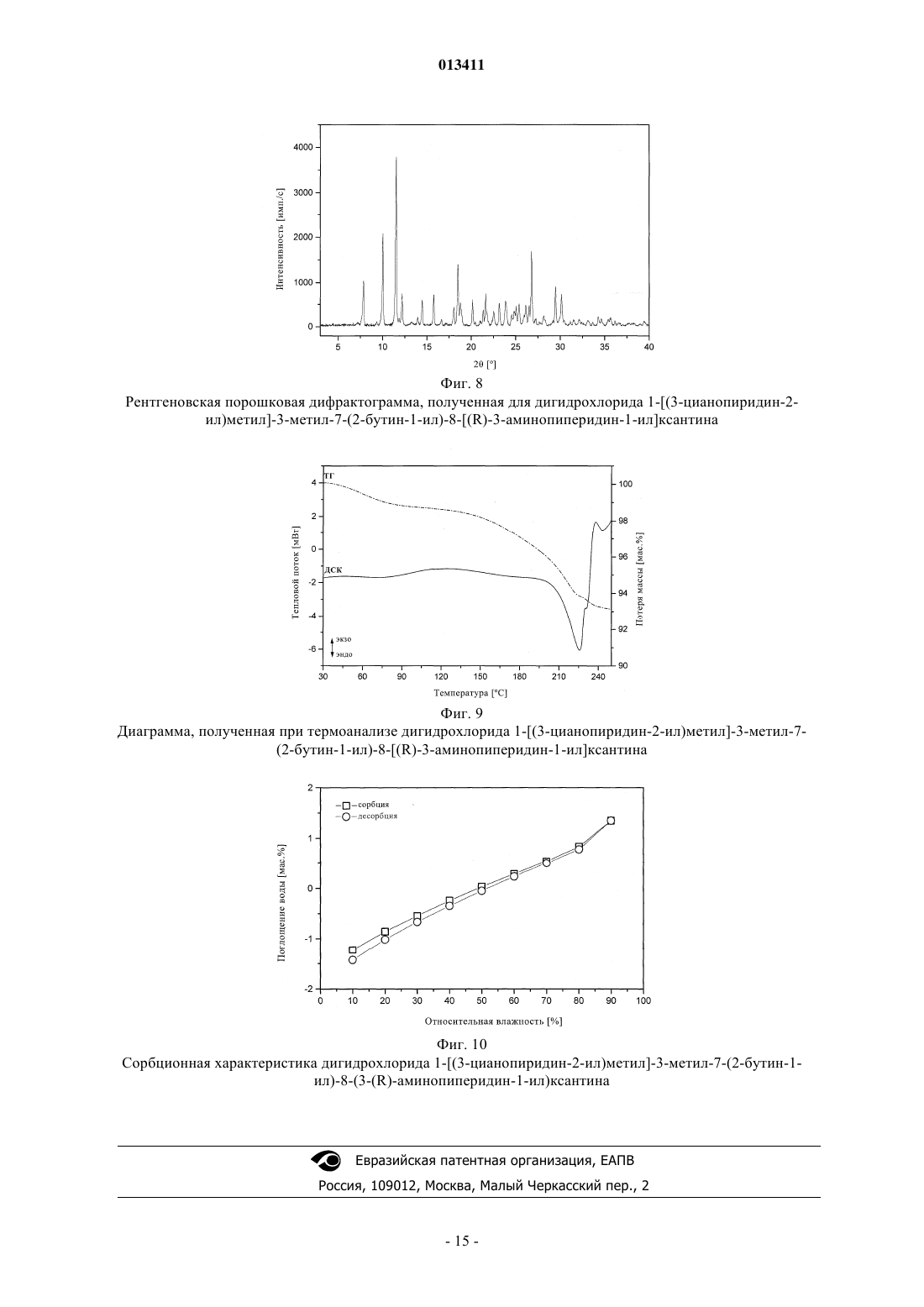
013411 Настоящее изобретение относится к новым замещенным ксантинам формулы их таутомерам, энантиомерам, их смесям и их солям, прежде всего их физиологически совместимым солям с неорганическими или органическими кислотами, таким, например, как гидрохлориды, обладающим ценными фармакологическими свойствами, прежде всего ингибирующим действием на активность дипептидилпептидазы IV (DPP-IV), к их получению, их применению для профилактики или лечения заболеваний или патологических состояний, которые взаимосвязаны с повышенной активностью ферментаDPP-IV или которые можно предупредить либо облегчить за счет снижения активности фермента DPPIV, прежде всего сахарного диабета типа I или типа II, к содержащим одно из соединений общей формулы (I) или одну из его физиологически совместимых солей лекарственным средствам, а также к способу их приготовления. Производные ксантинов, обладающие ингибирующим действием на фермент DPP-IV, уже известны из WO 02/068420, WO 02/02560, WO 03/004496, WO 03/024965, WO 04/018468, WO 04/048379, JP 2003300977 и ЕР 1338595. В основу настоящего изобретения была положена задача предложить новые соединения формулы I,прежде всего их соли, с оптимальным для их фармацевтического применения набором свойств. Наряду с собственно эффективностью при определенном показании действующее вещество для возможности его применения в качестве лекарственного средства должно по многим критериям отвечать и иным требованиям. Подобные критерии большей частью связаны с физико-химическими свойствами действующего вещества. В качестве не ограничивающих примеров подобных критериев можно назвать стабильное сохранение исходным веществом своего действия в различных окружающих условиях, в процессе приготовления лекарственного препарата и в составе конечных лекарственных средств. Поэтому лекарственное действующее вещество, используемое для приготовления лекарственных композиций, должно обладать высокой стабильностью, сохраняющейся даже в различных окружающих условиях. Обязательное соблюдение этого требования обусловлено необходимостью исключить применение лекарственных композиций,в которых наряду с собственно действующим веществом присутствуют, например, и продукты его разложения. В подобном случае содержание действующего вещества в лекарственных препаратах может оказаться меньше указанного производителем. В результате абсорбции влаги содержание лекарственного действующего вещества уменьшается изза обусловленного поглощением воды увеличения массы. Поэтому лекарственные средства, проявляющие склонность к поглощению влаги, необходимо защищать от влаги на время хранения, например, за счет добавления соответствующих осушителей либо хранения лекарственного средства в условиях, в которых оно защищено от контакта с влагой. Помимо этого поглощение влаги может привести к уменьшению содержания лекарственного действующего вещества в процессе приготовления лекарственного препарата, если лекарственное действующее вещество не защищено от контакта с влагой и непосредственно подвергается воздействию факторов окружающей среды. По этой причине лекарственное действующее вещество предпочтительно должно обладать лишь минимально возможной гигроскопичностью. Поскольку для получения лекарственной формы с постоянно воспроизводимым содержанием в ней действующего вещества важное значение имеет его кристаллическая модификация, изначально необходимо получать максимально полную информацию о любом возможном полиморфизме действующего вещества, представленного в кристаллической форме. Если действующее вещество может существовать в различных полиморфных модификациях, то необходимо удостовериться в том, что определенная кристаллическая модификация действующего вещества не претерпит никаких изменений в приготовленном позже на его основе лекарственном препарате. В противном случае подобные полиморфные превращения могут отрицательно сказаться на эффективности медикамента и ее воспроизводимости. С учетом сказанного выше предпочтительны действующие вещества, характеризующиеся лишь минимальной склонностью к полиморфным превращениям. Другим критерием, который при определенных условиях может иметь особо важное значение в зависимости от выбранной лекарственной формы или выбранной технологии ее приготовления, является растворимость действующего вещества. Так, например, при приготовлении лекарственных форм в виде растворов (например, для инфузий) обязательным условием является наличие у действующего вещества достаточной растворимости в физиологически совместимых растворителях. Особо важное значение имеет и достаточная растворимость действующего вещества, включаемого в состав лекарственных средств,принимаемых внутрь. Учитывая сказанное выше, еще одна задача настоящего изобретения состояла в том, чтобы предложить лекарственное действующее вещество, которое не только обладало бы высокой фармакологической-1 013411 эффективностью, но и в максимально возможной степени удовлетворяло бы по своим физикохимических свойствам рассмотренным выше требованиям. При создании изобретения неожиданно было установлено, что указанные выше задачи позволяют решить предлагаемые в изобретении соли соединения формулы I с соляной кислотой, их энантиомеры и их смеси. Особенно предпочтительны согласно настоящему изобретению моно- и дигидрохлорид, а также их энантиомеры и их смеси. Используемые в описании настоящего изобретения и формуле изобретения выражения "соль с соляной кислотой" и "гидрохлорид" носят синонимичный характер. Объектом изобретения в соответствии с этим являются соли 1-[(3-цианопиридин-2-ил)метил]-3 метил-7-(2-бутин-1-ил)-8-(3-аминопиперидин-1-ил)ксантина с соляной кислотой, а также их энантиомеры и их смеси. К таковым относятся, например, моно- и дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина и 1-[(3-цианопиридин-2-ил)метил]-3 метил-7-(2-бутин-1-ил)-8-[(S)-3-аминопиперидин-1-ил]ксантина, а также их смеси, включая рацемат. Еще одним объектом изобретения являются фармацевтические композиции, содержащие по меньшей мере одну из указанных выше солей или один из указанных выше гидратов, а также способ приготовления соответствующих лекарственных средств. Предлагаемые в изобретении соединения общей формулы I и их соответствующие фармацевтически приемлемые соли с учетом их способности подавлять активность DPP-IV позволяют влиять на все те патологические состояния или заболевания, на которые можно воздействовать за счет подавления активности DPP-IV. Поэтому можно ожидать, что предлагаемые в изобретении соединения пригодны для профилактики или лечения таких заболеваний или патологических состояний, как сахарный диабет типа 1 и типа 2, преддиабет, снижение толерантности к глюкозе или изменения уровня сахара в крови натощак, диабетические осложнения (например, ретинопатия, нефропатия или невропатия), метаболический ацидоз или кетоз, реактивная гипогликемия, инсулинорезистентность, метаболический синдром, дислипидимии различного генеза, артрит, атеросклероз и родственные заболевания, ожирение, отторжение аллотрансплантата и вызванный кальцитонином остеопороз. Помимо этого предлагаемые в изобретении соединения позволяют предупреждать дегенерацию В-клеток, например, апоптоз или некроз панкреатических В-клеток. Предлагаемые в изобретении соединения пригодны далее для повышения или восстановления функциональной активности панкреатических клеток и наряду с этим для увеличения количества и размера панкреатических В-клеток. Кроме того, исходя из той роли, которую играют глюкагоноподобные пептиды, такие, например, как GLP-1 и GLP-2, и с учетом их связи с ингибированием активности фермента DPP-IV ожидается, что предлагаемые в изобретении соединения окажутся пригодны помимо прочего для достижения седативного или устраняющего состояние страха эффекта и, кроме того,окажутся способны благоприятно влиять на катаболические состояния после хирургических операций или на гормональные стрессовые реакции или позволят снизить смертность и заболеваемость после инфаркта миокарда. Помимо этого предлагаемые в изобретении соединения пригодны для лечения всех состояний, взаимосвязанных с вышеописанными эффектами и опосредуемых пептидом GLP-1 или GLP2. Предлагаемые в изобретении соединения равным образом могут использоваться в качестве мочегонных или гипотензивных средств и пригодны для предупреждения и лечения острой почечной недостаточности. Предлагаемые в изобретении соединения могут далее использоваться для лечения воспалительных заболеваний дыхательных путей. Равным образом они пригодны для предупреждения и терапии хронических воспалительных заболеваний кишечника, таких, например, как синдром раздраженного кишечника (СРК), болезнь Крона или язвенный колит, а также для применения при панкреатите. Помимо этого ожидается, что их можно будет использовать при любом типе повреждений или нарушений в желудочно-кишечном тракте, в том числе, например, и при колитах и энтеритах. Кроме того, ожидается,что ингибиторы DPP-IV, а тем самым и предлагаемые в изобретении соединения можно будет применять для лечения бесплодия или для улучшения репродуктивной способности человека или млекопитающих и прежде всего в том случае, когда бесплодие взаимосвязано с инсулинорезистентностью или с синдромом поликистоза яичников. С другой стороны, эти соединения способны влиять на подвижность сперматозоидов и поэтому могут использоваться в качестве мужских контрацептивов. Такие соединения способны помимо этого положительно влиять на состояния, связанные с дефицитом соматотропных гормонов и проявляющиеся в карликовом росте, а также их целесообразно использовать при всех тех показаниях,при которых допускается применение соматотропных гормонов. Предлагаемые в изобретении соединения благодаря их ингибирующему действию на активность DPP-IV пригодны также для лечения различных аутоиммунных заболеваний, таких, например, как ревматоидный артрит, множественный склероз,тиреоидиты, базедова болезнь и другие. Помимо этого они могут использоваться при вирусных заболеваниях, в том числе, например, и при ВИЧ-инфекциях, для стимуляции гемопоэза, при доброкачественной гиперплазии простаты, при гингивитах, а также для лечения нейронных нарушений и нейродегенеративных заболеваний, таких, например, как болезнь Альцгеймера. Предлагаемые в изобретении соединения можно использовать и для терапии опухолей, прежде всего для изменения процесса инвазии опухоли, в том числе и метастазирования. В качестве примера при этом можно назвать их применение при Т-клеточных лимфомах, остром лимфобластном лейкозе, клеточном раке щитовидной железы, базалиоме-2 013411 или раке молочной железы. К числу других показаний относятся апоплексический удар, ишемии различного генеза, болезнь Паркинсона и мигрень. Помимо этого к другим показаниям относятся фолликулярный и эпидермолитический гиперкератозы, повышенная пролиферация кератиноцитов, псориаз, энцефаломиелиты, гломерулонефриты, липодистрофии, а также психосоматические, депрессивные и нейропсихические заболевания различного генеза. Предлагаемые в изобретении соединения можно также использовать в сочетании с действующими веществами других типов. К подобного рода терапевтическим средствам, которые могут использоваться в комбинации с предлагаемыми в изобретении соединениями, относятся, например, антидиабетические средства, такие как метформин, сульфонилмочевины (например, глибенкламид, толбутамид, глимепирид), натеглинид, репаглинид, тиазолидиндионы (например, росиглитазон, пиоглитазон), агонисты рецептора PPAR (например, GI 262570) и антагонисты рецептора PPAR, модуляторы рецептора PPAR/(например, KRP 297), модуляторы рецептора PPAR//, активаторы AMPK, ингибиторы АСС 1 и АСС 2,ингибиторы DGAT, агонисты SMT3-рецептора, ингибиторы 11-HSD, агонисты или миметики FGF19,ингибиторы -глюкозидазы (например, акарбоза, воглибоза), иные ингибиторы DPP-IV, 2-антагонисты,инсулин и его аналоги, GLP-1 и аналоги GLP-1 (например, эксендин-4) или амилин. Наряду с указанными выше в комбинации с предлагаемыми в изобретении соединениями могут также использоваться ингибиторы SGLT2, такие как Т-1095 или KGT1251 (869682), ингибиторы (белок-тирозин)-фосфатазы 1,вещества, влияющие на дерегуляцию продуцирования глюкозы в печени, такие как ингибиторы глюкозо 6-фосфатазы, фруктозо-1,6-бисфосфатазы или гликогенфосфорилазы, антагонисты глюкагонового рецептора и ингибиторы фосфоенолпируваткарбоксикиназы, киназы гликогенсинтазы (протеинкиназы) или пируватдегидрогеназы, средства, понижающие уровень липидов в крови, такие как ингибиторы HMGCoA-редуктазы (например, симвастатин, аторвастатин), фибраты (например, безафибрат, фенофибрат),никотиновая кислота и ее производные, агонисты рецептора PPAR, агонисты рецептора PPAR, ингибиторы АСАТ (например, авасимиб) или ингибиторы всасывания холестерина, такие как эзетимиб, связывающие желчные кислоты вещества, такие как колестирамин, ингибиторы подвздошного транспорта желчных кислот, средства, повышающие уровень липопротеинов высокой плотности в крови, такие как ингибиторы СЕТР или регуляторы АВС 1 или же антагонисты LXR, агонисты LXR или регуляторыLXR/, либо действующие вещества для лечения ожирения, такие как сибутрамин, тетрагидролипстатин, дексфенфлурамин или аксокин, антагонисты рецептора каннбиноида 1, антагонисты рецептора МСН-1, агонисты рецептора МС 4, антагонисты NPY5 либо NPY2 или 3-агонисты, такие как SB-418790 или AD-9677, а также агонисты рецептора 5HT2c. Помимо этого в сочетании с предлагаемыми в изобретении соединениями можно использовать медикаменты, влияющие на повышенное кровяное давление, такие, например, как антагонисты AII или ингибиторы АСЕ, диуретики, -блокаторы, Са-антагонисты и другие или их комбинации. Для достижения соответствующего действия предлагаемые в изобретении соединения целесообразно вводить в организм от 1 до 4 раз в день в дозе, которая при внутривенном введении составляет от 1 до 100 мг, предпочтительно от 1 до 30 мг, а при пероральном введении составляет от 1 до 1000 мг, предпочтительно от 1 до 100 мг. С этой целью предлагаемые в изобретении соединения формулы I, необязательно в сочетании с действующими веществами других типов, перерабатывают совместно с одним или несколькими обычными инертными носителями и/или разбавителями, например с кукурузным крахмалом,лактозой, тростниковым сахаром, микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, водой/этанолом, водой/глицерином, водой/сорбитом, водой/полиэтиленгликолем, пропиленгликолем, цетилстеариловым спиртом, карбоксиметилцеллюлозой или жиросодержащими веществами, такими как отвержденный жир, или их приемлемыми смесями, в обычные галеновы формы, такие как таблетки, драже, капсулы, порошки, суспензии или суппозитории. На прилагаемых к описанию фиг. 1, 3, 5 и 8 показаны рентгеновские порошковые дифрактограммы соединений из примеров 2 (безводная форма, а также моногидрат), 3 и 4, на фиг. 2, 6 и 9 показаны диаграммы, полученные при термоанализе соединений из примеров 2, 3, соответственно 4, а на фиг. 4, 7 и 10 показаны сорбционные характеристики свободного основания, а также моно- и дигидрохлорида 1-[(3 цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина (примеры 2, 3 и 4). Ниже изобретение проиллюстрировано на примерах. Пример 1. D-Тартрат (соль) R-энантиомера 3-(фталимидо)пиперидина. а. Гидрирование. В реактор для гидрирования загружают 10,00 кг (106,25 моль) 3-аминопиридина, 500 г техническо-3 013411 го активированного угля и 65 л уксусной кислоты. Затем добавляют 50 г катализатора Нишимуры(имеющийся в продаже смешанный родиевоплатиновый катализатор), суспендированного в 2,5 л уксусной кислоты и после этого промывают 2,5 л уксусной кислоты. Далее гидрируют при 50 С и давлении водорода 100 бар до прекращения поглощения водорода, после чего гидрируют еще в течение 30 мин при 50 С. Затем катализатор и активированный уголь отфильтровывают и промывают 10 л уксусной кислоты. Подобная реакция успешно протекает и при не столь высоком давлении. б. Ацилирование. В реактор загружают 15,74 кг (106,25 моль) фталевого ангидрида и смешивают с фильтратом с предшествующей стадии гидрирования. После этого промывают 7,5 л уксусной кислоты и затем реакционную смесь кипятят с обратным холодильником, отгоняя при этом в течение часа около 30% от всего количества использованной уксусной кислоты. В завершение реакционную смесь охлаждают до 90 С. в. Расщепление рацематов. К реакционному раствору для ацилирования при 90 С дозируют нагретый до 50 С раствор 11,16 кгD-(-)-винной кислоты (74,38 моль) в 50 л абсолютного этанола. Далее промывают 10 л абсолютного этанола и перемешивают в течение 30 мин при 90 С, что сопровождается кристаллизацией продукта. После охлаждения до 5 С продукт отделяют центрифугированием и промывают абсолютным этанолом. г. Перекристаллизация. Влажный сырой продукт нагревают с обратным холодильником в смеси из 50 л ацетона и 90 л воды до образования раствора. После этого раствор охлаждают до 5 С, что сопровождается выкристаллизовыванием продукта. Далее суспензию перемешивают в течение 30 мин при 5 С, продукт отделяют центрифугированием и затем промывают смесью из 20 л ацетона и 10 л воды. В завершение продукт сушат в сушильном шкафу при 45 С в инертной атмосфере. Выход: 11,7-12,5 кг. Пример 2. Получение 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина в виде основания. а. 3-Циано-2-(хлорметил)пиридин. 165,5 г (0,98 моль) 2-гидроксиметил-3-пиридинкарбоксамида совместно с 270 мл оксихлорида фосфора нагревают до 90-100 С с выдержкой при этой температуре в течение 1 ч. Далее реакционную смесь охлаждают до комнатной температуры и затем по каплям добавляют к примерно 800 мл нагретой до 5060 С воды. После гидролиза оксихлорида фосфора при охлаждении нейтрализуют раствором едкого натра, что сопровождается выпадением продукта в осадок. Продукт отфильтровывают, промывают 300 мл воды и затем сушат при 35-40 С. Выход: 122,6 г (82% от теории). б. 1-[(3-Цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-бромксантин. В реактор загружают 202 г (0,68 моль) 3-метил-7-(2-бутин-1-ил)-8-бромксантина, 188,5 г (1,36 моль) безводного карбоната калия и 1,68 л N-метил-2-пирролидона и нагревают до 70 С. После этого по каплям добавляют 119 г (0,75 моль) 2-хлорметил-3-цианопиридина в 240 мл N-метил-2-пирролидина. Далее содержимое реактора перемешивают в течение 19 ч при 70 С. По завершении реакции к реакционной смеси добавляют 2,8 л воды и охлаждают до 25 С. Продукт отфильтровывают, промывают 2 л воды и сушат в сушильном шкафу при 70 С в инертной атмосфере. Выход: 257,5 г (91% от теории). в. 1-[(3-Цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-фталимидопиперидин-1 ил)ксантин. В реактор загружают 230 г (0,557 моль) 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)8-бромксантина, 318 г (0,835 моль) D-тартрата 3-(фталимидо)пиперидина и 1,15 л N-метил-2 пирролидона. Затем содержимое реактора нагревают до 140 С. По достижении этой температуры в течение 20 мин дозируют 478 мл (2,78 моль) диизопропилэтиламина и затем реакционную смесь перемешивают в течение 2 ч при 140 С. После этого реакционную смесь охлаждают до 75 С и разбавляют 720 мл метанола. Затем при 68-60 С добавляют 2,7 л воды и охлаждают до 25 С. Продукт отфильтровывают и промывают 2 л воды. Далее продукт сушат в сушильном шкафу при 70 С в инертной атмосфере. Полученный таким путем сырой продукт затем при кипячении размешивают в 1 л метанола, фильтруют в горячем состоянии, промывают 200 мл метанола и затем сушат при 70 С в инертной атмосфере. Выход: 275 г (88% от теории). г. 1-[(3-Цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин.(0,733 моль) 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)фталимидопиперидин-1-ил)ксантина нагревают в 4125 мл толуола до 80 С. После этого при 75-80 С к суспензии добавляют 445 мл этаноламина (7,33 моль). Для полного завершения реакции смесь перемешивают в течение 2 ч при 80-85 С, что сопровождается переходом твердых веществ в раствор. После этого фазы разделяют. Этаноламинную фазу дважды экстрагируют теплым толуолом (порциями по 1 л). Объединенные толуольные фазы дважды промывают нагретой до 75-80 С водой порциями по 2 л. Затем толуольные фазы сушат над сульфатом натрия, фильтруют и после этого путем перегонки в вакууме концентрируют до объема примерно 430 мл. Далее при 50-55 С дозируют 1 л трет-бутилметилового эфира и затем охлаждают до 0-5 С. Продукт выделяют путем фильтрации, затем промывают третбутилметиловым эфиром и сушат в сушильном шкафу при 60 С. Выход: 273,25 г (86,2% от теории). Температура плавления: 1883 С (безводная форма). Безводная форма 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина остается стабильной при относительной влажности воздуха до 50%, при относи-5 013411 тельной влажности воздуха более 50% эта форма поглощает около 4% воды и превращается при этом в моногидрат, как это со всей очевидностью следует из приведенной на фиг. 4 диаграммы, отражающей сорбционные свойства указанного соединения. При последующем снижении относительной влажности вновь до уровня 50% или ниже снова образуется безводная форма, т.е. превращение в моногидрат носит полностью обратимый характер. Таблица 1 Дифракционные максимумы (рефлексы) и их интенсивность (относительная), выявленные при анализе безводной формы 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин 1-ил)ксантина рентгеновской порошковой дифрактометрией-6 013411 Таблица 2 Дифракционные максимумы (рефлексы) и их интенсивность (относительная), выявленные при анализе моногидрата 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1 ил)ксантина рентгеновской порошковой дифрактометрией Пример 3. Моногидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3 аминопиперидин-1-ил]ксантина. 5,00 г 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1 ил]ксантина в виде основания растворяют в 50 мл метанола. Далее добавляют 3,0 мл 3,9-молярного раствора соляной кислоты в изопропаноле. После этого растворитель отгоняют, остаток суспендируют в 40 мл этилацетата и кипятят с обратным холодильником, что сопровождается образованием осадка. Затем смесь охлаждают до комнатной температуры, осадок отфильтровывают, промывают небольшим количеством этилацетата и сушат. В завершение продукт перекристаллизовывают из абсолютного этанола. Выход: 2,7 г (50% от теории). Температура плавления: 2655 С (с разложением). Полученный таким путем моногидрохлорид проявляет менее выраженную гигроскопичность и не претерпевает обратимого превращения в гидратную фазу, которое наблюдается у свободного основания при относительной влажности в интервале от 50 до 60% (см. сорбционную характеристику моногидрохлорида на фиг. 7). Моногидрохлорид начинает поглощать воду лишь при высокой относительной влажности воздуха (более 80%). Зависящие от влажности воздуха рентгеновские порошковые дифрактограммы моногидрохлорида свидетельствуют об отсутствии его фазового превращения при относительной влажности свыше 80%.-7 013411 Таблица 3 Дифракционные максимумы (рефлексы) и их интенсивность (относительная), выявленные при анализе безводной формы моногидрохлорида 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3 аминопиперидин-1-ил]ксантина рентгеновской порошковой дифрактометрией Пример 4. Дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3 аминопиперидин-1-ил]ксантина. 1-[(3-Цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантин в виде основания (1,00 г, 2,31 ммоль) растворяют при температуре кипения в 9,5 мл абсолютного этанола и 0,5 мл метил-трет-бутилового эфира. После этого добавляют 1,2 мл 3,9-молярного раствора соляной кислоты в изопропаноле. При этом образуется осадок. После охлаждения до комнатной температуры смесь фильтруют, промывают небольшим количеством метил-трет-бутилового эфира и сушат. Выход: 1,04 г (89,0% от теории). Температура плавления: 2055 С (с разложением), начиная с примерно 150 С происходит выделение газообразного HCl. Полученный таким путем дигидрохлорид также проявляет лишь незначительную гигроскопичность и не претерпевает обратимого превращения в гидратную фазу, которое наблюдается у свободного основания при относительной влажности в интервале от 50 до 60% (см. сорбционную характеристику дигидрохлорида на фиг. 10). Дигидрохлорид непрерывно поглощает некоторое количество воды во всем интервале изменения влажности воздуха. Зависящие от влажности воздуха рентгеновские порошковые дифрактограммы дигидрохлорида также свидетельствуют об отсутствии его фазового превращения при относительной влажности в пределах от 10 до 90%. Таблица 4 Дифракционные максимумы (рефлексы) и их интенсивность (относительная), выявленные при анализе безводной формы дигидрохлорида 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3 аминопиперидин-1-ил]ксантина рентгеновской порошковой дифрактометрией Температуры плавления определяли посредством ДСК с использованием для этого прибора фирмыMettler-Toledo (тип DSC 821). Температуре плавления соответствует температурный пик на ДСКдиаграмме. Измерения проводили при скорости нагрева 10 K/мин в атмосфере инертного газа (в токе азота). Измерения проводили при скорости нагрева 10 K/мин в атмосфере азота. Для получения рентгеновских порошковых дифрактограмм использовали, за одним исключением,рентгеновский порошковый дифрактометр STOE STADI Р. Этот дифрактометр работает с K1 излучением меди (=1,54056 ) и оснащен позиционно-чувствительным детектором. Источник рентгеновского излучения работал при силе тока 40 мА и напряжении 40 кВ. Для получения рентгеновской порошковой дифрактограммы моногидрата свободного основания использовали рентгеновский порошковый дифрактометр Bruker D8 Advance, на который надевали специальную ячейку для создания и поддержания заданной влажности воздуха фирмы MRI. Дифрактограмму записывали при относительной влажности примерно 72%. Дифрактометр Bruker D8 Advance работает с K-излучением меди (=1,5418 ) и также оснащен позиционно-чувствительным детектором. Источник рентгеновского излучения работал при силе тока 30 мА и напряжении 40 кВ. Пример 5.-9 013411 Получение. Действующее вещество смешивают с фосфатом кальция, кукурузным крахмалом, поливинилпирролидоном, гидроксипропилметилцеллюлозой и половиной от указанного количества стеарата магния. Из полученной смеси на таблетировочной машине получают прессованные продукты диаметром примерно 13 мм, которые протирают на соответствующей машине через сито с размером ячеек 1,5 мм и смешивают с остальным количеством стеарата магния. Из этого гранулята на таблетировочной машине прессуют таблетки заданной формы. Масса ядра: 230 мг. Пуансон: диаметр 9 мм, с вогнутой рабочей поверхностью. На полученные таким путем ядра драже наносят пленочное покрытие, состоящее в основном из гидроксипропилметилцеллюлозы. Готовые драже с пленочным покрытием полируют пчелиным воском. Масса драже: 245 мг. Пример 6. Получение. Действующее вещество смешивают с лактозой и крахмалом и равномерно увлажняют водным раствором поливинилпирролидона. После продавливания влажной массы через сито (с размером ячеек 2,0 мм) и сушки в решетчатом сушильном шкафу при 50 С продукт вновь просеивают через сито (с размером ячеек 1,5 мм) и примешивают смазывающее вещество. Готовую к прессованию смесь перерабатывают в таблетки. Масса таблетки: 220 мг. Диаметр таблетки: 10 мм, двоякоплоская с двусторонней фасеткой и разделительной насечкой с одной стороны. Пример 7. Получение. Смесь действующего вещества с лактозой, кукурузным крахмалом и кремниевой кислотой увлажняют 20%-ным водным раствором поливинилпирролидона и продавливают через сито с размером ячеек 1,5 мм. Высушенный при 45 С гранулят еще раз протирают через то же самое сито и смешивают с указанным количеством стеарата магния. Из этой смеси прессуют таблетки. Масса таблетки: 300 мг. Пуансон: диаметр 10 мм, с плоской рабочей поверхностью. Пример 8. Твердожелатиновые капсулы с содержанием действующего вещества 150 мг. Состав из расчета на 1 капсулу: Получение. Действующее вещество смешивают со вспомогательными веществами, просеивают через сито с размером ячеек 0,75 мм и смешивают до гомогенности в соответствующем аппарате. Полу- 10013411 ченную смесь расфасовывают в твердожелатиновые капсулы размера 1. Масса содержимого капсулы: примерно 320 мг. Оболочка капсулы: твердожелатиновая капсула размера 1. Пример 9. Получение. После расплавления массы для суппозиториев в ней гомогенно диспергируют действующее вещество и расплавленную массу разливают по предварительно охлажденным формам. Пример 10. Получение. Дистиллированную воду нагревают до 70 С. Далее в ней при перемешивании растворяют метиловый и пропиловый эфиры n-гидроксибензойной кислоты, а также глицерин и натриевую соль карбоксиметилцеллюлозы. Раствор охлаждают до комнатной температуры, при перемешивании добавляют действующее вещество и диспергируют до гомогенности. После добавления и растворения сахара, раствора сорбита и ароматизатора суспензию для удаления из нее воздуха вакуумируют при перемешивании. В 5 мл суспензии содержание действующего вещества составляет 50 мг. Пример 11. Получение. Действующее вещество растворяют в необходимом количестве 0,01 н. HCl, раствору добавлением поваренной соли придают изотоничность, после чего стерилизуют фильтрацией и расфасовывают в 2-миллилитровые ампулы. Пример 12. Ампулы с содержанием действующего вещества 50 мг. Получение. Действующее вещество растворяют в необходимом количестве 0,01 н. HCl, раствору добавлением поваренной соли придают изотоничность, после чего стерилизуют фильтрацией и расфасовывают в 10-миллилитровые ампулы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-аминопиперидин-1- 11013411 ил)ксантина. 2. Моно- или дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3 аминопиперидин-1-ил]ксантина. 3. Моно- или дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3 аминопиперидин-1-ил]ксантина в кристаллической безводной форме. 4. Моногидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина. 5. Дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина. 6. Моногидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина с температурой плавления 2655 С. 7. Дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина с температурой плавления 2055 С. 8. Моногидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина, на рентгеновской порошковой дифрактограмме которого присутствуют дифракционные максимумы, соответствующие следующим характеристическим значениям d: 10,38, 8,99,6,80, 5,19, 4,44, 4,31, 3,98, 3,93, 3,57, 3,50 . 9. Дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина, на рентгеновской порошковой дифрактограмме которого присутствуют дифракционные максимумы, соответствующие следующим характеристическим значениям d: 11,24, 8,81,7,67, 7,25, 5,61, 4,79, 4,10, 3,32, 3,03, 2,96 . 10. Применение соединения по одному из пп.1-9 для приготовления лекарственного средства, пригодного для лечения сахарного диабета типа I и типа II, артрита, ожирения, отторжения аллотрансплантата и вызванного кальцитонином остеопороза. 11. Применение соединения по одному из пп.1-9 для приготовления лекарственного средства, пригодного для лечения сахарного диабета типа II или ожирения. 12. Фармацевтическая композиция, содержащая соль по одному из пп.1-9 и необязательно один или несколько инертных носителей и/или разбавителей. 13. Фармацевтическая композиция, содержащая моногидрохлорид 1-[(3-цианопиридин-2-ил)метил]3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина и необязательно один или несколько инертных носителей и/или разбавителей. 14. Фармацевтическая композиция, содержащая дигидрохлорид 1-[(3-цианопиридин-2-ил)метил]-3 метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина и необязательно один или несколько инертных носителей и/или разбавителей. 15. Способ приготовления фармацевтической композиции по п.12, заключающийся в том, что соль по одному из пп.1-9 объединяют с одним или несколькими инертными носителями и/или разбавителями. 16. Фармацевтическая композиция, приготовленная из моногидрохлорида по пп.4, 6 или 8 и необязательно одного или нескольких инертных носителей и/или разбавителей. Фиг. 1 Рентгеновская порошковая дифрактограмма, полученная для безводной формы 1-[(3-цианопиридин-2 ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина Фиг. 2 Диаграмма, полученная при термоанализе безводной формы 1-[(3-цианопиридин-2-ил)метил]-3-метил-7(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина Фиг. 3 Рентгеновская порошковая дифрактограмма, полученная для моногидрата 1-[(3-цианопиридин-2 ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина Фиг. 5 Рентгеновская порошковая дифрактограмма, полученная для моногидрохлорида 1-[(3-цианопиридин-2 ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина Фиг. 6 Диаграмма, полученная при термоанализе моногидрохлорида 1-[(3-цианопиридин-2-ил)метил]-3-метил 7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина Фиг. 7 Сорбционная характеристика моногидрохлорида 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1 ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина Фиг. 8 Рентгеновская порошковая дифрактограмма, полученная для дигидрохлорида 1-[(3-цианопиридин-2 ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина Фиг. 9 Диаграмма, полученная при термоанализе дигидрохлорида 1-[(3-цианопиридин-2-ил)метил]-3-метил-7(2-бутин-1-ил)-8-[(R)-3-аминопиперидин-1-ил]ксантина Фиг. 10 Сорбционная характеристика дигидрохлорида 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1 ил)-8-(3-(R)-аминопиперидин-1-ил)ксантина
МПК / Метки
МПК: C07D 473/04, A61K 31/522, A61P 3/10
Метки: применение, средств, 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-аминопиперидин-1-ил)ксантина, лекарственных, гидрохлориды, получение, качестве
Код ссылки
<a href="https://eas.patents.su/16-13411-gidrohloridy-1-3-cianopiridin-2-ilmetil-3-metil-7-2-butin-1-il-8-3-aminopiperidin-1-ilksantina-ih-poluchenie-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Гидрохлориды 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-аминопиперидин-1-ил)ксантина, их получение и их применение в качестве лекарственных средств</a>
Предыдущий патент: Использование фенилсемикарбазонов для обработки семян
Следующий патент: Новый ген sms 27
Случайный патент: Устройство для механизированного извлечения нефти с использованием нефтесборных лент