Замещенные индолиноны, их получение и их применение в качестве лекарственных средств
Номер патента: 3514
Опубликовано: 26.06.2003
Авторы: Ван Меель Якобус С.А., Редеманн Норберт, Хеккель Армин, Вальтер Райнер, Грелль Вольфганг
Формула / Реферат
1. Замещенные индолиноны общей формулы
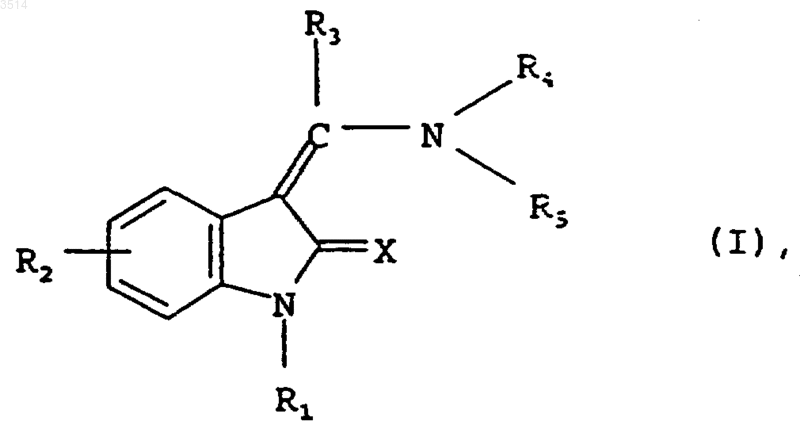
в которой
X обозначает атом кислорода или серы,
R1 обозначает атом водорода, C1-C4алкоксикарбонильную или C2-C4алканоильную группу,
R2 обозначает карбокси- или C1-C4алкоксикарбонильную группу либо необязательно замещенную одной или двумя C1-C3алкильными группами аминокарбонильную группу, при этом заместители могут быть идентичными или разными,
R3 обозначает атом водорода или C1-C6алкильную группу, которая начиная с положения 2 по отношению к атому углерода группы R3-C(R4NR5)= может быть замещена атомом фтора, хлора либо брома, гидрокси-, C1-C3алкокси-, C1-C3алкилсульфенильной, C1-C3алкилсульфинильной, C1-C3алкилсульфонильной, фенилсульфенильной, фенилсульфинильной, фенилсульфонильной, амино-, C1-C3алкиламино-, ди(C1-C3алкил)амино-, C2-C5алканоиламино- или N-(C1-C3алкиламино)-C2-C5алканоиламиногруппой,
R4 обозначает атом водорода, C1-C6алкильную группу или необязательно замещенную C1-C3алкильной группой C5-C7циклоалкильную группу, в которой метиленовая группа в положении 3 либо 4 по отношению к атому углерода группы R3-C(R4NR5)= может быть заменена на необязательно замещенную C1-C3алкильной группой иминогруппу,
или обозначает фенильную или нафтильную группу, которые могут быть замещены
атомом фтора, хлора, брома либо иода,
необязательно замещенной 1-3 атомами фтора метоксигруппой,
C2-C3алкоксигруппой, которая в положении 2 либо 3 может быть замещена C1-C3алкиламино-, ди(C1-C3алкил)амино- или 5-7-членной циклоалкилениминогруппой, при этом дополнительно один алкильный фрагмент в вышеназванных алкиламино- и диалкиламиногруппах может быть соответственно замещен фенильной группой,
трифторметильной, амино-, C1-C3алкиламино-, ди(C1-C3алкил)амино-, C2-C5алканоиламино-, N-(C1-C3алкил)-C2-C5алканоиламино-, C1-C5алкилсульфониламино-, N-(C1-C3алкил)-C1-C5алкилсульфониламино-, фенилсульфониламино-, N-(C1-C3алкил)фенилсульфониламино-, аминосульфонильной, C1-C3алкиламиносульфонильной или ди(C1-C3алкил)аминосульфонильной группой, при этом дополнительно один алкильный фрагмент в вышеназванных алкиламино- и диалкиламиногруппах может быть соответственно замещен фенильной группой,
карбонильной группой, замещенной гидрокси-, C1-C3алкокси-, амино-, C1-C3алкиламино- или N-(C1-C5алкил)-C1-C3алкиламиногруппой, при этом дополнительно один алкильный фрагмент в вышеназванных группах может быть соответственно замещен карбокси-, C1-C3алкоксикарбонильной либо фенильной группой или в положении 2 либо 3 ди(C1-C3алкил)амино-, пиперазиновой, N-(C1-C3алкил)пиперазиновой или 5-7-членной циклоалкилениминогруппой,
C1-C3алкильной группой, замещенной амино-, C1-C7алкиламино-, C5-C7циклоалкиламино-, C5-C7циклоалкил-C1-C3алкиламино- либо фенил-C1-C3алкиламиногруппой, которые дополнительно у атома аминового азота могут быть замещены соответственно C1-C3алкильной группой, в которой атомы водорода частично либо полностью заменены на атомы фтора, C5-C7циклоалкильной, C2-C4алкенильной или C1-C4алкильной группой, при этом указанный выше C1-C4алкильный заместитель дополнительно может быть замещен соответственно циано-, карбокси-, C1-C3алкоксикарбонильной, пиридильной, имидазолильной, бензо[1,3]диоксол- или фенильной группой, при этом фенильная группа может быть одно-, дву- либо тризамещенной атомами фтора, хлора или брома, метильной, метокси-, трифторметильной, циано- либо нитрогруппой и заместители могут быть идентичными или разными, или же в положении 2, 3 либо 4 может быть замещен гидроксигруппой,
C1-C3алкильной группой, которая может быть замещена гидрокси-, карбокси-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1-диоксидотиоморфолиновой, пиперазиновой, N-(C1-C3алкил)пиперазиновой либо N-фенилпиперазиновой группой, 5-7-членной циклоалкенилениминогруппой либо 4-7-членной циклоалкилениминогруппой, при этом вышеназванные 5-7-членные циклоалкилениминогруппы могут быть замещены одной либо двумя C1-C3алкильными группами, C5-C7циклоалкильной либо фенильной группой, C1-C3алкил-, C5-C7циклоалкил-, фенил-, карбокси- либо C1-C4алкоксикарбонильной группой и гидроксигруппой, а одна смежная с атомом азота метиленовая группа в составе вышеназванных циклоалкилениминогрупп может быть заменена на карбонильную группу,
C1-C3алкильной группой, замещенной 5-7-членной циклоалкилениминогруппой, при этом с вышеназванными 5-7-членными циклоалкилениминогруппами через 2 смежных атома углерода сконденсирована необязательно одно- либо двузамещенная атомами фтора, хлора или брома, метальными или метоксигруппами фенильная группа, где заместители могут быть идентичными либо разными, или необязательно замещенная атомом фтора, хлора, брома либо иода, метильной, метокси- либо аминогруппой оксазоловая, имидазоловая, тиазоловая, пиридиновая, пиразиновая или пиримидиновая группа,
при этом указанные выше однозамещенные фенильные группы дополнительно могут быть замещены атомом фтора, хлора либо брома, метильной, метокси- либо нитрогруппой,
или обозначает 5-членную гетероароматическую группу, содержащую иминогруппу, один атом кислорода либо серы или иминогруппу, один атом кислорода либо серы и один либо два атома азота,
или обозначает 6-членную гетероароматическую группу, содержащую один, два либо три атома азота, при этом вышеуказанные 5- и 6-членные гетероароматические группы дополнительно могут быть замещены атомом хлора либо брома или метильной группой или с указанными 5- и 6-членными гетероароматическими группами через два смежных атома углерода может быть сконденсировано фенильное кольцо, и
R5 обозначает атом водорода или C1-C3алкильную группу, при условии, что когда X обозначает атом кислорода и R1 и R5 каждый обозначает атом водорода, R4 не может означать фенильную группу, которая замещена C1-C3алкиламино, ди(C1-C3алкил)амино, C1-C5алкилсульфониламино, фенилсульфониламино, аминосульфонил, C1-C3алкиламиносульфонил, ди(C1-C3алкил)аминосульфонил или N-(C1-C5алкил)-C1-C3алкиламинокарбонильной группой,
при этом имеющиеся карбокси-, амино- или иминогруппы могут быть замещены отщепляемыми в физиологических условиях группами,
их энантиомеры и/или диастереомеры и их соли.
2. Замещенные индолиноны общей формулы I по п.1, в которых
X обозначает атом кислорода,
R1 обозначает атом водорода,
R2 обозначает аминокарбонильную группу,
R3 обозначает атом водорода шыш C1-C4алкильную группу, которая начиная с положения 2 по отношению к атому углерода группы R3-C(R4NR5)= может быть замещена атомом хлора либо брома или фенилсульфонильной группой,
R4 обозначает атом водорода, C1-C3алкильную группу или необязательно замещенную метильной группой циклопентильную либо циклогексильную группу, при этом в циклопентильной и циклогексильной группах метиленовая группа в положении 3 либо 4 по отношению к атому углерода группы R3-C(R4NR5)= может быть заменена на необязательно замещенную метильной группой иминогруппу,
или обозначает фенильную группу, которая может быть замещена
атомом фтора, хлора, брома либо иода,
необязательно замещенной 1-3 атомами фтора метоксигруппой,
C2-C3алкоксигруппой, замещенной в положении 2 либо 3 метиламино-, диметиламино- или 5-7-членной циклоалкилениминогруппой, при этом дополнительно одна метильная группа в составе вышеназванных аминогрупп может быть соответственно замещена фенильной группой,
трифторметильной, амино-, C2-C5алканоиламино-, N-(C1-C3алкил)-C2-C5алканоиламино-, C1-C5алкилсульфониламино-, N-(C1-C3алкил)-C1-C5алкилсульфониламино-, фенилсульфониламино-, N-(C1-C3алкил)фенилсульфониламино- или аминосульфонильной группой, при этом дополнительно один алкильный фрагмент в вышеназванных алкиламино- и диалкиламиногруппах может быть соответственно замещен фенильной группой,
карбонильной группой, замещенной гидрокси-, C1-C3алкокси-, амино-, C1-C3алкиламино- или N-(C1-C5алкил)-C1-C3алкиламиногруппой, при этом дополнительно один алкильный фрагмент в вышеназванных группах может быть соответственно замещен карбокси-, C1-C3алкоксикарбонильной либо фенильной группой или в положении 2 либо 3 - ди(C1-C3алкил)амино-, пиперазиновой, N-(C1-C3алкил)пиперазиновой или 5-7-членной циклоалкилениминогруппой,
C1-C3алкильной группой, замещенной амино-, C1-C7алкиламино-, C5-C7циклоалкиламино-, C5-C7циклоалкил-C1-C3алкиламино- либо фенил-C1-C3алкиламиногруппой, которые дополнительно у атома аминового азота могут быть замещены соответственно C1-C3алкильной группой, в которой атомы водорода частично либо полностью замещены на атомы фтора, C5-C7циклоалкильной, C2-C4алкенильной или C1-C4алкильной группой,
при этом указанный выше C1-C4алкильный заместитель дополнительно может быть замещен соответственно циано-, карбокси-, C1-C3алкоксикарбонильной, пиридильной, имидазолильной, бензо[1,3]диоксол- или фенильной группой, при этом фенильная группа может быть однозамещенной атомом фтора, хлора либо брома, метильной, метокси-, циано-, трифторметильной либо нитрогруппой или дву- либо тризамещенной атомами фтора, хлора либо брома, метильными либо метоксигруппами и заместители могут быть идентичными или разными, или в положении 2, 3 либо 4 может быть замещен гидроксигруппой,
C1-C3алкильной группой, которая может быть замещена гидрокси-, карбокси-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1-диоксидотиоморфолиновой, пиперазиновой, N-(C1-C3алкил)пиперазиновой либо N-фенилпиперазиновой группой, 5-7-членной циклоалкенилениминогруппой либо 4-7-членной циклоалкилениминогруппой, при этом вышеназванные 5-7-членные циклоалкилениминогруппы могут быть замещены одной либо двумя C1-C3алкильными группами, циклогексильной либо фенильной группой, C1-C3алкил-, циклогексил-, фенил-, карбокси- либо C1-C4алкоксикарбонильной группой и гидроксигруппой, а одна смежная с атомом азота метиленовая группа в составе вышеназванных циклоалкилениминогрупп может быть заменена на карбонильную группу,
C1-C3алкильной группой, замещенной 5-7-членной циклоалкилениминогруппой, при этом с вышеназванными 5-7-членными циклоалкилениминогруппами через 2 смежных атома углерода может быть сконденсирована необязательно одно- либо двузамещенная атомами фтора, хлора либо брома, метильными либо метоксигруппами фенильная группа, где заместители могут быть идентичными либо разными, или необязательно замещенная аминогруппой пиразиновая или тиазоловая группа,
при этом дополнительно вышеуказанные однозамещенные фенильные группы могут быть замещены атомом фтора, хлора либо брома, метильной, метокси- либо нитрогруппой,
или обозначает необязательно замещенную атомом хлора либо брома или метильной группой пиридильную группу,
или обозначает необязательно замещенную метильной группой оксазолильную, изоксазолильную, имидазолильную или тиазолильную группу, с которой через 2 смежных атома углерода может быть сконденсировано фенильное кольцо, и
R5 обозначает атом водорода или C1-C3алкильную группу, при условии, что когда X обозначает атом кислорода и R1 и R5 каждый обозначает атом водорода, R4 не может означать фенильную группу, которая замещена C1-C5алкилсульфониламино, фенилсульфониламино, аминосульфонил или N-(C1-C5алкил)-C1-C3алкиламинокарбонильной группой,
их энантиомеры и/или диастереомеры и их соли.
3. Замещенные индолиноны общей формулы I по п.1 или 2, в которых R2 находится в положении 5, их энантиомеры и/или диастереомеры и их соли.
4. Замещенные индолиноны общей формулы I по п.1, в которых
X обозначает атом кислорода,
R1 обозначает атом водорода,
R2 в положении 5 обозначает аминокарбонильную группу,
R3 обозначает атом водорода или C1-C4алкильную группу, которая в концевом положении может быть замещена атомом хлора либо брома или фенилсульфонильной группой,
R4 обозначает атом водорода, C1-C3алкильную группу или необязательно замещенную метильной группой циклопентильную либо циклогексильную группу, при этом в циклогексильной группе метиленовая группа в положении 4 по отношению к атому углерода группы R3-C(R4NR5)= может быть заменена на необязательно замещенную метильной группой иминогруппу, или обозначает фенильную группу, которая может быть замещена атомом фтора, хлора, брома либо иода;
метильной либо этильной группой, которые могут быть замещены соответственно C1-C3алкиламино-, ди(C1-C3алкил)амино-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1-диоксидотиоморфолиновой, N-фенилпиперазиновой, 5-6-членной циклоалкенилениминогруппой либо 5-7-членной циклоалкилениминогруппой, при этом вышеназванные 5-7-членные циклоалкилениминогруппы могут быть замещены одной либо двумя метильными группами, циклогексильной либо фенильной группой, метильной, циклогексильной либо фенильной группой и гидроксигруппой, или
метильной либо этильной группой, которые могут быть соответственно замещены фенильной группой, замещенной 5-7-членной циклоалкилениминогруппой, при этом дополнительно с указанными выше циклоалкилениминогруппами через 2 смежных атома углерода сконденсировано фенильное кольцо,
метильной либо этильной группой, замещенных амино-, метиламино- либо этиламиногруппой, которые дополнительно у атома аминового азота замещены соответственно бензильной либо фенилэтильной группой, при этом фенильный фрагмент в составе вышеназванных групп может быть соответственно однозамещенным атомом фтора, хлора либо брома, метильной, метокси-, циано-, трифторметильной лшсю нитрогруппой или может быть дву- или тризамещенным атомами фтора, хлора либо брома, метильными либо метоксигруппами и заместители могут быть идентичными или разными, при этом дополнительно указанные выше однозамещенные фенильные группы могут быть замещены атомом фтора, хлора либо брома, метильной, метокси- либо нитрогруппой, и
R5 обозначает атом водорода или C1-C4алкильную группу,
их энантиомеры и/или диастереомеры и их соли.
5. Замещенные индолиноны общей формулы I по п.1, в которых
X обозначает атом кислорода,
R1 обозначает атом водорода,
R2 в положении 5 обозначает аминокарбонильную группу,
R3 обозначает атом водорода или C1-C4алкильную группу,
R4 обозначает фенильную группу, которая может быть замещена
атомом фтора, хлора, брома либо иода,
метильной либо этильной группой, которые могут быть замещены соответственно C1-C3алкиламино-, ди(C1-C3алкил)амино-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1-диоксидотиоморфолиновой, N-фенилпиперазиновой, 5-6-членной циклоалкенилениминогруппой либо 5-7-членной циклоалкилениминогруппой, при этом вышеназванные 5-7-членные циклоалкилениминогруппы могут быть замещены одной либо двумя метильными группами, циклогексильной либо фенильной группой, метильной, циклогексильной либо фенильной группой и гидроксигруппой, или
метильной либо этильной группой, которые могут быть соответственно замещены фенильной группой, замещенной в положении 4, 5-7-членной циклоалкилениминогруппой, при этом дополнительно с указанными выше циклоалкилениминогруппами через 2 смежных атома углерода сконденсировано фенильное кольцо,
метильной либо этильной группой, замещенных амино-, метиламино- либо этиламиногруппой, которые дополнительно у атома аминового азота замещены бензильной группой и в которых фенильный фрагмент может быть однозамещенным атомом фтора, хлора либо брома, метильной, метокси-, циано-, трифторметильной либо нитрогруппой, двузамещенным метильными либо метоксигруппами или тризамещенным метильными либо метоксигруппами и заместители могут быть идентичными или разными, при этом дополнительно вышеуказанные однозамещенные фенильные группы могут быть замещены атомом фтора, хлора либо брома, метильной, метокси- либо нитрогруппой, и
R5 обозначает атом водорода или C1-C4алкильную группу,
их энантиомеры и/или диастереомеры и их соли.
6. Замещенные индолиноны общей формулы I по п.1 из группы, включающей
(а) 3-Z-[1-(4-пиперидинометилфениламино)-1-метилметилен]-5-амидо-2-индолинон,
(б) 3-Z-[1-(4-бромфениламино)-1-метилметилен]-5-амидо-2-индолинон,
(в) 3-Z-[1-(4-пиперидинометилфениламино)-1-бутилметилен]-5-амидо-2-индолинон,
(г) 3-Z-[1-(4-хлорфениламино)-1-метилметилен]-5-амидо-2-индолинон,
(д) 3-Z-(1-фениламинометилен)-5-амидо-2-индолинон,
(е) 3-Z-[1-(4-(N-бензил-N-метиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинон,
(ж) 3-Z-[1-(4-(N-(4-хлорбензил)аминометил)фениламино)-1-метилметилен]-5-амидо-2-индолинон,
(з) 3-Z-[1-(4-(N-бензил-N-этиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинон,
(и) 3-Z-[1-(4-(N-бензиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинон,
(к) 3-Z-[1-(4-(N-бензил-N-метиламинометил)фениламино)метилен]-5-амидо-2-индолинон,
(л) 3-Z-[1-(4-(2,3,4,5-тетрагидробензо(d)азепин-3-илметил)фениламино)-1-метилметилен]-5-амидо-2-индолинон,
(м) 3-Z-[1-(4-пиперидинометил-3-нитрофениламино)-1-метилметилен]-5-амидо-2-индолинон и
(н) 3-Z-[1-(4-метил-3-нитрофениламино)-1-метилметилен]-5-амидо-2-индолинон,
а также их энантиомеры и/или диастереомеры и их соли.
7. 3-Z-[1-(4-(N-бензил-N-метиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинон и его соли.
8. 3-Z-[1-(4-(2,3,4,5-тетрагидробензо(d)азепин-3-илметил)фениламино)-1-метилметилен]-5-амидо-2-индолинон и его соли.
9. Физиологически приемлемые соли соединений по любому из пп.1-8.
10. Лекарственные средства, содержащие в своем составе соединение по любому из пп.1-8 или соль по п.9 при необходимости наряду с одним либо несколькими инертными носителями и/или разбавителями.
11. Применение соединения по любому из пп.1-8 или соли по п.9 для изготовления соответствующего лекарственного средства, предназначенного для лечения избыточной или аномальной пролиферации клеток.
12. Способ получения лекарственного средства по п.10, отличающийся тем, что соединение по любому из пп.1-8 или соль по п.9 нехимическим путем вводят в один либо несколько инертных носителей и/или растворителей.
Текст
1 Настоящее изобретение относится к новым замещенным индолинонам общей формулы к их изомерам, их солям, прежде всего к их физиологически приемлемым солям, каковые соединения обладают ценными свойствами. Указанные соединения общей формулы I, в которой R1 обозначает атом водорода или пролекарственный остаток, обладают ценными фармакологическими свойствами, в частности ингибирующим действием по отношению к различным киназам, в первую очередь по отношению к комплексам СDК (CDK1, CDK2, CDK3,CDK4, CDK6, CDK7, CDK8 и CDK9) с их специфическими циклинами (А, В 1, В 2, С, D1, D2,D3, Е, F, G1, G2, Н, I и К) и по отношению к вирусному циклину (см. L. Mengtao в Journ. Virology 71(3), стр. 1984-1991 (1997, а остальные соединения приведенной выше общей формулыI, в которой R1 имеет значения, отличные от атома водорода и пролекарственного остатка,представляют собой ценные промежуточные продукты для получения соединений, названных первыми. Объектом настоящего изобретения являются в соответствии с этим вышеуказанные соединения общей формулы I, при этом соединения, в которых R1 обозначает атом водорода или пролекарственный остаток, обладают ценными фармакологическими свойствами, содержащие эти фармакологически эффективные соединения лекарственные средства, их применение и способ их получения. В вышеприведенной общей формуле IX обозначает атом кислорода или серы,R1 обозначает атом водорода, С 1 С 4 алкоксикарбонильную или С 2-С 4 алканоильную группу,R2 обозначает карбокси- или С 1 С 4 алкоксикарбонильную группу либо необязательно замещенную одной или двумя С 1 С 3 алкильными группами аминокарбонильную группу, при этом заместители могут быть идентичными или разными,R3 обозначает атом водорода или С 1 С 6 алкильную группу, которая начиная с положения 2 по отношению к атому углерода группы R3-C(R4NR5)= может быть замещена атомом фтора, хлора либо брома, гидрокси-, С 1-С 3 алкокси-, С 1-С 3 алкилсульфенильной, С 1-С 3 алкилсульфинильной, С 1-С 3 алкилсульфонильной,фенилсульфенильной,фенилсульфинильной,фенилсульфонильной, амино-, С 1-С 3 алкиламино-, ди(С 1-С 3 алкил)амино-, С 2-С 5 алканоиламино- или N-(С 1-С 3 алкиламино)-С 2-С 5 алканоиламиногруппой, 003514R4 обозначает атом водорода, С 1 С 6 алкильную группу или необязательно замещенную С 1-С 3 алкильной группой С 5 С 7 циклоалкильную группу, в которой метиленовая группа в положении 3 либо 4 по отношению к атому углерода группы R3-C(R4NR5)= может быть заменена на необязательно замещенную С 1-С 3 алкильной группой иминогруппу,или обозначает фенильную или нафтильную группу, которые могут быть замещены атомом фтора, хлора, брома либо иода,необязательно замещенной 1-3 атомами фтора метоксигруппой, С 2-С 3 алкоксигруппой,которая в положении 2 либо 3 может быть замещена С 1-С 3 алкиламино-,ди(С 1-С 3 алкил) амино- или 5-7-членной циклоалкилениминогруппой, при этом дополнительно один алкильный фрагмент в вышеназванных алкиламино- и диалкиламиногруппах может быть соответственно замещен фенильной группой,трифторметильной, амино-, С 1-С 3 алкиламино-,ди(С 1-С 3 алкил)амино-,С 2-С 5 алканоиламино-, N-(С 1-С 3 алкил)-С 2-С 5 алканоиламино-, С 1-С 5 алкилсульфониламино-, N-(С 1-С 3 алкил)-С 1-С 5 алкилсульфониламино-, фенилсульфониламино-, N-(С 1-С 3 алкил)фенилсульфониламино-, аминосульфонильной, С 1-С 3 алкиламиносульфонильной или ди(С 1-С 3 алкил)аминосульфонильной группой, при этом дополнительно один алкильный фрагмент в вышеназванных алкиламино- и диалкиламиногруппах может быть соответственно замещен фенильной группой,карбонильной группой, замещенной гидрокси-, С 1-С 3 алкокси-, амино-, С 1-С 3 алкиламино- или N-(С 1-С 5 алкил)-С 1-С 3 алкиламиногруппой, при этом дополнительно один алкильный фрагмент в вышеназванных группах может быть соответственно замещен карбокси-,С 1-С 3 алкоксикарбонильной либо фенильной группой или в положении 2 либо 3 -ди(С 1 С 3 алкил)амино-, пиперазиновой, N-(С 1-С 3 алкил)пиперазиновой или 5-7-членной циклоалкилениминогруппой,С 1-С 3 алкильной группой, замещенной амино-, С 1-С 7 алкиламино-, С 5-С 7 циклоалкиламино-,С 5-С 7 циклоалкил-С 1-С 3 алкиламинолибо фенил-С 1-С 3 алкилоаминогруппой, которые дополнительно у атома аминового азота могут быть замещены соответственно C1-С 3 алкильной группой, в которой атомы водорода частично либо полностью заменены на атомы фтора, С 5 С 7 циклоалкильной, С 2-С 4 алкенильной или С 1 С 4 алкильной группой, при этом указанный выше C1-С 4 алкильный заместитель дополнительно может быть замещен соответственно циано-,карбокси-, C1-С 3 алкоксикарбонильной, пиридильной, имидазолильной, бензо[1,3]диоксолили фенильной группой, при этом фенильная группа может быть одно-, дву- либо тризамещенной атомами фтора, хлора или брома, метальной, метокси-, трифторметильной, циано 3 либо нитрогруппой и заместители могут быть идентичными или разными, или же в положении 2, 3 либо 4 может быть замещен гидроксигруппой,C1-С 3 алкильной группой, которая может быть замещена гидрокси-, карбокси-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1 диоксидотиоморфолиновой, пиперазиновой, N(С 1-С 3 алкил)пиперазиновой либо N-фенилпиперазиновой группой, 5-7-членной циклоалкенилениминогруппой либо 4-7-членной циклоалкилениминогруппой, при этом вышеназванные 5-7-членные циклоалкилениминогруппы могут быть замещены одной либо двумя C1 С 3 алкильными группами, С 5-С 7 циклоалкильной либо фенильной группой, C1-С 3 алкил-, С 5 С 7 циклоалкил-, фенил-, карбокси- либо С 1 С 4 алкоксикарбонильной группой и гидроксигруппой, а одна смежная с атомом азота метиленовая группа в составе вышеназванных циклоалкилениминогрупп может быть заменена на карбонильную группу,C1-С 3 алкильной группой, замещенной 5-7 членной циклоалкилениминогруппой, при этом с вышеназванными 5-7-членными циклоалкилениминогруппами через 2 смежных атома углерода сконденсирована необязательно одно- либо двузамещенная атомами фтора, хлора или брома, метильными или метоксигруппами фенильная группа, где заместители могут быть идентичными либо разными, или необязательно замещенная атомом фтора, хлора, брома либо иода, метальной, метокси- либо аминогруппой оксазоловая, имидазоловая, тиазоловая, пиридиновая, пиразиновая или пиримидиновая группа,при этом указанные выше однозамещенные фенильные группы дополнительно могут быть замещены атомом фтора, хлора либо брома, метильной, метокси- либо нитрогруппой,или обозначает 5-членную гетероароматическую группу, содержащую иминогруппу,один атом кислорода либо серы или иминогруппу, один атом кислорода либо серы и один либо два атома азота, или обозначает 6-членную гетероароматическую группу, содержащую один,два либо три атома азота, при этом вышеуказанные 5- и 6-членные гетероароматические группы дополнительно могут быть замещены атомом хлора либо брома или метильной группой или с указанными 5- и 6-членными гетероароматическими группами через два смежных атома углерода может быть сконденсировано фенильное кольцо, и R5 обозначает атом водорода или C1-С 3 алкильную группу. Кроме того, имеющиеся в каком-либо из соединений приведенной выше общей формулыI карбокси-, амино- или иминогруппы могут быть замещены отщепляемыми in vivo группами. При этом наряду с уже упомянутыми выше алкоксикарбонильными и алканоильными группами под отщепляемыми in vivo группами под 003514 4 разумеваются, в частности, ацильная группа,такая как бензоильная, пиридиноильная, пентаноильная или гексаноильная группа, аллилоксикарбонильная группа, C1-С 16 алкоксикарбонильная группа, такая как пентоксикарбонильная,гексилоксикарбонильная, октилоксикарбонильная, нонилоксикарбонильная, гексилоксикарбонильная, октилоксикарбонильная, нонилоксикарбонильная, децилоксикарбонильная, ундецилоксикарбонильная, додецилоксикарбонильная или гексадецилоксикарбонильная группа, фенил-C1-С 6 алкоксикарбонильная группа, такая как бензилоксикарбонильная, фенилэтоксикарбонильная или фенилпропоксикарбонильная группа, C1-С 3 алкилсульфонил-С 2-С 4 алкоксикарбонильная, C1-С 3aлкoкcи-C2-C4aлкoкcи-C2-C4aлкoкcикapбoнильнaя или RcCO-O-(RdCRe)-O-COгpyппa, в которой Rc представляет собой C1 С 8 алкильную, С 5-С 7 циклоалкильную, фенильную или фенил-C1-С 3 алкильную группу,Re представляет собой атом водорода, C1 С 3 алкильную, С 5-С 7 циклоалкильную или фенильную группу иRd представляет собой атом водорода илиC1-С 3 алкильную группу либо RсCO-O-(RdCRe)О-группу,при этом вышеназванные сложноэфирные группы также могут использоваться в качестве группы, переводимой in vivo в карбоксигруппу. Предпочтительными соединениями общей формулы I являются такие соединения, в которыхX обозначает атом кислорода,R1 обозначает атом водорода,R2 обозначает аминокарбонильную группу,R3 обозначает атом водорода или С 1 С 4 алкильную группу, которая начиная с положения 2 по отношению к атому углерода группы R3-C(R4NR5) = может быть замещена атомом хлора либо брома или фенилсульфонильной группой,R4 обозначает атом водорода, C1-С 3 алкильную группу или необязательно замещенную метильной группой циклопентильную либо циклогексильную группу, при этом в циклопентильной и циклогексильной группах метиленовая группа в положении 3 либо 4 по отношению к атому углерода группыR3-C(R4NR5) = может быть заменена на необязательно замещенную метильной группой иминогруппу, или обозначает фенильную группу, которая может быть замещена атомом фтора, хлора, брома либо иода,необязательно замещенной 1-3 атомами фтора метоксигруппой,С 2-С 3 алкоксигруппой, замещенной в положении 2 либо 3 метиламино-, диметиламиноили 5-7-членной циклоалкилениминогруппой,при этом дополнительно одна метильная группа в составе вышеназванных аминогрупп может быть соответственно замещена фенильной группой, 5 трифторметильной, амино-, С 2-С 5 алканоиламино-, N-(С 1-С 3 алкил)-С 2-С 5 алканоиламино-,C1-С 5 алкилсульфониламино-, N-(С 1-С 3 алкил)C1-С 5 алкилсульфониламино-, фенилсульфониламино-, N-(С 1-С 3 алкил)фенилсульфониламиноили аминосульфонильной группой, при этом дополнительно один алкильный фрагмент в вышеназванных алкил амино- и диалкиламиногруппах может быть соответственно замещен фенильной группой,карбонильной группой, замещенной гидрокси-, C1-С 3 алкокси-, амино-, C1-С 3 алкиламино- или N-(С 1-С 5 алкил)-С 1-С 3 алкиламиногруппой, при этом дополнительно один алкильный фрагмент в вышеназванных группах может быть соответственно замещен карбокси-, C1 С 3 алкоксикарбонильной либо фенильной группой или в положении 2 либо 3 -ди(C1 С 3 алкил)амино-, пиперазиновой, N-(C1-С 3 алкил) пиперазиновой или 5-7-членной циклоалкилениминогруппой,C1-С 3 алкильной группой, замещенной амино-,С 1-С 7 алкиламино-,С 5-С 7 циклоалкиламино-, С 5-С 7 циклоалкил-С 1-С 3 алкиламинолибо фенил-C1-С 3 алкиламиногруппой, которые дополнительно у атома аминового азота могут быть замещены соответственно C1-С 3 алкильной группой, в которой атомы водорода частично либо полностью замещены на атомы фтора, С 5 С 7 циклоалкильной, С 2-С 4 алкенильной или С 1 С 4 алкильной группой,при этом указанный выше С 1-С 4 алкильный заместитель дополнительно может быть замещен соответственно циано-, карбокси-, C1 С 3 алкоксикарбонильной, пиридильной, имидазолильной, бензо[1,3]диоксол- или фенильной группой, при этом фенильная группа может быть однозамещенной атомом фтора, хлора либо брома, метильной, метокси-, циано-, трифторметильной либо нитрогруппой или дву- либо тризамещенной атомами фтора, хлора либо брома, метильными либо метоксигруппами и заместители могут быть идентичными или разными, или в положении 2, 3 либо 4 может быть замещен гидроксигруппой,C1-С 3 алкильной группой, которая может быть замещена гидрокси-, карбокси-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1 диоксидотиоморфолиновой, пиперазиновой, N(C1-С 3 алкил)пиперазиновой либо N-фенилпиперазиновой группой, 5-7-членной циклоалкенилениминогруппой либо 4-7-членной циклоалкилениминогруппой, при этом вышеназванные 5-7-членные циклоалкилениминогруппы могут быть замещены одной либо двумя C1 С 3 алкильными группами, циклогексильной либо фенильной группой, C1-С 3 алкил-, циклогексил-,фенил-, карбокси либо C1-С 4 алкоксикарбонильной группой и гидроксигруппой, а одна смежная с атомом азота метиленовая группа в составе вышеназванных циклоалкилениминогрупп может быть заменена на карбонильную 6 группу, -C1-С 3 алкильной группой, замещенной 5-7-членной циклоалкилениминогруппой, при этом с вышеназванными 5-7-членными циклоалкилениминогруппами через 2 смежных атома углерода может быть сконденсирована необязательно одно- либо двузамещенная атомами фтора, хлора либо брома, метильными либо метоксигруппами фенильная группа, где заместители могут быть идентичными либо разными, или необязательно замещенная аминогруппой пиразиновая или тиазоловая группа, при этом дополнительно вышеуказанные однозамещенные фенильные группы могут быть замещены атомом фтора, хлора либо брома, метальной, метокси- либо нитрогруппой,или обозначает необязательно замещенную атомом хлора либо брома или метальной группой пиридильную группу, или обозначает необязательно замещенную метильной группой оксазолильную, изоксазолильную, имидазолильную или тиазолильную группу, с которой через 2 смежных атома углерода может быть сконденсировано фенильное кольцо, иR5 обозначает атом водорода или C1 С 3 алкильную группу, предпочтительны прежде всего такие соединения общей формулы I, в которых R1-R3 и R5 имеют указанные выше значения, аR4 обозначает атом водорода, C1 С 6 алкильную группу или необязательно замещеннуюC5 С 7 циклоалкильную группу, в которой метиленовая группа в положении 3 либо 4 по отношению к атому углерода группы R3-C(R4NR5)= может быть заменена на необязательно замещенную C1-С 3 алкильной группой иминогруппу,или обозначает фенильную или нафтильную группу, которые могут быть замещены атомом фтора, хлора, брома либо иода, C1-С 3 алкокси,амино-, C1-С 3 алкиламино-, ди(С 1-С 3 алкил)амино-, С 2-С 5 алканоиламино-, N-(C1-С 3 алкиламино)-С 2-С 5 алканоиламино-, С 1-С 5 алкилсульфониламино-, N-(С 1-С 3 алкил)-С 1-С 5 алкилсульфониламино-, фенилсульфониламино - либо N-(C1 С 3aлкил)фeнилcyльфoнилaминoгpyппoй или C1 С 3 алкильной группой, которая может быть замещена С 1-С 5 алкиламино-, ди(C1-С 5 алкил)амино-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1-диоксидотиоморфолиновой, пиперазиновой, N-(С 1-С 3 алкил)пиперазиновой, Nфенилпиперазиновой,С 5-С 7 циклоалкенилениминогруппой либо С 4-С 7 циклоалкилениминогруппой, при этом вышеназванные С 5 С 7 циклоалкилениминогруппы могут быть замещены одной либо двумя C1-С 3 алкильными группами, С 5-С 7 циклоалкильной либо фенильной группой, C1-С 3 алкил-, С 5-С 7 циклоалкил-,фенил-,карбоксилибоC1-С 4 алкоксикарбонильной группой и гидроксигруппой,а также их изомеры и их соли. 7 К особенно предпочтительным относятся такие соединения общей формулы I, в которыхR1-R5 имеют указанные выше значения иX обозначает атом кислорода,R1 обозначает атом водорода,R2 в положении 5 обозначает аминокарбонильную группу,R3 обозначает атом водорода или С 1 С 4 алкильную группу, которая в концевом положении может быть замещена атомом хлора либо брома или фенилсульфонильной группой,R4 обозначает атом водорода, C1 С 3 алкильную группу или необязательно замещенную метильной группой циклопентильную либо циклогексильную группу, при этом в циклогексильной группе метиленовая группа в положении 4 по отношению к атому углерода группы R3-C(R4NR5)= может быть заменена на необязательно замещенную метильной группой иминогруппу, или обозначает фенильную группу, которая может быть замещена атомом фтора, хлора, брома либо иода,метильной либо этильной группой, которые могут быть замещены соответственно C1 С 3 алкиламино-, ди(С 1-С 3 алкил)амино-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1 диоксидотиоморфолиновой, N-фенилпиперазиновой, 5-6-членной циклоалкенилениминогруппой либо 5-7-членной циклоалкилениминогруппой, при этом вышеназванные 5-7-членные циклоалкилениминогруппы могут быть замещены одной либо двумя метальными группами, циклогексильной либо фенильной группой, метильной, циклогексильной либо фенильной группой и гидроксигруппой, или метильной либо этильной группой, которые могут быть соответственно замещены фенильной группой, замещенной 5-7-членной циклоалкилениминогруппой, при этом дополнительно с указанными выше циклоалкилениминогруппами через 2 смежных атома углерода сконденсировано фенильное кольцо,метильной либо этильной группой, замещенных амино-, метиламино- либо этиламиногруппой, которые дополнительно у атома аминового азота замещены соответственно бензильной либо фенилэтильной группой, при этом фенильный фрагмент в составе вышеназванных групп может быть соответственно однозамещенным атомом фтора, хлора либо брома, метильной, метокси-, циано-, трифторметильной либо нитрогруппой или может быть дву- или тризамещенным атомами фтора, хлора либо брома, метильными либо метоксигруппами и заместители могут быть идентичными или разными, при этом дополнительно указанные выше однозамещенные фенильные группы могут быть замещены атомом фтора, хлора либо брома, метильной, метокси- либо нитрогруппой, иR5 обозначает атом водорода или С 1 С 4 алкильную группу, а также их изомеры и их соли. Наиболее предпочтительными являются такие соединения общей формулы I, в которыхX обозначает атом кислорода,R1 обозначает атом водорода,R2 в положении 5 обозначает аминокарбонильную группу,R3 обозначает атом водорода или С 1 С 4 алкильную группу,R4 обозначает фенильную группу, которая может быть замещена атомом фтора, хлора, брома либо иода,метильной либо этильной группой, которые могут быть замещены соответственно C1 С 3 алкиламино-, ди(С 1-С 3 алкил)амино-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1 диоксидотиоморфолиновой, N-фенилпиперазиновой, 5-6-членной циклоалкенилениминогруппой либо 5-7-членной циклоалкилениминогруппой, при этом вышеназванные 5-7-членные циклоалкилениминогруппы могут быть замещены одной либо двумя метильными группами, циклогексильной либо фенильной группой, метильной, циклогексильной либо фенильной группой и гидроксигруппой, или метильной либо этильной группой, которые могут быть соответственно замещены фенильной группой, замещенной в положении 4,57-членной циклоалкилениминогруппой, при этом дополнительно с указанными выше циклоалкилениминогруппами через 2 смежных атома углерода сконденсировано фенильное кольцо,метильной либо этильной группой, замещенных амино-, метиламино- либо этиламиногруппой, которые дополнительно у атома аминового азота замещены бензильной группой и в которых фенильный фрагмент может быть однозамещенным атомом фтора, хлора либо брома, метильной, метокси-, циано-, трифторметильной либо нитрогруппой, двузамещенным метильными либо метоксигруппами или тризамещенным метильными либо метоксигруппами и заместители могут быть идентичными или разными, при этом дополнительно вышеуказанные однозамещенные фенильные группы могут быть замещены атомом фтора, хлора либо брома, метильной, метокси- либо нитрогруппой, иR5 обозначает атом водорода или С 1 С 4 алкильную группу, а также их изомеры и их соли. В качестве примеров особенно предпочтительных соединений можно назвать соединения из группы, включающей:(н) 3-Z-[1-(4-метил-3-нитрофениламино)-1 метилметилен]5-амидо-2-индолинон,а также их изомеры и их соли. Согласно изобретению новые соединения можно получать, например, по следующим способам, в принципе известным из литературы. а) В этом варианте предусмотрено взаимодействие соединения общей формулы в которой X и R3 имеют указанные выше значения, R2' имеет значения, указанные выше для R2,R6 обозначает атом водорода или защитную группу для атома азота лактамовой группы, при этом один из остатков R2' или R6 может представлять собой также необязательно образованную через спейсер связь с твердой фазой, а другой из остатков R2' или R6 имеет значения, указанные выше, и Z1 обозначает атом галогена,гидрокси-, алкокси- либо аралкоксигруппу, например атом хлора либо брома, метокси-, этокси- либо бензилоксигруппу, с амином общей формулы в которой R4 и R5 имеют указанные выше значения, и при необходимости последующим отщеплением используемой защитной группы для атома азота лактамовой группы или отщеплением от твердой фазы. В качестве защитной группы для атома азота лактамовой группы приемлемы, например,ацетильная, бензоильная, этоксикарбонильная, 003514 10 трет-бутоксикарбонильная или бензилоксикарбонильная группа, а в качестве твердой фазы смола, такая как 4-(2',4'-диметоксифениламинометил)феноксисмола, при этом связь целесообразно осуществлять через аминогруппу,или смола, содержащая фрагменты пбензилокси и бензилового спирта, при этом связь целесообразно осуществлять через такой спейсер, как производное 2,5-диметокси-4 гидроксибензила. Реакцию осуществляют предпочтительно в растворителе, таком как диметилформамид, толуол, ацетонитрил, тетрагидрофуран, диметилсульфоксид, метиленхлорид, либо в их смесях,необязательно в присутствии инертного основания, такого как триэтиламин, N-этилдиизопропиламин или гидрокарбонат натрия, при температурах в интервале от 20 до 175 С, при этом используемую защитную группу можно одновременно отщеплять в результате переамидирования. Если Z1 в соединении общей формулы II обозначает атом галогена, то реакцию предпочтительно проводят в присутствии инертного основания при температурах в интервале от 20 до 120 С. Если же Z1 в соединении общей формулыII обозначает гидрокси-, алкокси- или аралкоксигруппу, то реакцию предпочтительно проводят при температурах в интервале от 20 до 200 С. Последующее отщепление необязательно используемой защитной группы целесообразно осуществлять либо гидролитическим путем в водном или спиртовом растворителе, например в смеси метанол/вода, этанол/вода, изопропанол/вода, тетрагидрофуран/вода, диоксан/вода,диметилформамид/вода, в метаноле или этаноле, в присутствии основания щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия, при температурах в интервале от 0 до 100 С, предпочтительно при температурах в интервале от 10 до 50 С, либо предпочтительно путем переамидирования с помощью органического основания, такого как аммиак, метиламин, бутиламин, диметиламин или пиперидин, в растворителе, таком как метанол, этанол, диметилформамид и в их смесях,или же с использованием избытка применяемого амина при температурах в интервале от 0 до 100 С, предпочтительно при температурах в интервале от 10 до 50 С. Отщепление от используемой твердой фазы предпочтительно осуществлять с помощью трифторуксусной кислоты и воды при температурах в интервале от 0 до 35 С, предпочтительно при комнатной температуре. б) В этом варианте для получения соединения общей формулы I, в которой R2 представляет собой указанную выше аминокарбонильную группу, соединение общей формулы в которой R1 и R3-R5 имеют значения, указанные выше, либо его реакционноспособные производные подвергают амидированию амином общей формулыH-(R7NR8) (V) в которой R7 и R8 могут быть идентичными или разными и обозначают атомы водорода или C1 С 3 алкильные группы. Амидирование осуществляют предпочтительно в растворителе, таком как метиленхлорид, диэтиловый эфир, тетрагидрофуран, толуол, диоксан, ацетонитрил, диметилсульфоксид или диметилформамид, необязательно в присутствии неорганического либо третичного органического основания, предпочтительно при температурах в интервале от 20 С до температуры кипения используемого растворителя. При этом амидирование целесообразно проводить с помощью соответствующей кислоты, предпочтительно в присутствии отбирающего воду (обезвоживающего) агента, например в присутствии изобутилового эфира хлормуравьиной кислоты,тетраэтилового эфира ортоугольной кислоты,триметилового эфира ортоуксусной кислоты,2,2-диметоксипропана,тетраметоксисилана,тионилхлорида, триметилхлорсилана, трихлорида фосфора, пентоксида фосфора, N,N'дициклогексилкарбодиимида,смесиN,N'дициклогексилкарбодиимида и N-гидроксисукцинимида, N,N'-дициклогексилкарбодиимида и 1-гидроксибензтриазола, тетрафторбората 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония, смеси тетрафторбората 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония и 1 гидроксибензтриазола, N,N'-карбонилдиимидазола или смеси трифенилфосфина и тетрахлорметана, и необязательно с добавками основания,такого как пиридин, 4-диметиламинопиридин,N-метилморфолин или триэтиламин, предпочтительно при температурах в интервале от 0 до 150 С, предпочтительно при температурах в интервале от 0 до 100 С, а ацилирование с помощью соответствующего реакционноспособного соединения, в частности его ангидрида,сложного эфира, имидазолидов или галогенидов, целесообразно проводить при необходимости в присутствии третичного органического основания, такого как триэтиламин, Nэтилдиизопропиламин либо N-метилморфолин,при температурах в интервале от 0 до 150 С,предпочтительно при температурах в интервале от 50 до 100 С. В случае получения согласно изобретению соединения общей формулы I, содержащего алкоксикарбонильную группу, его можно по 003514 12 средством гидролиза переводить в соответствующее карбоксисоединение, или в случае получения соединения общей формулы I, содержащего амино- или алкиламиногруппу, его можно путем алкилирования либо восстановительного алкилирования переводить в соответствующее алкиламино- либо диалкиламиносоединение, или в случае получения соединения общей формулы I, содержащего амино- или алкиламиногруппу, его можно путем ацилирования переводить в соответствующее ацильное соединение, или в случае получения соединения общей формулы I, содержащего карбоксигруппу, его можно путем этерификации или амидирования переводить в соответствующее сложноэфирно- или аминокарбонильное соединение,или в случае получения соединения общей формулы I, содержащего нитрогруппу, его можно путем восстановления переводить в соответствующее аминосоединение. Последующий гидролиз осуществляют предпочтительно в водном растворителе, например в воде, смеси изопропанол/вода, тетрагидрофуран/вода или диоксан/вода, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, либо в присутствии основания щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия, при температурах в интервале от 0 до 100 С, предпочтительно при температурах в интервале от 10 до 50 С. Последующее восстановительное алкилирование осуществляют предпочтительно в соответствующем растворителе, таком как метанол,смесь метанол/вода, метанол/вода/аммиак, этанол, простой эфир, тетрагидрофуран, диоксан или диметилформамид, необязательно с добавками кислоты, такой как соляная кислота, в присутствии каталитически инициированного водорода, например водорода в присутствии никеля Ренея, платины или палладия на угле,либо в присутствии гидрида металла, такого как борогидрид натрия, борогидрид лития или алюмогидрид лития, при температурах в интервале от 0 до 100 С, предпочтительно при температурах в интервале от 20 до 80 С. Последующее алкилирование осуществляют с помощью соответствующего алкилирующего агента, такого как алкилгалогенид или диалкилсульфат, как например метилиодид, диметилсульфат или пропилбромид, предпочтительно в растворителе, таком как метанол, этанол, метиленхлорид, тетрагидрофуран, толуол,диоксан, диметилсульфоксид или диметилформамид, необязательно в присутствии неорганического либо третичного органического основания, такого как триэтиламин, N-этилдиизопропиламин или диметиламинопиридин, предпочтительно при температурах в интервале от 20 С до температуры кипения используемого растворителя. 13 Последующее ацилирование осуществляют предпочтительно в растворителе, таком как метиленхлорид, диэтиловый эфир, тетрагидрофуран, толуол, диоксан, ацетонитрил, диметилсульфоксид или диметилформамид, необязательно в присутствии неорганического либо третичного органического основания, предпочтительно при температурах в интервале от 20 С до температуры кипения используемого растворителя. При этом ацилирование целесообразно проводить с помощью соответствующей кислоты, предпочтительно в присутствии отбирающего воду (обезвоживающего) агента, например в присутствии изобутилового эфира хлормуравьиной кислоты, тетраэтилового эфира ортоугольной кислоты, триметилового эфира ортоуксусной кислоты, 2,2-диметоксипропана, тетраметоксисилана, тионилхлорида, триметилхлорсилана, трихлорида фосфора, пентоксида фосфора,N,N'-дициклогексилкарбодиимида, смеси N,N'дициклогексилкарбодиимида и N-гидроксисукцинимида, N,N'-дициклогексилкарбодиимида и 1-гидроксибензтриазола, тетрафторбората 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония,смеси тетрафторбората 2-(1 Нбензотриазол-1-ил)-1,1,3,3-тетраметилурония и 1-гидроксибензтриазола, N,N'-карбонилдиимидазола или смеси трифенилфосфина и тетрахлорметана, и необязательно с добавками основания, такого как пиридин, 4-диметиламинопиридин, N-метилморфолин или триэтиламин, при температурах в интервале от 0 до 150 С, предпочтительно при температурах в интервале от 0 до 100 С, а ацилирование с помощью соответствующего реакционноспособного соединения, в частности его ангидрида,сложного эфира, имидазолидов или галогенидов, целесообразно проводить при необходимости в присутствии третичного органического основания, такого как триэтиламин, Nэтилдиизопропиламин либо N-метилморфолин,при температурах в интервале от 0 до 150 С,предпочтительно при температурах в интервале от 50 до 100 С. Последующую этерификацию или последующее амидирование целесообразно осуществлять взаимодействием соответствующего реакционноспособного производного карбоновой кислоты с соответствующим спиртом или амином, описанным выше. Последующее восстановление нитрогруппы осуществляют предпочтительно путем гидрогенолиза, например, с помощью водорода, в присутствии катализатора, такого как палладий на угле или никель Ренея, в растворителе, таком как метанол, этанол, этиловый эфир уксусной кислоты, диметилформамид, смесь диметилформамида и ацетона или ледяной уксусной кислоты, необязательно с добавками кислоты,такой как соляная кислота или ледяная уксусная кислота, при температурах в интервале от 0 до 50 С, предпочтительно, однако, при комнатной 14 температуре и при давлении водорода в пределах от 1 до 7 бар, предпочтительно, однако, от 3 до 5 бар. При проведении описанных выше реакций необязательно имеющиеся реакционноспособные группы, такие как карбокси-, амино-, алкиламино- или иминогруппы, можно защищать в ходе реакции обычными защитными группами,а по завершении реакции снова отщеплять их. Так, например, для защиты карбоксильной группы может использоваться триметилсилильная, метильная, этильная, трет-бутильная, бензильная либо тетрагидропиранильная группа, а для защиты амино-, алкиламино- или иминогруппы пригодны ацетильная, трифторацетильная, бензоильная, этоксикарбонильная, третбутоксикарбонильная, бензилоксикарбонильная,бензильная, метоксибензильная либо 2,4 диметоксибензильная группа, а для защиты аминогруппы - дополнительно фталильная группа. Последующее отщепление необязательно используемой защитной группы осуществляют,например, гидролитическим путем в водном растворителе, например в воде, в смеси изопропанол/вода, тетрагидрофуран/вода или диоксан/вода, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, либо в присутствии основания щелочного металла, такого как гидроксид лития,гидроксид натрия или гидроксид калия, при температурах в интервале от 0 до 100 С, предпочтительно при температурах в интервале от 10 до 50 С. Отщепление же бензильной, метоксибензильной или бензилоксикарбонильной группы осуществляют, например, путем гидрогенолиза,в частности с помощью водорода в присутствии катализатора, такого как палладий на угле, в растворителе, таком как метанол, этанол, этиловый эфир уксусной кислоты, диметилформамид,смесь диметилформамида и ацетона или ледяная уксусная кислота, необязательно с добавками кислоты, такой как соляная кислота или ледяная уксусная кислота, при температурах в интервале от 0 до 50 С, предпочтительно, однако, при комнатной температуре и давлении водорода в пределах от 1 до 7 бар, предпочтительно, однако, от 3 до 5 бар. Отщепление метоксибензильной группы может проводиться также в присутствии окислителя, такого как церий (IV)-аммонийнитрат, в растворителе, таком как метиленхлорид, ацетонитрил или смесь ацетонитрил/вода, при температурах в интервале от 0 до 50 С, предпочтительно, однако, при комнатной температуре. Отщепление же 2,4-диметоксибензильной группы целесообразно осуществлять в трифторуксусной кислоте в присутствии анизола. Отщепление трет-бутильной или третбутилоксикарбонильной группы предпочтительно осуществлять путем обработки кислотой, 15 такой как трифторуксусная кислота либо соляная кислота, необязательно с использованием растворителя, такого как метиленхлорид, диоксан, уксусный эфир или простой эфир. Отщепление фталильной группы предпочтительно осуществлять в присутствии гидразина или первичного амина, такого как метиламин,этиламин либо н-бутиламин, в растворителе,таком как метанол, этанол, изопропанол, смесь толуол/вода или диоксан, при температурах в интервале от 20 до 50 С. Далее, полученные хиральные соединения общей формулы I могут разделяться на их энантиомеры и/или диастереомеры. Так, например,полученные соединения общей формулы I, образующиеся в форме рацематов, по известным методам (см. Allinger N.L. и Eliel E.L. в "Topicsin Stereochemistry", том 6, изд-во Wiley Interscience, 1971) можно разделять на их оптические антиподы, а соединения общей формулы I,по меньшей мере, с 2 асимметричными атомами углерода благодаря их физико-химическим различиям по известным методам, например посредством хроматографии и/или путем фракционированной кристаллизации, можно разделять на их диастереомеры, которые в случае их получения в рацемической форме можно разделять, как описано выше, на энантиомеры. Предпочтительно разделять энантиомеры посредством колоночной хроматографии по хиральным фазам либо путем перекристаллизации из оптически активного растворителя, либо взаимодействием с оптически активной субстанцией, образующей с рацемическим соединением соли или производные, например сложные эфиры или амиды, прежде всего с кислотами и их активированными производными или спиртами, а разделение полученной таким образом смеси диастереомерных солей или производных осуществлять, например, исходя из различной степени их растворимости, при этом из чистых диастереомерных солей или производных действием соответствующих средств могут высвобождаться свободные антиподы. К наиболее приемлемым оптически активным кислотам относятся среди прочих D- и L-формы винной кислоты, дибензоилвинной кислоты, ди-отолилвинной кислоты, яблочной кислоты, миндальной кислоты, камфорсульфоновой кислоты,глутаминовой кислоты, N-ацетилглутаминовой кислоты,аспарагиновой кислоты,Nацетиласпарагиновой кислоты или хинной кислоты. В качестве оптически активного спирта можно использовать, например, (+)- или (-)ментол, а в качестве оптически активной ацильной группы в амидах можно применять, например, (+)- или (-)-метилоксикарбонил. Далее, получаемые соединения формулы I можно переводить в их соли, прежде всего для применения в фармацевтике - в их физиологически приемлемые соли с органическими или неорганическими кислотами. Такими кислотами 16 в этих целях могут служить среди прочих соляная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота, фумаровая кислота, янтарная кислота, молочная кислота,лимонная кислота, винная кислота, малеиновая кислота или метансульфокислота. Кроме того, получаемые описанным выше путем новые соединения формулы I, если они содержат карбоксигруппу, при необходимости могут переводиться затем в их соли с органическими или неорганическими основаниями, прежде всего для применения в фармацевтике - в их физиологически приемлемые соли. Такими основаниями в этих целях могут служить среди прочих гидроксид натрия, гидроксид калия,циклогексиламин, этаноламин, диэтаноламин и триэтаноламин. Используемые в качестве исходных продуктов соединения общих формул I-V частично известны из литературы либо их можно получать по методам, известным из литературы, или же по технологии, описанной в примерах. Как уже указывалось выше, новые соединения общей формулы I, в которой R1 представляет собой атом водорода или пролекарственный остаток, обладают ценными фармакологическими свойствами, прежде всего ингибирующим действием по отношению к различным киназам и комплексам циклин/CDK, а также подавляют пролиферацию культивированных раковых клеток человека и рост опухолей после орального введения у лишенных волосяного покрова мышей, инфицированных раковыми клетками человека. Представленные в качестве примеров в табл. 1 соединения испытывали на их биологическую эффективность следующим образом: Тест 1. Ингибирование ферментативной активности комплекса циклин/CDK in vitro. Для продуцирования активных человеческих холоферментов циклин/CDK использовали клетки насекомых High Five (BTI-TN-5B1-4),которые инфицировали высоким титром рекомбинантного бакуловируса. С использованием бакуловирусного вектора, содержащего два промотора (энхансерный промотор полиэдрина,Р 10-энхансерный промотор), экспрессировали в одной и той же клетке меченные с помощьюCDK6). Активный холофермент выделяли с помощью аффинной хроматографии на сефарозе,содержащей глутатион. Рекомбинантный pRB,меченый с помощью GST (аминокислотные остатки в положениях 379-928), продуцировали в Е. coli и очищали с помощью аффинной хроматографии на сефарозе, содержащей глутатион. 17 Применяемые для анализа киназной активности субстраты выбирали в зависимости от конкретных киназ. В качестве субстрата для комплексов циклин E/CDK2, циклин A/CDK2,циклин B/CDK1 и v-циклин/СDК 6 использовали гистон H1 (фирма Sigma). В качестве субстрата для комплексов циклин D1/CDK4, циклин(аминокислотные остатки в положениях 379928). Лизаты рекомбинантных инфицированных бакуловирусами клеток насекомых или также рекомбинантные киназы (полученные путем очистки из лизатов) вместе с несущим радиоактивную метку АТФ инкубировали в 1%-ном растворе ДМСО (диметилсульфоксид) в течение 45 мин при 30 С в присутствии пригодного для этих целей субстрата с различными концентрациями ингибитора. Протеины субстрата со связанной радиоактивностью осаждали с помощью 5%-ной ТХК (трихлоруксусная кислота) в гидрофобные многолуночные титрационные микропланшеты из поливинилиденфторида (фирмаMillipore) или с помощью 0,5%-ного раствора фосфорной кислоты осаждали на фильтры типаWhatman Р 81. После добавления сцинтилляционной жидкости измеряли радиоактивность с помощью жидкостного сцинтилляционного счетчика типа Wallace 1450 Microbeta. Для каждой концентрации вещества измерения проводили в двух повторностях; при этом вычисляли значения IС 50, характеризующие ингибирование фермента. Тест 2. Ингибирование пролиферации культивируемых клеток опухоли человека. Клетки опухоли лейомиосаркомы линииSK-UT-1B (полученные из Американской коллекции типовых культур (АТСC культивировали в минимальной эссенциальной среде, содержащей заменимые аминокислоты (фирмаGibco), дополненной пируватом натрия (1 ммоль), глутамином (2 ммоля) и 10% фатальной бычьей сыворотки (фирма Gibco), и собирали на логарифмической фазе роста. Затем клетки линии SK-UT-1B вносили в лунки многолуночного планшета типа Cytostar (фирма Amersham) с плотностью 4000 клеток на лунку и инкубировали в термостате в течение ночи. К клеткам добавляли соединения в различных концентрациях (растворенные в ДМСО; конечная концентрация: 1%). После инкубации в течение 48 ч в каждую лунку добавляли 14 С-тимидин (фирмаAmersham) и инкубировали еще в течение 24 ч. Количество 14 С-тимидина, включенного в присутствии ингибитора в клетки опухоли, и количество клеток, находящихся на S-фазе (фаза синтеза) клеточного роста, измеряли с помощью жидкостного сцинтилляционного счетчика типаWallace 1450 Microbeta. Значения IC50, характеризующие ингибирование пролиферации (ингибирование встраивания 14 С-тимидина), вычис 003514 18 ляли с поправкой на фоновое излучение. Все измерения проводили в двух повторностях. Тест 3. Исследование действия in vivo на лишенных волосяного покрова (бестимусных) мышах, имеющих опухоли. Самцам и/или самкам бестимусных мышей(мыши линии NMRI nu/nu; вес 25-35 г; количество особей в группе N = 10-20) путем подкожной инъекции объемом 0,1 мл вводили по 10 клеток [клетки линии SK-UT-1B или немелкоклеточного рака легкого линии NCI-H460 (полученные из АТСC)]; в альтернативном варианте подкожно имплантировали небольшие кусочки опухолевой ткани в виде скоплений клеток линии SK-UT-1B или линии NCI-Н 460. По истечении 1-3 недель после инъекции, соответственно имплантации животным ежедневно на протяжении 2-4 недель вводили орально (с помощью желудочного зонда) ингибитор киназы. Рост опухоли измеряли трижды в неделю с помощью цифрового штангенциркуля. Действие ингибитора киназы на рост опухоли выражали в виде процента ингибирования по сравнению с контрольной группой, обработанной плацебо. В приведенной ниже таблице представлены результаты, полученные в тесте 2 in vitro. Соединение ( примера) 1 (11) 1 (8) 1 (26) 1 (3) 1 (1) 1 (96) 1 (91) 1 (95) 1 (51) 1 (105) 1 (110) 1 (117) 1 (71) Благодаря их биологическим свойствам новые соединения общей формулы I, их изомеры и их физиологически приемлемые соли пригодны для лечения заболеваний, связанных с избыточной либо аномальной пролиферацией клеток. К таким заболеваниям относятся (но не ограничиваясь только ими) вирусные инфекции(например ВИЧ-инфекция и саркома Капоши),воспаления и аутоиммунные заболевания (например колит, артрит, болезнь Альцгеймера,гломерулонефрит и заживление ран), бактериальные, грибковые и/или паразитарные инфекции, лейкозы, лимфома и солидные опухоли,кожные заболевания (например псориаз), остеопатия, заболевания сердечно-сосудистой системы (например рестеноз и гипертрофия). Кроме того, они могут применяться для защиты быстро разрастающихся клеток (например волосковых,интестинальных клеток, клеток крови и клетокпредшественников) от ДНК-повреждения, обусловленного радиацией, УФ-облучением и/или лечением с использованием цитостатиков. 19 Новые соединения могут быть рассчитаны на краткий либо длительный курс лечения вышеназванных заболеваний, при необходимости в сочетании с другими известными соединениями, в частности с другими цитостатиками. Требуемая для достижения соответствующего эффекта дозировка составляет предпочтительно при внутривенном введении от 0,1 до 30 мг/кг, предпочтительно от 0,3 до 10 мг/кг, а при оральном введении - от 0,1 до 100 мг/кг, предпочтительно от 0,3 до 30 мг/кг, соответственно при 1-4-разовом приеме в день. В этих целях из получаемых согласно изобретению соединений формулы I, при необходимости в сочетании с другими активными веществами, совместно с одним либо несколькими обычными инертными носителями и/или разбавителями, такими например, как кукурузный крахмал, молочный сахар, сахароза, микрокристаллическая целлюлоза, стеарат магния, поливинилпирролидон,лимонная кислота, винная кислота, вода, вода/этанол, вода/глицерин, вода/сорбит, вода/полиэтиленгликоль, пропиленгликоль, цетилстеариловый спирт, карбоксиметилцеллюлоза или жирные субстанции, такие как твердый жир, либо их соответствующие смеси, можно изготавливать обычные галеновые композиции в форме таблеток, драже, капсул, порошков,суспензий, свечей или в виде растворов для инъекций либо вливания. Ниже изобретение более подробно поясняется на примерах. Пример 1. Метиловый эфир 1-ацетил-2 индолинон-5-карбоновой кислоты. 10,5 г метилового эфира 2-индолинон-5 карбоновой кислоты (получение аналогичноOgawa и др., Chem. Pharm. Bull 36, стр. 22532258 (1988 перемешивают в 30 мл ацетангидрида в течение 4 ч при 140 С. Затем смеси дают остыть, сливают на ледяную воду и осадок отфильтровывают с помощью вакуум-фильтра. Продукт повторно промывают водой, после чего растворяют с помощью метиленхлорида, сушат над сульфатом натрия и концентрируют. Выход: 11 г (86% от теории),Rf-значение: 0,63 (силикагель, метиленхлорид/метанол в соотношении 50:1). Пример 2. Метиловый эфир 1-ацетил-3-(1 этокси-1-бутилметилен)-2-индолинон-5-карбоновой кислоты. 11 г метилового эфира 1-ацетил-2 индолинон-5-карбоновой кислоты перемешивают в 110 мл ацетангидрида и 30 мл триэтилового эфира ортобензойной кислоты в течение 2 ч при 100 С. Затем центрифугируют, остаток промывают простым эфиром и отфильтровывают с помощью вакуум-фильтра. Выход: 11,5 г (67% от теории),Rf-значение: 0,55 (силикагель, метиленхлорид/петролейный эфир/уксусный эфир в соотношении 4:5:1).(1) метиловый эфир 1-ацетил-3-(1 этоксиметилен)-2-индолинон-5-карбоновой кислоты, получаемый из метилового эфира 1 ацетил-2-индолинон-5-карбоновой кислоты и триметилового эфира ортомуравьиной кислоты;(2) метиловый эфир 1-ацетил-3-(1-этокси 1-метилметилен)-2-индолинон-5-карбоновой кислоты, получаемый из метилового эфира 1 ацетил-2-индолинон-5-карбоновой кислоты и триэтилового эфира ортоуксусной кислоты;(3) метиловый эфир 1-ацетил-3-(1-этокси 1-этилметилен)-2-индолинон-5-карбоновой кислоты, получаемый из метилового эфира 1 ацетил-2-индолинон-5-карбоновой кислоты и триэтилового эфира ортопропионовой кислоты. Пример 3. 28,0 г смолы Ринка [МБГА-смола (метилбензгидриламиносмола), фирма Novobiochem] помещают в 330 мл диметилформамида для набухания. Затем добавляют 330 мл 30%-ного пиперидина в диметилформамиде и встряхивают в течение 7 мин с целью отщепления 9 Н-флуорен 9-илметоксикарбонильной группы, после чего смолу несколько раз промывают диметилформамидом. Далее добавляют 10,5 г 2-индолинон 5-карбоновой кислоты, (получение аналогичноOgawa, Hidenori и др., Chem. Pharm. Bull. 36,стр. 2253-2258 (1988 5,6 г гидроксибензотриазола, 13,3 г тетрафторбората О-(бензотриазол-1 ил)-N,N,N',N'-тетраметилурония и 5,7 мл Nэтилдиизопропиламина в 300 мл диметилформамида и встряхивают в течение 1 ч. Затем раствор отфильтровывают с помощью вакуумфильтра и смолу пять раз промывают 300 мл диметилформамида и трижды 300 мл метиленхлорида. Для сушки через смолу пропускают поток азота. Выход: 20 г насыщенной смолы. Пример 4. 0,4 г полученной согласно примеру 3 насыщенной смолы перемешивают с 2,5 мл ацетангидрида при 90 С в течение 1 ч. Затем добавляют 2,5 мл триметилового эфира ортовалериановой кислоты и встряхивают в течение последующих 3 ч при 110 С. После этого смолу отфильтровывают с помощью вакуум-фильтра и промывают последовательно диметилформамидом, метанолом и метиленхлоридом. Выход: 0,6 г влажной смолы. Аналогично примеру 4 получают следующие насыщенные смолы:(1) насыщенную 3-Z-(1-этоксиметилен)-5 амидо-2-индолиноном смолу,получаемую взаимодействием продукта из примера 1 с триэтиловым эфиром ортомуравьиной кислоты;(2) насыщенную 3-Z-(1-метокси-1-метилметилен)-5-амидо-2-индолиноном смолу, получаемую взаимодействием продукта из примера 1 с триметиловым эфиром ортоуксусной кислоты;(3) насыщенную 3-Z-(1-метокси-1-этилметилен)-5-амидо-2-индолиноном смолу, получаемую взаимодействием продукта из примера 1 с триметиловым эфиром ортопропионовой кислоты;(4) насыщенную 3-Z-(1-метокси-1-пропилметилен)-5-амидо-2-индолиноном смолу, получаемую взаимодействием продукта из примера 1 с триметиловым эфиром ортомасляной кислоты;(5) насыщенную 3-Z-(1-метокси-1-этенилметилен)-5-амидо-2-индолиноном смолу, получаемую взаимодействием продукта из примера 1 с 3,3,3-триэтоксипроп-1-еном;(6) насыщенную 3-Z-[1-метокси-1-(3-бромпропил)метилен]-5-амидо-2-индолиноном смолу, получаемую взаимодействием продукта из примера 1 с триметиловым эфиром 4-бромортомасляной кислоты;(7) насыщенную 3-Z-[1-метокси-1-(2-фенилсульфонилэтил)метилен]-5-амидо-2-индолиноном смолу, получаемую взаимодействием продукта из примера 1 с триэтиловым эфиром 3 фенилсульфонилортопропионовой кислоты. Пример 5. 4-(N-этиламинометил)нитробензол. 6 г 4-нитробензилбромида растворяют в 25 мл этанола, смешивают с 25 мл 10%-ного раствора этиламина в этаноле и в течение 2 ч кипятят с обратным холодильником. Затем смесь центрифугируют, остаток растворяют с помощью метиленхлорида и промывают разбавленным едким натром. В завершение органическую фазу концентрируют. Выход: 2,3 г (46% от теории),Rf-значение: 0,2 (силикагель, метиленхлорид/метанол в соотношении 9:1). Аналогично примеру 5 получают следующие соединения: 4-[N-(4-хлорфенилметил)аминометил]нитробензол,4-(N-циклогексиламинометил)нитробензол,4-(N-изопропиламинометил)нитробензол,4-(N-бутиламинометил)нитробензол,4-(N-метоксикарбонилметиламинометил) нитробензол,4-(N-(бензилметил)аминометил)нитробензол,4-(пирролидинометил)нитробензол,4-(морфолинометил)нитробензол,4-(пиперидинометил)нитробензол,4-(гексаметилениминометил)нитробензол,4-(4-гидроксипиперидинометил)нитробензол,4-(4-метилпиперидинометил)нитробензол,4-(4-этилпиперидинометил)нитробензол,4-(4-изопропилпиперидинометил)нитробензол,4-(4-фенилпиперидинометил)нитробензол,4-(4-бензилпиперидинометил)нитробензол,4-(4-этоксикарбонилпиперидинометил)нитробензол, 003514 24 4-(6-метокси-1,2,3,4-тетрагидроизохинолин-2-илметил)нитробензол,4-(7-метокси-1,2,3,4-тетрагидроизохинолин-2-илметил)нитробензол,4-(2,3,4,5-тетрагидроазепино(4,5-b)пиразин-3-илметил)нитробензол,4-(7-амино-2,3,4,5-тетрагидроазепино(4,5b)пиразин-3-илметил)нитробензол,4-(2-амино-5,6,7,8-тетрагидроазепино(4,5d)тиазол-6-илметил)нитробензол,4-(5,6,7,8-тетрагидроазепино(4,5-d)тиазол 6-илметил)нитробензол. Пример 6. 4-(N-этил-N-трет-бутоксикарбониламинометил)нитробензол. 2,2 г 4-(этиламинометил)нитробензола растворяют в 50 мл уксусного эфира и в течение 30 мин перемешивают при комнатной температуре с 2,6 г ди-трет-бутилдикарбоната. Затем раствор промывают водой и концентрируют. Выход: 3,4 г (97% от теории),Rf-значение: 0,9 (силикагель, метиленхлорид/метанол в соотношении 9:1). Аналогично примеру 6 получают следующие соединения: 4-[N-(4-хлорфенилметил)-N-трет-бутоксикарбониламинометил]нитробензол,4-(N-циклогексил-N-трет-бутоксикарбониламинометил)нитробензол,4-(N-изопропил-N-трет-бутоксикарбониламинометил)нитробензол,4-(N-бутил-N-трет-бутоксикарбониламинометил)нитробензол,4-(N-метоксикарбонилметил-N-трет-бутоксикарбониламинометил)нитробензол,4-(N-бензил-N-трет-бутоксикарбониламинометил)нитробензол,4-(N-этил-N-трет-бутоксикарбониламинометил)нитробензол. Пример 7. 4-(N-этил-N-трет-бутоксикарбониламинометил)анилин 6,4 г 4-(N-этил-N-трет-бутоксикарбониламинометил)нитробензола растворяют в 60 мл метанола и гидрируют в присутствии 1,5 г никеля Ренея при комнатной температуре и давлении 3 бара. Затем катализатор отфильтровывают и раствор концентрируют. Выход: 4,78 г,Rf-значение: 0,7 (силикагель, метиленхлорид/метанол в соотношении 50:1). Аналогично примеру 7 получают следующие соединения: 4-[N-(4-хлорфенилметил)-N-трет-бутоксикарбониламинометил]анилин,4-(N-циклогексил-N-трет-бутоксикарбониламинометил)анилин,4-(N-изопропил-N-трет-бутоксикарбониламинометил)анилин,4-(N-бутил-N-трет-бутоксикарбониламинометил)анилин,4-(N-метоксикарбонилметил-N-третбутоксикарбониламинометил)анилин, 25 4-(N-бензил-N-трет-бутоксикарбониламинометил)анилин,4-(пирролидинометил)анилин,4-(морфолинометил)анилин,4-(пиперидинометил)анилин,4-(гексаметилениминометил)анилин,4-(4-гидроксипиперидинометил)анилин,4-(4-метилпиперидинометил)анилин,4-(4-этилпиперидинометил)анилин,4-(4-изопропилпиперидинометил)анилин,4-(4-фенилпиперидинометил)анилин,4-(4-бензилпиперидинометил)анилин,4-(4-этоксикарбонилпиперидинометил) анилин,4-(диметиламинометил)анилин,4-(ди-н-пропиламинометил)анилин,4-(4-трет-бутоксикарбонилпиперазинометил)анилин,3-(диметиламинометил)анилин,4-(2-диэтиламиноэтил)анилин,4-(2-морфолиноэтил)анилин,4-(2-пирролидиноэтил)анилин,4-(2-пиперидиноэтил)анилин,4-(N-этил-N-бензиламинометил)анилин,4-(N-пропил-N-бензиламинометил)анилин,4-(N-метил-N-(4-хлорфенилметил)аминометил)анилин,4-(N-метил-N-(4-бромфенилметил)аминометил)анилин,4-(N-метил-N-(3-хлорфенилметил)аминометил)анилин,4-(N-метил-N-(3,4-диметоксифенилметил) аминометил)анилин,4-(N-метил-N-(4-метоксифенилметил)аминометил)анилин,4-[N-(2,2,2-трифторэтил)-N-бензиламинометил]анилин,4-[N-(2,2,2-трифторэтил)-N-(4-хлорфенилметил)аминометил]анилин,4-(2,6-диметилпиперидинометил)анилин,4-(тиоморфолинометил)анилин,4-(S-оксидотиоморфолинометил)анилин,4-(S,S-диоксидотиоморфолинометил)анилин,4-(азетидинометил)анилин,4-(2,5-дигидропиррол-1-илметил)анилин,4-(3,6-дигидро-2 Н-пиридин-1-илметил) анилин,4-(2-метоксикарбонилпирролидинометил) анилин,4-(3,5-диметилпиперидинометил)анилин,4-(4-фенилпиперазинометил)анилин,4-(4-фенил-4-гидроксипиперидинометил) анилин,4-[N-(3,4,5-триметоксибензил)-N-метиламинометил]анилин,4-[N-(3,4-диметоксибензил)-N-этиламинометил]анилин,4-(N-бензил-N-этиламинометил)анилин,4-[N-(3-хлорбензил)-N-метиламинометил] анилин, 003514 26 4-[N-(2,6-дихлорбензил)-N-метиламинометил]анилин 4-[N-(4-трифторметилбензил)-N-метиламинометил]анилин,4-(N-бензил-N-изопропиламинометил)анилин,4-(N-бензил-N-трет-бутиламинометил)анилин,4-(диизопропиламинометил)анилин,4-(ди-н-пропиламинометил)анилин,4-(диизобутиламинометил)анилин,4-(2,3,4,5-тетрагидробензо(d)азепин-3 илметил)анилин,4-(2,3-дигидроизоиндол-2-илметил)анилин,4-(6,7-диметокси-1,2,3,4-тетрагидроизхинолин-2-илметил)анилин,4-(1,2,3,4-тетрагидроизохинолин-2-илметил)анилин,4-[N-(2-гидроксиэтил)-N-бензиламинометил]анилин,4-[N-(1-этилпентил)-N-(пиридин-2-илметил)аминометил]анилин,4-(N-фенетил-N-метиламинометил)анилин,4-[N-(3,4-дигидроксифенетил)-N-метиламинометил]анилин,4-[N-(3,4,5-триметоксифенетил)-N-метиламинометил]анилин,4-[N-(3,4-диметоксифенетил)-N-метиламинометил]анилин,4-[N-(4-нитрофенетил)-N-метиламинометил]анилин,4-(N-фенетил-N-бензиламинометил)анилин,4-(N-фенетил-N-циклогексиламинометил)анилин,4-[N-(2-(пиридин-2-ил)этил)-N-метиламинометил]анилин,4-[N-(2-(пиридин-4-ил)этил)-N-метиламинометил]анилин,4-[N-(пиридин-4-илметил)-N-метиламинометил]анилин,4-(дибензиламинометил)анилин,4-[N-(4-нитробензил)-N-пропиламинометил]анилин,4-[N-бeнзил-N-(3-цианопропил)аминометил]анилин,4-(N-бензил-N-аллиламинометил)анилин,4-[N-бензил-N-(2,2,2-трифторэтил)аминометил]анилин,4-[N-(бензо(1,3)диоксол-5-илметил)-Nметиламинометил]анилин,4-(7-хлор-2,3,4,5-тетрагидробензо(d)азепин-3-илметил)анилин,4-(7,8-дихлор-2,3,4,5-тетрагидробензо(d) азепин-3-илметил)анилин,4-(7-метокси-2,3,4,5-тетрагидробензо(d)азепин-3-илметил)анилин,4-(7-метил-2,3,4,5-тетрагидробензо(d)азепин-3-илметил)анилин, 27 4-(7,8-диметокси-2,3,4,5-тетрагидробензо(d)азепин-3-илметил)анилин,4-(6,7-дихлор-1,2,3,4-тетрагидроизохинолин-2-илметил)анилин,4-(6,7-диметил-1,2,3,4-тетрагидроизохинолин-2-илметил)анилин,4-(6-хлор-1,2,3,4-тетрагидроизохинолин-2 илметил)анилин,4-(7-хлор-1,2,3,4-тетрагидроизохинолин-2 илметил)анилин,4-(6-метокси-1,2,3,4-тетрагидроизохинолин-2-илметил)анилин,4-(7-метокси-1,2,3,4-тетрагидроизохинолин-2-илметил)анилин,4-(2,3,4,5-тетрагидроазепино(4,5-b)пиразин-3-илметил)анилин,4-(7-амино-2,3,4,5-тетрагидроазепино(4,5b)пиразин-3-илметил)анилин,4-(2-амино-5,6,7,8-тетрагидроазепино(4,5d)тиазол-6-илметил)анилин,4-(5,6,7,8-тетрагидроазепино(4,5-d)тиазол 6-илметил)анилин. Получение конечных продуктов Пример 1. 3-Z-(1-фениламино-1-бутилметилен)-5-амидо-2-индолинон. 600 мг полученной согласно примеру 4 смолы суспендируют в 3 мл диметилформамида и в течение 10 ч встряхивают при 70 С с 0,4 г анилина. Затем отфильтровывают и смолу несколько раз промывают метиленхлоридом, метанолом и диметилформамидом. Далее с целью отщепления ацетильной группы добавляют в течение 2 ч 3 мл раствора аммиака в метаноле. После повторной промывки диметилформамидом и метиленхлоридом добавляют в течение 90 мин 4 мл 10%-ной трифторуксусной кислоты в метиленхлориде, смолу отделяют и раствор концентрируют. Остаток растворяют в небольшом количестве 1 н. едкого натра и экстрагируют небольшим количеством метиленхлорида. Органическую фазу сушат над сульфатом натрия и центрифугируют. Выход: 37 мг, Rfзначение: 0,6(1) 3-Z-(1-фениламинометилен)-5-амидо-2 индолинон: получение: из полученной согласно примеру 4 (1) смолы и анилина,Rf-значение: 0,59 (силикагель, метиленхлорид/метанол в соотношении 9:1),C16H13N3O2,масс-спектр: m/z = 279 (М+);(2) 3-Z-[1-(4-метилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-метиланилина,Rf-значение: 0,44 (силикагель, метиленхлорид/метанол в соотношении 9:1), 003514(3) 3-Z-[1-(4-хлорфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-хлоранилина,Rf-значение: 0,45 (силикагель, метиленхлорид/метанол в соотношении 9:1),C17H14ClN3O2,масс-спектр: m/z = 327/329 (М+);(4) 3-Z-[1-(4-этилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-этиланилина,Rf-значение: 0,43 (силикагель, метиленхлорид/метанол в соотношении 9:1),C19H19N3O2,масс-спектр: m/z = 321 (М+);(5) 3-Z-[1-(4-метоксифениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-метоксианилина,Rf-значение: 0,46 (силикагель, метиленхлорид/метанол в соотношении 9:1),C18H17N3O2,масс-спектр: m/z = 323 (М+);(6) 3-Z-[1-(4-иодфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-иоданилина,Rf-значение: 0,36 (силикагель, метиленхлорид/метанол в соотношении 9:1) С 17 Н 14IN3O2,масс-спектр: m/z = 419 (М+);(7) 3-Z-[1-(4-фторфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и 4-фторанилина,Rf-значение: 0,60 (силикагель, метиленхлорид/метанол в соотношении 9:1),C17H14FN3O2,масс-спектр: m/z = 311 (М+);(8) 3-Z-[1-(4-бромфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-броманилина,Rf-значение: 0,53 (силикагель, метиленхлорид/метанол в соотношении 9:1),C17H14BrN3O2,масс-спектр: m/z = 371/373 (М+);(9) 3-Z-(1-фениламино-1-метилметилен)-5 амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и анилина,Rf-значение: 0,58 (силикагель, метиленхлорид/метанол в соотношении 9:1),C17H15N3O2,масс-спектр: m/z = 293 (М+);(10) 3-Z-(1-амино-1-метилметилен)-5-амидо-2-индолинон: получение: из полученной согласно примеру IV (2) смолы и аммиака, 29(11) 3-Z-[1-(4-пиперидинометилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(пиперидинометил) анилина,Rf-значение: 0,31 (силикагель, метиленхлорид/метанол в соотношении 9:1),C23H26N4O2,масс-спектр: m/z = 390 (М+);(12) 3-Z-[1-(4-пирролидинметилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(пирролидинметил)анилина,Rf-значение: 0,20 (силикагель, метиленхлорид/метанол в соотношении 4:1),C22H24N4O2,масс-спектр: m/z = 376 (М+);(13) 3-Z-[1-(4-дипропиламинометилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(ди-н-пропиламинометил) анилина,Rf-значение: 0,71 (силикагель, метиленхлорид/метанол в соотношении 4:1),C24H30N4O2,масс-спектр: m/z = 406 (М+);(14) 3-Z-[1-[4-(2-пиперидиноэтил)фениламино]-1-метилметилен]-5-амидо-2 -индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(2-пиперидиноэтил)анилина,Rf-значение: 0,38 (силикагель, метиленхлорид/метанол в соотношении 4:1),C24H28N4O2,масс-спектр: m/z = 404 (М+);(15) 3-Z-[1-[4-(2-диэтиламиноэтил)фениламино]-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(2-диэтиламиноэтил) анилина,Rf-значение: 0,33 (силикагель, метиленхлорид/метанол в соотношении 4:1),C23H28N4O2,масс-спектр: m/z = 393 (М+);(16) 3-Z-[1-(4-(2-гексаметилениминометил) фениламино)-1-метилметилен]-5-амидо-2 индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(гексаметилениминометил) анилина,Rf-значение: 0,34 (силикагель, метиленхлорид/метанол в соотношении 4:1),C24H28N4O2,масс-спектр: m/z = 404 (М+); 30 получение: из полученной согласно примеру 4(2) смолы и 4-(N-метил-N-метансульфониламино)анилина,Rf-значение: 0,36 (силикагель, метиленхлорид/метанол в соотношении 9:1),С 19H20N4O4S,масс-спектр: m/z = 400 (М+);(18) 3-Z-[1-(4-метансульфониламинофениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(метансульфониламино) анилина,Rf-значение: 0,31 (силикагель, метиленхлорид/метанол в соотношении 9:1)(19) 3-Z-[1-(4-бромфениламино)-1-этилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(3) смолы и 4-броманилина,Rf-значение: 0,52 (силикагель, метиленхлорид/метанол в соотношении 9:1),C18H16BrN3O2,масс-спектр: m/z = 385/387 (М+/М+2+);(20) 3-Z-[1-(4-пиперидинометилфениламино)-1-этилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(3) смолы и 4-(пиперидинометил) анилина,Rf-значение: 0,42 (силикагель, метиленхлорид/метанол в соотношении 4:1)(21) 3-Z-[1-(4-пиперидинометилфениламино)-1-пропилметилен] -5-амидо-2-индолинон: получение: из полученной согласно примеру 4(4) смолы и 4-(пиперидиноме-тил)анилина,Rf-значение: 0,49 (силикагель, метиленхлорид/метанол в соотношении 4:1),C25H30N4O2,масс-спектр: m/z = 418 (М+);(22) 3-Z-[1-(4-бромфениламино)-1-пропилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(4) смолы и 4-броманилина,Rf-значение: 0,53 (силикагель, метиленхлорид/метанол в соотношении 9:1),C19H18BrN3O2,масс-спектр: m/z = 399/401 (М+/М + 2+);(23) 3-Z-[(4-бромфениламино)метилен]-5 амидо-2-индолинон: получение: из полученной согласно примеру 4(1) смолы и 4-броманилина, C16H12BrN3O2,масс-спектр: m/z = 357/359 (М+/М+2+);(24) 3-Z-[(4-пиперидинометилфениламино)метилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(1) смолы и 4-(пиперидинометил)анилина,C22H24N4O2, 31 масс-спектр: m/z = 376 (М+);(25) 3-Z-[1-(4-бромфениламино)-1-бутилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 смолы и 4-броманилина,Rf-значение: 0,53 (силикагель, метиленхлорид/метанол в соотношении 9:1),C20H20BrN3O2,масс-спектр: m/z = 413/415 (М+/М+2+);(26) 3-Z-[1-(4-пиперидинометилфениламино)-1-бутилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 смолы и 4-(пиперидинометил)анилина,Rf-значение: 0,48 (силикагель, метиленхлорид/метанол в соотношении 4:1),C26H32N4O2,масс-спектр: m/z = 432 (М+);(27) 3-Z-[1-(4-пиперидинометилфениламино)-1-этенилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(5) смолы и 4-(пиперидинометил)анилина;(28) 3-Z-[1-(4-пиперидинометилфениламино)-1-(3-бромпропил)метилен]-5-амидо-2 индолинон: получение: из полученной согласно примеру 4(6) смолы и 4-(пиперидинометил)анилина;(29) 3-Z-[1-(4-пиперидинометилфениламино)-1-(2-фенилсульфонилэтил)метилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(7) смолы и 4-(пиперидинометил)анилина;(30) 3-Z-[1-(4-(2,6-диметилпиперидинометил)фениламино)-1-метилметилен]-5-амидо-2 индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(2,6-диметилпиперидинометил)анилина;(31) 3-Z-[1-(4-тиоморфолинометилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(тиоморфолинометил)анилина,Rf-значение: 0,60 (силикагель, метиленхлорид/метанол в соотношении 9:1),C22H24N4O2S,масс-спектр: m/z - 408 (М+);(32) 3-Z-1-[(4-тиоморфолино-S-оксидметил)фениламино]-1-метилметилен-5-амидо-2 индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(тиоморфолино-S-оксидметил)анилина,Rf-значение: 0,21 (силикагель, метиленхлорид/метанол в соотношении 9:1),C22H24N4O3S,масс-спектр: m/z = 425 (М+); 32 получение: из полученной согласно примеру 4(2) смолы и 4-(тиоморфолино-S,Sдиоксидметил)анилина;(34) 3-Z-[1-(4-азетидинометилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(азетидинометил) анилина;(35) 3-Z-1-[4-(2,5-дигидропиррол-1 илметил)фениламино]-1-метилметилен-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(2,5-дигидропиррол-1 илметил)анилина,Rf-значение: 0,10 (силикагель, метиленхлорид/метанол в соотношении 9:1),C22H22N4O2,масс-спектр: m/z = 375 (М+Н+);(36) 3-Z-[1-[4-(3,6-дигидро-2 Н-пиридин-1 илметил)фениламино]-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(3,6-дигидро-2 Н-пиридин 1-илметил)анилина,Rf-значение: 0,20 (силикагель, метиленхлорид/метанол в соотношении 9:1),C23H24N4O2,масс-спектр: m/z = 389 (М+Н+);(37) 3-Z-1-[4-(2-этоксикарбонилпирролидинометил)фениламино]-1-метилметилен-5 амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(2-этоксикарбонилпирролидинометил)анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C24H26N4O4,масс-спектр: m/z = 435 (М+Н+);(38) 3-Z-[1-[4-(3,5-диметилпиперидинометил)фениламино]-1-метилметилен]-5-амидо-2 индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(3,5-диметилпиперидинометил)анилина,Rf-значение: 0,16 (силикагель, метиленхлорид/метанол в соотношении 9:1),C25H30N4O2,масс-спектр: m/z = 418 (М+);(39) трифторацетат 3-Z-[1-[4-(4-фенилпиперазинометил)фениламино]-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(4-фенилпиперазинометил)анилина,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 9:1),C28H29N5O2,масс-спектр: m/z = 468 (М+Н+); 33 получение: из полученной согласно примеру 4(2) смолы и 4-(4-фенил-4-гидроксипиперидинометил) анилина,C29H30N4O3,масс-спектр: m/z = 483 (М+Н+);(41) 3-Z-[1-(3-метоксифениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 3-метоксианилина,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 9:1),C18H17N3O3,масс-спектр: m/z = 323 (М+Н+);(42) 3-Z-[1-(3-этоксикарбонилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и этилового спирта 3 аминобензойной кислоты,C20H19N3O4,масс-спектр: m/z = 365 (М+);(43) трифторацетат 3-Z-[1-(4-диметиламинометилфениламино)-1-метилметилен]-5 амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-диметиламинометиланилина,C20H22N4O2,масс-спектр: m/z = 351 (М+Н+);(44) 3-Z-[1-[4-(4-циклогексилпиперидинометил)фениламино]-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(4-циклогексилпиперидинометил)анилина;(45) 3-Z-[1-(4-морфолинофениламино)-1 метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-морфолиноанилина,C2lH22N4O3,масс-спектр: m/z = 378 (М+);(46) 3-Z-[1-(N-метилпиперидин-4-иламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-амино-N-метилпиперидина,C17H22N4O2,масс-спектр: m/z = 314 (М+);(47) 3-Z-[1-(4-метилциклогексиламино)-1 метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-метилциклогексиламина,C18H23N3O2,масс-спектр: m/z = 313 (М+);(48) 3-Z-(1-циклопентиламино-1-метилметилен)-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и циклопентиламина,Rf-значение: 0,70 (силикагель, метиленхлорид/метанол в соотношении 4:1),C16H19N3O2,масс-спектр: m/z = 285 (М+); 34 получение: из полученной согласно примеру 4(50) 3-Z-[1-(4-этоксикарбонилметиламинометилфениламино)-1-метилметилен]-5-амидо-2 индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(этоксикарбонилметил-Nтрет-бутилоксикарбониламинометил)анилина,C21H22N4O4,масс-спектр: m/z = 394 (М+);(51) 3-Z-[1-(4-бензиламинометилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(N-бензил-N-третбутилоксикарбониламинометил)анилина,Rf-значение: 0,24 (силикагель, метиленхлорид/метанол в соотношении 9:1),C25H24N4O2,масс-спектр: m/z = 412 (М+);(52) трифторацетат 3-Z-[1-(4-бутиламинометилфениламино)-1-метилметилен]-5-амидо-2 индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(N-бутил-N-трет-бутилоксикарбониламинометил)анилина,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 4:1)(53) трифторацетат 3-Z-[1-(4-этиламинометилфениламино)-1-метилметилен]-5-амидо-2 индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(N-этил-N-трет-бутилоксикарбониламинометил)анилина,Rf-значение: 0,20 (силикагель, метиленхлорид/метанол в соотношении 4:1),C20H22N4O2,масс-спектр: m/z = 351 (М+Н+);(54) трифторацетат 3-Z-[1-(4 циклогексиламинометилфениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-[циклогексил-(N-третбутилоксикарбониламинометил]анилина,C24H28N4O2,масс-спектр: m/z = 405 (М+Н+);(55) трифторацетат 3-Z-[l-(4-изoпpoпилaминoмeтилфeнилaминo)-l-метилметилен]-5 амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(N-изопропил-N-третбутилоксикарбониламинометил)анилина,C21H24N4O2,масс-спектр: m/z = 365 (М + Н+); 35 получение: из полученной согласно примеру 4(2) смолы и 4-трифторметоксианилина,C18H14F3N3O3,масс-спектр: m/z = 377 (М+);(57) 3-Z-[1-(4-дифторметоксифениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-дифторметоксианилина,Rf-значение: 0,5 (силикагель, метиленхлорид/метанол в соотношении 9:1),C18H15F2N3O3,масс-спектр: m/z = 359 (М+Н+);(58) 3-Z-[1-(4-бром-3-хлорфениламино)-1 метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и 4-бром-3-хлоранилина,C17H13BrClN3O2,масс-спектр:(59) 3-Z-[1-(4-трифторметил-3-бромфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-трифторметил-3-броманилина,C18H13BrF3N3O2,масс-спектр: m/z = 439/441 (М+/М + 2+);(60) 3-Z-[1-(4-хлорфениламино)метилен]5-амидо-2-индолинон: получение: из полученной согласно примеру 4(1) смолы и 4-хлоранилина, C16H12ClN3O2,масс-спектр: m/z = 312/314 (М+);(61) 3-Z-[1-(3-бромфениламино)-1 метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 3-броманилина,C17H14BrN3O2,масс-спектр: m/z = 371/373 (М+);(62) 3-Z-[1-(3-хлорфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 3-хлоранилина,C17H14ClN3O2,масс-спектр: m/z = 327/329 (М+);(63) 3-Z-[1-(2-хлорфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и 2-хлоранилина,C17H14ClN3O2,масс-спектр: m/z = 327/329 (М+);(64) 3-Z-[1-(4-бром-3-метилфениламино)1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-бром-3-метиланилина,Rf-значение: 0,60 (силикагель, метиленхлорид/метанол в соотношении 9:1),C18H16BrN3O2,масс-спектр: m/z = 385/387 (М+);(65) 3-Z-[1-(4-бром-3-метоксифениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-бром-3-метоксианилина, 003514(66) 3-Z-[1-(4-фтор-3-нитрофениламино)-1 метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-фтор-3-нитроанилина,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 9:1),C17H13FN4O4,масс-спектр: m/z = 356 (М+);(67) 3-Z-[1-(4-бром-3-нитрофениламино)1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-бром-3-нитроанилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C17H13BrN4O4,масс-спектр: m/z = 416/418 (М+);(68) 3-Z-[1-(4-этил-3-нитрофениламино)-1 метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и 4-этил-3-нитроанилина,Rf-значение: 0,70 (силикагель, метиленхлорид/метанол в соотношении 9:1),C19H18N4O4,масс-спектр: m/z = 366 (М+);(69) 3-Z-[1-(4-хлор-3-нитрофениламино) 1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-хлор-3-нитроанилина,C17H13C1N4O4,масс-спектр: m/z = 371/373 (М+);(70) 3-Z-[1-(3-нитрофениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 3-нитроанилина,C17H14N4O4,масс-спектр: m/z = 338 (М+Н+);(71) 3-Z-[1-(4-метил-3-нитрофениламино)1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и 4-метил-3-нитроанилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C18H16N4O4,масс-спектр: m/z = 352 (М+);(72) 3-Z-[1-(4-бром-3-метоксикарбонилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и этилового эфира 2-бром-5 аминобензойной кислоты,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C19H16BrN3O4,масс-спектр: m/z = 429/431 (М+Н+);(73) 3-Z-[1-(4-карбамоилфениламино)-1 метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-аминобензамида, 37(74) 3-Z-[1-(4-пиперидинокарбонилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и 1-(4-аминобензоил)пиперидина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C23H24N4O3,масс-спектр: m/z = 404 (М+);(75) трифторацетат 3-Z-[1-(4-(2-(диэтиламиноэтилкарбамоилфениламино-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-амино-N-[2-(диэтиламино)этил]бензамида,Rf-значение: 0,30 (силикагель, метиленхлорид/метанол в соотношении 9:1),C24H29N5O3,масс-спектр: m/z = 436 (М+Н+);(76) 3-Z-[1-(4-трифторметилфениламино)1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-трифторметиланилина,C18H14F3N3O2,масс-спектр: m/z = 361 (М+);(77) 3-Z-[1-(3-гидроксиметилфениламино)1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 3-аминобензилового спирта,C18H17N3O3,масс-спектр: m/z = 323 (М+);(78) 3-Z-[1-(4-(гидроксикарбонилфениламино-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-аминобензойной кислоты,Rf-значение: 0,20 (силикагель, метиленхлорид/метанол в соотношении 4:1),С 18 Н 15N3O4,масс-спектр: m/z = 336 (М+Н+);(79) 3-Z-[1-(4-этоксикарбонилметил-3-нитрофениламино)-1-метилметилен]-5-амидо-2 индолинон: получение: из полученной согласно примеру 4 (2) смолы и этилового эфира 4-амино-2 нитрофенилуксусной кислоты,Rf-значение: 0,70 (силикагель, метиленхлорид/метанол в соотношении 9:1),C21H20N4O6,масс-спектр: m/z = 424 (М+);(80) 3-Z-[1-(3-метоксикарбонил-4-метилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и метилового эфира 3-амино 6-метилбензойной кислоты,Rf-значение: 0,70 (силикагель, метиленхлорид/метанол в соотношении 9:1),C20H19N3O4, 003514(81) 3-Z-[1-(3-диэтилкарбамоил-4-метилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и диэтиламида 3-амино-6 метилбензойной кислоты,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C23H26N4O3,масс-спектр: m/z = 406 (М+);(82) 3-Z-[1-(3-этилкарбамоил-4-метилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и этиламида 3-амино-6 метилбензойной кислоты,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 9:1),C21H22N4O3,масс-спектр: m/z = 378 (М+);(83) 3-Z-[1-(3-сульфамоил-4-метилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4 (2) смолы и амида 3-амино-6 метилфенилсульфокислоты,Rf-значение: 0,30 (силикагель, метиленхлорид/метанол в соотношении 9:1),C18H18N4O4S,масс-спектр: m/z = 386 (М+);(84) 3-Z-[1-(3-ацетиламино-4-метилфениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-амино-2-ацетиламинотолуола,Rf-значение: 0,65 (силикагель, метиленхлорид/метанол в соотношении 9:1),C20H20N4O3,масс-спектр: m/z = 364 (М+);(85) трифторацетат 3-Z-[1-(4-(2-диметиламиноэтоксифениламино-1-метилметилен]5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(2-диметиламиноэтокси) анилина,Rf-значение: 0,10 (силикагель, метиленхлорид/метанол в соотношении 4:1),C21H24N4O3,масс-спектр: m/z = 380 (М+);(86) трифторацетат 3-Z-[1-(4-(2-пиперидиноэтоксифениламино-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(2-пиперидиноэтокси)анилина,Rf-значение: 0,70 (силикагель, метиленхлорид/метанол в соотношении 4:1),C24H28N4O3,масс-спектр: m/z = 420 (М+); 39 получение: из полученной согласно примеру 4(2) смолы и 4-(3-диметиламинопропокси) анилина,Rf-значение: 0,10 (силикагель, метиленхлорид/метанол в соотношении 4:1),C22H26N4O3,масс-спектр: m/z = 394 (М+);(88) трифторацетат 3-Z-[1-(4-(3-пиперидинопропокси)фениламино)-1-метилметилен]-5 амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(3-пиперидинопропокси) анилина,Rf-значение: 0,20 (силикагель, метиленхлорид/метанол в соотношении 4:1),C25H30N4O3,масс-спектр: m/z = 434 (М+);(89) трифторацетат 3-Z-[1-(4-(3-(N-бензилN-метиламино)пропокси)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-[3-(N-бензил-Nметиламино)пропокси]анилина,Rf-значение: 0,60 (силикагель, метиленхлорид/метанол в соотношении 4:1),C28H30N4O3,масс-спектр: m/z = 470 (М+);(90) трифторацетат 3-Z-[1-(4-(N-бензиламинометил)фениламино)-1-метилметилен]-5 амидо-2-индолинона: получение: из полученной согласно примеру 4(1) смолы и 4-(N-бензил-N-третбутоксикарбониламинометил)анилина,C24H22N4O2,масс-спектр: m/z = 399 (М+Н+);(91) трифторацетат 3-Z-[1-(4-(N-(4-хлорбензил)аминометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(N-(4-хлорбензил-N-третбутоксикарбониламинометиланилина,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 9:1),C25H23ClN4O2,масс-спектр: m/z = 446/448 (М+);(92) трифторацетат 3-Z-[1-(4-(N-(3,4,5 триметоксибензил)-N-метиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-[N-(3,4,5 триметоксибензил)-N-метиламинометил]анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C29H32N4O5,масс-спектр: m/z = 516 (М+); 40 получение: из полученной согласно примеру 4(2) смолы и 4-[N-(3,4-диметоксибензил)N-метиламинометил]анилина,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 9:1),C28H30N4O4,масс-спектр: m/z = 486 (М+);(94) трифторацетат 3-Z-[1-(4-(N-(3,4 диметоксибензил)-N-этиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-[N-(3,4-диметоксибензил)N-этиламинометил]анилина,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 9:1),C29H32N4O4,масс-спектр: m/z = 500 (М+);(95) трифторацетат 3-Z-[1-(4-(N-бензил-Nэтиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-[N-бензил-N-этиламинометил]анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C27H28N4O2,масс-спектр: m/z = 440 (М+);(96) трифторацетат 3-Z-[1-(4-(N-бензил-Nметиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-[N-бензил-Nметиламинометил]анилина,Rf-значение: 0,55 (силикагель, метиленхлорид/метанол в соотношении 9:1),С 26 Н 26N4O2,масс-спектр: m/z = 426 (М+);(97) трифторацетат 3-Z-[1-(4-(N-бензил-Nметиламинометил)фениламино)-1-этилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(3) смолы и 4-[N-бензил-Nметиламинометил]анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C27H28N4O2,масс-спектр: m/z = 440 (М+);(98) трифторацетат 3-Z-[1-(4-(N-бензил-Nметиламинометил)фениламино)-1-пропилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(4) смолы и 4-[N-бензил-N-метиламинометил]анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C28H30N4O2,масс-спектр: m/z = 454 (М+); 41 получение: из полученной согласно примеру 4(2) смолы и 4-[N-(4-хлорбензил)-Nметиламинометил]анилина,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 9:1),C26H25ClN4O2,масс-спектр: m/z = 460/462 (М+);(100) трифторацетат 3-Z-[1-(4-(N-(3 хлорбензил)-N-метиламинометил)фениламино)1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-[N-(3-хлорбензил)-Nметиламинометил]анилина,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 9:1),C26H25ClN4O2,масс-спектр: m/z = 460/462 (М+);(101) трифторацетат 3-Z-[1-(4-(N-(2,6 дихлорбензил)-N-метиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-[N-(2,6-дихлорбензил)-Nметиламинометил]анилина,Rf-значение: 0,38 (силикагель, метиленхлорид/метанол в соотношении 9:1),C26H24C12N4O2,масс-спектр: m/z = 494/496/498 (М + 2+/М+4+);(102) трифторацетат 3-Z-[1-(4-(N-(4 трифторметилбензил)-N-метиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-[N-(4 трифторметилбензил)-N-метиламинометил]анилина,Rf-значение: 0,38 (силикагель, метиленхлорид/метанол в соотношении 9:1),C27H25F3N4O2,масс-спектр: m/z = 494 (М+);(103) трифторацетат 3-Z-[1-(4-(N-бензилN-изопропиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(N-бензил-Nизопропиламинометил) анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C28H30N4O2,масс-спектр: m/z = 454 (М+);(104) трифторацетат 3-Z-[1-(4-(N-бензилN-трет-бутиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(N-бензил-N-третбутиламинометил)анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C29H32N4O2,масс-спектр: m/z = 468 (М+);(105) трифторацетат 3-Z-[1-(4-(N-бензилN-метиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(1) смолы и 4-(N-бензил-N-метиламинометил)анилина,C25H24N4O2,масс-спектр: m/z = 413 (М+Н+);(106) трифторацетат 3-Z-[1-(4-(N-бензилN-этиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(1) смолы и 4-(N-бензил-Nэтиламинометил)анилина,C26H26N4O2,масс-спектр: m/z = 427 (М + Н+);(107) трифторацетат 3-Z-[1-(4-(диизопропиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(диизопропиламинометил)анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 4:1),C24H30N4O2,масс-спектр: m/z = 406 (М+);(108) трифторацетат 3-Z-[1-(4-(ди-нпропиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(ди-н-пропиламинометил)анилина,C23H28N4O2,масс-спектр: m/z = 393 (М + Н+);(109) трифторацетат 3-Z-[1-(4-(диизобутиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(диизобутиламинометил)анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C26H34N4O2,масс-спектр: m/z = 434 (М+);(110) трифторацетат 3-Z-[1-(4-(2,3,4,5 тетрагидробензо(d)азепин-3-илметил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(2,3,4,5-тетрагидробензо(111) трифторацетат 3-Z-[1-(4-(1,3 дигидроизоиндол-2-илметил)фениламино)-1 метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(1,3-дигидроизоиндол-2 илметил)анилина, 43(112) трифторацетат 3-Z-[1-(4-(6,7 диметокси-1,2,3,4-тетрагидроизохинолин-2 илметил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(6,7-диметокси-1,2,3,4 тетрагидроизохинолин-2-илметил)анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C29H30N4O4,масс-спектр: m/z = 499 (М+Н+);-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(1,2,3,4 тетрагидроизохинолин-2-илметил)анилина;(114) трифторацетат 3-Z-[1-(4-(N(этоксикарбонилметил)-N-бензиламинометил)фениламино)-1-метилметилен]-5-амидо-2 индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(N-(этоксикарбонилметил) N-бензиламинометил)анилина,Rf-значение: 0,60 (силикагель, метиленхлорид/метанол в соотношении 9:1),C29H30N4O4,масс-спектр: m/z = 498 (М+);(115) трифторацетат 3-Z-[1-(4-(N-(2 гидроксиэтил)-N-бензиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(N-(2-гидроксиэтил)-Nбензиламинометил)анилина,Rf-значение: 0,40 (силикагель, метиленхлорид/метанол в соотношении 9:1),C27H28N4O3,масс-спектр: m/z = 456 (М+);(116) трифторацетат 3-Z-[1-(4-(N-(1 этилпентил)-N-(пиридин-2-илметил)-аминометил)фениламино)-1-метилметилен]-5-амидо-2 индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-[N-(1-этилпентил)-N-(пиридин-2-илметил)-аминометил]анилина,Rf-значение: 0,45 (силикагель, метиленхлорид/метанол в соотношении 9:1),С 31 Н 37N5O2,масс-спектр: m/z = 511 (М+);(117) 3-Z-[1-(4-(пиперидинометил)-3-нитрофениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из полученной согласно примеру 4(2) смолы и 4-(пиперидинометил)-3 нитроанилина,Rf-значение: 0,70 (силикагель, метиленхлорид/метанол в соотношении 9:1),C23H25N5O4, 003514(118) трифторацетат 3-Z-[1-(4-(N-фенетилN-метиламинометил)фениламино)-1-метилметилен]-5-амидо-2-индолинона: получение: из полученной согласно примеру 4(2) смолы и 4-(N-фенетил-N-метиламинометил)анилина,Rf-значение: 0,50 (силикагель, метиленхлорид/метанол в соотношении 9:1),C27H28N4O2,масс-спектр: m/z = 441 (М+Н+);C25H30N4O2,масс-спектр: m/z = 418 (М+),Rf-значение: 0,26 (силикагель, метиленхлорид/метанол в соотношении 4:1). Пример 2. 3-Z-[1-(4-диэтилкарбамоилфениламино)-1 метилметилен]-5-амидо-2-индолинон 2 г смолы, полученной согласно примеру 4 б подвергают аналогично примеру 1 взаимодействию с 2 г этилового эфира 4 аминобензойной кислоты в диметилформамиде при 110 С. Влажную насыщенную смолу суспендируют в 15 мл диоксана и 15 мл метанола и перемешивают в течение 40 ч с 12 мл 1 н. едкого натра. Затем нейтрализуют разбавленной соляной кислотой и промывают метиленхлоридом,метанолом и диметилформамидом. После этого 300 мг смолы суспендируют в 3 мл диметилформамида и затем в течение 40 ч выдерживают при комнатной температуре вместе с 0,2 мл диэтиламина, 0,5 г ТБТУ (тетрафторборат Обензотриазол-1-ил-N,N,N',N'-1-тетраметилурония) и 0,8 мл N-этилдиизопропиламина. В завершение продукт аналогично примеру 1 отщепляют от смолы. Выход: 61 мг,Rf-значение: 0,30 (силикагель, метиленхлорид/метанол в соотношении 9:1),C22H24N4O3,масс-спектр: m/z = 392 (М+). Аналогично примеру 2 получают следующие соединения:(силикагель, метиленхлорид/метанол в соотношении 4:1),C22H24N4O3,масс-спектр: m/z = 392 (М+). Пример 3. 3-Z-[1-(4-(N-метил-N-бензоиламино)фениламино)-1-метилметилен]-5-амидо-2-индолинон 4,5 г полученной согласно примеру 4 б смолы подвергают аналогично примеру 1 взаимодействию с 3,4 г (4-(9 Н-флуорен-9 илметоксикарбонил)метиламино)анилина в диметилформамиде. Затем 9 Н-флуорен-9-илметоксикарбонильную группу отщепляют с помощью 40 мл 30%-ного пиперидина в диметилформамиде и смолу несколько раз промывают. После этого 400 мг смолы суспендируют в 4 мл диметилформамида и 0,3 мл триэтиламина и в течение 1 ч подвергают взаимодействию с 0,3 мл бензоилхлорида при комнатной температуре. В завершение продукт аналогично примеру 1 отщепляют от смолы с помощью трифторуксусной кислоты. Выход: 25 мг,Rf-значение: 0,51 (силикагель, метиленхлорид/метанол в соотношении 9:1),C30H24N4O3,масс-спектр: m/z = 426 (М+). Аналогично примеру 3 получают следующие соединения: 50 получение: аналогично примеру 3 взаимодействием с хлорангидридом фенилметансульфокислоты,Rf-значение: 0,43 (силикагель, метиленхлорид/метанол в соотношении 9:1),C25H24N4O4S,масс-спектр: m/z = 364 (М-Н+). Пример 4. Метиловый эфир 3-Z-[1-(4-(N-6 ензил-Nметиламинометил)фениламино)-1-метилметилен]-2-индолинон-5-карбоновой кислоты 8,0 г (28 ммолей) метилового эфира 1 ацетил-3-(1-этоксиметилметилен)-2-индолинон 5-карбоновой кислоты растворяют в 60 мл диметилформамида и в течение 6 ч перемешивают при 80 С с 6,3 г (28 ммолей) 4-(N-бензил-Nметиламинометил) анилина. Затем добавляют 30 мл концентрированного аммиака и выдерживают в течение 2 ч при 45 С. После этого раствор упаривают и остаток промывают этанолом и простым эфиром. В завершение хроматографируют в небольшой селикагельной колонке с помощью этилового эфира уксусной кислоты/этанола в соотношении 9:1. Выход: 8,6 г (70% от теории),tпл 150-152C,C27H27N3O3,масс-спектр: m/z = 442 (М+). Аналогично примеру 4 получают следующие соединения:C29H29N3O2,масс-спектр: m/z = 467 (М+). Пример 5. 3-Z-[1-(4-(N-бензил-N-метиламинометил) фениламино)-1-метилметилен]-2-индолинон-5 карбоновая кислота 2,3 г ( 5 ммолей) метилового эфира 3-Z-[1(4-(N-бензил-N-метиламинометил)фенилами 51 но)-1-метилметилен]-2-индолинон-5-карбоновой кислоты растворяют в 50 мл метанола и 50 мл диоксана и в течение 1 ч перемешивают при 70 С с 25 мл 1 н. едкого натра. Затем нейтрализуют с помощью 25 мл 1 н. соляной кислоты и концентрируют досуха. Остаток несколько раз промывают водой и сушат. Выход: 1,9 г (85% от теории),C26H25N3O3,масс-спектр: m/z = 428 (М+Н+). Аналогично примеру 5 получают следующие соединения:C28H27N3O3,масс-спектр: m/z = 453 (М+). Пример 6. 3-Z-[1-(4-(N-бензил-N-метиламинометил)фениламино)-1-метилметилен]-2-индолинон-5-диэтилкарбамоил-2-индолинон 0,3 г 3-Z-[1-(4-(N-бензил-N-метиламинометил)фениламино)-1-метилметилен]-2-индолинон-5-карбоновой кислоты растворяют с 1,2 г Nэтилдиизопропилэтиламина в 8 мл диметилформамида. Затем добавляют 0,1 г диэтиламина и 0,4 г ТБТУ (тетрафторборат O-бензотриазол 1-ил-N,N,N',N'-тетраметилурония) и перемешивают в течение 20 ч при комнатной температуре. После этого концентрируют и остаток суспендируют в воде и экстрагируют метиленхлоридом. Органическую фазу концентрируют и хроматографируют в силикагельной колонке с помощью метиленхлорида/этанола в соотношении 19:1. Выход: 0,2 г (68% от теории),Rf-значение: 0,36 (силикагель, метиленхлорид/этанол в соотношении 19:1),C30H34N4O2,масс-спектр: m/z = 482 (М+). Аналогично примеру 6 получают следующие соединения: (1) 3-Z-[1-(4-(пиперидинометил)фениламино)-1-метилметилен]-2-индолинон-5-диэтилкарбамоил-2-индолинон: получение: из полученного согласно примеру 5(1) соединения и диэтиламина, 003514(2) 3-Z-[1-(4-(N-метил-N-метилсульфониламино)фениламино)-1-метилметилен]-2-индолинон-5-диэтилкарбамоил-2-индолинон: получение: из полученного согласно примеру 5(4) соединения и диэтиламина,C23H28N4O4S,масс-спектр: m/z = 457 (М+Н+);(27) 3-Z-[1-фениламино-1-метилметилен]5-диэтилкарбамоил-2-индолинон. Пример 7. 3-Z-[1-(4-метил-3-аминофениламино)-1 метилметилен]-5-амидо-2-индолинон 130 мг 3-Z-[1-(4-метил-3-нитрофениламино)-1-метилметилен]-5-амидо-2-индолинона растворяют в 9 мл метанола и гидрируют при комнатной температуре в присутствии 50 мг никеля Ренея и давлении водорода 3 бара. Затем катализатор отфильтровывают и раствор концентрируют. Выход: 97 мг (70% от теории),Rf-значение: 0,60 (силикагель, метиленхлорид/этанол в соотношении 4:1),C18H18N4O2,масс-спектр: m/z = 322 (М+). Аналогично примеру 7 получают следующее соединение:(1) 3-Z-[1-(4-(пиперидинометил)-3-аминофениламино)-1-метилметилен]-5-амидо-2-индолинон: получение: из 3-Z-[1-(4-(пиперидинометил)-3-нитрофениламино)-1-метилметилен]-5-амидо-2-индолинона,Rf-значение: 0,15 (силикагель, метиленхлорид/этанол в соотношении 9:1),C23H27N5O2,масс-спектр: m/z = 406 (М+Н+). Пример 8. Ампула с сухим препаратом, содержащим 75 мг активного вещества из расчета на 10 мл Состав: Активное вещество Маннит Вода для инъекционных целей Получение: Активное вещество и маннит растворяют в воде. После заполнения ампулы проводят сушку вымораживанием. Для приготовления готового к использованию раствора разбавляют специальной водой для инъекционных целей. Пример 9. Ампула с сухим препаратом, содержащим 35 мг активного вещества из расчета на 2 мл Состав: Активное вещество Маннит Вода для инъекционных целей 54 Получение: Активное вещество и маннит растворяют в воде. После заполнения ампулы проводят сушку вымораживанием. Для приготовления готового к использованию раствора разбавляют специальной водой для инъекционных целей. Пример 10. Таблетка, содержащая 50 мг активного вещества Состав: Активное вещество Молочный сахар Кукурузный крахмал Поливинилпирролидон Стеарат магния Получение: Ингредиенты (1), (2) и (3) смешивают и гранулируют с использованием водного раствора ингредиента (4). К высушенному грануляту примешивают ингредиент (5). Из этой смеси прессуют таблетки в форме биплана с односторонней фасеткой и насечкой с обеих сторон. Диаметр таблеток: 9 мм. Пример 11. Таблетка, содержащая 350 мг активного вещества Состав: Активное вещество Молочный сахар Кукурузный крахмал Поливинилпирролидон Стеарат магния Получение: Ингредиенты (1), (2) и (3) смешивают и гранулируют с использованием водного раствора ингредиента (4). К высушенному грануляту примешивают ингредиент (5). Из этой смеси прессуют таблетки в форме биплана с односторонней фасеткой и насечкой с обеих сторон. Диаметр таблеток 12 мм. Пример 12. Капсулы, содержащие 50 мг активного вещества Состав: Активное вещество Кукурузный крахмал высушенный Молочный сахар порошкообразный Стеарат магния Получение: Ингредиент (1) растирают вместе с ингредиентом (3). Эту растертую массу добавляют при интенсивном перемешивании к смеси из ингредиентов (2) и (4). В завершение эту порошковую смесь с помощью соответствующего дозирующего устройства расфасовывают в капсулы размером 3 с твердым желатиновым покрытием. Пример 13. Капсулы, содержащие 350 мг активного вещества Состав: Активное вещество 350,0 мг Кукурузный крахмал высушенный 46,0 мг Молочный сахар порошкообразный 30,0 мг Стеарат магния 4,0 мг 430,0 мг Получение: Ингредиент (1) растирают вместе с ингредиентом (3). Эту растертую массу добавляют при интенсивном перемешивании к смеси из ингредиентов (2) и (4). В завершение эту порошковую смесь с помощью соответствующего дозирующего устройства расфасовывают в капсулы размером 0 с твердым желатиновым покрытием. Пример 14. Суппозитории, содержащие 100 мг активного вещества Состав одной свечи: Активное вещество Полиэтиленгликоль (мол. масса 1500) Полиэтиленгликоль (мол. масса 6000) Полиэтиленсорбитанмоностеарат Получение: Полиэтиленгликоль расплавляют совместно с полиэтиленсорбитанмоностеаратом. При температуре 40 С измельченную активную субстанцию диспергируют в расплаве до достижения гомогенности. Затем охлаждают до 38 С и разливают в предварительно слегка охлажденные формы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Замещенные индолиноны общей формулыX обозначает атом кислорода или серы,R1 обозначает атом водорода, С 1-С 4 алкоксикарбонильную или С 2-С 4 алканоильную группу,R2 обозначает карбокси- или С 1-С 4 алкоксикарбонильную группу либо необязательно замещенную одной или двумя C1-С 3 алкильными группами аминокарбонильную группу, при этом заместители могут быть идентичными или разными,R3 обозначает атом водорода или С 1 С 6 алкильную группу, которая начиная с положения 2 по отношению к атому углерода группы R3-C(R4NR5)= может быть замещена атомом фтора, хлора либо брома, гидрокси-, C1-С 3 алкокси-, C1-С 3 алкилсульфенильной, C1-С 3 алкилсульфинильной, C1-С 3 алкилсульфонильной, фенилсульфенильной, фенилсульфинильной, фенилсульфонильной,амино-,C1-С 3 алкиламино-, ди(С 1-С 3 алкил)амино-, С 2-С 5 алкано 56 иламино- или N-(C1-С 3 алкиламино)-С 2-С 5 алканоиламиногруппой,R4 обозначает атом водорода, C1 С 6 алкильную группу или необязательно замещенную C1-С 3 алкильной группой С 5-С 7 циклоалкильную группу, в которой метиленовая группа в положении 3 либо 4 по отношению к атому углерода группы R3-C(R4NR5)= может быть заменена на необязательно замещеннуюC1-С 3 алкильной группой иминогруппу,или обозначает фенильную или нафтильную группу, которые могут быть замещены атомом фтора, хлора, брома либо иода,необязательно замещенной 1-3 атомами фтора метоксигруппой,С 2-С 3 алкоксигруппой, которая в положении 2 либо 3 может быть замещена C1 С 3 алкиламино-, ди(С 1-С 3 алкил)амино- или 5-7 членной циклоалкилениминогруппой, при этом дополнительно один алкильный фрагмент в вышеназванных алкиламино- и диалкиламиногруппах может быть соответственно замещен фенильной группой,трифторметильной, амино-, C1-С 3 алкиламино-, ди(С 1-С 3 алкил)амино-, С 2-С 5 алканоиламино-, N-(С 1-С 3 алкил)-С 2-С 5 алканоиламино-,C1-С 5 алкилсульфониламино-, N-(C1-С 3 алкил)С 1-С 5 алкилсульфониламино-, фенилсульфониламино-, N-(C1-С 3 алкил)фенилсульфониламино-,аминосульфонильной, C1-С 3 алкиламиносульфонильной или ди(C1-С 3 алкил)аминосульфонильной группой, при этом дополнительно один алкильный фрагмент в вышеназванных алкиламино- и диалкиламиногруппах может быть соответственно замещен фенильной группой,карбонильной группой, замещенной гидрокси-, C1-С 3 алкокси-, амино-, C1-С 3 алкиламиноили N-(С 1-С 5 алкил)-С 1-С 3 алкиламиногруппой,при этом дополнительно один алкильный фрагмент в вышеназванных группах может быть соответственно замещен карбокси-, C1-С 3 алкоксикарбонильной либо фенильной группой или в положении 2 либо 3 ди(C1-С 3 алкил)аминопиперазиновой, N-(С 1-С 3 алкил)пиперазиновой или 5-7-членной циклоалкилениминогруппой,С 1-С 3 алкильной группой, замещенной амино-, C1-С 7 алкиламино-, С 5-С 7 циклоалкиламино-,C5-С 7 циклоалкил-C1-С 3 алкиламино- либо фенил-С 1-С 3 алкиламиногруппой, которые дополнительно у атома аминового азота могут быть замещены соответственно С 1-С 3 алкильной группой, в которой атомы водорода частично либо полностью заменены на атомы фтора, С 5 С 7 циклоалкильной, С 2-С 4 алкенильной или С 1 С 4 алкильной группой, при этом указанный выше C1-С 4 алкильный заместитель дополнительно может быть замещен соответственно циано-,карбокси-, C1-С 3 алкоксикарбонильной, пиридильной, имидазолильной, бензо[1,3]диоксолили фенильной группой, при этом фенильная группа может быть одно-, дву- либо тризамещенной атомами фтора, хлора или брома, ме 57 тильной, метокси-, трифторметильной, цианолибо нитрогруппой и заместители могут быть идентичными или разными, или же в положении 2, 3 либо 4 может быть замещен гидроксигруппой,C1-С 3 алкильной группой, которая может быть замещена гидрокси-, карбокси-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1 диоксидотиоморфолиновой, пиперазиновой, N(С 1-С 3 алкил)пиперазиновой либо N-фенилпиперазиновой группой, 5-7-членной циклоалкенилениминогруппой либо 4-7-членной циклоалкилениминогруппой, при этом вышеназванные 57-членные циклоалкилениминогруппы могут быть замещены одной либо двумя C1 С 3 алкильными группами, С 5-С 7 циклоалкильной либо фенильной группой, C1-С 3 алкил-, C5 С 7 циклоалкил-, фенил-, карбокси- либо C1 С 4 алкоксикарбонильной группой и гидроксигруппой, а одна смежная с атомом азота метиленовая группа в составе вышеназванных циклоалкилениминогрупп может быть заменена на карбонильную группу,C1-С 3 алкильной группой, замещенной 5-7 членной циклоалкилениминогруппой, при этом с вышеназванными 5-7-членными циклоалкилениминогруппами через 2 смежных атома углерода сконденсирована необязательно одно- либо двузамещенная атомами фтора, хлора или брома, метальными или метоксигруппами фенильная группа, где заместители могут быть идентичными либо разными, или необязательно замещенная атомом фтора, хлора,брома либо иода, метильной, метокси- либо аминогруппой оксазоловая, имидазоловая, тиазоловая,пиридиновая, пиразиновая или пиримидиновая группа,при этом указанные выше однозамещенные фенильные группы дополнительно могут быть замещены атомом фтора, хлора либо брома, метильной, метокси- либо нитрогруппой,или обозначает 5-членную гетероароматическую группу, содержащую иминогруппу,один атом кислорода либо серы или иминогруппу,один атом кислорода либо серы и один либо два атома азота,или обозначает 6-членную гетероароматическую группу, содержащую один, два либо три атома азота, при этом вышеуказанные 5- и 6-членные гетероароматические группы дополнительно могут быть замещены атомом хлора либо брома или метильной группой или с указанными 5- и 6-членными гетероароматическими группами через два смежных атома углерода может быть сконденсировано фенильное кольцо, иR5 обозначает атом водорода или C1 С 3 алкильную группу, при условии, что когда X обозначает атом кислорода и R1 и R5 каждый обозначает атом водорода, R4 не может означать фенильную группу, которая замещена C1-С 3 алкиламино,ди(С 1-С 3 алкил)амино,С 1-С 5 алкилсульфониламино,фенилсульфониламино,аминосульфонил, C1-С 3 алкиламиносульфонил, 003514 58 ди(C1-С 3 алкил)аминосульфонил или N-(С 1-С 5 алкил)-С 1-С 3 алкиламинокарбонильной группой,при этом имеющиеся карбокси-, аминоили иминогруппы могут быть замещены отщепляемыми в физиологических условиях группами,их энантиомеры и/или диастереомеры и их соли. 2. Замещенные индолиноны общей формулы I по п.1, в которыхX обозначает атом кислорода,R1 обозначает атом водорода,R2 обозначает аминокарбонильную группу,R3 обозначает атом водорода или С 1 С 4 алкильную группу, которая начиная с положения 2 по отношению к атому углерода группы R3-C(R4NR5)= может быть замещена атомом хлора либо брома или фенилсульфонильной группой,R4 обозначает атом водорода, С 1 С 3 алкильную группу или необязательно замещенную метильной группой циклопентильную либо циклогексильную группу, при этом в циклопентильной и циклогексильной группах метиленовая группа в положении 3 либо 4 по отношению к атому углерода группы R3C(R4NR5)= может быть заменена на необязательно замещенную метильной группой иминогруппу,или обозначает фенильную группу, которая может быть замещена атомом фтора, хлора, брома либо иода,необязательно замещенной 1-3 атомами фтора метоксигруппой,С 2-С 3 алкоксигруппой, замещенной в положении 2 либо 3 метиламино-, диметиламиноили 5-7-членной циклоалкилениминогруппой,при этом дополнительно одна метильная группа в составе вышеназванных аминогрупп может быть соответственно замещена фенильной группой,трифторметильной, амино-, С 2-С 5 алканоиламино-, N-(C1-С 3 алкил)-С 2-С 5 алканоиламино-, С 1-С 5 алкилсульфониламино-, N-(C1-С 3 алкил)-С 1-С 5 алкилсульфониламино-, фенилсульфониламино-, N-(C1-С 3 алкил)фенилсульфониламино- или аминосульфонильной группой, при этом дополнительно один алкильный фрагмент в вышеназванных алкиламино- и диалкиламиногруппах может быть соответственно замещен фенильной группой,карбонильной группой, замещенной гидрокси-, C1-С 3 алкокси-, амино-, C1-С 3 алкиламиноили N-(С 1-С 5 алкил)-С 1-С 3 алкиламиногруппой,при этом дополнительно один алкильный фрагмент в вышеназванных группах может быть соответственно замещен карбокси-, C1-С 3 алкоксикарбонильной либо фенильной группой или в положении 2 либо 3 -ди(C1 С 3 алкил)амино-, пиперазиновой, N-(C1-С 3 алкил)пиперазиновой или 5-7-членной циклоалкилениминогруппой, 59C1-С 3 алкильной группой, замещенной амино-,C1-С 7 алкиламино-, С 5-С 7 циклоалкиламино-, С 5 С 7 циклоалкил-C1-С 3 алкиламино- либо фенил-C1 С 3 алкиламиногруппой, которые дополнительно у атома аминового азота могут быть замещены соответственно C1-С 3 алкильной группой, в которой атомы водорода частично либо полностью замещены на атомы фтора, С 5-С 7 циклоалкильной, С 2 С 4 алкенильной или С 1-С 4 алкильной группой,при этом указанный выше С 1-С 4 алкильный заместитель дополнительно может быть замещен соответственно циано-,карбокси-,C1 С 3 алкоксикарбонильной, пиридильной, имидазолильной, бензо[1,3]диоксол- или фенильной группой, при этом фенильная группа может быть однозамещенной атомом фтора, хлора либо брома, метильной, метокси-, циано-, трифторметильной либо нитрогруппой или дву- либо тризамещенной атомами фтора, хлора либо брома, метильными либо метоксигруппами и заместители могут быть идентичными или разными, или в положении 2, 3 либо 4 может быть замещен гидроксигруппой,C1-С 3 алкильной группой, которая может быть замещена гидрокси-, карбокси-, тиоморфолиновой,1-оксидотиоморфолиновой, 1,1-дио-ксидотиоморфолиновой,пиперазиновой,N-(С 1-С 3 алкил)пиперазиновой либо N-фенилпиперазиновой группой, 5-7-членной циклоалкенилениминогруппой либо 4-7-членной циклоалкилениминогруппой, при этом вышеназванные 5-7-членные циклоалкилениминогруппы могут быть замещены одной либо двумя C1-С 3 алкильными группами, циклогексильной либо фенильной группой, C1-С 3 алкил-, циклогексил-, фенил-, карбокси- либо С 1-С 4 алкоксикарбонильной группой и гидроксигруппой, а одна смежная с атомом азота метиленовая группа в составе вышеназванных циклоалкилениминогрупп может быть заменена на карбонильную группу,C1-С 3 алкильной группой, замещенной 5-7 членной циклоалкилениминогруппой, при этом с вышеназванными 5-7-членными циклоалкилениминогруппами через 2 смежных атома углерода может быть сконденсирована необязательно однолибо двузамещенная атомами фтора, хлора либо брома, метильными либо метоксигруппами фенильная группа, где заместители могут быть идентичными либо разными, или необязательно замещенная аминогруппой пиразиновая или тиазоловая группа,при этом дополнительно вышеуказанные однозамещенные фенильные группы могут быть замещены атомом фтора, хлора либо брома, метильной, метокси- либо нитрогруппой,или обозначает необязательно замещенную атомом хлора либо брома или метильной группой пиридильную группу,или обозначает необязательно замещенную метильной группой оксазолильную, изоксазолильную, имидазолильную или тиазолильную группу, с которой через 2 смежных атома углерода может быть сконденсировано фенильное кольцо, иR5 обозначает атом водорода или C1 С 3 алкильную группу, при условии, что когда X обозначает атом кислорода и R1 и R5 каждый обозначает атом водорода, R4 не может означать фенильную группу, которая замещена C1 С 5 алкилсульфониламино, фенилсульфониламино,аминосульфонил или N-(С 1-С 5 алкил)-C1-С 3 алкиламинокарбонильной группой,их энантиомеры и/или диастереомеры и их соли. 3. Замещенные индолиноны общей формулы I по п.1 или 2, в которых R2 находится в положении 5, их энантиомеры и/или диастереомеры и их соли. 4. Замещенные индолиноны общей формулы I по п.1, в которыхX обозначает атом кислорода,R1 обозначает атом водорода,R2 в положении 5 обозначает аминокарбонильную группу,R3 обозначает атом водорода или С 1 С 4 алкильную группу, которая в концевом положении может быть замещена атомом хлора либо брома или фенилсульфонильной группой,R4 обозначает атом водорода, C1-С 3 алкильную группу или необязательно замещенную метильной группой циклопентильную либо циклогексильную группу, при этом в циклогексильной группе метиленовая группа в положении 4 по отношению к атому углерода группы R3-C(R4NR5)= может быть заменена на необязательно замещенную метильной группой иминогруппу, или обозначает фенильную группу, которая может быть замещена атомом фтора, хлора, брома либо иода; метильной либо этильной группой, которые могут быть замещены соответственно C1-С 3 алкиламино-, ди(C1-С 3 алкил)амино-, тиоморфолиновой, 1-оксидотиоморфолиновой, 1,1-диоксидотиоморфолиновой, N-фенилпиперазиновой, 5-6 членной циклоалкенилениминогруппой либо 5-7 членной циклоалкилениминогруппой, при этом вышеназванные 5-7-членные циклоалкилениминогруппы могут быть замещены одной либо двумя метильными группами, циклогексильной либо фенильной группой, метильной, циклогексильной либо фенильной группой и гидроксигруппой, или метильной либо этильной группой, которые могут быть соответственно замещены фенильной группой, замещенной 5-7-членной циклоалкилениминогруппой, при этом дополнительно с указанными выше циклоалкилениминогруппами через 2 смежных атома углерода сконденсировано фенильное кольцо,метильной либо этильной группой, замещенных амино-, метиламино- либо этиламиногруппой,которые дополнительно у атома аминового азота замещены соответственно бензильной либо фенилэтильной группой, при этом фенильный фрагмент в составе вышеназванных групп может быть соответственно однозамещенным атомом фтора, хлора либо брома, метильной, метокси-, циано-, трифторметильной либо нитрогруппой или может быть двуили тризамещенным атомами фтора, хлора либо
МПК / Метки
МПК: A61P 35/00, A61K 31/4045, C07D 209/34
Метки: средств, лекарственных, индолиноны, замещенные, применение, получение, качестве
Код ссылки
<a href="https://eas.patents.su/30-3514-zameshhennye-indolinony-ih-poluchenie-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные индолиноны, их получение и их применение в качестве лекарственных средств</a>
Предыдущий патент: Гетероциклические соединения как ингибиторы ферментов ротамаз
Следующий патент: Новый способ получения изоиндолина
Случайный патент: Профильная рельсовая система












