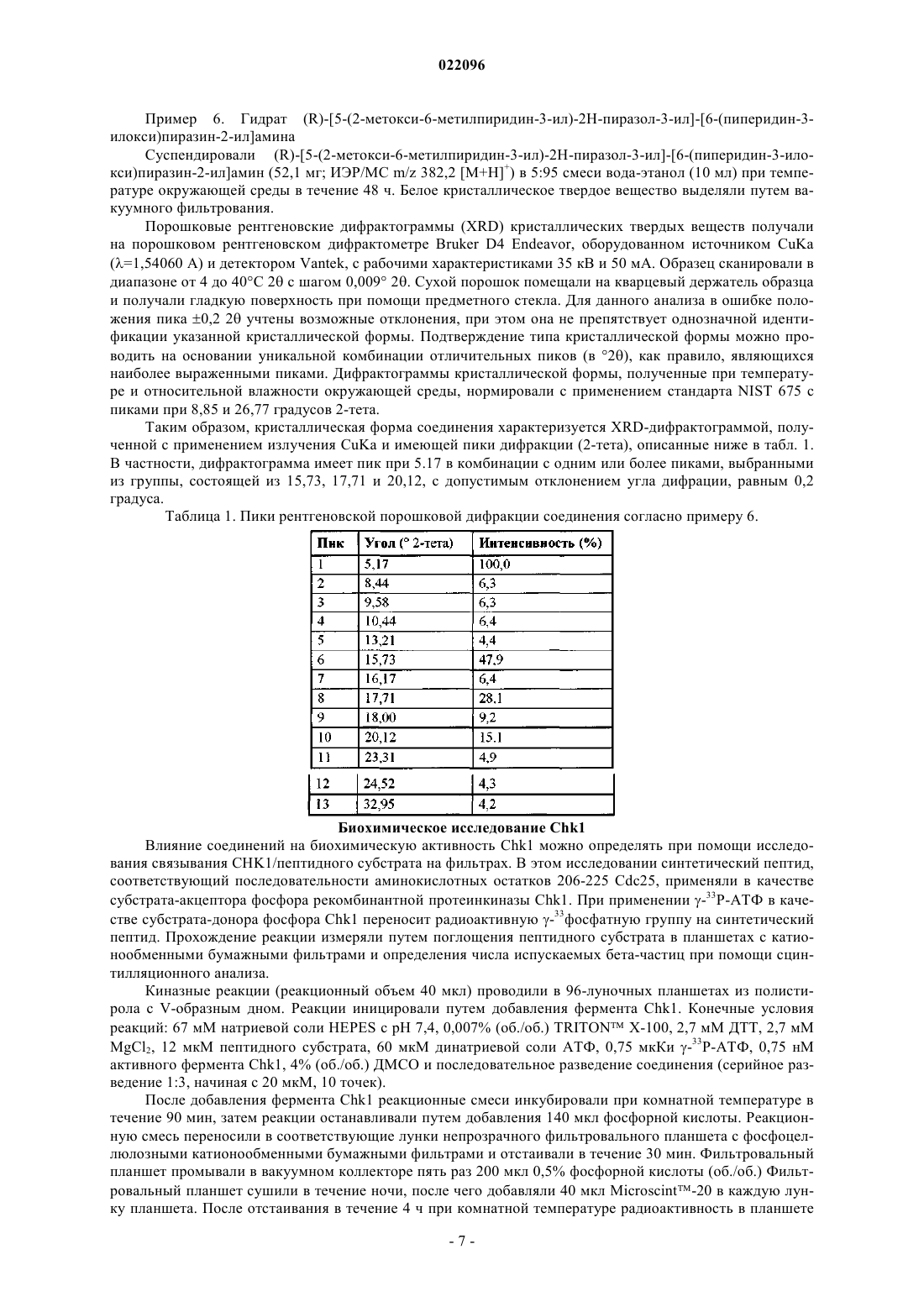
Соединения, подходящие для ингибирования chk1
Формула / Реферат
1. Соединение, представляющее собой (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемую соль.
2. Соединение по п.1, представляющее собой (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амин.
3. Соединение по п.1, представляющее собой метансульфокислую соль (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина.
4. Соединение по п.1, представляющее собой уксуснокислую соль (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина.
5. Соединение по п.1, представляющее собой гемиоксалат (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина.
6. Соединение по п.1, представляющее собой гемисукцинат (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина.
7. Фармацевтическая композиция для ингибирования Chk1, содержащая соединение или фармацевтически приемлемую соль по любому из пп.1-6 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
8. Применение соединения или фармацевтически приемлемой соли по любому из пп.1-6 для лечения рака.
9. Применение по п.8, где лечение осуществляется одновременно, раздельно или последовательно в комбинации с ионизирующим излучением.
10. Применение по п.8, где лечение осуществляется одновременно, раздельно или последовательно в комбинации с одним или более химиотерапевтическими агентами.
11. Применение по п.10, отличающееся тем, что один или более химиотерапевтических агентов выбраны из группы, состоящей из 5-фторурацила, гидроксимочевины, гемцитабина, метотрексата, пеметрекседа, доксорубицина, этопозида, цисплатина и таксола.
12. Применение по любому из пп.8-11, отличающееся тем, что рак выбран из группы, состоящей из рака мочевого пузыря, рака толстой кишки, рака желудка, рака печени, рака легкого, рака молочной железы, меланомы, рака яичников, рака поджелудочной железы, мезотелиомы, рака почки и рака матки.
Текст
СОЕДИНЕНИЯ, ПОДХОДЯЩИЕ ДЛЯ ИНГИБИРОВАНИЯ CHK1 В настоящем изобретении предложено аминопиразольное соединение, или его фармацевтически приемлемая соль, которое ингибирует Chk1 и подходит для лечения рака.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Настоящее изобретение относится к аминопиразольному соединению, или его фармацевтически приемлемой соли, которое ингибирует Chk1 и подходит для лечения раковых заболеваний, характеризующихся нарушениями репликации дезоксирибонуклеиновой кислоты (ДНК), сегрегации хромосом и/или делении клеток.Chk1 представляет собой протеинкиназу, которая расположена ниже Atm и/или Atr в пути сигнальной трансакции контрольной точки повреждения ДНК В клетках млекопитающих Chk1 фосфорилируется в ответ на действие агентов, которые вызывают повреждения ДНК, включая ионизирующее излучение(ИИ), ультрафиолетовое (УФ) излучение и гидроксимочевину Указанное фосфорилирование, активирующее Chk1 в клетках млекопитающих, зависит от Atr Chk1 участвует в Atr-зависимом контроле повреждений ДНК, приводя к остановке клеточного цикла в фазах S и G2M Chk1 фосфорилирует и инактивирует Cdc25A -фосфатазу двойной специфичности, которая обычно дефосфорилирует циклин E/Cdk2 и тем самым останавливает клеточный цикл в S-фазе. Chk1 также фосфорилирует и инактивирует Cdc25C фосфатазу двойной специфичности, которая дефосфорилирует циклин B/Cdc2 (также известный какCdkl) и тем самым останавливает клеточный цикл на границе G2 и митоза (Furnari et al., Science, 277 1495-7, 1997). В обоих случаях регуляция активности Cdk приводит к остановке клеточного цикла и предотвращает митоз клеток при наличии повреждения ДНК или нереплицированной ДНК. Сообщалось о различных ингибиторах Chk1. Кроме того, в WO 2005/121121 предложены конкретные аминопиразолы, рассматриваемые в качестве модуляторов метаболизма глюкозы. Тем не менее, сохраняется потребность в ингибиторах Chk1, являющихся высокоактивными ингибиторами контрольных точек клеточного цикла и способных эффективно действовать в качестве усилителей ДНК-повреждающих агентов. В настоящем изобретении предложены соединения, являющиеся высокоактивными ингибиторами Chk1, которые могут оказывать положительный эффект при лечении рака. Указанные соединения активно предотвращают опосредованную Chk1 остановку клеточного цикла,вызванную введением ДНК-повреждающих агентов в тканевую культуру и in vivo. Кроме того, соединения согласно настоящему изобретению обеспечивают ингибирование Chk2, которое может иметь благоприятный эффект при лечении рака. Кроме того, соединения согласно настоящему изобретению ингибируют пролиферацию раковых клеток за счет механизма, зависимого от ингибирования Chk1. Указанные новые соединения могут решить проблему безопасного и эффективного способа лечения рака. В настоящем изобретении предложено соединение, которое представляет собой (R)-[5-(2-метокси 6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемую соль. Предпочтительными вариантами реализации являются (R)-[5-(2-метокси-6 метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амин, метансульфокислая соль(R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2 ил]амина, уксуснокислая соль (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин 3-илокси)пиразин-2-ил]амина, гемиоксалат (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил][6-(пиперидин-3-илокси)пиразин-2-ил]амина и гемисукцинат (R)-[5-(2-метокси-6-метилпиридин-3-ил)2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина. В качестве конкретного варианта реализации в настоящем изобретении предложено соединение,которое представляет собой (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3 илокси)пиразин-2-ил]амин. В настоящем изобретении предложены метансульфокислые соли, уксуснокислые соли, а также гемиоксалаты и гемисукцинаты (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин 3-илокси)пиразин-2-ил] амина. Другой вариант реализации представляет собой гидрат (R)-[5-(2-метокси-6-метилпиридин-3-ил)2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина. В настоящем изобретении предложен гидрат (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол 3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина в кристаллической форме. В настоящем изобретении также предложен гидрат (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Нпиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина в кристаллической форме, характеризующийся порошковой рентгеновской дифрактограммой, имеющей пик 20,2 при 5,17 в комбинации с одним или более пиками, выбранными из группы, состоящей из 15,73, 17,71 и 20,12. В настоящем изобретении предложена фармацевтическая композиция, содержащая (R)-[5-(2 метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или наполнитель. В настоящем изобретении предложена фармацевтическая композиция, содержащая (R)-[5-(2 метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем, разбавителем или наполнителем и, возможно, с другими терапевтическими ингредиентами. В настоящем изобретении предложено применение (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Нпиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака. В дополнение, в настоящем изобретении также предложено применение (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3 илокси)пиразин-2-ил]амина или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака, где указанное лечение включает комбинированную терапию с применением ионизирующего излучения. Кроме того, в настоящем изобретении предложено применение (R)-[5-(2 метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака при помощи комбинированной терапии, где указанная комбинированная терапия включает введение указанного лекарственного средства и введение одного или более химиотерапевтических агентов одному пациенту. В настоящем изобретении предложен (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил][6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемая соль для применения в терапии. В дополнение, в настоящем изобретении также предложены (R)-[5-(2-метокси-6 метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемая соль и ионизирующее излучение для применения в терапии. Кроме того, в настоящем изобретении предложены (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-16-(пиперидин-3 илокси)пиразин-2-ил]амин или его фармацевтически приемлемая соль и один или более химиотерапевтических агентов для применения в терапии. В настоящем изобретении предложен (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил][6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемая соль для применения для лечения рака. В дополнение, в настоящем изобретении также предложены (R)-[5-(2-метокси-6 метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемая соль и ионизирующее излучение для применения для лечения рака. Кроме того, в настоящем изобретении предложены (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемая соль и один или более химиотерапевтических агентов для применения для лечения рака. В настоящем изобретении предложено применение (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Нпиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака, причем указанное лекарственное средство необходимо вводить одновременно, раздельно или последовательно с ионизирующим излучением. В настоящем изобретении предложено применение (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Нпиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака, прчем указанное лекарственное средство также содержит один или более химиотерапевтических агентов, или его необходимо вводить одновременно,раздельно или последовательно с одним или более химиотерапевтическими агентами. В настоящем изобретении предложен (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил][6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемая соль для одновременного, раздельного или последовательного применения в комбинации с ионизирующим излучением для лечения рака. В настоящем изобретении предложен (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил][6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемая соль для одновременного, раздельного или последовательно применения в комбинации с одним или более химиотерапевтическими агентами для лечения рака. Кроме того, в настоящем изобретении предложены предпочтительные варианты реализации применений, описанных в настоящей заявке, в которых один или более химиотерапевтических агентов выбраны из группы, состоящей из 5-фторурацила, гидроксимочевины, гемцитабина, метотрексата, пеметрекседа, доксорубицина, этопозида, цисплатина и таксола. В дополнение, в настоящем изобретении предложены более предпочтительные варианты реализации применений, описанных в настоящей заявке, в которых два химиотерапевтических агента выбраны из группы, состоящей из 5-фторурацила. гидроксимочевины, гемцитабина, метотрексата, пеметрекседа, доксорубицина, этопозида, цисплатина и таксола. Также в настоящем изобретении предложены еще более предпочтительные варианты реализации применений, описанных в настоящей заявке, в которых химиотерапевтический агент выбран из группы, состоящей из 5-фторурацила, гидроксимочевины, гемцитабина, метотрексата, пеметрекседа, доксорубицина, этопозида, цисплатина и таксола. Предпочтительные варианты реализации применений, описанных в настоящей заявке, направлены на раковые заболевания, выбранные из группы, состоящей из рака мочевого пузыря, рака толстой кишки, рака желудка, рака печени, рака легкого, рака молочной железы, меланомы, рака яичников, рака поджелудочной железы, мезотелиомы, рака почки и рака матки. Следует понимать, что используемые выше и далее в описании изобретения следующие термины,если не указано иное, имеют следующие значения:"Фармацевтически приемлемая соль" или "фармацевтически приемлемые соли" относятся к относительно нетоксичным неорганическим и органическим солям соединений согласно настоящему изобретению. Соединения согласно настоящему изобретению способны взаимодействовать, например, с рядом неорганических и органических кислот, с образованием фармацевтически приемлемых солей. Указанные фармацевтически приемлемые соли и общие способы их получения хорошо известны в данной области техники. См., например, Р. Stahl et al., Handbook of Pharmaceutical Salts Properties, Selection, and Use,(VCHA/Wiley-VCH, 2002), S. M. Berge et al., "Pharmaceutical Salts", Journal of Pharmaceutical Sciences, Vol 66, No 1, January 1977. Соединения согласно настоящему изобретению предпочтительно получают в виде фармацевтических композиций с применением одного или более фармацевтически приемлемых носителей, разбавителей или наполнителей и вводят при помощи различных способов. Предпочтительно такие композиции предназначены для перорального, подкожного или внутривенного введения. Такие фармацевтические композиции и способы их получения хорошо известны в данной области техники. См., например, Remington The Science and Practice of Pharmacy (A. Gennaro et al., eds, 21st ed, Mack Publishing Co, 2005). Подразумевается, что термины "лечение", "лечить", "излечение" и т.д. включают замедление или обращение вспять прогрессирования нарушения. Указанные термины также включают облегчение,улучшение, смягчение, устранение или снижение тяжести одного или более симптомов нарушения или состояния, даже если указанное нарушение или состояние фактически не устраняется и даже если прогрессирование указанного нарушения или состояния как таковое не замедляется или не обращается вспять. Терапевтически эффективное количество или эффективное количество означает количество соединения или его фармацевтически приемлемой соли согласно настоящему изобретению или фармацевтической композиции, содержащей соединение или его фармацевтически приемлемую соль, согласно настоящему изобретению, которое будет вызывать биологический или медицинского ответа или желаемое терапевтическое действие на ткань, систему организма, животное, млекопитающее или человека,которого добиваются исследователи, ветеринары, врачи или другие клиницисты. Фактическое вводимое количество соединения согласно настоящему изобретению будет определяться лечащим врачом с учетом соответствующих условий, включая состояние, требующее лечения,выбранный способ введения, фактическое вводимое соединение согласно настоящему изобретению, возраст, массу тела и реакцию индивидуального пациента и тяжесть симптомов пациента. Ежедневные дозировки, как правило, находятся в диапазоне от примерно 0,1 до примерно 10 мг/кг массы тела. В некоторых случаях дозировки ниже нижнего предела вышеуказанного диапазона могут быть более чем достаточными, в то же время в других случаях необходимо применять дозы, превышающие верхнюю границу указанного диапазона. Соединения согласно настоящему изобретению можно получать при помощи ряда способов, известных в данной области техники, а также описанных ниже в примерах получения и примерах. Конкретные стадии синтеза каждого описанного способа можно объединять различным образом для получения соединений согласно настоящему изобретению. Реагенты и исходные вещества, как правило, легкодоступны специалистам в данной области техники. Другие можно получить при помощи традиционных способов органической химии и химии гетероциклических соединений; способов, аналогичных примерам синтеза известных соединений со схожей структурой, и способов, описанных в последующих примерах получения и примерах, включая любые новые способы. Приведенные ниже примеры получения и примеры предложены для подробной дополнительной иллюстрации настоящего изобретения и представляют собой типовые способы синтеза указанных соединений. Названия соединений согласно настоящему изобретению получали в ISIS Draw 2.5SP2 при помощи встроенного инструмента Autonom. Используемые в настоящем описании следующие термины имеют указанные значения: "БХК" относится к бицинхониновой кислоте; "БСА" относится к бычьему сывороточному альбумину; "ДМСО" относится к диметилсульфоксиду; "DPBS" относится к буферному раствору на основе двухосновного фосфата; "ДТТ" относится к дитиотреитолу, "EtOAc" относится к этилацетату; "ЭБС" относится к эмбриональной бычьей сыворотке, "HEPES" относится к N-2-гидроксиэтилпиперазин-N'-2 этансульфокислоте, "MEM" относится к минимально обогащенной среде, "МеОН" относится к метанолу,"ФБР" относится к фосфатному буферному раствору, "PI" относится к йодиду пропидия, "РНКаза" относится к рибонуклеазе A, "RPMI" означает Мемориальный институт Розуэлл-Парка (Roswell Park Memorial Institute), "TBST" относится к трис-буферному раствору Tween-20, "ТГФ" относится к тетрагидрофурану, "TR-FRET" относится к резонансному переносу энергии флуоресценции с разрешением по времени. "Tris" относится к трис(гидроксиметил)аминометану, "Tnton-X" относится к трет-октилфениловому эфиру 4-(1,1,3,3-тетраметилбутил)фенилполиэтиленгликоля и m-октилфеноксиполиэтоксиэтанолполиэтиленгликоля, и "Tween-20" относится к полисорбату 20. Пример получения 1. Трет-бутил-(R)-3-(6-хлорпиразин-2-ил)оксипиперидин-1-карбоксилат Гидрид натрия (225,6 г, 5,64 моль) диспергировали в ТГФ (3 л) и температуру понижали до 0-5 С. Раствор (R)-3-гидрокси-1-ВОС-пиперидина (891,6 г, 4,43 моль) в ТГФ (3 л) добавляли в течение 1 ч, поддерживая температуру в диапазоне 0-5 С. Реакционную смесь перемешивали в течение 1 ч. 2,6 дихлорпиразин (600 г, 4,03 моль) в виде раствора в ТГФ (3 л) добавляли по каплям в течение 1,5 ч, поддерживая указанную температуру. Реакционную смесь перемешивали в течение 2 ч при 25-30 С, затем выливали в лед. Смесь разбавляли водой и экстрагировали этилацетатом. Экстракты сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаточную маслянистую жидкость растирали с 5% дихлорметаном в гексане с получением продукта в виде белого твердого вещества. Твердое вещество собирали путем фильтрования и сушили с получением 1538 г неочищенного вещества. Неочищенный продукт снова растирали с 5% дихлорметаном в гексане с получением белого твердого вещества с количественным выходом ИЭР/MC m/z 314,1 [М+Н]+. Пример получения 2. Метиловый эфир 2-метокси-6-метилникотиновой кислоты В перемешиваемый раствор метилового эфира 2-хлор-6-метилникотиновой кислоты (10,4 г, 56,52 ммоль) в МеОН в атмосфере азота добавляли раствор натрия (2,58 г, 113.04 ммоль) в метаноле (80,0 мл)(металлический натрий растворяли в метаноле в атмосфере азота) при комнатной температуре. Реакционную смесь кипятили с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры и рН доводили до 7 при помощи уксусной кислоты. Реакционную смесь разбавляли этилацетатом (100 мл) и водой (30 мл). Органический слой отделяли, а водный слой экстрагировали этилацетатом (275 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Выход 7,25 г (71%). 1 Н ЯМР (400 МГц, CDCl3),8,066-8,047 (d,J = 7,6 Гц, 1 Н), 6,782-6,764 (d, J = 7,2 Гц, 1H), 4,029 (s,3H), 3,879 (s, 3H), 2,483 (s, 3H), ИЭР/МС m/z 182,2 [М+Н]+. Пример получения 3. 5-(2-Метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-иламин(300 мл) при -78 С и оставляли перемешиваться в течение 30 мин при -78 С. Метиловый эфир 2-метокси 6-метилникотиновой кислоты (20 г. 105,1 ммоль) в ТГФ (200 мл) добавляли и перемешивали при -78 С в течение еще 30 мин. Реакцию гасили при -78 С водой (500 мл) и смесь промывали EtOAc (2250 мл). Водный слой отделяли и упаривали. Полученное вещество дважды перегоняли с толуолом с получением 3-(2-метокси-6-метилпиридин-3-ил)-3-оксопропионитрила. Выход = 21,4 г (неочищенное вещество) ИЭР/МС m/z 191,1 [М+Н]+. Раствор 3-(2-метокси-6-метилпиридин-3-ил)-3-оксопропионитрила (21 г, 110,4 ммоль) в этаноле(21,0 мл) добавляли и реакционную смесь грели при 100 С в течение 2 ч. Растворитель выпаривали и реакционную смесь разбавляли EtOAc (500 мл) и насыщенным раствором бикарбоната натрия (100 мл). Органический слой отделяли и водный слой экстрагировали EtOAc (2250 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта, который использовали на следующей стадии без дополнительной очистки. Выход = 16,5 г (73%). 1 Н ЯМР (400 МГц, ДМСО-d6)11,50 (bs, 1H), 7,90 (d, J =7,6 Гц, 1H), 6,86 (d, J = 7,6 Гц, 1H), 5,88 (s,1H), 4,64 (s, 2H), 3,91 (s, 3H), 2,38 (s, 3H). Пример получения 4. Трет-бутиловый эфир 5-амино-3-(2-метокси-6-метилпиридин-3-ил)пиразол-1 карбоновой кислоты Раствор 5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-иламина (16,0 г, 78,3 ммоль) в ТГФ (200 мл) медленно добавляли в перемешиваемую суспензию NaH (60% в минеральном масле, 3,4 г, 85,0 ммоль) в ТГФ (200 мл) при 0 С. Через 15 мин выдерживания при 0 С ди-трет-бутилдикарбонат (19,8 мл,86 ммоль) медленно добавляли в реакционную смесь и перемешивали при 0 С в течение 30 мин. Реакцию гасили ледяной водой (примерно 250 мл) и продукт экстрагировали этилацетатом (2500 мл). Объединенные органические фракции промывали водой и насыщенным раствором NaCl (200 мл), сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением неочищенного вещества. Полученное вещество дважды растирали с гексаном с получением 18,5 г (78%) соединения, указанного в заголовке. 1(85,5 г, 263 ммоль) в 1,4-диоксане (1,4 л) в равных частях помещали в две круглодонные колбы, расположенных рядом, и каждую из них продували аргоном в течение 2 ч Pd(OAc)2 (5,4 г, 24,6 ммоль) добавляли (по половине от этого количества в каждый сосуд) и продували в течение еще 1 ч. Реакционные смеси затем нагревали при 90-95 С в течение 1 ч. Реакционные смеси охлаждали до комнатной температуры, объединяли и разбавляли этилацетатом (1 л). Смесь затем фильтровали через диатомитовую землю, промывали этилацетатом и фильтрат концентрировали. Неочищенный продукт очищали на силикагеле с применением 15% EtOAc/гексан в качестве элюента с получением 55 г (выход 57%) белого порошка 55 г очищенного продукта, объединяли с 15 г аналогично полученного и очищенного вещества(полученного из 20 г трет-бутилового эфира 5-амино-3-(2-метокси-6-метилпиридин-3-ил)пиразол-1 карбоновой кислоты). Объединенное вещество (70 г) растворяли в смеси ТГФ и метанола 4:1 (1,4 л) и обрабатывали QuadraSil АР (140 г) в течение 2 ч. Реакционную смесь фильтровали через диатомитовую землю и промывали этилацетатом (4100 мл). Фильтрат снова перемешивали с QuadraSil АР (140 г) в течение 2 ч и фильтровали, как указано выше. Растворитель выпаривали с получением соединения,указанного в заголовке, в виде белого твердого вещества. Выход = 70 г (47%). ИЭР/МС m/z 582,5 В перемешиваемый раствор трет-бутилового эфира (R)-3-6-[2-трет-бутоксикарбонил-5-(2-метокси 6-метилпиридин-3-ил)-2 Н-пиразол-3-иламино]пиразин-2-илоксипиперидин-1-карбоновой кислоты (13,0 г, 22,3 ммоль) в дихлорметане (150 мл) добавляли раствор трифторуксусной кислоты (12,4 мл, 167 ммоль) в дихлорметане (20 мл) в течение 5 мин при 0 С. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 3 ч. Реакционную смесь разбавляли дихлорметаном(1000 мл), затем добавляли насыщенный раствор бикарбоната натрия (250 мл), а затем перемешивали в течение 4 ч. Органическую фракцию отделяли и сушили над безводным сульфатом натрия, фильтровали и упаривали. Полученное вещество кристаллизовали из изопропанола с получением целевого продукта. Выход = 7,2 г (85%). 1 Н ЯМР (400 МГц, ДМСО-d6)12,40 (s, 1H), 9,71 (s, 1H), 8,02 (d, J =7,6 Гц, 1H), 7,97 (s, 1H), 7,46 (s,1H), 6,93 (d, J =7,6 Гц, 1H), 6,91 (s, 1H), 4,94-4,86 (m, 1H), 3,97 (s, 3H), 3,20-3,13 (m, 1H), 2,83-2,75 (m, 1H),2,57 (dd, J = 12,0, 8,4 Гц, 1 Н), 2,53-2,45 (m. размыт, 1 Н), 2,42 (s, 3H), 2,15-2,05 (m, 1H), 1,71-1,63 (m, 1H),1,60-1,49 (m, 1H), 1,49-1,40 (m, 1H); ИЭР/МС m/z 382,5 [M+H]+ Пример 2. Метансульфокислая соль (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6(пиперидин-3-илокси)пиразин-2-ил]амина ммоль) в дихлорметане (25 мл) при 0 С. Реакционную смесь оставляли нагреваться до комнатной температуры и встряхивали в течение 45 мин. Растворитель выпаривали и полученную соль последовательно промывали диэтиловым эфиром (10 мл) и пентаном (10 мл) с получением целевого продукта. Выход = 1,139 г (92,6%). 1 Н ЯМР (400 МГц, ДМСО-d6),12,5 (bs, 1H), 9,81 (s, 1H), 8,73 (bs, 1H), 8,54 (bs, 1H), 8,07 (s, 1H),7,96 (d, J = 7,6 Гц, 1H), 7,56 (s, 1H), 6,95 (d, J = 7,6 Гц, 1H), 6,81 (s, 1H), 5,31-5,24 (m, 1H), 3,97 (s, 3H),3,48-3,39 (m, 1H), 3,39-3,30 (m, 1H), 3,18-3,10 (m, 1H), 3,10-3,01 (m, 1H), 2,43 (s, 3H), 2,32 (s, 3H), 2,031,85 (m, 3H), 1,73-1,65 (m, 1H); ИЭР/МС m/z 382,4 [M+H]+. Пример 3. Соль (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3 илокси)пиразин-2-ил]амина и уксусной кислоты В раствор (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина (0,100 г, 0,26 ммоль) в дихлорметане (10 мл) добавляли уксусную кислоту (0,015 мл, 0,26 ммоль), растворенную в дихлорметане (1 мл), при 0 С. Реакционную смесь перемешивали в течение 60 мин при комнатной температуре, а затем растворитель выпаривали с получением остатка. Остаток растирали с диэтиловым эфиром (20 мл), затем с н-пентаном (20 мл). Вещество сушили в глубоком вакууме в течение 4 ч с получением целевого продукта. Выход = 0,060 г (51,8%). 1 Н ЯМР (400 МГц, ДМСО-d6)12,40 (bs, 1H), 9,70 (s, 1H), 8.02 (d, J = 7,6 Гц, 1H), 7,98 (s, 1H), 7,46 В раствор (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина (0,100 г, 0,26 ммоль) в дихлорметане (10 мл) добавляли щавелевую кислоту (0,012 мг,0,13 ммоль), растворенную в МеОН (0,1 мл), при 0 С. Реакционную смесь перемешивали в течение 60 мин при комнатной температуре, а затем растворитель выпаривали с получением остатка. Остаток растирали с диэтиловым эфиром (20 мл), затем с н-пентаном (20 мл). Вещество сушили в глубоком вакууме в течение 4 ч с получением соединения, указанного в заголовке. Выход = 0,095 г (77%). 1 Н ЯМР (400 МГц, ДМСО-d6)9,77 (s, 1H), 8,07 (s, 1 Н), 7,95 (d, J=7,6 Гц, 1H), 7,55 (s, 1H), 6,95 (d,J=7,6 Гц, 1 Н), 6,79 (s, 1H), 5,33-5,24 (m, 1H), 3,97 (s, 3H), 3,45-3,30 (m, 2H), 3,18-3,09 (m, 1H), 3,08-2,98 В раствор (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина (0,1 г, 0,26 ммоль) в дихлорметане (10 мл) добавляли янтарную кислоту (0,015 г, 0,13 ммоль), растворенную в этаноле (1 мл, растворение проводили при 50 С) при комнатной температуре. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Растворитель выпаривали и полученный остаток растирали с диэтиловым эфиром (20 мл), затем с н-пентаном (20 мл). Вещество сушили в глубоком вакууме в течение 8 ч с получением соединения, указанного в заголовке. Выход = 0,102 г (78%). 1 Н ЯМР (400 МГц, ДМСО-d6)12,4 (bs, 1H), 9,72 (s, 1H), 8,05-7,96 (m, 2H), 7,48 (s, 1H), 6,93 (d,J=7,6 Гц, 1 Н), 6,86 (s, 1H), 5,06-4,97 (m, 1H), 3,97 (s, 3H), 2,90-2,81 (m, 1H), 2,74-2,62 (m, 1H), 2,42 (s, 3H),2,30 (s, 2 Н), 2,09-2,01 (m, 1H), 1,80-1,60 (m, 2 Н), 1,57-1,46 (m, 1H), 1,14-1,10 (m, 1 Н), 1,10-1,00 (m, 1H); ИЭР/МС m/z 382,4 [М+Н]+ Пример 6. Гидрат (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3 илокси)пиразин-2-ил]амина Суспендировали (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амин (52,1 мг; ИЭР/МС m/z 382,2 [М+Н]+) в 5:95 смеси вода-этанол (10 мл) при температуре окружающей среды в течение 48 ч. Белое кристаллическое твердое вещество выделяли путем вакуумного фильтрования. Порошковые рентгеновские дифрактограммы (XRD) кристаллических твердых веществ получали на порошковом рентгеновском дифрактометре Bruker D4 Endeavor, оборудованном источником CuKa(=1,54060 А) и детектором Vantek, с рабочими характеристиками 35 кВ и 50 мА. Образец сканировали в диапазоне от 4 до 40 С 2 с шагом 0,009 2. Сухой порошок помещали на кварцевый держатель образца и получали гладкую поверхность при помощи предметного стекла. Для данного анализа в ошибке положения пика 0,2 2 учтены возможные отклонения, при этом она не препятствует однозначной идентификации указанной кристаллической формы. Подтверждение типа кристаллической формы можно проводить на основании уникальной комбинации отличительных пиков (в 2), как правило, являющихся наиболее выраженными пиками. Дифрактограммы кристаллической формы, полученные при температуре и относительной влажности окружающей среды, нормировали с применением стандарта NIST 675 с пиками при 8,85 и 26,77 градусов 2-тета. Таким образом, кристаллическая форма соединения характеризуется XRD-дифрактограммой, полученной с применением излучения CuKa и имеющей пики дифракции (2-тета), описанные ниже в табл. 1. В частности, дифрактограмма имеет пик при 5.17 в комбинации с одним или более пиками, выбранными из группы, состоящей из 15,73, 17,71 и 20,12, с допустимым отклонением угла дифрации, равным 0,2 градуса. Таблица 1. Пики рентгеновской порошковой дифракции соединения согласно примеру 6. Биохимическое исследование Chk1 Влияние соединений на биохимическую активность Chk1 можно определять при помощи исследования связывания CHK1/пептидного субстрата на фильтрах. В этом исследовании синтетический пептид,соответствующий последовательности аминокислотных остатков 206-225 Cdc25, применяли в качестве субстрата-акцептора фосфора рекомбинантной протеинкиназы Chk1. При применении -33 Р-АТФ в качестве субстрата-донора фосфора Chk1 переносит радиоактивную -33 фосфатную группу на синтетический пептид. Прохождение реакции измеряли путем поглощения пептидного субстрата в планшетах с катионообменными бумажными фильтрами и определения числа испускаемых бета-частиц при помощи сцинтилляционного анализа. Киназные реакции (реакционный объем 40 мкл) проводили в 96-луночных планшетах из полистирола с V-образным дном. Реакции иницировали путем добавления фермента Chk1. Конечные условия реакций: 67 мМ натриевой соли HEPES с рН 7,4, 0,007% (об./об.) TRITON Х-100, 2,7 мМ ДТТ, 2,7 мМMgCl2, 12 мкМ пептидного субстрата, 60 мкМ динатриевой соли АТФ, 0,75 мкКи -33 Р-АТФ, 0,75 нМ активного фермента Chk1, 4% (об./об.) ДМСО и последовательное разведение соединения (серийное разведение 1:3, начиная с 20 мкМ, 10 точек). После добавления фермента Chk1 реакционные смеси инкубировали при комнатной температуре в течение 90 мин, затем реакции останавливали путем добавления 140 мкл фосфорной кислоты. Реакционную смесь переносили в соответствующие лунки непрозрачного фильтровального планшета с фосфоцеллюлозными катионообменными бумажными фильтрами и отстаивали в течение 30 мин. Фильтровальный планшет промывали в вакуумном коллекторе пять раз 200 мкл 0,5% фосфорной кислоты (об./об.) Фильтровальный планшет сушили в течение ночи, после чего добавляли 40 мкл Microscint-20 в каждую лунку планшета. После отстаивания в течение 4 ч при комнатной температуре радиоактивность в планшете измеряли при помощи сцинтиллятора микропланшетов MicroBeta Trilux (Perkin Elmer). Для определения IC50 ингибирование в процентах для каждой концентрации вычисляли на основании числа сцинтилляций, отнесенного к данным контрольных лунок каждого планшета. Данные для десяти точек концентрации соединения затем подставляли в четырехпараметровое логистическое уравнение с применением Activity Base 4.0. Абсолютные значения IC50 вычисляли при помощи полученной кривой. Соединения согласно настоящему изобретению исследовали по существу согласно приведенному выше описанию. Например, по результатам исследования соединение согласно примеру 1 имело значение IC50 0,001 мкМ (n=6). Кроме того, по результатам исследования соединение согласно примеру 2 имело значение IC50 0,001 мкМ (n=3). Эти результаты показывают, что соединения, включенные в объем настоящего изобретения, являются высокоактивными ингибиторами Chk1. Биохимическое исследование Chk2 Влияние соединений на биохимическую активность Chk2 можно определять при помощи исследования связывания CHK2/пептидного субстрата на фильтрах. В данном исследовании синтетический пептид, соответствующий последовательности аминокислотных остатков 206-225 Cdc25C, применяли в качестве субстрата-акцептора фосфора рекомбинантной протеинкиназы Chk2. При применении -33 Р-АТФ в качестве субстрата-донора фосфора Chk2 переносит радиоактивную -33 фосфатную группу на синтетический пептид. Прохождение реакции измеряли путем поглощения пептидного субстрата в планшетах с катионообменными бумажными фильтрами и определения числа испускаемых бета-частиц при помощи сцинтилляционного анализа. Киназные реакции (реакционный объем 40 мкл) проводили в 96-луночных планшетах из полистирола с V-образным дном. Реакции инициировали путем добавления фермента Chk2. Конечные условия реакций: 67 мМ натриевой соли HEPES с рН 7,4, 0,007% (об./об.) TRITON Х-100, 2,7 мМ ДТТ, 2,7 мМMgCl2, 12 мкМ пептидного субстрата, 60 мкМ динатриевой соли АТФ, 0,75 мкКи -33 Р-АТФ, 1,4 нМ активного фермента Chk2, 4% (об./об.) ДМСО и последовательное разведение соединения (серийное разведение 1:3, начиная с 20 мкМ, 10 точек). После добавления фермента Chk2 реакционные смеси инкубировали при комнатной температуре в течение 90 мин, затем реакции останавливали путем добавления 140 мкл фосфорной кислоты. Реакционную смесь переносили в соответствующие лунки непрозрачного фильтровального планшета с фосфоцеллюлозными катионообменными бумажными фильтрами и отстаивали в течение 30 мин. Фильтровальный планшет промывали в вакуумном коллекторе пять раз 200 мкл 0,5% фосфорной кислоты (об./об.). Фильтровальный планшет сушили в течение ночи, после чего добавляли 40 мкл Microscint-20 в каждую лунку планшета. После отстаивания в течение 4 ч при комнатной температуре радиоактивность в планшете измеряли при помощи сцинтиллятора микропланшетов MicroBeta Trilux (Perkin Elmer). Для определения IC50 ингибирование в процентах для каждой концентрации вычисляли при помощи значения TR-FRET, отнесенного к данным контрольных лунок каждого планшета. Данные для десяти точек концентрации соединения затем подставляли в четырехпараметровое логистическое уравнение с применением ActivityBase 4.0. Абсолютные значения IC50 вычисляли при помощи полученной кривой. Соединения согласно настоящему изобретению исследовали по существу согласно приведенному выше описанию. Например, по результатам исследования соединение согласно примеру 1 имело значение IC50,равное 0,011 мкМ (СКО=0,002, n=6). Кроме того, по результатам исследования соединение согласно примеру 2 имело значение IC50, равное 0,012 мкМ (СКО=0,008, n=3). Эти результаты показывают, что соединения, включенные в объем настоящего изобретения, являются высокоактивными ингибиторамиChk2. Клеточное исследование аутофосфорилирования Chk1 Ингибитор Chk1 препятствует фосфорилированию субстратов, обусловленному киназной активностью белка, в клетках, в которых активирован ответ на повреждение ДНК. Легко поддающимся обнаружению субстратом Chk1 является участок аутофосфорилирования самой Chk1, серин 296. Следующий иммуноблот можно применять для измерения уровня фосфорилирования серина 296 в Chk1 и непрямого определения активности Chk1 протеинкиназы. Клетки HeLa выращивали в MEM/сбалансированном солевом растворе Эрла с L-глутамином, содержащем 10% (об./об.) инактивированной нагреванием эмбриональной бычьей сыворотки, 1 аминокислоты, заменимые для MEM, 1 пируват натрия и 1105 клеток в 600 мкл питательной среды MEM на лунку 24-луночного планшета для клеточных культур. Клетки инкубировали в течение 24 ч при 37 С, 5% CO2 и относительной влажности 95-100%. 16 мкл 4 мкМ маточного раствора доксорубицина в питательной среде добавляли в каждую соответствующую лунку для достижения конечной концентрации доксорубицина 100 нМ. Планшеты возвращали в инкубатор еще на 24 ч, после чего добавляли ингибитор Chk1. Соединения растворяли в концентрации 10 мМ в 100% ДМСО, затем разбавляли до 2 мМ в 40% (об./об.) ДМСО, а затем разбавляли до 100 мкМ в питательной среде, содержащей 4% (об./об.) ДМСО. Затем проводили серийные разбавления соединений (1:3) для получения концентраций в диапазоне от 100 мкМ до 0,005 мкМ. 66 мкл маточного раствора соединения добавляли в соответствующие лунки планшета для достижения конечной концентрации ДМСО, равной 0,4% (об./об.), и конечной концентрации соединения в диапазоне от 1 до 0,0005 мкМ. Планшеты возвра-8 022096 щали в инкубатор еще на 2 ч, а затем удаляли для проведения клеточного лизиса и процессинга в клетке. Среду затем удаляли из планшета, каждую лунку промывали один раз 0,5 мл ледяного фосфатного буферного раствора Дульбекко (DPBS), все жидкости удаляли и планшет помещали в лед до окончания процедуры. В каждую лунку добавляли 75 мкл ледяного лизисного буфера, состоящего из буфера для экстракции клеток, содержащего коктейль ингибиторов фосфатаз (Sigma, катР 0044 + Р 5725) и таблетки с коктейлем ингибиторов протеаз (Roche Diagnostics, кат 11836153001). Через 10 мин содержимое каждой лунки соскребали со стенок и лизат переносили в 1,5 мл полипропиленовую пробирку для микроцентрифугирования, помещенную в лед. Каждый лизат обрабатывали ультразвуком в течение 45 с в чашечном ультразвуковом гомогенизаторе планшетов (Misonix) в виде суспензии на бане лед/вода. 50 мкл каждого образца переносили в 0,5 мл полипропиленовую пробирку для микроцентрифугирования,содержащую 25 мкл 4 буфера для образцов Laemmli, грели при 95 С в течение 5 мин и хранили в замороженном виде при -80 С. Оставшийся лизат применяли для определения концентрации белка (набор для исследования белков с БХК, Thermo Scientific). Пять мкг каждого клеточного лизата в буфере для образцов наносили в гель в 96-луночный планшет Е-Page и проводили электрофорез. Белки под действием электрофореза перемещались из геля в ПВДФ мембрану Immobilon-P (0,45 мкм) в соответствии со способами, хорошо известными в данной области техники (Towbin et al., PNAS (1979) 76(9), 4350-4). Мембрану быстро промывали 10 мМ Tris/HCl, pH 8,0, 150 мМ NaCl и 0,05% (об./об.) Tween 20 (TBST) и выдерживали для пропитки в течение 1 ч при 25 С в TBST/5% (об./об.) восстановленного сухого молокаCarnation. Мембрану промывали четыре раза TBST в течение 5 мин, затем выдерживали для пропитки при 4 С в течение 24 ч в TBST/5% (мас./об.) бычьего сывороточного альбумина и соответствующем разбавленном антителе кролика к фосфо-Chk1 (серин 296). Мембрану промывали 4 TBST в течение 5 мин при 25 С, а затем выдерживали для пропитки при 25 С в течение 2 ч в TBST/5% молока, содержащем соответствующий разбавленный ослиный антикроличий IgG, конъюгированный с пероксидазой хрена(GE Healtcare, катNA9340) для детектирования аутофосфорилированного белка Chk1. Мембрану промывали снова 4 TBST в течение 5 мин при 25 С. Конъюгаты антиген-антитело-репортер, иммобилизованные на мембране, детектировали при помощи реагента Super Signal Western Femto для детектирования HRP (пероксидазы хрена) с применением системы визуализации FUJI LAS-4000. Интенсивности полос фосфо-Chk1 (ser296) вычисляли при помощи программного обеспечения "Total Lab" (Nonlinear Dynamics). Ингибирование в процентах индуцированного доксорубицином аутофосфорилирования Chk1 вычисляли при помощи следующей формулы ингибирование в % = (интенсивность полосы образецфосфо-Chk1-интенсивность полосы отрицательный контроль без доксорубицина-фосфоChk1)/(интенсивность полосы положительный контроль с доксорубицином-фосфо-Chk1 - отрицательный контроль без доксорубицина-фосфо-Chk1)100 Соединения согласно настоящему изобретению исследовали по существу согласно приведенному выше описанию. По результатам указанного исследования соединение согласно примеру 1 имело значение ЕС 50 0,001 мкМ (n=1). По результатам указанного исследования соединение согласно примеру 3 имело значение ЕС 50 0,001 мкМ (n=1). Эти результаты показывают, что соединения, включенные в объем настоящего изобретения, являются высокоактивными ингибиторами Chk1. Прогностическое исследование индуцируемой доксорубицином нейтрализации контрольной точкиG2M в клетках HeLa Ингибитор Chk1 отключает контрольную точку G2M повреждения ДНК в опухолевых клетках р 53 минус, обработанных ингибитором топоизомеразы II, доксорубицином. Мерой нейтрализации контрольной точки G2M является фосфорилирование серина 10 гистона Н 3, которое происходит после прохождения клетки через контрольную точку G2M и вступления клетки в митоз. Следующее многопараметрическое визуализирующее исследование можно применять для измерения уровня фосфорилирования гистона Н 3 в клетках. Клетки HeLa выращивали в среде MEM, содержащей 10% (об./об.) ЭБС и помещали в количестве 2000 клеток на лунку в черные планшеты с прозрачным дном, покрытые поли-D-лизином, до достижения объема 100 мкл на лунку. Планшеты затем инкубировали в инкубаторе клеточных культур в течение 18-24 ч (37 С, 5% CO2, относительная влажность 95%). После начальной инкубации 20 мкл среды MEM, содержащей 10% ЭБС и 625 нМ доксорубицин, добавляли в соответствующие лунки планшета до конечной концентрации 125 нМ. Планшеты возвращали в инкубатор на 24 ч для остановки клеточного цикла в контрольной точке G2M. На следующий день клетки обрабатывали соединениями. Соединения растворяли в концентрации 10 мМ в 100% ДМСО, а затем разбавляли с получением 10 маточного раствора с концентрацией 50 мкМ в MEM и 4% (об./об.) ДМСО. Затем проводили серийные разбавления соединений (1:2) с получением концентраций в диапазоне от 50 мкМ до 0,39 мкМ. Тринадцать мкл маточного раствора соединения добавляли в соответствующие лунки планшета до достижения конечной концентрации ДМСО, равной 0,4%, и конечной концентрации соединения в диапазоне от 5 мкМ до 0,039 мкМ. Планшеты возвращали в инкубатор еще на 7 ч, а затем удаляли для фиксации клеток. Жидкость осторожно удаляли из каждой лунки и 100 мкл фиксатора PREFER добавляли. Планшеты выдерживали при комнатной температуре в течение 20 мин, фиксатор удаляли и клетки затем пермеабилизировали путем добавления 100 мкл/лунку 0,1% (об./об.) Triton X 100 в DPBS в течение 10 мин. Раствор удаляли и планшет дважды промывали 100 мкл DPBS на лунку, затем добавляли 100 мкл DPBS, содержащего 50 мкг/мл рибонуклеазы А (РНКаза поджелудочной железы быка), в течение одного часа при комнатной температуре. Раствор РНКазы удаляли и клетки окрашивали для определения наличия гистона Н 3, фосфорилированного по серину 10 (рНН 3), путем добавления в каждую лунку 50 мкл раствора РНКазы, содержащего разбавленное 1:500 кроличье антитело к рНН 3 (ser10) и 1% (мас./об.) БСА. Планшеты запечатывали и выдерживали при 4 С в течение ночи. Первичное антитело удаляли путем двукратной промывки каждого планшета 100 мкл DPBS на лунку и заменяли его 50 мкл разбавленного 1:750 козьего антикроличьего IgG Alexa Fluor 488 (H+L) (2 мг/мл) в DPBS, содержащем 1% (мас./об.) БСА. Планшеты закрывали алюминиевой фольгой для защиты от света и выдерживали в течение одного часа при комнатной температуре. Планшеты снова промывали дважды 100 мкл DPBS на лунку и заменяли на 100 мкл 15 нМ йодида пропидия (разбавление 1:100 исходного раствора в ФБР). Планшеты закрывали черной крышкой для защиты от света. Планшеты инкубировали в течение 30 мин для окрашивания ядер. Планшеты сканировали в лазерных сканирующих цитометрах флуоресценции микропланшетов ACUMENEXPLORER с длиной волны возбуждения 488 нм (ТТР LABTECH LTC) для измерения содержания рНН 3 и ДНК, включая 2N и 4N. рНН 3-положительные клетки определяли по средней интенсивности Alexa 488 при 519 нм. Общую интенсивность йодида пропидия/ДНК при 655-705 нм использовали для определения индивидуальных клеток и субпопуляций клеток в различных фазах клеточного цикла (клетки 2N, клетки 4N). Конечное число каждой популяции определяли путем нормализации к % от общего числа клеток с получением следующих конечных результатов исследования % рНН 3, %2N и %4N 100% активность затем определяли путем обработки клеток контрольным ингибитором в максимальной концентрации 100 нМ для определения конечной активности (в %) каждого соединения 0% активность определяли в отсутствие введения соединения. Относительную ЕС 50 определяли при помощи ACTIVITYBASE с использованием Excel Fit путем построения кривой с применением подстановки в четырехпараметровое логистическое уравнение 205, для определения % рНН 3 относительно контрольного максимального значения, принятого за 100%. Соединения согласно настоящему изобретению исследовали, по существу, согласно приведенному выше описанию. По результатам указанного исследования соединение согласно примеру 1 имело значение ЕС 50, равное 0,029 мкМ (n=1). По результатам указанного исследования соединения согласно примерам 2 и 3 имели значения ЕС 50, равные 0,033 мкМ (n=1) и 0,019 мкМ(n=1) соответственно. Эти результаты показывают, что соединения, включенные в объем настоящего изобретения, отключают контрольную точку повреждения ДНК G2M. Исследование ECtfs (двойная сенсибилизация) Ингибитор Chk1 может увеличивать антипролиферативную активность гемцитабина (или других цитотоксических средств) за счет нейтрализации контрольной точки в S фазе, приводя к продолжительному и увеличенному повреждению ДНК. Уровень непрерывной пролиферации опухолевых клеток после повреждения ДНК можно анализировать путем определения способности клеток реплицировать свою ДНК. В этом исследовании определяют способность клеток реплицировать свою ДНК после возникновения возможности репарации повреждения ДНК клетками. В этом исследовании клетки обрабатывати последовательно разбавленным гемцитабином, а затем через 22 ч соединением согласно примеру 3. Еще через 44 ч относительное число клеток определяли при помощи исследования восстановления красителя(3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2 Нтетразолий). Параметр ECtfs является мерой концентрации ингибитора Chk1, необходимой для снижения в два раза концентрации GI90 гемцитабина, измеренной в этом же исследовании в отсутствие ингибирования Chk1. Клетки НТ-29 (получали из АТСС) выращивали в RPMI 1640, содержащей 10% (об./об.) ЭБС, инактивированной нагреванием. Клетки помещали в количестве 2,5103 на лунку до достижения объема 100 мкл в 96-луночные планшеты для тканевых культур и инкубировали в течение 24 ч. Проводили серийные разбавления гемцитабина в 6 х концентрациях в среде МакКоя 5 А (модифицированной)(1) и добавляли в лунки в количестве 20 мкл на лунку. Проводили разбавления гемцитабина, начиная с максимальной конечной концентрации гемцитабина, равной 1,0 мкМ, до достижения концентрации 0,5 нМ. Ингибитор Chk1 получали путем разбавления в ДМСО до 4000 конечной концентрации, а затем разбавляли в 666 раз в среде МакКоя с получением 6 х маточных растворов. Проводили разбавления ингибитора Chk1 в 2,5 раза, начиная с 25 до 0,3 нМ. Через 22 часа после добавления гемцитабина добавляли 24 мкл ингибитора Chk1 в лунки, содержащие 120 мкл среды и гемцитабин. В каждую лунку, содержащую разбавленный гемцитабин, разбавленный ингибитор Chk1 вводили один раз. В контрольные лунки вводили по отдельности ДМСО, гемцитабин или ингибитор Chk1. Через 44 часа после добавления ингибитора Chk1 30 мкл реагента для исследования CellTiter 96 AQueous добавляли в каждую лунку и выдерживали при комнатной температуре в течение 1 ч 45 мин. Определяли поглощение при 490 нм на спектрофотометре SpectraMax (Molecular Devices). Данные, полученные на спектрофотометре SpectraMax, анализировали при помощи GraphPad Prism 4.0. Сначала усредненное контрольное поглощение в отсутствие клеток вычитали из всех других значений матрицы данных каждого планшета. Затем усредняли данные, полученных в двух повторностях. Получали нормированные данные для каждой концен- 10022096 трации ингибитора Chk1, где 0% числа клеток соответствовали А 490=0, а 100% числа клеток соответствовали среднему значению при концентрации гемцитабина, равной 0 нМ. Эти результаты затем преобразовывали. Концентрации гемцитабина переводили в логарифмические концентрации, нормированное число клеток переводили в ингибирование в процентах (ингибирование в процентах = 100 - нормированное число клеток). Строили график по преобразованным данным, использовали нелинейную регрессию для оценки значения EC50 гемцитабина для каждой концентрации ингибитора Chk1. Нелинейную регрессию рассчитывали с учетом изменения наклона кривой в отсутствие ограничений для максимума или минимума кривых зависимостей доза-ответ. Значение ECtfs рассчитывали следующим образом: определяли значения GI50 гемцитабина для каждой концентрации ингибитора Chk1, строили график и концентрацию ингибитора Chk1, необходимую для снижения GI50 гемцитабина в два раза, определяли путем интерполяции. Соединения согласно настоящему изобретению исследовали по существу согласно приведенному выше описанию. По результатам исследования соединение согласно примеру 3 имело значение ECtfs,равное 1,0 нМ (СКО=0,1, n=3). Кроме того, соединение в 25 нМ концентрации снижало значение ЕС 50 гемцитабина в 7 раз с 22 нМ до 3 нМ в случае клеток карциномы толстой кишки НТ-29. Само по себе соединение согласно примеру 3 оказывало незначительное действие на пролиферацию клеток НТ-29. Эти результаты показывают, что соединения, включенные в объем настоящего изобретения, эффективно увеличивают антипролиферативную активность гемцитабина в низких концентрациях. Значения IC50 гемцитабина, полученные при введении различных концентраций соединения согласно примеру 3 Исследование направленного ингибирования Chk1 in vivo Клетки Calu-6 помещали в питательную среду (MEM и сбалансированный солевой раствор Эрла сL-глутамином, содержащий 10% (об./об.) инактивированной нагреванием ЭБС, 1 заменимые аминокислоты для MEM, 1 пируват натрия) и выращивали. Клетки собирали и промывали дважды фосфатным буферным раствором, и 1106 клеток в питательной среде (не содержащей сыворотку) смешивали с равным объемом матрицы BD Matrigel, затем вводили подкожную инъекцию в бок предварительно облученных (4,5 Гр) "голых" мышей (бестимусных мышей). Через 15 дней после введения имплантата (размер опухоли = 150-200 мм 3) дозу 150 мг/кг гемцитабина в виде свежеприготовленного в день введения состава в солевом растворе интраперитонеально вводили животным. Через 6 ч животным перорально вводили соединение-ингибитор Chk1 в виде состава в 0,2% Tween-80/0,5% метилцеллюлозы, рН доводили до 6,8 путем добавления разбавленного NaOH. Животных умерщвляли через 2 ч после введения дозы ингибитора Chk1, опухоли собирали и немедленно помещали в ледяной буфер для экстракции клеток,содержащий коктейль ингибиторов фосфатаз (Sigma, кат.Р 0044 + Р 5725) и таблетки с коктейлем ингибиторов протеаз (Roche Diagnostics, кат.11836153001). Опухоли обрабатывали в 1,5-2,0 мл лизисного буфера в 15 мл полипропиленовую коническую пробирку, охлаждаемую льдом, при помощи электрического гомогенизатора тканей с продолжительностью максимального уровня нагрузки, равной 15 с. Выдерживая образец во льду, лизат отбирати четыре раза при помощи 1 мл шприца с иглой 25 калибра. 0,35 мл лизата опухоли переносили в 1,5 мл полипропиленовую пробирку для микроцентрифугирования, содержащую 0,15 мл 4 буфера для образцов Laemmli. Образец затем перемешивали и нагревали в течение 5 мин при 95 С, обрабатывали ультразвуком на высокой мощности в течение 1 мин с применением чашечного ультразвукового гомогенизатора Misonix 3000. Образцы затем хранили во льду или при -80 С для определения направленного ингибирования при помощи вестерн-блот анализа. 5 мкг каждого лизата опухоли в буфере для образцов вводили в гель в 96-луночный планшет E-Page и проводили электрофорез. Белки перемещались в нитроцеллюлозную мембрану ВА 83 Protran (Whatman, кат 10402405) в соответствии с процессами, хорошо известными в данной области техники (Towbin et al., PNAS (1979) 76(9), 4350-4). Мембрану затем обрабатывали для измерения содержания белка Chk1, аутофосфорилированного по серину 296. Мембрану быстро промывали водой, затем 10 мМ Tris/HCl, pH 8,0, 150 мМ NaCl и 0,05% (об./об.), Tween 20 (TBST) и выдерживали для пропитки в течение одного часа при 25 С вTBST/5% (масс./об.) восстановленного сухого молока Carnation. Мембрану затем промывали четыре разаTBST в течение 5 минут. Мембрану выдерживали для пропитки при 4 С в течение 16 ч в TBST/5%(масс./об.) БСА и соответствующем разбавленном кроличьем антителе фосфо-Chk1 к фосфо-Chk1 (серин 296). Затем мембрану промывали четыре раза TBST в течение 5 мин при 25 С, а затем выдерживали для пропитки при 25 С в течение 2 ч в TBST/5% молока, содержащем соответствующим образом разбавленный ослиный антикроличий IgG, конъюгированный с пероксидазой хрена, для детектирования фосфоChk1 (ser296). Мембрану промывали снова 4 раза TBST в течение 5 мин при 25 С. Конъюгаты антигенантитело-репортер, иммобилизованные на мембране, детектировали при помощи реагента Super SignalWestern Femto для детектирования HRP. Сигналы детектировали и фиксировали при помощи системы визуализации FUJI LAS-4000. Интенсивности полос фосфо-Chk1 (ser296) вычисляли при помощи программного обеспечения "Total Lab"(Nonlinear Dynamics). Ингибирование в процентах индуцированного гемцитабином аутофосфорилирования Chk1 вычисляли при помощи следующей формулы: ингибирование в % = (интенсивность полосы образец-фосфо-Chk1 - средняя интенсивность полосы положительный контроль с гемцитабином (Мах)фосфо-Chk1)/(средняя интенсивность полосы отрицательный контроль (Min)-фосфо-Chk1 - средняя интенсивность полосы положительный контроль с гемцитабином (Мах)-фосфо-Chk1)100. Соединения, включенные в объем настоящего изобретения, исследовали по существу согласно приведенному выше описанию. Например, по результатам исследования соединение согласно примеру 3 имело значение эффективной дозы направленной модуляции (Target Modulatory Effective Dose, TMED50) аутофосфорилирования Chk1, равное 1.3 мг/кг (n=1). Полученный результат показывает, что соединения,включенные в объем настоящего изобретения, эффективно ингибируют активацию протеинкиназы Chk1in vivo. Модели ксенотрансплантатов опухолей человека Способность ингибиторов Chk1 усиливать уничтожение опухолей ДНК-повреждающими агентами можно определять in vivo при помощи эффективных моделей ксенотрансплантатов опухолей легкогоCalu-6 и толстой кишки НТ-29. Клетки рака легкого Calu-6 помещали в питательную среду (MEM и сбалансированный солевой раствор Эрла с L-глутамином, содержащий 10% (об./об.) инактивированной нагреванием ЭБС, 1 заменимые аминокислоты для MEM, 1 пируват натрия), а клетки рака толстой кишки НТ-29 (АТСС) помещали в питательную среду (среда МакКоя 5 А, содержащая 10% ЭБС) и выращивали. Клетки собирали и промывали дважды фосфатным буферным раствором, и 5106 клеток (НТ-29) или 1106 клеток (Calu-6) в питательной среде (не содержащей сыворотку) смешивали с равным объемом матрицы BD Matrigel, затем вводили подкожную инъекцию в бок бестимусных мышей (CD-I nu/nu). Подкожное введение ингибитора Chk1 Примерно на 16 день после введения имплантата (150-200 мм 3) 60 мг/кг дозу гемцитабина в виде свежеприготовленного в день введения состава в солевом растворе интраперитонеально вводили животным Через 24 ч животным вводили соединение согласно примеру 3 в 0,2% Tween-80/0,5% метилцеллюлозы подкожно два раза в сутки. Через два дня, в которые введение не проводили, повторно проводили три дополнительных цикла дозирования (Q4D4 и соединение согласно примеру 3 с интервалами +24 ч). Подавление роста опухоли (TGI, tumor growth inhibition) вычисляли в виде снижения в процентах среднего размера опухоли в группе животных, которым вводили соединение, относительно среднего размера опухоли в контрольной группе животных, которым вводили носитель. Соединения, включенные в объем настоящего изобретения, исследовали по существу согласно приведенному выше описанию. Например,показано, что соединение согласно примеру 3, которое вводили в комбинации с гемцитабином, имело высокую дозозависимую противоопухолевую активность в моделях ксенотрансплантатов опухолей НТ 29 и Calu-6, при этом происходило шестикратное увеличение подавления роста опухоли по сравнению с гемцитабином при его отдельном введении. Полученный результат показывает, что соединения, включенные в объем настоящего изобретения, при подкожном введении значительно увеличивают противоопухолевую активность гемцитабина в моделях ксенотрансплантатов опухолей человека. НТ 29, подкожное введение н/в = статистически незначимая величина Пероральное введение ингибитора Chk1 Примерно на 16 день после введения имплантата (150-200 мм 3) 40 мг/кг дозу гемцитабина в виде свежеприготовленного в день введения состава в солевом растворе интраперитонеально вводили животным. Через 24 ч животным вводили соединение-ингибитор Chk1 в 0,2% Tween-80/0,5% метилцеллюлозы перорально два раза в сутки. Через три дня, в которые введение не проводили, повторно проводили три дополнительных цикла дозирования (Q5D4 и соединение согласно примеру 3 с интервалами +24 ч). Подавление роста опухоли (TGI) вычисляли согласно описанию, приведенному в предыдущем абзаце. Соединения, включенные в объем настоящего изобретения, исследовали по существу аналогично приведенному выше описанию. Например, показано, что соединение согласно примеру 3, которое вводили в комбинации с гемцитабином, имело высокую дозозависимую противоопухолевую активность в моделях ксенотрансплантатов опухолей НТ-29 и Calu-6, при этом происходило увеличение подавления роста опухоли в 2,9 раза по сравнению с гемцитабином при его отдельном введении. Полученный результат показывает, что соединения, включенные в объем настоящего изобретения, при пероральном введении значительно увеличивают противоопухолевую активность гемцитабина в моделях ксенотрансплантатов опухолей человека. н/в = статистически незначимая величина НТ 29, пероральное введение н/в = статистически незначимая величина ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представляющее собой (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол-3-ил][6-(пиперидин-3-илокси)пиразин-2-ил]амин или его фармацевтически приемлемую соль. 2. Соединение по п.1, представляющее собой (R)-[5-(2-метокси-6-метилпиридин-3-ил)-2 Н-пиразол 3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амин. 3. Соединение по п.1, представляющее собой метансульфокислую соль (R)-[5-(2-метокси-6 метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина. 4. Соединение по п.1, представляющее собой уксуснокислую соль (R)-[5-(2-метокси-6- 13022096 метилпиридин-3-ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина. 5. Соединение по п.1, представляющее собой гемиоксалат (R)-[5-(2-метокси-6-метилпиридин-3-ил)2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина. 6. Соединение по п.1, представляющее собой гемисукцинат (R)-[5-(2-метокси-6-метилпиридин-3 ил)-2 Н-пиразол-3-ил]-[6-(пиперидин-3-илокси)пиразин-2-ил]амина. 7. Фармацевтическая композиция для ингибирования Chk1, содержащая соединение или фармацевтически приемлемую соль по любому из пп.1-6 и фармацевтически приемлемый носитель, разбавитель или наполнитель. 8. Применение соединения или фармацевтически приемлемой соли по любому из пп.1-6 для лечения рака. 9. Применение по п.8, где лечение осуществляется одновременно, раздельно или последовательно в комбинации с ионизирующим излучением. 10. Применение по п.8, где лечение осуществляется одновременно, раздельно или последовательно в комбинации с одним или более химиотерапевтическими агентами. 11. Применение по п.10, отличающееся тем, что один или более химиотерапевтических агентов выбраны из группы, состоящей из 5-фторурацила, гидроксимочевины, гемцитабина, метотрексата, пеметрекседа, доксорубицина, этопозида, цисплатина и таксола. 12. Применение по любому из пп.8-11, отличающееся тем, что рак выбран из группы, состоящей из рака мочевого пузыря, рака толстой кишки, рака желудка, рака печени, рака легкого, рака молочной железы, меланомы, рака яичников, рака поджелудочной железы, мезотелиомы, рака почки и рака матки.
МПК / Метки
МПК: A61K 31/4995, C07D 401/14, A61P 35/00
Метки: ингибирования, подходящие, соединения
Код ссылки
<a href="https://eas.patents.su/15-22096-soedineniya-podhodyashhie-dlya-ingibirovaniya-chk1.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, подходящие для ингибирования chk1</a>
Предыдущий патент: Имидазо[4.5-c]хинолины в качестве ингибиторов днк-пк
Следующий патент: Очищающие композиции концентрированного мыла
Случайный патент: Производные бензазола и их применение в качестве модуляторов jnk