Соединения, пригодные для ингибирования chk1
Номер патента: 18118
Опубликовано: 30.05.2013
Авторы: Майерс Стивен Скотт, Касар Рамеш, Фару Франсин С., Холкомб Райан Коутсуорт
Формула / Реферат
1. Соединение, представляющее собой 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил, или его фармацевтически приемлемая соль или сольват указанной соли.
2. Соединение по п.1, представляющее собой 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил, или его фармацевтически приемлемая соль.
3. Соединение по п.1, представляющее собой 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил.
4. Соединение по п.1, представляющее собой муравьинокислую соль 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила или дигидрохлоридную соль 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила.
5. Соединение по п.1, представляющее собой метансульфокислую соль 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила.
6. Соединение по п.1, представляющее собой
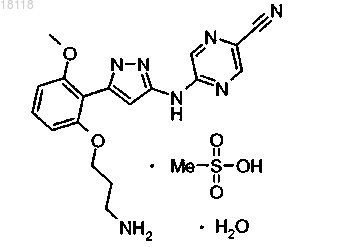
7. Соединение по п.6 в кристаллической форме, характеризующейся порошковой дифракционной рентгенограммой, содержащей пики при 2q±0,02°, равные 12,64, 21,25 и 26,15.
8. Фармацевтическая композиция, содержащая соединение или соль по любому из пп.1-7 в комбинации с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
9. Способ лечения рака, включающий введение пациенту, который в этом нуждается, эффективного количества соединения или соли по любому из пп.1-7.
10. Способ по п.9, где указанный рак выбран из группы, состоящей из рака мочевого пузыря, рака толстой кишки, рака желудка, рака печени, рака легких, рака молочной железы, меланомы, рака яичников, рака поджелудочной железы, мезотелиомы, рака почек и рака матки.
Текст
СОЕДИНЕНИЯ, ПРИГОДНЫЕ ДЛЯ ИНГИБИРОВАНИЯ Chk1 В изобретении предложено аминопиразольное соединение или его фармацевтически приемлемая соль или сольват указанной соли, которое ингибирует Chk1 и подходит для лечения рака. Фару Франсин С., Холкомб Райан Коутсуорт, Касар Рамеш, Майерс Стивен Скотт (US) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Настоящее изобретение относится к аминопиразольному соединению или его фармацевтически приемлемой соли или сольвату указанной соли, которое ингибирует Chk1 и применимо для лечения раковых заболеваний, характеризующихся дефектами репликации дезоксирибонуклеиновой кислоты(ДНК), сегрегации хромосом или клеточного деления.Chk1 представляет собой протеинкиназу, которая функционирует после Atm и/или Atr в пути передачи сигнала контроля повреждения ДНК. В клетках млекопитающих Chk1 подвергается фосфорилированию в ответ на действие агентов, вызывающих повреждение ДНК, включая ионизирующее излучение(ИИ), ультрафиолетовый свет и гидроксимочевину. Это фосфорилирование, которое активирует Chk1 в клетках млекопитающих, зависит от Atr. Chk1 играет свою роль в Atr-зависимом контроле повреждения ДНК, ведущем к блокировке клеточного цикла в фазе S и G2M. Chk1 фосфорилирует и инактивируетCdc25A - фосфатазу с двойной специфичностью, которая обычно дефосфорилирует циклин E/Cdk2, останавливая ход клеточного цикла в фазе S. Chk1 также фосфорилирует и инактивирует Cdc25C - фосфатазу с двойной специфичностью, которая дефосфорилирует циклин B/Cdc2 (также известный как Cdk1),блокируя клеточный цикл на границе фазы G2 и митоза (Fernery et al., Science, 277:1495-7, 1997). В обоих случаях регуляция активности Cdk вызывает остановку клеточного цикла для предотвращения вступления клетки в митоз при наличии повреждений в ДНК или нереплицированной ДНК. Сообщалось о различных ингибиторах Chk1, см., например, WO 05/066163, WO 04/063198,WO 03/093297 и WO 02/070494. Кроме того, ряд аминопиразольных ингибиторов Chk1 предложен вWO 05/009435. Тем не менее, все еще существует потребность в ингибиторах Chk1, являющихся мощными ингибиторами контрольных точек клеточного цикла, которые могут эффективно выступать в качестве усилителей агентов, повреждающих ДНК. Согласно настоящему изобретению предложено новое аминопиразольное соединение или его фармацевтически приемлемая соль или сольват указанной соли, которое является мощным ингибитором Chk1. Данное соединение или его фармацевтически приемлемая соль или сольват указанной соли эффективно предотвращают опосредованную Chk1 остановку клеточного цикла,вызванную обработкой агентами, повреждающими ДНК, в культуре клеток и in vivo. Кроме того, согласно настоящему изобретению соединение или его фармацевтически приемлемая соль или сольват указанной соли также обеспечивают ингибирование Chk2, что может быть полезным при лечении рака. Кроме того, отсутствие ингибирования некоторых других протеинкиназ, таких как CDK1, может обеспечивать терапевтическую пользу за счет минимизации нежелательных эффектов. Далее, согласно настоящему изобретению соединение или его фармацевтически приемлемая соль или сольват указанной соли ингибируют пролиферацию раковых клеток по механизму, зависимому от ингибирования Chk1. Согласно настоящему изобретению предложено новое аминопиразольное соединение или его фармацевтически приемлемая соль или сольват указанной соли, которое является антагонистом Chk1. Такие новые соединения могут быть направлены на удовлетворение потребности в безопасных и эффективных способах лечения рака. Согласно настоящему изобретению предложено соединение, представляющее собой 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил, или его фармацевтически приемлемая соль или сольват указанной соли. Предпочтительными вариантами реализации настоящего изобретения являются 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил,соль муравьиной кислоты 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3 иламино)пиразин-2-карбонитрила,дигидрохлоридная соль 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3 иламино)пиразин-2-карбонитрила; соль метансульфокислоты 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3 иламино)пиразин-2-карбонитрила, а также моногидрат 2-пиразинкарбонитрил 5-5-[2-(3-аминопропокси)-6-метоксифенил]-1H-пиразол-3 ил]амино]мономезилата. Согласно конкретному варианту реализации настоящего изобретения предложено соединение,представляющее собой 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2 карбонитрил. Согласно настоящему изобретению предложены формиат, дигидрохлорид и мезилат 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила. Согласно настоящему изобретению также предложено соединение, представляющее собой моногидрат 2-пиразинкарбонитрил 5-5-[2-(3-аминопропокси)-6-метоксифенил]-1H-пиразол-3 ил]амино]мономезилата. Согласно настоящему изобретению предложен моногидрат 2-пиразинкарбонитрил 5-5-[2-(3-аминопропокси)-6-метоксифенил]-1H-пиразол-3-ил]амино]мономезилата в кристаллической форме, характеризующейся порошковой дифракционной рентгенограммой, содержащей пики при 20,02, равные 12,64, 21,25 и 26,15. Согласно настоящему изобретению предложена фармацевтическая композиция, содержащая 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил или его фармацевтически приемлемую соль или сольват указанной соли в комбинации с фармацевтически приемлемым носителем, разбавителем или эксципиентом. Согласно настоящему изобретению предложен способ лечения рака, включающий введение пациенту, который в этом нуждается, эффективного количества 5-(5-(2-(3-аминопропокси)-6-метоксифенил)1H-пиразол-3-иламино)пиразин-2-карбонитрила или его фармацевтически приемлемой соли или сольвата указанной соли. Кроме того, согласно настоящему изобретению также предложен способ лечения рака, включающий введение пациенту, который в этом нуждается, эффективного количества 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила или его фармацевтически приемлемой соли или сольвата указанной соли совместно с применением ионизирующего излучения. Далее, согласно настоящему изобретению также предложен способ лечения рака, включающий введение пациенту,который в этом нуждается,эффективного количества 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила или его фармацевтически приемлемой соли или сольвата указанной соли совместно с применением химиотерапевтического агента. Согласно настоящему изобретению предложено применение 5-(5-(2-(3-аминопропокси)-6 метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила или его фармацевтически приемлемой соли или сольвата указанной соли для получения лекарственного средства для лечения рака. Кроме того,согласно настоящему изобретению также предложено применение 5-(5-(2-(3-аминопропокси)-6 метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила или его фармацевтически приемлемой соли или сольвата указанной соли для получения лекарственного средства для лечения рака, при этом указанное лечение включает комбинированную терапию с использованием ионизирующего излучения. Кроме того, согласно настоящему изобретению также предложено применение 5-(5-(2-(3 аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила или его фармацевтически приемлемой соли или сольвата указанной соли для получения лекарственного средства для лечения рака путем комбинированной терапии, при этом указанная комбинированная терапия включает введение указанного лекарственного средства и одного или нескольких других химиотерапевтических агентов одному и тому же пациенту. Согласно настоящему изобретению предложен 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1Hпиразол-3-иламино)пиразин-2-карбонитрил или его фармацевтически приемлемая соль или сольват указанной соли для применения в терапии. Согласно настоящему изобретению также предложен 5-(5-(2-(3 аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил или его фармацевтически приемлемая соль или сольват указанной соли для применения при лечении рака. Кроме того, согласно настоящему изобретению предложен 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3 иламино)пиразин-2-карбонитрил или его фармацевтически приемлемая соль или сольват указанной соли для применения в терапии совместно с ионизирующим излучением. Более того, согласно настоящему изобретению предложен 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2 карбонитрил или его фармацевтически приемлемая соль или сольват указанной соли для применения в терапии совместно с химиотерапевтическими агентами. Согласно настоящему изобретению предложен 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1Hпиразол-3-иламино)пиразин-2-карбонитрил или его фармацевтически приемлемая соль или сольват указанной соли, для применения при лечении рака. Кроме того, согласно настоящему изобретению также предложен 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил или его фармацевтически приемлемая соль или сольват указанной соли для применения совместно с ионизирующим излучением при лечении рака. Кроме того, согласно настоящему изобретению предложен 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил или его фармацевтически приемлемая соль или сольват указанной соли для применения совместно с химиотерапевтическими агентами при лечении рака. Согласно настоящему изобретению предложено применение 5-(5-(2-(3-аминопропокси)-6 метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила или его фармацевтически приемлемой соли или сольвата указанной соли для получения лекарственного средства для лечения рака, при этом лекарственное средство предназначено для одновременного, раздельного или последовательного введения совместно с ионизирующим излучением. Согласно настоящему изобретению предложено применение 5-(5-(2-(3-аминопропокси)-6 метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила или его фармацевтически приемлемой соли или сольвата указанной соли для получения лекарственного средства для лечения рака, при этом лекарственное средство также содержит химиотерапевтический агент или предназначено для одновременного, раздельного или последовательного введения совместно с химиотерапевтическим агентом. Согласно настоящему изобретению предложен 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1Hпиразол-3-иламино)пиразин-2-карбонитрил или его фармацевтически приемлемая соль или сольват указанной соли для применения в комбинации одновременно, раздельно или последовательно с ионизи-2 018118 рующим излучением для лечения рака. Согласно настоящему изобретению предложен 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1Hпиразол-3-иламино)пиразин-2-карбонитрил или его фармацевтически приемлемая соль или сольват указанной соли для применения в комбинации одновременно, раздельно или последовательно с химиотерапевтическими агентами для лечения рака. Согласно настоящему изобретению предложена фармацевтическаякомпозиция, содержащая 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил или его фармацевтически приемлемую соль или сольват указанной соли в комбинации с фармацевтически приемлемым носителем и необязательно с другими терапевтическими компонентами. Кроме того, согласно настоящему изобретению предложены предпочтительные варианты реализации описанных в настоящем изобретении способов и применений, где химиотерапевтический агент выбран из группы, состоящей из 5-фторурацила, гидроксимочевины, гемцитабина, метотрексата, пеметрекседа, доксорубицина, этопозида, цисплатина и таксола. Предпочтительные варианты реализации описанных в настоящем изобретении способов и применений относятся к раковым заболеваниям, выбранным из группы, состоящей из рака мочевого пузыря, рака толстой кишки, рака желудка, рака печени, рака легких, рака молочных желез, меланомы, рака яичников, рака поджелудочной железы, мезотелиомы, рака почек и рака матки. Соединение или его фармацевтически приемлемая соль или сольват указанной соли согласно настоящему изобретению могут существовать в таутомерных формах. В том случае, если таутомерные формы существуют, каждая из форм и их смеси находятся в рамках настоящего изобретения. Если не указано иное, настоящее изобретение включает фармацевтически приемлемые соли соединения из примера 3, а также сольваты свободного основания соединения из примера 3 или его фармацевтически приемлемую соль. В настоящем описании термин "фармацевтически приемлемая соль" относится к солям соединения из примера 3. Примеры фармацевтически приемлемых солей и способов их получения известны в данной области техники, см., например, Stahl et al., "Handbook of Pharmaceutical Salts:(2000). Помимо фармацевтически приемлемых солей, настоящее изобретение включает и другие соли. Они могут выступать в качестве промежуточных продуктов при очистке соединений или при получении других фармацевтически приемлемых солей или применяться для идентификации, характеризации или очистки. В настоящем описании термин "пациент" относится к человеку или другим млекопитающим. Более конкретно, термин "пациент" относится к человеку. Термин "лечение" (или "лечить") относится к процессу, включающему замедление, прерывание, остановку, контроль, уменьшение или обращение течения или тяжести симптома, нарушения, состояния или заболевания. В настоящем описании термин "эффективное количество" относится к количеству или дозе соединения или его фармацевтически приемлемой соли или сольвату указанной соли, описанного в настоящем документе, которое в отдельности или в комбинации с ионизирующим излучением или химиотерапевтическим агентом после однократного или многократного введения дозы пациенту обеспечивает желаемый эффект у подвергаемого диагностике или лечению пациента. Эффективное количество может быть без труда определено лечащим врачом, как специалистом в данной области, с учетом ряда факторов, таких как вид млекопитающего; его размер, возраст и общее состояние здоровья; совместное введение других агентов при необходимости; конкретное заболевание; степень или тяжесть указанного заболевания; реакция отдельного пациента; конкретное вводимое соединение; способ введения; характеристики биологической доступности введенного препарата; выбранный режим дозирования; использование каких-либо сопутствующих лекарственных средств и другие значимые условия. 20-150 мг/м 2 является эффективным количеством описанного в изобретении соединения или его фармацевтически приемлемой соли или сольвата указанной соли, что, однако, никоим образом не должно рассматриваться в качестве ограничения данного изобретения. В настоящем описании термин "комбинированная терапия" относится к раздельному, одновременному или последовательному введению описанного в настоящем документе соединения или его фармацевтически приемлемой соли или сольвата указанной соли и химиотерапевтического агента. Кроме того,термин "комбинированная терапия" относится к раздельному, одновременному или последовательному введению описанного в настоящем изобретении соединения или его фармацевтически приемлемой соли или сольвата указанной соли и воздействия ионизирующего излучения. Соединение из примера 3 или его фармацевтически приемлемая соль или сольват указанной соли можно составить для введения как части фармацевтической композиции. В связи с этим фармацевтические композиции, содержащие соединение из примера 3 или его фармацевтически приемлемую соль или сольват указанной соли в комбинации с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами, являются важным вариантом реализации настоящего изобретения. Примеры фармацевтических композиций и способы их получения широко известны в данной области техники, см., например, REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY, A. Gennaro,et al., eds., 19th ed., Mack Publishing (1995). Соединение или его фармацевтически приемлемую соль или сольват указанной соли согласно настоящему изобретению можно вводить любым способом, который делает его биодоступным, включая пероральный и парентеральный пути. Например, указанное соединение или его фармацевтически приемлемую соль или сольват указанной соли можно вводить перорально, подкожно, внутримышечно, внутривенно, трансдермально, местно, интраназально, ректально, трансбуккально и другим подобным способом. Альтернативно, указанное соединение или его фармацевтически приемлемую соль или сольват указанной соли можно вводить с помощью инфузии. Внутривенная инфузия является предпочтительным путем введения. В настоящем описании следующие термины имеют указанные значения: ВСА - бицинхониновая кислота;DMEM - модифицированная по способу Дульбекко среду Игла; ДМФА - диметилформамид; ДМСО - диметилсульфоксид;TR-FRET - перенос энергии флюоресценции с временным разрешением; Трис - трис-(гидроксиметил)аминометан;Tween-20 - полисорбат 20. Результаты следующих исследований свидетельствуют о том, что соединение согласно настоящему изобретению или его фармацевтически приемлемая соль или сольват указанной соли подходят для применения в качестве ингибитора Chk1, ингибитора Chk2 и в качестве противоракового агента. В настоящем описании "IC50" обозначает концентрацию агента, которая обеспечивает 50% от максимального ингибирующего ответа, возможного для данного агента, а "EC50" обозначает концентрацию агента, обеспечивающую 50% от максимального ответа, возможного для данного агента. Биохимический тест на Chk1. Влияние соединений на биохимическую активность Chk1 может быть определено с использованием анализа TR-FRET. В этом анализе используются маркированные тербием антитела, что позволяет обнаруживать фосфорилированный продукт, образующийся в реакции с участием киназы, меченного флуоресцеином субстрата и АТФ. Антитела связываются с фосфорилированным субстратом, что приводит к увеличению значения TR-FRET, вычисляемого как отношение сигнала акцептора (флуоресцеин) к сигналу донора (тербий). Киназные реакции (объем реакции 25 мкл) проводят в 96-луночных наполовину черных полистирольных планшетах (Costa, кат.3694). Реакции инициируют добавлением АТФ. Окончательные условия реакции составляют 50 мМ HEPES рН 7,5, 0,005 об.% TRITON X-100, 2 мМ ДТТ, 2 мМ MgCl2,104 нМ субстрата флуоресцеин-ПКС (Invitrogen, кат.PV3506), 30 мкМ АТФ, 1,5 нМ активного фермента Chk1 (Millipore, кат.14-346), 4 об.% ДМСО и серийные разведения соединения из примера 2(10 серийных разведений 1:3, начиная с 20 мкМ). После добавления АТФ реакции инкубируют при комнатной температуре в течение 75 мин и затем останавливают добавлением 25 мкл буфера для разбавления TR-FRET (Invitrogen кат.PV3574), содержащего 10 мМ ЭДТА и 2,1 нМ антител Tb-pSer (Invitrogen, кат.PV3574). Остановленные реакции инкубируют при комнатной температуре в течение 60 мин,а затем измеряют TR-FRET с использованием спектрофотометра для анализа планшетов Envision фирмыPerkinElmer с фильтрами для длины волны возбуждения 340 нм и эмиссии 495 и 520 нм. Для определения IC50 вычисляют процент ингибирования для каждой концентрации с использованием соотношения TR-FRET из контролей, поставленных на каждом планшете. Затем данные для десяти различных концентраций соединения вводят в логистическое уравнение с четырьмя параметрами с помощью ActivityBase 4.0. Абсолютные значения IC50 вычисляют с помощью полученной кривой. Для соединения из примера 2 в этом исследовании получается значение IC500,001 мкМ. Это показывает, что описанные в настоящем изобретении соединения являются мощными ингибиторами Chk1. Биохимический тест на Chk2. Влияние соединений на биохимическую активность Chk2 может быть определено с использованием анализа TR-FRET. В этом анализе используют маркированные тербием антитела, что позволяет обнаружить фосфорилированный продукт, образующийся в реакции с участием киназы, меченного флуоресцеином субстрата и АТФ. Антитела связываются с фосфорилированным субстратом, что приводит к увеличению значения TR-FRET, вычисляемого как отношение сигнала акцептора (флуоресцеин) к сигналу донора (тербий). Киназные реакции (объем реакции 25 мкл) проводят в 96-луночных наполовину черных полистирольных планшетах (Costa, кат.3694). Реакции инициируют добавлением АТФ. Окончательные условия реакции составляют 50 мМ HEPES рН 7,5, 0,005 об.% TRITON Х-100, 2 мМ ДТТ, 2 мМ MgCl2,104 нМ субстрата флуоресцеин-ПКС (Invitrogen, кат.PV3506), 30 мкМ АТФ, 2,5 нМ активного фермента Chk2 (Millipore, кат.14-347), 4 об.% ДМСО и серийные разведения соединения из примера 2(10 серийных разведений 1:3, начиная с 20 мкМ). После добавления АТФ реакции инкубируют при комнатной температуре в течение 75 мин и затем останавливают добавлением 25 мкл буфера для разбавления TR-FRET (Invitrogen, кат.PV3574), содержащего 10 мМ ЭДТА и 2,1 нМ антител Tb-pSer(Invitrogen, кат.PV3574). Остановленные реакции инкубируют при комнатной температуре в течение 60 мин, а затем измеряют TR-FRET с использованием спектрофотометра для анализа планшетов Envision фирмы PerkinElmer с фильтрами для длины волны возбуждения 340 нм и эмиссии 495 и 520 нм. Для определения IC50 вычисляют процент ингибирования для каждой концентрации с использованием соотношения TR-FRET из контролей, поставленных на каждом планшете. Затем данные для десяти различных концентраций соединения вводят в логистическое уравнение с четырьмя параметрами с помощью ActivityBase 4.0. Абсолютные значения IC50 вычисляют с помощью полученной кривой. Для соединения из примера 2 в этом исследовании получается значение IC50 0,0047 мкМ. Это показывает, что описанные в настоящем изобретении соединения являются мощными ингибиторами Chk2. Тест на аутофосфорилирование Chk1 в клетках. Ингибитор Chk1 предотвращает фосфорилирование субстратов за счет киназной активности указанного белка в клетках, в которых активирован ответ на повреждение ДНК. Легко детектируемым субстратом Chk1 является сайт аутофосфорилирования самого белка Chk1, серин 296. Следующий анализ с использованием иммуноблота можно использовать для измерения степени фосфорилирования серина 296 белка Chk1 и косвенно уровня активности протеинкиназы Chk1. Клетки HeLa (приобретенные в АТСС) культивируют в MEM с солями Эрла (Invitrogen), L-глутамином (Gibco) и с добавлением 10 об.% термоинактивиронной FBS (Gibco), 1 заменимых аминокислот среды MEM (Gibco), 1 пирувата натрия (Gibco) и рассевают в 24-луночные планшеты для клеточных культур по 1105 клеток в 600 мкл культуральной среды MEM (см. выше) в лунку. Клетки инкубируют в течение 24 ч при 37C,5%-ном CO2 и 95-100%-ной влажности. 16 мкл 4 мкМ раствора доксорубицина (Sigma) для разведения в культуральной среде добавляют к каждой соответствующей лунке для получения конечной концентрации 100 нМ доксорубицина. Планшеты помещают в инкубатор еще на 24 ч перед добавлением соедине-5 018118 ния-ингибитора Chk1. Соединения растворяют в концентрации 10 мМ в 100%-ном ДМСО, затем разбавляют до 2 мМ в 40%-ном (об.%) ДМСО, а затем разбавляют до 100 мкМ в культуральной среде плюс 4 об.% ДМСО. Впоследствии подготавливают серийные разбавления соединений (1:3) в диапазоне от 100 до 0,005 мкМ. 66 мкл раствора указанного соединения для разведения добавляют в соответствующие лунки планшета для получения конечной концентрации ДМСО 0,4 об.% и конечной концентрации соединения в диапазоне от 1 до 0,0005 мкМ. Планшеты помещают в инкубатор еще на 2 ч, а затем вынимают для лизирования клеток и обработки. Затем среду удаляют из планшета, каждую лунку промывают один раз 0,5 мл ледяного DPBS (Gibco), удаляют всю жидкость и помещают планшет на лед до конца процедуры. В каждую лунку добавляют 75 мкл ледяного лизирующего буфера, включающего буфер для экстракции клеток (Invitrogen), который содержит ингибиторы фосфатазы (Sigma) и ингибиторы протеазы (Roche Diagnostics). Спустя 10 мин каждую лунку соскабливают и переносят лизат в микроцентрифужную полипропиленовую пробирку объемом 1,5 мл на льду. Каждый лизат обрабатывают ультразвуком в течение 45 с на соникаторе с чашечным излучателем (Misonix), при этом выдерживая образцы в водяной/ледяной бане. 50 мкл каждого образца переносят в микроцентрифужную полипропиленовую пробирку объемом 0,5 мл, содержащую 25 мкл 4 буфера для образцов Лэммли (240 мМ Tris-HCl, pH 6,8, 40% глицерина, 0,05% бромфенолового синего, 8 об.% ДСН и 20 об.% 2-меркаптоэтанола), нагревают при 95C в течение 5 мин и хранят замороженными при -80C. Оставшийся лизат используют для определения концентрации белка (ВСА protein assay kit, Thermo Scientific). 5 мкг каждого клеточного лизата в буфере для образцов наносят на 96-луночный гель E-Page (Invitrogen) и подвергают электрофорезу согласно инструкциям изготовителя. Белки переносят из геля на мембрану Immobilon-P (Millipore) согласно широко распространенным в данной области техники методам [Towbin et al., 1979]. Мембрану быстро ополаскивают раствором, содержащим 10 мМ Tris/HCl pH 8,0, 150 мМ NaCl и 0,05 об.% Tween 20(TBST) и вымачивают в течение 1 ч при 25C в TBST/5 об.% разведенного сухого молока Carnation. Мембрану промывают четыре раза в TBST в течение 5 мин, затем вымачивают при 4C в течение 24 ч вTBST/5 об.% БСА с соответствующим разведением антител кролика против фосфорилированного Chk1(серин 296) (Cell Signaling). Мембрану промывают четыре раза в TBST в течение 5 мин при 25C, а затем вымачивают в 25C в течение 2 ч в TBST/ 5%-ном молоке, содержащем соответствующее разведение конъюгата ослиных антикроличьих IgG с пероксидазой хрена (HRP; Amersham), для обнаружения аутофосфорилированного белка Chk1. Мембрану снова промывают TBST четыре раза в течение 5 мин при 25C. Комплексы антиген-антитело-репортер, иммобилизированные на мембране, детектируют с помощью Super Signal Western Femto HRP-detection reagent (Pierce) в соответствии с рекомендациями изготовителя с использованием хемилюминесцентного устройства для визуализации (Fujifilm). Интенсивность полосы фосфорилированного Chk1 (серин 296) вычисляют с использованием программного обеспечения"Total Lab" (Nonlinear Dynamics). Процент ингибирования вызванного доксорубицином аутофосфорилирования Chk1 вычисляют с помощью следующей формулы:% ингибирования = (интенсивность полосы фосфорилированного Chk1 из образца - интенсивность полосы фосфорилированного Chk1 из отрицательного контроля без доксорубицина)/(интенсивность полосы фосфорилированного Chk1 из положительного контроля с доксорубицином - интенсивность полосы фосфорилированного Chk1 из отрицательного контроля без доксорубицина)100. Для соединения из примера 2 в этом исследовании было получено значение EC500,0005 мкМ. Это показывает, что описанные в настоящем изобретении соединения являются мощными ингибиторамиChk1. Тест на вызванное доксорубицином подавление контрольной точки G2M клеточного цикла в клетках HeLa с использованием микропланшетного цитометра Acumen. Ингибитор Chk1 инактивирует точку G2M контроля повреждения ДНК в дефектных по р 53 опухолевых клетках, обработанных ингибитором топоизомеразы II доксорубицином. Мерой подавления контрольной точки G2M является фосфорилирование гистона H3 по серину 10, которое происходит после прохождения клеткой контрольной точки G2M и входа в митоз. Описанное ниже исследование, связанное с высокосодержательным анализом изображений, можно использовать для измерения фосфорилирования гистона H3 в клетках. Клетки HeLa (приобретенные в АТСС) культивируют в среде MEM Media(Gibco) с добавлением 10%-ного (об.%) FBS и рассевают в покрытые поли-D-лизином черные планшеты с прозрачным дном (BD Biocoat кат.3504640) по 2000 клеток в 100 мкл на лунку. Затем планшеты выдерживают в инкубаторе для клеточных культур течение 18-24 ч (37C, 5% CO2 и 95%-ная относительная влажность). После начальной инкубации добавляют 20 мкл среды Gibco MEM Media с 10%ной FBS, содержащей 625 нМ доксорубицина, к соответствующим лункам планшетов, получая конечную концентрацию 125 нМ. Планшеты помещают в инкубатор на 24 ч, что достаточно для блокировки клеток в контрольной точке G2M. На следующий день клетки обрабатывают соединением из примера 2. Соединение из примера 2 растворяют в концентрации 10 мМ в 100%-ном ДМСО, а затем разбавляют до 10 Х раствора для разведения, начиная от 50 мкМ, в 4%-ной (об.%) ДМСО-МЕМ. Впоследствии были приготовлены серийные разбавления соединений (1:2) в диапазоне от 50 до 0,39 мкМ. 13 мкл раствора соединения для разведения добавляют в соответствующие лунки планшета для получения конечной концентрации ДМСО 0,4% и конечной концентрации соединения в диапазоне от 5 до 0,039 мкМ. Планшеты помещают в инкубатор еще на 7 ч, а затем вынимают для фиксации. Жидкость осторожно удаляют из каждой лунки и добавляют 100 мкл фиксатора PREFER (Anatech LTD. кат.414). Планшеты выдерживают при комнатной температуре в течение 20 мин, удаляют фиксатор, а затем мембрану клеток делают проницаемой добавлением 100 мкл на лунку 0,1%-ного (об.%) Triton X 100 (Pierce кат.28314) в DPBS (Gibco кат.14040) в течение 10 мин. Раствор удаляют и дважды промывают планшет 100 мкл DPBS на лунку с последующим добавлением 100 мкл DPBS, содержащего 50 мкг/мл РНКазы (Ribonuclease A, Sigma кат.R-6513), в течение 1 ч при комнатной температуре. Раствор РНКазы удаляют и окрашивают клетки для выявления присутствия гистона H3, фосфорилированного по серину 10 (pHH3), добавляя к каждой лунке 50 мкл раствора РНКазы, содержащего 1:500 разведение антител кролика против pHH3 (ser10) (UBI кат.06-570) плюс 1% (вес./об.) БСА (Gibco кат.15260). Планшеты запечатывают и выдерживают при 4C в течение ночи. Первичные антитела удаляют, дважды промывая каждый планшет 100 мкл DPBS на лунку и заменяют 50 мкл 1:750 разведения козьих антикроличьих IgG, конъюгированных с красителем Alexa 488 (Invitrogen кат.А 11008) вDPBS плюс 1% BSA. Планшеты, покрытые алюминиевой фольгой для защиты от света, инкубируют в течение 1 ч при комнатной температуре. Планшеты снова дважды промывают 100 мкл DPBS на лунку и заменяют их содержимое 100 мкл 15 нМ пропидиум иодида (разведение 1:100 с помощью PBS из исходного раствора, Molecular Probes кат.Р 3566). Планшеты запечатывают черной пленкой для защиты от света. Планшеты инкубируют в течение 30 мин для окраски ядер. Планшеты сканируют с помощью Лазерного сканирующего флюоресцентного микропланшетного цитометра ACUMEN EXPLORER с использованием длины волны возбуждения 488 нм (ТТР LABTECH LTC) для измерения pHH3 и содержания ДНК, включая диплоидные (2N) и тетраплоидные клетки (4N). pHH3-позитивные клетки идентифицируют с помощью средней интенсивности сигнала красителя Alexa 488 в области 519 нм. Общую интенсивность сигнала пропидийиодида/ДНК в области 655-705 нм используют для идентификации отдельных клеток и субпопуляций клеток на различных стадиях клеточного цикла (диплоидные клетки 2N,тетраплоидные клетки 4N). Конечную величину каждой клеточной популяции определяют путем нормирования к % от общего числа клеток, получая конечный результат эксперимента в %pHH3, %2N и %4N. Затем 100%-ную активность определяют путем обработки клеток максимальной концентрацией 100 нМ контрольного соединения-ингибитора для установления конечной процентной активности каждого соединения. За 0%-ную активность принимают активность в отсутствие обработки каким-либо соединением. Относительную EC50 определяют с помощью средства подбора кривых ACTIVITY BASE, совместимого с Excel, используя логистический подбор с четырьмя параметрами, уравнение 205, для определения %pHH3 относительно максимального значения в контроле при 100%. Для соединения из примера 2 в этом исследовании было получено значение EC50 0,0105 мкМ. Это показывает, что описанные в настоящем изобретении соединения инактивируют точку G2M контроля повреждения ДНК. Тест на ЕСдкпч (Двукратное повышение чувствительности). Ингибитор Chk1 способен усиливать антипролиферативную активность гемцитабина (или других цитотоксических соединений) за счет подавления контрольной точки внутри фазы S, что проявляется в устойчивом и повышенном уровне повреждения ДНК. Способность к непрерывной пролиферации опухолевой клетки после повреждения ДНК можно исследовать путем определения способности клеток реплицировать свою ДНК. В этом эксперименте оценивается способность клеток реплицировать свою ДНК после того, как у клеток была возможность произвести репарацию повреждений ДНК. В этом эксперименте клетки обрабатывают гемцитабином, а затем соединением из примера 2. После периода восстановления клетки оценивают на предмет способности включать радиоактивный тимидин в ДНК во время фазы S. Параметр ЕСдкпч является мерой концентрации ингибитора Chk1, необходимой для уменьшения в два раза концентрации гемцитабина, вызывающей 90%-ное ингибирование роста опухоли, измеренной в этом тесте в отсутствие ингибирования Chk1. Клетки НТ-29 (приобретенные в АТСС) выращивают на среде RPMI 1640 с добавлением 10 об.% термоинактивированной FBS (Gibco). Эти клетки рассевают в 96-луночные планшеты для клеточных культур Corning Costar по 1,3103 клеток в лунку. После рассева клеток планшеты для клеточных культур инкубируют при комнатной температуре в течение 45 мин,прежде чем вернуть их в 37C. Планшеты инкубируют в течение 24 ч перед добавлением гемцитабина. Перед добавлением гемцитабина из всех лунок планшета удаляют среду и заменяют ее 150 мкл свежей среды RPMI на лунку. Растворы гемцитабина для разведения в концентрации 10 мМ готовят в фосфатносолевом буфере. Разведения гемцитабина готовят в 4 концентрации в среде RPMI и добавляют в лунки по 50 мкл на лунку. Самая высокая конечная концентрация гемцитабина, которую используют в эксперименте, составляет 80 мкМ, а остальные разбавления производят с четырехкратными интервалами. 2 ч спустя содержащую гемцитабин среду удаляют из лунок и замещают ее 150 мкл свежей среды RPMI на лунку. Соединение из примера 2 (10 мМ в ДМСО) сначала разбавляют ДМСО до 2000 конечных концентраций, а затем разбавляют 1:500 средой RPMI для получения 4 растворов для разведения для добавления в лунки. Добавленный объем составляет 50 мкл. Разведения соединений проводят с двукрат-7 018118 ными интервалами, начиная с концентрации 5000 нМ. Спустя 24 ч после добавления соединения из примера 2 содержащую ингибиторы среду удаляют аспирацией и заменяют 200 мкл свежей среды RPMI на лунку. Спустя 72 ч после удаления соединения из примера 2 начинают мечение с помощью маркированного тритием тимидина. 3 Н-тимидин (NET 027X001, PerkinElmer, удельная активность 20 Ки/ммоль) растворяют 1:20 в полной среде RPMI для получения концентрации 0,05 мКи/мл. 20 мкл этого раствора добавляют в каждую лунку для получения концентрации 3 Н-тимидина 1 мкКи/лунку. Мечение клеток проводят в течение 24 ч. Среду, содержащую 3 Н-тимидин, полностью удаляют из лунок. Затем планшеты замораживают при -20C в течение нескольких часов. Для сбора ДНК, содержащей включенный 3 Нтимидин, планшеты размораживают в течение нескольких минут, а затем в каждую лунку добавляют 120 мкл 0,1 н. NaOH. Затем каждый планшет инкубируют в течение 10 мин при 37C с медленным помешиванием на роторной мешалке. ДНК собирают с помощью Filtermate 196 Harvester (PerkinElmer) и помещают на 96-луночные планшеты Unifilter GF/C (PerkinElmer, кат.6005174). Лунки планшета для клеточных культур, в котором проводили мечение клеток, промывают водой 5 раз. Мембраны планшетаUnifilter промывают дополнительными 4,5 мл на лунку (31,0 мл и 1,5 мл в конце). Затем планшеты Unifilter высушивают при 37C в течение по крайней мере 6 ч. Дно каждого фильтр-планшета запечатывают клеящейся полоской Backseal (PerkinElmer) и добавляют 50 мкл на лунку MicroScint-20 (Perkin Elmer). Затем каждый планшет запечатывают прозрачной клеящейся полоской Topseal (PerkinElmer). Сбор данных с планшетов проводят с помощью сцинтилляционного счетчика Topcount (PerkinElmer) со скоростью 1 мин/лунку. Число импульсов 3 Н-тимидина в минуту (имп/мин) экспортируют в программу Prism(GraphPad) для анализа и построения графика. Зависимость эффекта от дозы гемцитабина определяют для каждой концентрации соединения из примера 2. Для этого нормируют показатель имп/мин, взяв за 100% мечения средний показатель имп/мин для концентрации соединения из примера 2 в отсутствие гемцитабина, а за отсутствие мечения (100%-ое ингибирование) имп/мин = 0 (отсутствие импульсов в минуту). Для построения графика в программе Prism концентрации гемцитабина преобразовывают в логарифмические значения, а кривые "доза-эффект" получают с помощью нелинейной регрессии. Ограничения крайних значений не вводились. Значение ЕСдкпч составляет 0,3 нМ. Более того, 3 нМ соединения из примера 2 снижают EC50 гемцитабина в 7 раз с 37 до 5 нМ в клетках карциномы толстой кишки НТ 29. Действие соединения из примера 2 также увеличивает процент ингибирования пролиферации с 52 для гемцитабина до 73 для указанной комбинации. Сами по себе 3 нМ соединения из примера 2 оказывают слабый эффект на пролиферацию клеток НТ 29. Тест на целевое ингибирование Chk1 in vivo. Клетки Calu-6 (ATCC) культивируют и наращивают в питательной среде (MEM с солями Эрла(Invitrogen, с L-глютамином (Gibco) с добавлением 10 об.% термоинактивированной FBS (Gibco),1-кратной средой MEM с заменимыми аминокислотами (Gibco), 1 пируватом натрия (Gibco). Клетки собирают и дважды промывают фосфатно-солевым буфером, смешивают 1106 клеток в питательной среде (без сыворотки) с равным объемом BD Matrigel matrix (BD Bioscience, Franklin, NJ), затем вводят подкожно в бок предварительно облученных (4,5 Гр) голых мышей (атимические голые мыши от Harlan,Indianapolis, IN). На 15-й день после имплантации (размер опухоли = 150-200 мм 3) начинают ежедневно внутрибрюшинно вводить животным свежеприготовленный физиологический раствор гемцитабина(Hospira, Lake Forest, IL) в дозировке 150 мг/кг, 6 ч спустя животным внутривенно вводят соединение из примера 2, растворенное в смеси с молярным соотношением метансульфоновая кислота/20% Captisol(CYDEX, Overland Park, KS), в переменной дозировке от 15 мг/кг и ниже. Животных умерщвляют спустя 2 ч после введения ингибитора Chk1, проводят сбор опухолей и немедленно обрабатывают их в ледяном буфере для экстракции клеток (Cell Extraction buffer) (Invitrogen, кат.FNN0011), содержащем ингибиторы фосфатазы (Sigma) и ингибиторы протеазы (Roche Diagnostics). Опухоли обрабатывают в 1,5-2,0 мл лизирующего буфера в замороженной полипропиленовой конической пробирке на 15 мл с использованием моторизованного тканевого гомогенизатора (Powergen 700) в интенсивном режиме в течение 15 с. Держа образец на льду, лизат четыре раза втягивают через шприц на 1 мл с иглой 25 размера. Затем 0,35 мл лизата опухоли переносят в микроцентрифужную полипропиленовую пробирку объемом 1,5 мл,содержащую 0,15 мл 4 буфера для образцов Лэммли (240 мМ Tris-HCl, рН 6,8, 40% глицерина, 0,05% бромфенолового синего, 8 об.% ДСН и 20 об.% -меркаптоэтанола). Затем образец перемешивают, нагревают при 95C в течение 5 мин и обрабатывают ультразвуком в течение 1 мин на соникаторе Misonix 3000 с чашечным излучателем в режиме высокой мощности. После этого образцы хранят на льду или при -80C для оценки целевого ингибирования с помощью вестерн-блоттинга. Оставшийся лизат используют для определения концентрации белка (ВСА protein assay kit, Thermo Scientific). 5 мкг каждого опухолевого лизата в буфере для образцов наносят на 96-луночный гель Е-Page (Invitrogen) и подвергают электрофорезу согласно инструкциям изготовителя. Белки переносят на мембрану Nitrocellulose ProtranBA83 (Whatman) согласно широко распространенным в данной области техники методам [Towbin et al.,1979]. Затем мембрану подвергают процессу измерения аутофосфорилирования белка Chk1 по серину 296. Мембрану кратко ополаскивают водой, а затем раствором, содержащим 10 мМ Tris/HCl рН 8,0,150 мМ NaCl и 0,05 об.% Tween 20 (TBST) и вымачивают в течение 1 ч при 25C в TBST/5 об.% разве-8 018118 денного сухого молока Carnation. Затем мембрану четыре раза промывают в TBST в течение 5 мин. Мембрану вымачивают при 4C в течение 16 ч в TBST/5 об.% БСА с соответствующим разведением антител кролика против фосфорилированного Chk1 (серин 296) (Cell Signaling). После этого мембрану промывают четыре раза в TBST в течение 5 мин при 25C, а затем вымачивают при 25C в течение 2 ч вTBST/5%-ном молоке, содержащем соответствующее разведение конъюгата ослиных антикроличьих IgG с пероксидазой хрена (HRP; Amersham), для обнаружения фосфорилированного Chk1 (серин 296). Мембрану снова промывают TBST четыре раза в течение 5 мин при 25C. Конъюгаты антиген-антителорепортер, иммобилизованные на мембране, детектируют с помощью Super Signal Western FemtoHRP-detection reagent (Pierce) в соответствии с рекомендациями изготовителя. Сигналы детектируют и фиксируют с использованием системы визуализации FUJI LAS-4000. Интенсивность полосы фосфорилированного Chk1 (серин 296) подсчитывают с использованием программного обеспечения "Total Lab" (Nonlinear Dynamics). Процент ингибирования вызванного гемцитабином аутофосфорилирования Chk1 вычисляют с помощью следующей формулы:% ингибирования = (интенсивность полосы фосфорилированного Chk1 из образца - средняя интенсивность полосы фосфорилированного Chk1 из положительного контроля (Мах) с гемцитабином)/(средняя интенсивность полосы фосфорилированного Chk1 из отрицательного контроля (Min) средняя интенсивность полосы фосфорилированного Chk1 из положительного контроля (Max) с гемцитабином)100. Для соединения из примера 2 в этом исследовании получают значение целевой модулирующей эффективной дозы 50 (ЦМЭД 50) для аутофосфорилирования Chk1, равное 0,03 мг/кг. Ксенотрансплантатные модели опухолей человека. Способность ингибиторов Chk1 осуществлять уничтожение опухоли может быть определена in vivo с использованием ксенотрансплантатных моделей эффективности опухолей легкого Calu-6 и толстого кишечника НТ-29. Клетки рака легких Calu-6 (АТСС) культивируют и наращивают в питательной среде(MEM с солями Эрла (Invitrogen) с L-глютамином (Gibco) с добавлением 10 об.% термоинактивированной FBS (Gibco), 1MEM с заменимыми аминокислотами (Gibco), 1 пируватом натрия (Gibco),а клетки рака толстой кишки НТ-29 (АТСС) культивируют и наращивают в питательной среде (среда Мак-Коя 5 А (Gibco) с добавлением 10 об.% FBS (Gibco. Клетки собирают и дважды промывают в фосфатно-солевом буфере, смешивают 5106 (НТ-29) или 1106 (Calu-6) клеток в питательной среде (без сыворотки) с равным объемом BD Matrigel matrix (BD Bioscience, Franklin, NJ), затем подкожно вводят в бок голых мышей (CD-1 nu/nu, из Charles River Labs, Wilmington, MA). Примерно на 16-й день после имплантации (150-200 мм 3) начинают ежедневно вводить животным внутрибрюшинно свежеприготовленный физиологический раствор с гемцитабином в дозировке 60 мг/кг, 24 ч спустя животным внутривенно вводят соединение из примера 2, растворенное в смеси с молярным соотношением метансульфоновая кислота/20% Captisol (CYDEX, Overland Park, KS). После дня отдыха введение дозы повторяют в течение еще 3 циклов (Q3D4 со сдвигом +24 ч по ингибитору Chk1). Каждая группа, обрабатываемая одной дозой, состоит из девяти животных. Реакцию опухоли определяют измерением объема опухоли,выполняющимся два раза в неделю во время курса лечения. Ингибирование роста опухоли (ИРО) вычисляют как процент снижения среднего размера опухоли у группы, которую обрабатывают соединением,по сравнению со средним размером опухоли у контрольной группы, которую обрабатывают инертным веществом. Соединение из примера 2 само по себе и в комбинации с гемцитабином демонстрирует превосходную дозозависимую противоопухолевую активность как в ксенотрансплантатных моделях опухолей НТ-29, так и опухолей Calu-6, увеличивая ингибирование роста опухоли до шести раз по сравнению с гемцитабином в чистом виде. Дозирование эффективности единичного агента. Способность ингибиторов Chk1 осуществлять уничтожение опухоли может быть определена in vivo с использованием ксенотрансплантатной модели эффективности рака легкого Calu-6. Клетки рака легкого Calu-6 (АТСС) культивируют, как описано выше. Клетки собирают и дважды промывают в фосфатносолевом буфере и 1106 клеток (Calu-6) в питательной среде (без сыворотки) смешивают с равным объемом BD Matrigel matrix (BD Bioscience, Franklin, NJ), а затем подкожно вводят в бок голых мышей(150-200 мм 3) начинают вводить соединение из примера 2 в дозировке 15 мг/кг (подкожно (п/к, дважды в сутки (2 раза/сутки 5 и пауза на 2 дня)3 цикла. Реакцию опухоли определяют измерением объема опухоли, выполняющимся два раза в неделю во время курса лечения. Соединение из примера 2, вводимое по 5-дневному графику 2 раза/сутки (15 мг/кг), обеспечивает лучшее ингибирование роста по сравнению с ранее описанным графиком ввода комбинации гемицитабина и соединения из примера 2. Полный регресс опухоли имеет быстрый и стойкий характер. Тест на пролиферацию и цитотоксичность в монослое. Одним из показателей активности ингибитора Chk1 является его способность ингибировать пролиферацию раковых клеток в культуре вследствие неконтролируемой активации ориджинов репликации(Conti et al. Cell Cycle. 6: 2760-2767, 2007). Определение антипролиферативной активности ингибитораChk1 в клеточных линиях, полученных из широкого диапазона типов опухолей, является показателем того, какие типы опухолей могут быть клинически восприимчивыми к химиотерапии с использованием ингибиторов Chk1. Описанный ниже тест на клеточную пролиферацию проводится в Oncotest, GmbH в Германии. 30 клеточных линий солидных опухолей получают из 13 различных гистотипов опухолей,каждый из которых представлен 1-6 различными клеточными линиями (Oncotest, GmbH). Их получают из рака мочевого пузыря, мозга, толстого кишечника, желудка, печени, легких, молочной железы, яичников, поджелудочной железы, почек и тела матки, а также из меланомы и плевромезотелиомы. Все клеточные линии получают в Oncotest из выделенных из пациентов опухолевых ксенотрансплантатов (Rothet al., 1999). Происхождение ксенотрансплантатов донора описано Fiebig et al. (Fieberg et al., 1992 and 1999). Клеточные линии обычно пересевают один или два раза в неделю и поддерживают в культуре вплоть до 20 пассажей. Все клетки выращивают при 37C в увлажненной атмосфере с 5%-ным CO2 в среде RPMI 1640 (РАА, Clbe, Germany) с добавлением 10 об.% эмбриональной сыворотки теленка (РАА, Clbe,Germany) и 0,1 мг/мл гентамицина (РАА, Colbe, Germany). Для оценки цитотоксической активности соединений по отношению к этим клеточным линиям используют модифицированный тест с иодидом пропидия. В общих чертах, адгезивные клетки собирают из находящихся в экспоненциальной фазе роста культур с помощью трипсинизации, подсчитывают и высевают в 96-луночные титрационные микропланшеты с плоским дном, при этом плотность клеток зависит от клеточной линии (4000-20000 клеток/лунка). После 24-часового периода восстановления, который дает клеткам возможность прикрепиться к субстрату и возобновить экспоненциальный рост, добавляют 10 мкл культуральной среды (6 контрольных лунок/планшет) или культуральной среды, содержащей соединение из примера 2. Растворы соединения для разведения из примера 2 приготавливают в ДМСО в концентрации 1 мМ. Последующие разбавления проводят в полной среде для клеточных культур RPMI 1640 следующим образом: раствор в ДМСО для разведения сначала разбавляют 1:22 (содержание ДМСО 4,5 об.%). Используя этот раствор,готовят серийные разбавления (полулогарифмические или 2-кратные) в среде для клеточных культур. Для заключительного этапа разбавления (1:15) 10 мкл на лунку соответствующего конечного раствора соединения непосредственно добавляют к 140 мкл на лунку культуральной среды. Конечная концентрация ДМСО составляет 0,3 об.%. Соединение из примера 2 тестируют в трех повторах на десяти точках кривой концентрации, а обработку продолжают в течение 4 дней. После 4 дней обработки культуральную среду удаляют и заменяют 200 мкл водного раствора PI с концентрацией 7 мкг/мл. Для подсчета числа жизнеспособных клеток проницаемость клеток повышают с помощью замораживания, что приводит к гибели всех клеток, которые остаются прикрепленными к поверхности лунки после обработки соединением. Наконец, измеряют флюоресценцию PI, используя считывающее устройство для микропланшетов Cytofluor 4000 ( возбуждения = 530 нм,эмиссии = 620 нм), для определения общего числа жизнеспособных клеток. Ингибирование роста выражают значением тест/контроль 100 (% Т/К). На основе значений Т/К определяют относительные значения IC50, используя нелинейную регрессию(log[конц. ингибитора] в сопоставлении с ответом (% Т/К. Соединение из примера 2 ингибирует рост большинства этих опухолевых клеточных линий при EC50 менее 20 нМ, позволяя предполагать потенциально широкую противораковую активность у агента в чистом виде. Примеры получения и примеры приведены с целью более подробной иллюстрации настоящего изобретения и представляют собой типичные способы синтеза соединения или его фармацевтически приемлемой соли или сольвата указанной соли. Названия соединений согласно настоящему изобретению в общем случае получены при помощи ChemDraw Ultra 10.0 или 11.0, кроме случаев, когда указано иное. Путь синтеза А. Пример получения 1. 5-Изотиоцианатопиразин-2-карбонитрил Раствор тиофосгена (1,86 г, 15 ммоль) в ТГФ добавляют по каплям к раствору 5-аминопиразин-2 карбонитрила (1,20 г, 10 ммоль) и пиридина (2 мл) в CH2Cl2 (200 мл) и ТГФ (25 мл) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Смесь концентрируют и неочищенный продукт разбавляют этилацетатом, фильтруют и концентрируют, получая указанное в заголовке соединение. Диизопропилазодикарбоксилат (2,82 г, 14,0 ммоль) добавляют при перемешивании к раствору третбутил-3-гидроксипропилкарбамата (2,45 г , 14,0 ммоль), 1-(2-гидрокси-6-метоксифенил)этанона (1,94 г,11,7 ммоль) и трифенилфосфина (3,66 г, 14,0 ммоль) в ТГФ (50 мл) при комнатной температуре. После перемешивания в течение 18 ч растворитель удаляют при пониженном давлении и неочищенный продукт хроматографируют (градиент гексан-этилацетат 0-60%), получая 1,60 г указанного в заголовке соединения. Пример 1. Соль муравьиной кислоты 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3 иламино)пиразин-2-карбонитрила 1 М раствор гексаметилдисилазана лития в ТГФ (7,6 мл, 7,6 ммоль) медленно добавляют при перемешивании к раствору трет-бутил-3-(2-ацетил-3-метоксифенокси)пропилкарбамата (1,08 г, 3,17 ммоль) в безводном ТГФ (25 мл) при комнатной температуре. После перемешивания в течение 10 мин добавляют 5-изотиоцианатопиразин-2-карбонитрил (0,510 г, 3,17 ммоль) в ТГФ (4 мл) и продолжают перемешивание в течение 30 мин. Реакционную смесь концентрируют и повторно растворяют в этаноле (50 мл) и уксусной кислоте (5 мл) с последующим добавлением гидрата гидразина (2 мл). Затем полученную реакционную смесь нагревают при 120C в течение 2 мин. После этого реакционную смесь охлаждают до комнатной температуры, разбавляют в воде (100 мл) и экстрагируют этилацетатом (2100 мл). Органическую часть высушивают над безводным Na2SO4, фильтруют и концентрируют. Неочищенный продукт повторно растворяют в дихлорметане (50 мл), обрабатывают трихлоруксусной кислотой (10 мл) и перемешивают при комнатной температуре в течение 15 мин. Растворитель удаляют и неочищенный продукт(49,9 г, 361 ммоль), йодид натрия (2,68 г, 18,1 ммоль) и 4-метоксибензилхлорид (27,0 мл, 198,6 ммоль) в ТГФ и нагревают смесь с обратным холодильником в течение ночи. Смесь охлаждают до комнатной температуры, разбавляют водой и экстрагируют этилацетатом. Объединенные органические экстракты промывают раствором соли и высушивают над безводным MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают хроматографией на силикагеле с использованием в качестве элюента этилацетата/гексанов, получая 32,51 г (57%) требуемого продукта в виде белого твердого вещества. Пример получения 4. 1-(2-Метокси-6-(4-метоксибензилокси)фенил)-3,3-бис-(метилтио)проп-2-ен-1-он В колбу с круглым дном объемом 500 мл помещают 95% NaH (7,28 г, 288 ммоль) и добавляют безводный ДМСО (170 мл). К получившейся гетерогенной смеси по каплям добавляют 1-[2-метокси-6-(4 метоксибензилокси)фенил]этанон (41,2 г, 144 ммоль) в безводном ДМСО (60 мл). Смесь перемешивают при комнатной температуре в течение 10 мин и в это время по каплям добавляют сероуглерод (8,69 мл,- 11018118 144 ммоль), а сразу после этого метилйодид (18,0 мл, 288 ммоль). При добавлении обоих реактивов происходит выделение газа и теплоты, поэтому его необходимо проводить осторожно. Однородный раствор перемешивают при комнатной температуре в течение 18 ч, а затем медленно добавляют к трем объемам воды. Твердый продукт отфильтровывают и высушивают под высоким вакуумом, получая указанное в заголовке соединение в виде оранжевого твердого вещества. Пример получения 5. 5-Бром-N-(5-(2-метокси-6-(4-метоксибензилокси)фенил)-1H-пиразол-3-ил)пиразин-2-амин 5-Бромпиразин-2-амин (3,73 г, 21,4 ммоль) растворяют в ТГФ (30 мл) и охлаждают до -78C. Медленно добавляют раствор н-бутиллития в гексане (10,32 мл, 23,5 ммоль). Реакционную смесь перемешивают при низкой температуре в течение 15 мин, а затем медленно нагревают до комнатной температуры и перемешивают в течение еще 1 ч. Смесь повторно охлаждают до 0C и добавляют раствор 1-(2-метокси-6-(4-метоксибензилокси)фенил)-3,3-бис-(метилтио)проп-2-ен-1-она (8,39 г, 21,4 ммоль) в ТГФ (50 мл) через канюлю. Раствор становится однородным и его перемешивают в течение 15 мин при комнатной температуре перед нагреванием с обратным холодильником в течение 10 ч. Затем раствор охлаждают до комнатной температуры и удаляют растворитель при пониженном давлении. Сухой остаток растворяют в EtOH (150 мл) и добавляют ледяную уксусную кислоту (1,3 мл, 23,5 ммоль). Добавляют гидрат гидразина (5,25 мл, 107 ммоль) и нагревают раствор с обратным холодильником в течение еще 8 ч. Смесь охлаждают до комнатной температуры и концентрируют под вакуумом. Продукт очищают хроматографией на силикагеле (CH2Cl2/MeOH), получая 5,76 г (74%) коричневого твердого вещества. Пример получения 6. 2-(3-(5-Бромпиразин-2-иламино)-1H-пиразол-5-ил)-3-метоксифенол 5-Бром-N-(5-(2-метокси-6-(4-метоксибензилокси)фенил)-1H-пиразол-3-ил)пиразин-2-амин (3,1 г,6,43 ммоль) растворяют в MeOH (100 мл). Газообразный HCl пропускают через указанную реакционную смесь в течение 20 мин. Смесь перемешивают в течение 2 ч и удаляют растворитель при пониженном давлении. Остаток повторно растворяют в 3:1 хлороформ/изопропиловом спирте (100 мл) и объединяют с насыщенным раствором NaHCO3 (100 мл). Слои разделяют и водный слой экстрагируют этилацетатом(350 мл). Объединенные органические слои концентрируют и растирают в порошок в присутствии метанола, получая 1,5 г (64%) коричневого твердого вещества. Пример получения 7. трет-Бутил-3-(2-(3-(5-бромпиразин-2-иламино)-1H-пиразол-5-ил)-3 метоксифенокси)пропилкарбамат Диизопропилазодикарбоксилат (1,73 мл, 8,76 ммоль) добавляют при перемешивании к раствору трет-бутил-3-гидроксипропилкарбамата (0,83 мл, 4,83 ммоль), 2-(3-(5-бромпиразин-2-иламино)-1Hпиразол-5-ил)-3-метоксифенола (1,59 г, 4,38 ммоль) и полистиролтрифенилфосфина (5,91 г, 8,76 ммоль) в ТГФ (50 мл) при комнатной температуре. После перемешивания в течение 45 мин реакцию отфильтровывают и удаляют растворитель при пониженном давлении. Получившийся остаток хроматографируют(10 мл) дегазируют потоком азота в течение 1 ч и затем нагревают до 80C. К реакции добавляютPd(Ph3P)4 (0,080 г, 0,070 ммоль) и смесь нагревают в течение ночи. Реакцию охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (CH2Cl2/MeOH), получая 0,251 г (73%) указанного в заголовке соединения. Путь синтеза С. Пример получения 9. В 5-литровую колбу с ободком, оборудованную стержнем и лопастью воздушной мешалки, термометром, водяным холодильником и азотным барботером, помещают гидрид натрия (22,4 г, 560,1 ммоль) и безводный ТГФ (3 л). При хорошем перемешивании к смеси добавляют 2-амино-5-цианопиразин(67,0 г, 557,8 ммоль) порциями в течение 1,5 ч, допуская вспенивание. На протяжении всей процедуры поддерживают внутреннюю температуру 22C. Смесь перемешивают в течение 35 мин. Затем в течение 1 ч добавляют 1-(2-метокси-6-(4-метоксибензилокси)фенил)-3,3-бис-метилсульфанилпропенон (146,0 г,373,9 ммоль) при 22C. Желтую суспензию перемешивают в течение 45 мин при комнатной температуре,а затем нагревают до тех пор, пока реакция не начинает слегка закипать. После 19 ч при 65C реакционную смесь охлаждают до 15C. Затем смесь разделяют на две части, каждую из которых гасят добавлением в воду (2 л) и экстрагируют этилацетатом (21 л). Органические экстракты объединяют и промывают раствором соли, высушивают над безводным Na2SO4, отфильтровывают и концентрируют при пониженном давлении при 40C, получая 196 г желто-оранжевого твердого вещества, которое используют на следующем этапе без дальнейшей очистки.(196 г,423,8 ммоль) и абсолютный этанол (3 л). При перемешивании к суспензии в атмосфере азота добавляют гидрат гидразина (41,0 мл, 838,7 ммоль) и ледяную уксусную кислоту (66,0 мл, 1,15 моль). Отмечается небольшой экзотермический эффект. Желтую суспензию нагревают до 65C. Затем нагревание прекращают и оставляют реакционную смесь охлаждаться до комнатной температуры. Смесь оставляют на ночь в атмосфере азота. Твердое вещество собирают фильтрацией, промывают свежим этанолом и высушивают в вакууме при 45C, получая 140 г (выход 87% для двух этапов) ярко-желтого твердого веще- 13018118 ства. Продукт используют на следующем шаге без дальнейшей очистки. В 10-литровую колбу с ободком, оборудованную стержнем и лопастью воздушной мешалки, термометром, водяным холодильником и выходом к щелочным газоочистителям, помещают 5-(5-(2-метокси-6-(4-метоксибензилокси)фенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил (140 г,326,76 ммоль) и 4 н. раствора хлористого водорода (2500 мл, 10,0 моль) в 1,4-диоксане. Смесь хорошо перемешивают при 60-65C в течение 1,5 ч, а затем оставляют ее охлаждаться до 50C. По прошествии в общей сложности 4 ч, добавляют дополнительное количество 4 н. хлористого водорода в 1,4-диоксане(1000 мл) и возобновляют нагревание до 65C. По прошествии 1 ч при этой температуре нагревание останавливают и оставляют смесь охлаждаться до комнатной температуры в течение ночи с перемешиванием. Смесь отфильтровывают через большую воронку Бюхнера. Собранное твердое вещество промывают свежим 1,4-диоксаном, а затем на короткое время полностью сцеживают жидкость. Основной объем осадка на фильтре возвращают в 10-литровую колбу и энергично перемешивают с водой (2 л) и этилацетатом (3,5 л). Затем смесь ощелачивают добавлением концентрированного аммиака (440 мл). Раствор отфильтровывают, а затем переносят в 5-литровую делительную воронку. Водный слой отделяют и повторно экстрагируют этилацетатом (0,5 л). Объединенные органические слои промывают солевым раствором, высушивают над сульфатом натрия, отфильтровывают и концентрируют. Твердое вещество высушивают в вакууме при 45C, получая 101,3 г. Неочищенный продукт суспендируют в теплом безводном тетрагидрофуране (2,2 л) и загружают на колонку силикагеля (1 кг), заполненную во влажной среде изогексана. Продукт элюируют этилацетатом. Объединенные фракции частично концентрируют, получившийся осадок собирают фильтрацией и высушивают в вакууме при 40C в течение ночи, получая 60,9 г. В 5-литровую круглодонную колбу с ободком, оборудованную стержнем и лопастью воздушной мешалки, термометром, капельной воронкой для уравнивания давления и азотным барботером, помещают 5-(5-(2-гидрокси-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил (47,0 г, 152 ммоль) и безводный ТГФ (1,2 л). Суспензию охлаждают при перемешивании в атмосфере азота до 0C. В другую 2-литровую трехгорлую круглодонную колбу, оснащенную большой магнитной мешалкой, термометром и азотным барботером, помещают трифенилфосфин (44,0 г; 168 ммоль) и безводный ТГФ (600 мл). Раствор охлаждают при перемешивании в атмосфере азота до 0C, добавляют диизопропилазодикарбоксилат (34,2 г; 169 ммоль) и наблюдают формирование раствора молочного цвета. Через 3-4 мин добавляют раствор трет-бутил-N-(3-гидроксипропил)карбамата (30,3 г, 173 ммоль) в безводном ТГФ (100 мл) и перемешивают смесь в течение 3-4 мин. Затем эту смесь при перемешивании добавляют в течение более чем 5 мин к суспензии начальных веществ при 0C. Реакционная смесь быстро превращается в темный раствор и ее оставляют медленно нагреваться до комнатной температуры. Через 6,5 ч приготавливают дополнительные количества реактивов, как описано выше, с использованием PPh3 (8 г), диизопропилазодикарбоксилата (6,2 г) и карбамата (5,4 г) в безводном ТГФ (150 мл). Смесь добавляют к реакционной смеси, охлаждают до -5C и оставляют на ночь нагреваться до комнатной температуры. Растворитель удаляют в вакууме. Получающийся вязкий раствор наносят на колонку с силикагелем и элюируют продукт этилацетатом. Концентрированные фракции раздельно растирают в порошок в присутствии метанола и получающиеся твердые вещества собирают фильтрацией. Объединенные твердые вещества снова растирают в порошок в присутствии метанола (400 мл), а затем отделяют фильтрацией и высушивают в вакууме при 50C в течение ночи, получая 31,3 г требуемого продукта. 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2 В 5-литровую круглодонную колбу с ободком, оборудованную стержнем и лопастью воздушной мешалки, термометром и воздушным холодильником с присоединенным барботером, помещают третбутил-3-(2-(3-(5-цианопиразин-2-иламино)-1H-пиразол-5-ил)-3-метоксифенокси)пропилкарбамат (30,9 г,66,3 ммоль) и этилацетат (3 л). Механически перемешиваемую желтую суспензию охлаждают чуть ниже 10C. Затем осуществляют энергичное барботирование хлористым водородом из газового баллона через газовую входную трубу в течение 15 мин в ледяной бане. После 5 ч смесь заметно густеет на вид. Твердые вещества собирают фильтрацией, промывают этилацетатом, а затем высушивают в вакууме при 60C в течение ночи, получая 30,0 г. 1 Дигидрохлорид 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2 карбонитрила (3,0 г, 6,84 ммоль) суспендируют в 200 мл CH2Cl2. Добавляют 1 н. NaOH (200 мл,200 ммоль). Смесь перемешивают с помощью магнитной мешалки в атмосфере азота при комнатной температуре в течение 5 ч. Твердые вещества собирают фильтрацией и полностью промывают водой. Осадок на фильтре высушивают в вакууме при 50C в течение ночи, получая 2,26 г (90%) свободного основания в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6)1,81 (м, 2H), 2,73 (т, J=6,2 Гц, 2H), 3,82 (с, 3H), 4,09 (т, J=6,2 Гц, 2H),6,76 (т, J=8,2 Гц, 2H), 6,93 (ушир.с, 1H), 7,31 (т, J=8,2 Гц, 1H), 8,52 (ушир.с, 1H), 8,67 (с, 1H). ЖХ-МС/ЭР m/z 366,2 [М+1]+. Пример 4. Соль метансульфоновой кислоты 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3 иламино)пиразин-2-карбонитрила 5-(5-(2-(3-Аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил (1,0 г,2,74 ммоль) суспендируют в MeOH (100 мл). 1 М раствор метансульфоновой кислоты в MeOH (2,74 мл,2,74 ммоль) добавляют к смеси по каплям с перемешиванием. Твердое вещество почти полностью растворяется, его обрабатывают ультразвуком, перемешивают в течение 15 мин, отфильтровывают и концентрируют до 50 мл. Раствор охлаждают в течение ночи при -15C и собирают образовавшееся твердое вещество фильтрацией. Твердое вещество высушивают в вакуум-сушильном шкафу в течение ночи, получая 0,938 г (74%) желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)1,97 (м, 2H), 2,28 (с, 3H), 2,95 (м, 2H), 3,79 (с, 3H), 4,09 (т, J=5,9 Гц,2H), 6,753 (д, J=8,4 Гц, 1H), 6,766 (д, J=8,4 Гц, 1H), 6,85 (ушир.с, 1H), 7,33 (т, J=8,4 Гц, 1H), 7,67 (ушир.с,- 15018118 1-(2-Гидрокси-6-метоксифенил)этанон (1300 г, 7,82 моль) и диметилформамид (10,4 л) добавляют в 22-литровую колбу и перемешивают до получения раствора. Карбонат калия (2700 г, 19,54 моль) добавляют порциями, а затем перемешивают в течение по меньшей мере 30 мин. Используя капельную воронку, 4-метоксибензилхлорид (14700 г, 9,39 моль) добавляют по каплям к смеси в течение более 2,5 ч, поддерживая температуру 30C. Реакционную смесь разогревают до 35C и поддерживают эту температуру в течение 12 ч. За ходом реакции наблюдают с помощью ВЭЖХ и считают ее полностью завершенной после 13 ч при 35C. Суспензию отфильтровывают и полученные твердые вещества промывают диметилформамидом (1 л). Экстракционная обработка фильтрата этилацетатом и водой с последующей концентрацией приводит к получению восково-желтого твердого вещества. К этому твердому веществу добавляют метил-трет-бутиловый эфир (2,6 л). Получившуюся суспензию взбалтывают. Свободно текущую вследствие этого суспензию отфильтровывают и промывают метил-трет-бутиловым эфиром (1 л). Белое твердое вещество высушивают под вакуумом, получая 1539 г (69%) указанного в заголовке соединения. Точка плавления 105-107C. Пример получения 14. 1-(2-Метокси-6-(4-метоксибензилокси)фенил)-3,3-бис-(метилтио)проп-2-ен-1-он К смеси трет-бутоксида лития (602,4 г, 7,52 моль) в безводном ДМСО (11,0 л) в атмосфере азота добавляют 1-(2-метокси-6-(4-метоксибензилокси)фенил)этанон (1000,0 г, 3,49 моль). Получившуюся смесь перемешивают в течение 30 мин и медленно добавляют CS2 (259 мл, 4,296 моль) в течение 1-1,5 ч,поддерживая внутреннюю температуру ниже 30C. После перемешивания в течение по меньшей мере 1 ч при комнатной температуре медленно добавляют йодметан (1000 г, 7,045 моль), поддерживая внутреннюю температуру ниже 30C. Получившуюся смесь перемешивают при комнатной температуре от 30 мин до 1 ч. Завершение реакции подтверждают с помощью ВЭЖХ. Получившуюся реакционную смесь охлаждают с последующей экстракционной обработкой водой и этилацетатом. Получившуюся органическую часть концентрируют с образованием суспензии, которую отфильтровывают и промывают этилацетатом (1 л), а затем метил-трет-бутиловым эфиром (21 л). Выделенное твердое вещество высушивают при 40C в вакуумном сушильном шкафу, получая 1057 г (77%) указанного в заголовке соединения. Точка плавления 93-94C. В сухую инертную 22-литровую колбу добавляют гидрид натрия (159,2 г, 3,98 моль) и тетрагидрофуран (10,4 л). Смесь охлаждают до 5-15C. 5-Изоцианопиразин-2-амин (382,2 г, 3,18 моль) добавляют четырьмя порциями в течение 30 мин, чтобы контролировать высвобождение водорода, дожидаясь снижения вспенивания между добавлениями и поддерживая температуру 10C. Смесь перемешивают в течение 15-90 мин, позволяя температуре повыситься до 15C. К реакционной смеси добавляют 1-(2-метокси-6-(4-метоксибензилокси)фенил)-3,3-бис-(метилтио)проп-2-ен-1-он (1036 г, 2,65 моль) порциями, чтобы контролировать вспенивание. Получившуюся суспензию перемешивают в течение 15 мин. Смесь мягко нагревают с обратным холодильником при 66C. За ходом реакции наблюдают с помощью ВЭЖХ. Реакцию гасят добавлением в охлажденную воду (14,2 л) с последующей экстракционной обработкой этилацетатом. Органическую часть концентрируют с образованием суспензии, которую отфильтровывают, получая 957 г (78%) указанного в заголовке соединения. Точка плавления 128-135C. В 20-литровом сосуде смешивают этанол (11,28 л) и уксусную кислоту (318 мл, 5,545 моль). Пары реакции отводят в газоочиститель на основе хлорной извести с продувкой азотом. (Е)-5-(3-(2-Метокси-6(4-метоксибензилокси)фенил)-1-(метилтио)-3-оксопроп-1-ениламино)пиразин-2-карбонитрил (940 г,1,931 моль) и раствор этанола/уксусной кислоты добавляют в 22-литровую реакционную колбу. К получившейся коричневой суспензии добавляют моногидрат гидразина (197 г, 3,935 моль), при этом наблюдается небольшой экзотермический эффект. Получившуюся желтую суспензию медленно нагревают до 65-70C и наблюдают за реакцией с помощью ВЭЖХ. Продолжительность реакции составляет менее 1 ч. Густую суспензию медленно охлаждают в течение 1-2 ч до температуры ниже 30C. Суспензию отфильтровывают и промывают холодным этанолом. Материал высушивают под вакуумом при 40C, получая (820 г, 99,1%) указанного в заголовке соединения. Точка плавления 215-117C. Во всех нижеописанных операциях образующиеся газообразные продукты отводят в газоочистительную систему с каустической содой, чтобы контролировать газообразование HCl. 5-(5-(2-Метокси-6(4-метоксибензилокси)фенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрил (1,24 кг, 2,89 моль) и 4 н.HCl в диоксане (26,06 кг, 99,28 моль) помещают в 60-литровый стеклянный реакционный аппарат. Суспензию медленно нагревают до 60-70C. За ходом реакции наблюдают с помощью ВЭЖХ. Через 9 ч устанавливают окончание реакции. Коричневую суспензию охлаждают до 20C и выдерживают в течение ночи. Кислотную реакционную смесь отфильтровывают и промывают осадок с фильтра этилацетатом(7 л). Влажный осадок высушивают под вакуумом до постоянного веса, получая 1010 г (выход после поправок 91,84%) указанного в заголовке соединения. Точка плавления 225-228C (свободное основание).(618 г,1,62 моль) суспендируют в тетрагидрофуране (6,18 л, 10 объемов) и охлаждают до температуры от -5 до 0C в ледяной бане с ацетоном. Триэтиламин (330 г, 3,25 моль) добавляют через капельную воронку в течение 30-40 мин при температуре от -5 до 5C. Получившуюся суспензию перемешивают при температуре от -5 до 5C в течение 60-90 мин. Нерастворимый гидрохлорид триэтиламина отфильтровывают и собирают раствор фенола 5-(2-гидрокси-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2 карбонитрила) в соответствующем реакционном сосуде. Осадок на фильтре ополаскивают ТГФ (1,24 л). Раствор фенола в ТГФ хранят при 15-20C до момента использования. Трифенилфосфин (1074 г, 4,05 моль) растворяют при комнатной температуре в ТГФ (4,33 л). Прозрачный бесцветный раствор охлаждают в ледяной бане с ацетоном до температуры от -5 до 5C. Диизопропилазодикарбоксилат (795 г, 3,89 моль) добавляют по каплям через капельную воронку в течение 40-60 мин, поддерживая температуру ниже 10C. Получившуюся густую белую суспензию снова охлаждают до температуры от -5 до 0C. трет-Бутил-3-гидроксипропилкарбамат (717 г, 4,05 моль) растворяют в минимальном количестве ТГФ (800 мл). К суспензии реагента добавляют раствор трет-бутил-3 гидроксипропилкарбамата/ТГФ через капельную воронку в течение 20-30 мин при температуре от -5 до 5C. Готовый реактив перемешивают в ледяной бане при температуре от -5 до 0C до момента использования. Готовую суспензию реагента (20%) добавляют к раствору субстрата при 15-20C. Остатки реагента возвращают в ледяную баню. Раствор субстрата перемешивают при комнатной температуре в течение 30 мин, затем отбирают образцы для ВЭЖХ. Вторую, приблизительно 20%-ную, часть реагента добавляют к субстрату, перемешивают при комнатной температуре и отбирают образцы как и ранее. Добавление реагента продолжают, следя за завершением реакции с помощью ВЭЖХ. Завершенную реакцию концентрируют и измельчают в порошок в присутствии теплого метанола (4,33 л, 50-60C) с последующим охлаждением в ледяной бане. Получившийся желтый осадок отфильтровывают, ополаскивают холодным MeOH (2 л) и высушивают до постоянного веса, получая 544 г (72%) указанного в заголовке соединения. Точка плавления 214-216C. трет-Бутил-3-(2-(3-(5-цианопиразин-2-иламино)-1H-пиразол-5-ил)-3-метоксифенокси)пропилкарбамат (1430 г, 3,07 моль) суспендируют в ацетоне (21,5 л) в 30-литровом реакционном аппарате. Метансульфоновую кислоту (1484 г, 15,36 моль) добавляют через капельную воронку умеренной струей. Суспензию нагревают с обратным холодильником приблизительно при 52C на протяжении 1-3 ч и следят за завершением реакции с помощью ВЭЖХ. После завершения реакции ее охлаждают с помощью обратного холодильника до 15-20C в течение 4,5 ч. Желтую суспензию соли 2-пиразинкарбонитрил 5-5-[2-(3-аминопропокси)-6-метоксифенил]-1H-пиразол-3-ил]амино]димезилата отфильтровывают,промывают ацетоном (7 л) и высушивают в вакуум-сушильном шкафу. Соль димезилата (1608 г, 2,88 моль) суспендируют в воде (16 л). Гидроксид натрия (50%-ный водный, 228 г, 2,85 моль) медленно наливают к суспензии. Суспензию нагревают до 60C и перемешивают в течение 1 ч. Затем ее охлаждают до 16C в течение 4 ч и отфильтровывают. Влажный осадок с фильтра ополаскивают ацетоном (4 л) и высушивают до постоянного веса в вакуум-сушильном шкафу при 40C,получая 833 г (94%) моногидрата 2-пиразинкарбонитрил 5-5-[2-(3-аминопропокси)-6-метоксифенил]1H-пиразол-3-ил]амино]мономезилата. Точка плавления 222,6C.ES/MS m/z 366,2 [М+1]+. Пример 5 а. Моногидрат 2-пиразинкарбонитрил 5-5-[2-(3-аминопропокси)-6-метоксифенил]-1H-пиразол-3 ил]амино]мономезилата (по номенклатуре Chemical Abstracts). Неочищенный моногидрат 2-пиразинкарбонитрил 5-5-[2-(3-аминопропокси)-6-метоксифенил]-1Hпиразол-3-ил]амино]мономезилата очищают, используя следующую процедуру. Технически чистый моногидрат 2-пиразинкарбонитрил 5-5-[2-(3-аминопропокси)-6-метоксифенил]-1H-пиразол-3 ил]амино]мономезилата (1221 г, 2,55 моль) суспендируют в смеси растворителей ацетон/вода 1:1 (14,7 л). Твердое вещество растворяют нагреванием смеси до 50-55C. Раствор очищают фильтрованием при тем- 18018118 пературе 50-55C через 0,22-мкм картриджный фильтр. Раствор медленно охлаждают до температуры кристаллизации около 42-45C и проводят кристаллизацию. Медленное охлаждение продолжают следующие 30-60 мин, чтобы подтвердить образование центров кристаллизации. Негустую суспензию охлаждают от 38 до 15C в течение 3 ч. Проводят перегонку под вакуумом, удаляя ацетон при 110-90 мм и 20-30C. Смесь охлаждают от 30 до 15C в течение 14 ч, выдерживают 2 ч при 15C, а затем отфильтровывают. Повторно кристаллизованный материал ополаскивают смесью вода/ацетон 19:1 (2 л), а затем водой (6 л) и высушивают до постоянного веса в вакуумном сушильном шкафу при 40C, получая 1024 гES/MS m/z 366,2 [М+1]+. Рентгенограммы порошковой дифракции (ПРД - порошковая рентгеновская дифракция) могут быть получены на порошковом дифрактометре Bruker D8 Advance, оборудованном источником CuK(=1,54056 ангстрем) и работающем при 40 кВ и 40 мА с позиционно-чувствительным детектором. Каждый образец сканируют между 4 и 35 при 20,02 с использованием размера шага 0,026 при 20,02 и времени шага 0,3 с с щелью расходимости 0,6 мм и щелью детектора 10,39 мм. Как первичные, так и вторичные щели Соллера находятся под углом 2; антирассеивающие щели составляют 6,17 мм; поглотитель воздушного рассеивания присутствует. Положения характеристических пиков и относительные интенсивности. Анализ с помощью дифференциальной сканирующей калориметрии (ДСК) может быть выполнен на приборе ДСК Mettler-Toledo (Model DSC822e). Образцы нагревают от 25 до 350C в закрытых алюминиевых резервуарах с микроотверстием со скоростью 10C/мин при продувке азотом в объеме 50 мл/мин. Термогравиметрический анализ (ТГА) может быть выполнен на приборе ТГА Mettler-Toledo (ModelTGA/SDTA 851e). Образцы нагревают от 25 до 350C в закрытых алюминиевых резервуарах с микроотверстием со скоростью 10C/мин при продувке азотом в объеме 50 мл/мин. Тепловая кривая, полученная в анализе ДСК, показывает формирование слабого пологого эндотермического эффекта в области 80-140C и последующее резкое возникновение эндотермического эффекта плавления при 222C (пик при 225C). При анализе ТГА наблюдается 4%-ная потеря массы в области 25140C. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представляющее собой 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1H-пиразол-3 иламино)пиразин-2-карбонитрил, или его фармацевтически приемлемая соль или сольват указанной соли. 2. Соединение по п.1, представляющее собой 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1Hпиразол-3-иламино)пиразин-2-карбонитрил, или его фармацевтически приемлемая соль. 3. Соединение по п.1, представляющее собой 5-(5-(2-(3-аминопропокси)-6-метоксифенил)-1Hпиразол-3-иламино)пиразин-2-карбонитрил. 4. Соединение по п.1, представляющее собой муравьинокислую соль 5-(5-(2-(3-аминопропокси)-6 метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила или дигидрохлоридную соль 5-(5-(2-(3 аминопропокси)-6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила. 5. Соединение по п.1, представляющее собой метансульфокислую соль 5-(5-(2-(3-аминопропокси)6-метоксифенил)-1H-пиразол-3-иламино)пиразин-2-карбонитрила. 6. Соединение по п.1, представляющее собой 7. Соединение по п.6 в кристаллической форме, характеризующейся порошковой дифракционной рентгенограммой, содержащей пики при 20,02, равные 12,64, 21,25 и 26,15. 8. Фармацевтическая композиция, содержащая соединение или соль по любому из пп.1-7 в комбинации с фармацевтически приемлемым носителем, разбавителем или эксципиентом. 9. Способ лечения рака, включающий введение пациенту, который в этом нуждается, эффективного количества соединения или соли по любому из пп.1-7. 10. Способ по п.9, где указанный рак выбран из группы, состоящей из рака мочевого пузыря, рака толстой кишки, рака желудка, рака печени, рака легких, рака молочной железы, меланомы, рака яичников, рака поджелудочной железы, мезотелиомы, рака почек и рака матки.
МПК / Метки
МПК: C07D 403/12, A61K 31/497, A61P 35/00
Метки: пригодные, соединения, ингибирования
Код ссылки
<a href="https://eas.patents.su/21-18118-soedineniya-prigodnye-dlya-ingibirovaniya-chk1.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, пригодные для ингибирования chk1</a>
Предыдущий патент: Регулирование запаха
Следующий патент: Новый неводный раствор диклофенака для местного применения и способ его получения
Случайный патент: Система обеспечения безопасности












