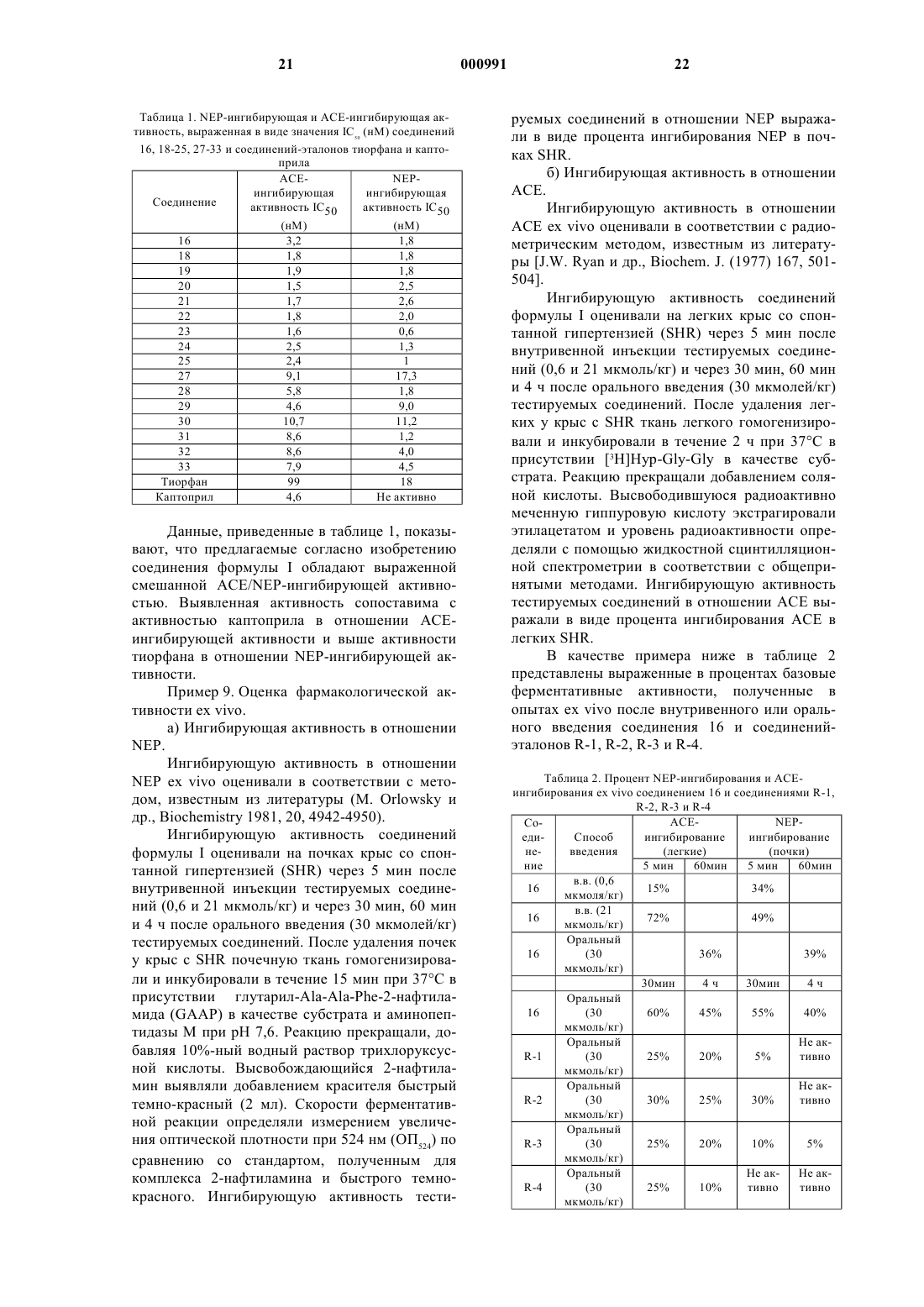
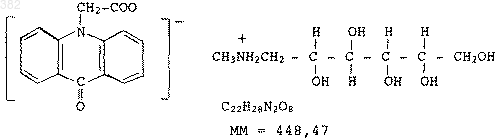Тиольные производные, обладающие ингибирующей активностью в отношении металлопептидаз.
Номер патента: 991
Опубликовано: 28.08.2000
Авторы: Семераро Клаудио, Сантанджело Франческо, Романьяно Стефано, Пеллачини Франко, Фантуччи Марио, Норчини Габриеле
Формула / Реферат
1. Соединение формулы
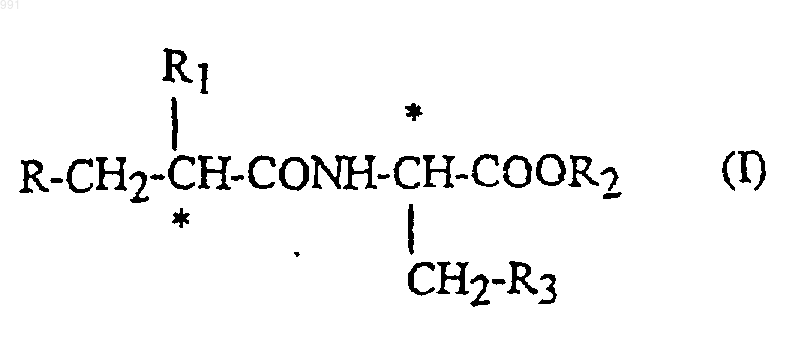
где R обозначает меркаптогруппу или группу R4COS, которая превращается в организме в меркаптогруппу;
R1 обозначает С2-С4алкильную группу с прямой или разветвленной цепью или арильную или арилалкильную группу, имеющую от 1 до 6 атомов углерода в алкильном фрагменте, где арил обозначает фенил или 5- или 6-членный ароматический гетероцикл с одним или двумя гетероатомами, выбранными из группы, включающей азот, кислород и серу, необязательно замещенный одним или несколькими одинаковыми или различными заместителями, выбранными из группы, включающей атомы галогена, гидроксигруппы, алкокси-, алкил-, алкилтио-, алкилсульфонильные или алкоксикарбонильные группы, которые имеют от 1 до 6 атомов углерода в алкильном фрагменте, С1-С3алкильные группы, которые содержат один или несколько атомов фтора, карбоксигруппы, нитрогруппы, амино- или аминокарбонильные группы, ациламиногруппы, аминосульфонильные группы, моно- или диалкиламино- или моно- или диалкиламинокарбонильные группы, имеющие от 1 до 6 атомов в алкильном фрагменте;
R2 обозначает водород, С1-С4алкильную группу с прямой или разветвленной цепью или бензильную группу;
R3 обозначает фенильную группу, замещенную 5- или 6-членным ароматическим гетероциклом, который содержит один или два гетероатома, выбранных из группы, включающей азот, кислород и серу, причем, фенильная и гетероциклическая группы необязательно замещены одним или несколькими одинаковыми или различными заместителями, имеющими значения, указанные для R1;
R4 обозначает С1-С4алкильную группу с прямой или разветвленной цепью или фенильную группу;
атомы углерода, помеченные звездочкой являются стереогенными центрами;
и его фармацевтически приемлемые соли.
2. Соединение формулы I по п.1, где R3 обозначает фенильную группу, замещенную в положении 4 гетероциклической группой.
3. Соединение формулы I по п.2, где R1 обозначает арилалкильную группу, необязательно замещенную одним или несколькими одинаковыми или различными заместителями, выбранными из группы, включающей атомы галогена, гидрокси-, алкил- или алкоксигруппы.
4. Соединение формулы I по п.3, где R1 обозначает фенилалкильную группу, необязательно замещенную одним или несколькими одинаковыми или различными заместителями, выбранными из группы, включающей атомы галогена, гидрокси-, алкил- или алкоксигруппы.
5. Соединение формулы I по п.1 в форме соли щелочного металла, выбранного из группы, включающей натрий, литий и калий.
6. Способ получения соединения формулы I по п.1, включающей взаимодействие между соединением формулы
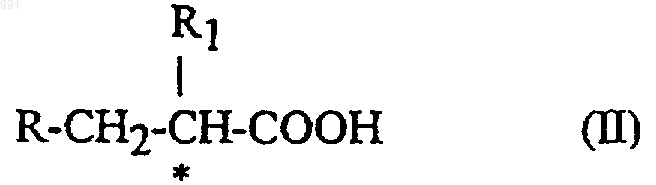
где R и R1 имеют указанные выше значения, и производным фенилаланина формулы
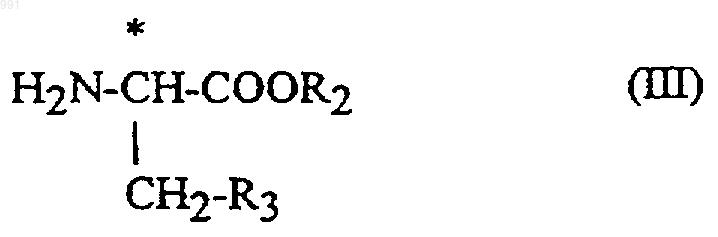
где R2 и R3 имеют указанные выше значения.
7. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы I по п.1 в смеси с носителем, пригодная для фармацевтического применения.
8. Фармацевтическая композиция по п.7, предназначенная для лечения сердечно-сосудистых заболеваний.
9. Способ лечения сердечно-сосудистых заболеваний, включающий введение терапевтически эффективного количества соединения формулы I по п.1.
10. Соединение, выбранное из группы, включающей:
метиловый эфир N-(3-фенилкарбонилтио-2-фенилметилпропионил)-4-(2-тиазолил)-L-фенилаланина;
метиловый эфир N-(3-фенилкарбонилтио-2-фенилметилпропионил)-4-(2-пиридил)-L-фенилаланина;
бензиловый эфир N-(3-фенилкарбонилтио-2-фенилметилпропионил)-4-(3-пиридил)-L-фенилаланина;
метиловый эфир N-(3-фенилкарбонилтио-2-фенилметилпропионил)-4-(2-фурил)-L-фенилаланина;
этиловый эфир N-(3-фенилкарбонилтио-2-фенилметилпропионил)-4-(5-пиримидинил)-L-фенилаланина;
метиловый эфир N-(3-фенилкарбонилтио-2-фенилметилпропионил)-4-(2-пиразинил)-L-фенилаланина;
метиловый эфир N-(3-фенилкарбонилтио-2-фенилметилпропионил)-4-(2-тиенил)-L-фенилаланина;
метиловый эфир N-(3-фенилкарбонилтио-2-фенилметилпропионил)-4-(3-тиенил)-L-фенилаланина;
метиловый эфир N-(3-фенилкарбонилтио-2-фенилметилпропионил)-4-(3-фурил)-L-фенилаланина;
метиловый эфир N-[3-фенилкарбонилтио-2-(3-пиридилметил)пропионил]-4-(2-тиазолил)-L-фенилаланина;
N-(3-меркапто-2-фенилметилпропионил)-4-(2-тиазолил)-L-фенилаланин;
N-(3-меркапто-2-фенилметилпропионил)-4-(2-пиридил)-L-фенилаланин;
N-(3-меркапто-2-фенилметилпропионил)-4-(3-пиридил)-L-фенилаланин;
N-(3-меркапто-2-фенилметилпропионил)-4-(2-фурил)-L-фенилаланин;
N-(3-меркапто-2-фенилметилпропионил)-4-(5-пиримидинил)-L-фенилаланин;
N-(3-меркапто-2-фенилметилпропионил)-4-(2-пиразинил)-L-фенилаланин;
N-(3-меркапто-2-фенилметилпропионил)-4-(2-тиенил)-L-фенилаланин;
N-(3-меркапто-2-фенилметилпропионил)-4-(3-тиенил)-L-фенилаланин;
N-(3-меркапто-2-фенилметилпропионил)-4-(3-фурил)-L-фенилаланин;
N-[3-меркапто-2-(3-пиридилметил)пропионил]-4-(2-тиазолил)-L-фенилаланин;
метиловый эфир N-[3-ацетилтио-2-(3-метоксифенил)метилпропионил]-4-(2-тиазолил)-L-фенилаланина;
метиловый эфир N-[3-ацетилтио-2-(2-фторфенил)метилпропионил]-4-(2-тиазолил)-L-фенилаланина;
метиловый эфир N-[3-фенилкарбонилтио-2-(2-тиенил)метилпропионил]-4-(2-тиазолил)-L-фенилаланина;
метиловый эфир N-[2-(2-фурил)метил-3-фенилкарбонилтиопропионил]-4-(2-тиазолил)-L-фенилаланина;
метиловый эфир N-[2-(3-метил-5-изоксазолил)метил-3-фенилкарбонил-тиопропионил]-4-(2-тиазолил)-L-фенилаланина;
N-[3-меркапто-2-(3-метоксифенил)метилпропионил]-4-(2-тиазолил)-L-фенилаланин;
N-[3-меркапто-2-(3-тиенил)метилпропионил]-4-(2-тиазолил)-L-фенилаланин;
N-[3-меркапто-2-(3-метил-5-изоксазолил) метилпропионил]-4-(2-тиазолил)-L-фенилаланин;
N-[2-(2-фторфенил)метил-3-меркаптопропионил]-4-(2-тиазолил)-L-фенилаланин;
N-[2-(2-фурил)метил-3-меркаптопропионил]-4-(2-тиазолил)-L-фенилаланин;
и его (2S)- или (2R)-стереоизомеры.
Текст
1 Настоящее изобретение относится к тиольным производным, обладающим ингибирующей активностью в отношении металлопептидаз, в частности изобретение относится к производнымN-меркаптоацилфенилаланина,пригодным для лечения сердечно-сосудистых заболеваний. Интерес к изучению молекул, обладающих способностью ингибировать металлопептидазы,с точки зрения фармакологии, обусловлен ролью указанных ферментов, проявляющейся на уровне сердечно-сосудистой системы. Хорошо известным является тот факт, что соединения,которые обладают ингибирующей активностью в отношении ангиотензинпревращающего фермента (ACE), весьма перспективны для лечения гипертензии, сердечной недостаточности и постинфарктного состояния благодаря тому, что они ингибируют образование ангиотензина II вещества, которое оказывает различные воздействия, в том числе увеличивает кровяное давление. Соединения, обладающие ингибирующей активностью в отношении эндотелинпревращающего фермента (ECE), пригодны в качестве антисосудосуживающих агентов, поскольку они ингибируют образование эндотелина, пептида,состоящего из 21 аминокислоты и обладающего сосудосуживающей активностью. И наоборот,соединения, обладающие ингибирующей активностью в отношении фермента нейтральная эндопептидаза (NEP), который также называют энкефалиназой, пригодны в качестве сосудорасширяющих агентов, поскольку фермент NEP ответственен за инактивацию не только эндогенного энкефалина, но также и некоторых натрийуретических факторов, среди которых, например, следует отметить предсердный факторANF), гормон, секретируемый сердцем, который увеличивает расширение кровеносных сосудов и на почечном уровне повышает диурез и натрийурез. Таким образом, с учетом их разных механизмов действия на сердечно-сосудистую систему соединения, обладающие ингибирующей активностью в отношении металлопептидаз,обычно используются по отдельности или в комбинации для лечения гипертензии, почечной недостаточности, застойной сердечной недостаточности и ишемических кардиопатологий. Из тиольных производных, обладающих ингибирующей активностью в отношении металлопептидаз, в качестве соединений - ближайших аналогов для NEP- и ACE-ингибиторов соответственно рассматриваются тиорфан [(DL(3-меркапто-2-бензилпропаноил)глицин, впервые описанный Roquest и др. в Nature, том 288,стр. 286-288 (1980), и каптоприл (The MerckIndex, XI изд., 1773, стр. 267). В литературе описаны другие имеющие тиольное строение молекулы, которые обладают 2 ингибирующей активностью в отношении металлопептидаз. В патентах США 4401677 и 4199512 (оба на имя E.R. SquibbSons, Inc.) описаны меркаптоалканоильные аминокислоты, обладающие ингибирующей активностью в отношении энкефалиназы и ингибирующей активностью в отношении ACE соответственно. В европейской заявке 0419327 (SocieteCivile Bioproject) описаны некоторые производные аминокислот, обладающие ингибирующей активностью в отношении энкефалиназы и в отношении ACE сответственно. В европейской заявке 0449523 (E.R. SquibbSons, Inc.) описаны меркапто- или ацилтилтиофторметиламиды, обладающие ингибирующей активностью в отношении NEP. В международной заявке WO 93/08162(INSERM)] описаны ацилмеркаптоалканоилдипептиды, обладающие ингибирующей активностью в отношении нейтральной эндопептидазы и пептидилдипептидазы А. В европейской заявке 0566157 (ScheringCorporation) описаны тиольные производные,такие, как, например, N-меркаптоациламинокислоты, обладающие ингибирующей активностью в отношении NEP.-Меркаптоацильные дипептиды, обладающие ингибирующей активностью в отношении ACE и NEP, также описаны у S.S. Bhagwat и др. в BioorganicMedicinal Chemistry Letters, 7,735-738, 1995. В этой последней работе авторы сделали заключение, что присутствие бифенилметильной группы придает представляющую интерес смешанную ACE/NEP-ингибирующую активность молекулам, имеющим строение меркаптоацильного дипептида, а замещение бифенильной группы такими группами, как или -нафтил, приводит к существенному снижению активности. Согласно настоящему изобретению были обнаружены производные N-меркаптоацилфенилаланина, которые обладают выраженной ингибируюшей активностью в отношении ангиотензинпревращающего фермента, а также в отношении фермента нейтральная эндопептидаза (смешанная или двойная ACE/NEPингибирующая активность), что делает их особенно пригодными для лечения сердечнососудистых патологий. Таким образом, объектом настоящего изобретения являются соединения формулыR обозначает меркаптогруппу или группуR1 обозначает С 2-С 4 алкильную группу с прямой или разветвленной цепью или арильную либо арилалкильную группу, имеющую от 1 до 6 атомов углерода в алкильном фрагменте, где арил обозначает фенил или 5- или 6-членный ароматический гетероцикл с одним или двумя гетероатомами, выбранными из группы, включающей азот, кислород и серу, необязательно замещенный одним или несколькими одинаковыми или различными заместителями, выбранными из группы, включающей атомы галогена,гидроксигруппы, алкокси-, алкил-, алкилтио-,алкилсульфонильные или алкоксикарбонильные группы, которые имеют от 1 до 6 атомов углерода в алкильном фрагменте, С 1-С 3 алкильные группы, которые содержат один или несколько атомов фтора, карбоксигруппы, нитрогруппы,амино- или аминокарбонильные группы, ациламиногруппы, алкиламиногруппы, аминосульфонильные группы, моно- или диалкиламино- или моно- или диалкиламинокарбонильные группы,имеющие от 1 до 6 атомов в алкильном фрагменте;R2 обозначает водород, С 1-С 4 алкильную группу с прямой или разветвленной цепью или бензильную группу;R3 обозначает фенильную группу, замещенную 5- или 6-членным ароматическим гетероциклом, который содержит один или два гетероатома, выбранных из группы, включающей азот, кислород и серу, причем фенильная и гетероциклическая группы необязательно замещены одним или несколькими одинаковыми или различными заместителями, имеющими значения,указанные для R1;R4 обозначает С 1-С 4 алкильную группу с прямой или разветвленной цепью или фенильную группу; атомы углерода, помеченные звездочкой,являются стереогенными центрами; и их фармацевтически приемлемые соли. Соединения формулы I содержат два стереогенных центра и поэтому могут находиться в форме стереоизомеров. Таким образом, объектом настоящего изобретения являются соединения формулы I в форме стереоизомерной смеси, а также в форме отдельных стереоизомеров. Предлагаемые соединения формулы I проявляют смешанную ACE/NEP-ингибирующую активность и пригодны для лечения сердечнососудистых заболеваний. Хотя оба понятия смешанная и двойная используются взаимо 000991 4 заменяемо, понятие двойная является более широко применяемым в литературе для соединений, обладающих одновременно как ACE-,так и NEP-ингибирующей активностью. В контексте настоящего описания понятия смешанная и двойная рассматриваются как эквивалентные. В контексте настоящего описания, если не указано иное, под понятием алкильная группа с прямой или разветвленной цепью подразумевают алкил, такой как метил, этил, н-пропил,изопропил, н-бутил, втор-бутил, трет-бутил,изобутил, н-пентил, 2-пентил, 3-пентил, изопентил, трет-пентил, н-гексил и изогексил; под понятием алкоксигруппа с прямой или разветвленной цепью подразумевают алкоксигруппу,такую, как метокси-, этокси-, н-пропокси- и изопропоксигруппу; под понятием атом галогена подразумевают атом фтора, хлора, брома или йода; под понятием ацил подразумевают ацильную группу, являющуюся производным алифатической или ароматической карбоновой кислоты, такой, как уксусная, пропионовая,масляная и бензойная кислота; под понятием 5 или 6-членный ароматический гетероцикл с 1 или 2 гетероатомами, выбранными из группы,включающей азот, кислород и серу, подразумевают такую группу, как тиазол, изоксазол,оксазол, изотиазол, пиразол, имидазол, тиофен,пиррол, пиридин, пиримидин, пиразин, пиридазин и фуран, необязательно сконденсированный с бензольным кольцом. Примерами фармацевтически приемлемых солей соединений формулы I являются соли щелочных или щелочно-земельных металлов и соли фармацевтически приемлемых органических оснований. Предпочтительными соединениями формулы I являются соединения, в которых R3 обозначает фенильную группу, замещенную в положении 4 гетероциклической группой. Более предпочтительными в этом классе являются соединения формулы I, в которых R1 обозначает арилалкильную группу, необязательно замещенную одним или несколькими одинаковыми или различными заместителями,выбранными из группы, включающей атомы галогена, гидроксигруппу, алкильную или алкоксигруппу. Еще более предпочтительными соединениями в этом классе являются соединения формулы I, в которых R1 обозначает фенилалкильную группу, необязательно замещенную одним или несколькими одинаковыми или различными заместителями, выбранными из группы, включающей атомы галогена, гидроксигруппу, алкильную или алкоксигруппу. Предпочтительными примерами фармацевтически приемлемых солей соединений формулы I являются соли щелочных металлов,таких как натрий, литий и калий. 5 Для специалиста в данной области техники очевидно, что соединения формулы I, в которыхR обозначает группу R4COS, обладают способностью превращаться в организме в соединения,у которых R является меркаптогруппой, а соединения формулы I, в которых R2 обозначает алкильную или бензильную группу, являются биологическими предшественниками (пролекарствами) соответствующих соединений формулы I, в которых R обозначает меркаптогруппу(R означает SH) или R2 обозначает атом водорода (R2 означает Н) соответственно. Конкретные примеры предпочтительных соединений формулы I по изобретению включают: метиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(2-тиазолил)фенилаланина; бензиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(2-пиридил)фенилаланина; метиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(3-пиридил)фенилаланина; метиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(2-фурил)фенилаланина; этиловый эфир N-(3-фенилкарбонилтио-2 фенилметилпропионил)-4-(5-пиримидинил)фенилаланина; метиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(2-пиразинил)фенилаланина; метиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(2-тиенил)фенилаланина; метиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(3-тиенил)фенилаланина; метиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(3-фурил)фенилаланина; метиловый эфир N-[3-фенилкарбонилтио 2-(3-пиридилметил)пропионил]-4-(2-тиазолил) фенилаланина; метиловый эфир N-[3-ацетилтио-2-(3 метоксифенил)метилпропионил]-4-(2-тиазолил) фенилаланина; метиловый эфир N-[3-ацетилтио-2-(2 фторфенил)метилпропионил]-4-(2-тиазолил) фенилаланина; метиловый эфир N-[3-фенилкарбонилтио 2-(2-тиенил)метилпропионил]-4-(2-тиазолил) фенилаланина; метиловый эфир N-[2-(2-фурил)метил-3 фенилкарбонилтиопропионил]-4-(2-тиазолил) фенилаланина; метиловый эфирN-[2-(2-фурил)метил-3-меркаптопропионил]-4-(2-тиазолил)фенилаланин. Получение предлагаемых согласно настоящему изобретению соединений формулы I проводят в соответствии со способом синтеза,включающим взаимодействие между соединением формулы где R и R1 имеют указанные выше значения, и производным фенилаланина формулы где R2 и R3 имеют указанные выше значения. Реакцию конденсации проводят в соответствии со способами, общепринятыми в химии пептидов. До проведения реакции может оказаться целесообразным соответствующим образом защитить необязательные функциональные группы, которые могут препятствовать взаимодействию. Необязательную защиту проводят общепринятыми способами. В отношении соединений, в которых R обозначает группу R4COS,предпочтительно использовать в качестве промежуточных веществ соединения формулы II,получая таким образом соответствующие соединения формулы I, в которых R обозначает группу R4COS, из которых путем гидролиза могут быть получены соединения формулы I, в которых R обозначает группу SH. Оценка при 7 годности необязательной защиты, а также выбор приемлемого типа защиты, соответствующего проводимой реакции и функциональным группам, подлежащим защите, хорошо известны специалистам в данной области. Удаление необязательных защитных групп проводят в соответствии с общепринятыми способами. Общие примеры применения защитных групп в органической химии можно найти уWileySons, Inc., 2-е изд., 1991. Соединения формулы II являются известными или легко могут быть получены известными методами, как описано, например, в патенте Великобритании 1576161 на имя E.R.SquibbSons, Inc. В альтернативном варианте соединения формулы II могут быть получены в соответствии с методами синтеза, описанными уM.C. Fourni-Zalusky и др. в J. Med. Chem. 1994,37, 1070-1083. Промежуточные соединения формулы III также являются известными или легко могут быть получены известными методами. Например, соединения формулы III могут быть получены в соответствии с методами синтеза, описанными у W.C. Shieh и др. в J. Org. Chem. 1992,57, 379-381. В альтернативном варианте соединения формулы III могут быть получены с помощью методов сочетания (поперечного сочетания) с использованием в качестве исходных веществ галогенированных гетероциклических соединений и производных станнилфенилаланина, как описано у D.C. Wilbur и др. в BioconjugateChem., 1993, 4, 574-580. Соединения формулы I в форме отдельных стереоизомеров получают путем стереоселективного синтеза или разделения стереоизомерной смеси в соответствии с общепринятыми способами. Получение солей предлагаемых соединений формулы I также проводят в соответствии с общепринятыми способами. Соединения формулы I по изобретению проявляют смешанную ACE/NEP-ингибирующую активность и пригодны для лечения сердечно-сосудистых заболеваний. Ингибирующую активность соединений формулы I оценивали в опытах in vitro (пример 8). В частности, ингибирующую активность соединений формулы I оценивали в сравнении с вышеуказанными тиорфаном и каптоприлом. Обнаруженная ингибирующая активность invitro соединений формулы I, выраженная в виде значения IC50, проявляется в диапазоне наномолярных (нМ) концентраций. Обнаруженная ингибирующая активность в отношении ACE оказалась сопоставимой с активностью каптоприла,а ингибирующая активность в отношении NEP оказалась выше, чем у тиорфана. 8 Кроме того, ингибирующую активность соединений формулы I также оценивали в опытах ex vivo в сравнении с известными соединениями (пример 9). В частности, в качесте эталонов для сравнения применяли N-[3-меркапто-2(3,4-метилендиоксифенил)метилпропионил]-(S)фенилаланин и N-[3-меркапто-2-(3,4-метилендиоксифенил)метилпропионил]-(S)-тирозин,описанные в качестве ингибиторов энкефалиназы и ACE в вышеуказанной европейской заявке 0419327 и обозначенные в настоящем описании как соединения R-1 и R-2 соответственно, а такжеACE в патенте США 4199512 и в качестве ингибиторов энкефалиназы в патенте США 4401677 и обозначенные в настоящем описании как соединения R-3 и R-4 соответственно.ACE/NEP-ингибирующую активность в опытах ex vivo, в частности, определяли оценкой ферментативной активности в гомогенатах ткани (легкого и почки для ACE- и NEPактивности соответственно), взятых у крыс со спонтанной гипертензией (SHR), которым тестируемые соединения вводили внутривенно или орально. Следует отметить, что активность, которую проявляют соединения формулы I в опытах ex vivo, подтверждает смешанную активность (двойную активность), обнаруженную в опытах in vitro, также и после орального введения. Более того, обнаруженная указанная активность оказалась существенно более высокой,чем у соединений-эталонов. Для практического применения в терапии на основе соединений формулы I могут быть изготовлены твердые или жидкие фармацевтические композиции, пригодные для орального или парентерального введения. Таким образом,фармацевтические композиции, содержащие терапевтически эффективное количество соединения формулы I в смеси с носителем, предназначенные для фармацевтического применения,являются еще одним объектом настоящего изобретения. Конкретными примерами фармацевтических композиций по настоящему изобретению являются таблетки, таблетки с покрытием,капсулы, грануляты, растворы и суспензии, пригодные для орального введения, растворы и суспензии, пригодные для парентерального введения. Фармацевтические композиции по изобретению получают в соответствии с общепринятыми способами. Суточная доза соединения формулы I или соответствующего пролекарства может зависеть от ряда факторов, таких, как серьезность заболевания, индивидуальная реакция пациента или тип композиции, но она обычно составляет 0,110 мг на кг веса тела и может применяться в виде однократной дозы или может быть разделена на несколько суточных доз. 9 Ниже изобртение проиллюстрировано на примерах. Если не указано иное, быструю хроматографию проводили с использованием силикагеля для быстрой хроматографии компанииBaker (код 7024-00). Пример 1. Получение этилового эфира Nтрет-бутоксикарбонил-4-(5-пиримидинил)-Lфенилаланина. Смесь,содержащую 5-пиримидинилборную кислоту (850 мг; 2 ммоля), этиловый эфир N-трет-бутоксикарбонил-4-трифторметилсульфонил-L-фенилаланина (450 мг; 2,2 ммоля),раствор карбоната натрия (530 мг) в воде (2,59 мл) и смесь толуол:этанол в соотношении 10:4,5(20 мл), дегазировали азотом в течение 30 мин. Далее к реакционной смеси добавляли тетракис(трифенилфосфин)палладий(0) (120 мг; 0,06 ммоля), нагревали до 90 С и выдерживали при перемешивании в течение 3 ч. Затем смесь выдерживали при комнатной температуре и вновь добавляли этиловый эфир N-трет-бутоксикарбонил-4-трифторметилсульфонил-L-фенилаланина (112 мг) и тетракис(трифенилфосфин)палладий(0) (30 мг). Смесь еще раз нагревали до 90 С и выдерживали при перемешивании в течение 18 ч. После охлаждения реакционной смеси до комнатной температуры добавляли этилацетат (100 мл) и воду (40 мл). Фазы разделяли и органическую фазу сушили над сульфатом натрия и упаривали под вакуумом. Полученный остаток очищали быстрой хроматографией (силикагель, элюент гексан : этилацетат в соотношении 7:3, давление азота 0,1 атм.), получая при этом этиловый эфир N-третбутоксикарбонил-4-(5-пиримидинил)-L-фенилаланина (130 мг; выход 14%) в виде бесцветного масла. 1H-ЯМР (200 МГц, CDCl3):(част./млн): 1,24 (t, 3H, CH2-CH3); 1,40 [s, 9H, C(CH3)3]; 3,013,25 (m, 2H, CH2-CH); 4,19 (q, 2H, CH2-CH3); 4,52-4,65 (m, 1H, CH-COO); 5,06 (d, 1H, NH); 7,25-7,52 (m, 4H, фенилен); 8,91 (s, 2H, N-CH-CCH-N); 9,19 (s, 1H, N-CH-N). Пример 2. Получение метилового эфира Nтрет-бутоксикарбонил-4-(2-тиазолил)-L-фенилаланина. Метиловый эфир N-трет-бутоксикарбонил 4-(трифторметилсульфонил)-L-фенилаланина (8 г; 32,3 ммоля) и хлорид бис(трифенилфосфин) палладия (2,3 г) добавляли к раствору 2 триметилстаннилтиазола (13,8 г; 32,3 ммоля) в смеси тетрагидрофуран:толуол в соотношении 10:1 (50 мл), предварительно дегазированной азотом. Смесь нагревали с обратным холодильником в течение 24 ч и затем еще раз добавляли 2-триметилстаннилтиазол (2 г). Через 6 ч при нагревании с обратным холодильником вновь добавляли метиловый эфир N-трет-бутоксикарбонил-4-(трифторметилсульфонил)-L-фенилаланина (2 г) и хлорид бис(трифенилфосфин)палладия (700 мг). Образовавшуюся реак 000991 10 ционную смесь выдерживали, перемешивая, при 70 С в течение 16 ч, а затем охлаждали до комнатной температуры. Затем к смеси добавляли воду (200 мл) и экстрагировали метиленхлоридом (4 х 200 мл). Объединенные органические фазы сушили над сульфатом натрия и упаривали под вакуумом. Полученный остаток очищали экспресс-хроматографией (силикагель, элюент метиленхлорид : этилацетат в соотношении 9:1,давление азота 0,1 атм.), получая при этом метиловый эфир N-трет-бутоксикарбонил-4-(2 тиазолил)-L-фенилаланина (2,3 г; выход 20%). 1(d, 1H, S-CH-CH-N); 7,15-7,90 (m, 4H, фенилен). Пример 3. Получение метилового эфира Nтрет-бутоксикарбонил-4-(3-пиридил)-L-фенилаланина. 3-Бромпиридин (1,67 г; 10 ммолей) и тетракис(трифенилфосфин)палладий(0) (370 мг; 0,219 ммоля) добавляли к раствору метилового эфира N-трет-бутоксикарбонил-4-(трибутилстаннил)-L-фенилаланина (4 г; 7,03 ммоля), полученного согласно D.S. Wilbur и др., BioconjugateChem. 1973, 4, 574-580, в безводном диметилформамиде (30 мл), предварительно дегазированном азотом. Реакционную смесь выдерживали при перемешивании в течение 10 мин при комнатной температуре и затем выдерживали при 105 С в течение 6 ч. Вновь добавляли тетракис(трифенилфосфин)палладий(0)(0,0035 ммоля), смесь выдерживали при 105 С в течение 8 ч и охлаждали до комнатной температуры. Затем в реакционную смесь добавляли воду (100 мл) и экстрагировали гексаном (3 х 150 мл). Объединенные органические фазы промывали насыщенным водным раствором фторида калия,сушили над сульфатом натрия и упаривали под вакуумом. Полученный остаток объединяли с этилацетатом и фильтровали. Образовавшийся раствор упаривали под вакуумом и остаток очищали экспресс-хроматографией (силикагель,элюент гексан : этилацетат в соотношении 8:2,давление азота 0,1 атм.), получая метиловый эфир N-трет-бутоксикарбонил-4-(3-пиридил)-Lфенилаланина (1,5 г; выход 60%) в виде бесцветного масла. МС (C.I.): (M+H)+=357. 1(bd, 1H, NH); 7,19-7,51 (m, 4H, фенилен); 7,308,82 (bm, 4H, пиридил). Аналогичным образом получали следующие соединения: метиловый эфир N-трет-бутоксикарбонил 4-(2-пиридил)-L-фенилаланина: МС (C.I.): (M+H)+=357;H-ЯМР (200 МГц, CDCl3):(част./млн): 1,41 [m, 9H, C(CH3)3]; 2,98-3,18 (m, 2H, CH2); 3,71 (s, 3H, COOCH3); 4,53-4,64 (m, 1H, CHCOO); 4,98 (bd, 1H, NH); 7,02-7,28 (m, 3H, тиенил); 7,10-7,54 (m, 4H, фенилен). Пример 4. Получение дигидрохлорида метилового эфира 4-(3-пиридил)-L-фенилаланина. Тионилхлорид (0,85 мл; 4,78 ммоля) добавляли по каплям к раствору метилового эфираN-трет-бутоксикарбонил-4-(3-пиридил)-L-фенилаланина (1,4 г; 3,93 ммоля) в метаноле (30 мл), полученного согласно примеру 3, поддерживая температуру на уровне 0 С. По окончании добавления температуру реакционной смеси доводили до комнатной и выдерживали при перемешивании в течение 8 ч. Растворитель выпаривали при пониженном давлении, получая дигидрохлорид метилового эфира 4-(3 пиридил)-L-фенилаланина (820 мг; выход 71%),который непосредственно использовали в следующих реакциях. МС (C.I.): (M+H)+=257 (свободное основание). 1H-ЯМР (200 МГц, D2O):(част./млн): 3,11-3,32 (m, 2H, CH2); 3,67 (s, 3H, CH3); 4,314,37 (m, 1H, CH); 7,30-7-63 (m, 4H, фенилен); 7,97 (dd, 1H, CH-N-CH-CH-CH); 8,59 (d, 1H, CHN-CH-CH-CH); 8,65-8,71 (m, 1H, CH-N-CH-CH); 8,89 (d, 1H, CH-N-CH-CH-CH). Работая аналогично, получали следующие соединения: дигидрохлорид метилового эфира 4-(2 пиридил)-L-фенилаланина: МС (C.I.): (M+H)+=257 (свободное основание); 1H-ЯМР (200 МГц, D2O):(част./млн): 3,12-3,33 (m, 2H, CH2); 3,64 (s, 3H, CH3); 4,304,37 (m, 1H, CH); 7,36-7,73 (m, 4H, фенилен); 7,78-8,58 (m, 4H, пиридил); дигидрохлорид этилового эфира 4-(5 пиримидинил)-L-фенилаланина: 1(част./млн): 1,11 (t, 3H, CH2-CH3); 3,10-3,35 (m,2H, CH2-CH); 4,04-4,20 (m, 2H, CH2-CH3); 4,224,35 (m, 1H, CH); 7,40-7,84 (m, 4H, фенилен); 9,15 (s, 2H, N-CH-C-CH-N); 9,19 (s, 1H, N-CHN); дигидрохлорид метилового эфира 4-(2 пиразинил)-L-фенилаланина: МС (C.I.): (M+H)+=258 (свободное основание); 1H-ЯМР (200 МГц, DСl 1 н.):(част./млн): 3,45-3,67 (m, 2H, CH2); 3,98 (s, 3H, CH3); 4,654,72 (m, 1H, CH); 7,68-8,26 (m, 4H, фенилен); 9,02 (d, 1H, CH-N-CH-CH); 9,44 (dd, 1H, CH-NCH-CH); 9,54 (d, 1H, CH-N-CH-CH); гидрохлорид метилового эфира 4-(2 тиенил)-L-фенилаланина: МС (C.I.): (M+H)+=262 (свободное основание); 1H-ЯМР (200 МГц, D2O):(част./млн): 2,98-3,19 (m, 2H, CH2); 3,65 (s, 3H, CH3); 4,214,28 (m, 1H, CH); 6,96-7,28 (m, 3H, тиенил); 7,08-7,52 (m, 4H, фенилен); дигидрохлорид метилового эфира 4-(2 тиазолил)-L-фенилаланина: 1H-ЯМР (200 МГц, D2O):(част./млн): 3,10-3,32 (m, 2H, CH2-СН); 3,68 (s, 3H, CH3); 4,30-4,38 (m, 1H, CH); 7,30-7,80 (m, 4H, фенилен); 7,70-7,91 (m, 2H, тиазолил). Пример 5. Получение 2-изобутил-3-фенилкарбонилтиопропионовой кислоты. Смесь 2-изобутилакриловой кислоты (6,34 г; 49 ммолей) и тиобензойной кислоты (5,96 мл; 51 ммоль) выдерживали, перемешивая, при 100 С в течение 2 ч. Затем реакционную смесь обрабатывали петролейным эфиром при 4060 С (100 мл) и охлаждали при -70 С в бане сухой лед/ацетон. После фильтрации и промывки петролейным эфиром при -70 С собирали остаток, из которого после сушки при пониженном давлении получали 2-изобутил-3-фенилкарбонилтиопропионовую кислоту (11,12 г; выход 85%) в виде твердого вещества белого цвета. 1(m, 1H); 3,10-3,40 (m, 2H); 7,35-7,62 (m, 3H); 7,90-8,00 (d, 2H). Аналогичным образом получали следующие соединения: 2-(3-метоксифенил)метил-3-фенилкарбонилтиопропионовую кислоту: 1H-ЯМР (200 МГц, ДМСО-d6):(част./ млн): 2,45-3,25 (m, 5H, S-CH2-CH-CH2); 3,90 (s,2H, CH2-фенил); 6,85-7,91 (m, 13H, арил). Пример 6. Получение метилового эфира N[(2S)-3-фенилкарбонилтио-2-фенилметилпропионил]-4-(2-тиазолил)-L-фенилаланина (соединение 1). Раствор гидроксибензотриазола (0,54 г; 4 ммоля) в тетрагидрофуране (30 мл) и затем раствор дициклогексилкарбодиимида (0,825 г; 4 ммоля) в метиленхлориде (15 мл) добавляли с перемешиванием при 0 С к смеси, содержащей(2S)-3-фенилкарбонилтио-2-(фенилметилпропионовую кислоту (1,2 г; 4 ммоля), дигидрохлорид метилового эфира 4-(2-тиазолил)-L-фенилаланина (1,34 г; 4 ммоля), полученный согласно примеру 4, триэтиламин (1,11 мл; 8 ммолей) в тетрагидрофуране (20 мл) и в метиленхлориде(30 мл). Реакционную смесь выдерживали при перемешивании в течение 20 ч, затем отфильтровывали дициклогексилмочевину и растворитель выпаривали при пониженном давлении. Остаток собирали этилацетатом и раствор промывали 20%-ным водным раствором хлорида натрия, 5%-ным раствором бикарбоната натрия и еще раз 20%-ным раствором хлорида натрия. После разделения фаз и упаривания органической фазы образовавшееся белое твердое вещество очищали экспресс-хроматографией (силикагель, элюент этилацетат : гексан в соотношении 40:60, давление азота 0,1 атм.), получая таким путем метиловый эфир N-[(2S)-3 фенилкарбонилтио-2-фенилметилпропионил]-4(2-тиазолил)-L-фенилаланина (1,5 г).H-ЯМР (200 МГц, CDCl3):(част./млн): 2,63-3,35 (m, 7H, CH2-CH-CH2, CH2-C6H4 тиазолил); 3,68 (s, 3H, COOCH3); 4,75-4,85 (m,1H, CH-COO); 5,78 (d, 1H, NH); 7,10-8,00 (m,16H, арил). Аналогичным образом, используя в качестве исходных веществ известные соединения или соединения, полученные согласно примерам 4 и 5, получали следующие соединения: метиловый эфир N-[(2S)-(3-фенилкарбонилтио-2-фенилметилпропионил]-4-(2-фурил)L-фенилаланина (соединение 2):H-ЯМР (200 МГц, CDCl3):(част./млн): 2,68-3,37 (m, 7H); 3,60-3,61 (2s, 3H, COOCH3); 4,31-4,45 (m, 1H, CH-COOCH3); 6,01-6,10 (2d,1H, NH); 6,80-8,00 (m, 14H). Пример 7. Получение N-[(2S)-3-меркапто 2-фенилметилпропионил]-4-(2-тиазолил)-Lфенилаланина (соединение 16). Метиловый эфир N-[(2S)-3-фенилкарбонилтио-2-фенилметилпропионил]-4-(2-тиазолил)-L-фенилаланина (1,4 г; 2,57 ммоля), полученный, как описано в примере 6, суспендировали в этаноле (30 мл), дегазировали, барботируя азотом, для удаления кислорода. К суспензии при 5 С добавляли по каплям водный дегазированный 1 н. раствор гидроксида натрия (7,7 мл) и в конце добавления дополнительную порцию дегизированного этанола (20 мл). Реакционную смесь выдерживали при перемешивании в течение 4 ч при комнатной температуре, затем охлаждали до 0 С и подкисляли 5%-ной соляной кислотой (10 мл). Реакционную смесь упаривали досуха и остаток собирали ацетонитрилом и водой и затем фильтровали, получая таким путем N-[(2S)-3-меркапто-2-фенилметилпропионил]-4-(2-тиазолил)-L-фенилаланин (1 г).(d, 1H, NH); 12,76 (s, 1H, COOH). Аналогичным образом получали следующие соединения:(m, 2H, тиазолил); 8,46-8,53 (2d, 1H, NH). Пример 8. Оценка фармакологической активности in vitro. а) Ингибирующая активность в отношенииNEP оценивали на мембранах коркового слоя почки крыс, полученных в соответствии со способом, описанным у T. Maeda и др. в Biochim.Biophys. Acta 1983, 731(1), 115-120. У самцов крыс линии Sprague-Dawley весом примерно 300 г удаляли почки и выдерживали при 4 С. Корковый слой почки осторожно отсекали, тонко измельчали и суспендировали в гомогенизирующем буфере (10 мМ фосфат натрия, рН 7,4, содержащий 1 мМ MgCl2, 30 мМNaCl, 0,02% NaN3) в соотношении 1:15 мас./об. Затем ткань гомогенизировали в течение 30 с на холоду с использованием гомогенизатора типа 20 наслаивали на 10 мл сахарозы (41% мас./об.) и центрифугировали при 31200 об/мин в течение 30 мин при 4 С с фиксированным углом ротора. Мембраны собирали с поверхности буфера/сахарозы, дважды промывали 50 мМ трисHCl-буфером (рН 7,4) и ресуспендировали в этом же буфере для хранения до использования в виде небольших аликвотных количеств при 80 С. Ингибирующую активность в отношенииNEP оценивали в соответствии с методом, описанным у C. Llorens и др. в Eur. J. Pharmacol. 69,(1981), 113-116, согласно данному описанию. Аликвотные количества полученной по описанной выше методике суспензии мембран (концентрация 5 мкг/мл протеинов) предварительно инкубировали в присутствии ингибитора аминопептидазы (бестатин -1 мМ) в течение 10 мин при 30 С. Добавляли [3H][Leu5]-энкефалин(15 нМ) и трис-HCl-буфер, рН 7,4 (50 мМ) таким образом, чтобы получить конечный объем 100 мкл. Инкубацию (20 мин при 30 С) прекращали,добавляя 0,1 М HCl (100 мкл). Образование метаболита [3H]Tyr-Gly-Gly количественно оценивали с помощью хроматографии на полистироловых колонках (Porapak Q). Процент ингибирования образования метаболита в препаратах мембран, обработанных соединениями формулыI и соединениями-эталонами, по сравнению с необработанными препаратами мембран выражали в виде значения IC50 (нМ). б) Ингибирующая активность в отношенииACE оценивали в соответствии с методом, известным из литературы [B.Holmquist и др.Analytical Biochemistry, 95, 540-548 (1979)]. 50 мкМ ACE (250 миллиед./мл, выделенный из легкого кролика, КФ 3.4.15.1, фирмаSIGMA) предварительно инкубировали в термостатированных кюветах при 37 С с 50 мкл соединения формулы I или соединения-эталона или соответствующего носителя. Реакцию начинали добавлением 0,8 мМ фурилакрилоилфенилаланилглицил-глицина(FAPGG-SIGMA). Одновременно с помощью спектрофотометра типа Beckman DU-50, снабженного программой для расчета дельта A/мин и коэффициентов регрессии кривых, описывающих кинетику фермента, регистрировали непрерывно в течение 5 мин поглощение при 340 нм. Процент ингибирования фермента в препаратах, обработанных соединениями формулы I или соединениямиэталонами, по сравнению с необработанными препаратами выражали в виде значения IC50(нМ). Значения IC50 (нМ), соответствующие ингибирующей активности в отношении ACE и ингибирующей активности в отношении NEP соединений 16, 18-25, 27-33 и соединенийэталонов тиорфана и каптоприла, приведены ниже в таблице 1.ACENEPингибирующая ингибирующая Соединение активность IC50 активность IC50 16 18 19 20 21 22 23 24 25 27 28 29 30 31 32 33 Тиорфан Каптоприл Данные, приведенные в таблице 1, показывают, что предлагаемые согласно изобретению соединения формулы I обладают выраженной смешанной ACE/NEP-ингибирующей активностью. Выявленная активность сопоставима с активностью каптоприла в отношении ACEингибирующей активности и выше активности тиорфана в отношении NEP-ингибирующей активности. Пример 9. Оценка фармакологической активности ex vivo. а) Ингибирующая активность в отношенииNEP ex vivo оценивали в соответствии с методом, известным из литературы (M. Orlowsky и др., Biochemistry 1981, 20, 4942-4950). Ингибирующую активность соединений формулы I оценивали на почках крыс со спонтанной гипертензией (SHR) через 5 мин после внутривенной инъекции тестируемых соединений (0,6 и 21 мкмоль/кг) и через 30 мин, 60 мин и 4 ч после орального введения (30 мкмолей/кг) тестируемых соединений. После удаления почек у крыс с SHR почечную ткань гомогенизировали и инкубировали в течение 15 мин при 37 С в присутствии глутарил-Ala-Ala-Phe-2-нафтиламида (GAAP) в качестве субстрата и аминопептидазы M при рН 7,6. Реакцию прекращали, добавляя 10%-ный водный раствор трихлоруксусной кислоты. Высвобождающийся 2-нафтиламин выявляли добавлением красителя быстрый темно-красный (2 мл). Скорости ферментативной реакции определяли измерением увеличения оптической плотности при 524 нм (OП 524) по сравнению со стандартом, полученным для комплекса 2-нафтиламина и быстрого темнокрасного. Ингибирующую активность тести 22 руемых соединений в отношении NEP выражали в виде процента ингибирования NEP в почках SHR. б) Ингибирующая активность в отношенииACE ex vivo оценивали в соответствии с радиометрическим методом, известным из литературы [J.W. Ryan и др., Biochem. J. (1977) 167, 501504]. Ингибирующую активность соединений формулы I оценивали на легких крыс со спонтанной гипертензией (SHR) через 5 мин после внутривенной инъекции тестируемых соединений (0,6 и 21 мкмоль/кг) и через 30 мин, 60 мин и 4 ч после орального введения (30 мкмолей/кг) тестируемых соединений. После удаления легких у крыс с SHR ткань легкого гомогенизировали и инкубировали в течение 2 ч при 37 С в присутствии [3H]Hyp-Gly-Gly в качестве субстрата. Реакцию прекращали добавлением соляной кислоты. Высвободившуюся радиоактивно меченную гиппуровую кислоту экстрагировали этилацетатом и уровень радиоактивности определяли с помощью жидкостной сцинтилляционной спектрометрии в соответствии с общепринятыми методами. Ингибирующую активность тестируемых соединений в отношении ACE выражали в виде процента ингибирования ACE в легких SHR. В качестве примера ниже в таблице 2 представлены выраженные в процентах базовые ферментативные активности, полученные в опытах ex vivo после внутривенного или орального введения соединения 16 и соединенийэталонов R-1, R-2, R-3 и R-4. Таблица 2. Процент NEP-ингибирования и ACEингибирования ex vivo соединением 16 и соединениями R-1,R-2, R-3 и R-4(30 25% 20% 10% 5% мкмоль/кг) Оральный Не акНе акR-4 23 Данные, приведенные в таблице 2, подтверждают, что предлагаемые согласно изобртению соединения формулы I обладают выраженной ACE/NEP-ингибирующей активностью как после внутривенного введения, так и после орального введения. При этом в опытах exvivo ACE/NEP-ингибирующая активность соединений формулы I оказалась существенно более высокой по сравнению с таковой соединений-эталонов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулыR обозначает меркаптогруппу или группуR1 обозначает С 2-С 4 алкильную группу с прямой или разветвленной цепью или арильную или арилалкильную группу, имеющую от 1 до 6 атомов углерода в алкильном фрагменте, где арил обозначает фенил или 5- или 6-членный ароматический гетероцикл с одним или двумя гетероатомами, выбранными из группы, включающей азот, кислород и серу, необязательно замещенный одним или несколькими одинаковыми или различными заместителями, выбранными из группы, включающей атомы галогена,гидроксигруппы, алкокси-, алкил-, алкилтио-,алкилсульфонильные или алкоксикарбонильные группы, которые имеют от 1 до 6 атомов углерода в алкильном фрагменте, С 1-С 3 алкильные группы, которые содержат один или несколько атомов фтора, карбоксигруппы, нитрогруппы,амино- или аминокарбонильные группы, ациламиногруппы, аминосульфонильные группы,моно- или диалкиламино- или моно- или диалкиламинокарбонильные группы, имеющие от 1 до 6 атомов в алкильном фрагменте;R2 обозначает водород, С 1-С 4 алкильную группу с прямой или разветвленной цепью или бензильную группу;R3 обозначает фенильную группу, замещенную 5- или 6-членным ароматическим гетероциклом, который содержит один или два гетероатома, выбранных из группы, включающей азот, кислород и серу, причем, фенильная и гетероциклическая группы необязательно замещены одним или несколькими одинаковыми или различными заместителями, имеющими значения, указанные для R1;R4 обозначает С 1-С 4 алкильную группу с прямой или разветвленной цепью или фенильную группу; 24 атомы углерода, помеченные звездочкой являются стереогенными центрами; и его фармацевтически приемлемые соли. 2. Соединение формулы I по п.1, где R3 обозначает фенильную группу, замещенную в положении 4 гетероциклической группой. 3. Соединение формулы I по п.2, где R1 обозначает арилалкильную группу, необязательно замещенную одним или несколькими одинаковыми или различными заместителями,выбранными из группы, включающей атомы галогена, гидрокси-, алкил- или алкоксигруппы. 4. Соединение формулы I по п.3, где R1 обозначает фенилалкильную группу, необязательно замещенную одним или несколькими одинаковыми или различными заместителями,выбранными из группы, включающей атомы галогена, гидрокси-, алкил- или алкоксигруппы. 5. Соединение формулы I по п.1 в форме соли щелочного металла, выбранного из группы, включающей натрий, литий и калий. 6. Способ получения соединения формулыI по п.1, включающей взаимодействие между соединением формулы где R и R1 имеют указанные выше значения, и производным фенилаланина формулы где R2 и R3 имеют указанные выше значения. 7. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы I по п.1 в смеси с носителем, пригодная для фармацевтического применения. 8. Фармацевтическая композиция по п.7,предназначенная для лечения сердечно-сосудистых заболеваний. 9. Способ лечения сердечно-сосудистых заболеваний, включающий введение терапевтически эффективного количества соединения формулы I по п.1. 10. Соединение, выбранное из группы,включающей: метиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(2-тиазолил)-Lфенилаланина; метиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(2-пиридил)-Lфенилаланина; бензиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(3-пиридил)-Lфенилаланина; метиловый эфир N-(3-фенилкарбонилтио 2-фенилметилпропионил)-4-(2-фурил)-Lфенилаланина;
МПК / Метки
МПК: C07D 277/30, A61P 9/00, A61K 31/425
Метки: производные, активностью, тиольные, металлопептидаз, обладающие, ингибирующей, отношении
Код ссылки
<a href="https://eas.patents.su/14-991-tiolnye-proizvodnye-obladayushhie-ingibiruyushhejj-aktivnostyu-v-otnoshenii-metallopeptidaz.html" rel="bookmark" title="База патентов Евразийского Союза">Тиольные производные, обладающие ингибирующей активностью в отношении металлопептидаз.</a>
Предыдущий патент: Игла, снабженная ползуном, для вязальной машины
Следующий патент: Антагонисты гормона, высвобождающего гонадотропин.
Случайный патент: Система и способ гидратации олефинов