Ненуклеозидные ингибиторы обратной транскриптазы как антагонисты пролиферации и индукторы дифференцировки клеток
Номер патента: 7004
Опубликовано: 30.06.2006
Авторы: Спадафора Коррадо, Лавия Патриция, Нерви Клара, Маттеи Элизабетта, Лорендзини Родольфо Нелло, Паломбини Гильельмо
Формула / Реферат
1. Применение по меньшей мере одного соединения-ингибитора обратной транскриптазы для получения фармацевтической композиции для противодействия утрате дифференцировки клеток и уменьшения скорости пролиферации клеток при раковых и не раковых патологиях, где вышеуказанное соединение выбрано из класса соединений 5,11-дигидро-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепина.
2. Применение по п.1, где соединение способно стимулировать дифференцировку клеток.
3. Применение по п.1, где соединение способно уменьшать скорость пролиферации клеток.
4. Применение по п.1, при котором раковые патологии выбраны из группы лейкемий и твердых опухолей, таких как эпителиальные, мезенхимальные опухоли и опухоли нервной системы, тератокарцинома, фибро- и остеосаркома, рак толстой кишки, рак молочной железы, глиома и гепатома.
5. Применение по меньшей мере одного соединения-ингибитора обратной транскриптазы для получения фармацевтической композиции для противодействия утрате дифференцировки клеток и уменьшения скорости пролиферации клеток при раковых и не раковых патологиях, где вышеуказанное соединение выбрано из числа невирапина, эфавиренца, делавирдина, соответствующих им солей и/или фармацевтически приемлемых производных.
6. Применение по п.5, где соединение способно стимулировать дифференцировку клеток.
7. Применение по п.5, где соединение способно уменьшать скорость пролиферации клеток.
8. Применение по п.5, при котором раковые патологии выбраны из группы лейкемий и твердых опухолей, таких как эпителиальные, мезенхимальные опухоли и опухоли нервной системы, тератокарцинома, фибро- и остеосаркома, рак толстой кишки, рак молочной железы, глиома и гепатома.
9. Применение по пп.1-8, при котором фармацевтические композиции дополнительно включают носители, и/или разбавители, и/или растворители, и/или наполнители для получения композиций для перорального, внутривенного, внутримышечного или подкожного введения.
10. Применение по пп.1-9, при котором фармацевтические композиции имеют вид пилюль, суспензий или растворов.
11. Применение 5,11-дигидро-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепинов для получения фармацевтических композиций, обладающих антипролиферативной активностью и активностью, индуцирующей дифференцировку клеток.
12. Применение по меньшей мере одного соединения, выбранного из числа невирапина, эфавиренца, делавирдина, соответствующих им солей и/или фармацевтически приемлемых производных, для получения фармацевтических композиций, обладающих антипролиферативной активностью и активностью, индуцирующей дифференцировку клеток.
Текст
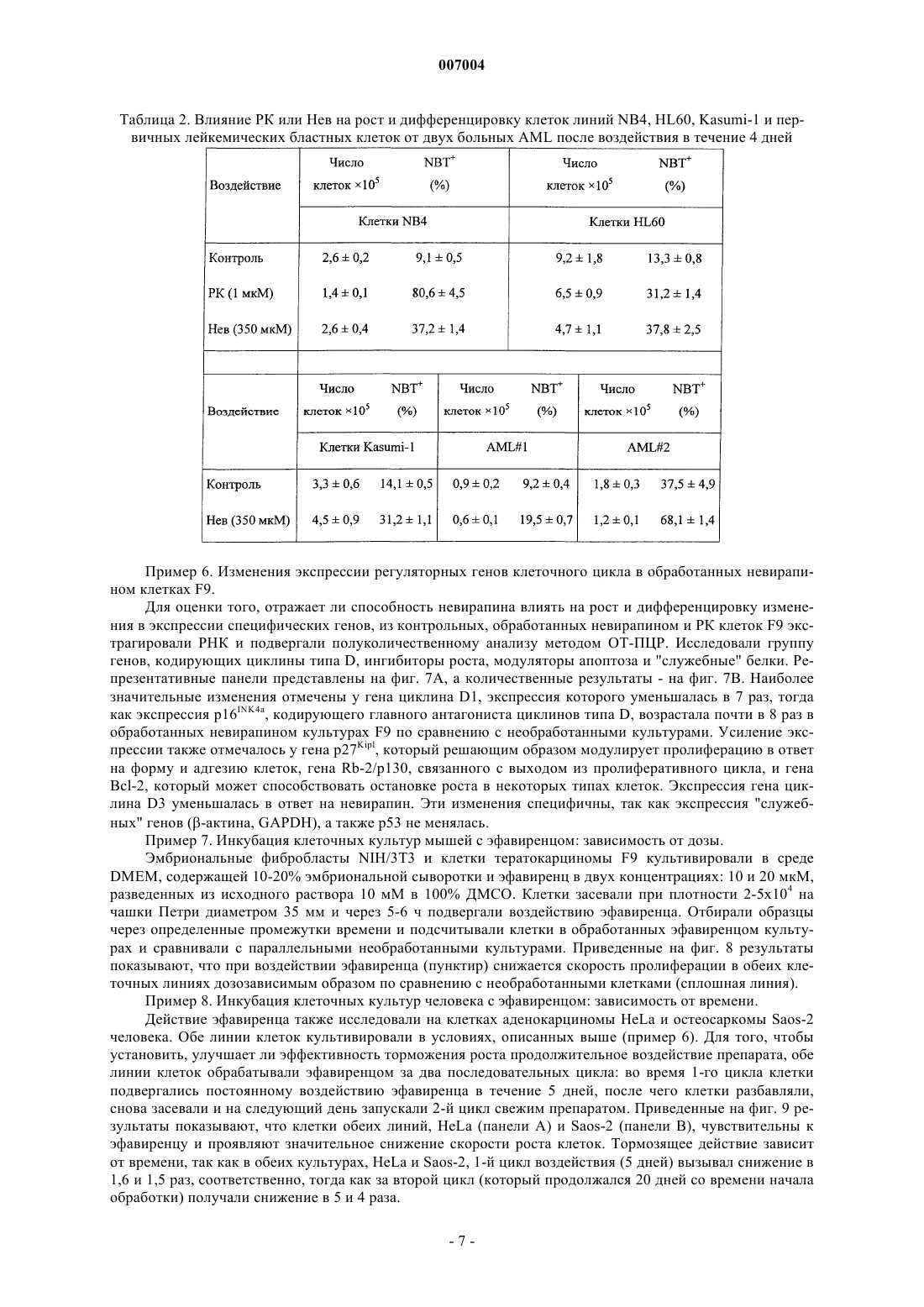
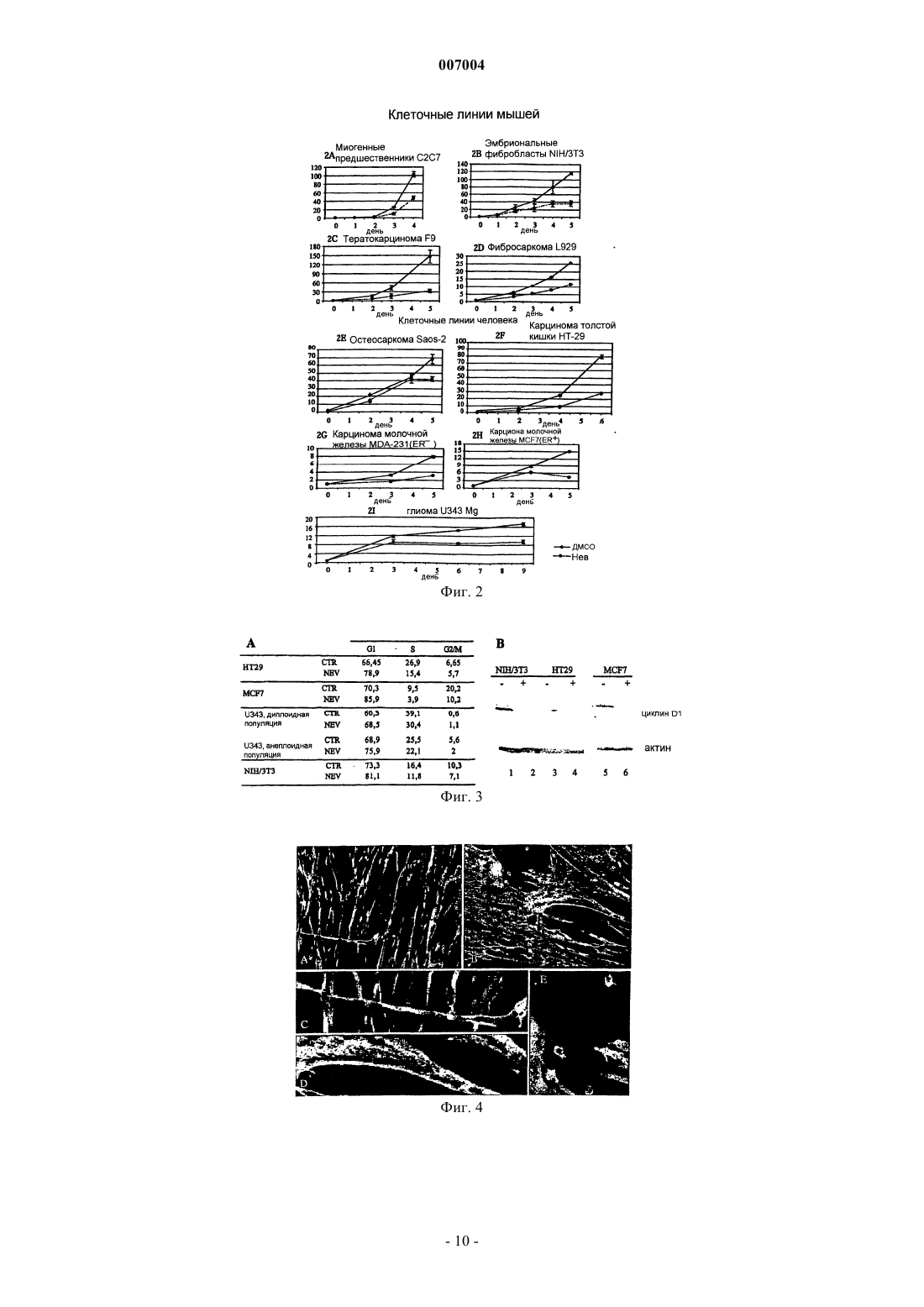
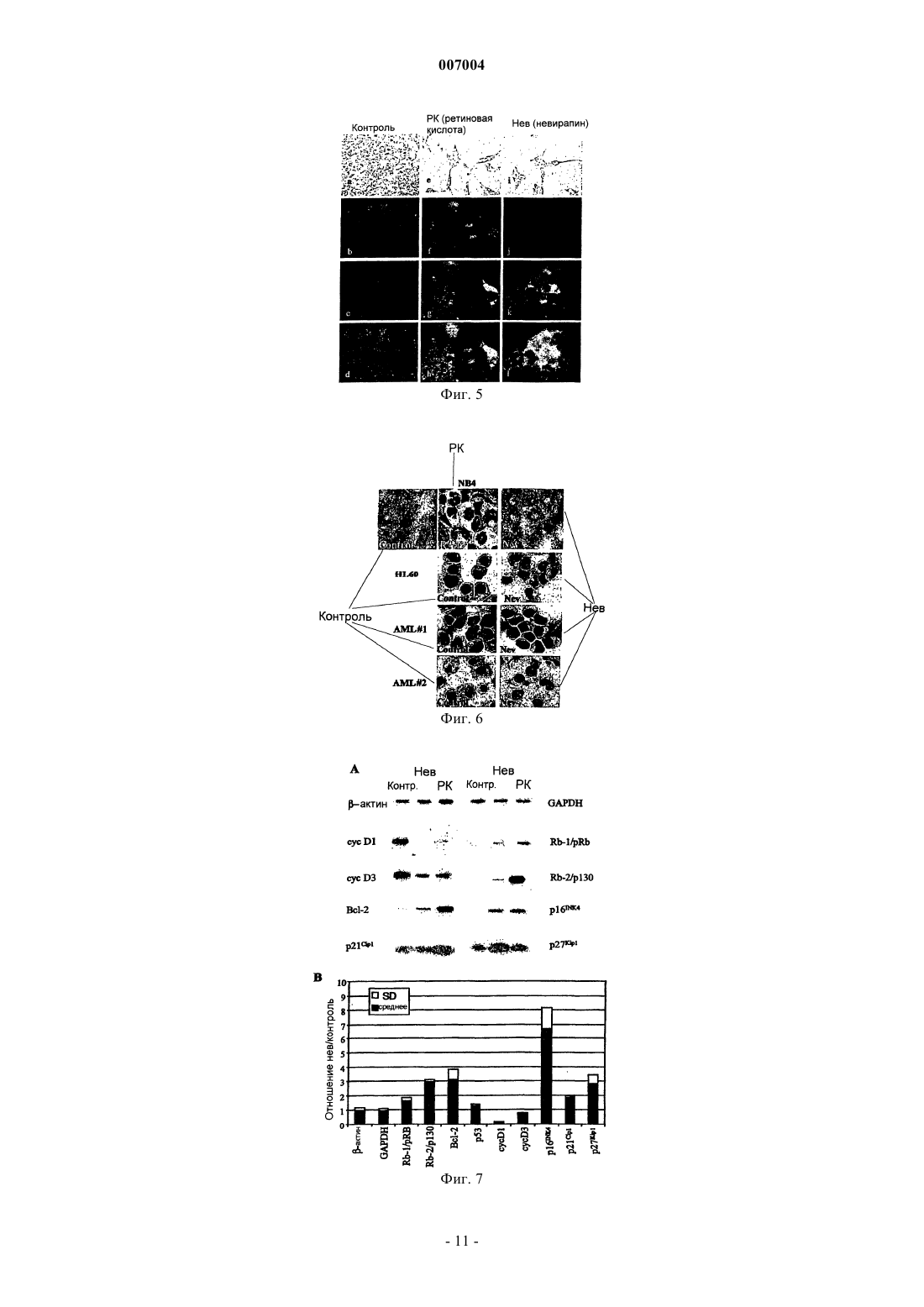
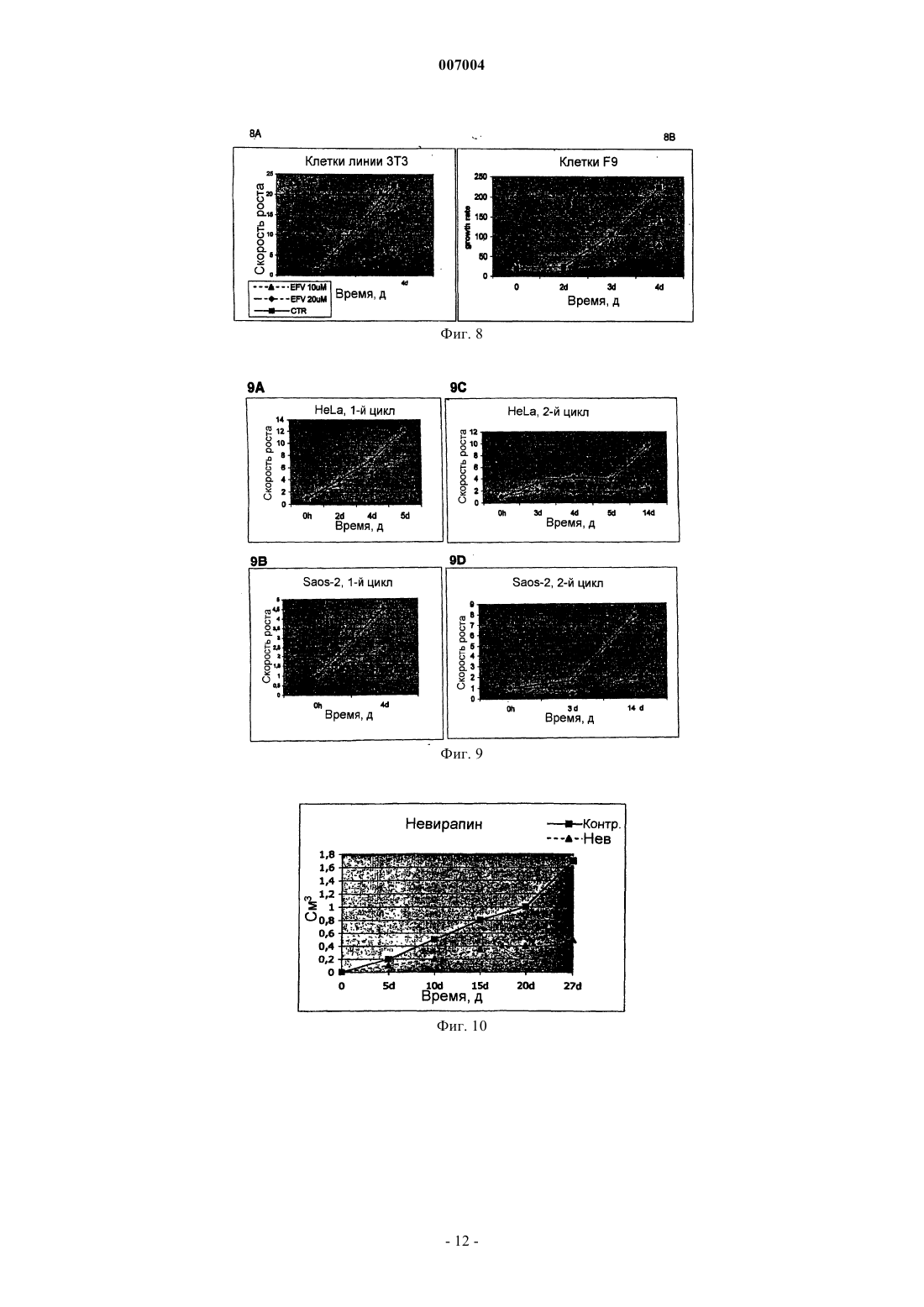
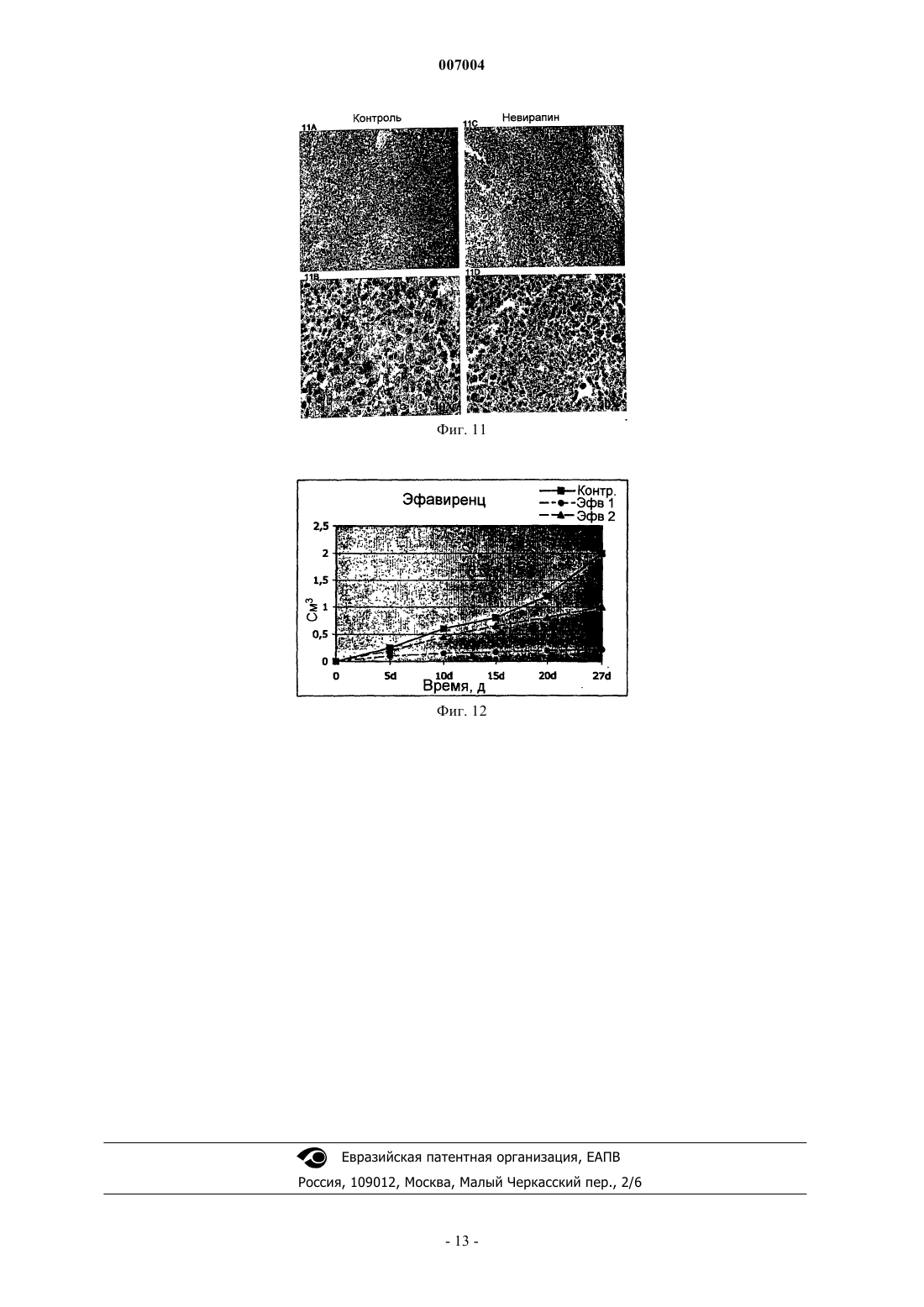
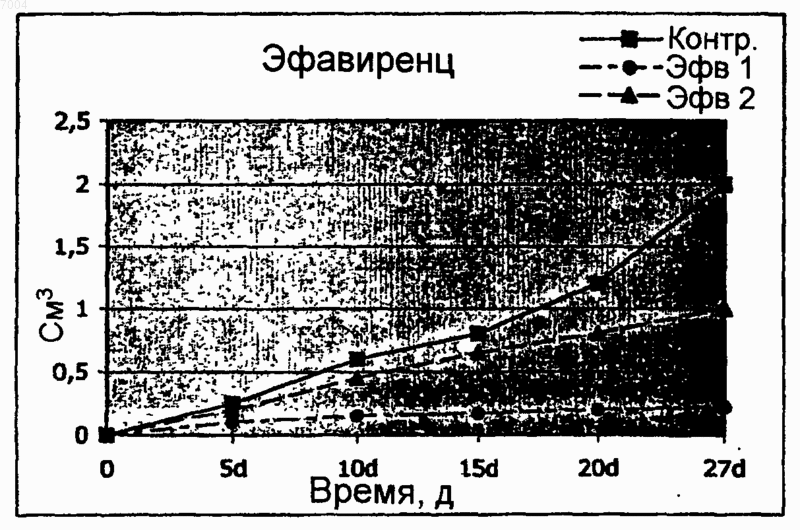
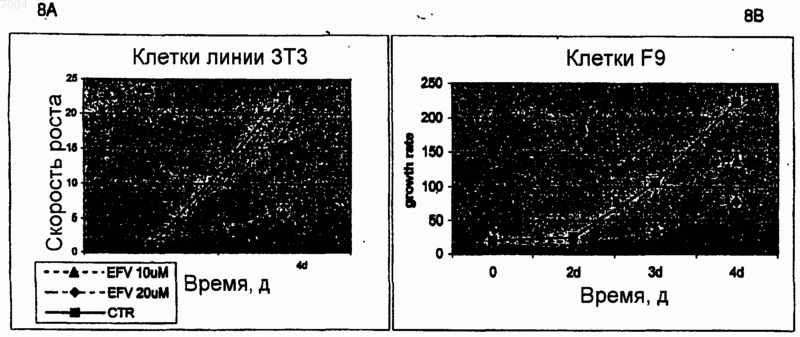
007004 Область техники, к которой относится изобретение Настоящее изобретение касается ненуклеозидных ингибиторов обратной транскриптазы (ОТ) как антагонистов пролиферации и индукторов дифференцировки клеток для медицинского применения при лечении и/или предупреждении заболеваний, связанных с пролиферацией и дифференцировкой, таких как раковые заболевания. Уровень техники Эндогенная (не теломерная) обратная транскриптаза (ОТ) - это фермент, который кодируется двумя классами широко распространенных повторяющихся элементов во всех эукариотических геномах: ретротранспозонами и эндогенными ретровирусами (di Marzo Veronese F, Copeland TD, DeVico AL, Rahmaninhibitors of HIV-1 reverse transcriptase: nevirapine as a prototype drug). Экспрессия кодирующих ОТ генов обычно репрессируется в терминально дифференцированных, не патологических тканях, где она обнаруживается лишь на базальном уровне, однако остается высокой в зародышевых, эмбриональных тканях и раковых клетках. Роль, которую играет ОТ в таких фундаментальных процессах, как рост и дифференцировка клеток, остается не выясненной. Невирапин, эфавиренц и рескриптор, также известные под коммерческими названиями Viramune,Sustiva и Rescriptor соответственно, известны как ненуклеозидные ингибиторы ОТ и широко применяются при лечении СПИД в качестве антиретровирусных препаратов. В частности, невирапин имеет следующую эмпирическую формулу: C15H14N4O. В очищенном состоянии он представляет собой кристаллическое твердое вещество с молекулярным весом 266,302, точкой плавления 247-249 С и растворимостью 0,1 мг/мл в воде и 5,5 мг/мл в спирте, которое может быть получено в соответствии с указаниями,представленными в патенте ЕР 429987. Невирапин (5,11-дигидро-11-циклопропил-4-метил-6 Ндипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он) входит в группу соединений 5,11-дигидро-6 Н-дипиридо[3,2b:2',3'-е][1,4]диазепина, известных в качестве ненуклеозидных ингибиторов ОТ и применяемых в профилактике и лечении ВИЧ-инфекций, как описано в ЕР 429987. Эфавиренц (м.в. 315,68) - это (-)-6-хлор-4-циклопропилэтинил-4-трифторметил-1,4-дигидро-2 Н-3,1 бензоксазинон (следующие источники включены в настоящее изобретение путем ссылки: 1. Young S.D.,Britcher S.F., Tran L.O.; Payne L.S., Lumma W.C., Lyle T.A., Huff J.R., Anderson P.S., Olsen D.B., Carrollreverse transcriptase. Antimicrob. Agents Chemoter. 39(12): 2602-2605 (1995)]. Рескриптор (м.в. 552,68) - это [1-(5-метансульфонамидо)-1 Н-индол-2-ил-карбонил]-4-[3(изопропиламино)-2-пиридинил]пиперазин (следующие источники включены в настоящее изобретение путем ссылки: 1. Romero D.L., Morge R.A., Genin M.J., Biles C., Busso M., Resnick L., Althaus I.W., ReusserShaw и другие [Int. J. STDAIDS, 10, 417-418 (1999)] продемонстрировали возможность излечения саркомы Капоши с помощью комбинированной терапии невирапином совместно с двумя дополнительными активными компонентами нуклеозидной природы, которые являются ингибиторами обратной транскриптазы.Grimaudo и другие [Eur. J. Cancer, 34 (11), 1756-1763 (1998) и US 6,258,839] описали оценку при invitro тестировании антиопухолевой активности ненуклеозидных ингибиторов обратной транскриптазы(NNRTIs, non-nucleosidic reverse transcriptase inhibitors). Активность состава, описанного Grimaudo, оценивали по измерению экспрессии белков р 53 и Вс 1-2 в лейкозных клетках человека HL60. US 6,258,839 раскрывает класс соединений флавоноидной природы. Было показано, что высокие дозы описанных составов уменьшают рост клеток опухолевых клеточных линий человека. Однако в этих работах не приведено никаких доказательств, объясняющих наблюдаемое явление.Ghori и другие [Colorectal disease 2000 UK, 2 (2), 106-112, (2000)] в своей работе тестировали в in vitro экспериментах аналоги нуклеозидов, чтобы установить их эффективность в механизмах, которые участвуют в ингибировании теломеразы.Lam и другие [Biochem. and Biophys. Res. Commun., 285 (4), 1071-1075, (2001)] показали, что белок хипсин (hypsin) обладает антипролиферативной активностью по отношению к клеткам гепатомы и лейкемии. Предварительные исследования в нашей группе показали, что невирапин и эфавиренц вызывают раннюю и эффективную остановку развития эмбрионов мышей на ранних стадиях при добавлении в-1 007004 культуры эмбрионов, полученные оплодотворением in vitro (IVF). Это наблюдение впервые показало,что оба препарата могут потенциально ингибировать пролиферацию клеток и навело нас на мысль протестировать их влияние на раковые клетки. Сущность изобретения Настоящее изобретение основывается на открытии того факта, что ненуклеозидные ингибиторы ОТ способствуют дифференцировке клеток одновременно со снижением пролиферации клеток. Термин "ингибитор" в настоящем изобретении относится к соединениям, препятствующим ферментативной активности путем прямого связывания с молекулами ОТ. Точнее, невирапин и эфавиренц связываются с гидрофобным карманом на субъединице р 66 ОТ, который располагается вблизи от каталитического сайта, функционирование которого при этом нарушается. Согласно этому определению и в рамках данного изобретения указанные выше коммерчески доступные соединения, а именно Viramune (невирапин), Sustiva (эфавиренц) и Rescriptor (делавирдин), а также другие соединения, способные препятствовать активности ОТ, могут применяться при лечении и/или предупреждении патологий, характеризующихся утратой клеточной дифференцировки и неконтролируемым ростом клеток. Таким образом,целью настоящего изобретения является применение ненуклеозидных соединений, проявляющих ингибирование активности ОТ по вышеуказанному механизму, которые могут применяться в профилактике и/или терапии для предотвращения утраты дифференцировки при патологиях, связанных с дедифференцировкой, и в качестве антипролиферативных лекарств при лечении раковых заболеваний. В частности,ингибиторы ОТ, противодействующие процессам клеточной пролиферации и дедифференцировки, могут применяться при лечении раковых заболеваний у человека, в особенности эпителиальных, мезенхимальных опухолей и опухолей нервной системы, включая лейкемии и твердые опухоли, такие как тератокарцинома, фибро- и остеосаркома, рак толстой кишки, рак молочной железы, глиома и гепатома. Среди ненуклеозидных ингибиторов ОТ настоящее изобретение определенно включает применение коммерчески доступных соединений, которые в настоящее время используются для лечения ВИЧинфекций и обладают активностью ненуклеозидных нгибиторов ОТ, включая их родственные фармацевтические формы. Среди таковых особенно предпочтительны следующие: Viramune (невирапин) (Boehringer), Sustiva (эфавиренц) (Bristol-Myers Squibb) и Rescriptor (делавирдин) (Agouron Pharmaceuticals). Вышеназванные соединения, и в частности невирапин, в их общеупотребимых и коммерчески доступных фармацевтических формах предлагаются в качестве примера соединений, пригодных для получения фармацевтических композиций для применения в тех случаях, когда необходимо контролировать дифференцировку и/или пролиферацию клеток, то есть способствующих дифференцировке и обладающих противораковой активностью. Терапевтический эффект этих молекул должен соответствовать их способности к ингибированию ОТ. Следующей целью изобретения является профилактическое или терапевтическое воздействие на пролиферацию клеток у млекопитающих, в частности у человека, вместе со способствующим дифференцировке и противораковым действием. Прочие цели станут понятными из подробного описания изобретения. Краткое описание фигур Фиг. 1 - обратная транскриптаза в клеточных линиях мышей и человека. Фиг. 1 А - определение функциональной активности ОТ после инкубации РНК MS2 с лизатами из различных типов клеток человека (дорожки 1-9) и мышей (дорожки 10-22). Дорожка 1 - лейкемия NB4, 2 - лейкемия R4, 3 - лейкемияKasumi-1, 4 - лейкемия HL60, 5 - остеосаркома Saos-2, 6 - карцинома молочной железы MDA-231, 7 карцинома молочной железы MCF7, 8 - глиома U343 Mg, 9 - карцинома толстой кишки НТ-29, 10 - эмбриональные фибробласты NIH/3T3, 11 - миобласты С 2 С 7, 12 - тератокарцинома F9, 13 - фибросаркомаL929, 14 - контроль с лизатом F9, но без РНК MS2, 15 - только буфер, 16 - без лизата клеток млекопитающих, 17 - без РНК MS2 и без лизата клеток, 18 - положительный контроль с коммерческой ОТ, 19 без MS2-cпeцифичecкиx олигонуклеотидов, дорожки 20-22 - полные реакции с лизатом F9, преинкубированным с невирапином в концентрации 1 мкМ (дорожка 20), 10 мкМ (дорожка 21) и 100 мкМ (дорожка 22). Дорожки М - маркеры молекулярного веса ДНК, дорожка 23 - положительный контроль с коммерческой ОТ. Фиг. 1 В - анализ методом Western-гибридизации белков ОТ (верхние панели) и -тубулина(нижние панели) в экстрактах из целых клеток (ЦК) и ядер. Экстракты ЦК получали из клеток F9 (дорожка 1), NIH/3T3 (дорожка 2), MCF7 (дорожка 3), MDA-231 (дорожка 4), NB4 (дорожка 5), HL60 (дорожка 6) и ML2 (дорожка 7). Экстракты ядер получали из клеток F9 (дорожка 1), MCF7 (дорожка 2),MDA-231 (дорожка 3), NIH/3T3 (дорожка 4), HL60 (дорожка 5) и NB4 (дорожка 6). Фиг. 2 - невирапин ингибирует пролиферацию в клеточных линиях мышей и человека. Клетки культивировали в присутствии (пунктир) и в отсутствие (ДМСО, сплошная линия) невирапина. Пролиферацию выражали в виде отношения числа клеток в указанное время к исходному числу клеток, которое принимали за 1. Точки представляют средние значения, столбики - стандартное отклонение по меньшей мере из трех независимых определений у всех типов клеток. Фиг. 3 А - анализ клеточного цикла у контрольных и обработанных невирапином клеток. Распределение фаз клеточного цикла определяли методом FACS через 72 ч после начала применения невирапина. У клеток глиомы линии U343 клеточный цикл анализировали отдельно во фракции диплоидных клеток(составляющей около 2/3 от всех клеток) и в остальной фракции (около 1/3), в которой возникает анеуплоидия. Фиг. 3 В - анализ методом Western-гибридизации циклина D1 (верхняя панель) в экстрактах из указанных типов клеток, культивированных в течение 72 ч в присутствии (+, дорожки 2, 4 и 6) или в отсутствие (-, дорожки 1, 3 и 5) невирапина. Фильтр подвергали повторной гибридизации с антителом против актина в качестве контроля на равное количество материала (нижняя панель). Фиг. 4. Дифференцировка миогенных клеток С 2 С 7 после воздействия невирапина. Миобласты С 2 С 7 обрабатывали ДМСО (А, С) или невирапином (В, D, Е), а затем культивировали в среде для дифференцировки, после чего окрашивали с помощью антител против МНС (FITC, зеленый цвет) и красителя Hoechst 33258 для выявления ядер (синий цвет); представлены совмещенные фотографии. При увеличении х 20 миотрубочки в контрольных культурах (фиг. 4 А) выглядят более тонкими и встречаются реже, чем после воздействия невирапина (фиг. 4 В). Фиг. 4 С - миотрубочки из А при увеличении х 60. Фиг. 4D - миотрубочки из В при увеличении х 60. Фиг. 4 Е - МНС-положительные миобласты в поле В при увеличении х 60. Фиг. 5 - морфологическая дифференцировка у клеток F9, обработанных ретиноевой кислотой (РК) и невирапином. Культуры F9, обработанные ДМСО (контроль, фиг. 5 а, 5b, 5 с, 5d), невирапином (фиг. 5 е,5f, 5g, 5h) или РК (фиг. 5i, 5j, 5k, 5l), сначала исследовали in vivo после 72 ч культивирования, отмечая морфологическую реорганизацию (панели фиг. 5 а, 5 е, 5i, объектив х 60). По прошествии 96 ч образцы фиксировали и обрабатывали для иммунофлуоресценции на 1-цепь коллагена типа IV (фиг. 5 с, 5g, 5k) и окрашивания ядер методом DAPI (фиг. 5b, 5f, 5j); на фиг. 5d, 5h и 5i представлены совмещенные фотографии (объектив х 100). Фиг. 6 - обработка невирапином устраняет блокирование дифференцировки у бластных клетокAML. Морфологическая дифференцировка по окрашиванию Wright-Giemsa у клеток промиелоцитов линии NB4, клеток HL60 и бластных клеток от двух больных AML (AML1 и AML2) после обработки невирапином 400 мкМ (Нев) в течение 5 дней. Клетки NB4 также обрабатывали 1 мкМ РК, которая индуцирует дифференцировку гранулоцитов. В качестве контроля представлены необработанные клетки. Фиг. 7 - невирапин индуцирует изменения экспрессии генов у клеток F9. Тотальную РНК из клетокF9, культивированных в присутствии ДМСО (контроль), невирапина или РК, подвергали амплификации методом ОТ-ПЦР с помощью олигонуклеотидов к указанным генам, переносили на мембрану и гибридизировали со внутренними олигонуклеотидами. Репрезентативные панели представлены на фиг. 7 А. Фиг. 7 В - количественные изменения экспрессии генов. Продукты ОТ-ПЦР гибридизировали со внутренними олигонуклеотидами и определяли количественно методом денситометрии. Отношение сигналов невирапин-контроль нормализировали относительно сигналов -актина в том же эксперименте. Темные гистограммы представляют средние значения, а светлые - стандартное отклонение по меньшей мере из трех опытов по каждому гену. Фиг. 8 - эфавиренц ингибирует пролиферацию в клеточных линиях мышей (фиг. 8 А - клеточные линии 3 Т 3, фиг. 8 В - клетки F9). Клетки культивировали в присутствии (пунктир) и в отсутствие (ДМСО,сплошная линия) эфавиренца. Пролиферацию выражали в виде отношения числа клеток в указанное время к исходному числу клеток, которое принимали за 1. Точки представляют средние значения по меньшей мере из трех независимых определений. Фиг. 9 - эфавиренц ингибирует пролиферацию в клеточных линиях человека (фиг. 9 А - клеткиHeLa, 1-й цикл, фиг. 9 В - клетки HeLa, 2-й цикл, фиг. 9 С - клетки Saos, 1-й цикл, фиг. 9D - клетки Saos, 2 й цикл). Клетки культивировали в присутствии (пунктир) и в отсутствие (ДМСО, сплошная линия) эфавиренца. Пролиферацию выражали в виде отношения числа клеток в указанное время к исходному числу клеток, которое принимали за 1. Точки представляют средние значения по меньшей мере из трех независимых определений. Фиг. 10 - рост гепатомы Morris в контроле (сплошная линия) и у получавшей невирапин (пунктир) крысы. Скорость роста опухоли выражали как объем (в см 3) в зависимости от времени (в днях со времени инокуляции). Фиг. 11 - образцы тканей из обработанных невирапином (Нев) и необработанных (Контр.) крыс. Верхние панели (объектив х 10): трансформированные зоны на панели Нев (фиг. 11 В) заметно меньше по сравнению с необработанной (Контр.) тканью (фиг. 11 А). Нижние панели (объектив х 40): четко видны клетки, подвергающиеся апоптозу, в образце Нев (фиг. 11D), но не в образце Контр. (фиг. 11 С). Фиг. 12 - рост гепатомы Morris в контроле (сплошная линия) и у двух получавших эфавиренц (пунктир) крыс (EFV1 и EFV2). Скорость роста опухоли выражали как объем (в см 3) в зависимости от времени(в днях со времени инокуляции). Подробное раскрытие изобретения Сначала мы обнаружили активность ОТ, фермента-мишени ингибиторов, в целом ряде экстрактов из клеточных линий мышей и человека, используя метод определения ОТ на основе ПЦР. Затем добавляли невирапин (350-400 мкМ) или эфавиренц (10-20 мкМ) в культуры клетокпредшественников мышей (миогенные клетки-предшественники С 2 С 7, эмбриональные фибробластыNIH/3T3) и раковых клеток мышей и человека (тератокарцинома F9, фибросаркома L929, карцинома тол-3 007004 стой кишки НТ-29, карцинома молочной железы MCF-7, экспрессирующая эстрогеновые рецепторы(ER+), карцинома молочной железы MDA-231, отрицательная по эстрогеновым рецепторам (ER-), глиомаU343 Mg и остеосаркома Saos-2). Результаты показали, что ингибиторы ОТ вызывают снижение скорости пролиферации клеток и усиливают дифференцировку клеток. Дифференцировка также наблюдалась в клеточных линиях (NB4, HL60, Kasumi-1) острой миелоидной лейкемии (AML) и у первичных бластных клеток от двух больных AML, о чем свидетельствуют морфологические, функциональные и иммунофенотипические данные. Анализ методом ОТ-ПЦР мРНК, экстрагированной из клеток F9 до и после обработки невирапином, выявил значительное репрограммирование экспрессии генов в группе генов, решающим образом регулирующих клеточный цикл: экспрессия циклинов D1 и D3 уменьшилась, тогда как экспрессия их антагониста р 16 усилилась, в меньшей степени уменьшилась экспрессия ингибитора киназы р 27 и связанных с ретинобластомой генов Rb-1 и Rb-2. Эти результаты подтверждают мнение о том, что: а) эндогенная активность ОТ играет роль в онкогенезе и b) ингибиторы ОТ способствуют превращению раковых фенотипов в нормальные фенотипы. Индуцированную невирапином дифференцировку исследовали более подробно в клетках мультипотентной линии F9 и миогенной линии С 2 С 7, регистрируя появление специфических маркеров дифференцировки, которые не экспрессируются в клетках-предшественниках, а именно, -цепи коллагена IV в клетках F9 и миозина в клетках С 2 С 7, соответственно. Более того, исследования на морфологическом (соотношение ядро/цитоплазма и снижение базофильности), функциональном (определение NBT) и иммунофенотипическом (экспрессия специфичных к зародышевой линии поверхностных антигенов) уровне свидетельствуют, что обработка невирапином может устранить блокирование дифференцировки в клеточных линиях AML человека в первичных трансформированных бластных клетках от больных AML. На основании этих данных предложено использовать ненуклеозидные соединения, проявляющие ингибирование активности ОТ по вышеописанному механизму, в профилактике и/или терапии в качестве лекарств, препятствующих утере дифференцировки при патологиях, связанных с дедифференцировкой,таких как рабдомиосаркома, и в качестве антипролиферативных лекарств в терапии рака, в особенности эпителиальных, мезенхимальных опухолей и опухолей нервной системы, включая лейкемии и твердые опухоли, такие как тератокарцинома, фибро- и остеосаркома, рак толстой кишки, рак молочной железы,глиома и гепатома. Предпочтительны соединения, которые коммерчески доступны, применяются для лечения СПИД и обладают активностью ненуклеозидных нгибиторов ОТ. Особенно предпочтительны Viramune (невирапин) (Boehringer), Sustiva (эфавиренц) (Bristol-Myers Squibb) и Rescriptor (делавирдин) (Agouron Pharmaceuticals). Вышеназванные соединения, и в частности невирапин, в их общеупотребимых и коммерчески доступных фармацевтических формах предлагаются в качестве примера соединений, пригодных для получения фармацевтических композиций для применения в тех случаях, когда необходимо контролировать дифференцировку и в то же время противодействовать пролиферации клеток, то есть способствующих дифференцировке и обладающих противораковым действием. Терапевтический эффект этих молекул должен соответствовать их способности к ингибированию ОТ. Профилактическое или терапевтическое воздействие на пролиферацию клеток по изобретению может осуществляться у млекопитающих, в частности у человека. Нуждающимся в этом пациентам можно давать терапевтически эффективное количество по меньшей мере одного соединения, обладающего активностью ненуклеозидного ингибитора ОТ и приносящего лечебную пользу пациенту. Ненуклеозидные соединения по изобретению можно применять в фармацевтических композициях для получения медикаментов, способствующих дифференцировке и обладающих противораковым действием. Композиции для описанного в настоящем изобретении применения могут быть получены смешиванием эффективных количеств по меньшей мере одного активного начала с одним или несколькими физиологически приемлемыми носителями, и/или разбавителями, и/или растворителями, и/или наполнителями и вспомогательными веществами, облегчающими получение из активных соединений препарата,который может иметь фармацевтическое применение, например, в виде пилюль, растворов, суспензий. Эти фармацевтические композиции могут быть получены уже известным способом, например, при помощи стандартных процессов смешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульгирования, инкапсулирования, вкрапления или лиофилизации. Лекарственная форма зависит от выбранного способа применения. Фармацевтические композиции могут применяться перорально или путем внутривенного, внутримышечного или подкожного введения. Применение, дозировка и способы введения - согласно указаниям, приведенным в патенте ЕР 429987. Дозы и способы применения различаются в зависимости от типа и тяжести заболевания. Данное описание будет в дальнейшем продолжено описанием некоторых экспериментальных примеров с использованием вышеуказанных молекул. Однако следует подчеркнуть, что вследствие различий в химической структуре соединений, предпочтительных согласно настоящему изобретению, предусмат-4 007004 ривается, что изобретение не ограничивается такими молекулами, а могут применяться и другие соединения, обладающие активностью ингибиторов ОТ. Нижеследующие примеры следует рассматривать как иллюстративные и не ограничивающие рамки настоящего изобретения. Примеры Пример 1. Эндогенная активность ОТ в раковых клетках. Энзиматическая активность ОТ, являющаяся мишенью описанных в настоящем изобретении ингибиторов, была обнаружена во всех клеточных линиях, происходящих от мышей и человека, которые тестировали в данной работе основанным на ПЦР методом. Приведенные на фиг. 1 А результаты показывают, что лизаты из всех клеточных линий несут активность ОТ, способную к обратной транскрипции invitro экзогенной РНК (РНК фага MS2) с образованием амплифицированного продукта ожидаемого размера, то есть 112 п.о. (дорожки 1-13), причем кДНК не синтезируется, если в инкубационной смеси отсутствует РНК MS2 (дорожка 14) или клеточный лизат (дорожка 16). Более того, активность ОТ ингибируется, если клеточный лизат был преинкубирован с невирапином дозозависимым образом: продукт в 112 п.о. исчезает после инкубации в присутствии 100 мкМ (дорожка 22), но не 1 мкМ (20) или 10 мкМ(21). Присутствие фермента ОТ в раковых клетках также подтверждается при Western-гибридизации. Из фиг. 1 В видно, что белковые молекулы распознаются специфическими поликлональными антителами против ОТ как в целых клетках (ЦК), так и в лизатах ядер. Эти результаты показывают, что ОТ присутствует в раковых клетках и в виде белка, и в виде энзиматической активности, и она ингибируется невирапином. Пример 2. Инкубация клеточных культур мышей и человека с невирапином: замедление деления клеток. Предшественники мышечных клеток С 2 С 7, эмбриональные фибробласты NIH/3T3, клетки тератокарциномы F9 и фибросаркомы L929 (все мышиные) и клетки человека из следующих клеточных линий: остеосаркомы Saos-2, карциномы толстой кишки НТ-29, карциномы молочной железы MDA-231 (ER-),карциномы молочной железы MCF-7 (ER+), глиомы U343 культивировали в среде DMEM, содержащей 10-20% эмбриональной сыворотки и 350 мкМ невирапина, полученного разбавлением исходного раствора (250 мМ) в 100% ДМСО. Клетки засевали при плотности 2-5 х 104 на чашки Петри диаметром 35 мм и подвергали воздействию невирапина через 5-6 ч. Отбирали образцы через определенные промежутки времени и подсчитывали клетки в обработанных невирапином культурах и в контрольных (обработанных ДМСО) культурах. Приведенные на фиг. 2 результаты показывают, что при воздействии невирапина(пунктир) снижается скорость пролиферации во всех клеточных линиях. Наблюдались и некоторые различия по реакции на тормозящее действие препарата в зависимости от типа клеток: клетки тератокарциномы F9 проявляли наибольшую чувствительность - уменьшение скорости пролиферации в 5 раз после 120-часовой обработки. Близкая эффективность отмечалась и на клетках карциномы толстой кишки НТ 29. Самая замедленная реакция оказалась у клеток остеосаркомы Saos-2: только после 5-дневной обработки скорость роста начинала снижаться по сравнению с контрольными культурами. Пример 3. Инкубация клеточных культур с невирапином: выход из клеточного цикла. Анализ методом FACS обработанных невирапином клеточных культур выявил изменения в профиле клеточного цикла у некоторых типов клеток: как видно из фиг. 3 А, в культурах NIH/3T3, НТ-29, MCF7 и U343 Mg происходило накопление ДНК типа G0/G1 после 72-часового воздействия невирапина, тогда как за то же самое время контрольные образцы проявляли профили клеточного цикла, типичные для пролиферирующих культур. Это сопровождалось значительным снижением уровня циклина D1 в культурах NIH/3T3, НТ-29, MCF-7 (фиг. 3 В) и глиомы U343 Mg (данные не приводятся) под воздействием невирапина по сравнению с необработанным контролем. Пример 4. Инкубация клеточных культур с невирапином: индукция дифференцировки. Невирапин влияет на процессы дифференцировки клеток, как это видно при использовании модельных клеточных систем, способных к дифференцировке in vitro с характерным профилем. У миогенных сателлитных клеток С 2 С 7 мышей, которые пролиферируют как одноядерные миобласты, можно индуцировать дифференцировку при отмене фактора роста с образованием многоядерных миотрубочек,экспрессирующих специфичные для мышц гены. В наших экспериментах клетки С 2 С 7 культивировали в присутствии или в отсутствие невирапина в течение 90 ч (за это время культуры достигали насыщающей плотности), а затем переносили в среду для дифференцировки на 48 ч. При подсчете под световым микроскопом (n = 300 клеток из случайно выбранных полей) соотношение между многоядерными миотрубочками (то есть клетками, имеющими более 3 ядер) и одно/двуядерными клетками составило примерно 1:1 в обработанных невирапином образцах по сравнению с 1:2 в необработанных образцах. Также анализировали однослойные культуры методом иммунофлуоресценции (ИФ) с использованием поликлональных антител к тяжелой цепи миозина (МНС), позднего маркера дифференцировки мышц. В контрольных культурах, находившихся в среде для дифференцировки в течение 48 ч, многоядерные МНС-содержащие миотрубочки были тонкими и заметно меньшими (фиг. 4 С), чем в культурах, предварительно обработанных невирапином (фиг. 4D). Выделенные миобласты в основном были МНС-отрицательными в кон-5 007004 трольных культурах (фиг. 4 А), тогда как синтез миозина был уже активирован в миобластах, выделенных из обработанных невирапином чашек (фиг. 4 Е). Невирапин также индуцировал дифференцировку в клетках тератокарциномы F9. Необработанные клетки F9 имеют круглую форму и имеют тенденцию к образованию агрегатов во время роста (фиг. 5 а). Под воздействием ретиноевой кислоты (РК), хорошо известного индуктора дифференцировки, через 72 ч появляются характерные морфологические признаки дифференцировки (фиг. 5 е), включая уменьшение тенденции к образованию агрегатов, увеличение адгезивности и реорганизацию поверхности клеток с появлением дифференцированной морфологии. Аналогичные изменения наблюдались и в обработанных невирапином культурах (фиг. 5i). Морфологическая реорганизация сопровождалась увеличением синтеза 1-цепи коллагена IV типа (фиг. 5k) - маркера дифференцировки, вызванной воздействием РК (фиг. 5g),который синтезируется на низком уровне в контрольных культурах (фиг. 5 с). В совокупности результаты на фиг. 4 и 5 показывают, что невирапин индуцирует дифференцировку или способствует ей в двух разных типах клеток. Пример 5. Обработка невирапином индуцирует дифференцировку бластных клеток острой миелоидной лейкемии (AML) человека. Анализировали действие невирапина на клетки острой промиелоцитарной линии NB4, экспрессирующей онкопротеин t(15;17) PML/RAR, ответственный за блокировку дифференцировки в этих бластных клетках, и клетки острой миелобластической лейкемии HL60, ввиду их известной чувствительности к вызванной РК дифференцировке в гранулоциты. После 5 дней обработки невирапином отмечалось появление клеток с морфологией типа миеломоноцитов в обеих линиях клеток (фиг. 6), тогда как РК в концентрации 1 мкМ индуцировала появление клеток с морфологией типа метамиелоцитов, как уже сообщалось (фиг. 6 и не приведенные данные). Затем анализировали экспрессию 3 поверхностных антигеновCD11b, CD14 и CD15 после 4 дней культивирования в присутствии РК или невирапина (табл. 1). Индукция CD11b связана с дифференцировкой в гранулоциты, CD 14 считается специфическим антигеном моноцитов, a CD15 является антигеном миеломоноцитов. Одновременная индукция CD14 и CD11b относится к дифференцировке моноцитов. При обработке РК возрастал уровень CD11b и CD15, но не CD14 в обеих линиях клеток, что согласуется с индукцией дифференцировки в гранулоциты. В обработанных невирапином клетках NB4 и HL60 наблюдалась сильная индукция экспрессии маркеров CD15 и, в меньшей степени, CD11b и CD14. Таким образом, обработка невирапином индуцирует экспрессию маркеров дифференцировки миеломоноцитов, что согласуется с опытами по морфологии. При обработке невирапином также возрастало число положительных клеток при анализе методом восстановления красителяNBT примерно в 2,0-3,5 раза (табл. 2). Способствующее дифференцировке действие невирапина также анализировали на клетках миелоидной лейкемии, слабо чувствительных к вызванной РК дифференцировке в гранулоциты, таких как линия клеток Kasumi-1, экспрессирующих продукт транслокации t(8; 21) AML1/ETO, и на первичных бластных клетках от двух больных AML. Несмотря на то, что обработка невирапином фактически не вызывала остановки пролиферации, она вызывала хоть и умеренное, но постоянное накопление клеток в фазеG1 клеточного цикла (данные не приводятся). Кроме того, клетки Kasumi-1 и первичные бластные клетки AML в ответ на обработку невирапином запускали дифференцировку, как свидетельствует появление:(i) морфологических изменений, связанных с дифференцировкой в миеломоноциты (фиг. 6), состоящих в конденсации хроматина с первоначальной сегментацией ядер, уменьшении отношения ядро/цитоплазма,уменьшении базофильности цитозоля и появлении околоядерной области Гольджи (отмечены специфические гранулы в случае AML1); (ii) функциональных изменений, засвидетельствованных возрастанием положительной реакции NBT (табл. 2); (iii) изменений в экспрессии маркеров миелоидного иммунофенотипа CD11b, CD 14 и CD 15 (табл. 1 и не приведенные данные). Степень индукции признаков миелоидной дифференцировки в первичных бластных клетках AML была сравнима с таковой у клеток NB4 иHL60. Таблица 1. Цитофлуорометрический анализ поверхностных маркеров в линиях клетокNB4 и HL60 после воздействия в течение 4 дней РК (1 мкМ) или Нев (450 мкМ): средняя интенсивность флуоресценции специфических маркеров.-6 007004 Таблица 2. Влияние РК или Нев на рост и дифференцировку клеток линий NB4, HL60, Kasumi-1 и первичных лейкемических бластных клеток от двух больных AML после воздействия в течение 4 дней Пример 6. Изменения экспрессии регуляторных генов клеточного цикла в обработанных невирапином клетках F9. Для оценки того, отражает ли способность невирапина влиять на рост и дифференцировку изменения в экспрессии специфических генов, из контрольных, обработанных невирапином и РК клеток F9 экстрагировали РНК и подвергали полуколичественному анализу методом ОТ-ПЦР. Исследовали группу генов, кодирующих циклины типа D, ингибиторы роста, модуляторы апоптоза и "служебные" белки. Репрезентативные панели представлены на фиг. 7 А, а количественные результаты - на фиг. 7 В. Наиболее значительные изменения отмечены у гена циклина D1, экспрессия которого уменьшалась в 7 раз, тогда как экспрессия р 16INK4a, кодирующего главного антагониста циклинов типа D, возрастала почти в 8 раз в обработанных невирапином культурах F9 по сравнению с необработанными культурами. Усиление экспрессии также отмечалось у гена p27Kipl, который решающим образом модулирует пролиферацию в ответ на форму и адгезию клеток, гена Rb-2/p130, связанного с выходом из пролиферативного цикла, и гена Всl-2, который может способствовать остановке роста в некоторых типах клеток. Экспрессия гена циклина D3 уменьшалась в ответ на невирапин. Эти изменения специфичны, так как экспрессия "служебных" генов (-актина, GAPDH), а также р 53 не менялась. Пример 7. Инкубация клеточных культур мышей с эфавиренцом: зависимость от дозы. Эмбриональные фибробласты NIH/3T3 и клетки тератокарциномы F9 культивировали в средеDMEM, содержащей 10-20% эмбриональной сыворотки и эфавиренц в двух концентрациях: 10 и 20 мкМ,разведенных из исходного раствора 10 мМ в 100% ДМСО. Клетки засевали при плотности 2-5 х 104 на чашки Петри диаметром 35 мм и через 5-6 ч подвергали воздействию эфавиренца. Отбирали образцы через определенные промежутки времени и подсчитывали клетки в обработанных эфавиренцом культурах и сравнивали с параллельными необработанными культурами. Приведенные на фиг. 8 результаты показывают, что при воздействии эфавиренца (пунктир) снижается скорость пролиферации в обеих клеточных линиях дозозависимым образом по сравнению с необработанными клетками (сплошная линия). Пример 8. Инкубация клеточных культур человека с эфавиренцом: зависимость от времени. Действие эфавиренца также исследовали на клетках аденокарциномы HeLa и остеосаркомы Saos-2 человека. Обе линии клеток культивировали в условиях, описанных выше (пример 6). Для того, чтобы установить, улучшает ли эффективность торможения роста продолжительное воздействие препарата, обе линии клеток обрабатывали эфавиренцом за два последовательных цикла: во время 1-го цикла клетки подвергались постоянному воздействию эфавиренца в течение 5 дней, после чего клетки разбавляли,снова засевали и на следующий день запускали 2-й цикл свежим препаратом. Приведенные на фиг. 9 результаты показывают, что клетки обеих линий, HeLa (панели А) и Saos-2 (панели В), чувствительны к эфавиренцу и проявляют значительное снижение скорости роста клеток. Тормозящее действие зависит от времени, так как в обеих культурах, HeLa и Saos-2, 1-й цикл воздействия (5 дней) вызывал снижение в 1,6 и 1,5 раз, соответственно, тогда как за второй цикл (который продолжался 20 дней со времени начала обработки) получали снижение в 5 и 4 раза.-7 007004 Пример 9. Противораковая активность невирапина in vivo: обработка крыс с гепатомой Morris 3924A. а) Линия крыс и характеристика опухоли Линия крыс: инбредная линия ACI/T (около 180 г). Опухоль: гепатома Morris 3924A - это быстрорастущая опухоль, которая возникает у инбредных крыс ACI/T. Через 3 недели после инокуляции размер опухоли составляет около 10 см 3. Получение раковых клеток: раковые клетки гепатомы получали из животных примерно через 2 недели после инокуляции. Опухоль извлекали из животного хирургическим путем, очищали от соединительных и некротических тканей и нарезали на мелкие кусочки. Затем фрагменты опухоли суспендировали в стерильном физрастворе и инокулировали во внутренний участок одного бедра с помощью шприца на 20 мл с иглой большого размера. Обычно вводили 0,5 мл клеточной суспензии. Прививаемость опухоли составила почти 99%. Процедуры: проводили предварительную обработку 3 крыс невирапином путем ежедневных инъекций (0,2 мл/крысу) раствора невирапина (исходный раствор 180 мг/2 мл ДМСО) в течение 11 дней (18 мг/крысу/день). На 11-й день обработанным крысам и 3 необработанным контрольным крысам инокулировали подкожно клетки гепатомы. Результаты. Через 17 дней после инокуляции у контрольных крыс появились типичные опухоли размером 2-4 см 3, тогда как только у одного из обработанных невирапином животных появился небольшой узелок размером в несколько мм на месте укола. Представленный на фиг. 10 график зависимости от времени показывает, что скорости роста опухолей у контрольных (сплошная линия) и обработанных невирапином (пунктир) крыс различались. На кривой роста в контроле представлены средние значения из 3 животных, тогда как на кривой невирапина представлена скорость роста одного животного из числа обработанных, у которого появилась небольшая опухоль. Опухолевые ткани извлекали хирургическим путем из необработанных и обработанных невирапином крыс и подвергали гистологическому анализу. Из фиг. 11 видно, что в образце из обработанной невирапином крысы (панели Нев) трансформированные зоны заметно уменьшились, а клетки проявляют четкие признаки апоптоза по сравнению с необработанным образцом (панели Контр.). В заключение, предварительная обработка невирапином эффективно противодействует возникновению и росту полученной опытным путем гепатомы у крыс (2/3) с генетической предрасположенностью именно к этой опухоли. Две крысы остались здоровыми после прививки опухоли, тогда как у третьей обнаруживалась небольшая опухоль. При тех же самых условиях у необработанных крыс возникали быстрорастущие опухоли (3/3) и они погибали, как правило, в течение 27 дней. Пример 10. Противораковая активность невирапина in vivo: обработка мышей BALB/C с привитыми асцитными опухолями. Процедура. 10 мышам BALB/C инокулировали внутрибрюшинно (дважды) клетки асцитной опухоли путем инъекции 0,2 мл асцитной жидкости, взятой у животного, которое инокулировали за 8 дней до этого. В тот же день начинали обработку невирапином путем внутрибрюшинной инъекции 1 мг/мышь/день (исходный раствор 10 мг/мл в ДМСО) у 5 из 10 мышей, инокулированных раковыми клетками. Мышей обрабатывали невирапином непрерывно на протяжении 7 дней. Результаты. Через 7-8 дней у всех контрольных животных проявлялось вздутие брюшной полости,содержащее 5-7 мл асцитной жидкости, как установлено после забоя животных. Напротив, три из пяти(3/5) обработанных невирапином животных оставались здоровыми без каких-либо признаков возникновения опухоли; отсутствие опухолей подтвердилось после забоя 2 из этих животных через 15 дней после прививки опухоли и анализа их тел. Оставшееся в живых обработанное животное осталось здоровым навсегда. Стоит отметить, что мыши с привитыми асцитными опухолями живут только 12-14 дней. В заключение, данный эксперимент доказывает, что введение невирапина в то же самое время, что и прививка опухоли навсегда блокирует возникновение асцитной опухоли у 3 из 5 мышей. При тех же условиях опухоли возникали у необработанных крыс (5/5), которые все погибли через 12-14 дней после инокуляции. Пример 11. Противораковая активность эфавиренца in vivo: обработка крыс с гепатомой Morris 3924A. Процедура и результаты. 4 крысам инокулировали клетки гепатомы Morris штамма 3924A. В тот же день у 2 из них начинали обработку эфавиренцом путем инъекции 1 мг/крысу/день. На фиг. 12 представлена скорость роста опухолей у контрольных (сплошная линия) и обработанных эфавиренцом животных(пунктир). Опухоли росли быстро у контрольных крыс, которые обе погибли на 27-й день после инокуляции; напротив, только у одного из двух обработанных животных возникла опухоль заметно меньшего размера, тогда как второе осталось совершенно здоровым. В заключение, данный эксперимент доказывает, что введение эфавиренца, начатое в то же самое время, что и прививка опухоли, эффективно противодействует возникновению и росту гепатомы Morris. Из двух обработанных крыс одна оставалась здоровой несколько недель после прививки опухоли, а у второй возникла заметно меньшая опухоль. При тех же условиях опухоли возникали у необработанных крыс (2/2), которые погибли на 27-й день.-8 007004 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение по меньшей мере одного соединения-ингибитора обратной транскриптазы для получения фармацевтической композиции для противодействия утрате дифференцировки клеток и уменьшения скорости пролиферации клеток при раковых и не раковых патологиях, где вышеуказанное соединение выбрано из класса соединений 5,11-дигидро-6 Н-дипиридо[3,2-b:2',3'-е][1,4]диазепина. 2. Применение по п.1, где соединение способно стимулировать дифференцировку клеток. 3. Применение по п.1, где соединение способно уменьшать скорость пролиферации клеток. 4. Применение по п.1, при котором раковые патологии выбраны из группы лейкемий и твердых опухолей, таких как эпителиальные, мезенхимальные опухоли и опухоли нервной системы, тератокарцинома, фибро- и остеосаркома, рак толстой кишки, рак молочной железы, глиома и гепатома. 5. Применение по меньшей мере одного соединения-ингибитора обратной транскриптазы для получения фармацевтической композиции для противодействия утрате дифференцировки клеток и уменьшения скорости пролиферации клеток при раковых и не раковых патологиях, где вышеуказанное соединение выбрано из числа невирапина, эфавиренца, делавирдина, соответствующих им солей и/или фармацевтически приемлемых производных. 6. Применение по п.5, где соединение способно стимулировать дифференцировку клеток. 7. Применение по п.5, где соединение способно уменьшать скорость пролиферации клеток. 8. Применение по п.5, при котором раковые патологии выбраны из группы лейкемий и твердых опухолей, таких как эпителиальные, мезенхимальные опухоли и опухоли нервной системы, тератокарцинома, фибро- и остеосаркома, рак толстой кишки, рак молочной железы, глиома и гепатома. 9. Применение по пп.1-8, при котором фармацевтические композиции дополнительно включают носители, и/или разбавители, и/или растворители, и/или наполнители для получения композиций для перорального, внутривенного, внутримышечного или подкожного введения. 10. Применение по пп.1-9, при котором фармацевтические композиции имеют вид пилюль, суспензий или растворов. 11. Применение 5,11-дигидро-6 Н-дипиридо[3,2-b:2',3'-е][1,4]диазепинов для получения фармацевтических композиций, обладающих антипролиферативной активностью и активностью, индуцирующей дифференцировку клеток. 12. Применение по меньшей мере одного соединения, выбранного из числа невирапина, эфавиренца, делавирдина, соответствующих им солей и/или фармацевтически приемлемых производных, для получения фармацевтических композиций, обладающих антипролиферативной активностью и активностью, индуцирующей дифференцировку клеток.
МПК / Метки
МПК: A61K 31/495, A61K 31/55, A61K 31/535
Метки: ингибиторы, дифференцировки, обратной, индукторы, пролиферации, ненуклеозидные, транскриптазы, клеток, антагонисты
Код ссылки
<a href="https://eas.patents.su/14-7004-nenukleozidnye-ingibitory-obratnojj-transkriptazy-kak-antagonisty-proliferacii-i-induktory-differencirovki-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Ненуклеозидные ингибиторы обратной транскриптазы как антагонисты пролиферации и индукторы дифференцировки клеток</a>
Предыдущий патент: Способ выявления риска развития у субъекта заболевания, связанного с кислотой
Следующий патент: Антитела против tnf, композиции, способы и применения
Случайный патент: Новые производные триазиндиона в качестве модуляторов рецептора гамкв