Антитела против tnf, композиции, способы и применения
Номер патента: 7005
Опубликовано: 30.06.2006
Авторы: Шили Дэвид, Хивнер Джордж, Скаллон Бернард, Найт Дэвид М., Джайлс-Комар Джилл
Формула / Реферат
1. По меньшей мере одно выделенное антитело млекопитающего против TNF, содержащее по меньшей мере одну вариабельную область, содержащую SEQ ID NO: 7 или 8.
2. Выделенная нуклеиновая кислота, кодирующая по меньшей мере одно выделенное антитело млекопитающего против TNF, содержащее по меньшей мере одну вариабельную область, содержащую SEQ ID NO: 7 или 8.
3. Прокариотическая или эукариотическая клетка-хозяин, содержащая выделенную нуклеиновую кислоту по п.2.
4. Композиция, содержащая по меньшей мере одно выделенное антитело млекопитающего против TNF, имеющее по меньшей мере одну вариабельную область, содержащую SEQ ID NO: 7 или 8, и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
5. Способ лечения связанного с TNF состояния у человека, предусматривающий введение ингибирующего TNF количества фармацевтически приемлемой композиции, содержащей антитело по п.1 в количестве, эффективном для лечения указанного связанного с TNF состояния, где указанное связанное с TNF состояние выбрано из группы, состоящей из ревматоидного артрита, болезни Крона, псориатического артрита, псориаза, анкилозирующего спондилита, кахексии, воспаления сустава, карциномы, гепатита С, язвенного колита, воспалительного заболевания кишечника, астмы, хронической обструктивной болезни легких, эндометриоза и язв.
6. По меньшей мере одно выделенное антитело млекопитающего против TNF, содержащее или (i) все аминокислотные последовательности гипервариабельных участков (CDR) тяжелых цепей из SEQ ID NO: 1, 2 и 3; или (ii) все аминокислотные последовательности CDR легких цепей из SEQ ID NO: 4, 5 и 6.
7. Выделенная нуклеиновая кислота, кодирующая по меньшей мере одно выделенное антитело млекопитающего против TNF, содержащее, или (i) все аминокислотные последовательности CDR тяжелых цепей из SEQ ID NO: 1, 2 и 3; или (ii) все аминокислотные последовательности CDR легких цепей из SEQ ID NO: 4, 5 и 6.
8. Прокариотическая или эукариотическая клетка-хозяин, содержащая выделенную нуклеиновую кислоту по п.7.
9. Композиция, содержащая по меньшей мере одно выделенное антитело млекопитающего против TNF, имеющее или (i) все аминокислотные последовательности CDR тяжелых цепей из SEQ ID NO: 1, 2 и 3; или (ii) все аминокислотные последовательности CDR легких цепей из SEQ ID NO: 4, 5 и 6, и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
10. Способ лечения связанного с TNF состояния у человека, предусматривающий введение ингибирующего TNF количества фармацевтически приемлемой композиции, содержащей антитело по п.6 в количестве, эффективном для лечения указанного связанного с TNF состояния, где указанное связанное с TNF состояние выбрано из группы, состоящей из ревматоидного артрита, болезни Крона, псориатического артрита, псориаза, анкилозирующего спондилита, кахексии, воспаления сустава, карциномы, гепатита С, язвенного колита, воспалительного заболевания кишечника, астмы, хронической обструктивной болезни легких, эндометриоза и язв.
11. По меньшей мере одно выделенное антитело млекопитающего против TNF, содержащее по меньшей мере один CDR тяжелой или легкой цепи с аминокислотной последовательностью по меньшей мере одной из SEQ ID NO: 1, 2, 3, 4, 5 или 6.
12. Выделенная нуклеиновая кислота, кодирующая по меньшей мере одно выделенное антитело млекопитающего против TNF, содержащее по меньшей мере один CDR тяжелой или легкой цепи с аминокислотной последовательностью по меньшей мере одной из SEQ ID NO: 1, 2, 3, 4, 5 или 6.
13. Прокариотическая или эукариотическая клетка-хозяин, содержащая выделенную нуклеиновую кислоту по п.12.
14. Композиция, содержащая по меньшей мере одно выделенное антитело млекопитающего против TNF, имеющее по меньшей мере один CDR тяжелой или легкой цепи с аминокислотной последовательностью по меньшей мере одной из SEQ ID NO: 1, 2, 3, 4, 5 или 6, и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
15. Способ лечения связанного с TNF состояния у человека, предусматривающий введение ингибирующего TNF количества фармацевтически приемлемой композиции, содержащей антитело по п.11 в количестве, эффективном для лечения указанного связанного с TNF состояния, где указанное связанное с TNF состояние выбрано из группы, состоящей из ревматоидного артрита, болезни Крона, псориатического артрита, псориаза, анкилозирующего спондилита, кахексии, воспаления сустава, карциномы, гепатита С, язвенного колита, воспалительного заболевания кишечника, астмы, хронической обструктивной болезни легких, эндометриоза и язв.
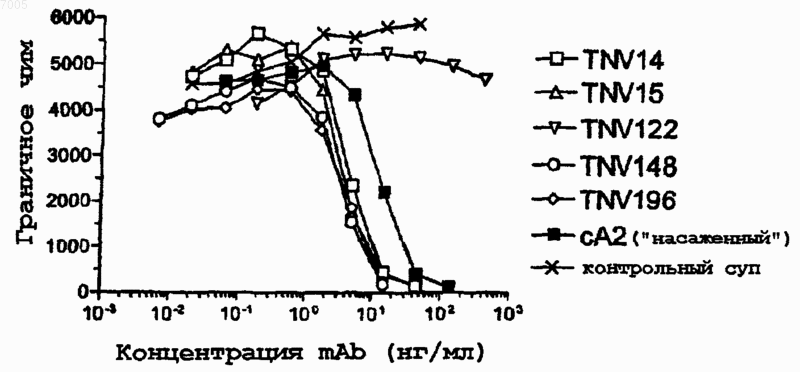
Текст
007005 Предпосылки создания изобретения Область техники, к которой относится изобретение Данное изобретение частично основывается и притязает на приоритет предварительных заявок на патент США 60/223360, поданной 7 августа 2000 г., и 60/236826, поданной 29 сентября 2000 г., включенных в данное описание в качестве ссылок. Настоящее изобретение относится к антителам, включая определенные части или варианты, специфичные для по меньшей мере одного белка фактора некроза опухоли альфа (TNF) или его фрагмента, а также нуклеиновой кислоте, кодирующей такие антитела против TNF, комплементарным нуклеиновым кислотам, векторам, клеткам-хозяевам и способам их получения и применения, включая лекарственные композиции, введение и устройства. Уровень техникиTNF-альфа представляет собой растворимый гомотример субъединиц белка массой 17 кД (Smith etal., J. Biol. Chem., 262:6951-6954 (1987. Также существует мембраносвязанная форма предшественникаTNF массой 26 кД (Kriegler et al., Cell, 53:45-53 (1988. Для общего представления о TNF см. Beutler etal., Nature 320:584 (1986); Old, Science, 230:630 (1986; и Le et al., Lab. Invest., 56:234 (1987). Другие клетки, кроме моноцитов или макрофагов, также продуцируют TNF-альфа. Например, TNFальфа продуцируют человеческие немоноцитарные клеточные линии опухоли (Rubin et al., J. Exp. Med.,164:1350 (1986); Spriggs et al., Proc. Natl. Acad. Sci. USA, 84:6563 (1987. Т-Лимфоциты периферической крови CD4+ и CD8+ и некоторые культивированные линии Т- и В-клеток (Cuturi et al., J. Exp. Med.,165:1581 (1987); Sung et al., J. Exp. Med., 168:1539 (1988); Turner et al., Eur. J. Immunol., 17:1807-1814TNF-альфа оказывает провоспалительное действие, приводящее к повреждению тканей, такое как разрушение хрящей и костей (Saklatvala, Nature, 322:547-549 (1986); Bertolini, Nature, 319:516-518 (1986,индукции фактора адгезии, индукции прокоагулянтной активности на эндотелиальных клетках сосудов(Pober et al., J. Immunol., 136:1680 (1986, усилению прилипания нейтрофилов и лимфоцитов (Pober et al.,J. Immunol., 138:3319 (1987, стимуляции высвобождения фактора активации тромбоцитов из макрофагов, нейтрофилов и эндотелиальных клеток сосудов (Camussi et al., J. Exp. Med., 166:1390 (1987. Последние факты связывают TNF-альфа с инфекционными заболеваниями (Cerami et al., Immunol.Today, 9:28 (1988, иммунными нарушениями, новообразованиями (Oliff et al., Cell, 50:555 (1987, аутоиммунными нарушениями и реакцией трансплатата против хозяина (Piguet et al., J. Exp. Med., 166:1280(1987. Связь TNF-альфа со злокачественными и инфекционными заболеваниями часто относят к катаболическому состоянию хозяина. Больные злокачественными опухолями страдают от потери веса, как правило, связанной с анорексией. Сильное истощение, связанное со злокачественными опухолями и другими болезнями, известно как"кахексия" (Kern et al., J. Parent. Enter. Nutr., 12:286-298 (1988. Кахексия включает прогрессирующую потерю массы, анорексию и стойкую потерю недостаточной массы тела в ответ на рост злокачественной опухоли. Кахектическое состояние вызывает наибольшую болезненность и смертность при злокачественной опухоли. Имеются доказательства, что TNF-альфа участвует в развитии кахексии при злокачественной опухоли, инфекционных заболеваниях и других каболических состояниях (см., например, Beutlerand Cerami, Ann. Rev. Immunol., 7:625-655 (1989. Полагают, что TNF-альфа играет центральную роль в грамотрицательном сепсисе и эндотоксическом шоке (Michie et al., Br. J. Surg., 76:670-671 (1989); Debets et al., Second Vienna Shock Forum, p.463466 (1989); Simpson et al., Crit. Care Clin., 5:27-47 (1989, включая лихорадку, недомогание, анорексию и кахексию. Эндотоксин сильно активирует продуцирование моноцитов/макрофагов и секрецию TNFальфа и других цитокинов (Kornbluth et al., J. Immunol., 137:2585-2591 (1986. TNF-альфа и другие цитокины, образованные моноцитами, опосредуют метаболические и нейрогуморальные реакции на эндотоксин (Michie et al., New Engl. J. Med., 318:1481-1486 (1988. Введение эндотоксина добровольцам вызывает острое заболевание с симптомами, напоминающими грипп, включая лихорадку, тахикардию, ускоренный метаболизм и выделение гормонов стресса (Revhaug et al., Arch. Surg., 123:162-170 (1988. У пациентов, страдающих от грамотрицательного сепсиса, увеличивается уровень TNF-альфа в кровотоке(Waage et al., Lancet, 1:355-357 (1987); Hammerle et al., Second Vienna Shock Forum, p.715-718 (1989); Debets et al., Crit. Care Med., 17:489-497 (1989); Calandra et al., J. Infect. Dis., 161:982-987 (1990. Таким образом, TNF-альфа вовлекается в воспалительные заболевания, аутоиммунные заболевания,вирусные, бактериальные и паразитарные инфекции, злокачественные опухоли и/или нейрогенеративные заболевания и является удобной мишенью для специфического биологического лечения при таких заболеваниях, как ревматоидный артрит и болезнь Крона. Сообщается о благоприятном действии при испытаниях с открытой меткой с химерными моноклональными антителами против TNF-альфа (сА 2) с подавлением воспаления и успешным повторным лечением после рецидива при ревматоидном артрите (Elliottet al., Arthritis Rheum., 36:1681-1690 (1983); и Elliott et al., Lancet, 344:1125-1127 (1994 и при болезни Крона (Van Dullemen et al., Gastroenterology, 109:129-135 (1995. Также сообщается о благоприятных результатах при случайном двойном слепом плацебо-контролируемом испытании сА 2 при ревматоидном артрите с подавлением воспаления (Elliott et al., Lancet, 344:1105-1110 (1994. Антитела к веществу-1 007005"модулятору", который характеризуется как кахектин (обнаружено, что последний идентичен TNF), описаны Cerami et al. (публикация патента ЕРО 0212489, 4 марта 1987 г.). Такие антитела указаны как применимые при диагностических иммуноанализах и лечении шока при бактериальных инфекциях. Rubin etal. (публикация патента ЕРО 0218868, 22 апреля 1987 г.) описывают моноклональные антитела противTNF человека, гибридомы, секретирующие такие антитела, способы получения таких антител и применение таких антител при иммуноанализе TNF. Yone et al. (публикация патента ЕРО 0288088, 26 октября 1988 г.) описывают антитела против TNF, в том числе mAb, и их применимость для диагностики заболеваний методом иммуноанализа, в частности, болезни Кавасаки и бактериальной инфекции. Сообщается,что жидкости организма больных болезнью Кавасаки (острый лихорадочный синдром кожно-слизистых лимфоузлов у детей: Kawasaki Т., Allergy, 16:178 (1967); Kawasaki Т., Shonica (Pediatrics), 26:935 (1985 содержат повышенные концентрации TNF, связанные с развитием патологии (Yone et al., см. выше). Другие исследователи описывают mAb, специфические для рекомбинатного TNF человека, с нейтрализующей активностью in vitro (Liang, C-M. et al., Biochem. Biophys. Res. Comm., 137:847-854 (1986);al., Hybridoma, 6:489-507 (1987); Hirai M. et al., J. Immunol. Meth., 96:57-62 (1987); Moller A. et al., Cytokine, 2:162-169 (1990. Некоторые из таких mAb использовали для картирования эпитопов TNF человека и разработки иммуноферментных анализов (Fendly et al., см. выше; Hirai et al., см. выше; Moller et al., см. выше) и для обеспечения очистки рекомбинантного TNF (Bringman et al., см. выше). Однако указанные исследования не обеспечивают основу для получения антител, нейтрализующих TNF, которые можно использовать при диагностике in vivo или лечении людей, из-за иммуногенности, отсутствия специфичности и/или фармацевтической пригодности. Показано, что нейтрализующие антисыворотки или mAb против TNF у других млекопитающих, отличных от человека, отменяют вредные физиологические изменения и предупреждают гибель после летального заражения при экспериментальной эндотоксемии и бактериемии. Такое действие показано, например, при анализах летальности грызунов и на модельных системах болезни приматов (Mathison J.C. etShock, 30:279-292 (1990. Предполагаемые локусы связывания рецепторов hTNF описываются Eck and Sprang, J. Biol. Chem.,264(29), 17595-17605 (1989), которые идентифицировали локусы связывания TNF-a как состоящие из аминокислот 11-13, 37-42, 49-57 и 155-157. В заявке РСТ W091/02078 (дата приоритета 7 августа 1989 г.) описываются лиганды TNF, которые могут связываться с моноклональными антителами, имеющими следующие эпитопы: по меньшей мере один из 1-20, 56-77 и 108-127; по меньшей мере два из 1-20, 5677, 108-127 и 138-149; все из 1-18, 58-65, 115-125 и 138-149; все из 1-18 и 108-128; все из 56-79, 110-127 и 135- или 136-155; все из 1-30, 117-128 и 141-153; все из 1-26, 117-128 и 141-153; все из 22-40, 49-96 или 97, 110-127 и 136-153; все из 12-22, 36-45, 96-105 и 132-157; все как из 1-20, так и из 76-90; все из 22-40,69-97, 105-128 и 135-155; все из 22-31 и 146-157; все из 22-40 и 49-98; по меньшей мере один из 22-40,49-98 и 69-97, оба из 22-40 и 70-87. Антитела млекопитающих, отличных от человека, химерные, поликлональные (например, антисыворотки) и/или моноклональные антитела (Mab) и фрагменты (например, продукты их протеолитического расщепления или их слитые белки) являются потенциальными лекарственными средствами, которые в ряде случаев исследуются с целью попытки лечения некоторых заболеваний. Однако такие антитела или фрагменты при введении людям могут дать иммунную реакцию. Такая иммунная реакция может привести к опосредуемому иммунным комплексом клиренсу антител или их фрагментов из кровообращения и сделать повторное введение неподходящим для лечения, что снижает лечебную пользу для пациента и ограничивается повторное введение антител или фрагментов. Например, повторное введение антител или фрагментов, содержащих части, не происходящие от человека, может привести к сывороточной болезни и/или анафилаксии. Для того, чтобы избежать указанных и других проблем, использован ряд подходов для снижения иммуногенности таких антител и их частей, включая химеризацию и гуманизацию,хорошо известные из уровня техники. Однако такие и другие подходы все еще могут привести к образованию антител или фрагментов с некоторой иммуногенностью, низкой аффинностью, низкой авидностью или к проблемам с культурами клеток, масштабированием, получением и/или низким выходом. Таким образом, такие антитела или фрагменты могут оказаться не идеально подходящими для получения или применения в качестве лекарственных белков. Соответственно, существует потребность в создании антител против TNF или фрагментов, преодолевающих большинство указанных проблем, а также превосходящих известные антитела или их фрагменты. Сущность изобретения Настоящее изобретение относится к выделенным антителам человека, приматов, грызунов, млекопитающих, химерным, гуманизированным и/или CDR-слитым антителам против TNF, иммуноглобулинам, продуктам их расщепления и другим их специфическим частям и вариантам, а также к композициям-2 007005 с антителами против TNF, кодирующим или комплементарным нуклеиновым кислотам, векторам, клеткам-хозяевам, композициям, составам, устройствам, трансгенным животным, трансгенным растениям и способам их получения и применения, описанным в данном описании, в сочетании с известным в технике. Настоящее изобретение также относится по меньшей мере к одному выделенному антителу противTNF, описанному в данном описании. Антитело согласно настоящему изобретению включает любой белок или пептид, содержащий молекулу, содержащую по меньшей мере один гипервариабельный участок(CDR) тяжелой цепи, или легкой цепи, или его лигандсвязывающую часть, вариабельную область тяжелой цепи, или легкой цепи, константную область тяжелой цепи или легкой цепи, каркасный участок, или любую его часть, которые можно включить в антитело настоящего изобретения. Антитело изобретения может включать антитело или может происходить от любого млекопитающего, такого как человек,мышь, кролик, крыса, грызун, примат или другое млекопитающее, или любое их сочетание, и т.п. Настоящее изобретение относится, в одном аспекте, к выделенным молекулам нуклеиновых кислот,включающим, комплементарным или гибридизующимся с полинуклеотидом, кодирующим специфические антитела против TNF, содержащим по меньшей мере одну его специфическую последовательность,домен, часть или вариант. Настоящее изобретение также относится к рекомбинантным векторам, содержащим указанные молекулы нуклеиновых кислот антител против TNF, клеткам-хозяевам, содержащим такие нуклеиновые кислоты и/или рекомбинантные векторы, а также к способам получения и/или применения таких нуклеиновых кислот антител, векторов и/или клеток-хозяев. По меньшей мере одно антитело изобретения связывается по меньшей мере с одним специфическим эпитопом, специфическим по меньшей мере к одному белку TNF, субъединице, фрагменту, части или любой их комбинации. По меньшей мере один эпитоп может содержать по меньшей мере один связывающийся с антителом участок, который содержит по меньшей мере одну часть указанного белка, и указанный эпитоп, предпочтительно, состоит из по меньшей мере 1-5 аминокислот из по меньшей мере одной его части, такой как по меньшей мере один функциональный, внеклеточный, растворимый, гидрофильный, внешний или цитоплазматический домен, указанного белка или любой его части. По меньшей мере одно антитело может, необязательно, содержать по меньшей мере одну специфическую часть по меньшей мере одного гипервариабельного участка (CDR) (например, CDR1, CDR2 илиCDR3 вариабельной области тяжелой или легкой цепи) и/или по меньшей мере одну константную или вариабельную область каркасного участка или любую его часть. По меньшей мере одна аминокислотная последовательность антитела также может, необязательно, содержать по меньшей мере одну специфическую замену, вставку или делецию, описанные в данном описании или известные в технике. Настоящее изобретение также относится по меньшей мере к одному выделенному антителу противTNF, описанному в данном описании, где антитело обладает по меньшей мере одной активностью, такой как, но не ограничиваясь этим, ингибирование индуцированных TNF факторов адгезии клетки, ингибирование связывания TNF с рецептором, улучшенным артритным индексом на мышиной модели (см., например, примеры 3-7). Антитело против TNF можно, таким образом, скринировать на соответствующую активность известными методами, такую как биологическая активность в отношении белка TNF и другую активность. Настоящее изобретение также относится по меньшей мере к одному антиидиотипическому антителу против TNF по меньшей мере к одному антителу против TNF настоящего изобретения. Антиидиотипическое антитело включает любой белок или пептид, содержащий молекулу, содержащую по меньшей мере часть молекулы иммуноглобулина, например, но не ограничиваясь этим, по меньшей мере один гипервариабельный участок (CDR) тяжелой или легкой цепи иммуноглобулина или его лигандсвязывающую часть, вариабельную область тяжелой или легкой цепи, константную область тяжелой или легкой цепи, каркасный участок, или любую его часть, которые можно ввести в антитело настоящего изобретения. Антитело изобретения может содержаться в или происходить от любого млекопитающего, такого как человек, мышь, кролик, грызун, примат или другое млекопитающее. Настоящее изобретение относится, в одном аспекте, к выделенным молекулам нуклеиновых кислот,содержащих, комплементарных или гибридизующихся с полинуклеотидом, кодирующим по меньшей мере одно антиидиотипическое антитело против TNF, содержащим по меньшей мере одну специфическую его последовательность, домен, часть или вариант. Настоящее изобретение также относится к рекомбинантным векторам, содержащим указанные молекулы нуклеиновых кислот, кодирующих антиидиотипическое антитело против TNF, клеткам-хозяевам, содержащим такие нуклеиновые кислоты и/или рекомбинантные векторы, а также к способам получения и/или применения таких нуклеиновых кислот антиидиотипических антител, векторов и/или клеток-хозяев. Настоящее изобретение также относится по меньшей мере к одному способу экспрессии по меньшей мере одного антитела против TNF, или антиидиотипического антитела против TNF в клеткехозяине, включающему культивирование клеток-хозяев, как описывается в данном описании, в условиях,где по меньшей мере одно антитело против TNF экспрессируется в количествах, которые можно обнаружить и/или извлечь.-3 007005 Настоящее изобретение также относится по меньшей мере к одной композиции, содержащей (а) выделенную нуклеиновую кислоту, кодирующую антитело против TNF, и/или антитела, описанные в данном описании, и (b) подходящий носитель или разбавитель. Композиция также может содержать, необязательно, по меньшей мере одно другое соединение, белок или композицию. Настоящее изобретение также относится по меньшей мере к одному способу введения терапевтически эффективного количества антител против TNF или композиции для модуляции или лечения по меньшей мере одного связанного с TNF состояния в клетке, ткани, органе, у животного или пациента,и/или введения до, после или во время такого состояния, как известно в технике и/или описано в данном описании. Настоящее изобретение также относится по меньшей мере к одной композиции, устройству и/или способу доставки терапевтически или профилактически эффективного количества по меньшей мере одного антитела против TNF по настоящему изобретению. Настоящее изобретение также относится по меньшей мере к одному способу или композиции с антителами против TNF для диагностики по меньшей мере одного связанного с TNF состояния в клетке,ткани, органе, у животного или пациента, и/или диагностики до, после или во время такого состояния,как известно в технике и/или описано в данном описании. Настоящее изобретение также относится по меньшей мере к одной композиции, устройству и/или способу доставки с целью диагностики по меньшей мере одного антитела против TNF по настоящему изобретению. Описание фигур Фиг. 1 дает графическое представление, отражающее анализ способности mAb TNV в супернатантах клеток гибридом ингибировать связывание TNF с рецептором рекомбинантного TNF. Различные количества супернатантаов клеток гибридом, содержащих известные количества mAb TNV, предварительно инкубируют с фиксированной концентрацией (5 нг/мл) 125I-меченного TNF. Смесь переносят в 96-луночные планшеты Optiplates, предварительно сенсибилизированные p55-sf2 - слитым белком рецептор рекомбинантного TNF/IgG. Количество TNF, связанного с рецептором р 55 в присутствии mAb,определяют после вымывания несвязанного вещества и подсчета с использованием счетчика гаммаквантов. Хотя в данных экспериментах проверяли восемь образцов mAb TNV, для простоты три mAb,идентичных, как показал анализ последовательности ДНК, одному из других mAb TNV (см. раздел 5.2.2), на фигуре не указаны. Каждый образец испытывают дважды. Приведенные результаты являются характерными результатами двух независимых экспериментов. Фиг. 2 показывает последовательности ДНК вариабельных областей тяжелой цепи mAb TNV. Показанный ген зародышевой линии является геном DP-46. "TNV" показывает, что приведенная последовательность является последовательностью TNV14, TNV15, TNV148 и TNV196. Первые три нуклеотида в последовательности TNV определяют кодон инициации трансляции Met. Точки в последовательностях гена mAb TNV показывают, что нуклеотид тот же, что и в последовательности зародышевой линии. Первые 19 нуклеотидов (подчеркнуты) последовательностей TNV соответствуют олигонуклеотиду, используемому для амплификации вариабельной области методом ПЦР (PCR). Начало трансляции аминокислоты (однобуквенная аббревиатура) со зрелого mAb показана только для гена зародышевой линии. Три домена CDR в трансляции аминокислоты зародышевой линии отмечены жирным шрифтом и подчеркнуты. Линии, отмеченные TNV148(В), показывают, что приведенная последовательность имеет отношение как к TNV148, так и к TNV148 В. "Бреши" в последовательности ДНК зародышевой линии (CDR3) имеют место из-за того, что последовательность неизвестна или не существует в гене зародышевой линии. Тяжелые цепи mAb TNV используют соединяющий участок J6. Фиг. 3 показывает последовательности ДНК вариабельных областей легких цепей mAb TNV. Показанный ген зародышевой линии является характерным членом семейства человеческих генов Vg/38K с вариабельной областью каппа зародышевой линии. Точки в последовательностях гена mAb TNV показывают, что нуклеотид тот же, что и в последовательности зародышевой линии. Первые 16 нуклеотидов(подчеркнуты) последовательностей TNV соответствуют олигонуклеотиду, используемому для ПЦРамплификации вариабельной области. Начало трансляции аминокислоты зрелого mAb (однобуквенная аббревиатура) показана только для гена зародышевой линии. Три домена CDR в трансляции аминокислоты зародышевой линии отмечены жирным шрифтом и подчеркнуты. Линии, отмеченные TNV148(В),показывают, что приведенная последовательность имеет отношение как к TNV148, так и к TNV148B."Бреши" в последовательности ДНК зародышевой линии (CDR3) имеют место из-за того, что последовательность неизвестна или отсутствуют в гене зародышевой линии. Легкие цепи mAb TNV используют соединяющий участок J3. Фиг. 4 показывает расшифрованные аминокислотные последовательности вариабельных областей тяжелой цепи mAb TNV. Приведенные аминокислотные последовательности (однобуквенная аббревиатура) расшифрованы из последовательности ДНК, определенной как из неклонированных продуктов ПЦР, так и из клонированных продуктов ПЦР. Аминокислотные последовательности показаны по частям в доменах выделенной сигнальной последовательности (сигнал), каркасном участке (FW) и гипервариа-4 007005 бельном участке (CDR). Аминокислотная последовательность для гена зародышевой линии DP-46 приводится на верхней линии для каждого домена. Точки показывают, что аминокислотная последовательность mAb TNV идентична гену зародышевой линии. TNV148(В) показывает, что приведенная последовательность имеет отношение как к TNV148, так и к TNV148B. "TNVs" показывает, что приведенная последовательность имеет отношение ко всем mAb, если не приводится другая последовательность. Штрихи в последовательности зародышевой линии (CDR3) показывают, что последовательности неизвестны или не существуют в гене зародышевой линии. Фиг. 5 показывает расшифрованные аминокислотные последовательности вариабельных областей легкой цепи mAb TNV. Приведенные аминокислотные последовательности (однобуквенная аббревиатура) расшифрованы из последовательности ДНК, определенной как из неклонированных продуктов ПЦР,так и из клонированных продуктов ПЦР. Аминокислотные последовательности показаны по частям в доменах выделенной сигнальной последовательности (сигнал), каркасном участке (FW) и гипервариабельном участке (CDR). Аминокислотная последовательность для гена с легкой цепью типа Vg/38K приводится на верхней линии для каждого домена. Точки показывают, что аминокислота в mAb TNV идентична гену зародышевой линии. TNV148(В) показывает, что приведенная последовательность имеет отношение как к TNV148, так и к TNV148B. "Все" показывает, что приведенная последовательность имеет отношение к TNV14, TNV15, TNV148, TNV148B и TNV186. Фиг. 6 показывает схематические пояснения к экспрессирующим плазмидам тяжелой и легкой цепи, используемым для получения клеток С 466, экспрессирующих rTNV148B. pl783 является плазмидой тяжелой цепи и р 1776 является плазмидой легкой цепи. Кодирующие домены вариабельной и константной областей rTNV148B показаны черными участками. Иммуноглобулиновые энхансеры в интронах J-C показаны серыми участками. Приводятся соответствующие сайты рестрикции. Плазмиды показаны ориентированными таким образом, что транскрипция генов Аb происходит в направлении по часовой стрелке. Плазмида p1783 имеет длину 19,53 т.п.н. и плазмида р 1776 имеет длину 15,06 т.п.н. Полные нуклеотидные последовательности обеих плазмид известны. Кодирующую последовательность вариабельной области в pl783 можно легко заменить другой последовательностью вариабельной области тяжелой цепи посредством замены рестрикционного фрагмента BsiWI/BstBI. Кодирующую последовательность вариабельной области в р 1776 можно заменить другой последовательностью вариабельной области посредством замены рестрикционного фрагмента SalI/AflII. Фиг. 7 дает графическое представление об анализе кривой роста пяти клеточных линий, продуцирующих rTNV148B. Культуры инициируют в день 0, высевая клетки в колбы Т 75 в среды I5Q+MHX, и получают плотность жизнеспособных клеток 1,0 х 105 клеток/мл в объеме 30 мл. Клеточные культуры,используемые для данных исследований, культивируют непрерывно, так как осуществляют трансфекции и субклонирование. В последующие дни клетки в Т-колбах тщательно ресуспендируют и извлекают аликвоты культуры в 0,3 мл. Исследования кривой роста заканчивают, когда число клеток падает ниже 1,5 х 105 клеток/мл. Число живых клеток в аликвоте определяют путем исключения трипанового синего, и оставшуюся аликвоту хранят для последнего определения концентрации mAb. На всех аликвотах образцов одновременно осуществляют ELISA на человеческий IgG. Фиг. 8 показывает графическое сравнение скоростей роста клеток в присутствии различных концентраций МНХ для отбора. Субклоны клеток С 466 А и С 466 В распускают в свободных от МНХ средах(IMDM, 5% FBS, 2 мМ глутамина) и культивируют еще в течение двух суток. Затем обе клеточные культуры делят на три культуры, которые или не содержат МНХ, или содержат 0,2 Х МНХ или 1X МНХ. На другой день культуры высевают в свежие колбы Т 75 в исходной плотности 1 х 105 клеток/мл, и клетки подсчитывают с интервалом в 24 ч в течение одной недели. Время удвоения в течение первых 5 суток вычисляют с использованием формулы в SOP PD32.025 и показывают в виде столбцов. Фиг. 9 дает графическое представление о стабильности продуцирования mAb со временем в двух клеточных линиях, продуцирующих rTNV148B. Субклоны клеток, культивируемых непрерывно с тех пор, как осуществляют трансфекции и субклонирование, используют для начала длительного культивирования в 24-луночных культуральных планшетах. Клетки культивируют в средах I5Q с или без МНХ для отбора. Клетки непрерывно пересевают путем расщепления культур каждые 4-6 дней и сохранения новых жизнеспособных культур, в то время как прежние культуры истощаются. Аликвоты супернатанта отработанных клеток собирают сразу после истощения культур и хранят до определения концентрацийmAb. На всех аликвотах образцов одновременно осуществляют ELISA на человеческий IgG. Фиг. 10 показывает изменение массы на мышиной модели артрита Tg 197 в ответ на антитела против TNF настоящего изобретения по сравнению с контрольными антителами в примере 4. Для исследования на Tg 197 мышей в возрасте приблизительно 4 недель, основываясь на виде и массе тела, отбирают в одну из 9 обрабатываемых групп и обрабатывают однократным интраперитонеальным болюсом - в 1 мг/кг или 10 мг/кг - PBS Дульбекко (D-PBS) или антителами против TNF настоящего изобретения(TNV14, TNV148 или TNV196). Когда массы анализируют как изменение по сравнению с массой до введения, животные, обработанные 10 мг/кг сА 2, на протяжении всего исследования последовательно показывают более высокое прибавление массы, чем животные, обработанные D-PBS. Такое прибавление мас-5 007005 сы существенно в недели 3-7. Животные, обработанные 10 мг/кг TNV148, также достигают существенного прибавления массы на неделе 7 исследования. Фиг. 11, А-С, представляют развитие тяжести заболевания на основании артритного индекса, как представлено в примере 4. Артритный индекс группы, обработанной 10 мг/кг сА 2, ниже, чем у контрольной группы с D-PBS, начиная с недели 3 и на протяжении остальной части исследования (неделя 7). Животным, обработанным 1 мг/кг TNV14, и животным, обработанным 1 мг/кг сА 2, после 3 недели не удается показать значительное снижение AI по сравнению с группой, обработанной D-PBS. Нет существенного различия между группами, обработанными 10 мг/кг, при сравнении групп с подобными дозами друг с другом (10 мг/кг сА 2 по сравнению с 10 мг/кг TNV14, 148 и 196). Когда сравнивают группы, обработанные 1 мг/кг, группа, обработанная 1 мг/кг TNV148, показывает существенно более низкий AI, чем обработанная 1 мг/кг сА 2, на 3, 4 и 7 неделях. Обработка 1 мг/кг TNV148 также дает существенно более низкий AI, чем в группах, обработанных 1 мг/кг TNV14, на 3 и 4 неделях. Хотя TNV196 показывает существенное снижение AI до 6 недели исследования (при сравнении с группой, обработанной D-PBS),значимой в заключение исследования признана только обработка 1 мг/кг TNV148. Фиг. 12 показывает изменение массы на мышиной модели артрита Tg 197 в ответ на антитела против TNF настоящего изобретения по сравнению с контрольными антителами в примере 5. Для исследования на Tg 197 мышей в возрасте приблизительно 4 недель, основываясь на виде и массе тела, отбирают в одну из 8 обрабатываемых групп и обрабатывают интраперитонеальным болюсом контрольного вещества (D-PBS) или антителами (TNV14, TNV148) в 3 мг/кг (неделя 0). Инъекции повторяют всем животным в недели 1, 2, 3 и 4. Группы 1-6 оценивают на эффективность испытываемого вещества. Образцы сывороток, полученные от животных групп 7 и 8, оценивают на индукцию иммунной реакции и фармакокинетический клиренс TNV14 или TNV148 в недели 2, 3 и 4. Фиг. 13, А-С, являются графиками, представляющими развитие тяжести заболевания в примере 5 на основании артритного индекса. Артритный индекс группы, обработанной 10 мг/кг сА 2, значительно ниже, чем у контрольной группы с D-PBS, начиная с недели 2 и на протяжении остальной части исследования (неделя 5). Животным, обработанным 1 мг/кг или 3 мг/кг сА 2, и животным, обработанным 3 мг/кг сА 2 TNV14, не удается достичь значительного снижения AI в любое время исследования по сравнению с контрольной группой, обработанной D-PBS. Животные, обработанные 3 мг/кг TNV148, показывают значительное снижение при сравнении с группой, обработанной D-PBS, на недели 3 и далее до недели 5. Животные, обработанные 10 мг/кг сА 2, показывают значительное снижение AI при сравнении с обеими более низкими дозами (1 мг/кг и 3 мг/кг) сА 2 в недели 4 и 5 исследования, а также существенно более низкий AI, чем у животных, обработанных TNV14, в недели 3-5. Хотя существенных различий между любыми группами, обработанными 3 мг/кг, не выявлено, AI для животных, обработанных 3 мг/кгTNV14, в некоторые моменты времени существенно выше, чем при обработке 10 мг/кг, в то время как животные, обработанные TNV148, существенно не отличались от животных, обработанных 10 мг/кг сА 2. Фиг. 14 показывает изменение массы на мышиной модели артрита Tg 197 в ответ на антитела против TNF настоящего изобретения по сравнению с контрольными антителами в примере 6. Для исследования на Tg 197 мышей в возрасте приблизительно 4 недель, основываясь на виде и массе тела, отбирают в одну из 6 обрабатываемых групп и обрабатывают однократным интраперитонеальным болюсом антител (сА 2 или TNV148), или в 3 мг/кг, или в 5 мг/кг. В данном исследовании используют контрольные группы, обработанные D-PBS и 10 мг/кг сА 2. Фиг. 15 представляет развитие тяжести заболевания на основании артритного индекса, как представлено в примере 6. Все обрабатываемые группы показывают некоторую защиту в более ранние моменты времени, причем обработанные 5 мг/кг сА 2 и 5 мг/кг TNV148 показывают значительное снижениеAI в недели 1-3, и все обработанные группы показывают значительное снижение AI в неделю 2. Позднее при исследовании животные, обработанные 5 мг/кг сА 2, показывают некоторую защиту со значительным снижением в недели 4, 6 и 7. Низкая доза (3 мг/кг) как сА 2, так и TNV148, показывает существенное снижение в 6 неделю, и все обработанные группы показывают существенное снижение в неделю 7. Ни одна из обработанных групп не способна сохранить существенное снижение в заключение исследования(неделя 8). Нет существенных различий между какими-либо обработанными группами (за исключением контрольной группы с физиологическим раствором) в какой-либо момент времени. Фиг. 16 показывает изменение массы на мышиной модели артрита Tg 197 в ответ на антитела против TNF настоящего изобретения по сравнению с контрольными антителами в примере 7. Сравнивают эффективность однократного интраперитонеального болюса TNV148 (полученного из клеток гибридомы) и rTNV148B (полученного из трансфицированных клеток). Для исследования на Tg 197 мышей в возрасте приблизительно 4 недель, основываясь на виде и массе тела, отбирают в одну из 9 обрабатываемых групп и обрабатывают однократным интраперитонеальным болюсом PBS Дульбекко (D-PBS) или антителами (TNV148, rTNV148B) в 1 мг/кг. Фиг. 17 представляет развитие тяжести заболевания на основании артритного индекса, как представлено в примере 7. Артритный индекс группы, обработанной 10 мг/кг сА 2, ниже, чем контрольной группы с D-PBS, начиная с недели 4 и на протяжении остальной части исследования (неделя 8). Как группы, обработанные TNV148, так и группа, обработанная 1 мг/кг сА 2, показывают значительное сни-6 007005 жение AI в неделю 4. Хотя предыдущее исследование (Р-099-017) показало, что TNV148 несколько эффективнее в отношении снижения артритного индекса после однократного интраперитонеального болюса в 1 мг/кг, данное исследование показывает, что AI групп, обработанных обоими вариантами антителTNV, несколько выше. Хотя (за исключением недели 6) в группе, обработанной 1 мг/кг сА 2, нет существенного повышения по сравнению с группой, обработанной 10 мг/кг сА 2, и в группах, обработанныхTNV148, происходит некоторое повышение в недели 7 и 8, существенных различий в AI при обработке 1 мг/кг сА 2, 1 мг/кг TNV148 и 1 мг/кг TNV148B, не имеется в любой момент исследования. Описание изобретения Настоящее изобретение относится к выделенным, рекомбинантным и/или синтетическим антителам против TNF человека, приматов, грызунов, млекопитающих, химерным, гуманизированным и/или CDRслитым антителам против TNF и антиидиотипическим антителам TNF к ним, а также к композициям и кодирующим молекулам нуклеиновых кислот, содержащих по меньшей мере один полинуклеотид, кодирующий по меньшей мере одно антитело против TNF или антиидиотипическое антитело. Настоящее изобретение также относится, но не ограничивается перечисленным, к способам получения и применения таких нуклеиновых кислот и антител и антиидиотипических антител, включая диагностические и терапевтические композиции, способы и устройства. Используемые в данном описании термины "антитело против фактора некроза опухоли альфа", "антитело против TNF", "часть антитела против TNF" или "фрагмент антитела против TNF" и/или "вариант антитела против TNF" и подобные термины относятся к любому белку или пептиду, содержащему молекулу, которая содержит по меньшей мере часть молекулы иммуноглобулина, такую как по меньшей мере один гипервариабельный участок (CDR) тяжелой или легкой цепи или его лигандсвязывающую часть,вариабельная область тяжелой или легкой цепи, константная область тяжелой или легкой цепи, каркасный участок, или любую ее часть, или по меньшей мере одну часть рецептора TNF или связывающего белка, которую можно ввести в антитело настоящего изобретения. Такое антитело также, необязательно,может воздействовать на специфический лиганд, такой, но не ограничиваясь этим, где такое антитело модулирует, снижает, повышает, выступает антагонистом, агонистом, смягчает, облегчает, блокирует,ингибирует, нейтрализует, препятствует, или иным образом воздействует на по меньшей мере одну активность или связывание TNF, или на активность или связывание рецептора TNF in vitro, in situ и/или invivo. В качестве примера, не являющегося ограничением, подходящее антитело против TNF, специфическая часть или вариант по настоящему изобретению может связываться с по меньшей мере одним TNF или его специфическими частями, вариантами или доменами. Подходящее антитело против TNF, специфическая часть или вариант также могут, необязательно, воздействовать на по меньшей мере одну активность или функцию TNF, такую как синтез РНК, ДНК или белка, высвобождение TNF, передача сигнала рецептором TNF, расщепление мембраны TNF, активность TNF, продуцирование и/или синтез TNF,или другую активность или функцию. Также подразумевается, что термин "анти-тело" охватывает антитела, фрагменты их расщепления, специфические части и варианты, включая миметики антител или части антител, имитирующие строение и/или функцию антитела или его специфического фрагмента или его части, включая одноцепочечные антитела и их фрагменты. К функциональным фрагментам относятся антигенсвязывающие фрагменты, связывающиеся с TNF млекопитающего. Например, изобретением охватываются фрагменты антител, способные связываться с TNF или его частью, в том числе Fab (например, при расщеплении папаином), Fab' (например, при расщеплении пепсином и частичном восстановлении) и F(ab')2 (например, при расщеплении пепсином), facb (например, при расщеплении плазмином),pFc' (например, при расщеплении пепсином или плазмином), Fd (например, при расщеплении пепсином,частичном восстановлении и реагрегации), фрагменты Fv или scFv (например, методами молекулярной биологии), и другие фрагменты (см., например, Colligan, Immunology, см. выше). Такие фрагменты можно получить ферментативным расщеплением, синтетическими или рекомбинантными методами, известными в технике и/или описанными в данном описании. Антитела также можно получить во многих процессированных формах с использованием генов антител, в которых один или несколько стоп-кодонов введены в обратном направлении естественного сайта терминации. Например,можно создать комбинированный ген, кодирующий часть тяжелой цепи F(ab')2, для включения последовательностей ДНК, кодирующих CH1-домен и/или шарнирную область тяжелой цепи. Различные части антител можно соединить химически обычными методами или методами генной инженерии можно получить белок с определенной последовательностью. Используемый в данном описании термин "человеческое антитело" относится к антителу, в котором, по существу, каждая часть белка (например, CDR, каркасный участок, домены СL, СH (например,СH1, СH2, СH3), шарнир (VL, VH является неиммуногенной для людей только с незначительными изменениями или вариациями последовательности. Подобным образом, антитела, называемые антителами приматов (обезьяны, бабуина, шимпанзе и т.п.), грызуна (мыши, кролика, морской свинки, хомяка и т.п.) и других млекопитающих, означают такие специфические антитела вида, подрода, рода, подсемейства,семейства. Кроме того, химерные тела включают любую комбинацию вышеназванных антител. Такие изменения или вариации, необязательно и предпочтительно, сохраняют или снижают иммуногенность в отношении людей или других видов, по сравнению с немодифицированными антителами. Таким обра-7 007005 зом, человеческие антитела отличаются от химерных или гуманизированных антител. Отмечается, что человеческие антитела могут продуцироваться животными, не относящимися к человеку, или прокариотическими, или эукариотическими клетками, способными экспрессировать гены функциональности реаранжированного иммуноглобулина человека (например, тяжелой цепи и/или легкой цепи). Кроме того,когда человеческое антитело представляет собой одноцепочечное антитело, оно может содержать линкерный пептид, не обнаруживаемый в нативных человеческих антителах. Например, Fv может содержать линкерный пептид, такой как от двух до примерно восьми остатков глицина или других аминокислот,связывающий вариабельную область тяжелой цепи и вариабельную область легкой цепи. Считают, что такие линкерные пептиды происходят от человека. Можно также использовать биспецифические, гетероспецифические, гетероконъюгированные или подобные антитела, являющиеся моноклональными, предпочтительно человеческими антителами или гуманизированными, обладающие специфичностями связывания с по меньшей мере двумя различными антигенами. В данном случае одна из специфичностей связывания существует для по меньшей мере одного белка TNF, другая специфичность - для любого другого антигена. Способы получения биспецифических антител известны в технике. Традиционно, рекомбинантное получение биспецифических антител основывается на совместной экспрессии двух пар тяжелой и легкой цепей иммуноглобулина, где две тяжелые цепи имеют различные специфичности (Milstein and Cuello, Nature, 305:537 (1983. Из-за случайного выбора тяжелых и легких цепей иммуноглобулина такие гибридомы (квадромы) продуцируют возможную смесь молекул 10 различных антител, из которых только одна имеет правильную биспецифическую структуру. Очистка нужных молекул, которую обычно проводят на стадиях аффинной хроматографии, весьма громоздкая, а выход продукта низкий. Подобные процедуры описываются, например, в WO 93/08829, патентах США 6210668, 6193967, 6132992, 6106833, 6060285, 6037453, 6010902, 5989530,5959084, 5959083, 5932448, 5833985, 5821333, 5807706, 5643759, 5601819, 5582996, 5496549, 4676980,WO 91/00360, WO 92/00373, ЕР 03089, Traunecker et al., EMBO J., 10:3655 (1991), Suresh et al., Methods inEnzymology, 121:210 (1986), включенных в данное описание в качестве ссылок. Антитела против TNF (также называемые антителами против TNF), полезные в способах и композициях настоящего изобретения, можно, необязательно, охарактеризовать высокой аффинностью связывания с TNF и, необязательно и предпочтительно, как имеющие низкую токсичность. В частности, в настоящем изобретении полезны антитела, специфические фрагменты или варианты по изобретению, где отдельные компоненты, такие как вариабельная область, константная область и каркасный участок, отдельно и/или коллективно, необязательно и предпочтительно, обладают низкой иммуногенностью. Антитела, которые можно использовать в изобретении, необязательно, характеризуются своей способностью оказывать лечебное действие на пациентов в течение длительного периода с поддающимся оценке смягчением симптомов и низкой и/или приемлемой токсичностью. Низкая или приемлемая иммуногенность и/или высокая аффинность, а также другие подходящие свойства, могут вносить вклад в достигаемые результаты лечения. "Низкая иммуногенность" в данном случае определяется как появление достаточных реакций НАНА, НАСА или НАМА у менее 75% или предпочтительно у менее 50% пациентов,которых лечат, и/или появление у пациента низких титров (менее примерно 300, предпочтительно менее примерно 100, при измерении иммуноферментным анализом методом двойных антигенов) (Elliott et al.,Lancet, 344:1125-1127 (1994), работа включена в данное описание в качестве ссылки). Применимость Выделенные нуклеиновые кислоты настоящего изобретения можно использовать для получения по меньшей мере одного антитела против TNF или его специфического варианта, которые можно использовать для измерения или воздействия на клетку, орган или животное (включая млекопитающих и людей),для диагностики, контроля, модуляции, лечения, облегчения, в помощь для предупреждения распространения или ослабления симптомов по меньшей мере одного связанного с TNF состояния, выбранного из числа по меньшей мере одного иммунного нарушения или заболевания, сердечно-сосудистого нарушения или заболевания, инфекции, злокачественности и/или неврологического нарушения или заболевания,и других расстройств и заболеваний. Такой способ может включать введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно антитело против TNF, в клетку, ткань, орган, животному или пациенту, нуждающемуся в такой модуляции, лечении, облегчении, предупреждении или ослаблении симптомов, действий или механизмов. Эффективное количество может включать количество в примерно 0,001-500 мг/кг на однократное (например, болюсное), многократное или непрерывное введение, или для достижения концентрации в сыворотке 0,01-5000 мкг/мл сыворотки на однократное, многократное или непрерывное введение, или в любом эффективном интервале или величине в нем, установленных и определенных с использованием известных способов, описанных в данном описании или известных в технике. Ссылки Все публикации или патенты, цитированные в данном описании, включены в него в качестве ссылок, так как указывают на состояние уровня техники на момент создания настоящего изобретения, и/или относятся к описанию и возможностям настоящего изобретения. Публикации относятся к любым науч-8 007005 ным и патентным публикациям или любой другой информации, доступной в любом информационном формате, включая все записанные, электронные или печатные форматы. Перечисленные далее работы включены в данное описание в качестве ссылок. Ausubel et al., Current Protocols in Molecular Biology, JohnColligan et al., Current Protocols in Protein Science, John WileySons, Inc., NY, NY (1997-2001). Антитела настоящего изобретения По меньшей мере одно антитело против TNF настоящего изобретения может, необязательно, продуцироваться клеточной линией, смешанной клеточной линией, иммортализованной клеточной линией или клональной популяцией иммортализованных клеток, хорошо известных в технике. См., например,Ausubel et al., Current Protocols in Molecular Biology, John WileySons, Inc., NY, NY (1987-2001); Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor, NY (1989); HarlowScience, John WileySons, Inc., NY, NY (1997-2001); работы включены в данное описание в качестве ссылок. Человеческие антитела, специфические к белкам TNF человека или их фрагментам, можно создать против соответствующего иммунногенного антигена, такого как выделенный белок TNF и/или его часть(включая синтетические молекулы, такие как синтетические пептиды). Подобным образом можно создать генерализованные антитела других млекопитающих. Получение иммунногенных антигенов и получение моноклональных антител можно осуществить с использованием любых подходящих методов. При одном из подходов получают гибридому посредством слияния подходящей иммортализованной клеточной линии (например, миеломной клеточной линии, такой как, но без ограничений, Sp2/0,Sp2/0-AG14, NSO, NS1, NS2, AE-1, L.5, 243, P3X63Ag8.653, Sp2 SA3, Sp2 MAI, Sp2 SS1, Sp2SA5, U937,MLA 144, ACT IV, MOLT4, DA-1, JURKAT, WEHI, K-562, COS, RAJI, NIH 3T3, HL-60, MLA 144, NAMAIWA, NEURO 2A или подобной, или другой, или гетеромиелом, продуктов их слияния или любых образованных из них гибридных клеток) или любой подходящей клеточной линии, известной в технике(см., например, www.atcc.org, www.lifetech.com., и т.п.), с клетками, продуцирующими антитела, такими как, без ограничений, выделенные или клонированные клетки селезенки, периферической крови, лимфы,миндалин или другие В-клетки, или любыми другими клетками, экспрессирующими константную или вариабельную области или каркасный участок или последовательности CDR тяжелой или легкой цепи,или эндогенные или гетерологичные нуклеиновые кислоты, такие как рекомбинантные или эндогенные,вирусные, бактериальные, водорослей, прокариотические, амфибий, насекомых, рептилий, рыб, млекопитающих, грызунов, лошадиные, овечьи, козьи, приматов, эукариотические, геномная ДНК, кДНК,рДНК, митохондриальная ДНК или РНК, хлоропластовая ДНК или РНК, гяРНК, мРНК, тРНК, одноцепочечные, двухцепочечные или трехцепочечные, гибридизированные и т.п., или любое их сочетание. См.,например, Ausubel, см. выше, и Colligan, Immunology, см. выше, глава 2 включена в данное описание в качестве ссылки. Клетки, продуцирующие антитела, также можно получить из периферической крови или, предпочтительно, селезенки или лимфоузлов людей или других подходящих животных, иммунизированных представляющими интерес антигенами. Любую другую подходящую клетку-хозяина также можно использовать для экспрессии гетерологичной или эндогенной нуклеиновой кислоты, кодирующей антитело настоящего изобретения, его специфический фрагмент или вариант. Слитые клетки (гибридомы) или рекомбинантные клетки можно выделить с использованием условий селективного культивирования или других известных способов, и клонировать путем предельного разведения или сортировки клеток или другими известными способами. Клетки, продуцирующие антитела с нужной специфичностью, можно отобрать подходящим методом анализа (например, ELISA). Можно использовать другие подходящие способы получения или выделения антител с требуемой специфичностью, включая, но не ограничиваясь ими, способы, при которых отбирают рекомбинантные антитела из библиотеки пептидов или белков (например, библиотеки бактериофагов, рибосом, олигонуклеотидов, РНК, кДНК или подобной, или другой библиотеки; например, доступной от Cambridge antibody Technologies, Cambridgeshire, UK; MorphoSys, Martinsreid/Planegg, DE; Biovation, Aberdeen, Scotland(Enzon); PCT/US91/02989 (Affymax); WO 89/06283; ЕР 371998; ЕР 550400; (Xoma); EP 229046; PCT/US 91/07149 (Ixsys); или стохастически полученных пептидов или белков - US 5723323, 5763192, 5814476,5817483, 5824514, 5976862, WO 86/05803, EP 590689 (Ixsys, теперь Applied Molecular Evolution (AME,все включены в настоящее описание в качестве ссылок, или способы, имеющие в основе иммунизацию-9 007005 животных (например, мышей SCID, Nguyen et al., Microbiol. Immunol., 41:901-907 (1997); Sandhu et al.,Crit. Rev. Biotechnol., 16:95-118 (1996); Eren et al., Immunol., 93:154-161 (1998), все работы включены в настоящее описание в качестве ссылок, как и патенты и заявки), способных продуцировать спектр человеческих антител, известные в технике и/или описанные в данном описании. Такие методы включают воспроизведение рибосом (Hanes et al., Proc. Natl. Acad. Sci. USA, 94:4937-4942 (May 1997); Hanes et al.,Proc. Natl. Acad. Sci. USA, 95:14130-14135 (Nov. 1998; технологии получения антител из малого числа клеток (например, selected lymphocyte antibody method ("SLAM") (патент США 5627052), Wen et al., J.B-cell selection (Steenbakkers et al., Molec. Biol. Reports 19:125-134 (1994); Jonak et al., Progress Biotech,Vol. 5, In Vitro Immunization in Hybridoma Technology, Borrebaeck, ed., Elsevier Science Publishers B.V.,Amsterdam, Netherlands (1988. Способы конструирования или гуманизации антител, отличных от человека и человека, также можно использовать, и они хорошо известны в технике. Как правило, гуманизированное или сконструированное антитело содержит один или несколько аминокислотных остатков из источника, не являющегося человеком, например крысы, кролика, не являющегося человеком примата или другого млекопитающего. Такие аминокислотные остатки часто называют "импортными" остатками, взятыми, обычно, из "импортной" вариабельной, константной или другой области известной последовательности человека. Известные последовательности человеческого Ig описываются, например, в которые все полностью включены в данное описание в качестве ссылок. Такие импортированные последовательности можно использовать для снижения иммуногенности или ослабления, усиления или изменения связывания, аффинности, ускорения, замедления, авидности,специфичности, времени полужизни или любых других подходящих характеристик, как известно в тех- 10007005 нике. Как правило, сохраняются часть или все отличные от человеческих и человеческие CDR, в то время как отличные от человеческих последовательности вариабельной и константной областей заменяются на человеческие или другие аминокислоты. Антитела также можно, необязательно, гуманизировать с сохранением высокой аффинности к антигену и других благоприятных биологических свойств. Для того,чтобы достичь такой цели, гуманизированные антитела можно, необязательно, получить способом анализа родительских последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов обычно доступны и знакомы специалистам в данной области техники. Доступны компьютерные программы, иллюстрирующие и отображающие трехмерные конформационные структуры выбранных последовательностей-кандидатов иммуноглобулинов. Просмотр таких отображений позволяет проанализировать вероятную роль остатков в функционировании последовательностей-кандидатов иммуноглобулинов, т.е. проанализировать остатки, влияющие на способность иммуноглобулина-кандидата связываться со своим антигеном. Таким образом, можно выбрать остатки FR из консенсусной и импортной последовательностей и соединить, так что достигаются нужные характеристики антител, такие как повышенная аффинность в отношении антигена(ов)-мишени(ей). Как правило, остатки CDR прямо и весьма существенно вовлекаются во влияние на связывание антигена. Гуманизицию или инженерию антител настоящего изобретения можно осуществить с использованием любого известного способа, такого как способы, описанные в Winter (Jones et al., Nature, 321:522 (1986); Riechmann et al.,Nature, 332:323 (1988); Verhoeyen et al., Science, 239:1534 (1988, Sims et al., J. Immunol., 151:2296 (1993);et al., J. Immunol., 151:2623 (1993), патенты США 5723323, 5976862, 5824514, 5817483, 5814476,5763192, 5723323, 5766886, 5714352, 6204023, 6180370, 5693762, 5530101, 5585089, 5225539, 4816567,PCT/: US98/16280, US96/18978, US91/09630, US91/05939, US94/01234, GB89/01334, GB91/01134,GB92/01755; WO90/14443, WO90/14424, WO90/14430, ЕР 229246, включенных в данное описание в качестве ссылок, включая ссылки, цитированные в них, и в других работах. Антитела против TNF также можно получить, необязательно, путем иммунизации трансгенных животных (например, мыши, крысы, хомяка, примата, не относящегося к человеку, и т.п.), способных продуцировать спектр человеческих антител, как описывается в данном описании и/или как известно в технике. Клетки, продуцирующие антитела против TNF человека, можно выделить из таких животных и иммортализовать с использованием подходящих способов, таких как способы, описанные в данном описании. Трансгенных мышей, которые могут продуцировать спектр человеческих антител, связывающихся с человеческими антигенами, можно получить известными способами (например, описанными в патентах США 5770428, 5569825, 5545806, 5625126, 5625825, 5633425, 5661016 и 5789650, выданных включенных в данное описание в качестве ссылок, и в других работах). Как правило, такие мыши содержат по меньшей мере одну трансгенсодержащую ДНК по меньшей мере от одного локуса иммуноглобулина человека, который функционально реаранжирован, или который может претерпевать функциональную реаранжировку. Эндогенные локусы иммуноглобулина в таких мышах можно разрушить или удалить для устранения способности животных продуцировать антитела, кодируемые эндогенными генами. Скриниг антител на специфическое связывание с подобными белками или фрагментами можно удобно осуществить с использованием библиотек отображений пептидов. Такой способ включает скрининг больших коллекций пептидов на отдельные члены с нужными функцией или строением. Скрининг антител из библиотек отображений пептидов хорошо известен в технике. Отображенные пептидные последовательности могут иметь длину от 3 до 5000 или более аминокислот, часто 5-100 аминокислот, и- 11007005 часто - от примерно 8 до 25 аминокислот. Кроме методов прямого химического синтеза получения пептидных библиотек описаны некоторые методы рекомбинантных ДНК. Один тип включает отображение пептидной последовательности на поверхности бактериофага или клетки. Каждый бактериофаг или клетка содержит нуклеотидную последовательность, кодирующую определенную отображенную пептидную последовательность. Такие способы описываются в патентных публикациях РСТ 91/17271,91/18980, 91/19818 и 93/08278. Другие системы получения библиотек пептидов содержат аспекты как химического синтеза in vitro, так и рекомбинантных способов. См. патентные публикации РСТ 92/05258, 92/14843 и 96/19256. См. также патенты США 5658754 и 5643768. Библиотеки отображений пептидов, вектор и набор для скрининга коммерчески доступны от таких поставщиков, как InvitrogenXoma; Colligan, см. выше; Ausubel, см. выше; или Sambrook, см. выше; все перечисленные выше патенты и публикации включены в данное описание в качестве ссылок. Антитела настоящего изобретения также можно получить с использованием по меньшей мере одной нуклеиновой кислоты, кодирующей антитело против TNF, с целью получения трансгенных животных или млекопитающих, таких как козы, коровы, лошади, овцы и т.п., которые продуцируют такие антитела в своем молоке. Таких животных можно получить с использованием известных способов. См.,например, патенты США 5827690; 5849992; 4873316; 5849992; 5994616; 5565362; 5304489, и т.п.,включенные в данное описание в качестве ссылок, и другие работы. Антитела настоящего изобретения также можно получить с использованием по меньшей мере одной нуклеиновой кислоты, кодирующей антитело против TNF, с целью получения трансгенных растений и культивированных растительных клеток (например, табака, маиса и других), продуцирующих такие антитела, специфические части или варианты в частях растений или в клетках, культивируемых из них. Как пример, не являющийся ограничением, листья трансгенного табака, экспрессирующие рекомбинантные белки, успешно используют для получения больших количеств рекомбинантных белков, например, с использованием индуцируемого промотора. См. Cramer et al., Curr. Top. Microbiol. Immunol., 240:95-118(1999) и цитированные в указанной работе ссылки. Также используют трансгенную кукурузу для экспрессии на коммерческих уровнях производства белков млекопитающих с биологическими активностями, равноценными активностям, получаемым в других рекомбинантных системах или выделенных в чистом виде из природных источников. См., например, Hood et al., Adv. Exp. Med. Biol., 464:127-147 (1999),и цитированные в указанной работе ссылки. Антитела, в том числе фрагменты антител, такие как одноцепочечные антитела (scFv), получают в больших количествах также из семян трансгенных растений,включая семена табака и клубни картофеля. См., например, Conrad et al., Plant. Mol. Biol., 38:101-109(1998), и цитированные в указанной работе ссылки. Таким образом, антитела настоящего изобретения также можно получить с использованием трансгенных растений согласно известным способам. См. также Fischer et al., Biotechnol. Appl. Biochem., 30:99-108 (Oct., 1999), Ma et al., Trends Biotechnol., 13:522-7(1995); Ma et al., Plant. Physiol., 109:341-6 (1995); Whitelam et al., Biochem. Soc. Trans., 22:940-944 (1994); и ссылки, цитированные в указанных работах. См. также литературу для общего представления об экспрессии антител растениями, и не только. Каждая из указанных выше ссылок включена в данное описание в качестве ссылки. Антитела изобретения могут связываться с TNF человека в широком интервале аффинности (КD). В предпочтительном варианте по меньшей мере одно человеческое mAb настоящего изобретения может,необязательно, связываться с TNF человека с высокой аффинностью. Например, человеческое mAb может связываться с TNF человека с КD, по величине равным или меньше примерно 10-7 М, таким как, без ограничений, 0,1-9,9 (или любого интервала или величины в указанном пределе) х 10-7, 10-8, 10-9, 10-10,10-11, 10-12, 10-13, или любого интервала или величины в указанном пределе. Аффинность или авидность антитела к антигену можно определить экспериментально с использованием любого подходящего способа. (См., например, Berzofsky et al., "Antibody-Antigen Interactions", вFundamental Immunology, Paul W.E., Ed., Raven Press: New York, NY (1984); Kuby, Janis, Immunology,W.H. Freeman and Company: New York, NY (1992); и способы, описанные в данном описании). Измеряемая аффинность взаимодействия конкретных антитела и антигена может изменяться, если измеряется в разных условиях (например, таких как концентрация соли, рН). Таким образом, измерения аффинности и других антигенсвязывающих параметров (например, КD, Кa, Кd) осуществляют, предпочтительно, в стандартных растворах антител и антигенов и стандартном буфере, таком как буфер, описанный в данном описании. Молекулы нуклеиновых кислот С использованием приведенных в данном описании сведений, таких как о нуклеотидных последовательностях, кодирующих по меньшей мере 70-100% последовательных аминокислот по меньшей мере одной из SEQ ID No: 1, 2, 3, 4, 5, 6, 7, 8, их специфических фрагментах, вариантах или консенсусных по- 12007005 следовательностях, или депозитном векторе, содержащем по меньшей мере одну из таких последовательностей, можно получить молекулу нуклеиновой кислоты настоящего изобретения, кодирующей по меньшей мере одно антитело против TNF, с использованием способов, описанных в данном описании или известных в технике. Молекулы нуклеиновых кислот настоящего изобретения могут находиться в форме РНК, такой как мРНК, гяРНК, тРНК, или любой другой форме, или в форме ДНК, в том числе кДНК и геномной ДНК,или другой ДНК, полученной клонированием или полученной синтетически или любыми их сочетаниями. ДНК может являться трехцепочечной, двухцепочечной или одноцепочечной, или представлять любое их сочетание. Любая часть по меньшей мере одной цепи ДНК или РНК может представлять собой кодирующую цепь, также известную как смысловая цепь, или она может представлять собой некодирующую цепь, также известную как антисмысловая цепь. Выделенные молекулы нуклеиновых кислот настоящего изобретения могут являться молекулами нуклеиновых кислот, содержащими открытую рамку считывания (ORF), необязательно, с одним или несколькими интронами, например, по меньшей мере одной специфической частью по меньшей мере одного CDR, например CDR1, CDR2 и/или CDR3, по меньшей мере одной тяжелой цепи (например, SEQ IDNO: 1-3) или легкой цепи (например, SEQ ID NO: 4-6), или другими интронами; молекулами нуклеиновых кислот, содержащими кодирующую последовательность для антитела против TNF или вариабельной области (например, SEQ ID NO: 7,8); и молекулами нуклеиновых кислот, содержащими нуклеотидную последовательность, по существу, отличающуюся от описанных выше, но которая, из-за вырожденности генетического кода, еще кодирует по меньшей мере одно антитело против TNF, описанное в данном описании и/или известное в технике. Конечно, генетический код хорошо известен в технике. Таким образом,для специалиста в данной области техники будет самым обычным делом получение таких вырожденных вариантов нуклеиновых кислот, кодирующих специфические антитела против TNF настоящего изобретения. См., например, Ausubel et al., см. выше, и такие варианты нуклеиновых кислот включены в настоящее изобретение. Не являющиеся ограничительными примеры выделенных молекул нуклеиновых кислот настоящего изобретения включают SEQ ID NO: 10, 11, 12, 13, 14, 15, соответствующие не являющимся ограничительными примерам нуклеиновой кислоты, кодирующей, соответственно, НС CDR1,НС CDR2, НС CDR3, LC CDR1, LC CDR2, LC CDR3, вариабельную область НС и вариабельную областьLC. В другом аспекте изобретение относится к выделенным молекулам нуклеиновых кислот, кодирующих антитело против TNF с аминокислотной последовательностью, кодируемой нуклеиновой кислотой,содержащейся в плазмиде, депонированной под обозначенными названиями клонов и депозитнымиАТСС, соответственно, депонированных. Как указывается в данном описании, молекулы нуклеиновых кислот настоящего изобретения, содержащие нуклеиновую кислоту, кодирующую антитело против TNF, могут включать, но не ограничиваться перечисленным, молекулы, сами кодирующие аминокислотную последовательность фрагмента антитела; кодирующую последовательность для всего антитела или его части; кодирующую последовательность для антитела, фрагмента или части, а также дополнительные последовательности, такие как кодирующая последовательность по меньшей мере одной сигнальной последовательности или слитого пептида, с или без вышеуказанных дополнительных кодирующих последовательностей, таких как по меньшей мере один интрон, вместе с дополнительными некодирующими последовательностями, включая, но не ограничиваясь перечисленным, некодирующие 5'- и 3'-последовательности, такие как транскрибированные не транслируемые последовательности, которые играют роль при транскрипции, процессировании мРНК, включая сплайсинг, и сигналы полиаденилирования (например, связывания рибосом и устойчивости мРНК); дополнительную кодирующую последовательность, кодирующую дополнительные аминокислоты, такие как обеспечивающие дополнительные функциональности. Таким образом, последовательность, кодирующая антитело, может быть слита с маркерной последовательностью, такой как последовательность, кодирующая пептид, что облегчает очистку слитых антител, содержащих фрагменты или части антител. Полинуклеотиды, селективно гибридизующиеся с полинуклеотидом, описанным в данном описании Настоящее изобретение относится к выделенным нуклеиновым кислотам, гибридизурующимся в условиях селективной гибридизации с полинуклеотидом, описанным в данном описании. Таким образом,полинуклеотиды в таком варианте можно использовать для выделения, детекции и/или количественного определения нуклеиновых кислот, содержащих такие полинуклеотиды. Например, полинуклеотиды настоящего изобретения можно использовать для идентификации, выделения или амплификации неполных или полноразмерных клонов в депонированной библиотеке. В некоторых вариантах полинуклеотиды представляют собой геномные последовательности или последовательности кДНК, выделенные или иным образом комплементарные кДНК из библиотеки нуклеиновых кислот человека или млекопитающего. Предпочтительно, библиотека кДНК содержит по меньшей мере 80% полноразмерных последовательностей, предпочтительно по меньшей мере 85 или 90% полноразмерных последовательностей, и- 13007005 предпочтительнее по меньшей мере 95% полноразмерных последовательностей. Библиотеки кДНК можно нормализовать для повышения представления редких последовательностей. Условия гибридизации низкой или умеренной жесткости, как правило, но не исключительно, используются с последовательностями с пониженной идентичностью последовательности относительно комплементарных последовательностей. Условия умеренной и высокой жесткости можно использовать, необязательно, в случае последовательностей большей идентичности. Условия низкой жесткости допускают селективную гибридизацию последовательностей с примерно 70% идентичностью последовательностей и могут использоваться для идентификации ортологичных или паралогичных последовательностей. Необязательно, полинуклеотиды данного изобретения будут кодировать по меньшей мере часть антитела, кодируемого полинуклеотидами, описанными в данном описании. Полинуклеотиды данного изобретения включают нуклеотидные последовательности, которые можно использовать для селективной гибридизации с полинуклеотидом, кодирующим антитело настоящего изобретения. См., например, Ausubel, см. выше; Colligan, см. выше, включенные в данное описание в качестве ссылок. Конструирование нуклеиновых кислот Выделенные нуклеиновые кислоты настоящего изобретения можно создать с использованием (а) рекомбинантных методов, (b) синтетических методов, (с) методами очистки или их сочетанием, хорошо известными в технике. Обычно нуклеиновые кислоты могут содержать последовательности в дополнение к полинуклеотиду настоящего изобретения. Например, в нуклеиновую кислоту можно встроить сайт множественного клонирования, содержащий одну или несколько эндонуклеаз, для того, чтобы способствовать выделению полинуклеотида. Также можно встроить транслируемые последовательности для того, чтобы способствовать выделению транслируемого полинуклеотида настоящего изобретения. Например, гексагистидиновая маркерная последовательность является удобным средством для очистки белков настоящего изобретения. Нуклеиновая кислота настоящего изобретения, исключая кодирующую последовательность,представляет собой, необязательно, вектор, адаптор или линкер для клонирования и/или экспрессии полинуклеотида настоящего изобретения. Можно добавить дополнительные последовательности к таким клонирующим и/или экспрессирующим последовательностям, с целью оптимизации их функции при клонировании и/или экспрессии,для того, чтобы способствовать выделению полинуклеотида, или с целью улучшения введения полинуклеотида в клетку. Использование клонирующих векторов, экспрессирующих векторов и линкеров хорошо известно в технике (см., например, Ausubel, см. выше; или Sambrook, см. выше). Рекомбинантные способы конструирования нуклеиновых кислот Выделенные композиции нуклеиновых кислот данного изобретения, таких как РНК, кДНК, геномная ДНК или любое их сочетание, можно получить из биологических источников с использованием любого числа методологий клонирования, известных специалистам в данной области техники. В некоторых вариантах олигонуклеотидные зонды, селективно гибиридизирующие с полинуклеотидами настоящего изобретения в условиях высокой жесткости, используют для идентификации нужной последовательности в библиотеке кДНК или геномной ДНК. Выделение РНК и конструирование библиотек кДНК и ДНК хорошо известно рядовым специалистам в данной области техники (см., например, Ausubel, см. выше; или Sambrook, см. выше). Скрининг нуклеиновых кислот и способы выделения Библиотеку кДНК или геномную библиотеку можно скринировать с использованием зонда на основе последовательности полинуклеотида настоящего изобретения, как описано в данном описании. Зонды можно использовать для гибридизации с последовательностями геномной ДНК или кДНК для выделения гомологичных генов в одних и тех же или разных организмах. Специалистам в данной области техники будет понятно, что при анализе можно использовать различную степень жесткости; и жесткой может быть среда или для гибридизация или для промывки. Так как условия гибридизации становятся более жесткими, должна существовать большая степень комплементарности между зондом и мишенью для того, чтобы происходило образование дуплекса. Степень жесткости можно регулировать с помощью одного или нескольких факторов, таких как температура, ионная сила, рН и наличие растворителя для неполной денатурации, такого как формамид. Например, жесткость гибридизации обычно изменяют путем изменения полярности реагирующего раствора через, например, манипуляции с концентрацией формамида в интервале от 0 до 50%. Степень комплементарности (идентичность последовательностей), требуемая для детектируемого связывания, будет изменяться в соответствии с жесткостью среды для гибридизации и/или среды для промывки. Степень комплементарности оптимально будет составлять 100 или 70-100%, или любой интервал или величину в указанных пределах. Однако следует представлять, что незначительные изменения последовательности в зондах и праймерах можно компенсировать снижением жесткости среды для гибридизации и/или промывки. Способы амплификации РНК или ДНК хорошо известны в технике и могут использоваться согласно настоящему изобретению без излишнего экспериментирования на основании указаний, представленных в данном описании.- 14007005 Известными способами амплификации ДНК или РНК являются полимеразная цепная реакция(ПЦР) и родственные способы амплификации (см., например, патенты США 4683195, 4683202,4800159, 4965188, Mullis et al.; 4795699 и 4921794, Tabor et al.; 5142033, Innis; 5122464, Wilson et al.; 5091310, Innis; 5066584, Gyllensten et al.; 4889818, Gelfand et al.; 4994370, Silver et al.; 4766067, Biswas; 4656134, Ringold), и амплификация, опосредуемая РНК, при которой используют РНК, антисмысловую к последовательности-мишени, в качестве матрицы для синтеза двухцепочечной ДНК (патент США 5130238, Malek et al., торговое наименование NASBA) (все указанные ссылки внесены в данное описание в качестве ссылок, см., например, Ausubel, см. выше; или Sambrook, см. выше), и другие способы. Например, технологию полимеразной цепной реакции (ПЦР) можно использовать для амплификации последовательностей полинуклеотидов настоящего изобретения и родственных генов непосредственно из библиотек геномной ДНК или кДНК. ПЦР и другие способы амплификации in vitro также могут быть полезны, например, для клонирования последовательностей нуклеиновых кислот, кодирующих экспрессируемые белки, для получения нуклеиновых кислот для применения в качестве зондов для детекции присутствия нужной РНК в образцах, для секвенирования нуклеиновых кислот или для других целей. Примеры методов, достаточные для ориентации специалистов в способах амплификации in vitro,имеются в Berger, см. выше, Sambrook, см. выше, а также в Mullis et al., патент США 4683202 (1987), и(1990). Коммерчески доступные наборы для геномной ПЦР-амплификации известны в технике. См., например, набор для геномной ПЦР Advantage-GC (Clontech). Кроме того, для улучшения выхода длинных продуктов ПЦР можно использовать белок Т 4 гена 32 (Boehringer Mannheim). Синтетические способы конструирования нуклеиновых кислот Выделенные нуклеиновые кислоты настоящего изобретения можно также получить прямым химическим синтезом известными способами (см., например, Ausubel, см. выше). Химический синтез, как правило, дает одноцепочечные олигонуклеотиды, которые можно превратить в двухцепочечную ДНК методом гибридизации с комплементарной последовательностью или полимеризацией с ДНКполимеразой с использованием одной цепи в качестве матрицы. Специалисту в данной области техники будет понятно, что хотя химический синтез ДНК может быть ограничен последовательностями в примерно 100 или больше оснований, можно получить более длительные последовательности лигированием более коротких последовательностей. Рекомбинантные экспрессирующие кассеты Настоящее изобретение также относится к рекомбинантным экспрессирующим кассетам, содержащим нуклеиновую кислоту настоящего изобретения. Нуклеотидную последовательность настоящего изобретения, например, кДНК, или геномную последовательность, кодирующую антитело настоящего изобретения, можно использовать для конструирования рекомбинантной экспрессирующей кассеты, которую можно ввести в по меньшей мере одну клетку-хозяина. Рекомбинантная экспрессирующая кассета обычно будет содержать полинуклеотид настоящего изобретения, оперативно соединенный с регуляторными последовательностями инициации транскрипции, которые будут управлять транскрипцией полинуклеотида в предполагаемой клетке-хозяине. Как гетерологичные, так и негетерологичные (т.е., эндогенные) промоторы можно использовать для управления экспрессией нуклеиновых кислот настоящего изобретения. В некоторых вариантах выделенные нуклеиновые кислоты служат в качестве промоторов, эхансеров или других элементов, которые можно ввести в соответствующую позицию (в обратном направлении, в прямом направлении или в интрон) негетерологичной формы полинуклеотида настоящего изобретения таким образом, чтобы положительно или отрицательно регулировать экспрессию полинуклеотида настоящего изобретения. Например, эндогенные промоторы можно изменить in vivo или in vitro путем мутации, делеции и/или замены. Векторы и клетки-хозяева Настоящее изобретение также относится к векторам, включающим нуклеиновые кислоты настоящего изобретения, клеткам-хозяевам, генетически созданным с помощью рекомбинантных векторов, и получению по меньшей мере одного антитела против TNF рекомбинантными методами, хорошо известными в технике. См., например, Sambrook et al., см. выше; Ausubel et al., см. выше; работы, включенные в данное описание в качестве ссылок. Полинуклеотиды, необязательно, можно соединить с вектором, содержащим селектируемый маркер для размножения в хозяине. Как правило, плазмидный вектор вводят в преципитат, такой как кальцийфосфатный преципитат, или в комплекс с нагруженным липидом. Если вектор представляет собой вирус,его можно упаковать in vitro с использованием соответствующей пакующей клеточной линии и затем трансдуцировать в клетки-хозяева. ДНК-вставка должна оперативно связываться с соответствующим промотором. Экспрессирующие конструкции также будут содержать сайты для инициации транскрипции, терминации и, в транскрибируемом участке, сайт связывания рибосом для трансляции. Кодирующая часть зрелых транскриптов,экспрессированных конструкциями, будет, предпочтительно, включать инициацию трансляции в начале и кодон терминации (например, UAA, UGA или UAG), соответственно располагающиеся в конце транс- 15007005 лируемой мРНК, с UAA и UAG, предпочтительными для экспрессии клеток млекопитающих или эукариот. Экспрессирующие векторы, предпочтительно, но необязательно, будут включать по меньшей мере один селектируемый маркер. Такие маркеры включают, но не ограничиваются перечисленным, гены устойчивости к метотрексату (МТХ), дигидрофолатредуктазе (DHFR, патенты США 4399216; 4634665; 4656134; 4956288; 5149636; 5179017), ампициллину, неомицину (G418), микофеноловой кислоте или глутаминсинтетазе (GS, патенты США 5122464; 5770359; 5827739) для культуры эукариотических клеток и гены устойчивости к ампициллину для культивирования в Е. coli и других бактериях или прокариотах (вышеперечисленные патенты включены в данное описание в качестве ссылок). Соответствующие культуральные среды и условия для вышеописанных клеток-хозяев известны в технике. Подходящие векторы будут очевидны для специалистов. Введение векторной конструкции в клетку-хозяина можно осуществить кальцийфосфатной трансфекцией, опосредованной DEAE-декстраном трансфекцией,опосредованной катионным липидом трансфекцией, электропорацией, трансдукцией, инфицированием или другими известными способами. Такие способы описаны, например, в Sarnbrook, см. выше, главы 14 и 16-18; в Ausubel, см.выше, главы 1, 9, 13, 15, 16. По меньшей мере одно антитело настоящего изобретения можно экспрессировать в модифицированной форме, такой как слитый белок, и можно включить не только сигналы секреции, но также дополнительные гетерологичные функциональные участки. Например, участок дополнительных аминокислот,в частности заряженных аминокислот, можно добавить к N-концу антитела для улучшения устойчивости и сохранности в клетке-хозяине, во время очистки или во время последующих операций и хранения. Также к антителу настоящего изобретения можно добавить пептидные группы для облегчения очистки. Такие участки можно удалить до окончательного получения антитела или по меньшей мере одного его фрагмента. Такие способы описываются во многих известных лабораторных руководствах, таких какSambrook, см. выше, главы 17.29-17.42 и 18.1-18.74; Ausubel, см. выше, главы 16, 17 и 18. Рядовым специалистам в данной области техники известны многочисленные экспрессирующие системы, доступные для экспрессии нуклеиновой кислоты, кодирующей белок настоящего изобретения. С другой стороны, нуклеиновые кислоты настоящего изобретения можно экспрессировать в клеткехозяине, манипулируя клеткой-хозяином, содержащим эндогенную ДНК, кодирующую антитело настоящего изобретения. Такие способы хорошо известны в технике, например, описанные в патентах США 5580734, 5641670, 5733746 и 5733761, включенных в данное описание в качестве ссылок. Примерами клеточных культур, полезных для продуцирования антител, их специфических частей или вариантов являются клетки млекопитающих. Системы клеток млекопитающих часто будут находиться в форме монослоев клеток, хотя также можно использовать суспензии клеток млекопитающих или биореакторы. В технике разработан ряд подходящих линий клеток-хозяев, способных экспрессировать интактные гликозилированные белки, в том числе, клеточные линии COS-1 (например, АТСС CRL 1650), COS-7 (например, АТСС CRL 1651), НЕК 293, ВНК 21 (например, АТСС CRL-10), СНО (например,АТСС CRL 1610) и BSC-1 (например, АТСС CRL-26), клетки Cos-7, клетки СНО, клетки hep G2,Р 3 Х 63 Аg8.653, SP2/0-Agl4, клетки 293, клетки Hela и т.п., которые легко доступны, например, от Американской коллекции типовых культур, Manassas, Va (www.atcc.org). Предпочтительными клеткамихозяевами являются клетки лимфоидного происхождения, такие как миеломные и лимфомные клетки. Особенно предпочтительными клетками-хозяевами являются клетки P3X63Ag8.653 (АТСС, инвентарныйCRL-1580) и клетки SP2/0-Ag14 (АТСС, инвентарныйCRL-1851). В особенно предпочтительном варианте рекомбинантной клеткой является клетка P3X63Ab8.653 или клетка SP2/0-Ag14. Экспрессирующие векторы для указанных клеток могут включать одну или несколько из перечисленных далее регулирующих экспрессию последовательностей, таких как сайт начала репликации; промотор (например, поздние или ранние промоторы SV40, промотор CMV (патенты США 5168062; 5385839), промотор HSV tk, промотор pgk (фосфоглицераткиназа), промотор EF-1-альфа (патент США 5266491), по меньшей мере один промотор иммуноглобулина человека); энхансер и/или процессингинформирующие сайты, такие как сайты связывания рибосом, сайты РНК-сплайсинга, сайты полиаденилирования (например, сайт присоединения большого Т-Аg-поли-А SV40), и последовательности терминаторов транскрипции. См., например, Ausubel, см. выше; Sambrook, см. выше. Другие клетки, полезные для получения нуклеиновых кислот или белков настоящего изобретения, известны и/или доступны, например, из каталога клеточных линий и гибридом Американской коллекции типовых культур(www.atcc.org) или других известных или коммерческих источников. Когда используют эукариотические клетки в качестве хозяев, в вектор обычно включают последовательности полиаденилирования или терминации транскрипции. Примером терминаторной последовательности является последовательность полиаденилирования из гена гормона роста коровы. Также можно включать последовательности для точного сплайсинга транскрипта. Примером сплайсингпоследовательности является интрон VP1 из SV40 (Sprague et al., J. Virol., 45:773-781 (1983. Кроме того,в вектор можно ввести последовательности генов для регулирования репликации в клетке-хозяине, известные в технике.- 16007005 Очистка анитител Антитела против TNF можно извлечь из рекомбинантных клеточных культур и очистить хорошо известными способами, включая очистку с протеином А, осаждение сульфатом аммония или этанолом,кислотную экстракцию, анион- или катионобменную хроматографию, хроматографию на фосфоцеллюлозе, гидрофобную хроматографию, аффинную хроматографию, хроматографию на гидроксиапатите и хроматографию на лектинах, и другие способы. Для очистки также можно использовать высокоэффективную жидкостную хроматографию ("ВЭЖХ"). См., например, Colligan, Current Protocols in Immunology, или Current Protocols in Protein Science, John WileySons, NY, NY (1997-2001), например, главы 1,4, 6, 8, 9, 10, включенные в данное описание в качестве ссылок. Антитела настоящего изобретения включают очищенные природные продукты, продукты химического синтеза и продукты, полученные рекомбинантными методами из эукариотного хозяина, в том числе, например, из клеток дрожжей, высшего растения, насекомого и млекопитающего. В зависимости от хозяина, используемого при получении рекомбинантным способом, антитела настоящего изобретения могут быть гликозилированными или негликозилированными, и гликозилированные предпочтительнее. Такие способы описываются во многих известных лабораторных руководствах, таких как Sambrook, см. выше, разделы 17.37-17.42; Ausubel, см. выше, главы 10, 12, 13, 15, 16, 18 и 20; Colligan, Protein Science,см. выше, главы 12-14, которые все включены в данное описание в качестве ссылок. Антитела против TNF Выделенные антитела настоящего изобретения содержат аминокислотные последовательности антител, описанные в данном описании, кодируемые любым подходящим полинуклеотидом, или любые выделенные или полученные антитела. Предпочтительно, человеческое антитело или антигенсвязывающий фрагмент связывается с TNF человека и посредством этого частично или полностью нейтрализует по меньшей мере одну биологическую активность белка. Антитело или его специфическая часть или вариант, которые частично или, предпочтительно, полностью нейтрализует по меньшей мере одну биологическую активность белка TNF или фрагмента, могут связываться с белком или фрагментом и посредством этого ингибируют активности, опосредуемые через связывание TNF с рецептором TNF или через другие TNF-зависимые или опосредуемые механизмы. Используемый в данном описании термин "нейтрализующее антитело" относится к антителу, которое может ингибировать TNF-зависимую активность примерно на 20-120%, предпочтительно по меньшей мере на 10, 20, 30, 40, 50, 55, 60, 65, 70, 75, 80, 85,90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% или более, в зависимости от анализа. Способность антитела против TNF ингибировать TNF-зависимую активность оценивают, предпочтительно, методом по меньшей мере одного подходящего анализа белка или рецептора, описанным в данном описании и/или известным в технике. Человеческое антитело по изобретению может быть любого класса (IgG, IgA, IgM,IgE, IgD и т.п.) или изотипа и может содержать легкую цепь каппа или лямбда. В одном варианте человеческое антитело содержит тяжелую цепь IgG или определенный фрагмент, например, по меньшей мере одного из изотипов IgG1, IgG2, IgG3 или IgG4. Антитела такого типа можно получить, используя трансгенную мышь или другое трансгенное млекопитающее, не относящееся к человеку, содержащее трансгены с по меньшей мере одной человеческой легкой цепью (например, IgG, IgA и IgM (например, 1, 2,D3, 4), описанные в данном описании и/или известные в технике. В другом варианте человеческое антитело против TNF человека содержит тяжелую цепь IgG1 и легкую цепь IgG1. По меньшей мере одно антитело изобретения связывается по меньшей мере с одним специфическим эпитопом, специфическим по меньшей мере к одному белку TNF, его субъединице, фрагменту, части или любому их сочетанию. По меньшей мере один эпитоп может содержать по меньшей мере один антителосвязывющий участок, содержащий по меньшей мере одну часть указанного белка, где эпитоп,предпочтительно, состоит по меньшей мере из одной внеклеточной, растворимой, гидрофильной, внешней или цитоплазматической части указанного белка. По меньшей мере один специфический эпитоп может содержать любую комбинацию по меньшей мере от одной аминокислотной последовательности из по меньшей мере 1-3 аминокислот до полной специфической части последовательных аминокислот SEQID No: 9. Как правило, человеческое антитело или антигенсвязывающий фрагмент настоящего изобретения будет содержать по меньшей мере один человеческий гипервариабельный участок (CDR1, CDR2 иCDR3) или вариант по меньшей мере одной вариабельной области тяжелой цепи, и по меньшей мере один человеческий гипервариабельный участок (CDR1, CDR2 и CDR3) или вариант по меньшей мере одной вариабельной области легкой цепи. Как пример, не являющийся ограничением, антитело или антигенсвязывающий фрагмент или вариант могут содержать по меньшей мере одну тяжелую цепь CDR3 с аминокислотной последовательностью SEQ ID No: 3 и/или легкую цепь CDR3 с аминокислотной последовательностью SEQ ID No: 6. В частном варианте антитело или антигенсвязывающий фрагмент могут содержать антигенсвязывающий участок, содержащий по меньшей мере часть по меньшей мере одной тяжелой цепи CDR (т.е., CDR1, CDR2 и/или CDR3) с аминокислотной последовательностью, соответствующей CDR1, 2 и/или 3 (например, SEQ ID NO: 1, 2 и/или 3). В другом частном варианте антитело или антигенсвязывающий фрагмент или вариант могут содержать антигенсвязывающий участок, содержа- 17007005 щий по меньшей мере часть по меньшей мере одной легкой цепи CDR (т.е., CDR1, CDR2 и/или CDR3) с аминокислотной последовательностью, соответствующей CDR1, 2 и/или 3 (например, SEQ ID No: 4, 5 и/или 6). В предпочтительном варианте три CDR тяжелой цепи и три CDR легкой цепи антитела или антигенсвязывающего фрагмента имеют аминокислотную последовательность, соответствующую CDR по меньшей мере одного mAb TNV148, TNV14, TNV15, TNV196, TNV118, TNV32, TNV86, описанных в данном описании. Такие антитела можно получить, соединяя химически различные части (например,CDR, каркасный участок) антитела с использованием обычных методов, путем получения и экспрессии(т.е., одной или нескольких) молекулы нуклеиновой кислоты, кодирующей антитело, с использованием обычных методов технологии рекомбинантных ДНК, или используя любой другой подходящий способ. Антитело против TNF может содержать по меньшей мере одну вариабельную область тяжелой или легкой цепи с определенной аминокислотной последовательностью. Например, в предпочтительном варианте антитело против TNF содержит по меньшей мере одну из по меньшей мере одной вариабельной области тяжелой цепи, необязательно содержащую аминокислотную последовательность SEQ ID NO: 7,и/или по меньшей мере одной вариабельной области легкой цепи, необязательно содержащую аминокислотную последовательность SEQ ID NO: 8. Антитела, связывающиеся с TNF человека и содержащие определенную вариабельную область тяжелой или легкой цепи, можно получить с использованием подходящих способов, таких как отображение фагов (Katsube Y. et al., Int. J. Mol. Med., 1(5):863-868 (1998,или способов с использованием трансгенных животных, известных в технике и/или описанных в данном описании. Например, трансгенную мышь, содержащую функционально реаранжированный трансген тяжелой цепи иммуноглобулина человека, и трансген, содержащий ДНК из локуса легкой цепи иммуноглобулина человека, который может претерпевать функциональную реаранжировку, можно иммунизировать TNF человека или его фрагментом с целью добиться продуцирования антител. При необходимости,клетки, продуцирующие антитела, можно выделить, и можно получить гибридомы или другие иммортализованные клетки, продуцирующие антитела, как описывается в данном описании и/или известно в технике. С другой стороны, антитело, специфическую часть или вариант можно экспрессировать в подходящей клетке-хозяине с использованием кодирующей нуклеиновой кислоты или ее части. Изобретение также относится к антителам, антигенсвязывающим фрагментам, иммуноглобулиновым цепям и CDR, содержащим аминокислоты в последовательности, по существу, такой же, как аминокислотная последовательность, описанная в данном описании. Предпочтительно, такие антитела или антигенсвязывающие фрагменты и антитела, содержащие такие цепи или CDR, могут связываться с TNF человека с высокой аффинностью (например, КD меньше или равен примерно 10-9 М). Аминокислотные последовательности, по существу, такие же, как последовательности, описанные в данном описании,включают последовательности, содержащие консервативные аминокислотные замены, а также делеции и/или вставки аминокислот. Консервативной аминокислотной заменой называется замена первой аминокислоты второй аминокислотой с химическими и/или физическими свойствами (такими как, например,заряд, структура, полярность, гидрофобность/гидрофильность), подобными свойствам первой аминокислоты. Консервативные замены включают замену одной аминокислоты другой в пределах следующих групп: лизин (K), аргинин (R) и гистидин (Н); аспарагиновая кислота (D) и глутаминовая кислота (Е); аспаргин (N), глутамин (Q), серин (S), треонин (Т), тирозин (Y), К, R, Н, D и Е; аланин (А), валин (V),лейцин (L), изолейцин (I), пролин (Р), фенилаланин (F), триптофан (W), метионин (М), цистеин (С) и глицин (G); F, W и Y; С, S и Т. Аминокислотные коды Аминокислоты, составляющие антитела против TNF настоящего изобретения, часто обозначаются аббревиатурами. Обозначения аминокислот можно указать, обозначая аминокислоту первой буквой ее буквенного кода, тремя буквами ее кода, названия или трехнуклеотидными кодонами, что хорошо известно в технике (см. Alberts В. et al., Molecular Biology of The Cell, Third Ed., Garland Publishing, Inc, New Антитело против TNF настоящего изобретения может включать одну или несколько аминокислотных замен, делеций или дополнений из-за или природных мутаций или действий человека, описанных в данном описании. Конечно, число аминокислотных замен, которые может сделать специалист, зависит от многих факторов, включая указанные выше. Вообще говоря, число замен, вставок или делеций аминокислот для любого данного антитела против TNF, фрагмента или варианта не будет превышать 40, 30, 20, 19, 18, 17,16, 15, 14, 13, 12, 11, 10, 9, 8, 1, 6, 5, 4, 3, 2, 1, например 1-30 или любого интервала или величины в указанных пределах, как определено в данном описании. Аминокислоты в антителе против TNF настоящего изобретения, являющиеся необходимыми для функции, можно идентифицировать способами, известными в технике, такими как сайт-направленный мутагенез или аланинсканирующий мутагенез (см., например, Ausubel, см. выше, главы 8,15; Cunninghamand Wells, Science, 244:1081-1085 (1989. В последней процедуре вводят отдельные аланиновые мутации в каждый остаток в молекуле. Затем полученные мутантные молекулы проверяют на биологическую активность, такую как, например, нейтрализующую активность в отношении TNF, или другую активность. Сайты, критичные для связывания антитела, также можно идентифицировать методами структурного анализа, такими как кристаллизация, ядерный магнитный резонанс или протоаффинное мечение (Smith etal., J. Mol. Biol., 224:899-904 (1992), и de Vos et al., Science, 255:306-312 (1992. Антитела против TNF настоящего изобретения могут включать, но не ограничиваться перечисленным, по меньшей мере одну часть, последовательность или сочетание, выбранные из числа от 5 до всех последовательных аминокислот из по меньшей мере одной из SEQ ID NO: 1, 2, 3, 4, 5, 6. Антитело против TNF также, необязательно, может содержать полипептид по меньшей мере из одной из 70-100% последовательных аминокислот по меньшей мере из одной из SEQ ID NO: 7, 8. В одном варианте аминокислотная последовательность иммуноглобулиновой цепи или ее части(например, вариабельной области, CDR) имеет примерно 70-100% идентичность (например, 70, 71, 72,73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, или любой интервал или величину в указанных пределах) с аминокислотной последовательностью соответствующей цепи по меньшей мере одной из SEQ ID NO: 7, 8. Например, аминокислотную последователь- 19007005 ность вариабельной области легкой цепи можно сравнить с последовательностью SEQ ID NO: 8, или аминокислотную последовательность CDR3 тяжелой цепи можно сравнить с последовательностью SEQID NO: 7. Предпочтительно, определяют 70-100% идентичность аминокислот (т.е., 90, 91, 92, 93, 94, 95. 96, 97, 98, 99, 100, или любой интервал или величину в указанных пределах) с использованием подходящего вычислительного алгоритма, известного в технике. Примерами последовательностей вариабельных областей тяжелой и легкой цепи являются SEQ IDNO: 7, 8. Антитела настоящего изобретения или их специфические варианты могут содержать любое число последовательных аминокислотных остатков из антитела настоящего изобретения, где такое число выбирают из группы целых чисел, составляющих 10-100% от числа последовательных остатков в антителе против TNF. Необязательно, такая последовательность последовательных аминокислот имеет длину в по меньшей мере примерно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180,190, 200, 210, 220, 230, 240, 250 или больше аминокислот, или соответствует любому интервалу или величине в указанных пределах. Кроме того, число таких последовательностей может представлять любое целое число, выбранное из группы от 1 до 20, например, по меньшей мере 2, 3, 4 или 5. Как понятно специалистам в данной области техники, настоящее изобретение включает по меньшей мере одно биологически активное антитело настоящего изобретения. Биологически активные антитела имеют специфическую активность, составляющую по меньшей мере 20, 30 или 40%, предпочтительно по меньшей мере 50, 60 или 70% и наиболее предпочтительно по меньшей мере 80, 90 или 95-100%, от активности нативного (несинтетического), эндогенного или родственного и известного антитела. Способы оценки и количественного определения ферментативной активности и специфичности субстрата хорошо известны специалистам в данной области техники. В другом аспекте изобретение относится к человеческим антителам и антигенсвязывающим фрагментам, описанным в данном описании, модифицированным путем ковалентного присоединения органической группы. Такие модификации могут дать антитела или антигенсвязывающие фрагменты с улучшенными фармакокинетическими свойствами (например, с повышенным in vivo временем полужизни в сыворотке). Органическая группа может представлять собой линейную или разветвленную гидрофильную полимерную группу, остаток жирной кислоты или эфира жирной кислоты. В отдельных вариантах гидрофильная полимерная группа может иметь молекулярную массу от примерно 800 до примерно 120000 Да и может представлять собой полиалкиленгликоль (например, полиэтиленгилколь (PEG), полипропиленгликоль (PPG, углеводный полимер, полиаминокислоту или поливинипирролидон, и остаток жирной кислоты или эфира жирной кислоты может содержать от примерно восьми до примерно сорока атомов углерода. Модифицированные антитела и антигенсвязывающие фрагменты изобретения могут содержать одну или несколько органических групп, связанных ковалентно, прямо или косвенно с антителом. Каждая органическая группа, связанная с антителом или антигенсвязывающим фрагментом изобретения, может представлять собой, независимо, гидрофильную полимерную группу, остаток жирной кислоты или остаток эфира жирной кислоты. Используемый в данном описании термин "жирная кислота" охватывает монокарбоновые кислоты и дикарбоновые кислоты. Используемый в данном описании термин "гидрофильная полимерная группа" относится к органическому полимеру, который в воде растворяется лучше, чем в октане. Например, полилизин более растворим в воде, чем в октане. Таким образом, антитело, модифицированное ковалентным присоединением полилизина, охватывается изобретением. Гидрофильные полимеры, подходящие для модификации антител изобретения, могут являться линейными или разветвленными и включают, например, полиалкангликоли (например, PEG, монометоксиполиэтиленгликоль(mPEG), PPG и т.п.), углеводы (например, декстран, целлюлозу, олигосахариды, полисахариды и т.п.),полимеры гидрофильных аминокислот (например, полилизин, полиаргинин, полиаспартат и т.п.) и поливинилпирролидон. Предпочтительно, гидрофильный полимер, модифицирующий антитело изобретения,имеет молекулярную массу от примерно 800 до примерно 150000 Да как отдельный молекулярный объект. Например, можно использовать PEG5000 и PEG20000, где подстрочный индекс представляет собой среднюю молекулярную массу полимера в дальтонах. Гидрофильная полимерная группа может быть замещена одной-шестью алкильными группами или остатками жирных кислот или эфиров жирных кислот. Гидрофильные полимеры, замещенные остатком жирной кислоты или эфира жирной кислоты,можно получить с использованием подходящих способов. Например, полимер, содержащий аминогруппу, можно ввести в реакцию присоединения с карбоксилат-ионом жирной кислоты или эфира жирной кислоты, а активированный карбоксилатион (например, активированный N,N-карбонилдиимидазолом) жирной кислоты или эфира жирной кислоты можно ввести в реакцию присоединения с гидроксильной группой полимера. Жирные кислоты и эфиры жирных кислот, подходящие для модификации антител, могут быть насыщенными или могут содержать одну или несколько ненасыщенных связей. Жирными кислотами, подходящими для модификации антител изобретения, являются, например, ионы н-додеканоат (C12, лаурат),н-тетрадеканоат (C14, миристат), н-октадеканоат (C18, стеарат), н-эйкозаноат (С 20, арахидат), н-докозаноат- 20007005 кислота, октадекандикарбоновая кислота, докозандикарбоновая кислота, и т.п. Подходящими эфирами жирных кислот являются моноэфиры дикарбоновых кислот, содержащие линейную или разветвленную низшую аликильную группу. Низшая аликильная группа может содержать от одного до примерно двенадцати, предпочтительно от одного до примерно шести атомов углерода. Модифицированные человеческие антитела и антигенсвязывающие фрагменты можно получить с использованием подходящих способов, таких как взаимодействие с одним или несколькими модифицирующими агентами. Используемый в данном описании термин "модифицирующий агент" относится к подходящей органической группе (например, гидрофильному полимеру, жирной кислоте, эфиру жирной кислоты), содержащей активирующую группу. "Активирующая группа" представляет собой химическую группу или функциональную группу, которая может, в подходящих условиях, взаимодействовать с другой химической группой, посредством чего образуется ковалентная связь между модифицирующим агентом и другой химической группой. Например, аминореактивными активирующими группами являются электрофильные группы, такие как тозилат, мезилат, галоген (хлор, бром, фтор, йод), Nгидроксисукцинимидилэфиры (NHS), и т.п. Активирующие группы, которые могут взаимодействовать с тиолами, включают, например, малеимид, йодацетил, акрилоил, пиридилдисульфиды, тиол 5-тиол-2 нитробензойной кислоты (TNB-тиол), и т.п. Альдегидная функциональная группа может соединяться с амин- или гидразидсодержащими молекулами, а азидогруппа может реагировать с группой трехвалентного фосфора с образованием фосфорамидатных или фосфоримидных связей. Подходящие способы введения активирующих групп в молекулы известны в технике (см., например, Hermanson G.T., BioconjugateTechniques. Academic Press: San Diego, CA (1996. Активирующая группа может соединяться с органической группой непосредственно (например, гидрофильным полимером, жирной кислотой, эфиром жирной кислоты) или через линкерную группу, например двухвалентную группу C1-C12, где один или несколько атомов углерода могут быть заменены гетероатомом, таким как атом кислорода, азота или серы. Подходящими линкерными группами являются, например, тетраэтиленгликоль, -(СН 2)3-, -NH-(CH2)6-NH-,-(CH2)2-NH- и -CH2-O-CH2-CH2-O-CH2-CH2-O-CH-NH-. Модифицирующие агенты, содержащие линкерную группу, можно получить, например, взаимодействием моно-Вос-алкилдиамина (например, моноВос-этилендиамина, моно-Вос-диаминогексана) с жирной кислотой в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC), с образованием амидной связи между свободным амином и карбоксилат-ионом жирной кислоты. Защитную группу Воc можно удалить из продукта обработкой трифторуксусной кислотой (ТФК), воздействующей на первичный амин, который может соединяться с другим описанным карбоксилат-ионом или может взаимодействовать с малеиновым ангидридом, и полученный продукт циклизуют, и получают активированное малеимидопроизводное жирной кислоты (см., например, Thompson et al., WO 92/16221, включенную в данное описание в качестве ссылки). Модифицированные антитела изобретения можно получить взаимодействием человеческого антитела или антигенсвязывающего фрагмента с модифицирующим агентом. Например, органические группы можно присоединить к антителу неспецифически, используя аминореактивный модифицирующий агент, например, эфир NHS или PEG. Модифицированные человеческие антитела или антигенсвязывающие фрагменты также можно получить восстановлением дисульфидных связей (например, внутрицепных дисульфидных связей) антитела или антигенсвязывающего фрагмента. Затем восстановленные антитело или антигенсвязывающий фрагмент можно ввести во взаимодействие с тиолреактивным модифицирующим агентом и получить модифицированное антитело изобретения. Модифицированные человеческие антитела и антигенсвязывающие фрагменты, содержащие органическую группу, связанную со специфическими сайтами антитела настоящего изобретения, можно получить с использованием подходящих способов, таких как обратный протеолиз (Fisch et al., Bioconjugate Chem., 3:147-153 (1992); Werlen et al.,Bioconjugate Chem., 5:411-417 (1994); Kumaran et al., Protein Sci., 6 (10):2233-2241 (1997); Itoh et al., Bioorg. Chem., 24(1):59-68 (1996); Capellas et al., Biotechnol. Bioeng., 56 (4):456-463 (1997, и способов, описанных в Hermanson G.T., Bioconjugate Techniques. Academic Press: San Diego, CA (1996). Антиидиотипические антитела к композициям антитела против TNF Кроме моноклональных или химерных антител против TNF настоящее изобретение также относится к антиидиотипическим (анти-Id) антителам, специфическим для таких антител изобретения. Анти-Id антитело является антителом, узнающим уникальные детерминанты, обычно ассоциированные с антигенсвязывающим участком другого антитела. Анти-Id можно получить иммунизацией животного того же вида и генетического типа (например, мышиного штамма), что и источник Id-антитела, антителами или их СDR-содержащими участками. Иммунизированное животное будет узнавать и реагировать на идиотипические детерминанты иммунизирующего антитела и продуцировать анти-Id антитела. Анти-Id антитела также можно использовать в качестве "иммуногена" для индукции иммунной реакции у другого животного, продуцирующего так называемые антитела против анти-Id. Композиции антител против TNF Настоящее изобретение также относится по меньшей мере к одной композиции антител противTNF, содержащей по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть или по меньшей мере семь или больше его антител против TNF, описанных в данном описании и/или известных в технике, которые образуют компози- 21007005 ции, смесь или форму, не встречающиеся в природе. Такие композиции содержат не встречающиеся в природе композиции, содержащие по меньшей мере один или два полноразмерных делегированных по С- и/или N-концу варианта, домена, фрагмента или специфических варианта аминокислотной последовательности антитела против TNF, выбранной из группы, состоящей из 70-100% последовательных аминокислот SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, или их специфических фрагментов, доменов или вариантов. Предпочтительные композиции антител против TNF включают по меньшей мере один или два полноразмерных фрагмента, домена или варианта, таких как по меньшей мере один CDR или LBR, содержащие части последовательности антитела против TNF из 70-100% SEQ ID NO: 1, 2, 3, 4, 5, 6, или их специфических фрагментов, доменов или вариантов. Другие предпочтительные композиции содержат 40-99% по меньшей мере одной из 70-100% SEQ ID NO: 1, 2, 3, 4, 5, 6, или их специфических фрагментов, доменов или вариантов. Проценты таких композиций являются массовыми, объемными, концентрацией, молярностью или моляльностью жидких или сухих растворов, смесей, суспензий, эмульсий или коллоидных систем,известных в технике или описанных в данном описании. Композиции антител против TNF настоящего изобретения также могут включать по меньшей мере одну композицию или фармацевтическую композицию, содержащую по меньшей мере одно антитело против TNF, в любом количестве, подходящем и эффективном для клетки, ткани, органа, животного или пациента, нуждающихся в такой модуляции, обработке или лечении, также содержащую, необязательно,по меньшей мере один компонент, выбранный из числа по меньшей мере одного анатагониста (например, антитела против TNF или его фрагмента, растворимого рецептора TNF или его фрагмента, их слитых белков или антагониста TNF с небольшой молекулой, или другого антагониста), антиревматического средства (например, метотрексата, ауранофина, ауротиоглюкозы, азатиоприна, этанерцепта, золотонатрийтиомалата, гидроксихлорохинсульфата, лефлуномида, сульфазалзина), миорелаксанта, наркотического средства, нестероидного противовоспалительного лекарственного средства (NSAID), аналгетика, анестетика, седативного средства, местного анестетика, нервно-мышечного блокатора, антимикробного средства (например, аминогликозида, противогрибкого средства, антипаразитарного средства, противовирусного средства, карбапенема, цефалоспорина, фторхинолона, макролида, пенициллина, сульфонамида, тетрациклина, другого антимикробного средства), антипсориатического средства, кортикостероида,анаболического стероида, средства, связанного с диабетом, минерального вещества, питательного вещества, средства для щитовидной железы, витамина, связанного с кальцием гормона, средства против диареи, противокашлевого средства, противорвотного средства, средства против язвы, слабительного, антикоагулянта, эритропоэтина (например, эпоэтина-альфа), филграстима (например, G-CSF, Neupogen), сарграмостима (GM-CSF, Leukine), средства для иммунизации, иммуноглобулина, иммуносупрессора (например, базиликсимаба, циклоспорина, даклицумаба), гормона роста, гормонзаменяющего лекарственного средства, модулятора эстрогенового рецептора, мидриатического средства, циклоплегического средства, алкилирующего агента, антиметаболита, ингибитора митоза, радиофармацевтического средства,антидепрессанта, антиманиакального средства, антипсихотического средства, анксиолитика, снотворного, симпатомиметического средства, стимулятора, донепезила, такрина, лекарственного средства против астмы, бета-агониста, стероида для ингаляции, ингибитора лейкотриена, метилксантина, кромолина,эпинерфина или аналога, дорназы-альфа (Pulmozyme), цитокина или антагониста цитокина. Примерами таких цитокинов являются любой из IL-1 - IL-23, и другие цитокины. Подходящие дозировки хорошо известны в технике. См., например. Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition, Appleton andLange, Stamford, CT (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, CA (2000), включенные в данное описание в качестве ссылок. Такие противораковые или противоинфекционные средства также могут включать молекулы токсина, ассоциированные, связанные, введенные в состав или вводимые по меньшей мере с одним антителом настоящего изобретения. Токсин, необязательно, может действовать как селективно убивающий патологическую клетку или ткань. Патологическая клетка может являться раковой клеткой или другой клеткой. Такие токсины могут представлять собой очищенные токсины или рекомбинантные токсины,или другие, или фрагменты, содержащие по меньшей мере один функциональный домен токсина, например, выбранный по меньшей мере из одного из числа рицина, дифтерийного токсина, токсина змеиного яда, или бактериальный токсин. Термин "токсин" также включает как эндотоксины, так и экзотоксины,продуцируемые любыми встречающимися в природе, мутантными или рекомбинантными бактериями или вирусами, которые могут вызвать любое патологическое состояние у человека или других млекопитающих, в том числе токсиновый шок, который может привести к гибели. К таким токсинам можно отнести, не ограничиваясь перечисленным, термолабильный энтеротоксин (LT) энтеротоксигенной Е. coli,термостабильный энтеротоксин (ST) , цитотоксин Shigella, энтеротоксины Aeromonas, токсин-1 токсического шока (TSST-1), стафилококковый энтеротоксин А (SEA), В (SEB) или С (SEC), стрептококковые энтеротоксины и т.п. К таким бактериям относятся, но не ограничиваются перечисленным, штаммы видов энтеротоксигенной Е. coli (ETEC), энтерогеморрагической Е. coli (например, штаммы серотипа 0157:Н 7), вид Staphylococcus (например, Staphylococcus aureus, Staphylococcus pyogenes), вид ShigellaCo., Boston (1990); Evans et al., eds., Bacterial Infections of Humans: Epidemiology and Control, 2d Ed., pp. 239-254, Plenum Medical Book Co., New York (1991); Mandell et al., Principles and Practice of Infectious Diseases, 3d Ed., Churchill Livingstone, New York (1990); Berkow et al., eds., The Merck Manual. 16th edition,Merck and Co., Rahway, N.J., 1992; Wood et al., FEMS Microbiology Immunology, 76:121-134 (1991); Marrack et al., Science, 248:705-711 (1990), включенные в данное описание в качестве ссылок. Составы, композиции или комбинации антител против TNF настоящего изобретения также могут содержать по меньшей мере одно из любых подходящих вспомогательных веществ, таких как разбавитель, связующее вещество, стабилизатор, буферы, соли, липофильные растворители, консервант, адъювант или подобное вещество. Предпочтительны фармацевтически приемлемые вспомогательные вещества. Примеры, не являющиеся ограничительными, и способы получения таких стерильных растворов хорошо известны в технике, например, из Gennaro, Ed., Remington's Pharmaceutical Sciences, 18th Edition,Mack Publishing Co. (Easton, PA), 1990 и других источников. Фармацевтически приемлемые носители можно выбрать обычным образом, чтобы они подходили для способа введения, по растворимости и/или устойчивости композиции антител против TNF, фрагментов или вариантов, как хорошо известно в технике или описывается в данном описании. К фармацевтическим наполнителям и добавкам, полезным в композиции настоящего изобретения,относятся, но не ограничиваются перечисленным, белки, пептиды, аминокислоты, липиды и углеводы(например, сахара, включая моносахариды, ди-, три-, тетра- и олигосахариды; дериватизированные сахара, такие как альдиты, альдоновые кислоты, этерифицированные сахара и т.п.; и полисахариды или полимерные сахара), которые могут присутствовать по отдельности или в сочетании, при содержании одного или в сочетании 1-99,99 мас.% или об.%. Примерами белков-эксципиентов являются сывороточный альбумин, такой как сывороточный альбумин человека (HSA), рекомбинантный альбумин человека(rНА), желатин, казеин и т.п. Характерными представителями аминокислотных компонентов и/или антител, которые могут функционировать в буфере, являются аланин, глицин, аргинин, бетаин, гистидин,глутаминовая кислота, аспарагиновая кислота, цистеин, лизин, лейцин, изолейцин, валин, метионин, фенилаланин, аспартам и т.п. Одной из предпочтительных аминокислот является глицин. Наполнители-углеводы, подходящие для применения в изобретении, включают, например, моносахариды, такие как фруктоза, мальтоза, галактоза, глюкоза, D-манноза, сорбоза и т.п.; дисахариды, такие как лактоза, сахароза, трегалоза, целлобиоза и т.п.; полисахариды, такие как рафиноза, мелезитоза, мальтодекстрины, декстраны, крахмалы и т.п.; и альдиты, такие как маннит, ксилит, мальтит, лактит, ксилитсорбит (глюцитол), миоинозит и т.п. Предпочтительными углеводными наполнителями для применения в настоящем изобретении являются маннит, трегалоза и рафиноза. Композиции антител против TNF также могут включать буфер или агент для доводки рН, обычно,буфер представляет собой соль, полученную из органической кислоты или основания. Характерные буферы включают соли органических кислот, такие как соли лимонной кислоты, аскорбиновой кислоты,глюконовой кислоты, угольной кислоты, винной кислоты, янтарной кислоты, уксусной кислоты или фталевой кислоты; трис, гидрохлорид трометамина, или фосфатные буферы. Предпочтительными буферами для применения в настоящем изобретении являются соли органических кислот, такие как цитраты. Кроме того, композиции антител против TNF изобретения могут включать полимерные наполнители/добавки, такие как поливинилпирролидоны, фиколлы (полисахариды), декстраты (например, циклодекстрины, такие как 2-гидроксипропилциклодекстрин), полиэтиленгликоли, отдушки, антимикробные средства, подсластители, антиоксиданты, антистатики (например, полисорбаты, такие как твин 20 и твин 80), липиды (например, фосфолипиды, жирные кислоты), стероиды (например, холестерин) и хелатообразующие агенты (например, ЭДТК). Такие и другие известные фармацевтические наполнители и/или добавки, подходящие для применения в композициях антител против TNF, частей или вариантов по настоящему изобретению, известны в технике, например, перечисляются в "Remington: The SciencePractice of Pharmacy", 19th ed., WilliamsWilliams (1995), и в "Physician's Desk Reference", 52nd ed., Medical Economics, Montvale, NJ (1998),включенных в данное описание в качестве ссылок. Предпочтительными носителями или наполнителями являются углеводы (например, сахариды и альдиты) и буферы (например, цитратный) и полимерные вещества. Композиции Как отмечалось выше, изобретение относится к устойчивым композициям, представляющим собой,предпочтительно, фосфатный буфер с физиологическим раствором или выбранной солью, а также к стабилизированным растворам и композициям, содержащим консервант, а также к стабилизированным растворам для многократного применения, подходящим для фармацевтического или ветеринарного применения, содержащим по меньшей мере одно антитело против TNF в фармацевтически приемлемой компо- 23007005 зиции. Стабилизированные композиции содержат по меньшей мере один известный консервант или, необязательно, выбранный из группы, состоящей из по меньшей мере одного из числа фенола, м-крезола,п-крезола, о-крезола, хлоркрезола, бензилового спирта, нитрита фенилртути, феноксиэтанола, формальдегида, хлорбутанола, хлорида магния (например, гексагидрата), алкилпарабена (например, метил-, этилпропил-, бутилпарабена и т.п.), хлорида бензалкония, хлорида бензотония, дегидроацетата натрия и тимеросала, или их смесей, в водном разбавителе. Можно использовать любую концентрацию или смесь,как известно в технике, такую как 0,001-5%, или в любом интервале или любой величины в указанных пределах, такую как, например, 0,001, 0,003, 0,005, 0,009, 0,01, 0,02, 0,03, 0,05, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5,0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1,3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,3, 4,5, 4,6, 4,7, 4,8, 4,9, или в любом интервале или любой величины в указанных пределах. Примеры, не являющиеся ограничительными, включают отсутствие консерванта, 0,1-2% м-крезола (например, 0,2, 0,3, 0,4, 0,5, 0,9, 1,0%), 0,1-3% бензилового спирта (например,0,5, 0,9, 1,1, 1,5, 1,9, 2,0, 2,5%), 0,001-0,5% тимеросала (например, 0,005, 0,01%), 0,001-2,0% фенола (например, 0,05, 0,25, 0,28, 0,5, 0,9, 1,0%), 0,0005-1,0% алкилпарабена(ов) (например, 0,00075, 0,0009, 0,001,0,002, 0,005, 0,0075, 0,009, 0,01, 0,02, 0,05, 0,075, 0,09, 0,1, 0,2, 0,3, 0,5, 0,75, 0,9, 1,0%) и т.п. Как отмечалось выше, изобретение относится к изделию, содержащему упаковку и по меньшей мере один флакон, содержащий раствор по меньшей мере одного антитела против TNF с описанными ранее буферами и/или консервантами, необязательно, в водном разбавителе, где указанная упаковка содержит этикетку, на которой указывается, что такой раствор можно хранить в течение 1, 2, 3, 4, 5, 6, 9, 12, 18, 20,24, 30, 36, 40, 48, 54, 60, 66, 72 ч или более. Изобретение также относится к изделию, содержащему упаковку, первый флакон, содержащий лиофилизованное по меньшей мере одно антитело против TNF, и второй флакон, содержащий водный разбавитель описанного ранее буфера и/или консерванта, где указанная упаковка содержит этикетку, которая инструктирует пациента, как восстановить по меньшей мере одно антитело против TNF в водном разбавителе с образованием раствора, который можно хранить в течение двадцати четырех часов или более. По меньшей мере одно антитело против TNF согласно изобретению можно получить рекомбинантными методами, в том числе, из клеток млекопитающего или трансгенных препаратов, или можно выделить в чистом виде из других биологических источников, как описывается в данном описании или известно в технике. Содержание по меньшей мере одного антитела против TNF в продукте настоящего изобретения включает количества, дающие, после восстановления в случае влажной/сухой системы, концентрации от примерно 1,0 мкг/мл до примерно 1000 мг/мл, хотя рабочими являются и более низкие и более высокие концентрации, в зависимости от предполагаемого носителя при доставке, например составы растворов будут отличаться от чрескожного пэтча, будут разными для легочного, чресслизистого или осмотического введения или введения с микронасосом. Предпочтительно, водный разбавитель, необязательно, также содержит фармацевтически приемлемый консервант. Предпочтительными консервантами являются консерванты, выбранные из группы, состоящей из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, алкилпарабена(метил-, этил-пропил-, бутилпарабена и т.п.), хлорида бензалкония, хлорида бензотония, дегидроацетата натрия и тимеросала или их смесей. Концентрация консерванта, используемого в композиции, является концентрацией, достаточной для получения антимикробного действия. Такие концентрации зависят от выбранного консерванта и легко определяются специалистом в данной области техники. Другие наполнители, например агенты для придания изотоничности, буферы, антиоксиданты, усилители консервантов, можно, необязательно и предпочтительно, добавлять к разбавителю. Агент для придания изотоничности, такой как глицерин, обычно используют в известных концентрациях. Физиологически переносимый буфер, предпочтительно, добавляют для обеспечения улучшенного регулирования рН. Композиции могут иметь рН в широком интервале, например, от примерно рН 4 до примерно рН 10,и предпочтительные интервалы составляют от примерно рН 5 до примерно рН 9, и наиболее предпочтителен интервал от примерно 6,0 до примерно 8,0. Предпочтительно, композиции настоящего изобретения имеют рН от примерно 6,8 до примерно 7,8. Предпочтительными буферами являются фосфатные буферы, наиболее предпочтителен натрийфосфатный, в частности, забуференный фосфатом физиологический раствор (PBS). В составы или композиции для уменьшения агрегации можно добавлять, необязательно, другие добавки, такие как фармацевтически приемлемые солюбилизаторы, подобные твину 20 (полиоксиэтиленPEG (полиэтиленгликоль), или неионные поверхностно-активные вещества, такие как полисорбат 20 или 80 или полоксамер 184 или 188, полиолы Pluronic, другие блоксополимеры и хелатообразователи, такие как ЭДТК и EGTA. Такие добавки особенно полезны, если для введения композиции используют насос или пластиковый контейнер. Присутствие фармацевтически приемлемого поверхностно-активного вещества уменьшает склонность белка к агрегации.- 24007005 Композиции настоящего изобретения можно получить способом, включающим смешивание по меньшей мере одного антитела против TNF и консерванта, выбранного из группы, состоящей из фенола,м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, алкилпарабена (метил-, этил- пропил-,бутилпарабеена и т.п.), хлорида бензалкония, хлорида бензотония, дегидроацетата натрия и тимеросала,или их смесей, в водном разбавителе. Смешивание по меньшей мере одного антитела против TNF и консерванта в водном разбавителе осуществляют с использованием обычных процедур растворения и перемешивания. Для того, чтобы получить подходящую композицию, например, отмеренное количество по меньшей мере одного антитела против TNF в забуференном растворе соединяют с нужным консервантом в забуференном растворе в количествах, достаточных для обеспечения нужных концентраций белка и консерванта. Специалист в данной области техники может знать варианты такого способа. Например,порядок добавления компонентов, используются ли дополнительные добавки, температура и рН при получении композиции являются, факторами, которые можно оптимизировать в отношении концентрации и используемого способа введения. Заявляемые композиции можно предоставить пациентам в виде прозрачных растворов или двух флаконов, в том числе флакона с лиофилизованным по меньшей мере одним антителом против TNF, которое восстанавливают с помощью второго флакона, содержащего воду, консервант и/или водный разбавитель. Любой из флаконов - единственный с раствором или один из двух, в котором требуется восстановление, можно использовать повторно несколько раз, и его содержимое может быть достаточным для однократного или нескольких циклов лечения пациента и таким образом может обеспечить более удобный режим лечения, чем доступные в настоящее время. Заявляемые изделия полезны для введения в течение периода от немедленного до двадцати четырех часов или более. Соответственно, заявляемые изделия предлагают пациенту значительные преимущества. Композиции изобретения могут безопасно храниться при температурах от примерно 2 до примерно 40 С и сохранять биологическую активность белка в течение длительных периодов времени, причем на этикетке на упаковке указывается, что раствор может храниться и/или использоваться на протяжении 6,12, 18, 24, 36, 48, 72 или 96 ч или более. Если используют содержащий консервант разбавитель, на такой метке могут быть указаны 1-12 месяцев, полгода, полтора года и/или два года. Растворы, содержащие по меньшей мере одно антитело против TNF по изобретению, можно получить способом, включающим смешивание по меньшей мере одного антитела с водным разбавителем. Смешивание осуществляют с использованием обычных процедур растворения и перемешивания. Для того, чтобы получить подходящее разбавление, например, отмеренное количество по меньшей мере одного антитела в воде или буфере соединяют в количествах, достаточных для предоставления белка и,необязательно, консерванта или буфера в нужных концентрациях. Специалист в данной области техники может знать варианты такого способа. Например, порядок добавления компонентов, используются ли дополнительные добавки, температура и рН при получении композиции являются факторами, которые можно оптимизировать в отношении концентрации и используемого способа введения. Заявляемые продукты можно предоставить пациентам в виде прозрачных растворов или двух флаконов, в том числе флакона с лиофилизованным по меньшей мере одним антителом против TNF, которое восстанавливают с помощью второго флакона, содержащего водный разбавитель. Любой из флаконов единственный с раствором или один из двух, в котором требуется восстановление, можно использовать повторно несколько раз, и его содержимое может быть достаточным для однократного или нескольких циклов лечения пациента и таким образом обеспечивает более удобный режим лечения, чем доступные в настоящее время. Заявляемые продукты можно предоставить пациентам косвенно, обеспечивая аптеки, клиники или другие такие учреждения и объекты прозрачными растворами или двумя флаконами, в том числе флаконом с лиофилизованным по меньшей мере одним антителом против TNF, которое восстанавливают с помощью второго флакона, содержащего водный разбавитель. В таком случае прозрачный раствор может находиться в емкости до одного литра и даже большей, из которой более маленькие порции раствора по меньшей мере одного антитела можно брать один или несколько раз и переносить в меньшие флаконы для обеспечения покупателей аптеки или пациентов клиники. Известные устройства, содержащие такие системы из отдельных флаконов, включают пэн-шприцы для доставки раствора, такие как BD Pens, BD Autojector, Humaject, NovoPen, B-DPen, AutoPen иBecton Dickensen (Франклин-Лэйкс, Нью-Джерси), www.bectondickenson.com), Disetronic (Бурдорф,Швейцария, www.disetronic.com), Bioject, Портленд, Орегон (www.bioject.com), National Medical Products,Weston Medical (Петербург, Соединенное Королевство, www.weston-medical.com), Medi-Ject Corp. (Миннеаполис, Миннесота, www.mediject.com). Известные устройства с системой с двумя флаконами включают системы пэн-шприцов для восстановления лиофилизованного лекарственного средства в картрижде для доставки восстановленного раствора, такие как HumatroPen. Заявляемые продукты включают упаковку. Упаковка обеспечивает, кроме информации, требуемой проверяющими органами, условия, в которых продукт можно использовать. Упаковка настоящего изо- 25007005 бретения в случае двух флаконов с сухим/влажным продуктом предоставляет инструкции для пациента по восстановлению раствора по меньшей мере одного антитела против TNF в водном разбавителе и по применению раствора в течение периода в 2-24 ч или более. В случае одного флакона с продуктомраствором, этикетка указывает, что такой раствор можно использовать в течение периода в 2-24 ч или более. Заявляемые продукты полезны для применения в качестве фармацевтических продуктов для людей. Композиции настоящего изобретения можно получить способом, включающим смешивание по меньшей мере одного антитела против TNF и выбранного буфера, предпочтительно фосфатного буфера,содержащего физиологический раствор или выбранную соль. Смешивание по меньшей мере одного антитела против TNF и буфера в водном разбавителе осуществляют с использованием обычных процедур растворения и перемешивания. Для того, чтобы получить подходящую композицию, например, отмеренное количество по меньшей мере одного антитела в воде или буфере соединяют с нужным буферирующим агентом в воде в количествах, достаточных для предоставления белка и буфера в нужных концентрациях. Специалист в данной области техники может знать варианты такого способа. Например, порядок добавления компонентов, используются ли дополнительные добавки, температура и рН при получении композиции, являются факторами, которые можно оптимизировать в отношении концентрации и используемого способа введения. Заявляемые устойчивые или стабилизированные композиции можно предоставить пациентам в виде прозрачных растворов или в виде двух флаконов, включающих флакон с лиофилизованным по меньшей мере одним антителом против TNF, которое восстанавливают с помощью второго флакона, содержащего консервант или буфер и наполнители в водном разбавителе. Любой из флаконов - единственный с раствором или один из двух, в котором требуется восстановление до раствора, можно использовать повторно несколько раз, и его содержимое может быть достаточным для однократного или нескольких циклов лечения пациента и таким образом обеспечивает более удобный режим лечения, чем доступные в настоящее время. По меньшей мере одного типа антитела против TNF в виде или устойчивых или стабилизированных композиций или растворов, описанных в данном описании, можно ввести пациенту согласно настоящему изобретению с помощью различных способов доставки, включая SC или IM инъекцию; чрескожный, легочный, чресслизистый, с помощью имплантата, осмотического насоса, картриджа, микронасоса или другие способы, хорошо известные в данной области. Терапевтические применения Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного связанного с TNF заболевания, в клетке, ткани, органе, у животного или пациента, известному в технике или описанному в данном описании, с использованием по меньшей мере одного двухинтегринового антитела настоящего изобретения. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного связанного с TNF заболевания, в клетке, ткани, органе, у животного или пациента, в том числе, но без ограничения, по меньшей мере одного заболевания из числа ожирения, заболевания иммунной системы,сердечно-сосудистого заболевания, инфекционной болезни, злокачественной болезни или нервной болезни. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного иммунного заболевания в клетке, ткани, органе, у животного или пациента, в том числе, но без ограничения, по меньшей мере одного заболевания из числа ревматоидного артрита, ювенильного ревматоидного артрита, системного начального ювенильного ревматоидного артрита, псориатического артрита,анкилозирующего спондилита, язвы желудка, серонегативной артропатии, остеоартрита, воспалительного заболевания кишечника, язвенного колита, системной красной волчанки, антифосфолипидного синдрома, иридоциклита/увеита/оптического неврита, идиопатического пневмофиброза, системного васкулита/грануломатоза Вегенера, саркоидоза, орхита/обратных процедур вазэктомии, аллергических/атопических болезней, астмы, аллергического ринита, экземы, аллергического контактного дерматита, аллергического конъюнктивита, пневмонита при гиперчувствительности, трансплантатов, отторжения трансплантатов органов, болезни "трансплантат против хозяина", синдрома системной воспалительной реакции, грамположительного сепсиса, грамотрицательного сепсиса, культуроотрицательного сепсиса, грибкового сепсиса, нейтропенической лихорадки, уросепсиса, менингококцемии, травмы/кровоизлияния,ожогов, воздействия ионизирующего излучения, острого панкреатита, респираторного дистресссиндрома взрослых, алкогольного гепатита, хронических воспалительных патологий, болезни Крона,серповидно-клеточной анемии, нефроза, атопических болезней, аллергических реакций, сенной лихорадки, круглогодичного ринита, конъюнктивита, эндометриоза, крапивницы, системной анафилаксии, дерматита, пернициозной анемии, гемолитической болезни, тромбоцитопении, отторжения трансплантата любого органа или ткани, отторжения трансплантата почек, отторжения трансплантата сердца, отторжения трансплантата печени, отторжения трансплантата поджелудочной железы, отторжения трансплантата легкого, отторжения трансплантата костного мозга (ВМТ), отторжения аллотрансплантата кожи, отторжения хрящевого трансплантата, отторжения костного трансплантата, отторжения трансплантата- 26007005 тонкой кишки, отторжения имплантата плодного тимуса, отторжения трансплантата паращитовидной железы, отторжения ксенотрансплантата любого органа или ткани, отторжения аллотрансплантата, антирецепторных аллергически реакций, болезни Грейвса, болезни Рейно, инсулинрезистентного диабета по типу В, тяжелой псевдопаралитической миастении, опосредуемой антителами цитотоксичности, аллергических реакций по III типу, синдрома POEMS (сочетания полинейропатии, спланхномегалии, эндокринопатии, моноклональной гаммапатии и патологии кожи), полинейропатии, спланхномегалии, эндокринопатии, моноклональной гаммапатии, синдрома изменений кожи, пузырчатки, склеродермии, смешанной болезни соединительной ткани, идийпатической болезни Аддисона, сахарного диабета, хронического активного гепатита, первичного билиарного цирроза, витилиго, васкулита, синдрома постинфарктной кардиотомии, гипертензии по типу IV, гранулем, вызванных внутриклеточными паразитами, чувствительности к лекарственному средству, болезни обмена веществ/идиопатического заболевания, болезни Вильсона, гемохроматоза, дефицита альфа-1-ингибитора трипсина, диабетической ретинопатии, тиреоидита Хасимото, остеопороза, развития оси гипоталамуса-гипофиза-надпочечников, тиреоидита, энцефаломиелита, кахексии, муковисцидоза, хронической болезни легких новорожденных, хронической обструктивной болезни легких (ХОБЛ), наследственного гематофагоцитарного лимфогистиоцитоза, кожных состояний, псориаза, алопеции, нефротического синдрома, нефрита, гломерулонефрита, острой почечной недостаточности, гемодиализа, уремии, отравлении, преэклампсии, при терапии okt3, цитокиновой терапии, химиотерапии, лучевой терапии (например, включая лечение тоастении, анемии, кахексии и т.п.), хронической салицилатной интоксикации и т.п. См., например, Merck Manual, 12th-17th Editions,MerckCompany, Rahway, NJ (1972, 1977, 1982, 1987, 1992, 1999); Pharmacotherapy Handbook, Wells etal., eds., Second Edition, Appleton and Lange, Stamford, Conn. (1998, 2000), включенные в данное описание в качестве ссылок. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одного сердечно-сосудистого заболевания в клетке, ткани, органе, у животного или пациента, в том числе, но без ограничения, по меньшей мере одного заболевания из числа синдрома остановки сердца, инфаркта миокарда, застойной сердечной недостаточности, инсульта, ишемического удара, кровоизлияния, артериосклероза, атеросклероза, рестеноза, диабетической атеросклеротической болезни, гипертензии, артериальной гипертензии, реноваскулярной гипертензии, синкопе, шока, сифилиса сердечно-сосудистой системы, сердечной недостаточности, легочного сердца, первичной легочной гипертензии, сердечных аритмий, эктопических сокращений предсердий, трепетания предсердий, фибрилляции предсердий (непрерывной или пароксизмальной), постперфузионного синдрома, воспалительной реакции на аппарат искусственного кровообращения, хаотической или мультифокальной предсердной тахикардии, регулярной тахикардии узких QRS, специфических аритмий, фибрилляции желудочков, аритмии пучка Гиса,атрио-вентрикулярной блокады, блокады ножки пучка Гиса, миокардиальных ишемических нарушений,ишемической болезни сердца, стенокардии, кардиомиопатии, дилятационной застойной кардиомиопатии, рестриктивной кардиомиопатии, пороков клапанов сердца, эндокардита, болезни перикарда, кардиальных опухолей, аортальных и периферических аневризм, рассечения аорты, воспаления аорты, закупорки брюшной аорты и ее ветвей, периферических сосудистых нарушений, закупорки артерий, атеросклероза периферических сосудов, облитерирующего тромбоангиита, функциональных нарушений периферических артерий, феномена и болезни Рейно, акроцианоза, эритромелалгим, болезней вен, тромбоза вен, варикозной болезни вен, артериовенозного свища, лимфедемы, жирового отека, нестабильной стенокардии, постнасосного синдрома и т.п. Такой способ может, необязательно, включать введение эффективного количества композиции или фармацевтической композиции по меньшей мере одного антитела против TNF в клетку, ткань, орган, животному или пациенту, нуждающимся в таких модуляции, обработке или лечении. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одной инфекционной болезни в клетке, ткани, органе, у животного или пациента, в том числе, но без ограничения, по меньшей мере одной болезни из числа острой или хронической бактериальной инфекции, острого и хронического паразитарного или инфекционного процесса, в том числе, бактериальных, вирусных и грибковых инфекций, ВИЧ-инфекции/ВИЧ-невропатии, менингита, гепатита (А, В или С или подобного), септического артрита, перитонита, пневмонии, эпиглоттита, заражения Е. coli 0157:h7, гемолитического уремического синдрома/тромболитической тромбоцитопенической пурпуры, малярии, геморрагической лихорадки денге, лейшманиоза, лепры, токсического шока, стрептококкового миозита,газовой гангрены, заражения Mycobacterium tubercilosis, Mycobacterium avium intracellulare, пневмонииPneumocystis carnii, воспаления тазовых органов, орхита/эпидидимита, заражения Legionella, болезни Лайма, гриппа, заражения вирусом Эпстайна-Барр, угрожающего жизни гемафагоцитарного синдрома,угрожающего жизни энцефалита/асептического менингита и подобных болезней. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одной злокачественной болезни в клетке, ткани, органе, у животного или пациента, в том числе, но без ограничения, по меньшей мере одной болезни из числа лейкоза, острого лейкоза, острого лимфобластного лейкоза (ОЛЛ), В-клеточного, Т-клеточного или FAB ОЛЛ, острого миелоидного лейкоза (AML), хронического миелолейкоза (ХМЛ), хронического лимфолейкоза (ХЛЛ), волосато-клеточного лейкоза, миело- 27007005 диспластического синдрома (MDS), лимфомы, болезни Ходжкина, злокачественной лимфомы, неходжкинской лимфомы, лимфомы Беркитта, множественной лимфомы, саркомы Капоши, колоректальной карциномы, панкреатической карциномы, назофарингеальной карциномы, злокачественного гистиоцитоза, паранеопластического синдрома/гиперкальциемии злокачественной опухоли, солидных опухолей,аденокарцином, сарком, злокачественной меланомы, гемангиомы, метастазирующей опухоли, резорбции костей, связанной со злокачественной опухолью, боли в костях, связанной со злокачественной опухолью,и подобных болезней. Настоящее изобретение также относится к способу модуляции или лечения по меньшей мере одной нервной болезни в клетке, ткани, органе, у животного или пациента, в том числе, но без ограничения, по меньшей мере одной болезни из числа нейродегенеративных заболеваний, рассеянного склероза, мигрени, СПИД-ассоциированной деменции, демиелинизирующих болезней, таких как рассеянный склероз и острый поперечный миелит; экстрапирамидальных и мозжечковых расстройств, таких как повреждения кортикоспинальной системы; нарушений базальных ядер или мозжечковых расстройств; гиперкинетических двигательных расстройств, таких как хорея Гентингтона и старческая хорея; расстройств движения,вызванных лекарственным средством, таких как расстройства, вызванные лекарственными средствами,блокирующими допаминовые рецепторы ЦНС; гипокинетических двигательных расстройств, таких как болезнь Паркинсона; прогрессирующего надъядерного паралича; структурных повреждений мозжечка; спиномозжечковых дегенеративных состояний, таких как спинальная атаксия, атаксия Фридрайха, мозжечковокорковые дегенеративные состояния, дегенеративные состояния множества систем (Менцеля,Дижерина-Томаса, Ши-Драгера и Мачадо-Жозефа); системных расстройств (болезни Рефсума, абеталипопротеидемии, атаксии, телеангиэктазии и митохондриального многосистемного расстройства); демиелинизирующих серединных расстройств, таких как рассеянный склероз, острый поперечный миелит; и расстройств двигательных единиц, таких как нейрогенные мышечные атрофии (дегенерации клеток переднего рога, такой как боковой амиотрофический склероз, спинальная мышечная атрофия детей раннего возраста, юношеская спинальная мышечная атрофия); болезни Альцгеймера; синдрома Дауна в среднем возрасте; диффузной болезни тела Льюи; старческой деменции, ассоциированной с телом Льюи; синдрома Вернике-Корсакова; хронического алкоголизма; болезни Крейтцфельдта-Якоба; подострого склерозирующего панэнцефалита, болезни Халлеррордена-Шпаца и деменции боксеров, и подобных болезней. Такой способ может включать, необязательно, введение по меньшей мере одного антитела против TNF или специфической части или варианта в клетку, ткань, орган, животному или пациенту, нуждающимся в таких модуляции, обработке или лечении. См., например, Merck Manual, 16th Edition, MerckCompany,Rahway, NJ (1992). Любой способ настоящего изобретения может включать введение эффективного количества композиции, содержащей по меньшей мере одно антитело против TNF, в клетку, ткань, орган, животному или пациенту, нуждающимся в такой модуляции, обработке или терапии. Такой способ может, необязательно, также включать совместное введение или комбинированную терапию для лечения такого иммунного заболевания, где введение указанного по меньшей мере одного антитела против TNF, его специфической части или варианта, также сопровождается введением до, одновременно и/или после по меньшей мере одного активного компонента, выбранного из числа по меньшей мере одного антагониста (например,антитела против TNF или его фрагмента, растворимого рецептора TNF или его фрагмента, их слитых белков или антагониста TNF с небольшой молекулой, или другого антагониста), антиревматического средства (например, метотрексата, ауранофина, ауротиоглюкозы, азатиоприна, этанерцепта, золотонатрийтиомалата, гидроксихлорохинсульфата, лефлуномида, сульфазалзина), миорелаксанта, наркотического средства, нестероидного противовоспалительного лекарственного средства (NSAID), аналгетика, анестетика, седативного средства, местного анестетика, нервно-мышечного блокатора, антимикробного средства (например, аминогликозида, противогрибкого средства, антипаразитарного средства, противовирусного средства, карбапенема, цефалоспорина, фторхинолона, макролида, пенициллина, сульфонамида, тетрациклина, другого антимикробного средства), антипсориатического средства, кортикостероида,анаболического стероида, средства, связанного с диабетом, минерального вещества, питательного вещества, средства для щитовидной железы, витамина, связанного с кальцием гормона, средства против диареи, противокашлевого средства, противорвотного средства, средства против язвы, слабительного, антикоагулянта, эритропоэтина (например, эпоэтина-альфа), филграстима (например, G-CSF, Neupogen), сарграмостима (GM-CSF, Leukine), средства для иммунизации, иммуноглобулина, иммуносупрессора (например, базиликсимаба, циклоспорина, даклицумаба), гормона роста, гормонзаменяющего лекарственного средства, модулятора эстрогенового рецептора, мидриатического средства, циклоплегического средства, алкилирующего агента, антиметаболита, митотического ингибитора, радиофармацевтического средства, антидепрессанта, антиманиакального средства, антипсихотического средства, анксиолитика,снотворного, симпатомиметического средства, стимулятора, донепезила, такрина, лекарственного средства против астмы, бета-агониста, стероида для ингаляции, ингибитора лейкотриена, метилксантина,кромолина, эпинерфина или аналога, дорназы-альфа (Pulmozyme), цитокина или антагониста цитокина. Подходящие дозировки хорошо известны в технике. См., например, Wells et al., eds., Pharmacotherapymacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, CA (2000), включенные в данное описание в качестве ссылок. Антагонистами TNF, подходящими для композиций, комбинированной терапии, совместного введения, устройств и/или способов настоящего изобретения (также включающие в себя по меньшей мере одно антитело, его специфическую часть и вариант настоящего изобретения), являются, но не ограничиваются перечисленным, антитела против TNF, их антигенсвязывающие фрагменты и рецепторные молекулы, специфически связывающиеся с TNF; соединения, предотвращающие и/или ингибирующие синтезTNF, высвобождение TNF или его действие на клетки-мишени, такие как талидомид, тенидап, ингибиторы фосфодиэстеразы (например, пентоксифиллин и ролипрам), агонисты аденозиновых рецепторов А 2b и усилители аденозиновых рецепторов А 2b; соединения, предотвращающие и/или ингибирующие передачу сигнала рецепторами TNF, такие как ингибиторы митогенактивированной протеинкиназ (МАРкиназ); соединения, блокирующие и/или ингибирующие расщепление мембранного TNF, такие как ингибиторы металлопротеиназ; соединения, блокирующие и/или ингибирующие TNF-активность, такие как ингибиторы ангиотензин-превращающего фермента (АСЕ) (например, каптоприл); и соединения, блокирующие и/или ингибирующие продуцирование и/или синтез TNF, такие как ингибиторы МАР-киназ. В данном случае "антитело к фактору некроза опухоли", "антитело против TNF", "антитело противTNF-a" или фрагмент уменьшает, блокирует, ингибирует, отменяет или препятствует активности TNFin vitro, in situ и/или, предпочтительно, in vivo. Например, . подходящее антитело против TNF человека настоящего изобретения может связываться с TNF-, и к нему относятся антитела против TNF, их антигенсвязывающие фрагменты и их специфические мутанты или домены, специфически связывающиеся сTNF. Подходящее антитело против TNF или фрагмент также могут ослаблять, блокировать, отменять,препятствовать, предотвращать и/или ингибировать синтез РНК, ДНК или белка TNF, высвобождениеTNF, продуцирование и/или синтез TNF. Химерное антитело сА 2 состоит из антигенсвязывающей вариабельной области высокоаффинного нейтрализующего мышиного античеловеческого антитела против TNF- IgG1, обозначенного А 2, и константной области человеческого каппа-иммуноглобулина IgG1. Участок Fc человеческого IgG1 улучшает аллогенную эффекторную функцию антитела, повышает сывороточное время полужизни в кровотоке и уменьшает иммуногенность антитела. Авидность и специфичность антигенной детерминанты химерного антитела сА 2 происходят от вариабельной области мышиного антитела А 2. В отдельном варианте предпочтительным источником для нуклеиновых кислот, кодирующих вариабельную область мышиного антитела А 2 является гибридомная клеточная линия А 2. Химерное А 2 (сА 2) нейтрализует цитотоксическое действие как природного, так и рекомбинантного человеческого TNF- в зависимости от дозы. Из анализов связывания химерного антитела сА 2 и рекомбинантного человеческого TNF- вычислена константа аффинности химерного антитела сА 2, равная 1,04 х 1010 М-1. Предпочтительные способы определения специфичности и аффинности моноклональных антител методом конкурентного ингибирования можно найти в Harlow et al., Antibodies: A LaboratoryInterscience, New York (1987-2000); и Muller, Meth. Enzymol., 92:589-601 (1983), включенных в данное описание в качестве ссылок. В отдельном варианте мышиные моноклональные антитела А 2 получают с помощью клеточной линии, обозначенной с 134 А. Химерные антитела сА 2 получают с помощью клеточной линии, обозначенной с 168 А. В технике описаны другие примеры моноклональных антител против TNF, которые можно использовать в настоящем изобретении (см., например, патент США 5231024; Moller et al., Cytokine, 2(3):162169 (1990); заявка на патент США 07/943852 (зарегистрирована 11 сентября 1992 года); Rathjen et al.,международная публикацияWO 91/02078 (опубликована 21 февраля 1991); Rubin et al., публикация патента ЕРО 0218868 (опубликована 22 апреля 1987 года); Yone et al., публикация патента ЕРО 0288088 (опубликована 26 октября 1988 года); Liang et al., Biochem. Biophys. Res. Comm., 137:847-854al., Hybridoma, 6:489-507 (1987); и Hirai et al., J. Immunol. Meth., 95:57-62 (1987), включенные в данное описание в качестве ссылок. Рецепторные молекулы TNF Предпочтительными рецепторными молекулами TNF, полезными в настоящем изобретении, являются молекулы, связывающиеся с TNF- с высокой аффинностью (см., например, Feldmann et al., международная публикацияWO 92/07076 (опубликована 30 апреля 1992 г); Schall et al., Cell, 61:361-370(1990); и Loetsher et al., Cell, 61:351-359 (1990), включенные в данное описание в качестве ссылок) и, необязательно, обладающие низкой иммуногенностью. В частности, в настоящем изобретении полезны рецепторы клеточной поверхности TNF в 55 кДа (р 55 TNF-R) и 75 кДА (р 75 TNF-R). Укороченные формы таких рецепторов, содержащие внеклеточные домены (ECD) рецепторов или их функциональные- 29007005 части (см., например, Corcoran et al., Eur. J. Biochem., 223:840 (1994, также полезны в настоящем изобретении. Укороченные формы рецепторов TNF, содержащие ECD, обнаружены в урине и сыворотке в виде белков массой 20 и 40 кДа, ингибирующих связывание TNF- (Engelmann et al., J. Biol. Chem.,265:1531-1536 (1990. Мультимерные рецепторные молекулы TNF и гибридные иммунорецепторные молекулы TNF и их производные и фрагменты или части являются дополнительными примерами рецепторов молекул TNF, полезных в способах и композициях настоящего изобретения. Рецепторные молекулы TNF, которые можно использовать в изобретении, характеризуются своей способностью оказывать лечебное действие на пациентов длитeльнoе время с хорошим и даже превосходным облегчением симптомов и низкой токсичностью. Низкая иммуногенность и/или высокая аффинность, а также другие не указанные свойства, могут вносить вклад в достигаемые результаты лечения. Мультимерные рецепторные молекулы TNF, полезные в настоящем изобретении, содержат полную или функциональную часть ECD двух или большего числа рецепторов TNF, связанные через пептидные линкеры или другие непептидные связи, такие как полиэтиленгликоль (PEG). Мультимерные молекулы также могут содержать сигнальный пептид секретируемого белка для экспрессии мультимерной молекулы. Такие мультимерные молекулы и способы их получения описываются в заявке на патент США 08/437533 (зарегистрированной 9 мая 1995 года), включенной в данное описание в качестве ссылки. Гибридные иммунорецепторные молекулы TNF, полезные в способах и композициях настоящего изобретения, содержат по меньшей мере одну часть одной или нескольких молекул иммуноглобулинов и целиком или функциональную часть одного или нескольких рецепторов TNF. Такие гибридные иммунорецепторные молекулы можно собрать в виде мономеров или гетеро- или гомодимеров. Гибридные иммунорецепторные молекулы также могут быть одновалентными или многовалентными. Примером такой гибридной иммунорецепторной молекулы TNF является слитый белок рецептора TNF и IgG (рецепторTNF/IgG). Гибридные иммунорецепторные молекулы TNF и способы их получения известны в техникеUSA, 91:215-219 (1994); Butler et al., Cytokine, 6(6):616-623 (1994); Baker et al., Eur, J. Immunol., 24:20402048 (1994); Beutler et al., патент США 5447851; и заявка на патент США 08/442133 (зарегистрированная 16 мая 1995 г), все работы внесены в данное описание в качестве ссылок). Способы получения гибридных иммунорецепторных молекул можно также найти в Capon et al., патент США 5116964; Capon et al., патент США 5225538; и Capon et al., Nature, 337:525-531 (1989), все работы внесены в данное описание в качестве ссылок. Функциональный эквивалент, фрагмент или участок рецепторной молекулы TNF относится к части рецепторной молекулы TNF или части последовательности рецепторной молекулы TNF, кодирующей рецепторную молекулу TNF, имеющей достаточный размер и последовательности для того, чтобы походить на рецепторные молекулы TNF, которые можно использовать в настоящем изобретении (например,связывающиеся с TNF с высокой аффинностью и обладающие низкой иммуногенностью). Функциональный эквивалент рецепторной молекулы TNF также включает модифицированные рецепторные молекулыTNF, функционально похожие на рецепторные молекулы TNF, которые можно использовать в настоящем изобретении (например, связывающиеся с TNF с высокой аффинностью и обладающие низкой иммуногенностью). Например, функциональный эквивалент рецепторной молекулы TNF может содержать молчащий кодон или одну или несколько аминокислотных замен, делеций или присоединений (например, замену одной аминокислоты на другую аминокислоту; или замену кодона, кодирующего ту же самую или другую гидрофобную аминокислоту, на другой кодон, кодирующий гидрофобную аминокислоту). См. Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Assoc. and WileyInterscience, New York (1987-2000). Цитокины включают любой известный цитокин. См., например, CopewithCytokines.com. Антагонистами цитокинов являются, но не ограничиваются перечисленным, любое антитело, его фрагмент или миметик, любой растворимый рецептор, его фрагмент или миметик, любой низкомолекулярный антагонист или любое их сочетание. Терапевтическое лечение Любой способ настоящего изобретения может заключаться в способе лечения опосредуемого TNF расстройства, включающего введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно антитело против TNF, в клетку, ткань, орган, животному или пациенту, нуждающимся в таких модуляции, обработке или лечении. Такой способ также может заключаться, необязательно, в совместном введении или комбинированной терапии для лечения таких иммунных заболеваний, где введение указанного по меньшей мере одного антитела против TNF, его специфической части или варианта, также включает введение до, одновременно и/или после по меньшей мере одного активного компонента, выбранного из числа по меньшей мере одного антагониста TNF (например, но без ограничений, антитела против TNF или его фрагмента, растворимого рецептора TNF или его фрагмента, их слитых белков или антагониста TNF с небольшой молекулой), антиревматического средства (например, метотрексата, ауранофина, ауротиоглюкозы, азатиоприна, этанерцепта, золотонатрийтиомалата, гидроксихлорохинсульфата, лефлуномида, сульфазалзина), миорелаксанта, наркотическо- 30
МПК / Метки
МПК: C12N 15/13, A61K 39/395, G01N 33/50, C12N 5/10, C07K 16/42, G01N 33/577, A61P 37/00, C12N 15/79, C07K 16/24
Метки: против, антитела, способы, композиции, применения
Код ссылки
<a href="https://eas.patents.su/30-7005-antitela-protiv-tnf-kompozicii-sposoby-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела против tnf, композиции, способы и применения</a>
Предыдущий патент: Ненуклеозидные ингибиторы обратной транскриптазы как антагонисты пролиферации и индукторы дифференцировки клеток
Следующий патент: Устройство для волюметрических измерений расхода в системе для внутривенных вливаний
Случайный патент: Способ получения антистатических твердых уф-отверждаемых покрытий на оптических изделиях












