Способ получения диарилпиридинов, полезных в качестве ингибиторов cox-2
Номер патента: 2427
Опубликовано: 25.04.2002
Авторы: Джерена Линда, Ларсен Роберт Д., Россен Кай, Дэвис Ян В., Пай Филип Дж., Журне Мишель
Формула / Реферат
1. Способ получения соединений формулы 5
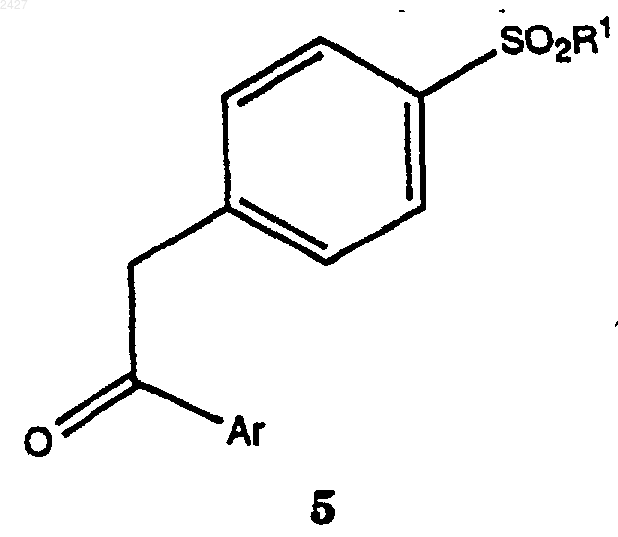
в которой R1 выбран из группы, включающей
(a) СН3,
(b) NH2,
(c) NНС(O)СF3,
(d) NНСН3; и
Аr представляет моно-, ди- или тризамещенный фенил или пиридинил (или его N-оксид), в которых заместители выбраны из группы, включающей
(a) водород,
(b) галоген,
(c) С1-4алкокси,
(d) С1-4алкилтио,
(e) CN,
(f) С1-4алкил,
(g) С1-4фторалкил;
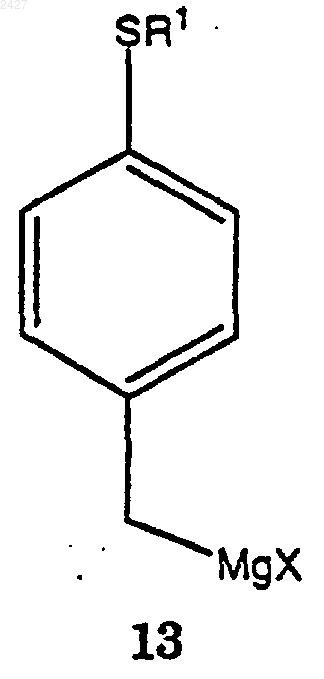
включающий взаимодействие соединения формулы 13
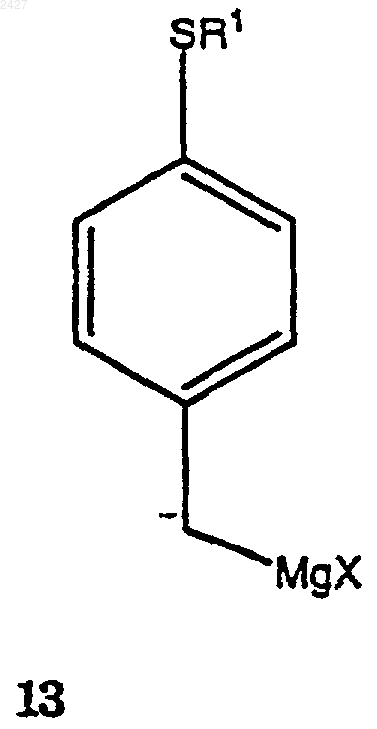
в которой Х представляет галоген, принадлежащий к группе, включающей йод, хлор, бром и фтор,
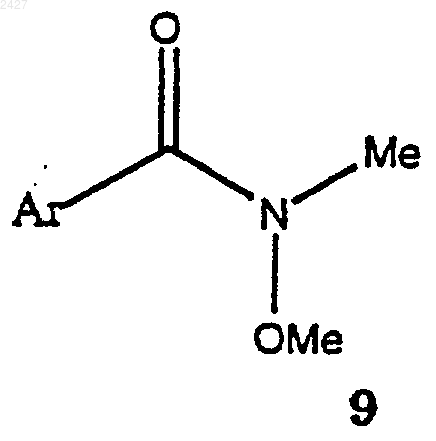
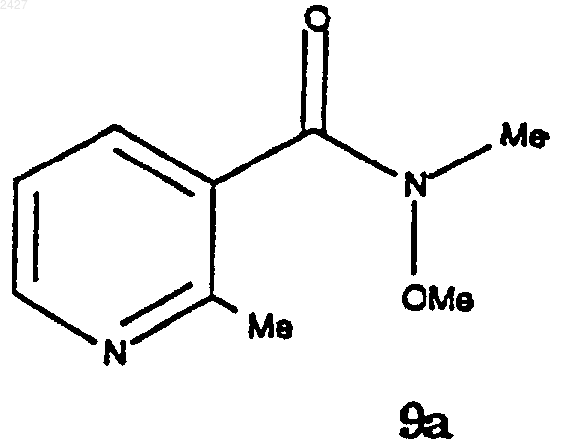
с соединением формулы 9
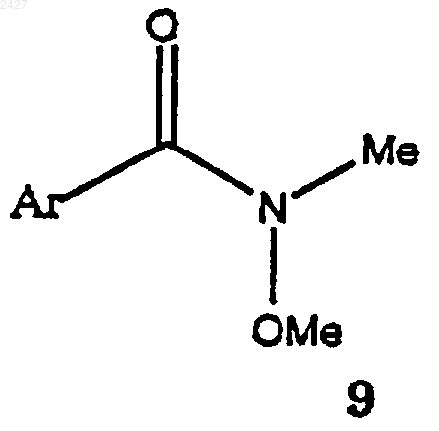
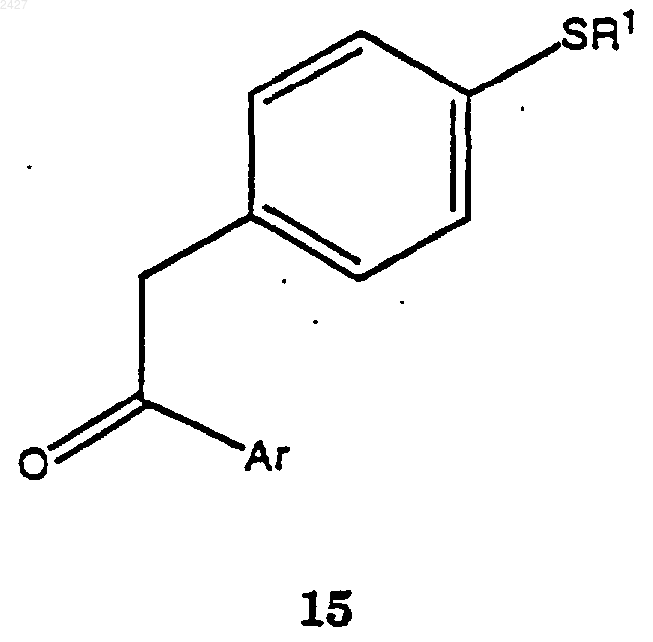
с получением соединения формулы 15
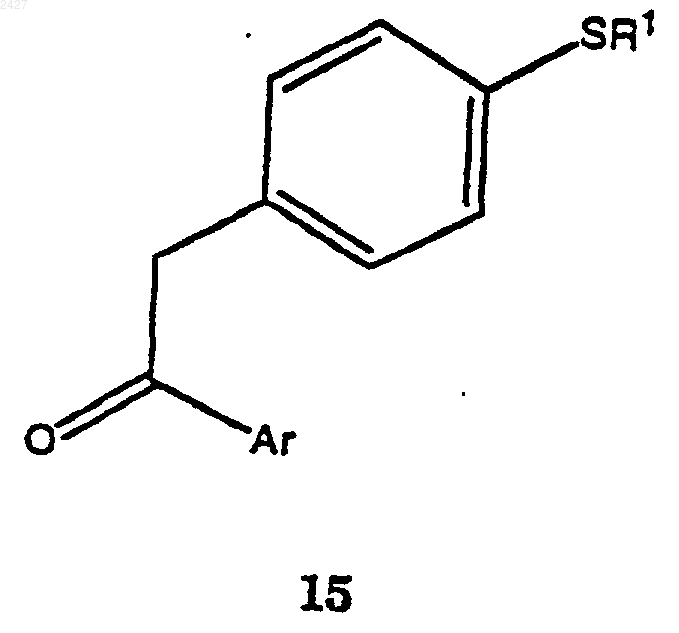
и окисление соединения формулы 15 с использованием окисляющего агента и необязательно катализатора и кислоты, с получением соединения формулы 5.
2. Способ по п.1, в котором окисляющий агент принадлежит к группе, включающей перекись водорода, оксон и смесь перекись водорода/уксусная кислота, а кислота представляет уксусную, пропионовую, метансульфоновую кислоту или серную кислоту.
3. Способ по п.1, в котором катализатором является Na2WO4.
4. Способ по п.2, в котором окисляющим агентом является оксон или перекись водорода, а кислотой - серная кислота.
5. Способ по п.1, в котором Аr представляет моно- или ди-, тризамещенный 3-пиридинил.
6. Способ по п.1, в котором R1 представляет СН3 или NH2.
7. Способ по п.1, в котором Аr представляет моно- или дизамещенный 3-пиридинил, а заместители выбраны из группы, включающей
(a) водород,
(b) галоген,
(c) C1-3алкокси,
(d) C1-3алкилтио,
(e) C1-3алкил,
(f) СF3 и
(g) CN.
8. Способ получения соединения формулы 13а
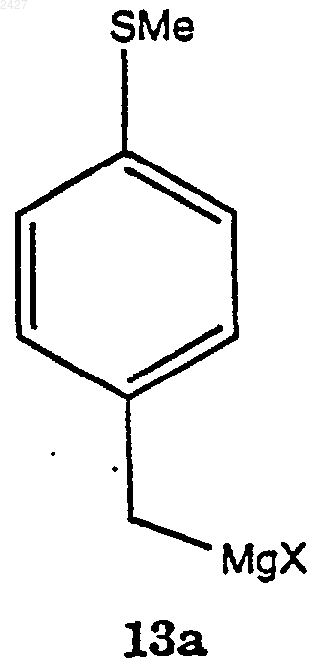
в которой Х представляет галоген, принадлежащий к группе, включающей йодид, хлорид, бромид и фторид;
включающий взаимодействие соединения формулы 12а
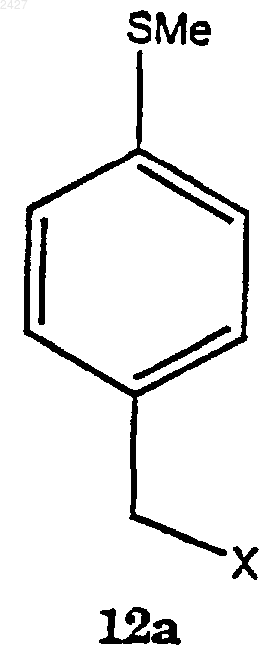
с магнием в присутствии смеси растворитель/сорастворитель с получением соединения формулы 13а.
9. Способ по п.8, в котором Х представляет хлорид.
10. Способ по п.8, в котором смесь растворитель/сорастворитель выбирают из группы, включающей толуол/тетрагидрофуран, тетрагидрофуран/диэтиловый эфир, толуол/диэтиловый эфир, тетрагидрофуран/метил-трет-бутиловый эфир, толуол/метил-трет-бутиловый эфир, толуол/диоксан и тетрагидрофуран/диоксан.
11. Способ по п.10, в котором смесь растворитель/сорастворитель представляет толуол/тетрагидрофуран.
12. Способ по п. 8, в котором молярное отношение растворителя к сорастворителю составляет приблизительно от 0,5:4 до 1:1.
13. Способ по п.12, в котором молярное отношение растворителя к сорастворителю составляет приблизительно от 1:2 до 1:1.
14. Способ получения соединения формулы I
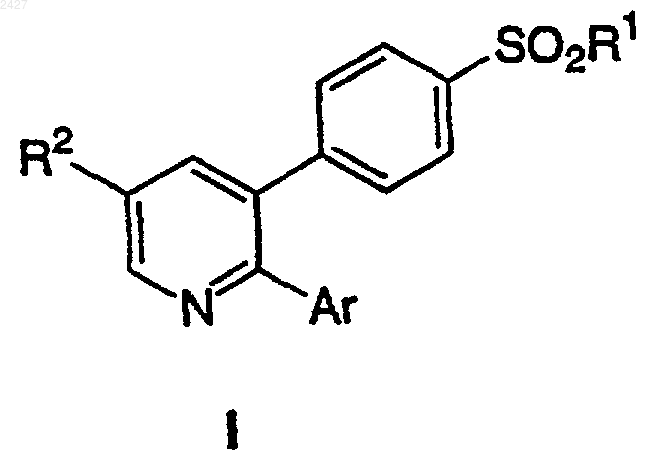
в которой
R1 выбран из группы, включающей
(a) СН3,
(b) NH2,
(c) NНС(O)СF3,
(d) NHCH3;
Аr представляет моно-, ди- или тризамещенный фенил или пиридинил (или его N-оксид), в которых заместители выбраны из группы, включающей
(a) водород,
(b) галоген,
(с) С1-4алкокси,
(d) С1-4алкилтио,
(e) CN,
(f) С1-4алкил,
(g) С1-4фторалкил, и
R2 выбран из группы, включающей
(a) F, Cl, Вr, I,
(b) CN,
(c) азид,
который включает взаимодействие соединения формулы 12
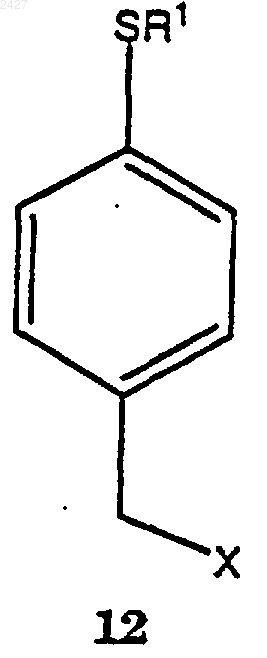
в которой Х представляет галоген, принадлежащий к группе, включающей йодид, хлорид, бромид и фторид;
с магнием в присутствии смеси растворитель/сорастворитель с получением соединения формулы 13
взаимодействие соединения формулы 13 с соединением формулы 9
с получением соединения формулы 15
и окисление соединения формулы 15 с использованием окисляющего агента и необязательно катализатора в кислых условиях с получением соединения формулы

конденсацию соединения формул А1 и А2

в кислых условиях и необязательно в присутствии нереакционноспособного растворителя и в присутствии аммониевого реагента, с соединением 5 с получением соединения формулы I.
15. Способ по п.14, в котором окисляющий агент принадлежит к группе, включающей перекись водорода, оксон и смесь перекись водорода/уксусная кислота, а кислотой является уксусная, пропионовая, метансульфоновая кислота или серная кислота.
16. Способ по п.14, в котором катализатором является Na2WO4.
17. Способ по п.15, в котором окисляющий агент представляет оксон или перекись водорода, а кислотой является серная кислота.
18. Способ по п.14, в котором Аr представляет моно-, ди- или тризамещенный 3-пиридинил.
19. Способ по п.14, в котором R1 представляет СН3 или NH2, а R2 представляет F, Вr или Сl.
20. Способ по п.14, в котором Аr представляет моно- или дизамещенный 3-пиридинил и заместители выбраны из группы, включающей
(a) водород,
(b) галоген,
(с) C1-3алкокси,
(d) C1-3алкилтио,
(e) C1-3алкил,
(f) СF3 и
(g) CN.
21. Способ по п.14, в котором Х представляет хлорид.
22. Способ по п.14, в котором смесь растворитель/сорастворитель выбирают из группы, включающей толуол/тетрагидрофуран, тетрагидрофуран/диэтиловый эфир, толуол/диэтиловый эфир, тетрагидрофуран/метил-трет-бутиловый эфир, толуол/метил-трет-бутиловый эфир, толуол/диоксан и тетрагидрофуран/диоксан.
23. Способ по п.2, в котором смесью растворитель/сорастворитель является толуол/тетрагидрофуран.
24. Способ по п.14, в котором молярное отношение растворителя к сорастворителю составляет приблизительно от 0,5:4 до 1:1.
25. Способ по п.24, в котором молярное отношение растворителя к сорастворителю составляет приблизительно от 1:2 до 1:1.
26. Способ по п.14, осуществляемый с использованием соединения Аl, в котором кислые условия заключаются в добавлении уксусной или пропионовой кислоты, нереакционноспособным растворителем является тетрагидрофуран, диоксан, C1-6алканол или толуол, а аммониевым реагентом - аммиак, ацетат аммония и пропионат аммония.
27. Способ по п.14, осуществляемый с использованием соединения А2, в котором кислые условия заключаются в добавлении уксусной кислоты, метансульфоновой кислоты или пропионовой кислоты или их смеси, нереакционноспособным растворителем является тетрагидрофуран, диоксан, C1-6алканол или толуол, а аммониевым реагентом - аммиак, ацетат аммония, гидроксид аммония и пропионат аммония.
28. Способ по п.27, в котором кислые условия заключаются в добавлении смеси пропионовой и метансульфоновой кислот, а аммониевым реагентом является гидроксид аммония.
29. Способ получения соединения формулы II
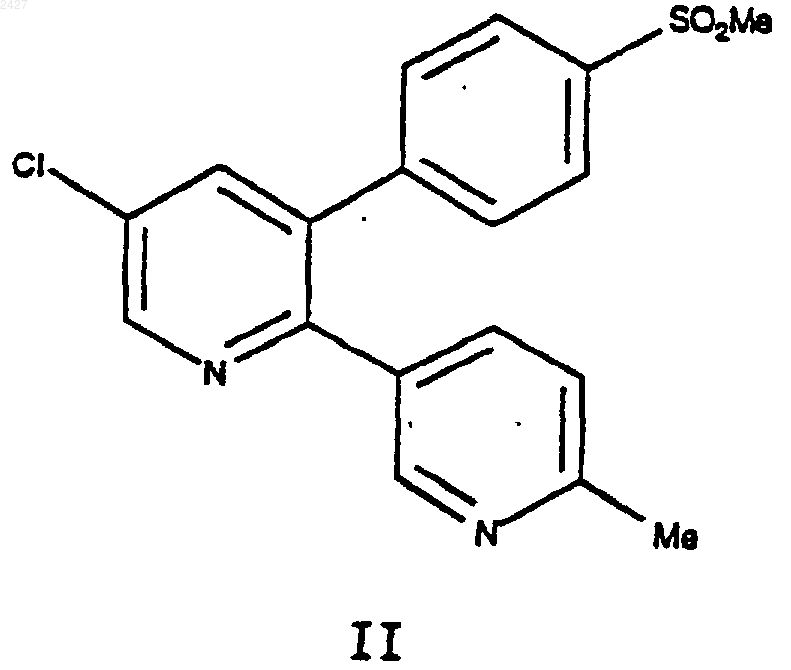
включающий взаимодействие соединения формуыы 12а
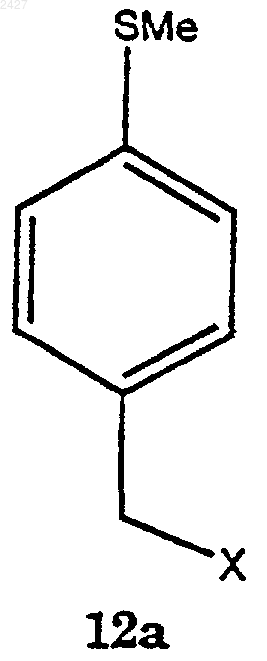
в которой Х представляет галоген, принадлежащий к группе, включающей йодид, хлорид, бромид и фторид;
с магнием в присутствии смеси растворитель/сорастворитель с получением соединения формулы 13а
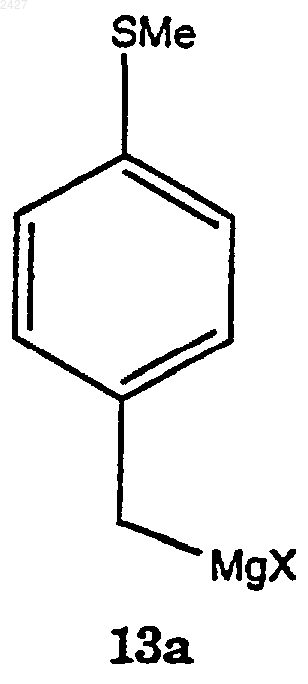
взаимодействие соединения формулы 13а с соединением формулы 9а
с получением соединения формулы 15а
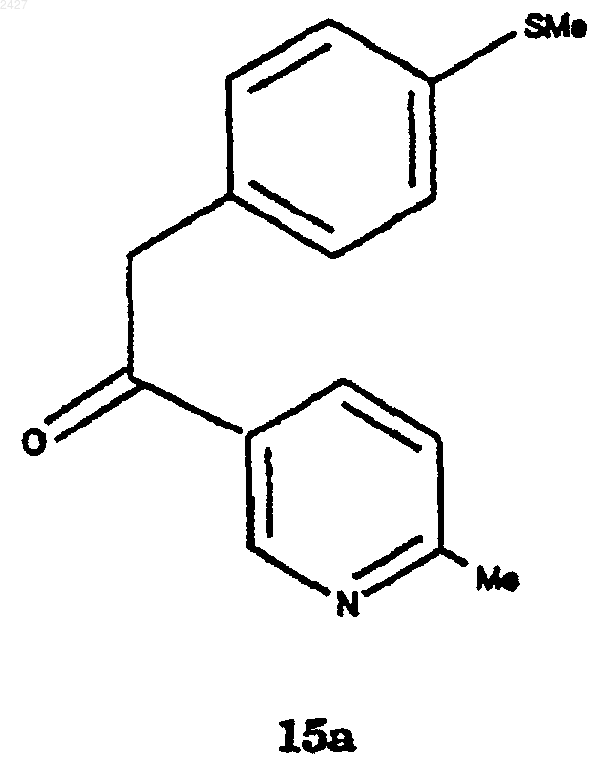
и окисление соединения формулы 15а с использованием окисляющего агента и необязательно катализатора в кислых условиях с получением соединения формулы
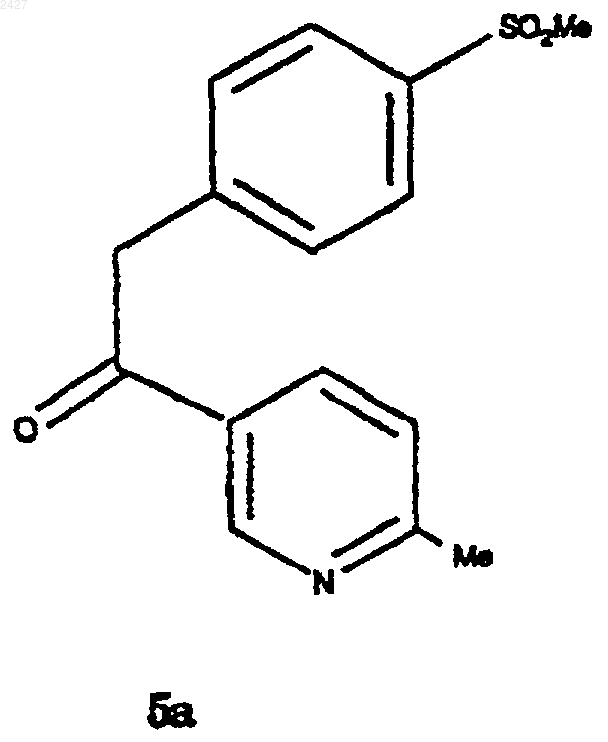
конденсацию соединения формулы А1 или А2

в которых R2 представляет Сl,
в кислых условиях и необязательно в присутствии нереакционноспособного растворителя и в присутствии аммониевого реагента, с соединением 5а с получением соединения формулы II.
30. Способ по п.29, в котором Х представляет хлорид.
31. Способ по п.29, осуществляемый с использованием соединения А1, в котором кислые условия заключаются в добавлении уксусной или пропионовой кислоты, нереакционноспособным растворителем является тетрагидрофуран, диоксан, C1-6алканол или толуол, а аммониевым реагентом - аммиак, ацетат аммония и пропионат аммония.
32. Способ по п.29, осуществляемый с использованием соединения А2, в котором кислые условия заключаются в добавлении уксусной кислоты, метансульфоновой кислоты или пропионовой кислоты или их смеси, нереакционноспособным растворителем является тетрагидрофуран, диоксан, C1-6алканол или толуол, а аммониевым реагентом - аммиак, ацетат аммония, гидроксид аммония и пропионат аммония.
Текст
1 Предпосылки изобретения Настоящее изобретение относится к способу получения некоторых противовоспалительных соединений. В частности, заявка относится к способу получения соединений формулы I, которые описаны ниже, и эти соединения являются потенциальными ингибиторами циклооксигеназы-2. Нестероидные противовоспалительные лекарственные средства, в основном, проявляют свою противовоспалительную, обезболивающую и жаропонижающую активность и ингибируют индуцированные гормонами сокращения матки и некоторые виды раковых опухолей посредством ингибирования простагландин-G/Нсинтазы, также известной как циклооксигеназа. До недавнего времени только одна форма циклооксигеназы была охарактеризована, она соответствует циклооксигеназе-1 или конститутивному ферменту, который первоначально идентифицирован в бычьих семенных пузырьках. Недавно из цыплят, морских источников и человеческих источников был клонирован, секвенирован и охарактеризован ген для второй индуцируемой формы циклооксигеназы (циклооксигеназы-2). Этот фермент отличается от циклооксигеназы-1, которая в настоящее время также клонирована из овец, морских и человеческих источников, секвенирована и охарактеризована. Вторая форма циклооксигеназы, циклооксигеназа-2, способна быстро и легко индуцироваться с помощью ряда агентов, включая митогены, эндотоксины, гормоны, цитокины и факторы роста. Так как простагландины играют как физиологическую, так и патологическую роль, мы пришли к выводу, что конститутивный фермент, циклооксигеназа-1, является ответственной в большой степени за эндогенное базальное высвобождение простагландинов и,следовательно, имеет большое значение для их физиологических функций, таких как сохранение желудочно-кишечной целостности и почечного тока крови. В противоположность этому нами сделан вывод, что индуцируемая форма,циклооксигеназа-2, главным образом ответственна за патологические эффекты простагландинов, когда происходит быстрая индукция фермента в ответ на такие агенты, как воспалительные агенты, гормоны, факторы роста и цитокины. Таким образом, селективный ингибитор циклооксигеназы-2 будет иметь аналогичные нестероидным противовоспалительным лекарственным средствам противовоспалительные,жаропонижающие и обезболивающие свойства и, кроме того, будет ингибировать индуцированные гормонами сокращения матки и обладать потенциальным противораковым действием, но будет также проявлять пониженную способность вызывать некоторые побочные эффекты, основанные на этом механизме. В частности, такие соединения должны обладать пониженным потенциалом желудочно-кишечной 2 токсичности, пониженными почечными побочными эффектами, пониженным влиянием на время кровотечения и, возможно, пониженной способностью индуцировать приступы астмы у пациентов-астматиков, чувствительных к аспирину. В заявке WO 96/24585, опубликованной 15 августа 1996 г., и в WO 96/10012, опубликованной 4 апреля 1996 г., раскрыты способы получения 2-арил-3-арилпиридинов. Также следует обратить внимание на публикации ЕР-А 0548559; R.P.Thummel и др., Journal of OrganicChemical and Pharmaceutical Bulletin, Vol. 24,1, 1976; DE 3634259a; и EP-A-0075727. В изобретении, описанном ниже, 2-арил-3-арилпиридины получают с помощью простого для проведения двухстадийного превращения амида Вейнреба в предпоследний кетосульфон из легко доступных исходных материалов. Таким образом, способ является неожиданно удобным и более эффективным, чем ранее описанная методика, по которой 2-арил-3-арилпиридины получали серией ступенчатых присоединений арильных групп к центральному пиридиновому кольцу. Более того, способ настоящего изобретения также неожиданно более эффективен в том, что не требуются ни дорогие палладиевые реагенты,ни обременительная последовательность введения защитных групп и снятия защиты, которая необходима в способе предшествующего уровня техники. Краткая характеристика изобретения Изобретение охватывает способ получения промежуточных соединений ингибиторов циклооксигеназы-2, таких как соединения структурной формулы 5 Соединение 5 используется при получении сильных ингибиторов циклооксигеназы-2 структурной формулы I, которые полезны при лечении воспалений и других опосредуемых циклооксигеназой-2 заболеваний(a) СН 3,(b) NH2,(c) NНС(O)СF3,(d) NHCH3; Аr представляет моно-, ди- или тризамещенный фенил или пиридинил (или его Nоксид), в которых заместители выбраны из группы, включающей(a) F, Сl, Вr, I,(b) CN,(c) азид. Подробное описание изобретения В первом аспекте изобретение охватывает способ получения соединения формулы 5, которое является промежуточным соединением ингибиторов СОХ-2 4 в которой Аr имеет значения, описанные выше,и окисление соединения формулы 15 с использованием окисляющего агента и необязательно катализатора и кислоты, с получением соединения формулы 5. Во втором аспекте изобретение охватывает способ получения соединения формулы 13 а в которой Х представляет галоген, принадлежащий к группе, включающей хлор, бром и фтор, который включает взаимодействие соединения формулы 12 а причем способ включает взаимодействие соединения формулы 13 с магнием в присутствии смеси растворитель/сорастворитель с получением соединения формулы 13 а. В третьем аспекте изобретение охватывает способ получения соединения формулы I в которой Аr представляет собой моно-, ди- или тризамещенный фенил или пиридинил (или егоN-оксид), в которых заместители выбраны из группы, включающей(a) водород,(b) галоген,(c) С 1-4 алкокси,(d) С 1-4 алкилтио,(e) CN,(f) С 1-4 алкил,(g) С 1-4 фторалкил,с получением соединения формулы 15Ar представляет моно-, ди- или тризамещенный фенил или пиридинил (или его Nоксид), в которых заместители выбраны из группы, включающей(a) F, Cl, Вr, I,(b) CN,(c) азид,который включает взаимодействие соединения формулы 12 6 присутствии аммониевого реагента, с соединением 5 с получением соединения формулы I. В соответствии с четвертым аспектом изобретение охватывает способ получения соединения формулы II в которой Х представляет галоген, принадлежащий к группе, включающей иод, хлор, бром и фтор, с магнием в присутствии смеси растворитель/сорастворитель, с получением соединения формулы 13 взаимодействие соединения формулы 13 с соединением формулы 9 включающий взаимодействие соединения формулы 12 а в которой Х представляет галоген, принадлежащий к группе, включающей йодид, хлорид,бромид и фторид; с магнием в присутствии смеси растворитель/сорастворитель с получением соединения формулы 13 а в которой Аr имеет значения, описанные выше,с получением соединения формулы 15 взаимодействие соединения формулы 13 а с соединением формулы 9 а в которой Аr имеет значения, описанные выше,и окисление соединения формулы 15 с использованием окисляющего агента и необязательно катализатора в кислых условиях, с получением соединения формулы с получением соединения формулы 15 а в кислых условиях, необязательно в присутствии нереакционноспособного растворителя и в и окисление соединения формулы 15 а с использованием окисляющего агента и необязательно катализатора в кислых условиях с получением соединения формулы конденсацию соединения формулы А 1 или А 2 в которых R2 представляет Сl,в кислых условиях и необязательно в присутствии нереакционноспособного растворителя и в присутствии аммониевого реагента, с соединением 5 а с получением соединения формулы II. Дополнительный аспект настоящего изобретения реализуется тогда, когда используется соединение Аl, при этом кислые условия заключаются в добавлении уксусной или пропионовой кислоты, нереакционноспособным растворителем является тетрагидрофуран, диоксан, C1-6 алканол, хлорбензол, дихлорбензол, ксилол или толуол и аммониевым реагентом является аммиак, ацетат аммония или пропионат аммония. Еще один аспект настоящего изобретения реализуется, когда используется соединение А 2,при этом кислые условия обеспечиваются добавлением уксусной кислоты, метансульфоновой кислоты или пропионовой кислоты или их смеси, предпочтительно смеси пропионовой кислоты и метансульфоновой кислоты, нереакционноспособным растворителем является тетрагидрофуран, диоксан, C1-6 алканол, хлорбензол, дихлорэтан, ксилол или толуол, а аммониевый реагент представляет аммиак, ацетат аммония, гидроксид аммония и пропионат аммония,предпочтительно гидроксид аммония. В данном описании, если не оговорено особо, реакции обычно проводят в растворителях, таких как бензол, хлорбензол, дихлорбензол, толуол и ксилол; в эфирных растворителях,таких как диэтиловый эфир, ди-н-бутиловый и диизопентиловый эфиры, анизол, простые циклические эфиры, такие как тетрагидрофуран, 4 метил-1,3-диоксан, дигидропиран, тетрагидрофурфуриловый эфир, метиловый эфир, этиловый эфир, 2-этокситетрагидрофуран и тетрагидрофуран (ТГФ); в сложноэфирных растворителях, таких как этил- и изопропилацетат; галогенуглеродных растворителях, включающих моно- или дигалоген-С 1-4 алкил, таких как дихлорметан; в С 6-10-линейных, разветвленных или циклических углеводородных растворителях,включающих гексан; и в азотсодержащих растворителях, включающих N,N-диметилацетамид, N,N-диметилформамид (ДМФ), N-этил 002427 8 пирролидинон, N-метилпирролидинон и ацетонитрил. Предпочтительными растворителями являются спирт, дихлорметан, ТГФ и ДМФ. В настоящем описании Х представляет галоген, принадлежащий к группе, включающей йодид, хлорид, бромид или фторид, предпочтительно хлорид, а соединение 12 является промышленно доступным. Что касается первого аспекта настоящего изобретения, то окисляющий агент принадлежит к группе, включающей перекись водорода,оксон, перекись водорода/уксусную кислоту и т.д., предпочтительно используется оксон или перекись водорода, и катализатором являетсяNa2WO4. Кислота включает уксусную кислоту,пропионовую или другую карбоновую кислоту,соляную кислоту или серную кислоту и др. Величина рН поддерживается приблизительно от 2 до 5, предпочтительно приблизительно 2-4. Реакцию предпочтительно проводят с использованием кислоты, такой как серная кислота. Молярное отношение соединения 13 к соединению 9 может обычно меняться приблизительно от 1:1 до 2:1, предпочтительно приблизительно от 1:5 до 1. Обычно используется избыток соединения 13 относительно соединения 9. Молярное отношение соединения 15 к окисляющему агенту может меняться приблизительно от 1:1 до 1:10. Молярное отношение катализатора к соединению 15 может обычно меняться приблизительно от 1:1 до 1:1000, предпочтительно составляет приблизительно 1:100. Реакцию можно удобно проводить при температуре в интервале приблизительно от 0 до 100 С,предпочтительно приблизительно от 50 до 60 С,и ей, по существу, дают протекать до окончания в течение от 1 до 24 ч. В данном описании во втором аспекте настоящего изобретения смесь растворитель/ сорастворитель включает смеси растворителей,такие как толуол/тетрагидрофуран, тетрагидрофуран/диэтиловый эфир, толуол/диэтиловый эфир, тетрагидрофуран/метил-трет.-бутиловый эфир, толуол/метил-трет.-бутиловый эфир, толуол/диоксан, тетрагидрофуран/диоксан и т.д.,предпочтительно толуол/тетрагидрофуран. Молярное отношение соединения 12 к смеси растворитель/сорастворитель обычно меняется приблизительно от 1:20 до 1:1, предпочтительно приблизительно от 1:3 до 1:1. Молярное отношение растворителя к сорастворителю может обычно меняться приблизительно от 0,5:4 до 1:1, предпочтительно от 1:2 до 1:1. Молярное отношение соединения 12 к магнию может меняться обычно приблизительно от 1:2 до 1:1. Обычно соединение 12 смешивают с требуемым количеством сорастворителя и добавляют к растворителю, содержащему магний, и реакцию удобно проводят в температурном интервале приблизительно от 0 до 40 С; предпочтительно приблизительно от 10 до 35 С. Реакции дают протекать до полного окончания в 9 течение от 1 до 5 ч; обычно в течение от 1 до 2 ч. Что касается третьего аспекта настоящего изобретения, как это очевидно для квалифицированного в данной области специалиста, реагенты обычно сами обеспечивают кислые условия. Следовательно, использование не вступающей в реакцию кислоты не является необходимым. Однако добавление кислоты, такой как уксусная или пропионовая кислота или другой карбоновой кислоты или смеси кислот, таких как смесь пропионовой кислоты и метансульфоновой кислоты, охватывается объемом настоящего изобретения. В настоящем описании нереакционноспособный растворитель включает тетрагидрофуран, диоксан, C1-6 алканол, хлорбензол, дихлорбензол, ксилол и толуол. К аммониевому реагенту в настоящем изобретении относятся аммиак, соли аммония, такие как ацетат аммония и пропионат аммония, и водный аммиак, такой как гидроксид аммония. Кроме того, смесь видов аммониевых реагентов также входит в определение аммониевого реагента. Молярное соотношение соединение А 1 или А 2 и соединения 5 может обычно меняться приблизительно от 3:1 до 1:2, предпочтительно приблизительно от 1:1 до 1,5. Обычно используется избыток соединения А 1. Молярное отношение соединения А 1 или А 2 к аммониевому реагенту обычно может меняться приблизительно от 1:1 до 1:10. Данную реакционную стадию удобно проводить в температурном интервале приблизительно от 40 до 180 С; предпочтительно приблизительно от 80 до 140 С, и ей дают протекать до полного завершения в течение приблизительно от 2 до 18 ч; обычно в течение приблизительно от 6 до 12 ч. Что касается третьего аспекта изобретения,R2 предпочтительно представляет галоген, более предпочтительно F, Вr или Сl, наиболее предпочтительно Сl. Что касается всех аспектов настоящего изобретения, предпочтительным подклассом соединений формулы I являются соединения, в которых Аr представляет моно- или дизамещенный пиридинил. В пределах данного подкласса особенно предпочтительными являются 3 пиридинильные изомеры. Также по всем аспектам настоящего изобретения еще одним предпочтительным подклассом соединений формулы I являются соединения, в которых R1 представляет СН 3 илиNH2. Обычно СН 3 является предпочтительным с точки зрения специфичности для COX-2, а группа NH2 предпочтительна с точки зрения эффективности. Также по всем аспектам настоящего изобретения еще одним предпочтительным подклассом соединений формулы I являются со 002427 10 единения, в которых Аr не замещен или замещен СН 3. В пятом аспекте настоящего изобретения описываются соединения формулы А 2(a) галоген,(b) CN,(c) азид,(d) С 2-6 алкил, необязательно замещенный 1-3 группами из числа C1-6 алкила, гидрокси,галогена, карбонила, СO2, NO2, OC1-6 алкила,SC1-6 алкила, группы N(C1-6 алкил)2,(е) C5-10 арил или гетероарил, необязательно замещенный 1-3 группами из числа C1-6 алкила, гидрокси, галогена, карбонила, СO2,NO2, OC1-6 алкила, SC1-6 алкила, группы N(С 1-6 алкил)2. Предпочтительными являются соединения,когда R2 представляет галоген, алкил, фенил или замещенный фенил. Наиболее предпочтительными являются соединения, в которых R2 представляет фтор, бром, йод, хлор, этил, изопропил, фенил, трифторфенил. В данном описании "алкил" означает разветвленные, циклические и линейные насыщенные алифатические углеводородные группы,содержащие определенное количество атомов углерода. Примерами циклоалкильных групп являются циклопропил, циклобутил, циклопентил, циклогексил и др. В данном описании "арил" включает арильные и гетероарильные группы, как замещенные, так и незамещенные, которые определяются как карбазолил, фурил, тиенил, пирролил, изотиазолил, имидазолил, изоксазолил,тиазолил, оксазолил, пиразолил, пиразинил, пиридил, пиримидил, пуринил или хинолинил, а также ароматические кольца, например фенил,замещенный фенил и аналогичные группы, а также конденсированные кольца, например нафтил и др. Замещение может включать от 1 до 3 групп из числа C1-6 алкила, гидрокси, галогена,карбонила, СО 2, NO2, ОС 1-6 алкила, SC1-6 алкила,группы N(С 1-6 алкил)2 и др. В данном описании "галоген" включает хлор, фтор, бром и йод. Соединения формулы I полезны для ослабления боли, жара и воспаления при различных состояниях, включая ревматическую лихорадку, симптомы, связанные с гриппом или другими вирусными инфекциями,обычную простуду, нижеспинную и шейную боль, дисменорею, головную боль, зубную боль,растяжения и напряжения, миозиты, невралгию,синовит, артрит, включая ревматоидный артрит при дегенерации суставов (остеоартрит), подагру и анкилозирующий спондилит, бурсит, ожо 11 ги, раны после хирургических и стоматологических процедур. Кроме того, такие соединения могут ингибировать клеточные опухолевые преобразования и метастазный рост опухолей и,следовательно, могут использоваться при лечении рака. Соединения формулы I могут также быть полезны при лечении слабоумия, включая предстарческое и старческое слабоумие, и, в частности, слабоумия, связанного с болезнью Альцгеймера (т.е. слабоумия Альцгеймера). Благодаря их высокой активности в отношении циклооксигеназы-2 (СОХ-2) и/или их селективности в отношении циклооксигеназы-2 по сравнению с циклооксигеназой-1 (СОХ-1),как показано выше, соединения формулы I оказываются полезными в качестве средства, альтернативного обычным нестероидным противовоспалительным лекарственным средствам(NSAID'S), в особенности, когда такие нестероидные противовоспалительные лекарственные средства могут иметь противопоказания, например, для пациентов с пептической язвой,гастритом, региональным энтеритом, язвенным колитом, дивертикулитом или с рецидивами желудочно-кишечных повреждений; GI кровотечениями, нарушениями свертывания, в том числе анемией, такой как гипопротромбинемия,гемофилия, или другими проблемами кровотечения (включая проблемы, связанные с пониженной или нарушенной функцией тромбоцитов); болезнями почек (например, нарушенная почечная функция); у дооперативных пациентов или принимающих антикоагулянты; и у пациентов, чувствительных к астме, вызываемойNSAID'S. Соединения настоящего изобретения являются ингибиторами циклооксигеназы-2 и поэтому полезны при лечении заболеваний, опосредуемых циклооксигеназой-2, которые перечислены выше. Их активность иллюстрируется их способностью селективно ингибировать циклооксигеназу-2 в сравнении с циклооксигеназой-1. Соответственно, в одном из анализов способность соединений настоящего изобретения лечить заболевания, опосредуемые циклооксигеназой, может быть продемонстрирована путем измерения количества простагландина Е 2(ПГЕ 2), синтезированного в присутствии арахидоновой кислоты, циклооксигеназы-1 или циклооксигеназы-2 и соединений формулы I. Величина IC50 представляет собой концентрацию ингибитора, необходимую для снижения синтеза PGE до 50% от полученной при сравнении с контролем без ингибитора. В этой связи мы установили, что соединения примеров более чем в 100 раз эффективнее при ингибировании СОХ 2, чем при ингибировании СОХ-1. Кроме того,все они имеют СОХ-2 IC50 от 1 нМ до 1 мМ. Для сравнения: Ибупрофен имеет показатель IC50 для СОХ-2 1 мМ, а Индометацин имеет IC50 для СОХ-2 приблизительно 100 нМ. 12 Для лечения любого из заболеваний, опосредуемых циклооксигеназой, соединения формулы I могут вводиться перорально, топически или местно, парентерально, путем ингаляционного распыления или ректально в стандартных единичных дозированных лекарственных формах, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители. Термин "парентеральный", используемый в данном описании, включает подкожные инъекции, внутривенные, внутримышечные, внутригрудинные инъекции или приемы вливания или инфузии. Помимо лечения теплокровных животных, таких как мыши, крысы, лошади, крупный рогатый скот, овцы, собаки, кошки и др., соединения настоящего изобретения эффективны при лечении человека. Изобретение далее иллюстрируется следующими не ограничивающими примерами, в которых, если не оговорено особо,1) все операции проводят при комнатной температуре или при температуре окружающей среды, т.е. при температуре в интервале 1825 С; упаривание растворителя осуществляют с использованием роторного испарителя при пониженном давлении (600-4000 Па, 4,5-30 мм рт.ст.) при температуре бани до 60 С; за ходом реакции следят с помощью тонкослойной хроматографии (ТСХ) или высокоэффективной жидкостной хроматографии (ВЭЖХ); и время реакции дано только для целей иллюстрации; температуры плавления являются нескорректированными, а "д" указывает разложение; приведенные температуры плавления представляют собой температуры, полученные для материалов, полученных, как описано, полиморфизм может быть результатом выделения материалов с различными температурами плавления при некоторых получениях; структуру и чистоту всех конечных продуктов подтверждают с помощью, по меньшей мере, одной из следующих методик: ТСХ, масс-спектрометрия, ядерный магнитный резонанс (ЯМР) или на основе данных микроанализа; выходы приведены только в целях иллюстрации; приводимые данные ЯМР представлены в форме значений дельтадля основных определяемых протонов, выраженных в частях на миллион (м.д.) относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта, которые определяются при 300 или 400 МГц с использованием указанного растворителя; для обозначения вида сигнала используются обычные сокращения: с - синглет, д дублет, т - триплет, м - мультиплет, ш. - широкий сигнал; и др., кроме того "Аr" означает сигналы ароматических протонов; химические символы имеют свое обычное значение; также используются следующие сокращения: об.(объем), вес. (весовой), т.кип.(температура кипения), т.пл.(температура плавления), л(моль(и,ммоль(миллимоль(и,экв.(эквивалент(ы. Следующие аббревиатуры имеют указанные значения: Аббревиатуры алкильных групп 3-Амино-2-хлоракролеин Кетосульфон Метансульфокислота н-Пропионовая кислота Гидроксид аммония (14, 8 М) Толуол Смесь н-пропионовой кислоты (400 мл), 3 амино-2-хлоракролеина (140 г, 1,31 моля), кетосульфона (136 г, 0,469 моля), толуола (1,35 л),пропионовой кислоты (690 мл, 92,5 моля) и метансульфокислоты (67 мл, 10,3 моля) нагревалась с обратным холодильником (114 С) в течение 12 ч с азеотропной отгонкой воды. Реакционный раствор охлаждался до комнатной температуры и разбавлялся изопропилацетатом (1 л). Добавлялась вода (1 л) и водную фазу нейтрализовали концентрированным водным раствором гидроксида аммония (600 мл). Органический слой промывался смесью 1:1 рассол/вода(21 л). Объединенные водные слои экстрагируют изопропилацетатом (900 мл). Объединенные органические слои обрабатывают Darco G60 и затем концентрируют. После перекристаллизации из смеси изопропилацетат/гексаны получают бесцветное твердое вещество (123,1 г,65%), т.пл. 135 С (ДСК). Пример 1 А. 5-Хлор-3-(метилсульфонил) фенил-2-(3-пиридил)-пиридин; соединение 1. 2-Хлормалондиальдегид Кетон В Пропионовая кислота Ацетат аммония 14 Смесь кетона В (5,0 г), 2-хлормалондиальдегида (4,8 г) и ацетата аммония нагревают до 130 С. Образующуюся уксусную кислоту удаляют отгонкой и нагревание при температуре 136 С продолжают в течение 15 ч. Реакционную смесь подщелачивают карбонатом натрия, добавляют воду и продукт экстрагируют в дихлорметане (2150 мл). Органический слой обрабатывают углем (Dowex), сушат (MgSO4) и удаляют растворитель. Получают соединение 1 в виде не совсем белого твердого вещества (3,4 г, выход 55%). К суспензии хлормалондиальдегида (220 мг) в толуоле добавляют N,N-диметилформамид. Добавляют оксалилхлорид и реакционную смесь перемешивают до полного растворения. К раствору кетона В (500 мг) в ТГФ (15 мл) при температуре -78 С по каплям добавляют бис(триметилсилил)амид лития (1,8 мл, 1 М раствор в ТГФ). Реакционную смесь подогревают до температуры окружающей среды в течение 1 ч с образованием енолята лития В (см. общую формулу В 1) перед повторным охлаждением до -78 С. Добавляют раствор 2,3 дихлоракролеина и позволяют температуре подняться до комнатной температуры. Через 1 ч через раствор пропускают газообразный аммиак и через 30 мин добавляют ацетат аммония. Реакционную смесь подогревают до 60 С в течение 1 ч и выливают в водный раствор гидроксида натрия (2 М, 100 мл). Продукт экстрагируют дихлорметаном (2150 мл), сушат (MgSO4) и удаляют растворитель, получают соединение 1 Раствор метилового эфира 6-метилникотиновой кислоты (21,56 г) и N,O-диметилгидроксиламина (13,9 г) в ТГФ (150 мл) охлаждают до -10 С. В течение 2,5 ч добавляют изопропилмагнийхлорид (110 мл). Реакционную смесь выливают в водный раствор уксусной кислоты (10 об.%, 126 мл) при 5 С. К смеси добавляют толуол (60 мл), затем слои разделяют. Водный слой экстрагируют толуолом (260 мл) и растворитель удаляют. Твердые примеси отфильтровывают и фильтрат концентрируют,получают амид Вейнреба в виде светлооранжевого масла (24,2 г, выход 94,3%). Пример 3. Реактив Гриньяра. 16 Кетосульфид Метанол Вольфрамат натрия Вода Серная кислота (2 н.) Перекись водорода (30%) Смесь кетосульфида (270 г, 1,05 моля),серной кислоты (2 н., 20 мл) и метанола (2,70 л) нагревают при 55 С. Добавляют водный раствор вольфрамата натрия (6,0 г, 0,02 моля) и затем добавляют перекись водорода (380 мл) в течение 1 ч. Добавляют воду (3 л) и смесь охлаждают до комнатной температуры и затем фильтруют. Твердые вещества промывают водой (2 л) и сушат в вакууме потоком азота, получая кетосульфон 8 (250,2 г, 82,5%) в виде бесцветного твердого вещества. Пример 5. Хлормалональдегид Водный аммиак (30%, 14,8 н.) Изопропиловый спирт (ИПС) 4-Тиометилбензилхлорид Магний Толуол Тетрагидрофуран Амид Вейнреба 2 Смесь магния (191 г, 7,86 моля), толуола (4 л), 4-тиометилбензилхлорида (566 г, 3,28 моля) и тетрагидрофурана (0,545 л, 6,73 моля) загружают на протяжении 3-4 ч. В дополнительную колбу загружают амид Вейнреба (300 г, 1,66 моля) и толуол (1,7 л) и охлаждают до -20 С. В течение 30 мин добавляют приготовленный выше раствор реактива Гриньяра и смесь выдерживают в течение 1 ч. Реакционную смесь гасят добавлением 50% водной уксусной кислоты (0,5 л). Добавляют толуол (1 л) и воду (1 л) и слои разделяют. Водный слой экстрагируют толуолом (2 х 2 л). Объединенные органические экстракты экстрагируют разбавленной соляной кислотой (12 л). К водному слою добавляют этилацетат и водным раствором аммиака (0,6 л) устанавливают необходимое значение рН. Фазы разделяют и водный слой экстрагируют этилацетатом (21,25 л). Объединенные экстракты концентрируют на роторном испарителе, получая светло-желтое твердое вещество (326,5 г,выход 76%). Пример 4. Окисление.(400 г, 3,76 моля) и изопропиловый спирт (400 мл). Раствор концентрируют при пониженном давлении при медленной непрерывной подаче изопропилового спирта (общее количество 4,0 л). Полученную темно-коричневую жидкость разбавляют изопропиловым спиртом (400 мл). Смесь добавляют к охлажденному (5 С) раствору 30%-ного водного аммиака (370 мл) в изопропиловом спирте (2 л). Смесь выдерживают в течение 3 ч, и продукт собирают фильтрованием(373 г, выход 93%). Пример 5 А. Существует несколько путей получения хлормалондиальдегида. Получение из 1,1,2,3,3-пентахлорпропана. Подробное описание эксперимента опубликовано в Houben-Weyl-Muller: Methoden derVerlag, Stuttgard, 1954, стр. 119. Исходное вещество 1,1,2,3,3-пентахлорпропан является промышленно доступным продуктом фирмы Pfaltz Получение из мукохлорной кислоты. Следующая методика представляет собой незначительно измененный вариант оригинальной методики Дикмана (Dieckmann, Веr.Deut.Chem.Ges., 1904, 37, 4638). Мукохлорная кислота Анилин Вода К раствору анилина в воде при 85 С в энергично перемешиваемой 2 л колбе маленькими порциями добавляют мукохлорную кислоту на протяжении 30 мин. При добавлении мукохлорной кислоты появляется желтая окраска,которая быстро исчезает. Реакционная смесь остается гетерогенной и фильтрование аликвоты после 30 мин нагревания показывает, что реакция завершилась. Реакционную смесь нагревают при 90 С в течение 60 мин, охлаждают до 50 С и фильтруют. Осадок на фильтре промывают 50 мл 2 н. НСl и 100 мл Н 2 О. Продукт сушат струей N2,получая 57 г (выход 100%) 3-анилидо-2 хлоракролеина в виде серого твердого вещества. ЯМР 13 С (ДМСО-d6), , м.д.: 108, 117, 124,129, 140, 147, 182. 3-Анилидо-2-хлоракролеин 57 г (0,30 моля) 5 н. раствор NaOH 120 мл (0,6 моля) Раствор 3-анилидо-2-хлоракролеина в 120 мл 5 н. NaOH нагревают до 100 С в течение 90 мин. Темный черный раствор дважды экстрагируют порциями по 50 мл метил-трет-бутилового эфира. Первая органическая промывка удаляет большую часть темной окраски раствора, а вторая промывка давала лишь слегка окрашенное вещество. При охлаждении водной фазы образуется кристаллический осадок. Этот продукт является натриевой солью 3-хлормалондиальдегида. Водную фазу подкисляют добавлением 60 мл 37% раствора НСl. Водную фазу экстрагируют (метил-трет-бутиловый эфир/ТГФ 50/50,общий объем 400 мл) и объединенные органические фазы сушат MgSO4. После обработкиDarco G60 и фильтрования через слой SiO2 раствор упаривают, получая 19,6 г (62% общий выход) хлормалондиальдегида в виде темного твердого вещества. Перекристаллизация из приблизительно 10 мл метил-трет-бутилового эфира дает 11,13 г чистого хлормалондиальдегида в виде рыжевато-коричневого твердого вещества.Commun., 1961, 26, 3051) упоминает об образовании 3-диметиламино-2-хлоракролеина при реакции хлоруксусной кислоты с реагентом Вильсмеера, получаемым из РОСl3 и ДМФ. Видоизменение и распространение данной методики дает хлормалондиальдегид в виде его натриевой соли. К 1000 мл ДМФ при 10 С добавляют оксалилхлорид (280 мл, 3,2 моля). Реакция сильно экзотермична и образуется тяжелый осадок. После выдерживания в течение 2 ч добавляют хлорацетилхлорид (110 мл, 1,4 моля) и реакционную смесь нагревают до 75 С в течение 3 ч. Анализ аликвоты методом ЯМР 1H показывает полное потребление хлорацетилхлорида и реакционную смесь гасят добавлением в 1 л воды. К охлажденному раствору добавляют 500 мл 50% раствора NaOH. Реакционную смесь нагревают с обратным холодильником в течение 5 ч. При охлаждении образуется осадок, который отфильтровывают и промывают водой. Рыжеватокоричневое твердое вещество сушат в потокеN2, получая 84 г рыжевато-коричневого твердого вещества (выход 54%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединений формулы 5(a) СН 3,(b) NH2,(c) NНС(O)СF3,(d) NНСН 3; и Аr представляет моно-, ди- или тризамещенный фенил или пиридинил (или его Nоксид), в которых заместители выбраны из группы, включающей(g) С 1-4 фторалкил; включающий взаимодействие соединения формулы 13 с получением соединения формулы 15 и окисление соединения формулы 15 с использованием окисляющего агента и необязательно катализатора и кислоты, с получением соединения формулы 5. 2. Способ по п.1, в котором окисляющий агент принадлежит к группе, включающей перекись водорода, оксон и смесь перекись водорода/уксусная кислота, а кислота представляет уксусную, пропионовую, метансульфоновую кислоту или серную кислоту. 3. Способ по п.1, в котором катализатором является Na2WO4. 4. Способ по п.2, в котором окисляющим агентом является оксон или перекись водорода,а кислотой - серная кислота. 5. Способ по п.1, в котором Аr представляет моно- или ди-, тризамещенный 3-пиридинил. 6. Способ по п.1, в котором R1 представляет СН 3 или NH2. 7. Способ по п.1, в котором Аr представляет моно- или дизамещенный 3-пиридинил, а заместители выбраны из группы, включающей(g) CN. 8. Способ получения соединения формулы 13 а в которой Х представляет галоген, принадлежащий к группе, включающей йодид, хлорид,бромид и фторид; включающий взаимодействие соединения формулы 12 а с магнием в присутствии смеси растворитель/сорастворитель с получением соединения формулы 13 а. 9. Способ по п.8, в котором Х представляет хлорид. 10. Способ по п.8, в котором смесь растворитель/сорастворитель выбирают из группы,включающей толуол/тетрагидрофуран, тетрагидрофуран/диэтиловый эфир, толуол/диэтиловый эфир, тетрагидрофуран/метил-трет-бутиловый эфир, толуол/метил-трет-бутиловый эфир,толуол/диоксан и тетрагидрофуран/диоксан. 11. Способ по п.10, в котором смесь растворитель/сорастворитель представляет толуол/тетрагидрофуран. 12. Способ по п. 8, в котором молярное отношение растворителя к сорастворителю составляет приблизительно от 0,5:4 до 1:1. 13. Способ по п.12, в котором молярное отношение растворителя к сорастворителю составляет приблизительно от 1:2 до 1:1. 14. Способ получения соединения формулы I(a) СН 3,(b) NH2,(c) NНС(O)СF3,(d) NHCH3; Аr представляет моно-, ди- или тризамещенный фенил или пиридинил (или его Nоксид), в которых заместители выбраны из группы, включающей(a) F, Cl, Вr, I,(b) CN,(c) азид,который включает взаимодействие соединения формулы 12 в которой Х представляет галоген, принадлежащий к группе, включающей йодид, хлорид,бромид и фторид; с магнием в присутствии смеси растворитель/сорастворитель с получением соединения формулы 13 взаимодействие соединения формулы 13 с соединением формулы 9 с получением соединения формулы 15 и окисление соединения формулы 15 с использованием окисляющего агента и необязательно катализатора в кислых условиях с получением соединения формулы конденсацию соединения формул А 1 и А 2 в кислых условиях и необязательно в присутствии нереакционноспособного растворителя и в присутствии аммониевого реагента, с соединением 5 с получением соединения формулы I. 15. Способ по п.14, в котором окисляющий агент принадлежит к группе, включающей перекись водорода, оксон и смесь перекись водорода/уксусная кислота, а кислотой является уксусная, пропионовая, метансульфоновая кислота или серная кислота. 16. Способ по п.14, в котором катализатором является Na2WO4. 17. Способ по п.15, в котором окисляющий агент представляет оксон или перекись водорода, а кислотой является серная кислота. 18. Способ по п.14, в котором Аr представляет моно-, ди- или тризамещенный 3 пиридинил. 19. Способ по п.14, в котором R1 представляет СН 3 или NH2, а R2 представляет F, Вr или Сl. 20. Способ по п.14, в котором Аr представляет моно- или дизамещенный 3-пиридинил и заместители выбраны из группы, включающей(g) CN. 21. Способ по п.14, в котором Х представляет хлорид. 22. Способ по п.14, в котором смесь растворитель/сорастворитель выбирают из группы,включающей толуол/тетрагидрофуран, тетрагидрофуран/диэтиловый эфир, толуол/диэтиловый эфир, тетрагидрофуран/метил-трет-бутиловый эфир, толуол/метил-трет-бутиловый эфир,толуол/диоксан и тетрагидрофуран/диоксан. 23. Способ по п.2, в котором смесью растворитель/сорастворитель является толуол/ тетрагидрофуран. 24. Способ по п.14, в котором молярное отношение растворителя к сорастворителю составляет приблизительно от 0,5:4 до 1:1. 25. Способ по п.24, в котором молярное отношение растворителя к сорастворителю составляет приблизительно от 1:2 до 1:1. 26. Способ по п.14, осуществляемый с использованием соединения Аl, в котором кислые условия заключаются в добавлении уксусной или пропионовой кислоты, нереакционноспособным растворителем является тетрагидрофуран, диоксан, C1-6 алканол или толуол, а аммониевым реагентом - аммиак, ацетат аммония и пропионат аммония. 27. Способ по п.14, осуществляемый с использованием соединения А 2, в котором кислые условия заключаются в добавлении уксусной кислоты, метансульфоновой кислоты или пропионовой кислоты или их смеси, нереакционноспособным растворителем является тетрагидрофуран, диоксан, C1-6 алканол или толуол, а аммониевым реагентом - аммиак, ацетат аммония,гидроксид аммония и пропионат аммония. 28. Способ по п.27, в котором кислые условия заключаются в добавлении смеси пропионовой и метансульфоновой кислот, а аммониевым реагентом является гидроксид аммония. 29. Способ получения соединения формулы II с получением соединения формулы 15 а включающий взаимодействие соединения формулы 12 а конденсацию соединения формулы А 1 или А 2 в которой Х представляет галоген, принадлежащий к группе, включающей йодид, хлорид,бромид и фторид; с магнием в присутствии смеси растворитель/сорастворитель с получением соединения формулы 13 а взаимодействие соединения формулы 13 а с соединением формулы 9 а и окисление соединения формулы 15 а с использованием окисляющего агента и необязательно катализатора в кислых условиях с получением соединения формулы в которых R2 представляет Сl,в кислых условиях и необязательно в присутствии нереакционноспособного растворителя и в присутствии аммониевого реагента, с соединением 5 а с получением соединения формулы II. 30. Способ по п.29, в котором Х представляет хлорид. 31. Способ по п.29, осуществляемый с использованием соединения А 1, в котором кислые условия заключаются в добавлении уксусной или пропионовой кислоты, нереакционноспособным растворителем является тетрагидрофуран, диоксан, C1-6 алканол или толуол, а аммониевым реагентом - аммиак, ацетат аммония и пропионат аммония. 32. Способ по п.29, осуществляемый с использованием соединения А 2, в котором кислые условия заключаются в добавлении уксусной кислоты, метансульфоновой кислоты или пропионовой кислоты или их смеси, нереакционноспособным растворителем является тетрагидрофуран, диоксан, C1-6 алканол или толуол, а аммониевым реагентом - аммиак, ацетат аммония,гидроксид аммония и пропионат аммония.
МПК / Метки
МПК: C07C 223/02, C07D 213/61
Метки: ингибиторов, качестве, cox-2, способ, получения, диарилпиридинов, полезных
Код ссылки
<a href="https://eas.patents.su/14-2427-sposob-polucheniya-diarilpiridinov-poleznyh-v-kachestve-ingibitorov-cox-2.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения диарилпиридинов, полезных в качестве ингибиторов cox-2</a>
Предыдущий патент: Практически безводное порообразующее вещество и способ его получения
Следующий патент: Стабильные композиции, содержащие левозимендан и альгиновую кислоту
Случайный патент: Игрушка с усовершенствованной трёхмерной головоломкой












