Циклические n,n’-диарилтиомочевины и n,n’-диарилмочевины – антагонисты андрогеновых рецепторов, противораковое средство, способ получения и применения
Номер патента: 20681
Опубликовано: 30.12.2014
Авторы: Митькин Олег Дмитриевич, Иващенко Александр Васильевич
Формула / Реферат
1. Циклические N,N'-диарилтиомочевины и N,N'-диарилмочевины общей формулы 1, их оптические (R)- и (S)-изомеры и их фармацевтически приемлемые соли, обладающие свойствами антагонистов андрогеновых рецепторов
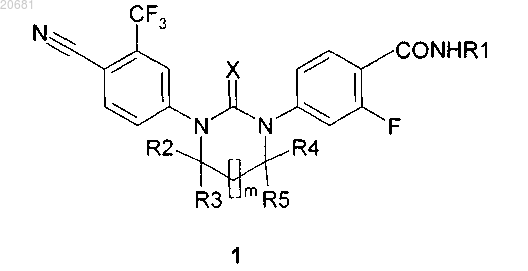
где X представляет собой кислород или серу; m = 0 или 1;
R1 представляет собой C1-C3 алкил;
R2 и R3 представляют собой водород; или
R2 и R3 вместе с атомом углерода, с которым они связаны, образуют группу С = О;
R4 и R5 представляют собой водород; или
R4 представляет собой водород, a R5 представляет собой метил;
или R4 представляет собой метил, R5 представляет собой CH2R6 группу, в которой R6 представляет собой C1-C3 алкоксикарбонил, карбоксил, необязательно замещенную гидроксильную группу, в которой заместителями могут быть водород, метил, бензил;
или R4 и R5 вместе с атомом углерода, с которым они связаны, образуют пяти- или шестичленный насыщенный гетероцикл, включающий один атом кислорода или азота, который может быть замещен метилом;
или R4 и R5 вместе с атомом углерода, с которым они связаны, представляют собой группу NH.
2. Соединения по п.1, представляющие собой циклические N,N'-диарилтиомочевины и N,N'-диарилмочевины общей формулы 1.2, 1.3 или 1.4, их оптические (R)- и (S)-изомеры и их фармацевтически приемлемые соли

где X, R1, R2, R3, R4 и R5 имеют вышеуказанное значение.
3. Соединения по п.2, представляющие собой циклические N,N'-диарилтиомочевины формулы 1.2.2, 1.2.3, их оптические (R)-изомеры - (R)-1.2.2, (R)-1.2.3 и (S)-изомеры - (S)-1.2.2 и (S)-1.2.3
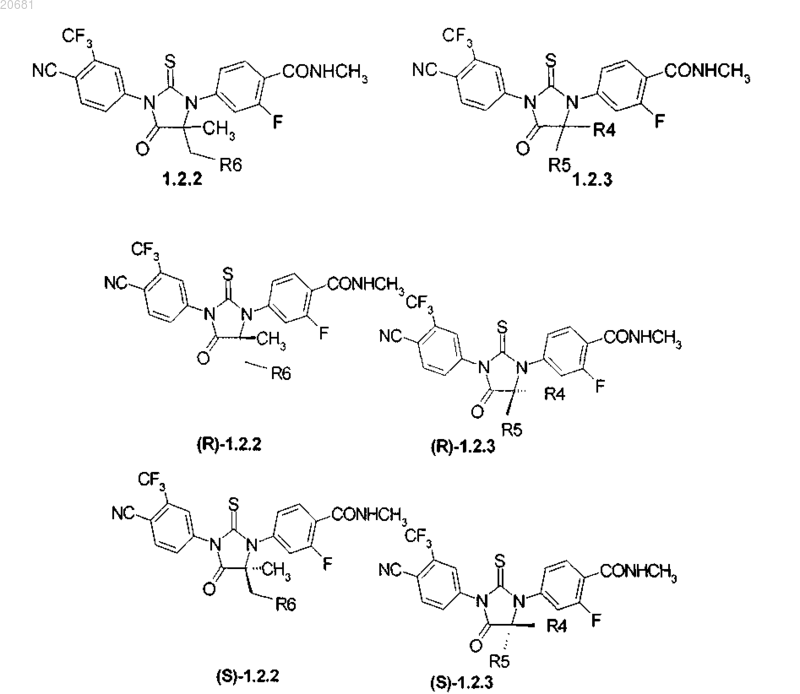
где R4 и R5 вместе с атомом углерода, с которым они связаны, образуют пяти- или шестичленный насыщенный гетероцикл, включающий один атом кислорода или азота, который может быть замещен метилом, R6 имеет вышеуказанное значение.
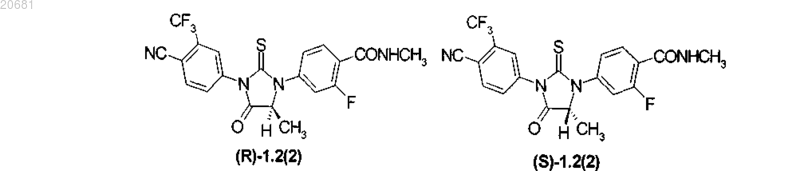
4. Соединения по п.3, представляющие собой циклические N,N'-диарилтиомочевины формулы 1.2(1), 1.2(2), их оптические (R)-изомер (R)-1.2(2) и (S)-изомер - (S)-1.2(2)
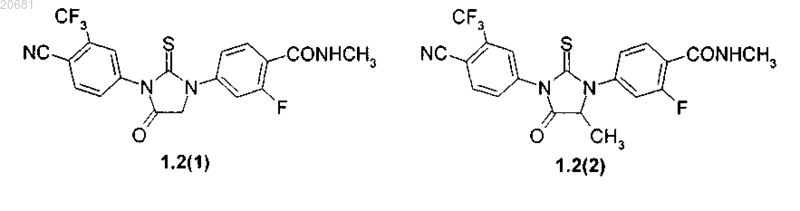
5. Соединения по п.2, представляющие собой соединения формулы 1.2.2(1), 1.2.2(2), 1.2.2(3), 1.2.3(1), 1.2.3(2) и 1.2.3(3), их оптические (R)-изомеры - (R)-1.2.2(1), (R)-1.2.2(2), (R)-1.2.2(3), (R)-1.2.3(1) и (S)-изомеры - (S)-1.2.2(1), (S)-1.2.2(2), (S)-1.2.2(3), (S)-1.2.3(1)
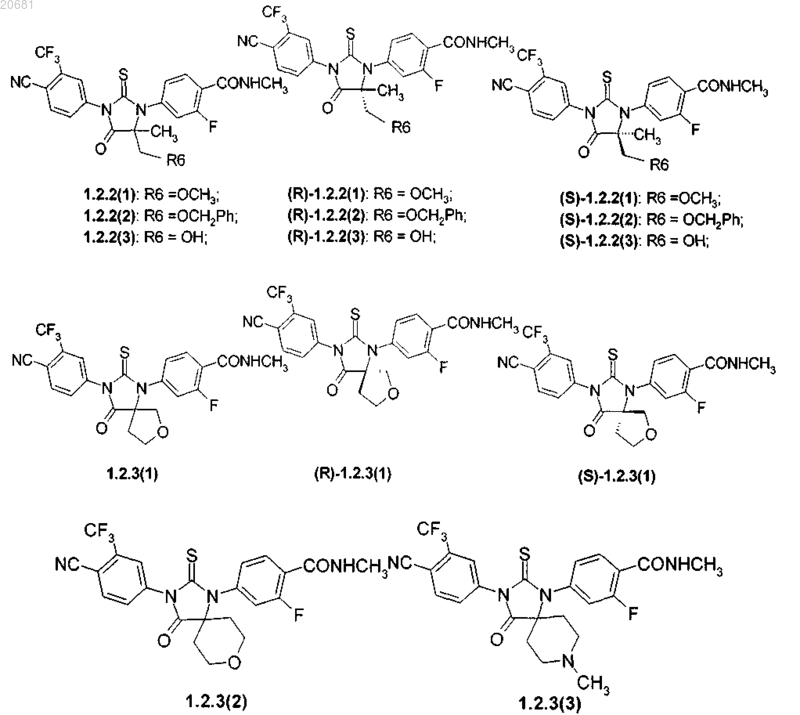
где R6 представляет собой гидроксильную группу, в которой заместители могут принимать значение водород, метил, бензил.
6. Способ получения соединений общей формулы 1.2 и их оптических (R)- и (S)-изомеров по пп.1-4 взаимодействием соответствующих 4-(цианометил)аминобензамидов 4.1 или (4-карбамоилфениламино)уксусных кислот 4.2 или их оптических (R)- и (S)-изомеров с изотиоцианатом 3.2

7. Противораковое средство, представляющее собой по крайней мере одну циклическую N,N'-диарилтиомочевину или N,N'-диарилмочевину общей формулы 1 по любому из пп.1-4, обладающее свойствами антагониста андрогеновых рецепторов.
8. Фармацевтическая композиция, обладающая свойством антагониста андрогеновых рецепторов, содержащая в качестве активного компонента противораковое средство по п.7.
9. Способ получения фармацевтической композиции по п.8 смешением противоракового средства по п.7 с инертным наполнителем и/или растворителем.
10. Лекарственное средство в форме таблеток, капсул или инъекций для лечения раковых заболеваний, включающее в свой состав противораковое средство по п.7 или фармацевтическую композицию по п.8.
11. Лекарственное средство по п.10, предназначенное для лечения рака простаты.
12. Способ лечения раковых заболеваний, в том числе рака простаты, введением лекарственного средства по пп.10, 11, или фармацевтической композиции по п.8, или противоракового средства по п.7.
Текст
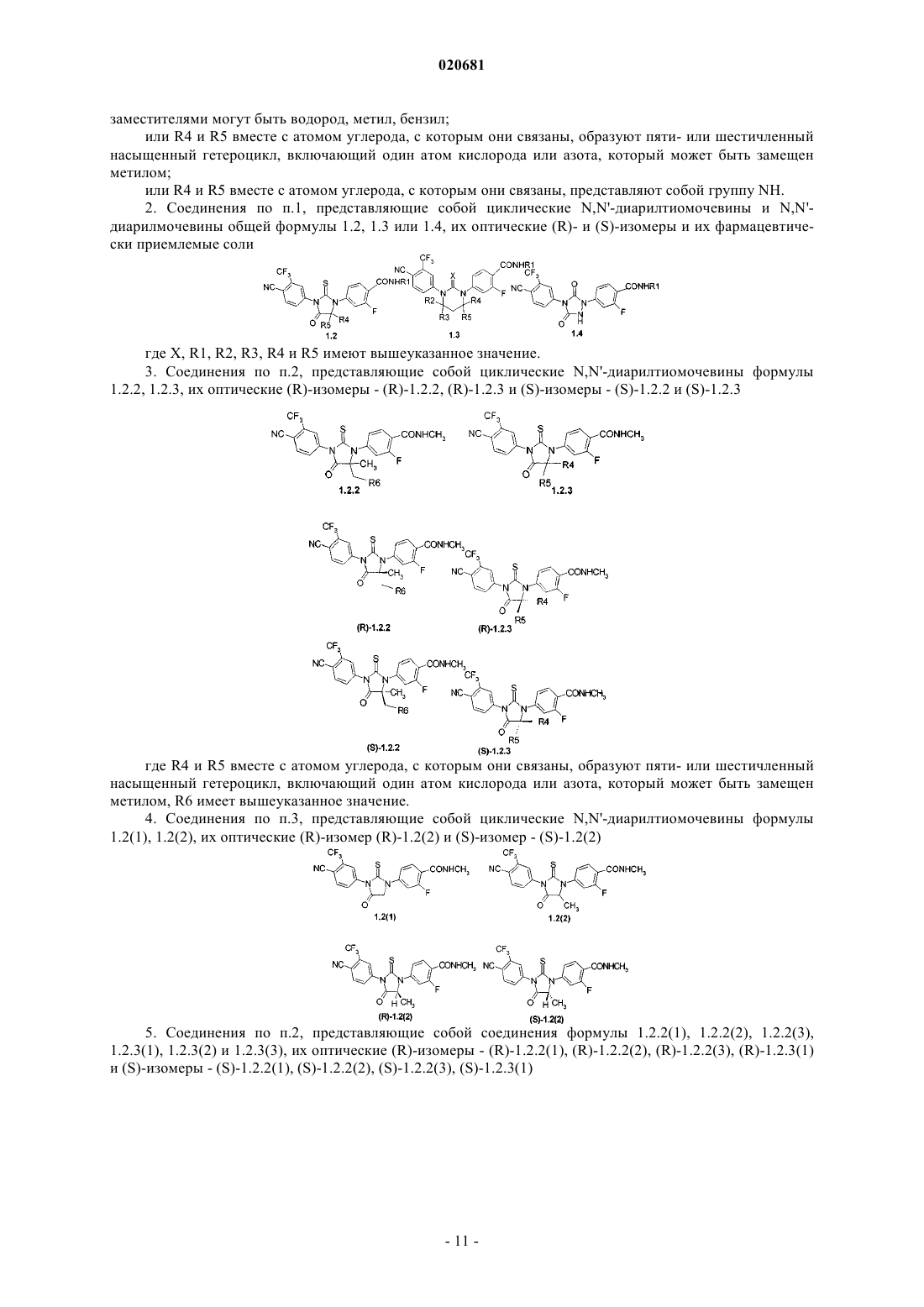
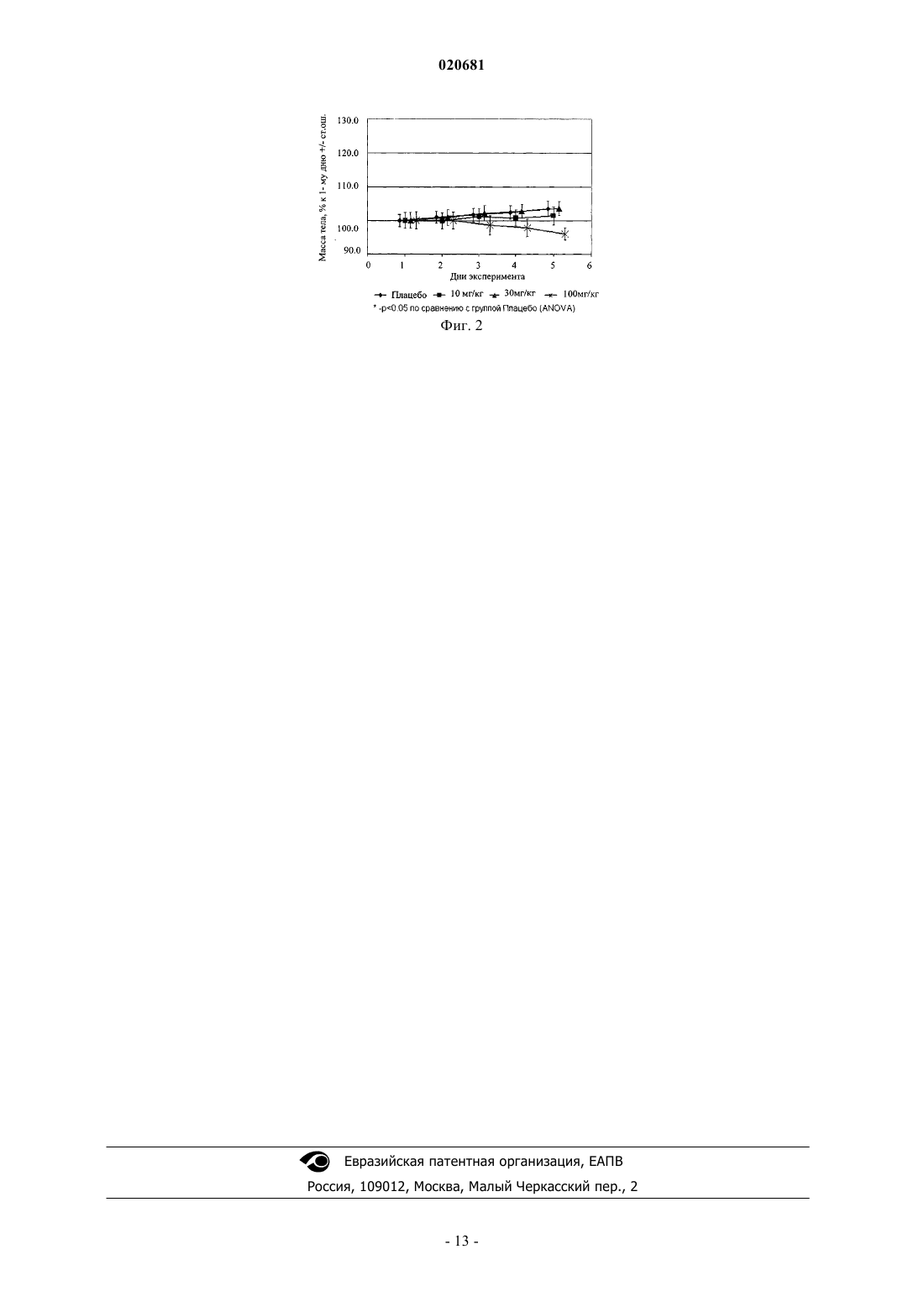
N,N'диарилтиомочевинам - антагонистам андрогеновых рецепторов, противораковому средству,фармацевтической композиции, лекарственному средству и способу лечения раковых заболеваний, в том числе рака простаты. Предложены циклические N,N'-диарилтиомочевины илиN,N'-диарилмочевины общей формулы 1, их оптические (R)- и (S)-изомеры и их фармацевтически приемлемые соли, обладающие свойствами антагонистов андрогеновых рецепторов, 020681 где X представляет собой кислород или серу; m = 0 или 1; R1 представляет собой C1-C3 алкил; R2 и R3 представляют собой водород; или R2 и R3 вместе с атомом углерода, с которым они связаны, образуют группу С=О; R4 и R5 представляют собой водород; или R4 представляет собой водород, a R5 представляет собой метил; или R4 представляет собой метил, R5 представляет собой CH2R6 группу, в которой R6 представляет собой C1-C3 алкоксикарбонил,карбоксил, необязательно замещенную гидроксильную группу, в которой заместители могут быть водородом, метилом, бензилом; или R4 и R5 вместе с атомом углерода, с которым они связаны, образуют пяти- или шестичленный насыщенный гетероцикл, включающий по крайней мере один атом кислорода или азота, который может быть замещен метилом, или R4 и R5 вместе с атомом углерода, с которым они связаны, представляют собой группу NH.(71)(73) Заявитель и патентовладелец: ИВАЩЕНКО АЛЕКСАНДР ВАСИЛЬЕВИЧ; ИВАЩЕНКО АНДРЕЙ АЛЕКСАНДРОВИЧ; САВЧУК НИКОЛАЙ ФИЛИППОВИЧ (RU) Область техники Изобретение относится к новым циклическим N,N'-диарилмочевинам и N,N'-диарилтиомочевинам антагонистам андрогеновых рецепторов, противораковому средству, фармацевтической композиции,лекарственному средству и способу лечения рака, в том числе рака простаты. Предшествующий уровень техники Известны антагонисты андрогеновых рецепторов, представляющие собой 1,3-диарил-5,5-диметил 2-тиоксоимидазолидин-4-оны I, 5,7-диарил-6-тиоксо-5,7-диазаспиро[3,4]октан-8-оны II и 1,3-диарил-2 тиоксо-1,3-диазаспиро[4,4]нонан-4-оны III, обладающие противораковой активностью [WO 2006124118,WO 2007127010]. Среди соединений этого класса наиболее продвинутым является антагонист андрогеновых рецепторов 4-[5,5-диметил-4-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксоимидазолидин-1 ил]-N-метил-2-фторбензамид MDV3100, находящийся в настоящее время в III фазе клинических испытаний, в качестве средства для лечения рака простаты [Drug Data Rep., 2009, 31(6), 609]. Поиск высокоэффективных противораковых лекарственных препаратов, обладающих повышенной активностью и пониженной токсичностью, по-прежнему является одним из основных направлений создания новых фармакологических средств для лечения рака, в том числе и рака простаты. В этой связи актуальным является разработка новых противораковых субстанций, фармацевтических композиций и лекарственных препаратов, а также способов их получения и применения. Раскрытие изобретения Ниже приведены определения терминов, которые использованы в описании этого изобретения."Азагетероцикл" означает ароматическую или неароматическую моноциклическую или полициклическую систему, содержащую в цикле, по крайней мере, один атом азота. Азагетероцикл может иметь один или более "заместителей циклической" системы. "Активный компонент" (лекарственное вещество,drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства)."Алкил" означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. "Разветвленная" означает, что алкильная цепь имеет один или несколько "низших алкильных" заместителей. Алкил может иметь один или несколько одинаковых или различных заместителей ("алкильных заместителей") включая галоген, алкенилокси, циклоалкил, арил, гетероарил,гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси и т.п."Антагонисты" означают лиганды, которые связываются с рецепторами определенного типа и не вызывают активного клеточного ответа. Антагонисты препятствуют связыванию агонистов с рецепторами и тем самым блокируют передачу специфического рецепторного сигнала."Арил" означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимуществено от 6 до 10 атомов углерода. Арил может содержать один или более "заместителей циклической системы", которые могут быть одинаковыми или разными. Представителями арильных групп являются фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с неароматической циклической системой или гетероциклом. "Гетероциклил" означает ароматическую или неароматическую насыщенную моноциклическую или полициклическую систему, включающую от 3 до 10 атомов углерода, преимущественно от 5 до 6 атомов углерода,в которой один или несколько атомов углерода замещены на гетероатом, такой как азот, кислород, сера. Приставка "аза", "окса" или "тиа" перед гетероциклилом означает наличие в циклической системе атома азота, атома кислорода или атома серы, соответственно. Гетероциклил может иметь один или несколько"заместителей циклической системы", которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероциклиле, могут быть окислены до N-оксида, S-оксида или S-диоксида. Представителями гетероциклилов являются пиперидинил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,4-диоксан-2-ил, тетрагидрофуранил, тетрагидротиофенил и др. "Гидрат" означает стехиометрическую или нестехиометрическую композицию соединения или его соли с водой."Заместитель" означает химический радикал, который присоединен к скэффолду (фрагменту), например, "заместитель алкильный", "заместитель аминогруппы", "заместитель карбамоильный", "заместитель циклической системы", значения которых определены в данном разделе."Лекарственное средство (препарат)" - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул инъекций, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лече-1 020681 ния и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего. "Низший алкил" означает линейный или разветвленный алкил с 1-4 атомами углерода. "Фармацевтическая композиция" обозначает композицию, включающую в себя соединение формулы 1 и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как, консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например,таких как, парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы,жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения. Фармацевтические композиции, как правило, получают с помощью стандартных процедур, предусматривающих смешение активного соединения с жидким или тонко измельченным твердым носителем."Фармацевтически приемлемая соль" означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты,нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты,пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные. (Подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим солям относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, предпочтительными являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил) аминометан и им подобные. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин. Авторы обнаружили новые циклические N,N'-диарилтиомочевины и N,N'-диарилмочевины общей формулы 1, их оптические (R)- и (S)-изомеры и фармацевтически приемлемые соли, являющиеся антагонистами андрагеновых рецепторов. где X представляет собой кислород или серу;R4 и R5 представляют собой водород; или R4 представляет собой водород, a R5 представляет собой метил; или R4 представляет собой метил, R5 представляет собой CH2R6 группу, в которой R6 представляет собой C1-C3 алкоксикарбонил, карбоксил, необязательно замещенную гидроксильную группу, в которой заместители могут быть водород, метил, бензил; или R5 и R4 вместе с атомом углерода, с которым они связаны, образуют пяти или шестичленный гетероцикл, включающий, по крайней мере, один атом кислорода или азота, который может быть замещен метилом,или R4 и R5 вместе с атомом углерода, с которым они связаны, представляют собой группу NH. Предпочтительными являются N,N'-диарилтиомочевины и N,N'-диарилмочевины, их оптические(R)- и (S)-изомеры и фармацевтически приемлемые соли общей формулы 1.2, 1.3 или 1.4. где X, R1, R2, R3, R4 и R5 имеют вышеуказанное значение. Более предпочтительными являются циклические N,N'-диарилтиомочевины формулы 1.2(1), 1.2(2),1.2.2 и 1.2.3, и их оптические (R)-изомеры - (R)-1.2(2), (R)-1.2.2, (R)-1.2.3 и (S)-изомеры - (S)-1.2(2), (S)1.2.2 и (S)-1.2.3 где R5 и R4 вместе с атомом углерода, с которым они связаны, образуют пяти или шестичленный гетероцикл, включающий по крайней мере один атом кислорода или азота, который может быть замещен метилом, R6 имеет вышеуказанное значение. Более предпочтительными являются также соединения формулы 1.2.2(1), 1.2.2(2), 1.2.2(3), 1.2.3(1),1.2.3(2) и 1.2.3(3), их оптические (R)-изомеры - (R)-1.2.2(1), (R)-1.2.2(2), (R)-1.2.2(3), (R)-1.2.3(1), и (S)изомеры - (S)-1.2.2(1), (S)-1.2.2(2), (S)-1.2.2(3), (S)-1.2.3(1) где R6 представляет собой гидроксильную группу, в которой заместители могут принимать значение водород, метил, бензил. Предметом данного изобретения является способ получения соединений общей формулы 1.2 и их оптических (R)- и (S)-изомеров. 1,3-Диарилгидантоины общей формулы 1.2 получают при взаимодействии изотиоцианата 3.2 с соответствующими 4-(цианометил)аминобензамидами 4.1 или (4-карбамоилфениламино)уксусными кислотами 4.2 с по схеме 1. Схема 1 где R1, R4 и R5 имеют вышеуказанное значение. Оптически активные циклические N,N'-диарилтиомочевины, (R)-1.2 и (S)-1.2 изомеры, получают либо, исходя из соответствующих оптически активных исходных (R)-4.1, (R)-4.2, (S)-4.1 и (S)-4.2, либо разделением на энантиомеры рацемических смесей циклических N,N'-диарилтиомочевин 1.2. где R1, R4 и R5 имеют вышеуказанное значение. 1,3-Диарил-тетрагидропиримидин-2-оны общей формулы 1.3.1 получают при взаимодействии соответствующих N,N'-диарилмочевин общей формулы 2 с 1,3-дибромпропаном по схеме 2. Схема 2 где R1 имеет вышеуказанное значение. Соединения общей формулы 1.3.2 получают при взаимодействии изоцианата 3.1 или изотиоцианата 3.2 с соответствующими этил -аланинатами общей формулы 5 с последующей циклизацией образующихся мочевин общей формулы 6 по схеме 3. где X и R1 имеют вышеуказанное значение. 1,4-Диарил-[1,2,4]триазолидин-3,5-дионы общей формулы 1.4 получают при взаимодействии соответствующего гидразина 7 с изоцианатом 3.1 с последующей конденсацией образующегося семикарбазида 8 с дифосгеном по схеме 4. Схема 4 где R1 имеет вышеуказанное значение. Новые антагонисты андрогенных рецепторов пригодны также для изучения молекулярного механизма ингибирования и активации андрогенных рецепторов. Новые циклические N,N'-диарилтиомочевины и N,N'-диарилмочевины общей формулы 1 являются антагонистами андрогенных рецепторов, причем по активности они превосходят известные антагонисты андрогенных рецепторов, опубликованные в патентных заявках WO 2006124118, WO 2007127010, и вDrug Data Rep., 2009, 31(6), 609. Кроме того, новый антагонист 1.2.2(1) более чем в три раза менее токсичен, чем антагонистMDV3100, так как его максимально переносимая доза (MTD), найденная в экспериментах на самцах мышей линии CD1 составляет MTD100 мг/кг, в то время как MDV3100 имеет MTD 30 мг/кг. Предметом данного изобретения является новое противораковое средство, представляющее собой,по крайней мере, одну циклическую N,N'-диарилтиомочевину или N,N'- диарилмочевину общей формулы 1. Предметом данного изобретения является также новая фармацевтическая композиция, содержащая в качестве активного компонента, по крайней мере, одну циклическую N,N'-диарилтиомочевину илиN,N'- диарилмочевину общей формулы 1, ее оптически активный изомер или фармацевтически приемлемую соль, обладающую противораковой активностью, в эффективном количестве. Более предпочтительной является фармацевтическая композиция, обладающая активностью в отношении рака простаты, содержащая в качестве активного компонента по крайней мере одну циклическую N,N'-диарилтиомочевину или N,N'-диарилмочевину общей формулы 1, ее оптический изомер или фармацевтически приемлемую соль. Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми экспициентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с циклической N,N'-диарилтиомочевиной или N,N'-диарилмочевиной общей формулы 1, ее оптически активным изомером или фармацевтически приемлемой солью по настоящему изобретению может включать и другие активные компоненты, в том числе обладающие противораковой активностью, при условии, что они не вызывают нежелательных побочных эффектов. При необходимости использования фармацевтической композиции по настоящему изобретению в клинической практике она может смешиваться с традиционными фармацевтическими носителями. Носители, используемые в фармацевтической композиции по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты,дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы,стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты. Целью настоящего изобретения также является способ получения фармацевтических композиций. Поставленная цель достигается смешением нового противоракового средства с инертным наполнителем и/или растворителем, отличительная особенность которого состоит в том, что в качестве противо-5 020681 ракового средства используют, по крайней мере, одну циклическую N,N'-диарилтиомочевину или N,N'диарилмочевину общей формулы 1, ее оптически активный изомер или фармацевтически приемлемую соль. Предметом данного изобретения является также лекарственное средство, в форме таблеток, капсул или инъекций, включающее в свой состав новое противораковое средство или новую фармацевтическую композицию, предназначенную для лечения рака. Более предпочтительным лекарственным средством, включающим в свой состав новое противораковое средство или новую фармацевтическую композицию, является лекарственное средство, предназначенное для лечения рака простаты. Предметом данного изобретения являются также терапевтические коктейли для лечения раковых заболеваний, в том числе рака простаты, включающие в качестве одного из компонентов новое лекарственное средство или новую фармацевтическую композицию, содержащие в качестве активного компонента, по крайней мере, одну циклическую N,N'-диарилтиомочевину или N,N'-диарилмочевину общей формулы 1, их оптически активный изомер или фармацевтически приемлемую соль. Терапевтический коктейль для лечения рака простаты, наряду с лекарственным средством по данному изобретению, может содержать другие известные препараты, предназначенные для лечения раковых заболеваний. В соответствии с данным изобретением способ лечения раковых заболеваний животных и людей, в том числе рака простаты, заключается во введении теплокровному животному или человеку нового лекарственного средства, новой фармацевтической композиции или нового терапевтического коктейля. Лекарственные средства могут вводиться перорально или парентерально, например, внутривенно,подкожно, внутрибрюшинно или местно. Клиническая дозировка лекарственного средства общей формулы 1 у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10500 мг, предпочтительно - 50300 мг. Поэтому во время приготовления лекарственного средства из фармацевтической композиции по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10500 мг лекарственного средства общей формулы 1 предпочтительно 50300 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочти гельно - от одного до шести раз). Лучший вариант осуществления изобретения Изобретение поясняется чертежами. Фиг. 1. Изменение веса самцов мышей при пероральном введении соединения 1.2.2(1). Фиг. 2. Изменение веса самцов мышей при пероральном введении соединения MDV3100. В представленных ниже примерах описан синтез N,N'-диарилтиомочевин и N,N'-диарилмочевин и данные их биологических испытаний, которые иллюстрируют, но не ограничивают, данное изобретение. Пример 1. Синтез N-метил-4-4-оксо-2-тиоксо-3-[3-(трифторметил)-4-цианофенил]-имидазолидин 1-ил-2-фторбензамида 1.2(1). К раствору 279 мг (1 ммоль) 4-иодметил-2-фторбензамида в 3 мл ДМФА добавляют 80 мг (1.07 ммоль) глицина и 207 мг (1.5 ммоль) K2CO3. Реакционную смесь перемешивают в микроволновой печи при 140C в течение 18 мин, охлаждают, разбавляют 10 мл AcOEt и 10 мл воды, нейтрализуют HCl до рН 2-3, органический слой отделяют, водный экстрагируют AcOEt (520 мл). Объединенные экстракты промывают рассолом, сушат над Na2SO4 и упаривают в вакууме. Продукт выделяют колоночной хроматографией на SiO2. Получают N-(4-метилкарбамоил-2-фторфенил)глицин 4.2(1) (R1=CH3, R4=R5=H,). Раствор 113 мг (0.5 ммоль) N-(4-метилкарбамоил-2-фторфенил)глицина 4.2(1) и 174 мг (1.0 ммоль) 4-изотиоцианато-2-(трифторметил)бензонитрила 3.2 в 2 мл ДМФА перемешивают при 90C в течение 12 ч. Реакционную смесь упаривают в вакууме и методом HPLC выделяют Nметил-4-4-оксо-2-тиоксо-3-[3-(трифторметил)-4-цианофенил]-имидазолидин-1-ил-2-фторбензамид 1.2(1). LCMS (М+Н)+ 437. Пример 2. Общий метод синтеза N-метил-4-5-метил-4-оксо-2-тиоксо-3-[3-(трифторметил)-4 цианофенил]имидазолидин-1-ил-2-фторбензамида 1.2(2), N-метил-4-(S)-5-метил-4-оксо-2-тиоксо-3-[3(трифторметил)-4-цианофенил]имидазолидин-1-ил-2-фторбензамида (S)-1.2(2) и N-метил-4-(R)-5 метил-4-оксо-2-тиоксо-3-[3-(трифторметил)-4-цианофенил]имидазолидин-1-ил-2-фторбензамида(R)1.2(2). К раствору 667 мг (3.9 ммоль) N-метил-2,4-дифторбензамида в 3 мл ДМСО добавляют 347 мг (7.8 ммоль) (D,L)-, (D)- или (L)-аланина и 2.54 г (7.8 ммоль) Cs2CO3. Реакционную массу перемешивают в закрытой пробирке при 90C в течение 18 ч. Охлажденную смесь разбавляют изопропанолом, нейтрализуют 1.36 мл (15.6 ммоль) HCl, фильтруют, упаривают в вакууме и методом HPLC выделяют N-(4 метилкарбамоил-3-фторфенил)аланин 4.2(2) (R1=CH3, R4=H, R5=CH3) (S)-N-(4-метилкарбамоил-3 фторфенил)аланин (S)-4.2(2) или (R)-N-(4-метилкарбамоил-3-фторфенил)аланин (R)-4.2(2). LCMS(М+Н)+ 241. 1H ЯМР (ДМСО-d6, 400 МГц): 12.66 (уш. с, 1 Н), 7.62 (м, 1 Н), 7.45 (т, J= 8.8 Гц, 1H), 6.67 (уш. д, J= 7.2 Гц, 1 Н), 6.42 (дд, J1 = 8.4 Гц, J2 = 2.0 Гц, 1 Н), 6.29 (дд, J1 = 14.8 Гц, J2 = 2.0 Гц, 1 Н), 4.03 (м, 1 Н),2.73 (д, J= 4.4 Гц, 3H), 1.37 (д, J= 7.2 Гц, 3H). Раствор 110 мг (0.46 ммоль) амина 4.2(2), (S)-4.2(2) или (R)4.2(2) и 144 мг (0.55 ммоль) 4-изотиоцианато-2-(трифторметил)-бензонитрила 3.2 в 2 мл ДМФА перемешивают в микроволной печи при 90C в течение 12 ч, затем добавляют еще 50 мг (0.19 ммоль) 4 изотиоцианато-2-(трифторметил)-бензонитрила 3.2 и перемешивание продолжают в течение еще 12 ч. Реакционную массу упаривают в вакууме и методом HPLC выделяют соответственно N-метил-4-5 метил-4-оксо-2-тиоксо-3-[3-(трифторметил)-4-цианофенил]имидазолидин-1-ил-2-фторбензамид 1.2(2),или N-метил-4-(S)-5-метил-4-оксо-2-тиоксо-3-[3-(трифторметил)-4-цианофенил]имидазолидин-1-ил-2 фторбензамидN-метил-4-(R)-5-метил-4-оксо-2-тиоксо-3-[3-(трифторметил)-4 цианофенил]имидазолидин-1-ил-2-фторбензамид (R)-1.2(2). Кажущиеся константы ингибирования андрогеновых рецепторов (Ki) для этих соединений составляют соответственно: Ki1.2(2) = 140.2 nM, Ki(S)-1.2(2) = 106.7 nM и Ki(R)-1.2(2) = 73.6 nM. LCMS (М+Н)+ 451. 1H ЯМР (CDCl3, 400 МГц): 8.28 (т, J= 8.6 Гц, 1 Н), 8.01 (д, J= 8.0 Гц, 1 Н), 7.94 (д, J = 1.2 Гц, 1 Н), 7.81 (дд, J1 = 8.0 Гц, J2 = 1.2 Гц, 1H), 7.48 (дд, J1 = 12.4 Гц, J2 = 1.6 Гц, 1 Н), 7.36 (дд, J1 = 8.4 Гц, J2 = 1.6 Гц, 1 Н), 6.72(уш. м, 1 Н), 4.83 (к, J = 7.2 Гц, 1 Н), 3.08 (д, J= 4.8 Гц, 3H), 1.60 (д, J= 7.2 Гц, 3H). Пример 3. Синтез N-метил-4-2-тио-3-[3-(трифторметил)-4-цианофенил]гидантоин-1-ил-2-фторбензамидов 1.2.2 и 1.2.3 (общая методика). Раствор 0.75 ммоль соответствующего N-метил-2-фтор-4-[(1 цианометил)амино]бензамида 4.1 и 342 мг (1.5 ммоль) 4-изотиоцианато-2-(трифторметил)бензонитрила 3.2 в 3 мл ДМФА перемешивают в микроволной печи при 110 C в течение 12 ч. Реакционную смесь растворяют в 30 мл МеОН, добавляют 7.5 мл 1N HCl и кипятят в течение 1.5 ч. Раствор упаривают в вакууме, обрабатывают водой, осадок отфильтровывают, промывают водой и высушивают в вакууме. Продукт выделяют методом HPLC. Получают N-метил-4-[5-метил-5-(метоксиметил)-4-оксо-2-тиоксо-3-[3(трифторметил)-4-цианофенил]имидазолидин-1-ил]-2-фторбензамид 1.2.2(1), Ki1.2.2(1) = 115.9 nM, который разделяют на энантиомеры с помощью жидкостной хроматографии высокого давления на ChiralpakHD-H 251 см (Chiral Technologies Inc., USA). В качестве элюента используют смесь 80% н-гексана, 20% 2-пропанола и 0.02% триэтиламина. Скорость потока 4 мл/мин. Получают оптически чистые изомерыH ЯМР (ДМСО-d6, 400 МГц): 10.09 (уш. с, 1 Н), 8.48 (к, J = 4.4 Гц, 1H), 8.43 (д, J = 8.4 Гц, 1H), 8.29 (с,1 Н), 8.11 (д, J= 8.4 Гц, 1 Н), 7.84 (т, J = 8.0 Гц, 1H), 7.42 (д, J = 10.4 Гц, 1 Н), 7.30 (д, J = 8.0 Гц, 1 Н), 3.50 (м,4 Н), 2.80 (д, J = 4.4 Гц, 3H), 2.78 (с, 3H), 2.72 (д, J = 14.0 Гц, 1H), 2.16 (м, 2 Н). Пример 4. Синтез N-метил-4-[5-(гидроксиметил)-5-метил-4-оксо-2-тиоксо-3-[3-(трифторметил)-4 цианофенил]имидазолидин-1-ил]-2-фторбензамида 1.2.2(3). К раствору 55 мг (0.11 ммоль) N-метил-4-[5 метил-5-(метоксиметил)-4-оксо-2-тиоксо-3-[3-(трифторметил)-4-цианофенил]имидазолидин-1-ил]-2 фторбензамида в 1.5 мл CH2Cl2 под аргоном при -78C по каплям прибавляют 53 мкл (0.55 ммоль) BBr3. Реакционную массу перемешивают 3 ч при -78C и затем еще 3 ч при комнатной температуре. По окон-7 020681 чании реакции избыток BBr3 нейтрализуют добавлением 10 мл 5% раствора карбоната натрия, продукт экстрагируют AcOEt, сушат над Na2SO4, упаривают в вакууме и методом HPLC выделяют N-метил-4-[5(гидроксиметил)-5-метил-4-оксо-2-тиоксо-3-[3-(трифторметил)-4-цианофенил]имидазолидин-1-ил]-2 фторбензамид 1.2.2(3), Ki1.2.2(3) = 46.3 nM, 1H ЯМР (ДМСО-d6, 400 МГц): 8.43 (уш. м, 1 Н), 8.39 (д, J= 8.4 Гц, 1 Н), 8.13 (с, 1 Н), 7.98 (д, J = 8.4 Гц, 1 Н), 7.78 (т, J= 8.0 Гц, 1 Н), 7.42 (д, J= 10.8 Гц, 1 Н), 7.37 (д, J = 8.0 Гц, 1 Н), 5.93(т, J =4.4 Гц, 1 Н), 3.81 (дд, J1 = 11.6 Гц, J2 = 4.4 Гц, 1 Н), 3.45 (дд, J1 = 11.6 Гц, J2 = 5.0 Гц, 1 Н),2.79 (д, J= 4.0 Гц, 3H), 1.38 (с, 3H). Пример 5. Синтез 4-метил-3-(4-метилкарбамоил-3-фторфенил)-5-оксо-2-тиоксо-1-[3-(трифторметил)-4-цианофенил]имидазолидин-4-илуксусной кислоты 1.2.2(5) (R1=CH3, R4=CH3, R5=CH2COOH). К раствору 46 мг (0.086 ммоль) эфира 1.2.2(4) 2 мл спирта добавляют раствор 7 мг (0.172 ммоль) NaOH в 0.5 мл воды и реакционную массу перемешивают 12 ч (LCMS контроль). Раствор упаривают, добавляют 2 мл изопропанола и 15 мкл (0.172 ммоль) HCl, фильтруют и вновь упаривают в вакууме. 4-Метил-3-(4 метилкарбамоил-3-фторфенил)-5-оксо-2-тиоксо-1-[3-(трифторметил)-4-цианофенил]имидазолидин-4 илуксусную кислоту 1.2.2(5) выделяют методом HPLC. LCMS (М+Н)+ 469. 1H ЯМР (ДМСО-d6, 400 МГц): 13.31 (уш. с, 1 Н), 8.44 (м, 2 Н), 8.10 (с, 1 Н), 7.95 (д, J = 7.6 Гц, 1 Н), 7.81 (т, J = 8.0 Гц, 1 Н), 7.25 (д, J= 10.8 Гц, 1 Н), 7.19 (д, J=8.0 Гц, 1 Н), 3.16 (д, J= 17.6 Гц, 1 Н), 2.79 (д, J = 3.6 Гц, 3H), 2.70 (д, J = 17.6 Гц,1 Н), 1.59 (с, 3H). Пример 6. Синтез 4-[3-[3-(трифторметил)-4-цианофенил]-2-оксо-тетрагидро-пиримидин-1(2H)-ил]N-метил-2-фторбензамида 1.3.1. К раствору 100 мг (0.26 ммоль) 4-[4-циано-3-(трифторметил)фенилкарбамоиламино]-N-метил-2-фторбензамида 2 в 2 мл ДМФА добавляют 109 мг (0.79 ммоль) K2CO3 и 32 мкл (0.32 ммоль) 1,3-дибромпропана. Смесь перемешивают при 90C. Через 18 ч добавляют еще 109 мг K2CO3 и 32 мкл 1,3-дибромпропана и продолжают перемешивание при той же температуре. Добавление повторяют еще 2 раза. По окончании реакции смесь упаривают в вакууме, остаток растворяют в хлороформе, промывают водой, сушат над Na2SO4, растворитель отгоняют. Продукт выделяют методом колоночной хроматографии на SiO2 (элюент - AcOEt). LCMS (М+Н)+ 421. 1H ЯМР (ДМСО-d6, 400 МГц): 8.17 (уш. м, 1H), 8.13 (д, J = 8.4 Гц, 1H), 8.07 (д, J= 2.0 Гц, 1 Н), 7.83 (дд, J1 = 8.4 Гц, J2 = 2.0 Гц, 1 Н), 7.62(т, J= 8.4 Гц, 1 Н), 7.38 (дд, J1 = 12.4 Гц, J2 = 2.0 Гц, 1 Н), 7.29 (дд, J1= 8.4 Гц, J2 = 2.0 Гц, 1 Н), 3.90 (т, J = 5.8 Гц, 2 Н), 3.81 (т, J= 5.8 Гц, 2 Н), 2.77 (д, J = 4.8 Гц, 3H), 2.21 (м, 2 Н). Пример 7. Синтез N-метил-4-[3-(трифторметил)-4-цианофенил]-2,4-диоксотетрагидропиримидин 1(2H)-илбензамида 1.3.2(1), (Х=О, R1=CH3). К раствору 9 г (53.6 ммоль) 4-амино-N-метил-2 фторбензамида в 90 мл ДМСО прибавляют 8 г (80 ммоль) этилакрилата и 0.81 г (5.4 ммоль) DBU и перемешивают 24 ч при 70C (LCMS контроль). Реакционную массу подвергают лиофилизации, остаток перекристаллизовывают из водного спирта. Получают этил N-[4-(метилкарбамоил)-3-фторфенил]-аланинат 5. LCMS (М+Н)+ 269. 1H ЯМР (ДМСО-d6, 400 МГц)7.57 (уш. с, 1 Н), 7.48 (т, J = 8.8 Гц, 1 Н),6.47 (уш. с, 1 Н), 6.42 (д, J = 8.8 Гц, 1 Н), 6.33 (д, J = 14.8 Гц, 1 Н), 4.07 (к, J = 7.2 Гц, 2 Н), 3.32 (уш. м, 2 Н),2.73 (д, J = 4.4 Гц, 3H), 2.55 (т, J = 6.4 Гц, 2 Н), 1.18 (т, J = 7.2 Гц, 3H). Раствор 425 мг (1.87 ммоль) 4 изоцианато-2-(трифторметил)бензонитрила 3.1 и 500 мг (1.87 ммоль) этил N-[4-(метилкарбамоил)-3 фторфенил]аланината 5 (R1=CH3) в 10 мл CH2Cl2 перемешивают 15 ч. Реакционную массу упаривают в вакууме и продукт выделяют методом колоночной хроматографии на SiO2 (элюент - гексан : AcOEt:Et3N =1:1:0.03). Получают этил N-[4-(метилкарбамоил)-3-фторфенил]-N-[3-(трифторметил)-4 цианофенил]карбамоилаланинат 6(1) (R1=CH3, Х=О). LCMS (М+Н)+ 481. К раствору 500 мг (1.04 ммоль) этил N-[4-(метилкарбамоил)-3-фторфенил]-N-[3-(трифторметил)-4-цианофенил]карбамоил-аланината 6(1) в 5 мл АсОН добавляют 2.5 мл HCl и перемешивают 15 ч. Реакционную массу выливают в воду, продукт экстрагируют EtOAc. Органический слой сушат над Na2SO4, упаривают в вакууме и колоночной хроматографией на SiO2 (элюент-гексан : AcOEt =1:1) выделяют N-метил-4-[3-(трифторметил)4-цианофенил]-2,4-диоксотетрагидропиримидин-1(2H)-илбензамид 1.3.2, (Х=О, R1=CH3); Ki1.3.2(1) = 85.6(т, J = 6.4 Гц, 2 Н), 3.03 (т, J = 6.4 Гц, 2 Н), 2.77 (д, J = 4.4 Гц, 3H). Пример 8. Синтез N-метил-4-[3-(трифторметил)-4-цианофенил]-4-оксо-2-тиоксотетрагидропиримидин-1(2H)-илбензамида 1.3.2(2), (X=S, R1=CH3). Раствор 320 мг (1.51 ммоль) 4-изотиоцианато-2(трифторметил)бензонитрила 3.2 и 404 мг (1.51 ммоль) этил N-[4-(метилкарбамоил)-3-фторфенил]-аланината 5 (R1=CH3) в 8 мл ДМФА нагревют в микроволновой печи при 60C в течение 8 ч. Реакционную массу упаривают в вакууме и колоночной хроматографией на SiO2 (элюент - гексан : AcOEt = 1:2) выделяют этил N-[4-(метилкарбамоил)-3-фторфенил]-N-[3-(трифторметил)-4-цианофенил]тиокарбамоил-р-аланинат 6(2) (R1=CH3, X=S). LCMS (M+H)+ 497. К раствору 200 мг (0.4 ммоль) эфира 6(2) в 1 мл спирта добавляют раствор 32 мг (0.8 ммоль) NaOH в 0.25 мл воды и полученную смесь перемешивают при 80C в течение 2 ч (LCMS контроль), охлаждают, нейтрализуют 69 мкл (0.8 ммоль) HCl, упаривают в вакууме, остаток экстрагируют горячим изопропанолом и вновь упаривают в вакууме. Получают N-[4-(метилкарбамоил)-3-фторфенил]-N-[3-(трифторметил)-4-цианофенил]тиокарбамоилаланин 6(3) (R1=CH3, X=S). LCMS (М+Н)+ 469. К раствору 114 мг (0.24 ммоль) полученной кисло-8 020681 ты 6(3) в 1.5 мл ДМФА добавляют 86 мг (0.36 ммоль) TBTU и 110 мг (0.84 ммоль) диизопропилэтиламина. Реакционную смесь перемешивают при 45C в течение 15 ч. По окончании реакции (LCMS контроль) раствор выливают в воду и экстрагируют EtOAc. Органический слой сушат над Na2SO4, упаривают в вакууме и методом HPLC выделяют N-метил-4-[3-(трифторметил)-4-цианофенил]-4-оксо-2-тиоксотетрагидропиримидин-1(2H)-ил-2-фторбензамид 1.3.2(2) (R1=CH3, X=S); Ki1.3.2(2) = 95.2 nM. LCMS(M+H)+ 451. 1H ЯМР (ДМСО-d6, 400 МГц): 8.35 (к, J = 4.4 Гц, 1 Н), 8.27 (д, J = 8.0 Гц, 1 Н), 8.06 (д, J = 1.6 Гц, 1 Н), 7.83 (дд, J1 = 8.0 Гц, J2 = 1.6 Гц, 1 Н), 7.71 (т, J = 8.2 Гц, 1 Н), 7.42 (дд, J1= 11.0 Гц, J2 = 1.8 Гц, 1 Н),7.33 (дд, J1 = 8.2 Гц, J2 = 1.8 Гц, 1H), 4.13 (т, J = 6.8 Гц, 2 Н), 3.17 (т, J = 6.8 Гц, 2 Н), 2.78 (д, J = 4.4 Гц, 3H). Пример 9. Синтез N-метил-2-фтор-4-[4-[3-(трифторметил)-4-цианофенил]-3,5-диоксо-1,2,4-триазолидин-1-ил]бензамида 1.4 (R1=CH3). К раствору 1 г (5.95 ммоль) 4-амино-N-метил-2-фторбензамида в 3.1 мл 5N HCl добавляют по каплям 2.38 мл 2.5 М раствора NaNO2, поддерживая температуру смеси 5C. Смесь перемешивают еще 30 мин при той же температуре, после чего полученный раствор прикапывают к суспензии 4.03 г (17.9 ммоль) SnCl22H2O в 4.2 мл соляной кислоты при 0C и перемешивание продолжают в течение 2 ч при этой температуре. Выпавший осадок отфильтровывают, растворяют в 40 мл воды и добавляют NaOH до сильнощелочной реакции. Смесь экстрагируют эфиром (3100 мл), сушат над MgSO4 и упаривают в вакууме. Получают 4-гидразино-N-метил-2-фторбензамид 7(R1=CH3). LCMS(М+Н)+184. 1 Н ЯМР (CDCl3, 400 МГц): 7.96 (т, J = 8. 4 Гц, 1 Н), 6.64 (уш. м, 1 Н), 6.60 (т, J = 1.6 Гц, 1 Н),6.57 (дд, J1 = 7.2 Гц, J2 = 2.0 Гц, 1 Н), 5.60 (уш. с, 1 Н), 3.66 (уш. с, 2 Н), 3.00 (дд, J1= 4.8 Гц, J2 = 1.2 Гц, 1H). К раствору 54 мг (0.29 ммоль) 4-гидразино-N-метил-2-фторбензамида 7 в 3 мл диоксана прибавляют раствор 59 мг (0.27 ммоль) 4-изоцианато-2-(трифторметил)бензонитрила 3.1 в 2 мл диоксана и полученную смесь перемешивают в течение 2 ч. Затем диоксан отгоняют в вакууме, остаток растирают с эфиром, отфильтровывают и сушат в вакууме. Получают 2-[(4-метилкарбамоил)-3-фторфенил]-N-[3(трифторметил)-4-цианофенил]гидразинкарбоксамид 8(1) (R1=CH3). LCMS (M+H)+ 405. 1H ЯМР (ДМСОd6, 400 МГц): 9.65 (уш. с, 1 Н), 8.72 (уш. с, 1 Н), 8.37 (с, 1H), 8.25 (уш. с, 1H), 8.03 (уш. м, 1 Н), 7.88 (д, J = 8.8 Гц, 1H), 7.58 (м, 2 Н), 6.63 (д, J = 8.4 Гц, 1 Н), 6.48 (д, J = 14.0 Гц, 1 Н), 2.77 (д, J = 4.4 Гц, 3H). К 80 мг(0.2 ммоль) 2-[(4-метилкарбамоил)-3-фторфенил]-N-[3-(трифторметил)-4-цианофенил]гидразинкарбоксамида 8(1) в 2 мл дихлорэтана добавляют последовательно 56 мкл (0.4 ммоль) триэтиламина и 27 мкл (0.22 ммоль) дифосгена. Реакционную смесь перемешивают в закрытой пробирке при 80C 15 ч. Растворитель отгоняют в вакууме и остаток хроматографируют на SiO2 (элюент - CH2Cl2: МеОН, градиент от 100:1 до 20:1). Получают N-метил-2-фтор-4-[4-[3-(трифторметил)-4-цианофенил]-3,5-диоксо-1,2,4 триазолидин-1-ил]бензамид 1.4 (R1=CH3). Ki1.4 = 55.2 nM, LCMS (М+Н)+ 422. 1H ЯМР (ДМСО-d6, 400 МГц): 11.53 (с, 1 Н), 8.22 (уш. м, 1 Н), 8.16 (д, J = 8.8 Гц, 1 Н), 7.99 (дд, J1 = 8.8 Гц, J2 =1.6 Гц, 1 Н), 7.95 (д, J= 1.6 Гц, 1 Н), 7.81 (т, J=8.4 Гц, 1 Н), 7.69 (дд, J1 = 8.8 Гц, J2 = 2.0 Гц, 1 Н), 7.62 (дд, J1 = 12.0 Гц, J2 = 2.0 Гц,1 Н), 2.79 (д, J = 4.4 Гц, 3H). Пример 10. Определение антагонистической активности циклических N,N'-диарилтиомочевин иN,N'-диарилмочевин общей формулы 1 и их аналога MDV3100 по отношению к андрогеновым рецепторам. Способность новых циклических N,N'-диарилмочевин общей формулы 1 и препарата MDV3100 блокировать андрогеновые рецепторы определяли по эффективности ингбирования ими стимулированной дегидротестостероном экспрессии специфического для простаты антигена (ПСА) в канцерных клетках простаты человека LNCap, полученных из Американского банка тканевых культур (АТСС, США). Эти клетки чувствительны к 5 дигидротестостерону (ДГТ) и в его присутствии продуцируют канцерный маркер (ПСА). Клетки выращивали в среде RPMI 1640 (Invitrogen, США), содержащей 10% телячью сыворотку (Hyclone, США), 1% антибактериальную/антигрибковую смесь (Sigma, США) и 4,5% глюкозу. Перед экспериментом клетки отмывали и суспендировали в ту же среду, в которой, однако, вместо телячьей сыворотки была использована сыворотка, обработанная активированным углем для удаления следов гормонов. Клетки разливали по 100 мкл (10000 клеток) в ячейки 96-луночных плашек и оставляли на 4 дня в инкубаторе при 37C (100% влажности) в атмосфере 95% воздух/5% CO2. После инкубации к клеткам добавляли циклические N,N'-диарилтиомочевины или N,N'-диарилмочевины общей формулы 1 в различных концентрациях, а затем - 20 нМ ДГТ (концентрация, соответствующая 80-90% от максимальной стимуляции). Клетки оставляли на 5 суток для дополнительной инкубации в тех же условиях. После этого образцы надклеточной среды отбирали для анализа на содержание ПСА. Анализ проводили по протоколу, рекомендованному производителем набора для определения ПСА (Alpha Diagnostic International, США). После увлажнения лунок, содержащих на донышке прикрепленные антитела к ПСА, к ним добавляли по 25 мкл образцов и затем по 100 мкл антител к ПСА, к которым предварительно была конъюгирована пероксидаза хрена. После 30 минутной инкубации при комнатной температуре, содержимое лунок удаляли, лунки несколько раз промывали и в каждую лунку заливали (по) 100 мкл хромогенного субстрата пероксидазы. Плашки выдерживали 15 мин при комнатной температуре, в каждую лунку добавляли по 50 мкл стоп раствора; при этом образуется краситель, интенсивность поглощения которого была измерена при 450 нм; полученная величина пропорциональна концентрации ПСА в образце. По данным зависимости снижения наработки ПСА, вызванной дигидротестостероном (ДГТ), от концентрации исследованных веществ, были построены кривые доза-ответ, на основании которых определены величины IC50. Последние были использованы для вычисления величин кажущихся констант ингибирова-9 020681 ния (Ki) соединений общей формулы I по уравнению Ченг-Пруссова. [Cheng, Y., Prusoff, W. H. "Relationship between the inhibition constant (Ki) and the concentration of inhibitor which causes 50 per cent inhibition(150) of an enzymatic reaction". Biochem Pharmacol. (1973) 22 , 3099-3108]: Ki = IC50/(1+L/KD), где L - концентрация агониста (ДГТ), KD - константа активации рецептора, численно равная величине EC50, которая определяется в каждом эксперименте по данным зависимости стимуляции синтеза ПСА от концентрации ДГТ. Полученные результаты, представленные в соответствующих примерах, свидетельствуют о том, что новые антагонисты андрогеновых рецепторов в ряде случаев более активны, чем MDV3100, испытанный в этих же условиях как свидетель, для которого KiMDV3100= 79.5 nM. Пример 11. Определение максимально переносимой дозы новых антагонистов 1.2.2(1) и 1.2.3(3) и их аналога MDV3100. Максимально переносимые дозы (MTD) новых антагонистов 1.2.2(1) и 1.2.3(3) и их аналога MDV3100 определяли в экспериментах на самцах мышей линии CD1 при пероральном введении 1 раз в сутки в течение 5 дней в дозах 10, 30 и 100 мг/кг. Вещество растворяли в стерильной воде с добавлением Твин-80. Контрольным животным (группа Плацебо) вводили стерильную воду с Твин-80. Учитывали вес тела, а также смертность животных. Статистическое сравнение групп проводили по непараметрическому критерию ANOVA, с использованием программы Statistica. При введении соединения 1.2.2(1) и 1.2.3(3) в дозах до 100 мг/кг гибель мышей не наблюдалась. На 3-й - 4-й дни в группе мышей, получавших изучаемые вещества в дозе 100 мг/кг, масса тела была меньше по сравнению с контрольным животным, однако статистической значимости при этом не наблюдалось(фиг. 1). Эти данные свидетельствуют о том, что соединения 1.2.2(1) и 1.2.3(3) имеют MTD 100 мг/кг. При введении соединения MDV3100 в дозах 10 и 30 мг/кг гибели мышей не наблюдалось. В группе мышей, которым изучаемое вещество вводили в дозе 100 мг/кг, на 3-й день масса тела начала снижаться. На 5-й день масса тела у животных из этой группы статистически значимо отличалась от массы тела животных из группы Плацебо (p=0,002, фиг. 2). Погибло одно животное. Эти данные свидетельствуют о том, что соединение MDV3100 имеет MTD30 мг/кг.). Пример 12. Получение лекарственного средства в форме таблеток. Смешивают 1600 мг крахмала,1600 мг измельченной лактозы, 400 мг талька и 1000 мг N-метил-4-[5-метил-5-(метоксиметил)-4-оксо-2 тиоксо-3-[3-(трифторметил)-4-цианофенил]-имидазолидин-1-ил]-2-фторбензамид (R)-1.2.2(1). Полученную фармацевтическую композицию спрессовывают в брусок. Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 560 мг каждая. Пример 13. Получение лекарственного средства в форме капсул. Тщательно смешивают N-метил-4[5-метил-5-метилоксиметил-3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксоимидазолидин-1-ил]-2 фтор-бензамид (R)-1.2.2(1) с порошком лактозы в соотношении 2:1. Полученную фармацевтическую композицию упаковывают по 300 мг в желатиновые капсулы подходящего размера. Пример 14. Получение лекарственного средства в форме инъекционных композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивают 500 мг N-метил-4-[5-метил-5 метилоксиметил-3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксоимидазолидин-1-ил]-2-фторбензамид(R)-1.2.2(1) с 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают. Промышленная применимость Изобретение может быть использовано в медицине, ветеринарии, биохимии. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Циклические N,N'-диарилтиомочевины и N,N'-диарилмочевины общей формулы 1, их оптические(R)- и (S)-изомеры и их фармацевтически приемлемые соли, обладающие свойствами антагонистов андрогеновых рецепторов где X представляет собой кислород или серу; m = 0 или 1;R4 представляет собой водород, a R5 представляет собой метил; или R4 представляет собой метил, R5 представляет собой CH2R6 группу, в которой R6 представляет собой C1-C3 алкоксикарбонил, карбоксил, необязательно замещенную гидроксильную группу, в которой заместителями могут быть водород, метил, бензил; или R4 и R5 вместе с атомом углерода, с которым они связаны, образуют пяти- или шестичленный насыщенный гетероцикл, включающий один атом кислорода или азота, который может быть замещен метилом; или R4 и R5 вместе с атомом углерода, с которым они связаны, представляют собой группу NH. 2. Соединения по п.1, представляющие собой циклические N,N'-диарилтиомочевины и N,N'диарилмочевины общей формулы 1.2, 1.3 или 1.4, их оптические (R)- и (S)-изомеры и их фармацевтически приемлемые соли где X, R1, R2, R3, R4 и R5 имеют вышеуказанное значение. 3. Соединения по п.2, представляющие собой циклические N,N'-диарилтиомочевины формулы 1.2.2, 1.2.3, их оптические (R)-изомеры - (R)-1.2.2, (R)-1.2.3 и (S)-изомеры - (S)-1.2.2 и (S)-1.2.3 где R4 и R5 вместе с атомом углерода, с которым они связаны, образуют пяти- или шестичленный насыщенный гетероцикл, включающий один атом кислорода или азота, который может быть замещен метилом, R6 имеет вышеуказанное значение. 4. Соединения по п.3, представляющие собой циклические N,N'-диарилтиомочевины формулы 1.2(1), 1.2(2), их оптические (R)-изомер (R)-1.2(2) и (S)-изомер - (S)-1.2(2) 5. Соединения по п.2, представляющие собой соединения формулы 1.2.2(1), 1.2.2(2), 1.2.2(3),1.2.3(1), 1.2.3(2) и 1.2.3(3), их оптические (R)-изомеры - (R)-1.2.2(1), (R)-1.2.2(2), (R)-1.2.2(3), (R)-1.2.3(1) и (S)-изомеры - (S)-1.2.2(1), (S)-1.2.2(2), (S)-1.2.2(3), (S)-1.2.3(1) где R6 представляет собой гидроксильную группу, в которой заместители могут принимать значение водород, метил, бензил. 6. Способ получения соединений общей формулы 1.2 и их оптических (R)- и (S)-изомеров по пп.1-4 взаимодействием соответствующих 4-(цианометил)аминобензамидов 4.1 или (4-карбамоилфениламино) уксусных кислот 4.2 или их оптических (R)- и (S)-изомеров с изотиоцианатом 3.2 7. Противораковое средство, представляющее собой по крайней мере одну циклическую N,N'диарилтиомочевину или N,N'-диарилмочевину общей формулы 1 по любому из пп.1-4, обладающее свойствами антагониста андрогеновых рецепторов. 8. Фармацевтическая композиция, обладающая свойством антагониста андрогеновых рецепторов,содержащая в качестве активного компонента противораковое средство по п.7. 9. Способ получения фармацевтической композиции по п.8 смешением противоракового средства по п.7 с инертным наполнителем и/или растворителем. 10. Лекарственное средство в форме таблеток, капсул или инъекций для лечения раковых заболеваний, включающее в свой состав противораковое средство по п.7 или фармацевтическую композицию по п.8. 11. Лекарственное средство по п.10, предназначенное для лечения рака простаты. 12. Способ лечения раковых заболеваний, в том числе рака простаты, введением лекарственного средства по пп.10, 11, или фармацевтической композиции по п.8, или противоракового средства по п.7.
МПК / Метки
МПК: A61K 31/4166, A61K 9/08, C07D 471/10, C07D 239/22, C07D 239/10, C07D 233/86, C07D 233/72, A61P 35/00, C07D 249/12, A61K 31/513, A61K 31/4196, C07D 491/107, A61K 9/48, A61K 31/527, A61K 31/4188, A61K 9/20
Метки: получения, n,n'-диарилтиомочевины, циклические, способ, применения, средство, рецепторов, антагонисты, n,n'-диарилмочевины, андрогеновых, противораковое
Код ссылки
<a href="https://eas.patents.su/14-20681-ciklicheskie-nn-diariltiomocheviny-i-nn-diarilmocheviny-antagonisty-androgenovyh-receptorov-protivorakovoe-sredstvo-sposob-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Циклические n,n’-диарилтиомочевины и n,n’-диарилмочевины – антагонисты андрогеновых рецепторов, противораковое средство, способ получения и применения</a>
Предыдущий патент: Защитный шлем, в частности, для работника лесного хозяйства
Следующий патент: Низкоэмиссионное остекление
Случайный патент: Способ получения обладающего антихолинергическим действием тиотропийбромида