Применение ингибиторов дипептидилпептидазы
Формула / Реферат
1. Применение соединения формулы I
или его свободного основания, или его фармацевтически приемлемой соли в качестве лекарственного средства для ингибирования дипептидилпептидазы IV, где соединение I вводят один раз в неделю в еженедельной дозе более 250 и не более 400 мг.
2. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 275 мг.
3. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 300 мг.
4. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 350 мг.
5. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 400 мг.
6. Применение по п.1, где еженедельная доза вводимого соединения составляет не более 350 мг.
7. Применение по любому из пп.1-6, где еженедельная дозированная форма адаптирована для введения путем, выбранным из перорального, парентерального, интраперитонеального, внутривенного, интраартериального, трансдермального, сублингвального, внутримышечного, ректального, трансбуккального, интраназального, липосомального, посредством ингаляций, вагинального, внутриглазного, посредством местной доставки, подкожного, введения в жировую ткань, введения в сустав и интратекального введения.
8. Применение по любому из пп.1-6, где еженедельная дозированная форма адаптирована для орального введения.
9. Применение по любому из пп.1-6, где еженедельная дозированная форма является твердой препаративной формой, адаптированной для орального введения.
10. Применение по любому из пп.1-6, где еженедельная дозированная форма является таблеткой или капсулой, адаптированной для орального введения.
11. Применение по любому из пп.1-6, где еженедельная дозированная форма является препаративной формой с длительным высвобождением, адаптированной для орального введения.
12. Применение по любому из пп.1-11, где соединение 1 присутствует в форме свободного основания.
13. Применение по любому из пп.1-11, где соединение 1 присутствует в форме фармацевтически приемлемой соли.
14. Применение по любому из пп.1-11, где соединение 1 присутствует в форме сукцинатной соли.
15. Применение по любому из пп.1-14 для лечения диабета II типа.
16. Применение по любому из пп.1-14 для лечения предиабетического состояния.
Текст
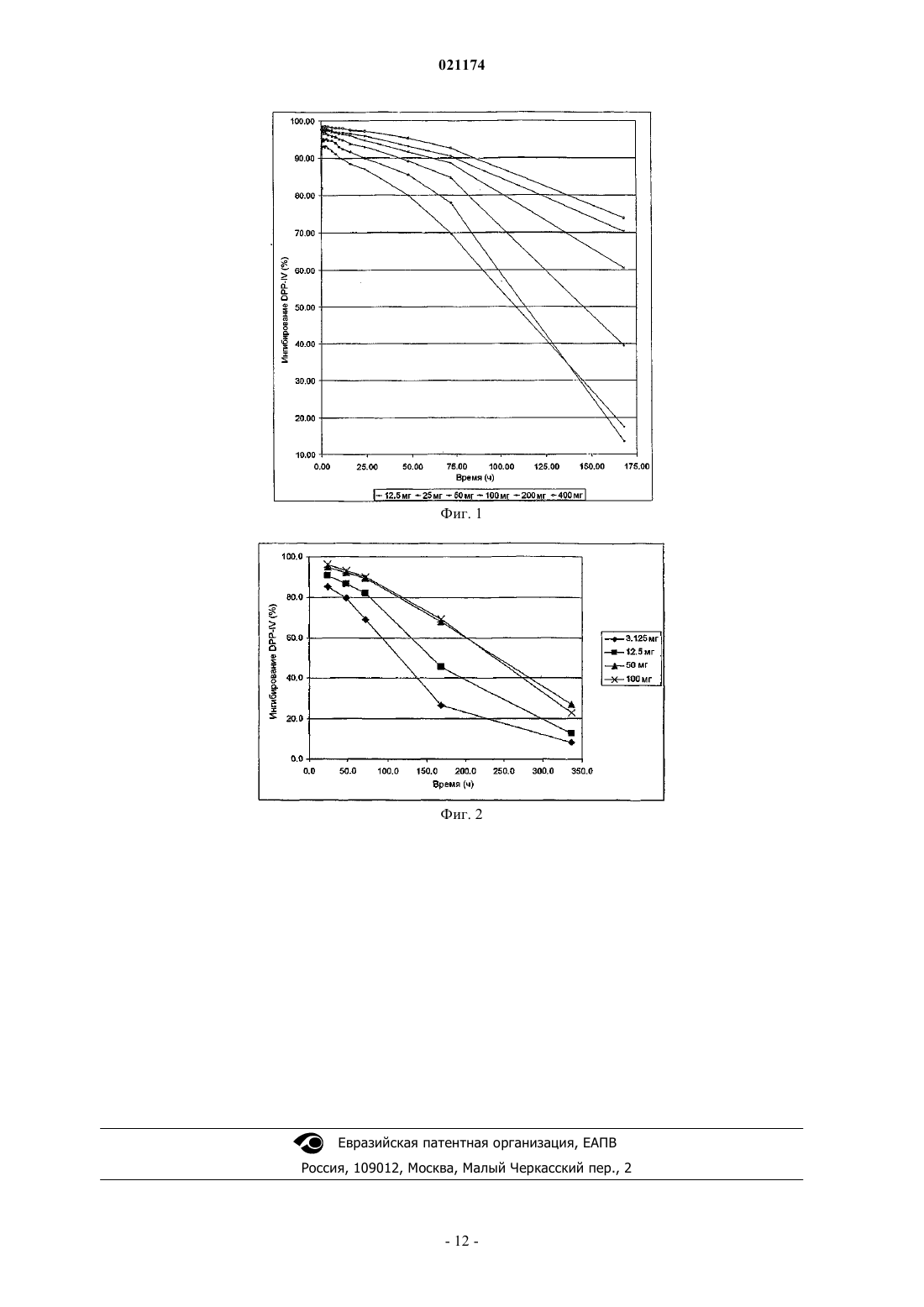
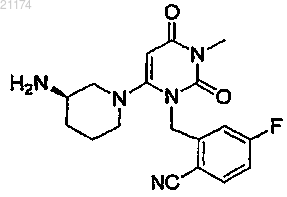
для ингибирования дипептидилпептидазы IV, где указанное соединение вводят один раз в неделю в еженедельной дозе более 250 и не более 400 мг.(71)(73) Заявитель и патентовладелец: ТАКЕДА ФАРМАСЬЮТИКАЛ КОМПАНИ ЛИМИТЕД (JP) Область техники изобретения Изобретение относится к применению соединений для ингибирования дипептидилпептидазы IV, а также к способам лечения, основанным на таком введении. Предшествующий уровень техники изобретения Описание связанной области техники Дипептидилпептидаза IV (IUBMB Enzyme Nomenclature EC.3.4.14.5) представляет собой мембранный белок II типа, который в литературе называли огромным множеством названий, включая DPP4, DP4,DAP-IV, FAP, белок, образующий комплекс с аденозиндеаминазой 2, белок, связывающий аденозиндеаминазу (ADAbp), дипептидиламинопептидаза IV; Xaa-Pro-дипептидиламинопептидаза;T-клетки Tp109; X-PDAP. В настоящем описании дипептидилпептидазу IV называют какDPP-IV представляет собой неклассическую сериновую аминодипептидазу, которая удаляет дипептиды Xaa-Pro с аминоконца (N-конца) полипептидов и белков. Также сообщали о зависимом от DPP-IV медленном высвобождении дипептидов типа X-Gly или X-Ser для некоторых естественных пептидов.DPP-IV постоянно экспрессируется на эпителиальных и эндотелиальных клетках множества различных тканей (кишечника, печени, легких, почек и плаценты) и также обнаруживается в жидкостях организма. DPP-IV также экспрессируется на циркулирующих Т-лимфоцитах и является идентичной поверхностному антигену клеток CD26.DPP-IV отвечает за метаболическое расщепление определенных эндогенных пептидов (GLP-1(7-36), глюкагон) in vivo и обладает продемонстрированной протеолитической активностью в отношении множества других пептидов (GHRH, NPY, GLP-2, VIP) in vitro.GLP-1 (7-36) представляет собой пептид из 29 аминокислот, образующийся при посттрансляционном процессинге проглюкагона в тонкой кишке. GLP-1 (7-36) обладает множеством эффектов in vivo,включая стимуляцию секреции инсулина, ингибирование секреции глюкагона, стимуляцию насыщения и замедление опустошения желудка. На основании его физиологического профиля считают, что действиеGLP-1 (7-36) будет полезным для предупреждения и лечения диабета II типа и потенциально ожирения. Например, было обнаружено, что экзогенное введение GLP-1 (7-36) (непрерывная инфузия) пациентам с диабетом является эффективным в этой популяции пациентов. К сожалению, GLP-1 (7-36) быстро разлагается in vivo, и было показано, что он имеет короткий период полужизни in vivo (t1/2=1,5 мин). На основании исследования генетически выведенных мышей, нокаутированных по DPP-IV, и в исследованиях in vivo/in vitro с селективными ингибиторами DPP-IV было показано, что DPP-IV является основным ферментом, разрушающим GLP-1 (7-36) in vivo. GLP-1 (7-36) эффективно разлагается DPP-IV до GLP-1 (9-36), который предположительно действует как физиологический антагонист GLP-1 (7-36). Следовательно, считают, что ингибирование DPP-IV in vivo применимо для потенцирования эндогенных уровней GLP-1 (7-36) и уменьшения образования его антагониста GLP-1 (9-36). Следовательно, считают,что ингибиторы DPP-IV будут применимыми средствами для предупреждения, замедления прогрессирования и/или лечения состояний, опосредованных DPP-IV, в частности диабета, точнее - сахарного диабета II типа, диабетической дислипидемии, состояний нарушенной толерантности к глюкозе (НТГ), состояний нарушенной гликемии натощак (НГН), метаболического ацидоза, кетоза, регуляции аппетита и ожирения. Было показано, что несколько соединений ингибируют DPP-IV. Тем не менее, все еще существует необходимость в новых ингибиторах DPP-IV и способах введения таких ингибиторов для лечения заболеваний. Краткое описание изобретения Предложено применение, включающее введение пациенту еженедельно дозы 1-400 мг/неделю соединения I, необязательно 12,5-400 мг/неделю соединения I, необязательно 20-400 мг/неделю соединенияI, необязательно 20-200 мг/неделю соединения I, необязательно 50-400 мг/неделю соединения I и необязательно 100-400 мг/неделю соединения I. В одном варианте вводят еженедельную дозу соединения I 3,125, 12,5, 20, 25, 50, 75, 100, 125, 150,175, 200, 250 или 400 мг, необязательно вводят еженедельную дозу соединения I 100, 125, 150, 175, 200,250 или 400 мг. Также предлагается применение, включающее введение пациенту еженедельной дозы более чем 250 мг соединения I, необязательно по меньшей мере 275 мг соединения I, необязательно по меньшей мере 300 мг соединения I, необязательно по меньшей мере 350 мг соединения I и необязательно по меньшей мере 400 мг соединения I. В одном варианте еженедельная доза соединения I, вводимая пациенту, составляет не более чем 400 мг. В еще одном варианте еженедельная доза соединения I, вводимая пациенту, составляет не более чем 350 мг. В еще одном варианте еженедельная доза соединения I, вво-1 021174 димая пациенту, составляет более чем 250 и не более чем 400 мг. В других вариантах пациенту вводят еженедельные дозы 275, 300, 350 или 400 мг соединения I. В еще одном варианте введение осуществляют 1 раз в неделю, и оно может необязательно проводиться 1 раз в неделю в виде однократной дозы. Необязательно, введение проводят 1 раз в неделю в течение по меньшей мере 1 месяца, необязательно в течение по меньшей мере 2 месяцев и необязательно в течение по меньшей мере 3 месяцев. В одном варианте введение осуществляют утром и, необязательно,проводят утром перед первым приемом пищи пациента. Введение может осуществляться огромным множеством путей введения, включая, но не ограничиваясь, путь, выбранный из группы, состоящей из перорального, парентерального, интраперитонеального,внутривенного, интраартериального, трансдермального, сублингвального, внутримышечного, ректального, трансбуккального, интраназального, липосомального, посредством ингаляций, вагинального, внутриглазного, посредством местной доставки, подкожного введения в жировую ткань, введения в сустав,внутрибрюшинного и интратекального введения. В одном определенном варианте введение осуществляют перорально. Также предлагается применение соединения формулы (I) в дозированной форме, содержащей разовую дозу, где такая лекарственная форма, содержащая разовую дозу, включает более чем 250 мг соединения I, необязательно по меньшей мере 275 мг соединения I, необязательно по меньшей мере 300 мг соединения I, необязательно по меньшей мере 350 мг соединения I и необязательно по меньшей мере 400 мг соединения I. Соединение I присутствует в лекарственной форме, содержащей разовую дозу, в количестве более чем 250 мг соединения I, необязательно по меньшей мере 275 мг соединения I, необязательно по меньшей мере 300 мг соединения I, необязательно по меньшей мере 350 мг соединения I и необязательно по меньшей мере 400 мг соединения I. В другом варианте лекарственное средство включает не более чем 400 мг соединения I. В еще одном варианте лекарственное средство включает не более чем 350 мг соединения I. В еще одном варианте лекарственное средство включает более чем 250 и не более чем 400 мг соединения I. В других вариантах лекарственное средство включает 275, 300, 350 или 400 мг соединенияI. В отношении каждого из вышеупомянутых вариантов осуществления изобретения и их вариантов,касающихся фармацевтических композиций, соединение I может присутствовать в фармацевтической композиции в виде свободного основания или в виде его фармацевтически приемлемой соли. В определенных вариантах соединение I присутствует в виде соли HCl, метасульфоната, сукцината, бензоата, толуолсульфоната, R(-)-манделата или бензолсулфоната соединения I. Лекарственное средство может, необязательно, быть лекарственной формой для перорального введения, содержащей разовую дозу, необязательно, твердой композицией, приспособленной для перорального введения, и, необязательно, таблеткой или капсулой, приспособленной для перорального введения. Кроме того, в отношении каждого из вышеуказанных вариантов осуществления изобретения и их вариантов, касающихся лекарственных средств, лекарственное средство может, необязательно, быть лекарственной формой, приспособленной для парентерального (подкожного, внутривенного, субдермального или внутримышечного) введения, содержащей разовую дозу, необязательно раствором, приспособленным для парентерального введения, и необязательно суспензией, приспособленной для парентерального введения. Лекарственное средство также может быть лекарственным средством продленного высвобождения, приспособленным для перорального введения. Соединение формулы (I) может использоваться для предупреждения или лечения состояний, опосредованных DPP-IV, таких как диабет, в частности сахарный диабет II типа; диабетическая дислипидемия; нарушенная толерантность к глюкозе (НТГ); нарушенная гликемия натощак (НГН); метаболический ацидоз; кетоз; регуляция аппетита; ожирение; осложнения, ассоциированные с диабетом, включая диабетическую нейропатию, диабетическую ретинопатию и заболевания почек; гиперлипидемия, включая гипертриглицеридемию, гиперхолестеринемию, гипоЛПВПемию и постпрандиальную гиперлипидемию; артериосклероз; гипертония; инфаркт миокарда; стенокардия; инфаркт головного мозга, инсульт и метаболический синдром. Соединение I и лекарственные средства, включающие соединение I, могут использоваться для лечения ряда заболеваний, в частности для лечения у пациента патологического состояния диабета II типа и для лечения пациентов с преддиабетическим состоянием. Соединение I, соединение формулы (I) в форме свободного основания и его фармацевтически приемлемые соли и основания, могут использоваться для предупреждения или лечения соединений, опосредованных DPP-IV, таких как диабет, точнее - сахарный диабет 2 типа; и для лечения преддиабетического состояния. Соответственно, настоящее изобретение относится к следующему. 1. Применение соединения формулы I в качестве лекарственного средства для ингибирования дипептидилпептидазы IV, где соединение I вводят один раз в неделю в еженедельной дозе более 250 и не более 400 мг. 2. Применение по п.1, где еженедельная доза вводимого соединении составляет по меньшей мере 275 мг. 3. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 300 мг. 4. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 350 мг. 5. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 400 мг. 6. Применение по п.1, где еженедельная доза вводимого соединения составляет не более 350 мг. 7. Применение по любому из пп.1-6, где указанная еженедельная дозированная форма адаптирована для введения путем, выбранным из перорального, парентерального, интраперитонеального, внутривенного, интраартериального, трансдермального, сублингвального, внутримышечного, ректального, трансбуккального, интраназального, липосомального, посредством ингаляций, вагинального, внутриглазного,посредством местной доставки, подкожного, введения в жировую ткань, введения в сустав и интратекального введения. 8. Применение по любому из пп.1-6, где указанная еженедельная дозированная форма адаптирована для орального введения. 9. Применение по любому из пп.1-6, где указанная еженедельная дозированная форма является твердой препаративной формой, адаптированной для орального введения. 10. Применение по любому из пп.1-6, где указанная еженедельная дозированная форма является таблеткой или капсулой, адаптированной для орального введения. 11. Применение по любому из пп.1-6, где указанная еженедельная дозированная форма является препаративной формой с длительным высвобождением, адаптированной для орального введения. 12. Применение по любому из пп.1-11, где соединение 1 присутствует в форме свободного основания. 13. Применение по любому из пп.1-11, где соединение 1 присутствует в форме фармацевтически приемлемой соли. 14. Применение по любому из пп.1-11, где соединение 1 присутствует в форме сукцинатной соли. 15. Применение по любому из пп.1-14 для применения для лечения диабета II типа. 16. Применение по любому из пп.1-14 для лечения преддиабетического состояния. В отношении всех вышеупомянутых вариантов осуществления изобретения отмечено, что варианты могут быть интерпретированы как открытые в том смысле, что способы могут включать дополнительные действия, кроме указанных, включая введение пациенту других фармацевтически активных материалов. Подобным образом, если не указано иначе, фармацевтические композиции, наборы и изделия могут дополнительно включать другие материалы, включая другие фармацевтически активные материалы. Краткое описание чертежей На фиг. 1 проиллюстрировано ингибирование DPP-IV в плазме людей после однократного перорального введения соединения I. На фиг. 2 проиллюстрировано ингибирование DPP-IV в плазме людей после однократного перорального введения соединения I. Описание изобретения Определения. Если не указано иначе, следующие термины, используемые в описании и формуле изобретения,должны иметь следующие значения для целей настоящего изобретения."Заболевание" специфически включает любое состояние нездоровья животного или его части и включает состояние нездоровья, которое может быть вызвано или быть свойственным медицинской или ветеринарной терапии, применяемой у этого животного, т.е. "побочные эффекты" такого лечения."Фармацевтически приемлемый" обозначает, что он является применимым для получения фармацевтической композиции, которая в общем является безопасной, нетоксичной и ни биологически, ни иным образом нежелательной и включает, что она может быть приемлемой для ветеринарного применения, а также фармацевтического применения у людей."Фармацевтически приемлемые соли" обозначают соли, которые являются фармацевтически приемлемыми, как определено выше, и которые обладают желательной фармакологической активностью. Такие соли включают, но не ограничиваются, аддитивные соли кислот, полученные с неорганическими кислотами, такими как соляная, бромисто-водородная, серная, азотная, фосфорная кислоты и подобные; или с органическими кислотами, такими как уксусная, трифторуксусная, пропионовая, гексановая,гептановая, циклопентанпропионовая, гликолевая, пируватная, молочная, малоновая, янтарная,яблочная,малеиновая,фумаровая,виннокаменная,лимонная,бензойная,о-(4-гидроксибензоил)бензойная, коричная, миндальная, метансульфоновая, этансульфоновая,1,2-этандисульфоновая, 2-гидроксиэтансульфоновая, бензолсульфоновая, п-хлорбензолсульфоновая, 2 нафталинсульфоновая, п-толуолсульфоновая, камфорсульфоновая, 4-метилбицикло[2.2.2]окт-2-ен-1 карбоновая,глюкогептоновая,4,4'-метилен-бис-(3-гидрокси-2-ен-1-карбоновая кислота),3-фенилпропионовая, триметилуксусная, третичная бутилуксусная, лаурилсерная, глюконовая, глютамовая, гидроксинафтоевая, салициловая, стеариновая, муконовая кислоты и подобные. Фармацевтически приемлемые соли также включают, но не ограничиваются, аддитивные соли оснований, которые могут быть образованы, когда присутствующие кислые протоны способны реагировать с неорганическими или органическими основаниями. Приемлемые неорганические основания включают,но не ограничиваются, гидроксид натрия, карбонат натрия, гидроксид калия, гидроксид алюминия и гидроксид кальция. Приемлемые органические основания включают, но не ограничиваются, этаноламин,диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и подобные."Субъект" и "пациент" включает людей и млекопитающих нечеловеческого рода (например, собак,кошек, кроликов, крупный рогатый скот, лошадей, овец, коз, свиней, оленей и подобное) и немлекопитающих (например, птиц и подобных)."Терапевтически эффективное количество" обозначает, что количество соединения, которое при введении животному для лечения заболеваний, достаточно для осуществления такого лечения заболевания."Лечение" или "способ лечения" обозначает любое введение терапевтически эффективного количества соединения и включает:(1) предупреждение развития заболевания у животного, которое может быть предрасположено к заболеванию, но еще не имеет истории или признаков патологии или симптомов заболевания;(2) ингибирование заболевания у животного, которое имеет или проявляет признаки патологии, или симптомов заболевания (т.е. остановка последующего развития патологии и/или патологии); или(3) облегчение заболевания у животного, которое имеет или проявляет признаки патологии или симптомов заболевания (т.е. обратное развитие патологии и/или симптомов). Подробное описание изобретения 1. 2-[6-(3-Аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-илметил]-4 фторбензонитрил и его композиции. Настоящее изобретение в общем относится к введению 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4 диоксо-3,4-дигидро-2 Н-пиримидин-1-илметил]-4-фторбензонитрила ("соединение I"), структура которого представлена ниже: В примере 1 описан один способ синтеза соединения I. Отмечено, что могут быть использованы другие способы для синтеза соединения I в рамках понимания обычного специалиста в области техники. Как подробно описано ниже, соединение I обладает эффектами длительного ингибирования DPP-IV. Соединение I может вводиться в форме свободного основания, а также может вводиться в форме солей, гидратов и пролекарств, которые преобразуются in vivo в форму свободного основания соединения I. Например, в рамках настоящего изобретения находится введение соединения I в виде фармацевтически приемлемых солей, полученных из различных органических и неорганических кислот и оснований в соответствии с методиками, хорошо известными в области техники. Как используется в настоящем описании, соединение I предназначено для охватывания солей, гидратов и пролекарств соединения I,если не указано иначе. Фармацевтически приемлемая соль соединения I предпочтительно обладает улучшенными фармакокинетическими свойствами по сравнению с формой свободного основания соединения I. Фармацевтически приемлемые соли также могут придавать желательные фармакокинетические свойства соединения I, которыми оно ранее не обладало, и даже могут положительно влиять на фармакодинамику соединения в отношении его терапевтической активности в организме. Определенные примеры солей, гидратов и пролекарств соединения I включают, но не ограничиваются формами солей, образованных неорганическими или органическими кислотами, например галоген-4 021174 водороды, такие как гидрохлорид, гидробромид и гидройодид; другие минеральные кислоты и их соответствующие соли, такие как сульфат, нитрат, фосфат и др.; алкил и моноарилсульфонаты, такие как этансульфонат, толуолсулфонат и бензолсульфонат; и другие органические кислоты и их соответствующие соли, такие как ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, салицилат и аскорбат. Дополнительные аддитивные соли кислот включают, но не ограничиваются, адипат, альгинат,аргинат, аспартат, бисульфат, бисульфит, бромид, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, фумарат, галактерат (из слизевой кислоты), галактуронат, глюкогептаноат, глюконат, глютамат,глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид,гидройодид, 2-гидроксиэтансульфонат, йодид, изотионат, изобутират, лактат, лактобионат, малат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат,никотинат, нитрат, оксалат, олеат, памоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат, фосфат, фосфонат и фталат. В определенных вариантах соединение I вводят в виде соли HCl, метансульфоната, сукцината, бензоата, толуолсульфоната, R-(-)манделата или бензолсульфоната соединения I. В примере 1 описано получение различных солевых форм соединения I, включая соли ТФУ, HCl, бензойной, птолуолсульфоновой, янтарной, R-(-)-миндальной и бензолсульфоновой кислот. 2. Введение и применение соединения I. Настоящее изобретение в общем относится к применению, включающему введение соединения I пациенту в еженедельной дозе более 250 и не более 400 мг соединения I в неделю. Отмечено, что, если особым образом не указано иначе, соединение I может вводиться в форме его свободного основания или в виде фармацевтически приемлемой соли. Однако дозировки и диапазоны, указанные в настоящем описании, всегда основаны на молекулярной массе формы свободного основания соединения I. Настоящее изобретение также относится к способу, включающему введение пациенту соединения I в еженедельной дозе более чем 250 мг соединения I, необязательно по меньшей мере 275 мг соединенияI, необязательно по меньшей мере 300 мг соединения I, необязательно по меньшей мере 350 мг соединения I и необязательно по меньшей мере 400 мг соединения I. В другом варианте еженедельная доза соединения I, вводимая пациенту, составляет не более чем 400 мг. В еще одном варианте еженедельная доза соединения I, вводимая пациенту, составляет не более чем 350 мг. В еще одном варианте еженедельная доза соединения I, вводимая пациенту, составляет более чем 250 и не более чем 500 мг. В еще одном варианте еженедельная доза соединения I, вводимая пациенту, составляет более чем 250 и не более чем 400 мг. В других вариантах пациенту вводят еженедельную дозу 275, 300, 350 или 400 мг соединения I. Отмечено, что, если особым образом не указано иначе, соединение I может вводиться в форме свободного основания или в виде фармацевтически приемлемой соли. Однако дозировки и диапазоны,представленные в настоящем описании, основаны на молекулярной массе формы свободного основания соединения I. Соединение I может вводиться посредством любого пути введения. В определенных вариантах осуществления изобретения, однако, способ по настоящему изобретению представляет собой пероральное введение соединения I. Такой тип введения является преимущественным, так как он легкий и может использоваться пациентом самостоятельно. Соединение I можно вводить один или более раз в неделю. Преимуществом настоящего изобретения, однако, является то, что соединение I может эффективно вводиться в дозировках, указанных в настоящем описании, один раз в неделю и также может вводиться в виде лекарственной формы, содержащей разовую дозу, один раз в неделю. Из-за возможности введения соединения I в дозировке, указанной в настоящем описании, только один раз в неделю и перорально, для пациентов облегчается самостоятельное введение соединения I, что улучшает приверженность к лечению среди пациентов, которым требуется ингибирование активности DPP-IV in vivo. Преимущественно соединение I подходит для длительного непрерывного применения и может вводиться пациентам в течение продолжительного периода времени. Соответственно, может осуществляться способ, когда соединение I вводят пациенту каждую неделю (необязательно 1 раз еженедельно) в течение по меньшей мере 1 месяца, необязательно в течение по меньшей мере 2 месяцев, необязательно в течение по меньшей мере 3 месяцев и, если необходимо, необязательно в течение продолжительности течения заболевания пациентов. Преимущественно соединение I можно вводить в любое время в течение дня. Необязательно, соединение I вводят один раз в неделю, когда введение осуществляют утром перед приемом пищи. Так как соединение I может стимулировать секрецию инсулина, когда уровень глюкозы крови достигает 100 мг/дл и выше, может быть полезным иметь соединение I в системной циркуляции перед возникающим постпрандиально повышением уровня глюкозы в крови. Соединение I может вводиться любому пациенту, который получит пользу от курса лечения, приводящего к уменьшению активности DPP-IV in vivo. Как подробно описано ниже, на фиг. 1 и 2 проиллюстрирован наблюдаемый эффект, которым введение соединения I обладает на активность DPP-IV в человеческой плазме после однократного перорального введения. Как может быть видно из данных, показан-5 021174 ных на фиг. 1, путем введения соединения I в дозе, указанной в настоящем описании, соединение I может эффективно использоваться при патологических состояниях, где желательно снизить активность DPP-IV плазмы. В свете представленных данных считают, что, когда по меньшей мере 12,5 мг соединения I вводят пациенту, активность DPP-IV в плазме пациента может снижаться на более чем 10% относительно исходной в течение периода по меньшей мере 168 ч после введения; когда по меньшей мере 50 мг соединения I вводят пациенту, активность DPP-IV плазмы пациента может быть снижена более чем на 35% относительно исходного в течение периода по меньшей мере 168 ч после введения, и когда 200 или 400 мг соединения I вводят пациенту, активность DPP-IV в плазме пациента может быть снижена более чем на 70% относительно исходного в течение по меньшей мере 168 ч после введения. Примеры определенных показаний для введения соединения I включают, но не ограничиваются,предупреждение, замедление прогрессирования и/или лечение состояний, опосредованных DPP-IV, в частности диабета, точнее - сахарного диабета 2 типа, диабетической дислипидемии, нарушенной толерантности к глюкозе (НТГ), нарушенной гликемии натощак (НГН), метаболического ацидоза, кетоза,регуляции аппетита, ожирения и осложнений, ассоциированных с диабетом, включая диабетическую нейропатию, диабетическую ретинопатию, воспалительные заболевания кишечника, болезнь Крона, энтерит, индуцированный химиотерапией, воспаление слизистой оболочки полости рта, синдром короткой кишки и заболевания почек. Состояния, опосредованные DPP-IV, включают гиперлипидемию, такую как гипертриглицеридемия, гиперхолестеринемия, гипоЛПВПемия и постпрандиальная гиперлипидемия; артериосклероз; гипертония; инфаркт миокарда, стенокардия, инфаркт головного мозга, инсульт и метаболический синдром. Считают, что введение соединения I пациентам с диабетом I или II типа после минимального лечения в течение по меньшей мере 30 дней улучшит один или более сердечно-сосудистых показателей. Также считают, что введение соединения I в комбинации с одним или более противодиабетическими или инкретиновыми соединениями пациентам с диабетом I или II типа после минимального лечения в течение по меньшей мере 30 дней улучшит один или более сердечно-сосудистых показателей. Примеры сердечно-сосудистых показателей, которые могут быть улучшены, включают, но не ограничиваются, снижение среднего систолического артериального давления, увеличение холестерина ЛПВП, улучшение соотношения ЛПНП/ЛПВП и снижение триглицеридов. Также считают, что введение соединения I в комбинации с одним или более противодиабетическими или инкретиновыми соединениями пациентам с воспалительными заболеваниями желудочнокишечного тракта (включая, но не ограничиваясь, воспалительные заболевания кишечника, болезнь Крона, энтерит, индуцированный химиотерапией, воспаление слизистой оболочки полости рта и синдром короткой кишки) после минимального лечения в течение по меньшей мере 30 дней улучшит состояние слизистой оболочки желудочно-кишечного тракта. Улучшение состояния слизистой оболочки желудочно-кишечного тракта может быть продемонстрировано посредством, но не ограничено, увеличения площади поверхности кишечника, уменьшения воспаления и/или увеличения всасывания питательных веществ. Введение соединения I один раз в неделю в дозировке, указанной в настоящем описании, пациенту с диабетом II типа также может быть полезным. Пациенты, получающие соединение I, также могут иметь нарушения секреции инсулина островками поджелудочной железы скорее, чем пациенты, у которых развилась инсулинорезистентность в периферических инсулиночувствительных тканях/органах. Преимущественно введение соединения I один раз в неделю в дозировке, указанной в настоящем описании, также может использоваться для лечения пациентов, у которых имеется предиабет. Считают,что введение соединения I пациенту, который имеет предиабет, служит для замедления развития у такого пациента диабета II типа. Постоянное повышение глюкозы крови десенсибилизирует функцию островков поджелудочной железы и нарушает секрецию инсулина. Путем улучшения уровня циклической АМФ и динамики кальция в -клетках клетки активируют гены, восстанавливающие поврежденные компоненты-клеток, и являются менее подверженными глюкозотоксичности. Ожидают, что введение соединения I один раз в неделю в дозировке, указанной в настоящем описании, обладает диапазоном желательных биологических эффектов in vivo. Например, введение соединения I один раз в неделю в дозировке, указанной в настоящем описании, при сравнении с плацебоконтролем снижает уровень глюкозы крови пациента. Такое снижение постпрандиального уровня глюкозы крови помогает пациентам с диабетом поддерживать более низкий уровень глюкозы крови. При введении соединения I один раз в неделю в дозировке, указанной в настоящем описании, также ожидают получить эффект повышения уровня инсулина пациента или чувствительности к инсулину. Инсулин облегчает поступление глюкозы в мышцы, жировую и некоторые другие ткани. Механизм, посредством которого клетки могут потреблять глюкозу, осуществляется путем облегченной диффузии при стимуляции рецепторов инсулина. С-пептид и инсулин являются белковыми цепями, созданными активацией и делением проинсулина (неактивного предшественника инсулина). С-пептид и инсулин создаются и хранятся в -клетках поджелудочной железы. Когда инсулин высвобождается в кровоток, также высвобождается такое же количество С-пептида. Это делает С-пептид полезным в качестве маркера про-6 021174 дукции инсулина. Ожидают, что введение соединения I в соответствии с изобретением увеличит уровень С-пептида пациента. Также ожидают, что введение соединения I один раз в неделю в дозировке, указанной в настоящем описании, после длительного лечения соединением I обладает эффектом снижения уровня гемоглобинаAlc пациента больше чем на 0,5% при сравнении с плацебо-контролем. Также ожидают, что, кроме того,введение соединения I один раз в неделю в дозировке, указанной в настоящем описании, обладает эффектом снижения уровня гемоглобина Alc пациента больше чем на 0,2% при сравнении с плацебоконтролем после длительного лечения соединением I. Известно, что значения Hb-Alc прямо пропорциональны концентрации глюкозы в крови в течение продолжительности жизни эритроцитов. Следовательно, Hb-Alc указывает на уровень глюкозы крови пациентов в течение предшествующих 90 дней, в большей степени в последние 30 дней. Следовательно, наблюдаемое снижение гемоглобина Alc пациента подтверждает продолжительное снижение уровня глюкозы крови пациента в результате введения соединения I один раз в сутки в дозировке, указанной в настоящем описании. 3. Композиции, включающие соединение I. Соединение I может быть включено в лекарственное средство, адаптированное для различных путей введения. Например, соединение I может содержаться в лекарственном средстве, пригодном для введения путем, выбираемым из группы, состоящей из перорального, парентерального, внутрибрюшинного,внутривенного, интраартериального, чрескожного, сублингвального, внутримышечного, ректального,трансбуккального, интраназального, липосомального, введения посредством ингаляции, вагинального,интраокулярного, посредством местного введения (например, посредством катетера или стента), подкожного, введения в жировую ткань, введения в сустав, интраперитонеального и интратекального введения. Как таковое, соединение I может быть рецептировано во множестве фармацевтически приемлемых композиций, включая инъекционные формы (например, подкожные, внутривенные, внутримышечные и интраперитонеальные инъекции), капельные инфузии, формы для наружного нанесения (например, препараты назальных спреев, трансдермальные препараты, мази и др.) и суппозитории (например, ректальные и вагинальные суппозитории). Такие различные фармацевтически приемлемые соединения могут быть получены известными методиками, обычно используемыми в фармацевтической промышленности с фармацевтически приемлемым носителем, обычно используемым в фармацевтической промышленности. Как используется в настоящем описании, композиция, включающая соединение I, охватывает формы свободного основания соединения I, соли, гидраты и пролекарства соединения I, a также другие материалы, которые могут быть включены в такие композиции для предназначенных целей, включая другие активные ингредиенты, если не указано иначе. Определенные солевые формы соединения I, которые могут использоваться, включают, но не ограничиваются, соли HCl, метансулфонат, сукцинат, бензоат,толуолсульфонат, R-(-)манделат или бензолсульфонат соединения I. Как указано выше, соединение I может преимущественно использоваться при введении пациенту в еженедельной дозе более 250 и не более 400 мг соединения I в неделю. Как также отмечено выше, желательно вводить соединение I один раз в неделю. Соответственно, фармацевтические композиции по настоящему изобретению могут быть в лекарственной форме, содержащей разовую дозу, включающую от 250 до 400 мг/неделю соединения I. В специфических вариантах осуществления изобретения фармацевтическая композиция включает 250 и 400 мг соединения I. В каждом случае представленные дозировки и диапазоны соединения I основаны на молекулярной массе формы свободного основания соединения I. Соединение I также может преимущественно использоваться при введении пациенту в еженедельной дозе более чем 250 мг соединения I, необязательно по меньшей мере 275 мг соединения I, необязательно по меньшей мере 300 мг соединения I, необязательно по меньшей мере 350 мг соединения I и необязательно по меньшей мере 400 мг соединения I. В другом варианте еженедельная доза соединения I,вводимая пациенту, составляет не более чем 400 мг. В еще одном варианте еженедельная доза соединения I, вводимая пациенту, составляет не более чем 350 мг. В еще одном варианте еженедельная доза соединения I, вводимая пациенту, составляет более чем 250 и не более чем 400 мг. Специфические дозировки, которые могут использоваться, включают, но не ограничиваются, 275, 300, 350 или 400 мг соединения I в неделю. В каждом случае представленные дозировки и диапазоны соединения I основаны на молекулярной массе формы свободного основания соединения I. Как также отмечено выше, желательно вводить соединение I один раз в неделю. Соответственно,фармацевтические композиции по настоящему изобретению могут быть в лекарственной форме, содержащей разовую дозу, включающей дозу от 250 до 400 мг/неделю соединения I. В других вариациях лекарственное средство включает 250, 275, 300, 350 или 400 мг соединения I. В каждом случае представленные дозировки и диапазоны соединения I основаны на молекулярной массе формы свободного основания соединения I. Фармацевтические композиции по настоящему изобретению также могут быть в лекарственной форме, содержащей разовую дозу, включающую дозу более чем 250 мг соединения I, необязательно по меньшей мере 275 мг соединения I, необязательно по меньшей мере 300 мг соединения I, необязательно по меньшей мере 350 мг соединения I и необязательно по меньшей мере 400 мг соединения I. В одном варианте фармацевтическая композиция включает не более чем 400 мг соединения I. В других вариантах фармацевтическая композиция включает не более чем 350 мг соединения I. В еще одном варианте фармацевтическая композиция включает более чем 250 и не более чем 400 мг соединения I. В других вариантах фармацевтическая композиция включает 275, 300, 350 или 400 мг соединения I. В каждом случае обеспечиваемые дозировки и диапазоны соединения I основаны на молекулярной массе формы свободного основания соединения I. Как также отмечено выше, соединение I может преимущественно использоваться при пероральном введении. Соответственно, композиции по настоящему изобретению могут необязательно быть приспособлены для перорального введения. В одном варианте такая фармацевтическая композиция является твердой композицией, предназначенной для перорального введения. В этом отношении композиция, например, может быть в форме таблетки или капсулы. В другом варианте такая фармацевтическая композиция представляет собой жидкую композицию, предназначенную для перорального введения. Как также отмечено выше, соединение I может преимущественно использоваться при введении парентерально. Соответственно, композиции по настоящему изобретению могут необязательно быть приспособлены для парентерального введения. В одном варианте такая фармацевтическая композиция представляет собой композицию раствора, предназначенного для парентерального введения. В другом варианте такая фармацевтическая композиция представляет собой композицию суспензии, предназначенной для парентерального введения. В одном варианте осуществления изобретения фармацевтическая композиция находится в лекарственной форме, содержащей разовую дозу, которая включает соединение I в одном из диапазонов дозировки, указанных в настоящем описании. Отмечено, что упаковочные материалы, используемые по настоящему изобретению, могут представлять собой множество разделенных контейнеров, таких как разделенная бутылка или разделенный фольгированный пакет. Контейнер может быть любого обычного очертания или формы, известных в области техники, которые сделаны из фармацевтически приемлемого материала, например бумаги или картонной коробки, стеклянной или пластиковой бутылки или флакона, повторно герметизируемого пакета(например, для хранения "запаса" таблеток для помещения в другой контейнер) или блистерной упаковки с отдельными дозами для выдавливания из упаковки в соответствии со схемой лечения. Используемый контейнер будет зависеть от точной используемой формы дозирования. Возможно совместное использование более чем одного контейнера в единственной упаковке для продажи лекарственной формы,содержащей разовую дозу. Например, таблетки могут содержаться в бутыли, которая, в свою очередь,содержится в коробке. Одним определенным примером упаковки по настоящему изобретению является так называемая блистерная упаковка. Блистерные упаковки хорошо известны в фармацевтической промышленности и широко используются для упаковки фармацевтических лекарственных форм (таблетки, капсулы и подобные). Блистерные упаковки обычно состоят из листа относительно твердого материала (предпочтительно твердого прозрачного пластикового материала), покрытого фольгой. Во время процесса упаковки в твердом материале формируют углубления. Углубления имеют размер и форму отдельных упаковываемых таблеток или капсул или могут иметь форму и размер для размещения нескольких упаковываемых таблеток и/или капсул. Затем таблетки или капсулы соответственно помещают в углубления и лист относительно твердого материала герметизируют пластиковой фольгой с расположением фольги напротив образованных углублений. В результате таблетки или капсулы герметизируют отдельно или вместе,по желанию, в углублениях между фольгой и листом. Лист предпочтительно имеет такую плотность, что таблетки или капсулы могут быть выделены из блистерной упаковки путем ручного надавливания на углубления, в результате чего в фольге образуются отверстия в месте углубления. Затем таблетка или капсула может быть выдавлена через указанное отверстие. 4-Фтор-2-метилбензонитрил (3). Смесь 2-бром-5-фтортолуола (2) (3,5 г, 18,5 ммоль) и CuCN (2 г, 22 ммоль) в ДМФ (100 мл) нагревали в колбе с обратным холодильником в течение 24 ч. Реакционную смесь разводили водой и экстрагировали гексаном. Органическую фракцию сушили над MgSO4 и растворитель удаляли для получения продукта 3 (выход 60%). 1CCl4 нагревали с обратным холодильником в атмосфере азота в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры. Твердое вещество удаляли фильтрацией. Органический раствор концентрировали для получения сырого продукта в виде масла, которое использовали на следующей стадии без дополнительной очистки. 1(0,86 г, 4 ммоль) и K2CO3 (0,5 г, 4 ммоль) в ДМСО (10 мл) перемешивали при 60 С в течение 2 ч. Реакционную смесь разводили водой и экстрагировали EtOAc. Органическую фракцию сушили над MgSO4 и растворитель удаляли. Остаток очищали колоночной хроматографией. Получали 0,66 г продукта (выход: 60%). 1 Н-ЯМР (400 МГц, CDCl3):7,73 (дд, J=7,2, 8,4 Гц, 1 Н), 7,26 (д, J=4,0 Гц, 1 Н), 7,11-7,17 (м, 1 Н),6,94 (дд, J=2,0, 9,0 Гц, 1 Н), 6,034 (с, 2 Н), 3,39 (с, 3 Н);(500 мг, 5,4 ммоль) перемешивали в герметичной пробирке в EtOH (3 мл) при 100 С в течение 2 ч. Окончательное соединение получали в виде соли ТФУ после очистки ВЭЖХ. 1 Н-ЯМР (400 МГц, CD3OD):7,77-7,84 (м, 1 Н), 7,16-7,27 (м, 2 Н), 5,46 (с, 1 Н), 5,17-5,34 (ABq, 2H,J=35,2, 15,6 Гц), 3,33-3,47 (м, 2 Н), 3,22 (с, 3 Н), 2,98-3,08 (м, 1 Н), 2,67-2,92 (м, 2 Н), 2,07-2,17 (м, 1 Н), 1,821,92 (м, 1 Н), 1,51-1,79 (м, 2 Н); ТФУ соль соединения I суспендировали в ДХМ и затем промывали насыщенным Na2CO3. Органический слой сушили и удаляли в вакууме. Остаток растворяли в ацетонитриле и при 0 С добавляли НС 1 в диоксане (1,5 экв.). После удаления растворителя получали соль HCl. 1 Н-ЯМР (400 МГц, CD3OD):7,77-7,84 (м, 1 Н), 7,12-7,26 (м, 2 Н), 5,47 (с, 1 Н), 5,21-5,32 (ABq, 2 Н,J=32,0, 16,0 Гц), 3,35-3,5 (м, 2 Н), 3,22 (с, 3 Н), 3,01-3,1 (м, 1 Н), 2,69-2,93 (м, 2 Н), 2,07-2,17 (м, 1 Н), 1,831,93 (м, 1 Н), 1,55-1,80 (м, 2 Н);MS (ES) [m+H]: рассчитанный для C18H20FN5O2, 357,38; обнаруженный, 357,38. Общая методика для получения солей соединения I. Бензонитриловый продукт при желании может быть выделен в виде свободного основания, но предпочтительно продукт может быть дополнительно преобразован в соответствующую аддитивную соль кислоты. В частности, бензонитриловый продукт (приблизительно 10 мг) в растворе MeOH (1 мл) обрабатывали различными кислотами (1,05 экв.). Растворам позволяли стоять в течение трех дней открытыми на воздухе. Если образовывался осадок, смесь фильтровали и соль сушили. Если твердое вещество не образовывалось, смесь концентрировали в вакууме и осадок выделяли. Таким образом, получали соли соединения I из следующих кислот: бензойной, п-толуолсульфоновой, янтарной, R-(-)-миндальной и бензолсульфоновой. Стадии выделения и/или очистки промежуточных соединений в описанном выше способе необязательно могут быть пропущены, если промежуточный продукт из реакционной смеси получается в виде относительно чистых соединений и побочные продукты или примеси реакционной смеси не влияют на последующие стадии реакции. Когда возможно, одна или более стадий выделения могут быть исключены для обеспечения более короткого времени обработки, и исключение дополнительной обработки также может давать более высокий выход реакции. 2. Эффект введения на активность DPP-IV плазмы. Однократную дозу соединения I вводили перорально 6 людям в дозировке 12,5, 25, 50, 100, 200 и 400 мг соответственно (всего 36 людей). На фиг. 1 проиллюстрирован наблюдаемый эффект, который введение соединения I оказывает после введения на активность человеческой DPP-IV плазмы. Как можно отметить, через 168 ч после введения соединение I снижало активность DPP-IV в человеческой плазме более чем на 10% относительно исходного. Следовательно, как можно видеть из данных, показанных на фиг. 1, путем введения соединения I один раз в неделю в дозе, указанной в настоящем описании, соединение I может эффективно использоваться в отношении патологических состояний, при которых желательно снизить активность DPP-IV плазмы. В свете представленных данных считают, что, когда пациенту вводят по меньшей мере 50 мг соединения I, активность DPP-IV плазмы пациента может быть снижена больше чем на 35% относительно исходного в течение периода по меньшей мере 168 ч после введения, когда пациенту вводят по меньшей мере 100 мг соединения I, активность DPP-IV плазмы пациента может быть снижена более чем на 60% относительно исходного в течение периода по меньшей мере 168 ч после введения и, когда пациенту вводят по меньшей мере 200 мг соединения I, активность DPP-IV плазмы пациента может быть снижена более чем на 70% относительно исходного в течение периода по меньшей мере 168 ч после введения. 3. Эффект введения на активность DPP-IV плазмы. Однократную дозу соединения I вводили людям перорально в дозировке 3,125 мг (9 человек),12,5 мг (8 человек), 50 мг (7 человек) и 100 мг (8 человек) соответственно. На фиг. 2 проиллюстрирован наблюдаемый эффект, который введение соединения I оказывает на активность DPP-IV плазмы человека после введения. Как может быть видно, соединение I снижало активность DPP-IV в человеческой плазме более чем на 20% относительно исходного через 168 ч после введения. Следовательно, как может быть видно из данных, показанных на фиг. 2, путем введения соединения I один раз в неделю в дозировке,указанной в настоящем описании, соединение I может эффективно использоваться в отношении патологических состояний, при которых желательно снизить активность DPP-IV плазмы. В свете представленных данных считают, что, когда пациенту вводят по меньшей мере 50 мг соединения I, активностьDPP-IV плазмы пациента может быть снижена более чем на 65% относительно исходного в течение периода по меньшей мере 168 ч после введения. Для специалиста в области техники очевидно, что могут быть осуществлены различные модификации и варианты в отношении соединений, композиций, наборов и способов по настоящему изобретению без отклонения от рамок и сущности изобретения. Следовательно, настоящее изобретение охватывает обеспеченные модификации и варианты настоящего изобретения, которые вытекают из рамок приложенной формулы изобретения и ее эквивалентов. Настоящее изобретение основано на предварительной заявке США 60/894624, содержание которой включено в настоящее описание в виде ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы I или его свободного основания, или его фармацевтически приемлемой соли в качестве лекарственного средства для ингибирования дипептидилпептидазы IV, где соединение I вводят один раз в неделю в еженедельной дозе более 250 и не более 400 мг. 2. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 275 мг. 3. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 300 мг. 4. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 350 мг. 5. Применение по п.1, где еженедельная доза вводимого соединения составляет по меньшей мере 400 мг. 6. Применение по п.1, где еженедельная доза вводимого соединения составляет не более 350 мг. 7. Применение по любому из пп.1-6, где еженедельная дозированная форма адаптирована для введения путем, выбранным из перорального, парентерального, интраперитонеального, внутривенного, интраартериального, трансдермального, сублингвального, внутримышечного, ректального, трансбуккального, интраназального, липосомального, посредством ингаляций, вагинального, внутриглазного, посредством местной доставки, подкожного, введения в жировую ткань, введения в сустав и интратекального введения. 8. Применение по любому из пп.1-6, где еженедельная дозированная форма адаптирована для орального введения. 9. Применение по любому из пп.1-6, где еженедельная дозированная форма является твердой препаративной формой, адаптированной для орального введения. 10. Применение по любому из пп.1-6, где еженедельная дозированная форма является таблеткой или капсулой, адаптированной для орального введения. 11. Применение по любому из пп.1-6, где еженедельная дозированная форма является препаративной формой с длительным высвобождением, адаптированной для орального введения. 12. Применение по любому из пп.1-11, где соединение 1 присутствует в форме свободного основания. 13. Применение по любому из пп.1-11, где соединение 1 присутствует в форме фармацевтически приемлемой соли. 14. Применение по любому из пп.1-11, где соединение 1 присутствует в форме сукцинатной соли. 15. Применение по любому из пп.1-14 для лечения диабета II типа. 16. Применение по любому из пп.1-14 для лечения предиабетического состояния.
МПК / Метки
МПК: A61K 31/513, A61P 35/00, A61P 3/10, A61P 31/18
Метки: применение, дипептидилпептидазы, ингибиторов
Код ссылки
<a href="https://eas.patents.su/13-21174-primenenie-ingibitorov-dipeptidilpeptidazy.html" rel="bookmark" title="База патентов Евразийского Союза">Применение ингибиторов дипептидилпептидазы</a>
Предыдущий патент: Сельскохозяйственная рабочая машина и способ регулирования ее рабочей системы
Следующий патент: Способ получения жидкого продукта из легкого газа (варианты) и система переработки легкого газа
Случайный патент: Производные хинуклидина в качестве антагонистов м3