Способ получения сульфонилпирролов в качестве ингибиторов гистондезацетилаз (hdac)
Формула / Реферат
1. Способ получения соединения формулы I
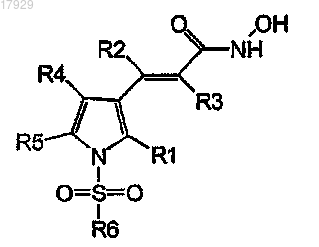
Формула I
где R1 представляет собой водород, C1-4-алкил, галоген или C1-4-алкокси;
R2 представляет собой водород или C1-4-алкил;
R3 представляет собой водород или C1-4-алкил;
R4 представляет собой водород, C1-4-алкил, галоген или C1-4-алкокси;
R5 представляет собой водород, C1-4-алкил, галоген или C1-4-алкокси;
R6 представляет собой -T1-Q1, где
Т1 представляет собой связь;
Q1 представляет собой Ar1, Aa1, Hh1 или Ah1, где
Ar1 представляет собой фенил или R61- и/или R62-замещенный фенил, где
R61 представляет собой C1-4-алкил или -T2-N(R611)R612, где либо
Т2 представляет собой связь;
R611 представляет собой C1-4-алкил, C1-4-алкокси-C2-4-алкил или фенил-C1-4-алкил;
R612 представляет собой C1-4-алкил или C1-4-алкокси-C2-4-алкил или
R611 и R612 вместе и с включением атома азота, с которым они связаны, образуют гетероциклическое кольцо Het1, где
Het1 представляет собой морфолинил, тиоморфолинил, S-оксо-тиоморфолинил, S,S-диоксо-тиоморфолинил, пиперидинил или пирролидинил, либо
Т2 представляет собой C1-4-алкилен или C2-4-алкилен, прерванный кислородом;
R611 представляет собой C1-4-алкил, C1-4-алкокси-C2-4-алкил или фенил-C1-4-алкил;
R612 представляет собой C1-4-алкил или C1-4-алкокси-C2-4-алкил или
R611 и R612 вместе и с включением атома азота, с которым они связаны, образуют гетероциклическое кольцо Het1, где
Het1 представляет собой морфолинил, тиоморфолинил, S-оксо-тиоморфолинил, S,S-диоксо-тиоморфолинил, пиперидинил, пирролидинил, имидазолил, пирролил или пиразолил;
R62 представляет собой C1-4-алкил, C1-4-алкокси, галоген, циано, C1-4-алкокси-C1-4-алкил, C1-4-алкилкарбониламино или C1-4-алкилсульфониламино;
Аа1 представляет собой бис-арильный радикал, состоящий из двух арильных групп, которые независимо выбраны из группы, состоящей из фенила и нафтила, и которые связаны вместе через одинарную связь;
Hh1 представляет собой бис-гетероарильный радикал, состоящий из двух гетероарильных групп, которые независимо выбраны из группы, состоящей из моноциклических 5- или 6-членных гетероарильных радикалов, содержащих один или два гетероатома, каждый из которых выбран из группы, состоящей из азота, кислорода и серы, и которые связаны вместе через одинарную связь;
Ah1 представляет собой гетероариларильный радикал или арилгетероарильный радикал, состоящий из гетероарильной группы, выбранной из группы, состоящей из моноциклических 5- или 6-членных гетероарильных радикалов, содержащих один или два гетероатома, каждый из которых выбран из группы, состоящей из азота, кислорода и серы, и арильной группы, выбранной из группы, состоящей из фенила и нафтила, где указанные гетероарильная и арильная группы связаны вместе через одинарную связь,
где Аа1, Hh1 и Ah1 могут быть возможно замещены R63 и/или R64, где
R63 представляет собой C1-4-алкил, фенил-C1-4-алкил, C1-4-алкокси, трифторметил, циано, галоген, полностью или преимущественно фторзамещенный C1-4-алкокси, C1-4-алкокси-C1-4-алкил, C1-4-алкилсульфониламино, толилсульфониламино, фенилсульфониламино, C1-4-алкилкарбониламино, карбамоил, моно- или ди-C1-4-алкиламинокарбонил, моно- или ди-C1-4-алкиламиносульфонил или -T3-N(R631)R632, где
T3 представляет собой связь, C1-4-алкилен или C2-4-алкилен, прерванный кислородом;
R631 представляет собой C1-4-алкил, C1-4-алкокси-C2-4-алкил или фенил-C1-4-алкил;
R632 представляет собой C1-4-алкил или C1-4-алкокси-C2-4-алкил или
R631 и R632 вместе и с включением атома азота, с которым они связаны, образуют гетероциклическое кольцо Het2, где
Het2 представляет собой морфолинил, тиоморфолинил, S-оксо-тиоморфолинил, S,S-диоксо-тиоморфолинил, пиперидинил, пирролидинил, имидазолил, пирролил или пиразолил;
R64 представляет собой C1-4-алкил, C1-4-алкокси или галоген,
включающий стадию взаимодействия хлорангидрида акриловой кислоты формулы II'
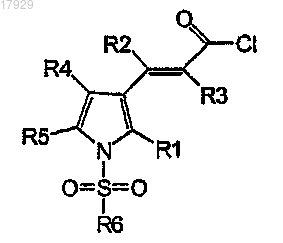
Формула II'
где R1, R2, R3, R4, R5 и R6 имеют значения, как они определены выше,
с водным гидроксиламином и, возможно, превращения полученного соединения в его соль присоединения кислоты.
2. Способ по п.1, где соединение формулы II' получают путем преобразования кислоты формулы II
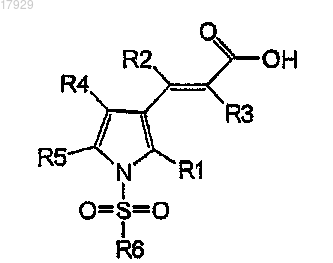
Формула II
где R1, R2, R3, R4, R5 и R6 имеют значения, как они определены в п.1,
в ее хлорангидрид формулы II'.
3. Способ по п.2, в котором хлорангидрид формулы II' получают путем взаимодействия кислоты формулы II с тионилхлоридом или оксалилхлоридом.
4. Способ по п.2, в котором соединение формулы II получают способом, включающим следующие стадии:
удлинение углеродной цепи соединения формулы V
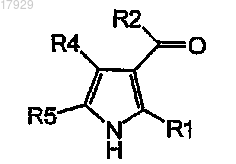
Формула V
где R1, R2, R4 и R5 имеют значения, как они определены в п.1,
с получением соединения формулы IV
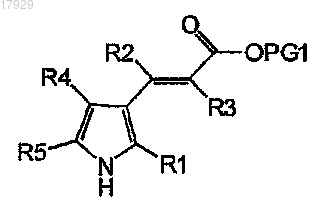
Формула IV
где R1, R2, R3, R4 и R5 имеют значения, как они определены в п.1, и PG1 обозначает подходящую временную защитную группу для карбоксильной группы,
взаимодействие соединения формулы IV с соединением формулы R6-SO2-X, где R6 является таким, как определено в п.1, и X представляет собой подходящую уходящую группу, с получением соответствующего соединения формулы III
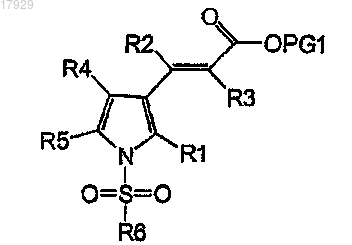
Формула III
где R1, R2, R3, R4, R5 и R6 имеют значения, как они определены в п.1, и PG1 обозначает подходящую временную защитную группу для карбоксильной группы, и
удаление защитной группы PG1 с получением соединения формулы II.
5. Способ по любому из пп.1-4, в котором соединение формулы I получают в форме свободного основания.
6. Способ по любому из пп.1-4, в котором соединение формулы I непосредственно получают в форме его соли гидрохлорида путем взаимодействия соединения формулы II' с водным гидроксиламином.
7. Способ по любому из пп.1-4, где соединение формулы I получают в форме соли присоединения кислоты, отличной от гидрохлорида, способом, включающим
взаимодействие свободного основания соединения формулы I с подходящей кислотой или производным кислоты с образованием соответствующей соли присоединения кислоты или
превращение соли присоединения кислоты соединения формулы I в другую соль присоединения кислоты.
8. Способ по п.7, где соль присоединения кислоты соединений формулы I, отличная от гидрохлорида, представляет собой метансульфонат.
9. Способ получения фармацевтической композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль присоединения кислоты, включающий получение соединения формулы I или его фармацевтически приемлемой соли присоединения кислоты способом по любому из пп.1-8 и смешивание полученного соединения с фармацевтическими эксципиентами.
10. Способ по п.9, где фармацевтическая композиция предназначена для лечения, предупреждения или ослабления доброкачественной и/или злокачественной неоплазии, такой как, например, рак, гиперпролиферативных заболеваний доброкачественного или злокачественного характера и/или расстройств, чувствительных к индукции апоптоза.
Текст
СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОНИЛПИРРОЛОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ГИСТОНДЕЗАЦЕТИЛАЗ (HDAC) Предложен способ получения соединения формулы (I), где R1, R2, R3, R4, R5 и R6 имеют значения,которые определены в описании, включающий стадию взаимодействия хлорангидрида акриловой кислоты формулы (II'), где R1, R2, R3, R4, R5 и R6 имеют значения, которые определены в описании, с водным гидроксиламином и, возможно, превращения полученного соединения в его соль присоединения кислоты. Область использования изобретения Изобретение относится к новому способу получения производных N-сульфонилпиррола и их солей,которые применяют в фармацевтической промышленности для получения фармацевтических композиций. Предшествующий уровень техники Транскрипционная регуляция в клетках является сложным биологическим процессом. Одним из основных принципов является регуляция посредством посттрансляционной модификации гистоновых белков, а именно гистоновых белков H2A/B, H3 и H4, образующих октамерный коровый комплекс гистонов. Этот комплекс N-концевых модификаций на остатках лизина путем ацетилирования или метилирования,а на остатках серина путем фосфорилирования составляет часть так называемого "гистонового кода"(StrahlEllis, Nature 403, 41-45, 2000). В простой модели ацетилирование положительно заряженных остатков лизина уменьшает сродство к отрицательно заряженной ДНК, которая теперь становится доступной для поступления транскрипционных факторов. Ацетилирование и дезацетилирование гистонов катализируется гистонацетилтрансферазами (HAT) и гистондезацетилазами (HDAC). HDAC ассоциированы с транскрипционными репрессорными комплексами, переключая хроматин на транскрипционно неактивную молчащую структуру (Marks et al. NatureCancer Rev 1, 194-202, 2001). Противоположное остается верным для HAT, которые ассоциированы с транскрипционными активаторными комплексами. До сих пор описано три различных класса HDAC, а именно HDAC класса I (HDAC 1-3, 8) с Mr, равной 42-55 кДа, локализованные преимущественно в ядре и чувствительные к ингибированию трихостатином А (TSA); HDAC класса II (HDAC 4-7, 9, 10) с Mr,равной 120-130 кДа, и чувствительностью к TSA и HDAC класса III (гомологи Sir2), которые достаточно отличаются по их NAD+-зависимости и нечувствительности к TSA. Химиотерапия рака была установлена на основании концепции о том, что раковые клетки с неконтролируемой пролиферацией и высокой долей клеток в митозе преимущественно уничтожаются. Стандартные противораковые химиотерапевтические лекарственные средства в результате уничтожают раковые клетки при индукции программируемой клеточной гибели ("апоптоза") путем нацеливания на основные клеточные процессы и молекулы, а именно РНК/ДНК (алкилирующие и карбамилирующие агенты, аналоги платины и ингибиторы топоизомеразы), метаболизм (лекарственные средства данного класса называют антиметаболитами), а также аппарат митотического веретена (стабилизирующие и дестабилизирующие ингибиторы тубулина). Ингибиторы гистондезацетилаз (HDI) составляют новый класс противораковых лекарственных средств с активностью индуцирования дифференцировки и апоптоза. Посредством нацеливания на гистондезацетилазы HDI воздействуют на ацетилирование гистона (белка) и структуру хроматина, индуцируя комплексное транскрипционное перепрограммирование, примером которого является повторная активация опухолевых супрессорных генов и подавление онкогенов. Кроме осуществления ацетилирования N-концевых остатков лизина в коровых гистоновых белках существуют негистоновые мишени, важные для биологии раковых клеток, такие как белок теплового шока 90 (Hsp90) или опухолевый супрессорный белок p53. Медицинское применение HDI может не ограничиваться терапией рака, поскольку была показана эффективность в моделях воспалительных заболеваний, ревматоидного артрита и нейродегенерации. Пирролилпропенамиды, замещенные бензоилом или ацетилом, описаны в опубликованной литературе в качестве ингибиторов HDAC, причем показана возможность присоединения ацильной группы по положению 2 или 3 пиррольного каркаса (Mai et al., Journal Med. Chem. 2004, vol. 47, No. 5, 1098-1109; или Ragno et al., Journal Med. Chem. 2004, vol. 47, No. 5, 1351-1359). Дополнительные пирролилзамещенные производные гидроксамовой кислоты описаны в US 4960787 в качестве ингибиторов липоксигеназы, или в US 6432999 в качестве ингибиторов циклооксигеназы, или в ЕР 570594 в качестве ингибиторов клеточного роста. Принимая во внимание сохраняющуюся в данной области техники потребность в новых хорошо переносимых и более эффективных ингибиторах HDAC, в публикациях международных заявокN-сульфонилпирролов в качестве ингибиторов HDAC. В WO 2005/087724, WO 2007/039403 и WO 2007/039404 также раскрыт способ получения указанных N-гидроксиакриламидных производных. Этот способ получения включает на последней стадии синтез N-гидроксиакриламидных производных, начиная с соответствующих акриловых кислот. Во время указанного синтеза соответствующее производное акриловой кислоты подвергают сочетанию с O-(тетрагидро-2H-пиран-2-ил)гидроксиламином путем взаимодействия с реагентом амидного связывания (EDCHCl и HOBtH2O, где EDC означает гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида;HOBt означает гидрат 1 гидроксибензотриазола. После удаления защитной группы путем перемешивания с кислой ионообменной смолой получают соответствующее N-гидроксиакриламидное производное: Однако использование O-(тетрагидро-2H-пиран-2-ил)гидроксиламина и EDCHCl является недостатком не только с точки зрения аспектов стоимости, но также в связи с тем, что эти реагенты недоступны в больших количествах. Кроме того, O-(тетрагидро-2H-пиран-2-ил)гидроксиламин является взрывчатым веществом, и необходимо удаление побочных продуктов на дополнительной стадии очистки, например, колоночной хроматографией. Задача изобретения, таким образом, заключается в том, чтобы предложить промышленно приемлемый, менее дорогостоящий, но, по меньшей мере, в равной степени эффективный способ получения Nгидроксиакриламидных производных соединений N-сульфонилпиррола, обладающих ингибиторной активностью в отношении HDAC, который дает возможность получить продукт реакции за меньшее количество стадий и с высоким выходом и чистотой. Описание изобретения В соответствии с первым аспектом настоящего изобретения теперь разработан новый способ получения N-гидроксиакриламидных производных N-сульфонилпиррола, обладающих ингибиторной активностью в отношении HDAC, который более подробно описан ниже, включающий стадию преобразования промежуточного соединения, представляющего собой хлорангидрид акриловой кислоты, в соответствующее N-гидроксиакриламидное производное. Неожиданно обнаружено, что данную реакцию можно проводить с водным гидроксиламином без образования побочных продуктов акриловой кислоты, и это приводит к образованию свободного основания соответствующего N-гидроксиакриламида Nсульфонилпиррола или его соответствующего гидрохлорида. Указанное обнаружение особенно неожиданно, поскольку хлорангидриды, подобные вышеописанным промежуточным соединениям, в целом весьма склонны к гидролизу при контакте с водой. В этом отношении в хорошо известном учебном издании Jerry March, Advanced Organic Chemistry [4th edition,1992, p. 377] указано следующее: галогенангидриды являются настолько реактивными, что гидролиз легко осуществить. Действительно, самые простые галогенангидриды должны храниться в безводных условиях, чтобы они не взаимодействовали с водой в воздухе. Следовательно, вода обычно является достаточно сильным нуклеофилом для взаимодействия, хотя в сложных случаях может требоваться гидроксидный ион. Даже более удивительно, что использование защищенного гидроксиламина в способе предшествующего уровня техники привело к образованию значительных количеств побочных продуктов акриловой кислоты. Таким образом, новый разработанный способ получения N-гидроксиакриламидных производных соединений N-сульфонилпиррола, обладающих ингибиторной активностью в отношении HDAC, в соответствии с настоящим изобретением дает преимущества в том, что он является значительно более экономически эффективным, чем способ, известный из предшествующего уровня техники, и обеспечивает прямое образование N-гидроксиакриламидов без необходимости в дополнительных стадиях удаления защиты и очистки. Настоящее изобретение, следовательно, относится в первом общем аспекте к новому способу получения соединения формулы I, которое представляет собой N-гидроксиакриламидное производное соединения N-сульфонилпиррола и обладает ингибиторной активностью в отношении HDACR2 представляет собой водород или C1-4-алкил;R3 представляет собой водород или C1-4-алкил;Ar1 представляет собой фенил или R61- и/или R62-замещенный фенил, гдеR611 и R612 вместе и с включением атома азота, с которым они связаны, образуют гетероциклическое кольцо Het1, гдеR611 и R612 вместе и с включением атома азота, с которым они связаны, образуют гетероциклическое кольцо Het1, гдеAa1 представляет собой бис-арильный радикал, состоящий из двух арильных групп, которые независимо выбраны из группы, состоящей из фенила и нафтила и которые связаны вместе через одинарную связь;Hh1 представляет собой бис-гетероарильный радикал, состоящий из двух гетероарильных групп,которые независимо выбраны из группы, состоящей из моноциклических 5- или 6-членных гетероарильных радикалов, содержащих один или два гетероатома, каждый из которых выбран из группы, состоящей из азота, кислорода и серы, и которые связаны вместе через одинарную связь;Ah1 представляет собой гетероариларильный радикал или арилгетероарильный радикал, состоящий из гетероарильной группы, выбранной из группы, состоящей из моноциклических 5- или 6-членных гетероарильных радикалов, содержащих один или два гетероатома, каждый из которых выбран из группы,состоящей из азота, кислорода и серы, и арильной группы, выбранной из группы, состоящей из фенила и нафтила, где указанные гетероарильная и арильная группы связаны вместе через одинарную связь, где Аа 1, Hh1 и Ah1 могут быть возможно замещены R63 и/или R64, где R63 представляет собой C1-4-алкил,фенил-C1-4-алкил, C1-4-алкокси, трифторметил, циано, галоген, полностью или преимущественно фторзамещенный C1-4-алкокси, C1-4-алкокси-C1-4-алкил, C1-4-алкилсульфониламино, толилсульфониламино, фенилсульфониламино, C1-4-алкилкарбониламино, карбамоил, моно- или ди-C1-4-алкиламинокарбонил, моно- или ди-C1-4-алкиламиносульфонил или -T3-N(R631)R632, гдеR631 и R632 вместе и с включением атома азота, с которым они связаны, образуют гетероциклическое кольцо Het2, гдеR64 представляет собой C1-4-алкил, C1-4-алкокси или галоген,включающему стадию взаимодействия хлорангидрида акриловой кислоты формулы II' Формула II' где R1, R2, R3, R4, R5 и R6 имеют значения, как они определены выше,с водным гидроксиламином и, возможно, превращения полученного соединения в его соль присоединения кислоты. В следующем аспекте настоящее изобретение относится к новому способу получения соединения формулы I в соответствии с первым общим аспектом, дополнительно включающему стадии:(1) получения соединения формулы II Формула II где R1, R2, R3, R4, R5 и R6 имеют значения, как они определены выше, и(2) преобразования соединения формулы II в его хлорангидрид формулы II'. В третьем аспекте настоящее изобретение относится к способу, при котором вышеописанную стадию (2) осуществляют с тионилхлоридом или оксалилхлоридом. В четвертом аспекте настоящее изобретение относится к способу, при котором вышеописанную стадию (1) осуществляют путем синтеза соединения формулы II в соответствии со способом, включающим следующие стадии: удлинение углеродной цепи соединения формулы V Формула V где R1, R2, R4 и R5 имеют значения, как они определены выше,с получением соединения формулы IV Формула IV где R1, R2, R3, R4 и R5 имеют значения, как они определены выше, и PG1 обозначает подходящую временную защитную группу для карбоксильной группы; взаимодействие соединения формулы IV с соединением формулы R6-SO2-X, где R6 является таким,как определено выше, и X представляет собой подходящую уходящую группу, с получением соответствующего соединения формулы III Формула III где R1, R2, R3, R4, R5 и R6 имеют значения, как они определены выше, и PG1 обозначает подходящую временную защитную группу для карбоксильной группы, и удаление защитной группы PG1 с получением соединения формулы II. В пятом аспекте настоящее изобретение относится к способу в соответствии с любым из предшествующих аспектов, при котором соединение формулы I получают в форме свободного основания. В шестом аспекте настоящее изобретение относится к способу в соответствии с любым из предшествующих аспектов от одного до четырех, при котором соединение формулы I непосредственно получают в форме его соли гидрохлорида путем взаимодействия соединения формулы II' с водным гидроксиламином. В седьмом аспекте настоящее изобретение относится к способу в соответствии с любым из предшествующих аспектов от одного до четырех для получения солей соединений формулы I, отличных от гидрохлорида, включающему взаимодействие свободного основания соединения формулы I с подходящей кислотой или производным кислоты с образованием соответствующей соли присоединения кислоты, или превращение соли присоединения кислоты соединения формулы I в другую соль присоединения кислоты. В восьмом аспекте настоящее изобретение относится к способу в соответствии с седьмым аспектом,где соль присоединения кислоты соединений формулы I, отличная от гидрохлорида, представляет собой метансульфонат. В девятом аспекте настоящее изобретение относится к способу получения фармацевтической ком-4 017929 позиции, содержащей соединение формулы I или его фармацевтически приемлемую соль присоединения кислоты, включающему синтез соединения формулы I или его соли присоединения кислоты в соответствии с любым из предшествующих аспектов и включение полученного соединения с традиционными фармацевтическими эксципиентами в состав композиции. В десятом аспекте настоящее изобретение относится к способу в соответствии с девятым аспектом,где фармацевтическая композиция предназначена для лечения, предупреждения или ослабления доброкачественной и/или злокачественной неоплазии, такой как, например, рак, гиперпролиферативных заболеваний доброкачественного или злокачественного характера и/или расстройств, чувствительных к индукции апоптоза. Особенно предпочтительно получение соли метансульфоната соединений формулы I в соответствии со способом, который описан в любом из приведенных выше аспектов, в частности(Е)-N-гидрокси-3-1-[4-(1-метил-1H-пиразол-4-ил)бензолсульфонил]-1H-пиррол-3-илакриламида. Предпочтительно хлорирующий агент в способе в соответствии с вышеописанными аспектами от одного до восьми используют в 2-3-кратном молярном избытке относительно соединения формулы II. Температура реакции хлорирования предпочтительно находится в диапазоне от 40 до 60C. Даже более предпочтительно водный гидроксиламин используют в 10-30-кратном молярном избытке относительно соединения формулы II'. Температура стадии образования амида предпочтительно находится в диапазоне от 10 до 30C,наиболее предпочтительно при комнатной температуре. В другом предпочтительном воплощении реакционную смесь перемешивают в течение 20-90 мин после завершения добавления соединения формулы II' к водному раствору, содержащему гидроксиламин. В наиболее предпочтительном воплощении изобретения соль метансульфонат любого из трех перечисленных выше предпочтительных соединений получают в соответствии со способом, использующим предпочтительные условия реакции, которые описаны выше. Наилучший способ осуществления изобретения Соединения формулы I могут быть получены в соответствии с приведенной ниже схемой реакции путем взаимодействия соли гидрохлорида соответствующих соединений акриловой кислоты формулы II с хлорирующим агентом и добавления полученного хлорангидрида формулы II' к раствору водного гидроксиламина и предпочтительно ТГФ Вследствие этого соединения формулы I осаждаются либо непосредственно в виде свободного основания, либо в виде соли гидрохлорида, оба из которых можно легко выделить фильтрованием с высокой степенью чистоты. Если желательно, свободное основание можно превратить в его гидрохлорид путем взаимодействия с хлороводородом. Аналогичные методики существуют для получения других солей присоединения кислот и хорошо известны специалисту в данной области техники. Предпочтительные примеры хлорирующего агента включают SOCl2 и (COCl)2, но не ограничены ими. Соединения формулы II могут быть получены в соответствии с приведенной ниже схемой реакций: В данной схеме реакций углеродную цепь соединения формулы V, где R1, R2, R4 и R5 имеют значения, как они определены выше, удлиняют, например, путем реакции конденсации (с производным малоновой кислоты), либо путем реакции Виттига или Жюлиа, либо, в частности, когда R2 представляет собой водород, путем реакции Хорнера-Уэдсворта-Эммонса (с диалкиловым эфиром (алкоксикарбонил)фосфоновой кислоты) с получением соединения формулы IV, где R1, R2, R3, R4 и R5 имеют значения, как они определены выше, и PG1 обозначает подходящую временную защитную группу для карбоксильной группы, например трет-бутил или одна из известных в данной области техники защитных групп, упомянутых в "Protective Groups in Organic Synthesis" by T. Greene and P. Wuts (John WileySons, Inc. 1999, 3rd Ed.) или в "Protecting Groups" ("Thieme Foundations Organic Chemistry Series NGroup" by P. Kocienski (Thieme Medical Publishers, 2000). Соединения формулы V известны или могут быть получены в соответствии с известными в данной области техники методиками, либо могут быть получены из соединений формулы VI для случая, где R2 представляет собой водород. Соединения формулы VI известны или доступны известными способами. Соединение формулы IV можно подвергать взаимодействию с соединением формулы R6-SO2-X, гдеR6 имеет значения, как они определены выше, и X представляет собой подходящую уходящую группу,такую как, например, хлор, с получением соответствующего соединения формулы III, где R1, R2, R3, R4,R5, R6 и PG1 имеют значения, как они определены выше. Соединения формулы R6-SO2-X известны или могут быть получены известными способами. На следующей стадии реакции защитную группу PG1 соединения формулы III можно удалить способом, известным в данной области техники, с получением соединения формулы II. Соединение формулы II' может быть получено путем взаимодействия соединения формулы II с тионилхлоридом или оксалилхлоридом. Это взаимодействие, возможно, может быть осуществлено в виде процесса in situ без выделения соединения формулы II'. Т.е. соединение формулы II' можно не выделяя подвергать взаимодействию с водным гидроксиламином с образованием соединения формулы I. Подразумевается, что настоящее изобретение включает оба варианта, т.е. образование in situ соединения формулы I из соединения формулы II путем взаимодействия не выделенного промежуточного соединения формулы II' с водным гидроксиламином и взаимодействия выделенного промежуточного соединения формулы II' с водным гидроксиламином с образованием соединения формулы I. Способ in situ предпочтителен. Возможно, форму свободного основания соединения формулы I можно превратить в одну из его солей присоединения кислот. Кроме того, гидрохлорид соединения формулы I или любую другую его соль присоединения кислоты можно превратить в его форму свободного основания. Соли могут быть получены путем растворения формы свободного основания соединений формулы I в подходящем растворителе (например, в кетоне, таком как ацетон, метилэтилкетоне или метилизобутилкетоне, эфире, таком как диэтиловый эфир, тетрагидрофуране или диоксане, хлорированном углеводороде, таком как метиленхлорид или хлороформ, либо в низкомолекулярном алифатическом спирте,таком как этанол или изопропанол), который содержит желаемую кислоту или основание, либо к которому затем добавляют желаемую кислоту или основание. Затем соли могут быть получены путем фильтрования, переосаждения, осаждения нерастворителем для соли присоединения (например, изопропанолом, ацетоном или ацетонитрилом) или путем выпаривания растворителя. Форма свободного основания соединений формулы I может быть получена из его соли гидрохлорида путем подщелачивания, а затем далее преобразована в другие соли, как описано выше. Таким образом, могут быть получены фармакологически приемлемые соли. Приведенные ниже примеры служат для дополнительной иллюстрации изобретения, не ограничивая его. Примеры Гидрохлорид В реакционный сосуд загружали гидрохлорид (Е)-3-[1-(4-диметиламинометилбензолсульфонил)1H-пиррол-3-ил]акриловой кислоты (20,0 кг, 53,92 моль), Celite Hyflow Supercel (10,0 кг) и 1-метил-2 пирролидон (130,0 л). Суспензию нагревали до 60-68 Х, перемешивали в течение 15-45 мин и фильтровали. Фильтровальный осадок промывали 1-метил-2-пирролидоном (10,0 л) и фильтрат переносили в реакционный сосуд. Раствор нагревали до 40-50C и добавляли тионилхлорид (19,0 кг, 159,94 моль) за период 1-1,5 ч. После перемешивания в течение 20-45 мин раствор хлорангидрида охлаждали до 18-28C. Во второй реакционный сосуд загружали водный гидроксиламин (50%, 42,8 кг, 647 моль) и ТГФ(40,0 л). Полученный выше раствор гидрохлорида (E)-3-[1-(4-диметиламинометилбензолсульфонил)-1Hпиррол-3-ил]акрилоилхлорида добавляли при 18-30C за период 2-4 ч. После перемешивания в течение 20-40 мин добавляли ацетон (47,6 л, 647 ммоль) при 17-25C в течение 45-90 мин. Реакционную смесь перемешивали в течение 30 мин и добавляли ацетонитрил (570,0 л) за период 1-2 ч. Суспензию перемешивали при 17-25C в течение по меньшей мере 4 ч, охлаждали до 5-13C и перемешивали в течение 1-2 ч. Твердое вещество центрифугировали и использовали без дополнительной сушки на следующей стадии образования свободного основания.(30,0 г, 75,6 ммоль) суспендировали в ацетонитриле (540 мл) и добавляли тионилхлорид (12,1 мл,166,3 ммоль) за период 10 мин. Суспензию нагревали до 60C и перемешивали в течение 2 ч. Полученный выше раствор гидрохлорида (E)-3-[1-(5-пиридин-2-ил-тиофен-2-сульфонил)-1Hпиррол-3-ил]акрилоилхлорида добавляли к водному раствору гидроксиламина (50%, 150 г, 2,27 моль) при 20-25C за период 45 мин. После перемешивания в течение 65 мин добавляли воду (300 мл) и охлаждали до 0C. Суспензию фильтровали и фильтровальный осадок промывали водой (150 мл). Указанное в заголовке соединение было получено в виде бежевого твердого вещества (17,3 г).(31,5 мл, 355,4 ммоль) в течение 5 мин. Суспензию нагревали до 55C и перемешивали в течение 1 ч. Полученный выше раствор гидрохлорида (E)-3-1-[4-(1-метил-1H-пиразол-4-ил)бензолсульфонил]1H-пиррол-3-илакрилоилхлорида добавляли к водному раствору гидроксиламина (50%, 105 мл,1,78 моль) при 10-20C за период 20 мин. После перемешивания в течение 90 мин суспензию фильтровали и сушили. Сырой продукт (48,4 г) суспендировали в смеси изопропанола (480 мл) и воды (480 мл) и перемешивали при кипячении с обратным холодильником в течение 1 ч. После охлаждения до комнатной температуры суспензию фильтровали и сушили. Указанное в заголовке соединение было получено в виде бежевого твердого вещества (28,1 г). Промышленная применимость Соединения, которые получены в соответствии с данным изобретением, обладают ценными фармакологическими свойствами по ингибированию активности и функции гистондезацетилазы. Они вызывают гиперацетилирование некоторых белков-субстратов и, как функциональное следствие, например, индукцию или подавление экспрессии гена, индукцию распада белка, остановку клеточного цикла, индукцию дифференцировки и/или индукцию апоптоза. Термин "индукция апоптоза" и аналогичные термины используют для идентификации соединения,которое осуществляет программируемую клеточную гибель в клетках, контактирующих с этим соединением. Апоптоз определяют как комплексные биохимические события в контактирующей клетке, такие как активация цистеин-специфичных протеиназ ("каспаз") и фрагментация хроматина. Индукция апоптоза в клетках, контактирующих с соединением, может быть необязательно сопряжена с ингибированием клеточной пролиферации или клеточной дифференцировки. Предпочтительно ингибирование пролиферации, индукция дифференцировки и/или индукция апоптоза специфичны для клеток с аберрантным клеточным ростом."Индукцию дифференцировки" определяют как процесс перепрограммирования клеток, приводящий к обратимой или необратимой остановке клеточного цикла в фазе GO и возобновление экспрессии подгруппы генов, типичных для определенного специализированного нормального типа клеток или ткани (например, возобновление экспрессии белков молочного жира и жира в клетках карциномы молочной железы). Далее, изобретение относится к способу получения фармацевтической композиции для ингибирования, лечения, ослабления или предупреждения клеточной неоплазии. "Неоплазия" определена клетками, проявляющими аберрантную клеточную пролиферацию, и/или выживание, и/или блокирование дифференцировки. Термин "неоплазия" включает "доброкачественную неоплазию", которую описывают гиперпролиферацией клеток, неспособных к образованию агрессивной метастазирующей опухоли in vivo,и, в противоположность этому, "злокачественную неоплазию", которую описывают клетками с множественными клеточными и биохимическими аномалиями, способными к образованию системного заболевания, например, к образованию метастаза опухоли в отдаленных органах. Фармацевтические композиции, полученные в соответствии с настоящим изобретением, предпочтительно применяют для лечения злокачественной неоплазии, также описанной как рак, характеризующейся опухолевыми клетками, в конечном итоге метастазирующими в отдаленные органы или ткани. Примеры злокачественной неоплазии, которую лечат производными N-сульфонилпиррола по настоящему изобретению, включают солидные и гематологические опухоли. Примерами солидных опухолей являются опухоли молочной железы, мочевого пузыря, кости, головного мозга, центральной и периферической нервной системы, ободочной кишки, эндокринных желез (например, щитовидной железы и коры надпочечников), пищевода, эндометрия, зародышевых клеток, головы и шеи, почки, печени, легкого,глотки и гипофаринкса, мезотелиомы, яичника, поджелудочной железы, простаты, прямой кишки, почечных клеток, тонкого кишечника, мягких тканей, семенника, желудка, кожи, уретры, влагалища и вульвы. Злокачественная неоплазия включает наследуемые раки, примерами которых является ретинобластома и опухоль Вильмса. Кроме того, злокачественная неоплазия включает первичные опухоли в указанных органах и соответствующие вторичные опухоли в отдаленных органах ("метастазы опухоли"). Примерами гематологических опухолей являются агрессивные и медленно растущие формы лейкоза и лимфомы, а именно неходжкинская лимфома, хронический и острый миелоидный лейкоз (ХМЛ/ОМЛ),острый лимфобластный лейкоз (ОЛЛ), ходжкинская лимфома, множественная миелома и Т-клеточная лимфома. Также включены миелодиспластический синдром, неоплазия плазматических клеток, паранеопластические синдромы, раковые опухоли с неизвестным первичным местом, а также злокачественные опухоли, обусловленные СПИД. Далее, в изобретении предложен способ получения фармацевтических композиций для лечения млекопитающего, в частности человека, страдающего заболеванием, отличным от клеточной неоплазии,чувствительным к терапии ингибитором гистондезацетилаз. Эти незлокачественные заболевания включают:(1) артропатии и остеопатологические состояния или заболевания, такие как ревматоидный артрит,остеоартрит, подагра, полиартрит и псориатический артрит;(2) аутоиммунные заболевания, такие как системная красная волчанка и отторжение трансплантата;(3) гиперпролиферативные заболевания, такие как пролиферация гладкомышечных клеток, включая сосудистые пролиферативные расстройства, атеросклероз и рестеноз;(4) острые и хронические воспалительные состояния или заболевания и кожные состояния, такие как неспецифический язвенный колит, болезнь Крона, аллергический ринит, аллергический дерматит,муковисцидоз, хронический обструктивный бронхит и астма;(8) нейропатологические расстройства, такие как болезнь Паркинсона, болезнь Альцгеймера или расстройства, обусловленные полиглутамином, и(9) патологические состояния, поддающиеся лечению посредством потенцирования экспрессии эндогенных генов, а также усиления экспрессии трансгена в генотерапии. Способ по настоящему изобретению дает соединения в очищенной или в по существу чистой форме, как, например, со степенью чистоты более чем примерно 50%, более предпочтительно примерно 60%, более предпочтительно примерно 70%, более предпочтительно примерно 80%, более предпочтительно примерно 90%, более предпочтительно примерно 95%, более предпочтительно примерно 97%,более предпочтительно примерно 99% по массе, как определено способами, известными в данной области техники. Фармацевтические композиции, получаемые в соответствии с настоящим изобретением, находятся в твердой или жидкой форме, в частности в твердых пероральных лекарственных формах, таких как таблетки и капсулы, а также суппозитории и другие фармацевтические лекарственные формы. Они содержат одно или более чем одно соединение формулы I и фармацевтически приемлемый эксципиент. Возможно, может присутствовать дополнительный активный ингредиент, в частности дополнительное противораковое лекарственное средство. Фармацевтические композиции, получаемые в соответствии с данным изобретением, могут обладать ингибиторной активностью в отношении гистондезацетилаз, активностью индуцирования апоптоза,антипролиферативными эффектами и/или активностью индуцирования клеточной дифференцировки. Фармацевтические композиции, содержащие соединение формулы I, получаемые в соответствии с данным изобретением, готовят способами, которые сами по себе известны и знакомы специалистам в данной области техники. В виде фармацевтических композиций соединения формулы I (т.е. активные соединения) применяют в комбинации с подходящими фармацевтическими вспомогательными веществами и/или эксципиентами, например, в форме таблеток, таблеток с покрытием, капсул, каплет, суппозиториев, пластырей (например, таких как трансдермальная терапевтическая система (ТТС, эмульсий,суспензий, гелей или растворов, где содержание активного соединения предпочтительно составляет от 0,1 до 95% и где в результате соответствующего выбора вспомогательных веществ и/или эксципиентов может быть получена фармацевтическая форма введения (например, форма замедленного высвобождения или энтеросолюбильная форма), точно подходящая к данному активному соединению и/или желаемому началу действия. Специалист в данной области техники знаком с эксципиентами (т.е. вспомогательными веществами, наполнителями, разбавителями, носителями или адъювантами), которые подходят для желаемых фармацевтических препаратов, препаратов или композиций, согласно его/ее компетенции. Кроме растворителей, загустителей, мазевых основ можно использовать другие эксципиенты, например антиоксиданты, диспергирующие агенты, эмульгаторы, консерванты, солюбилизаторы, красители, комплексообразующие агенты или стимуляторы проникновения. Специалисту в данной области техники согласно его/ее компетенции данного рода известна суммарная суточная дозировка(и) и форма(ы) введения соединения формулы I и любого дополнительного терапевтического агента(ов), вводимого совместно. Указанная суммарная суточная дозировка(и) может варьировать в широком диапазоне. Что касается подходящих комбинаций для совместного введения, схем дозирования, лекарственных средств, наборов, коммерческих упаковок, способов лечения и т.д., соединений формулы I, сделана ссылка на WO 2007/039404, описание которой полностью включено в данное описание, в частности на с. 88-96. Введение соединений, полученных в соответствии с данным изобретением, комбинаций и фармацевтических композиций, полученных в соответствии с изобретением, можно осуществлять любым из общепринятых способов введения, доступных в данной области техники. Иллюстративные примеры подходящих способов введения включают внутривенную, пероральную, назальную, парентеральную,местную, чрескожную и ректальную доставку. Предпочтительны пероральная и внутривенная доставка. Для дополнительных подробностей сделана ссылка на WO 2007/039404, в частности на с. 87, предпоследний параграф. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы IR2 представляет собой водород или C1-4-алкил;R3 представляет собой водород или C1-4-алкил;Ar1 представляет собой фенил или R61- и/или R62-замещенный фенил, гдеR611 и R612 вместе и с включением атома азота, с которым они связаны, образуют гетероциклическое кольцо Het1, гдеR611 и R612 вместе и с включением атома азота, с которым они связаны, образуют гетероциклическое кольцо Het1, гдеR62 представляет собой C1-4-алкил, C1-4-алкокси, галоген, циано, C1-4-алкокси-C1-4-алкил, C1-4 алкилкарбониламино или C1-4-алкилсульфониламино; Аа 1 представляет собой бис-арильный радикал, состоящий из двух арильных групп, которые независимо выбраны из группы, состоящей из фенила и нафтила, и которые связаны вместе через одинарную связь;Hh1 представляет собой бис-гетероарильный радикал, состоящий из двух гетероарильных групп,которые независимо выбраны из группы, состоящей из моноциклических 5- или 6-членных гетероарильных радикалов, содержащих один или два гетероатома, каждый из которых выбран из группы, состоящей из азота, кислорода и серы, и которые связаны вместе через одинарную связь;Ah1 представляет собой гетероариларильный радикал или арилгетероарильный радикал, состоящий из гетероарильной группы, выбранной из группы, состоящей из моноциклических 5- или 6-членных гетероарильных радикалов, содержащих один или два гетероатома, каждый из которых выбран из группы,состоящей из азота, кислорода и серы, и арильной группы, выбранной из группы, состоящей из фенила и нафтила, где указанные гетероарильная и арильная группы связаны вместе через одинарную связь,где Аа 1, Hh1 и Ah1 могут быть возможно замещены R63 и/или R64, гдеR63 представляет собой C1-4-алкил, фенил-C1-4-алкил, C1-4-алкокси, трифторметил, циано, галоген,полностью или преимущественно фторзамещенный C1-4-алкокси, C1-4-алкокси-C1-4-алкил, C1-4 алкилсульфониламино, толилсульфониламино, фенилсульфониламино, C1-4-алкилкарбониламино, карбамоил, моно- или ди-C1-4-алкиламинокарбонил, моно- или ди-C1-4-алкиламиносульфонил или -T3N(R631)R632, гдеR631 и R632 вместе и с включением атома азота, с которым они связаны, образуют гетероциклическое кольцо Het2, гдеR64 представляет собой C1-4-алкил, C1-4-алкокси или галоген,включающий стадию взаимодействия хлорангидрида акриловой кислоты формулы II' Формула II' где R1, R2, R3, R4, R5 и R6 имеют значения, как они определены выше,с водным гидроксиламином и, возможно, превращения полученного соединения в его соль присоединения кислоты. 2. Способ по п.1, где соединение формулы II' получают путем преобразования кислоты формулы II Формула II где R1, R2, R3, R4, R5 и R6 имеют значения, как они определены в п.1,в ее хлорангидрид формулы II'. 3. Способ по п.2, в котором хлорангидрид формулы II' получают путем взаимодействия кислоты формулы II с тионилхлоридом или оксалилхлоридом. 4. Способ по п.2, в котором соединение формулы II получают способом, включающим следующие стадии: удлинение углеродной цепи соединения формулы V Формула V где R1, R2, R4 и R5 имеют значения, как они определены в п.1,с получением соединения формулы IV Формула IV где R1, R2, R3, R4 и R5 имеют значения, как они определены в п.1, и PG1 обозначает подходящую временную защитную группу для карбоксильной группы,взаимодействие соединения формулы IV с соединением формулы R6-SO2-X, где R6 является таким,как определено в п.1, и X представляет собой подходящую уходящую группу, с получением соответствующего соединения формулы III Формула III где R1, R2, R3, R4, R5 и R6 имеют значения, как они определены в п.1, и PG1 обозначает подходящую временную защитную группу для карбоксильной группы, и удаление защитной группы PG1 с получением соединения формулы II. 5. Способ по любому из пп.1-4, в котором соединение формулы I получают в форме свободного основания. 6. Способ по любому из пп.1-4, в котором соединение формулы I непосредственно получают в форме его соли гидрохлорида путем взаимодействия соединения формулы II' с водным гидроксиламином. 7. Способ по любому из пп.1-4, где соединение формулы I получают в форме соли присоединения кислоты, отличной от гидрохлорида, способом, включающим взаимодействие свободного основания соединения формулы I с подходящей кислотой или производным кислоты с образованием соответствующей соли присоединения кислоты или превращение соли присоединения кислоты соединения формулы I в другую соль присоединения кислоты. 8. Способ по п.7, где соль присоединения кислоты соединений формулы I, отличная от гидрохлорида, представляет собой метансульфонат. 9. Способ получения фармацевтической композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль присоединения кислоты, включающий получение соединения формулы I или его фармацевтически приемлемой соли присоединения кислоты способом по любому из пп.18 и смешивание полученного соединения с фармацевтическими эксципиентами. 10. Способ по п.9, где фармацевтическая композиция предназначена для лечения, предупреждения или ослабления доброкачественной и/или злокачественной неоплазии, такой как, например, рак, гиперпролиферативных заболеваний доброкачественного или злокачественного характера и/или расстройств,чувствительных к индукции апоптоза.
МПК / Метки
МПК: C07D 207/48, C07D 403/12, A61P 35/00, A61K 31/40
Метки: способ, сульфонилпирролов, получения, гистондезацетилаз, ингибиторов, hdac, качестве
Код ссылки
<a href="https://eas.patents.su/13-17929-sposob-polucheniya-sulfonilpirrolov-v-kachestve-ingibitorov-gistondezacetilaz-hdac.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения сульфонилпирролов в качестве ингибиторов гистондезацетилаз (hdac)</a>
Предыдущий патент: Способ получения дарифенацина гидробромида
Следующий патент: Оптический прицел для легкого вооружения
Случайный патент: Система сбора данных по распределительной электросети переменного тока












