6,7-диалкокси хиназолиновые производные, эффективные для лечения нарушений, связанных с раком
Номер патента: 18514
Опубликовано: 30.08.2013
Авторы: Адибхатла Кали Сатьа Бхуджанга Рао, Венкайя Чоудари Наннапанени, Джиотхи Прасад Раманадхам, Нагешвара Рао Боллепалли
Формула / Реферат
1. Применение хиназолинового производного формулы
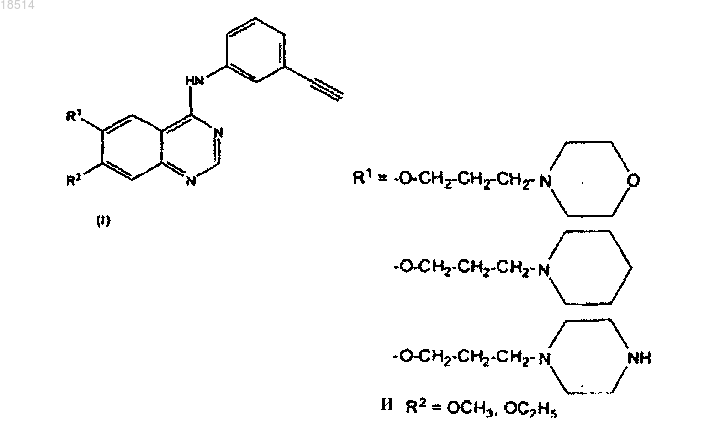
или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака легких, рака молочной железы.
2. Применение по п.1, отличающееся тем, что
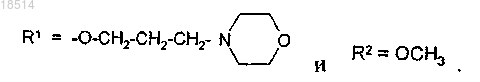
3. Применение по п.2, отличающееся тем, что фармацевтически приемлемая соль представляет собой моногидрохлорид (NRC-2694A).
4. Применение по п.2, отличающееся тем, что фармацевтически приемлемая соль представляет собой дигидрохлорид (NRC-2694В).
Текст
6,7-ДИАЛКОКСИ ХИНАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ, ЭФФЕКТИВНЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ, СВЯЗАННЫХ С РАКОМ Настоящее изобретение относится к применению хиназолинового производного формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака легких и рака молочной железы. Хиназолиновые производные формулы (I) обеспечивают гораздо более сильные и особые антипролиферативные свойства по сравнению с другими известными членами хиназолинового класса лекарственных препаратов, гораздо менее токсичны и их профиль безопасности крайне благоприятен для терапевтических применений. Джиотхи Прасад Раманадхам,Адибхатла Кали Сатьа Бхуджанга Рао,Нагешвара Рао Боллепалли, Венкайя Чоудари Наннапанени (IN) Дементьев В.Н. (RU)(71)(73) Заявитель и патентовладелец: НАТКО ФАРМА ЛИМИТЕД (IN) Изобретение относится к 6,7-диалкокси хиназолиновым производным или их фармацевтически приемлемым солям, которые проявляют противораковую активность и, следовательно, могут быть полезными в методах лечения человека. Изобретение также относится к способам производства указанных хиназолиновых производных и содержащим их фармацевтическим композициям. В большинстве проводимых ранее режимах лечения клеточных пролиферативных заболеваний, таких как псориаз и рак, применялись соединения, ингибирующие синтез ДНК. Такие соединения токсичны для клеток, и их положительные эффекты можно использовать только тогда, когда они проявляют селективность в отношении быстро делящихся клеток опухоли. В последние годы было обнаружено, что клетка может стать раковой путем трансформации части ее ДНК в онкоген, т.е. ген, который при активации приводит к образованию злокачественных клеток опухоли (Bradshas, Mutagenesis, 1986, 1:91). Отдельные онкогены кодируют ферменты тирозинкиназы, и эти определенные рецепторы фактора роста представляют собой одновременно и ферменты тирозинкиназы (Larsen et al., Ann. Reports in Med. Chem. 1989, Chapt.13). Рецепторные тирозинкиназы являются важными в путях передачи биохимических сигналов, инициирующих размножение клеток. Они содержат внеклеточный домен, который отвечает за связывание факторов роста, таких как эпидермальный фактор роста, и внутриклеточный участок, который выполняет функцию киназы по фосфорилированию аминокислот тирозина в белках и, следовательно, влиянию на клеточную пролиферацию. Известно, что такие киназы часто присутствуют в распространенных видах рака у человека, таких как рак молочной железы (Saimbury et al., Brit, J. Cancer, 1988, 58:458), рак желудочно-кишечного тракта, рак толстой кишки, рак прямой кишки и рак желудка (Bolen et al., OncogeneRes., 1987, 1:149). Было обнаружено, что тирозинкиназная активность (TK активность) чаще обнаруживается в злокачественных клетках, чем в нормальных клетках (Hunter, Cell., 1987, 50: 823). Недавно было доказано, что рецептор эпидермального фактора роста (EGFR), который проявляетTK активность, является сверхэкспрессированным во многих видах рака у человека, таких как рак мозга,рак легких, плоскоклеточный рак, рак мочевого пузыря, рак желудка, рак молочной железы, рак органов головы и шеи, рак пищевода, рак щитовидной железы и подобных (W.J. Gullick, Brit. Med. Bull. 1991; 47: 87). Рецептор эпидермального фактора роста (EGFR), член семейства рецепторных тирозинкиназ (RTK),включает четыре рецептора Erb1/HER1, Erb1/HER2, Erb1/HER3 и Erb1/HER4. В важной стратегии ингибирования активности EGFR-TK применялись маленькие синтетические молекулы (Arteaga C.L., Exp. Cell. Res., 2003, 284: 122-130). Определенные хиназолиновые производные,подобные гефитинибу (Iressa, Astra Zenoca), эрлотинибу (OSI-774, Tarceva), PD-183805, PKI-166,EKB-569, PD-168393, CGP-59362, были тщательно исследованы на возможные параметры лечения нескольких видов рака (Baselga et al., Oncology 2002, 63: 6-16, Cohen RB., Clin. Colorectal Cancer, 2003, 2: 246-251). В европейских патентных заявках EP 0566226, EP 0602851 А 1, EP 0635507 A1, EP 0635498 A1,EO 0520722 A1 раскрыты определенные хиназолиновые производные, обладающие противораковыми свойствами в результате их ингибирующего TK свойства. В американских патентах 5475001, 5457105, 5616582, 5770599, 5747498, 6900221 и др. рассмотрены хиназолиновые производные с такими структурными особенностями, как замещенные анилиновые группы в положении 4 и различные функционализированные алкильные группы в положениях 6 и 7 хиназолинового ядра. Особым образом в американских патентах 5457105 и 5616582 рассмотрен N-(3-хлор-4-фторфенил)7-метокси-6-[3-(4-морфолинил)пропокси]-4-хиназолинамин (гефинитиб), и в 5747498, 690221 рассмотренN-(3-этилнилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин (эрлотиниб). В WO 2005/070909, WO 2007/060691 А 2 и WO 06/090413 рассмотрены варианты синтеза или полиморфные формы этих двух известных противораковых лекарственных препаратов. Ввиду большого предложения указанных соединений хиназолинового класса, нами был произведен синтез и скрининг большого количества новых химических структурных единиц с новыми структурными характеристиками. Удивительно и неожиданно было обнаружено, что хиназолины, содержащие 3 этиниланилиновую группу в положении 4 и особенно замещенные алкоксигруппы в положениях 6 и 7,обеспечивают гораздо более сильные и особые антипролиферативные свойства по сравнению с другими известными членами хиназолинового класса лекарственных препаратов. Также удивительно, что соединения данного изобретения гораздо менее токсичны и профиль безопасности крайне благоприятен для терапевтических применений. Новые химические структурные единицы, описанные в данном изобретении, обозначены общей структурой (I) и ранее не были синтезированы или исследованы на их терапевтические эффекты и профиль безопасности. соединение (I) представляет собой NRC-2694, где Соль моно-HCl NRC-2694 представляет собой NRC-2694A. Соль DiHCl NRC-2694 представляет собой NRC-2694 В. Новые соединения данного изобретения, особенно NRC-2694, обладают неожиданными превосходными антираковыми/антипролиферативными свойствами и обеспечивают дополнительные терапевтические преимущества по сравнению с известными лекарственными препаратами этого класса,как подробно описано ниже. 1) Низкая ингибирующая концентрация. Ингибирующая концентрация (IC50) в МТТ-методе определения пролиферации составила величину в диапазоне 40-90 нг/мл (100-200 нм), при этом для эрлотинибаHCl эта величина равна 836 нг/мл (1945 нм). То же самое было подтверждено вестерн-блоттингом и исследованием инвазии Матригеля. 2) Полная регрессия опухоли. Полную регрессию опухоли наблюдали с помощью орального введения соединений бестимусной мыши, имплантированной клетками опухоли легкого человека А 549 в дозе 10 мг/кг. При сравнительном исследовании, даже при дозе 100 мг/кг, эрлотиниб HCl не смог вызвать полную регрессию опухоли. Визуальное исследование тканей легкого мыши, имплантированной А 549 и эксперименты по экспрессии люциферазы дали аналогичные результаты. 3) Эффективность лекарственного препарата. Повышение эффективной дозы составило величину(ED50), равную 6,3 мг/кг для типичного соединения данного изобретения, т.е. NRC-2694, в то время как величина, полученная для эрлотиниба HCl, составила 22 мг/кг. 100% лечебный эффект наблюдали с NRC-2694, в отличие от всего 50-60% в случае эрлотинибаHCl. 4) Дополнительные специфические показатели. Соединения данного изобретения, в основном NRC2694, обнаружили дополнительные показатели, такие как регуляция в сторону уменьшения уровней экспрессии ErbB2, ErbB3, ErbB4 и VEGFR рецепторов. Этот особый, значимый и удивительный результат был совершенно неожиданным и не наблюдался в случае с эрлотинибом HCl. 5) Профиль безопасности. Профиль безопасности соединений данного изобретения, в основномNRC-2694, является обнадеживающим и неожиданно широким и крайне полезным. Таким образом, NRC2694 показал максимально переносимую дозу (MTD) 500 мг/кг по сравнению с 2000 мг/кг для эрлотиниба HCl. Широкое терапевтическое окно, предложенное NRC-2694, было продемонстрировано его величиной LD0, равной 2000 мг/кг, по сравнению с 500 мг/кг для эрлотиниба HCl. Величина LD50 не может быть точно определена для NRC-2694 по сравнению с величиной 805 мг/кг, определенной для эрлотинибаHCl. Следующие примеры представлены для иллюстрации процесса приготовления соединений настоящего изобретения, а также их великолепной биологической эффективности и, следовательно, не могут считаться ограничением объема изобретения.i) Приготовление 4-хлор-6-[3-(4-морфолинил)пропокси-4-хиназолина (IIIa). В чистую и высушенную четырехгорлую колбу с круглым дном емкостью 5 л, снабженную механической мешалкой, обратным холодильником, выравнивающей давление капельной воронкой и термометром, загружали хлороформ (3000 мл), диметилформамид (30 мл) с последующим 7-метокси-6-(3 морфолинопропокси)-3,4-дигидрохиназолин-4-оном (IIa) (150 г), полученным согласно способу, представленному в примере 1 опубликованной международной заявки РСТ WO 2005/070909 A1. Медленно добавляли оксалилхлорид (120 г), реакционную массу нагревали до температуры флегмы и поддерживали при температуре флегмы в течение примерно 5 ч. Тестирование ВЭЖХ показало завершение реакции. Растворитель хлороформ и избыточный оксалилхлорид отгоняли под умеренным вакуумом. Реакционную массу охлаждали примерно до 40 С и добавляли хлороформ (300 мл), после чего растворитель снова отгоняли под умеренным вакуумом. Реакционную смесь охлаждали до комнатной температуры и добавляли ацетонитрил (3000 мл), после чего перемешивали в течение 10-15 мин и хранили в атмосфере азота для проведения следующей стадии.(I, NRC-2694). В пятигорлую колбу с круглым дном емкостью 5 л, снабженную механической мешалкой, обратным холодильником и термометром, содержащую соединение хлора в ацетонитриле из стадии (i), медленно добавляли 3-этиниланилин (69 г) в течение примерно 10-15 мин, после чего реакционную массу нагревали до температуры флегмы и поддерживали при температуре флегмы в течение 4 ч. Тестирование ВЭЖХ показало завершение реакции. Затем реакционную смесь охлаждали до 22-35 С и фильтровали,кек промывали ацетонитрилом (500 мл) и высушивали. Высушенное сырое соединение переносили в другую колбу с круглым дном емкостью 5 л и заливали водой (2500 мл), после чего медленно поднимали температуру до 60-65 С и устанавливали уровень рН реакционной массы до 10-12 слабым раствором гидроксида натрия. Отделенный твердый продукт фильтровали, промывали водой и высушивали при 7075 С для получения 173,0 г N-(3-этинилфенил)-6-(3-морфолинпропокси)-7-метокси-4-хиназоламина в виде грязно-белого твердого вещества. В четырехгорлую колбу с круглым дном емкостью 5 л, снабженную механической мешалкой, обратным холодильником и термометром, загружали толуол (3750 мл) с последующим N-(3-этинилфенил)6-(3-морфолинопропокси)-7-метокси-4-хиназолинамином (50 г), полученным способом, описанным в приведенном выше примере (1). Реакционную смесь нагревали до 90-95 С до полного растворения твердой фазы. Затем обрабатывали активированным углем и фильтровали. Фильтрат охлаждали до 25-35 С,выдерживали примерно в течение 1 ч, фильтровали и высушивали материал для получения 40,15 г N-(3 этинилфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4-хиназолинамина в виде белого кристаллического вещества. Точка плавления: 185-187 С. Чистота: 99,72% (ВЭЖХ).Mass: 419 (M+l). Пример 2. Рекристаллизация N-(3-этинилфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4 хиназолинамина из ацетонитрила. В четырехгорлую колбу с круглым дном емкостью 5 л, снабженную механической мешалкой, обратным холодильником и термометром, загружали ацетонитрил (1000 мл) с последующим N-(3 этинилфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4-хиназолинамином (25 г), полученным способом, описанным в представленном выше примере 1. Реакционную смесь медленно нагревали до 65-70 С до полного растворения твердой фазы, обрабатывали активированным углем и реакционную массу фильтровали. Фильтрат переносили в другую колбу с круглым дном, медленно охлаждали до 10-15 С и выдерживали в течение 30 мин при этой температуре. Реакционную массу фильтровали и после отмывания осадка охлажденным ацетонитрилом высушивали для получения 20,50 г N-(3-этинилфенил)-7 метокси-6-[3-(4-морфолинил)пропокси]-4-хиназолинамина в виде белого кристаллического вещества. Точка плавления: 186-187 С. Чистота: 99,68% (ВЭЖХ). Пример 3. Рекристаллизация N-(3-этинилфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4 хиназолинамина из этилацетата. В трехгорлую колбу с круглым дном емкостью 3 л, снабженную механической мешалкой, обратным холодильником и термометром, загружали этилацетат (2000 мл) с последующим N-(3 этинилфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4-хиназолинамином (25 г), полученным способом, описанным в представленном выше примере 1. Реакционную массу медленно нагревали до 65-70 С до полного растворения твердой фазы, обрабатывали активированным углем и реакционную массу фильтровали. Фильтрат переносили в другую колбу с круглым дном, медленно охлаждали до 10-15 С и выдерживали в течение 30 мин при этой температуре. Кристаллическую массу фильтровали и после отмывания осадка охлажденным этилацетатом высушивали для получения 20,95 г N-(3-этинилфенил)-6-[3(4-морфолинил)пропокси]-7-метокси-4-хиназолинамина в виде белого кристаллического вещества. Точка плавления: 185-187 С. Чистота: 99,7% (ВЭЖХ). Пример 4. ПриготовлениеN-(3-этинилфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4 хиназолинамина моногидрохлорида (NRC-2694A). В трехгорлую колбу с круглым дном емкостью 500 мл, снабженную механической мешалкой, обратным холодильником и термометром, загружали изопропиловый спирт (250 мл) с последующим N-(3 этинилфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4-хиназолинамином (5 г), полученным способом, описанным в примере 1. Температуру реакционной массы поднимали до 65-70 С до полного растворения твердой фазы, обрабатывали активированным углем и фильтровали. Фильтрат охлаждали примерно до 55-60 С и добавляли 1 моль-экв. HCl-газа, растворенного в растворе изопропилового спирта,после выделения соли моногидрохлорида. Реакционную массу выдерживали при температуре флегмы в течение примерно 2 ч и затем охлаждали до комнатной температуры, фильтровали и высушивали для получения 5,1 г N-(3-этинилфенил)-6-(3-морфолинопропокси)-7-метокси-4-хиназолинамина моногидрохлорида в виде белого кристаллического вещества. Чистота: 99,8% (ВЭЖХ). Содержание HCl (химическое): 8,19% (теоретическое значение: 8,01%)N-(3-этинилфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4 хиназолинамина дигидрохлорида (NRC-2694B). В трехгорлую колбу с круглым дном емкостью 500 мл, снабженную механической мешалкой, обратным холодильником и термометром, загружали изопропиловый спирт (250 мл) с последующим N-(3-4 018514 этинилфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4-хиназолинамином (5 г), полученным способом, представленным в примере 1. Температуру реакционной массы увеличивали до 65-70 С до полного растворения твердой фазы. Обрабатывали активированным углем и фильтровали. Фильтрат охлаждали примерно до 55-60 С и добавляли 2 моль-экв. HCl-газа, растворенного в растворе изопропилового спирта, при выделении дигидрохлорида. Реакционную массу выдерживали при температуре флегмы в течение примерно 2 ч, после чего охлаждали до комнатной температуры, фильтровали и высушивали для получения 5,5 г N-(3-этинилфенил)-7-метокси-6-[3-(4-морфолинил)пропокси]-4-хиназолинамина дигидрохлорида в виде белого кристаллического вещества. Чистота: 99,78% (ВЭЖХ). Содержание HCl (химическое): 14,9% (теоретическое значение: 14,83%)IR (KBr) (см-1): 3406.8, 3194.1, 2942.7, 2681.9, 2623.6, 1633.7, 1566.2, 1528.6, 1512.5, 1438.6, 1359.6,1282.3, 1218.3, 1157.1, 1132.7, 1105.9, 1075.6, 1001.9, 942.1, 875.3, 816.1, 787.2. Пример 6. Максимальная переносимая доза (MTD) и оценка острой токсичности (табл. 1 и 2). Раннее цитируемое исследование MTD проводили на мышах линии Swiss Albino женских и мужских особей (вес 20-25 г). Изучение проводили согласно правилам 420 руководства OECD (Организации экономического сотрудничества и развития), в промежутке между 9.00 часами утра и 17.00 часами для того, чтобы избежать суточного ритма, соединения эрлотиниб и NRC-2694 суспендировали в 2% аравийской камеди и вводили в дозах 5, 50, 300 и 2000 мг/кг (внутрь) перорально. Промежуточные дозы вводили в зависимости от летальности. Животных наблюдали на общие изменения поведения каждый час до 6 ч после введения лекарственного препарата. Кроме того, животных наблюдали до 72 ч на летальность, в случае ее наличия. Выживших животных аутопсировали на подтверждение абсорбции соединения в ЖКТ (желудочнокишечном тракте). Острую токсичность эрлотиниба и NRC-2694 изучали на мышах женских и мужских особей. Перорально вводили дозы 500, 750, 1000 и 2000 мг/кг. Каждая группа состояла из 5 мышей. Животных наблюдали на летальность в течение 14 дней после введения соединения. Выживших животных аутопсировали на подтверждение абсорбции соединения в ЖКТ. Величину LD50 определяли с помощью Litchfield and Wilcoxon (J. Pharmacol. Exp. Ther. 1949, 96:99113). Результаты исследования токсичности представлены в табл. 1 и 2. Было обнаружено, что максимальная переносимая доза (MTD) эрлотиниба HCl составила 500 мг/кг (перорально), в то время как дляNRC-2694 она составила 2000 мг/кг (перорально). Аналогично, было обнаружено, что величина LD0 для эрлотиниба HCl составила 500 мг/кг (перорально) и 2000 мг/кг (перорально) для NRC-2694. Таким образом, была доказана неожиданная и удивительно низкая токсичность и профиль безопасности для NRC2694 по сравнению с эрлотинибом HCl. Таблица 1 Сравнительное раннее цитируемое исследование (MTD) эрлотиниба HCl и NRC-2694 (мыши) Таблица 2 Исследование острой токсичности LD50 (однократная доза, 7 дней наблюдения) у мышейLD0: Летальности не наблюдали в конце 7 дней. Пример 7. Качественная оценка и оценка терапевтической эффективности in vitro и in vivo. Образцы. Эрлотиниб использовали в качестве контрольного лекарственного препарата, биологическую активность новых соединений данного изобретения тестировали в сравнении с этим лекарственным препаратом в качестве положительного контроля.i) МТТ-тест для оценки пролиферации. МТТ [3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид] тест, впервые описанный Мосманном в 1983 г., основан на способности митохондриального фермента дегидрогеназы жизнеспособных клеток расщеплять тетразолиевые кольца бледно-желтой МТТ и образовывать темно-синие кристаллы формазана, в значительной степени проницаемые для клеточных мембран, таким образом приводя к его накоплению внутри здоровых клеток. Солюбилизация клеток путем добавления детергента приводит к высвобождению кристаллов, которые являются солюбилизированными. Число выживших клеток прямо пропорционально уровню полученного продукта формазана. Цвет может быть рассчитан с помощью обычного колориметрического анализа. Этот анализ проводили с использованием эрлотиниба и тестируемых соединений при концентрации 0-1000 нг/мл в А 549 и Р 1299 клетках. Протокол был основан на АТСС (Американской Коллекции Типовых Культур) и соответствовал инструкциям производителя (каталожный номер: 30-1010K). На основании МТТ-теста для оценки пролиферации было определено, что ингибирующая концентрация (IC50) соединений изобретения изменялась от 40 до 90 нг/мл (100-200 нм), в то время как эрлотиниб гидрохлорид, который использовали в качестве положительного контроля, имел величину до 836 нг/мл (1945 нм). Таким образом, можно сделать вывод, что новые соединения данного изобретения по меньшей мере в 10 раз сильнее эрлотиниба гидрохлорида.ii) Вестерн-блот анализ (фиг. 1). Идеальные концентрации лекарственного препарата из МТТ-теста для оценки пролиферации использовали для обработки 1106 Н 1299 или А 549 клеток в соответствующей среде в течение 72 ч, после чего лизаты клеток экстрагировали и разделяли в 10% SDS PAGE геле при восстановительных условиях. Гели блоттировали на обработанные нейлоновые мембраны (Biorad) и иммунотестировали на EGFR,PI3K и AKT. Наблюдали значительное дозозависимое изменение в экспрессии EGFR. NRC-2694 вызывал ингибирование экспрессии EGFR при концентрациях 80 нг (190 нм), в то время как для эрлотиниба HCl концентрация составила 800 нг (1860 нм). Таким образом, десятикратное увеличение эффективности NRC2694 является очевидным.iii) Анализ на инвазию матригеля (Matrigel) (фиг. 2). Инвазивность H1299 и А 549 клеток in vitro в присутствии разных концентраций NRC соединений(как определено МТТ-тестом) оценивали с помощью анализа в модифицированной камере Бойдена. Клетки обрабатывали этими соединениями в течение 48 ч. 1106 клеток суспендировали в 600 мкл бессывороточной среды, дополненной 0,2% BSA и помещенной в верхний отсек камер Трансвелл (CorningCostar Fisher Scientific кат.07-200-158, Pittsburgh PA), покрытых матригелем (0,7 мг/мл). Нижний отсек камеры заполняли 200 мкл сывороточной среды и клетки оставляли мигрировать в течение 24 ч. После инкубации клетки фиксировали, окрашивали Hema-3 и подсчитывали, как описано ранее (Mohanamet al. 1993). Количество мигрировавших клеток выражали как процент инвазии. Соединение NRC-2694 показало значительное снижение инвазии дозозависимым образом.iv) Оценка in vivo на подкожных опухолях легкого у бестимусных мышей (фиг. 3). Бестимусные мыши были имплантированы 2106 А 549 клетками на правой стороне тазовой конечности. После установления образования опухоли (2 мм) мышей орально или внутривенно обрабатывали тестируемыми соединениями, включая эрлотиниб HCl, который использовали в качестве положительного контроля. В качестве базовой дозы установили дозу 100 мг/кг эрлотиниба HCl. Опухоль измеряли и изучали полную регрессию опухоли у мышей, обработанных NRC-2694 в дозе 10 мг/кг. Однако опухоли все еще присутствовали в контрольной группе, обработанной аналогично эрлотинибом HCl, даже при уровне дозы 100 мг/кг. Таким образом, было установлено десятикратное превосходство в эффективности соединения данного изобретения (NRC-2694).v) Оценка тканей легкого, взятых у бестимусных мышей после лечения (фиг. 4). Легкие, взятые у бестимусных мышей, имплантированных экспрессирующими люциферазу А 549 клетками, обработанных разными концентрациями эрлотиниба HCl и NRC-2694 путем перорального/интраперитонеального введения, изучали на остаточные опухоли. Полную регрессию опухолей наблюдали в группе, обработанной NRC-2694, в то время как в группе, обработанной эрлотинибом HCl, опухоли все еще присутствовали, что подтверждало неожиданную превосходную эффективность соединений данного изобретения.vi) Визуальное исследование опухолей в легочных тканях (фиг. 5). Бестимусных мышей имплантировали А 549 клетками с помощью внутрилегочных инъекций. Мышей обрабатывали путем перорального/интраперитонеального введения эрлотиниба HCl и NRC-2694 в дозах 2,5 и 20 мг/кг. Через тридцать дней ежедневной обработки лекарственными препаратами мышей умерщвляли и извлекали легкие. Легочные ткани фиксировали в 10% забуференном формальдегиде, заливали в парафин и изготавливали срезы. Срезы окрашивали НЕ согласно установленным протоколам для визуализации твердых или диффузных опухолей. Группа, обработанная NRC-2694, питалась гораздо лучше, чем группа, обработанная эрлотинибомHCl, при всех уровнях доз, что подтверждало превосходную эффективность NRC-2694.vii) Бестимусные мыши, имплантированные экспрессирующими люциферазу А 549 клетками (фиг. 6 и 7). Бестимусных мышей, имплантированных экспрессирующими люциферазу А 549 клетками, обработанных разными концентрациями эрлотиниба HCl и NRC-2694 перорально или интраперитонеально, исследовали на опухоли, и наглядные изображения представлены в виде фиг. 6 и 7. Наблюдалось, что группа, обработанная NRC-2694, питалась лучше, чем группа, обработанная эрлотинибом HCl. Опухолей не наблюдали в конце 42 дня лечения NRC-2694, в то время как остаточные опухоли все еще присутствовали в группе, обработанной эрлотинибом HCl как пероральным, так и интраперитонеальным способами введения.vii) Лечебный эффект на основании in vivo исследований у бестимусных мышей. Лечебный эффект как отношение количества излеченных животных к количеству животных, участвовавших в исследовании, табулирован и представлен в табл. 3. Таблица 3 Лечебный эффект NRC-2694 и эрлотиниба HCl на рак легкого Можно видеть, что соотношение близко к 100% в случае NRC-2694, в то время как соотношение находится между 40-68% в случае исследования группы с эрлотинибом HCl.ix) Оценка ED50. Величину ED50 оценивали на основе исследования среза легкого и регрессии опухоли. Величина 6,3 мг/кг была рассчитана для NRC-2694, в то время как величина, полученная для эрлотиниба HCl, составила 22 мг/кг при пероральном способе введения. Таким образом, была подтверждена превосходная эффективность соединения настоящего изобретения. х) Исследование in vitro с другими рецепторами, такими как HER-1, HER-2, HER-3, HER-4 иVEGFR (фиг. 8). Для определения воздействия NRC-2694 на другие разные рецепторы EGFR семейства (Erb/HER),раковые клетки А 549 легкого человека обрабатывали разными концентрациями NRC-2694 параллельно с эрлотинибом HCl для проведения одновременного сравнения. Уровни Erb-1, Erb-2, Erb-3, Erb-4 и VEGFR определяли вестерн-блот анализами. Наблюдали, что NRC-2694 эффективно регулировал в сторону уменьшения уровни Erb B2, Erb B3,Erb B4 и VEGFR, в то время как таких показателей не наблюдали с эрлотинибом HCl. Дополнительный показатель ингибирования уровней экспрессии вышеупомянутых рецепторов является четким доказательством неожиданного и удивительного свойства главной молекулы данного изобретения, а именноxi) Заключение. Неожиданные, удивительные и великолепные противораковые свойства и дополнительные терапевтические возможности соединения настоящего изобретения являются, таким образом, доказанными в приведенных выше экспериментах по сравнению с эрлотинибом HCl. Пример 8. Далее представлена иллюстративная фармацевтическая лекарственная форма, содержащая соединение формулы NRC-2694 или ее фармацевтически приемлемую соль, для терапевтического или профилактического применения у человека. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение хиназолинового производного формулы или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака легких, рака молочной железы. 2. Применение по п.1, отличающееся тем, что 3. Применение по п.2, отличающееся тем, что фармацевтически приемлемая соль представляет собой моногидрохлорид (NRC-2694A). 4. Применение по п.2, отличающееся тем, что фармацевтически приемлемая соль представляет собой дигидрохлорид (NRC-2694 В). Фиг. 1 Вестерн-блот анализ А 549 клеток, обработанных эрлотинибом HCl и NRC-2694. Наблюдали дозозависимое уменьшение уровней EGFR Фиг. 2 Анализ на инвазию Н 1299 клеток в матригеле, обработанных эрлотинибом и NRC-2694. Наблюдали дозозависимое уменьшение инвазии Фиг. 3 Уменьшение размера опухоли, вызванное оральным и внутривенным введением эрлотиниба HCl иNRC-2695 у бестимусных мышей, имплантированных А 549 клетками опухоли легкого человека Фиг. 4 Легкие, взятые у бестимусных мышей с экспрессирующими люциферазу клетками А 549, обработанные разными концентрациями эрлотиниба HCl и NRC-2694 оральным или внутривенным введением Фиг. 5 Образцы окрашенных НЕ срезов опухоли бестимусных мышей, содержащие легкие, после обработки эрлотинибом HCl и NRC-2694 Фиг. 6 Бестимусные мыши, имплантированные экспрессирующими люциферазу клетками А 549, обработанными разными концентрациями эрлотиниба HCl оральным и внутривенным введением Фиг. 7 Бестимусные мыши, имплантированные экспрессирующими люциферазу клетками А 549, обработанные разными концентрациями NRC-2694 орально и внутривенно Фиг. 8 Изучение эффекта NRC NCEs относительно других рецепторов, таких как HER-1,2,3,4 и VEGFR in vitro. Наблюдали уменьшение уровней Erb1, Erb2, Erb3 и Erb4 после обработки NRC-2694 в клетках А 549
МПК / Метки
МПК: A61K 31/517, C07D 239/94, A61P 35/00
Метки: эффективные, лечения, нарушений, 6,7-диалкокси, раком, связанных, производные, хиназолиновые
Код ссылки
<a href="https://eas.patents.su/12-18514-67-dialkoksi-hinazolinovye-proizvodnye-effektivnye-dlya-lecheniya-narushenijj-svyazannyh-s-rakom.html" rel="bookmark" title="База патентов Евразийского Союза">6,7-диалкокси хиназолиновые производные, эффективные для лечения нарушений, связанных с раком</a>
Предыдущий патент: Способ получения 1,2-пропандиола
Следующий патент: Устройство для утилизации дымовых газов
Случайный патент: Конъюгаты синтетических агонистов tlr и их применение












