Способ получения фармацевтических промежуточных соединений
Номер патента: 16762
Опубликовано: 30.07.2012
Авторы: Баркоци Йосеф, Мольнар Эникё, Суладьи Янош, Вайон Мария, Мезеи Тибор, Порч-Маккаи Марта, Вольк Балаж, Лукач Дьюла
Формула / Реферат
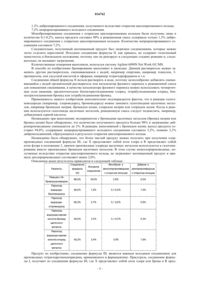
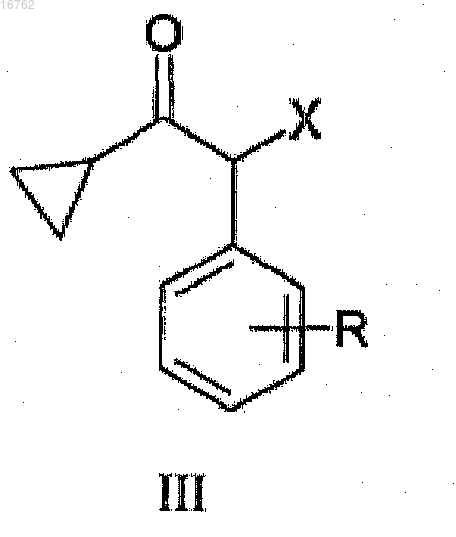
1. Способ получения соединений общей формулы III

где R представляет собой атом фтора или хлора и X представляет собой атом хлора или брома,
путем галогенирования циклопропилбензилкетона общей формулы II
где R представляет собой атом фтора или хлора,
характеризующийся тем, что:
а) галогенирование выполняют в смеси водного раствора галогеноводорода и водного раствора пероксида водорода в присутствии растворителя, смешивающегося с водой, или в присутствии катализатора фазового переноса, или
б) галогенирование выполняют в смеси соли щелочного металла с водным раствором галогеноводорода, водного раствора пероксида водорода и серной кислоты.
2. Способ по п.1, где реакцию проводят в присутствии 1-5 моль эквивалентов водного раствора галогеноводорода и 1-10 моль эквивалентов водного раствора пероксида водорода, рассчитанных по отношению к соединению формулы II.
3. Способ по п.1, где реакцию проводят предпочтительно в присутствии 2-4 моль эквивалентов водного раствора галогеноводорода и 4-6 моль эквивалентов водного раствора пероксида водорода, рассчитанных по отношению к соединению формулы II.
4. Способ по п.1, где в реакции используют водный раствор бромоводорода или раствор бромоводорода в уксусной кислоте или газообразный бромоводород.
5. Способ по п.4, где в реакции используют 48 мас.% водного раствора бромоводорода.
6. Способ по п.1, где в реакции используют водный раствор пероксида водорода.
7. Способ по п.6, где в реакции используют 25-40 мас.% водного раствора пероксида водорода.
8. Способ по п.1, где растворителем, смешивающимся с водой, является диоксан, уксусная кислота, тетрагидрофуран или С1-4 спирт, обладающий разветвленной или неразветвленной цепью.
9. Способ по п.8, где С1-4 спирт, обладающий разветвленной или неразветвленной цепью, представляет собой метиловый спирт, этиловый спирт или изопропиловый спирт.
10. Способ по п.1, где катализатором фазового переноса является четвертичная соль аммония.
11. Способ по п.10, где четвертичная соль аммония представляет собой бензилтриэтиламмония хлорид, тетрабутиламмония хлорид, бензилтриэтиламмония бромид или тетрабутиламмония бромид.
12. Способ по п.1, где солью щелочного металла является бромид натрия, хлорид натрия, бромид калия или хлорид калия.
13. Способ по п.1, где в реакции используют 1-5 моль эквивалентов соли щелочного металла и 2-10 моль эквивалентов водного раствора пероксида водорода.
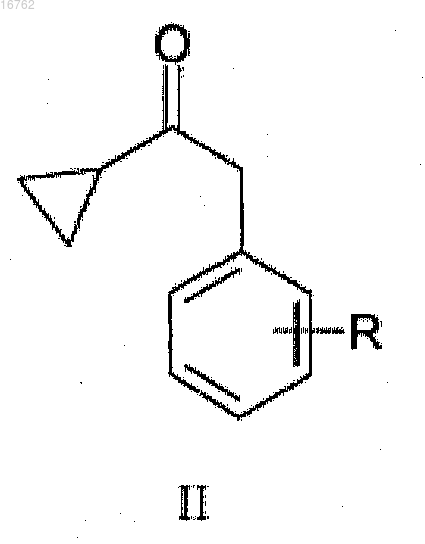
14. Способ получения соединения формулы I
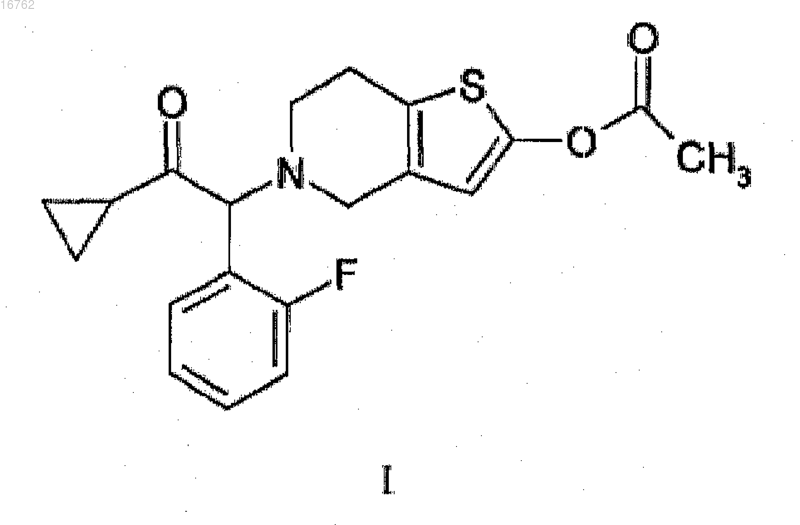
из соединения формулы III
где R представляет собой атом фтора в положении 2, X представляет собой атом хлора или брома,
характеризующийся тем, что соединение циклопропилбензилкетона формулы II
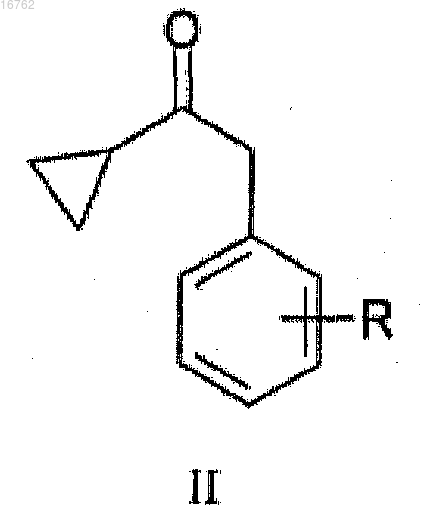
где R представляет собой атом фтора в положении 2,
галогенируют в смеси раствора водного раствора галогеноводорода и водного раствора пероксида водорода в присутствии растворителя, смешивающегося с водой, или в присутствии катализатора фазового переноса; либо галогенирование выполняют в смеси соли щелочного металла с водным раствором галогеноводорода, водного раствора пероксида водорода и серной кислоты, и полученное соединение формулы III
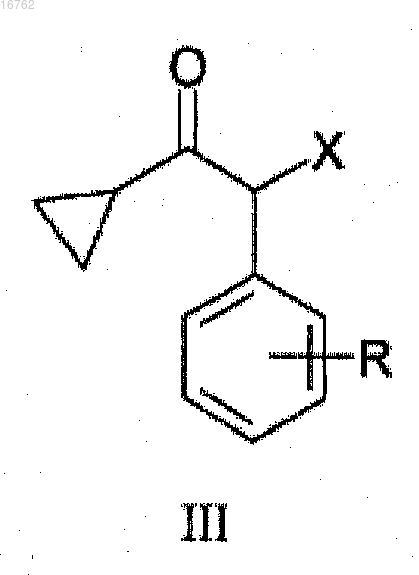
где R представляет собой атом фтора в положении 2 и X представляет собой атом хлора или брома,
превращают в соединение формулы I

или его соль присоединения кислоты.
Текст
СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ Изобретатель: Изобретение относится к способу получения соединений общей формулы III где R представляет собой атом фтора или хлора и X представляет собой атом хлора или брома,путем галогенирования циклопропилбензилкетона общей формулы II где R представляет собой атом хлора или брома, и галогенирование выполняют в смеси водного раствора галогенводорода и водного раствора пероксида водорода в присутствии растворителя, смешивающегося с водой, либо в присутствии катализатора фазового переноса; либо галогенирование выполняют в смеси соли щелочного металла с водным раствором галогеноводорода, водного раствора пероксида водорода и серной кислоты. Способ можно осуществлять предпочтительно в промышленном масштабе. Соединение формулы III, где R представляет собой атом фтора в положении 2 и X, как описано выше, является промежуточным соединением в производстве прасугреля, являющегося ингибитором тромбоцитов, применяемым в терапии.(71)(73) Заявитель и патентовладелец: ЭГИШ ДЬДЬСЕРДЬЯР НЬИЛЬВАНОШАН МЮКД РЕСВЕНЬТАРШАШАГ (HU)II, где галогенирование выполняют в смеси водного раствора галогеноводорода и водного раствора пероксида водорода, в присутствии растворителя, смешивающегося с водой, либо в присутствии катализатора фазового переноса, либо галогенирование выполняют в смеси соли щелочного металла с водным раствором галогеноводорода, водного раствора пероксида водорода и серной кислоты. Способ следует применять предпочтительно в промышленном масштабе. Предшествующий уровень техники 2-Галоген-1-циклопропил-2-замещенные фенилэтаноновые соединения общей формулы III являются важными исходными веществами производных тетрагидротиенопиридина, которые используются в фармацевтической терапии. Одними из наиболее важных представителей производных тетрагидротиенопиридина являются соединения формулы I, а именно 5-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]4,5,6,7-тетрагидротиено[3,2-с]пиридин-2-ил ацетат, имеющий международное непатентованное название прасугрель, используется для предотвращения и лечения тромбоза и тромоэмболии. Ингибитор тромбоцитов прасугрель, его производные и способ его производства описан впервые в патенте Венгрии 218785 и патенте Венгрии 211876 и их эквивалентах. Цель настоящего изобретения относится к способу получения 2-галоген-1-циклопропил-2-замещенных фенилэтанонов формулыIII, являющихся наиболее важными структурными представителями вышеупомянутых соединений. Способ по настоящему изобретению применим в промышленном масштабе и позволяет получать соединения общей формулы III с высокой степенью чистоты. В процессе получения прасугреля, а также других эффективных соединений - ингибиторов тромбоцитов, обладающих схожей химической структурой, ключевыми промежуточными соединениями являются 2-галоген-1-циклопропил-2-замещенные соединения фенилэтанона общей формулы III, которые могут содержать различные заместители в ароматическом кольце. Наиболее важным представителем этих соединений являются вещества формулы IV, замещенные фтором в положении 2. Из литературы известно только несколько способов получения соединений общей формулы III, они лишь частично применимы в промышленном масштабе. Согласно способу получения, описанному в патентах Венгрии 218785 и 211876, соединения циклопропила общей формулы III получают бромированием циклопропилбензилкетоновых соединений формулы II в четыреххлористом углероде, в присутствии примерно эквимолярного количества Nбромсукцинимида, дибензоилпероксида при кипячении в течение 8 ч. Выход соединения общей формулы III составляет 83%, где R представляет собой атом в положении 2 и X является атомом брома. В заявке на патент США 2003/134872 описан способ получения соединения формулы IV при таких же условиях, причем соединение формулы IV очищают колоночной хроматографией, выход реакции составляет 68%. Недостатками указанных выше способов является то, что N-бромсукцинимид частично разлагается во время бромирования, что приводит к образованию элементарного брома. Бром является чрезвычайно коррозионным, поэтому использование брома требует специальных условий и особых материалов. Даже небольшое загрязнение железа может увеличить количество образующихся побочных продуктов во время галогенирования. Согласно способу получения, описанному в патенте US5874581, путем активирования соединения формулы II, где R представляет собой атом фтора в положении 2, получают соединение формулы III,где X замещен атомом хлора. Реакцию проводят в дихлорметане, при температуре 5 С, с газообразным хлорсульфурилом или хлором. После получения чистота полученного неочищенного продукта составляла 80% согласно данным ГХ, далее его использовали для получения прасугреля без дополнительной очистки. Недостаток способа заключается в очень быстрой реакции хлорсульфурила с водой, образующийся во время реакции газообразный хлор является токсичным и взрывоопасным. Все действия с хлорсульфурилом и хлором следует выполнять только в специальных аппаратах с соблюдением всех строгих требований безопасности. Общим недостатком упомянутых выше способов является необходимость выполнения галогенирования в хлорированных углеводородах (четыреххлористом углероде или дихлорметане). Эти растворители, особенно четыреххлористый углерод, являются очень токсичными и их применение в промышленных масштабах крайне редко. Другой недостаток способов заключается в очистке неочищенного продукта путем колоночной хроматографии. Такой способ очистки не подходит для получения большого количества конечного продукта в промышленном масштабе. Для очистки требуется большое количество реагентов, поэтому способ становится более дорогостоящим и неприемлемым с точки зрения воздействия на окружающую среду. Цель настоящего изобретения заключается в преодолении недостатков указанных выше способов и разработке экономичного, простого способа получения с хорошим выходом, который можно использовать в промышленном масштабе. Дополнительной целью настоящего изобретения является разработка способа очистки, в котором не требуется использование хлорированных растворителей и других реаген-1 016762 тов, загрязняющих окружающую среду, а также разработка способа, не требующего очистки колоночной хроматографией. Указанные выше цели были достигнуты способом получения по настоящему изобретению. Краткое описание изобретения Целью настоящего изобретения является способ получения соединений общей формулы III где R представляет собой атом фтора или хлора, X представляет собой атом хлора или брома,из соединений циклопропилбензилкетона общей формулы II где R представляет собой атом фтора или хлора,путем галогенирования. Галогенирование выполняют в смеси водного раствора галогеноводорода и водного раствора пероксида в присутствии растворителя, смешивающегося с водой, или в присутствии катализатора фазового переноса, либо в смеси соли щелочного металла с водным раствором галогеноводорода, водного раствора пероксида водорода и серной кислоты. Галогенирование по настоящему изобретению выполняют в смеси водного раствора галогеноводорода и водного раствора пероксида водорода в присутствии 1-5 моль эквивалентов, предпочтительно 2-4 моль эквивалентов, водного раствора галогеноводорода и 1-10 моль эквивалентов, предпочтительно 4-6 моль эквивалентов, водного раствора пероксида водорода. В реакции используется водный раствор бромоводорода или раствор бромоводорода в уксусной кислоте либо газообразный бромоводород, предпочтительно 48 мас.% водного раствора бромоводорода и водного раствора пероксида водорода, предпочтительно 25-40 мас.% водного раствора пероксида водорода. Растворителем, смешивающимся с водой, используемым при галогенировании, которое выполняют в смеси с водным раствором галогеноводорода и водным раствором пероксида водорода, является предпочтительно диоксан, уксусная кислота,тетрагидрофуран или С 1-4 спирт, имеющие неразветвленную или разветвленную цепь, предпочтительно метиловый спирт, этиловый спирт или изопропиловый спирт. Когда способ получения по настоящему изобретению выполняют без добавления растворителя, используемым катализатором фазового переноса является четвертичная соль аммония, предпочтительно бензилтриэтиламмония хлорид, тетрабутиламмония хлорид, бензилтриэтиламмония бромид или тетрабутиламмония бромид. Реакцию по настоящему изобретению, где галогенирование соединения общей формулы III выполняют в смеси соли щелочного металла с водным раствором галогеноводорода, водного раствора пероксида водорода и серной кислоты, предпочтительно солью щелочного металла является бромид натрия,хлорид натрия, бромид калия или хлорид калия. В способе предпочтительно использовать 1-5 моль эквивалентов соли щелочного металла и 2-10 моль эквивалентов водного раствора пероксида водорода. Галогенирование по настоящему изобретению выполняют при температуре от 20 до 100 С. При комнатной температуре реакция завершается в течение нескольких дней и чистота получаемого неочищенного продукта составляет примерно 90%, поэтому его можно использовать далее без дополнительной очистки. При температуре от 70 до 100 С реакция полностью завершается в течение нескольких часов,однако в этом случае неочищенный продукт требует дополнительной очистки, которую можно легко выполнить перегонкой.-2 016762 Другим воплощением настоящего изобретения является способ получения соединений формулы I из соединения формулы III где R представляет собой атом фтора в положении 2 и X представляет собой атом хлора или брома,где соединение циклопропилбензилкетона формулы II где R представляет собой атом фтора в положении 2,подвергают галогенированию в смеси водного раствора галогеноводорода и водного раствора пероксида водорода в присутствии растворителя, смешивающегося с водой, или в присутствии катализатора фазового переноса; либо галогенирование выполняют в смеси серной кислоты и соли щелочного металла с водным раствором галогеноводорода, далее соединение формулы III где R представляет собой атом фтора в положении 2 и X представляет собой атом хлора или брома,переводят в соединение формулы I или его соль присоединения кислоты согласно известным способам. Подробное описание изобретения Сущность настоящего изобретения заключается в выполнении галогенирования без использования молекул элементарного галогена, таких как хлор или бром, или без использования наиболее часто используемых агентов галогенирования, известных из литературы и получаемых из галогенов, например Nбромсукцинимида, бромдиоксана, хлорсульфурила и др. Особым преимуществом настоящего изобретения является отказ от использования вредных для окружающей среды агентов галогенирования, и, в то же время, отсутствие необходимости использования какой-либо специальной аппаратуры в реакции, способ можно выполнять в обычно используемой аппаратуре. Растворителем, используемым в реакции, является вода и растворители, смешивающиеся с водой, представляют собой, например, уксусную кислоту, диоксан, тетрагидрофуран, или спирты с короткой углеродной цепью. Данные растворители, смешивающиеся с водой, или катализаторы фазового переноса обеспечивают растворение большинства соединений формулы III в реакционной смеси.-3 016762 Сравнительные эксперименты. Получение соединения формулы IV из циклопропил-2-фторбензилкетона. Несколько реакций галогенирования, известных из литературы, выполняли для подтверждения преимуществ патентуемого способа. Одна из этих реакций представляет собой галогенирование бромидом, где исходным соединением способа является соединение формулы II, где R представляет собой атом фтора в положении 2. Несколько реакций выполняли при различных условиях, сравнивали выход реакции и примеси. 1. Получение соединения формулы IV с бромом. Осуществляли реакцию соединения формулы II с эквимолярным количеством брома в дихлорметане, при комнатной температуре в течение 12 ч до момента исчезновения брома. Согласно данным ГХ/МС реакционная смесь содержала: 15% соединения формулы IV; 35% монобромированного соединения, получаемого вследствие открытия циклопропанового кольца; 17% дибромированного соединения, получаемого вследствие раскрытия циклопропанового кольца; 19% непрореагировавшего исходного соединения. После добавления пиридина к реакционной смеси полученное количество соединения формулы IV увеличилось до 30%, однако соотношение веществ в смеси было таким же, как в смеси, описанной выше. Такую же реакцию проводили в уксусной кислоте. Согласно данным ГХ/МС реакционная смесь содержала только 3,5% соединения формулы IV. Состав смеси был следующим: 3,5% соединения формулы IV; 15% монобромированного соединения, получаемого вследствие открытия циклопропанового кольца; 47% дибромированного соединения, получаемого вследствие открытия циклопропанового кольца; 31% непрореагировавшего исходного соединения. Результаты вышеописанных экспериментов показывают, что соединение формулы IV невозможно получить с хорошим выходом, используя бром. 2. Получение соединения формулы IV с N-бромсукцинимидом. Повторили способ, описанный в заявке на патент США 2003/134872, где бромирование выполняли с N-бромсукцинимидом в четыреххлористом углероде, неочищенный продукт исследовали способом ГХ/МС. Согласно данным ГХ/МС реакционная смесь содержала: 68,5% соединения формулы IV; 5,8% монобромированного соединения, получаемого вследствие открытия циклопропанового кольца; 5,5% дибромированного соединения, получаемого вследствие открытия циклопропанового кольца; 16,0% непрореагировавшего исходного соединения. Фиг. 1 демонстрирует хроматограмму ГС, из которой видно существенное количество примесей в неочищенном продукте. Такую же реакцию провели в дихлорметане вместо четыреххлористого углерода, реакционную смесь кипятили с обратным холодильником в течение 10 ч. Количество полученных примесей было таким же. Эффективная очистка соединения IV практически невозможна. Перегонка представляет собой способ, подходящий для разделения веществ, обладающих существенно разными точками кипения. Среди продуктов, полученных в результате указанных выше реакций, соединение формулы IV можно хорошо отделить от исходного вещества и от дибромсоединения, поскольку их молекулярные массы существенно различаются. Монобромированные примеси, образовавшиеся вследствие открытия циклопропанового кольца, с общим содержанием 5,8% невозможно отделить от соединения формулы IV, поскольку их молекулярные массы идентичны и точки плавления практически совпадают с таковой конечного продукта. Более того, данные монобромизомеры взаимодействуют подобно соединению IV в последующих стадиях химической реакции, поэтому некоторые побочные продукты образуются на следующей стадии реакции. Очищение реакционной смеси колоночной хроматографией не является успешным, поскольку различные примеси продукта являются изомерами, обладающими очень схожими химическими структурами, а также вследствие того, что их хроматографические характеристики очень близки друг к другу. 3. Получение соединения формулы IV согласно настоящему изобретению. Неожиданно было обнаружено, что с помощью способа получения по настоящему изобретению можно получить соединение формулы IV с высокой степенью чистоты по сравнению со способами, описанными выше (хроматограмма ГХ на фиг. 2). Бромирование выполняли смесью пероксида водорода-бромида водорода в диоксане при комнатной температуре в течение нескольких дней. Согласно данным ГХ/МС реакционная смесь содержала: 90,0% соединения формулы IV; 0,1-0,2% монобромированного соединения, получаемого вследствие открытия циклопропанового кольца;-4 016762 1,3% дибромированного соединения, получаемого вследствие открытия циклопропанового кольца; 7,2% непрореагировавшего исходного соединения. Монобромированные соединения с открытым циклопропановым кольцом были получены лишь в количестве 0,1-0,2%, выход продукта составил 90% и реакционная смесь содержала только 1,3% дибромированного соединения с открытым циклопропановым кольцом. Количество непрореагировавшего соединения составило 7,2%. Следовательно, полученный неочищенный продукт был загрязнен соединениями, которые можно легко отделить перегонкой. Исходное соединение формулы II, как примесь, не содержит галогеновый заместитель в бензильном положении, поэтому оно не реагирует в следующих стадиях реакции и, следовательно, не вызывает загрязнения. Количественные измерения выполняли, используя систему Agilent 6890N Net Work GC/MS. В способе по изобретению бромирование выполняют в диоксане. Данный растворитель можно заменить другим растворителем, смешивающимся с водой, например спиртами, например этанолом, 2 пропанолом, или уксусной кислотой и эфирами, например тетрагидрофураном и т.п. Соединения общей формулы II нельзя растворить в воде, поэтому целесообразно добавлять смешивающийся с водой органический растворитель или катализатор фазового переноса к реакционной смеси для повышения смешивания, в качестве катализатора фазового переноса можно использовать четвертичные соли аммония, предпочтительно бензилтриэтиламмония хлорид, тетрабутиламмония хлорид, бензилтриэтиламмония бромид или тетрабутиламмония бромид. Применимость нашего изобретения дополнительно подтверждается фактом, что в реакции галогеноводороды (например, хлороводород, бромоводород) можно заменить галогенидами щелочных металлов, например бромидом натрия, бромидом калия, хлоридом натрия или хлоридом калия. Когда в реакции используются галогениды щелочных металлов, реакционную смесь следует подкислить, например,добавлением серной кислоты. Неожиданно при выполнении экспериментов с бромидами щелочных металлов (бромид натрия или бромид калия) было обнаружено, что количество получаемого продукта больше 90% и загрязнение дибромпроизводными уменьшается до 2%. В реакции, выполняемой с бромидом калия, выход продукта составил 94,0%, содержание непрореагировавшего исходного соединения составило 3,2%, помимо 2,3% дибромсоединений, образующихся в результате открытия циклопропанового кольца. Неожиданно было обнаружено, что более чистый продукт можно получить при получении хлорпроизводных соединений формулы III, где X представляет собой атом хлора и R представляет собой атом фтора в положении 2, причем производные хлориды щелочных металлов используются в галогенировании вместо производных бромидов щелочных металлов. В этом случае монохлорпроизводные, получаемые вследствие открытия циклопропанового кольца, не загрязняют неочищенный продукт и примеси дихлорпроизводных составляют менее 2,0%. Описанные выше результаты приводятся в следующей таблице. Продукт по изобретению, соединение формулы III, является важным исходным соединением для производных тетрагидротиенопиридина, применяемого в фармацевтике. Прасугрель, соединение формулы I, получают из соединения формулы III, где X представляет собой атом хлора или брома и R пред-5 016762 ставляет собой атом фтора в положении 2, путем бромирования соединения формулы II согласно одному из способов по настоящему изобретению и последующей реакцией полученного бромированного соединения с 4,5,6,7-тетрагидротиено[2,3-с]пиридином формулы V согласно способу получения, описанному в патенте ВенгрииHU 211876. В положении 2 тиофенового кольца оксогруппу получают способами,известными из уровня техники, и прасугрель формулы I окончательно получают о-ацетилированием в основных условиях, и, если необходимо, переводят в соль присоединения кислоты. Примеры Изобретение далее объясняется примерами, приведенными ниже, без ограничения объема настоящего изобретения. Пример 1. 2-Бром-циклопропил-2-(2-фторфенил)этанон [соединение формулы IV]. В 1000 мл круглодонную колбу добавили раствор циклопропил-2-фторбензилкетона (44,6 г,0,25 моль), диоксан (500 мл), водный раствор пероксида водорода (30 мас.%, 125 мл, 1,22 моль) и водный раствор бромоводорода (48 мас.%, 71,3 мл, 0,63 моль). Реакционную смесь нагрели до 50 С и перемешали в течение 2 ч при температуре 80-85 С. К бесцветному раствору добавили сульфат натрия (20 г) при 25 С и перемешали до полного растворения, экстрагировали, органический слой промыли водным раствором гидрокарбоната натрия (5 мас.%, 150 мл), разделили и органический слой сушили над сульфатом магния, далее упарили. Полученный продукт: 59,2 г светло-желтого масла. Выход: 82,9%. Содержание (измеренное ГХ): 87,1%. Согласно результатам исследования ГХ содержит 7,5% исходного соединения, 2,5% монобромированного производного и 1,3% дибромированного производного. Продукт очищен вакуумной перегонкой. Точка кипения: 90 С/39,9966 Па. Продукт, полученный после перегонки: 49,1 г бесцветного масла. Содержание полученного заявленного продукта (измеренное ГХ) после перегонки: 97,5%. ИК (пленка): 3405, 3011, 1113, 1614,1587, 1491, 1458, 1380, 1235, 1196, 1068, 1023. 1 Н-ЯМР (CDCl3, 500 МГц): 7,49 (t, 1H), 7,33 (m, 1H), 7,18 (t, 1H), 7,08 (t, 1H), 5,96 (s, 1 Н), 2,14 (т,1 Н), 1,17 (т, 1 Н), 1,11 (т, 1 Н), 1,02 (т, 1 Н), 0,94 (т, 1 Н). 13 С-ЯМР (CDCl3, 125 МГц): 200,5, 159,7 (d, J=249,0 Гц), 731,1 (d, J=2,4 Гц), 130,8 (d, J=8,3 Гц), 124,7(d, J=3,9 Гц), 123,4 (d, J=13,2 Гц), 115,6 (d, J=22,0 Гц), 48,3 (d, J=2,9 Гц), 18,7, 12,7, 12,6. Пример 2. 2-Бром-1-циклопропил-2-(4-хлорфенил)этанон [соединение формулы III R=4-Cl]. В 250 мл круглодонную колбу добавили раствор циклопропил-4-хлорбензилкетона (9,74 г,50 ммоль), диоксан (100 мл), водный раствор пероксида водорода (30 мас.%, 0,23 моль) и водный раствор бромоводорода (48 мас.%, 14,7 мл, 0,13 моль). Реакционную смесь перемешивали в течение 2 ч при температуре 60-65 С. К бесцветному раствору добавили раствор сульфата натрия (20 г) при 25 С и перемешивали до полного растворения, экстрагировали и верхний органический слой сушили над сульфатом магния, затем упаривали. Полученный продукт: 15,6 г светло-желтого масла. Выход: 87,2%. Содержание (измеренное ГХ): 87,5%. Согласно результатам исследования ГХ/МС содержит 3,7% исходного соединения, 0,5% дибромированных примесей. Продукт очищен вакуумной перегонкой. Точка кипения: 116 С/40 Па (0,3 мм рт.ст.). Продукт, полученный после перегонки: 11,0 г масла, кристаллизующегося при стоянии. Кристаллизуется из н-гексана. Точка плавления: 38-40 С белые кристаллы, согласно данным ГХ 99,5%. ИК (KBr): 2978, 1699, 1492, 1415, 1381, 1074, 1016. 1 Н-ЯМР (CDCl3, 200 МГц): 7,40 (d, 2 Н), 7,35 (d, 2H), 5,56 (s, 1H), 2,15 (m, 1 Н), 1,12 (m, 2H), 1,00 (m,2H). 13 С-ЯМР (CDCl3, 50 МГц): 201,3, 135,1, 134,0, 130,3, 129,1, 54,9, 18,7, 13,0, 12,9. Пример 3. 2-Бром-1-циклопропил-2-(2-фторфенил)этанон [соединение формулы IV]. В 250 мл круглодонную колбу добавили раствор циклопропил-2-фторбензилкетона (8,91 г,50 ммоль), уксусную кислоту (50 мл), водный раствор пероксида водорода (30 мас.%, 15 мл 0,14 моль) и раствор бромоводорода в уксусной кислоте (33 мас.%, 14,7 мл, 0,13 моль). Реакционную смесь перемешали в течение 1 ч при температуре 95 С. Бесцветный раствор разбавили водой (150 г), экстрагировали толуолом (100 мл), органический слой отделили, просушили и упарили в вакууме. Полученный продукт: 11,4 г светло-желтого масла. Выход: 75,4%. Содержание (измеренное ГХ): 85,0%, загрязнен 5,2% исходного соединения, 7,5% дибромированного производного. Продукт очищен вакуумной перегонкой.-6 016762 Точка кипения: 95 С/53,3 Па (0,4 мм рт.ст.) Продукт, полученный после перегонки: 8,3 г бесцветного масла. Содержание заявленного продукта (измерено ГХ) после перегонки: 98,5%. Пример 4. 2-Бром-1-циклопропил-2-(2-фторфенил)этанон [соединение формулы IV]. В 250 мл круглодонную колбу добавили раствор циклопропил-2-фторбензилкетона (8,91 г,50 ммоль), этанол (50 мл), водный раствор пероксида водорода (30 мас.%, 30 мл, 0,29 моль) и водный раствор бромоводорода (48 мас.%, 22,6 мл, 0,20 моль). Реакционную смесь кипятили в течение получаса и бесцветный раствор упарили. К остатку добавили воду (50 мл) и этилацетат (50 мл) при 25 С, фазы разделили, органическую фазу сушили и упарили. Полученный продукт: 9,4 г светло-желтого масла. Выход: 73,8%. Содержание (измеренное ГХ): 83,4% заявленного продукта, загрязнен 15,2% исходного соединения 0,5% дибромированного производного. Пример 5. 2-Бром-1-циклопропил-2-(2-фторфенил)этанон [соединение формулы IV]. В 250 мл круглодонную колбу добавили раствор циклопропил-2-фторбензилкетона (8,91 г,50 ммоль), N-бензилтриэтиламмонийбромид (2,0 г), водный раствор пероксида водорода (30 мас.%,40 мл, 0,39 моль) и водный раствор бромоводорода (48 мас.%, 28,3 мл, 0,25 моль). Реакционную смесь интенсивно перемешали в течение 2 ч при 85 С, продукт экстрагировали дважды этилацетатом (250 мл) и объединенные фазы этилацетата сушили и упарили. Полученный продукт: 10,2 г светло-желтого масла. Выход: 67,1%. Содержание (измеренное ГХ): 83,4% заявленного продукта, который загрязнен 7,1% исходного соединения 7,5% дибромированного производного. Пример 6. 2-Бром-1-циклопропил-2-(2-фторфенил)этанон [соединение формулы IV]. Получение выполняли согласно примеру 1, отличие заключается в том, что водный раствор бромоводорода (48 мас.%, 71,3 мл, 0,63 моль) добавили по каплям к исходной смеси при 25 С при охлаждении и интенсивном перемешивании. Полученную смесь перемешали в течение 5 дней при комнатной температуре, и продукт получили по примеру 1. Полученный продукт: 59,2 г светло-желтого масла. Выход: 82,9%. Содержание (измеренное ГХ): 90,0%. Согласно данным ГХ, неочищенный продукт содержит 7,2% исходного соединения и только 1,3% дибромированного производного, что меньше полученного дибромированного производного в примере 1. Продукт, при необходимости, может быть очищен перегонкой. Точка кипения: 90 С/40 Па (0,3 мм рт.ст.). Полученный продукт после перегонки: 49,1 г бесцветного масла. Содержание (ГХ) после перегонки: 97,5%. Пример 7. 2-Хлор-1-циклопропил-2-(2-фторфенил)этанон [соединение формулы III X=Cl, R=2-F)]. Получение выполняли согласно примеру 1, отличие заключается в том, что вместо бромоводорода к реакционной смеси добавили водный концентрированный раствор соляной кислоты (105 мл,1,24 моль). Данный раствор по каплям добавили к исходной реакционной смеси при 25 С при охлаждении и интенсивном перемешивании. Полученную смесь перемешали в течение 3 дней при комнатной температуре и продукт получили по примеру 1. Полученный продукт: 51,0 г бесцветного масла. Выход: 82,9%. Содержание (измеренное ГХ): 94,5%. Согласно данным ГХ/МС, неочищенный продукт содержал 3,5% исходного вещества и 1,4% дихлорпроизводного, поэтому дальнейшая очистка не требовалась. Пример 8. 2-Хлор-1-циклопропил-2-(2-фторфенил)этанон [вещество формулы III X=Cl, R=2-F)]. В 250 мл круглодонную колбу добавили раствор циклопропил-2-фторбензилкетона (9,74 г,50 ммоль), диоксан (100 мл), водный раствор пероксида водорода (30 мас.%, 0,23 моль) и концентрированный водный раствор соляной кислоты (11 мл, 0,13 моль). Реакционную смесь перемешивали в течение 2 ч при температуре 80 С, далее ее охладили и к бесцветному раствору добавили раствор сульфата натрия (20 г) и этилацетат (50 мл) к реакционной смеси. Верхний органический слой экстрагировали водным раствором гидрокарбоната натрия и сушили над сульфатом магния, затем упаривали. Полученный продукт: 10,3 г светло-желтого масла. Выход: 86,1%. Содержание (измеренное ГХ): 95,3%. Согласно результатам ГХ, продукт содержит 3,7% исходного соединения и 0,5% дибромированного производного. Неочищенный продукт, при необходимости, можно-7 016762 очистить вакуумной перегонкой. Точка кипения: 58 С/26,6 Па (0,2 мм рт.ст.). Полученный продукт после перегонки: 8,2 г бесцветного масла. Содержание (измеренное ГХ) после дистилляции: 98,5%. Пример 9. 2-Бром-1-циклопропил-2-(2-фторфенил)этанон [соединение формулы IV]. Получение выполняли согласно примеру 1, отличие заключается в том, что вместо водного раствора бромоводорода (48 мас.%, 71,3 мл, 0,63 моль) к исходной реакционной смеси добавили бромид калия(75,0 г, 0,63 моль) и медленно серную кислоту (30,0 г, 0,30 моль). Заявленный продукт получили согласно примеру 1. Полученный продукт: 48,8 г светло-желтого масла. Выход: 86,3%. Содержание (данные ГХ): 94,0%. Согласно результатам ГХ, продукт содержит 3,2% исходного вещества и 2,3 дибромпроизводного. Пример 10. 2-Бром-1-циклопропил-2-(2-фторфенил)этанон [соединение формулы IV]. Способ получения выполняли согласно примеру 1 с той разницей, что вместо водного раствора бромоводорода (48 мас.%, 71,3 мл, 0,63 моль) к исходной реакционной смеси при охлаждении добавили бромид калия (52,0 г, 0,50 моль) при 25 С и медленно серную кислоту (30,0 г, 0,30 моль). Реакционную смесь перемешали в течение 3 дней при комнатной температуре и заявленный продукт обработали согласно примеру 1. Полученный продукт: 48,5 г светло-желтого соединения. Выход: 84,1%. Содержание (по данным ГХ): 92,1%. Согласно данным ГХ, неочищенный продукт содержит 4,3% исходного соединения и 1,5% дибромпроизводного. Заявленный продукт, при необходимости, очищали перегонкой. Пример 11. 2-Хлор-1-циклопропил-2-(2-фторфенил)этанон [соединение формулы III X=Cl, R=2-F)]. Способ выполняли по примеру 1 с той разницей, что вместо водного раствора бромоводорода(48 мас.%, 71,3 мл, 0,63 моль) к исходной реакционной смеси при охлаждении добавили хлорид натрия(29,5 г, 0,50 моль) при 25 С и медленно серную кислоту (25,0 г, 0,25 моль). Реакционную смесь перемешали 48 ч при комнатной температуре, указанный продукт обработали согласно примеру 1. Полученный продукт: 60,4 г светло-желтого масла. Содержание (данные ГХ): 93,2%. Согласно данным ГХ, неочищенный продукт содержит 3,4% исходного соединения и 1,9% дихлорпроизводного. Указанный продукт, при необходимости, можно очистить перегонкой. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединений общей формулы III где R представляет собой атом фтора или хлора и X представляет собой атом хлора или брома,путем галогенирования циклопропилбензилкетона общей формулы II где R представляет собой атом фтора или хлора,характеризующийся тем, что: а) галогенирование выполняют в смеси водного раствора галогеноводорода и водного раствора пероксида водорода в присутствии растворителя, смешивающегося с водой, или в присутствии катализатора фазового переноса, или б) галогенирование выполняют в смеси соли щелочного металла с водным раствором галогеново-8 016762 дорода, водного раствора пероксида водорода и серной кислоты. 2. Способ по п.1, где реакцию проводят в присутствии 1-5 моль эквивалентов водного раствора галогеноводорода и 1-10 моль эквивалентов водного раствора пероксида водорода, рассчитанных по отношению к соединению формулы II. 3. Способ по п.1, где реакцию проводят предпочтительно в присутствии 2-4 моль эквивалентов водного раствора галогеноводорода и 4-6 моль эквивалентов водного раствора пероксида водорода, рассчитанных по отношению к соединению формулы II. 4. Способ по п.1, где в реакции используют водный раствор бромоводорода или раствор бромоводорода в уксусной кислоте или газообразный бромоводород. 5. Способ по п.4, где в реакции используют 48 мас.% водного раствора бромоводорода. 6. Способ по п.1, где в реакции используют водный раствор пероксида водорода. 7. Способ по п.6, где в реакции используют 25-40 мас.% водного раствора пероксида водорода. 8. Способ по п.1, где растворителем, смешивающимся с водой, является диоксан, уксусная кислота,тетрагидрофуран или С 1-4 спирт, обладающий разветвленной или неразветвленной цепью. 9. Способ по п.8, где С 1-4 спирт, обладающий разветвленной или неразветвленной цепью, представляет собой метиловый спирт, этиловый спирт или изопропиловый спирт. 10. Способ по п.1, где катализатором фазового переноса является четвертичная соль аммония. 11. Способ по п.10, где четвертичная соль аммония представляет собой бензилтриэтиламмония хлорид, тетрабутиламмония хлорид, бензилтриэтиламмония бромид или тетрабутиламмония бромид. 12. Способ по п.1, где солью щелочного металла является бромид натрия, хлорид натрия, бромид калия или хлорид калия. 13. Способ по п.1, где в реакции используют 1-5 моль эквивалентов соли щелочного металла и 2-10 моль эквивалентов водного раствора пероксида водорода. 14. Способ получения соединения формулы I из соединения формулы III где R представляет собой атом фтора в положении 2 и X представляет собой атом хлора или брома,характеризующийся тем, что соединение циклопропилбензилкетона формулы II где R представляет собой атом фтора в положении 2,галогенируют в смеси раствора водного раствора галогеноводорода и водного раствора пероксида водорода в присутствии растворителя, смешивающегося с водой, или в присутствии катализатора фазового переноса; либо галогенирование выполняют в смеси соли щелочного металла с водным раствором галогеноводорода, водного раствора пероксида водорода и серной кислоты, и полученное соединение формулы III где R представляет собой атом фтора в положении 2 и X представляет собой атом хлора или брома,-9 016762 превращают в соединение формулы I или его соль присоединения кислоты.
МПК / Метки
МПК: C07D 495/04, C07C 49/567, C07C 45/63
Метки: промежуточных, фармацевтических, способ, соединений, получения
Код ссылки
<a href="https://eas.patents.su/11-16762-sposob-polucheniya-farmacevticheskih-promezhutochnyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения фармацевтических промежуточных соединений</a>
Предыдущий патент: Упаковка
Следующий патент: Композиция для производства кисломолочного продукта (варианты)
Случайный патент: Применение полипептидов цитокина zcyto человека и мыши и антител к данным полипептидам для лечения различных заболеваний