Способ получения циклопропанкарбоновых кислот и их промежуточных соединений
Номер патента: 683
Опубликовано: 28.02.2000
Авторы: Винкельманн Иб, Клемменсен Пер Дауселль, Колинн-Андерсен Ханс
Формула / Реферат
1. Способ получения соединений общей формулы I
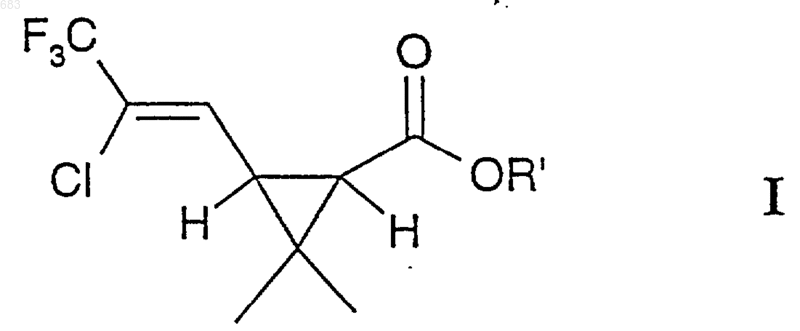
где R' представляет Н, а два атома водорода циклопропанового кольца находятся в цис-положении по отношению друг к другу, включающий взаимодействие между соединением общей формулы II
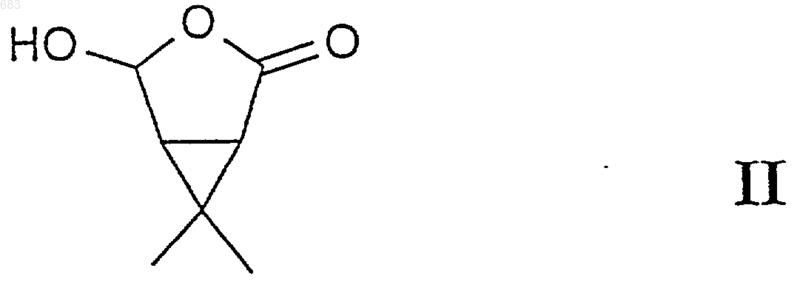
и соединением СF3-CClХ2, где Х представляет атом галогена, в частности атом хлора или брома, в инертной среде в присутствии Zn и при подходящей температуре от 0 до 150шС, предпочтительно от 20 до 100шС, в течение которого в качестве промежуточных соединений образуются соединения III и IV
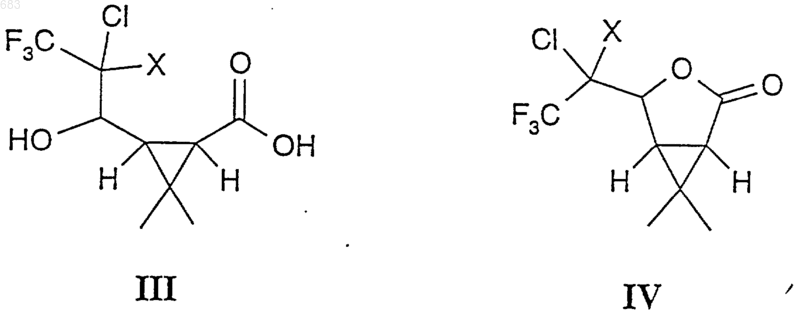
которые не выделяют, и, когда, после некоторого периода времени, анализ показывает, что исходное вещество II, по существу, израсходовано, что образовались вышеуказанные промежуточные соединения III и IV и что в небольшом количестве образовался конечный продукт I, добавление дегидратирующего агента, который немедленно превращает промежуточное соединение III в промежуточное соединение IV и, спустя еще некоторое время, превращает промежуточное соединение IV, по существу, полностью в конечный продукт I, преимущественно в виде Z-изомера, как в оптически чистой, так и в рацемической форме, причем тщательно следят, чтобы постоянно присутствовал непрореагировавший металлический цинк.
2. Способ по п.1, в котором инертной средой является ДМФА.
3. Способ по п.1 или 2, в котором дегидратирующим агентом является уксусный ангидрид.
4. Способ по любому из пп.1-3, в котором часть или весь используемый цинк заменяют на электрохимически генерированный металлический цинк.
5. Соединение 3-(2,2-дихлор-3,3,3-трифтор-1-гидроксипропил)-2,2-диметил-(1R,цис)-циклопропанкарбоновая кислота (IIIa, Х = Сl).
6. Соединение цис-3-(2,2-дихлор-3,3,3-трифтор-1-гидроксипропил)-2,2-диметилциклопропанкарбоновая кислота (IIIb, X = Сl).
7. Соединение (1R, 5S)-4-(1,1-дихлор-2,2,2-трифторэтил)-6,6-диметил-3-оксабицикло[3.1.0]гексан-2-он (IVа, Х = Сl).
Текст
1 Настоящее изобретение относится к соединениям, применяемым в качестве промежуточных соединений для получения эфиров циклопропанкарбоновых кислот, и также относится к способам получения этих соединений. Эфиры циклопропанкарбоновой кислоты являются инсектицидно активными соединениями, которые известны как "пиретроиды", и поскольку они объединяют в себе исключительно хорошие инсектицидные свойства с очень низкой токсичностью для млекопитающих, они представляют большой интерес. Поэтому прилагают большие усилия для поиска экономически выгодных способов их получения и получения наиболее важных промежуточных соединений для этих способов.Ib: 1RS, цис, Z Один из классов таких пиретроидных соединений, проявляющих необыкновенно высокую активность, имеет общую формулу I, где атомы углерода 1 и 3 являются асимметричными атомами углерода, a R' выбирают из группы радикалов, известных как радикалы, ответственные за инсектицидную активность молекулы, например, из числа RSциано-3 феноксибензила или Sциано-3-феноксибензила, или 2-метилбифенил-3-илметила, или 2,3,5,6-тетрафтор-4-метилбензила. Список ссылочной литературы приводится в конце настоящего описания. Известно, что стереоизомерная конфигурация кислотной группы сложного эфира Iа должна иметь 1R, цис, Z геометрию, чтобы обладать максимальной инсектицидной активностью, т.е. абсолютная конфигурация у атома углерода 1 является R, два атома водорода у атомов углерода 1 и 3 находятся в цисположении, а атом хлора и циклопропановая группа находятся по одну сторону от двойной связи углерод-углерод (1). Следовательно, очень важна возможность получения активного изомера I технически, а также экономически выгодным способом для того, чтобы свести к минимуму используемое количество активного вещества (инсектицида) при обработке сельскохозяйственных культур,жилищ и т.п. Из вышесказанного следует, что если нужно получить такие соединения формулы Iа, необходимо либо обеспечить возможность стереоспецифического химического синтеза, либо выделить нужный стереоизомер из рацемической смеси методами физического разделения. Последний способ обычно дороже и редко используется в промышленном масштабе. 2 Известно, что биокартол (Biocartol) приведенной ниже формулы II можно ввести во взаимодействие с галогенсодержащим соединением с одним атомом углерода, таким как СНВr3,СНСl3 или CHClF2, в присутствии сильного основания для получения производных циклопропанкарбоновой кислоты (2). Также известно, что рацемическое соединение приведенной ниже формулы IVb можно получить циклизацией 4-диазоацетокси-5,5 дихлор-6,6,6-трифтор-2-метил-2-гексана в суспензии ацетилацетоната меди (II) в кипящем диоксане, когда циклопропановое кольцо формируется, таким образом, на последней стадии последовательности реакций (3). Кроме того, полагают, что рацемическое соединение приведенной ниже формулы IVb можно получить взаимодействием эфиров цис 3-формил-2,2-диметилциклопропанкарбоновой кислоты и 1,1,1-трихлор-2,2,2-трифторэтана в присутствии цинка (3). В настоящее время найден способ получения коммерчески важных соединений типа I, в котором в качестве исходного вещества используют вещество биокартол (формула II), которое легко получают в оптически чистой форме IIa из встречающегося в природе (+)-3-карена или в рацемической форме IIb озонолизом хризантемовой кислоты или ее производных (3, 4, 5, 6). Метиловый эфир транс-3-(диметоксиметил)-2,2 диметилциклопропанкарбоновой кислоты, который коммерчески доступен от, например, Aldrich-Chemie, также через гидролиз и эпимеризацию-лактонизацию, является источником IIb. Этот способ синтеза достаточно специфичен в отношении стереоизомерии продуктов, так что геометрию IIa можно снова обнаружить в продукте Iа. В этом способе устраняется дорогостоящее расщепление рацематов, а также потери выхода, связанные с получением нежелательных изомеров. В настоящем изобретении описан ряд новых синтезов (см. схему реакций) (1R, цис, Z)кислотной части пиретроидных эфиров формулы Ia (R'=Н) из биокартола IIа, которые осуществляют через новые промежуточные соедине 3 ния IIIa и/или IVa настоящего изобретения. Эти способы синтеза можно использовать также для получения рацемической (1RS, цис, Z)кислотной части пиретроидных эфиров формулы Ib (R'=Н) из рацемического биокартола IIb через новое промежуточное соединение IIIb. Здесь также описаны способы синтеза I(R'=Н) (осуществляемый в одном реакторе синтез) из II, когда промежуточные соединения III и IV не выделяют, но, однако, идентифицируют и характеризуют с помощью газовой хроматографии. Эти способы синтеза используют для синтеза Iа из IIа и Ib из IIb. Настоящее изобретение относится к соединениям общей формулы III или соединениям общей формулы IV, где Х представляет атом галогена, в частности, хлора. Предпочтительными соединениями общей формулы III являются цис-3-(2,2-дихлор-3,3,3 трифтор-1-гидроксипропил)-2,2-диметилциклопропанкарбоновая кислота (IIIb, Х=Сl) и 3-(2,2 дихлор-3,3,3-трифтор-1-гидроксипропил)-2,2 диметил-(1R, цис)-циклопропанкарбоновая кислота (IIIa, Х=Сl). Соединение IIIb (X=Сl) и соединение IIIa(X=Сl) характеризуются тем, что являются идеальными и новыми исходными веществами для синтеза IVb (X=Сl) и IVa (X=Сl), соответственно, и, в конечном итоге, Ib (R'=Н) и Iа (R'=Н),соответственно. Это также иллюстрируется вышеописанным синтезом в одном реакторе I из II путем последовательного добавления реагентов,когда III и IV используют как промежуточные соединения. Предпочтительным соединением общей формулы IV является (1R,5S)-4-(1,1-дихлор 2,2,2-трифторэтил)-6,6-диметил-3-оксабицикло[3.1.0]гексан-2-он приведенной ниже формулы IVa (X=Cl). Соединение IVa (X=Сl) характеризуется тем, что является идеальным и новым веществом для синтеза Ia (R'=Н), а также тем, что неожиданно обнаружено, что дальнейшая реакция дает в результате почти исключительно Zизомер соединения I. Учитывая асимметричность атома С, соседнего с группой СХСl, и асимметрию в самой группе СХСl (в случае ХСl), соединения IIIa и IVa (и, подобным образом, IIIb и IVb) могут существовать в нескольких изомерных формах и необязательно в равных количествах. Пропорции могут быть показаны газохроматографическим анализом и анализом с помощью ЯМР. Все указанные изомеры 4 дают один и тот же конечный продукт Iа (соотв.,Ib). ЯМР и газохроматографический анализы конечных продуктов Iа и Ib показывают, что предпочтительно выделяют Z-изомер, обычно более 90% Z-изомера, а сырые продукты легко могут быть очищены с получением более 99%Z-изомера. Настоящее изобретение относится к получению соединений общей формулы I, где R' представляет Н, а два атома водорода в циклопропановом кольце находятся в цис-положении по отношению друг к другу, взаимодействием соединений общей формулы II и соединенияCF3-CClX2, где Х представляет атом галогена, в частности, хлора или брома, в инертной среде,например, ДМФА, в присутствии избытка металлического цинка, при подходящей температуре от 0 до 150 С, предпочтительно - от 20 до 100 С. Через некоторое время, когда газохроматографический анализ реакционной смеси показывает, что исходное соединение II израсходовано, что промежуточные соединения III и IV образовались и что в небольшом количестве образовался конечный продукт I, добавляют дегидратирующий агент, который сразу же превращает промежуточное соединение III в промежуточное соединение IV, что устанавливают с помощью газовой хроматографии. Спустя еще некоторый период времени промежуточное соединение IV полностью превращается в конечный продукт I, преимущественно в виде Zизомера, как в оптически чистой, так и в рацемической форме, при условии, что постоянно присутствует непрореагировавший металлический цинк. Когда в вышеуказанном случае применяют металлические реагенты, такие реагенты возможно заменить каталитическим количеством того же металла, который регенерируется электрохимически во время реакции. Настоящее изобретение далее иллюстрируется приведенными ниже примерами. Выход и чистоту определяют с помощью газовой и/или жидкостной хроматографии, а также ЯМРспектроскопией. Пример 1. Получение 3-(2,2-дихлор-3,3,3 трифтор-1-гидроксипропил)-2,2-диметил-(1R,цис)-циклопропанкарбоновой кислоты (IIIa,X=Сl) из биокартола IIа. К раствору 0,02 молей IIа (2,84 г) и 0,022 молей 1,1-дихлор-2,2,2-трифторэтана (3,36 г) в смеси 5 г сухого ДМФ и 25 мл сухого ТГФ, охлажденному с помощью наружного охлаждения до 70 С, при перемешивании постепенно добавляют 27 мл 1 М раствора трет-бутилата калия так, чтобы поддерживать температуру реакции ниже 55 С. Затем проводят реакцию при той же температуре в течение 30 мин, а затем реакцию останавливают рассчитанным количеством конц. НСl (водн.). После самопроизволь 5 ного нагревания до комнатной температуры полученный в результате раствор выливают в смесь воды и метил-трет-бутилового эфира. Водную и органическую фазы разделяют и водную фазу затем экстрагируют 225 мл метилтрет-бутиловым эфиром (МТВЕ). Объединенную органическую фазу сушат над Na2SO4 и упаривают при пониженном давлении. Получают 1,1 г сырого продукта с чистотой 60%, измеренной газовой хроматографией. Сырой продукт очищают кристаллизацией из гексана и выделяют 0,4 г IIIa (28% от теоретического выхода), с температурой плавления (т. пл.) 126129 С (разлож.) и чистотой по ЯМР 95%. Удельное вращение []D25 = 11 (1,28 г/100 мл,ТГФ). 1H-ЯМР (250 МГц, CDCl3+CD3OD): 1,21 м.д. (с, 3 Н); 1,31 м.д. (с, 3 Н); 1,7 м.д. (м, 2 Н); 4,51 м.д. (д, J=8,8 Гц, 1 Н); 4,8 м.д. (ушир. сигнал, 2 Н) - для основного изомера, 1,27 м.д. (с,3 Н); 1,39 м.д. (с, 3 Н) - для незначительного количества изомера. 13 С-ЯМР (63 МГц, СDСl3+СD3OD): 16,1 м.д. (к); 28,4 м.д. (с); 28,6 м.д. (к); 29,5 м.д. (д); 35,8 м.д. (д); 71,4 м.д. (д); 88,9 м.д. (кс, 32 Гц); 122,9 м.д. (кс, 282 Гц); 174,8 м.д. (с). Аналогичным способом из IIb получают цис-3-(2,2-дихлор-3,3,3-трифтор-1-гидроксипропил)-2,2-диметилциклопропанкарбоновую кислоту (IIIb, X=Cl). Т. пл. 127-130 С. 1(кс, 277 Гц); 177,4 м.д. (с). Пример 2. Получение 3-(2,2-дихлор-3,3,3 трифтор-1-гидроксипропил)-2,2-диметил-(1R,цис)-циклопропанкарбоновой кислоты (IIIa,X=Cl) из биокартола IIа. Охлаждают до 70 С 13 мл 1 М раствора трет-бутилата калия (13 ммоль) в ТГФ в атмосфере сухого азота. К охлажденному раствору добавляют по каплям смесь 5 ммоль IIа (0,7 г), 8 ммоль 1,1-дихлор-2,2,2-трифторэтана (1,22 г),1,0 г сухого ДМФА и 5 мл сухого ТГФ, при охлаждении и перемешивании, так, чтобы температура не превышала 55 С. Через 90 мин добавляют еще 2 мл трет-бутилата калия (2 ммоль) и немедленно добавляют 2 ммоль 1,1-дихлор 2,2,2-трифторэтана (0,31 г). Предыдущую операцию повторяют дважды, с тем же промежутком времени. Таким образом, добавляют общее количество 19 мл трет-бутилата калия и 14 ммоль 1,1-дихлор-2,2,2-трифторэтана. После проведения реакции в течение 6 ч добавляют 4 мл конц. НСl при непрерывном охлаждении смеси до 55 С, после чего реакционную смесь оставляют для самопроизвольного нагревания 6 до комнатной температуры. Реакционную смесь обрабатывают по методике примера 1. Выход соединения IIIa в виде порошка составляет 0,9 г(61% от теор. выхода), чистота которого по данным ЯМР составляет 95%. Аналогичным способом из IIb получают цис-3-(2,2-дихлор-3,3,3-трифтор-1-гидроксипропил)-2,2-диметилциклопропанкарбоновую кислоту (IIIb, Х=Сl). Пример 3. Получение (1R,5S)-4-(1,1 дихлор-2,2,2-трифторэтил)-6,6-диметил-3 оксабицикло[3.1.0]гексан-2-она (IVa, X=Сl) изIIIa. Растворенный в 10 мл уксусного ангидрида IIIa (0,005 моль; 1,52 г) перемешивают при 85 С в течение 2,25 ч, охлаждают до комнатной температуры, обрабатывают водным растворомNаНSО 3 и дважды экстрагируют МТВЕ, экстракты сушат над Na2SO4 и упаривают. Выделяют 1,35 г вещества, которое очищают хроматографией на диоксиде кремния (CH2Cl2). Выделяют 1,23 г IVa (чистота 93,4%, газ. хром.; выход 83%). Перекристаллизация 0,51 г этого продукта из 10 мл н-гексана дает 0,31 г бесцветных игольчатых кристаллов с чистотой, превышающей 95% (ЯМР-анализ), с т. пл. 91-93 С. Удельное вращение []D25 = +5 (1,27 г/100 мл,СНСl3). 1(кс, 284 Гц); 171,9 м.д. (с). Рентгеновские кристаллографические исследования перекристаллизованного продуктаIVa показывают следующую кристаллическую структуру:=90; =110,505 (12); =90; объем элементарной ячейки = 588,79 (33) 3. Число молекул на элементарную ячейку,Z=2. Вычисленная плотность = 1,5627 Мг/м 3 Координаты индивидуальных атомов в элементарной ячейке приводятся в данной ниже таблице. Аналогичным способом из IIIb получают 4-(1,1-дихлор-2,2,2-трифторэтил)-6,6-диметил 3-оксабицикло[3.1.0]гексан-2-он (IVb, X=Cl). 1(кс, 284 Гц); 171,9 м.д. (с). Пример 4. Получение цис-3-(2-бром-2 хлор-3,3,3-трифтор-1-гидроксипропил)-2,2 диметилциклопропанкарбоновой кислоты (IIIb,Х=Вг) из биокартола IIb. Синтез осуществляют по методике примера 2,используя 1-бром-1-хлор-2,2,2 трифторэтан вместо 1,1-дихлор-2,2,2 трифторэтана. Перекристаллизация из толуола дает белый порошок (IIIb) с т. пл. 170-172 С и чистотой более 95% (ЯМР, сумма нескольких изомеров). 1(кс, 282 Гц); 172,0 м.д. (с). Спектральные данные даны для основного изомера. Пример 5. Получение Z-цис-3-(2-хлор 3,3,3-трифтор-1-пропенил)-2,2-диметилциклопропанкарбоновой кислоты (Ib) из IIb. 8 Суспензию порошка Zn (0,03 моль; 1,96 г) в растворе IIb (0,005 моль; 0,71 г) и 1,1,1 трихлортрифторэтана (0,015 моль; 2,81 г) в 10 мл сухого ДМФА перемешивают при нагревании с обратным холодильником при 65 С в течение 4 ч, пока газохроматографический анализ не показывает, что весь IIb превратился в смесьIIIb и IVb и также небольшого количества Ib. Добавляют уксусный ангидрид (0,01 моль; 1,02 г) и продолжают перемешивание при 60 С в течение 5 ч, причем постоянно следят, чтобы в реакционной смеси присутствовал непрореагировавший порошок Zn. Продукт выделяют экстракцией МТВЕ реакционной смеси, к которой добавлена водная НСl. МТВЕ-фазу сушат над(в литературе для Ib приведено значение 108110 С) (7). Пример 6. Получение Z-3-(2-хлор-3,3,3 трифтор-1-пропенил)-2,2-диметил-(1R,3R)циклопропанкарбоновой кислоты (Iа) из IVa. Суспензию порошка Zn (0,004 моль; 0,26 г) в растворе IVa (0,0026 моль; 0,72 г) в 3 мл ДМФА перемешивают при 60 С в течение 7,5 ч и после охлаждения до комнатной температуры добавляют 10 мл воды и 5 мл конц. НСl. Смесь экстрагируют три раза МТВЕ, экстракты сушат над Na2SO4 и упаривают. В результате получают 0,65 г кристаллов, которые, в соответствии с газохроматографическим анализом, имеют почти 100% чистоту. Выход около 100%. Перекристаллизация из 10 мл н-гептана дает 0,21 г белых кристаллов с т. пл. 105-108 С. Удельное вращение []D25 = +47 (1,14 г/100 мл, СНСl3). 1 Н-ЯМР (250 МГц, CDCl3): 1,32 м.д. (с,2 х 3 Н); 1,99 м.д. (д, J=8,3 Гц, 1 Н); 2,23 м.д. (дд,J=9,3 и 8,3 Гц, 1 Н); 6,87 м.д. (д, J=9,3 Гц, 1 Н); 10,8 м.д. (ушир. сигнал, 1 Н). При 6,58 м.д. (д,J=9,6 Гц) получают сигнал, соответствующий содержанию Е-изомера 5%, который полностью исчезает при перекристаллизации вещества. 13 С-ЯМР (63 МГц, СDСl3): 14,9 м.д. (к); 28,6 м.д. (к); 29,5 м.д. (с); 31,6 м.д. (д); 32,7 м.д.(д); 120,5 м.д. (кс, 38 Гц); 122,1 м.д. (кс, 271 Гц); 129,7 м.д. (кд, 5 Гц); 176,6 м.д. (с). Взаимодействие незначительного количества Iа с избытком тионилхлорида и затем с избытком метанола дает метиловый эфир Iа. Анализ этого эфира газовой хроматографией на хиральной колонке показывает, что он имеет оптическую чистоту энантиомерного остатка 95%. Пример 7. Получение Z-3-(2-хлор-3,3,3 трифтор-1-пропенил)-2,2-диметил-(1R,3R)циклопропанкарбоновой кислоты (Ia) из IVa. Используют проточную ячейку для микроэлектролиза (Electro Micro Flow Cell от фирмыElectrocell АВ, Швеция) со свинцовым катодом и графитовым анодом, причем каждый электрод имеет площадь 10 см 2. В качестве ионоизбира 9 тельной мембраны используют Selemion CMV,катионоизбирательную мембрану от фирмыAsahi Glass Co., Япония. Осторожно растворяют 10 мл конц. серной кислоты в 300 мл метанола. Заливают 150 мл в качестве католита и 150 мл в качестве анолита. Включают циркуляционные насосы и, когда установится температура 50 С,к католиту добавляют раствор IVa (0,0072 моль; 2,00 г) в 10 мл метанола. Присоединяют идущие к электродам провода, начинают подачу тока и устанавливают постоянное напряжение 4,0 В. В момент времени = 0 ток равен 0,30 А. Отбирают образцы каждые 30 мин и через 270 мин ток отключают и отсоединяют подводку. В конце эксперимента ток составляет 0,20 А. Выгружают католит и после добавления 50 мл воды обрабатывают, отгоняя метанол на роторном испарителе при 50 С и давлении 100 мм рт. ст. Затем водную фазу экстрагируют метилтрет-бутиловым эфиром и экстракт сушат и упаривают. Получают 1,68 г масла, которое смешивают с 10 мл 2 N NaOH (водн. р-р) и оставляют стоять при перемешивании в течение 2 ч. Водную фазу подкисляют конц. НСl (водн.) и экстрагируют метил-трет-бутиловым эфиром, и экстракт затем сушат и упаривают. Получают 1,33 г кристаллического вещества, которое, по газохроматографическому анализу, имеет чистоту 95%. Выход 75%. Пример 8. Получение Z-3-(2-хлор-3,3,3 трифтор-1-пропенил)-2,2-диметил-(1R,3R)циклопропанкарбоновой кислоты (Iа) из IIа. Суспензию порошка Zn (0,045 моль; 2,94 г) в растворе IIа (0,015 моль; 2,13 г) и 1,1,1 трихлортрифторэтана (0,038 моль; 7,12 г) в 25 мл сухого ДМФА перемешивают в 50-мл футерованном тефлоном автоклаве в течение 2 ч при 50 С. Автоклав открывают, и газохроматографический анализ показывает, что весь IIа превратился в смесь IIIa и IVb с небольшим количеством Iа. Добавляют уксусный ангидрид(0,018 моль; 1,84 г), автоклав закрывают, греют в течение 15 мин при 50 С и снова открывают. Газохроматографический анализ показывает,что весь IIIa превратился в IVa. Добавляют порошок Zn (0,018 моль; 1,18 г), автоклав снова закрывают и оставляют стоять при перемешивании при 70 С в течение 2 ч. Автоклав открывают и продукт выделяют из реакционной смеси экстрагированием МТВЕ, и добавляют к экстракту водный раствор НСl. МТВЕ-фазу сушат над Na2SO4 и упаривают. Выход Iа 2,48 г (чистота 95%, 68% от теор. выхода). Перекристаллизация из н-гептана дает продукт с т. пл. 106107 С. Список ссылочной литературы 1. British Patent 2 000 764 (23 March 1977),ICI 2. Danish patent application 2849/78 (26 June 1978), Roussel-Uclaf, S.A.Corporation. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединений общей формулы I где R' представляет Н, а два атома водорода циклопропанового кольца находятся в цисположении по отношению друг к другу, включающий взаимодействие между соединением общей формулы II и соединением СF3-CClХ 2, где Х представляет атом галогена, в частности атом хлора или брома, в инертной среде в присутствии Zn и при подходящей температуре от 0 до 150 С, предпочтительно от 20 до 100 С, в течение которого в качестве промежуточных соединений образуются соединения III и IV которые не выделяют, и, когда, после некоторого периода времени, анализ показывает, что исходное вещество II, по существу, израсходовано, что образовались вышеуказанные промежуточные соединения III и IV и что в небольшом количестве образовался конечный продукт I,добавление дегидратирующего агента, который немедленно превращает промежуточное соединение III в промежуточное соединение IV и,спустя еще некоторое время, превращает промежуточное соединение IV, по существу, полностью в конечный продукт I, преимущественно в виде Z-изомера, как в оптически чистой, так и в рацемической форме, причем тщательно следят, чтобы постоянно присутствовал непрореагировавший металлический цинк. 2. Способ по п.1, в котором инертной средой является ДМФА. 3. Способ по п.1 или 2, в котором дегидратирующим агентом является уксусный ангидрид. 4. Способ по любому из пп.1-3, в котором часть или весь используемый цинк заменяют на электрохимически генерированный металлический цинк. 5. Соединение 3-(2,2-дихлор-3,3,3 трифтор-1-гидроксипропил)-2,2-диметил-(1R,цис)-циклопропанкарбоновая кислота (IIIa, Х = Сl).
МПК / Метки
МПК: C07D 307/93, C07C 61/35
Метки: промежуточных, соединений, кислот, получения, способ, циклопропанкарбоновых
Код ссылки
<a href="https://eas.patents.su/7-683-sposob-polucheniya-ciklopropankarbonovyh-kislot-i-ih-promezhutochnyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения циклопропанкарбоновых кислот и их промежуточных соединений</a>
Предыдущий патент: Способ получения бензо[b]тиофенов, промежуточные соединения и способ их получения.
Следующий патент: Применение бета-d-галактопиранозил-d-ксилозы для получения композиций и растворов , предназначенных для определения лактазы кишечника
Случайный патент: Способ и устройство для обработки отработанных масел











