Производные 3-деоксидесмикозина
Номер патента: 4059
Опубликовано: 25.12.2003
Авторы: Наранджя Амалия, Павлович Дражен, Лопотар Невенка, Джерек Марко
Формула / Реферат
1. Производные 3-деоксидесмикозина формулы I
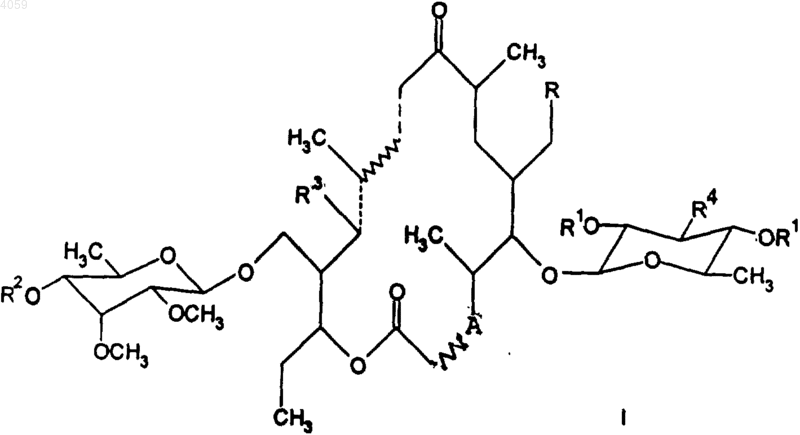
в которой R представляет COH или CH(OCH3)2, R1 и R2 означают H или ацетил, R3 означает H или OH, R4 означает N(CH3)2 или N-O(CH3)2, A представляет карбонильную группу (C=O) или CH, линия --- представляет простую или двойную связь, линия ... представляет  или двойную или простую связь и линия
или двойную или простую связь и линия ![]() представляет двойную или простую связь,
представляет двойную или простую связь,
при условии, что когда A представляет CH, ![]() в положении 2, 3 представляет двойную связь и R1 и R2 не являются ацетилом.
в положении 2, 3 представляет двойную связь и R1 и R2 не являются ацетилом.
2. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1 и R2 означают ацетил, R3 означает H, R4 означает N(CH3)2, A означает карбонильную группу, линии --- и ... представляют двойные связи и линия ![]() представляет простую связь.
представляет простую связь.
3. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1 и R3 означают H, R2 означает ацетил, R4 означает N(CH3)2, A означает карбонильную группу или отсутствует, линии --- и ... представляют двойные связи и линия ![]() представляет простую связь.
представляет простую связь.
4. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1, R2 и R3 означают H, R4 означает N(CH3)2, A означает карбонильную группу, линии --- и ... представляют двойные связи и линия ![]() представляет простую связь.
представляет простую связь.
5. Соединение формулы I по п.1, отличающееся тем, что R представляет CHO, R1, R2 и R3 означают H, R4 означает N(CH3)2, A означает карбонильную группу, линии --- и ... представляют двойную связь и линия ![]() представляет простую связь.
представляет простую связь.
6. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1 и R2 означают ацетил, R3 означает H, R4 означает N(CH3)2, A означает карбонильную группу, линии ---, ... и ![]() представляют простые связи.
представляют простые связи.
7. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1 и R3 означают H, R2 означает ацетил, R4 означает N(CH3)2, A означает карбонильную группу, линии ---, ... и ![]() представляют простые связи.
представляют простые связи.
8. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1, R2 и R3 означают H, R4 означает N(CH3)2, A означает карбонильную группу, линии --- , ... и ![]() представляют простые связи.
представляют простые связи.
9. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1 и R2 означают ацетил, R3 означает H, R4 означает N-O(CH3)2, A означает карбонильную группу, линия --- представляет двойную связь, линия ... представляет  и линия
и линия ![]() представляет простую связь.
представляет простую связь.
10. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1 и R3 означают H, R2 означает ацетил, R4 означает N-O(CH3)2, A означает карбонильную группу, линия --- представляет двойную связь, линия ... представляет  и линия
и линия ![]() представляет простую связь.
представляет простую связь.
11. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1, R2 и R3 означают H, R4 означает N-O(CH3)2, A означает карбонильную группу, линия --- представляет двойную связь, линия ... представляет  и линия
и линия ![]() представляет простую связь.
представляет простую связь.
12. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1, R2 и R3 означают H, R4 означает N(CH3)2, A означает карбонильную группу, линия --- представляет простую связь, линия ... представляет  и линия
и линия ![]() представляет простую связь.
представляет простую связь.
13. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1 и R3 означают H, R2 означает ацетил, R4 означает N(CH3)2, A означает карбонильную группу, линия --- представляет простую связь, линия ... представляет  и линия
и линия ![]() представляет простую связь.
представляет простую связь.
14. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1 и R2 означают H, R3 означает OH, R4 означает N(CH3)2, A означает карбонильную группу, линии --- и ... представляют простые связи и линия ![]() представляет простую связь.
представляет простую связь.
15. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1, R2 и R3 означает H, R4 означает N-O(CH3)2, A представляет CH, линия --- представляет двойную связь, линия ... представляет  и линия
и линия ![]() представляет простую связь в положении 11, 12 и двойную связь в положении 2, 3.
представляет простую связь в положении 11, 12 и двойную связь в положении 2, 3.
16. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1, R2 означают H и R3 означает OH, R4 означает N(CH3)2, A представляет CH, линии --- и ... представляют простые связи и линия ![]() представляет двойную связь.
представляет двойную связь.
17. Соединение формулы I по п.1, отличающееся тем, что R представляет CH(OCH3)2, R1, R2 и R3 означают H, R4 означает N(CH3)2, A представляет CH, линии ---, ... и ![]() представляют простую связь в положении 11, 12 и двойную связь в положении 2, 3.
представляют простую связь в положении 11, 12 и двойную связь в положении 2, 3.
18. Соединение формулы I по п.1, отличающееся тем, что R представляет CHO, R1, R2 и R3 означают H, R4 означает N(CH3)2, A представляет CH, линии ---, ... и ![]() представляют простую связь в положении 11, 12 и двойную связь в положении 2, 3.
представляют простую связь в положении 11, 12 и двойную связь в положении 2, 3.
Текст
1 Техническая проблема Настоящее изобретение относится к новым производным тилозина, новым синтетическим продуктам макролидного класса, проявляющим противомикробную активность. Изобретение, в частности, относится к производным 3-деоксидесмикозина формулы (I) в которой R представляет СНО или СН(ОСН 3)2,R1 и R2 означают Н или ацетил, R3 представляет Н или ОН, R4 означает Н(СН 3)2 или N-O(СН 3)2,линияпредставляет простую или двойную связь, линияпредставляет или двойную,или простую связь и линия представляет двойную или простую связь, при условии, что когда А представляет СН,в положении 2, 3 представляет двойную связь и R1 и R2 не являются ацетилом,и к способу их получения. Предшествующий уровень техники Известно, что 13-гидроксипроизводные тилозина были получены восстановительным разрывом кольца оксирана (F. Narandja, SI 9700281). Известно также, что 10,11,12,13-тетрагидропроизводные тилозина получют каталитическим гидрированием тилозина (А. Narandja,ЕР 287082 В 3). Также известно, что были получены 3-деокси-2,3-дидегидропроизводные тилозина (S.Kageyama, Bull. Chem. Jpn. 65, 3405,1992), а также 3-деокси-3-оксопроизводные 6-Oметилэритромицина (A. Agouridas, J. Med.Chem. 41, 4080, 1998). Однако согласно известному уровню техники, до сих пор не описаны ни 3-деокси-3 оксопроизводные класса тилозина, ни 3-деокси 2,3-дидегидропроизводные с измененной левой стороной молекулы в положениях С-10 - С-13 и способы их получения. Техническое решение Найдено, что производные 3-деоксидесмикозина формулы I в которой R представляет СНО или СН(ОСН 3)2,R1 и R2 представляют H или ацетил, R3 означает Н или ОН, R4 означает N(СН 3)2 или Н-O(СН 3)2,линияпредставляет простую или двойную связь, линияпредставляет или двойную,или простую связь и линия представляет 2 двойную или простую связь, при условии, что в положении когда А представляет СН,2, 3 представляет двойную связь и R1 и R2 не являются ацетилом, могут быть получены, исходя из соединения формулы III в которой R представляет Н или SO2 СН 3 и линияпредставляет двойную или простую связь. Согласно настоящему изобретению соединение формулы III, в которой R представляет Н и линияпредставляет двойную связь, подвергают А) реакции окисления в растворе хлористого метилена в присутствии 15-28 эквивалентов ДЛМСО, 8-14 эквивалентов гидрохлоридаN-(3-диметиламинопропил)-N'-этилкарбодиимида и 8-14 эквивалентов пиридинтрифторацетата в течение 2-6 ч при температуре 10-25 С, после чего полученное соединение формулы I, в которой R представляет СН(ОСН 3)2, R1 и R2 означают ацетил, R3 означает Н, R4 представляет Н(СН 3)2, линииипредставляют двойные связи и линия представляет простую связь,необязательно подвергают В) метанолизу при температуре дефлегмации с обратным холодильником в течение 4-6 ч и полученное соединение формулы I, в которойR представляет СН(ОСН 3)2, R1 и R3 означают Н,R2 означает ацетил, R4 означает N(СН 3)2, линиииозначают двойные связи и линия представляет простую связь,подвергают необязательно В 1) щелочному метанолизу в смеси метанола и 25% NH4OH (2:1) при 5 С в течение периода 48-60 ч, после чего полученное соединение формулы I, в которой R представляет СН(ОСН 3)2, R1, R2 и R3 означают Н, R4 означаетN(СН 3)2, линиииозначают двойные связи и линия представляет простую связь,необязательно подвергают В 2) гидролизу в смеси ацетонитрила и 1% трифторуксусной кислоты (2:3) в течение 2 ч при комнатной температуре, получая соединение формулы I, в которой R представляет СНО,R1, R2 и R3 означают Н, R4 означает N(СН 3)2,линиииозначают двойные связи и линия представляет простую связь,или необязательно,соединение формулы I, в которой R представляет СН(ОСН 3)2, R1 и R2 означают ацетил,R3 означает Н, R4 означает N(СН 3)2, линиииозначают двойные связи и линия представляет простую связь,подвергают 3 С) реакции каталитического гидрирования в присутствии 2-5% Pd/C (мас./мас.) при комнатной температуре в течение 5-8 ч при давлении водорода 0,3-0,5 МПа, после чего полученное соединение формулы I, в которой R представляет СН(ОСН 3)2, R1 и R2 означают ацетил,R3 означает Н, R4 означает N(СН 3)2, линии ,и представляют простые связи,может быть необязательно подвергнуто реакциям метанолиза или щелочного метанолиза по способу, описанному в В или В 1; или необязательно его подвергаютD) реакции окисления в растворе хлористого метилена в присутствии 3-6 эквивалентов м-хлорпербензойной кислоты в течение 6-10 ч при комнатной температуре, получая соединение формулы I, в которой R представляет СН(ОСН 3)2, R1 и R2 означают ацетил, R3 означает Н, R4 означает N-O(СН 3)2, линияпредставляет двойную связь, линияпредставляет и линия представляет простую связь,или необязательно,соединение формулы I, в которой R представляет СН(ОСН 3)2, R1 и R3 означают Н, R2 означает ацетил, R4 означает N-(СН 3)2, линия и линияпредставляют двойные связи и линия представляет простую связь, подвергают реакции окисления по способу, описанному в D,и полученное соединение формулы I, в которойR представляет СН(ОСН 3)2, R1 и R3 означают Н,R2 означает ацетил, R4 означает N-O(СН 3)2, линияпредставляет двойную связь, линияозначает и линия представляет простую связь,необязательно подвергают реакции каталитического гидрирования по способу, описанному в С, получая соединение формулы I, в которой R представляет СН(ОСН 3)2, R1 и R3 означают Н, R2 означает ацетил, R4 означает N-(СН 3)2, линияпредставляет простую связь, линияозначает и линия представляет простую связь, которое необязательно подвергают Е) реакции восстановления Zn-порошком в растворе EtOH и 10% водного раствора NH4OH(1:2) при поддержании значения рН 5,0-5,5, получая соединение формулы I, в которой R представляет СН(ОСН 3)2, R1 означает Н, R3 означает ацетил, R2 означает ОН, R4 означает N(СН 3)2,линииипредставляют простые связи, линия представляет двойную связь,или необязательно,соединение формулы I, в которой R представляет СН(ОСН 3)2, R1, R2 и R3 означают Н, R4 означает N(СН 3)2, линииипредставляют двойные связи и линия представляет простую связь, подвергают реакции окисления по способу, описанному в D, и полученное соединение формулы I, в которой R представляет СН(ОСН 3)2, R1, R2 и R3 означают Н, R4 означаетN-O(СН 3)2, линияпредставляет двойную связь, линияозначает и линия представляет простую связь,необязательно подвергают реакции каталитического гидрирования по способу, описанному в С, получая соединение формулы I, в которой R представляет СН(ОСН 3)2, R1, R2 и R3 означают Н, R4 означаетN-(СН 3)2, линияпредставляет простую связь,линияозначает и линия представляет простую связь,или необязательно,восстановлению Zn-порошком по способу,описанному в Е, получая соединение формулы I,в которой R представляет СН(ОСН 3)2, R1 и R2 означают Н, R3 означает ОН, R4 означаетN(СН 3)2, линииипредставляют простые представляет двойную связи, линия связь,или необязательно,соединение формулы III, в которой R представляет Н и линияпредставляет двойную связь, подвергают реакции каталитического гидрирования по способу, описанному в С, и полученное соединение формулы III, в которойF) реакции мезилирования в растворе пиридина с добавлением 3-5 эквивалентов метансульфохлорида при 10 С в течение 3-5 ч и полученное соединение формулы III, в которой R представляет SO2 СН 3 и линияпредставляет простую связь, подвергаютG) реакции элиминирования мезилата в смеси метанола и 25% NH4OH (2:1) при комнатной температуре в течение 5 ч и впоследствии метанолизу по способу, описанному в В 1, и полученное соединение формулы II, в которой R представляет СН(ОСН 3)2, R1 означает Н, R2 означает N(СН 3)2, линии ,и представляют простые связи, подвергают реакции гидролиза ацеталя по способу, описанному в В 2,или необязательно,соединение формулы II, в которой R представляет СН(ОСН 3)2, R1 означает Н, R2 означаетN(СН 3)2, линииипредставляют двойные связи и линия представляет простую связь, подвергают реакции окисления по способу, описанному в D, и полученное соединение формулы II, в которой R представляет СН(ОСН 3)2, R1 означает Н, R2 означает NO(CH3)2, линияпредставляет двойную связь,линияозначает и линия представляет простую связь,необязательно подвергают реакции восстановления по способу, описанному в Е, получая соединение формулы II, в которой R представляет СН(ОСН 3)2, R1 означает ОН, R2 означает N(СН 3)2, линииипред 5 ставляют простые связи и линия представляет двойную связь. Согласно настоящему изобретению выделение продуктов проводят с помощью общепринятых способов экстракции из щелочных водных растворов с использованием галогенированных углеводородов, таких как хлористый метилен, хлороформ или тетрахлорметан, с последующим выпариванием до сухого остатка. Ход реакции сопровождают хроматографией на тонком слое силикагеля (Merck 60 F254) в системах растворителей хлористый метилен метанол - 25% гидроксид аммония (90:9:1,5,система А), (90:9:0,5, система А 1) или хлористый метилен - ацетон (8:2, система В) (7:3, система С). Если необходимо, разделение продуктов реакции и очистку продуктов для спектральных анализов осуществляют на колонке с силикагелем (Merck 60, 230-400 меш/ASTM или 60-230 меш/ASTM в системах растворителей А,В и С). Идентификацию новых соединений проводят с помощью спектроскопии УФ и ЯМР и масс-анализа. Новые соединения демонстрируют антибактериальную активность, однако, они могут также использоваться в качестве промежуточных продуктов для получения новых производных. Следующие примеры иллюстрируют данное изобретение, но никоем образом не ограничивают его. Получение 20-диметилацеталя 2',4'-диацетилдесмикозина. 20-Диметилацеталь десмикозин (20 г, 24,4 ммоль) растворяли в хлористом метилене (100 мл), к нему добавляли ацетангидрид (7,2 мл,76,2 ммоль) и перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь выливали в 400 мл воды, подщелачивали до значения рН 8,5 и затем после удаления органического слоя еще раз экстрагировали хлористым метиленом. Объединенные экстракты промывали насыщенным раствором NaHCO3, сушили и упаривали до сухого остатка. Получали: 19,6 г, 89,0%; Rf (A) 0,68; Rf (В) 0,45; MH+ 902. Получение 20-диметилацеталя 2',4',4-триацетилдесмикозина. 20-Диметилацеталь 2',4'-диацетилдесмикозина (19,6 г, 21,7 ммоль) растворяли в хлористом метилене (700 мл) и к нему добавляли 4(диметиламино)пиридин (0,54 г, 3,7 ммоль),триэтиламин (27 мл) и ацетангидрид (2,7 мл,28,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, выливали в 1000 мл воды и после удаления органического слоя еще раз экстрагировали хлористым метиленом. Объединенные экстракты сушили и упаривали до сухого остатка. Получали: 19,5 г, 95,1%; Rf (A) 0,90; Rf (В) 0,60; МH+ 944. 6 Получение 20-диметилацеталя 3-метансульфонил-2',4',4-триацетилдесмикозина. 20-Диметилацеталь 2',4',4-триацетилдесмикозина (3 г, 3,18 ммоль) растворяли в пиридине (9,5 мл) и охлаждали до 10 С, после чего к раствору постепенно добавляли метансульфохлорид (1,57 мл, 12,4 ммоль). Реакционный раствор перемешивали в течение 3 ч при 10 С, после чего его выливали в 250 мл воды, подщелачивали до значения рН 9,2 и выдерживали при перемешивании в течение 30 мин. Густой белый осадок отделяли фильтрованием и все еще влажный осадок растворяли в хлороформе (60 мл) и промывали насыщенным раствором NaCl(120 мл). Экстракт сушили и упаривали до сухого остатка. Получали: 3,05 г, 94,1%; Rf (А) 0,95; Rf (В) 0,70; МН+ 1022. Получение 20-диметилацеталя 2,3-ангидродесмикозина. 20-Диметилацеталь 3-метансульфонил 2',4',4-триацетилдесмикозин (3 г, 2,9 ммоль) растворяли в метаноле (60 мл), к нему добавляли 25% NH4OH (30 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь упаривали при пониженном давлении до 1/3 объема, экстрагировали хлороформом, сушили и упаривали до сухого остатка. Неочищенный продукт растворяли в метаноле(160 мл) и нагревали при температуре дефлегмации в течение 6 ч, после чего метанол упаривали, а продукт растворяли в хлороформе (150 мл), промывали насыщенным растворомNaHCO3 и упаривали до сухого остатка. Получали: 2,22 г, 94,4%; Rf (A) 0,50; МН+ 800. Пример 1. 20-Диметилацеталь 3-деокси-3 оксо-2',4',4-триацетилдесмикозина (1). 20-Диметилацеталь 2',4',4-триацетилдесмикозина (10 г, 0,01 ммоль) растворяли в хлористом метилене (230 мл), к раствору добавляли диметилсульфоксид (16 мл, 0,22 моль) и затем гидрохлоридN-(3-диметиламинопропил)-N'этилкарбодиимида (20 г, 0,1 моль) и реакционную смесь охлаждали до 10 С. Раствор пиридинтрифторацетата (20,2 г, 0,1 моль) в хлористом метилене (115 мл) добавляли по каплям в течение 30 мин. После 4 ч перемешивания при комнатной температуре, реакционный раствор выливали в 850 мл воды, органический слой отделяли и еще раз экстрагировали хлористым метиленом. Объединенные экстракты промывали насыщенным раствором NaCl и упаривали до сухого остатка. Получали: 9,73 г, 97,6%; Rf (А) 0,95; Rf (С) 0,65; МН+ 942: УФмакс 282 нм,18900. Хроматографией на колонке с силикагелем в системе растворителей С получали продукт со следующими характеристиками, демонстрирующими продукт соразмерный с его енольной формой (в соотношении 1:1; определенном по интенсивности характерных сигналов):(кв, 3 хСОМе). Пример 2. 20-Диметилацеталь 3-деокси-3 оксо-4-ацетилдесмикозина (2). Соединения 1 (9 г, 9,6 ммоль) растворяли в метаноле (180 мл) и нагревали при температуре дефлегмации в течение 4 ч, после чего реакционный раствор упаривали до сухого состояния,а продукт растворяли в хлороформе (90 мл) и промывали насыщенным раствором NaHCO3. Экстракт сушили и упаривали до сухого остатка. Получали: 8,1 г, 98%; Rf (A) 0,45; МН+ 858. В результате хроматографии на колонке с силикагелем в системе щелочных растворителей А, соотношение кето-енол было сдвинуто в пользу кето-формы (3:1). 1(32 мл) и выдерживали при 5 С в течение периода 60 ч. Реакционный раствор упаривали до маслянистого продукта, который растворяли в хлороформе (60 мл), промывали насыщенным раствором NaHCO3 и упаривали до сухого остатка. Получали: 2,25 г, 74,0%; Rf (A) 0,38; МН+ 816. 8 Хроматографией на колонке с силикагелем в системе растворителей А получали продукт со следующими характеристиками: 1H-ЯМР (CDCl3) м.д.: 7,16, 7,08 (1H, д, Н 11), 6,25, 6,02 (1H, д, Н-10), 5,81, 5,74 (1H, д, Н 13), 4,74 (1H, с, Н-2, енол), 4,64 (1H, д, Н-1"),4,38 (1H, д, Н-1'), 3,53 (3 Н, с, 3"-ОМе), 3,47 (3 Н,с, 2"-ОМе), 3,29 (3 Н, с, 20-ОМе), 3,22 (3 Н, с, 20 ОМе), 2,34 (6 Н, с, NMe2), 1,78 (3 Н, с, Н-22). Пример 4. 3-Деокси-3-оксодесмикозин (4). Соединение 3 (1 г, 1,22 ммоль) растворяли в ацетонитриле (10 мл) и 1% трифторуксусной кислоте (12 мл), перемешивали в течение 2 ч при комнатной температуре, к смеси добавляли хлороформ (7 мл) и подщелачивали до значения рН 8,5. Органический слой отделяли, еще раз экстрагировали хлороформом и объединенные экстракты сушили и упаривали до сухого остатка. Получали: 0,79 г, 84,0%; Rf (A) 0,32; MH+ 770. Хроматографией на колонке с силикагелем в системе растворителей А выделяли продукт с характеристиками кето-формы. 1(мас./мас.) и гидрировали в течение 7 ч при комнатной температуре и при давлении водорода 0,5 МПа. После завершения реакции, катализатор отделяли фильтрованием, а этанол упаривали до сухого остатка при пониженном давлении. Получали: 5,8 г, 96,3%; Rf (A) 0,88; Rf (9B) 0,45; MH+ 948; (не поглощается в спектре УФ). Хроматографией на колонке с силикагелем в системе растворителей В получали продукт со следующими характеристиками: 1(с, С-1), 170,0, 169,1 (с, 3 хСОМе), 39,2 (т, С-13),34,8 (т, С-10), 29,7 (д, С-12), 29,4 (т, С-11), 20,8,20,7, 20,06 (кв, 3 хСОМе). Пример 6. 20-Диметилацеталь 3-деокси-3 оксо-2',4',4-триацетил-10,11,12,13-тетрагидродесмикозина (6). Способ А Соединение 5 (5 г, 5, ммоль) растворяли в хлористом метилене (120 мл), к раствору добав 9 ляли диметилсульфоксид (8 мл, 0,11 моль) и затем гидрохлорид N-(3-диметиламинопропил)N'-этилкарбодиимида (10 г, 50 ммоль) и реакционную смесь охлаждали до 10 С. Раствор пиридинтрифторацетата (10,2 г, 50 ммоль) в хлористом метилене (60 мл) добавляли по каплям в течение 30 мин. После 4 ч перемешивания при комнатной температуре, реакционный раствор выливали в 430 мл воды, органический слой отделяли и еще раз экстрагировали хлористым метиленом. Объединенные экстракты промывали насыщенным раствором NaCl и упаривали до сухого остатка. Получали: 4,75 г, 95,2%; Rf (A) 0,93; Rf (В) 0,60; MH+ 946; (не поглощается в спектре УФ). Хроматографией на колонке с силикагелем в системе растворителей В получали кетоенольный продукт (соотношение 3:1 в пользу кето-формы) со следующими характеристиками: 13 С-ЯМР (CDCl3) м.д.: 216,4, 215,1 (с, С 9), 205,9 (с, С-3, кето), 178,2 (с, С-3, енол), 172,4,166,7 (с, С-1), 170,0, 169,7, 169,1 (с, 3 хСОМе),48,0 (т, С-2, кето), 39,6 (т, С-13), 33,8 (т, С-10),29,9 (д, С-12), 29,4 (т, С-11), 20,8, 20,7, 20,6 (кв,3 хСОМе). Пример 7. 20-Диметилацеталь 3-деокси-3 оксо-4-ацетил-10,11,12,13-тетрагидродесмикозина (7). Способ А Соединение 6 (9 г, 9,5 ммоль) растворяли в метаноле (180 мл) и нагревали при температуре дефлегмации в течение 4 ч, после чего реакционную смесь упаривали до сухого состояния, а продукт растворяли в хлороформе (90 мл) и промывали насыщенным раствором NаНСО 3. Экстракт сушили и упаривали до сухого остатка. Получали: 7,7 г, 93,9%; Rf (A) 0,42; МН+ 862; (не поглощается в спектре УФ). Хроматографией на колонке с силикагелем в системе растворителей А получали кетоенольный продукт (соотношение 3:1 в пользу кето-формы) со следующими характеристиками: 13 С-ЯМР (СDСl3) м.д.: 216,6, 215,1 (с, С 9), 205,9 (с, С-3, кето), 178,2 (с, С-3, енол), 172,4,166,7 (с, С-1), 169,7 (с, СОМе), 48,0 (т, С-2, кето), 39,6 (т, С-13), 33,8 (т, С-10), 29,9 (д, С-12),29,4 (т, С-11), 20,8, 20,7, 20,6 (кв, 3 хСОМе). Способ В Соединение 2 (6 г, 6,97 ммоль) растворяли в этаноле (250 мл), добавляли 3 г 10% Pd/C(мас./мас.) и гидрировали в течение 6 ч при комнатной температуре и при давлении водорода 0,5 МПа. После завершения реакции, катализатор отделяли фильтрованием, а этанол упаривали до сухого остатка при пониженном давлении. Получали: 5,7 г, 95,0%. Хроматографией на колонке с силикагелем в системе растворителей А получали продукт с 10 теми же характеристиками, что продукт, полученный по способу А. Пример 8. 20-Диметилацеталь 3-деокси-3 оксо-10,11,12,13-тетрагидродесмикозина (8). Способ А Соединение 7 (3,0 г, 3,48 ммоль) растворяли в метаноле (60 мл), к раствору добавляли 25% NH4OH (30 мл) и выдерживали при 5 С в течение периода 60 ч. Реакционный раствор упаривали и обрабатывали по способу, описанному в примере 3. Получали: 2,08 г, 73,0%; Rf (A) 0,35; MH+ 820. Хроматографией на колонке с силикагелем в системе растворителей А получали продукт со следующими характеристиками: 1(с, С-3), 166,7 (с, С-1), 45,8 (т, С-2), 39,4 (т, С 13), 34,8 (т, С-10), 29,7 (д, С-12), 29,4 (т, С-11). Способ В Соединение 3 (6 г, 7,35 ммоль) растворяли в этаноле (250 мл), к раствору добавляли 3 г 10% PD/C (мас./мас.) и гидрировали в течение 7 ч при комнатной температуре при давлении водорода 0,5 МПа. После завершения реакции,катализатор отделяли фильтрованием, а этанол упаривали при пониженном давлении до сухого остатка. Получали 5,8 г, 96,2%. Хроматографией на колонке с силикагелем в системе растворителей А 1 получали продукт с теми же характеристиками, что продукт, полученный по способу А. Пример 9. (3'Н-оксид) 20-диметилацеталя 12,13-эпокси-3-деокси-3-оксо-2',4',4-триацетилдесмикозина (9). Соединение 1 (2 г, 2,12 ммоль) растворяли в хлористом метилене (40 мл), добавляли 71% м-хлорпербензойную кислоту (2,05 г, 8,4 ммоль) и перемешивали при комнатной температуре в течение 8 ч. Реакционную смесь выливали в 80 мл воды, подщелачивали до значения рН 8,6,перемешивали в течение 30 мин и отделяли органический слой. Затем его еще раз экстрагировали хлористым метиленом. Объединенные экстракты сушили и упаривали до сухого остатка. Получали: 1,91 г, 94,0%; Rf (A) 0,23; MH+ 974; УФмакс 238 нм,14597. Хроматографией на колонке с силикагелем в системе растворителей А получали кетоенольный продукт (соотношение 3:1 в пользу кето-формы) со следующими характеристиками: 1(с, С-1), 171,6, 170,3, 170,1 (с, 3 хСОМе), 150,4,147,3 (д, С-11), 124,2, 123,3 (д, С-10), 62,9 (с, С 12), 48,3 (т, С-2). Пример 10. (3'N-оксид) 20-диметилацеталя 12,13-эпокси-3-деокси-3-оксо-4-ацетилдесмикозина (10). Соединение 2 (3 г, 3,5 ммоль) растворяли в хлористом метилене (60 мл), добавляли 71% мхлорпербензойную кислоту (3,35 г, 14,0 ммоль) и смесь перемешивали при комнатной температуре в течение 8 ч. Продукт выделяли из реакционного раствора, как описано в примере 9. Получали: 2,64 г, 85%; Rf (А) 0,22; МН+ 890; УФмакс 238 нм,15297. Хроматографией на колонке с силикагелем в системе растворителей А получали кетоенольный продукт (соотношение 3:1 в пользу кето-формы) со следующими характеристиками: 1 Н-ЯМР (CDCl3) м.д.: 11,91 (1H, s, 3-OH,взаимозаменяемый с D2O), 6,57, 6,55 (1H, д, Н 11), 6,43, 6,41 (1H, д, Н-10), 4,64 (1H, д, Н-1"),4,44 (1H, дд, Н-4"), 4,42 (1H, д, Н-1'), 3,59 (3 Н, с,3"-ОМе), 3,46 (6 Н, с, N-Ме, 2"-ОМе), 3,31 (3 Н, с,20-ОМе), 3,29 (3 Н, с, 20-ОМе), 3,25 (3 Н, с,NMe), 2,12 (3 Н, с, 3 хСОМе), 1,51 (3 Н, с, Н-22). 13 С-ЯМР (CDCl3) м.д.: 205,7 (с, С-3, кето),200,8 (с, С-9), 179,2 (с, С-3, енол), 175,3, 166,2(с, С-1), 170,1 (с, СОМе), 150,4, 147,3 (д, С-11),124,2, 123,3 (д, С-10), 62,9 (с, С-12), 48,3 (т, С-2). Пример 11. (3'N-оксид) 20-диметилацеталя 12,13-эпокси-3-деокси-3-оксодесмикозина (11). Соединение 3 (2 г, 2,45 ммоль) растворяли в хлористом метилене (40 мл), добавляли к нему 71% м-хлорпербензойную кислоту (2,37 г, 9,8 ммоль), после чего реакцию и выделение проводили по способу, описанному в примере 9. Получали: 1,64 г, 79%; Rf (A) 0,22; МH+ 848. Хроматографией на колонке с силикагелем в системе растворителей А получали кетоенольный продукт (соотношение 3:1 в пользу кето-формы) со следующими характеристиками: 1 Н-ЯМР (CDCl3) м.д.: 11,91 (1 Н, s, 3-OH,взаимозаменяемый с D2O), 6,56, 6,53 (1H, д, Н 11), 6,41, 6,40 (1 Н, д, Н-10), 4,64 (1 Н, д, Н-1"),4,42 (1H, д, Н-1'), 3,59 (3 Н, с, 3"-ОМе), 3,46 (6 Н,с, N-Me, 2"-ОМе), 3,31 (3 Н, с, 20-ОМе), 3,29(3 Н, с, 20-ОМе), 3,25 (3 Н, с, NМе), 1,51 (3 Н, с,Н-22). Пример 12. 20-Диметилацеталь 10,11 дигидро-12,13-эпокси-3-деокси-3-оксодесмикозина (12). Соединение 11 (1 г, 1,18 ммоль) растворяли в этаноле (50 мл), к нему добавляли 0,33 г 10% Pd/C (мас./мас.), после чего гидрировали по способу, описанному в примере 5. 12 Получали: 0,95 г, 96,9%; Rf (A) 0,50; MH+ 834; (не поглощается в спектре УФ). Хроматографией на колонке с силикагелем в системе растворителей А получали продукт со следующими характеристиками: 1H-ЯМР (CDCl3) м.д.: 4,64 (1H, д, Н-1"),4,38 (1H, д, Н-1'), 3,59 (3 Н, с, 3"-ОМе), 3,46 (3 Н,с, 2"-ОМе), 3,31 (3 Н, с, 20-ОМе), 3,29 (3 Н, с, 20 ОМе), 3,50 (6 Н, с, NMe2), 1,34 (3 Н, с, Н-22). Пример 13. 20-Диметилацеталь 10,13 дигидро-13-гидрокси-3-деокси-3-оксо-4-ацетилдесмикозина (13). Соединение 10 (1 г, 1,12 ммоль) растворяли в этаноле (20 мл), к раствору добавляли 10% водный раствор NH4Cl (40 мл) и постепенно Znпорошок (2 г). Смесь перемешивали при комнатной температуре в течение 6 ч, после чего Zn удаляли фильтрованием, а реакционный раствор упаривали до 1/2 объема, добавляли хлороформ(20 мл) и смесь подщелачивали до значения рН 8,5. Органический слой отделяли и проводили еще одну экстракцию хлороформом. Объединенные экстракты сушили и упаривали до сухого остатка. Получали: 0,64 г, 65%; Rf (A) 0,45; MH+ 876. Хроматографией на колонке с силикагелем в системе растворителя А получали кетоенольный продукт (1:1) со следующими характеристиками: 1H-ЯМР (CDCl3) м.д.: 12,04 (1 Н, s, 3-OH,взаимозаменяемый с D2O), 5,38, 5,30 (1H, т, Н 11), 4,78 (1H, с, Н-2, енол), 4,49 (1 Н, д, Н-1"),4,38 (1H, д, Н-1'), 4,30 (1H, дд, Н-4"), 3,59 (3 Н, с,3"-ОМе), 3,46 (3 Н, с, 2"-ОМе), 3,31 (3 Н, с, 20 ОМе), 3,29 (3 Н, с, 20-ОМе), 2,39 (6 Н, с, NMe2),2,12 (9 Н, с, СОМе), 1,49 (3 Н, с, Н-22). Пример 14. (3'N-Оксид) 20-диметилацеталя 2,3-ангидро-12,13-эпоксидесмикозина (14). 20 Диметилацеталь 2,3-ангидродесмикозина (4 г, 5,00 ммоль) растворяли в хлористом метилене (80 мл), добавляли 71% м-хлорпербензойную кислоту (4,84 г, 0,02 моль), а затем осуществляли окисление по способу, описанному в примере 9. Получали: 2,8 г, 68%; Rf (А) 0,20; МН+ 832; УФмакс 238 нм,12247. Хроматографией на колонке с силикагелем в системе растворителей А получали продукт со следующими характеристиками: 1 13 раствор NH4OH (24 мл) и постепенно Znпорошок (2,5 г). После перемешивания в течение 8 ч при комнатной температуре осуществляли выделение по способу, описанному в примере 14. Получали: 0,95 г, 96,9% Rf (A) 0,48; МН+ 818; (не поглощается в спектре УФ). 1(3 Н, с, 20-ОМе), 2,51 (6 Н, с, NMe2), 1,68 (3 Н, с,Н-22). Пример 16. 20-Диметилацеталь 3-метансульфонил-2',4',4-триацетил-10,11,12,13-тетрагидродесмикозина (16). Соединение 5 (3 г, 3,16 ммоль) растворяли в пиридине (9,15 мл) и охлаждали до 10 С, после чего постепенно добавляли метансульфохлорид (1,57 мл, 12,4 ммоль). Реакционный раствор перемешивали в течение 3 ч при 10 С, выливали в 250 мл воды, подщелачивали до значения рН 9,2 и затем оставляли для перемешивания в течение 30 мин. Густой белый осадок отделяли фильтрованием и еще влажный осадок растворяли в хлороформе (60 мл) и промывали насыщенным раствором NaCl (120). Экстракт сушили и упаривали до сухого остатка. Получали: 2,95 г, 86,5%; Rf (С) 0,70; МН+ 1026; (не поглощается в спектре УФ). Хроматографией на колонке с силикагелем в системе С растворителей получали продукт со следующими характеристиками: 1(3 Н, с, 20-ОМе), 3,10 (3 Н, с, SO2Me), 2,34 (6 Н, с,NMe2), 2,12 (3 Н, с, СОМе), 2,06 (6 Н, с,2 хСОМе), 0,96 (3 Н, с, Н-22). Пример 17. 20-Диметилацеталь 2,3-ангидро-10,11,12,13-тетрагидродесмикозина (17). Соединение 16 (2 г, 1,95 ммоль) растворяли в метаноле (40 мл), к раствору добавляли 25% раствор NH4OH (20 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Реакционный раствор упаривали до 1/3 объема при пониженном давлении, экстрагировали хлороформом, сушили и упаривали до сухого остатка. Неочищенный продукт растворяли в метаноле (80 мл) и нагревали при температуре дефлегмации в течение 6 ч. Впоследствии, метанол упаривали, продукт растворяли в хлороформе (40 мл), промывали насыщенным раствором NаНСО 3 и упаривали до сухого осадка. Получали: 1,39 г, 89,0%; Rf (A) 0,45; MH+ 804. 1(с, С-1), 148,8 (д, С-3), 122,7 (д, С-2), 40,9 (т, С 13), 31,5 (т, С-10), 30,1 (с, С-12), 28,3 (т, С-11),20,4 (кв, С-22). Пример 18. 2,3-Ангидро-10,11,12,13-тетрагидродесмикозин (18). Соединение 17 (1 г, 1,2 ммоль) растворяли в ацетонитриле (10 мл) и в 1% трифторуксусной кислоте (13 мл). Реакционный раствор перемешивали в течение 2 ч при комнатной температуре, а затем проводили выделение по способу,описанному в примере 4. Получали: 0,80 г, 85,0%; Rf (A) 0,35; MH+ 758. 1 в которой R представляет СОН или СН(ОСН 3)2,R1 и R2 означают Н или ацетил, R3 означает Н или ОН, R4 означает N(СН 3)2 или N-O(СН 3)2, А представляет карбонильную группу (С=O) или СН, линияпредставляет простую или двойную связь, линияпредставляет или двойную или простую связь и линия представляет двойную или простую связь,при условии, что когда А представляет CH,в положении 2, 3 представляет двойную связь и R1 и R2 не являются ацетилом. 2. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2, R1 иN(СН 3)2, А означает карбонильную группу, линииипредставляют двойные связи и линия представляет простую связь. 3. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2, R1 иN(СН 3)2, А означает карбонильную группу или отсутствует, линииипредставляют двойные связи и линия представляет простую связь. 4. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2, R1,R2 и R3 означают Н, R4 означает N(СН 3)2, А означает карбонильную группу, линииипредставляют двойные связи и линия представляет простую связь. 5. Соединение формулы I по п.1, отличающееся тем, что R представляет СНО, R1, R2 и R3 означают Н, R4 означает N(СН 3)2, А означает карбонильную группу, линииипредставляют двойную связь и линия представляет простую связь. 6. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2, R1 иN-O(СН 3)2, А означает карбонильную группу,линияпредставляет двойную связь, линияпредставляет и линия представляет простую связь. 10. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2,R1 и R3 означают Н, R2 означает ацетил, R4 означает N-O(СН 3)2, А означает карбонильную группу, линияпредставляет двойную связь,линияпредставляет и линия представляет простую связь. 11. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2,R1, R2 и R3 означают Н, R4 означает N-O(СН 3)2,А означает карбонильную группу, линия представляет двойную связь, линияпредстав 16 ляет и линия представляет простую связь. 12. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2,R1, R2 и R3 означают Н, R4 означает N(СН 3)2, А означает карбонильную группу, линияпредставляет простую связь, линияпредставляет и линия представляет простую связь. 13. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2,R1 и R3 означают Н, R2 означает ацетил, R4 означает N(СН 3)2, А означает карбонильную группу, линияпредставляет простую связь, линияпредставляет и линия представляет простую связь. 14. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2,R1 и R2 означают Н, R3 означает ОН, R4 означаетN(СН 3)2, А означает карбонильную группу, линииипредставляют простые связи и линия представляет простую связь. 15. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2,R1, R2 и R3 означает Н, R4 означает N-O(СН 3)2, А представляет СН, линияпредставляет двойную связь, линияпредставляет и линия представляет простую связь в положении 11, 12 и двойную связь в положении 2, 3. 16. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2,R1, R2 означают Н и R3 означает ОН, R4 означаетN(СН 3)2, А представляет СН, линииипредставляют простые связи и линия представляет двойную связь. 17. Соединение формулы I по п.1, отличающееся тем, что R представляет СН(ОСН 3)2,R1, R2 и R3 означают Н, R4 означает N(CH3)2, А представляет СН, линии ,и представляют простую связь в положении 11, 12 и двойную связь в положении 2, 3. 18. Соединение формулы I по п.1, отличающееся тем, что R представляет СНО, R1, R2 иR3 означают Н, R4 означает N(СН 3)2, А представляет СН, линии ,и представляют простую связь в положении 11, 12 и двойную связь в положении 2, 3.
МПК / Метки
МПК: C07H 17/08, A61K 31/70, A61P 31/04
Метки: производные, 3-деоксидесмикозина
Код ссылки
<a href="https://eas.patents.su/9-4059-proizvodnye-3-deoksidesmikozina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3-деоксидесмикозина</a>
Предыдущий патент: Синтетические пептиды, обладающие поверхностной активностью, и их применение для приготовления синтетического сурфактанта
Случайный патент: Мускариновые агонисты












