Способ синтеза ингибиторов циклооксигеназы-2
Номер патента: 2975
Опубликовано: 26.12.2002
Авторы: Корли Эдвард Г., Россен Кай, Ларсен Роберт Д., Пай Филип Дж., Дэвис Ян В.
Формула / Реферат
1. Способ синтеза соединения формулы I
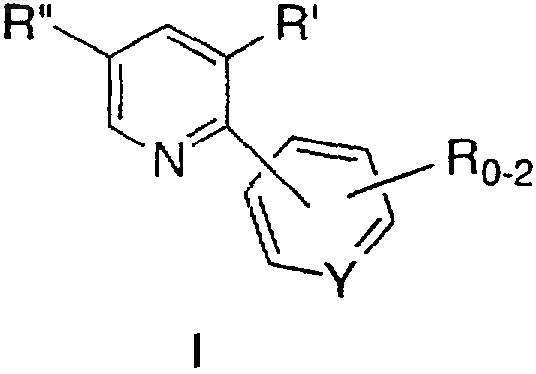
в которой присутствует 0-2 группы R;
каждый из R, R' независимо представляет C1-10-алкил, С6-10-арил, аралкил, галоген,
-S(O)mH, -S(O)mC1-6-алкил, -S(О)m-арил, нитро, амино, C1-6-алкиламино, ди-С1-6-алкиламино, -S(O)mNH2, -S(О)mNH-C1-6-алкил, -S(О)mNHC(О)СF3 и циано, причем алкильная и арильная группы и алкильная и арильная части аралкила, -S(О)m-C1-6-алкила, -S(О)m-арила, C1-6-алкиламино, ди-С1-6-алкиламино и -S(О)mNH-C1-6-алкила необязательно замещены 1-3 группами, выбранными из C1-4-алкила, арила, галогена, гидроксила, -S(O)mН, -S(О)mC1-6-алкила, -CN, C1-6-алкокси, амино, C1-6-алкилами-но, ди-С1-6-алкиламино, -S(O)mNH2, -S(О)mNH-C1-6-алкила,
-S(O)mNHC(О)СF3 и арилокси;
R"' представляет C1-10-алкил, галоген;
Y представляет N и
m равно 0, 1 или 2,
включающий взаимодействие соединения формулы II
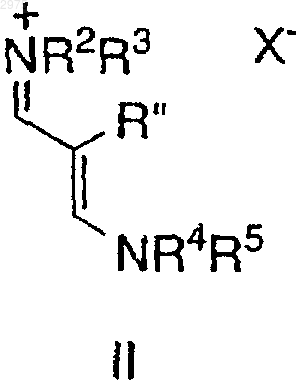
в которой R2-R5, каждый независимо, представляет C1-6-алкил, арил или аралкил и
Х- представляет подходящий противоион,
с соединением формулы III
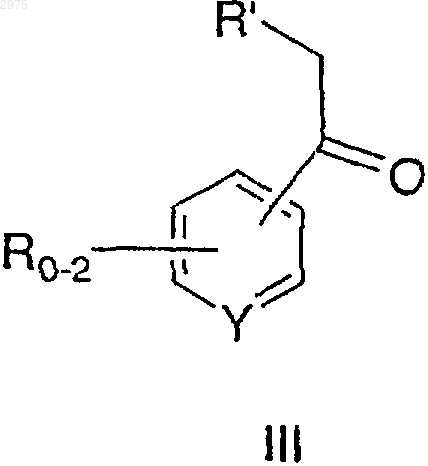
в которой R, R' и Y имеют значения, определенные ранее,
в присутствии основания с образованием соединения формулы I.
2. Способ по п.1, в котором получают соединение формулы I'

в которой R, R' и Y имеют значения, определенные ранее, способ включает взаимодействие соединения формулы II
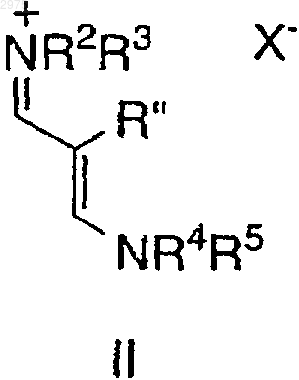
в которой R2-R5 и Х- имеют значения, определенные ранее, с соединением формулы III'
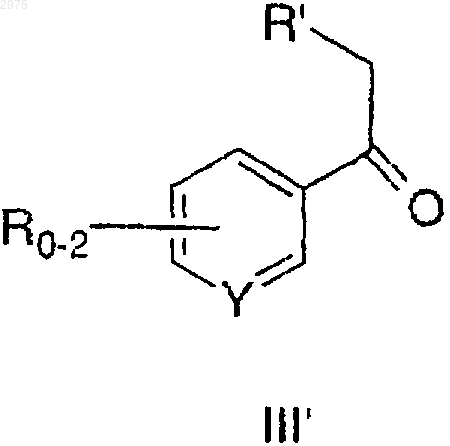
в присутствии основания с образованием соединения формулы I'.
3. Способ по п.1, в котором присутствует одна группа R и представляет C1-10-алкил, С6-10-арил, аралкил, галоген, -S(O)mН, -S(О)m-C1-6-алкил, -S(О)m-аралкил, -S(О)m-арил, нитро или циано.
4. Способ по п.3, в котором присутствует одна группа R и представляет C1-10-алкил.
5. Способ по п.4, в котором присутствует одна группа R, которая представляет метил.
6. Способ по п.2, в котором присутствует одна группа R и представляет метил, присоединенный следующим образом
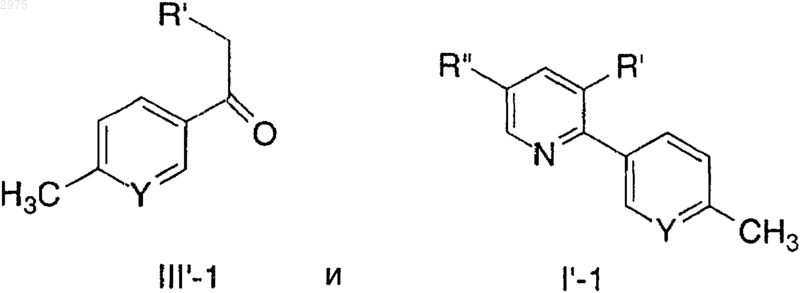
7. Способ по п.1, в котором R' представляет C6-10-арил, замещенный группой -S(О)m-С1-6-алкил.
8. Способ по п.7, в котором R' представляет фенил, замещенный метансульфонилом в положении 4'.
9. Способ по п.8, в котором R" представляет галоген.
10. Способ по п.9, в котором R" представляет хлор.
11. Способ по п.1, в котором группы R2-R5 представляют C1-6-алкил.
12. Способ по п.11, в котором группы R2-R5 представляют метил.
13. Способ по п.1, в котором Х- представляет противоион, выбранный из группы, состоящей из фосфатов; сульфатов; ацетатов; перхлората; боратов; антимонатов; галогенидов; бензоата и напсилата.
14. Способ по п.13, в котором Х- представляет противоион, выбранный из группы, состоящей из гексафторфосфата; сульфата; мезилата; тозилата; трифлата; ацетата; трифторацетата; перхлората; тетрафторбората; тетрафенилбората; гексафторантимоната; хлорида; бромида; фторида; иодида; бензоата и напсилата.
15. Способ по п.14, в котором Х- представляет гексафторфосфат.
16. Способ по п.14, в котором Х- представляет галогенид.
17. Способ по п.16, в котором галогенид представляет хлорид.
18. Способ по п.1, в котором основание выбирают из группы, состоящей из гидроксида Na и K; карбоната Cs; C1-6-алкоксидов Li, Na и K; амидов Li, Na и K и гидридов Li, Na и K.
19. Способ по п.18, в котором основание выбирают из группы, состоящей из изопропоксида лития, трет-бутоксида калия, LHDMS, NaHMDS, LDA и NaH.
20. Соединение, имеющее структурную формулу
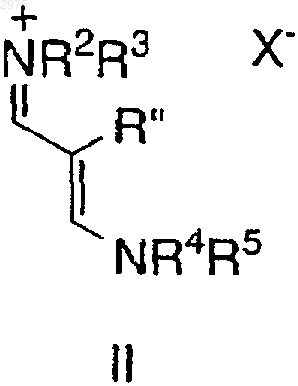
в которой R2-R5, каждый независимо, представляет C1-6-алкил, арил или аралкил,
R'" независимо представляет C1-10-алкил, галоген;
Х- представляет противоион, выбранный из группы, состоящей из гексафторфосфата, тетрафторбората, тетрафенилбората и гексафторантимоната.
21. Соединение по п.20, представленное структурной формулой II-а
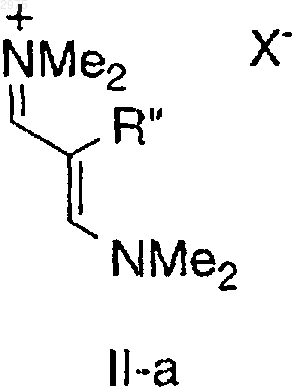
в которой R" независимо представляет C1-10-алкил, галоген и Х- представляет гексафторфосфат.
22. Соединение по п.21, в котором R" представляет галоген.
23. Соединение по п.22, в котором галоген представляет хлор.
Текст
1 Данное изобретение относится к способу синтеза некоторых соединений, ингибирующих СОХ-2. Дополнительно включены некоторые промежуточные продукты синтеза. Циклооксигеназа-2 (СОХ-2) является ферментом, который причастен к боли, воспалению,индуцированным гормонами сокращениям матки и росту некоторых типов раковых заболеваний. До недавнего времени была охарактеризована только одна форма циклооксигеназы, она соответствует циклооксигеназе-1 или конститутивному ферменту, первоначально идентифицированному в бычьих семенных пузырьках. Недавно был клонирован, секвенирован и охарактеризован ген еще одной индуцируемой формы циклооксигеназы (циклооксигеназа-2) из птичьих, мышиных и человеческих источников. Этот фермент отличается от циклооксигеназы-1. СОХ-2 быстро и легко индуцируется различными агентами, в том числе митогенами, эндотоксином, гормонами, цитокинами и факторами роста. В то время как конститутивный фермент,циклооксигеназа-1, ответственен большей частью за эндогенную базальную секрецию простагландинов и, исходя из этого, играет важную роль в их физиологических функциях, таких как поддержание желудочно-кишечной целостности и почечного кровотока, индуцируемая форма,циклооксигеназа-2, главным образом, ответственна за патологические действия простагландинов, когда быстрое индуцирование этого фермента происходит в ответ на такие агенты,как воспалительные агенты, гормоны, факторы роста и цитокины. Таким образом, селективный ингибитор циклооксигеназы-2 будет снижать лихорадку, ингибировать воспалительный процесс, противодействовать индуцируемым гормонами сокращениям матки и обладать сильным противораковым действием, наряду с пониженной способностью вызывать некоторые основанные на этом механизме побочные действия. Одной целью данного изобретения является предоставление схемы синтеза ингибирующих СОХ-2 соединений, в которой используют пониженные температуры при синтезе. Еще одной целью изобретения является использование синтетического пути, который обеспечивает высокие выходы. Следующей целью данного изобретения является предоставление синтетической схемы,которая использует минимум стадий способа. Эти и другие цели будут понятны обычному специалисту в данной области из содержащейся в данном описании информации. Краткое изложение сущности изобретения Описывается способ синтеза соединений формулы Im равно 0, 1 или 2, включающий взаимодействие соединения формулы II в которой R2-R5, каждый независимо, представляет C1-6-алкил, арил или аралкил и X- представляет подходящий противоион, с соединением формулы III в которой R, R' и Y имеют определенные ранее значения,в присутствии основания с получением соединения формулы I. Включаются также некоторые промежуточные соединения. Подробное описание изобретения Изобретение описывается подробно с использованием терминов, определяемых ниже,если не оговорено иное. Термин "алкил" относится к одновалентному, образованному из алкана (углеводорода) радикалу, содержащему от 1 до 15 атомов углерода, если не оговорено иное. Он может быть прямым, разветвленным или циклическим. Предпочтительные неразветвленный или разветвленные алкильные группы включают метил,этил, пропил, изопропил, бутил и трет-бутил. Предпочтительные циклоалкильные группы включают циклопентил и циклогексил. Алкил включает также неразветвленную или разветвленную алкильную группу, которая содержит или прерывается циклоалкиленовой частью. Примеры ее включают следующие: где х плюс у = числу от 0 до 10 и w плюс z равно числу от 0 до 9. 3 Алкиленовая и одновалентная алкильная часть(и) алкильной группы может быть присоединена в любой доступной точке присоединения к циклоалкиленовой части. Когда присутствует замещенный алкил, он относится к неразветвленной, разветвленной или циклической алкильной группе, определенной выше, замещенной 1-3 группами, определенными в отношении каждой переменной. Термин "алкокси" относится к группам обозначенной длины или в неразветвленной,или в разветвленной конфигурации. Примерами таких алкоксигрупп являются метокси, этокси,пропокси, изопропокси, бутокси, изобутокси,трет-бутокси, пентокси, изопентокси, гексокси,изогексокси и тому подобное. Термин "галоген" включает фтор, хлор,бром и йод. Арил относится к ароматическим кольцам,например, фенилу, замещенному фенилу и подобным группам, а также к кольцам, которые сконденсированы, например, нафтилу. Арил,таким образом, содержит, по меньшей мере,одно кольцо, имеющее, по меньшей мере, 6 атомов, причем присутствует вплоть до двух таких колец, содержащих вплоть до 10 атомов с чередующимися (резонирующими) двойными связями между соседними атомами углерода. Предпочтительными арильными группами являются фенил и нафтил. Предпочтительные замещенные арилы включают фенил и нафтил,замещенные одной или двумя группами. Х- представляет подходящий противоион. Следовательно, промежуточные продукты формулы II являются формами солей, которые могут быть или могут не быть "фармацевтически приемлемыми", определенными ниже. Подгруппа значений X-, которые представляют особенный интерес, включает следующие: фосфаты, например гексафторфосфат и тому подобное; сульфаты; сульфонаты, например мезилат(метансульфонат), тозилат (толуолсульфонат),трифлат (трифторметилсульфонат) и тому подобное; ацетаты, например ацетат, трифторацетат и тому подобное; перхлорат; борат, например тетрафторборат, тетрафенилборат и тому подобное; антимонат, например гексафторантимонат; галогенид, например Cl, F, Вr и I; бензоат и напсилат. Предпочтительные значения Х-, которые используют в описанном здесь способе, выбраны из группы, состоящей из гексафторфосфата; галогенидов; сульфата; сульфонатов; трифторацетата; перхлората; тетрафторбората; тетрафенилбората и гексафторантимоната. Соли, охватываемые термином "фармацевтически приемлемые соли", относятся, по существу, к нетоксичным солям соединений, которые обычно получают взаимодействием свободного основания с подходящей органической или неорганической кислотой. Характерные представители солей включают следующие: ацетат, 002975 4 бензоат, галогениды; напсилат и фосфат/дифосфат. Предпочтительные значения Х-, которые имеют отношение к новым промежуточным продуктам, описанным здесь, включают гексафторфосфат, тетрафторборат, тетрафенилборат и гексафторантимонат. Соединения, используемые в данном изобретении, могут содержать один или несколько асимметричных атомов углерода и могут существовать в рацемической и оптически активных формах. Все эти соединения являются полезными в пределах объема данного изобретения. Когда соединение является хиральным, наряду со смесями энантиомеров включаются отдельные энантиомеры, по существу, свободные от другого энантиомера. Имеют место также полиморфы и гидраты указанных соединений. Соединения формулы I можно вводить в виде пероральных дозированных форм, таких как таблетки, капсулы (каждая включает готовые препаративные формы с регулируемым во времени высвобождением и длительным высвобождением активного ингредиента), пилюли,порошки, гранулы, эликсиры, настойки, суспензии, сиропы и эмульсии. Кроме того, их можно также вводить парентерально, например, с помощью внутривенной (в виде как болюса, так и инфузии), внутрибрюшинной, подкожной или внутримышечной инъекции. Используются следующие аббревиатуры:Me = метил,Et = этил,n-Рr, Рr = нормальный пропил,i-Pr = изопропил,n-Bu, Bu = нормальный бутил,i-Bu = изобутил,s-Bu = вторичный бутил,t-Bu = третичный бутил,с-Рr = циклопропил,с-Вu = циклобутил,с-Реn = циклопентил,с-Нех = циклогексил,Вn = бензил,ВОС, Воc = трет-бутилоксикарбонил,ВОР = гексафторфосфат бензотриазол-1 илокси-трис(диметиламино)фосфония,выч. = вычисленный,CBZ, Cbz = бензилоксикарбонил,CDI = N,N'-карбонилдиимидазол,DCC = дициклогексилкарбодиимид,DCM = дихлорметан,DIEA = диизопропилэтиламин,ДМФ = N,N-диметилформамид,DMAP = 4-диметиламинопиридин,DSC = N,N'-дисукцинимидилкарбонат,EDC = гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида,EI-MS = масс-спектроскопия с электронной ионизацией,EtOAc = этилацетат,EtOH = этанол, 5 экв. = эквивалент,FAB-MC = масс-спектрометрия с бомбардировкой быстрыми атомами,HMDS = бис(триметилсилил)амид,НОАс = уксусная кислота, НОВТ,HOBt = гидроксибензотриазол,ЖХВД = жидкостная хроматография высокого давления,KHMDS = бис(триметилсилил)амид калия,LAH = литийалюминийгидрид,LDA = диэтиламид лития,LHMDS = бис(триметилсилил)амид лития,МеОН = метанол,МФ = молекулярная формула,МГц = мегагерц,ЖХСД = жидкостная хроматография среднего давления,NMM = N-метилморфолин,ЯМР = ядерный магнитный резонанс,Ph = фенил,получ. = полученный,TFA = трифторуксусная кислота,ТГФ = тетрагидрофуран,ТСХ = тонкослойная хроматография,ТМС = триметилсилан. В одном аспекте изобретения описывается способ синтеза соединения формулы IY представляет С или N; и m равно 0, 1 или 2, включающий взаимодействие соединения формулы II в которой R2-R5, каждый независимо, представляет C1-6-алкил, арил или аралкил и Х- представляет подходящий противоион, с соединением формулы III в которой R, R1 и Y имеют значения, определенные ранее, в присутствии основания с образованием соединения формулы I. В предпочтительном аспекте изобретения описывается способ синтеза соединения формулы I' в которой присутствует 0-2 группы R; каждый из R, R' и R", независимо, представляет C1-10-алкил, С 6-10-арил, аралкил, галоген, -S(O)mH, -S(O)mC1-6-алкил, -S(O)m-арил,ди-С 1-6 нитро,амино,C1-6-алкиламино,алкиламино, -S(O)mNH2, -S(О)mNH-C1-6-алкил,-S(О)mNHC(О)СF3 и циано, причем алкильная и арильная группы и алкильная и арильная части аралкила, -S(O)m-С 1-6-алкила, -S(O)m-арила, C1-6 алкиламино, ди-С 1-6-алкиламино и -S(O)mNH-C1-6 алкила необязательно замещены 1-3 группами, выбранными из C1-4-алкила, арила, галогена, гидроксила, -S(O)mH, -S(O)mС 1-6-алкила, -CN, C1-6 алкокси,амино,C1-6-алкиламино,ди-С 1-6 алкиламино, -S(O)mNH2, -S(O)mNH-C1-6-aлкилa,-S(O)mNHC(O)CF3 и арилокси;Y представляет С или N; и m равно 0, 1 или 2, включающий взаимодействие соединения формулы II в которой R2-R5, каждый независимо, представляет C1-6-алкил, арил или аралкил и Х- представляет подходящий противоион, с соединением формулы III' в которой R, R1 и Y имеют значения, определенные ранее, в присутствии основания с образованием соединения формулы I'. Аспект изобретения, который представляет особый интерес, относится к способам, описанным выше, где присутствует одна группа R и представляет C1-10-алкил, С 6-10-арил, аралкил,галоген, -S(O)mH, -S(О)m-C1-6-алкил, -S(О)mаралкил, S(O)m-арил, нитро или циано. Более конкретно, способы, которые представляют особый интерес, относятся к способу,описанному выше, где присутствует один R и представляет C1-10-алкильную группу. Еще более конкретно, этот способ относится к способу,описанному выше, где присутствует один R, 7 который представляет метил. Наиболее предпочтительным является способ, который описывается выше, где присутствует один R и представляет метил, присоединенный следующим образом В пределах данной подгруппы все другие переменные имеют значения, определенные ранее. В еще одном аспекте, изобретение охватывает способ получения соединения формулы I, в которой Y представляет N. В пределах данной подгруппы все другие переменные имеют значения, как определенные ранее. В другом аспекте изобретения, который представляет особый интерес, способ включает соединение, в котором R' выбран из группы,состоящей из С 6-10-арила, замещенного -S(O)mС 1-6-алкилом. Более конкретно, данный способ включает соединение, в котором R' представляет фенил, замещенный метансульфонилом в положении 4', как показано ниже В пределах этой подгруппы все другие переменные имеют значения, определенные ранее. В следующем аспекте данного изобретения, который представляет особый интерес,способ включает соединение, в котором R" выбран из C1-10-алкила, C6-10-арила, аралкила, галогена, -S(O)mН, -S(O)m-С 1-С 6-алкила, нитро и циано. Более конкретно, изобретение, которое представляет интерес, относится к способу, гдеR" представляет галоген или С 6-10-арил. Еще более конкретно, R" представляет галоген, особенно хлор. В пределах данной подгруппы все другие переменные имеют значения, определенные ранее. В следующем аспекте изобретения способ использует соединение формулы II, в которойR2-R5 представляют C1-6-алкил и, особенно, метил. В пределах этой формулы все другие переменные имеют значения, определенные ранее. В следующем аспекте изобретения способ использует соединение формулы II, в которойX- представляет член, выбранный из группы,состоящей из гексафторфосфата, галогенида,сульфата, сульфоната, бората, трифторацетата или перхлората. Более конкретно, Х- представляет член, выбранный из гексафторфосфата,хлорида, сульфоната, выбранного из метан 002975 8 сульфоната, толуолсульфоната и трифторметилсульфоната, тетрафторбората и трифторацетата. В пределах этой формулы все другие переменные имеют значения, определенные первоначально. Используемый здесь термин "основание" относится к органическим и неорганическим основаниям, таким как гидроксид натрия или калия, карбонат цезия, алкоксидные основанияLi, Na или К, такие как изопропоксид натрия,калия или лития, трет-бутоксид натрия, калия или лития и тому подобное, амидные основанияLi, Na или К, такие как LHMDS, LDA и тому подобное, и гидридные основания Na, К или Li. Для целей данного описания реакции, если не оговорено иное, обычно проводят в растворителе, таком как бензол, хлорбензол, дихлорбензол, толуол и ксилол; простые эфирные растворители, такие как диэтиловый эфир, ди-нбутиловый и диизопентиловые эфиры, анизол; циклические простые эфиры, такие как тетрагидропиран, 4-метил-1,3-диоксан, дигидропиран, тетрагидрофурфурилметиловый эфир, этиловый эфир, 2-этокситетрагидрофуран и тетрагидрофуран (ТГФ); галогенуглеродные растворители, включающие моно- или дигалоген С 1-4-алкан, такой как дихлорметан; неразветвленные, разветвленные или циклические С 6-10 углеводородные растворители, включающие гексан; и азотсодержащие растворители, включающие N,N-диметилацетамид, N,N-диметилформамид (ДМФ), N-этилпирролидинон, Nметилпирролидинон и ацетонитрил. Предпочтительными растворителями являются спирт, ТГФ и ДМФ. В типичном случае реакцию проводят, по существу, в нереакционноспособном растворителе,например, тетрагидрофуране, диоксане, C1-6 алканоле, хлорбензоле, дихлорбензоле или ксилоле. Реакцию, на удивление, можно проводить,по существу, при комнатной температуре. Соединения формулы I полезны для ослабления боли, лихорадки и воспаления различных состояний, включающих ревматическую лихорадку, симптомы, связанные с гриппом или другими вирусными инфекциями, обычный насморк, боли нижней части спины и шеи, дисменорею, головную боль, зубную боль, напряжение и растяжение, миозит, невралгию, синовит,артрит, включая ревматоидный артрит, дегенеративную болезнь суставов (остеоартрит), подагру, анкилозирующий спондилоартрит, бурсит, ожоги, травмы после хирургических и зубных процедур. Кроме того, такие соединения могут ингибировать клеточные опухолевые преобразования и метастатический рост опухоли и, следовательно, могут использоваться при лечении раковых заболеваний. Соединения формулы I могут также быть полезны при лечении деменции, в том числе предстарческой и старческой деменции и, в частности, деменции, 9 связанной с болезнью Альгеймера (т.е. деменции Альцгеймера). Благодаря их высокой активности в отношении циклооксигена-2 (СОХ-2) и/или селективности относительно циклооксигеназы-2(СОХ-1), соединения формулы I полезны в качестве альтернативы другим нестероидным противовоспалительным лекарственным средствам(NSAID'S), особенно, когда такие нестероидные противовоспалительные лекарственные средства могут быть противопоказаны, например, пациентам с пептическими язвами, гастритом, региональным энтеритом, неспецифическим язвенным колитом, дивертикулитом или с повторяющимися желудочно-кишечными повреждениями; лекарственных средств для лечения желудочно-кишечных кровотечений, нарушений свертывания крови, включая анемию, такую как гипопротромбинемия, гемофилии или других проблем кровотечения (включая кровотечения,относящиеся к пониженной или ослабленной функции тромбоцитов); почечной болезни (т.е. ослабленной почечной функцией); лекарственных средств, предшествующих хирургической операции или приему антикоагулянтов, и лекарственных средств, восприимчивых к NSAIDиндуцированной астме. Данные соединения являются ингибиторами циклооксигеназы-2 и, тем самым, полезны для лечения опосредованных циклооксигеназой 2 заболеваний, перечисленных выше. Данная активность иллюстрируется их способностью ингибировать циклооксигеназу-2 селективно по сравнению с циклооксигеназой-1. В соответствии с этим, в одном испытании способность соединений данного изобретения лечить опосредованные циклооксигеназой заболевания может быть продемонстирована измерением количества простагландина E2 (ПРЕ 2), синтезированного в присутствии арахидоновой кислоты, циклооксигеназы-1 или циклооксигеназы-2 и соединения формулы I. Величины IC50 представляют концентрацию ингибитора, требуемую для возврата синтеза ПГЕ 2 до 50% от количества, получаемого по сравнению с неингибированным контролем. Для лечения любых этих опосредованных циклооксигеназой заболеваний соединения формулы I можно вводить перорально, местно,парентерально, путем ингаляционного спрея или ректально в виде дозированных единичных лекарственных готовых препаративных форм,содержащих общепринятые нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители. Используемый здесь термин"парентеральное введение" включает способы подкожных инъекций, внутривенной, внутримышечной, внутригрудинной инъекции или инфузии. Помимо лечения теплокровных животных, таких как мыши, крысы, лошади, крупный рогатый скот, овцы, собаки, кошки и т.д., со 002975 10 единение изобретения эффективно при лечении людей. Данный способ далее описывается в связи со следующей схемой. Схема I Обсуждаемый здесь процесс может быть описан в связи с приведенным выше общим описанием. Реактив Гриньяра а (0,1-3 М, 0,8-2 эквивалента) получают из соответствующего галогенида, например, Z представляет хлорид, и магния, в подходящем растворителе, таком как ТГФ, простой эфир, толуол или их смеси. Реактив Гриньяра добавляют к холодному раствору(от 0 до -78 С, предпочтительно от -10 до -30 С) амида b в подходящем растворителе, что приводит к образованию кетона III. Кетон III выделяют после водной обработки с помощью экстракции и кристаллизации. Обработка кетона III (0,05-2 М) подходящим основанием, например алкоксидом металла, в подходящем растворителе при температуре от около -78 до около 50 С, в типичном случае менее чем около 20 С, приводит к образованию энолятного промежуточного продукта (не показан). Энолят подвергают реакции с триметиниевой солью с образованием промежуточного продукта (не показан), который гасят в подходящую кислоту (0,05-10 М). Примером является уксусная соль. К смеси добавляют аммиак (в типичном случае в виде водного раствора) и смесь выдерживают при температуре от температуры окружающей среды до температуры дефлегмации в течение нескольких часов. Продукт выделяют экстракцией с использованием, например, простого эфира, этилацетата или метиленхлорида и кристаллизацией с образованием соединения формулы I. Изобретение далее иллюстрируется следующими неограничивающими его примерами,в которых, если не оговорено особо(i) все операции проводили при комнатной температуре или температуре окружающей среды, т.е. при температуре в диапазоне около 1825 С; выпаривание растворителя проводили при пониженном давлении (600-4000 паскалей: 4,530 мм Нg) с температурой бани вплоть до около 60 С; ход реакций контролировали тонкослойной хроматографией (ТСХ) или жидкостной хроматографией высокого давления (ЖХВД),время реакции приводится только для иллюстрации; полиморфизм может приводить к выделению материалов с различными точками плавления в некоторых получениях; структура и чистота всех конечных продуктов удостоверялась, по меньшей мере, одним из следующих способов: ТСХ, масс-спектрометрия, спектрометрия ядерного магнитного резонанса (ЯМР) или микроаналитические данные; когда они приведены, данные ЯМР даются в форме величин дельтадля основных диагностических протонов, данных в частях на миллион (м.д.) относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта, определяемых при 300 МГц или 400 МГц с использованием индикаторного растворителя; для вида сигнала используют общепринятые сокращения: с, синглет; д, дублет; т, триплет; м, мультиплет; шир.,широкий и т.д.; помимо этого "Аr" обозначает ароматический сигнал; химические символы имеют их обычные значения; используются также следующие сокращения: об. (объем), м.(150 мл) охлаждали до -10 С. В течение 2,5 ч добавляли изопропилмагнийхлорид (110 мл). Реакционную смесь выливали в водную уксусную кислоту (10% об., 126 мл) при 5 С. К смеси добавляли толуол (60 мл), затем слои разделяли. Водный слой экстрагировали толуолом (2 х 60 мл) и растворитель удаляли. Твердые примеси удаляли фильтрованием и фильтрат концентрировали, получая амид Вайнреба РЕ-1 в виде светло-оранжевого масла (24,2 г). Препаративный пример 2. Реакция Гриньяра 4-Тиометилбензилхлорид Магний Толуол Тетрагидрофуран Амид Вайнреба РЕ-1 12 и тетрагидрофурана (0,545 л, 6,73 моль) загружали в течение 3-4 ч. В дополнительную колбу загружали амид Вайнреба РЕ-1 (300 г, 1,66 моль) и толуол (1,7 л) и охлаждали до -20 С. Полученный выше раствор Гриньяра добавляли в течение 30 мин и смесь выдерживали в течение 1 ч. Реакционную смесь гасили добавлением 50% водной уксусной кислоты (0,5 л). Добавляли толуол (1 л) и воду (1 л) и слои разделяли. Водный слой экстрагировали толуолом (2 х 2 л). Объединенные органические экстракты экстрагировали разбавленной хлористо-вородной кислотой (1 х 2 л). К водному слою добавляли этилацетат и рН регулировали аммиаком (0,6 л). Фазы разделяли и водный слой экстрагировали этилацетатом (2 х 1,25 л). Объединенные экстракты концентрировали на роторном испарителе, получая РЕ-2 в виде светло-желтого твердого вещества (326,5 г). Препаративный пример 3. Окисление Кетосульфид РЕ-2 Метанол Вольфрамат натрия Вода Серная кислота (2 н) Пероксид водорода(2,70 л) нагревали при 55 С. Добавляли водный раствор вольфрамата натрия (6,0 г, 0,02 моль),затем в течение 1 ч добавляли пероксид водорода (380 мл). Добавляли воду (3 л) и смесь охлаждали до температуры окружающей среды, затем фильтровали. Твердые вещества промывали водой (2 л) и сушили в вакууме потоком азота,получая кетосульфон РЕ-3 (250,2 г) в виде бесцветного твердого вещества. Пример 1. Хлоруксусную кислоту (0,99 кг, 10,57 ммоль) добавляли к диметилформамиду (4,37 кг, 59,78 моль) и смесь нагревали до 75 С. В течение 5 ч добавляли оксихлорид фосфора(3,36 кг, 21,91 моль). Реакционную смесь выдерживали в течение 3 ч, затем охлаждали до температуры окружающей среды. Реакционную смесь и гидроксид натрия (19,7 кг) добавляли совместно в течение 2 ч к смеси воды (12 кг),60% по массе водной гексафторфосфорной кислоты (2,87 кг, 11,71 моль) и 4,7 н гидроксида натрия (2,3 кг) при 9 С. Реакционную колбу 13 промывали диметилформамидом (0,36 кг) и добавляли к продукту гашения. Смесь выдерживали в течение 40 мин, затем фильтровали. Сырое твердое вещество промывали водой (8,6 кг). Твердое вещество перекристаллизовывали из воды (10,8 кг) и изопропанола (3,8 кг) нагреванием до 67 С. Смесь охлаждали до 4 С и затем фильтровали. Твердое вещество промывали смесью вода/изопропанол (11 кг, 26:1) и сушили, получая целевое соединение 1 в виде желтого твердого вещества (2,28 кг). Пример 2.(617 г, 5,5 моль) в ТГФ (5,38 л, 5,38 моль) при 15 С. Добавляли соединение 1 (1,65 кг, 4,6 моль) и реакционную смесь выдерживали при температуре окружающей среды. Реакционную смесь переносили в раствор уксусной кислоты(2,0 л) в ТГФ (5 л) и смесь перемешивали в течение 1 ч. Добавляли концентрированный водный гидроксид аммония (4 л) и смесь нагревали при кипячении с обратным холодильником в течение 3 ч. Смесь охлаждали до 22 С и слои разделяли. Органический слой концентрировали до 3 л и добавляли изопропилацетат (5 л). Получаемый раствор снова концентрировали до 3-4 л и добавляли изопропилацетат (19 л). Раствор промывали насыщенным бикарбонатом натрия(2 х 9,5 л) и водой (2 х 9,5 л), концентрировали досуха и очищали, получая соединение 2 в виде твердого вещества (1,65 кг). Пример 3. Хлорацетилхлорид (14,50 г, 0,112 моль) добавляли к диметилформамиду (50 мл), и смесь нагревали до 75 С, получая прозрачный желтый раствор. Со скоростью 5 мл/ч добавляли оксихлорид фосфора (18,9 г, 0,123 моль). Реакционную смесь выдерживали в течение 3 ч, затем охлаждали до температуры окружающей среды. Реакционную смесь и 5 н гидроксид натрия (70 мл) добавляли совместно в течение 1 ч к смеси воды (200 мл) и гексафторфосфата натрия (21 г, 0,125 моль) при 9 С. Реакционную колбу промывали диметилформамидом (2 мл) и добавляли к продукту гашения. Смесь выдерживали в течение 40 мин, затем фильтровали. Сырое твердое вещество промывали водой(100 мл). Твердое вещество перекристаллизовывали из воды (224 мл) и изопропанола (56 мл) нагреванием до 70 С. Смесь охлаждали до 4 С,затем фильтровали. Твердое вещество промывали смесью вода/изопропанол (100 мл, 20:1) и сушили, получая CDT-фосфат в виде светложелтого твердого вещества (26,8 г). 14 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ синтеза соединения формулы Im равно 0, 1 или 2, включающий взаимодействие соединения формулы II в которой R2-R5, каждый независимо, представляет C1-6-алкил, арил или аралкил и Х- представляет подходящий противоион,с соединением формулы III в которой R, R' и Y имеют значения, определенные ранее,в присутствии основания с образованием соединения формулы I. 2. Способ по п.1, в котором получают соединение формулы I' в которой R, R' и Y имеют значения, определенные ранее, способ включает взаимодействие соединения формулы II в присутствии основания с образованием соединения формулы I'. 3. Способ по п.1, в котором присутствует одна группа R и представляет C1-10-алкил, С 6-10 арил, аралкил, галоген, -S(O)mН, -S(О)m-C1-6 алкил, -S(О)m-аралкил, -S(О)m-арил, нитро или циано. 4. Способ по п.3, в котором присутствует одна группа R и представляет C1-10-алкил. 5. Способ по п.4, в котором присутствует одна группа R, которая представляет метил. 6. Способ по п.2, в котором присутствует одна группа R и представляет метил, присоединенный следующим образом 16 бромида; фторида; иодида; бензоата и напсилата. 15. Способ по п.14, в котором Х- представляет гексафторфосфат. 16. Способ по п.14, в котором Х- представляет галогенид. 17. Способ по п.16, в котором галогенид представляет хлорид. 18. Способ по п.1, в котором основание выбирают из группы, состоящей из гидроксидаNa и К; карбоната Cs; C1-6-алкоксидов Li, Na и К; амидов Li, Na и К и гидридов Li, Na и К. 19. Способ по п.18, в котором основание выбирают из группы, состоящей из изопропоксида лития, трет-бутоксида калия, LHDMS,NaHMDS, LDA и NaH. 20. Соединение, имеющее структурную формулу в которой R2-R5, каждый независимо, представляет C1-6-алкил, арил или аралкил,R" независимо представляет C1-10-алкил,галоген; Х- представляет противоион, выбранный из группы, состоящей из гексафторфосфата, тетрафторбората, тетрафенилбората и гексафторантимоната. 21. Соединение по п.20, представленное структурной формулой II-а в которой R" независимо представляет C1-10-алкил,галоген и Х- представляет гексафторфосфат. 22. Соединение по п.21, в котором R" представляет галоген. 23. Соединение по п.22, в котором галоген представляет хлор.
МПК / Метки
МПК: C07D 211/00, A61K 31/44
Метки: способ, ингибиторов, синтеза, циклооксигеназы-2
Код ссылки
<a href="https://eas.patents.su/9-2975-sposob-sinteza-ingibitorov-ciklooksigenazy-2.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза ингибиторов циклооксигеназы-2</a>
Предыдущий патент: Свето- и термостойкий полиамид на основе капролактама, способ его получения и изделие, содержащее его
Следующий патент: Свето- и термостабильные полиамиды с повышенной устойчивостью к мокрым обработкам
Случайный патент: Способ и устройство для осушки газа













