Способ получения 3-арилокси, 4-арилфуран-2-онов, полезных в качестве ингибиторов циклооксигеназы-2
Формула / Реферат
1. Способ получения соединений формулы I
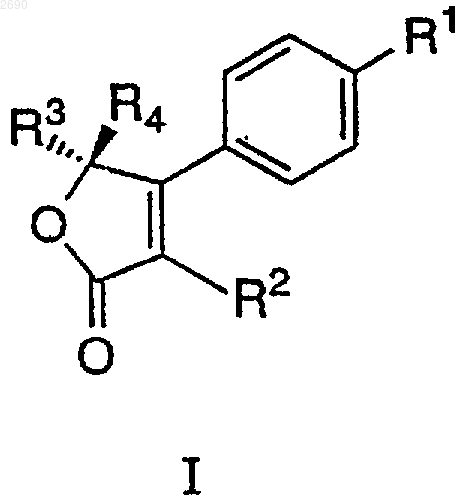
или их фармацевтических солей,
где R1 выбран из группы, состоящей из SСН3, -S(O)2СН3 и -S(O)2NH2;
R2 выбран из группы, состоящей из OR, моно- или дизамещенного фенила или пиридила, где заместители выбраны из группы, состоящей из метила, хлора и F;
R обозначает незамещенный или моно- или дизамещенный фенил или пиридил, где заместители выбраны из группы, состоящей из метила, хлора и F;
R3 обозначает Н, С1-4алкил, необязательно замещенный 1-3 группами из F, Cl или Вr, и
R4 обозначает Н, С1-4алкил, необязательно замещенный 1-3 группами из F, Cl или Вr, при условии, что R3 и R4 не являются одинаковыми, включающий стадии
(а) взаимодействия соединения формулы 3
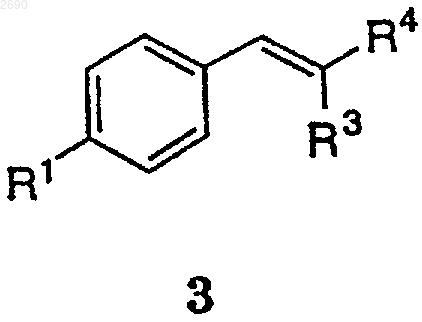
где R1, R3 и R4 описаны выше,
с первым лигандом, буфером основного характера, окислителем и, необязательно, с соокислителем, с получением соединения формулы 9
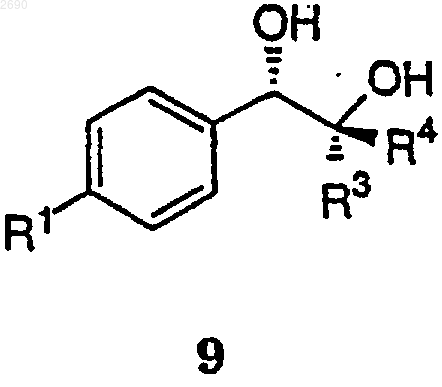
(b) окисления соединения формулы 9 окислителем, необязательно в присутствии первого основания, с получением соединения формулы 1

где R1, R3 и R4 описаны выше, и
(с) взаимодействия соединения формулы 1 с соединением формулы 2
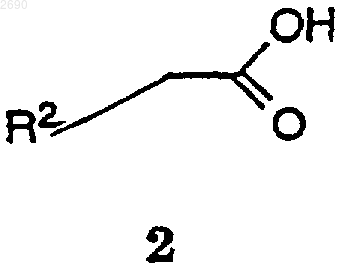
где R2 описаны выше, и
с активирующим агентом, необязательно с дегидратирующим агентом, подходящим катализатором и вторым основанием, с получением соединения формулы I.
2. Способ по п.1, где первый лиганд относится к группе, состоящей из (DHQD)2PHAL, (DHQD)2-DP-PHAL, (DHQD)2PYR, (DHQD)-PHN, (DHQD)2AQN, (DHQD)2DPP и (DHQD)-CLB, буфер основного характера относится к группе, состоящей из карбоната калия или натрия, окислителем является осмат калия и соокислитель относится к группе, состоящей из феррицианида калия и иода.
3. Способ по п.2, где первым лигандом является (DHQD)2-PHAL.
4. Способ по п.1, где первое основание относится к группе, состоящей из триэтиламина, трет-бутиламина и изопропиламина, окислителем является комплекс первого реагента, относящегося к группе, состоящей из диметилсульфоксида, хлорхромата пиридиния, бихромата пиридиния, фторхромата пиридиния и фторхромата пиридиния, и второго реагента, относящегося к группе, состоящей из оксалилхлорида, хлора и ацетилхлорида.
5. Способ по п.4, где первым основанием является триэтиламин и окислителем является диметилсульфоксид/оксалилхлорид.
6. Способ по п.1, где молярное отношение соединения формулы 9 к первому реагенту равно 1:4,0 или более и молярное отношение соединения формулы 9 ко второму реагенту равно 1:2,0 или более.
7. Способ по п.1, где ацилирующий агент принадлежит к группе, состоящей из мето-п-толуолсульфоната 1-циклогексил-3-(2-морфолиноэтил)карбодиимида, 1,3-дициклогексилкарбодиимида, 1-(3-диметиламинопропил)-3-этилкарбодиимида и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида, дегидратирующим агентом является изопропилтрифторацетат, катализатор принадлежит к группе, состоящей из 4-диметиламинопиридина и пиридина, и второе основание относится к группе, состоящей из 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU), 1,5-диазабицикло[4.3.0]нон-5-ена, триэтиламина, трет-бутиламина и изопропиламина.
8. Способ по п.1, где молярное отношение соединения формулы 1 к соединению формулы 2 равно 1:1 или более.
9. Способ получения соединения формулы 3
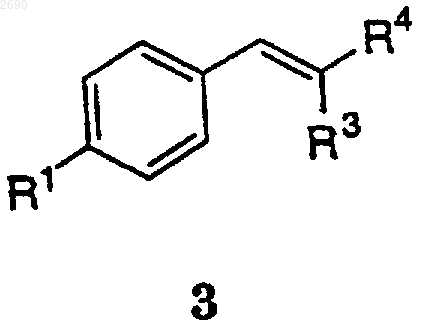
где R1 выбран из группы, состоящей из -SСН3 и -S(O)2СН3;
R3 обозначает Н, С1-4алкил, необязательно замещенный 1-3 группами из F, Cl или Вr, и
R4 обозначает Н, С1-4алкил, необязательно замещенный 1-3 группами из F, Cl или Вr, при условии, что R3 и R4 не являются одинаковыми, включающий
(а) взаимодействие соединения формулы 4
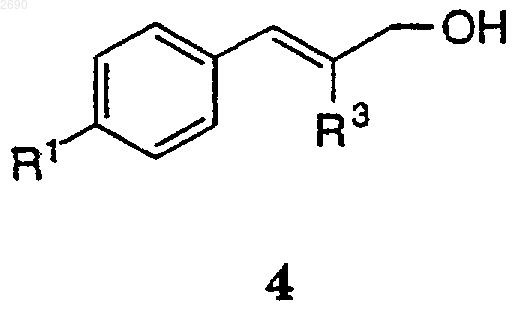
со стерически затрудненным основанием и ангидридом или галогенангидридом с получением соединения формулы 8
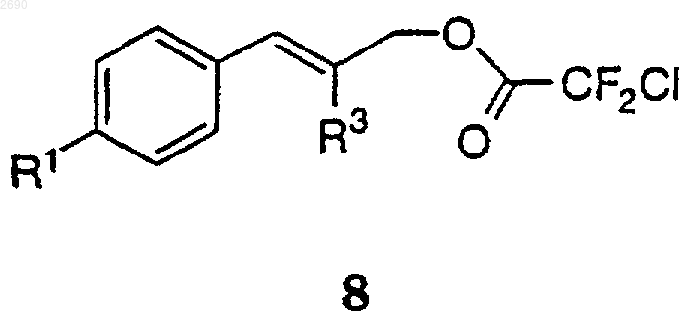
(b) взаимодействие без очистки соединения формулы 8 с фторидной солью и галогенидом металла, чтобы получить соединение формулы 3.
10. Способ по п.9, где стерически затрудненное основание относится к группе, состоящей из диизопропилэтиламина, C1-10алкилпиперидина и C1-10алкилпиридина, и ангидрид или галогенангидрид принадлежит к группе, состоящей из хлордифторуксусного ангидрида, уксусного ангидрида, хлорангидрида и бромангидрида.
11. Способ по п.10, где стерически затрудненным основанием является диизопропилэтиламин и гидридом является хлордифторуксусный ангидрид.
12. Способ по п.10, где фторидная соль принадлежит к группе, состоящей из фторида натрия, калия или лития, и галогенидом металла является иодид меди.
13. Способ по п.9, где молярное отношение соединения формулы 8 к галогениду металла обычно составляет 1:1 до 1:1,5.
14. Способ получения соединения формулы 3
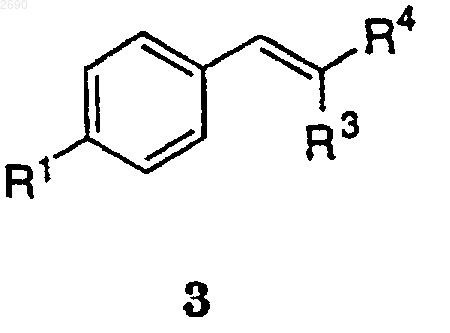
где R1 выбран из группы, состоящей из -S(O)2СН3 и -SСН3;
R3 обозначает Н, С1-4алкил, необязательно замещенный 1-3 группами из F, Cl или Вr, и
R4 обозначает Н, С1-4алкил, необязательно замещенный 1-3 группами из F, Cl или Вr, при условии, что R3 и R4 не являются одинаковыми, включающий
(а) взаимодействие соединения формулы 4
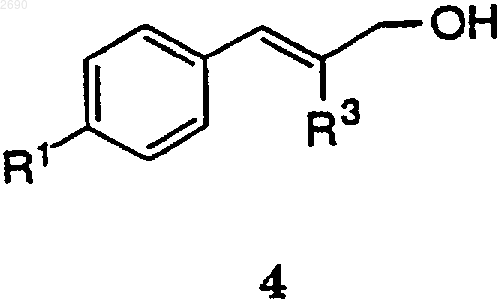
с имидазолом и галогенидом в присутствии трифенилфосфина, чтобы получить соединение формулы 7,
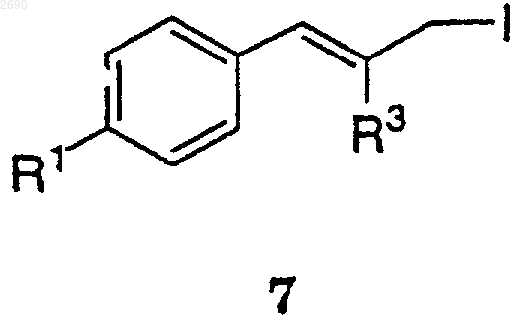
(b) взаимодействие соединения формулы 7 с алкилкупратом, чтобы получить соединение формулы 3.
15. Способ по п.14, где галогенидом является иод и алкилкупратом является трифторметилкупрат.
16. Способ получения соединения формулы 4
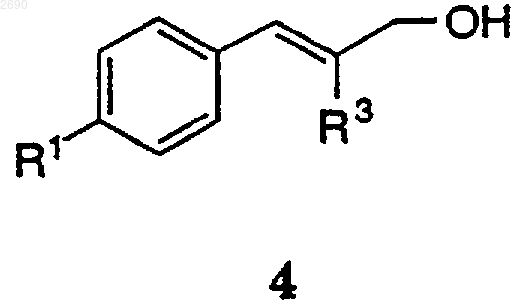
где R1 выбран из группы, состоящей SСН3 и -S(O)2СН3 и -S(O)2NH2; и
R3 обозначает Н, С1-4алкил, необязательно замещенный 1-3 группами из F, Cl или Вr, включающий
(а) взаимодействие соединения формулы 5
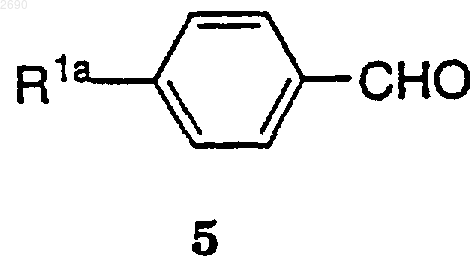
где R1a обозначает NH2SO2, -S(O)2СН3 и CH3S, с триэтил-2-фосфонопропионатом
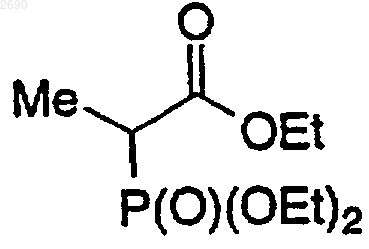
кислотой Льюиса, аминным основанием, с получением соединения формулы 6а

(b) взаимодействие соединения формулы 6а в C1-6алканольном растворителе в кислотных условиях с подходящим катализатором и окислителем с получением соединения формулы 6b
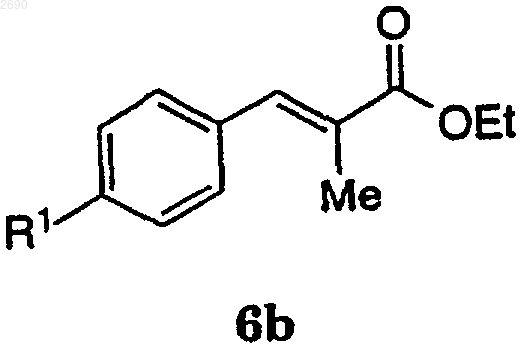
(с) взаимодействие соединения 6b с подходящим восстановителем, чтобы получить соединение формулы 4.
17. Способ по п.16, где аминное основание относится к группе, состоящей из триэтиламина, трет-бутиламина и изопропиламина, и кислотой Льюиса является галогенид магния, где галогенидом является бром, хлор или иод.
18. Способ по п.16, где C1-6алканол принадлежит к группе, состоящей из метанола, этанола, пропанола, изопропанола и пентанола, катализатором является вольфрамат натрия, кислотой является серная кислота, хлористо-водородная кислота или фумаровая кислота и окислителем является пероксид водорода или трет-бутилпероксид.
19. Способ по п.16, где восстановитель - гидрид диизобутилалюминия, лития алюмогидрид или диизопропилалюминий.
20. Способ по п.16, где восстановителем является гидрид диизобутилалюминия.
Текст
1 Предпосылки создания изобретения Изобретение относится к способу получения 3-арилокси, 4-арилфуран-2-онов, которые являются полезными в качестве ингибиторов циклооксигеназы-2 (СОХ-2). Такие соединения применимы в качестве противовоспалительных средств. Нестероидные противовоспалительные лекарства оказывают, в большинстве своем, противовоспалительное, обезболивающее и жаропонижающее действие и ингибируют гормонально-индуцированные сокращения матки и развитие некоторых типов рака посредством ингибирования простагландин-G/Н-синтазы,известной также как циклооксигеназа. Первоначально была известна только одна форма циклооксигеназы, она соответствует циклооксигеназе-1 (СОХ-1) или конститутивному ферменту,который обычно идентифицируют в бычьих семенных пузырьках. Позднее ген второй индуцируемой формы циклооксигеназы, циклооксигеназы-2 (СОХ-2), был клонирован из куриного,мышиного и человеческого материала, секвенирован и охарактеризован первоначально. Этот фермент отличается от COX-1, который был клонирован, секвенирован и охарактеризован из различных источников, включая овцу, мышь и человека. Вторая форма циклооксигеназы СОХ 2 является быстро и легко индуцируемой некоторыми агентами, включая митогены, эндотоксин, гормоны, цитокины и факторы роста. Так как простагландины играют как физиологические, так и патологические роли, заявитель пришел к заключению, что конститутивный фермент СОХ-1 ответствен в значительной мере за эндогенное основное выделение простагландинов и, следовательно, является важным для их физиологических функций, таких как сохранение целостности желудочно-кишечного тракта и почечного кровотока. В противоположность этому заявитель пришел к заключению, что индуцируемая форма СОХ-2 в основном ответственна за патологические эффекты простагландинов, когда быстрое индуцирование фермента,вероятно, происходит в ответ на такие агенты,как противовоспалительные средства, гормоны,факторы роста и цитокины. Таким образом, селективный ингибитор СОХ-2 будет иметь противовоспалительные, жаропонижающие и обезболивающие свойства, подобные свойствам обычного нестероидного противовоспалительного лекарства и, кроме того, вероятно, ингибировать гормоно-индуцируемые сокращения матки и иметь потенциальные противораковые эффекты, но будет иметь пониженную способность индуцировать некоторые из побочных эффектов, основанных на механизме действия. В частности, такое соединение должно иметь пониженную возможность желудочнокишечной токсичности, пониженную возможность почечных побочных эффектов, пониженное влияние на время кровоточивости и, воз 002690 2 можно, пониженную способность вызывать приступы астмы у чувствительных к аспирину астматиков. Более того, такое соединение будет также ингибировать простаноид-индуцируемое сокращение гладкой мускулатуры путем предотвращения синтеза вызывающих сокращение простаноидов и, следовательно, может быть использовано при лечении дисменореи, преждевременных родов, астмы и связанных с эозинофилами расстройств. Оно также будет полезным при лечении болезни Альцгеймера, для снижения потерь костной массы, особенно у женщин в постклимактерический период (т.е. для лечения остеопороза) и для лечения глаукомы. Краткое описание потенциальной полезности ингибиторов циклооксигеназы-2 дано в статье John Vane, Nature, Vol.367, pp.215-216, 1994 и в статье в Drug News and Perspectives, Vol.7,pp.501-512, 1994. Предложенные соединения и альтернативные способы получения соединений раскрыты в заявке РСТ СА 96/00682, поданной 10 сентября 1996 г., которая включена здесь в качестве ссылки. Краткое описание изобретения Описан способ получения 3-арилокси, 4 арилфуран-2-онов, которые полезны в качестве ингибиторов циклооксигеназы-2 (СОХ-2). Такие соединения полезны в качестве противовоспалительных агентов. Способ направлен на асимметричный синтез, который включает получение тризамещенных производных стирола реакцией Хорнера-Ведсворта-Эммонса и последующее в одном сосуде трифторметилирование аллилового спирта; получение -гидроксикетона с использованием асимметричного дигидроксилирования Шарплесса и окисления Сверна; эстерификацию -гидроксикетона феноксиуксусной кислотой и конденсацию Дайкмана полученного в результате сложного эфира. Подробное описание изобретения В одном аспекте изобретение касается способа получения соединений формулы I или их фармацевтических солей,где R1 выбран из группы, состоящей из SСН 3,-S(O)2 СН 3 и -S(O)2NH2;R2 выбран из группы, состоящей из OR,моно- или дизамещенного фенила или пиридила, где заместители выбраны иэ группы, состоящей из метила, хлора и F;R обозначает незамещенный или моноили дизамещенный фенил или пиридил, где заместители выбраны иэ группы, состоящей из метила, хлора и F; Четвертичный замещенный хиральный центр при С(5) существенно увеличивает сложность его синтеза. В этой заявке заявители описывают высокоэффективный асимметричный синтез (как поясняется на примере синтеза соединения 12 здесь ниже) наряду с открытием превращения в одном сосуде аллиловых спиртов в трифторметилированные соединения. Получение (Е)-аллиловых спиртов 4 а и 4b иллюстрируется схемой 1. Реакция ХорнераВедсворта-Эммонса альдегида 5 с триэтил-2 фосфонопропионатом в известных условиях дает ,-ненасыщенный сложный эфир 6 а. Окисление 6 а H2 О 2 в метаноле в присутствии каталитического количества Na2WO4 после разбавления водой дает кристаллическое вещество 6b. Оба 6 а и 6b восстанавливаются DIBAL-H в дихлорметане с получением соответствующих спиртов 4 а и 4b. Схема 1iii) DIBAL-H (2,5 экв.)/СН 2 Сl2, -78C. Пытаясь превратить аллиловый спирт 4b в соответствующее трифторметилированное соединение 3b, заявители вначале разработали модификацию процесса, предложенного Дюаном и сотрудниками (Схема 2). Смотри Duan, J.X., et al., J.Fluorine Chem., 1993, 61, р.279. Превращение 4b в 7 облегчают путем обработки 4b иодом в присутствии трифенилфосфина и имидазола в ацетонитриле при 0 С. Аллиловый иодид 7 изолируют после флеш-хроматографии. К сожалению, реакция сочетания 7 с алкилкупратом, таким как трифторметилкупрат, при 110120 С для получения производного стирола 3b 4 оказалась неэффективной. Необходимая хроматография для выделения как 7, так и 3b не позволяет рассматривать методику как полезную. Схема 2ii) ClCF2CO2Me/KF/CuI/DMF/90C. Подробное изучение реакции трифторметилирования показало, что сложный эфир 8b является одним из промежуточных соединений. Альтернативно промежуточное соединение 8b образуется в DMF (ДМФ) при обработке аллилового спирта 4b хлордифторуксусным ангидридом. При нагревании раствора с 1,1 экв. KF и 1 экв. CuI при 90 С в течение 1 ч чисто образуется желательный продукт 3b. В найденных заявителем оптимизированных условиях 3b эффективно выделяют. Подобным образом 4 а превращают в 3 а. Выбор основания является очень важен для реакции. Стерически затрудненные основания, такие как диизопропилэтиламин,дали наилучший результат. Кроме того, реакция наблюдается, даже когда используют столь малое количество, как приблизительно один эквивалент CuI. Этот способ составляет фактически одностадийный способ получения трифторметилированных соединений из аллиловых спиртов.ii) KF, CuI, 90C. Реакция асимметричного дигидроксилирования 3b коммерчески доступным реагентомAD-mix- и процедура, описанная Шарплессом,дают диол 9b. После интенсивных исследований по оптимизации условий реакции для улучшения энантиоселективности было найдено, что реакция наилучшим образом протекает в условиях, показанных в ур.2, с (DHQD)2PHAL в качестве лиганда. Реакция завершается в течение 5-6 ч с образованием 9b. Так как хиральный лиганд играет решающую роль в реакциях асимметричного дигидроксилирования, заявители также исследовали, может ли замена лиганда помочь в данной реакции. Наилучшим лигандом, значительно превосходящим остальные, 5 как показано в таблице,является(DHQD)2PHAL. При тех же условиях реакции асимметричное дигидроксилирование 3 а дает смесь 9 а, 9b и 9 с в соотношении 74:10:6 через 22 ч. Смесь после простой экстракции и удаления растворителя превращают в 9b обработкой ее Н 2 О 2 в метаноле в присутствии каталитического количества Na2WO4. Диол 9b обогащают до 98% (исключая ошибку) путем одноразовой перекристаллизации из смеси изопропилацетата и гексана. Таблица Асимметричное дигидроксилирование олефина 3b Продукт 9b, % ее Исходное Лиганд 1-Гидроксикетон 1 получают с оптимальным выходом окислением Сверна 9b при условии, что используют по меньшей мере 4 экв. окисляющих реагентов. Продукт кристаллизуют из толуола, чтобы получить аналитически чистое соединение 1. Превращение 1 и 3,4 дифторфеноксиуксусной кислоты 2 в 12 осуществляют в одном сосуде эстерификацией с использованием мето-п-толуолсульфоната 1 циклогексил-3-(2-морфолиноэтил)карбодиимида (CMC) и каталитического количества DMAP и последующей конденсации Dieckman, инициируемой DBU (схема 3). Обнаружено, что полная конверсия наблюдается, только когда используют изопропилтрифторацетат (1,2 экв.) в качестве агента, захватывающего воду. Продукт очищают перекристаллизацией в этаноле с получением оптически чистого соединения 12 из 1. Схема 3ii) 2/CMC/CH2Cl2/DMAP (10 мол.%) 4 ч,затем DBU (1,2 экв.)/СF3 СO2 СН(СН 3)2 (1,2 экв.) Таким образом, разработан практичный синтез ингибитора СОХ-2 12 с улучшенным общим выходом. Хроматография в способе не требуется. Одностадийное превращение аллиловых спиртов в трифторметилированные соединения обеспечивает эффективный усовершенствованный способ введения трифторметильной группы. Соответственно, изобретение схватывает способ получения соединений формулы I или их фармацевтических солей, гдеR2 выбран из группы, состоящей из OR,моно- или дизамещенного фенила или пиридила, где заместители выбраны из группы, состоящей из метила, хлора и F;R обозначает незамещенный или моноили дизамещенный фенил или пиридил, где заместители выбраны из группы, состоящей из метила, хлора и F;(а) взаимодействия соединения формулы 3 где R1, R3 и R4 описаны выше,с первым лигандом, буфером основного характера, окислителем и, необязательно, соокислителем, чтобы получить соединение формулы 9 Для целей этого изобретения первый лиганд будет включать (DHQD)2PHAL, (DHQD)2DP-PHAL,(DHQD)2PYR,(DHQD)-PHN,(DHQD)2AQN, (DHQD)2DPP и (DHQD)-CLB,предпочтительно (HDQD)2PHAL. Буфер основного характера будет включать карбонат калия или натрия; окислитель будет включать осмат калия, и соокислитель будет включать ферроцианид калия или иод. Обычно реакцию проводят в водном C1-6 алканоле, таком как третбутанол, изопропанол, метанол или пропанол в воде, предпочтительно трет-бутанол в воде. 7 Молярное отношение соединения формулы 3 к лиганду обычно равно 1:0,02-0,1. Молярное отношение соединения формулы 3 к окислителю обычно равно 1:1,5 или более [как понятно специалисту, "или более", как используется здесь, будет указывать, что второй названный член, такой как окислитель, в указанном выше случае может быть использован в количестве, превышающем названное количество. То есть в указанном выше случае молярное отношение соединения формулы 3 к окислителю может быть, например, 1:2 или 1:3]. Молярное отношение соединения формулы 3 к соокислителю обычно равно 1:1,5 или более. Буфер основного характера должен быть использован в таком количестве, чтобы обеспечить рН реакции при рН от 7 до 14, предпочтительно от 7 до 10. Реакции позволяют протекать при температуре от 0 до 25 С до практически полного ее завершения в течение 0,5-5 ч;(b) окисления соединения формулы 9 где R1, R3 и R4 описаны выше,окислителем и, необязательно, с первым основанием с получением соединения формулы 1 где R1, R3 и R4 описаны выше. Первое основание включает алкиламины,такие как триэтиламин, трет-бутиламин, изопропиламин и тому подобное, предпочтительно триэтиламин. Условия окисления должны включать условия, известные для превращения спирта в кетон, такие как окисление Сверна,окисление Des-Martin и тому подобное. Реакцию обычно проводят в нереакционноспособном растворителе, таком как бензол,толуол и ксилол; простые эфирные растворители, такие как простой диэтиловый эфир, простые ди-н-бутиловый и диизопентиловый эфиры, анизол, простые циклические эфиры, такие как тетрагидропиран, 4-метил-1,3-диоксан, дигидропиран, тетрагидрофурфуриловый, метиловый простой эфир, простой этиловый эфир, 2 этокситетрагидрофуран и тетрагидрофуран(THF); сложные эфирные растворители, включающие этил- и изопропилацетат; галогенуглеводородные растворители, включающие моноили дигалоген-С 1-4 алкил, такие как дихлорметан; C6-10 линейные, разветвленные или циклические углеводородные растворители, включающие гексан; и азотсодержащие растворители, включающие N,N-диметилацетамид, N,Nдиметилформамид (DMF), N-этилпирролидинон, N-метилпирролидинон и ацетонитрил. 8 Предпочтительными растворителями являются спирт, дихлорметан, THF и DMF. Молярное отношение соединения формулы 1 к первому реагенту обычно равно 1:4,0 или более. Молярное отношение соединения формулы 1 ко второму реагенту обычно равно 1:2,0 или более. Молярное отношение соединения формулы 1 к первому основанию обычно равно 1:5 или более. Реакции позволяют протекать при температуре от 0 до 25 С до ее практически полного завершения в течение 0,5-5 ч;(с) взаимодействия соединения формулы 1 где R2 описаны выше,активирующим агентом, необязательно с дегидратирующим агентом, подходящим катализатором и вторым основанием с получением соединения формулы I В данном описании активирующий агент включает CMC, 1,3-дициклогексилкарбодиимид(DCC), 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида(ЕDСl) и тому подобное, предпочтительно CMC. Дегидратирующий агент включает изопропилтрифторацетат. Подходящий катализатор включает 4 диметиламинопиридин (DMAP), пиридин или другие производные пиридина. Второе основание включает 1,8-диазабицикло [5.4.0]ундец-7 ен (DBU) 1,5-диазабицикло[4.3.0]-нон-5-ен или алкиламин, такой как триэтиламин, третбутиламин, изопропиламин и тому подобное. Для целей данного изобретения реакцию обычно проводят в нереакционноспособном растворителе, таком как бензол, толуол и ксилол; простые эфирные растворители, такие как простой диэтиловый эфир, простые ди-нбутиловый и диизопентиловый эфиры, анизол,простые циклические эфиры, такие как тетрагидропиран, 4-метил-1,3-диоксан, дигидропиран, тетрагидрофурфуриловый, метиловый простой эфир, простой этиловый эфир, 2 этокситетрагидрофуран и тетрагидрофуран(THF); сложные эфирные растворители, включающие этил- и изопропилацетат; галогенуглеводородные растворители, включающие моноили дигалоген-С 1-4 алкил, такие как дихлорме 9 тан; С 6-10 линейные, разветвленные или циклические углеводородные растворители, включающие гексан, и азотсодержащие растворители, включающие N,N-диметилацетамид, N,Nдиметилформамид (DMF), N-этилпирролидинон, N-метилпирролидинон и ацетонитрил. Предпочтительными растворителями являются спирт, дихлорметан, THF и DMF. Молярное отношение соединения формулы 1 к 2 обычно равно 1:1. Молярное отношение соединения формулы 1 ко второму дегидратирующему агенту обычно равно 1:1,3 или более. Молярное отношение соединения формулы 1 к катализатору обычно равно 1:0,1 или более. Реакции позволяют протекать при температуре от 0 до 25 С до практически полного ее завершения в течение 0,5-5 ч. Во втором аспекте изобретение относится к способу получения соединения формулы 3(а) взаимодействие соединения формулы 4 со стерически затрудненным основанием и ангидридом или галогенангидридом с получением соединения формулы 8 Стерически затрудненное основание включает диизопропилэтиламин, алкилпиперидин, алкилпиридин и тому подобное, предпочтительно диизопропилэтиламин. Ангидрид или галогенангидрид включает хлордифторуксусный ангидрид, уксусный ангидрид, хлорангидрид или бромангидрид и тому подобное, предпочтительно хлордифторуксусный ангидрид. Реакцию проводят, используя растворитель,такой как N,N-диметилформамид (DMF), N,Nдиметилацетамид(NMP) и тому подобное, предпочтительно DMF. Молярное отношение соединения формулы 4 к ангидриду или галогенангидриду обычно равно от 1:1 до 1:1,4. Молярное отношение соединения формулы 4 к затрудненному основанию обычно равно 1:2 до 1:2,5. Реакции позволяют протекать при температуре от 0 до 25 С практически до ее завершения в течение 0,5-5 ч.(b) взаимодействие без очистки соединения формулы 8 с фторидной солью и галогенидом металла с получением соединения формулы 3 Для целей этого изобретения фторидная соль включает фторид натрия, калия или лития,и галогенид металла включает иодид меди (I). Молярное отношение соединения формулы 8 к фторидной соли обычно равно от 1:1 до 1:1,4. Молярное отношение соединения формулы 8 к галогениду металла обычно равно 1:1 до 1:1,5. Реакции позволяют протекать при температуре от 0 до 25 С до практически полного ее завершения в течение 0,5-5 ч. В третьем аспекте изобретение относится к способу получения соединения формулы 3(а) взаимодействие соединения формулы 4 с имидазолом и галогенидом в присутствии трифенилфосфина с получением соединения формулы 7(b) взаимодействие соединения формулы 7 с алкилкупратом с получением соединения формулы 3. В четвертом аспекте изобретение относится к способу получения соединения формулы 4(а) взаимодействие соединения формулы 5 где R1a обозначает NH2SO2, -S(O)2 СН 3 и СН 3S,с триэтил-2-фосфонопропионатом, и подходящей кислотой Льюиса в аминном основании с получением соединения формулы 6 а Для целей этого изобретения аминное основание включает, но не ограничивается перечисленным, триэтиламин, трет-бутиламин, изопропиламин и тому подобное, предпочтительно триэтиламин; кислота Льюиса включает галогенид магния, где галогеном является бром, хлор,иод и тому подобное, предпочтительно бромид магния. Реакцию обычно проводят, используя растворитель, такой как бензол, толуол и ксилол; простые эфирные растворители, такие как простой диэтиловйй эфир, простые ди-н-бутиловый и диизопентиловый эфиры, анизол, простые циклические эфиры, такие как тетрагидропиран,4-мeтил-1,3-диоксан, дигидропиран, тетрагидрофурфуриловый, метиловый простой эфир,простой этиловый эфир, 2-этокситетрагидрофуран и тетрагидрофуран (THF); сложные эфирные растворители, включающие этил- и изопропилацетат; галогенуглеводородные растворители, включающие моно- или дигалоген-С 1-4 алкил,такие как дихлорметан; С 6-10 линейные, разветвленные или циклические углеводородные растворители, включающие гексан, и азотсодержащие растворители, включающие N,N-диметилацетамид, N,N-диметилформамид (DMF), Nэтилпирролидинон, N-метилпирролидинон и ацетонитрил. Предпочтительными растворителями являются спирт, дихлорметан, THF иDMF. Молярное отношение соединения формулы 5 к пропионату обычно равно 1:1 или более. Молярное отношение соединения формулы 5 к аминному основанию обычно равно 1:1 или более. Молярное отношение соединения формулы 5 к кислоте Льюиса обычно равно 1:1 или более. Реакции позволяют протекать при температуре от 0 до 25 С до практически полного ее завершения в течение 0,5-5 ч; в C1-6 алканольном растворителе и в кислотных условиях с подходящим катализатором и окислителем с получением соединения формулы 6b Для целей этого изобретения C1-6 алканол может включать метанол, этанол, пропанол,изопропанол, пентанол и тому подобное; а катализатор включает вольфрамат натрия. Кислотные условия могут быть обеспечены путем добавления кислоты, такой как серная кислота,хлористо-водородная кислота, фумаровая кислота и тому подобное; окислитель включает пероксид водорода, трет-бутил-гидропероксид или любой окислитель, известный в технике,который будет превращать сульфид в сульфон. Молярное отношение соединения формулы 6 а к окислителю обычно равно 1:1 или более. Молярное отношение соединения формулы 6 а к катализатору обычно равно 1:0,01 или более. Молярное отношение соединения формулы 6 а к кислоте обычно равно 1:0,01 или более. Реакции позволяют протекать при температуре от 0 до 25 С до практически полного ее завершения в течение 0,5-5 ч;(с) взаимодействие соединения формулы 6b с подходящим восстановителем с получением соединения формулы 4 Для целей этого изобретения восстановитель включает, но без ограничения перечисленным, гидрид диизобутилалюминия, смешанный гидрид лития и алюминия, гидрид диизопропилалюминия или какой-либо известный восстановитель, который будет восстанавливать сложный эфир до спирта. Реакцию обычно проводят, используя нереакционноспособный растворитель, такой как бензол, толуол и ксилол; простые эфирные растворители, такие как простой диэтиловый эфир,простые ди-н-бутиловый и диизопентиловый эфиры, анизол, простые циклические эфиры,такие как тетрагидропиран, 4-метил-1,3-диоксан, дигидропиран, тетрагидрофурфуриловый,метиловый простой эфир, простой этиловый эфир, 2-этокситетрагидрофуран и тетрагидрофуран (THF); сложные эфирные растворители,включающие этил- и изопропилацетат; галогенуглеводородные растворители, включающие моно- или дигалоген-С 1-4 алкил, такие как дихлорметан; С 6-10 линейные, разветвленные или циклические углеводородные растворители,включающие гексан, и азотсодержащие растворители, включающие N,N-диметилацетамид,N,N-диметилформамид (DMF), N-этилпирроли 13 динон, N-метилпирролидинон и ацетонитрил. Предпочтительными растворителями являются спирт, метиленхлорид, THF и DMF. Молярное отношение соединения формулы 6b к восстановителю обычно равно от 1:1 до 1:2,5 или более. Реакции позволяют протекать при температуре от 0 до 25 С до практически полного ее завершения в течение 0,5-5 ч. В данной заявке используемые аббревиатуры имеют следующие значения:THF - тетрагидрофуран Далее изобретение будет иллюстрировано следующими неограничивающими примерами,где, если не указано иначе,(i) все операции проводят при комнатной или окружающей температуре, то есть при температуре в пределах 18-25 С;(ii) испарение растворителя проводят, используя роторный испаритель, при пониженном давлении (600-4000 Паскаль: 4,5-30 мм рт.ст.) с температурой бани вплоть до 60 С;(iii) по ходу реакций проводят тонкослойную хроматографию (ТСХ) и времена реакций даны только для иллюстрации;(iv) температуры плавления не уточнены и"d" обозначает разложение; приведенные температуры плавления являются теми, которые достигнуты для материалов, полученных как описано; 14 полиморфизм может привести к выделению материалов с различными температурами плавления в некоторых препаратах;(v) структуру и чистоту конечных продуктов подтверждают, по меньшей мере, одной из следующих методик: ТСХ, масс-спектрометрия,спектрометрия ядерного магнитного резонанса(vi) выходы даны только для иллюстрации;(vii) когда указаны данные ЯМР, они приведены в форме дельтавеличин для основных диагностических протонов, представленных в миллионых долях (м.д.) по отношению к тетраметилсилану (TMS) в качестве внутреннего стандарта, определенных при 300 МГц или 400 МГц при использовании указанного растворителя; обычными аббревиатурами, используемыми для формы сигнала, являются: с. синглет; д. дублет; т. триплет; м. мультиплет; ш. широкий, и т.д.; в дополнение "Аr" обозначает ароматический сигнал;(viii) химические символы имеют их обычные значения; использованы также следующие аббревиатуры: об. (объем), маc. (масса), т.кип.(47 г, 0,19 моль) в ТГФ (200 мл) добавляют твердый эфират бромида магния (59 г, 0,23 моль) в токе азота. Через 5 мин добавляют триэтиламин (26,5 мл, 0,19 моль). Смесь перемешивают в течение 10 мин и добавляют (метилтио)бензальдегид (27,1 мл, 0,19 моль). После 15 ч при комнатной температуре смесь разбавляют водой (400 мл) и гексаном (400 мл). Два слоя разделяют. Органический слой промывают водой (400 мл), сушат над молекулярными ситами 4 ангстрема, фильтруют и концентрируют с получением 42,5 г (95%) сложного эфира 6 а в виде светло-желтого масла: ИК (чистый) 2980, 1705 и 1240 см-1; 1 Н ЯМР (CDCl3, 300 МГц)7,63 (1 Н), 7,33(1 М, 68 мкл) в метаноле (10 мл) добавляют по каплям 30% H2O2 (2,6 мл) при комнатной температуре в токе азота, поддерживая температуру при 38-45 С. Смесь выдерживают при температуре окружающей среды в течение 3 ч и охлаждают до 18 С. Сульфит натрия (20% водный раствор, 2,6 мл) добавляют медленно с внешним охлаждением, чтобы обеспечить температуру ниже 20 С. После выдерживания в течение 0,5 ч смесь разбавляют водой (20 мл) и фильтруют. Твердое вещество промывают водой (2 х 10 мл) и сушат в вакууме, чтобы получить 2,55 г 6b в виде светло-желтого твердого вещества: ИК (тонкая пленка) 1700 см-1; 1 К раствору сложного эфира 6b (34,8 г,0,13 моль) в дихлорметане (200 мл) добавляют неразбавленный DIBAL-H (57,8 мл, 0,33 моль) по каплям при -78 С в токе азота. Реакционную смесь перемешивают при -78 С дополнительно 1 ч и осторожно гасят метанолом (25 мл). После нагревания смеси до 0 С медленно добавляют насыщенный раствор NH4Cl (500 мл). Смесь выдерживают при температуре окружающей среды в течение 1 ч и фильтруют. Твердое вещество промывают дихлорметаном (2 х 300 мл). Фильтрат и промывную жидкость объединяют и разделяют два слоя. Водный слой экстрагируют дихлорметаном (150 мл). Объединенные органические растворы сушат над молекулярными ситами 4 ангстрема, фильтруют и концентрируют с получением 29,2 г (99%) 4b в виде белого твердого вещества: К раствору спирта 4b (11,30 г, 50 ммоль) и диизопропилэтиламина (21 мл, 0,12 моль) в ДМФ (50 мл) добавляют по каплям хлордифторуксусный ангидрид (11 мл, 60 ммоль) в токе азота с наружной охлаждающей баней, чтобы поддерживать температуру при 20-30 С. Через 5 мин добавляют фторид калия (3,5 г, 60 ммоль) и иодид меди (9,5 г, 50 ммоль). Смесь нагревают при 90 С в течение 1 ч, выливают в 100 г льда,экстрагируют этилацетатом (2 х 100 мл) и концентрируют. Остаток переносят в воронку, содержащую 250 г силикагеля, и элюируют 15% этилацетатом в гексане. Концентрирование элюента дает 10,3 г (74%) 3b в виде белого твердого вещества: ИК (тонкая пленка) 1600 и 1352 см-1; 1 К раствору сложного эфира 6 а (11,8 г, 50 ммоль) в дихлорметане (200 мл) добавляют неразбавленный DIBAL-H (22,3 мл, 0,125 моль) по каплям при -78 С в токе азота. Реакционную смесь перемешивают при -78 С дополнительно 1 ч и осторожно гасят метанолом (25 мл). После нагревания смеси до -40 С медленно добавляют насыщенный раствор NH4Cl (200 мл). Смесь выдерживают при температуре окружающей среды в течение 1 ч и два слоя (с некоторым количеством твердого алюминия) разделяют. Водный слой экстрагируют дихлорметаном(2 х 100 мл). Объединенные органические растворы сушат над молекулярными ситами 4 ангстрема, фильтруют и концентрируют, чтобы по 17 лучить 9,7 г (100%) 4 а в виде белого твердого вещества: т.пл. 76-77 С; ИК (тонкая пленка) 3500 и 1495 см-1; 1 К раствору спирта 4 а (9,5 г, 48,9 ммоль) и диизопропилэтиламина (20,5 мл, 0,12 моль) в ДМФ (100 мл) добавляют по каплям хлордифторуксусный ангидрид (10,8 мл, 58,7 ммоль) в токе азота с наружной охлаждающей баней,чтобы поддерживать температуру при 0-10 С. После нагревания до комнатной температуры добавляют фторид калия (3,5 г, 60 ммоль) и иодид меди (9,5 г, 50 ммоль). Смесь нагревают при 90 С в течение 1 ч, охлаждают до комнатной температуры, гасят льдом (100 г) и фильтруют через прокладку из солкафлока. Осадок промывают этилацетатом (3 х 100 мл). Фильтрат и промывные жидкости объединяют и два слоя разделяют. Органический слой промывают насыщенным раствором NH4Cl (2 х 50 мл) и концентрируют. Остаток переносят в 50 г силикагеля и продукт элюируют гексаном. Концентрирование элюента дает 7,3 г (61%) 3 а в виде светложелтого масла: ИК (неразбавленный) 1600 см-1; 1(DHQD)2PHAL (1,44 г, 1,76 ммоль) и дигидрат осмата калия (129 мг, 0,35 ммоль) растворяют в смеси воды (175 мл) и третбутилового спирта (175 мл) в токе азота. После перемешивания смеси при температуре окружающей среды в течение 1 ч добавляют карбонат калия (14,5 г, 105 ммоль) и феррицианид(III) калия (34,6 г, 105 ммоль). Температуру смеси доводят до 18-20 С и добавляют 3 а (8,62 г, 35 ммоль). Через 15 ч реакцию гасят сульфитом натрия (15 г) в воде (100 мл) и экстрагируют 18 этилацетатом (200 мл). Раствор этилацетата промывают солевым раствором (100 мл) и концентрируют. Остаток растворяют в метаноле (35 мл). Добавляют серную кислоту (1 М, 0,24 мл) и дигидрат вольфрамата калия (173 мг, 0,52 ммоль) с последующим медленным добавлением пероксида водорода (30% в воде, 7,3 мл),поддерживая температуру при 45-50 С. Спустя 3 ч смесь разбавляют водой (100 мл) и экстрагируют этилацетатом (3 х 100 мл). Объединенные экстракты промывают водой (100 мл) и концентрируют до сухости с получением 10,5 г сырого диола 9b в виде светло-желтого твердого вещества. Анализ SFC в этой точке указывает, что соединение составляет 82% ее. Сырой продукт растворяют в горячем IPAc (90 мл) и затем охлаждают до 23 С. Кристаллы (1,5 г, 12% ее,14,3% извлечение) собирают фильтрацией. Фильтрат разбавляют гексаном (конечное соотношение IPAc/гексан: 4/5) и кристаллы собирают фильтрацией с получением 7,6 г чистого 9b(98% ее, 72,4% извлечение) в виде белого твердого вещества: т.пл. 140,5-142,5 С; ИК (тонкая пленка) 3480 и 1380 см-1; 1(DHQD)2PHAL (0,82 г, 1 ммоль) и дигидрат осмата калия (73,7 мг, 0,20 ммоль) растворяют в смеси воды (100 мл) и трет-бутилового спирта (100 мл) в токе азота. После перемешивания смеси при температуре окружающей среды в течение 1 ч добавляют карбонат калия (8,3 г,60 ммоль) и феррицианид (III) калия (19,8 г,60 ммоль). Температуру смеси доводят до 1820 С и добавляют 3b (5,74 г, 20 ммоль). Через 7 ч реакцию гасят сульфитом натрия (15 г) в воде (100 мл) и экстрагируют этилацетатом(2 х 100 мл). Раствор этилацетата промывают солевым раствором (100 мл) и концентрируют досуха, чтобы получить 7,0 г сырого 9b (81,4%) в виде светло-желтого твердого вещества. Продукт очищают, как описано ранее, и он имеет точно такой же набор аналитических свойств,как и полученный из 3 а. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединений формулыI К раствору оксалилхлорида (0,36 мл,4,2 ммоль) в ТГФ (5 мл) добавляют безводный диметилсульфоксид (0,60 мл, 8,4 ммоль) при-78 С. Через 20 мин раствор 9b (0,62 г,2,0 ммоль) в ТГФ (2,5 мл) добавляют в течение более 20 мин. Через 2 ч смесь гасят триэтиламином (2,5 мл, 18 ммоль) и позволяют нагреваться до комнатной температуры свыше 1 ч. Добавляют воду (10 мл). Смесь экстрагируют этилацетатом (2 х 10 мл) и концентрируют. Остаток подвергают перекристаллизации из толуола(3 мл), чтобы получить 0,58 г соединения 1 в виде белого твердого вещества: т.пл. 101,5102,5 С; ИК (тонкая пленка) 3510 и 1690 см-1; 1 или их фармацевтических солей,где R1 выбран из группы, состоящей из SСН 3,-S(O)2 СН 3 и -S(O)2NH2;R2 выбран из группы, состоящей из OR,моно- или дизамещенного фенила или пиридила, где заместители выбраны из группы, состоящей из метила, хлора и F;R обозначает незамещенный или моноили дизамещенный фенил или пиридил, где заместители выбраны из группы, состоящей из метила, хлора и F;(а) взаимодействия соединения формулы 3 где R1, R3 и R4 описаны выше,с первым лигандом, буфером основного характера, окислителем и, необязательно, с соокислителем, с получением соединения формулы 9 К раствору соединения 1 (0,23 г,0,74 ммоль) и 2 (0,17 г, 0,90 ммоль) в метиленхлориде (5 мл) добавляют CMC (0,49 г, 1,1 ммоль). Затем через 1 ч добавляют изопропилтрифторацетат (0,13 мл, 0,89 ммоль) и DBU (0,14 мл,0,88 ммоль). Смесь перемешивают при комнатной температуре 3 ч и гасят водой (10 мл). Два слоя разделяют. Водный слой экстрагируют метиленхлоридом (5 мл). Объединенные органические растворы промывают 2 н. NaOH (10 мл) и водой (10 мл) сушат над молекулярными ситами 4 ангстрем, декантируют и концентрируют, чтобы получить 0,36 г твердого вещества(91 А% чистоты). Твердое вещество далее очищают перекристаллизации из абсолютного этанола (3 мл): т.пл. 140-141 С; ИК (тонкая пленка) 1775 и 1508 см-1; 1(b) окисления соединения формулы 9 окислителем, необязательно в присутствии первого основания, с получением соединения формулы 1(с) взаимодействия соединения формулы 1 с соединением формулы 2 21 с активирующим агентом, необязательно с дегидратирующим агентом, подходящим катализатором и вторым основанием, с получением соединения формулы I. 2. Способ по п.1, где первый лиганд относится к группе, состоящей из (DHQD)2PHAL,(DHQD)2-DP-PHAL, (DHQD)2PYR, (DHQD)PHN, (DHQD)2AQN, (DHQD)2DPP и (DHQD)CLB, буфер основного характера относится к группе, состоящей из карбоната калия или натрия, окислителем является осмат калия и соокислитель относится к группе, состоящей из феррицианида калия и иода. 3. Способ по п.2, где первым лигандом является (DHQD)2-PHAL. 4. Способ по п.1, где первое основание относится к группе, состоящей из триэтиламина,трет-бутиламина и изопропиламина, окислителем является комплекс первого реагента, относящегося к группе, состоящей из диметилсульфоксида, хлорхромата пиридиния, бихромата пиридиния, фторхромата пиридиния и фторхромата пиридиния, и второго реагента, относящегося к группе, состоящей из оксалилхлорида, хлора и ацетилхлорида. 5. Способ по п.4, где первым основанием является триэтиламин и окислителем является диметилсульфоксид/оксалилхлорид. 6. Способ по п.1, где молярное отношение соединения формулы 9 к первому реагенту равно 1:4,0 или более и молярное отношение соединения формулы 9 ко второму реагенту равно 1:2,0 или более. 7. Способ по п.1, где ацилирующий агент принадлежит к группе, состоящей из мето-птолуолсульфоната 1-циклогексил-3-(2-морфолиноэтил)карбодиимида, 1,3-дициклогексилкарбодиимида, 1-(3-диметиламинопропил)-3-этилкарбодиимида и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида, дегидратирующим агентом является изопропилтрифторацетат,катализатор принадлежит к группе, состоящей из 4-диметиламинопиридина и пиридина, и второе основание относится к группе, состоящей из 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU), 1,5 диазабицикло[4.3.0]нон-5-ена,триэтиламина,трет-бутиламина и изопропиламина. 8. Способ по п.1, где молярное отношение соединения формулы 1 к соединению формулы 2 равно 1:1 или более. 9. Способ получения соединения формулы 3(а) взаимодействие соединения формулы 4 со стерически затрудненным основанием и ангидридом или галогенангидридом с получением соединения формулы 8(b) взаимодействие без очистки соединения формулы 8 с фторидной солью и галогенидом металла, чтобы получить соединение формулы 3. 10. Способ по п.9, где стерически затрудненное основание относится к группе, состоящей из диизопропилэтиламина, C1-10 алкилпиперидина и C1-10 алкилпиридина, и ангидрид или галоген-ангидрид принадлежит к группе, состоящей из хлордифторуксусного ангидрида,уксусного ангидрида, хлорангидрида и бромангидрида. 11. Способ по п.10, где стерически затрудненным основанием является диизопропилэтиламин и гидридом является хлордифторуксусный ангидрид. 12. Способ по п.10, где фторидная соль принадлежит к группе, состоящей из фторида натрия, калия или лития, и галогенидом металла является иодид меди. 13. Способ по п.9, где молярное отношение соединения формулы 8 к галогениду металла обычно составляет 1:1 до 1:1,5. 14. Способ получения соединения формулы 3(а) взаимодействие соединения формулы 4 с имидазолом и галогенидом в присутствии трифенилфосфина, чтобы получить соединение формулы 7, 23(b) взаимодействие соединения формулы 7 с алкилкупратом, чтобы получить соединение формулы 3. 15. Способ по п.14, где галогенидом является иод и алкилкупратом является трифторметилкупрат. 16. Способ получения соединения формулы 4(а) взаимодействие соединения формулы 5 кислотой Льюиса, аминным основанием, с получением соединения формулы 6 а(b) взаимодействие соединения формулы 6 а в C1-6 алканольном растворителе в кислотных условиях с подходящим катализатором и окислителем с получением соединения формулы 6b(с) взаимодействие соединения 6b с подходящим восстановителем, чтобы получить соединение формулы 4. 17. Способ по п.16, где аминное основание относится к группе, состоящей из триэтиламина,трет-бутиламина и изопропиламина, и кислотой Льюиса является галогенид магния, где галогенидом является бром, хлор или иод. 18. Способ по п.16, где C1-6 алканол принадлежит к группе, состоящей из метанола, этанола, пропанола, изопропанола и пентанола,катализатором является вольфрамат натрия,кислотой является серная кислота, хлористоводородная кислота или фумаровая кислота и окислителем является пероксид водорода или трет-бутилпероксид. 19. Способ по п.16, где восстановитель гидрид диизобутилалюминия, лития алюмогидрид или диизопропилалюминий. 20. Способ по п.16, где восстановителем является гидрид диизобутилалюминия.
МПК / Метки
МПК: C07D 307/02
Метки: 4-арилфуран-2-онов, способ, полезных, циклооксигеназы-2, ингибиторов, 3-арилокси, качестве, получения
Код ссылки
<a href="https://eas.patents.su/13-2690-sposob-polucheniya-3-ariloksi-4-arilfuran-2-onov-poleznyh-v-kachestve-ingibitorov-ciklooksigenazy-2.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 3-арилокси, 4-арилфуран-2-онов, полезных в качестве ингибиторов циклооксигеназы-2</a>
Предыдущий патент: Способ лечения оппозиционного расстройства
Следующий патент: Диспергатор, снижающий осаждение побочных продуктов в коагуляционной ванне в производстве вискозных материалов
Случайный патент: Сельскохозяйственная система кондиционирования выбросов выхлопных газов












