Кристаллические полиморфы в, с и d 7-хлор-4-(пиперазин-1-ил)хинолина и способы их получения
Номер патента: 24202
Опубликовано: 31.08.2016
Авторы: Кастаньяни Роберто, Кабри Вальтер, Коланджели Винченцо, Кваттрочокки Джанандреа, Армароли Сильвия
Формула / Реферат
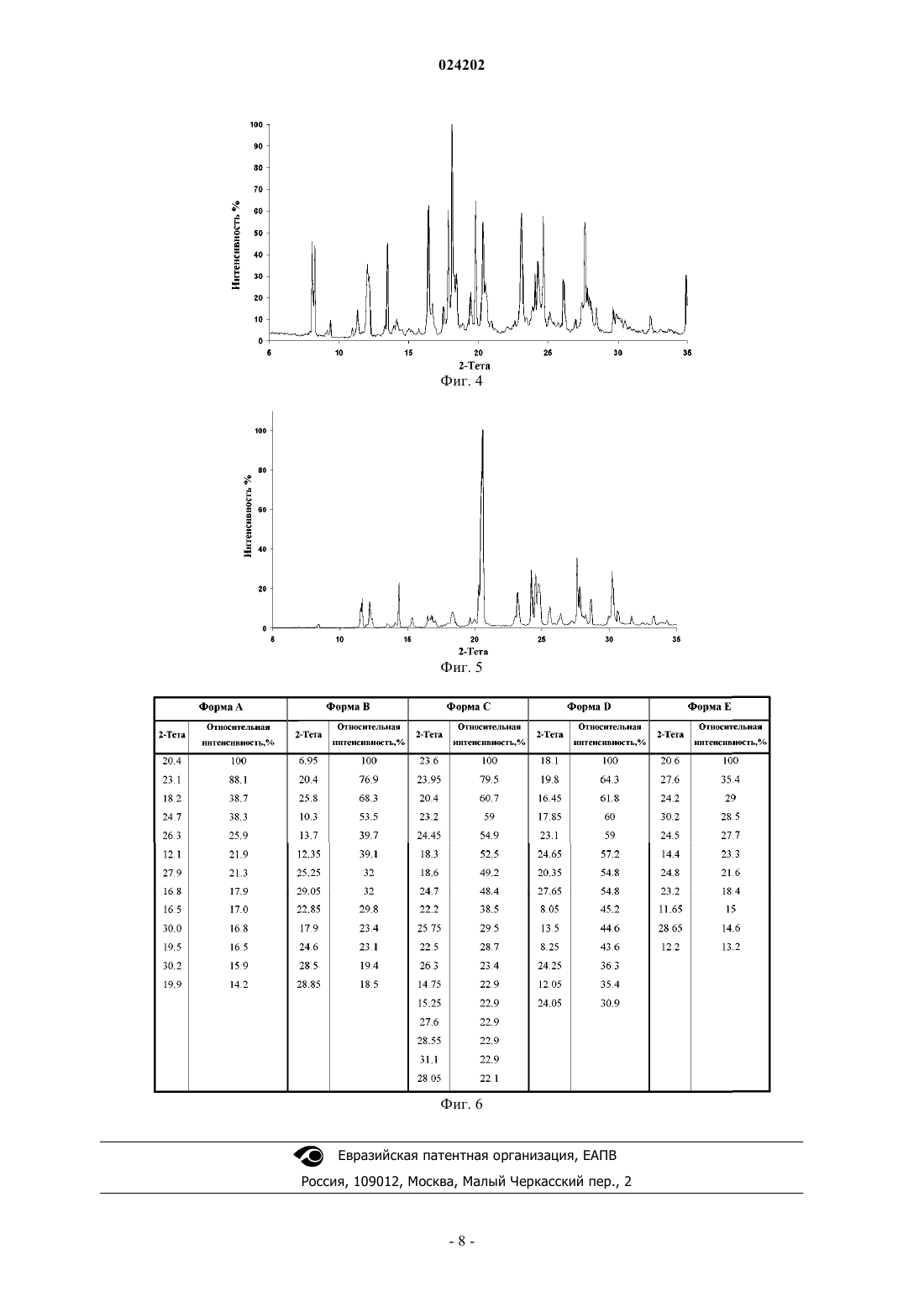
1. Кристаллический полиморф В 7-хлор-4-(пиперазин-1-ил)хинолина, порошковая рентгеновская дифрактограмма которого содержит по меньшей мере пять характеристических пиков при значениях углов 2q±0,1°, равных 6,95, 20,40, 25,80, 10,30 и 13,70°, а их интенсивность составляет по меньшей мере 30%.
2. Кристаллический полиморф В 7-хлор-4-(пиперазин-1-ил)хинолина по п.1, порошковая рентгеновская дифрактограмма которого дополнительно содержит следующие пики примерно при значениях углов 2q±0,1°, равных 12,35, 25,25, 29,05, 22,85, 17,9, 24,6, 28,5 и 28,85°.
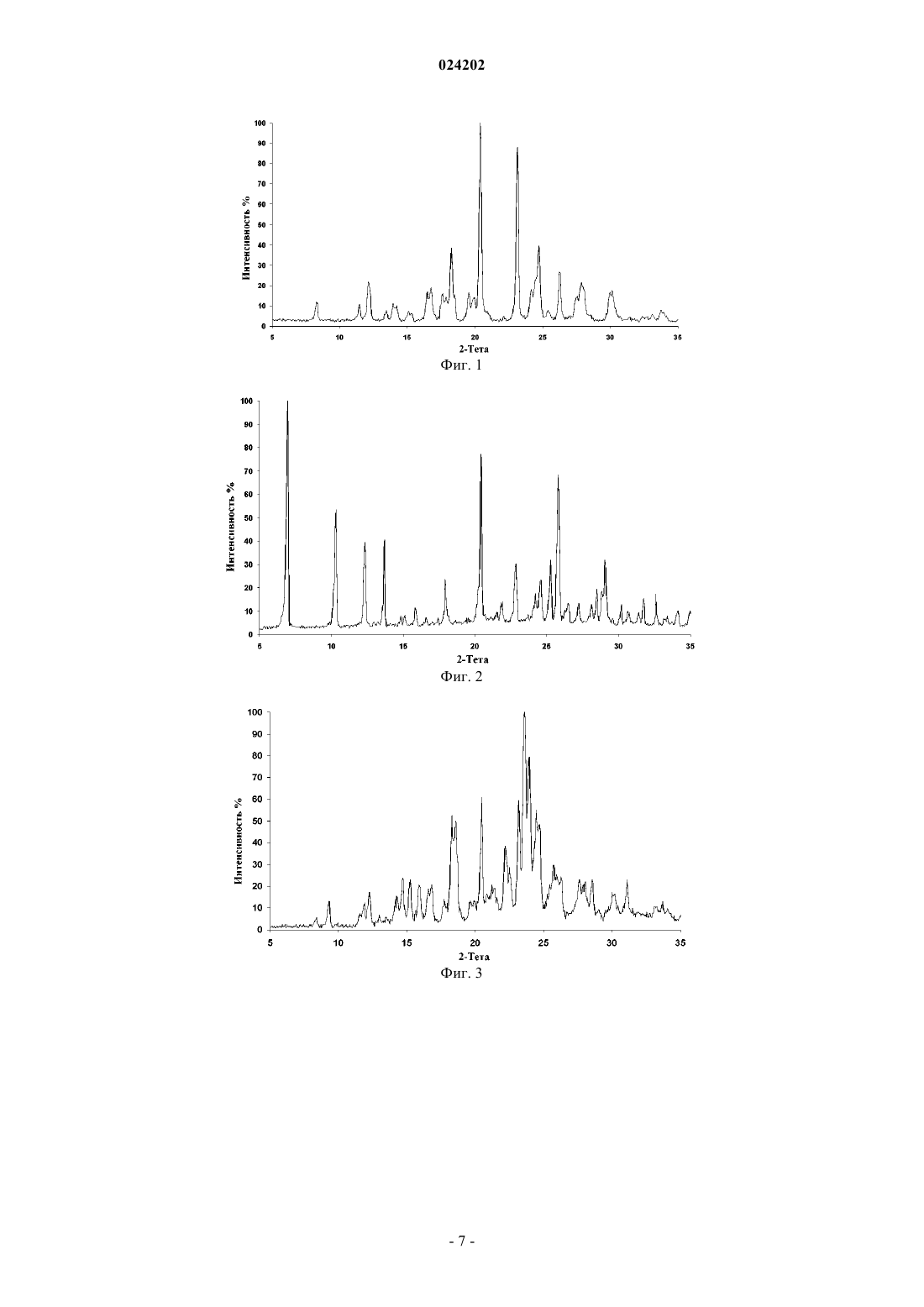
3. Кристаллический полиморф В 7-хлор-4-(пиперазин-1-ил)хинолина по п.1, характеризующийся рентгеновской дифрактограммой, по существу, идентичной приведенной на фиг. 2.
4. Способ получения полиморфа В 7-хлор-4-(пиперазин-1-ил)хинолина по п.1, включающий следующие стадии:
a) взаимодействие 4,7-дихлорхинолина с безводным пиперазином в полярном протонном растворителе в течение 6-10 ч при температуре обратной конденсации;
b) фильтрование суспензии, полученной на стадии а);
c) удаление растворителя при пониженном давлении и промывку полученного таким образом масла до тех пор, пока не произойдет кристаллизация;
d) промывку кристаллов, полученных на стадии с).
5. Способ по п.4, в котором количество эквивалентов пиперазина превышает количество 4,7-дихлорхинолина менее чем в 3 раза.
6. Способ по п.5, в котором количество эквивалентов пиперазина превышает количество 4,7-дихлорхинолина в 2,5 раза.
7. Способ по любому из пп.4-6, в котором полярный протонный растворитель на стадии а) представляет собой МеОН.
8. Кристаллический полиморф С 7-хлор-4-(пиперазин-1-ил)хинолина, порошковая рентгеновская дифрактограмма которого содержит следующие пики при значениях углов 2q±0,1°, равных 23,6, 23,95, 20,4, 23,2, 24,45, 18,3, 18,6, 24,7 и 22,2°, а их интенсивность составляет по меньшей мере 30%.
9. Кристаллический полиморф С 7-хлор-4-(пиперазин-1-ил)хинолина по п.8, порошковая рентгеновская дифрактограмма которого дополнительно содержит следующие пики примерно при значениях углов 2q±0,1°, равных 25,75, 22,5, 26,3, 14,75, 15,25, 27,6, 28,55, 31,1 и 28,05°.
10. Кристаллический полиморф С 7-хлор-4-(пиперазин-1-ил)хинолина по п.8, характеризующийся рентгеновской дифрактограммой, по существу, идентичной приведенной на фиг. 3.
11. Способ получения полиморфа С 7-хлор-4-(пиперазин-1-ил)хинолина по п.8, включающий следующие стадии:
a) взаимодействие 4,7-дихлорхинолина с безводным пиперазином в полярном протонном растворителе в течение 6-10 ч при температуре обратной конденсации;
b) фильтрование суспензии, полученной на стадии а);
c) удаление растворителя при пониженном давлении и промывку полученного таким образом масла до тех пор, пока не произойдет кристаллизация;
d) промывку кристаллов, полученных на стадии с);
e) растворение кристаллов, полученных на стадии d), в горячем гексане;
f) охлаждение раствора, полученного на стадии а), до комнатной температуры (КТ с обеспечением возможности протекания кристаллизации);
g) отфильтровывание кристаллов, полученных на стадии b).
12. Кристаллический полиморф D 7-хлор-4-(пиперазин-1-ил)хинолина, порошковая рентгеновская дифрактограмма которого содержит следующие пики при значениях углов 2q±0,1°, равных 18,1, 19,8, 16,45, 17,85, 23,1, 24,65, 20,35 и 27,65, а их интенсивность составляет по меньшей мере 30%.
13. Кристаллический полиморф D 7-хлор-4-(пиперазин-1-ил)хинолина по п.12, порошковая рентгеновская дифрактограмма которого дополнительно содержит следующие пики примерно при значениях углов 2q±0,1°, равных 8,05, 13,5, 8,25, 24,25, 12,05 и 24,05°.
14. Кристаллический полиморф D 7-хлор-4-(пиперазин-1-ил)хинолина по п.12, характеризующийся рентгеновской дифрактограммой, по существу, идентичной приведенной на фиг. 4.
15. Способ получения полиморфа D 7-хлор-4-(пиперазин-1-ил)хинолина по п.12, включающий следующие стадии:
a) взаимодействие 4,7-дихлорхинолина с безводным пиперазином в полярном протонном растворителе в течение 6-10 ч при температуре обратной конденсации;
b) фильтрование суспензии, полученной на стадии а);
c) удаление растворителя при пониженном давлении и промывка полученного таким образом масла до тех пор, пока не произойдет кристаллизация;
d) промывку кристаллов, полученных на стадии с);
e) растворение кристаллов, полученных на стадии d), в дихлорметане;
f) концентрирование раствора, полученного на стадии а), при пониженном давлении.
16. Применение кристаллического полиморфа 7-хлор-4-(пиперазин-1-ил)хинолина по одному из пп.1, 8, 12 в синтезе пиперахина или одной из его фармацевтически приемлемых солей.
Текст
Настоящее изобретение относится к кристаллическим полиморфам В, С, и D 7-хлор-4(пиперазин-1-ил)хинолина. Порошковая рентгеновская дифрактограмма полиморфа В содержит характеристические пики при значениях углов 20,1, равных 6,95, 20,40, 25,80, 10,30 и 13,70. Порошковая рентгеновская дифрактограмма полиморфа С содержит характеристические пики при значениях углов 20,1, равных 23,6, 23,95, 20,4, 23,2, 24,45, 18,3, 18,6, 24,7 и 22,2. Порошковая рентгеновская дифрактограмма полиморфа D содержит характеристические пики при значениях углов 20,1, равных 18,1, 19,8, 16,45, 17,85, 23,1, 24,65, 20,35 и 27,65. Интенсивность указанных характеристических пиков составляет по меньшей мере 30%. Изобретение также относится к способу получения кристаллических полиморфов В, С и D 7-хлор-4-(пиперазин-1-ил)хинолина и к их применению в синтезе пиперахина или одной из его фармацевтически приемлемых солей.(71)(73) Заявитель и патентовладелец: СИГМА-ТАУ ИНДУСТРИЕ ФАРМАСЬЮТИКЕ РИУНИТЕ С.П.А. (IT) Область техники Настоящее изобретение относится к новому способу синтеза 7-хлор-4-(пиперазин-1-ил)хинолина,основного промежуточного соединения в синтезе пиперахина (piperaquine). Изобретение также относится к кристаллической форме указанного производного хинолина и к его применению в синтезе пиперахина. Уровень техники Пиперахин (1,3-бис-[4-(7-хлорхинолил-4)-пиперазин-1]-пропан) формулы 1 представляет собой противомалярийное средство, принадлежащее к химическим соединениям класса бисхинолинов Пиперахин был впервые синтезирован в 1960-х гг. (патент США 3173918) и применялся при терапии в Китае и во Вьетнаме. В последнее десятилетие он снова стал объектом повышенного интереса,поскольку пиперахин является одним из соединений, подходящих для комбинированной терапии на основе артемизинина (АКТ). Eurartesim содержит комбинацию лекарственных средств пиперахин фосфата и дигидроартемизинина в фиксированном соотношении для лечения неосложненной малярии, вызываемой P. falciparum. Поскольку пиперахин характеризуется чрезвычайно продолжительным периодом полувыведения, ожидается, что в комбинации он будет обладать эффективностью как для лечения клинической стадии малярии, так и для обеспечения защиты от повторного заражения. В литературе описаны различные способы синтеза пиперахина, однако известные способы обычно включают применение ключевого промежуточного пиперазинхинолина формулы I, схема синтеза которого приведена ниже (схема 1). Схема 1 Большинство разработанных способов синтеза 7-хлор-4-пиперазин-1-илхинолина главным образом различаются применяемыми условиями реакции (т.е. типом растворителя, температурой реакции, условиями обработки) и чистотой указанного промежуточного соединения, а не выбором самих реагентов. Еще одна общая черта большинства указанных синтезов заключается в сложности очистки данного промежуточного соединения формулы I от побочных продуктов или избытка пиперазина, что приводит к низкому качеству конечного пиперахина. Фактически, основным выявленным недостатком при взаимодействии 4,7-дихлорхинолина с пиперазином является сопутствующее образование димера формулы 2 Установлено, что данный побочный продукт обладает некоторой токсичностью (Singh Т., et al., J.Med. Chem., 1971, 14, 4, 283). Кроме того, многие существующие способы синтеза соединений формулы I требуют применения повышенных температур реакционной смеси, и/или токсичных растворителей, и/или трудоемких процессов экстракции, и/или условий реакции с сильным разбавлением, и/или большого избытка пиперазина,который трудно полностью удалить на конечной стадии. Синтез 7-хлор-4-(пиперазин-1-ил)хинолин впервые был описан более 40 лет назад (патент США 3331843). Реакция между 4,7-дихлорхинолина и 4 экв. безводного пиперазина включала применение фенола в качестве растворителя, а также трудоемкий процесс обработки для получения целевого продукта присоединения. Последний требует дополнительной очистки для обеспечения высокого качества конечного соединения с температурой плавления, равной 113,5-114,5 С, соответствующей температуре плавления чистого производного. Кроме того, относительно высокое разбавление реакционной смеси, связанное с ядовитой природой растворителя (т.е. фенола), затрудняет практическое применение данной схемы синтеза в промышленных масштабах. В работе Сингха Т. с соавт. (Singh Т., et al.) сообщалось о синтезе 7-хлор-4-(пиперазин-1 ил)хинолина с применением 10 М избытка пиперазина, где реакцию проводили с обратным холодильником в этоксиэтаноле в течение 24 ч. Обработка включает подщелачивание при помощи NaOH и кристаллизацию из циклогексана (Singh Т., et al, J. Med. Chem., 1971, 14, 4, 283). Однако осуществление данного синтеза в значительной степени затруднено вследствие высокой токсичности указанного растворителя. Веннерстром Дж.Л. с соавт. (Vennerstrom J.L., et al.) проводили синтез, который включает перегонку растворителя и избытка пиперазина перед экстракцией трехкомпонентной смеси этилацетатдиэтиловый эфир-дихлорметан. Затем неочищенную реакционную смесь перекристаллизовывали из диэтилового эфира с получением целевого продукта присоединения (Vennerstrom J.L., et al., J. Med. Chem. 1998, 41, 4360). В недавней работе Лью Я. с соавт. (Liu Y., et al.) сообщалось о синтезе 7-хлор-4-(пиперазин-1 ил)хинолина в условиях сильного разбавления в N-метил-2-пирролидиноне и обработки при помощи дихлорметана с получением целевого соединения с 54% выходом (Liu Y., et al., Molecules, 2008, 13,2426). В WO 04002960 сообщалось о синтезе 7-хлор-4-(пиперазин-1-ил)хинолина с 65% выходом, в котором используется 10 экв. пиперазина и сильно разбавленный раствор в этаноле, где реакцию проводили в запаянной пробирке. В заявке на патент 639MUM2005 Заявителем сообщалось о синтезе, предполагающем использование сильно разбавленного раствора в метаноле, сопряженного с обработкой, требующей охлаждения реакционной смеси до 10 С перед отфильтровыванием примеси осажденного димера, а также избытка применяемого пиперазина. Затем целевой продукт присоединения экстрагировали дихлорметаном с получением соединения с чистотой 98%. Следует отметить, что даже после стадии фильтрации и экстракции дихлорметаном чистота соединения составила лишь 98%. Большей степени чистоты можно достичь при помощи трудоемкой стадии последовательной кристаллизации. В заявке US 11/420400 (соответствующей заявке на патент США US 2006/270852) сообщалось о синтезе 7-хлор-4-(пиперазин-1-ил)хинолина с 95% выходом, получаемым в результате длительного кипячения с обратным холодильником в течение 36 ч в изопропиловом спирте в присутствии карбоната калия. В недавней работе Сундуру Н. с соавт. (Sunduru N., et al.) сообщалось о синтезе 7-хлор-4(пиперазин-1-ил)хинолина с 80% выходом, получаемым в результате 5 ч кипячения с обратным холодильником в МеОН в присутствии 5 экв. пиперазина. Неожиданно было установлено, температура плавления полученного продукта присоединения (температура плавления 160-162 С) отличается более чем на 50 С от температуры плавления, указанной в других источниках (Sunduru N., et al., Bioorg. Med. Chem.,2009, 17, 6451). В WO 09050734 сообщалось о синтезе 7-хлор-4-(пиперазин-1-ил)хинолина с выходом от 82 до 86%,полученным в результате кипячения с обратным холодильником смеси 3/1 пиперазина и 4,7 дихлорхинолина в i-PrOH в присутствии карбоната калия. Данный способ также включает экстракцию водной фазы при помощи CH2Cl2 с целью удаления примеси димера и последующее подщелачивание водной фазы аммиачным раствором перед повторной экстракцией при помощи CH2Cl2. После удаления растворителя остаток обрабатывали в гексане с получением 7-хлор-4-(пиперазин-1-ил)хинолина с чистотой 98,56%. Таким образом, очень желательно разработать новый способ синтеза ценного 7-хлор-4-(пиперазин 1-ил)хинолина, который позволял бы избежать применения токсичных реагентов, и/или растворителя,и/или трудоемкого процесса экстракции, и/или большого разбавления, и/или большого избытка пиперазина, который трудно полностью удалить на конечной стадии. Описание изобретения В настоящем изобретении предложен новый экологичный способ синтеза полиморфного 7-хлор-4(пиперазин-1-ил)хинолина и применение последнего в синтезе пиперахина или одной из его фармацевтически приемлемых солей. Указанное получаемое соединение хинолина, по существу, не содержит примесей. В частности, продукт синтеза согласно настоящему изобретению позволяет получать соединение формулы I, причем последнее не содержит каких-либо следов соединений формулы 2 и любых значительных следов непрореагировавшего пиперазина. Формула I Продукт синтеза согласно настоящему изобретению является экологически безопасным (зеленым) и легкореализуемым в промышленном масштабе, а также представляет собой значительное усовершенствование по сравнению с существующими способами синтеза. Указанный синтез является высокоэффективным и экономически выгодным способом синтеза соединения формулы I. Один из вариантов реализации согласно настоящему изобретению включает способ синтеза соединения формулы I путем взаимодействия 4,7-дихлорхинолина и пиперазина в метанольном растворе. В предпочтительном варианте реализации добавляют менее трех стехиометрических эквивалентов пиперазина. В более предпочтительном варианте реализации реакционную смесь фильтруют после 8 ч кипяче-2 024202 ния с обратным холодильником в метаноле. В более предпочтительном варианте реализации посредством кристаллизации получают соединение формулы I высокой степени чистоты. В более предпочтительном варианте реализации кристаллизация включает применение воды. В еще более предпочтительном варианте реализации 7-хлор-4-(пиперазин-1-ил)хинолин получают в конкретной полиморфной форме. В частности, предпочтительными являются полиморфные формы В, С и D. Более конкретно наиболее предпочтительной является полиморфная форма В. Термин "промывка водой" (washing) и любые производные слова обозначают тот факт, что вода является компонентом, применяемым на стадии промывки. Термин "промывка органическим растворителем" (rinsing) и любые производные слова обозначают тот факт, что органический растворитель является компонентом, применяемым на стадии промывки. Выражение "по существу, чистый" обозначает соединение с чистотой, равной или превышающей 99%. Выражение "по существу, идентичный" означает, что специалист не наблюдает каких-либо различий между двумя объектами сравнения. В частности, в отношении рентгеновских спектров указанное выражение обозначает, что два спектра, даже если они не являются на 100% идентичными, соответствуют одинаковым химическим структурам, поскольку различие в положении пиков каждого из спектров находится в пределах погрешности эксперимента относительно значений 2, а также относительно интенсивностей каждого из пиков. Форма В. В предпочтительном варианте реализации получают кристаллическую форму В 7-хлор-4(пиперазин-1-ил)хинолина. Согласно настоящему изобретению предложена кристаллическая форма В 7-хлор-4-(пиперазин-1 ил)хинолина, порошковая рентгеновская дифрактограмма которой содержит по меньшей мере пять характерных пиков при значениях углов 20,1, равных 6,95, 20,40, 25,80, 10,30 и 13,70. Форма С. В другом предпочтительном варианте реализации получают кристаллическую форму С 7-хлор-4(пиперазин-1-ил)хинолина. Согласно настоящему изобретению предложена кристаллическая форма С 7-хлор-4-(пиперазин-1 ил)хинолина, порошковая рентгеновская дифрактограмма которой содержит по меньшей мере девять характерных пиков при значениях угла 20,1, равных 23,6, 23,95, 20,4, 23,2, 24,45, 18,3, 18,6, 24,7 и 22,2. Форма D. В другом более предпочтительном варианте реализации получают кристаллическую форму D 7 хлор-4-(пиперазин-1-ил)хинолина. Согласно настоящему изобретению предложена кристаллическая форма D 7-хлор-4-(пиперазин-1 ил)хинолина, порошковая рентгеновская дифрактограмма которой содержит по меньшей мере восемь характерных пиков при значениях угла 20,1, равных 18,1, 19,8, 16,45, 17,85, 23,1, 24,65, 20,35 и 27,65. Описание чертежей На фиг. 1 приведен рентгеновский спектр полиморфной формы А 7-хлор-4-(пиперазин-1-ил)хинолина. На фиг. 2 приведен рентгеновский спектр полиморфной формы В 7-хлор-4-(пиперазин-1-ил)хинолина. На фиг. 3 приведен рентгеновский спектр полиморфной формы С 7-хлор-4-(пиперазин-1-ил)хинолина. На фиг. 4 приведен рентгеновский спектр полиморфной формы D 7-хлор-4-(пиперазин-1-ил)хинолина. На фиг. 5 приведен рентгеновский спектр полиморфной формы Е 7-хлор-4-(пиперазин-1-ил)хинолина. На фиг. 6 приведена таблица всех пиков спектров рентгеновской дифракции пяти полимерных форм. Примеры Сокращения:bs - широкий синглет,d - дублет,CH2Cl2 - дихлорметан,Et2O - диэтиловый эфир,КТ - комнатная температура. Общие положения. Спектр ядерно-магнитного резонанса (1 Н и 13 С ЯМР) снимали при помощи спектрометра VarianInova 500, а слабопольные химические сдвиги приводили в частях на миллион (ppm) относительно тетраметилсилана в качестве внутреннего стандарта. Константы взаимодействия приводили в Гц. Пример 1. Безводный раствор пиперазина (54 кг) в 150 л метанола перемешивали до получения прозрачного раствора. Затем к раствору медленно добавляли 50 кг 4,7-дихлорхинолина. Раствор перемешивали при кипячении с обратным холодильником в течение 8 ч и охлаждали до КТ. Полученную суспензию фильтровали и удаляли растворитель при пониженном давлении. Полученное масло промывали водой (150 л) до образования твердого осадка. Осадок отфильтровывали и промывали водой с получением 72 кг кристаллической формы В 7-хлор-4-(пиперазин-1-ил)хинолина, содержащей 25% воды (мас./мас.). Выход = 86% (в пересчете на сухое вещество). 1 Н ЯМР (200 МГц CDCl3), : 1,92 (bs, 1H); 3,16 (s, 8H); 6,81 (d, J=5,1 Гц, 1H); 7,40 (dd, J=2,2 Гц, J= 9,0 Гц, 1 Н); 7,94 (d, J=9,0 Гц, 1 Н); 8,02 (d, J=2,2 Гц, 1 Н); 8,58 (d, J=5,1 Гц, 1 Н). Чистота. Возможное остаточное содержание исходного пиперазина определяли при помощи газовой хроматографии. Условия газовой хроматографии. Колонка: САМ (JW) 30 м 0,25 мм. Толщина пленки 0,25 мкм. Неподвижная фаза: полиэтиленгликоль, деактивированный по отношению к основаниям. Инжектор: с делением/без деления потока. Отношение деления потока: 1:20. Температура пробы: 320 С. Объем пробы: 1 мкл. Температура колонки: от 100 С в течение 3 мин (10 С/мин) до 140 С в течение 1 мин. Поток носителя: 1 мл/мин (Не). Детектор: ПИД. Температура детектора: 320 С. Получение образца раствора согласно примеру 1. 50 мг 7-хлор-4-(пиперазин-1-ил)хинолина, полученный в соответствии со способом, описанным в примере 1, растворяли в 10 мл этилацетата. Получение стандартного раствора пиперазина. 100 мг пиперазина (Sigma-Aldrich - Кат.Р 4,590-7) растворяли в 10 мл этилацетата с получением первого раствора. 50 мкл данного раствора разбавляли до 10 мл этилацетатом. Данную операцию повторяли еще раз с получением стандартного раствора. Исследование. 1 мл каждого из описанных выше растворов исследовали при помощи газовой хроматографии с применением условий, описанных выше. Содержание примеси исходного пиперазина составляло менее 30 ppm. Рентгеновский анализ. Специалистам в данной области техники понятно, что 2 значения на порошковой рентгеновской дифрактограмме могут незначительно отличаться от значений, полученных на разных экземплярах устройства или при использовании разных образцов, поэтому указанные значения не следует считать абсолютно истинными. Также специалистам в данной области техники понятно, что основные интенсивности на порошковой рентгеновской дифрактограмме могут колебаться в зависимости от условий измерения(т.е. положение изображения может зависеть от точной высоты, на которой находится образец в дифрактометре, и калибровки нуля дифрактометра; Jenkins, R., et al., "Introduction to X-Ray Powder Diffractometry", John WileySons 1996). Таким образом, еще один вариант реализации настоящего изобретения относится к кристаллической форме 7-хлор-4-(пиперазин-1-ил)хинолина, характеризующегося порошковой рентгеновской дифрактограммой, по существу, идентичной порошковой рентгеновской дифрактограмме, приведенной на фиг. 1. Для определения различий физико-химических свойств 7-хлор-4-(пиперазин-1-ил)хинолина, полученного по способу из примера 1 и способам, известным в данной области техники, применяли условия реакции, представленные в сравнительных примерах 2-7. Сравнительный пример 2. Данный сравнительный пример проводили в соответствии со способом, описанным в международной заявке на патент WO 09050734. Смесь безводного пиперазина (25,8 г, 0,30 моль), K2CO3 (13,8 г, 0,10 моль) и 4,7-дихлорхинолина(19,8 г, 0,10 моль) в i-PrOH (140 мл) кипятили с обратным холодильником в течение 18 ч. Затем реакционную смесь охлаждали до КТ и удаляли растворитель при пониженном давлении. Неочищенную реакционную смесь погружали в раствор H2O/CH2Cl2 (600 мл, 1/1). Органическую фазу отделяли и снова промывали Н 2 О перед подкислением до рН 4-4,5 путем добавления 50% вод. раствора АсОН. Затем вод-4 024202 ный слой отделяли и подщелачивали аммиачным раствором перед экстракцией при помощи CH2Cl2. Растворитель удаляли при пониженном давлении и осадок измельчали в гексане в течение 1 ч. Твердое вещество отфильтровывали с получением 20,26 г целевого продукта присоединения с 82% выходом. Дальнейшее исследование показало, что твердое вещество является кристаллическим и находится в кристаллической форме Е. Сравнительный пример 3. Данный сравнительный пример проводили в соответствии со способом, описанным в патенте Индии 639MUM2005. Смесь безводного пиперазина (16,3 г, 189 ммоль) и 4,7-дихлорхинолина (12,5 г, 63,1 ммоль) в МеОН(62,5 мл) кипятили с обратным холодильником в течение 8 ч. Затем реакционную смесь охлаждали до 10 С. Осадок отфильтровывали и промывали холодным МеОН (10 мл при 10 С). Фильтрат выпаривали досуха при пониженном давлении, после чего погружали в раствор H2O/CH2Cl2 (500 мл, 1/1). Органическую фазу отделяли и снова промывали Н 2 О (три раза по 150 мл) перед выпариванием при пониженном давлении. Осадок измельчали в гексане (50 мл) в течение 1 ч и отфильтровывали. Затем продукт промывали гексаном (20 мл) с получением 13,75 г целевого продукта присоединения с 88% выходом. Дальнейшее исследование показало, что твердое вещество является кристаллическим и находится в кристаллической форме Е. Сравнительный пример 4. Данный сравнительный пример проводили в соответствии со способом, описанным в международной заявке на патент WO 04002960. Смесь безводного пиперазина (43,1 г, 500 ммоль) и 4,7-дихлорхинолина (9,9 г, 50 ммоль) в EtOH(200 мл) кипятили с обратным холодильником в течение 18 ч. Затем реакционную смесь охлаждали до КТ и удаляли растворитель при пониженном давлении. Неочищенную реакционную смесь растворяли вAcOEt (350 мл) и полученный раствор промывали водой (один раз 250 мл и 4 раза 150 мл). Затем органическую фазу выпаривали при пониженном давлении с получением 11,33 г целевого продукта присоединения с 91% выходом. Дальнейшее исследование показало, что твердое вещество является кристаллическим и находится в кристаллической форме А. Сравнительный пример 5. Данный сравнительный пример проводили в соответствии со способом, описанным Сингхом Т. с соавт. (Singh Т., et al.) в J. Med. Chem., 1971, 14, 4, 283. Дальнейшее исследование показало, что твердое вещество является кристаллическим и находится в кристаллической форме Е. Сравнительный пример 6. Данный сравнительный пример проводили в соответствии со способом, описанным в патенте США 11/420400, соответствующем заявке на патент США 2006/270852. Дальнейшее исследование показало, что твердое вещество является кристаллическим и находится в кристаллической форме Е. Сравнительный пример 7. Твердое кристаллическое вещество из примера 1 сушили в эксикаторе при КТ в присутствии силикагеля в течение 24 ч с получением кристаллической формы А 7-хлор-4-(пиперазин-1-ил)хинолина. Пример 8. Твердое кристаллическое вещество, полученное в примере 7, растворяли в горячем гексане и полученный раствор охлаждали до КТ. После охлаждения дополнительно получали кристаллическую форму С 7-хлор-4-(пиперазин-1-ил)хинолина. Пример 9. Твердое кристаллическое вещество, полученное в примере 7, растворяли в CH2Cl2 при КТ. После концентрирования при пониженном давлении дополнительно получали кристаллическую форму D 7 хлор-4-(пиперазин-1-ил)хинолина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллический полиморф В 7-хлор-4-(пиперазин-1-ил)хинолина, порошковая рентгеновская дифрактограмма которого содержит по меньшей мере пять характеристических пиков при значениях углов 20,1, равных 6,95, 20,40, 25,80, 10,30 и 13,70, а их интенсивность составляет по меньшей мере 30%. 2. Кристаллический полиморф В 7-хлор-4-(пиперазин-1-ил)хинолина по п.1, порошковая рентгеновская дифрактограмма которого дополнительно содержит следующие пики примерно при значениях углов 20,1, равных 12,35, 25,25, 29,05, 22,85, 17,9, 24,6, 28,5 и 28,85. 3. Кристаллический полиморф В 7-хлор-4-(пиперазин-1-ил)хинолина по п.1, характеризующийся рентгеновской дифрактограммой, по существу, идентичной приведенной на фиг. 2. 4. Способ получения полиморфа В 7-хлор-4-(пиперазин-1-ил)хинолина по п.1, включающий следующие стадии:a) взаимодействие 4,7-дихлорхинолина с безводным пиперазином в полярном протонном растворителе в течение 6-10 ч при температуре обратной конденсации;b) фильтрование суспензии, полученной на стадии а);c) удаление растворителя при пониженном давлении и промывку полученного таким образом масла до тех пор, пока не произойдет кристаллизация;d) промывку кристаллов, полученных на стадии с). 5. Способ по п.4, в котором количество эквивалентов пиперазина превышает количество 4,7 дихлорхинолина менее чем в 3 раза. 6. Способ по п.5, в котором количество эквивалентов пиперазина превышает количество 4,7 дихлорхинолина в 2,5 раза. 7. Способ по любому из пп.4-6, в котором полярный протонный растворитель на стадии а) представляет собой МеОН. 8. Кристаллический полиморф С 7-хлор-4-(пиперазин-1-ил)хинолина, порошковая рентгеновская дифрактограмма которого содержит следующие пики при значениях углов 20,1, равных 23,6, 23,95,20,4, 23,2, 24,45, 18,3, 18,6, 24,7 и 22,2, а их интенсивность составляет по меньшей мере 30%. 9. Кристаллический полиморф С 7-хлор-4-(пиперазин-1-ил)хинолина по п.8, порошковая рентгеновская дифрактограмма которого дополнительно содержит следующие пики примерно при значениях углов 20,1, равных 25,75, 22,5, 26,3, 14,75, 15,25, 27,6, 28,55, 31,1 и 28,05. 10. Кристаллический полиморф С 7-хлор-4-(пиперазин-1-ил)хинолина по п.8, характеризующийся рентгеновской дифрактограммой, по существу, идентичной приведенной на фиг. 3. 11. Способ получения полиморфа С 7-хлор-4-(пиперазин-1-ил)хинолина по п.8, включающий следующие стадии:a) взаимодействие 4,7-дихлорхинолина с безводным пиперазином в полярном протонном растворителе в течение 6-10 ч при температуре обратной конденсации;b) фильтрование суспензии, полученной на стадии а);c) удаление растворителя при пониженном давлении и промывку полученного таким образом масла до тех пор, пока не произойдет кристаллизация;d) промывку кристаллов, полученных на стадии с);e) растворение кристаллов, полученных на стадии d), в горячем гексане;f) охлаждение раствора, полученного на стадии а), до комнатной температуры (КТ с обеспечением возможности протекания кристаллизации);g) отфильтровывание кристаллов, полученных на стадии b). 12. Кристаллический полиморф D 7-хлор-4-(пиперазин-1-ил)хинолина, порошковая рентгеновская дифрактограмма которого содержит следующие пики при значениях углов 20,1, равных 18,1, 19,8,16,45, 17,85, 23,1, 24,65, 20,35 и 27,65, а их интенсивность составляет по меньшей мере 30%. 13. Кристаллический полиморф D 7-хлор-4-(пиперазин-1-ил)хинолина по п.12, порошковая рентгеновская дифрактограмма которого дополнительно содержит следующие пики примерно при значениях углов 20,1, равных 8,05, 13,5, 8,25, 24,25, 12,05 и 24,05. 14. Кристаллический полиморф D 7-хлор-4-(пиперазин-1-ил)хинолина по п.12, характеризующийся рентгеновской дифрактограммой, по существу, идентичной приведенной на фиг. 4. 15. Способ получения полиморфа D 7-хлор-4-(пиперазин-1-ил)хинолина по п.12, включающий следующие стадии:a) взаимодействие 4,7-дихлорхинолина с безводным пиперазином в полярном протонном растворителе в течение 6-10 ч при температуре обратной конденсации;b) фильтрование суспензии, полученной на стадии а);c) удаление растворителя при пониженном давлении и промывка полученного таким образом масла до тех пор, пока не произойдет кристаллизация;d) промывку кристаллов, полученных на стадии с);e) растворение кристаллов, полученных на стадии d), в дихлорметане;f) концентрирование раствора, полученного на стадии а), при пониженном давлении. 16. Применение кристаллического полиморфа 7-хлор-4-(пиперазин-1-ил)хинолина по одному из пп.1, 8, 12 в синтезе пиперахина или одной из его фармацевтически приемлемых солей.
МПК / Метки
МПК: C07D 215/46
Метки: 7-хлор-4-(пиперазин-1-ил)хинолина, кристаллические, полиморфы, получения, способы
Код ссылки
<a href="https://eas.patents.su/9-24202-kristallicheskie-polimorfy-v-s-i-d-7-hlor-4-piperazin-1-ilhinolina-i-sposoby-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллические полиморфы в, с и d 7-хлор-4-(пиперазин-1-ил)хинолина и способы их получения</a>
Предыдущий патент: Ингибиторы вируса гепатита с
Следующий патент: Способ формирования внутриплеврального антирефлюксного пищеводно-желудочного анастомоза при субтотальной резекции пищевода
Случайный патент: Ферментативное получение липстатина