Агенты, усиливающие действие амра-рецепторов
Формула / Реферат
1. Соединение формулы
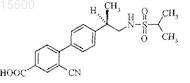
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, содержащая соединение формулы
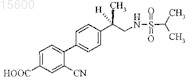
или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем.
3. Применение соединения по п.1 в качестве фармацевтического средства для усиления действия функции рецептора глутамата у млекопитающего.
4. Применение соединения по п.1 для изготовления медикамента для лечения болезни Паркинсона.
5. Применение соединения по п.1 для изготовления медикамента для лечения депрессии.
6. Применение соединения по п.1 для изготовления медикамента для лечения шизофрении.
7. Способ усиления действия функции рецептора глутамата у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанном воздействии, эффективного количества соединения по п.1.
Текст
Дата публикации и выдачи патента Номер заявки Настоящее изобретение относится к соединению, соответствующему формуле I или фармацевтически приемлемой соли указанного соединения, которое можно применять для лечения состояний, связанных со снижением функции глутамата, например психиатрических и неврологических нарушений.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 015600 Уровень техники Глутамат представляет собой основной возбуждающий нейромедиатор центральной нервной системы. АМРА-рецепторы представляют собой один из трех подтипов ионотропных рецепторов глутамата,выделяемых на основании их чувствительности к селективному активатору, -амино-3-гидрокси-5 метил-4-изоксазолпропионовой кислоте (АМРА). АМРА-рецепторы являются медиаторами ответных реакций клеток на глутамат, действующими как по непосредственному, так и по опосредованным механизмам. При активации глутаматом или АМРА ионные каналы АМРА-рецептора позволяют ионам натрия (Na+) и ионам кальция (Са 2+) непосредственно проходить через пору канала. Токи, проходящие через ионные каналы, активированные глутаматом через АМРА-рецепторы, не постоянны. На продолжительность токов влияют рефракторные состояния (состояния невозбудимости),вызываемые связыванием с глутаматом, которые называют десенсибилизацией, и скорость отщепления глутамата от центра связывания ионного канала, которое приводит к дезактивации. Входящий ток ионов через АМРА-рецепторы может быть усилен либо соединениями, которые препятствуют десенсибилизации, либо соединениями, которые снижают скорость дезактивации. Соединения, которые усиливают стимулируемый глутаматом входящий ток ионов через АМРА-рецепторы, называют положительными аллостерическими модуляторами АМРА-рецепторов или усилителями действия (потенциаторами) АМРА-рецепторов. Поскольку АМРА-рецепторы играют ключевую роль в передаче быстрых возбуждающих сигналов в центральной нервной системе, молекулы, которые усиливают функции АМРАрецепторов, имеют множество терапевтических мишеней. Кроме того, было показано, что соединения,которые аллостерически усиливают действие АМРА-рецепторов, усиливают синаптическую активностьin vitro и in vivo. Также было показано, что такие соединения усиливают способность к обучению и память у крыс, обезьян и человека. В нескольких опубликованных международных патентных заявках, см. WO 98/33496, WO 01/68592 и WO 01/90057, раскрыты некоторые сульфонамидные производные, которые можно использовать, например, в качестве усилителей действия АМРА-рецепторов и для лечения различных нарушений, например психиатрических и неврологических нарушений, а также половых расстройств. Тем не менее, все еще существует необходимость в разработке усилителей действия АМРА-рецепторов, обладающих повышенной эффективностью и улучшенными показателями безопасности. Соединения, соответствующие формуле I, также могут быть полезны для улучшения памяти (как кратковременной, так и долговременной) и способности к обучению. Краткое описание изобретения Настоящее изобретение относится к соединению, соответствующему формуле I или к фармацевтически приемлемой соли указанного соединения. Настоящее изобретение относится к соединению, соответствующему формуле I, для применения в качестве фармацевтического средства. Кроме того, настоящее изобретение относится к способу усиления функций рецепторов глутамата у пациента, который включает введение указанному пациенту, нуждающемуся в таком воздействии, эффективного количества соединения, соответствующего формуле I, или фармацевтически приемлемой соли указанного соединения. Кроме того, настоящее изобретение также относится к способу лечения шизофрении, когнитивных расстройств, связанных с шизофренией, болезни Альцгеймера, слабоумия по типу болезни Альцгеймера,умеренных когнитивных нарушений, болезни Паркинсона или депрессии у пациента, который включает введение указанному пациенту, нуждающемуся в таком лечении, эффективного количества соединения,соответствующего формуле I, или фармацевтически приемлемой соли указанного соединения. Другой аспект настоящего изобретения относится к применению соединения, соответствующего формуле I, или фармацевтически приемлемой соли указанного соединения для изготовления медикамента для лечения шизофрении, когнитивных расстройств, связанных с шизофренией, болезни Альцгеймера,слабоумия по типу болезни Альцгеймера, умеренных когнитивных нарушений, болезни Паркинсона или депрессии. Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение, соответствующее формуле I, или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель, разбавитель или наполнитель.-1 015600 Подробное описание изобретения В настоящем описании термин "усиление функции рецептора глутамата" (потенцирование) означает повышение реактивности (способности к ответной реакции) рецепторов глутамата, например АМРАрецепторов, в ответ на действие глутамата или агониста, включая, без ограничения, ингибирование быстрой десенсибилизации или дезактивации АМРА-рецепторов по отношению к глутамату. Действие соединения, соответствующего формуле I, или фармацевтически приемлемой соли указанного соединения в качестве усилителей функций глутаматного рецептора позволяет лечить или предотвращать широкий диапазон состояний. См. международные патентные заявки WO 98/33496 иWO 01/68592, в которых описаны различные нарушения, которые можно лечить при помощи усилителей функций рецептора глутамата. Указанные состояния включат состояния, связанные с пониженной функцией глутамата, например психиатрические и неврологические нарушения, например когнитивные нарушения и нейродегенеративные нарушения, такие как болезнь Альцгеймера; слабоумие по типу болезни Альцгеймера; возрастное слабоумие; возрастное нарушение памяти; нарушение двигательной функции,например позднюю (тардивную) дискинезию, болезнь Паркинсона; снятие вызванных наркотическим действием состояний (например, состояний, вызванных кокаином, амфетаминами, алкоголем); депрессию; синдром дефицита внимания; синдром дефицита внимания с гиперактивностью; психозы, например шизофрению; когнитивные расстройства, связанные с психозами, например шизофренией; психозы, обусловленные действием психоактивного средства, инсульта; и половые расстройства. Настоящее изобретение также относится к использованию соединения, соответствующего формуле I, для лечения каждого из указанных состояний, а также состояний, описанных в международных патентных заявкахWO 98/33496 и WO 01/68592. Соединение, соответствующее формуле I, также может быть использовано для улучшения памяти (как кратковременной, так и долговременной) и способности к обучению. Для специалиста в данной области техники понятно, что когнитивные способности включают различные "домены". Эти домены включают кратковременную память, долговременную память, оперативную память, исполнительные функции и внимание. В настоящем описании термин "когнитивное нарушение" охватывает любые нарушения, характеризующиеся недостаточностью одного или более когнитивных доменов, неограничивающие примеры которых включают кратковременную память, долговременную память, оперативную память, исполнительную функцию и внимание. Также подразумевается,что неограничивающие примеры нарушений, охватываемых термином "когнитивное нарушение", включают следующие конкретные нарушения: старческое ухудшение когнитивных функций; умеренные когнитивные нарушения; болезнь Альцгеймера; слабоумие; слабоумие по типу болезни Альцгеймера; слабоумие по типу болезни Паркинсона; слабоумие с тельцами Леви; устойчивое слабоумие, вызванное некоторыми веществами; устойчивое слабоумие, вызванное алкоголем; когнитивные нарушения, вызванные алкоголем; слабоумие при СПИД; нарушения способности к обучению; когнитивные расстройства,вызванные последствиями операций шунтирования и трансплантации на сердце, инсультом, церебральной ишемией, травмой спинного мозга, травмой головы, перинатальной гипоксией, остановкой сердца и гипогликемическим повреждением нервных клеток; слабоумие, вызванное сосудистыми нарушениями; слабоумие, вызванное множественными инфарктами; когнитивные расстройства, связанные с боковым амиотрофическим склерозом; и когнитивные расстройства, связанные с рассеянным склерозом. На основании клинических проявлений и поскольку у пациентов с умеренными когнитивными нарушениями с течением времени развивается слабоумие по типу болезни Альцгеймера, умеренные когнитивные нарушения определяют как потенциальную продромальную фазу слабоумия, связанного с болезнью Альцгеймера (Morris, et al., Arch. Neurol., 58, 397-405 (2001); Petersen, et al., Arch. Neurol., 56, 303-308 (1999. В четвертом издании Diagnostic and Statistical Manual of Mental Disorders (DSM-IV) (1994, AmericanPsychiatric Association, Washington, D.C.) описаны диагностические средства для идентификации многих из рассматриваемых в настоящем описании нарушений. Для специалиста в данной области очевидно, что существуют альтернативные варианты номенклатуры, нозологии и систем классификации рассматриваемых в настоящем описании нарушений, включая варианты, описанные в руководстве "International Statistical Classification of Diseases and Related Health Problems", десятая редакция (ICD-10) (1992, World HealthOrganization (ВОЗ), Женева), и что терминология и классификация развиваются по мере научного прогресса в области медицины. Настоящее изобретение включает фармацевтически приемлемые соли соединения, соответствующего формуле I. Соединение согласно настоящему изобретению включает кислотную группу и, следовательно, способно вступать в реакцию с любым из ряда органических и неорганических оснований с образованием фармацевтически приемлемой соли. В настоящем описании термин "фармацевтически приемлемая соль" означает соли соединения, соответствующего формуле I, которые, по существу, не токсичны для живых организмов. Такие соли включают фармацевтически приемлемые соли, перечисленные в публикации Journal of Pharmaceutical Science, 66, 2-19 (1977), которые известны специалисту в данной области техники. Соединение, соответствующее формуле I, может быть получено, например, в соответствии с процедурами, аналогичными описанным в международной патентной заявке WO 98/33496. Более конкретно,соединение, соответствующее формуле I, может быть получено в соответствии со схемами, методами и-2 015600 примерами, приведенными ниже в настоящем описании. Реактивы и исходные материалы легко доступны для специалиста в данной области техники. Аббревиатуры, символы и термины, используемые в описании примеров и тестов, имеют следующие значения: АсОН = уксусная кислота, ДХМ = дихлорметан, ДМАП = диметиламинопиридин, ДМЭ = диметоксиэтан, ДМФА = N,N-диметилформамид, ДМСО = диметилсульфоксид, (dppf) = 1,1'-бис(дифенилфосфино)ферроцен, э.и. = энантиомерный избыток, Et3N = триэтиламин, EtOAc = этилацетат,EtOH = этанол, ГХ = газовая хроматография, 1 Н ЯМР = протонная ядерно-магнитная резонансная спектрометрия, ВЭЖХ = высокоэффективная жидкостная хроматография, МС = масс-спектрометрия, Tf2O = трифторметансульфоновый ангидрид. Примеры синтеза Пример синтеза 1. Этиловый эфир 4-гидрокси-3-йодбензойной кислоты Этил-4-гидроксибензоат (102,2 г, 0,61 моль) растворяют в АсОН (200 мл) при 65 С. Добавляют по каплям раствор ICl (100 г, 0,61 моль) в АсОН (500 мл). После добавления смесь перемешивают при 65 С в течение 6 ч. Смесь выливают в лед/воду, фильтруют и промывают твердое вещество водой. Твердое вещество растворяют в CH2Cl2, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток подвергают хроматографии на силикагеле с использованием в качестве элюента CH2Cl2 и получают 131,3 г этил-4-гидрокси-3-йодбензоата (74% выход).(15,17 г, 169,5 ммоль). Смесь перемешивают при 100 С в течение ночи. После охлаждения смесь выливают в лед/воду. Полученное твердое вещество отфильтровывают, промывают водой и сушат при пониженном давлении. Твердое вещество растворяют в EtOAc. Фильтруют через Celite. Сушат над MgSO4 и растворитель удаляют, получая 22,36 г этил-3-циано-4-гидроксибензоата (76% выход).MS(ES): m/z = 190,0 [М-Н]. Пример синтеза 3. Этил 3-циано-4-трифторметансульфонилоксибензоат. Этил-3-циано-4-гидроксибензоат (22,36 г, 117,1 ммоль) растворяют в безводном CH2Cl2 (400 мл) при 0 С. Добавляют Et3N (24,3 мл, 175,6 ммоль), ДМАП (2,14 г, 17,5 ммоль) и по каплям Tf2O (49,5 г,175,6 ммоль). Смесь перемешивают при комнатной температуре в течение 2 ч. Смесь концентрируют при пониженном давлении и остаток подвергают хроматографии на силикагеле с использованием в качестве элюента смеси гексан/EtOAc 4:1, получая 34,99 г этил-3-циано-4-трифторметансульфонилоксибензоатаMS (ES): m/z = 190,0 [М-Н]. Пример синтеза 4. 2-Фенил-1-пропиламин HCl. В автоклав для гидрирования загружают в атмосфере азота смоченный водой 5% палладий на угле(453 г), этанол (6,36 л), 2-фенилпропионитрил (636 г, 4,85 моль) и, наконец, концентрированную (12 М) соляную кислоту (613 г, 5,6 моль). Смесь быстро перемешивают и нагнетают давление водорода до значения, составляющего от 75 до 78 psi (фунтов на квадратный дюйм). Смесь нагревают до температуры,составляющей от 50 до 64 С, в течение 3 ч. Давление снижают и реакционную смесь фильтруют, в результате чего получают две порции фильтрата. Фильтраты концентрируют при пониженном давлении,каждый приблизительно до 400 мл. К каждой порции добавляют метил-трет-бутиловый эфир (МТБЭ)(2,2 л каждый). Осадок перемешивают в течение ночи. Твердые вещества фильтруют, промывают свежим МТБЭ (100 мл) и сушат в течение ночи. Порции объединяют, получая гидрохлорид (HCl) 2-фенил 1-пропиламина (634,4 г, 76,2%) в виде белого порошка. 1 Н ЯМР анализ свободного основания: 1 Н ЯМР (CDCl3, 300 МГц)7,32 (м, 2 Н), 7,21 (м, 3 Н), 2,86 В сухую 3-литровую круглодонную колбу в атмосфере азота загружают 2-фенил-1-пропиламин HCl(317,2 г, 1,85 моль), сухой этанол (2,0 л) и гранулы NaOH (75,4 г, 1,89 моль), промытые добавочным количеством этанола (500 мл). Смесь перемешивают в течение 1,6 ч. Фильтруют и к желтому фильтрату добавляют по каплям раствор L-яблочной кислоты (62,0 г, 0,4 62 моль, 0,25 экв.) в этаноле (320 мл). Раствор нагревают до 75 С, затем перемешивают при 75 С в течение 30 мин. Нагревание снимают и оставляют раствор медленно охлаждаться. Полученный плотный осадок оставляют перемешиваться в течение-3 015600 ночи. Осадок фильтруют, промывают этанолом (325 мл) и сушат при пониженном давлении, получая яблочно-кислый (2R)-2-фенилпропиламин (147,6 г, 39,5%) в виде белого кристаллического вещества. Анализ свободного основания, 2-фенил-1-пропиламина, при помощи хиральной ГХ показал 83,2% энантиомерный избыток R-изомера (конфигурацию определяли спектрометрическим сравнением с коммерчески доступным 2-фенил-1-пропиламином.) 1 Н ЯМР (CDCl3, 300 МГц)7,32 (м, 2 Н), 7,21 (м, 3 Н), 2,86 (м, 2 Н), 2,75 (м, 1 н.), 1,25 (д, 3 Н, J=6,9),1,02 (шир.с, 2 Н). Суспензию яблочно-кислого (2R)-2-фениллропиламина (147,1 г, 83,2% э.и.) нагревают в 1325 мл этанола и 150 мл деионизированной воды до кипения (приблизительно 79,2 С) до растворения твердых веществ. Гомогенный раствор оставляют медленно охлаждаться при перемешивании в течение ночи. Осадок охлаждают (от 0 до 5 С) и фильтруют. Твердое вещество собирают, промывают этанолом(150 мл) и сушат при 35 С, в результате получают яблочно-кислый (2R)-2-фенилпропиламин (125,3 г,85,2% извлечение) в виде белого порошка. Анализ свободного основания, (2R)-2-фенил-1-пропиламина,при помощи хиральной ГХ показал 96,7% энантиомерный избыток R-изомера. 1CH2Cl2 (1000 мл) добавляют 1,0 н. NaOH (1050 мл, 1,05 моль). Смесь перемешивают при комнатной температуре в течение 1 ч. Органическую фазу отделяют и подвергают гравитационному фильтрованию в 3,0-литровую круглодонную колбу, промытую CH2Cl2 (200, мл). Полученное свободное основание,(2R)-2-фенилпропиламин, сушат при помощи азеотропной перегонки. Прозрачный фильтрат концентрируют до объема 600 мл посредством перегонки при атмосферном давлении через простую насадку для перегонки. Добавляют гептан (1000 мл), затем раствор вновь концентрируют при атмосферном давлении до 600 мл, используя продувку азотом для повышения скорости перегонки, при конечной температуре внутри колбы, составляющей 109 С. Раствор охлаждают до комнатной температуры в атмосфере азота при перемешивании, получая прозрачный, бесцветный раствор (2R)-2-фенилпропиламина в гептане (600 мл). К этому раствору добавляют 4-диметиламинопиридин (6,04 г, 0,0494 моль), триэтиламин (200 г, 1,98 моль) и CH2Cl2 (500 мл). Смесь перемешивают при комнатной температуре до получения прозрачного раствора. Раствор охлаждают до 5 С. При перемешивании в течение 2 ч по каплям добавляют раствор изопропилсульфонилхлорида (148 г, 1,04 моль) в CH2Cl2 (250 мл). Смесь оставляют постепенно нагреваться до комнатной температуры в течение 16 ч. Перемешиваемую смесь охлаждают до 8 С, затем по каплям добавляют 2 н. HCl (500 мл). Органическую фазу отделяют, экстрагируют водой (1500 мл) и насыщенным NaHCO3 (1500 мл). Органическую фазу отделяют, сушат (Na2SO4) и подвергают гравитационному фильтрованию. Фильтрат концентрируют при пониженном давлении и получают 2R)-2-фенилпропил)[(метилэтил)сульфонил]амин (230 г, 96%) в виде бледно-желтого масла. 1 Н ЯМР (CDCl3, 300 МГц)7,34 (м, 2 Н), 7,23 (м, 3 Н), 3,89 (шир.т, 1H, J=5,4), 3,36 (м, 1 Н), 3,22 (м,1 Н), 3,05 (м, 1 Н), 2,98 (м, 1H), 1,30 (д, 3 Н, J=7,2), 1,29 (д, 3 Н, J=6,9), 1,25 (д, 3 Н, J=6,9). Пример синтеза 7. [(2R)-2-(4-Йодфенил)пропил][(метилэтил)сульфонил]амин Перемешиваемый при комнатной температуре раствор 2R)-2-фенилпропил)[(метилэтил)сульфонил]амина (37,1 г, 0,154 моль) в ледяной уксусной кислоте (185 мл) обрабатывают концентрированнойH2SO4 (16,0 г, 0,163 моль), добавляемой по каплям в виде медленного потока, а затем промывают H2O(37 мл). К этому раствору добавляют H5IO6 (8,29 г, 0,0369 моль), а затем йод (17,9 г, 0,0707 моль). Полученную реакционную смесь нагревают и оставляют ее перемешиваться в течение 3 ч при 60 С. Исчезновение исходного материала отслеживают при помощи ВЭЖХ анализа, затем реакционную смесь охлаждают до 30 С. Поддерживая температуру между 25 и 30 С, по каплям добавляют 10%-ный водный раствор NaHSO3 (220 мл). Охлаждают до температуры, составляющей от 0 до 5 С, и получают твердое вещество. Твердое вещество отсасывают и промывают Н 2 О, получая 61,7 г сырого твердого вещества. Это твердое вещество повторно растворяют в теплом МТБЭ (500 мл). Этот раствор экстрагируют Н 2 О(2200 мл) и насыщенным раствором NaHCO3 (1200 мл). Органическую фазу отделяют и сушат MgSO4,фильтруют и концентрируют при пониженном давлении до объема, составляющего приблизительно 200 мл. К полученному раствору по каплям добавляют гептан (100 мл) при медленном перемешивании-4 015600 до начала кристаллизации. Добавляют еще 100 мл гептана. Полученную суспензию оставляют медленно перемешиваться в течение ночи при комнатной температуре. Смесь охлаждают до 0 С и фильтруют. Собранное твердое вещество промывают гептаном. Твердое вещество сушат на воздухе, получая[(2R)-2-(4 йодфенил)пропил][(метилэтил)сульфонил]амин (33,7 г, 59,8%) в виде белого порошка. Данные хиральной хроматографии указывают на наличие 100% э.и. 1 Объединяют [(2R)-2-(4-йодфенил)пропил][(метилэтил)сульфонил]амин (0,787 г, 2,14 ммоль), бис(пинаколят)дибор (0,599 г, 2,36 ммоль), PdCl2 (dppf), CH2Cl2 (0,052 г, 0,064 ммоль) и KOAc (0,630 г,6,42 ммоль) в ДМФА (40 мл) и нагревают до 80 С в атмосфере азота в течение 10 ч. Полученную темнокоричневую смесь выливают в EtOAc и промывают H2O и насыщенным водным раствором хлорида натрия. Органический слой отделяют и сушат (MgSO4). Фильтрат фильтруют и выпаривают, затем остаток подвергают хроматографическому элюированию и получают указанное в заголовке соединение (1,0 г,78%) в виде белого твердого вещества. Анализ. Вычислено: С, 58,86; Н, 8,23; N, 3,81. Найдено: С, 58,84; Н, 8,25; N, 3,96. Примеры Пример 1. 1-(R)-2-Циано-4'-[1-метил-2-(пропан-2-сульфониламино)этил]бифенил-4-карбоновая кислота Раствор 2-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пропиламида (2R)-пропан-2 сульфоновой кислоты (50 г, 136,2 ммоль), этилового эфира 3-циано-4-трифторметансульфонилоксибензойной кислоты (40 г, 123,8 ммоль), PdCl2(dppf)-ДХМ (3,03 г, 3,71 ммоль) и KOAc (36,43 г,371,4 ммоль) в ДМЭ:EtOH:H2O (200/200/200 мл) перемешивают в атмосфере азота при 80 С в течение 50 мин. Реакционную смесь выливают в лед с водой и экстрагируют EtOAc. Органический слой промывают водой и насыщенным водным раствором хлорида натрия, сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток подвергают хроматографии на силикагеле с использованием в качестве элюента градиент гексан/EtOAc от 4:1 до 3:1. Продукт растирают с гексаном, фильтруют и сушат, получая 37,95 г 1-(S)-этил-2-циано-4'-[1-метил-2-(пропан-2-сульфониламино)этил]бифенил-4-карбоксилатаMS(ES): m/z = 413,1 [М-Н]. 1-(R)-Этил-2-циано-4'-[1-метил-2-(пропан-2-сульфониламино)этил]бифенил-4-карбоксилат (37,95 г,91,7 ммоль) перемешивают в EtOH и водном 2 н. NaOH (458 мл, 916 ммоль) при комнатной температуре в течение 3 ч. EtOH удаляют и промывают водный слой Et2O. Водный слой подкисляют 1 н. HCl и затем экстрагируют этот слой EtOAc. Органический слой промывают водой и насыщенным водным раствором хлорида натрия, сушат над MgSO4, фильтруют и концентрируют в вакууме. Твердое вещество растирают с гексаном/МТБЭ (9:1), получая 28,4 г 1-(R)-2-циано-4'-[1-метил-2-(пропан-2-сульфониламино)этил]бифенил-4-карбоновой кислоты (80%).MS(ES): m/z = 385,1 [М-Н]. Способность соединения, соответствующего формуле I, усиливать ответную реакцию, медиатором которой является рецептор глутамата, может быть определена специалистом в данной области техники. См., например, патент США 6303816. В частности, можно применить следующий тест. Клетки HEK293, стабильно экспрессирующие iGluR4 человека (полученные как описано в опубликованной Европейской патентной заявкеЕР-А 1-0583917), использовали для электрофизиологического исследования усилителей действия АМРА-рецептора. Раствор для внеклеточной регистрации содержалNaOH и 295 мОсм кг-1. Раствор для внутриклеточной регистрации содержал (мМ): 140 CsCl, 1 MgCl2,10 HEPES, (N-[2-гидроксиэтил]пиперазин-N1-[2-этансульфоновую кислоту]) 10 EGTA (этилен-бис(оксиэтиленнитрило)тетрауксусной кислоты), рН 7,2 при добавлении CsOH и 295 мОсм кг-1. При использовании этих растворов сопротивление пипеток для регистрации составляло 2-3 МОм. Применяли методику фиксации потенциала (кламп-методика) с цельными клетками (Hamill et al. (1981) Pflgers Arch.,391: 85-100); клетки подвергали воздействию фиксированного напряжения -60 мВ и регистрировали кон-5 015600 трольный ток (отклик) для 1 мМ глутамата. Затем определяли отклик на 1 мМ глутамат в присутствии тестируемого соединения. Соединения считали активными в описанном тесте, если при концентрации в тесте, равной 10 мкМ (микромоль) или менее, они вызывали более чем 10%-ное повышение значения тока, вызываемого концентрацией глутамата 1 мМ. Для определения эффективности тестируемого соединения концентрацию тестируемого соединения как в промывочном растворе, так и в растворе, содержащем глутамат, повышали с полулогарифмическим шагом до достижения максимального наблюдаемого эффекта. Данные, полученные таким образом, подставляли в уравнение Хилла (Hill), из которого получали значение ЕС 50, являющееся показателем эффективности тестируемого соединения. Обратимость действия тестируемого соединения определяли, оценивая контрольные ответные реакции на 1 мМ глутамата. После повторного определения контрольного отклика на воздействие глутамата определяли усиление этих реакций под действием 100 мкМ циклотиазида, причем его вводили как в промывочный раствор, так и в раствор, содержащий глутамат. Таким способом можно определить эффективность тестируемого соединения по сравнению с эффективностью циклотиазида. Соединение, описанное в примере 1, подвергали исследованию, по существу, как описано выше, и было обнаружено, что его активность составляет 187,815,3 нМ (наномоль). Как таковое, соединение, описанное в примере 1, является эффективным усилителем действия АМРА. Кроме того, можно использовать некоторые поведенческие модели отчаяния у животных, которые могут быть реализованы специалистом в данной области техники, например тест с принудительным плаванием и тест с подвешиванием за хвост можно использовать для оценки потенциальной активности соединений согласно настоящему изобретению в качестве антидепрессантов при введении человеку. См.,например, "Experimental Approaches to Anxiety and Depression", под ред. J.M. Elliott, et al., (1992), JohnWileySons Ltd., глава 5, Behavioural Models of Depression, Porsolt и Lenegre, с. 73-85. Фармацевтические композиции согласно настоящему изобретению готовят известными способами с использованием хорошо известных и легкодоступных ингредиентов. При изготовлении композиций согласно настоящему изобретению активный ингредиент обычно смешивают с носителем, или разбавляют носителем, или вводят в носитель, и композиция может находиться в капсуле, саше, бумаге или другом контейнере. Если носитель имеет функцию разбавителя, он может представлять собой твердый,полутвердый или жидкий материал, который может служить носителем, наполнителем или средой для активного ингредиента. Композиции могут быть изготовлены в виде таблеток, пилюль, порошков, пастилок, саше, капсул, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей, мазей, содержащих,например, до 10 мас.% активного соединения, мягких и твердых желатиновых капсул, суппозиториев,стерильных растворов для инъекций и стерильных упакованных порошков. Некоторые примеры подходящих носителей, наполнителей и разбавителей включают лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, камедь, гуммиарабик, фосфат кальция, альгинаты, трагакантовую камедь, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон,целлюлозу, сироп в воде, метилцеллюлозу, метил- и пропилгидроксибензоаты, тальк, стеарат магния и минеральное масло. Составы могут дополнительно включать вещества, обеспечивающие скольжение,смачивающие вещества, эмульгирующие и суспендирующие вещества, консерванты, подсластители или вкусовые добавки. Композиции согласно настоящему изобретению могут быть приготовлены таким образом, чтобы обеспечивать быстрое, замедленное или отложенное высвобождение активного ингредиента после введения пациенту медикамента, при помощи процедур, хорошо известных в данной области техники. Композиции предпочтительно готовят в виде стандартной лекарственной формы; при этом каждая стандартная лекарственная форма содержит приблизительно от 0,1 до 300 мг, предпочтительно приблизительно от 0,1 до 100 мг и наиболее предпочтительно приблизительно от 1,0 до 100 мг соединения, соответствующего формуле I. Термин "стандартная лекарственная форма" означает физически дискретную единицу, которую можно использовать в качестве единичной дозы для введения человеку и другим млекопитающим; при этом каждая единица содержит заранее известное количество активного материала,рассчитанное таким образом, чтобы оно обеспечивало достижение желаемого терапевтического эффекта,в сочетании с подходящим фармацевтическим носителем, разбавителем или наполнителем. В настоящем описании термин "пациент" означает млекопитающее, например мышь, морскую свинку, крысу, собаку или человека. Очевидно, что предпочтительным пациентом является человек. В настоящем описании термины "лечение" или "лечить" означают снижение выраженности симптомов, устранение причины, либо временное, либо постоянное, или предотвращение или замедление возникновения симптомов указанного нарушения. Соответственно способы согласно настоящему изобретению включают как терапевтическое, так и профилактическое введение лекарственного средства. В настоящем описании термин "эффективное количество" означает количество соединения, соответствующего формуле I, которое после однократного или многократного введения соединения пациенту эффективно в лечении пациента, страдающего от названного нарушения. Эффективное количество может быть легко определено лечащим врачом-диагностом, который является специалистом в данной области, при помощи известных методик и по наблюдению за результатами, полученными в аналогичных случаях. При определении эффективного количества или дозировки-6 015600 лечащий врач-диагност должен учитывать ряд факторов, неограничивающие примеры которых включают вид млекопитающего; его размеры, возраст и общее состояние здоровья; конкретное заболевание или нарушение, которым страдает млекопитающее; степень развития или тяжесть заболевания или нарушения; ответную реакцию конкретного пациента; тип конкретного вводимого соединения; способ введения; характеристики биодоступности вводимого препарата; выбранный режим дозирования; наличие одновременно применяемых препаратов и другие существенные обстоятельства. Соединение, соответствующее формуле I, может быть введено различными путями, включая пероральный, перректальный, трансдермальный, подкожный, внутривенный, внутримышечный, буккальный или интраназальный пути введения. В качестве альтернативы соединение, соответствующее формуле I, может быть введено путем непрерывного вливания (инфузии). Обычная суточная доза содержит приблизительно от 0,005 до 10 мг/кг соединения, соответствующего формуле I. В предпочтительном случае суточные дозы содержат приблизительно от 0,005 до 5 мг/кг, в более предпочтительном приблизительно от 0,005 до 2 мг/кг. Дозировки медикаментов, применяемых в сочетании с предлагаемыми соединениями, также должны быть в конечном итоге установлены лечащим врачом на основании его знаний об указанных медикаментах,свойствах медикаментов, применяемых в сочетании, определенных в клинических испытаниях, и в соответствии с особенностями пациента, включая заболевания, отличающиеся от тех, которые лечит указанный лечащий врач. Инертные ингредиенты и способы введения вспомогательных фармацевтических материалов в композицию являются обычными. В данном случае могут быть использованы обычные способы получения фармацевтических составов, используемые в фармацевтике. В соответствии с настоящим изобретением могут быть использованы все обычные виды композиций, включая таблетки, жевательные таблетки, капсулы, растворы,парентеральные растворы, интраназальные спреи или порошки, драже, суппозитории, трансдермальные пластыри и суспензии. В общем случае композиции содержат приблизительно от 0,5 до 50% соединения в целом в зависимости от желаемых дозировок и типа используемых соединений. Тем не менее, количество соединений лучше всего выбирать равным эффективному количеству, то есть такому количеству каждого соединения, которое обеспечивает пациенту, нуждающемуся в таком лечении, необходимую дозировку лекарственного средства. Например, состав может включать 1% натрийкарбоксиметилцеллюлозы, 0,25% полисорбата 80 и 0,05% антивспенивателя Dow Corning Antifoam 1510-US в очищенной воде; состав вводят пероральным путем. Для ВВ (внутривенного введения) может быть использован ряд составов, например композиция, включающая 5% фармазольва, 1,8% 1 н. NaOH, 93,2% 5%-ной декстрозы в воде, или композиция, включающая 5% фармазольва и молярное отношение NaOH:активный ингредиент в 5%-ной декстрозе, равное 2:1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или его фармацевтически приемлемая соль. 2. Фармацевтическая композиция, содержащая соединение формулы или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем. 3. Применение соединения по п.1 в качестве фармацевтического средства для усиления действия функции рецептора глутамата у млекопитающего. 4. Применение соединения по п.1 для изготовления медикамента для лечения болезни Паркинсона. 5. Применение соединения по п.1 для изготовления медикамента для лечения депрессии. 6. Применение соединения по п.1 для изготовления медикамента для лечения шизофрении. 7. Способ усиления действия функции рецептора глутамата у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанном воздействии, эффективного количества соединения по п.1. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61P 25/16, A61P 25/18, C07C 311/06, A61K 31/18, A61P 25/24
Метки: действие, усиливающие, агенты, амра-рецепторов
Код ссылки
<a href="https://eas.patents.su/8-15600-agenty-usilivayushhie-dejjstvie-amra-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Агенты, усиливающие действие амра-рецепторов</a>
Предыдущий патент: Косметические средства, обладающие противомикробными свойствами
Следующий патент: Способ выделения теанина
Случайный патент: Способ усиления иммунореактивности












