Замещенные 4-(6-фтор-(1н)-индол-3-ил)-1,2,3,6-тетрагидропиридин для лечения нарушений центральной нервной системы
Формула / Реферат
1. Соединение формулы
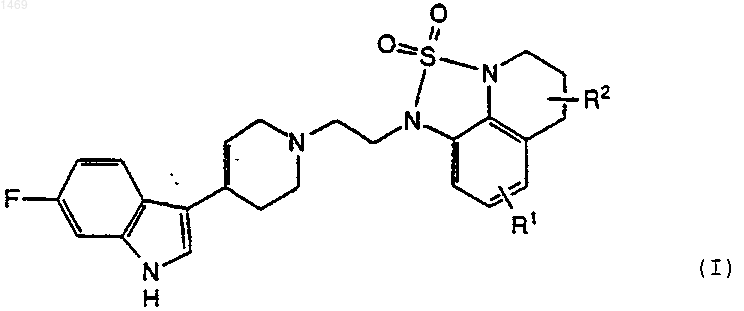
где R1 представляет водород, C1-4-алкил, C1-4-алкокси или галоген и R2 представляет водород, C1-4-алкил или C1-4-алкокси, или его соль.
2. Соединение по п.1, где как R1, так и R2 представляют водород или либо R1, либо R2 представляет водород.
3. Соединение по пп.1 или 2, где R1 представляет водород, метил, метокси или фтор и R2 представляет водород или метил.
4. 2,2-Диоксид 1-{2-[4-(6-фтор-1Н-индол-3-ил)-1,2,3,6-тетрагидро-1-пиридинил]-1-этил}-5,6-дигидро-1Н,4Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина или его соль.
5. 2,2-Диоксид 1-{2-[4-(6-фтор-1Н-индол-3-ил)-1,2,3,6-тетрагидро-1-пиридинил]-1-этил}-5,6-дигидро-1H,4Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина.
6. Фосфатная соль 2,2-диоксида 1-{2-[4-(6-фтор-1Н-индол-3-ил)-1,2,3,6-тетрагидро-1-пиридинил]-1-этил}-5,6-дигидро-1Н,4Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина.
7. Фармацевтическая композиция, включающая соединение по любому из пп.1-6 в комбинации с фармацевтически приемлемым разбавителем или носителем.
8. Соединение по любому из пп.1-6 в качестве фармацевтического средства.
9. Соединение по п.1 или его фармацевтически приемлемая соль, имеющие высокую связывающую активность в отношении 5-НТ2А-рецептора для лечения депрессии или страха.
10. Применение соединения по любому из пп.1-6 для приготовления лекарственного препарата для лечения нарушения центральной нервной системы.
11. Способ получения соединения по п.1, который включает взаимодействие соединения формулы
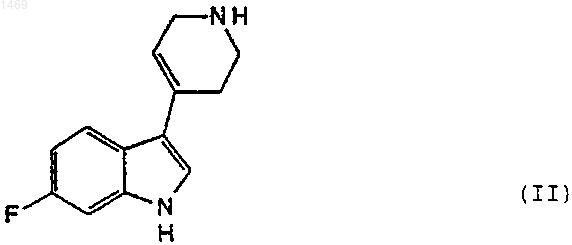
с соединением формулы
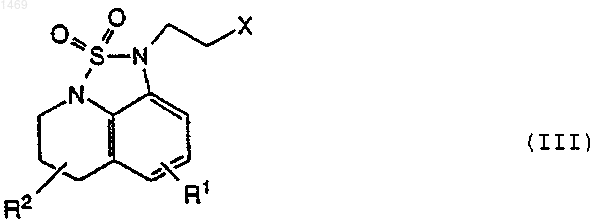
где X представляет уходящую группу.
12. Соединение по п.1, полученное способом по п.11.
13. Способ получения фармацевтической препаративной формы, который включает смешивание соединения по любому из пп.1-6 с фармацевтически приемлемым разбавителем или носителем.
14. Единичная дозированная форма, содержащая от 0,5 до 100 мг соединения по п.1 или его фармацевтически приемлемой соли в качестве активного ингредиента.
Текст
1 Данное изобретение относится к фармацевтическим соединениям и их использованию для лечения нарушений центральной нервной системы. Известно, что с некоторыми нейронными рецепторами серотонина (5-НТ), как, например,5-НТ 2 А-рецептором при определенных нарушениях центральной нервной системы, таких как, например, депрессия, происходят изменения. Одной из целей исследования для разработки улучшенных лекарственных средств является получение соединений, которые связываются со специфическими рецепторами, такими как 5-НТ 2 А-рецептор, и которые имеют также полезную активность в отношении других рецепторов, обеспечивая желаемый профиль активности без нежелательного или с минимальным побочным действием. Например, для лекарственного средства может быть желательно сочетание сродства к рецептору серотонина,а также ингибирующего действия в отношении повторного поглощения серотонина при наличии слабого связывания с 1-адренергическим рецептором и D2-рецептором допамина. Высокая степень сродства к 1- и D2-рецепторам связана с нежелательным сердечно-сосудистым и моторным побочным действием. Некоторые соединения, имеющие антагонистические в отношении серотонина свойства,описаны в Европейском патенте ЕР-А 0433149. Данное изобретение относится к соединениям формулы где R1 представляет водород, С 1-4-алкил, C1-4 алкокси или галоген и R2 представляет водород,С 1-4-алкил или С 1-4-алкокси, и их солям. Соединения изобретения и их фармацевтически приемлемые соли показаны для использования при лечении нарушений центральной нервной системы. Они активны в испытаниях in vitro и in vivo, что указывает на серотонергическую модуляцию и, особенно,связывающую активность по отношению к 5 НТ 2 А-рецептору, как описано ниже. В этом отношении соединения изобретения,неожиданным образом, оказались лучше, чем соединения известного уровня техники. Они также сильно ингибируют повторное поглощение серотонина и имеют очень низкое В вышеуказанной формуле (I) C1-4 сродство к 1- и D2-рецепторам. алкильная группа может быть разветвленной или неразветвленной и включает, например,метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил, предпочтительно, метил или этил, и, особенно, метил. C1-4-алкоксигруппа представляет собой одну такую алкильную группу, связанную с кольцом через атом кислорода, предпочтительно, метокси или этокси, и, 001469 2 особенно, метокси. Группа галоген, предпочтительно, представляет хлор или фтор, и, особенно, фтор. Предпочтительной группой соединений является группа соединений вышеуказанной формулы (I), где как R1, так и R2, представляют водород или либо R1, либо R2 представляет водород, и их соли. R1, предпочтительно, представляет водород, метил, метокси или фтор и R2,предпочтительно, представляет водород или метил. Наиболее предпочтительным соединением является 2,2-диоксид 1-2-[4-(6-фтор-1 Н-индол 3-ил)-1,2,3,6-тетрагидро-1-пиридинил]-1-этил 5,6-дигидро-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина и его соли, имеющие структуру вышеприведенной формулы (I), где как R1, так и R2 представляют водород. Как указано выше, можно, конечно, получить соли соединений изобретения, и такие соли включены в объем данного изобретения. Кислотно-аддитивные соли представляют собой,предпочтительно, фармацевтически приемлемые, нетоксичные аддитивные соли с подходящими кислотами, такие как соли с неорганическими кислотами,например,хлористоводородной, бромисто-водородной, азотной,серной или фосфорной кислотой, или с органическими кислотами, такими как органические карбоновые кислоты, например, гликолевая,малеиновая, гидроксималеиновая, яблочная,винная,лимонная,салициловая,оацетоксибензойная, или органические сульфоновые кислоты, 2-гидроксиэтансульфоновая,толуол-п-сульфоновая, нафталин-2-сульфоновая или бисэтан-сульфоновая кислота. Фосфат является наиболее предпочтительной солью. Помимо фармацевтически приемлемых солей в изобретение включены другие соли. Они могут служить в качестве промежуточных продуктов для очистки соединений или для получения соединений, или для получения других,например,фармацевтически приемлемых кислотно-аддитивных солей, или их можно использовать для идентификации, характеризации или очистки. Понятно, что соединения изобретения могут иметь один или несколько асимметричных атомов углерода, которые обуславливают наличие изомеров. Соединения обычно получают в виде рацемических смесей, но при желании индивидуальные изомеры можно выделить общепринятыми методиками. Такие рацемические смеси и индивидуальные оптические изомеры представляют собой часть данного изобретения,причем соединения применяют в виде рацематов или в энантимерно чистой форме. Изобретение включает способ получения соединений изобретения. Соединения можно получить,например,реакцией индолилпиперидинил-соединения формулы где X представляет уходящую группу, такую как галоген, особенно хлор. Реакцию, предпочтительно, проводят в полярном растворителе,таком как, например, ацетонитрил или вода, в присутствии основания, такого как, например,карбонат натрия, и при температуре от 50 С до 150 С. Соединение формулы (II) можно получить способами, известными в данной области, например, реакцией 4-пиперидона с 6-фториндолом в присутствии основания, такого как гидроксид калия, и с применением в качестве растворителя спирта, такого как метанол. Аналогично этому, способы получения соединений формулы (III) известны в данной области, как,например, реакцией диоксида тиадиазолхинолина в форме соли с 1,2-дигалогенэтаном в присутствии гидрида натрия и подходящего растворителя, такого как диметилформамид. Как указано выше, соединения изобретения активны в отношении и 5-НТ 2 А-рецептора серотонина. Их связывающую активность демонстрировали в испытании, описанном в Nelson, D. L. Et al., J. Pharmacol. Exp. Ther., 265,1272-1279, в котором сродство соединения к 2 А-рецептору человека измеряют по его способности замещать лиганд [3 Н]-кетансерин. В этом испытании соединения изобретения в следующих примерах имели значения Ki меньше,чем 6 нМ. Они, по меньшей мере, в четыре раза более активны в этом испытании, чем самое близкое по структуре соединение, конкретно описанное в Европейском патенте ЕР-А 0433149, а именно, 2,2-диоксид 1-3-[4-(5-фтор 1 Н-индол-3-ил)-1,2,3,6-тетрагидро-1 пиридинил]-1-пропил-5,6-дигидро-1 Н,4 Н 1,2,5-тиадиазоло[4,3,2-ij]хинолин. Действительно, наиболее активное соединение изобретения, соединение, у которого какR1, так и R2, представляют водород, приблизительно в двадцать восемь раз более активно. Сродство соединений изобретения к 5 НТ 2 А-рецептору и их превосходство подтверждали на модели морской свинки, используя модифицированный вариант испытания, описанного в Skingle, M. Et al., J. Psychopharmacol. 8, 14-21, в котором наблюдают влияние соединения на гипертермию, индуцированную 2,5 диметокси-4-иодамфетамином (DOI). 4 Кроме того, соединения изобретения являются ингибиторами повторного поглощения серотонина и обладают превосходной активностью как, например, в испытании, описанном вCarrol et al., J. Med. Chem. (1993), 36, 2886-2890,в котором измеряют свойственную активность соединения полностью ингибировать связывание селективных ингибиторов повторного поглощения серотонина с переносчиком серотонина. Эти результаты были подтверждены также испытаниями in vivo, в которых измеряют действие соединения на поведенческий синдром у мышей, которым вводили 5-НТР и ингибитор моноаминоксидазы (MAOI), такой как паргилин, см. Christensen, А.V., et al., Eur. J. Pharmacol. 41, 153-162 (1977). Как указано выше, соединения изобретения имеют превосходный профиль связывания рецептора, который не только объединяет исключительно высокое связывание 2 А и превосходное ингибирование повторного поглощения,но также имеет требуемое низкое сродство к 1 и D2-рецепторам. Измерение первого описано вGreengrass P. et al., Eur. J. Pharmacol. 55: 323326, и измерение последнего описано в Hall H.Et al., Prog. Neuro-Psycopharmacol. Biol. Psychiat. 12: 559-568. Этот характеристический профиль активности отличает соединения изобретения от структурно родственного соединения известного уровня техники, указанного выше. Другие соединения известного уровня техники, такие как соединения, описанные в J. Med. Chem. 1991, 34, 2477-2483 Chem. и J. Med. Chem. 1993,36, 1194-1202, имеют дополнительные структурные отличия или у них отсутствует эффективность in vivo. В связи с селективным сродством соединений изобретения к рецепторам серотонина,они показаны для использования при лечении различных состояний, таких как депрессия, биполярное расстройство, тревога, ожирение, нарушения питания, такие как анорексия и булимия, алкоголизм, боль, гипертензия, старение,потеря памяти, сексуальная дисфункция, психотические нарушения, шизофрения, желудочнокишечные расстройства, головная боль, сердечно-сосудистые нарушения, прекращение курения, эпилепсия, злоупотребление лекарственными средствами и наркомания, рвота, болезнь Альцгеймера и нарушения сна. Соединения изобретения, главным образом, предназначаются для лечения депрессии или страха или нарушений с депрессивным симптомом или симптомом страха. Соединения изобретения эффективны в широком интервале доз, причем точная вводимая доза зависит от таких факторов, как конкретное используемое соединение, состояние,которое лечат, тип и размер животного, которого лечат. Однако, требуемая доза обычно находится в пределах от 0,001 до 20, таком как от 0,01 до 20 мг/кг в день, например, при лечении 5 взрослых людей можно использовать дозы от 0,5 до 100 или 200 мг в день. Соединения изобретения обычно вводят перорально или инъекцией, и для этой цели соединения обычно используют в форме фармацевтической композиции. Такие композиции получают способами, хорошо известными в фармацевтической области, и включают, по меньшей мере, одно активное соединение. Соответственно, изобретение включает фармацевтическую композицию, содержащую в качестве активного ингредиента соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым разбавителем или носителем. При изготовлении композиций изобретения активный ингредиент обычно смешивают с носителем или разбавляют носителем, или заключают в носитель, который может быть в форме капсулы, саше, бумаги или другого контейнера. Конечно, можно применять более чем один активный ингредиент или наполнитель. Наполнителем может быть твердый, полутвердый или жидкий материал, который действует в качестве носителя, наполнителя или среды для активного ингредиента. Некоторыми примерами подходящих наполнителей являются лактоза, декстроза,сахароза, сорбит, маннит, крахмалы, аравийская камедь, фосфат кальция, альгинаты, трагакант,желатин, сироп, метилцеллюлоза, метил- и пропилгидроксибензоат, тальк, стеарат магния или масло. Композиции изобретения, при желании,могут быть изготовлены так, чтобы обеспечить быстрое, длительное или замедленное высвобождение активного ингредиента после введения пациенту. В зависимости от пути введения, вышеупомянутые композиции можно изготовить в виде таблеток, капсул или суспензий для перорального введения или растворов или суспензий для инъекций для парентерального введения или в виде суппозиториев. Предпочтительно,композиции изготовляют в виде единичной дозированной формы, причем каждая доза содержит от 0,5 до 100 мг, как правило, от 1 до 100 мг, активного ингредиента. Следующие примеры иллюстрируют получение соединений изобретения. Пример 1. 1-Диметиламино-2-(4-фтор-2 нитро)фенилэтен. Смесь 4-фтор-2-нитротолуола (50 г, 0,32 моль),диметилацеталя диметилформамида(76,77 г) и диметилформамида (910 мл) кипятили с обратным холодильником в атмосфере азота при перемешивании в течение 7 ч, охлаждали, оставляли для выстаивания в течение 16 ч,выливали в смесь лед-вода (2000 мл), перемешивали в течение 15 мин, полученный осадок выделяли фильтрованием, промывали водой(500 мл) и сушили, получая красный твердый продукт. 6 6-Фториндол. Гидрогенизатор Кука (Cook) объемом 40 л загружали в атмосфере азота 10% палладием на угле (9 г), суспендированным в толуоле (400 мл). К этой суспензии добавляли 1 диметиламино-2-(4-фтор-2-нитро)фенилэтен(137,2 г, 0,653 моль) в толуоле (1400 мл) и смесь гидрировали при 5,625 атм (80 пси) в течение 3,5 ч. Суспензию затем фильтровали через слой целита, который промывали толуолом (2 х 200 мл), и фильтрат и промывочную жидкость выпаривали при пониженном давлении, получая коричневое масло, которое кристаллизовалось при стоянии с образованием желто-коричневого твердого продукта 93,65 г. Этот твердый продукт растворяли в смеси этилацетат-гексан (7:3) и фильтровали через слой флэш-диоксида кремния. Целевые фракции собирали и выпаривали при пониженном давлении, получая бледнокоричневый твердый продукт. 4-(6-Фтор-[1 Н]-индол-3-ил)-1,2,3,6-тетрагидропиридин. Порошкообразный гидроксид калия (144,4 г) осторожно добавляли к механически перемешиваемой смеси 6-фториндола (42,23 г, 0,364 моль) и моногидрата гидрохлорида пиперидона(111,93 г, 0,728 моль) в метаноле (1500 мл). Смесь затем кипятили с обратным холодильником в атмосфере азота в течение 18 ч и затем добавляли еще гидроксид калия (40 г) и реакционную смесь затем кипятили с обратным холодильником в течение дополнительных 4 ч. Реакционную смесь оставляли для охлаждения до комнатной температуры, выливали в смесь ледвода (3000 мл) и перемешивали в течение 1 ч. Осажденный твердый продукт выделяли фильтрованием и сушили при 50 С в вакууме, получая твердый продукт. 8-Амино-1,2,3,4-тетрагидрохинолин. 8-Нитрохинолин (25 г, 0,143 моль) растворяли в уксусной кислоте (300 мл) и каталитически гидрировали над PtO2 (0,75 г) при 4,570 атм(65 пси) в течение ночи при комнатной температуре. Катализатор удаляли фильтрованием через слой целита и растворитель удаляли фильтрованием. Остаток растворяли в СН 2 Сl2 и добавляли водный гидрокарбонат натрия. Органическую часть экстрагировали СН 2 Сl2 и экстракты промывали водой (3 х 100 мл) и солевым раствором(3 х 100 мл). Экстракты затем сушили над безводным сульфатом магния, фильтровали и выпаривали, получая сырой продукт в виде коричневого масла. Его немедленно растворяли в СН 2 Сl2 и фильтровали через короткий слой диоксида кремния с элюированием этилацетатом,получая указанное в заголовке соединение. Калиевая соль 2,2-диоксида 5,6-дигидро 1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина. 8-Аминотетрагидрохинолин (6,60 г, 0,045 моль) в сухом диглиме (диметиловый эфир диэтиленгликоля) добавляли к перемешиваемому раствору сульфамида (4,93 г, 0,051 моль) в су 7 хом диглиме (40 мл) при 155-160 С. Реакционную смесь затем нагревали в течение 2 ч. После этого времени реакционную смесь охлаждали до комнатной температуры, добавляли воду и смесь подкисляли 1 н хлористоводородной кислотой. Раствор экстрагировали трет-бутиловым простым эфиром (4 х 100 мл). Экстракты промывали водой (2 х 100 мл) и затем добавляли уголь и фильтровали, получая прозрачный красный раствор. Затем к раствору по каплям добавляли 8 н гидроксид калия, осаждая белый твердый продукт. Его отделяли фильтрованием и промывали простым эфиром, получая целевой продукт. 2,2-Диоксид 2-хлорэтил-5,6-дигидро-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина. 2,2-Диоксид 5,6-дигидро-1 Н-4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина (1,92 г, 0,009 моль) растворяли в сухом ДМФ (80 мл) и по частям в атмосфере азота при комнатной температуре добавляли гидрид натрия (0,48 г, 0,010 моль). В виде одной порции добавляли бромхлорэтан(1,44 г, 0,010 моль) и раствор перемешивали в течение ночи при комнатной температуре. Реакционную смесь гасили водой, экстрагировали этилацетатом, объединенные экстракты промывали солевым раствором, сушили над безводным сульфатом магния, фильтровали и выпаривали при пониженном давлении, получая коричневое масло. Материал очищали хроматографией на флэш-диоксиде кремния, элюируя 20% смесью этилацетат/гексан. Продукт получали в виде светлого масла, которое кристаллизовалось при стоянии. 2,2-Диоксид 1-2-[4-(6-фтор-[1 Н]индол-3 ил)-1,2,3,6-тетрагидро-1-пиридинил]-1-этил 5,6-дигидро-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина. 2,2-Диоксид 2-хлорэтил-5,6-дигидро-1 Н,4 Н-1,2,5-тиадиазоло [4,3,2-ij] хинолина (3,75 г,0,0137 моль) и 4-(6-фтор-[1 Н]-индол-3-ил)1,2,3,6-тетрагидропиридин (2,97 г, 0,0137 моль) в воде (120 мл), содержащий карбонат натрия(7,26 г, 0,0085 моль), с каталитическим количеством иодида натрия (0,08 г) кипятили с обратным холодильником в течение 18 ч. После охлаждения материал экстрагировали дихлорметаном, экстракты сушили безводным сульфатом магния, фильтровали и выпаривали, получая оранжевую пену. Этот материал очищали хроматографией с элюированием дихлорметаном,затем смесью 5% метанол/дихлорметан, получая продукт в виде бледно-желтого твердого вещества. Продукт перекристаллизовывали из этилацетата, т. пл, 183-185 С. Свободное основание растворяли в метаноле, добавляли ортофосфорную кислоту и белый осадок отделяли фильтрованием и сушили в вакууме, получая фосфатную соль, т. пл. 156158 С. 8 Пример 2. Получение промежуточных продуктов. 6-Фтор-8-нитрохинолин. Серную кислоту (75%, об./об.) (116 г) добавляли к смеси 3-нитробензолсульфоната натрия (46,4 г, 0,206 моль), 2-нитро-4 фторанилина (25 г, 0,156 моль) и глицерина (29 г, 0,315 моль) и медленно нагревали до 130135 С и выдерживали при этой температуре в течение 8 ч. Ее охлаждали и оставляли для стояния в течение 11 ч, разбавляли водой (100 мл), делали основной при помощи аммиака(d=0,88 г/мл) и осажденный твердый продукт отделяли фильтрованием. Фильтрат промывали гидроксидом натрия (2 М, 2 х 50 мл) и водой (3 х 50 мл), сушили на воздухе и затем сушили в вакууме при 60 С в течение 4 ч, получая 6-фтор 8-нитрохинолин в виде твердого продукта. 8-Амино-6-фтор-1,2,3,4-тетрагидрохинолин. Оксид платины (0,475 г) добавляли к раствору 6-фтор-8-нитрохинолина (14,0 г, 72,9 ммоль) в уксусной кислоте (195 мл) и гидрировали при 4,219 атм (60 пси) в течение 24 ч. Раствор в уксусной кислоте фильтровали через целит для удаления катализатора и затем выпаривали в вакууме и остаток обрабатывали толуолом (150 мл). Толуол удаляли в вакууме и добавляли дополнительное количество толуола. Полученный раствор фильтровали и затем выпаривали в вакууме. Сырой продукт, темную жидкость, использовали непосредственно в следующей стадии. 2,2-Диоксид 8-фтор-5,6-дигидро-1 Н,4 Н-1,2,5 тиадиазоло[4,3,2-ij]хинолина. Сырой 8-амино-6-фтор-1,2,3,4-тетрагидрохинолин (10,34 г, 62,29 ммоль) в сухом пиридине (60 мл) добавляли к горячему сульфамиду(7,026 г, 74,75 ммоль) в сухом пиридине (60 мл) и смесь нагревали и перемешивали при кипячении с обратным холодильником в течение 4 ч. Ее охлаждали и оставляли для стояния в течение ночи. Пиридин выпаривали в вакууме, получая черный остаток, который распределяли между этилацетатом (300 мл) и 2 М хлористоводородной кислотой (195 мл). Смесь встряхивали, разделяли и промывали дополнительным количеством 2 М хлористоводородной кислоты(100 мл), водой (100 мл) и затем снова разделяли. Раствор сушили над сульфатом магния,сульфат магния удаляли фильтрованием и фильтрат обрабатывали углем. Уголь затем удаляли фильтрованием, фильтрат выпаривали и затем выпаривали в вакууме, получая слегка розоватый твердый продукт, т. пл. 174-176 С. 3-Метил-8-нитрохинолин. Серную кислоту (34 мл, 63,2 г, 645,2 ммоль) в воде (12 мл) добавляли к смеси пентоксида мышьяка (22,25 г, 96,8 ммоль) и 2 нитроанилина (22,28 г, 161,3 ммоль) и твердую часть растворяли. Полученный раствор затем нагревали до 100 С и добавляли диацетат 2 9 метил-2-пропен-1,1-диола (50 г, 290,3 ммоль),вызывая экзотермическую реакцию, которую регулировали так, чтобы температура не превышала 130 С. После добавления диацетата 2 метил-2-пропен-1,1-диола смесь нагревали и перемешивали при 130 С в течение 2 ч. Реакционную смесь затем охлаждали и выливали в смесь лед-вода. Полученную смесь делали основной водным раствором гидроксида натрия(50%) и затем добавляли толуол, и смесь нагревали до 90 С в течение 1 ч. Слой толуола затем декантировали и заменяли другой порцией толуола (400 мл). Смесь затем нагревали и перемешивали в течение ночи и толуол декантировали. Затем добавляли еще толуол (400 мл) и смесь нагревали и перемешивали в течение 2 ч до декантирования и объединения с двумя предыдущими экстрактами в толуоле. Объединенные экстракты в толуоле сушили (MgSO4),фильтровали и фильтрат выпаривали в вакууме,получая темно-коричневый твердый продукт. Этот твердый продукт растирали и диэтиловым простым эфиром, твердый продукт, выделенный фильтрованием, измельчали, промывали простым эфиром и сушили в вакууме при 50 С в течение 2 ч, получая твердый продукт. 8-Амино-3-метил-1,2,3,4-тетрагидрохинолин. Оксид платины (0,375 г) добавляли к раствору 3-метил-8-нитрохинолина (12,47 г, 66,3 ммоль) в уксусной кислоте (150 мл) и гидрировали при 4,219 атм (60 пси) в течение 24 ч. Раствор в уксусной кислоте фильтровали через целит для удаления катализатора и затем выпаривали в вакууме и остаток обрабатывали толуолом (150 мл). Толуол удаляли в вакууме. Добавляли еще толуол и полученный раствор фильтровали и затем выпаривали в вакууме. Сырой продукт затем растворяли в этилацетате и очищали хроматографией на подушке диоксида кремния. Собирали и объединяли фракции этилацетата, содержащие продукт, затем промывали водным раствором гидрокарбоната натрия (75 мл), сушили (MgS04) и фильтровали. Фильтрат выпаривали в вакууме, получая темно-коричневое масло. Калиевая соль 2,2-диоксида 5-метил-5,6 дигидро-1 Н-4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина. 8-Амино-3-метил-1,2,3,4-тетрагидрохинолин (7,56 г, 46,66 ммоль) в сухом пиридине (50 мл) добавляли к горячему сульфамиду (5,38 г,56 ммоль) в сухом пиридине (50 мл) и смесь нагревали и перемешивали механически при кипячении с обратным холодильником в течение 2 ч. Пиридин выпаривали в вакууме, получая черный остаток, который распределяли между этилацетатом и 2,5 М хлористо-водородной кислотой. Кислотный слой отделяли и органический слой промывали солевым раствором. Водный кислотный слой затем экстрагировали этилацетатом (3 х) и экстракт объединяли с первоначальным слоем этилацетата, обрабатывали углем, сушили сульфатом магния, фильтровали 10 и фильтрат выпаривали в вакууме, получая оранжевый твердый продукт. Этот твердый продукт растворяли в минимальном количестве трет-бутилметилового простого эфира и полученный раствор обрабатывали 8 М раствором гидроксида калия. Осажденный твердый продукт кремового цвета собирали фильтрованием и сушили в вакууме при 50 С, получая калиевую соль в виде твердого продукта, т. пл. 250 С. Следующие соединения изобретения были получены, как в примере 1, с использованием промежуточных продуктов, полученных способом, описанным выше. 2,2-Диоксид R,S-1-(2-(4-(6-фториндол-3 ил)-1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6 дигидро-4-метил-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2ij]хинолина, т. пл. 196-197 С. 2,2-Диоксид R,S-1-(2-(4-(6-фториндол-3 ил)-1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6 дигидро-5-метил-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2ij]хинолина, т. пл. 197-200 С. 2,2-Диоксид R,S-1-(2-(4-(6-фториндол-3 ил)-1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6 дигидро-6-метил-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2ij]хинолина, т. пл. 156-158 С. 2,2-Диоксид 1-(2-(4-(6-фториндол-3-ил)1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6-дигидро-7-метил-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина, т. пл. 187,8-189,7 С. 2,2-Диоксид 1-(2-(4-(6-фториндол-3-ил)1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6-дигидро-8-метил-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина, т. пл. 169,4-174 С. 2,2-Диоксид 1-(2-(4-(6-фториндол-3-ил)1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6-дигидро-9-метил-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij] хинолина, т. пл. 189,2-190,3 С. 2,2-Диоксид 7-фтор-1-(2-(4-(6-фториндол 3-ил)-1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6 дигидро-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина, т. пл. 178-178,4 С. 2,2-Диоксид 8-фтор-1-(2-(4-(6-фториндол 3-ил)-1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6 дигидро-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина, т. пл. 173-175 С. 2,2-Диоксид 9-фтор-1-(2-(4-(6-фториндол 3-ил)-1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6 дигидро-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина, т. пл. 188-190 С. 2,2-Диоксид 1-(2-(4-(6-фториндол-3-ил)1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6-дигидро-9-этил-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij] хинолина, т. пл. 166,4-168 С. 2,2-Диоксид 1-(2-(4-(6-фториндол-3-ил)1,2,3,6-тетрагидропиридин-1-ил)этил)-5,6-дигидро-9-метокси-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2ij]хинолина, т. пл. 187-189 С. Следующие примеры иллюстрируют типичные препаративные формы, содержащие соединение изобретения. Пример 3. Таблетки, каждая из которых содержит 10 мг активного ингредиента, изготовляют следующим образом: Активный ингредиент Крахмал Микрокристаллическая целлюлоза Поливинилпирролидон(в виде 10% раствора в воде) Натриевая соль карбоксиметилцеллюлозы Стеарат магния Всего Активный ингредиент, крахмал и целлюлозу тщательно смешивают. Раствор поливинилпирролидона смешивают с полученными порошками и пропускают через сито. Полученные таким образом гранулы сушат и снова пропускают через сито. К гранулам затем добавляли натриевую соль карбоксиметилцеллюлозы и стеарат магния и после смешивания гранулы прессуют на таблеточной машине, получая таблетки, каждая из которых весит 300 мг. Пример 4. Капсулы, каждая из которых содержит 20 мг активного ингредиента, изготовляют следующим образом: Активный ингредиент Высушенный крахмал Стеарат магния Всего Активный ингредиент, крахмал и стеарат магния пропускают через сито и заполняют в твердые желатиновые капсулы в количестве 200 мг. Пример 5. Капсулы, каждая из которых содержит 20 мг лекарственного средства, изготовляют следующим образом: Активный ингредиент Лактоза Лаурилсульфат натрия Натриевая соль гликолята крахмала Стеарат магния Активный ингредиент, лактозу, лаурилсульфат натрия и натриевую соль гликолята крахмала тщательно перемешивают. Смесь смешивают со стеаратом магния и заполняют в твердые желатиновые капсулы в количестве 200 мг. Пример 6. Таблетки, каждая из которых содержит 20 мг лекарственного средства, получают следующим образом: Активный ингредиент Лактоза Микрокристаллическая целлюлоза Гидроксипропилметилцеллюлоза Натриевая соль гликолята крахмала Стеарат магния Активный ингредиент, лактозу, микрокристаллическую целлюлозу, натриевую соль гли 12 колята крахмала и гидроксипропилметилцеллюлозу пропускают через сито и смешивают вместе. К смешанному порошку добавляют воду для образования сырой массы. Сырую массу пропускают через грубое сито,сушат, затем снова просеивают. Сухие гранулы смешивают со стеаратом магния и прессуют в таблетки массой 300 мг. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы где R1 представляет водород, C1-4-алкил, C1-4 алкокси или галоген и R2 представляет водород,C1-4-алкил или C1-4-алкокси, или его соль. 2. Соединение по п.1, где как R1, так и R2 представляют водород или либо R1, либо R2 представляет водород. 3. Соединение по п.1 или 2, где R1 представляет водород, метил, метокси или фтор и R2 представляет водород или метил. 4. 2,2-Диоксид 1-2-[4-(6-фтор-1 Н-индол 3-ил)-1,2,3,6-тетрагидро-1-пиридинил]-1-этил 5,6-дигидро-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина или его соль. 5. 2,2-Диоксид 1-2-[4-(6-фтор-1 Н-индол 3-ил)-1,2,3,6-тетрагидро-1-пиридинил]-1-этил 5,6-дигидро-1H,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина. 6. Фосфатная соль 2,2-диоксида 1-2-[4-(6 фтор-1 Н-индол-3-ил)-1,2,3,6-тетрагидро-1-пиридинил]-1-этил-5,6-дигидро-1 Н,4 Н-1,2,5-тиадиазоло[4,3,2-ij]хинолина. 7. Фармацевтическая композиция, включающая соединение по любому из пп.1-6 в комбинации с фармацевтически приемлемым разбавителем или носителем. 8. Соединение по любому из пп.1-6 в качестве фармацевтического средства. 9. Соединение по п.1 или его фармацевтически приемлемая соль, имеющие высокую связывающую активность в отношении 5-НТ 2 Арецептора для лечения депрессии или страха. 10. Применение соединения по любому из пп.1-6 для приготовления лекарственного препарата для лечения нарушения центральной нервной системы. 11. Способ получения соединения по п.1,который включает взаимодействие соединения формулы где X представляет уходящую группу. 12. Соединение по п.1, полученное способом по п.11. 14 13. Способ получения фармацевтической препаративной формы, который включает смешивание соединения по любому из пп.1-6 с фармацевтически приемлемым разбавителем или носителем. 14. Единичная дозированная форма, содержащая от 0,5 до 100 мг соединения по п.1 или его фармацевтически приемлемой соли в качестве активного ингредиента.
МПК / Метки
МПК: C07D 513/06, A61K 31/475, A61P 25/24
Метки: центральной, замещенные, лечения, нервной, нарушений, системы, 4-(6-фтор-(1н)-индол-3-ил)-1,2,3,6-тетрагидропиридин
Код ссылки
<a href="https://eas.patents.su/8-1469-zameshhennye-4-6-ftor-1n-indol-3-il-1236-tetragidropiridin-dlya-lecheniya-narushenijj-centralnojj-nervnojj-sistemy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 4-(6-фтор-(1н)-индол-3-ил)-1,2,3,6-тетрагидропиридин для лечения нарушений центральной нервной системы</a>
Предыдущий патент: Фармацевтическая композиция, содержащая ингибитор иммуноглобулин-рецепторного взаимодействия
Следующий патент: Синергетическая гербицидная композиция и способ борьбы с сорняками
Случайный патент: Способ склеивания заготовок паркета и пресс для его осуществления












