Производные изоиндолоиндолона, способ их получения и содержащие их фармацевтические композиции
Номер патента: 4035
Опубликовано: 25.12.2003
Авторы: Руссо Анн, Бутэн Жан Альбер, Вержбиский Мишель, Буссар Мари-Франсуа, Делагранж Филипп
Формула / Реферат
1. Соединение формулы (I)
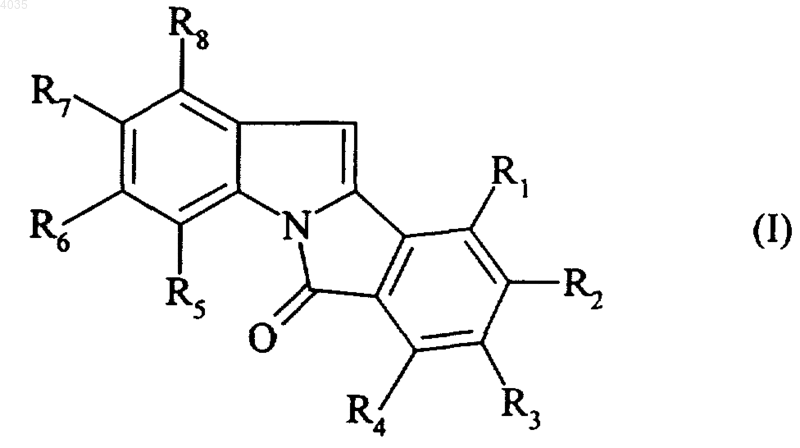
где R1, R2, R3, R4, R5, R6 и R8, которые могут быть одинаковыми или различными, каждый означает атом водорода или линейную или разветвленную (C1-C6)алкильную группу, арил(C1-C6)алкильную группу, в которой алкил может быть линейным или разветвленным, гидроксильную группу, линейную или разветвленную (C1-C6)алкоксигруппу, арил(C1-C6)алкоксигруппу, в которой алкоксильный остаток может быть линейным или разветвленным, линейную или разветвленную (C1-C6)ацилоксигруппу, арилкарбонилоксигруппу, карбокси(C1-C6)алкильную группу, в которой алкил может быть линейным или разветвленным, или карбоксильную группу,
R7 означает атом водорода или гидроксильную группу, линейную или разветвленную (C1-C6)алкоксигруппу, арил(C1-C6)алкоксигруппу, в которой алкоксильный остаток может быть линейным или разветвленным, линейную или разветвленную (C1-C6)ацилоксигруппу или арилкарбонилоксигруппу,
или одна из групп R1-R8 вместе с другой из групп R1-R8, расположенной рядом с ней, образует (C1-C2)алкилендиоксигруппу,
его оптические изомеры, если они существуют, и его аддитивные соли с фармацевтически приемлемыми кислотой или основанием,
при условии, что, как минимум, одна из групп R1-R8 означает гидроксильную группу, линейную или разветвленную (C1-C6)алкоксигруппу, линейную или разветвленную (C1-C6)ацилоксигруппу или арилкарбонилоксигруппу и что соединения формулы (I) являются другими, а не 1,3-диметокси-6H-изоиндоло[2,1-a]индол-6-оном.
2. Соединение формулы (I) по п.1, которое представляет собой 2-гидрокси-8,9-диметоксиизоиндоло[2,1-a]индол-6-он.
3. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (II)
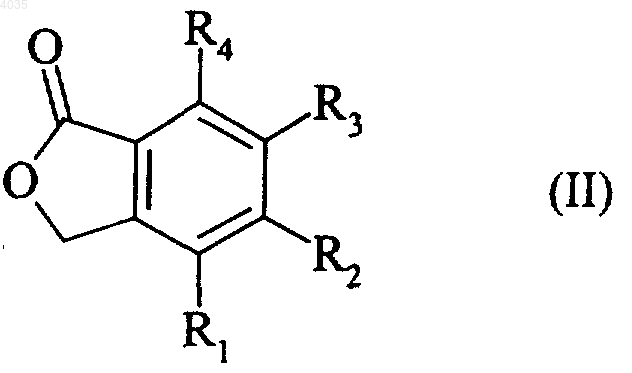
где R1, R2, R3 и R4 являются такими, как указано для формулы (I),
подвергается реакции с N-бромсукцинимидом с образованием соединения формулы (III)
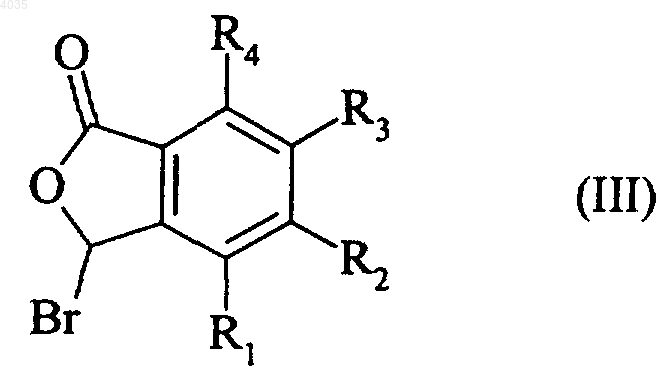
где R1, R2, R3 и R4 являются такими, как указано выше,
которое реагирует с трифенилфосфином с образованием соединения формулы (IV)
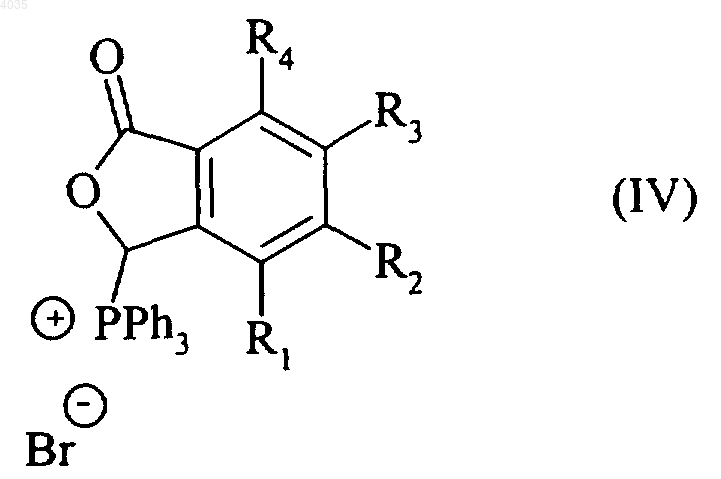
где R1, R2, R3 и R4 являются такими, как указано выше,
которое взаимодействует с соединением формулы (V)
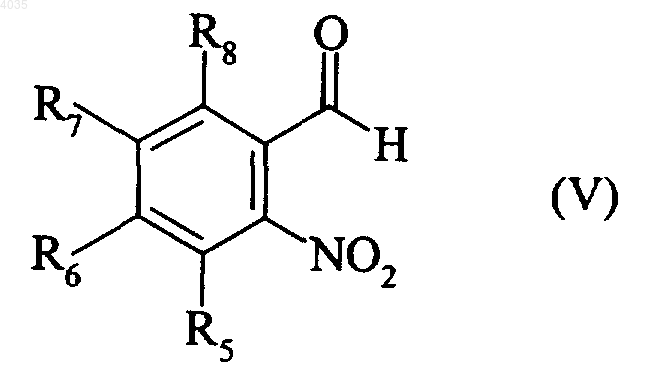
где R5, R6, R7 и R8 являются такими, как указано для формулы (I),
с образованием соединения формулы (VI)
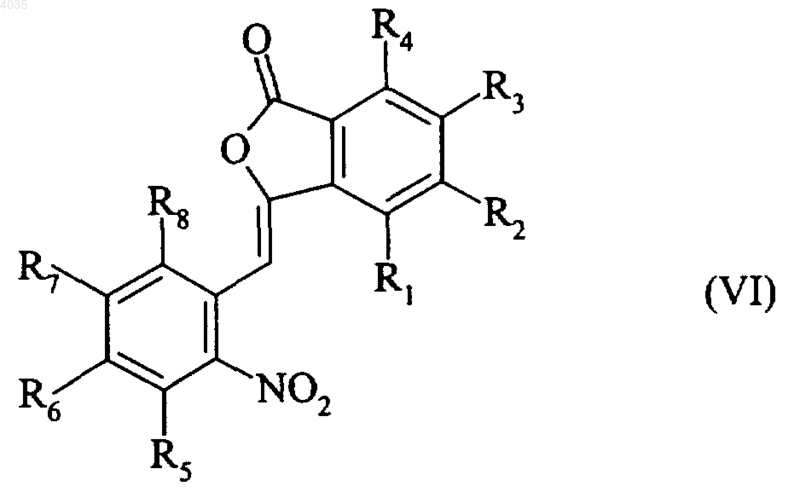
где R1, R2, R3, R4, R5, R6, R7 и R8 являются такими, как указано выше,
соединение формулы (VI) подвергают действию восстанавливающего агента и получают соединение формулы (VII)
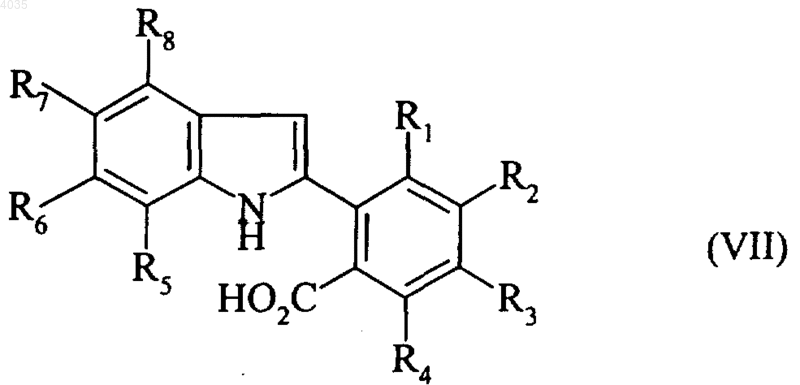
где R1, R2, R3, R4, R5, R6, R7 и R8 являются такими, как указано выше,
которое затем подвергают циклизации с образованием соединения формулы (I), которое, если необходимо, очищают в соответствии с принятой методикой очистки и разделяют, если желательно, на его оптические изомеры согласно обычной методике разделения, и превращают, если желательно, в аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
4. Фармацевтические композиции, включающие в качестве активного ингредиента соединение формулы (I) по п.1 или 2 в комбинации с одним или несколькими фармацевтически приемлемыми инертными нетоксичными носителями.
5. Фармацевтические композиции по п.4 для использования при получении лекарственных средств для лечения нарушений мелатонинергической системы.
Текст
1 Настоящее изобретение относится к новым производным изоиндолоиндолона, к способу их получения и к содержащим их фармацевтическим композициям, а также к их применению при лечении нарушений мелатонинергической системы. Ряд производных изоиндолоиндолона описан в литературе, в частности, в Tetrahedron 1993, 49 (1), 151-164, без указания какой-либо фармакологической активности этих соединений. Соединения по настоящему изобретению являются новыми и проявляют фармакологические характеристики, являющиеся очень ценными в отношении мелатонинергических рецепторов. Многочисленные исследования последних десяти лет продемонстрировали ключевую роль мелатонина (N-ацетил-5-метокситриптамина) во многих физиопатологических явлениях и в регуляции циркадного ритма, но мелатонин имеет довольно короткий полупериод существования,благодаря тому факту, что он быстро метаболизируется. Большой интерес, поэтому, представляет возможность сделать доступными клиницистам аналоги мелатонина, которые метаболически более устойчивы и имеют агонистический или антагонистический характер, и ожидаемый терапевтический эффект от которых будет выше эффекта самого гормона. В добавление к их полезному действию в отношении нарушений циркадного ритма (J.Neurosurg, 1985, 63. pp. 321-341) и нарушений сна (Psychopharmacology, 1990, 100, pp. 222226), лиганды мелатонинергической системы обладают ценными фармакологическими свойствами по отношению к центральной нервной системе, в частности, анксиолитическими и антипсихопатическими свойствами (Neuropharmacology of Pineal Secretions, 1990, 8 (3-4), pp. 264272), и болеутоляющими свойствами (Pharmacopsychiat., 1987, 20 pp. 222-223), и также свойствами для лечения болезни Паркинсона (J. Neurosurg. 1985, 63 pp. 321-341) и болезни Альцгеймера (Brain Research, 1990, 528, pp. 170-174). Соединения также продемонстрировали активность в отношении некоторых видов рака(Melatonin - Clinical Perspectives, Oxford University Press, 1988, pp. 164-165), овуляции (Science 1987, 227, pp. 714-720), диабета (Clinical Endocrinology, 1986, 24, pp. 359-364) и при лечении ожирения (International Journal of Eating Disorders, 1996, 20, pp. 443-446). Эти различные эффекты усиливаются при посредничестве специфических мелатониновых рецепторов. Молекулярно-биологические исследования продемонстрировали существование ряда подтипов рецепторов, способных к связыванию этого гормона (Trends Pharmacol. Sci., 1995, 16,p. 50; международная заявка на патент WO 97 04094). Некоторые из этих рецепторов могут 2 встречаться и могут быть характерными для различных видов, включая млекопитающих. Для того, чтобы можно было лучше понять физиологические функции этих рецепторов, большим преимуществом является возможность иметь в распоряжении специфические лиганды. Более того, такие соединения, благодаря селективному взаимодействию с одним или другим из этих рецепторов, могут быть отличными лекарственными средствами для клинициста при лечении патологий, связанных с мелатонинергической системой, о некоторых из которых упоминалось выше. Соединения по настоящему изобретению в дополнение к тому, что являются новыми, проявляют сильное сродство к мелатониновым рецепторам и значительную селективность к сайтам типа МТ 3. Настоящее изобретение, главным образом,относится к соединениям формулы (I)R1, R2, R3, R4, R5, R6 и R8, которые могут быть одинаковыми или различными, каждый означает атом водорода или линейную или разветвленную (C1-С 6)алкильную группу, арил(С 1 С 6)алкильную группу, в которой алкил может быть линейным или разветвленным, гидроксильную группу, линейную или разветвленную(С 1-С 6)алкоксигруппу, арил(С 1-С 6)алкоксигруппу, в которой алкоксильный остаток может быть линейным или разветвленным, линейную или разветвленную (С 1-С 6)ацилоксигруппу, арилкарбонилоксигруппу,карбокси(С 1-С 6)алкильную группу, в которой алкил может быть линейным или разветвленным, или карбоксильную группу,R7 означает атом водорода или гидроксильную группу, линейную или разветвленную(С 1-С 6)алкоксигруппу, арил(С 1-С 6)алкоксигруппу, в которой алкоксильный остаток может быть линейным или разветвленным, линейную или разветвленную (С 1-С 6)ацилоксигруппу или арилкарбонилоксигруппу, или одна из групп R1R8 вместе с другой из групп R1-R8, расположенной рядом с ней, образует (С 1-С 2)алкилендиоксигруппу,к их оптическим изомерам, если они существуют, и к их аддитивным солям с фармацевтически приемлемыми кислотой или основанием, при условии: что, как минимум, одна из групп R1-R8 означает гидроксильную группу, линейную или разветвленную (С 1-С 6)алкоксигруппу, линейную или разветвленную (С 1-С 6)ацилоксигруппу или арилкарбонилоксигруппу и что соединения 3 формулы (I) являются другими, а не 1,3-диметокси-6H-изоиндоло[2,1-а]индол-6-оном. Под понятием "арил" имеют в виду фенил,бифенил, нафтил или тетрагидронафтил, где каждая из этих групп необязательно замещена одним или более одинаковыми или различными атомами или группами, выбранными из атомов галоида и линейного или разветвленного (С 1-С 6) алкила, гидроксильной группы, линейной или разветвленной (С 1-С 6)алкоксигруппы, линейного или разветвленного полигалоид(С 1-С 6)алкила, аминогруппы (необязательно замещенной одной или несколькими линейными или разветвленными (С 1-С 6)алкильными группами),нитрогруппы, линейного или разветвленного(С 1-С 6)ацила и (С 1-С 2)алкилендиоксигруппы. Среди фармацевтически приемлемых кислот могут быть упомянуты, не предполагая каких-либо ограничений этим, соляная кислота,бромистоводородная кислота, серная кислота,фосфорная кислота, уксусная кислота, трифторуксусная кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, глутаровая кислота, фумаровая кислота, винная кислота, малеиновая кислота, лимонная кислота, аскорбиновая кислота, метансульфокислота, камфорная кислота, щавелевая кислота. Среди фармацевтически приемлемых оснований могут быть упомянуты, не предполагая каких-либо ограничений этим, гидроокись натрия, гидроокись калия, триэтиламин, третбутиламин. Изобретение также относится к способу получения соединений формулы (I), который отличается тем, что соединение формулы (II) где R1, R2, R3 и R4 являются такими, как указано для формулы (I),подвергается реакции сNбромсукцинимидом с образованием соединения формулы (III) где R1, R2, R3 и R4 являются такими, как указано выше,которое реагирует с трифенилфосфином с образованием соединения формулы (IV) где R5, R6, R7 и R8 являются такими, как указано для формулы (I), с образованием соединения формулы (VI) где R1, R2, R3, R4, R5, R6, R7 и R8 являются такими, как указано выше, соединение формулы (VI) подвергают действию восстанавливающего агента и получают соединение формулы (VII) где R1, R2, R3, R4, R5, R6, R7 и R8 являются такими, как указано выше, которое затем подвергают циклизации с образованием соединения формулы (I), которое, если необходимо, очищают в соответствии с принятой методикой очистки и разделяют, если желательно, на его оптические изомеры согласно обычной методике разделения, и превращают, если желательно,в аддитивные соли с фармацевтически приемлемыми кислотой или основанием. Доказано,что соединения по изобретению и содержащие их фармацевтические композиции являются полезными при лечении нарушений мелатонинергической системы. Фармакологическое изучение соединений по изобретению фактически продемонстрировало, что они не являются токсичными, имеют высокое селективное сродство к мелатониновым рецепторам и обладают существенной активностью в отношении центральной нервной системы и, в частности, было найдено, что они обладают лечебными свойствами в отношении нарушений сна, обладают анксиолитическими,антипсихопатическими и обезболивающими свойствами и свойствами, относящимися к капиллярному кровообращению, это подтвердило то, что соединения по изобретению полезны при лечении стресса, нарушений сна, тревоги, сезонных аффективных расстройств, сердечнососудистых патологий, патологий пищеварительной системы, бессонницы и усталости из-за нарушения суточного ритма организма, шизофрении, приступов паники, меланхолии, нарушений аппетита, ожирения, бессоницы, психопатических нарушений, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных нарушений, связанных с нормальным 5 или патологическим старением, мигрени, потери памяти, болезни Альцгеймера и нарушений мозгового кровообращения. Что касается другой сферы активности, то оказалось, что соединения по изобретению могут быть использованы для лечения нарушений половых функций, что они обладают ингибирующими овуляцию свойствами и иммуномодулирующими свойствами и что их возможно использовать при лечение злокачественных заболеваний. Соединения предпочтительно используют при лечении сезонных аффективных расстройств, нарушений сна, сердечно-сосудистых патологий, бессонницы и усталости вследствие нарушения суточного ритма организма, нарушений аппетита и ожирения. Например, соединения используются для лечения сезонных аффективных расстройств и нарушений сна. Данное изобретение относится также к фармацевтическим композициям, включающим соединение формулы (I) в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями. Среди фармацевтических композиций согласно изобретению могут быть упомянуты,главным образом, такие, которые пригодны для перорального, парентерального, назального,перкутанного или чрескожного, прямокишечного, перлингвального, глазного введения или введения через дыхательные пути, в частности таблетки или драже, подъязычные таблетки,саше, дозы лекарства в виде порошка, завернутого аптечным способом в бумагу, желатиновые капсулы, покрытые глазурованной оболочкой таблетки, лепшки, суппозитории, кремы, мази,гели для кожи и ампулы с содержимым для приема внутрь или для инъекций. Доза варьируется в соответствии с полом,возрастом и весом больного, со способом введения, с природой терапевтического показания или с возможными сопутствующими лечениями и лежит в диапазоне от 0,01 мг до 1 г за 24 ч в виде одного или нескольких введений. Следующие примеры иллюстрируют изобретение, но никак не ограничивают его. Использованные исходные соединения являются известными продуктами или продуктами, полученными согласно известным методикам получения. Строение соединений, описанных в примерах, определяли согласно обычным спектрометрическим методикам (инфракрасная спектрометрия, ЯМР, масс-спектрометрия). Пример 1. 2-Гидрокси-8,9-диметоксиизоиндоло[2,1-а]индол-6-он 6 К 10 ммолям 5,6-диметоксифталида, растворенного в дихлорметане, прибавляют 12 ммолей N-бромсукцинимида и затем реакционную смесь, облучаемую галогеновой лампой,кипятят с обратным холодильником в течение 5 ч. Смесь затем охлаждают до температуры окружающей среды и фильтруют, фильтрат затем упаривают, прибавляют толуол, полученную суспензию фильтруют и фильтрат упаривают. Полученный остаток фильтруют через двуокись кремния и получают ожидаемый продукт. Стадия Б. (5,6-Диметоксифталидил)трифенилфосфонийбромид. Прибавляют 10 ммолей трифенилфосфина к 10 ммолям полученного на вышеописанной стадии соединения в растворе толуола и затем реакционную смесь кипятят с обратным холодильником в течение 3 ч. После охлаждения до температуры окружающей среды смесь фильтруют и полученный слой осадка затем промывают и сушат, получают ожидаемый продукт. Температура плавления: 260 С. Стадия В. 3-(5-Гидрокси-2-нитробензилиден)-5,6-диметоксифталид. К 10 ммолям 5-гидрокси-2-нитробензальдегида, растворенного в диметилформамиде, прибавляют 10 ммолей триэтиламина и затем порциями 10 ммолей соединения, полученного на вышеописанной стадии. Реакционную смесь затем нагревают при 50 С в течение 1 ч 30 мин и затем охлаждают до температуры окружающей среды и упаривают. Затем прибавляют диэтиловый эфир и смесь перемешивают в течение ночи, а затем фильтруют. Полученный слой осадка затем промывают и получают ожидаемый продукт. Температура плавления: 253 С. Стадия Г. 3-(2-Амино-5-гидроксибензилиден)-5,6-диметоксифталид. Раствор соединения после вышеописанной стадии, (10 ммолей) в диметилформамиде выдерживают в атмосфере водорода в присутствии никелевого катализатора Ренея до поглощения 34 ммолей водорода. После отделения катализатора при фильтрации растворитель выпаривают и остаток сушат, получают ожидаемый продукт. Температура плавления: 231 С. Стадия Д. 2-(2-Карбокси-4,5-диметоксифенил)-5-гидроксииндол. Прибавляют 20 ммолей 1 н. водного раствора гидроокиси натрия к 10 ммолям соединения после вышеописанной стадии в спиртовом растворе и затем смесь кипятят с обратным холодильником три четверти часа. После охлаждения до 0 С устанавливают рН смеси, равный 1, используя 1 н. соляную кислоту, и затем после выдержки в течение 1 ч при температуре окружающей среды отфильтровывают образовавшийся осадок, затем промывают водой и сушат,получают ожидаемый продукт. Температура плавления: 160 С. 7 Стадия Е. 2-Гидрокси-8,9-диметоксиизоиндоло[2,1-а]индол-6-он. Растворяют в толуоле 10 ммолей полученного на вышеописанной стадии соединения и затем 0,15 ммоля п-толуолсульфокислоты помещают в колбу, снабженную насадкой ДинаСтарка. После кипячения с обратным холодильником в течение ночи температуру реакционной смеси доводят до температуры окружающей среды и затем фильтруют. Слой осадка затем промывают и потом прибавляют тетрагидрофуран, суспензию фильтруют, полученный фильтрат упаривают и остаток промывают и затем сушат, получают ожидаемый продукт. Температура плавления: 260 С. Элементный микроанализ: С% Н%N% Вычислено: 69,15 4,44 4,74 Найдено: 69,05 4,18 4,98 Пример 2. 2-Гидрокси-10-метоксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 4-метоксифталида и 5-гидрокси-2 нитробензальдегида. Температура плавления: 250 С. Элементный микроанализ: С% Н%N% Вычислено: 72,45 4,18 5,28 Найдено: 72,14 4,31 5,28 Пример 3. 2-Гидрокси-7,10-диметоксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 4,7-диметоксифталида и 5-гидрокси 2-нитробензальдегида. Температура плавления : 260 С Элементный микроанализ: С% Н%N% Вычислено: 69,15 4,44 4,74 Найдено: 68,80 4,52 4,81 Пример 4. 2-Гидрокси-8-метоксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 6-метоксифталида и 5-гидрокси-2 нитробензальдегида. Температура плавления: 217 С. Элементный микроанализ: С% Н%N% Вычислено: 72,45 4,18 5,28 Найдено: 72,10 4,51 5,06 Пример 5. 2,9-Дигидрокси-8-метоксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 5-гидрокси-6-метоксифталида и 5 гидрокси-2-нитробензальдегида. Температура плавления: 260 С. Пример 6. 2,8-Дигидроксиизоиндоло[2,1-а] индол-6-он. 8 Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 6-гидроксифталида и 5-гидрокси-2 нитробензальдегида. Температура плавления: 260 С. Пример 7. 8-Гидрокси-2-метоксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 6-гидроксифталида и 5-метокси-2 нитробензальдегида. Температура плавления: 110 С. Пример 8. 8-Гидрокси-2,3-метилендиоксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 6-гидроксифталида и 4,5-метилендиокси-2-нитробензальдегида. Температура плавления: 80 С. Пример 9. 2-Гидрокси-8,10-диметоксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 4,6-диметоксифталида и 5-гидрокси 2-нитробензальдегида. Температура плавления: 260 С. Элементный микроанализ: С% Н%N% Вычислено: 69,15 4,44 4,74 Найдено: 69,06 4,42 4,77 Пример 10. 3-Бензил-2-гидрокси-8,10 диметоксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 4,6-диметоксифталида и 4-бензил-5 гидрокси-2-нитробензальдегида. Пример 11. 2,7-Дигидроксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 7-гидроксифталида и 5-гидрокси-2 нитробензальдегида. Температура плавления: 250 С. Пример 12. 2,7,10-Тригидроксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 4,7-дигидроксифталида и 5-гидрокси 2-нитробензальдегида. Пример 13. 2,7-Дигидрокси-10-метоксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 7-гидрокси-4-метоксифталида и 5 гидрокси-2-нитробензальдегида. Пример 14. 1-Карбоксиэтил-8,9-диметоксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 5,6-диметоксифталида и 6-карбоксиэтил-2-нитробензальдегида. 9 Пример 15. 8-Карбокси-7,8-диметил-2-гидроксиизоиндоло[2,1-а]индол-6-он. Требующийся продукт получают в соответствии с методикой, описанной в примере 1,исходя из 6-карбокси-5,7-диметилфталида и 5 гидрокси-2-нитробензальдегида. Фармакологическое исследование соединений по изобретению Пример 16. Изучение связывания с связывающими сайтами МТ 3 мелатонина. Связывание с сайтами МТ 3 отличается в высшей степени быстрой кинетикой ассоциации и диссоциации и локализацией в ткани (мозг). Эксперименты по связыванию с сайтами МТ 3 проводят на мембранах мозга хомячков с применением 2-[125I]иодмелатонина в качестве радиоактивного лиганда в соответствии с протоколом, описанным P. Paul et al. (J. Pharmacol.Exp. Ther. 1999, 290, 334). Мембраны инкубируют 30 мин с 2-[125I]иодмелатонином при температуре 4 С и при различных концентрациях исследуемых соединений. После инкубирования мембраны быстро фильтруют и затем промывают холодным буфером, используя систему для фильтрования. Остаточную радиоактивность измеряют с помощью сцинтилляционного счетчика. Значения концентраций, вызывающих 50%-ное ингибирование, IC50, найденные для соединений по изобретению, свидетельствуют о сильном сродстве к сайтам типа МТ 3, эти значения являются меньшими, чем 10 нМ. При сравнении мелатонин в данном тесте имеет IC50 45 нМ. Пример 17. Фармацевтическая композиция. Состав для получения 1000 таблеток, каждая из которых содержит 10 мг активного ингредиента: Соединение из примера 1 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г 10 арил(С 1-С 6)алкокси(С 1-С 6)алкоксигруппу,группу, в которой алкоксильный остаток может быть линейным или разветвленным, линейную или разветвленную (С 1-С 6)ацилоксигруппу,арилкарбонилоксигруппу,карбокси(С 1-С 6)алкильную группу, в которой алкил может быть линейным или разветвленным, или карбоксильную группу,R7 означает атом водорода или гидроксильную группу, линейную или разветвленную(С 1-С 6)алкоксигруппу, арил(С 1-С 6)алкоксигруппу, в которой алкоксильный остаток может быть линейным или разветвленным, линейную или разветвленную (С 1-С 6)ацилоксигруппу или арилкарбонилоксигруппу,или одна из групп R1-R8 вместе с другой из групп R1-R8, расположенной рядом с ней, образует (С 1-С 2)алкилендиоксигруппу,его оптические изомеры, если они существуют, и его аддитивные соли с фармацевтически приемлемыми кислотой или основанием,при условии, что, как минимум, одна из групп R1-R8 означает гидроксильную группу,линейную или разветвленную (С 1-С 6)алкоксигруппу, линейную или разветвленную (С 1-С 6) ацилоксигруппу или арилкарбонилоксигруппу и что соединения формулы (I) являются другими,а не 1,3-диметокси-6H-изоиндоло[2,1-а]индол-6 оном. 2. Соединение формулы (I) по п.1, которое представляет собой 2-гидрокси-8,9-диметоксиизоиндоло[2,1-а]индол-6-он. 3. Способ получения соединений формулы(I) по п.1, отличающийся тем, что соединение формулы (II) где R1, R2, R3 и R4 являются такими, как указано для формулы (I),подвергается реакции с N-бромсукцинимидом с образованием соединения формулы ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) где R1, R2, R3 и R4 являются такими, как указано выше,которое реагирует с трифенилфосфином с образованием соединения формулы (IV) где R1, R2, R3, R4, R5, R6 и R8, которые могут быть одинаковыми или различными, каждый означает атом водорода или линейную или разветвленную (C1-С 6)алкильную группу, арил(С 1 С 6)алкильную группу, в которой алкил может быть линейным или разветвленным, гидроксильную группу, линейную или разветвленную где R5, R6, R7 и R8 являются такими, как указано для формулы (I),с образованием соединения формулы (VI) где R1, R2, R3, R4, R5, R6, R7 и R8 являются такими, как указано выше,соединение формулы (VI) подвергают действию восстанавливающего агента и получают соединение формулы (VII) где R1, R2, R3, R4, R5, R6, R7 и R8 являются такими, как указано выше,которое затем подвергают циклизации с образованием соединения формулы (I), которое,если необходимо, очищают в соответствии с принятой методикой очистки и разделяют, если желательно, на его оптические изомеры согласно обычной методике разделения, и превращают, если желательно, в аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 4. Фармацевтические композиции, включающие в качестве активного ингредиента соединение формулы (I) по п.1 или 2 в комбинации с одним или несколькими фармацевтически приемлемыми инертными нетоксичными носителями. 5. Фармацевтические композиции по п.4 для использования при получении лекарственных средств для лечения нарушений мелатонинергической системы.
МПК / Метки
МПК: C07D 487/04, A61P 25/00, A61K 31/407
Метки: фармацевтические, способ, содержащие, получения, изоиндолоиндолона, производные, композиции
Код ссылки
<a href="https://eas.patents.su/7-4035-proizvodnye-izoindoloindolona-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные изоиндолоиндолона, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Новые содержащие тиотропий порошки для ингаляции
Следующий патент: Предотвращение рецидива мигрени
Случайный патент: Способ снижения вязкости вязких текучих сред (варианты)











