Новые производные полигидроксипиразинов, способ их получения и содержащие их фармацевтические композиции
Формула / Реферат
1. Соединения общей формулы
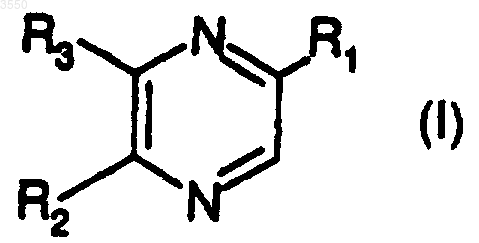
в которой R1 обозначает стереоизомерные формы цепи
-(CHOH)3-CH2-O-COR (II)
и
либо R2 обозначает атом водорода, а R3 обозначает стереоизомерные формы цепи
-CH2-(CHOH)2-CH2-O-COR (III),
либо R2 обозначает стереоиэомерные формы цепей
-(CHOH)3-CH2-O-COR (II)
или
-CH2-(CHOH)2-CH2-COR (III),
a R3 обозначает атом водорода, и R обозначает радикал -(Алк)i-(Циклоалк), в котором
Алк обозначает алкильный насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода, Циклоалк обозначает насыщенный циклический углеводородный радикал, содержащий 5 или 6 атомов углерода, и i равно 0 или 1;
а также и их стереоизомерные формы и их соли с минеральной или органической кислотой.
2. Соединения по п.1, имеющие общие формулы
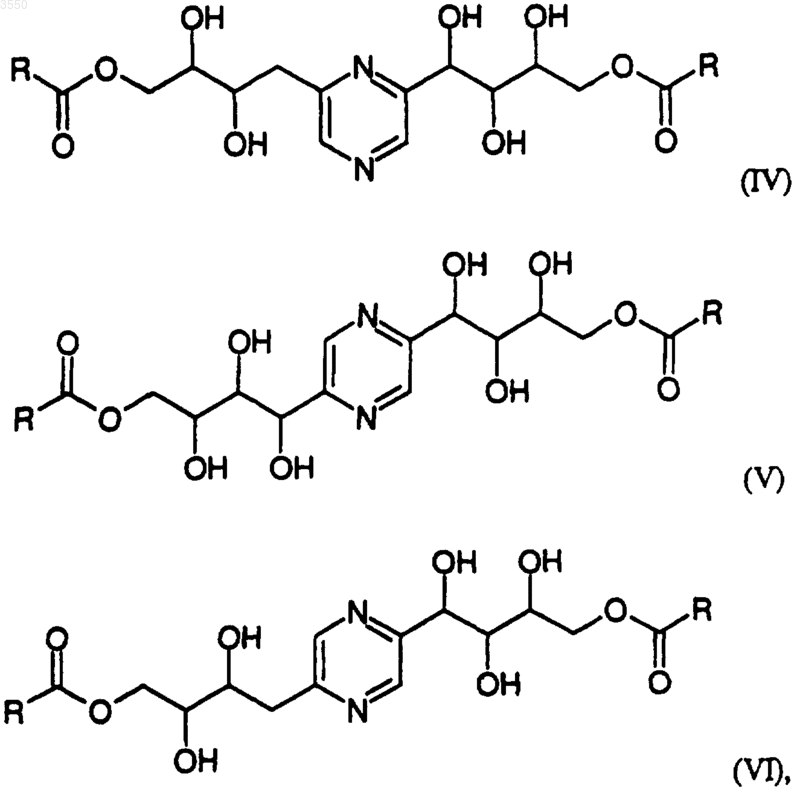
в которых R обозначает радикал -(Алк)i-(Циклоалк),
в котором
Алк обозначает алкильный насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода,
Циклоалк обозначает насыщенный циклический углеводородный радикал, содержащий 5 или 6 атомов углерода,
и i равно 0 или 1;
а также их стереоизомерные формы и их соли с минеральной или органической кислотой.
3. Соединения по любому из пп.1-2, имеющие общие формулы
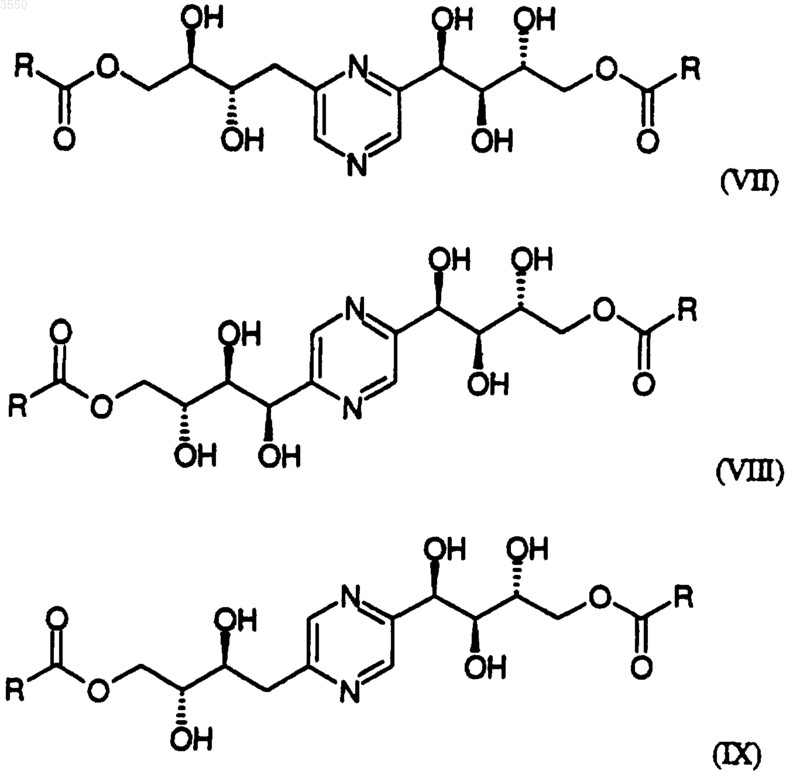
в которых R обозначает радикал -(Алк)i-(Циклоалк),
где Алк обозначает алкильный насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода,
Циклоалк обозначает насыщенный циклический углеводородный радикал, содержащий 5 или 6 атомов углерода,
и i равно 0 или 1;
а также их соли с минеральной или органической кислотой.
4. Соединения по любому из пп.1-3, имеющие общую формулу
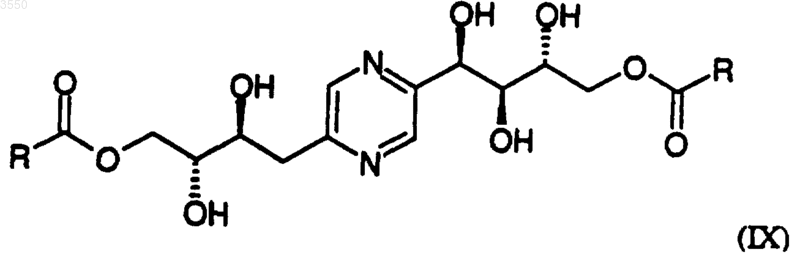
в которой R обозначает радикал -(Алк)i-(Циклоалк),
где Алк обозначает алкильный насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода,
Циклоалк обозначает насыщенный циклический углеводородный радикал, содержащий 5 или 6 атомов углерода,
и i равно 0 или 1;
а также к их солям с минеральной или органической кислотой.
5. Соединения по любому из пп.1-4, в которых R обозначает радикал -(Алк)i-(Циклоалк), в котором
Алк обозначает метильный насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода,
Циклоалк обозначает циклогексильный радикал,
i равно 0 или 1;
а также их соли с минеральной или органической кислотой.
6. Соединения по любому из пп.1-5, выбираемые индивидуально из
4,4'-O,O-дициклогексилоил-2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразина,
4,4'-O,O-ди(циклогексилацетил)-2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразина,
а также из их солей с минеральной или органической кислотой.
7. Соединение 4,4'-O,O-дициклогексилоил-2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразин, а также его соли с минеральной или органической кислотой.
8. Способ получения соединений, описанных в любом из пп.1-7, отличающийся тем, что соединение общей формулы
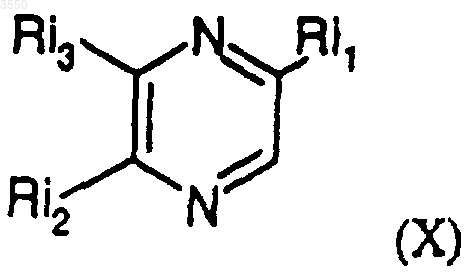
в которой
Ri1 обозначает стереоизомерные формы цепи
-(CHOH)3-CH2OH (XI)
и либо Ri2 обозначает атом водорода, a Ri3 обозначает стереоизомерные формы цепи
-CH2-(CHOH)2-CH2OH (XII),
либо Ri2 обозначает стереоизомерные формы цепей
-(CHOH)3-CH2OH (XI)
или
-CH2-(CHOH)2-CH2OH (XII),
а Ri3 обозначает атом водорода,
обрабатывают соответствующим ацилгалогенидом формулы R-COX, в которой R определен в пп.1-7, а X обозначает атом галогена.
9. Способ по п.8, отличающийся тем, что реакцию проводят в присутствии пиридина при температурах от 0 до 40шC.
10. Лекарственное средство, отличающееся тем, что оно содержит в качестве активного начала одно или несколько соединений по любому из пп.1-7 и одно или несколько эксципиентов.
11. Применение соединений по пп.1-7 для получения лекарственного средства для профилактики и/или лечения диабета и его осложнений.
Текст
1 Настоящее изобретение относится к новым соединениям общей формулы I а также к их солям с минеральными или органическими кислотами, к способу их получения, к фармацевтическим композициям на их основе и к их использованию в качестве противодиабетических средств. Соединения, обладающие гипогликемическими свойствами, общей формулы(В),-СНОН-СНОН-СНОН-СН 2 ОН либо R1 обозначает цепь формулы (А), а R2- атом водорода, были описаны в заявке WO 97/28813. Из известного уровня техники нельзя было предположить, что в результате структурных модификаций известных соединений можно получить предлагаемые согласно изобретению соединения общей формулы I, которые обладали бы значительно более высокой антигликемической активностью, и одновременно, были бы более биодоступны и/или менее токсичны. Настоящее изобретение относится к соединениям общей формулы I в которой R1 обозначает стереоизомерные формы цепи(III),либо R2 обозначает стереоизомерные формы цепей(III),a R3 обозначает атом водорода, и R обозначает радикал -(Аlk)i-Циклоалк,в котором Alk обозначает радикал алкил, а Циклоалк обозначает радикал циклоалкил, и i равно 0 или 1; а также к их стереоизомерным формам и их солям с минеральными или органическими кислотами. Подразумевают под алкилом: насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода,такой как метил, этил, пропил, изопропил, бу 003550 2 тил, изобутил, втор-бутил, трет-бутил, пентил или гексил; циклоалкилом: насыщенный циклический углеводородный радикал, содержащей 5 или 6 атомов углерода, такой как циклопентил или циклогексил. Таким образом, настоящее изобретение относится к соединениям, имеющим общие формулы в которых R обозначает радикал -(Алк)i(Циклоалк), в котором Алк обозначает алкильный радикал, а Циклоалк обозначает циклоалкильный радикал и i равно 0 или 1; а также к их стереоизомерным формам и их солям с минеральными или органическими кислотами. Согласно изобретению предпочтительны соединения, имеющие следующие общие формулы: в которых R обозначает радикал -(Алк)i(Циклоалк), где Алк обозначает алкильный радикал, а Циклоалк обозначает циклоалкильный радикал и i равно 0 или 1; а также к их солям с минеральными или органическими кислотами. Еще более предпочтительно настоящее изобретение относится к соединениям общей формулы IX в которой R обозначает радикал -(Алк)i(Циклоалк), где Алк обозначает алкильный радикал, а Циклоалк обозначает циклоалкильный радикал и i равно 0 или 1; а также к их солям с минеральными или органическими кислотами. Согласно более преимущественному аспекту, настоящее изобретение относится к соединениям общей формулы IX, в которойR обозначает радикал -(Алк)i-(Циклоалк),где Алк обозначает радикал метил,Циклоалк обозначает радикал циклогексил,и i равно 0 или 1; а также к их солям с минеральными или органическими кислотами. Соединения настоящего изобретения наиболее предпочтительно выбирают индивидуально из 4,4'-O,O-дициклогексилоил-2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)[2',3',4'-тригидроксибутил)]пиразина,4,4'-O,O-ди(циклогексилацетил)-2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразина,а также из их солей с минеральными или органическими кислотами. Из них более предпочтителен 4,4'-O,O-дициклогексилоил-2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразин,а также его соли с минеральными или органическими кислотами. Согласно настоящему изобретению, соединения общей формулы I, в которой R определен выше, могут быть получены из соединений общей формулы в которой Ri1 обозначает стереоизомерные формы цепи;-(СНОН)3-СН 2 ОН (XI) и либо Ri2 обозначает атом водорода, а Ri3 обозначает стереоизомерные формы цепи(XII),либо Ri2 обозначает стереоизомерные формы цепей 4 действием на них соответствующим ацилгалогенидом формулы R-СОХ, в которой R определен выше, а Х обозначает атом галогена, такой как хлор. Реакцию проводят в присутствии органического или минерального основания, преимущественно пиридина, при температурах в пределах от 0 до 40 С. Ацилгалогенид формулы R-COX, в которой R определен выше, а Х обозначает атом галогена такой как хлор, может быть приобретен на рынке, или, при необходимости, получен из соответствующей кислоты R-COOH с использованием обычных методов; в частности, ацилхлорид может быть получен из соответствующей кислоты действием оксалилхлорида в растворителе таком как дихлорметан, N,Nдиметилформамид или смесь этих растворителей. Целесообразно получать ацилгалогенид insitu. Соединения общей формулы Х могут быть получены следующим образом. Стереоизомерные формы соединения формулы (X) получают из стереоизомерных форм реагентов, которые указаны ниже, с использованием способа получения по изобретению. Стереоизомерные формы соединений формулы (X), у которых Ri1 обозначает стереоизомерные формы цепи(XI),Ri2 обозначает атом водорода и Ri3 - стереоизомерные формы цепи(XII) могут быть получены действием формиата аммония на альдозу или на смесь двух альдоз правовращающегося или левовращающегося ряда,имеющих общую формулу СНО-СНОН-Ri1, в которой Ri1 имеет такое же значение, как в формуле (X). Эту реакцию можно проводить предпочтительно при температуре в пределах от 15 до 100 С, преимущественно в водной среде. Альдозы могут быть приобретены на рынке или могут быть получены из а) имеющихся в продаже альдоз реакциями эпимеризации с применением или адаптированием методов, описанных вAdv.Carbohydr. Chem. 13, 63 (1958), в частности в щелочной среде с использованием разбавленного водного раствора едкого натра (0,030,05%) при температуре от 20 до 40 С; реакциями удлинения цепи с применением или адаптированием методов, описанных в "The(1972), в частности путем образования циангидрина исходной альдозы (например действием цианида натрия в водном растворе при температуре от 10 до 30 С в присутствии едкого натра при рН, близком к 9) с последующим гидролизом образовавшейся при этом нитрильной 5 функции в соответствующую кислотную функцию с применением или адаптированием методов, описанных в Organic Synthesis, volume I,p.436 и volume III, p.85 (например, с помощью соляной или концентрированной серной кислоты в водном растворе при температуре от 20 С до температуры кипения реакционной среды), и восстановлением карбоксильной кислотной функции в соответствующую альдегидную функцию с применением или адаптированием методов, описанных в J. Am. Chem. Soc. 71, 122(1949), в частности с использованием борогидрида щелочного металла (например, борогидрида натрия) в водном растворе при температуре от 20 С до температуры кипения реакционной среды; реакциями укорочения цепи с применением или адаптированием методов, описанных вHorton, Academic Press, New-York, Volume IB,1980, р. 929 или Chem. Ber., 83, 559 (1950), в частности превращением альдегидной функции альдозы в соответствующую гидроксиламиновую функцию с применением или адаптированием методов, описанных в Organic Synthesis,volume II, р.314 (например, с помощью солянокислого гидроксиламина в водном растворе в присутствии основания, такого как карбонат натрия при температуре от 20 до 50 С) с последующим действием 3,4-динитрофторбензола в присутствии двуокиси углерода и основания,такого как гидрокарбонат натрия в водном растворе с алифатическим спиртом (например, изопропиловым спиртом) при температуре от 50 до 80 С;b) соответствующих аллиловых спиртов с применением или адаптированием методов,описанных в Science, 220, 949 (1983), в частности, с помощью трет-бутилгидропероксида в присутствии комплекса титана (IV) такого как комплекс изопропилата титана (IV) с оптически чистым диалкилтартратом (например, диэтилтартратом) с последующим действием последовательно тиофенолятом натрия, п-хлорбензойной кислотой в уксусном ангидриде и гидридом диизопропилалюминия. Стереоизомеры сахара формулы XIII могут быть стереоизомерами альдозы с 6 атомами углерода. Из них преимущественно используемыми являются D-глюкоза, D-гулоза, D-манноза,D-галактоза, D-аллоза, D-альтроза, D-идоза, Dталоза, L-глюкоза, L-манноза, L-галактоза, Lаллоза, L-альтроза, L-идоза, L-талоза, L-гулоза. Стереоизомеры соединений формулы X, у которых Ri1 обозначает стереоизомерные формы цепи(XI) и Ri3 обозначает атом водорода, могут быть получены обработкой в щелочной среде какой 003550 6 либо аминоальдозы или смеси двух аминоальдоз общей формулы СНО-СН(NH2)-Ri1(XIV) возможно в виде солевого аддукта, такого как гидрохлорид, где Ri1 имеет такое же значение,как в общей формуле (X). Реакцию по преимуществу проводят при температуре, близкой к 20 С, и используют преимущественно аммиачный раствор, в частности 28%-ный раствор аммиака. Аминоальдозы формулы XIV приобретают на рынке или могут быть получены с применением или адаптированием методов, описанных,например, в(a) Methods Carbohydr. Chem., 7, 29 (1976),которые состоят в превращении альдегидной функции соответствующей альдозы в нитроэтиленовую группу с помощью нитрометана в щелочной среде (например, с этилатом натрия) с последующей обработкой полученного продукта последовательно насыщенным раствором аммиака при температуре от 20 до 30 С, гидроксидом бария в водном растворе при температуре от 20 до 30 С и, наконец, разбавленной серной кислотой (10-15%) при температуре от 20 до 30 С;Horton, Academic Press, New-York, Volume IB,1980, p.664, которые состоят в превращении альдегидной функции соответствующей альдозы в иминогруппу, исходя из первичного ароматического амина (например, анилина) с последующим взаимодействием последовательно с цианисто-водородной кислотой при температуре от 0 до 20 С и водородом в присутствии палладия в растворителе, таком как эфир (например, тетрагидрофуран) или алифатический спирт (например, этанол или метанол) при температуре от 20 до 50 С. Стереоизомеры аминоальдозы формулыXIV могут быть стереоизомерами аминоальдозы с 6 атомами углерода, такими как D-глюкозамин, D-галактозамин, L-глюкозамин, и L-галактозамин, из которых преимущественно используют D-глюкозамин и D-галактозамин и особенно D-глюкозамин, которые могут быть в форме солевого аддукта такого как гидрохлорид. Стереоизомеры соединений формулы X, у которых Ri1 обозначает стереоизомерные формы цепи(XII) и Ri3 обозначает атом водорода, могут быть получены либо из аминоальдозы или смеси двух аминоальдоз общей формулы 7 в которой Ri1 имеет такое же значение, как в формуле I, проведением реакции в кислой среде и, более конкретно, в среде уксусной кислоты, преимущественно при температуре от 15 до 100 С либо из кетозы или смеси 2 кетоз общей формулы(XV) в которой Ri1 имеет такое же значение, как в формуле X, при действии формиатом аммония и проведении реакции преимущественно при температуре от 15 до 100 С, предпочтительно в водной среде. Кетозы формулы XV приобретают на рынке или могут быть получены с применением или адаптированием методов, описанных, например,вa) Adv. Carbohydr. Chem., 13, 63 (1958), которые состоят во взаимодействии соответствующей альдозы, либо с основанием, таким как гидроксид кальция, гидроксид натрия, пиридин и хинолин, либо с кислотой, такой как серная кислота в водном растворе или в чистой фазе при температуре от 20 до 50 С;(1988), J. J. Org. Chem., 57, 5899 (1992), которые состоят, например, в конденсации гидроксипирувальдегида,1,3-дигидроксиацетона,1,3 дигидроксиацетон-монофосфата или гидроксипирувинной кислоты с замещенным в положении 2 2-гидроксиацетальдегидом, возможно оптически чистым, и, возможно, в присутствии фермента, такого как транскетолаза. Эту реакцию обычно проводят в водном растворе при температуре от 20 до 50 С, возможно в присутствии основания (например, гидроксида натрия), хлорида бария, хлорида магния или хлорида цинка. Производные, имеющие 2 гидроксиальдегидную группу, приобретают на рынке или могут быть получены из альдоз с применением или адаптированием методов,описанных Р. Collins, R. Ferrier в Monosaccharides, Their Chemistry and their roles in Natural(1996). Стереоизомеры аминоальдоз формулы XIV могут быть стереоизомерами аминоальдоз с 6 атомами углерода, такими как D-глюкозамин,D-галактозамин, L-глюкозамин, и L-галактозамин, из которых преимущественно используютD-глюкозамин и D-галактозамин и особенно Dглюкозамин, которые могут быть в форме солевого аддукта, такого как гидрохлорид. Стереоизомеры соединений формулы XV могут быть стереоизомерами кетоз с 6 атомами углерода, из которых преимущественно используются D-псикоза, D-фруктоза, D-сорбоза, D 003550 8 тагатоза, L-псикоза, L-фруктоза, L-сорбоза и Lтагатоза. Реакционные смеси, получаемые описанными выше способами, обрабатывают с применением традиционных физических (например,упаривание, экстракция, перегонка, хроматография, кристаллизация) или химических (например, солеобразование) методов. Соединения формулы I могут быть при необходимости превращены в солевые аддукты с минеральными или органическими кислотами в среде растворителя, такого как спирт, кетон,простой эфир или хлорсодержащий растворитель. Эти соли также составляют предмет изобретения. В качестве примера фармацевтически приемлемых солей могут быть названы солевые аддукты с минеральными или органическими кислотами, такие как ацетат, пропионат, сукцинат, бензоат, фумарат, малеат, оксалат, метансульфонат, изетионат, теофиллинацетат, салицилат, метилен-бис-b-оксинафтоат, гидрохлорид, сульфат, нитрат и фосфат. Соединения формулы I обладают ценными фармакологическими свойствами. Они являются сахаропонижающими средствами. Гипогликемическую активность соединений формулы I определяли по гипергликемической реакции при пероральном введении глюкозы мышам с нормальным уровнем сахара в соответствии с протоколом, приведенным в примере 3. Соединения общей формулы I по изобретению обладают низкой токсичностью. Их средняя летальная доза (ЛД 50) при пероральном введении мышам превышает 2000 мг/кг. В области терапии человека эти соединения представляют ценность при предотвращении и лечении диабета и, в частности, диабета типа II (диабет NID), диабета при ожирении,диабета пятидесятилетних, диабета полнокровных, старческого диабета и легкого диабета. Их можно использовать в качестве дополнения к инсулинотерапии при инсулинозависимом диабете, в случае которого они дают возможность постепенно уменьшать дозу инсулина, при нестабильном диабете, инсулинорезистентном диабете, в качестве дополнения к сахаропонижающим сульфамидам, когда последние не обеспечивают достаточного понижения гликемии. Эти продукты могут быть также использованы при осложнениях диабета, таких как гиперлипемии, нарушения липидного метаболизма, дислипемии, ожирение. Они представляют также ценность при профилактике и лечении атеросклеротических нарушений и их осложнений (коронопатии, инфаркт миокарда, кардиомиопатии, перерастание этих трех осложнений в недостаточность левого желудочка, различные артериопатии, артриты нижних конечностей с хромотой и перерастанием в язвы и гангрену,цереброваскулярная недостаточность и его ос 9 ложнения, половое бессилие сосудистого происхождения), диабетической ретинопатии и всех ее проявлений (повышение капиллярной проницаемости, расширение и тромбоз капилляров,микроаневризмы, артериовенозный шунт, расширение вен, проколочные и пятнистые кровотечения, выпоты, пятнистые отеки, проявления пролиферирующей ретинопатии: вновь образованные сосуды, рубцы пролиферирующего ретинита, кровотечения в стекловидном теле, отслойка сетчатки), диабетической катаракты,диабетической нейропатии в различных формах(периферические полинейропатии и такие ее проявления как парестезии, гиперэстезии и боли, мононейропатии, радикулопатии, автономные нейропатии, диабетические амиотрофии),проявлений диабетической стопы (язвы нижних конечностей и стопы), диабетической нефропатии в двух ее формах: диффузной и узелковой,атероматоза (повышение уровня липопротеидов высокой плотности (ЛВП), способствующее удалению холестерина из атеромных бляшек,понижение уровня липопротеидов низкой плотности (ЛНП), понижение отношения ЛНП/ЛВП,ингибирование окисления ЛНП, уменьшение липкости бляшек), гиперлипемии и дизлипемий(гиперхолестеринемии, гипертриглицеридимии,нормализация уровня жирных кислот, нормализация урикемии, нормализация апопротеинов А и В), катаракты, артериальной гипертонии и ее последствий. Лекарственные средства согласно изобретению представляют собой продукт согласно изобретению или комбинацию этих продуктов в чистом виде или в виде композиции, в которой эти соединения ассоциированы с каким-либо другим фармацевтически приемлемым продуктом, который может быть либо инертным, либо физиологически активным. Лекарственные средства согласно изобретению могут применяться перорально, парентерально, ректально или местно. В качестве твердых композиций для перорального применения могут быть использованы таблетки, порошки (желатиновые капсулы, облатки) или гранулы. В этих композициях активное начало согласно изобретению смешивают в токе аргона с одним или несколькими инертными разбавителями такими как крахмал, целлюлоза, сахароза, лактоза или кремнезем. Эти композиции могут также содержать и другие не являющиеся разбавителями вещества, например один или несколько смазывающих агентов, таких как стеарат магния или тальк, краситель,оболочка (драже) или лак. В качестве жидких композиций для перорального применения могут быть использованы фармацевтически приемлемые растворы, суспензии, эмульсии, сиропы и эликсиры, содержащие инертные разбавители такие как вода,этанол, глицерин, растительные масла или парафиновое масло. Эти композиции могут также 10 содержать и другие не являющиеся разбавителями вещества, например, увлажняющие агенты, мягчители, загустители, отдушки и стабилизаторы. Стерильные композиции для парентерального применения являются преимущественно водными и неводными растворами, суспензиями или эмульсиями. В качестве растворителя или носителя могут быть использованы вода, пропиленгликоль, полиэтиленгликоль, растительные масла (в частности, оливковое масло), инъецируемые эфиры органических кислот, например, этилолеат, или другие подходящие органические растворители. Эти композиции могут также содержать специальные добавки, в частности увлажнители, изотонизирующие агенты,эмульгаторы, диспергенты и стабилизаторы. Стерилизация композиций может быть произведена несколькими способами, например, асептической фильтрацией, когда в композицию вводят стерилизирующие агенты облучением или нагревом. Композиции могут быть также приготовлены в стерильной твердой форме, которые растворяют непосредственно перед применением в стерильной воде или в любой другой пригодной для инъекций стерильной среде. Композиции для ректального применения представляют собой свечи или ректальные капсулы, содержащие кроме активного вещества носители, такие как масло какао, полусинтетические глицериды или полиэтиленгликоли. Композиции для местного применения могут представлять собой, например, кремы, лосьоны, глазные капли (мази), жидкости для полоскания, капли для носа или аэрозоли. Дозы зависят от желаемого эффекта, продолжительности лечения и способа применения. Обычно они составляют от 150 до 600 мг в сутки при применении внутрь для взрослых при разовых дозах в пределах от 50 до 200 мг в расчете на активное вещество. Обычно врач определяет необходимую дозу в зависимости от возраста, веса и других относящихся к больному факторов. Приведенный ниже пример 4 иллюстрирует композиции изобретения. Изобретение относится также к использованию соединений общей формулы I для приготовления фармацевтических композиций, пригодных для лечения и/или профилактики диабета и осложнений диабета. Приведенные ниже примеры более детально иллюстрируют используемый в изобретении способ получения, не ограничивая при этом объема изобретения. Этот способ является частью общей суммы знаний специалиста, который может применить или адаптировать эти методы, чтобы осуществить настоящее изобретение. Пример 1. 4,4'-O,O-дициклогексилоил-2[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5[(2'S,3'R) (2',3',4'-тригидроксибутил)]пиразин. К 300 мг 2-[(1R,2S,3R)(1,2,3,4-тетрарадроксибутил)]5-[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразина, суспендированного в 7,5 см 3 пиридина, высушенного на молекулярных ситах 4, прибавляют по каплям в атмосфере аргона при температуре, близкой к 20 С, 0,328 см 3 циклогексаноилхлорида. Реакционную суспензию белого цвета перемешивают 15 ч при температуре, близкой к 20 С, после чего разбавляют 30 см 3 этилацетата и 30 см 3 дистиллированной воды. После разделения фаз декантацией органическую фазу промывают 20 см 3 насыщенного водного раствора хлорида натрия, высушивают над сульфатом магния, фильтруют на пористом стекле и досуха упаривают при пониженном давлении (0,2 кПа) и температуре, близкой к 40 С. Получают желтое масло, которое очищают препаративной хроматографией на 4 пластинках с силикагелем 60F254 Merck толщина 0,5 мм, 20 х 20 см), элюируя смесью дихлорметан-метанол (90/10 по объему). Фракции, содержащие только целевые продукты, экстрагируют смесью дихлорметан-метанол (80/20 по объему), фильтруют на пористом стекле и досуха упаривают при пониженном давлении (0,5 кПа) и температуре, близкой к 40 С, получая 23,3 мг 4,4'-O,O-дициклогексилоил-2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразина в виде белого твердого вещества. Полученный продукт обладает следующими характеристиками: Спектр ЯМР 1H (400 МГц, (СD3)2SO d6,в м.д.): от 1,10 до 1,95 (м, 20 Н в сумме: CH2 циклогексила); 2,34 (м, 2 Н:ОСОСН); 2,76 и 3,12(дд, J=12 и 2,5 Гц, 1 Н: другой Н из СН 2O 2); 4,63 (д, J=8,5 Гц, 1 Н:ОН в 2); 4,86 (д, J=7 Гц,1 Н:ОН в 5); 4,97 (д ушир., J=6,5 Гц, 1 Н:СН 2); 5,05 (д, J=6 Гц, 1 Н:ОН в 2); 5,11 (д, J=6 Гц,1 Н:ОН В 5); 5,40 (д, J=6,5 Гц, 1 Н:ОН в 2); 8,43 (с ушир., 1 Н:=СН в 6); 8,67 (с ушир.,1 Н:=СН в 3). 2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразин может быть получен из D-глюкозамина в присутствии уксусной кислоты или с применением или адаптированием методов, описанных в К 350 мг циклогексилуксусной кислоты в 2 см 3 дихлорметана, высушенного на молекулярных ситах 4 , прибавляют по каплям в атмосфере аргона при температуре, близкой к 20 С 0,26 см 3 оксалилхлорида. Реакционную смесь перемешивают при температуре, близкой к 20 С, в течение 1 ч, после чего имеющее место вначале выделение газа прекращается. К 300 мг 2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразина, суспендированного в 7,5 см 3 пиридина, высушенного на молекулярных ситах 4, прибавляют по каплям при температуре,близкой к 20 С, в атмосфере аргона приготовленный выше раствор хлорангидрида. Реакционную суспензию белого цвета перемешивают 17 ч при температуре, близкой к 20 С, после чего частично упаривают в токе воздуха при температуре, близкой к 20 С, и хроматографируют на 4 пластинках с силикагелем 60F254Merck (толщина 0,5 мм, 20 х 20 см), элюируя смесью дихлорметан-метанол (90/10 по объему). Фракции, содержащие только целевые продукты, экстрагируют смесью дихлорметан-метанол(80/20 по объему), фильтруют на пористом стекле и досуха упаривают при пониженном давлении (0,5 кПа) и температуре, близкой к 40 С, получая 31,5 мг 4,4'-O,O-ди(циклогексилацетил)-2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразина в виде белого твердого вещества. Полученный продукт обладает следующими характеристиками: Спектр ЯМР 1H (400 МГц, (СD3)2SO d6,в м.д.): от 0,85 до 1,80 (м, 22 Н в сумме: СН и СН 2 циклогексила); 2,20 (м, 4 Н:ОСОСН 2); 2,76 и 3,13(д, J=1 Гц, 1 Н:=СН в 6); 8,67 (с ушир., 1 Н:=СН в 3). 2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразин может быть получен из D-глюкозамина в присутствии уксусной кислоты или с применением или адаптированием методов, описанных в Advancesin Carbohydrate Chemistry and Biochemistry, Academic Press, New York, vol. 25, 1970, 311-349. Пример 3. Мыши Swiss albinos, весящие от 22 до 26 г,оставляют голодными в течение 2 ч. В конце этого периода измеряют гликемию и непосредственно после этого мышам вводят перорально дозу глюкозы (2 г/кг). Спустя 30 мин еще раз измеряют гликемию. Отбирают мышей, у которых значение гипергликемии превышает 170 мг/дл, и используют этих мышей для определения сахаропонижающей активности соединений изобретения. Отобранных таким образом мышей распределяют по группам, состоящим из, по меньшей мере, 10 животных. Отдельные группы получают один раз в сутки через желудочную трубку дозы от 3 до 50 мг/кг соединения в носителе, таком как вода или смесь метилцеллюлозы с твином и воды. Продолжительность лечения 4 дня. На четвертый день после завершения ввода препарата животные получают дозу глюкозы (2 г/кг) и спустя 20-40 мин измеряют гликемию. Степень ингибирования гипергликемической реакции на ввод глюкозы рассчитывают по отношению к реакции, измеренной в группе, получавшей один носитель. В этом тесте соединения по изобретению показывают степень ингибирования большую или равную 10%. Сравнительный тест согласно описанному выше протоколу был проведен с соединением примера 1 настоящего изобретения и, в качестве соединения сравнения, с 2-[(1R,2S,3R)(1,2,3,4 тетрагидроксибутил)]-5-(2',3',4'-тригидроксибутил)]пиразином, противодиабетическая активность которого была описана в заявке WO 97/28813: Полученные после применения дозы 3 мг/кг результаты показывают, что относительная активность соединения примера 1 по отношению к соединению сравнения составляет 149%. Пример 4. Пример 4 А. Приготовляют обычным способом желатиновые капсулы с дозами 50 мг активного соединения, имеющие следующий состав: Активное соединение 50 мг Целлюлоза 18 мг Лактоза 55 мг Коллоидальный кремнезем 1 мг Натриевый карбоксиметилкрахмал 10 мг Тальк 10 мг Стеарат магния 1 мг Пример 4 В. Приготовляют обычным способом таблетки с дозами 50 мг активного соединения,имеющие следующий состав: Активное соединение 50 мг Лактоза 104 мг 14 Целлюлоза Поливидон Натриевый карбоксиметилкрахмал Тальк Стеарат магния Коллоидальный кременезем Смесь гидроксиметилцеллюлозы,глицерина, оксида титана (72/3, 5/24,5) в достаточном количестве до доведения массы 1 готовой таблетки до Пример 4 С. Приготовляют раствор для инъекций, содержащий 50 мг активного соединения, имеющие следующий состав: Активное соединение 50 мг Бензойная кислота 80 мг Бензиловый спирт 0,06 мл Бензоат натрия 80 мг 95%-ный этанол 0,4 мл Гидроксид натрия 24 мг Пропиленгликоль 1,6 мл Вода в достаточном количестве до 4 мл ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы в которой R1 обозначает стереоизомерные формы цепи(II) и либо R2 обозначает атом водорода, а R3 обозначает стереоизомерные формы цепи(III),либо R2 обозначает стереоизомерные формы цепей(III),a R3 обозначает атом водорода, и R обозначает радикал -(Алк)i-(Циклоалк), в котором Алк обозначает алкильный насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода, Циклоалк обозначает насыщенный циклический углеводородный радикал, содержащий 5 или 6 атомов углерода, и i равно 0 или 1; а также и их стереоизомерные формы и их соли с минеральной или органической кислотой. 2. Соединения по п.1, имеющие общие формулы в которых R обозначает радикал -(Алк)i(Циклоалк),в котором Алк обозначает алкильный насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода,Циклоалк обозначает насыщенный циклический углеводородный радикал, содержащий 5 или 6 атомов углерода,и i равно 0 или 1; а также их стереоизомерные формы и их соли с минеральной или органической кислотой. 3. Соединения по любому из пп.1-2,имеющие общие формулы в которых R обозначает радикал -(Алк)i(Циклоалк),где Алк обозначает алкильный насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода,Циклоалк обозначает насыщенный циклический углеводородный радикал, содержащий 5 или 6 атомов углерода,и i равно 0 или 1; а также их соли с минеральной или органической кислотой. 4. Соединения по любому из пп.1-3,имеющие общую формулу в которой R обозначает радикал -(Алк)i(Циклоалк),где Алк обозначает алкильный насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода,Циклоалк обозначает насыщенный циклический углеводородный радикал, содержащий 5 или 6 атомов углерода,и i равно 0 или 1; а также к их солям с минеральной или органической кислотой. 5. Соединения по любому из пп.1-4, в которых R обозначает радикал -(Алк)i-(Циклоалк),в котором Алк обозначает метильный насыщенный углеводородный радикал с нормальной или разветвленной цепью, содержащей от 1 до 6 атомов углерода,Циклоалк обозначает циклогексильный радикал,i равно 0 или 1; а также их соли с минеральной или органической кислотой. 6. Соединения по любому из пп.1-5, выбираемые индивидуально из 4,4'-O,O-дициклогексилоил-2[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразина,4,4'-О,O-ди(циклогексилацетил)-2[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразина,а также из их солей с минеральной или органической кислотой. 7. Соединение 4,4'-О,O-дициклогексилоил 2-[(1R,2S,3R)(1,2,3,4-тетрагидроксибутил)]-5[(2'S,3'R)(2',3',4'-тригидроксибутил)]пиразин, а также его соли с минеральной или органической кислотой. 8. Способ получения соединений, описанных в любом из пп.1-7, отличающийся тем, что соединение общей формулы(XI) и либо Ri2 обозначает атом водорода, a Ri3 обозначает стереоизомерные формы цепи(XII),либо Ri2 обозначает стереоизомерные формы цепей(XII),а Ri3 обозначает атом водорода,обрабатывают соответствующим ацилгалогенидом формулы R-COX, в которой R определен в пп.1-7, а Х обозначает атом галогена. 9. Способ по п.8, отличающийся тем, что реакцию проводят в присутствии пиридина при температурах от 0 до 40 С. 18 10. Лекарственное средство, отличающееся тем, что оно содержит в качестве активного начала одно или несколько соединений по любому из пп.1-7 и одно или несколько эксципиентов. 11. Применение соединений по пп.1-7 для получения лекарственного средства для профилактики и/или лечения диабета и его осложнений.
МПК / Метки
МПК: C07D 241/12, A61P 3/10, A61K 31/495
Метки: содержащие, фармацевтические, получения, полигидроксипиразинов, композиции, производные, новые, способ
Код ссылки
<a href="https://eas.patents.su/10-3550-novye-proizvodnye-poligidroksipirazinov-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные полигидроксипиразинов, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Терапевтические комбинации, включающие в себя амлодипин и аторвастатин
Следующий патент: Моногидрат гидробромида элетриптана в качестве селективного агониста 5-нт1 рецептора
Случайный патент: Вещество, применяемое для лечения заболеваний, опосредованных pi3-киназой












