Способ получения производных камптотецина.
Формула / Реферат
1. Способ получения соединения формулы (I),
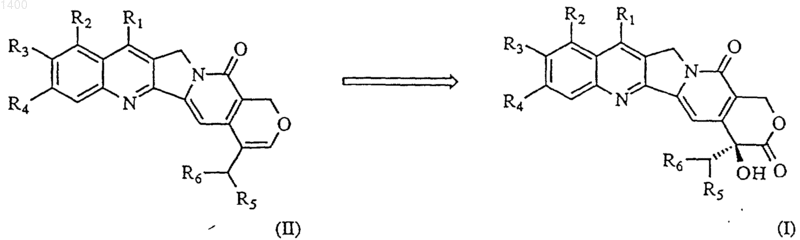
при котором дигидроксилируют соединение формулы (II), где
R1 и R2, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-8)алкенила, гидрокси-(С1-8)алкила либо (С1-8)алкокси (C1-8)алкила, или (-CH2NR7R8), где
1) R7 и R8, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-8)алкенила, гидрокси-(С1-8)алкила либо (С1-8)алкокси-(С1-8)алкила; или
2) R7 представляет собой водород, (С1-8)алкил, (С3-7)циклоалкил, (С3-7)циклоалкил-(С1-8)алкил, (С2-8)алкенил, гидрокси-(С1-8)алкил либо (С1-8)алкокси-(С1-8)алкил, а R8 представляет собой -COR9, где
R9 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, (С3-7)циклоалкил, (С3-7)циклоалкил-(С1-8)алкил, (С2-8)алкенил, гидрокси-(С1-8)-алкил, (С1-8)алкокси, (С1-8)алкокси-(С1-8)алкил; или
3) R7 представляет собой водород или (С1-8)алкил, a R8 представляет собой дифенилметил или -(CH2)tAr, где t равно числу от 0 до 5, а Аr представляет собой фенил, фурил, пиридил, N-метилпирролил, имидазолил, возможно замещенный одним или более чем одним заместителем, выбранным из гидрокси, метила, галогена и амино; или
4) R7 и R8, взятые вместе со связанным с ними азотом, образуют насыщенную 3-7-атомную гетероциклическую группу формулы (IА)
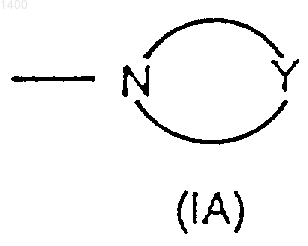
где Y представляет собой О, S, SO, SO2, CH2 или NR10, где
R10 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, арил; арил, замещенный одним или более чем одним заместителем, выбранными из групп: (С1-8)алкил, (С1-8)алкокси, галоген, нитро, амино, (С1-8)алкиламино, пергало-(С1-8)алкил, гидрокси-(С1-8)алкил, (C1-8)алкокси-(C1-6)-алкил, или -COR11, где
R11 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, (С1-8)алкокси, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С1-8)алкил, пергало-(С1-8)алкил, гидрокси-(С1-8)алкил, (С1-8)алкокси-(С1-8)алкил; R3 и R4 независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-8)алкенила, гидрокси-(С1-8)алкила либо (C1-8)алкокси(C1-8)алкила; или
R3 и R4, взятые вместе, образуют насыщенную 5-6-атомную гетероциклическую группу формулы (IВ)
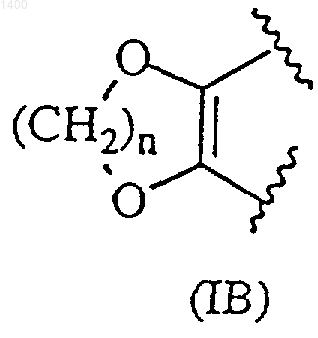
где n представляет собой целое число 1 или 2; или R3 представляет собой -OCONR12R13, где
R12 и R13, которые могут быть одинаковыми или различными, независимо выбраны из водорода, замещенной либо незамещенной алкильной группы с 1-4 атомами углерода или замещенной либо незамещенной карбоциклической или гетероциклической группы при условии, что, когда оба R12 и R13 являются замещенными либо незамещенными алкильными группами, они могут быть объединены вместе с атомом азота, с которым они связаны, с образованием гетероциклического кольца, прерываемого -О-, -S- и/или >N-R14, где R14 представляет собой водород, замещенную либо незамещенную алкильную группу с 1-4 атомами углерода или замещенную либо незамещенную фенильную группу, и
R5 представляет собой водород или (С1-8)алкил, и
R6 представляет собой водород или (С1-8)алкил, и
его фармацевтически приемлемые соли.
2. Соединение формулы (II)
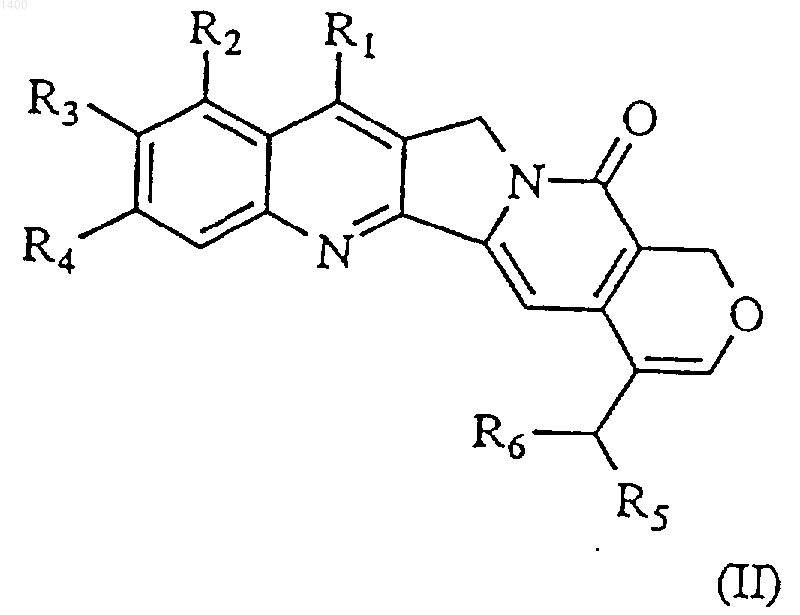
где R1 и R2, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-8)алкенила, гидрокси-(С1-8)алкила либо алкоксиалкила, или (-CH2NR7R8), где
1) R7 и R8, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-8)алкенила, гидрокси-(С1-8)алкила либо (С1-8)алкокси-(С1-8)алкила; или
2) R7 представляет собой водород, (С1-8)алкил, (С3-7)циклоалкил, (С3-7)циклоалкил-(С1-8)алкил, (С2-8)алкенил, гидрокси-(С1-8)алкил либо (С1-8)алкокси-(С1-8)алкил, а
R8 представляет собой -COR9, где
R9 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, (С3-7)циклоалкил, (С3-7)циклоалкил-(С1-8)алкил, (С2-8)алкенил, гидрокси-(С1-8)алкил, (С1-8)алкокси, (С1-8)алкокси-(С1-8)алкил; или
3) R7 представляет собой водород или (С1-8)алкил, a R8 представляет собой дифенилметил или -(Ch2)tAr, где t равно числу от 0 до 5, а Аr представляет собой фенил, фурил, пиридил, N-метилпирролил, имидазолил, возможно замещенный одним или более чем одним заместителем, выбранным из гидрокси, метила, галогена и амино; или
4) R7 и R8, взятые вместе со связанным с ними азотом, образуют насыщенную 3-7-атомную гетероциклическую группу формулы (IA)

где Y представляет собой О, S, SO, SO2, CH2 или NR10, где
R10 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С1-8)алкил, (С1-8)алкокси, галогена, нитро, амино, (С1-8)алкиламино, пергало-(С1-8)алкил, гидрокси-(С1-8)алкил, (С1-8)алкокси-(С1-8)алкила, или -COR11, где
R11 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, (С1-8)алкокси, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С1-8)алкил, пергало-(С1-8)алкил, гидрокси-(С1-8)алкил, (С1-8)алкокси-(С1-8)алкил;
R3 и R4 независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-8)алкенила, гидрокси-(С1-8)алкила либо алкоксиалкила; или R3 и R4, взятые вместе, образуют насыщенную 5-6-атомную гетероциклическую группу формулы (IВ)
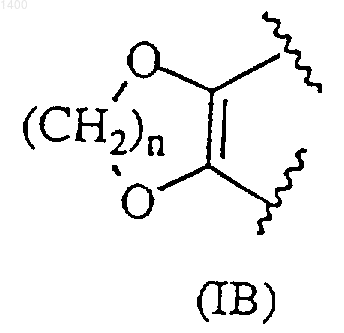
где n представляет собой целое число 1 или 2; или
R3 представляет сосющ -OCONR12R13, где
R12 и R13, которые могут быть одинаковыми или различными, независимо выбраны из водорода, замещенной либо незамещенной алкильной группы с 1-4 атомами углерода или замещенной либо незамещенной карбоциклической или гетероциклической группы при условии, что, когда и R12, и R13 являются замещенными либо незамещенными алкильными группами, они могут быть объединены вместе с атомом азота, с которым они связаны, с образованием гетероциклического кольца, прерываемого -О-, -S- и/или >N-R14, где R14 представляет собой водород, замещенную либо незамещенную алкильную группу с 1-4 атомами углерода или замещенную или незамещенную фенильную группу, и
R5 представляет собой водород или (С1-8)алкил, и
R6 представляет собой водород или (С1-8)алкил, и
его фармацевтически приемлемые соли.
3. Соединение по п.2, где это соединение представляет собой 11Н-1,4-диоксино[2,3-д]пирано[3'4':6,7]индолизино[1,2-b]хинолин-12(14Н)-он,8-этил-2,3-дигидро-15-[(4-метил-1-пиперазинил)метил].
4. Соединение формулы (III)
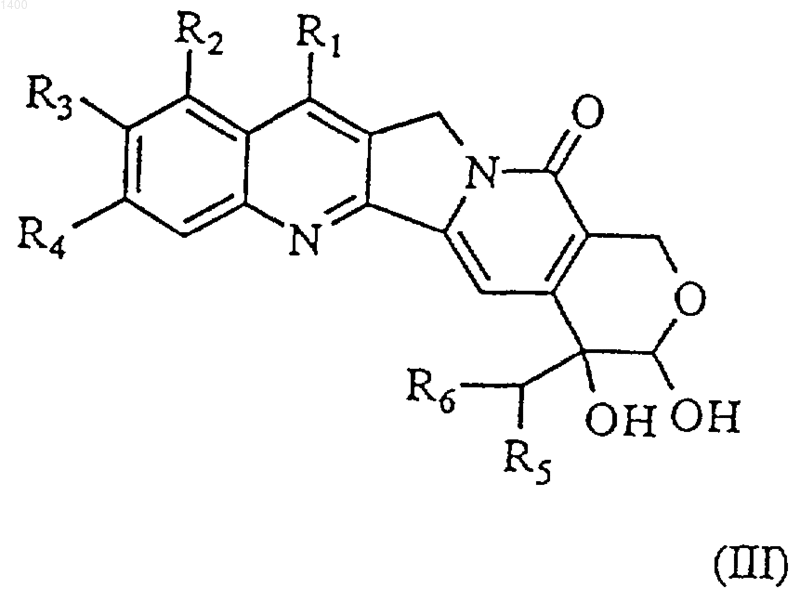
где R1 и R2, которые могут быть одинаковыми или различными, независимо выбраны из (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-3)алкенила, гидрокси-(С1-8)алкила либо(C1-8)алкокси (C1-8)алкила, или (-CH2NR7R8), где
1) R7 и R8, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-8)алкенила, гидрокси-(С1-8)алкила либо (С1-8)алкокси-(С1-8)алкила; или
2) R7 представляет собой водород, (С1-8)алкил, (С3-7)циклоалкил, (С3-7)циклоалкил-(С1-8)алкил, (С2-8)алкенил, гидрокси-(С1-8)алкил либо (С1-8)алкокси-(С1-8)алкил, а
R8 представляет собой -COR9, где
R9 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, (С3-7)циклоалкил, (С3-7)циклоалкил-(С1-8)алкил, (С2-8)алкенил, гидрокси-(С1-8)алкил, (С1-8)алкокси, (С1-8)алкокси-(С1-8)алкил; или
3) R7 представляет собой водород или (С1-8)алкил, a R8 представляет собой дифенилметил или -(CH2)tAr, где t равно числу от 0 до 5, а
Аr представляет собой фенил, фурил, пиридил, N-метилпирролил, имидазолил, возможно замещенный одним или более чем одним заместителем, выбранным из гидрокси, метила, галогена и амино; или
4) R7 и R8, взятые вместе со связанным с ними азотом, образуют насыщенную 3-7-атомную гетероциклическую группу формулы (IA)
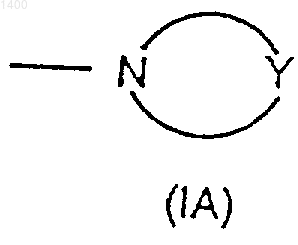
где Y представляет собой О, S, SO, SO2, CH2 или NR10, где
R10 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С1-8)алкил, (С1-8)алкокси, галогена, нитро, амино, (С1-8)алкиламино, пергало-(С1-8)алкил, гидрокси-(С1-8)алкил, (С1-8)алкокси-(С1-8)алкила, или -COR11, где
R11 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, (С1-8)алкокси, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С1-8)алкил, пергало-(С1-8)алкил, гидрокси-(С1-8)алкил, (С1-8)алкокси-(С1-8)алкил,
a R2 может также быть водородом;
R3 и R4 независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-8)алкенила, гидрокси-(С1-8)алкила либо алкоксиалкила; или
R3 и R4, взятые вместе, образуют насыщенную 5-6-атомную гетероциклическую группу формулы (IB)

где n представляет собой целое число 1 или 2; или
R3 представляет собой -OCONR12R13, где
R12 и R13, которые могут быть одинаковыми или различными, независимо выбраны из водорода, замещенной либо незамещенной алкильной группы с 1-4 атомами углерода или замещенной либо незамещенной карбоциклической или гетероциклической группы при условии, что, когда и R12, и R13 являются замещенными либо незамещенными алкильными группами, они могут быть объединены вместе с атомом азота, с которым они связаны, с образованием гетероциклического кольца, прерываемого -О-, -S- и/или >N-R14, где R14 представляет собой водород, замещенную либо незамещенную алкильную группу с 1-4 атомами углерода или замещенную или незамещенную фенильную группу, и
R5 представляет собой водород или (С1-8)алкил, и
R6 представляет собой водород или (С1-8)алкил, и
его фармацевтически приемлемые соли.
5. Соединение по п.4, где это соединение представляет собой 11Н-1,4-диоксино[2,3-g]пирано[3',4':6,7]индолизино[1,2-b]хинолин-12(8Н,14Н)-он,8-этил-2,3-дигидро-8,9-дигидрокси-15-[(4-метил-1-пиперазинил)метил]-(9R-цис).
6. Соединение формулы (IV)

где R1 и R2, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8) алкила, (С2-8)алкенила, гидрокси-(С1-8)алкила либо (C1-8)алкокси (C1-8)алкила, или (-CH2NR7R8), где
1) R7 и R8, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-3)алкенила, гидрокси-(С1-8)алкила либо (С1-8)алкокси-(С1-8)алкила; или
2) R7 представляет собой водород, (С1-8)алкил, (С3-7)циклоалкил, (С3-7)циклоалкил-(С1-8)алкил, (С2-8)алкенил, гидрокси-(С1-8)алкил либо (С1-8)алкокси-(С1-8)алкил, а
R8 представляет собой -COR9, где
R9 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, (С3-7)циклоалкил, (С3-7)циклоалкил-(С1-8)алкил, (С2-8)алкенил, гидрокси-(С1-8)алкил, (С1-8)алкокси, (С1-8)алкокси-(С1-8)алкил; или
3) R7 представляет собой водород или (С1-8)алкил, a R8 представляет собой дифенилметил или -(CH2)tAr, где t равно числу от 0 до 5, а
Аr представляет собой фенил, фурил, пиридил, N-метилпирролил, имидазолил, возможно замещенный одним или более чем одним заместителем, выбранным из гидрокси, метила, галогена и амино; или
4) R7 и R8, взятые вместе со связанным с ними азотом, образуют насыщенную 3-7-атомную гетероциклическую группу формулы (IА)

где Y представляет собой О, S, SO, SO2, CH2 или NR10, где
R10 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С1-8)алкил, (С1-8)алкокси, галогена, нитро, амино, (С1-8)алкиламино, пергало-(С1-8)алкил, гидрокси-(С1-8)алкил, (С1-8)алкокси-(С1-8)алкила, или -COR11, где
R11 представляет собой водород, (С1-8)алкил, пергало-(С1-8)алкил, (С1-8)алкокси, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С1-8)алкил, пергало-(С1-8)алкил, гидрокси-(С1-8)алкил, (С1-8)алкокси-(С1-8)алкил;
R3 и R4 независимо выбраны из водорода, (С1-8)алкила, (С3-7)циклоалкила, (С3-7)циклоалкил-(С1-8)алкила, (С2-8)алкенила, гидрокси-(С1-8)алкила либо алкоксиалкила; или
R3 и R4, взятые вместе, образуют насыщенную 5-6-атомную гетероциклическую группу формулы (IB)
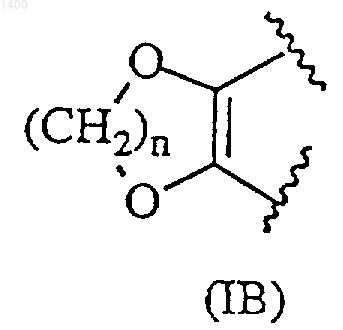
где n представляет собой целое число 1 или 2; или R3 представляет собой -OCONR12R13, где R12 и R13, которые могут быть одинаковыми или различными, независимо выбраны из водорода, замещенной либо незамещенной алкильной группы с 1-4 атомами углерода или замещенной либо незамещенной карбоциклической или гетероциклической группы при условии, что, когда и R12, и R13 являются замещенными либо незамещенными алкильными группами, они могут быть объединены вместе с атомом азота, с которым они связаны, с образованием гетероциклического кольца, прерываемого -О-, -S- и/или >N-R14, где R14 представляет собой водород, замещенную либо незамещенную алкильную группу с 1-4 атомами углерода или замещенную или незамещенную фенильную группу, и
R5 представляет собой водород или (С1-8)алкил, и
R6 представляет собой водород или (С1-8)алкил, и
его фармацевтически приемлемые соли.
7. Соединение по п.6, где это соединение представляет собой 4-этил-7-[7-иод-9-[(4-метилпиперазинил)метил]-2,3-дигидро-[1,4]диоксино[2,3-д]-хинолин-8-илметил]-1Н-пирано[3,4-с]пиридин-8-он.
8. Соединение формулы (VI)
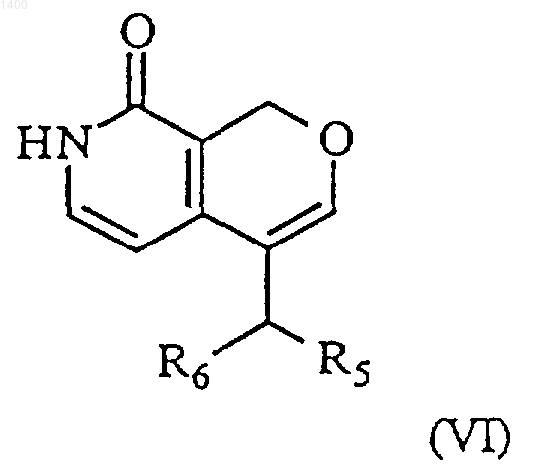
где R5 представляет собой водород или (С1-8)алкил, R6 представляет собой водород или (С1-8)алкил, и его фармацевтически приемлемые соли.
9. Соединение по п.8, где это соединение представляет собой 4-этил-1Н-пирано[3,4-с]пиридин-8-он.
Текст
1 Область изобретения Настоящее изобретение относится к способу получения камптотецина и аналогов камптотецина с использованием химических соединений, которые полезны в качестве промежуточных соединений, и к способам получения данных промежуточных соединений. Предпосылки изобретения Камптотецин представляет собой природное соединение, обнаруженное в Camptothecaacuminata. Установлено, что камптотецин и аналоги камптотецина обладают антилейкозными и противоопухолевыми свойствами. Камптотецин и аналоги камптотецина могут быть синтезированы с использованием способов, описанных в патенте США 4894456(Wall, et al., от 16 января 1990); патенте США 4399282 (Miyasaka, et al., от 16 августа 1983); патенте США 4399276 (Miyasaka, et al., от 16 августа 1983); патенте США 4943579 (Vishnuvajjala, et al., от 24 июля 1990); заявке на Европейский патент 0321122 А 2, поданной SmithKline Becham Corporation и опубликованной 21 июня 1989; Патенте США 4473692 (Miyasaka,et al., от 25 сентября 1984); заявке на Европейский патент 0325247 А 2, поданной KabushikiKaisha Yakult Honsh и опубликованной 26 июля 1989; заявке на Европейский патент 0556585 А 2,поданной Takeda Chemical Industries и опубликованной 25 августа 1993; Патенте США 4981968 (Wall, et al., от 1 января 1991); патенте США 5049668 (Wall, etal., от 17 сентября 1991); патенте США 5162532 (Comins, et al., от 10 ноября 1992); патенте США 5180722 (Wall, et al., от 19 января 1993) и заявке на Европейский патент 0540099 А 1, поданной Glaxo Inc. и опубликованной 5 мая 1993. В известных ранее способах получения камптотецина и аналогов камптотецина используют разделения или хиральные вспомогательные вещества, чтобы получать энантиомерно обогащенные промежуточные соединения. Проблема этих способов заключается в том, что разделение неизбежно влечет за собой отбрасывание половины рацемического материала, а хиральное вспомогательное вещество требует использования стехиометрических количеств хиральной субъединицы, чтобы стереоселективно ввести хиральный центр. В заявке на патент США с серийным номером 08/237081 и в статье Fang et al. в Journalof Organic Chemistry, 59(21), 6142-6143 (1994) описан способ, в котором используют каталитический процесс введения асимметрии. Одна из возможных проблем, связанная с такими описанными ранее способами, заключается в том,что некоторые из хирально-специфических промежуточных соединений сами по себе могут проявлять цитотоксичность. Кроме этого, конечная стадия синтеза, описанного в заявке на патент США с серийным номером 08/237081, 001400 2 требует использования палладиевого катализатора, который впоследствии должен быть удален из полученной лекарственной субстанции посредством многократных перекристаллизаций. Сильная цитотоксичность камптотецина и некоторых его аналогов требует соблюдения строгих мер предосторожности на протяжении всех последних стадий производства, чтобы защитить участвующий в производстве персонал и окружающую среду. Такие меры предосторожности усложняют и увеличивают стоимость производства камптотецина и его аналогов и обращения с ними. Задачей настоящего изобретения является разработка способа получения камптотецина и его аналогов, при котором хиральность в положении 20 не вводят до предпоследней стадии производства. Это должно уменьшить риск случайного загрязнения окружающей среды и нанесения вреда участвующему в производстве персоналу и, следовательно, снизить строгость мер предосторожности, поскольку будет сведено до минимума время хранения биологически активного материала и обращения с ним. Сущность изобретения Согласно настоящему изобретению предложен способ получения соединений формулы(I), при котором подвергают окислению соединения формулы (II)R1 и R2, которые могут быть одинаковыми или различными, независимо выбраны из водорода, низшего алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-низшего алкила, низшего алкенила,гидрокси-низшего алкила либо алкоксиалкила,или (-CH2NR7R8), где 1) R7 и R8, которые могут быть одинаковыми или различными, независимо выбраны из водорода, низшего алкила, (С 3-7)циклоалкила,(С 3-7)циклоалкил-низшего алкила, низшего алкенила, гидрокси-низшего алкила либо низшего алкокси-низшего алкила; или 2) R7 представляет собой водород, низший алкил,(С 3-7)циклоалкил,(С 3-7)циклоалкилнизший алкил, низший алкенил, гидроксинизший алкил либо низший алкокси-низший алкил, a R8 представляет собой -COR9, гдеR9 представляет собой водород, низший алкил, пергало-низший алкил, (С 3-7)циклоалкил,(С 3-7)циклоалкил-низший алкил, низший алкенил, гидрокси-низший алкил, низший алкокси,низший алкокси-низший алкил; или 3) R7 представляет собой водород или низший алкил, a R8 представляет собой дифенилметил или -(CH2)tAr, где: 3 Аr представляет собой фенил, фурил, пиридил, N-метилпирролил, имидазолил, возможно замещенный одним или более чем одним заместителем, выбранным из гидрокси, метила,галогена и амино; или 4) R7 и R8, взятые вместе со связанным с ними азотом, образуют насыщенную 3-7 атомную гетероциклическую группу формулыR10 представляет собой водород, низший алкил, пергало-низший алкил, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: низший алкил, низший алкокси, галоген,нитро, амино, низший алкиламино, пергалонизший алкил, гидрокси-низший алкил, низший алкокси-низший алкил или -COR11, где:R11 представляет собой водород, низший алкил, пергало-низший алкил, низший алкокси,арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: низший алкил, пергало-низший алкил, гидроксинизший алкил, низший алкокси-низший алкил; илиR3 и R4 независимо выбраны из водорода,низшего алкила, (С 3-7)циклоалкила, (С 3-7) циклолкил-низшего алкила, низшего алкенила,гидрокси-низшего алкила либо алкоксиалкила; илиR3 и R4, взятые вместе, образуют насыщенную 5-6-атомную гетероциклическую группу формулы (IБ) в которой n представляет собой целое число 1 или 2; или R3 представляет собой -OCONR12R13,гдеR12 и R13, которые могут быть одинаковыми или различными, независимо выбраны из водорода, замещенной либо незамещенной алкильной группы с 1-4 атомами углерода или замещенной либо незамещенной карбоциклической или гетероциклической группы при условии, что, когда и R12 и R13 являются замещенными или незамещенными алкильными группами, они могут совместно с атомом азота, с которым они связаны, образовывать гетероциклическое кольцо, прерываемое -О-, -S- и/или N-R14,где R14 представляет собой водород, замещен 001400 4 ную либо незамещенную алкильную группу с 14 атомами углерода или замещенную либо незамещенную фенильную группу, и R5 представляет собой водород или алкил, в частности, метил, а R6 представляет собой водород или алкил,в частности, водород и их фармацевтически приемлемые соли. Далее, в настоящем изобретении предложен способ получения соединений формулы (I),при котором соединение формулы (II) дигидроксилируют, а затем окисляют с получением соединения формулы (I). В дополнение к способу получения соединений формулы (I) из соединений формулы (II) другие аспекты данного изобретения включают в себя соединения формулы (II) и различные промежуточные соединения, полезные в образовании соединений формулы (I) и (II). Другие аспекты и преимущества настоящего изобретения станут очевидными из приведенного ниже детального описания изобретения. Детальное описание изобретения Используемый здесь термин "низший алкил" означает линейную или разветвленную алкильную группу с 1-8, предпочтительно 1-4 атомами углерода, такую как метил, этил, пропил, изопропил, н-бутил, трет-бутил, гексил и октил. Это определение также применимо к составляющей низшего алкила в группах: низший алкокси, низший алкилтио и ди(низший алкил)-амино. Так, примерами низших алкоксигрупп являются метокси, этокси,пропокси, втор-бутокси и изогексокси; примерами низших алкилтиогрупп являются метилтио, этилтио, трет-бутилтио и гексилтио, а примерами ди(низший алкил)-аминогрупп являются диметиламино, диэтиламино, диизопропиламино, ди(н-бутил)амино и дипентиламино. Используемые здесь термины "гало" и "галоген" относятся к заместителю, которым может быть фтор, хлор, бром или иод. Используемый здесь термин "трифлат" относится к трифторметансульфонату. Используемое здесь обозначение "С" означает градусы Цельсия. Используемый здесь термин "температура окружающей среды" означает температуру от приблизительно 20 С до приблизительно 30 С. Соединения по настоящему изобретению могут иметь 1 или более чем один асимметрический атом углерода, который формирует энантиомерные структуры, то есть "R"- и "S"-конфигурации. Настоящее изобретение включает в себя все энантиомерные формы и любые комбинации этих форм. В тех случаях, когда для простоты в структурных формулах не указана конкретная конфигурация, следует понимать, что представлены как энантиомерные формы, так и их смеси. Если не оговорено особо, номенклатурные обозначения"(R)" и "(S)" означают по существу оптически чистые R и S-энантиомеры, соответственно. 5 Настоящее изобретение также включает в себя другие формы соединений, в том числе сольваты, гидраты, различные полиморфы и т.п. Приемлемые соли включают в себя, но этим изобретение не ограничивается, соли с неорганическими кислотами и основаниями,такие как гидрохлорид, сульфат, фосфат, дифосфат, гидробромид и нитрат, или соли с органическими кислотами, такие как ацетат, малат,малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, пальмоат, салицилат, оксалат и стеарат. Другие примеры приемлемых солей описаны в "Pharmaceutical Salts", J. Pharm. Sci, 66(1), 1 (1977). Согласно одному из аспектов настоящего изобретения предложен способ получения соединений формулы (III) 6 Альтернативно, соединение формулы II окисляют до соединения формулы III по реакции ахирального дигидроксилирования с получением рацемического цис-диола, который затем разделяют ферментативно с получением энантиомерно обогащенного соединения формулы II. Описание реакций ахирального дигидроксилирования приводится в работе Larock,Comprehensive Organic Transformations, 493-496(1989). Реакцию разделения можно проводить в присутствии ацилирующего фермента, такого как панкреатические липазы, липазы из Pseudomonas fluorenscens, липазы из C.Cylindracea,липазы из Chromobacterium viscosum и липазы из Aspergillus niger, в присутствии ацилирующего агента, такого как винилацетат, при температуре от приблизительно 0 С до температуры окружающей среды в течение от приблизительно 2 до приблизительно 48 ч. Варианты этих условий можно найти в работе A. Klibanov,Asymmetric Transformations Catalyzed by Enzymes in Organic Solvents, Acc. Chem. Res. 23,114-120 (1990). Соединения формулы (II) могут быть получены циклизацией соединения формулы (IV) при котором дигидроксилируют соединения формулы (II) с использованием реакции каталитического асимметрического дигидроксилирования. В типичном случае реакция может быть проведена в присутствии осмиевого катализатора (например,дигидрата осмата(VI) калия, гидрата хлорида осмия(III) или тетраоксида осмия), катализатора на основе хирального третичного амина (например, производных алкалоидов хинного дерева, таких как гидрохинидин 1,4-фталазиндиилдиэфир), окисляющего агента (например, феррицианида(III) калия, перекиси водорода, Nоксида N-метилморфолина или электричества) и первичного амида (например, метансульфонамида) в щелочных условиях (например в присутствии карбоната калия) в водной смеси, содержащей полярный протонный растворитель(например, трет-бутанол, изо-пропанол или нпропанол). Реакция может быть проведена при температуре от приблизительно 0 С до приблизительно 30 С в течение от приблизительно 12 до приблизительно 48 ч. Приемлемые варианты этих условий описаны в литературе по родственным реакциям каталитического асимметрического дигидроксилирования (например, K.B. где Х представляет собой трифлат или гало, в частности, хлор-, бром- и иод-. Соединения формулы (IV) могут быть циклизованы посредством внутримолекулярной реакции Хека. Эта реакция может быть проведена в пpисутствии палладиевого катализатора(например, ацетонитриле или N,N-диметилформамиде) или полярном протонном растворителе(например, н-пропаноле, изопропаноле или трет-бутаноле). При использовании полярного апротонного растворителя может быть введен катализатор фазового переноса, такой как соль тетраалкиламмония галид (например, тетрабутиламмония хлорид, тетрабутиламмония бромид или тетрабутиламмония иодид). Предпочтительно, может также быть введен лиганд для палладиевого катализатора, такой как трифенилфосфин,три-о-толилфосфин,три-мтолилфосфин или три-п-толилфосфин. Реакцию можно проводить в атмосфере инертного газа,такого как азот или аргон, в подходящем реакционном сосуде, снабженном механической мешалкой и конденсатором с водяным охлаждением. Реакционная смесь может быть нагрета до температуры от приблизительно 50 С до приблизительно 110 С в течение от приблизительно 1 до приблизительно 48 ч. Варианты этих условий описаны в литературе о реакции 7 Хека, например, в R. Grigg et al., Tetrahedron 46,4003-4008 (1990). Соединения формулы (IV) могут быть получены конденсацией соединений формулы (V) и формулы (VI) где Х представляет собой трифлат или гало, в частности хлор-, бром- и иод-, а Z представляет собой соответствующую уходящую группу, такую как хлор-, бром-и иод- или группу OR15, гдеR15 представляет собой трифлат, мезилат, тозилат или, в частности, Н. В случае, когда Z представляет собой гидрокси, реакцию конденсации проводят в апротонном растворителе, например, метиленхлориде, в присутствии триалкил- или триарилфосфина, например, трифенилфосфина, и диалкилазодикарбоксилата, например, диэтилазодикарбоксилата, при температуре от приблизительно 0 С до приблизительно 50 С в течение приблизительно от 0,5 до 4 ч. Другие варианты вышеупомянутых условий можно найти в литературе о реакции Мицунобу (О. Mitsunobu, Synthesis, 1(1981. Когда Z представляет собой гало, трифлат,мезилат или тозилат, реакцию конденсации проводят в полярном апротонном растворителе,таком как ацетонитрил или N,N-диметилформамид, либо в полярном протонном растворителе, таком как изопропанол или трет-бутанол в присутствии основания, например, третбутоксида калия, при температуре от приблизительно 25 до приблизительно 100 С в течение приблизительно от 1 до 24 ч с получением соединения формулы (IV). Варианты вышеуказанных условий описаны в патенте США 5254690 (Comins et al., от 19 октября 1993),представленном здесь в виде ссылки. Соединения формулы (VI) могут быть получены из соединений формулы (VII) где R16 представляет собой алкил, в частности,метил. Реакция деалкилирования может быть проведена в полярном апротонном растворителе, например, ацетонитриле, в присутствии подходящего деалкилирующего реагента, например, триалкилсилилиодида, при температуре от приблизительно 0 С до 100 С в течение приблизительно 1-12 ч. 8 Триалкилсилилиодид может быть полученin situ взаимодействием триалкилсилилгалогенида, например, триметилсилилхлорида, и иодида щелочного металла, например, иодида натрия. Альтернативно, реакцию деалкилирования можно проводить в полярном протонном растворителе, например воде или этаноле, в присутствии сильной кислоты, например соляной кислоты, при температуре между приблизительно 0 С и 100 С в течение приблизительно 124 ч с получением соединения формулы (VI). Исходные материалы, соединения формулы (V) и формулы (VII) описаны в заявке на патент США под серийным номером 08/237081;Fang et al., Journal of Organic Chemistry, 59(21),6142-6153 (1994); PCT/US 95/05425 и PCT/US 95/05427. Соединения формулы (III) могут быть окислены с получением соединения формулы (I) Реакцию окисления можно проводить в подходящем растворителе, например, метиленхлориде, в присутствии окисляющего агента,например, диметилсульфоксида, активирующего реагента, например, оксалилхлорида, и основания, например, триэтиламина, при температуре между приблизительно -78 С и -20 С в течение от приблизительно 0,1 до приблизительно 1 ч с получением соединения формулы (I). Другие варианты этих условий можно найти в литературе по активированным оксидантам на основе серы (например, Mancuso and Swern, Synthesis,165-185 (1981) и March J., Advanced OrganicYork (1985), pp. 1057-1060, 1081-1082). Таким образом, последовательное преобразование соединений формул (V) и (VI) в соединения формулы (I) через промежуточные соединения формул (IV), (II) и (III) представлено следующей схемой Другим аспектом изобретения являются новые соединения фрмул (II), (III), (IV) и (VI). Соединения фрмул (II), (III), (IV), (V), (VI) и (VII) полезны в качестве промежуточных со 9 единений при получении камптотецина и аналогов камптотецина, например, соединений формулы (I) и соединений, описанных в заявке на Европейский патент 0540099 А 1, зарегистрированной Glaxo Inc. и опубликованной 5 мая 1993,представленной здесь в виде ссылки. Типичное получение производных камптотецина формулы (I) с использованием промежуточных соединений формул (II), (III), (IV), (V),(VI) и (VII) приведено здесь в виде примеров. Примеры Следующие примеры иллюстрируют различные аспекты настоящего изобретения, но они не должны рассматриваться как ограничивающие. Символы, соглашения и номенклатура,специально не оговоренные ниже, соответствуют таковым, используемым в современной химической литературе, например в Journal ofAmerican Chemical Society. В следующих далее примерах: "мг" означает миллиграмм(ы), "М" означает молярный,"мл" означает миллилитр(ы), "ммол" означает миллимоль(и), "л" означает литр(ы), "моль" означает, моль(и), "г" означает грамм(ы), "ТСХ" означает тонкослойную хроматографию,"ВЭЖХ" означает высокоэффективную жидкостную хроматографию, "мм" означает миллимоль(и), "т.п." означает точку плавления, "МГц" означает мегагерц, "1H-ЯМР" означает протонный ядерный магнитный резонанс, "Гц" означает герц, "ч" означает час(ы) и "н" означает нормальный. Если не указано иначе, все исходные материалы были получены от коммерческих поставщиков и использовались без дальнейшей очистки. Все реакции с участием соединений,чувствительных к кислороду или влажности,проводили в атмосфере сухого N2. Все реакционные смеси и хроматографические фракции анализировали с помощью тонкослойной хроматографии на пластинах силикагеля, производя визуализацию с помощью УФ и окрашивания l2. Пример 1. 4-Этил-1 Н-пирано[3,4-с]пиридин-8-он (соединение формулы (VI), где R5 представляет собой водород, a R6 является метилом). В круглодонную одногорлую колбу вместимостью 250 мл помещают 4-этил-8-метокси 1 Н-пирано[3,4-с]пиридин (10 г; 52,4 ммоля),полученный как описано в заявке на патент США под серийным номером 08/237081, Fang et(11,8 г; 79 ммолей). Эту смесь перемешивают в течение приблизительно 20 мин при температуре окружающей среды. К смеси добавляют триметилсилилхлорид (10 мл; 79 ммолей), что приводит к немедленному образованию осадка белого цвета. Полученную смесь кипятят с обратным холодильником приблизительно в течение 2 ч. Реакционную смесь охлаждают до темпера 001400 10 туры окружающей среды. К охлажденной реакционной смеси добавляют 50 мл насыщенного раствора натрия бикарбоната. Смесь перемешивают в течение 1 ч при температуре окружающей среды. Осадок собирают фильтрованием на воронке Бюхнера. Собранное твердое вещество высушивают в вакууме в течение приблизительно 12 ч при температуре между 25 и 38 С,получая первый сбор 4-этил-1 Н-пирано[3,4 с]пиридин-8-она в виде кристаллического твердого вещества рыжевато-коричневой окраски. Фильтрат концентрируют в вакууме и полученный остаток перекристаллизовывают из смеси ацетонитрил/метанол, получая дополнительно 4-этил-1 Н-пирано[3,4-с]пиридин-8-он в виде кристаллического твердого вещества рыжеватокоричневой окраски. Характеристики: т.п. 169-171 С; 1H ЯМР[2,3-g]хинолин-8-илметил]-1 Н-пирано[3,4-с] пиридин-8-он (соединение формулы (IV), где R1 представляет собой 4-метилпиперазинилметил,R2 представляет собой водород, R3 и R4 вместе являются этилендиокси, R5 является водородом,R6 является метилом, а Х является иодом). К раствору 4-этил-1 Н-пирано[3,4-с] пиридин-8-она (200 мг; 1,13 моля) и [7-иод-9-[(4 метилпиперазинил)метил]-2,3-дигидро-[1,4] диоксино[2,3-g]хинолин-8-ил]-метанола (514 мг; 1,13 ммоля), полученного как описано в заявке на патент США под серийным номером 08/237081, Fang et al., Journal of Organic Chemistry, 59(21), 6142-6143 (1994), PCT/US 95/05425 иPCT/US 95/05427, в 4,5 мл дихлорметана добавляют трифенилфосфин (326 мг; 1,24 ммоля). После перемешивания при температуре окружающей среды в течение 3 мин смесь охлаждают до 0 С с последующим добавлением по каплям диэтилазадикарбоксилата (0,20 мл; 1,24 ммоля). Коричневый раствор нагревают до температуры окружающей среды и перемешивают в течение 14 ч. Растворитель удаляют при пониженном давлении и полученный остаток хроматографируют на силикагеле. Элюирование 510%-ным метанолом в дихлорметане позволяет получить 4-этил-7-[7-иод-9-[(4-метил-пиперазинил)метил]-2,3-дигидро-[1,4]диоксино[2,3-g] хинолин-8-илметил]-1 Н-пирано[3,4-с]пиридин 8-он в виде твердого вещества желтого цвета. Характеристики: 1H ЯМР (200 МГц,CDCl3):1,03 (t, J=7,4 Гц, 3 Н), 2,18 (s, 3 Н), 2,25[2,3-g]хинолин-8-илметил]-1 Н-пирано[3,4-с] пиридин-8-она (50,0 мг;0,0813 ммоля) в 4 мл ацетонитрила последовательно добавляют ацетат палладия(II) (0,90 мг; 0,0040 ммоля), измельченный в порошок безводный карбонат калия (22,4 мг; 0,163 ммоля) и трифенилфосфин(10,6 мг; 0,0406 ммоля) при температуре окружающей среды. Смесь нагревают до температуры дефлегмации и перемешивают в течение 17 ч. Растворитель удаляют при пониженном давлении и полученный остаток хроматографируют на силикагеле. Элюирование 10%-ным метанолом в хлороформе дает 11 Н-1,4-диоксино[2,3g]пирано[3'4':6,7] индолизино[1,2-b]хинолин 12(14 Н)-он,8-этил-2,3-дигидро-15-[(4-метил 1 пиперазинил)метил] в виде твердого вещества желтого цвета. Характеристики: т.п. 223-225 С. 1[3',4':6,7]индолизино[1,2-b]хинолин-12(8 Н,14 Н)-он,8-этил-2,3-дигидро-8,9-дигидрокси-15[(4-метил-1-пиперазинил)метил]-(9R-цис) (соединение формулы (III), где R1 представляет собой 4-метилпиперазинилметил, R2 представляет собой водород, R3 и R4 вместе являются этилендиокси, R5 является водородом, a R6 является метилом). К AD-mix- (1,26 г), содержащему хиральный лиганд гидрохинидин 1,4-фталазиндиил диэфир, выпускаемый Aldrich Chemical Company, Milwaukee, Wl, в 4 мл смеси вода : третбутиловый спирт (1:1) добавляют метансульфонамид (24 мг; 0,260 ммоля). Коричневую смесь охлаждают до 0 С с последующим добавлением 11 Н-1,4-диоксино[2,3-g]пирано[3'4':6,7]индолизино[1,2-b]хинолин-12(14 Н)-он,8-этил-2,3 дигидро-15-[(4-метил-1 пиперазинил)метила](126 мг; 0,260 ммоля). Смеси позволяют нагреться до температуры окружающей среды и ее энергично перемешивают в течение 36 ч. Смесь разбавляют 8 мл воды и реакцию останавливают с помощью добавления 750 мг натрия сульфата. После дополнительного перемешивания в течение 20 мин смесь разбавляют 5 мл дихлорметана и фильтруют,получая твердое вещество, которое высушивают в высоком вакууме, получая 11 Н-1,4 001400 12 диоксино[2,3-g]пирано[3',4':6,7]индолизино[1,2b]хинолин-12(8 Н,14 Н)-oн,8-этил-2,3-дигидро 8,9-дигидрокси-15-[(4-метил-1-пиперазинил) метил]-(9R-цис) в виде твердого вещества светло-желтой окраски. Данные 1H ЯМР указывают на соотношение диастереомеров, равное 83:17. Возможно, два диастереомера являются эпимерами по гемиацетальному углероду. Характеристики (основной эпимер): т.п. 255-260 С с разложением. 1H ЯМР (300 МГц, DMSO-d6):0,97(ABq, JAB=39 Гц, =82 Гц, 2 Н), 4,83 (s, 1 Н),4,95 (s, 1H), 5,26 (s, 2H), 7,23 (s, 1 Н), 7,54 (s, 1H),7,70 (s, 1H). Для оценки энантиомерной селективности вышеупомянутого процесса основной, приведенный выше, диастереомер отдельно конвертируют в (S)- и (R)-О-метилманделаты в соответствии со следующим протоколом. Смесь вышеупомянутого твердого вещества (10 мг; 0,019 ммоля), (S)-O-метилминдальной кислоты(6,4 мг; 0,038 ммоля), 1,3-дициклогексилкарбодиимида (7,9 мг; 0,038 ммоля) и каталитического количества N,N-диметиламинопиридина в 2 мл дихлорметана перемешивают при температуре окружающей среды в течение 2 ч. Полученную белую суспензию фильтруют через короткую набивку с Целитом и промывают 2 мл дихлорметана. Объединенный фильтрат и промывки концентрируют при пониженном давлении, получая неочищенный продукт в виде твердого вещества. Интегральный анализ спектра 1H ЯМР (300 МГц, CDCl3) указывает на соотношение диастереомеров, равное 93:7. Это соответствует 86%-ной энантиочистоты для главного пентациклического спирта. То же самое соотношение получается, когда (R)манделаты получают из главного спирта. Сигналы для (S)- и (R)-О-метилманделатов комплементарны друг к другу. В обоих случаях для анализа используют острый сигнал протона аномерного центра. Пример 5. 11H-1,4 Диоксино[2,3-g]пирано[3',4':6,7]индолизино[1,2-b]хинолин-9,12(8 Н,14 Н)-дион,8-этил-2,3-дигидро-8-гидрокси-15[(4-метил-1-пиперазинил)метил]-(S) (соединение формулы (I), где R1 представляет собой 4 метилпиперазинилметил, R2 представляет собой водород, R3 и R4 вместе являются этилендиокси,R5 является водородом, a R6 является метилом). Раствор оксалилхлорида (0,14 мл; 1,5 ммоля) в 8 мл дихлорметана охлаждают до -78 С с последующим добавлением по каплям диметилсульфоксида (0,22 мл; 3,1 ммоля). Смесь перемешивают в течение 2 мин, а затем к ней добавляют 11 Н-1,4-диоксино[2,3-g]пирано[3',4':6,7] индолизино[1,2-b]хинолин-12(8H,14 Н)-он,8 этил-2,3-дигидро-8,9-дигидрокси-15-[(4-метил 1-пиперазинил)метил]-(9R-цис) (40 мг; 0,077 ммоля) в диметилсульфоксиде (2 мл). После 13 перемешивания при температуре -78 С в течение 15 мин смесь обрабатывают триэтиламином(0,85 мл; 6,2 ммоля), добавляя его по каплям. Убирают охлаждение и перемешивание продолжают в течение 10 мин. После остановки реакции добавлением 10 мл воды производят разделение слоев, и водный слой трижды экстрагируют хлороформом. Объединенные органические слои промывают насыщенным водным раствором хлорида натрия, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток коричневого цвета хроматографируют на силикагеле. Элюирование 10%-ным метанолом в хлороформе позволяет получить 26 мг (65%ный выход) 11 Н-1,4-диоксино[2,3-g]пирано[3',4':6,7]индолизино[1,2-b]хинолин-9,12(8 Н,14 Н)-дион,8-этил-2,3-дигидро-8-гидрокси-15[(4-метил-1-пиперазинил)метил]-(S) в виде твердого вещества желтого цвета. Характеристики: 1H ЯМР (300 МГц, CDCl3):1,06 (t, J=7,4 Гц, 3 Н), 1,91 (m, 2H), 2,31 (s, 3 Н), 2,59 (br. s,4H), 3,80 (br. s, 1H), 3,97 (s, 2H), 4,46 (s, 4H),5,32 (s, 2H), 5,55 (ABq, JAB=8,4 Гц, = 90 Гц,2H), 7,60 (s, 1 Н), 7,66 (s, 1H), 7,72 (s, 1H). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы(I), при котором дигидроксилируют соединение формулы (II), гдеR1 и R2, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С 1-8)алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-(С 1-8)алкила, (С 2-8)алкенила, гидрокси(С 1-8)алкила либо (С 1-8)алкокси (C1-8)алкила, или(-CH2NR7R8), где 1) R7 и R8, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С 1-8)алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-(С 1-8)алкила, (С 2-8)алкенила, гидрокси-(С 1-8)алкила либо (С 1-8)алкокси-(С 1-8)алкила; или 2) R7 представляет собой водород, (С 1-8) алкил, (С 3-7)циклоалкил, (С 3-7)циклоалкил-(С 1-8) алкил, (С 2-8)алкенил, гидрокси-(С 1-8)алкил либоR9 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, (С 3-7)циклоалкил, (С 3-7) циклоалкил-(С 1-8)алкил, (С 2-8)алкенил, гидрокси-(С 1-8)-алкил, (С 1-8)алкокси, (С 1-8)алкокси(С 1-8)алкил; или 3) R7 представляет собой водород или(С 1-8)алкил, a R8 представляет собой дифенилметил или -(CH2)tAr, где t равно числу от 0 до 5, 001400 14 а Аr представляет собой фенил, фурил, пиридил,N-метилпирролил, имидазолил, возможно замещенный одним или более чем одним заместителем, выбранным из гидрокси, метила, галогена и амино; или 4) R7 и R8, взятые вместе со связанным с ними азотом, образуют насыщенную 3-7 атомную гетероциклическую группу формулыR10 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, арил; арил, замещенный одним или более чем одним заместителем,выбранными из групп: (С 1-8)алкил, (С 1-8) алкокси, галоген, нитро, амино, (С 1-8)алкиламино,пергало-(С 1-8)алкил, гидрокси-(С 1-8)алкил, (C1-8) алкокси-(C1-8)-алкил, или -COR11, гдеR11 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, (С 1-8)алкокси, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С 1-8)алкил,пергало-(С 1-8)алкил, гидрокси-(С 1-8)алкил, (С 1-8) алкокси-(С 1-8)алкил; R3 и R4 независимо выбраны из водорода, (С 1-8)алкила, (С 3-7)циклоалкила,(С 3-7)циклоалкил-(С 1-8)алкила,(С 2-8)алкенила,гидрокси-(С 1-8)алкила либо (C1-8)алкокси(C1-8 ) алкила; илиR3 и R4, взятые вместе, образуют насыщенную 5-6-атомную гетероциклическую группу формулы (IВ) где n представляет собой целое число 1 или 2; или R3 представляет собой -OCONR12R13, гдеR12 и R13, которые могут быть одинаковыми или различными, независимо выбраны из водорода, замещенной либо незамещенной алкильной группы с 1-4 атомами углерода или замещенной либо незамещенной карбоциклической или гетероциклической группы при условии, что, когда оба R12 и R13 являются замещенными либо незамещенными алкильными группами, они могут быть объединены вместе с атомом азота, с которым они связаны, с образованием гетероциклического кольца, прерываемого-О-, -S- и/или N-R14, где R14 представляет собой водород, замещенную либо незамещенную алкильную группу с 1-4 атомами углерода или замещенную либо незамещенную фенильную группу, иR5 представляет собой водород или (С 1-8) алкил, иR6 представляет собой водород или (С 1-8) алкил, и 15 его фармацевтически приемлемые соли. 2. Соединение формулы (II) где R1 и R2, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С 1-8)алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-(С 1-8)алкила, (С 2-8)алкенила, гидрокси(С 1-8)алкила либо алкоксиалкила, или(-CH2NR7R8), где 1) R7 и R8, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С 1-8)алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-(С 1-8)алкила, (С 2-8)алкенила, гидрокси-(С 1-8)алкила либо (С 1-8)алкокси-(С 1-8)алкила; или 2) R7 представляет собой водород, (С 1-8) алкил, (С 3-7)циклоалкил, (С 3-7)циклоалкил-(С 1-8) алкил, (С 2-8)алкенил, гидрокси-(С 1-8)алкил либоR9 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, (С 3-7)циклоалкил, (С 3-7) циклоалкил-(С 1-8)алкил, (С 2-8)алкенил, гидрокси-(С 1-8)алкил, (С 1-8)алкокси, (С 1-8)алкокси(С 1-8)алкил; или 3) R7 представляет собой водород или(С 1-8)алкил, a R8 представляет собой дифенилметил или -(CH2)tAr, где t равно числу от 0 до 5,а Аr представляет собой фенил, фурил, пиридил,N-метилпирролил, имидазолил, возможно замещенный одним или более чем одним заместителем, выбранным из гидрокси, метила, галогена и амино; или 4) R7 и R8, взятые вместе со связанным с ними азотом, образуют насыщенную 3-7 атомную гетероциклическую группу формулыR10 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, арил; арил, замещенный одним или более чем одним заместителем,выбранным из групп: (С 1-8)алкил, (С 1-8)алкокси,галогена, нитро, амино, (С 1-8)алкиламино, пергало-(С 1-8)алкил, гидрокси-(С 1-8)алкил, (С 1-8) алкокси-(С 1-8)алкила, или -COR11, гдеR11 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, (С 1-8)алкокси, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С 1-8)алкил, 001400R3 и R4 независимо выбраны из водорода,(С 1-8)алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-(С 1-8)алкила, (С 2-8)алкенила, гидрокси-(С 1-8) алкила либо алкоксиалкила; или R3 и R4, взятые вместе, образуют насыщенную 5-6-атомную гетероциклическую группу формулы (IВ) где n представляет собой целое число 1 или 2; илиR12 и R13, которые могут быть одинаковыми или различными, независимо выбраны из водорода, замещенной либо незамещенной алкильной группы с 1-4 атомами углерода или замещенной либо незамещенной карбоциклической или гетероциклической группы при условии, что, когда и R12, и R13 являются замещенными либо незамещенными алкильными группами, они могут быть объединены вместе с атомом азота, с которым они связаны, с образованием гетероциклического кольца, прерываемого-О-, -S- и/или N-R14, где R14 представляет собой водород, замещенную либо незамещенную алкильную группу с 1-4 атомами углерода или замещенную или незамещенную фенильную группу, иR5 представляет собой водород или (С 1-8) алкил, иR6 представляет собой водород или (С 1-8) алкил, и его фармацевтически приемлемые соли. 3. Соединение по п.2, где это соединение представляет собой 11 Н-1,4-диоксино[2,3-g] пирано[3'4':6,7]индолизино[1,2-b]хинолин-12 где R1 и R2, которые могут быть одинаковыми или различными, независимо выбраны из (С 1-8) алкила, (С 3-7)циклоалкила, (С 3-7)циклоалкил(С 1-8)алкила, (С 2-8)алкенила, гидрокси-(С 1-8)алкила либо(C1-8)алкокси (C1-8)алкила, или(-CH2NR7R8), где 1) R7 и R8, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С 1-8)алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-(С 1-8)алкила, (С 2-8)алкенила, гидро 17 кси-(С 1-8)алкила либо (С 1-8)алкокси-(С 1-8)алкила; или 2) R7 представляет собой водород, (С 1-8) алкил, (С 3-7)циклоалкил, (С 3-7)циклоалкил-(С 1-8) алкил, (С 2-8)алкенил, гидрокси-(С 1-8)алкил либоR9 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, (С 3-7)циклоалкил,(С 3-7) циклоалкил-(С 1-8)алкил, (С 2-8)алкенил,гидрокси-(С 1-8)алкил, (С 1-8)алкокси, (С 1-8) алкокси-(С 1-8)алкил; или 3) R7 представляет собой водород или(С 1-8)алкил, a R8 представляет собой дифенилметил или -(CH2)tAr, где t равно числу от 0 до 5,а Аr представляет собой фенил, фурил, пиридил, N-метилпирролил, имидазолил, возможно замещенный одним или более чем одним заместителем, выбранным из гидрокси, метила,галогена и амино; или 4) R7 и R8, взятые вместе со связанным с ними азотом, образуют насыщенную 3-7 атомную гетероциклическую группу формулыR10 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, арил; арил, замещенный одним или более чем одним заместителем,выбранным из групп: (С 1-8)алкил, (С 1-8)алкокси,галогена, нитро, амино, (С 1-8)алкиламино, пергало-(С 1-8)алкил, гидрокси-(С 1-8)алкил, (С 1-8) алкокси-(С 1-8)алкила, или -COR11, гдеR11 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, (С 1-8)алкокси, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С 1-8)алкил,пергало-(С 1-8)алкил, гидрокси-(С 1-8)алкил, (С 1-8) алкокси-(С 1-8)алкил,a R2 может также быть водородом;R3 и R4 независимо выбраны из водорода,(С 1-8)алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-(С 1-8)алкила, (С 2-8)алкенила, гидрокси-(С 1-8) алкила либо алкоксиалкила; илиR3 и R4, взятые вместе, образуют насыщенную 5-6-атомную гетероциклическую группу формулы (IB) где n представляет собой целое число 1 или 2; илиR12 и R13, которые могут быть одинаковыми или различными, независимо выбраны из 18 водорода, замещенной либо незамещенной алкильной группы с 1-4 атомами углерода или замещенной либо незамещенной карбоциклической или гетероциклической группы при условии, что, когда и R12, и R13 являются замещенными либо незамещенными алкильными группами, они могут быть объединены вместе с атомом азота, с которым они связаны, с образованием гетероциклического кольца, прерываемого-О-, -S- и/или N-R14, где R14 представляет собой водород, замещенную либо незамещенную алкильную группу с 1-4 атомами углерода или замещенную или незамещенную фенильную группу, иR5 представляет собой водород или (С 1-8) алкил, иR6 представляет собой водород или (С 1-8) алкил, и его фармацевтически приемлемые соли. 5. Соединение по п.4, где это соединение представляет собой 11 Н-1,4-диоксино[2,3-g] пирано[3',4':6,7]индолизино[1,2-b]хинолин-12 где R1 и R2, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С 1-8)алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-(С 1-8) алкила, (С 2-8)алкенила, гидрокси(С 1-8)алкила либо (C1-8)алкокси (C1-8)алкила, или(-CH2NR7R8), где 1) R7 и R8, которые могут быть одинаковыми или различными, независимо выбраны из водорода, (С 1-8)алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-(С 1-8)алкила, (С 2-8)алкенила, гидрокси-(С 1-8)алкила либо (С 1-8)алкокси-(С 1-8)алкила; или 2) R7 представляет собой водород, (С 1-8) алкил, (С 3-7)циклоалкил, (С 3-7)циклоалкил-(С 1-8) алкил, (С 2-8)алкенил, гидрокси-(С 1-8)алкил либоR9 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, (С 3-7)циклоалкил, (С 3-7) циклоалкил-(С 1-8)алкил, (С 2-8)алкенил, гидрокси-(С 1-8)алкил, (С 1-8)алкокси, (С 1-8)алкокси(С 1-8)алкил; или 3) R7 представляет собой водород или(С 1-8)алкил, a R8 представляет собой дифенилметил или -(CH2)tAr, где t равно числу от 0 до 5, а Аr представляет собой фенил, фурил, пиридил, N-метилпирролил, имидазолил, возможно замещенный одним или более чем одним заместителем, выбранным из гидрокси, метила,галогена и амино; или 4) R7 и R8, взятые вместе со связанным с ними азотом, образуют насыщенную 3-7 атомную гетероциклическую группу формулыR10 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, арил; арил, замещенный одним или более чем одним заместителем,выбранным из групп: (С 1-8)алкил, (С 1-8)алкокси,галогена, нитро, амино, (С 1-8)алкиламино, пергало-(С 1-8)алкил, гидрокси-(С 1-8)алкил, (С 1-8) алкокси-(С 1-8)алкила, или -COR11, гдеR11 представляет собой водород, (С 1-8) алкил, пергало-(С 1-8)алкил, (С 1-8)алкокси, арил; арил, замещенный одним или более чем одним заместителем, выбранным из групп: (С 1-8)алкил,пергало-(С 1-8)алкил, гидрокси-(С 1-8)алкил, (С 1-8) алкокси-(С 1-8)алкил;R3 и R4 независимо выбраны из водорода,(С 1-8)алкила, (С 3-7)циклоалкила, (С 3-7) циклоалкил-(С 1-8)алкила, (С 2-8)алкенила, гидрокси-(С 1-8) алкила либо алкоксиалкила; илиR3 и R4, взятые вместе, образуют насыщенную 5-6-атомную гетероциклическую группу формулы (IB) где n представляет собой целое число 1 или 2; или R3 представляет собой -OCONR12R13, гдеR12 и R13, которые могут быть одинаковыми или различными, независимо выбраны из водорода, 20 замещенной либо незамещенной алкильной группы с 1-4 атомами углерода или замещенной либо незамещенной карбоциклической или гетероциклической группы при условии, что, когда и R12, и R13 являются замещенными либо незамещенными алкильными группами, они могут быть объединены вместе с атомом азота, с которым они связаны, с образованием гетероциклического кольца, прерываемого -О-, -Sи/или N-R14, где R14 представляет собой водород, замещенную либо незамещенную алкильную группу с 1-4 атомами углерода или замещенную или незамещенную фенильную группу,иR5 представляет собой водород или (С 1-8) алкил, иR6 представляет собой водород или (С 1-8) алкил, и его фармацевтически приемлемые соли. 7. Соединение по п.6, где это соединение представляет собой 4-этил-7-[7-иод-9-[(4-метилпиперазинил)метил]-2,3-дигидро-[1,4]диоксино где R5 представляет собой водород или (С 1-8) алкил, R6 представляет собой водород или (С 1-8) алкил, и его фармацевтически приемлемые соли. 9. Соединение по п.8, где это соединение представляет собой 4-этил-1 Н-пирано[3,4-с] пиридин-8-он.
МПК / Метки
МПК: C07D 491/22
Метки: получения, камптотецина, производных, способ
Код ссылки
<a href="https://eas.patents.su/11-1400-sposob-polucheniya-proizvodnyh-kamptotecina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных камптотецина.</a>
Предыдущий патент: Ингибиторы пролилэндопептидазы.
Следующий патент: Лактоновые производные 17.бета.-карбокси, карботио и амид андростанов
Случайный патент: Мощный трансформатор или катушка индуктивности












