Способ синтеза периндоприла и его фармацевтически приемлемых солей
Формула / Реферат
1. Способ синтеза соединения формулы (I)
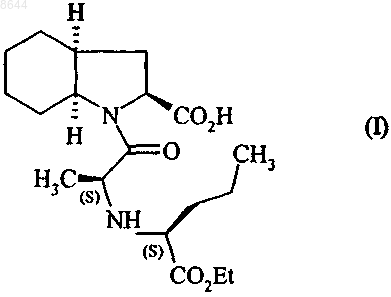
и его фармацевтически приемлемых солей,
который характеризуется тем, что соединение формулы (II)
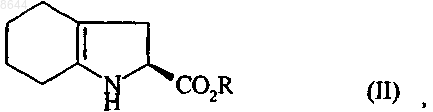
в которой R представляет собой атом водорода или бензил, или линейную, или разветвленную C1-С6-алкильную группу, подвергают реакции с соединением формулы (III), имеющим (R)-конфигурацию
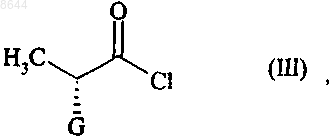
в которой G представляет собой атом хлора, брома или йода или гидрокси, n-толуолсульфонилокси, метансульфонилокси- или трифторметансульфонилоксигруппу,
в присутствии основания, получая соединение формулы (IV)
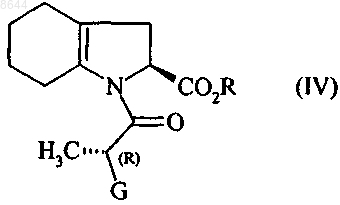
в которой R и G имеют значения, указанные выше,
которое подвергают реакции с соединением формулы (V), имеющим (S)-конфигурацию
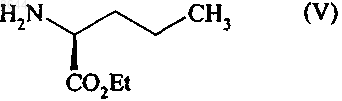
получая соединение формулы (VI)

в которой R имеет значения, указанные выше,
которое гидрируют в присутствии катализатора, получая, при необходимости, после снятия защиты соединение формулы (I).
2. Способ синтеза в соответствии с п.1, в котором основание, используемое для взаимодействия между соединениями формул (II) и (III), представляет собой органический амин, выбранный из триэтиламина, пиридина и диизопропилэтиламина, или неорганическое основание, выбранное из NaOH, KОН, Na2CO3, K2СО3, NaHCO3 и KНСО3.
3. Способ синтеза в соответствии с п.1, в котором G представляет собой атом хлора или брома или n-толуолсульфонилокси-, метансульфонилокси- или трифторметансульфонилоксигруппу.
4. Способ синтеза в соответствии с п.3, в котором взаимодействие между соединениями формул (IV) и (V) осуществляют в присутствии органического амина, выбранного из триэтиламина, пиридина и диизопропилэтиламина, или неорганического основания, выбранного из Nа2СО3, K2СО3, NаНСО3 и KНСО3.
5. Способ синтеза в соответствии с п.1, в котором G представляет собой гидроксигруппу.
6. Способ синтеза в соответствии с п.5, в котором взаимодействие между соединениями формул (IV) и (V) осуществляют в присутствии активирующего реагента, выбранного из йодида N-метил-N-фениламинотрифенилфосфония, и триамида гексаметилфосфора вместе с перхлоратом аммония, или, если R не представляет собой атом водорода, при помощи реакции Митцунобу.
7. Способ синтеза в соответствии с п.1, в котором катализатор выбирают из палладия, платины, родия и никеля.
8. Соединение формулы (IV)
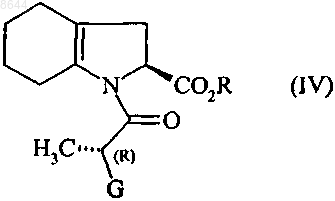
в которой R представляет собой атом водорода, или бензил, или линейную, или разветвленную C1-С6-алкильную группу и G представляет собой атом хлора, или брома, или гидрокси, n-толуолсульфонилокси-, метансульфонилокси- или трифторметансульфонилоксигруппу.
9. Способ в соответствии с любым из пп.1-7 для синтеза периндоприла в виде его трет-бутиламиновой соли.
Текст
008644 Настоящее изобретение относится к способу синтеза периндоприла формулы (I) и его фармацевтически приемлемых солей. Периндоприл и его фармацевтически приемлемые соли, в особенности его трет-бутиламиновая соль, обладают ценными фармакологическими свойствами. Их главное свойство состоит в ингибировании фермента, превращающего ангиотензин I (или кининазы II), что, с одной стороны, позволяет предотвратить превращение декапептида ангиотензина I в октапептид ангиотензин II (сосудосуживающий фактор) а, с другой стороны, предотвратить расщепление брадикинина (сосудорасширяющий фактор) до неактивного пептида. Эти два действия обуславливают положительное влияние периндоприла на сердечно-сосудистые заболевания, в особенности на артериальную гипертонию и сердечную недостаточность. Периндоприл, его получение и его применение для лечения описано в заявке на Европейский патент ЕР 0049658. Принимая во внимание фармацевтическую ценность этого соединения, важной является возможность его получения при помощи эффективного способа синтеза, который легко можно осуществить в промышленном масштабе, что приводит к получению периндоприла с хорошим выходом и с отличной чистотой при использовании исходных веществ с приемлемой стоимостью. В патентной заявке ЕР 0308341 описан синтез периндоприла путем сочетания бензилового эфира (2S,3 аS,7 аS)-октагидроиндол 2-карбоновой кислоты с этиловым эфиром N-[(S)-1-карбоксибутил]-(S)-аланина с последующим снятием защиты с карбоксильной группы гетероцикла посредством каталитической гидрогенизации. Сложный эфир (2S,3 аS,7 аS)-октагидроиндол-2-карбоновой кислоты не является коммерчески доступным продуктом и для его получения необходимо осуществление несколько стадий синтеза (включая стадию разделения), исходя из индол-2-карбоновой кислоты. Сейчас заявителем был открыт новый способ синтеза периндоприла, в котором используются легко доступные исходные вещества. Более конкретно, настоящее изобретение относится к способу синтеза периндоприла и его фармацевтически приемлемых солей, который характеризуется тем, что соединение формулы (II) в которой R представляет собой атом водорода или бензил или линейную или разветвленную C1-С 6 алкильную группу, подвергают реакции с соединением формулы (III), имеющим (R)-конфигурацию в которой G представляет собой атом хлора, брома или йода или толуолсульфонилокси-, метансульфонилокси- или трифторметансульфонилоксигруппу,в присутствии основания, получая соединение формулы (IV) получая соединение формулы (VI) в которой R имеет значения, указанные выше,которое гидрируют в присутствии катализатора, такого как палладий, платина, родий или никель,получая, при необходимости, после снятия защиты соединение формулы (I). Для взаимодействия между соединениями формул (II) и (III) могут применяться следующие основания, но не ограничиваясь только ими, в частности, органические амины, такие как триэтиламин, пиридин и диизопропилэтиламин, а также неорганические основания, такие как NaOH, КОН, Na2CO3, K2 СО 3,NаНСО 3 и KНСО 3. Если G представляет собой атом хлора, брома или йода, или n-толуолсульфонилокси, метансульфонилокси или трифторметансульфонилоксигруппу, то взаимодействие между соединениями формул (IV) и (V) предпочтительно осуществлять в присутствии основания, предпочтительно органического амина,такого как триэтиламин, пиридин или диизопропилэтиламин, или неорганического основания, такого какNa2CO3, K2 СО 3, NaHCO3 или KНСО 3. Если G представляет собой гидроксигруппу, то взаимодействие между соединениями формул (IV) и(V) предпочтительно осуществлять в присутствии активирующего реагента, такого как йодид N-метилN-фениламинотрифенилфосфония, или триамид гексаметилфосфора вместе с перхлоратом аммония, или,если R не представляет собой атом водорода, при помощи реакции Митцунобу. Соединения формулы (IV) являются новыми продуктами, которые пригодны в химической или фармацевтической промышленности в качестве промежуточных продуктов для синтеза, в особенности для синтеза периндоприла, и поэтому составляют неотъемлемую часть настоящего изобретения. Пример 1. трет-Бутиламиновая соль (2S,3aS,7aS)-1-(2S)-2-1(1S)-l-(этоксикарбонил)бутиламино]пропионилоктагидро-1H-индол-2-карбоновой кислоты Стадия А: Бензил (2S)-1-[(2R)-2-бpoмпропионил]-2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоксилат В реактор вносили 200 г бензил (2S)-2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоксилата и 1,5 л дихлорметана, после этого температуру реакционной смеси доводили до 0 С и добавляли 201 мл диизопропилэтиламина, затем 132 г (2R)-2-бромпропионилхлорида. После этого температуру реакционной смеси доводили до температуры окружающей среды. После перемешивания в течение 1 ч при этой температуре смесь промывали водой и затем разведенным раствором уксусной кислоты. Полученный таким образом раствор бензил (2S)-1-[(2R)-2-бромпропионил]-2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоксилата использовали на следующей стадии без дополнительной обработки. Стадия Б: Бензил (2S)-l-(2S)-2-[(1S)-l-(этоксикарбонил)бутиламино]пропионил-2,3,4,5,6,7 гексагидро-1 Н-индол-2-карбоксилат В реактор вносили 123 г этил (2S)-2-аминопентаноата, 160 мл триэтиламина и 160 мл ацетонитрила и после этого температуру смеси доводили до 60 С, медленно добавляли раствор, полученный на стадии А, и нагревали в колбе с обратным холодильником в течение 4 ч. После возвращения температуры до температуры окружающей среды смесь промывали водой и разведенным раствором уксусной кислоты и затем растворители выпаривали,получая бензил(2S)-1-(2S)-2-[(1S)-1-(этоксикарбонил)бутиламино]пропионил-2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоксилат. Стадия В: (2S,3aS,7aS)-1-(2S)-2-[(1S)-1-(Этоксикарбонил)бутиламино]пропионилоктагидро-1Hиндол-2-карбоновая кислота В сосуд для гидрирования вносили 200 г соединения, полученного на вышеописанной стадии, в растворе в уксусной кислоте и затем 5 г 10 % Pt/C. Гидрировали под давлением 5 бар при температуре от 15 до 30 С до абсорбирования теоретического количества водорода. Катализатор удаляли путем фильтрации, затем охлаждали до температуры от 0 до 5 С и полученное твердое вещество восстанавливали путем фильтрации. Осадок промывали и высушивали до постоянного веса. Таким образом получали(2S,3aS,7aS)-1-(2S)-2-[(1S)-l-(этоксикарбонил)бутиламино]пропионилоктагидро-1H-индол-2-карбоновую кислоту с выходом 85% и энантиомерной чистотой 98%. Стадия Г: трет-Бутиламиновая соль (2S,3aS,7aS)-1-(2S)-2-[(1S)-l-(этоксикарбонил)бутиламино]пропионилоктагидро-1H-индол-2-карбоновой кислоты Осадок, полученный на вышеописанной стадии (200 г), растворяли в 2,8 л ацетонитрила и затем добавляли 40 г трет-бутиламина и 0,4 л этилацетата. После этого полученную суспензию нагревали в колбе с обратным холодильником до полного растворения, затем полученный раствор в нагретом состоянии фильтровали и охлаждали при перемешивании до температуры от 15 до 20 С.-2 008644 Затем полученный осадок отфильтровывали, снова превращали в пасту с ацетонитрилом, высушивали и после этого перекристаллизовывали из этилацетата, получая ожидаемый продукт с выходом 95% и энантиомерной чистотой 99%. Пример 2: трет-Бутиламиновая соль (2S,3aS,7aS)-l-(2S)-2-[(1S)-1-(этоксикарбонил)бутиламино]пропионилоктагидро-1H-индол-2-карбоновой кислоты Стадия А: (2S)-1-[(2R)-2-Бромпропионил]-2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоновая кислота В реактор вносили 200 г (2S)-2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоновой кислоты, 75 мл воды и 150 мл толуола, и после этого температуру смеси доводили до температуры от 0 до 5 С и добавляли 250 мл 5 М раствор гидроксида натрия, затем раствор 202 г (2R)-2-бромпропионилхлорида в толуоле, при этом температуру поддерживали ниже 10 С, а значение рН смеси поддерживали равным 10 путем добавления 5 М раствора гидроксида натрия. После дополнительного перемешивания в течение 1 ч при 10 С добавляли концентрированную соляную кислоту для доведения рН смеси до 6. Толуольную фазу отделяли и затем в водную фазу добавляли концентрированную соляную кислоту для доведения рН до 2. После этого образованный осадок отфильтровывали и высушивали, получая (2S)-1-[(2R)-2-бромпропионил]2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоновую кислоту. Стадия Б: (2S)-1-(2S)-2-[(1S)-1-(Этоксикарбонил)бутиламино]пропионил-2,3,4,5,6,7-гексагидро 1H-индол-2-карбоновая кислота В реактор вносили 105 г этил (2S)-2-аминопентаноата, 135 мл триэтиламина и 135 мл ацетонитрила,и после этого температуру смеси доводили до 60 С, медленно добавляли раствор 200 г соединения, полученного на стадии А, в 1,3 л дихлорметана, и затем нагревали в колбе с обратным холодильником в течение 4 ч. После возвращения температуры до температуры окружающей среды смесь промывали водой и разведенным раствором уксусной кислоты, и затем растворители выпаривали, получая (2S)-l-(2S)2-[(1S)-1-(этоксикарбонил)бутиламино]пропионил-2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоновую кислоту. Стадии В и Г: аналогично стадиям В и Г примера 1. Пример 3: трет-Бутиламиновая соль (2S,3aS,7aS)-1-(2S)-2-[(1S)-1-(этоксикарбонил)бутиламино]пропионилоктагидро-1H-индол-2-карбоновой кислоты Стадия А: Бензил (2S)-1-[(2R)-2-n-толуолсульфонилоксипропионил]-2,3,4,5,6,7-гексагидро-1 Ниндол-2-карбоксилат В реактор вносили 200 г бензил (2S)-2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоксилата и 1,5 л дихлорметана, после этого температуру реакционной смеси доводили до 0 С и добавляли 201 мл диизопропилэтиламина, затем 202 г (1R)-2-хлор-1-метил-2-оксоэтил n-толуолсульфоната. После этого температуру реакционной смеси доводили до температуры окружающей среды. После перемешивания в течение 1 ч при этой температуре смесь промывали водой. Таким образом полученный раствор бензил (2S)-l-[(2R)2-n-толуолсульфонилоксипропионил]-2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоксилата использовали на следующей стадии без дополнительной обработки. Стадии Б-Г: аналогично стадиям Б-Г примера 1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ синтеза соединения формулы (I) и его фармацевтически приемлемых солей,который характеризуется тем, что соединение формулы (II) в которой R представляет собой атом водорода или бензил, или линейную, или разветвленную C1 С 6-алкильную группу, подвергают реакции с соединением формулы (III), имеющим (R)-конфигурацию-3 008644 в которой G представляет собой атом хлора, брома или йода или гидрокси, n-толуолсульфонилокси,метансульфонилокси- или трифторметансульфонилоксигруппу,в присутствии основания, получая соединение формулы (IV) получая соединение формулы (VI) в которой R имеет значения, указанные выше,которое гидрируют в присутствии катализатора, получая, при необходимости, после снятия защиты соединение формулы (I). 2. Способ синтеза в соответствии с п.1, в котором основание, используемое для взаимодействия между соединениями формул (II) и (III), представляет собой органический амин, выбранный из триэтиламина, пиридина и диизопропилэтиламина, или неорганическое основание, выбранное из NaOH, KОН,Na2CO3, K2 СО 3, NaHCO3 и KНСО 3. 3. Способ синтеза в соответствии с п.1, в котором G представляет собой атом хлора или брома илиn-толуолсульфонилокси-, метансульфонилокси- или трифторметансульфонилоксигруппу. 4. Способ синтеза в соответствии с п.3, в котором взаимодействие между соединениями формулKНСО 3. 5. Способ синтеза в соответствии с п.1, в котором G представляет собой гидроксигруппу. 6. Способ синтеза в соответствии с п.5, в котором взаимодействие между соединениями формул(IV) и (V) осуществляют в присутствии активирующего реагента, выбранного из йодида N-метил-Nфениламинотрифенилфосфония, и триамида гексаметилфосфора вместе с перхлоратом аммония, или,если R не представляет собой атом водорода, при помощи реакции Митцунобу. 7. Способ синтеза в соответствии с п.1, в котором катализатор выбирают из палладия, платины, родия и никеля. 8. Соединение формулы (IV) в которой R представляет собой атом водорода, или бензил, или линейную, или разветвленную C1 С 6-алкильную группу и G представляет собой атом хлора, или брома, или гидрокси, nтолуолсульфонилокси-, метансульфонилокси- или трифторметансульфонилоксигруппу. 9. Способ в соответствии с любым из пп.1-7 для синтеза периндоприла в виде его третбутиламиновой соли.
МПК / Метки
МПК: C07D 209/42, C07K 5/06
Метки: приемлемых, синтеза, способ, периндоприла, фармацевтически, солей
Код ссылки
<a href="https://eas.patents.su/5-8644-sposob-sinteza-perindoprila-i-ego-farmacevticheski-priemlemyh-solejj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза периндоприла и его фармацевтически приемлемых солей</a>
Предыдущий патент: Устройство и способ для гравийной набивки ствола скважины
Следующий патент: Способ получения иммуномодулятора
Случайный патент: Штамм blakeslea trispora и способ его применения









