Способ синтеза периндоприла и его фармацевтически приемлемых солей
Формула / Реферат
1. Способ получения периндоприла формулы (I)

а также его фармацевтически приемлемых солей, включающий взаимодействие сложного бензилового эфира формулы (IV)
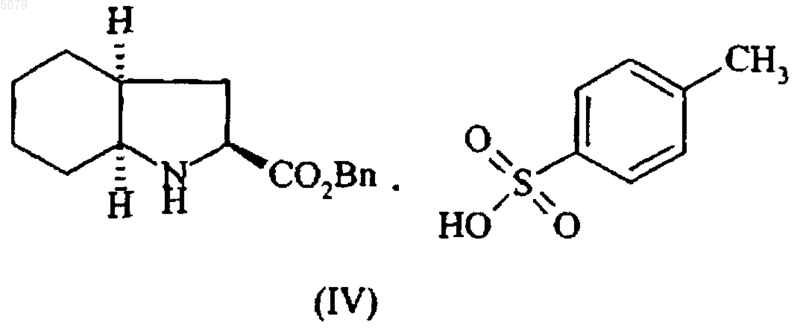
в которой Bn представляет собой бензильную группу, с соединением формулы (V)
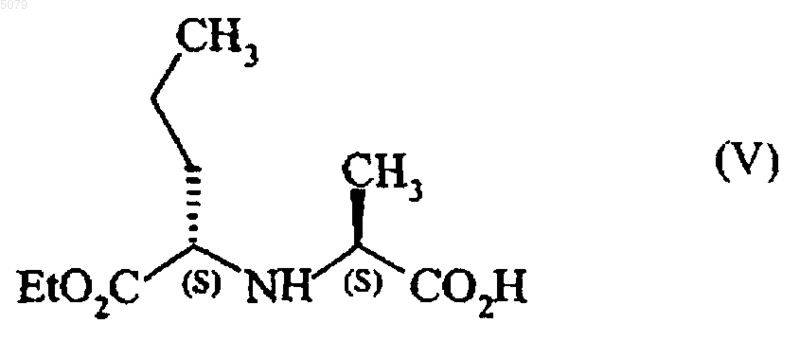
в этилацетате в присутствии 1-гидроксибензотриазола и дициклогексилкарбодиимида с последующим выделением полученного соединения формулы (VI)
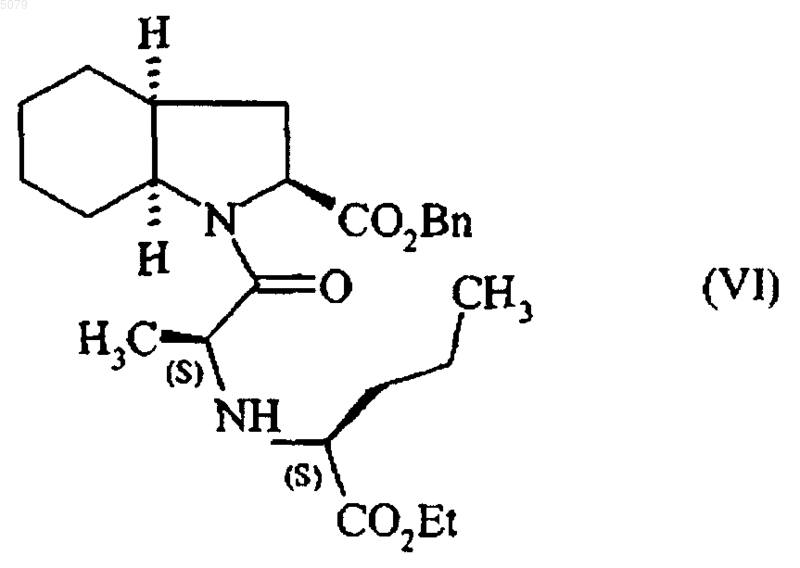
в которой Bn представляет собой бензильную группу, и удалением группы, защищающей карбоксильную группу гетероцикла в полученном соединении формулы (VI), путем каталитической гидрогенизации с получением периндоприла формулы (I), который при желании переводят в фармацевтически приемлемую соль, отличающийся тем, что 1-гидроксибензотриазол используют в количестве от 0,4 до 0,6 моль на моль применяемого соединения формулы (IV), дициклогексилкарбодиимид используют в количестве от 1 до 1,2 моль на моль применяемого соединения формулы (IV) и взаимодействие соединений формулы (IV) и формулы (V) проводят в отсутствии триэтиламина или в присутствии триэтиламина в количестве, которое меньше или равно 1 моль на моль применяемого соединения формулы (IV), при температуре от 20 до 77шC.
2. Способ по п.1, отличающийся тем, что периндоприл получают в виде его трет-бутиламиновой соли.
3. Способ по п.1, отличающийся тем, что взаимодействие соединений формулы (IV) и формулы (V) проводят в отсутствии триэтиламина.
4. Способ по п.1, отличающийся тем, что взаимодействие соединений формулы (IV) и формулы (V) проводят в присутствии триэтиламина в количестве, которое меньше или равно 1 моль на моль применяемого соединения формулы (IV).
5. Способ синтеза по п.4, отличающийся тем, что количество триэтиламина меньше или равно 0,25 моль на моль применяемого соединения формулы (IV).
6. Способ по любому из пп.1-5, отличающийся тем, что уровень загрязнения полученного соединения формулы (VI) соединениями формул (VII) и (VIII)
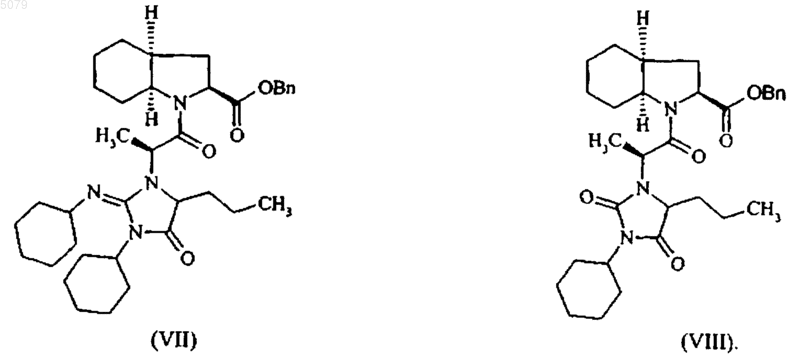
меньше чем 1,5 %.
7. Способ по любому из пп.1-6, отличающийся тем, что уровень загрязнения полученного периндоприла соединениями формул (II) и (III)
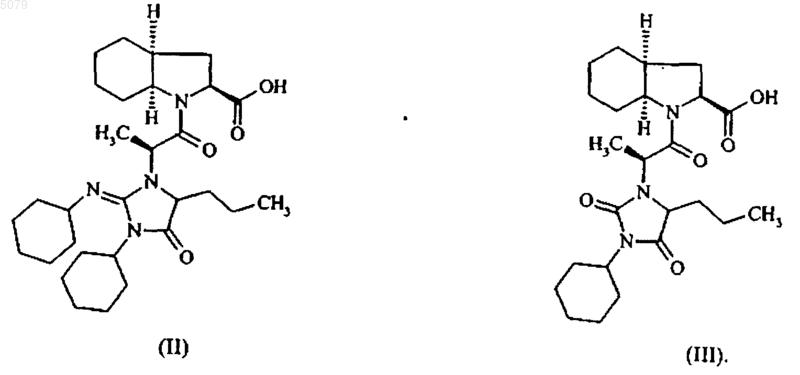
меньше чем 0,2 и 0,1% соответственно.
Текст
Настоящее изобретение относится к способу промышленного синтеза периндоприла формулы (I) и его фармацевтически приемлемых солей. Периндоприл, а также его фармацевтически приемлемые соли и, более конкретно, его трет-бутиламиновая соль имеют ценные фармакологические свойства. Их основное свойство состоит в ингибировании энзима, который переводит ангиотензин I (или киназу II), что дает возможность, с одной стороны, предотвращать перевод декапептида ангиотензина I в октапептид ангиотензин II (сосудосужающее), и с другой стороны, предотвращать разложение брадикинина (сосудорасширяющего средства) до неактивного пептида. Эти два действия вносят вклад в благоприятные эффекты периндоприла при сердечно-сосудистых заболеваниях, особенно, при артериальной гипертензии и сердечной недостаточности. Периндоприл, его получение и терапевтическое применение были описаны в Европейском патенте ЕР 0 049 658. При фармацевтической заинтересованности в этом соединении является важным иметь возможность получать его при помощи эффективного промышленного способа синтеза, который легко может применяться в промышленном масштабе, давая хороший выход периндоприла и, в особенности, с отличной степенью чистоты. Патент ЕР 0 308 341 описывает промышленный синтез периндоприла при помощи связывания бензилового эфира (2S,3 аS,7 аS)октагидроиндол-2-карбоновой кислоты с этиловым эфиромN-[(S)-1-карбоксибутил]-(S)аланина, после чего следует депротекция карбоксильной группы гетероцикла при помощи каталитической дегидрогенации. У этого способа имеется преимущество в том, что он дает хороший выход периндоприла по отношению к исходным материалам, для которых промышленный синтез уже был описан. Тем не менее, чистота периндоприла, получаемого этим способом, не является удовлетворительной, и это делает необходимой стадию очистки для того, чтобы получить периндоприл с качеством, которое позволило бы его применение в качестве фармацевтически активного ингредиента. Действительно, при условиях, описанных в этом патенте, получаемый периндоприл загрязнен существенными количествами загрязнений формул (II) и (III) Заявитель здесь разработал новый способ промышленного синтеза, который дает периндоприл со степенью чистоты, которая сопоставима с его применением в качестве фармацевтически активного ингредиента, уровни загрязнений формул (II) и (III) составляют менее 0,2 и 0,1 %, соответственно. Более конкретно, настоящее изобретение относится к способу промышленного синтеза периндоприла, который отличается тем, что сложный бензиловый эфир формулы (IV) в которой Вn представляет собой бензильную группу, подвергают реакции с соединением формулы (V) в этилацетате, в присутствии 1-гидроксибензотриазола в количестве от 0,4 до 0,6 моль на моль применяемого соединения формулы (IV) и в присутствии дициклогексилкарбодиимида в количестве от 1 до 1,2 моль на моль применяемого соединения формулы (IV), в отсутствии триэтиламина или в присутствии количества триэтиламина менее или равного 1 моль на моль применяемого соединения формулы (IV), предпочтительно менее или равного 0,25 моль на моль применяемого соединения формулы (IV),при температуре от 20 до 77 С, с получением после выделения соединения формулы (VI) в которой Вn представляет собой бензильную группу, карбоксильную группу гетероцикла которой подвергают депротекции при помощи каталитической гидрогенации с получением периндоприла формулы (I), который переводят,при желании, в фармацевтически приемлемую соль, такую как соль трет-бутиламина. Способ представляет особенный интерес,исходя из таких причин. Связывание в щелочной среде сложного бензилового эфира формулы (IV) с соединением формулы (V) было описано в патенте ЕР 0 308 341, но при описанных условиях (приме 3 нение 3 моль соединения формулы (V), 3 молей триэтиламина, 3,8 моль 1-гидроксибензотриазола и 2,9 моль дициклогексилкарбодиимида на моль применяемого соединения формулы(IV образуются многочисленные вторичные продукты. В частности, полученное соединение формулы (VI) содержит в существенных количествах (от 5 до 15%) загрязнения формул (VII) и(VIII), которые, при проведении дебензилирования, дают загрязнения формул (II) и (III) Неожиданно заявитель обнаружил, что снижение или даже избежание триэтиламина на стадии связывания сделало возможным ограничить уровни загрязнений формул (VII) и (VIII) в соединении формулы (VI) до менее чем 1,5%. Каталитическая гидрогенация соединения формулы (VI), полученного таким образом, дает периндоприл намного большей чистоты и, в частности, с уровнями загрязнений формул (II) и (III) менее чем 0,2 и 0,1%, соответственно. Дополнительно, снижение на стадии связывания количества соединения формулы (V), lгидроксибензотриазола и дициклогексилкарбодиимида позволяет получать выход соединения формулы (VI), который является таким же большим, как и при больших количествах реактивов, что, таким образом, делает способ намного более выгодным в промышленном масштабе. Примеры, приведенные ниже, иллюстрируют изобретение, но не ограничивают его ни коим образом. Пример 1. Бензил(2S,3aS,7 аS)-1-(2S)-2[(1S)-1-(этоксикарбонил)бутиламино]пропионилоктагидро-1 Н-индол-2-карбоксилат. При перемешивании в реактор вводят 1 кг паратолуолсульфоната бензилового эфира(2S,3 аS,7 аS)-октагидроиндол-2-карбоновой кислоты, 0,06 кг триэтиламина, 4,6 л этилацетата и затем, после перемешивания на протяжении 10 мин при температуре окружающей среды, 0,52 кг N-[(S)-этоксикарбонил-1-бутил]-(S)-аланина,0,15 кг 1-гидроксибензотриазола и 0,5 кг дициклогексилкарбодиимида. Гетерогенную смесь затем доводят до 30 С на протяжении 3 ч при хорошем перемешивании, а после этого охлаждают до 0 С и фильтруют. Фильтрат затем промывают, после чего выпаривают досуха с получением ожидаемого продукта с выходом 92%. Пример 2. (2S,3aS,7 аS)-1-(2S)-2-[(1S)-1(Этоксикарбонил)бутиламино]пропионилоктагидро-1 Н-индол-2-карбоновая кислота. Остаток, полученный на предыдущей стадии (1 кг), растворяют в 1 л метилциклогексана 4 и раствор переносят в гидрогенатор; затем добавляют 0,13 кг 5% палладия-на-углероде, суспензированного в 0,4 л метилциклогексана, после чего следуют 3,2 л воды. Смесь затем гидрогенируют под давлением 0,5 бар при температуре от 15 до 30 С до абсорбции теоретического количества водорода. После удаления катализатора при помощи фильтрации водную фазу фильтрата промывают метилциклогексаном и затем лиофилизируют с получением ожидаемого продукта с выходом 94%. Пример 3. Трет-бутиламиновая соль (2S,3aS,7aS)-l-(2S)-2-[(1S)-1-(этоксикарбонил)бутиламино]пропионилоктагидро-1 Н-индол-2-карбоновой кислоты. Лиофилизат, полученный на предыдущей стадии (1 кг), растворяют в 14 л этилацетата; затем добавляют 0,2 кг трет-бутиламина и 2 л этилацетата. Полученную суспензию затем нагревают с обратным холодильником до достижения полного растворения и полученный раствор подвергают горячей фильтрации и охлаждают при перемешивании до температуры 1520 С. Полученный осадок затем отфильтровывают, доводят снова до консистенции пасты при помощи этилацетата, сушат, а затем перемалывают с получением ожидаемого продукта с выходом 95%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения периндоприла формулы (I) а также его фармацевтически приемлемых солей, включающий взаимодействие сложного бензилового эфира формулы (IV) в которой Вn представляет собой бензильную группу, с соединением формулы (V) в этилацетате в присутствии 1-гидроксибензотриазола и дициклогексилкарбодиимида с последующим выделением полученного соединения формулы (VI) в которой Вn представляет собой бензильную группу, и удалением группы, защищающей карбоксильную группу гетероцикла в полученном соединении формулы (VI), путем каталитической гидрогенизации с получением периндоприла формулы (I), который при желании переводят в фармацевтически приемлемую соль,отличающийся тем, что 1-гидроксибензотриазол используют в количестве от 0,4 до 0,6 моля на моль применяемого соединения формулы (IV),дициклогексилкарбодиимид используют в количестве от 1 до 1,2 моля на моль применяемого соединения формулы (IV) и взаимодействие соединений формулы (IV) и формулы (V) проводят в отсутствии триэтиламина или в присутствии триэтиламина в количестве, которое меньше или равно 1 молю на моль применяемого соединения формулы (IV), при температуре от 20 до 77 С. 2. Способ по п.1, отличающийся тем, что периндоприл получают в виде его третбутиламиновой соли. 3. Способ по п.1, отличающийся тем, что взаимодействие соединений формулы (IV) и формулы (V) проводят в отсутствии триэтиламина. 4. Способ по п.1, отличающийся тем, что взаимодействие соединений формулы (IV) и формулы (V) проводят в присутствии триэтила 6 мина в количестве, которое меньше или равно 1 молю на моль применяемого соединения формулы (IV). 5. Способ синтеза по п.4, отличающийся тем, что количество триэтиламина меньше или равно 0,25 моля на моль применяемого соединения формулы (IV). 6. Способ по любому из пп.1-5, отличающийся тем, что уровень загрязнения полученного соединения формулы (VI) соединениями формул (VII) и (VIII) меньше чем 1,5%. 7. Способ по любому из пп.1-6, отличающийся тем, что уровень загрязнения полученного периндоприла соединениями формул (II) и
МПК / Метки
МПК: C07D 209/42, C07K 1/02
Метки: приемлемых, периндоприла, способ, фармацевтически, солей, синтеза
Код ссылки
<a href="https://eas.patents.su/4-5079-sposob-sinteza-perindoprila-i-ego-farmacevticheski-priemlemyh-solejj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза периндоприла и его фармацевтически приемлемых солей</a>
Предыдущий патент: Способ получения олефинов
Следующий патент: Способ получения сферических агломератов телитромицина и их применение для приготовления лекарственных форм
Случайный патент: Устройство и способ для производства соединений металлов








