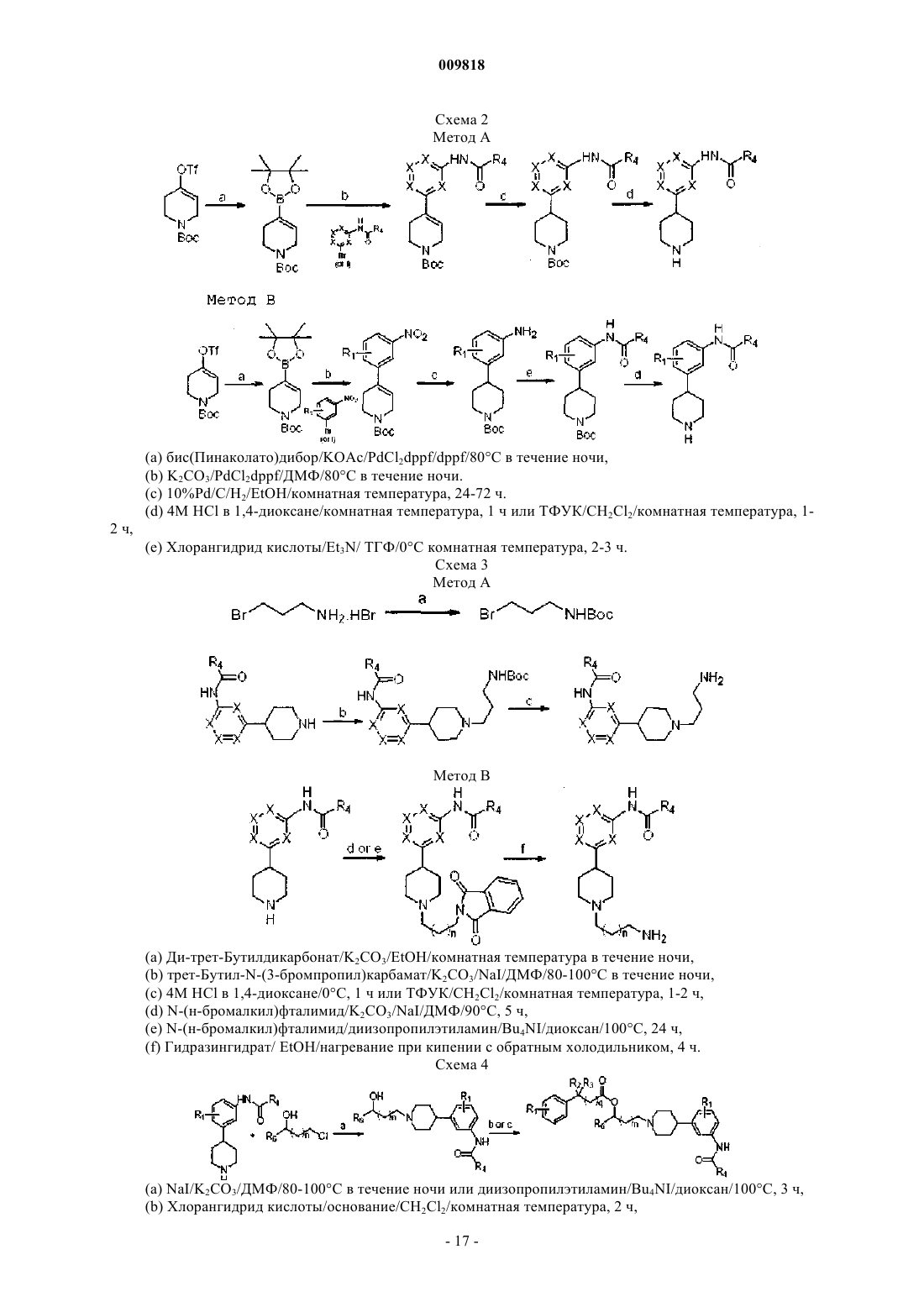
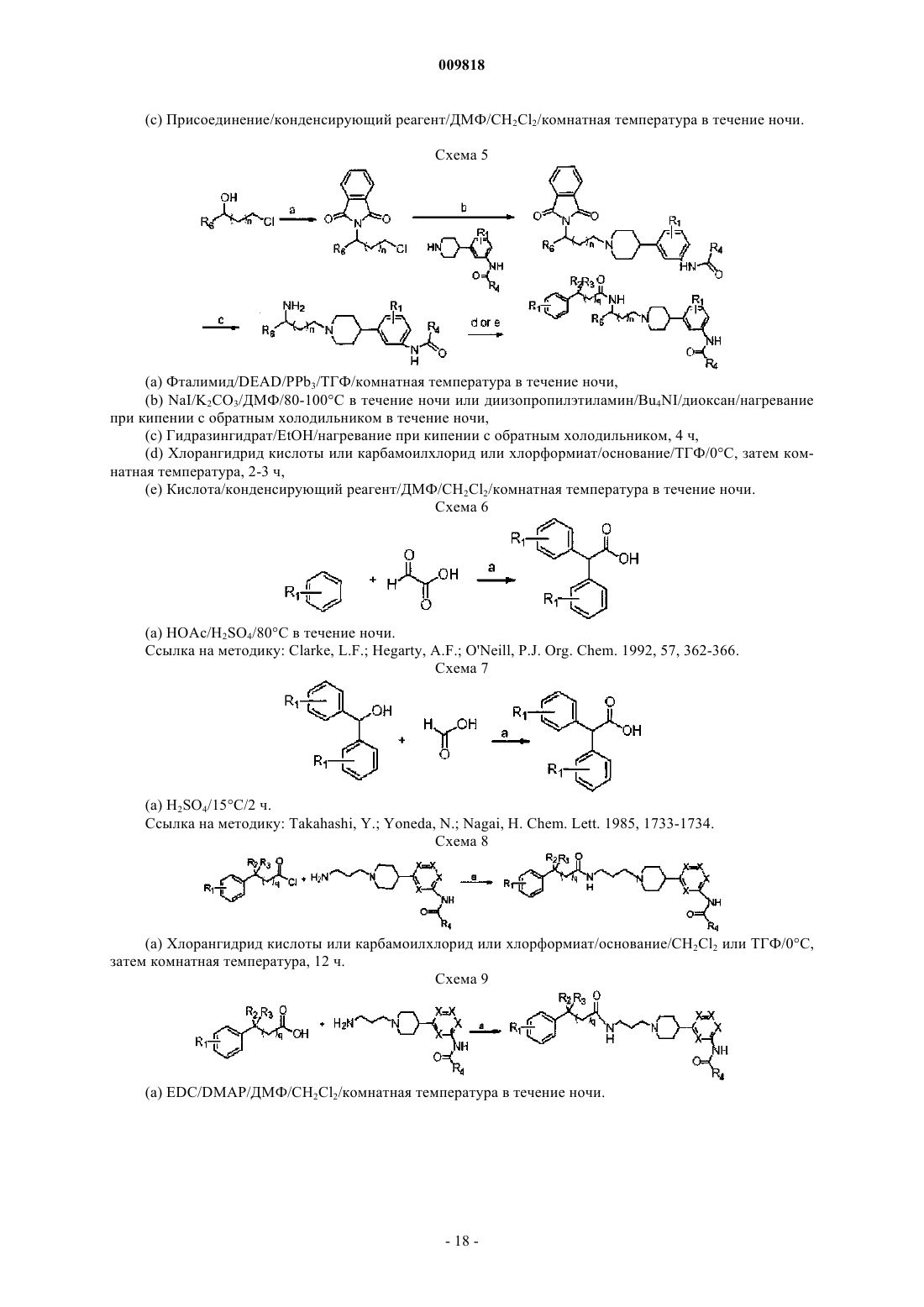
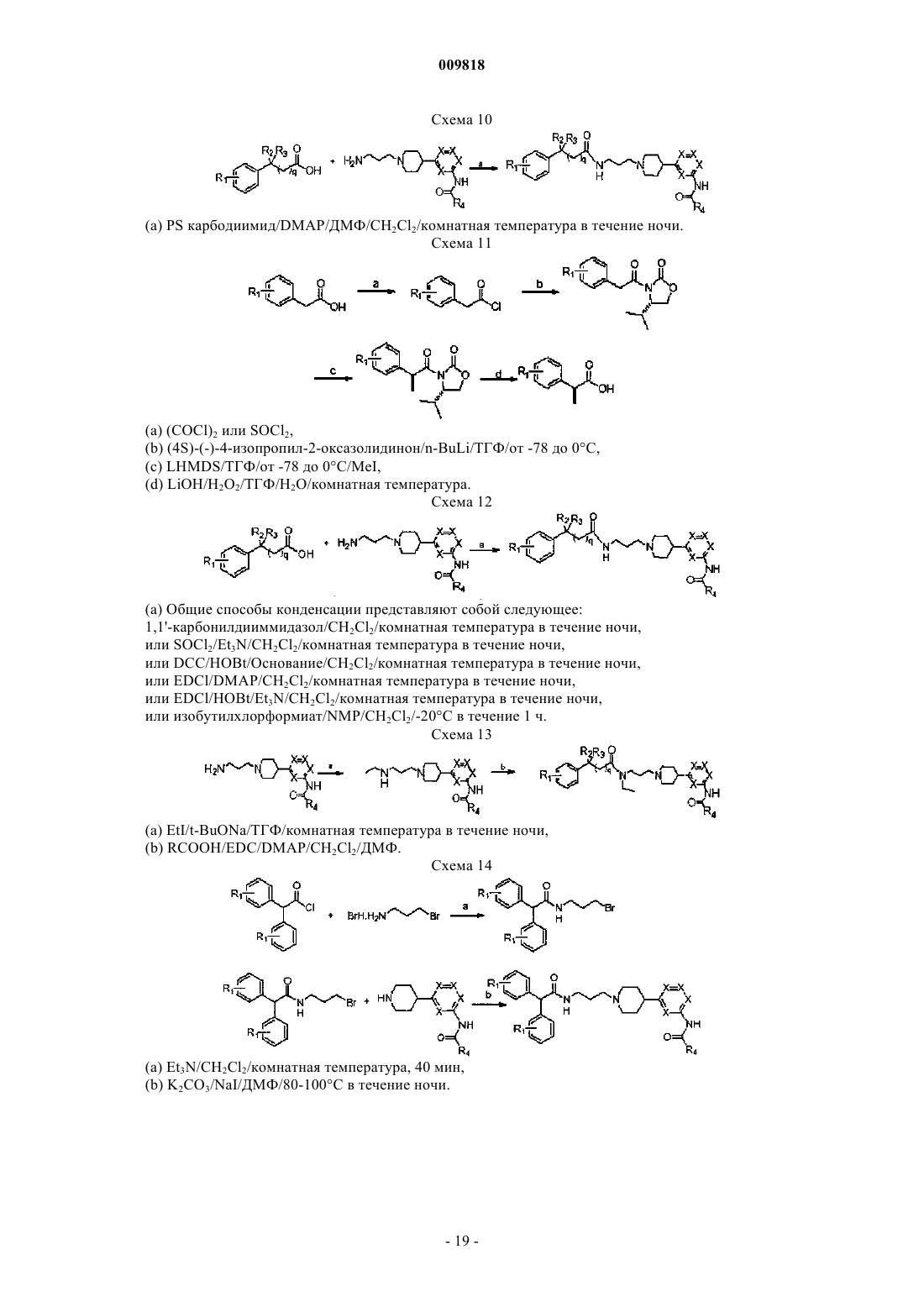
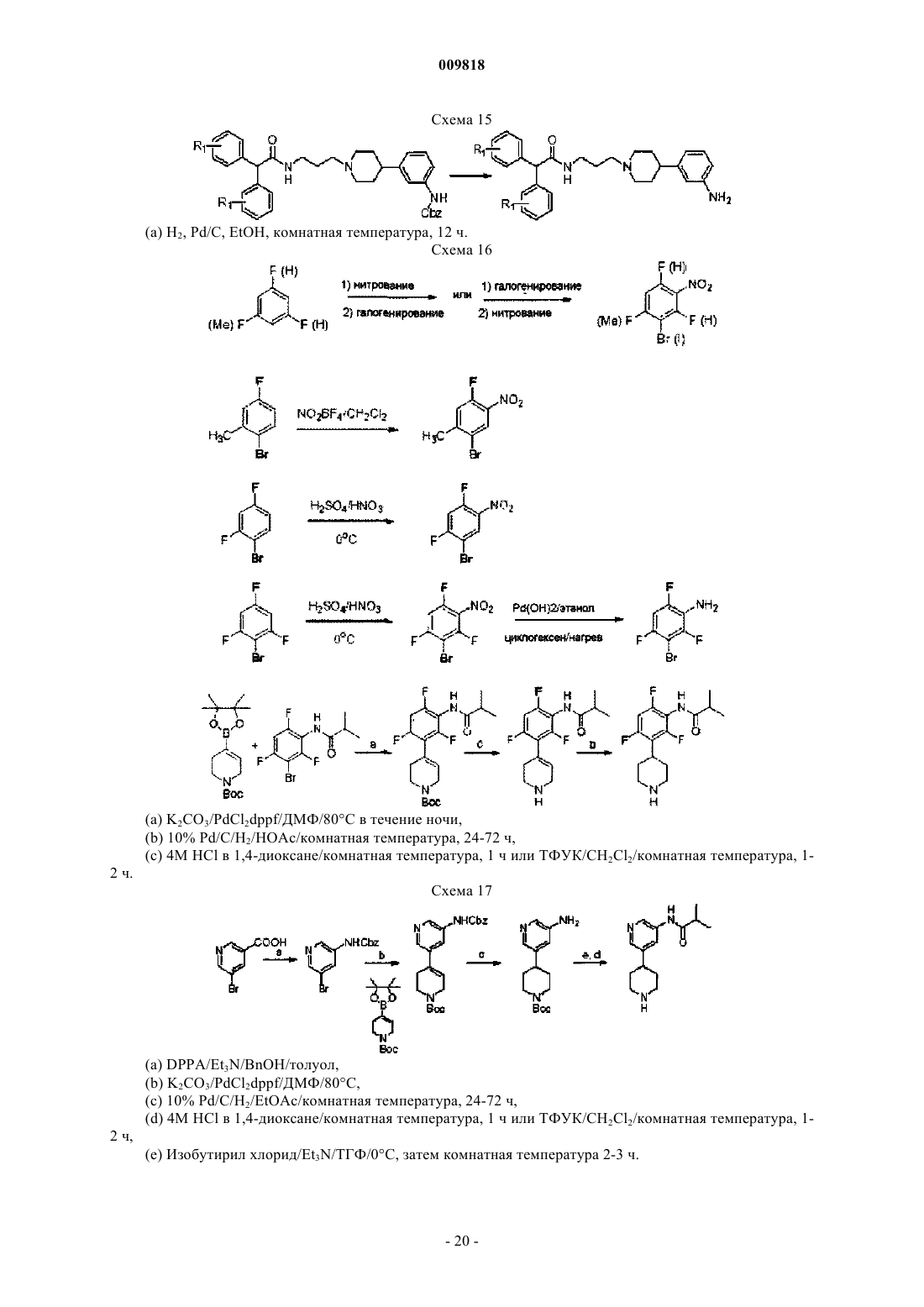
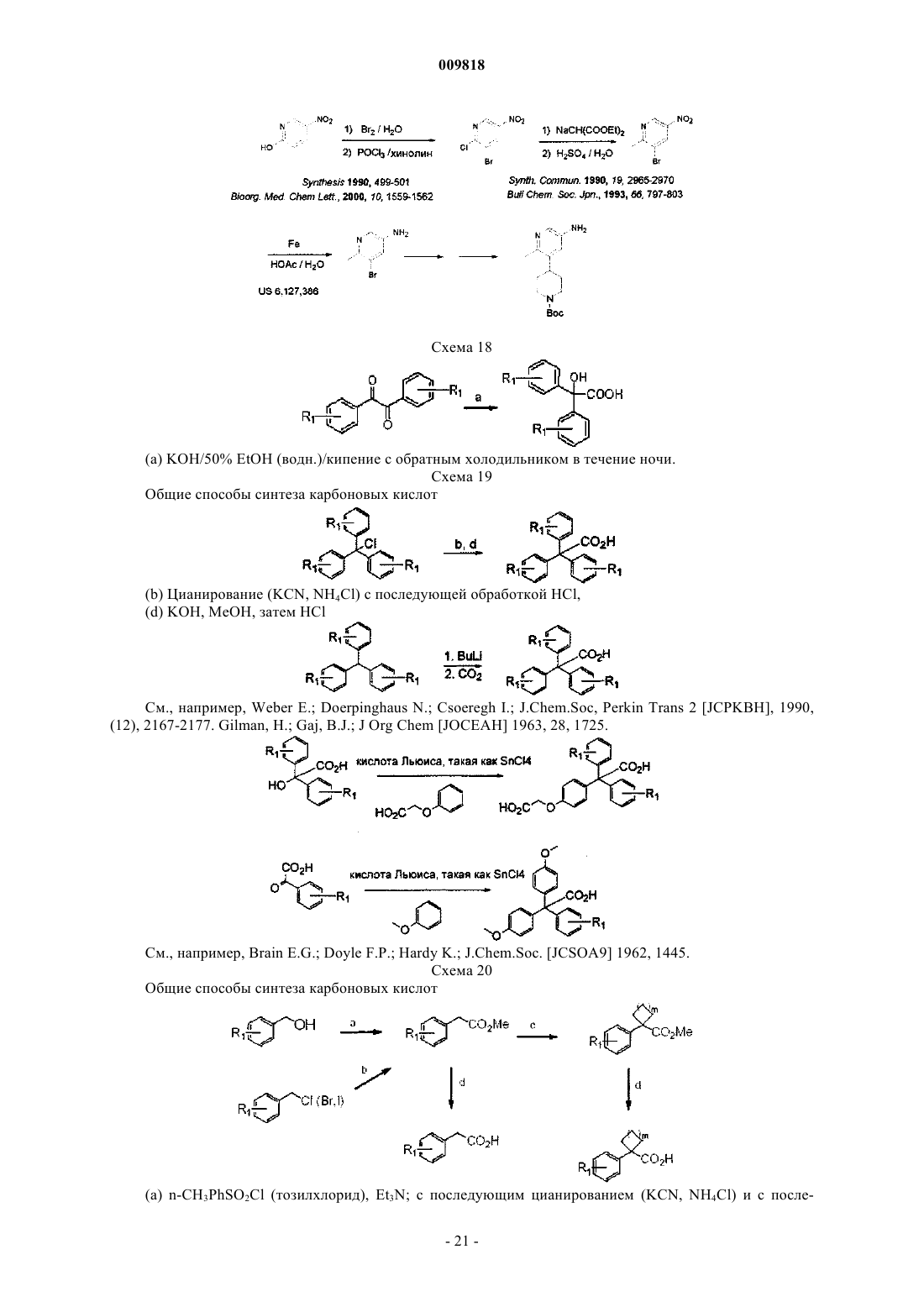
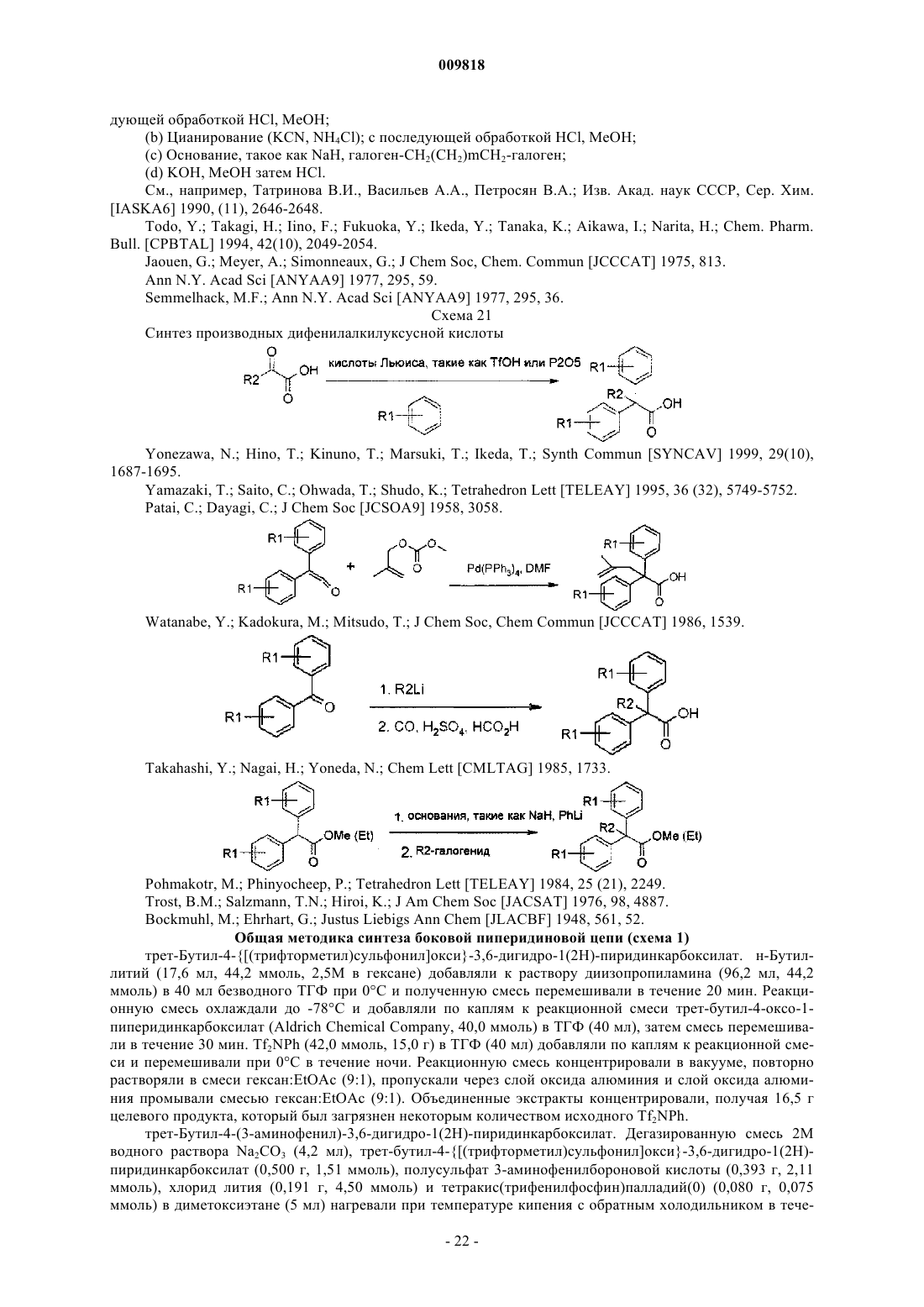
Замещенные алкиламидопиперидины
Номер патента: 9818
Опубликовано: 28.04.2008
Авторы: Дзианг Ю, Лу Каи, Марзабади Мохаммад Р., Ветцель Джон М., Чен Чиен-Ан
Формула / Реферат
1. Соединение, имеющее структуру
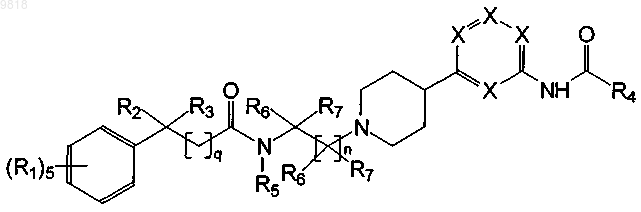
где каждый R1 независимо представляет собой водород; -F; -Cl или линейный или разветвленный С1-С7 алкил;
где R2 и R3 вместе могут представлять собой -(СН2)p-;
где R4 представляет собой линейный или разветвленный С1-С7 алкил или C3-C6 циклоалкил;
где каждый R5 независимо представляет собой водород;
где каждый R6 независимо представляет собой водород;
где каждый R7 независимо представляет собой водород;
где n представляет собой целое число 2;
где р представляет собой целое число от 2 до 5 включительно;
где q представляет собой целое число 0;
где каждый X независимо представляет собой CR1 или N, при условии, что если один X представляет собой N, то оставшиеся X представляют собой CR1;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где соединение имеет структуру
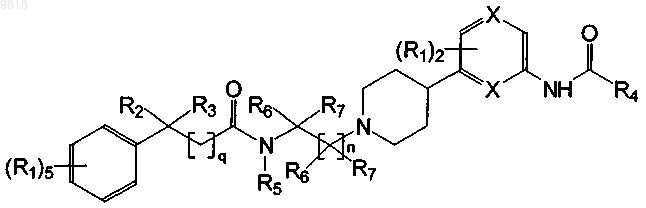
3. Соединение по п.2, где X представляет собой N.
4. Соединение по п.2, где X представляет собой CR1.
5. Соединение по п.1, где соединение является энантиомерно чистым
6. Соединение по п.1, где соединение является диастереомерно чистым.
7. Фармацевтическая композиция для лечения аффективного нарушения, нарушения мочеиспускания или нарушения питания, которая включает терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
8. Способ получения фармацевтической композиции, включающий смешивание соединения по п.1 и фармацевтически приемлемого носителя.
9. Применение соединения, имеющего структуру, определенную в п.1, для приготовления лекарственного средства для лечения субъекта, страдающего от эмоционального расстройства, выбранного из группы, состоящей из депрессии, основной депрессии, биполярного нарушения, агорафобии, специфической фобии, социальной фобии, навязчиво-компульсивного нарушения, пост-травматического стресса, острого стрессового состояния и тревожного состояния.
10. Применение соединения, имеющего структуру, определенную в п.1, для приготовления лекарственного средства для лечения субъекта, страдающего от нарушения мочеиспускания, выбранного из группы, состоящей из непроизвольного мочеиспускания, позывов с недержанием мочи, частого мочеиспускания, безотлагательных позывов к мочеиспусканию, никтурии или энуреза, включающий введение субъекту терапевтически эффективного количества соединения по п.1.
11. Применение соединения, имеющего структуру, определенную в п.1, для приготовления лекарственного средства для лечения субъекта, страдающего от нарушения питания, выбранного из группы, состоящей из ожирения, булимии, нервной булимии или нервной анорексии, включающий введение субъекту терапевтически эффективного количества соединения по п.1.
12. Соединение по п.1, выбранное из группы, которую составляют
1-(4-хлорфенил)-N-(3-{4-[3-(изобутириламино)фенил]-1-пиперидинил}пропил)циклопентанкарбоксамид;
1-(4-фторфенил)-N-(3-{4-[3-(изобутириламино)фенил]-1-пиперидинил}пропил)циклопентанкарбоксамид;
1-(2-хлор-4-фторфенил)-N-(3-{4-[3-(изобутириламино)фенил]-1-пиперидинил}пропил)циклопентанкарбоксамид;
1-(4-фторфенил)-N-(3-{4-[3-(изобутириламино)фенил]-1-пиперидинил}пропил)циклогексанкарбоксамид;
1-(2,4-дихлорфенил)-N-(3-{4-[3-(изобутириламино)фенил]-1-пиперидинил}пропил)циклопропанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[3-(изобутириламино)фенил]-1-пиперидинил}пропил)циклобутанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[3-(изобутириламино)фенил]-1-пиперидинил}пропил)циклопропанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[4-фтор-3-(изобутириламино)фенил]-1-пиперидинил}пропил)циклопропанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[3-(пропиониламино)фенил]-1-пиперидинил}пропил)циклобутанкарбоксамид;
1-(4-фторфенил)-N-(3-{4-[3-(пропиониламино)фенил]-1-пиперидинил}пропил)циклопентанкарбоксамид;
1-(4-фторфенил)-N-(3-{4-[3-(пропиониламино)фенил]-1-пиперидинил}пропил)циклогексанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[3-(пропиониламино)фенил]-1-пиперидинил}пропил)циклопентанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинил}пропил)циклопропанкарбоксамид;
1-(4-фторфенил)-N-(3-{4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинил}пропил)циклопентанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинил}пропил)циклогексанкарбоксамид;
1-(4-фторфенил)-N-(3-4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинил}пропил)циклогексанкарбоксамид;
N-(3-{4-[3-(бутириламино)фенил]-1-пиперидинил}пропил)-1-(4-хлорфенил)циклопропанкарбоксамид;
N-(3-{4-[3-(ацетиламино)фенил]-1-пиперидинил}пропил)-1-(4-фторфенил)циклогексанкарбоксамид;
N-(3-{4-[3-(ацетиламино)фенил]-1-пиперидинил}пропил)-1-(4-фторфенил)циклопентанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинил}пропил)циклобутанкарбоксамид;
N-(3-{4-[3-(ацетиламино)фенил]-1-пиперидинил}пропил)-1-(4-хлорфенил)циклобутанкарбоксамид;
N-(3-{4-[3-(ацетиламино)фенил]-1-пиперидинил}пропил)-1-(4-хлорфенил)циклогексанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинил}пропил)циклопропанкарбоксамид;
N-(3-{4-[3-(ацетиламино)фенил]-1-пиперидинил}пропил)-1-(4-хлорфенил)циклопентанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[5-(изобутириламино)-2-метилфенил]-1-пиперидинил}пропил)циклопентанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинил}пропил)циклопентанкарбоксамид;
1-(4-хлорфенил)-N-(3-{4-[5-(изобутириламино)-2-метилфенил]-1-пиперидинил}пропил)циклогексанкарбоксамид;
1-(4-хлорфенил)-N-(3-4-[5-(изобутириламино)-2-метилфенил]-1-пиперидинил}пропил)циклобутанкарбоксамид;
N-(3-{4-[3-(бутириламино)фенил]-1-пиперидинил}пропил)-1-(4-фторфенил)циклогексанкарбоксамид;
1-(4-хлорфенил)-N-(3-4-[5-(изобутириламино)-2-метилфенил]-1-пиперидинил}пропил)циклопропанкарбоксамид;
1-(4-фторфенил)-N-(3-{4-[5-(изобутириламино)-2-метилфенил]-1-пиперидинил}пропил)циклогексанкарбоксамид и
1-(4-фторфенил)-N-(3-{4-[5-(изобутириламино)-2-метилфенил]-1-пиперидинил}пропил)циклопентанкарбоксамид.
Текст
009818 Предпосылки создания изобретения Меланинконцентрирующий гормон (МСН) представляет собой циклический пептид, первоначально выделенный из гипофиза лососевых (рыба голец) (Kawauchi et al., 1983). В рыбе пептид, состоящий из 17 аминокислот, вызывает агрегацию меланина с меланофорами и ингибирует высвобождение АСТН, выступая в качестве функционального антагониста -MSH. МСН млекопитающих (19 аминокислот) является высококонсервативным для крысы, мыши и человека, проявляя 100% идентичность аминокислот, но его физиологические роли менее понятны. Сообщалось, что МСН участвует во множестве процессов,включая питание, водный баланс, энергетический метаболизм, общее состояние возбуждение/внимание,память и познавательные функции, а также психиатрические нарушения (см. обзоры Baker, 1991; Baker,1994; Nahon, 1994; Knigge et al., 1996). Его роль в питании или регулировании веса тела подкрепляется недавней публикаций в журнале Nature (Qu et al., 1996), где продемонстрировано, что МСН сверхэкспрессируется в гипоталамусе мышей ob/ob по сравнению с мышами ob/+ и что голодание дополнительно повышает мРНК МСН как у мышей, страдающих ожирением, так и у нормальных мышей во время голодания. МСН также стимулирует питание у нормальных крыс при введении в виде инъекции в боковой желудочек (Rossi et al., 1997). Также сообщалось, что МСН функционально антагонизирует поведенческие эффекты -MSH (Miller et al., 1993; Gonzalez et al., 1996; Sanchez et al., 1997); в дополнение было показано, что стресс увеличивает уровни РОМС мРНК, понижая при этом уровни предшественника МСН - мРНК препроМСН (ррМСН) (Presse et al., 1992). Таким образом, МСН может служить в качестве первичного нейропептида, вовлеченного в стрессовые реакции, а также в регулирование питания и половой активности (Baker, 1991; Knigge et al., 1996). Хотя предполагается, что биологическое действие МСН опосредовано специфическими рецепторами, сайты связывания МСН хорошо описаны не были. Сообщалось, что тритированный лиганд ([3 Н]МСН) проявляет специфическое связывание с мембранами мозга, но он оказался непригодным для анализов насыщения, так что ни сродство, ни Bmax определены не были (Drozdz и Eberle, 1995). Радиоактивное иодирование тирозина в тринадцатое положение привело к лиганду с заметно пониженной биологической активностью (см. Drozdz и Eberle, 1995). Напротив, радиоактивное иодирование аналога МСН[Phe13, Tyr19]-МСН оказалось успешным (Drozdz et al., 1995); лиганд сохранял биологическую активность и проявлял специфическое связывание с множеством клеточных линий, включая меланому (B16-F1, G4F,и G4F-7), РС 12 и клетки COS. В клетках G4F-7 Ko = 0,118 нМ и Bmax 1100 сайтов/клетку. Важно то,что связывание не ингибировалось -MSH, но слабо ингибировалось ANF крысы (Ki = 116 нМ относительно 12 нМ для природного МСН) (Drozdz et al., 1995). Позднее сообщалось о специфическом МСН связывании в трансформированных кератиноцитах (Burgaud et al., 1997) и клетка меланомы (Drozdz et al.,1998), где исследования по фотосшиванию позволяют предположить, что рецептор представляет собой мембранный белок с видимым молекулярным весом 45-50 кД, сопоставимым с диапазоном молекулярных масс суперсемейства рецепторов GPCR. До настоящего времени не сообщалось о радиоавторадиографических исследованиях локализации рецептора МСН. На основании локализации и биологической активности пептида МСН предполагается, что модулирование активности рецептора МСН может оказаться полезным для ряда терапевтических применений. Роль МСН в питании охарактеризована лучше всего для его потенциальных клинических применений. МСН экспрессируется в боковом гипоталамусе, области мозга, вовлеченной в регулирование жажды и голода (Grillon et al., 1997); недавно было показано, что орексины А и В, которые представляют собой эффективные орексигенные агенты, имеют очень близкое расположение с МСН в боковом гипоталамусе(Sakurai et al., 1998). Уровни мРНК МСН в данной области мозга повышены у крыс через 24 ч после лишения их пищи; (Herve и Fellman, 1997); после инъекции инсулина наблюдалось заметное увеличение избытка и интенсивности окрашивания МСН-иммунореактивного перикариона и волокон параллельно с повышением уровня мРНК МСН (Bahjaoui-Bouhaddi et al., 1994). Co способностью МСН стимулировать питание у крыс (Rossi et al., 1997) согласуется наблюдение, что уровни мРНК МСН повышенно регулируются в гипоталамусе страдающих ожирением мышей ob/ob mice (Qu et al., 1996) и понижаются в гипоталамусе крыс, обработанных лептином, потребление пищи и повышение веса тела у которых также снижены (Sahu, 1998). Оказалось, что МСН действует в качестве функционального антагониста меланокортиновой системы в своем влиянии на потребление пищи и на гормональную секрецию в НРА (гипоталамослизистая/надпочечная ось) (Ludwig et al., 1998). Совместно эти данные позволяют предположить роль эндогенного МСН в регуляции энергетического баланса и ответной реакции на стресс и обеспечить логическое обоснование для разработки специфических соединений, действующих в качестве рецепторов МСН для применения при лечении ожирения и родственных со стрессом нарушений. Во всех разновидностях, изученных к настоящему времени, основная часть нейронов МСН клеточной группы имеет достаточно постоянное расположение в данных областях бокового гипоталамуса и субталамуса, где они располагаются и могут быть частью некоторых из так называемых экстрапирамидальных двигательных цепей. Они включают основные стриато- и паллидо-фугальные пути, включая таламус и кору головного мозга, области гипоталамуса и обратные связи с субталамовыми ядрами, чрную субстанцию и центры среднего мозга (Bittencourt et al., 1992). При их расположении клеточная груп-1 009818 па МСН может пытаться образовать мостик или механизм для экспрессии гипоталамусной внутренней активности с подходящей и координированной двигательной активностью. Клинически это может иметь определенное значение для того, чтобы рассматривать вовлечение системы МСН в нарушения движения,такие как болезнь Паркинсона и хорея Хантингтона, в которые, как известно, включены в эстрапирамидальные цепи. В соответствии с исследованиями генетической цепи человека аутотентичные центры hMCH расположены на хромосоме 12 (12q23-24) и вариантные центры hMCH на хромосоме 5 (5q12-13) (Pedeutour etal., 1994). Расположение хромосомы (локус) 12q23-24 соответствует локусу, где размещается аутосомальная доминантная мозжечковая атаксия типа 11 (SCA2) (Auburger et al., 1992; Twells et al., 1992). Данное заболевание включает нейродегенеративные нарушения, включая оливомостомозжечковую атрофию. Кроме того, ген болезни Дариера расположен в локусе 12q23-24 (Crddock et al., 1993). Болезнь Дариера характеризуется аномалиями адгезии кератиноцитов и психическими расстройствами в некоторых семьях. С точки зрения функциональных и нейроанатомических моделей нервной системы МСН крысы и мозга человека, ген МСН может являться хорошим кандидатом для SCA2 или болезни Дариера. Интересно, что заболевания с высоким социальным влиянием расположены в данном локусе. Действительно, ген, ответственный за хронические или острые формы спинальной мышечной атрофии, приписан к хромосоме 5q12-13 с использованием генетического анализа сцепления между генными локусами(Melki et al., 1990; Westbrook et al., 1992). Кроме того, независимые линии доказательств поддерживают отнесение локуса специализированной шизофрении к хромосоме 5q11.2-13.3 (Sherrington et al., 1988;Bassett et al., 1988; Gilliam et al., 1989). На основании вышеуказанных исследований предполагается, что МСН может играть роль в нейродегенеративных заболеваниях и эмоциональных нарушениях. Дополнительные терапевтические применения для МСН-родственных соединений предлагаются на основании наблюдаемого влияния МСН в других биологических системах. Например, МСН может регулировать репродуктивные функции у самцов и самок крыс. Транскрипты МСН и пептид МСН были выявлены в зародышевых клетках при исследовании взрослых особей крыс. Что позволяет предположить,что МСН может участвовать в обновлении стволовой клетки и/или дифференциации ранних сперматоцитов (Hervieu et al., 1996). MCH, введенный непосредственно в срединное предзрительное поле (МРОА) или переднесрединное ядро (VMN), стимулирует половую активность у самок крыс (Gonzalez et al.,1996). У овариэктомированных крыс, которых насыщали эстрадиолом, МСН стимулировал высвобождение лютеинизирующего гормона (ЛГ), тогда как антисыворотка анти-МСН ингибировала высвобождение ЛГ (Gonzalez et al., 1997). Zona incerta, которая содержит большую популяцию клеточных тел МСН, ранее была идентифицирована как регуляторный сайт преовуляторного подъема концентрации ЛГ(MacKenzie et al., 1984). Сообщалось, что МСН влияет на высвобождение слизистых гормонов, включая АСТН и окситоксин. Аналоги МСН также можно использовать при лечении эпилепсии. В PTZ-модели приступа инъекция МСН перед индуцированием приступа предотвращает активность приступа, как на крысах, так и на морских свинках, на основании чего предполагается, что МСН-содержащие нейроны могут участвовать в относящейся к нервной системе схеме действия, предшествующей PTZиндуцированному приступу (Knigge и Wagner, 1997). Также наблюдалось, что МСН воздействует на поведенческие корреляции познавательных функций. Обработка МСН ускоряет затухание ответной реакции пассивной ликвидации у крыс, поднимая вопрос о возможности того факта, что антагонисты МСЕ рецептора могут оказаться благоприятными для хранения информации и/или сохранения памяти. Возможная роль МСН в модулировании или ощущении боли поддерживается плотной иннервацией околоводопроводного серого вещества (PAG) МСН-положительными волокнами. Наконец, МСН может участвовать в регулировании потребления жидкости. ICV инфузия МСН, проведенная находящейся в сознании овце, приводила к диауретическим, натрийуретическим и калийуретическим изменениям в ответ на повышение объема плазмы (Parkes, 1996). Совместно с анатомическими данными, сообщающими о присутствии МСН в регулирующих жидкость областях мозга, результаты указывают, что МСН может представлять собой важный пептид, включенный в центральный контроль гомеостаза жидкости у млекопитающих. Недавно были опубликованы данные по идентификации связанного с G-белком рецептора для МСН(Chambers et al., 1999; Saito et al., 1999). Данные группы исследователей идентифицировали МСН как эндогенный лиганд для одиночного связанного с G-белком рецептора SLC-1 человека (Lakaye et al.,1998). Крысиный гомолог данного рецептора (называемый сейчас МСН-1), как сообщалось, локализован в областях мозга крысы, связанных с поведением при питании (например, дорсосрединный и переднесрединный гипоталамус). Связь между МСН-1 и влиянием МСН на питание подкрепляется недавними сообщениями о фенотипе мышей с нокаутированным МСН-1. Две группы исследователей (Marsh et al.,2002; Chen et al., 2002) независимо показали, что целевое прерывание гена МСН-1 рецептора (нокаутирование МСН-1) у мышей приводит к появлению животных, которые являются гиперфаговыми, но тощими и имеют пониженную массу тела по сравнению с парным потомством дикого типа. Снижение массы тела приписывают увеличению метаболизма. Каждая из групп продемонстрировала, что мыши с нокаутированным МСН-1 резистентны к индуцированному питанием ожирению и, в общем, обладают весом, аналогичным весу потомства, поддерживаемого регулярным питанием.-2 009818 Наконец, к настоящему времени в литературе описаны синтетические молекулы антагонисты рецептора МСН-1.Bednarek et al. (Bednarek et al., 2002) сообщили о синтезе пептидных антагонистов МСН-1, обладающих высокой аффинностью. Кроме того Takekawa et al. (Takekawa et al., 2002), описали небольшую молекулу, являющуюся антагонистом МСН-1. Данное соединение, Т-226296, обладает высокой аффинностью в отношении рецептора МСН-1 (5-9 нМ для МСН-1 крысы и человека) и, как было показано,ингибирует потребление пищи, индуцированное внутрицеребровентикулярным применением МСН. Эти данные обосновывают стратегию использования антагониста рецептора МСН-1 для лечения ожирения. Кроме того, авторы настоящего изобретения в собственных исследованиях протестировали антагонисты МСН-1 на нескольких животных моделях, что хорошо известно в качестве прогноза для эффективности соединений при применении на людях, см. Borowsky, et al. (2002). Данные эксперименты показывают, что антагонисты МСН-1 могут использоваться для лечения ожирения, депрессии, тревожного состояния, а также заболеваний мочевыводящих путей. Как использовано в данном изобретении, термин антагонист относится к соединению, которое связывается с рецептором и понижает его активность в присутствии агониста. В случае связанного с Gбелком рецептора активация может быть измерена с использованием любой подходящей системы вторичного мессенджера, которая связывается с рецептором в клетке ткани, в которой экспрессируется рецептор. Некоторыми конкретными, но не органичивающими примерами хорошо известных систем вторичных мессенджеров являются аденилатциклаза, внутриклеточная мобилизация кальция, активация ионного канала, гуанилатциклаза и гидролиз фосфолипидинозитола. Наоборот, термин агонист относится к соединению, которое связывается с рецептором и повышает его активность по сравнению с активностью рецептора в отсутствие какого-либо агониста. В одном варианте осуществления данного изобретения описан синтез новых соединений, которые селективно связываются с клонированным рецептором меланинконцентрирующего гормона-1 (МСН 1) человека по сравнению с другими клонированными связанными с G-белком рецепторами ингибируют активацию рецепторов, как измерено с использованием анализов in vitro. Описанные далее анализы связывания рецептора in vitro были осуществлены на различных культивированных клеточных линиях, каждая из которых была трансфецирована и экспрессировала лишь единственный клонированный рецептор. Кроме того, соединения по настоящему изобретению также можно использовать для лечения аномальных состояний, таких как нарушения питания (ожирение, булимия и нервная булимия), половых/репродуктивных нарушений, депрессии и тревожных состояний, эпилептических припадков, гипертензии, церебрального кровоизлияния, застойной сердечной недостаточности, нарушений сна или любых других состояний, для которых антагонизм МСН 1 рецептора может оказаться благоприятным. Дополнительно соединения по настоящему изобретению можно использовать для снижения массы тела субъекта. Кроме того, соединения по настоящему изобретению можно использовать для лечения заболеваний мочевыводящих путей. Краткое изложение сущности изобретения Настоящее изобретение относится к соединению, имеющему структуру где каждый R1 независимо представляет собой водород; -F; -Cl или линейный или разветвленный С 1-С 7 алкил; где R2 и R3 вместе могут представлять собой -(СН 2)p-; где R4 представляет собой линейный или разветвленный С 1-С 7 алкил или С 3-С 6 циклоалкил; где каждый R5 независимо представляет собой водород; где каждый R6 независимо представляет собой водород; где каждый R7 независимо представляет собой водород; где каждый m независимо представляет собой целое число от 0 до 5 включительно; где n представляет собой целое число 2; где р представляет собой целое число от 2 до 5 включительно; где q представляет собой целое число 0; где каждый X независимо представляет собой CR1 или N, при условии, что если один X представляет собой N, то оставшиеся X представляют собой CR1; или его фармацевтически приемлемой соли. В одном варианте осуществления соединение имеет структуру где X, в одном случае, представляет собой N, а в другом случае представляет собой CR1. В предпочтительном варианте соединение является энантиомерно чистым, особенно диастереомерно чистым. Настоящее изобретение дополнительно относится к фармацевтической композиции для лечения аффективного нарушения, нарушения мочеиспускания или нарушения питания, которая включает терапевтически эффективное количество соединения, определенного выше, и фармацевтически приемлемый носитель. Изобретение также предлагает способ получения фармацевтической композиции, включающий смешивание соединения, указанного выше, и фармацевтически приемлемого носителя. Изобретение также предлагает применение соединения данного изобретения для приготовления лекарственного средства для лечения субъекта, страдающего от эмоционального расстройства, выбранного из группы, состоящей из депрессии, основной депрессии, биполярного нарушения, агорафобии, специфической фобии, социальной фобии, навязчиво-компульсивного нарушения, пост-травматического стресса, острого стрессового состояния и тревожного состояния. Изобретение также описывает применение соединения, имеющего структуру, определенную выше,для приготовления лекарственного средства для лечения субъекта, страдающего от нарушения мочеиспускания, выбранного из группы, состоящей из непроизвольного мочеиспускания, позывов с недержанием мочи, частого мочеиспускания, безотлагательных позывов к мочеиспусканию, никтурии или энуреза,включающий введение субъекту терапевтически эффективного количества соединения. Изобретение также описывает применение соединения, имеющего структуру, определенную выше,для приготовления лекарственного средства для лечения субъекта, страдающего от нарушения питания,выбранного из группы, состоящей из ожирения, булимии, нервной булимии или нервной анорексии,включающий введение субъекту терапевтически эффективного количества соединения. Изобретение предпочтительно предоставляет соединение, выбранное из группы, которую составляют 1-(4-хлорфенил)-N-(3-4-[3-(изобутириламино)фенил]-1-пиперидинилпропил)циклопентанкарбоксамид; 1-(4-фторфенил)-N-(3-4-[3-(изобутириламино)фенил]-1-пиперидинилпропил)циклопентанкарбоксамид; 1-(2-хлор-4-фторфенил)-N-(3-4-[3-(изобутириламино)фенил]-1-пиперидинилпропил)циклопентанкарбоксамид; 1-(4-фторфенил)-N-(3-4-[3-(изобутириламино)фенил]-1-пиперидинилпропил)циклогексанкарбоксамид; 1-(2,4-дихлорфенил)-N-(3-4-[3-(изобутириламино)фенил]-1-пиперидинилпропил)циклопропанкарбоксамид; 1-(4-хлорфенил)-N-(3-4-[3-(изобутириламино)фенил]-1-пиперидинилпропил)циклобутанкарбоксамид; 1-(4-хлорфенил)-N-(3-4-[3-(изобутириламино)фенил]-1-пиперидинилпропил)циклопропанкарбоксамид; 1-(4-хлорфенил)-N-(3-4-[4-фтор-3-(изобутириламино)фенил]-1-пиперидинилпропил)циклопропанкарбоксамид; 1-(4-хлорфенил)-N-(3-4-[3-(пропиониламино)фенил]-1-пиперидинилпропил)циклобутанкарбоксамид; 1-(4-фторфенил)-N-(3-4-[3-(пропиониламино)фенил]-1-пиперидинилпропил)циклопентанкарбоксамид; 1-(4-фторфенил)-N-(3-4-[3-(пропиониламино)фенил]-1-пиперидинилпропил)циклогексанкарбоксамид; 1-(4-хлорфенил)-N-(3-4-[3-(пропиониламино)фенил]-1-пиперидинилпропил)циклопентанкарбоксамид; 1-(4-хлорфенил)-N-(3-4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинилпропил)циклопропанкарбоксамид; 1-(4-фторфенил)-N-(3-4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинилпропил)циклопентанкарбоксамид; 1-(4-хлорфенил)-N-(3-4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинилпропил)циклогексан-4 009818 карбоксамид; 1-(4-фторфенил)-N-(3-4-[6-(изобутириламино)-2-пиридинил]-1-пиперидинилпропил)циклогексанкарбоксамид;N-(3-4-[3-(бутириламино)фенил]-1-пиперидинилпропил)-1-(4-фторфенил)циклогексанкарбоксамид; 1-(4-хлорфенил)-N-(3-4-[5-(изобутириламино)-2-метилфенил]-1-пиперидинилпропил)циклопропанкарбоксамид; 1-(4-фторфенил)-N-(3-4-[5-(изобутириламино)-2-метилфенил]-1-пиперидинилпропил)циклогексанкарбоксамид и 1-(4-фторфенил)-N-(3-4-[5-(изобутириламино)-2-метилфенил]-1-пиперидинилпропил)циклопентанкарбоксамид. Подробное описание изобретения Как использовано в настоящем изобретении, термин гетероарил включает пяти- и шестичленные ненасыщенные кольца, которые могут содержать один или несколько атомов кислорода, серы или азота. Примеры гетероарильной группы включают, но не ограничиваются указанным, карбазол, фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил,триазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил и триазинил. Кроме того, термин гетероарил включает конденсированные бициклические системы, которые могут содержать один или несколько гетероатомов, таких как кислород, сера и азот. Примеры таких гетероарильных групп включают, но не ограничиваются указанным, индолизинил, индолил, изоиндолил, бензо[b]фуранил, бензо[b]тиофенил, индазолил, бензимидазолил, пуринил, бензоксазолил, бензизоксазолил, бензо[b]тиазолил,имидазо[2,1-b]тиазолил, циннолинил, хиназолинил, хиноксалинил, 12,8-нафтиридинил, птеридинил, хинолинил, изохинолинил, фталимидил и 2,1,3-бензотиазолил. Термин гетероарил также включает указанные выше химические фрагменты, которые могут быть замещены одной или несколькими из следующих групп: -F, -Cl, -Br, -I, CN, -NO2, линейный или разветвленный C1-C7 алкил, линейный или разветвленный C1-C7 монофторалкил, линейный или разветвленный C1-C7 полифторалкил, линейный или разветвленный С 2-С 7 алкенил, линейный или разветвленный С 2-С 7 алкинил; С 3-С 7 циклоалкил, С 3 С 7 монофторциклоалкил, С 3-С 7 полифторциклсалкил, С 5-С 7 циклоалкенил. Термин гетероарил дополнительно включает N-оксиды указанных выше химических фрагментов, которые включают по крайней мере один атом азота. В настоящем изобретении термин арил означает фенил или нафтил. В настоящем изобретении термин линейный или разветвленный С 1-С 7 алкил относится к насыщенному углеводороду, содержащему от одного до семи атомов углерода включительно, такому как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил и 2-метил-1-пропил. Аналогично, алкенил и алкинил, соответственно, обозначают такие группы, содержащие от двух до семи атомов углерода, включая одну двойную связь и тройную связь соответственно, такие как этенил, пропенил, бутенил, этинил, пропинил и бутинил. Термин С 3-С 7 циклоалкил обозначает моноциклический карбоцикл,содержащий от трех до семи атомов углерода, такой как циклопропил, циклопентил, циклогексил и т.д. Термин С 1-С 7 алкил-С 3-С 6 циклоалкил обозначает насыщенный алкильный углеводород, замещенный-5 009818 моноциклическим карбоциклическим кольцом, имеющим от трех до семи атомов углерода, присоединенным через С 1-С 7 алкильный фрагмент, такой как метил-циклопропил, этил-циклопентил, н-пропилциклогексил и т.д. Изобретение относится к каждому чистому стереоизомеру любого из описанных здесь соединений. Такие стереоизомеры могут включать энантиомеры, диастереомеры или Е или Z алкеновые или иминовые изомеры. Изобретение также относится к стереоизомерным смесям, включая рацемические смеси,диастереоизомерные смеси или E/Z изомерные смеси. Стереоизомеры могут быть получены в чистом виде (Nogradi, M.; Stereoselective Synthesis, (1987) VCH Editor Ebel, H. и Asymmetric Synthesis, Volumes 3 В 5, (1983) Academic Press, Editor Morrison, J.) или они могут быть разделены различными способами,такими как кристаллизация и хроматографические методы (Jaques, J.; Collet, A.; Wilen, С; Enantiomer Racemates and Resolutions, 1981, John Wiley and Sons, и Asymmetric Synthesis, Vol. 2, 1983, Academic Press,Editor Morrison, J.). В дополнение соединения по настоящему изобретению могут представлять собой энантиомеры, диастереомеры, изомеры или два или несколько соединений могут присутствовать, образуя рацемические или диастереомерные смеси. Соединения по настоящему изобретению предпочтительно имеют 80%-ную чистоту, более предпочтительно 90%-ную чистоту и наиболее предпочтительно 95%-ную чистоту. В данное изобретение включены фармацевтически приемлемые соли и комплексы описанных здесь соединений. Кислоты и основания, из которых получают такую соль, включают, но не ограничиваются перечисленными в данном описании кислотами и основаниями. Кислоты включают, но не ограничиваются указанным, следующие неорганические кислоты: хлористо-водородную кислоту, бромисто-водородную кислоту, иодисто-водородную кислоту, серную кислоту и борную кислоту. Кислоты включают, но не ограничиваются указанным, следующие органические кислоты: уксусную кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, метансульфоновую кислоту, бензойную кислоту, гликолевую кислоту, молочную кислоту и миндальную кислоту. Основания включают, но не ограничиваются указанным, аммиак, метиламин, этиламин, пропиламин, диметиламин,диэтиламин, триметиламин, триэтиламин, этилендиамин, гидроксиэтиламин, морфолин, пиперазин и гуанидин. Изобретение дополнительно относится к гидратам и полиморфам всех описанных здесь соединений. Настоящее изобретение включает в свой объем пролекарства соединений по изобретению. В общем, такие пролекарства будут представлять собой функциональные производные соединений по изобретению, которые легко превращаются in vivo в требуемые соединения. Таким образом, в настоящем изобретении термин введение будет охватывать лечение различных описанных состояний с помощью конкретно описанных соединений или с использованием соединения, которое, не будучи специально раскрытым, превращается в конкретное соединение in vivo после введения пациенту. Обычные методики отбора и получения подходящих пролекарственных производных описаны, например, в Design of Prodrugs, ed. H. Bundgaard, Elsevier, 1985. Настоящее изобретение дополнительно включает метаболиты соединений по настоящему изобретению. Метаболиты включают активные частицы, образующиеся при введении соединений по данному изобретению в биологическую среду. Далее настоящее изобретение относится к. фармацевтической композиции, включающей терапевтически эффективное количество соединения по изобретению и фармацевтически приемлемый носитель. В одном варианте осуществления количество соединения составляет примерно от 0,01 до примерно 800 мг. В другом варианте осуществления количество соединения составляет примерно от 0,01 до примерно 500 мг. Еще в одном варианте осуществления количество соединения составляет примерно от 0,1 до примерно 250 мг. В другом варианте осуществления количество соединения составляет примерно от 0,1 до примерно 60 мг. Еще в одном другом варианте осуществления количество соединения составляет примерно от 1 до примерно 20 мг. В следующем варианте осуществления носитель представляет собой жидкость, и композиция представляет собой раствор. В другом варианте осуществления носитель представляет собой твердое вещество, и композиция представляет собой таблетку. В другом варианте осуществления носитель представляет собой гель, и композиция представляет собой капсулу, суппозиторий или крем. В следующем варианте осуществления соединение может быть введено в состав рецептуры как часть фармацевтического чрезкожного пластыря. Еще в одном следующем варианте осуществления соединение можно доставлять субъекту в виде спрея или ингалянта. Данное изобретение также относится к фармацевтической композиции, полученной путем объединения терапевтически эффективного количества соединения по данному изобретению и фармацевтически приемлемого носителя. Данное изобретение относится к способу получения фармацевтической композиции, включающему объединение терапевтически эффективного количества соединения по данному изобретению и фармацевтически приемлемого носителя. Твердый носитель может включать одно или несколько веществ, которые также могут выступать в качестве эндогенных носителей (например, питательное вещество или микропитательные носители),вкусовых агентов, смазывающих веществ, солюбилизаторов, суспендирующих агентов, наполнителей,агентов, улучшающих скольжение, вспомогательных веществ для прессования, связующих или дезинтегрирующих агентов для таблеток, также он может представлять собой инкапсулирующий материал. В-6 009818 таблетках, активный ингредиент смешивают с носителем, обладающим необходимыми компрессионными свойствами в подходящих пропорциях и придают ему требуемую форму и размер. Порошки и таблетки предпочтительно содержат до 99% активного ингредиента. Предпочтительные твердые носители предпочтительно включают, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин,крахмал, желатин, целлюлозу, поливинилпирролидин, низкоплавкие воски и ионообменные смолы. Жидкие носители используются при получении растворов, суспензий, эмульсий, сиропов, эликсиров и композиций под давлением. Активный ингредиент может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органическом растворителе, смеси их обоих или фармацевтически приемлемых маслах или жирах. Жидкий носитель может содержать другие подходящие фармацевтические вспомогательные добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, вкусовые агенты, суспендирующие агенты, загустители, красители,регуляторы вязкости, стабилизаторы или регуляторы осмотического давления. Подходящие примеры жидких носителей для перорального и парентерального введения включают воду (частично содержащую указанные выше вспомогательные добавки, например производные целлюлозы, предпочтительно раствор карбоксиметилцеллюлозы натрия), спирты (включая одноатомные спирты и многоатомные спирты,например гликоли) и их производные и масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носитель также может представлять собой масляный сложный эфир, такой как этилолеат или изопропилмиристат. Стерильные жидкие носители могут использоваться в стерильных жидких формах композиций для парентерального введения. Жидкий носитель для композиций под давлением может представлять собой галогенированный углеводород или другой фармацевтически приемлемый пропеллент. Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, можно использовать для внутримышечной, интратекальной, эпидуральной, внутрибрюшинной или подкожной инъекции. Стерильные растворы также можно вводить внутривенно. Соединения могут быть приготовлены в виде стерильной твердой композиции, которая может быть растворена или суспендирована во время введения с использованием стерильной воды, физиологического раствора или другой подходящей стерильной среды для инъекции. Носители предназначены для того, чтобы включать необходимые и инертные связующие вещества, суспендирующие агенты, лубриканты, ароматизаторы,подсластители, консерванты, красители и покрывающие вещества. Соединение можно вводить перорально в виде стерильного раствора или суспензии, содержащей другие растворенные или суспендированные агенты (например, достаточное количество физиологического раствора или глюкозы для придания раствору изотонических свойств), соли желчных кислот, камедь, желатин, моноолеат сорбита, полисорбат 80 (олеатные сложные эфиры сорбита и его ангидриды, сополимеризованные с этиленоксидом) и тому подобное. Соединения также можно вводить перорально в виде либо жидкой, либо твердой композиции. Композиции, подходящие для перорального введения включают твердые формы, такие как пилюли, капсулы,гранулы, таблетки и порошки, и жидкие формы, такие как растворы, сиропы, эликсиры и суспензии. Формы, используемые для парентерального введения, включают стерильные растворы, эмульсии и суспензии. Оптимальные дозировки для введения могут определяться специалистами в данной области и будут изменяться в зависимости от конкретного используемого соединения, концентрации препарата,способа введения и развития болезненного состояния. Дополнительные факторы, зависящие от конкретного субъекта, подвергаемого лечению, будут приводить к необходимости регулировать дозировку на основании возраста субъекта, веса, пола, питания и времени введения. В настоящей заявке термин терапевтически эффективное количество представляет собой любое количество соединения, которое при введении его субъекту, страдающему от заболевания, против которого соединения являются эффективными, вызывает уменьшение, ремиссию или регрессию заболевания. В настоящей заявке термин субъект относится к позвоночному животному, млекопитающему или человеку. Данное изобретение относится к способу лечения субъекта, страдающего от аномалии, где данная аномалия смягчается при уменьшении активности рецептора МСН 1, включающему введение субъекту соединения по изобретению, которое представляет собой антагонист рецептора МСН 1, в количестве эффективном для лечения аномалии у субъекта. В отдельных вариантах осуществления аномалия представляет собой регулирование нарушения стероидного или слизистого гормона, нарушение высвобождения эпинефрина, желудочно-кишечное нарушение, сердечно-сосудистое заболевание, нарушение электролитного баланса, гипертензию, диабет, дыхательное нарушение, астму, нарушение репродуктивной функции, иммунное нарушение, эндокринное нарушение, мышечно-скелетное нарушение, нейроэндокринное нарушение, когнитивное нарушение, нарушение памяти, такое как болезнь Альцгеймера, нарушение сенсорного модулирования и трансмиссии, нарушение моторной координации, нарушение сенсорной интеграции, нарушение моторной интеграции, нарушение допаминергической функции, такое как болезнь Паркинсона, нарушение сенсорной трансмиссии, нарушение обоняния, нарушение симпатической иннервации, аффективное нарушение, такое как депрессия и тревожное состояние, нарушение,связанное со стрессом, нарушение жидкостного баланса, нарушение, связанное с приступами, боль, психотическое поведение, такое как шизофрения, толерантность к морфину, опиатная зависимость, мигрень-7 009818 или нарушение мочевыводящих путей, такое как недержание мочи. Следующее описание депрессивных и тревожных нарушений приведено в целях иллюстрации полезности соединений по данному изобретению. Данные ниже определения депрессивных и тревожных нарушений перечислены в Diagnostic and Statistical Manual of Mental Disorders, 4-е издание (DSM-IV;American Psychiatric Association, 1994a) или Diagnostic and Statistical Manual of Mental Disorders, 3-е исправленное издание (DSM-III-R; American Psychiatric Association, 1987). Дополнительную информацию, касающуюся данных нарушений, можно найти в указанных ссылках, так же как и в процитированных ниже ссылках, все из которых включены в данное описание посредством ссылки. Депрессивные нарушения включают основное депрессивное нарушение и психическое депрессивное нарушение (American Psychiatric Association, 1994a; American Psychiatric Association, 1994b). Основное депрессивное нарушение характеризуется присутствием одного или нескольких основных депрессивных случаев без маниакальных или гипоманиакальных эпизодов. Основной депрессивный случай определяется как заметное и относительно постоянное депрессивное или психическое депрессивное настроение, которое обычно влияет на дневную деятельность (приблизительно каждый день по крайней мере в течение 2 недель); оно должно включать по крайней мере 4 из следующих 8 симптомов: изменение аппетита, изменение сна, психомоторное возбуждение или торможение, потеря интереса к обычным видам деятельности или снижение сексуального влечения, повышенная усталость, чувство вины или несостоятельности, замедленное мышление или нарушенная концентрация и суицидные попытки или суицидные идеи (MedicalEconomics Company, 2002). Психическое нарушение включает тип депрессии, который является не достаточно серьезным, чтобы называть его основным депрессивным случаем, но который длится намного дольше, чем основное депрессивное нарушение без выраженных фаз. Предполагается, что соединения по данному изобретению будут эффективными для лечения депрессии у пациентов с поставленным диагнозом депрессии при проведении одного или нескольких из следующих тестов: шкала оценок депрессии по Гамильтону (HDRS), фиксация по пунктам депрессивного настроения по Гамильтону, общая клиническая оценка (CGI) серьезности заболевания. Кроме того предполагается, что соединения по данному изобретению будут эффективными для индуцирования улучшений некоторых измеренных в данных тестах факторов, таких как подфакторные баллы HDRS,включая пункты депрессивного настроения, фактор нарушения сна и фактор тревоги и шкала CGIсерьезности заболевания. Также предполагается, что соединения по данному изобретению будут эффективными для предотвращения рецидивов основных депрессивных случаев. Тревожные нарушения включают паническое состояние, агорафобию с наличием в анамнезе панического состояния или без таковой,специфическую фобию, социальную фобию, навязчиво-компульсивное нарушение, посттравматический стресс, острое стрессовое состояние или генерализованное тревожное состояние. Предполагается, что соединения по данному изобретению будут эффективными для лечения любого из всех перечисленных нарушений у пациентов, у которых были диагностированы данные нарушения. Навязчиво-компульсивное нарушение характеризуется периодически повторяющимися и постоянными идеями, мыслями, импульсами или образами (навязчивые идеи), которые являются неприемлемыми для личности и/или повторяющимися, целенаправленным и преднамеренным поведением (компульсивные побуждения), которое воспринимается индивидуумом как неумеренное или неразумное (American Psychiatric Association, 1994a). Навязчивые идеи или компульсивные побуждения вызывают заметное недомогание, занимают длительное время или заметно влияют на социальную или профессиональную деятельность. Предполагается, что соединения по данному изобретению будут эффективными при лечении навязчивых идей и компульсивных побуждений у пациентов, у которых было диагностировано навязчиво-компульсивное нарушение при проведении подходящих тестов, которые могут включать, но не ограничиваются указанным: навязчиво-компульсивная шкала Yale Brown (YBOCS) (Goodman, 1989) (для взрослых), OCD шкала национального института общих психических заболеваний (NIMH GOCS), шкалаCGI-серьезности заболевания. Дополнительно подразумевается, что соединения по данному изобретению будут эффективными для индуцирования улучшений некоторых факторов, измеренных в данных тестах, таких как снижение на несколько баллов в общей шкале баллов в тесте YBOCS. Также предполагается, что соединения по данному изобретению будут эффективными для предотвращения рецидивов навязчиво-компульсивного нарушения. Паническое нарушение характеризуется периодически повторяющимися приступами паники и связанным с этим беспокойством о появлении дополнительных приступов, тревогой о последствиях или результатах приступов и/или заметным изменением поведения, относящимся к приступам (American Psychiatric Association, 1994a). Приступ паники определяются как дискретные периоды интенсивного страха или дискомфорта, во время которых четыре (или несколько) из следующих симптомов развиваются неожиданно и достигают пика в течение 10 мин: (1) сильное сердцебиение, частая сердечная пульсация или ускоренный сердечный ритм; (2) потоотделение; (3) тремор или дрожь; (4) ощущения краткого дыхания или удушья; (5) чувство удушья; (6) боль или дискомфорт в грудной клетке; (7) тошнота или боли в желудке; (8) чувство головокружения, неустойчивости, легкости в голове или слабость; (9) дереализация(ощущение нереальности) или деперсонализации (ощущение обособленности от себя самого); страх утраты контроля; (11) страх смерти; (12) онемения (нечувствительность или ощущение покалывания); (13)-8 009818 приступы холода или жара. Панические нарушения могут быть связаны или не связаны с агорафобией или иррациональным и часто страхом неспособности находиться в обществе. Предполагается, что соединения по данному изобретению будут эффективными при лечении панических нарушений у пациентов,которым поставлен диагноз панического нарушения на основании частоты появления приступов паники или с помощью шкалы CGI-серьезности заболевания. Дополнительно подразумевается, что соединения по данному изобретению будут эффективными для индуцирования улучшений некоторых факторов, измеренных при такой оценке, таких как уменьшение частоты или исключение приступов паники, улучшение по шкале CGI-серьезности заболевания или CGI-глобальное улучшение балла: 1 (очень сильное улучшение), 2 (сильное улучшение) или 3 (минимальное улучшение). Также предполагается, что соединения по данному изобретению будут эффективными для предотвращения рецидивов панического нарушения. Социальное тревожное состояние, также известное как социальная фобия, отличается заметным и постоянным страхом одной или нескольких общественных или профессиональных ситуаций, в которой индивидуум общается с незнакомыми людьми или испытывает излишнее внимание других людей(American Psychiatric Association, 1994a). Действие пугающей ситуации почти постоянно провоцирует тревогу, которая может достигать интенсивности приступа паники. Тревожные ситуации исключаются или переносятся с интенсивным страхом или душевным страданием. Уклонение, предчувствие патологического страха или недомогания в беспокойной ситуации(ях) значительно мешает обычному режиму индивидуума, профессиональной или учебной деятельности, общественной активности или взаимоотношениям или имеется заметное недомогание по поводу появления фобий. Меньшая степень проявления беспокойства или застенчивости обычно не требует психофармакологического лечения. Предполагается,что соединения по данному изобретению будут эффективными при лечении социального тревожного состояния у пациентов, которым поставлен диагноз социального тревожного состояния при проведении любого из следующих тестов: шкала социального беспокойства по Лейбовитцу (LSAS), шкала CGIсерьезности заболевания, шкала оценок тревоги Гамильтона (НАМ-А), шкала оценок депрессии Гамильтона (HAM-D), шкала оценки по оси V общественной и профессиональной деятельности DSM-IV, оценка по оси 11 (ICD-10) нетрудоспособности Всемирной Организации Здравоохранения, программа-2 (DAS2), шкала нетрудоспособности Шихана, профиль нетрудоспособности Шнейера, оценка качества жизни 100 Всемирной Организации Здравоохранения (WHOQOL-100) или с помощью других тестов, как описано в справочнике Bobes, 1998, который включен в данное описание в качестве ссылки. Дополнительно предполагается, что соединения по изобретению будут эффективными для индуцирования улучшений,измеренных в данных тестах, таких как изменение базовой линии по шкале социального беспокойства по Лейбовитцу (LSAS) или баллы CGI-глобального улучшения, составляющих 1 (очень сильное улучшение), 2 (значительное улучшение) или 3 (минимальное улучшение). Также подразумевается, что соединения по данному изобретению будут эффективными для предотвращения рецидивов социального тревожного нарушения. Общее тревожное нарушение отличается избыточной тревогой и беспокойством (тревожное ожидание), которые являются постоянными в течение по крайней мере 6 месяцев, и которое индивидууму трудно контролировать (American Psychiatric Association, 1994a). Оно должно быть связано по крайней мере с 3 из следующих 6 симптомов: беспокойность или чувство взвинченности или нетерпеливости,легкая утомляемость, трудность концентрации или озадаченность, раздражение, мышечное напряжение,нарушения сна. Диагностические критерии для данного заболевания описаны более подробно в DSM- IV,который включен в данное описание в качестве ссылки (American Psychiatric Association, 1994a). Предполагается, что соединения по данному изобретению будут эффективными при лечении общего тревожного нарушения у пациентов, которым поставлен диагноз данного заболевания на основании критериев,описанных в DSM-IV. Дополнительно подразумевается, что соединения по данному изобретению будут эффективными для снижения симптомов данного заболевания, таких как избыточное беспокойство и тревога, трудность контролирования беспокойства, беспокойность или чувство взвинченности или нетерпеливости, легкая утомляемость, трудность концентрации или озадаченность, раздражение, мышечное напряжение или нарушения сна. Также предполагается, что соединения по данному изобретению будут эффективными для предотвращения рецидивов общего тревожного нарушения. Для посттравматического стресса (PTSD), как определено DSM-III-R/IV (American Psychiatric Association, 1987, American Psychiatric Association, 1994a), требуется действие травматического случая, включающего в себя действительную или возможную угрозу смерти, или серьезный ущерб, или опасность физической целостности для самого индивидуума или других, и ответная реакция, включающая интенсивный страх, беспомощность или ужас. Симптомы, появляющиеся в результате действия травматического случая, включают повторное переживание случая в виде навязчивых мыслей, воспоминаний или снов и интенсивное физическое недомогание и физиологическую реактивность на действие аллюзий на данный случай, избегание ситуаций, напоминающих травматический случай, неспособность вспомнить детали происшедшего и/или неспособность общего сохранения активного состояния, проявляющуюся в виде пониженного интереса к важной деятельности, отчуждение от других людей, ограниченный диапазон эмоций или чувство недолговременности жизни; и симптомы автономного возбуждения, включая-9 009818 сверхбдительность, гиперболизированную реакцию испуга, нарушение сна, ухудшенную концентрацию и раздражение или вспышки гнева. Для диагноза PTSD требуется, чтобы симптомы присутствовали в течение, по крайней мере, месяца, и чтобы они вызывали клинически значимое недомогание или ухудшение в общественной, профессиональной или других важных областях деятельности. Предполагается,что соединения по данному изобретению будут эффективными при лечении PTSD у пациентов, которым поставлен диагноз PTSD при проведении любого из следующих тестов: клинически предписываемая шкала PTSD, часть 2 (CAPS), степень воздействия на пациента шкалы случаев (IES) (Medical EconomicsCompany, 2002, p. 2752). Дополнительно предполагается, что соединения по изобретению будут эффективными для индуцирования улучшений в баллах по шкале CAPS, IES, CGI-серьезности заболевания или тестам CGI-глобальных улучшений. Также предполагается, что соединения по данному изобретению будут эффективными для предотвращения рецидивов PTSD. В предпочтительном варианте осуществления предмет изобретения относится к способу лечения или управления следующими показаниями: депрессивные нарушения, тревожные состояния, нарушения питания/массы тела и нарушения мочевыводящих путей. Примерами депрессивных нарушений являются основное депрессивное нарушение или психические депрессивные нарушения. Примерами тревожных состояний являются паническое состояние, агорафобия без панического состояния в анамнезе, специфическая фобия, социальная фобия, навязчиво-компульсивное нарушение, посттравматический стресс, острое стрессовое состояние или генерализованное тревожное состояние. Примерами нарушений питания/массы тела являются ожирение, набор веса, булимия, нервная булимия или нервная анорексия. Примеры нарушений мочевыводящих путей включают, но не ограничиваются указанным, недержание мочи,гиперактивный мочевой пузырь, позывы с недержанием мочи, частые мочеиспускания, позывы к мочеиспусканию, ноктурию или энурез. Гиперактивный мочевой пузырь и позывы к мочеиспусканию могут быть связаны или не связаны с доброкачественной гиперплазией простаты. Данное изобретение относится к способу модифицирования потребления пищи субъектом, который включает введение субъекту соединения по изобретению в количестве, эффективном для уменьшения потребления, пищи субъектом. Данное изобретение также относится к способу лечения нарушения питания у субъекта, который включает введение субъекту соединения по изобретению в количестве, эффективном для лечения нарушения питания у субъекта. В варианте осуществления настоящего изобретения нарушение питания представляет собой ожирение, булимию, нервную булимию и нервную анорексию. Настоящее изобретение дополнительно относится к способу снижения массы тела субъекта, включающему введение субъекту соединения по изобретению, в количестве эффективном для снижения массы тела субъекта. Изобретение также относится к способу борьбы с ожирением у субъекта, нуждающегося в потере веса, включающему введение субъекту соединения по изобретению в количестве, эффективном для индуцирования потери массы тела субъекта. Данное изобретение также относится к способу борьбы с ожирением у субъекта, который уже начал снижение веса, включающему введение субъекту соединения по изобретению в количестве, эффективном для поддержания потери массы тела субъекта. Настоящее изобретение также относится к способу лечения депрессии у субъекта, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения депрессии у субъекта. Настоящее изобретение также относится к способу лечения тревожного состояния у субъекта, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения тревожного состояния у субъекта. Данное изобретение также относится к способу лечения депрессии и тревожного состояния у субъекта, включающему введение субъекту соединения по изобретению в количестве,эффективном для лечения депрессии и тревожного состояния у субъекта. Данное изобретение также относится к способу лечения основного депрессивного нарушения у субъекта, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения основного депрессивного нарушения у субъекта. Данное изобретение также относится к способу лечения психического депрессивного нарушения у субъекта, включающему введение субъекту соединения по изобретению в количестве,эффективном для лечения психического депрессивного нарушения у субъекта. Данное изобретение также относится к способу лечения навязчивых идей и принужденный состояний у субъекта с навязчивокомпульсивным заболеванием, который включает введение субъекту соединения по изобретению в количестве, эффективном для лечения у субъекта навязчивых идей и принужденных состояний. Данное изобретение также относится к способу лечения панического состояния, включающего или не включающего агорафобию, у субъекта, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения у субъекта панического состояния. Данное изобретение также относится к способу лечения у субъекта социального тревожного состояния, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения у субъекта социального тревожного состояния. Данное изобретение также относится к способу лечения у субъекта обобщенного тревожного состояния, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения у субъекта обобщенного тревожного состояния. Данное изобретение также относится к способу лечения у субъекта посттравматического стрессового состояния, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения у субъекта посттравматического стрессового состояния.- 10009818 Подразумевается, что соединения по данному изобретению будут эффективными для лечения ожирения, включая потерю веса и поддержание потери веса у пациентов, у которых ожирение диагностировано с помощью одного или нескольких следующих измерений: повышенный индекс массы тела, увеличенный охват талии (показатель внутрибрюшного жира), двойной энергетической рентгенодиффракционной абсорбциометрии (DEXA) и трукальной (относящейся к мужскому полу) массы жира. Дополнительно подразумевается, что соединения по изобретению будут эффективны для индуцирования улучшений некоторых факторов, измеренных в приведенных здесь тестах. Подразумевается, что соединения по данному изобретению будут эффективны при лечении нарушений мочевыводящих путей у пациентов,которые имеют позывы к недержанию или смешанное (с доминированием позывов) недержание, что проявляется в числе излишних случаев в неделю, числе излишних мочеиспусканий в день и небольшим объемом при опорожнении мочевого пузыря на одно мочеиспускание. Дополнительно подразумевается,что соединения по изобретению будут эффективными для индуцирования улучшений некоторых факторов, измеренных в приведенных здесь тестах. Настоящее изобретение также относится к способу лечения субъекта, страдающего от биполярных нарушений I и II, шизоаффективного нарушения, познавательных нарушений с подавленным настроением, нарушений личности, бессонницы, повышенной сонливости, нарколепсии, нарушения суточного ритма сна, кошмаров, беспокойного сна или сомнамбулизма. Настоящее изобретение также относится к способу лечения гиперактивного мочевого пузыря с симптомами позывов к недержанию мочи, позывов или частых мочеиспусканий у субъекта, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения у субъекта гиперактивного мочевого пузыря. Данное изобретение также относится к способу облегчения позывов к недержанию мочи у субъекта, страдающего от гиперактивного мочевого пузыря, включающему введение субъекту соединения по изобретению в количестве, эффективном для облегчения позывов к недержанию мочи у субъекта. Данное изобретение дополнительно относится к способу облегчения позывов к мочеиспусканию у субъекта, страдающего от гиперактивного мочевого пузыря, включающему введение субъекту соединения по изобретению в количестве, эффективном для облегчения позывов к мочеиспусканию у субъекта. Кроме того, данное изобретение относится к способу облегчения частых мочеиспусканий у субъекта, страдающего от гиперактивного мочевого пузыря, включающему введение субъекту соединения по изобретению в количестве, эффективном для облегчения частых мочеиспусканий у субъекта. Настоящее изобретение также относится к способу лечения субъекта, страдающего от нарушения мочевыводящих путей, который включает введение субъекту соединения по изобретению в количестве, эффективном для лечения нарушения мочевыводящих путей у субъекта. В некоторых вариантах осуществления нарушение мочевыводящих путей представляет собой недержание мочи, гиперактивный мочевой пузырь, частые мочеиспускания, позывы к мочеиспусканию, частые мочеиспускания, позывы к мочеиспусканию, ноктурию или энурез. Настоящее изобретение относится к способу облегчения симптомов нарушения у субъекта, включающему введение субъекту антагониста МСН 1 в количестве, эффективном для облегчения симптомов, где антагонист МСН 1 представляет собой любое из соединений изобретения. В варианте осуществления изобретения субъект представляет собой позвоночное животное, млекопитающее, человека или относящегося к семейству псовых. В другом варианте осуществления соединение вводят перорально. Еще в одном варианте осуществления соединение вводят в сочетании с пищей. В предпочтительном варианте осуществления предмет изобретения относится к способу лечения следующих показаний: депрессии, тревожного состояния, нарушений питания/массы тела и нарушений мочевыводящих путей. Примерами нарушений питания/массы тела являются ожирение, булимия или нервная булимия. Примеры нарушений мочевыводящих путей включают, но не ограничиваются указанным, недержание мочи, гиперактивный мочевой пузырь, частые мочеиспускания, позывы к мочеиспусканию,ноктурию или энурез. Гиперактивный мочевой пузырь и позывы к мочеиспусканию могут быть связаны или не связаны с доброкачественной гиперплазией простаты. Данное изобретение относится к способу модификации потребления пищи субъектом, который включает введение субъекту соединения по изобретению в количестве, эффективном для уменьшения потребления пищи субъектом. Данное изобретение также относится к способу лечения нарушения питания у субъекта, который включает введение субъекту соединения по изобретению в количестве, эффективном для уменьшения потребления пищи субъектом. В одном варианте осуществления настоящего изобретения нарушение питания представляет собой булимию, ожирение или нервную булимию. В варианте осуществления изобретения субъект представляет собой позвоночное животное, млекопитающее, человека или относящегося к семейству псовых. В следующем варианте осуществления соединение вводят в сочетании с пищей. Настоящее изобретение дополнительно относится к способу снижения массы тела у субъекта, который включает введение субъекту соединения по изобретению в количестве, эффективном для снижения массы тела у субъекта. Настоящее изобретение также относится к способу лечения субъекта,страдающего от депрессии, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения депрессии у субъекта. Настоящее изобретение кроме того относится к способу лечения субъекта, страдающего от тревожного состояния, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения тревожного состояния у субъекта.- 11009818 Настоящее изобретение также относится к способу лечения субъекта, страдающего от депрессии и тревожного состояния, включающему введение субъекту соединения по изобретению в количестве, эффективном для лечения депрессии и тревожного состояния у субъекта. Настоящее изобретение также относится к способу лечения субъекта, страдающего от основного депрессивного нарушения, психического депрессивного нарушения, биполярных нарушений I и II, шизоаффективного нарушения, познавательных нарушений с подавленным настроением, нарушений личности, бессонницы, повышенной сонливости, нарколепсии, нарушения суточного ритма сна, кошмаров,беспокойного сна, сомнамбулизма, навязчиво-компульсивного заболевания, панического состояния с наличием или без агорафобии, посттравматического стрессового нарушения, социально-тревожного состояния, социальной фобии и генерализованного тревожного состояния. Настоящее изобретение также относится к способу лечения субъекта, страдающего от нарушения мочевыводящих путей, который включает введение субъекту соединения по изобретению в количестве, эффективном для лечения нарушения мочевыводящих путей у субъекта. В некоторых вариантах осуществления нарушения мочевыводящих путей представляют собой недержание мочи, гиперактивный мочевой пузырь, позывы с недержанием мочи, частое мочеиспускание, безотлагательные позывы к мочеиспусканию, ноктурию или энурез. Далее настоящее изобретение относится к соединению, имеющему структуру где каждый R1 независимо представляет собой водород; -F; -Cl; -Br; -I; -CN; -NO2; линейный или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил; линейный или разветвленный С 2-С 7 алкенил; С 3-С 7 циклоалкил или С 5-С 7 циклоалкенил; арил; гетероарил; -N(R5)2; -(CH2)mOR5; -COR5; -CO2R5;-OCOR5; -CON(R5)2; -N(R5)COR5; -N(R5)CON(R5)2; -OCON(R5)2 или -N(R5)CO2R5; где R2 и R3 независимо представляют собой водород; -F; -Cl; -Br; -I; -CN; -(CH2)mOR5; -(CH2)mSR5; линейный или разветвленный С 1-С 7 алкил, монофторалкил, полифторалкил; арил или гетероарил, где арил или гетероарил может быть замещен одним или несколькими R1; или где R2 и R3 вместе могут представлять собой -(СН 2)р-; где R4 представляет собой водород; линейный или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, C3-C6 циклоалкил, -N(R5)2 или -(CH2)mOR5; где каждый R5 независимо представляет собой водород; арил; гетероарил или линейный или разветвленный C1-C7 алкил, где алкил может быть замещен арилом или гетероарилом; где каждый R6 независимо представляет собой водород; линейный или разветвленный C1-C7 алкил; где каждый R7 независимо представляет собой водород; фенил или линейный или разветвленныйC1-C7 алкил, где алкил может быть замещен фенилом; где R8 представляет собой водород или линейный или разветвленный C1-C7 алкил; где R4 и R8 вместе могут представлять собой -(СН 2)r-; где каждый m независимо представляет собой целое число от 0 до 5 включительно; где n представляет собой целое число от 1 до 5 включительно; где р представляет собой целое число от 2 до 7 включительно; где q представляет собой целое число от 0 до 2 включительно; где каждый X независимо представляет собой СН или N; где Z представляет собой СО; SO2 или может отсутствовать; или его фармацевтически приемлемой соли. В одном варианте осуществления изобретения соединение имеет структуру В другом варианте осуществления изобретения соединение имеет структуру где каждый R1 независимо представляет собой водород; -F; -Cl; -Br; -I; -CN; -NO2; линейный или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил; линейный или разветвленный С 2-С 7 алкенил; С 3-С 7 циклоалкил или С 5-С 7 циклоалкенил; арил; гетероарил; -N(R5)2; -(CH2)mOR5; -COR5; -CO2R5;-OCOR5; -CON(R5)2; -N(R5)COR5; -N(R5)CON(R5)2; -OCON(R5)2 или -N(R5)CO2R5; где R2 и R3 независимо представляют собой водород; -F; -Cl; -Br; -l; -CN; -(CH2)mOR5; -(CH2)mSR5; линейный или разветвленный С 1-С 7 алкил, монофторалкил, полифторалкил; арил или гетероарил, где арил или гетероарил может быть замещен одним или несколькими R1; или где R2 и R3 вместе могут представлять собой -(СН 2)р-; где R4 представляет собой линейный или разветвленный C1-C7 алкил, монофторалкил или полифторалкил, C3-C6 циклоалкил, C1-C7 алкил-С 3-С 6 циклоалкил; -N(R5)2 или -(CH2)mOR5; где каждый R5 независимо представляет собой водород; арил; гетероарил или линейный или разветвленный С 1-С 7 алкил, где алкил может быть замещен арилом или гетероарилом; где каждый R6 независимо представляет собой водород; линейный или разветвленный С 3-С 7 алкил; где каждый R7 независимо представляет собой водород; фенил или линейный или разветвленный С 1-С 7 алкил, где алкил может быть замещен фенилом; где каждый m независимо представляет собой целое число от 0 до 5 включительно; где n представляет собой целое число от 1 до 5 включительно; где р представляет собой целое число от 2 до 7 включительно; где q представляет собой целое число от 0 до 2 включительно; где X представляет собой СН или N; или его фармацевтически приемлемая соль. В подкласс изобретения входят соединения, где каждый R1 независимо представляет собой водород; линейный или разветвленный C1-C7 алкил; -F; -Cl; -Br; -I; -CN; -NO2; линейный или разветвленный-N(R5)CON(R5)2; где R2 и R3 независимо представляют собой водород; -F; -Cl; -Br; -I; -CN; -(CH2)mSR5; линейный или разветвленный C1-C7 алкил; арил или гетероарил, где арил или гетероарил может быть замещен одним или несколькими R1; или где R2 и R3 вместе могут представлять собой -(СН 2)р-; где R4 представляет собой линейный или разветвленный C1-C7 алкил; С 3-С 6 циклоалкил; -N(R5)2 или-(CH2)mOR5; где каждый R5 независимо представляет собой водород или линейный или разветвленный C1 С 3 алкил, где алкил может быть замещен фенилом; где m равно от 0 до 3; где n равно от 1 до 3; где р представляет собой целое число от 2 до 5 включительно; где q равно 0; где X представляет собой СН. В подклассе данного изобретения соединения имеют формулу В одном варианте осуществления изобретения соединения имеют следующую структуру: В одном варианте осуществления изобретения каждый R5 независимо представляет собой водород или линейный или разветвленный C1-C3 алкил,где алкил может быть замещен фенилом; R7 независимо представляет собой водород или линейный или разветвленный С 1-С 7 алкил; иR4 представляет собой линейный или разветвленный С 1-С 7 алкил. В одном варианте осуществления изобретения каждый R1 независимо представляет собой водород;-F; -Cl; -Br; -I или линейный или разветвленный С 1-С 7 алкил; и где R2 представляет собой водород или линейный или разветвленный С 1-С 7 алкил. В одном варианте осуществления n = 2. В одном варианте осуществления изобретения R1 представляет собой водород; -F; -Cl; -Br; -I или линейный или разветвленный С 1-С 7 алкил; иR2 представляет собой водород или линейный или разветвленный C1-C7 алкил. В одном варианте осуществления изобретения R2 представляет собой водород. В одном варианте осуществления R3 представляет собой ОН. Подкласс данного изобретения представляют собой соединения формулы В одном варианте осуществления изобретения R4 представляет собой C3-С 6 циклоалкил. В одном варианте осуществления данного изобретения каждый из R2 и R3 независимо представляет собой водород; -F; -Br или линейный или разветвленный С 1-С 7 алкил. В одном варианте осуществления данного изобретения R2 и R3 независимо представляют собой водород или линейный или разветвленный С 1-С 7 алкил. В одном варианте осуществления данного изобретения R2 и R3 независимо представляют собой водород; -F или -Br. В одном варианте осуществления данного изобретения R2 и R3 вместе представляют собой -(СН 2)р-. В одном варианте осуществления данного изобретения соединение имеет структуру В одном варианте осуществления изобретения R5 и R7 независимо представляют собой водород или линейный или разветвленный C1-C7 алкил. В одном варианте осуществления изобретения каждый R1 независимо представляет собой водород;-F; -Cl; -Br; -I или линейный или разветвленный C1-C7 алкил; иR2 представляет собой водород или линейный или разветвленный C1-C7 алкил. В одном варианте осуществления изобретения R4 представляет собой линейный или разветвленный С 1-С 7 алкил. В одном варианте осуществления изобретения соединение имеет следующее строение: В одном варианте осуществления изобретения соединение имеет следующее строение: В одном варианте осуществления R2 представляет собой водород или ОН, где R3 представляет собой фенил, замещенный одним или несколькими фрагментами R1; и q = 0. В одном варианте осуществления каждый R5 независимо представляет собой водород или линейный или разветвленный С 1-C3 алкил, где алкил может быть замещен фенилом фенилом;R7 независимо представляет собой водород или линейный или разветвленный С 1-С 7 алкил; иR4 представляет собой линейный или разветвленный C1-C7 алкил. В одном варианте осуществления каждый R1 независимо представляет собой водород; -F; -Cl; -Br; -I или линейный или разветвленный С 1-С 7 алкил. В одном варианте осуществления X представляет собой N. В одном варианте осуществления X представляет собой CR1. В одном варианте осуществления R2 представляет собой ОН. В одном варианте осуществления соединение имеет следующую структуру: В одном варианте осуществления R3 представляет собой фенил, замещенный одним или несколькими фрагментами R1; и q = 0. В одном варианте осуществления R5 и R7 независимо представляют собой водород или линейный или разветвленный С 1-С 7 алкил; иR4 представляет собой линейный или разветвленный С 1-С 7 алкил. В одном варианте осуществления R2 представляет собой водород; линейный или разветвленный С 1 С 7 алкил или -ОН. В одном варианте осуществления соединение является энантиомерно чистым. В одном варианте осуществления соединение является диастереомерно чистым. В одном варианте осуществления соединение является энантиомерно чистым и диастереомерно чистым. Настоящее изобретение также относится к фармацевтической композиции, включающей терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый носитель. Далее настоящее изобретение относится к фармацевтической композиции, полученной смешиванием соединения по настоящему изобретению и фармацевтически приемлемого носителя. Настоящее изобретение также относится к способу лечения субъекта, страдающего от нарушения,опосредованного МСН 1 рецептором, включающему введение субъекту терапевтически эффективного количества соединения по настоящему изобретению. В одном варианте осуществления терапевтически эффективное количество составляет между примерно 0,03 и примерно 300 мг. В одном варианте осуществления нарушение представляет собой депрессию, тревожное состояние,ожирение и недержание мочи. Настоящее изобретение также относится к способу лечения субъекта, страдающего от нарушения,выбранного из группы, состоящей из депрессии, тревожного состояния, недержания мочи и ожирения,включающему введение субъекту терапевтически эффективного количества соединения по настоящему изобретению.- 15009818 Настоящее изобретение будет более понятно из следующих экспериментальных подробностей. Однако специалисту в данной области будет ясно понятно что обсуждаемые здесь конкретные способы и результаты являются только иллюстрацией изобретения, как описано более подробно в следующей далее формуле изобретения. Экспериментальный раздел 1. Методы синтеза для примеров. Общие способы. Все реакции (за исключением проводившихся параллельным синтезом совокупностей реакций) проводили в атмосфере аргона и реагенты, в чистом виде или в подходящих растворителях, переносили в реакционные сосуды с помощью шприца или методом канюлирования. Параллельный синтез совокупности реакций проводили в ампулах (без инертной атмосферы) с использованием нагревающих встряхивающих устройств J-KEM (Saint Louis, МО). Безводные растворители получены от компании Aldrich Chemical Company использовали в том виде, как они были получены. Названия описанным соединениям давали с использованием программы ACD/Name (version 4,0, Advanced Chemistry Development Inc., Toronto, Ontario, M5H2L3, Canada). 1H ЯМР спектры регистрировали на Bruker Avance ЯМР спектрометре с рабочей частотой 400 МГц относительно тетраметилсилана в качестве внутреннего стандарта. Расщепленные сигналы обозначали следующим образом: с = синглет; д = дублет; т = триплет; кв = квартет; квинтет; секстет; септет; ушир. = уширенный сигнал; м = мультиплет. Элементный анализ выполнен Robertson Microlit Laboratories, Inc. Масс-спектры получены на спектрометре Platform II (Fisons) или Quattro Micro (Micromass) методом ионизации электрораспылением (ESMS) и представлены МН+ ионы. Тонкослойную хроматографию (ТСХ) проводили на стеклянных пластинах, предварительно покрытых силикагелем 60 F254 (0,25 мм, ЕМ Separations Tech.). Препаративную тонкослойную хроматографию проводили на стеклянных пластинах, предварительно покрытых силикагелем GF (2 мм, Analtech). Колоночную флэш-хроматографию проводили на силикагеле Merck 60 (230-400 меш). Температуры плавления (т.пл.) определяли в открытом капилляре на устройстве Mel-Temp и не корректировали. Описанные в экспериментальном разделе примеры являются только иллюстрацией способов, использованных для синтеза антагонистов МСН 1. Более подробное описание каждой реакции представлено в методиках, приведенных после схем реакций. Дополнительные соединения по изобретению могут быть получены с помощью приведенных в данном описании общих синтетических способов или путем введения изменений в данные методы. Определения переменных, указанные на приведенных ниже схемах,приведены в разделе Краткое изложение сущности изобретения. Например, переменная R4 может представлять собой линейный или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, С 3-C6 циклоалкил, C1-C7 алкил-C3-С 6 циклоалкил; -N(R5)2 или -(CH2)mOR5. Кроме того для ясности, число фрагментов (R1) в фениле было ограничено до одного. Схема 1(d) Хлорангидрид кислоты или карбамоилхлорид или хлорформиат/основание/ТГФ/0 С. затем комнатная температура, 2-3 ч,(е) 4 М HCl в 1,4-диоксане/комнатная температура, 1 ч или ТФУК/CH2Cl2/комнатная температура 12 ч.(a) NaI/K2CO3/ДМФ/80-100 С в течение ночи или диизопропилэтиламин/Bu4NI/диоксан/100 С, 3 ч,(b) Хлорангидрид кислоты/основание/CH2Cl2/комнатная температура, 2 ч,- 17009818(а) Фталимид/DEAD/PPb3/ТГФ/комнатная температура в течение ночи,(b) NaI/K2CO3/ДМФ/80-100 С в течение ночи или диизопропилэтиламин/Bu4NI/диоксан/нагревание при кипении с обратным холодильником в течение ночи,(с) Гидразингидрат/EtOH/нагревание при кипении с обратным холодильником, 4 ч,(d) Хлорангидрид кислоты или карбамоилхлорид или хлорформиат/основание/ТГФ/0 С, затем комнатная температура, 2-3 ч,(e) Кислота/конденсирующий реагент/ДМФ/CH2Cl2/комнатная температура в течение ночи. Схема 6(а) Хлорангидрид кислоты или карбамоилхлорид или хлорформиат/основание/CH2Cl2 или ТГФ/0 С,затем комнатная температура, 12 ч. Схема 9(а) Общие способы конденсации представляют собой следующее: 1,1'-карбонилдииммидазол/CH2Cl2/комнатная температура в течение ночи,или SOCl2/Et3N/CH2Cl2/комнатная температура в течение ночи,или DCC/HOBt/Основание/CH2Cl2/комнатная температура в течение ночи,или EDCl/DMAP/CH2Cl2/комнатная температура в течение ночи,или EDCl/HOBt/Et3N/CH2Cl2/комнатная температура в течение ночи,или изобутилхлорформиат/NMP/CH2Cl2/-20 С в течение 1 ч. Схема 13(a) DPPA/Et3N/BnOH/толуол,(b) K2CO3/PdCl2dppf/ДМФ/80 С,(с) 10% Pd/C/H2/EtOAc/комнатная температура, 24-72 ч,(d) 4M HCl в 1,4-диоксане/комнатная температура, 1 ч или ТФУК/CH2Cl2/комнатная температура, 1(е) Изобутирил хлорид/Et3N/ТГФ/0 С, затем комнатная температура 2-3 ч.(а) KOH/50% EtOH (водн.)/кипение с обратным холодильником в течение ночи. Схема 19 Общие способы синтеза карбоновых кислот См., например, Brain E.G.; Doyle F.P.; Hardy K.; J.Chem.Soc. [JCSOA9] 1962, 1445. Схема 20 Общие способы синтеза карбоновых кислотSemmelhack, M.F.; Ann N.Y. Acad Sci [ANYAA9] 1977, 295, 36. Схема 21 Синтез производных дифенилалкилуксусной кислотыBockmuhl, M.; Ehrhart, G.; Justus Liebigs Ann Chem [JLACBF] 1948, 561, 52. Общая методика синтеза боковой пиперидиновой цепи (схема 1) трет-Бутил-4-[(трифторметил)сульфонил]окси-3,6-дигидро-1(2 Н)-пиридинкарбоксилат. н-Бутиллитий (17,6 мл, 44,2 ммоль, 2,5 М в гексане) добавляли к раствору диизопропиламина (96,2 мл, 44,2 ммоль) в 40 мл безводного ТГФ при 0 С и полученную смесь перемешивали в течение 20 мин. Реакционную смесь охлаждали до -78 С и добавляли по каплям к реакционной смеси трет-бутил-4-оксо-1 пиперидинкарбоксилат (Aldrich Chemical Company, 40,0 ммоль) в ТГФ (40 мл), затем смесь перемешивали в течение 30 мин. Tf2NPh (42,0 ммоль, 15,0 г) в ТГФ (40 мл) добавляли по каплям к реакционной смеси и перемешивали при 0 С в течение ночи. Реакционную смесь концентрировали в вакууме, повторно растворяли в смеси гексан:EtOAc (9:1), пропускали через слой оксида алюминия и слой оксида алюминия промывали смесью гексан:EtOAc (9:1). Объединенные экстракты концентрировали, получая 16,5 г целевого продукта, который был загрязнен некоторым количеством исходного Tf2NPh. трет-Бутил-4-(3-аминофенил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилат. Дегазированную смесь 2 М водного раствора Na2CO3 (4,2 мл), трет-бутил-4-[(трифторметил)сульфонил]окси-3,6-дигидро-1(2 Н)пиридинкарбоксилат (0,500 г, 1,51 ммоль), полусульфат 3-аминофенилбороновой кислоты (0,393 г, 2,11 ммоль), хлорид лития (0,191 г, 4,50 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,080 г, 0,075 ммоль) в диметоксиэтане (5 мл) нагревали при температуре кипения с обратным холодильником в тече- 22009818 ние 3 ч в инертной атмосфере. Органический слой охлажденной реакционной смеси отделяли и водный слой промывали этилацетатом (350 мл). Объединенный органический раствор сушили и концентрировали в вакууме. Неочищенный продукт хроматографировали (силикагель, гексаны:EtOAc:дихлорметан = 6:1:1 с добавлением 1% изопропиламина), получая 0,330 г целевого продукта с 81% выходом.ESMS m/e: 275,2 (М+Н)+. трет-Бутил-4-[3-(амино)фенил]-1-пиперидинкарбоксилат. Смесь 3,10 г трет-бутил-4-(3 аминофенил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилата (11,3 ммоль) и 1,0 г 10% Pd/C в 200 мл этанола гидрировали при комнатной температуре с использованием водорода из баллона метода в течение 2 дней. Реакционную смесь фильтровали через целит и промывали этанолом. Объединенные этанольные экстракты концентрировали в вакууме и остаток хроматографировали на силикагеле (дихлорметан:метанол:изопропиламин = 95:5:1), получая 2,63 г целевого продукта (84%).ESMS m/e: 277,2 (М+Н)+. трет-Бутил-4-[3-(ацетиламино)фенил]-1-пиперидинкарбоксилат. В раствор 14,6 г (52,6 ммоль) третбутил-4-[3-(амино)фенил]-1-пиперидинкарбоксилата и 14,7 мл (105 ммоль) триэтиламина в 120 мл ТГФ при 0 С медленно добавляли 4,5 мл (63,1 ммоль) хлористого ацетила. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали в вакууме. Остаток растворяли в CH2Cl2 и промывали H2O, а затем насыщенным раствором соли. Органический слой сушили над MgSO4 и концентрировали в вакууме, получая 16,6 г (52,1 ммоль, 99%) целевого продукта. 1N-[3-(4-Пиперидил)фенил]ацетамид. Раствор HCl в диоксане (4 н., 5 мл) добавляли к трет-бутил-4[3-(ацетиламино)фенил]-1-пиперидинкарбоксилату (660 мг) в безводнном дихлорметане (15 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи и концентрировали в вакууме,получая HCl соль целевого продукта (550 мг). 1ESMS m/e: 347,2 (М+Н)+. Данные промежуточные соединения были синтезированы, как проиллюстрировано, с использованием вышеуказанных способов. 2-Метил-N-[3-(4-пиперидинил)фенил]пропанамид. В перемешиваемый раствор 2,20 г (6,50 ммоль) трет-бутил-4-[3-(изобутириламино)фенил]-1-пиперидинкарбоксилата в 100 мл 1,4-диоксана при 0 С барботировали газообразный HCl в течение 10 мин. Реакционную смесь оставляли нагреваться до комнатной температуры и барботаж газообразного HCl продолжали в течение 1 ч. Растворитель удаляли в вакууме, остаток растворяли в 50 мл воды и подщелачивали до pH 13 добавлением шариков KOH. Водный раствор экстрагировали 380 мл дихлорметаном. Объединенные органические экстракты сушили(MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель, 9:1:0,1 = дихлорметан:метанол:изопропиламин), получая 0,700 г (46% выход) целевого продукта:ESMS m/e: 247,2 (М+Н)+. С использованием описанных выше методов синтеза были дополнительно синтезированы следующие промежуточные соединения. трет-Бутил-4-[3-(пропиониламино)фенил]-1-пиперидинкарбоксилат: ESMS m/e: 333,4 (М+Н)+;N-[4-(4-пиперидинил)фенил]бутанамид: ESMS m/e: 247,2 (М+Н)+. Общая методика синтеза 4-арилпиперидинов (схема 2) трет-Бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилат. В круглодонную колбу емкостью 50 мл загружали бис(пинаколато)дибор (422 мг, 1,66 ммоль),KOAc (444 мг, 4,53 ммоль), PdCl2dppf (37,0 мг, 3,00 мол.%) и dppf (25,0 мг, 3,00 мол.%) и добавляли раствор трет-бутил-4-[(трифторметил)сульфонил]окси-3,6-дигидро-1(2 Н)-пиридинкарбоксилата (500 мг,1,51 ммоль) в 1,4-диоксане (10,0 мл) при комнатной температуре в атмосфере аргона. Смесь нагревали- 23009818 при 80 С в течение ночи. После охлаждения до комнатной температуры, смесь фильтровали через целит и целит промывали EtOAc (320 мл). Фильтраты концентрировали в вакууме. Полученный остаток растворяли в EtOAc и промывали H2O и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией (1:9, EtOAc:гексан),получая трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилат (355 мг, 76%): 1N-(3-Бром-4-метилфенил)-2-метилпропанамид. К раствору 1,0 г (5,40 ммоль) 3-бром-4-метиланилина и 0,91 мл (6,50 ммоль) триэтиламина в 10 мл ТГФ при 0 С медленно добавляли 0,68 мл (6,50 ммоль) 2-метилпропаноилхлорида. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали в вакууме. Остаток растворяли в CH2Cl2 и промывали H2O, а затем насыщенным раствором соли. Органический слой сушили над MgSO4 и концентрировали в вакууме, получая 1,37 г (5,35 ммоль, 99%) целевого продукта:ESMS m/e: 255,9 (М+Н)+. С использованием описанных выше способов дополнительно получали следующие промежуточные соединения.N-(6-Бром-2-пиридинил)-2-метилпропанамид: ESMS m/e: 242,8 (М+Н)+. трет-Бутил-4-[5-(изобутириламино)-2-метилфенил]-3,6-дигидро-1(2 Н)-пиридинкарбоксилат. В круглодонную колбу емкостью 50 мл, содержащую трет-бутил-4-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилат (500 мг, 1,62 ммоль), K2CO3 (670 мг, 4,86 ммоль) и PdCl2dppf (0,190 ммоль, 155 мг) добавляли раствор N-(3-бром-4-метилфенил)-2 метилпропанамида (415 мг, 1,62 ммоль) в ДМФ (10,0 мл) при комнатной температуре в атмосфере аргона. Смесь нагревали при 80 С в атмосфере аргона в течение ночи. После охлаждения до комнатной температуры, смесь фильтровали через целит и целит промывали EtOAc (320 мл). Фильтраты промывалиH2O (20 мл), насыщенным раствором соли (20 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (20% EtOAc/гексан), получая третбутил-4-[5-(изобутириламино)-2-метилфенил]-3,6-дигидро-1(2 Н)-пиридинкарбоксилат (360 мг, 62%):ESMS m/е: 303,0 (М-56+Н)+. трет-Бутил-4-[5-(изобутириламино)-2-метилфенил]-1-пиперидинкарбоксилат. Смесь трет-бутил-4[5-(изобутириламино)-2-метилфенил]-3,6-дигидро-1(2 Н)-пиридинкарбоксилата (335 мг, 0,93 ммоль) и 10% Pd/C (35,0 мг) в EtOH (20,0 мл) гидрировали при комнатной температуре в течение ночи с использованием водорода из баллона. Реакционную смесь фильтровали через целит и промывали этанолом (310 мл). Объединенные экстракты концентрировали в вакууме, получая трет-бутил-4-[5-(изобутириламино)2-метилфенил]-1-пиперидинкарбоксилат (335 мг, 100%):ESMS m/e: 361,4 (М+Н)+. 2-Метил-N-[4-метил-3-(4-пиперидинил)фенил]пропанамид. К раствору трет-бутил-4-[5(изобутириламино)-2-метилфенил]-1-пиперидинкарбоксилата (335 мг, 0,930 ммоль) в CH2Cl2 (10,0 мл) добавляли ТФУК (10,0 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 2 ч и концентрировали в вакууме. Остатки растворяли в 20 мл смеси CHCl3/i-PrOH (3:1) и подщелачивали 5%-ным раствором KOH (10 мл). Водный слой экстрагировали смесью CHCl3/i-PrOH (3:1, 310 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над MgSO4,фильтровали и концентрировали в вакууме, получая 2-метил-N-[4-метил-3-(4-пиперидинил)фенил]пропанамид (190 мг, 78%).ESMS m/e: 261,0 (M+H)+. С использованием описанных выше способов дополнительно получали следующие промежуточные соединения. 2-Метил-N-[2-метил-3-(4-пиперидинил)фенил]пропанамид, ESMS m/e: 261,3 (М+Н)+. 2-Метил-N-[6-(4-пиперидинил)-2-пиридинил]пропанамид, ESMS m/e: 248,1 (М+Н)+. Метод В (схема 2). трет-Бутил-4-(2-метокси-5-нитрофенил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилат. В круглодонную колбу емкостью 250 мл, содержащую трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6 дигидро-1(2 Н)-пиридинкарбоксилат (3,09 г, 10,0 ммоль), K2CO3 (4,14 г, 30,0 ммоль) и PdCl2dppf (419 мг) добавляли раствор 2-бром-4-нитроанизола (2,30 г, 10 ммоль) в ДМФ (10,0 мл) при комнатной температуре в атмосфере аргона. Смесь нагревали при 80 С в атмосфере аргона в течение ночи. После охлаждения до комнатной температуры, к смеси добавляли воду (500 мл). Водный слой экстрагировали EtOAc (2200 мл) и объединенные органические экстракты сушили над K2CO3, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (20% EtOAc/гексан), получая трет-бутил- 24009818 4-(2-метокси-5-нитрофенил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилат (1,51 г, 46%):ESMS m/e: 334,9 (М+Н)+. трет-Бутил-4-[5-амино-2-метоксифенил]-1-пиперидинкарбоксилат. Раствор трет-бутил-4-(2-метокси-5-нитрофенил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилата (1,30 г, 3,90 ммоль) и 10% Pd/C (200,0 мг) в смеси MeOH:EtOAc (1:4, 100 мл) гидрировали при комнатной температуре в течение 72 ч, используя водород из баллона. Реакционную смесь фильтровали через целит и промывали этанолом (3100 мл). Объединенные органические фильтраты концентрировали в вакууме, получая трет-бутил-4-[5-амино-2 метоксифенил]-1-пиперидинкарбоксилат (1,00 г, 84%):ESMS m/e: 307,2 (М+Н)+. трет-Бутил-4-[5-(изобутириламино)-2-метоксифенил]-1-пиперидинкарбоксилат: 1 Н ЯМР (400 МГц, CDCl3)7,39 (дд, 1 Н, J = 8,8, 2,8 Гц), 7,25 (ушир., 1 Н), 6,80 (д, 1 Н, J = 8,4 Гц),4,23 (ушир., 2 Н), 3,80 (с, 3H), 3,07 (тт, 1 Н, J = 11,8, 4,1 Гц), 2,89-2,73 (м, 2 Н), 2,49 (септет, 1 Н, J = 6,7 Гц),1,77 (д, 2 Н, J = 11,6 Гц), 1,64-1,52 (м, 3H), 1,48 (с, 9 Н), 1,25 (д, 6 Н, J = 6,8 Гц). С использованием описанных выше способов дополнительно получали следующие промежуточные соединения.ESMS m/e: 263,4 (М+Н)+. Общая методика синтеза N-(н-аминоалкил)пиперидина (схема 3) Метод А (схема 3). трет-Бутил-3-бромпропилкарбамат. Раствор гидробромида 3-бромпропиламина (10,9 г, 49,8 ммоль),ВОС 2 О (11,4 г, 52,3 ммоль) и K2CO3 (20,6 г, 149,4 ммоль) в этаноле (100 мл) перемешивали при комнатной температуре в течение ночи. Выпавшие в осадок соли удаляли фильтрованием и фильтрат концентрировали в вакууме. Остаток растворяли в дихлорметане и промывали водой, а затем насыщенным раствором соли. Органический слой сушили над MgSO4 и концентрировали в вакууме, получая 11,2 г (46,9 ммоль, 94%) целевого продукта: 1(1,10 г, 8,9 ммоль), диизопропилэтиламина (1,50 мл) и несколько кристаллов KI в диоксане (20 мл) нагревали при температуре кипения с обратным холодильником в течение 2 дней. Выпавшие в осадок соли удаляли фильтрованием, фильтрат концентрировали в вакууме и неочищенный продукт хроматографировали на силикагеле, получая целевой продукт (340 мг; 43%):N-3-[1-(3-Аминопропил)-4-пиперидинил]фенилацетамид. Трифторуксусную кислоту (1,0 мл) добавляли к раствору трет-бутил-3-4-[3-(ацетиламино)фенил]-1-пиперидинилпропилкарбамата (340 мг) в безводном дихлорметане (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь подщелачивали до pH 12 добавлением 10%-ного водного раствора KOH и затем дихлорметан удаляли в вакууме. Водный слой замораживали и лиофилизовали, получая твердое вещество, которое экстрагировали метанолом. Удаление растворителя давало целевой продукт (120 мг) в виде масла: 1H ЯМР (400 МГц, CD3OD)7,48 (м, 1 Н), 7,38 (д, 1 Н, J = 7,7 Гц), 7,24 (т, 1 Н, J = 7,7 Гц), 6,99 (д, 1 Н,J= 7,7 Гц), 3,11 (д, 2 Н, J = 11,6 Гц), 2,84 (т, 2 Н, J = 6,6 Гц), 2,59-2,52 (м, 1 Н), 2,50 (т, 2 Н, J = 6,6 Гц), 2,182,09 (м, 2 Н), 2,13 (с, 3H), 1,90-1,72 (м, 6 Н). С использованием описанных выше методов синтезировали следующие дополнительные промежуточные соединения.N-5-[1-(3-Аминопропил)-4-пиперидинил]-2-фторфенилбутанамид. ESMS m/e: 322,3 (М+Н)+. Метод В (схема 3). Стадия 1. Смесь пиперидина 1 (1,00 экв., 0,0226 ммоль), N-(н-бромалкил)фталимида (1,50 экв.,0,0338 ммоль), Bu4NI (200 мг) и диизопропилэтиламина (5,00 экв., 0,113 ммоль) в диоксане (200 мл) нагревали при 99 С в течение 24 ч. Контроль за ходом реакции осуществляли с помощью ТСХ (95:5,CH2Cl2:метанол). При необходимости дополнительно добавляли 0,0113 ммоль подходящего бромалкилфталимида к реакционной смеси и нагревание продолжали дополнительно в течение 48 ч. Реакционную смесь охлаждали до комнатной температуры, соль аммония отфильтровывали, растворитель удаляли при пониженном давлении. Неочищенный продукт хроматографировали (силикагель), получая целевой N-(нфталимидоалкил)пиперидин 2. Стадия 2. Снятие защитной группы в N-(н-фталимидоалкил)пиперидине со стадии 1 проводили нагреванием раствора фталимидзащищенного амина 2 с избытком гидразингидрата (10 экв.) в этаноле (0,51,0 М) при 90 С в течение 4 ч. Реакционную смесь контролировали методом ТСХ до окончания реакции. По завершении реакции смесь охлаждали до комнатной температуры, нерастворимые побочные продукты удаляли фильтрованием через целит и фильтрат концентрировали в вакууме. Неочищенный продукт хроматографировали (дихлорметан-метанол-изопропиламин), получая целевой N-(н-аминоалкил)пиперидин 3. С использованием описанных выше методов, синтезировали следующие дополнительные промежуточные соединения.N-3-[1-(2-Аминоэтил)-4-пиперидинил]фенил-2-метилпропанамид. Получен в соответствии со стадией 2 метода В (схема 3) с использованием N-(3-1-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]4-пиперидинилфенил)-2-метилпропанамида и гидразингидрата; ESMS m/e: 290,2 (М+Н)+. С использованием описанных выше методов синтезировали следующие дополнительные промежуточные соединения.N-3-[1-(3-Аминопропил)-4-пиперидинил]фенил-3,3-диметилбутанамид: ESMS m/e: 332,3 (М+Н)+. С использованием описанных выше методов, синтезировали следующие дополнительные промежуточные соединения.N-5-[1-(3-Аминопропил)-4-пиперидинил]-2-гидроксифенил-2-метилпропанамид: 1 Н ЯМР (400 МГц, CD3OD)8,12-8,08 (м, 1 Н), 7,70-7,66 (м, 2 Н), 7,44 (д, 1 Н, J = 2,2 Гц), 2,79-2,55 (м, 3H), 2,39-2,28 (м,3H), 2,26 (д, 2 Н, J = 11,6 Гц), 1,98 (дт, 2 Н, J = 12, 2,5 Гц), 1,74-1,53 (м, 6 Н), 1,11 (д, 6 Н, J = 6,8 Гц). Общая методика для схемы 4 Стадия 1.N-(3-1-[(3R)-3-Гидрокси-3-фенилпропил]-4-пиперидинилфенил)-2-метилпропанамид. В круглодонную колбу емкостью 25 мл добавляли при комнатной температуре 3-хлор-1-фенил-1-пропанол (0,545 г, 3,19 ммоль, 99% ее, Aldrich Chemical Co.), 2-метил-N-[3-(4-пиперидинил)фенил]пропанамид (0,748 г,3,04 ммоль), карбонат калия (0,420 г, 3,04 ммоль), йодид натрия (0,684 г, 4,56 ммоль) и ДМФ (6,0 мл). После перемешивания при 100 С в течение 3 ч данные ТСХ показали, что реакция завершилась. Реакционную смесь охлаждали до комнатной температуры и выливали в воду (50 мл) и водный слой экстрагировали хлористым метиленом (320 мл). Объединенные органические экстракты промывали насыщенным раствором соли (20 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией (1:1 = гексан:этилацетат с добавлением 1% изопропиламида), получая целевой продукт (1,09 г, 94%) в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3)8,10 (с, 1 Н), 7,46-7,35 (м, 6 Н), 7,27 (м, 2 Н), 6,98 (видимый д, 1 Н, J = 7,6 Гц), 5,02 (видимый дд, 1 Н, J = 4,4, 8,1 Гц), 3,18 (видимый дд, 2 Н, J = 2,5, 12,5 Гц), 2,74 (м, 2 Н), 2,50 (м,2 Н), 2,30-2,10 (м, 6 Н), 1,80 (м, 2 Н), 1,25 (д, 6 Н, J = 7,1 Гц); ESMS m/e: 381,2 (М+Н)+. Стадия 2. См. общие условия конденсации на схемах 8-10. Общая методика для схемы 5 Стадия 1. 2-[(1S)-3-Хлор-1-фенилпропил]-1 Н-изоиндол-1,3(2 Н)-дион. Получен в соответствии с общим способом, описанным Srebnik М.; Ramachandran P.V.; Brown, H.C. J.Org.Chem., 1988, 53, 2916-2920. Смесь фталимида (0,147 г, 1,0 ммоль), (R)-(+)-3-хлор-1-фенил-1-пропанола (0,171 г, 1,0 ммоль), трифенилфосфина (0,262 г, 1,0 ммоль) и диэтилазодикарбоксилата (0,174 г, 1,0 ммоль) в 5,0 мл ТГФ перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь концентрировали в вакууме. Остаток промывали пентаном (350 мл) и объединенные пентановые экстракты концентрировали и хроматографировали (силикагель, гексаны:EtOAc = 8:1 в качестве элюента), получая целевой продукт (0,121 г, 50%) в виде желтого твердого вещества: 1 Н ЯМР (400 МГц, CD3OD)7,82 (видимый дд, 2 Н, J = 2,9 Гц), 7,70 (видимый дд, 2 Н, J = 2,9 Гц),7,56 (м, 2 Н), 7,39-7, 27 (м, 3H), 5,64 (видимый дд, 1 Н, J = 7,0, 9,2 Гц), 3,57 (м, 2 Н), 3,05 (м, 1 Н), 2,82 (септет, 1 Н, J = 7,0 Гц);N-(3-1-[(3S)-3-(1,3-Диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)-3-фенилпропил]-4-пиперидинилфенил)-2-метилпропанамид. Смесь карбоната калия (29,2 мг, 0,211 ммоль), йодида натрия (47,5 мг, 0,317 ммоль), 2-метил-N-[3-(4-пиперидинил)фенил]пропанамида (51,8 мг, 0,211 ммоль) и 2-[(1S)-3-хлор-1 фенилпропил]-1 Н-изоиндол-1,3(2 Н)-диона (63,1 мг, 0,211 ммоль) в ДМФ (5,0 мл) перемешивали при 100 С в течение 3 ч, ТСХ показала, что реакция завершается за данное время. Реакционную смесь охлаждали до комнатной температуры, выливали в воду (50 мл) и водный слой экстрагировали хлористым метиленом (330 мл). Объединенные органические экстракты промывали насыщенным раствором соли(30 мл), сушили над MgSO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ [2,5% NH3 (2,0 М в метаноле) в CHCl3], получая целевой продукт (74,1 мг,77%) в виде густого масла: 2 Н ЯМР (400 МГц, CD3OD)7,83 (видимый дд, 2 Н, J = 2,9 Гц), 7,69 (видимый дд, 2 Н, J = 2,9 Гц),7,56 (видимый дт, 3H, J = 2,9, 7,3 Гц), 7,33 (м, 4 Н), 7,21 (т, 1 Н, J = 7,8 Гц), 7,09 (с, 1 Н), 6,81 (видимый д,1 Н, J = 7,8 Гц), 5,49 (видимый дд, 1 Н, J = 5,5, 9,5 Гц), 2,98 (д, 1 Н, J = 9,5 Гц), 2,87 (м, 2 Н), 2,50 (септет,1 Н, J= 6,7 Гц), 2,40-2,35 (м, 4 Н), 1,94 (м, 2 Н), 1,70-1,50 (м, 4 Н), 1,25 (д, 6 Н, J = 7,9 Гц);ESMS m/e: 510,4 (М+Н)+. Стадия 3. См. общие условия снятия защитной группы на схеме 3/метод В. Стадия 4. См. общие условия конденсации на схемах 8-10.- 27009818 Общая методика для схемы 6 бис(4-Фторфенил)уксусная кислота. Фторбензол (13,6 г, 0,142 моль) и моногидрат глиоксиловой кислоты (2,35 г, 0,0255 моль) растворяли в теплой уксусной кислоте (30,0 мл). Смесь охлаждали на бане лед/вода и добавляли по каплям концентрированную серную кислоту (20,0 мл) в течение 0,5 ч. Полученную густую красную суспензию перемешивали при 80 С в течение 12 ч и затем охлаждали до комнатной температуры. Добавляли воду (300 мл) и pH доводили до 3 с использованием гранул гидроксида калия и 10% раствора KOH. Водный раствор экстрагировали этилацетатом (3100 мл) и объединенные органические экстракты промывали насыщенным раствором соли (100 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая целевой продукт (5,18 г, 82%) в виде красного твердого вещества, которое использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (400 МГц, CD3OD)9,45 (ушир. с, 1 Н), 7,31-7,25 (м, 4 Н), 7,06-7,0 (м, 4 Н), 5,01 (с, 1 Н). Общая методика для схемы 7 бис(4-Метилфенил)уксусная кислота. В круглодонную колбу емкостью 250 мл добавляли 4,4'диметилбензгидрол (1,06 г, 5,00 ммоль) и 97% серную кислоту (44,0 мл). Смесь охлаждали до 15 С на бане со смесью лед/вода и добавляли по каплям с помощью капельной воронки муравьиную кислоту(12,0 мл) в течение 0,5 ч. Полученный пенистый раствор перемешивали при 15 С в течение 2 ч. Добавляли воду (300 мл) и pH доводили до 3 с использованием гранул гидроксида калия и 10% раствора KOH. Водный раствор экстрагировали этилацетатом (3100 мл) и объединенные органические экстракты промывали насыщенным раствором соли (100 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая целевой продукт (0,281 г, 26%) в виде бледно-желтого твердого вещества,которое использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (400 МГц, CD3OD)7,28-6,99 (м, 8 Н), 6,96 (ушир. с, 1 Н), 4,94 (с, 1 Н), 2,29 (с, 6 Н). Общая методика для схемы 8N-[3-(1-3-[(Дифенилацетил)амино]пропил-4-пиперидинил)фенил]-2-метилпропанамид. Смесь 2,2-дифенилацетилхлорида (0,300 ммоль, 69,2 мг), N-3-[1-(3-аминопропил)-4-пиперидинил]фенил-2 метилпропанамида (0,250 ммоль, 75,8 мг) и триэтиламина (0,500 ммоль, 50,5 мг) растворяли в ТГФ (2,00 мл) и смесь встряхивали на орбитальном встряхивающем устройстве J-KEM при комнатной температуре в течение 12 ч. Реакционную смесь концентрировали в вакууме и остаток очищали препаративной ТСХ(силикагель, CH2Cl2:аммиак (2,0 М в метаноле) 100:5], получая целевой продукт (83,3 мг, 62% выход): 1= 7,6 Гц) Элементный анализ. Вычислено для C32H39N3O2+HCl+0,19 CHCl3: С, 69,44; Н, 7,27; N, 7,55. Найдено: С, 69,44; Н, 7,43; N, 7,43; ESMS m/e: 498,4 (М+Н)+. Общая методика для схемы 9N-(3-4-[3-(Изобутириламино)фенил]-1-пиперидинилпропил)-2,2-дифенилпропанамид. Смесь 2,2 дифенилпропионовой кислоты (0,200 ммоль, 45,2 мг), N-3-[1-(3-аминопропил)-4-пиперидинил]фенил 2-метилпропанамида (0,200 ммоль, 60,7 мг), 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (EDC,0,400 ммоль, 62,0 мг) и 4-диметиламинопиридина (5,00 мг) растворяли в смеси CH2Cl2/ДМФ (1,00/0, 100 мл) и смесь встряхивали в орбитальном встряхивающем устройстве J-KEM при комнатной температуре в течение 12 ч. Реакционную смесь концентрировали в вакууме, очищали препаративной ТСХ [силикагель,CH2Cl2:аммиак (2,0 М в метаноле) 100:5], получая целевой продукт (43,8 мг, 42% выход): 1 Н ЯМР (400 МГц, CDCl3)7,50-7,43 (ушир., 1 Н), 7,43-7,39 (ушир., 1 Н), 7,39-7,18 (м, 12 Н), 6,89 (д,1 Н, J = 7,7 Гц), 6,23 (ушир.,1 Н) 3,42-3,32 (м, 2 Н), 2,85 (д, 2 Н, J = 10,8 Гц), 2,50 (квинтет, 1 Н, J = 7,4 Гц),2,45-2,36 (м, 1 Н), 2,28 (т, 2 Н, J = 6,4 Гц), 1,99 (с, 3H), 1,96-1,82 (м, 2 Н), 1,78-1,60 (м, 4 Н), 1,60-1,47 (м,2 Н), 1,23 (д, 6 Н, J = 7,0 Гц); ESMS m/e: 512,4 [М+Н]+. Общая методика для схемы 10 Библиотеку амидов конструировали в полипропиленовых 48-луночных планшетах Robbins "ReactorBlocks". В каждую лунку 48-луночного планшета "Reactor Blocks" помещали PS-CDI смолу (300 мг, 2,00 экв., получена от Argonaut Technologies). В каждую лунку добавляли амин (0,200 ммоль) и карбоновую кислоту (0,22 ммоль) в 3,00 мл CH2Cl2 и ДМФ (10:1). Планшеты Reactor Blocks герметично укупоривали и вращали в печи Robbins (FlexChem) при комнатной температуре в течение 12 ч. Растворы фильтровали параллельно в приемные планшеты и смолу промывали CH2Cl2 (2,0 мл) и MeOH (1,0 мл). Фильтрат и промывные жидкости концентрировали при пониженном давлении, получая целевой продукт, который анализировали методами 1 Н ЯМР и ESMS. 2-(4-Хлорфенил)-2-метил-N-(3-4-[3-(пропиониламино)фенил]-1-пиперидинилпропил)пропанамид. Получен в соответствии с общей методикой, представленной на схеме 10 с использованием 2-(4 хлорфенил)-2-метилпропановой кислоты и N-3-[1-(3-аминопропил)-4-пиперидинил]фенилпропанамида: 1 Н ЯМР (400 МГц, CDCl3)7,86 (с, 1 Н), 7,50 (с, 1 Н), 7,34-7,19 (м, 6 Н), 6,96 (д, 1 Н, J = 7,8 Гц), 6,726,67 (м, 1 Н), 3,42 (кв, 2 Н, J = 7,1 Гц), 3,31 (кв, 3H, J = 5,4 Гц), 2,49-2,35 (м, 5 Н), 2,08-1,95 (м, 2 Н), 1,821,74 (м, 2 Н), 1,71-1,62 (м, 3H), 1,56 (с, 6 Н), 1,24 (т, 3H, J = 7,8 Гц);ESMS m/e: 470,3 [М+Н]+. Общая методика для схемы 11(4S)-3-[(4-Фторфенил)ацетил]-4-изопропил-1,3-оксазолидин-2-он. К раствору (4S)-4-изопропил-1,3 оксазолидин-2-она (2,0 г, 15.5 ммоль) в безводном ТГФ (20 мл) при -78 С в атмосфере аргона добавляли по каплям 2,5 М раствор n-BuLi в гексанах (6,2 мл, 15,5 ммоль). После перемешивания при -78 С в течение 15 мин добавляли (4-фторфенил)ацетилхлорид (2,55 мл, 18.6 ммоль). Полученную реакционную смесь перемешивали при -78 С в течение 30 мин и при 0 С в течение 15 мин, гасили насыщенным раствором NH4Cl (5 мл) и концентрировали в вакууме. Остаток растворяли в EtOAc (100 мл) и промывали насыщенным раствором Na2CO3, затем насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (10-15%(4S)-3-[(4-Хлорфенил)ацетил]-4-изопропил-1,3-оксазолидин-2-он. К раствору (4S)-4-изопропил-1,3 оксазолидин-2-она (2,0 г, 15,5 ммоль) в безводном ТГФ (20 мл) при -78 С в атмосфере аргона добавляли по каплям 2,5 М раствор n-BuLi в гексанах (6,2 мл, 15,5 ммоль). После перемешивания при -78 С в течение 15 мин добавляли (4-хлорфенил)ацетилхлорид (2,70 мл, 21,8 ммоль). Полученную реакционную смесь перемешивали при -78 С в течение 30 мин и при 0 С в течение 15 мин, гасили насыщенным раствором NH4Cl (5 мл) и концентрировали в вакууме. Остаток растворяли в EtOAc (100 мл) и промывали насыщенным раствором Na2CO3, затем насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (10-15%(4R)-3-[(4-Фторфенил)ацетил]-4-изопропил-1,3-оксазолидин-2-он. К раствору (4R)-4-изопропил-1,3 оксазолидин-2-она (5,2 г, 40,3 ммоль) в безводном ТГФ (100 мл) при -78 С в атмосфере аргона добавляли по каплям 2,5 М раствор n-BuLi в гексанах (17,0 мл, 42,5 ммоль). После перемешивания при -78 С в течение 15 мин добавляли (4-фторфенил)ацетилхлорид (6,34 мл, 46,4 ммоль). Полученную реакционную смесь перемешивали при -78 С в течение 30 мин и при 0 С в течение 15 мин, гасили насыщенным раствором NH4Cl (15 мл) и концентрировали в вакууме. Остаток растворяли в EtOAc (200 мл) и промывали насыщенным раствором Na2CO3, затем насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (10%-15%(4R)-3-[(4-Хлорфенил)ацетил]-4-изопропил-1,3-оксазолидин-2-он. К раствору (4R)-4-изопропил-1,3 оксазолидин-2-она (5,3 г, 41,1 ммоль) в безводном ТГФ (100 мл) при -78 С в атмосфере аргона добавляли по каплям 2,5 М раствор n-BuLi в гексанах (17,0 мл, 42,5 ммоль). После перемешивания при -78 С в течение 15 мин добавляли (4-хлорфенил)ацетилхлорид (2,70 мл, 21,8 ммоль). Полученную реакционную смесь перемешивали при -78 С в течение 30 мин и при 0 С в течение 15 мин, гасили насыщенным раствором NH4Cl (15 мл) и концентрировали в вакууме. Остаток растворяли в EtOAc (200 мл) и промывали насыщенным раствором Na2CO3, затем насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (10%-15%-78 С в атмосфере аргона добавляли по каплям 1,0 М раствор NaHMDS в ТГФ (11,7 мл, 11,7 ммоль) в течение 10 мин. После перемешивания при -78 С в течение 1 ч добавляли MeI (3,30 мл, 53,0 ммоль). Полученную реакционную смесь перемешивали при -78 С в течение 1 ч и при -40 С в течение 2 ч, гасилиHOAc (32 ммоль) в эфире (20 мл), фильтровали через целит. Фильтрат концентрировали в вакууме и остаток растворяли в CH2Cl2 (100 мл) и промывали H2O, затем насыщенным раствором соли, сушили надMgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэшхроматографией (5%-10% EtOAc в гексане), получая 2,40 г (8,60 ммоль, 81%) (4S)-3-[(2S)-2-(4 фторфенил)пропаноил]-4-изопропил-1,3-оксазолидин-2-она: 1-78 С в атмосфере аргона добавляли по каплям 1,0 М раствор NaHMDS в ТГФ (4,20 мл, 4,20 ммоль) в течение 10 мин. После перемешивания при -78 С в течение 1 ч добавляли MeI (1,19 мл, 19,1 ммоль). Полученную реакционную смесь перемешивали при -78 С в течение 1 ч и при -40 С в течение 2 ч, гасилиHOAc (11,4 ммоль) в эфире (20 мл), фильтровали через целит. Фильтрат концентрировали в вакууме, и остаток растворяли в CH2Cl2 (50 мл) и промывали H2O, затем насыщенным раствором соли, сушили надMgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэшхроматографией (5%-10% EtOAc в гексане), получая 0,68 г (2,30 ммоль, 60%) (4S)-3-[(2S)-2-(4 хлорфенил)пропаноил]-4-изопропил-1,3-оксазолидин-2-она: 1-78 С в атмосфере аргона добавляли по каплям 1,0 М раствор NaHMDS в ТГФ (17,6 мл, 17,6 ммоль) в течение 10 мин. После перемешивания при -78 С в течение 1 ч добавляли MeI (5,0 мл, 80,0 ммоль). Полученную реакционную смесь перемешивали при -78 С в течение 1 ч и при -40 С в течение 2 ч, гасилиHOAc (48 ммоль) в эфире (20 мл), фильтровали через целит. Фильтрат концентрировали в вакууме и остаток растворяли в CH2Cl2 (200 мл) и промывали H2O, затем насыщенным раствором соли, сушили надMgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэшхроматографией (5%-10% EtOAc в гексане), получая 2,59 г (9,28 ммоль, 58%) (4R)-3-[(2R)-2-(4 фторфенил)пропаноил]-4-изопропил-1,3-оксазолидин-2-она: 1-78 С в атмосфере аргона добавляли по каплям 1,0 М раствор NaHMDS в ТГФ (11,0 мл, 11,0 ммоль) в течение 10 мин. После перемешивания при -78 С в течение 1 ч добавляли MeI (1,9 мл, 30,0 ммоль). Полученную реакционную смесь перемешивали при -78 С в течение 1 ч и при -40 С в течение 2 ч, гасилиHOAc (30,0 ммоль) в эфире (20 мл), фильтровали через целит. Фильтрат концентрировали в вакууме и остаток растворяли в CH2Cl2 (100 мл) и промывали H2O, затем насыщенным раствором соли, сушили надMgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэшхроматографией (5%-10% EtOAc в гексане), получая 1,58 г (5,35 ммоль, 54%) (4R)-3-[(2R)-2-(4 хлорфенил)пропаноил]-4-изопропил-1,3-оксазолидин-2-она: 1(2S)-2-(4-Фторфенил)пропановая кислота. К раствору (4S)-3-[(2S)-2-(4-фторфенил)пропаноил]-4 изопропил-1,3-оксазолидин-2-она (2,40 г, 8,60 ммоль) в 160 мл смеси ТГФ/H2O (3:1) при 0 С добавляли 30% Н 2 О 2 (7,8 мл, 68,8 ммоль) с последующим добавлением LiOH (722 мг, 17,2 ммоль). Полученную смесь перемешивали при 0 С в течение 2 ч и избыток пероксида гасили при 0 С 1,5 н. водным растворомNa2SO3 (51 мл). После забуферивания раствора до 9-10 водным раствором NaHCO3 и выпаривания ТГФ,вспомогательный хиральный оксазолидинон выделяли экстракцией EtOAc (50 мл 3). Водный слой подкисляли 3 н. HCl и экстрагировали EtOAc. Органический слой промывали насыщенным раствором соли,сушили над MgSO4, фильтровали и концентрировали в вакууме, получая 0,92 г (5,47 ммоль, 64%) (2S)-2(4-фторфенил)пропановой кислоты; []D=+70 (C=1, МеОН): 1(2S)-2-(4-Хлорфенил)пропановая кислота. К раствору (4S)-3-[(2S)-2-(4-хлорфенил)пропаноил]-4 изопропил-1,3-оксазолидин-2-она (678 мг, 2,30 ммоль) в 45 мл смеси ТГФ/H2O (3:1) при 0 С добавляли 30% H2O2 (2,1 мл, 18,4 ммоль) с последующим добавлением LiOH (193 мг, 4,6 ммоль). Полученную смесь перемешивали при 0 С в течение 2 ч и избыток пероксида гасили при 0 С 1,5 н. водным раствором
МПК / Метки
МПК: C07D 211/06, C07D 401/04, A61K 31/445, A61K 31/44
Метки: алкиламидопиперидины, замещенные
Код ссылки
<a href="https://eas.patents.su/30-9818-zameshhennye-alkilamidopiperidiny.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные алкиламидопиперидины</a>
Предыдущий патент: Способ выявления туберкулезной инфекции
Следующий патент: Косметическое изделие для ухода за кожей
Случайный патент: Забивка свай