11&beta – галоген – 7&alpha – замещенные эстратриены, способ получения фармацевтических препаратов, содержащих эти 11&beta – галоген – 7&alpha – замещенные эстратриены, и их применение для изготовления лекарственных средств
Номер патента: 2623
Опубликовано: 27.06.2002
Авторы: Шнайдер Мартин, Лессль Моника, Парчик Карстен, Лихтнер Розмари, Нишино Юкишиге, Хайнрих Николаус, Зауер Герхард, Хофмайстер Хельмут, Больманн Рольф, Фритцемейер Карл-Хайнрих, Кролл Йорг, Цорн Людвиг, Кюнцер Херманн
Формула / Реферат
1. 11b -Галоген-7a -замещенные эстратриены общей формулы I
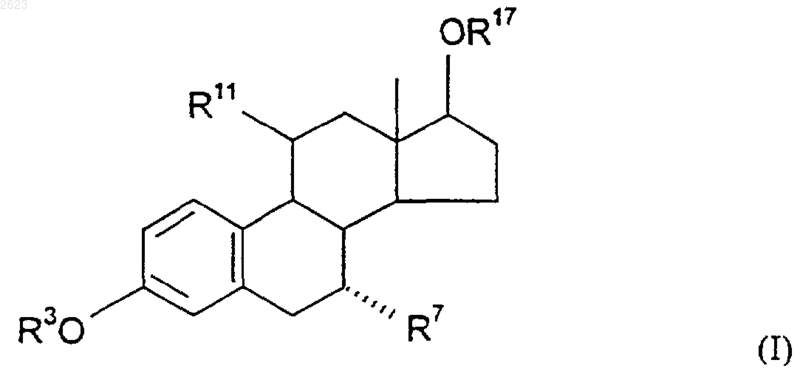
в которой
R3 обозначает атом водорода, углеводородный остаток с числом атомов углерода до 8 включительно или остаток субформулы R3'-С(О)-, где R3' обозначает атом водорода или углеводородный остаток с числом атомов углерода до 8 включительно либо фенильный остаток,
R7 обозначает остаток формулы -A-B-Z-R20, где А обозначает прямую связь или бензилиденовый остаток, при этом метиленовая группа связана с углеродным атомом стероида в положении 7, либо обозначает фениленовый остаток,
В обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с 3-14 атомами углерода и
Z представляет собой -NR21-, где R21 обозначает С1-С3алкильную группу, причем в этом случае R20 обозначает атом водорода, прямоцепочечную либо разветвленную алкильную, алкенильную или алкинильную группу с числом атомов углерода до 10 включительно либо представляет собой одну из следующих группировок: -D-CnF2n+1, где D обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 8 включительно, а n обозначает целое число в пределах 1-8, -L-CH=CF-CpF2p+1, где L обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с 2-7 атомами углерода, а р обозначает целое число в пределах 2-7, -D-О-(СН2)q-арил, где D имеет вышеуказанные значения, q обозначает 0, 1, 2 или 3, а арил представляет собой необязательно одно- или двукратно замещенный фенильный, 1- либо 2-нафтильный или гетероарильный остаток, -D-О-(СH2)r-СnF2n+1, где D и n имеют вышеуказанные значения, а r обозначает целое число в пределах 1-5, или
R20 и R21 вместе с атомом азота, с которым они связаны, образуют насыщенный либо ненасыщенный гетероцикл с 5 или 6 звеньями цепи, который необязательно содержит еще один или два гетероатома, выбранных из группы, включающей азот, кислород и серу, и который также необязательно замещен, или
Z представляет собой -SOx-, где х обозначает 0, 1 или 2, причем в этом случае R20 обозначает прямоцепочечную либо разветвленную алкильную, алкенильную или алкинильную группу с числом атомов углерода до 10 включительно либо представляет собой одну из следующих группировок: -D-CnF2n+1, где D обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 8 включительно, а n обозначает целое число в пределах 1-8, -L-CH=CF-CpF2p+1, где L обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с 2-7 атомами углерода, а р обозначает целое число в пределах 2-7, -D-O-(CH2)q-арил, где D имеет вышеуказанные значения, q обозначает 0, 1, 2 или 3, а арил представляет собой необязательно одно- или двукратно замещенный фенильный, 1- либо 2-нафтильный или гетероарильный остаток, -D-O-(CH2)r-CnF2n+1, где D и n имеют вышеуказанные значения, а r обозначает целое число в пределах 1-5, или
Z представляет собой -NR31-, причем в этом случае R20 обозначает прямоцепочечный либо разветвленный алкильный, алкенильный или алкинильный остаток с числом атомов углерода до 14 включительно, который может быть разорван одним-тремя гетероатомами -O- и -S- и группировками -NR32-, где R32 представляет собой атом водорода или С1-С3алкильный остаток, и/или может быть частично фторирован, или обозначает необязательно одно- либо двукратно замещенный арильный или гетероарильный остаток, необязательно одно- либо двукратно замещенный С3-С10циклоалкильный остаток, необязательно одно- либо двукратно замещенный С4-С15циклоалкилалкильный остаток, необязательно одно- либо двукратно замещенный C7-C20 аралкильный остаток, необязательно одно- либо двукратно замещенный гетероарил-С1-С6алкильный остаток или необязательно замещенный аминоалкильный остаток, а R31 представляет собой остаток формулы -C(O)R33 или -CH2-R33, причем в этом случае R33 обозначает прямоцепочечный либо разветвленный алкильный, алкенильный или алкинильный остаток с числом атомов углерода до 14 включительно, который может быть разорван одним-тремя гетероатомами -O- и -S- и группировками -NR32-, где R32 представляет собой атом водорода или С1-С3алкильный остаток, и/или может быть частично фторирован, или обозначает необязательно одно- либо двукратно замещенный арильный или гетероарильный остаток, необязательно одно- либо двукратно замещенный С3-С10циклоалкильный остаток, необязательно одно- либо двукратно замещенный С4-С15циклоалкилалкильный остаток, необязательно одно- либо двукратно замещенный С7-С20аралкильный остаток, необязательно одно- либо двукратно замещенный гетероарил-С1-С6алкильный остаток или необязательно замещенный аминоалкильный остаток либо бифениленовый остаток, за исключением следующих соединений:
11b -фтор-7a -{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)триен-3,17b -диол,
11b -фтор-7a -{5-[2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)триен-3,17b -диол,
11b -фтор-7a -{6-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]гексил}эстра-1,3,5(10)триен-3,17b -диол,
11b -фтор-7a -[5-[(2S)-2-(4-трифторметилфенилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)триен-3,17b -диол,
11b -фтор-7a -{5-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)триен-3,17b -диол,
11b -фтор-7a -[5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфинилметил)пирролидин-1-ил]пентил}эстра-1,3,5(10)триен-3,17b -диол,
11b -фтор-7a -{5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфонилметил)пирролидин-1-ил]пентил}эстра-1,3,5(10)триен-3,17b -диол,
R11 обозначает атом фтора или хлора,
R17 обозначает атом водорода или остаток субформулы R17'-С(O)-, где R17' представляет собой атом водорода или углеводородный остаток с числом атомов углерода до 8 включительно.
2. 11b -Галоген-7a -замещенные эстратриены по п.1, где R3 представляет собой атом водорода.
3. 11b -Галоген-7a -замещенные эстратриены по п.1, где R3 представляет собой бензоильный остаток.
4. 11b -Галоген-7a -замещенные эстратриены по п.1, где R11 представляет собой атом фтора.
5. 11b -Галоген-7a -замещенные эстратриены по п.1, где R17 представляет собой атом водорода.
6. 11b -Галоген-7a -замещенные эстратриены по п.1, где А обозначает прямую связь.
7. 11b -Галоген-7a -замещенные эстратриены по п.6, где R7 представляет собой остаток формулы -(CH2)s-Z-R20, в которой
s обозначает целое число в пределах 3-8,
Z представляет собой -NR21, где R21 обозначает С1-С3алкильную группу,
R20 представляет собой атом водорода, С1-С9алкильную группу или одну из следующих группировок:
-(СН2)m-СnF2n+1, где m и n, каждый независимо друг от друга, обозначает целое число в пределах 1-8,
-(CH2)o-CH=CF-CpF2p+1, где o обозначает 1, 2 или 3, а р обозначает целое число в пределах 2-7,
-(СН2)m-О-(СН2)q-арил, где m имеет вышеуказанные значения, q обозначает 0, 1, 2 или 3, а арил представляет собой необязательно одно- либо двукратно замещенный фенильный или гетероарильный остаток, -(СH2)m-O-(СH2)r-СnF2n+1, где m и n имеют вышеуказанные значения, а r обозначает целое число в пределах 1-5.
8. 11b -Галоген-7a -замещенные эстратриены по п.6, где R7 представляет собой остаток формулы -(CH2)s-Z-R20, в которой
s обозначает целое число в пределах 3-8,
Z представляет собой -NR21, где R21 обозначает С1-С3алкильную группу,
R20 и R21 вместе с атомом азота, с которым они связаны, образуют насыщенный либо ненасыщенный гетероцикл с 5 или 6 звеньями цепи, который необязательно содержит еще один или два гетероатома, выбранных из группы, включающей азот, кислород и серу, и который необязательно может быть замещен.
9. 11b -Галоген-7a -замещенные эстратриены по п.6, где R7 представляет собой остаток формулы -(СН2)s-Z-R20, в которой
s обозначает целое число в пределах 3-8,
Z представляет собой -SOx, a x обозначает 0, 1 или 2,
R20 представляет собой -(СН2)m-O-(СH2)r-СnF2n+1, где m и n имеют вышеуказанные значения, а r обозначает целое число в пределах 1-5.
10. 11b -Галоген-7a -замещенные эстратриены по п.1, где R7 выбран из группы, включающей следующие боковые цепи:
-(CH2)5N(СН3)(СH2)3С2F5,
-(СН2)5N(СН3)(СН2)6С2F5,
-(СН2)5N(СН3)(СН2)7С2F5,
-(СН2)5N(СН3)(СН2)8С2F5,
-(СН2)6N(СН3)(СН2)6С2F5,
-(СН2)6N(СН3)(СН2)7С2F5,
-(СН2)6N(СН3)(СН2)8С2F5,
-(СН2)5N(СН3)(СН2)2С4F9,
-(СН2)5N(СН3)(СН2)3С6F13,
-(СН2)5N(СН3)(СН2)3С8F17,
-(СН2)5N(СН3)(СН2)6С4F9,
-(СН2)5N(СН3)(СН2)6С6F13,
-(СН2)5N(СН3)(СН2)6С8F17,
-(СН2)5N(СН3)Н,
-(СН2)5N(СН3)(СН2)9H,
-(СН2)5N(СН3)СН2СH=CF-C2F5,
-(СН2)5N(СН3)СН2СH=CF-C3F7,
-(СН2)5N(СН3)СН2СH=CF-C5F11,
-(СН2)5N(СН3)СН2СH=CF-C7F15,
-(СН2)5-1-пирролидинил,
-(СН2)5N(СН3)(СН2)3Oфенил,
-(СН2)5N(СН3)(СН2)3Обензил,
-(СН2)5N(СН3)(СН2)3O(CH2)3C2F5,
-(СН2)9S(СН2)3С2F5,
-(СН2)9SO(СН2)3С2F5,
-(СН2)9SO2(СН2)3С2F5,
-(СН2)5N(СН3)(СН2)3СH(CH3)2,
-(СН2)5N(СН3)(СН2)3-пиридил,
-(СН2)5N(СН3)(СН2)3-фенил,
-(СН2)5N(СН3)(СН2)2-п-толил,
-(СН2)5N(СН3)(СН2)2-п-этoкcифeнил,
-(СН2)5N(СН3)(СН2)3-п-толил,
-(СН2)5N(СН3)(СН2)3-п-xлopфeнил,
-(СН2)5N(СН3)(СН2)3-O-CH2-фенил,
-(СН2)5N(СН3)(СН2)2-O-п-Вr-фенил,
-(СН2)5N(СН3)(СН2)2-О-п-СF3-фенил.
11. Соединения общей формулы I, а именно:
11b -фтор-7a -{5-[метил-(8,8,9,9,9-пентафторнонил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метилнониламино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(9,9,10,10,10-пентафтордецил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{6-[метил-(8,8,9,9,9-пентафторнонил)амино]гексил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{6-[метил-(9,9,10,10,10-пентафтордецил)амино]гексил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -(5-(метиламино)пентил)эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -(5-пирролидин-1-илпентил)эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(4,4,5,5,5-пентафторпентил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(4,4,5,5,6,6,7,7,8,8,9,9,9-тридекафторнонил)амино]пентил}эстра-1,3,5(10)-триеэ-3,17b -диол,
11b -фтор-7a -{5-[(4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-гептадекафторундецил)метиламино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(3,3,4,4,5,5,6,6,6-нонафторгексил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(7,7,8,8,8-пентафтороктил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{6-[метил-(7,7,8,8,8-пентафтороктил)амино]гексил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(7,7,8,8,9,9,10,10,10-нонафтордецил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(7,7,8,8,9,9,10,10,11,11,12,12,12-тридекафтордодецил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[(7,7,8,8,9,9,10,10,11,11,12,12,13,13,14,14,14-гептадекафтортетрадецил)метиламино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[(3,4,4,5,5,5-гексафторпент-2-енил)метиламино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
7a -{5-[(3,4,4,5,5,6,6,7,7,8,8,8-додекафторокт-2-енил)метиламино]пентил}-11b -фторэстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[(3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-гексадекафтордец-2-енил)метиламино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(3-феноксипропил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
7a -{5-[(3-бензилоксипропил)метиламино]пентил}-11b -фторэстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилокси)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]эстра-1,3,5(10)-триен-3,17b -диол,
N-[4-(11b -фтор-3,17-дигидроксиэстра-1,3,5 (10)-триен-7a -ил)бутил]-N- пентилбензамид,
4-ацетиламино-N-циклогексилметил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]бензамид,
4-ацетиламино-N-бензил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил) бутил]бензамид,
4-ацетиламино-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(2-метоксиэтил)бензамид,
4-ацетиламино-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(3-фенилпропил)бензамид,
4-ацетиламино-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-гексилбензамид,
4-ацетиламино-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-октилбензамид,
4-циано-N-циклогексилметил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]бензамид,
N-бензил-4-циано-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]бензамид,
4-циано-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(2-метоксиэтил)бензамид,
4-циано-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(3-фенилпропил)бензамид,
4-циaнo-N-[4-(11b -фтop-3,17b -дигидpoкcиэcтpa-1,3,5(10)-тpиeн-7a -ил)бутил]-N-гексилбензамид,
4-циано-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-октилбензамид,
3-циклогексил-N-циклогексилметил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]пропионамид,
N-бензил-3-циклогексил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]пропионамид,
3-циклoгeкcил-N-[4-(11b -фтop-3,17b -дигидpoкcиэcтpa-1,3,5(10)-триен-7a -ил)бутил]-N-(2-метоксиэтил)пропионамид,
3-циклогексил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(3-фенилпропил)пропионамид,
3-циклогексил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-гексилпропионамид,
3-циклогексил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-октилпропионамид,
N-циклогексилметил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-(3,4-диметоксифенил)ацетамид,
N-бензил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-(3,4-диметоксифенил)ацетамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(2-метоксиэтил)-(3,4-диметоксифенил)ацетамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-(3,4-диметоксифенил)-N-(3-фенилпропил)ацетамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-гексил-(3,4-диметоксифенил)ацетамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-(3,4-диметоксифенил)-N-октилацетамид,
N-циклогексилметил-4-этокси-N-[4-(11b -фтоЁ-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]бензамид,
N-бензил-4-этокси-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]бензамид,
4-этокси-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(2-метоксиэтил)бензамид,
4-этокси-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(3-фенилпропил)бензамид,
4-этокси-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-гексилбензамид,
4-этокси-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-октилбензамид,
N-циклогексилметил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]додеканамид,
N-бензил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]додеканамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(2-метоксиэтил)додеканамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(3-фенилпропил)додеканамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-гексилдодеканамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-октилдодеканамид,
N-циклогексилметил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]нафт-2-илацетамид,
N-бензил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]нафт-2-илацетамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(2-метоксиэтил) нафт-2-илацетамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]нафт-2-ил-N-(3-фенилпропил)ацетамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-гексилнафт-2-илацетамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]нафт-2-ил-N-октилацетамид,
N-циклогексилметил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-4-фенилбутирамид,
N-бензил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-4-фенилбутирамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(2-метоксиэтил)-4-фенилбутирамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-4-фeнил-N-(3-фенилпропил)бутирамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-гексил-4-фенилбутирамид,
N-[4-(11b -фтop-3,17b -дигидpoкcиэcтpa-1,3,5(10)-тpиeн-7a -ил)бутил]-N-октил-4-фенилбутирамид,
N-циклогексилметил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]пропионамид,
N-бензил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]пропионамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(2-метоксиэтил)пропионамид,
N-[4-(11b -фтop-3,17b -дигидpoкcиэcтpa-1,3,5(10)-тpиeн-7a -ил)бутил]-N-(3-фенилпропил)пропионамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-гексилпропионамид,
N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-октилпропионамид,
4-бифенил-N-циклогексилметил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]ацетамид,
4-бифенил-N-бензил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]ацетамид,
4-бифенил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(2-метоксиэтил)ацетамид,
4-бифенил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-(3-фенилпропил)ацетамид,
4-бифенил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-гексилацетамид,
4-бифенил-N-[4-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)бутил]-N-октилацетамид,
4-ацетиламино-N-циклогексилметил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]бензамид,
4-ацетиламино-N-бензил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]бензамид,
4-ацетиламино-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(2-метоксиэтил)бензамид,
4-ацетиламино-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(3-фенилпропил)бензамид,
4-ацетиламино-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-гексилбензамид,
4-ацетиламино-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-октилбензамид,
4-циано-N-циклогексилметил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]бензамид,
N-бензил-4-циано-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил] бензамид,
4-циано-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(2-метоксиэтил)бензамид,
4-циано-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(3-фенилпропил)бензамид,
4-циано-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-гексилбензамид,
4-циано-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-октилбензамид,
3-циклогексил-N-циклогексилметил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]пропионамид,
N-бензил-3-циклогексил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]пропионамид,
3-циклогексил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(2-метоксиэтил)пропионамид,
3-циклогексил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(3-фенилпропил)пропионамид,
3-циклогексил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-гексилпропионамид,
3-циклогексил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-октилпропионамид,
N-циклогексилметил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-(3,4-диметоксифенил)ацетамид,
N-бензил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-(3,4-диметоксифенил)ацетамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(2-метоксиэтил)-(3,4-диметоксифенил)ацетамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-(3,4-диметоксифенил)-N-(3-фенилпропил)ацетамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-гексил-(3,4-диметоксифенил)ацетамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-(3,4-диметоксифенил)-N-октилацетамид,
N-циклогексилметил-4-этокси-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]бензамид,
N-бензил-4-этокси-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]бензамид,
4-этокси-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(2-метоксиэтил)бензамид,
4-этокси-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(3-фенилпропил)бензамид,
4-этокси-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-гексилбензамид,
4-этокси-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-октилбензамид,
N-циклогексилметил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]додеканамид,
N-бензил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]додеканамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(2-метоксиэтил)додеканамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(3-фенилпропил)додеканамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-гексилдодеканамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-октилдодеканамид,
N-циклогексилметил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]нафт-2-илацетамид,
N-бензил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]нафт-2-илацетамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(2-метоксиэтил)нафт-2-илацетамид,
N-[5-(11b -фтop-3,17b -дигидpoкcиэcтpa-1,3,5(10)-тpиeн-7a -ил)пентил]нафт-2-ил-N-(3-фенилпропил)ацетамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-гексилнафт-2-илацетамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]нафт-2-ил-N-октилацетамид,
N-циклогексилметил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-4-фенилбутирамид,
N-бензил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-4-фенилбутирамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(2-метоксиэтил)-4-фенилбутирамид,
N-[5-(11b -фтop-3,17b -дигидpoкcиэcтpa-1,3,5(10)-тpиeн-7a -ил)пентил]-4-фенил-N-(3-фенилпропил)бутирамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-гeкcил-4-фeнилбyтиpaмид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-октил-4-фенилбутирамид,
N-циклогексилметил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]пропионамид,
N-бeнзил-N-[5-(11b -фтop-3,17b -дигидpoкcиэcтpa-1,3,5(10)-тpиeн-7a -ил)пентил]пропионамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(2-метоксиэтил)пропионамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(3-фенилпропил)пропионамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-гексилпропионамид,
N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-октилпропионамид,
4-бифeнил-N-циклoгeкcилмeтил-N-[5-(11b -фтop-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]ацетамид,
4-бифенил-N-бензил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил) пентил]ацетамид,
4-бифенил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(2-метоксиэтил)ацетамид,
4-бифенил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-(3-фенилпропил)ацетамид,
4-бифенил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-гексилацетамид,
4-бифенил-N-[5-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)пентил]-N-октилацетамид,
4-ацетиламино-N-циклогексилметил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]бензамид,
4-ацетиламино-N-бензил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]бензамид,
4-ацетиламино-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(2-метоксиэтил)бензамид,
4-ацетиламино-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(3-фенилпропил)бензамид,
4-ацетиламино-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-гексилбензамид,
4-ацетиламино-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-октилбензамид,
4-циано-N-циклогексилметил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]бензамид,
N-бензил-4-циано-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)триен-7a -ил)гексил] бензамид,
4-циано-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(2-метоксиэтил)бензамид,
4-циано-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(3-фенилпропил)бензамид,
4-циано-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-гексилбензамид,
4-циано-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-октилбензамид,
3-циклогексил-N-циклогексилметил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]пропионамид,
N-бензил-3-циклогексил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]пропионамид,
3-циклогексил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(2-метоксиэтил)пропионамид,
3-циклогексил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(3-фенилпропил)пропионамид,
3-циклогексил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-гексилпропионамид,
3-циклогексил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-октилпропионамид,
N-циклогексилметил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-(3,4-диметоксифенил)ацетамид,
N-бензил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-(3,4-диметоксифенил)ацетамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(2-метоксиэтил)-(3,4-диметоксифенил)ацетамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-(3,4-диметоксифенил)-N-(3-фенилпропил)ацетамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-гексил-(3,4-диметоксифенил)ацетамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-(3,4-диметоксифенил)-N-октилацетамид,
N-циклогексилметил-4-этокси-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]бензамид,
N-бензил-4-этокси-N-[6-(11b -фтор-3,17b -дигидроксиэстрр-1,3,5(10)-триен-7a -ил)гексил]бензамид,
4-этокси-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(2-метоксиэтил)бензамид,
4-этокси-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(3-фенилпропил)бензамид,
4-этокси-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-гексилбензамид,
4-этокси-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-октилбензамид,
N-циклогексилметил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]додеканамид,
N-бензил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]додеканамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(2-метоксиэтил)додеканамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(3-фенилпропил)додеканамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-гексилдодеканамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-октилдодеканамид,
N-циклогексилметил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-нафт-2-илацетамид,
N-бензил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]нафт-2-илацетамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(2-метоксиэтил)нафт-2-илацетамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]нафт-2-ил-N-(3-фенилпропил)ацетамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-гексилнафт-2-илацетамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]нафт-2-ил-N-октилацетамид,
N-циклогексилметил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-4-фенилбутирамид,
N-бeнзил-N-[6-(11b -фтop-3,17b -дигидpoкcиэcтpa-1,3,5(10)-тpиeн-7a -ил)гексил]-4-фенилбутирамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(2-метоксиэтил)-4-фенилбутирамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-4-фенил-N-(3-фенилпропил)бутирамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-Н-гексил-4-фенилбутирамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-октил-4-фенилбутирамид,
Н-циклогексилметил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]пропионамид,
N-бензил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]пропионамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(2-метоксиэтил)пропионамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(3-фенилпропил)пропионамид,
N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-гексилпропионамид,
N-[6-(11b -фтop-3,17b -дигидpoкcиэcтpa-1,3,5(10)-тpиeн-7a -ил)гексил]-N-октилпропионамид,
4-бифенил-N-циклогексилметил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]ацетамид,
4-бифенил-N-бензил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]ацетамид,
4-бифенил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-(2-метоксиэтил)ацетамид,
4-бифeнил-N-[6-(11b -фтop-3,17b -дигидpoкcиэcтpa-1,3,5(10)-тpиeн-7a -ил)гексил]-N-(3-фенилпропил)ацетамид,
4-бифенил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-гексилацетамид,
4-бифенил-N-[6-(11b -фтор-3,17b -дигидроксиэстра-1,3,5(10)-триен-7a -ил)гексил]-N-октилацетамид,
11b -фтор-7a -{5-[метил-(2-п-толилэтил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
7a -(5-{[2-(4-этоксифенил)этил]метиламино}пентил)-11b -фторэстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(3-фенилпропил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(3-пиридин-3-илпропил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(3-п-толилпропил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол,
7a -(5-{[3-(4-хлорфенил)пропил]метиламино}пентил)-11b -фторэстра-1,3,5(10)-триен-3,17b -диол,
7a -(5-{[3-(4-этоксифенил)пропил]метиламино}пентил)-11b -фторэстра-1,3,5(10)-триен-3,17b -диол,
11b -фтор-7a -{5-[метил-(4-метилпентил)амино]пентил}эстра-1,3,5(10)-триен-3,17b -диол.
12. Применение соединений общей формулы I по п.1 для изготовления лекарственных средств.
13. Фармацевтические препараты, содержащие в своем составе, по меньшей мере, одно соединение общей формулы I по п.1, а также фармацевтически приемлемый носитель.
Текст
Настоящее изобретение относится к 11 галоген-7-замещенным эстратриенам общей формулы IR3 обозначает атом водорода, углеводородный остаток с числом атомов углерода до 8 включительно или остаток субформулы R3'С(О)-, где R3' обозначает атом водорода или углеводородный остаток с числом атомов углерода до 8 включительно либо фенильный остаток,R7 обозначает остаток формулы -A-B-Z20R , где А обозначает прямую связь или бензилиденовый остаток, при этом метиленовая группа связана с углеродным атомом стероида в положении 7, либо обозначает фениленовый остаток,В обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с 3-14 атомами углерода иZ представляет собой -NR21-, где R21 обозначает С 1-С 3 алкильную группу, причем в этом случае R20 обозначает атом водорода, прямоцепочечную либо разветвленную алкильную, алкенильную или алкинильную группу с числом атомов углерода до 10 включительно либо представляет собой одну из следующих группировок: -D-СnF2n+1, где D обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 8 включительно, а n обозначает целое число в пределах 1-8, -LCH=CF-CpF2p+1, где L обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с 2-7 атомами углерода, а р обозначает целое число в пределах 2-7, -D-О-(СН 2)q-арил, где D имеет вышеуказанные значения, q обозначает 0, 1, 2 или 3, а арил представляет собой необязательно одно- или двукратно замещенный фенильный,1- либо 2-нафтильный или гетероарильный остаток, -D-O-(CH2)r-CnF2n+1, где D и n имеют вышеуказанные значения, а r обозначает целое число в пределах 1-5, или R20 и R21 вместе с атомом азота, с которым они связаны, образуют насыщенный либо ненасыщенный гетероцикл с 5 или 6 звеньями цепи, который необязательно содержит еще один или два гетероатома, выбранных из группы, включающей азот, кислород и серу, и который также необязательно замещен, илиZ представляет собой -SOx-, где х обозначает 0, 1 или 2, причем в этом случае R20 обозначает прямоцепочечную либо разветвленную алкильную, алкенильную или алкинильную группу с числом атомов углерода до 10 включи 002623 2 тельно либо представляет собой одну из следующих группировок: -D-CnF2n+1, где D обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 8 включительно, а n обозначает целое число в пределах 1-8, -L-CH=CF-CpF2p+1, где L обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с 2-7 атомами углерода, а р обозначает целое число в пределах 2-7, -D-O-(CH2)q-арил,где D имеет вышеуказанные значения, q обозначает 0, 1, 2 или 3, а арил представляет собой необязательно одно- или двукратно замещенный фенильный, 1- либо 2-нафтильный или гетероарильный остаток,-D-O-(CH2)r-CnF2n+1, где D и n имеют вышеуказанные значения, а r обозначает целое число в пределах 1-5, илиZ представляет собой -NR31-, причем в этом случае R20 обозначает прямоцепочечный либо разветвленный алкильный, алкенильный или алкинильный остаток с числом атомов углерода до 14 включительно, который может быть разорван одним-тремя гетероатомами -Oи -S- и группировками -NR32-, где R32 представляет собой атом водорода или С 1-С 3 алкильный остаток, и/или может быть частично фторирован, или обозначает необязательно одно- либо двукратно замещенный арильный или гетероарильный остаток, необязательно одно- либо двукратно замещенный С 3-С 10 циклоалкильный остаток, необязательно одно- либо двукратно замещенный С 4-С 15 циклоалкилалкильный остаток, необязательно одно- либо двукратно замещенный C7-C20 аралкильный остаток, необязательно одно- либо двукратно замещенный гетероарил-С 1-С 6 алкильный остаток или необязательно замещенный аминоалкильный остаток, аR31 представляет собой остаток формулы-C(O)R33 или -CH2-R33, причем в этом случае R33 обозначает прямоцепочечный либо разветвленный алкильный, алкенильный или алкинильный остаток с числом атомов углерода до 14 включительно, который может быть разорван однимтремя гетероатомами -O- и -S- и группировками-NR32-, где R32 представляет собой атом водорода или С 1-С 3 алкильный остаток, и/или может быть частично фторирован, или обозначает необязательно одно- либо двукратно замещенный арильный или гетероарильный остаток, необязательно одно- либо двукратно замещенный С 3 С 10 циклоалкильный остаток, необязательно одно- либо двукратно замещенный С 4-С 15 циклоалкилалкильный остаток, необязательно однолибо двукратно замещенный С 7-С 20 аралкильный остаток, необязательно одно- либо двукратно замещенный гетероарил-С 1-С 6 алкильный остаток или необязательно замещенный аминоалкильный остаток либо бифениленовый остаток,за исключением следующих соединений: 11-фтор-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)триен-3,17-диол,11-фтор-7-5-[2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентилэстра-1,3,5(10)триен-3,17-диол,11-фтор-7-6-[N-метил-N-3-(4,4,5,5,5 пентафторпентилтио)пропиламино]гексилэстра-1,3,5(10)триен-3,17-диол,11-фтор-7-5-[(2S)-2-(4-трифторметилфенилтиометил)пирролидин-1-ил]пентилэстра-1,3,5(10)триен-3,17-диол,11-фтор-7-5-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентилэстра-1,3,5(10)триен-3,17-диол,11-фтор-7-5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфинилметил)пирролидин-1-ил] пентилэстра-1,3,5(10)триен-3,17-диол,11-фтор-7-5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфонилметил)пирролидин-1-ил] пентилэстра-1,3,5(10)триен-3,17-диол,R11 обозначает атом фтора или хлора, R17 обозначает атом водорода или остаток субформулы R17'-С(O)-, где R17' представляет собой атом водорода или углеводородный остаток с числом атомов углерода до 8 включительно. Указанные в порядке исключения соединения описаны в заявке WO 98/07740. Согласно одному из вариантов настоящего изобретения предусматривается, что боковая цепь R7 не может иметь значений, указанных для нее в заявке РСТ/ЕР 97/04517 для этой боковой цепи.R3 в 7-замещенных эстратриенах по изобретению обозначает предпочтительно атом водорода. В то же время гидроксигруппа может быть этерифицирована с образованием простого эфира прямоцепочечным либо разветвленным,насыщенным либо ненасыщенным углеводородным остатком с числом атомов углерода до 8 включительно, таким например, как метил, этил,пропил, изопропил, бутил, изобутил, третбутил, пентил, изопентил, неопентил, гептил,гексил или октил, либо может быть этерифицирована с образованием сложного эфира ацильным остатком R3' -С(О)-, где R3' представляет собой атом водорода или углеводородный остаток с числом атомов углерода до 8 включительно либо фенильный остаток. Предпочтительным значением заместителяR11 является атом фтора. Заместитель R17 может обозначать атом водорода или остаток субформулы R17'-С(O)-, где R17' представляет собой атом водорода или углеводородный остаток с числом атомов углерода до 8 включительно. Предпочтителен для R17 атом водорода. Углеводородный остаток может представлять собой,например, метил, этил, пропил, изопропил, бу 002623 4 тил, изобутил, трет-бутил, пентил, изопентил,неопентил, гептил, гексил или октил. В предлагаемых согласно изобретению соединениях общей формулы IA обозначает прямую связь, фениленовый либо бензилиденовый остаток, причем в последнем случае метиленовая группа связана с атомом углерода стероидного скелета в положении 7. Под понятием "арильный остаток" в контексте настоящего описания имеются в виду фенильный, 1- либо 2-нафтильный остаток,предпочтителен из которых фенильный остаток. Если не указано иное, понятие "арил" во всех случаях включает и гетероарильный остаток. В качестве примеров такового можно назвать 2-,3- либо 4-пиридинил, 2- либо 3-фурил, 2- либо 3-тиенил, 2- либо 3-пирролил, 2-, 4- либо 5 имидазолил, пиразинил, 2-, 4- либо 5 пиримидинил и 3- либо 4-пиридазинил. Аралкильные группы в R20 и R31 могут содержать в кольце до 14 С-атомов, предпочтительно 6-10 С-атомов, а в алкильной цепи - 1-8,предпочтительно 1-4 С-атома. В качестве аралкильных групп можно назвать, например, бензил, фенилэтил, фенилпропил, нафтилметил и нафтилэтил. В качестве гетероаралкильного остатка можно назвать, например, фурилметил,тиенилэтил и пиридилпропил. Аралкильный,соответственно гетероаралкильный остаток может быть замещенным. В тех случаях, когда R20 и R21 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный гетероцикл с 5 либо 6 звеньями цепи, который необязательно содержит еще один или два гетероатома, выбранных из группы, включающей азот, кислород и серу, речь идет прежде всего о пирролидиновом, пиперидиновом, морфолиновом либо пиперазиновом кольце. В качестве заместителей для арильного,гетероарильного, аралкильного и гетероаралкильного остатков можно назвать, например,трифторметил, пентафторэтил, трифторметилтио, метокси, этокси, нитро, циано, галоген(фтор, хлор, бром, иод), гидрокси, амино, моно(С 1-С 8 алкил)- или ди(С 1-С 8 алкил) амино, причем обе алкильные группы являются идентичными либо разными, ди(аралкил) амино, причем обе аралкильные группы являются идентичными либо разными (аралкил см. выше значенияR20 и R31) и 1-метоксиацетиламино. Атом серы в боковой цепи может быть представлен в виде простого серного мостика(сульфид), в виде сульфона или сульфоксида. Касательно боковой цепи R7 согласно настоящему изобретению можно назвать в качестве примеров следующие остатки (А обозначает прямую связь): остаток формулы -(CH2)s-Z-R20,гдеs обозначает целое число в пределах 3-8, Z представляет собой -NR21, a R21 обозначает C1 С 3 алкильную группу, иR20 обозначает атом водорода, С 1-С 9 алкильную группу или одну из следующих группировок:-(СН 2)m-СnF2n+1, где m и n каждый независимо друг от друга обозначает целое число в пределах 1-8,-(CH2)o-CH=CF-CpF2p+1, где о обозначает 1,2 или 3, а р обозначает целое число в пределах 2-7,-(СН 2)m-О-(СН 2)q-арил, где m имеет вышеуказанное значение, q обозначает 0, 1, 2 или 3, а арил представляет собой необязательно однолибо двукратно замещенный фенильный или гетероарильный остаток,-(СН 2)m-О-(СН 2)r-CnF2n+1, где m и n имеют вышеуказанные значения, аr обозначает целое число в пределах 1-5; остаток формулы -(CH2)s-Z-R20, гдеs обозначает целое число в пределах 3-8,Z представляет собой -NR21, a R21 обозначает С 1-С 3 алкильную группу, и R20 и R21 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный гетероцикл с 5 либо 6 звеньями цепи, который необязательно содержит еще один или два гетероатома, выбранных из группы, включающей азот, кислород и серу, и который может быть замещен; остаток формулы - (СН 2)s-Z-R20, гдеs обозначает целое число в пределах 3-8,Z представляет собой -SOx-, a x обозначает 0, 1 или 2, иR20 представляет собой группу -(СH2)m-O(СH2)r-СnF2n+1, где m и n имеют вышеуказанные значения, а r обозначает целое число в пределах 1-5. В качестве особых боковых цепей следует назвать следующие:-(СН 2)5N(СН 3)(СН 2)3 СH(CH3)2,-(СН 2)5N(СН 3)(СН 2)3-пиридил,-(СН 2)5N(СН 3)(СН 2)3-фенил,-(СН 2)5N(СН 3)(СН 2)2-п-толил,-(СН 2)5N(СН 3)(СН 2)2-п-этoкcифeнил,-(СН 2)5N(СН 3)(СН 2)3-п-толил,-(СН 2)5N(СН 3)(СН 2)3-п-xлopфeнил,-(СН 2)5N(СН 3)(СН 2)3-O-CH2-фенил,-(СН 2)5N(СН 3)(СН 2)2-O-п-Вr-фенил,-(СН 2)5N(СН 3)(СН 2)2-О-п-СF3-фенил. Особые соединения общей формулы I описаны в примерах. Настоящее изобретение относится не только к этим соединениям общей формулы I, но в случае наличия в R7 атома азота и к их физиологически приемлемым аддитивным солям с органическими и неорганическими кислотами, к фармацевтическим препаратам, содержащим эти соединения общей формулы I, включая их кислотно-аддитивные соли, а также к их применению для изготовления лекарственных средств. Для образования кислотно-аддитивных солей пригодны неорганические и органические кислоты, известные специалисту в данной области техники и используемые для получения физиологически приемлемых солей. В качестве таких кислотно-аддитивных солей следует назвать прежде всего гидрохлориды, гидробромиды, ацетаты, цитраты, оксалаты, тартраты и метансульфонаты. Соединения общей формулы I представляют собой соединения с высокой антиэстрогенной эффективностью. Под предлагаемыми в изобретении соединениями имеются в виду, с одной стороны, чистые антиэстрогены, а с другой стороны, так называемые частичные (неполные) антагонисты,т.е. антиэстрогены с частичным эстрогенным действием, такие как тамоксифен или ралоксифен. В отличие от тамоксифена неполные антагонисты общей формулы I проявляют свое агонистическое, эстрогенное действие избирательно по отношению к тканям. В первую очередь это агонистическое действие проявляется по отношению к костным тканям, в сердечнососудистой системе и в центральной нервной системе (ЦНС). Что же касается матки, то агонистическое действие не наблюдается вовсе или проявляется лишь в очень малой степени. Соединения с антиэстрогенными свойствами, т.е. вещества, обладающие ингибирующим действием по отношению к эстрогенам,уже описаны в многочисленных публикациях. Так, в частности, в качестве соединений, наиболее близких по их структуре предлагаемым соединениям общей формулы I, следует рассматривать стероидные производные, описанные в ЕР 0138504 В 1. 7-[9-(4,4,5,5,5-Пентафторпентилсульфинил)-н-нонил]эстра-1,3,5(10)триен-3,17-диол(ЕР-А 0138504, с. 58, предпоследнее соедине 7 ние) проходит в настоящее время клинические испытания в гормонозависимой терапии опухолей (рака молочной железы) и является на сегодняшний день наилучшим известным соединением из числа указанных стероидных производных, т.е. обладающим наиболее эффективным антиэстрогенным действием. Фармацевтические композиции, содержащие в своем составе ингибиторы половых стероидов со стероидным скелетом, который имеет 7-боковую цепь при одновременном присутствии, по меньшей мере, еще одного заместителя в положении 14, 15 или 16, являются объектом изобретения в ЕР-А 0367576. Целый ряд соединений самого разного типа - в частности таковые стероидного происхождения, а также с 2-фенилиндольным скелетом-,обладающие антиэстрогенным действием и/или подавляющие биосинтез эстрогенов, описаны в заявке WO 93/10741. Другие стероидные антиэстрогены, несущие 11-фенильную группу, описаны в EP-AS 0384842 и 0629635. Предлагаемые в изобретении соединения представляют собой антиэстрогены с более сильным в большинстве случаев антиэстрогенным действием по сравнению с упомянутым выше 7-[9-(4,4,5,5,5-пентафторпентилсульфинил)-н-нонил]эстра-1,3,5(10)триен-3,17-диолом и/или представляют собой соединения, которые отличаются от 7-[9-(4,4,5,5,5-пентафторпентилсульфинил)-н-нонил]эстра-1,3,5(10)триен 3,17-диола своим частичным эстрогенным действием. Соединения общей формулы I по изобретению отличаются от известных стероидных производных согласно ЕР-А 0138504 и ЕР-А 0367576 наличием дополнительного атома 11 фтора. Эта структурная модификация имеет решающее значение для получения важных свойств предлагаемых соединений. Антиэстрогенную эффективность соединений по изобретению определяли в испытаниях по трансактивации. [Demirpence E., Duchesnereceptor in the cell-type and promoter-context dependent agonistic activity of the anti-estrogen 4hydroxytamoxifen; журнал The EMBO Journal,том 9, стр. 2811-2818 (1990)]. Клетки линии MVLN стабильно трансфектированы репортерным геном Vit-TK-LUC. Антиэстрогенную эффективность выявляли в присутствии 0,1 нМ эстрадиола.IC50-значения новых соединений находятся в диапазоне наномолярных концентраций. В отношении клеток линии MVLN для соедине 002623 8 ний из примеров 3 и 8 были получены следующие IC50-значения (тесты проводили в соответствии с вышеуказанными источниками): Соединение Пример 3 Пример 8 Результаты теста по исследованию роста матки у молодой особи крысы, при пероральном введении (тест на антиэстрогенное действие invivo) также подтверждают антиэстрогенную эффективность соединений по изобретению. Тестирование проводили по описанной ниже методике. Тест по исследованию роста матки у молодой особи крысы (антиэстрогенное действие) Методический принцип Реакция матки у грызунов на введение эстрогенов проявляется в увеличении веса (наблюдается как пролиферация, так и накопление воды). Этот рост следует подавлять за счет одновременного введения в соответствующей дозировке соединений, обладающих антиэстрогенным действием. Экспериментальная часть Животные Молодые женские особи крысы весом 3545 г в начале опытов, каждую дозу вводили 5-6 животным. Рецептура и введение субстанций Для перорального введения субстанции растворяли в 1 части этанола (Э) и дополняли 9 частями арахисового масла (AM). Проведение опытов Отнятых непосредственно от матери молодых особей крысы для адаптации к новым условиям доставляли за день до начала опытов и им сразу же - в том числе и в клетках - давали корм. Затем ежедневно один раз в течение 3 дней животным вводили тестируемую субстанцию в сочетании с 0,5 мкг эстрадиолбензоата (ЭБ). ЭБ вводили во всех случаях подкожно, тогда как тестируемую субстанцию вводили перорально. По истечении 24 ч после последнего введения животных взвешивали, умерщвляли и у них удаляли матку. Затем определяли вес препарированных маток во влажном состоянии (без содержимого). Контроль Отрицательный контроль: наполнитель(Э/АМ), 0,2 мл/животное/день. Положительный контроль: 0,5 мкг ЭБ/0,1 мл/животное/день. Оценка результатов На основе относительного веса удаленного органа (мг/100 г веса тела) для каждой группы определяли средние значения со стандартным отклонением (ХСО), а также среднюю статистическую значимость различий по отношению к контрольной группе по критерию Даннета(р 0,05). Степень подавления (в %) относитель 9 но ЭБ-контроля рассчитывали с помощью соответствующего программного обеспечения. Относительную эффективность испытуемых субстанций выявляли с помощью ковариационнного анализа и регрессионного анализа. Антиутеротрофное (подавляющее рост матки) действие на крысе Соединение из примера Антиутеротрофное действие при 0,3 мг [% подавления] 3 68 8 0 Под понятием "чистые антиэстрогены" в контексте настоящего описания имеются в виду такие соединения общей формулы I, которые в описанном ниже in vitro-тесте по исследованию эстрогенного действия не проявляют никакого агонистического эффекта либо проявляют его лишь в малой степени, т.е. агонистическое действие порядка 20% действия эстрадиола. Частичное эстрогенное действие Границы между чистыми антиэстрогенами и неполными агонистами, т.е. эстрогенами, обладающими избирательностью действия по отношению к тканям, не являются строго определенными ("размыты"). Тем самым соединения с незначительной агонистической эффективностью также могут использоваться при показаниях, указанных ниже для применения чистых антиэстрогенов. Частичное эстрогенное действие соединений по изобретению определяли в исследованиях по трансактивации. С этой целью клетки линии HeLa трансфектировали вектором экспрессии (HEGO) эстрогенного рецептора человека и репортерным геном rPR-TK-CAT. Этот репортерный ген содержит "эстрогенный ответный элемент" кроличьего прогестеронного рецептора (область + 698/+729) перед геном ТК-САТinvolved in the regulation of the progesterone receptor gene, EMBO J. 10, стр. 1875-1883 (1991. Эстрогенную эффективность определяли при концентрации 1 мкМ. Частичное эстрогенное действие: Соединение из примера Активация промотора-25 8 48 18 29 12 34 22 53 Примечание:отрицательный показатель означает супрессию активности репортерного гена ниже контрольных значений. Предлагаемые в изобретении соединения,прежде всего когда они являются чистыми антиэстрогенами, могут применяться для терапии обусловленных эстрогенами заболеваний, таких например, как рак молочной железы (терапия 10 второго порядка (second-line) рака молочной железы в случае резистентности к тамоксифену; для адьювантного лечения рака молочной железы вместо тамоксифена), рак эндометрия, рак предстательной железы, гиперплазия предстательной железы, ановуляционное бесплодие и меланома. Чистые антиэстрогены общей формулы I могут использоваться, кроме того, в качестве компонента в описанных в ЕР 346014 В 1 продуктах, содержащих в своем составе эстроген и чистый антиэстроген, а именно, для одновременного, последовательного либо раздельного применения в целях селективной эстрогенной терапии женщин во время либо после менопаузы. Соединения общей формулы I, прежде всего когда они являются чистыми антиэстрогенами,могут применяться совместно с антигестагенами (конкурентными антагонистами прогестерона) для лечения гормонозависимых опухолей(см. ЕР 310542 А). Другими показателями к возможному применению соединений общей формулы I являются выпадение волос у мужчин, диффузная алопеция либо алопеция как следствие химиотерапии, а также гирсутизм (см. Hye-Sun Oh и(1996), стр. 12525-12530). Кроме того, соединения общей формулы I могут использоваться для изготовления медикаментов, предназначенных для лечения эндометриоза и рака эндометрия. Далее, соединения общей формулы I можно применять для получения фармацевтических композиций, предназначенных для контроля мужского и женского бесплодия (мужское бесплодие: DE 19510862.0). Те соединения общей формулы I, которые обладают частичным эстрогенным действием,избирательным по отношению к тканям, могут найти применение в первую очередь для профилактики и терапии остеопороза и для изготовления препаратов, предназначенных в качестве средств гормонозаместительной терапии (ГЗТ) в период перед менопаузой, во время менопаузы и после нее. (см. Black, L.J., Sato, M., Rowley, E.R.,Magee, D.E., Bekele, A., Williams, D.C., Cullinan,G.J., Bendele, R., Kauffman, R.F., Bensch, W.R.,Frolik, C.A., Termine, J.D. and Bryant, H.U.: Raloxifene [LY 139481 HCl] prevents bone loss andInvest. 93: стр. 63-69, 1994). Настоящее изобретение относится также к фармацевтическим препаратам, содержащим в своем составе по меньшей мере одно соединение общей формулы I (или их физиологически приемлемые аддитивные соли с органическими и неорганическими кислотами) и к применению этих соединений для изготовления лекарственных средств, предназначенных прежде всего для лечения обусловленных эстрогенами заболева 11 ний и опухолей, и лекарственных средств для гормонозаместительной терапии (ГЗТ). Предлагаемые в изобретении соединения и их кислотно-аддитивные соли пригодны для получения соответствующих фармацевтических составов и композиций. Фармацевтические композиции, соответственно лекарственные средства содержат в качестве активного вещества одно либо несколько соединений по изобретению или их кислотно-аддитивные соли, необязательно в смеси с другими фармакологически, соответственно фармацевтически активными веществами. Лекарственные средства изготавливают по известной технологии с возможным использованием при этом известных и обычных фармацевтических вспомогательных веществ, равно как и других обычных носителей и разбавителей. В качестве таких носителей и вспомогательных веществ приемлемы среди прочих указанные, соответственно рекомендуемые для применения в фармацевтике, косметике и других родственных областях: Ullmans Encyklopadie der technischen Chemie, том 4 (1953),стр. 1-39; Journal of Pharmaceutical Sciences, том 52 (1963), стр. 918 и далее; Н. v. CzetschLindenwald, Hilfsstoffe fr Pharmazie und angrenzende Gebiete; Pharm. Ind.2, 1961, стр. 72 и далее; Dr. H.P. Fiedler, Lexikon der Hilfsstoffe furPharmazie, Kosmetik und angrenzende Gebiete,изд-во Cantor KG. Аулендорф в Вюртемберге 1971. Соединения можно вводить орально или парентерально, например внутрибрюшинно,внутримышечно, подкожно либо чрескожно. Возможна и имплантация соединений в ткань. Вводимое количество соединений варьируют в широких пределах, но с учетом в любом случае конкретных требований. В зависимости от состояния пациента и метода введения суточная доза назначаемого соединения может составлять от 0,1 до 25 мг/кг веса тела, предпочтительно от 0,5 до 5 мг/кг веса тела. Для человека это соответствует суточной дозе от 5 до 1250 мг, предпочтительно она составляет 50-200 мг. Такая доза рекомендуется прежде всего при терапии опухолей. Для орального введения могут назначаться капсулы, пилюли, таблетки, драже и т.п. Унифицированные дозы наряду с активным веществом могут содержать фармацевтически приемлемый носитель, как например крахмал, сахар,сорбит, желатин, замасливатели, кремниевую кислоту, тальк и т.п. Одна унифицированная доза для орального введения может содержать,например, от 5 до 500 мг активного вещества. Для достижения лучшей биосовместимости активного вещества соединения можно приготавливать также в виде циклодекстринклатратов. С этой целью соединения подвергают взаимодействию с -, - или -циклодекстрином либо его производными (см. РСТ/ЕР 95/02656). 12 Для парентерального введения активные вещества могут быть растворены либо суспендированы в соответствующем физиологически приемлемом разбавителе. В качестве разбавителей очень часто используют масла с добавками или без добавок вещества, способствующего растворению, поверхностно-активного вещества, суспендирующего агента или эмульгатора. В качестве примеров используемых в указанных целях масел можно назвать оливковое масло,арахисовое масло, хлопковое масло, соевое масло, касторовое масло и кунжутное масло. Из соединений общей формулы I можно приготавливать также композицию в виде раствора, предназначенного для орального введения и содержащего наряду с активным соединением общей формулы I: а) фармацевтически приемлемое масло и/или б) фармацевтически приемлемое липофильное поверхностно-активное вещество и/или в) фармацевтически приемлемое гидрофильное поверхностно-активное вещество и/или г) фармацевтически приемлемый смешиваемый с водой растворитель. В дополнение к этому можно сослаться на заявку WO 97/21440. Предлагаемые соединения могут применяться также в форме раствора для инъекций продленного действия или имплантатного препарата, которые можно приготавливать таким образом, чтобы обеспечить постепенное, замедленное высвобождение активного вещества. Имплантаты могут содержать в качестве инертных материалов, например, подверженные биологической деструкции полимеры или синтетические силиконы, такие как силоксановый каучук. Кроме того, для чрескожного введения активные вещества можно, например, заделывать в пластырь. Для изготовления содержащих активные соединения общей формулы I внутривагинальных (например вагинальных колец) или внутриматочных систем (например пессариев, спиралей) пригодны различные полимеры, такие например, как кремнийорганические полимеры,этиленвинилацетат, полиэтилен и полипропилен. Соединения по изобретению могут быть получены по описанной ниже технологии. Более подробно изобретение поясняется на представленных далее примерах. Аналогичным путем с использованием аналогичных реагентов в соответствии с указанными в примерах условиями можно получить и другие соединения общей формулы I. Для построения боковой цепи R7 в соединениях по изобретению прежде всего пригодны также методы введения и построения боковых цепей, описанные в заявке ЕР 0138504 В 1, при этом, однако, в качестве исходного соединения вместо 6-нортестостерона, гидроксифункцио 13 нальная группа которого в положении 17 ацилирована, следует использовать 11-фтористое соединение, а именно 11-фтор-6-андростендион. Восстановление кетогруппы в положении 17 происходит в этом случае на одной из последующих стадий. Соединения общей формулы I, где R31 представляет собой остаток формулы -C(O)R33,путем полного восстановления кетогруппы амида карбоновой кислоты с помощью алюмогидрида лития или подобных восстановителей можно переводить по методам, известным специалисту в данной области техники, в соединения, где R31 представляет собой -CH2-R33. Тиомостик в боковой цепи с помощью периодата натрия можно окислять до сульфоксида(пример 24 о); с помощью перкислоты в качестве окислителя, например м-хлорпербензойной кислоты, из сульфидов получают сульфоны. Омыление сложноэфирных группировок,равно как и этерификацию свободных гидроксигрупп с образованием сложных, соответственно простых эфиров осуществляют в каждом случае по общепринятым способам органической химии. С учетом различной реакционной способности этерифицированной и свободной 3 и 17-гидроксигруппы 3,17-диэфиры можно избирательно расщеплять в положении 3, после чего 3-гидрокси-17-ацилоксисоединение направленно в положении 3 функционализовать далее; в равной степени успешно можно этерифицировать 3,17-дигидроксисоединение избирательно лишь в положении 3 с образованием сложных, соответственно простых эфиров и затем направленно в положении 17 вводить другой остаток, отличающийся от уже находящегося в положении 3. Кислотно-аддитивные соли соединений общей формулы I могут быть получены также с помощью обычных методов из соединений общей формулы I. Как указывалось выше, изобретение поясняется более подробно на представленных ниже примерах. Примеры Пример 1. 11-Фтор-7-5-[метил-(8,8,9,9,9-пентафторнонил)амино]пентилэстра-1,3,5[5,4,0]ундец-7-ена при 0 С добавляют по каплям 4,6 мл фторида перфторбутан-1-сульфокислоты. По истечении 30 мин раствор разбавляют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 3,8 г 11-фторэстр-4-ен 3,17-диона с температурой плавления 173174 С. 11-Фтор-3-метоксиэстра-3,5-диен-17 он. 7,8 г 11-Фторэстр-4-ен-3,17-диона перемешивают в 40 мл 2,2-диметоксипропана с 780 мг толуол-4-сульфоната пиридиния в течение 5 ч при 80 С. Затем добавляют 1,5 мл триэтиламина, разбавляют уксусным эфиром и промывают насыщенным раствором хлорида натрия. После кристаллизации из метанола получают 5,3 г 11-фтор-3-метоксиэстра-3,5-диен-17-она с температурой плавления 173 С. в) 11-Фторэстра-4,6-диен-3,17-дион. К 5 г 11-фтор-3-метоксиэстра-3,5-диен 17-она в 50 мл ДМФ последовательно добавляют при 0 С 5 мл 10%-ного раствора ацетата натрия и порциями 2,5 г 1,3-дибром-5,5 диметилгидантоина. По истечении 30 мин добавляют сначала 2,3 г сульфита натрия, а затем 2,5 г бромида лития и 2 г карбоната лития и перемешивают в течение 2 ч при 100 С. Реакционную смесь сливают при перемешивании в ледяную воду. Затем выпавший продукт отфильтровывают с помощью вакуум-фильтра,растворяют в уксусном эфире, промывают водой, сушат и концентрируют под вакуумом. После перекристаллизации из уксусного эфира получают 3,6 г 11-фторэстра-4,6-диен-3,17 диона с температурой плавления 198 С. г) 11-Фтор-7-(5-трет-бутилдиметилсилилоксипентил)эстр-4-ен-3,17-дион. 7,9 г Магния в 40 мл ТГФ подвергают в атмосфере азота взаимодействию с раствором из 95,3 г 1-бром-5-трет-бутилдиметилсилилоксипентана [Tetrahedron Letters (1982), стр. 41474150] в 260 мл ТГФ с получением в результате реагента Гриньяра. Затем при -30 С добавляют 32 г иодида меди(I), после чего по каплям добавляют 29 г 11-фторэстра-4,6-диен-3,17-диона в 290 мл ТГФ. По завершении реакции примешивают 20,4 мл ледяной уксусной кислоты и реакционную смесь сливают при перемешивании в ледяную воду. Выпавший продукт отфильтровывают с помощью вакуум-фильтра,растворяют в уксусном эфире, нейтрализуют путем промывки водой и сушат. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 23,9 г 11 фтор-7-(5-трет-бутилдиметилсилилоксипентил)эстр-4-ен-3,17-диона в виде пенистого вещества. д) 11-Фтор-7-(5-гидроксипентил)эстр-4 ен-3,17-дион. Раствор из 23,1 г 11-фтор-7-(5-третбутилдиметилсилилоксипентил)эстр-4-ен-3,17 диона в 115 мл ТГФ и 64 мл воды перемешивают со 128 мл ледяной уксусной кислоты в течение 2,5 ч при 50 С. Затем реакционную смесь концентрируют под вакуумом, растворяют в уксусном эфире, промывают водой и сушат. В результате получают 20,4 г 11-фтор-7-(5 гидроксипентил)эстр-4-ен-3,17-диона в виде пенистого вещества. е) 7-(5-бромпентил)-11 фторэстр-4-ен-3,17-дион К раствору из 33 г 11 фтор-7-(5-гидроксипентил)эстр-4-ен-3,17 диона в 330 мл дихлорметана примешивают при-5 С 28,9 г трифенилфосфи-на и 36,7 г тетрабромметана и перемешивают в течение 0,5 ч. Затем добавляют дихлорметан и промывают водой, а также насыщенным раствором гидрокарбоната натрия и поваренной соли. Органическую фазу сушат над сульфатом натрия и концентрируют под вакуумом. После этого сырой продукт хроматографируют на силикагеле градиентом гексан/уксусный эфир, получая в результате 28,5 г 7-(5-бромпентил)-11 фторэстр-4-ен-3,17-диона с температурой плавления 75-76 С. ж) 7-(5-Бромпентил)-11-фтор-3-гидроксиэстра-1,3,5(10)триен-17-он. К 27,8 г 7-(5-бромпентил)-11-фторэстр 4-ен-3,17-диона в 190 мл ацетонитрила добавляют при 80 С 17 г бромида меди(II). По истечении 8 ч реакционную смесь сливают при перемешивании в воду, трижды экстрагируют уксусным эфиром, дважды промывают хлоридом аммония, гидрокарбонатом натрия и поваренной солью, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 20,4 г 7-(5-бромпентил)-11-фтор-3 гидроксиэстра-1,3,5(10)триен-17-она в виде бесцветных кристаллов с температурой плавления 178 С. з) 7-(5-Бромпентил)-11-фторэстра-1,3,5(10)-триен-3,17-диол. К раствору из 16,2 г 7-(5-бромпентил)11-фтор-3-гидроксиэстра-1,3,5 (10)триен-17 она в 162 мл тетрагидрофурана и из 90 мл этанола и 36 мл воды примешивают порциями при 0 С 4,7 г борогидрида натрия и перемешивают в течение 2 ч при 0 С. Затем сливают на воду,четырежды экстрагируют уксусным эфиром,промывают водой и раствором поваренной соли,сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 17,1 г сырого продукта. После хроматографии на силикагеле гексаном/уксусным эфиром получают 15,6 г чистого 7-(5-бромпентил)-11 фторэстра-1,3,5(10)-триен-3,17-диола. и) 11-Фтор-7-[5-(метиламино)пентил] эстра-1,3,5(10)-триен-3,17-диол. Раствор из 2 г 7-(5-бромпентил)-11 фторэстра-1,3,5(10)-триен-3,17-диола в 20 мл диметилформамида перемешивают с 8 мл 40%ного водного раствора метиламина в течение 3,5 ч при 80 С. Затем смесь сливают на воду, трижды экстрагируют уксусным эфиром, промывают водой и раствором поваренной соли, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 1,77 г 11-фтор-7 002623[5-(метиламино)пентил]эстра-1,3,5(10)-триен 3,17-диола. к) 11-Фтор-7-5-[метил-(8,8,9,9,9-пентафторнонил)амино]пентилэстра-1,3,5(10)-триен-3,17-диол. Раствор из 1,77 г 11-фтор-7-[5-(метиламино)пентил]эстра-1,3,5(10)-триен-3,17-диола в 18 мл диметилформамида перемешивают с 1,4 г 8,8,9,9,9-пентафторнонилтозилата в течение 1 ч при температуре ванны 80 С. Затем смесь сливают на воду, трижды экстрагируют уксусным эфиром, промывают водой и раствором поваренной соли, сушат над сульфатом натрия,концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. Таким путем получают 11-фтор-7-5-[метил(8,8,9,9,9-пентафторнонил)амино]пентил]эстра 1,3,5(10)-триен-3,17-диол в виде кристаллов с температурой плавления 110 С. Получение исходных соединений 8,8,9,9,9-Пентафторнонилтозилат. а) 4-Бензилоксибутан-1-ол. 42 г Гидрида натрия (60%-ного) порциями вводят при комнатной температуре в 900 мл абсолютного ДМФ. Затем к охлажденной до-20 С суспензии по каплям добавляют 88,6 мл 1,4-бутандиола в 450 мл абсолютного ДМФ таким образом, чтобы внутренняя температура не превышала -15 С. По завершении процесса добавления постепенно по каплям добавляют раствор из 121 мл бензилбромида в 870 мл абсолютного ДМФ, после чего реакционную смесь перемешивают в течение 30 мин при комнатной температуре. Реакцию завершают, осторожно добавляя 315 мл воды. Для дальнейшей переработки реакционную смесь сливают при перемешивании в 1,5 л воды и трижды экстрагируют порциями по 1 л простого эфира соответственно. Затем эфирные фазы объединяют, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии на силикагеле градиентом гексан/уксусный эфир получают 105 г 4-бензилоксибутан-1-ола в виде масла. б) 4-Бензилокси-1-бромбутан. К охлажденному до -15 С раствору из 105 г 4-бензилоксибутан-1-ола и 191 г трифенилфосфина в 1 л метиленхлорида добавляют порциями 239 г тетрабромметана и по завершении процесса добавления перемешивают в течение 1 ч при 0 С. После концентрирования под вакуумом реакционной смеси проводят очистку посредством хроматографии на силикагеле градиентом гексан/уксусный эфир. В результате получают 133 г 4-бензилокси-1-бромбутана в виде масла. в) 1-Бензилокси-8,8,9,9,9-пентафторнонан. К суспензии из 2,23 г магниевой стружки в 58 мл абсолютного ТГФ сначала добавляют при комнатной температуре 10% раствора из 20 г 4 бензилокси-1-бромбутана в 20 мл абсолютного 17 ТГФ. После начала реакции, инициированного за счет добавления иода, по каплям добавляют остальную часть раствора таким образом, чтобы поддерживать внутреннюю температуру на уровне 40 С. По завершении процесса добавления продолжают перемешивание еще в течение 1 ч при комнатной температуре, после чего раствор декантируют, отделяя от избыточного магния, и подают в капельную воронку. Далее этот раствор одновременно с раствором из 21 г 1,1,1,2,2-пентафтор-5-иодпентана в 97 мл абсолютного ТГФ добавляют по каплям при 0 С к раствору из 555 мг хлорида меди (II) и 350 мг хлорида лития в 58 мл абсолютного ТГФ. В течение еще 1 ч продолжают перемешивать при комнатной температуре, после чего реакционную смесь сливают при перемешивании в насыщенный раствор хлорида аммония, трижды экстрагируют простым эфиром, органическую фазу сушат над сульфатом магния и концентрируют под вакуумом. После препаративной колоночной хроматографии на силикагеле градиентом гексан/уксусный эфир получают 22 г практически полностью очищенного 1-бензилокси-8,8,9,9,9-пентафторнонана в виде масла. г) 8,8,9,9,9-Пентафторнонан-1-ол. 16 г 1-Бензилокси-8,8,9,9,9-пентафторнонана растворяют в 700 мл абсолютного метиленхлорида, примешивают при 0 С 18,4 мл N,Nдиметиланилина и перемешивают в течение 5 мин. Затем порциями добавляют 26,4 г трихлорида алюминия и реакционную смесь нагревают в течение 45 мин до 50 С. Для дальнейшей переработки смеси дают нагреться до комнатной температуры, сливают ее при перемешивании в 2 н. соляную кислоту, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. Сырой продукт хроматографируют на силикагеле градиентом гексан/уксусный эфир, получая в результате 8,6 г 8,8,9,9,9-пентафторнонан-1-ола в виде масла. д) 8,8,9,9,9-Пентафторнонилтозилат. В 26 мл абсолютного пиридина растворяют 3 г 8,8,9,9,9-пентафторнонан-1-ола, при 0 С добавляют 3,1 г п-толуолсульфонилхлорида и перемешивают в течение 1,5 ч на холоде. Затем реакционную смесь сливают в воду, трижды экстрагируют простым эфиром, сушат над сульфатом магния и концентрируют под вакуумом. После препаративной колоночной хроматографии на силикагеле градиентом гексан/уксусный эфир получают 4,1 г 8,8,9,9,9 пентафторнонилтозилата в виде прозрачного масла. 9,9,10,10,10-Пентафтордецилтозилат. а) 5-Бензилоксипентан-1-ол. 31,5 г Гидрида натрия (60%-ного) вводят порциями при комнатной температуре в 900 мл абсолютного ДМФ. Затем к охлажденной до-20 С суспензии по каплям добавляют 104,8 мл 1,5-пентадиола в 450 мл абсолютного ДМФ таким образом, чтобы внутренняя температура не 18 превышала -15 С. По завершении процесса добавления постепенно добавляют по каплям раствор из 121 мл бензилбромида в 870 мл абсолютного ДМФ, после чего реакционную смесь перемешивают в течение 30 мин при комнатной температуре. Осторожно добавляя 315 мл воды,реакцию завершают. Для дальнейшей переработки смесь сливают при перемешивании в 1,5 л воды и трижды экстрагируют порциями по 1 л простого эфира соответственно. Затем эфирные фазы объединяют, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии на силикагеле градиентом гексан/уксусный эфир получают 85 г 5 бензилоксипентан-1-ола в виде масла. б) 5-Бензилокси-1-бромпентан. К охлажденному до -15 С раствору из 85 г 5-бензилоксипентан-1-ола и 143 г трифенилфосфина в 720 мл метиленхлорида порциями добавляют 179 г тетрабромметана и по завершении процесса добавления перемешивают в течение 3 ч при 0 С. После концентрирования реакционной смеси под вакуумом проводят очистку посредством хроматографии на силикагеле градиентом гексан/метиленхлорид, получив в результате 71 г 5-бензилокси-1-бромпентана в виде масла. в) 1-Бензилокси-9,9,10,10,10-пентафтордекан. К суспензии из 2,23 г магниевой стружки в 58 мл абсолютного ТГФ при комнатной температуре добавляют сначала 10% раствора из 21,1 г 5-бензилокси-1-бромпентана в 20 мл абсолютного ТГФ. После начала реакции, инициированного добавками иода, по каплям добавляют остальную часть раствора таким образом, чтобы поддерживать внутреннюю температуру на уровне 40 С. По завершении процесса добавления перемешивание продолжают еще в течение 1 ч при комнатной температуре, после чего избыточный магний отделяют декантацией, а раствор подают в капельную воронку. Далее этот раствор одновременно с другим раствором из 21 г 1,1,1,2,2-пентафтор-5-иодпентана в 97 мл абсолютного ТГФ при 0 С добавляют по каплям к раствору из 555 мг хлорида меди(II) и 350 мг хлорида лития в 58 мл абсолютного ТГФ. Перемешивание продолжают еще в течение 1 ч при комнатной температуре, после чего реакционную смесь сливают при перемешивании в насыщенный раствор хлорида аммония, трижды экстрагируют простым эфиром, органическую фазу сушат над сульфатом магния и концентрируют под вакуумом. В результате получают 26,8 г сырого продукта, который без дальнейшей очистки используют на последующей стадии. г) 9,9,10,10,10-Пентафтордекан-1-ол. 26 г 1-Бензилокси-9,9,10,10,10-пентафтордекана растворяют в 1000 мл абсолютного метиленхлорида, смешивают при 0 С с 28,9 млN,N-диметиланилина и перемешивают в течение 5 мин. Затем порциями добавляют 41,1 г 19 трихлорида алюминия и реакционную смесь нагревают в течение 45 мин до 50 С. Для дальнейшей переработки смеси дают остыть до комнатной температуры, сливают ее при перемешивании в 2 н. соляную кислоту, трижды экстрагируют метиленхлоридом, органическую фазу промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. Сырой продукт хроматографируют на силикагеле градиентом гексан/уксусный эфир, получив в результате 7,8 г 9,9,10,10,10 пентафтордекан-1-ола в виде масла. д) 9,9,10,10,10-Пентафтордецилтозилат. В 8 мл абсолютного пиридина растворяют 1,0 г 9,9,10,10,10-пентафтордекан-1-ола, при 0 С добавляют 985 мг п-толуолсульфонилхлорида и перемешивают в течение 2 ч на холоде. Затем реакционную смесь сливают в воду, трижды экстрагируют простым эфиром, сушат над сульфатом магния и концентрируют под вакуумом. После препаративной колоночной хроматографии на силикагеле градиентом гексан/уксусный эфир получают 1,5 г 9,9,10,10,10 пентафтордецилтозилата в виде масла.N-Метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]амин. а) 3-Иодпропил-4,4,5,5,5-пентафторпентилсульфид. Раствор из 22,8 г 3-хлорпропил-4,4,5,5,5 пентафторпентилсульфида в 500 мл этилметилкетона в течение 5 ч при температуре ванны 100 С перемешивают в атмосфере азота с 40 г иодида натрия. Затем концентрируют досуха под вакуумом, смешивают с водой, трижды экстрагируют простым эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 30,6 г 3-иодпропил-4,4,5,5,5 пентафторпентилсульфида. б) N-Метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]амин. В раствор из 30,6 г 3-иодпропил-4,4,5,5,5 пентафторпентилсульфида в 200 мл абсолютного тетрагидрофурана при температуре ванны-78 С подают в конденсированном виде 45 г метиламина и в течение 1,5 ч перемешивают сначала при комнатной температуре, а затем в течение 4 ч при 60 С в реакторе, работающем под давлением. Перед открыванием реактора смеси дают остыть в течение ночи до комнатной температуры, после чего охлаждают до -78 С. Затем смеси дают нагреться до комнатной температуры для испарения избыточного метиламина, разбавляют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом, получив в результате 15,7 г Nметил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]амина в виде масла. 20 а) 3-Хлорпропил-4,4,5,5,5-пентафторпентансульфон. К раствору из 23 г 3-хлорпропил-4,4,5,5,5 пентафторпентилсульфида в 230 мл хлороформа при 0 С порциями примешивают 41,8 г 70%-ной м-хлорбензойной кислоты и в течение 1,5 ч перемешивают при комнатной температуре. Затем разбавляют дихлорметаном, промывают раствором гидросульфита натрия, гидрокарбоната натрия и поваренной соли, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 23,8 г чистого 3-хлорпропил 4,4,5,5,5-пентафторпентансульфона в виде кристаллов с температурой плавления 74-76 С. 6) 3-Иодпропил-4,4,5,5,5-пентафторпентансульфон. Раствор из 23,5 г 3-хлорпропил-4,4,5,5,5 пентафторпентансульфона в 500 мл этилметилкетона перемешивают в течение 5 ч при температуре ванны 100 С в атмосфере азота с 40 г иодида натрия. Затем концентрируют досуха,подают в воду, трижды экстрагируют уксусным эфиром, промывают до нейтрального состояния,сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 30,6 г 3 иодпропил-4,4,5,5,5-пентафторпентансульфона в виде кристаллов с температурой плавления 8889 С. в) N-Метил-[3-(4,4,5,5,5-пентафторпентансульфонил)пропил]амин. В раствор из 23,5 г 3-иодпропил-4,4,5,5,5 пентафторпентансульфона в 200 мл абсолютного тетрагидрофурана при температуре ванны-78 С подают в конденсированном виде 44 г метиламина и перемешивают сначала в течение 1,5 ч при комнатной температуре, а затем в течение 4 ч при 60 С в реакторе, работающем под давлением. Перед открыванием реактора смеси дают нагреться до комнатной температуры для испарения избыточного метиламина, затем разбавляют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 14,8 г N-метил[3-(4,4,5,5,5-пентафторпентансульфонил)пропил]амина в виде кристаллов с температурой плавления 55-57 С. 1-Бром-5-трет-бутилдиметилсилилоксипентан. а) 5-Бом-1-пентанол. К раствору из 50 г 5-бромпентилацетата в 1,6 л метанола добавляют по каплям 50 мл концентрированной серной кислоты и смесь в течение 30 ч перемешивают при комнатной температуре. После этого метанол удаляют под вакуумом, остаток растворяют с помощью диэтилового эфира, промывают насыщенным раствором поваренной соли до нейтрального состояния, сушат над сульфатом натрия и концентрируют. В результате получают 28 г 5-бром-1 пентанола в виде сырого продукта. 21 б) 1-Бром-5-трет-бутилдиметилсилилоксипентан. К раствору из 28 г сырого 5-бром-1 пентанола в 144 мл тетрагидрофурана примешивают 24 г имидазола. Затем по каплям добавляют раствор из 30,3 г трет-бутилдиметилхлорсилана в 46 мл тетрагидрофурана и в течение 4 ч перемешивают при комнатной температуре. Реакционную смесь сливают в воду,экстрагируют встряхиванием с использованием диэтилового эфира, органическую фазу четырежды промывают водой, сушат над сульфатом натрия и концентрируют. Сырой продукт хроматографируют на силикагеле гексаном/диэтиловым эфиром, получив в результате 42 г указанного в заголовке соединения в виде бесцветной жидкости. Пример 2. 11-Фтор-7-5-[метилнониламино]пентилэстра-1,3,5(10)-триен-3,17-диол. а) 7-(5-Хлорпентил)-11-фторэстр-4-ен 3,17-дион. К суспензии из 7,2 г магниевой стружки в 100 мл ТГФ в атмосфере азота сначала добавляют 20% раствора из 39 мл 1-бром-5 хлорпентана в 300 мл ТГФ. После начала реакции, инициированного добавками иода и дибромметана, остальную часть раствора добавляют таким образом, чтобы внутренняя температура не превышала 35 С. Во вторую колбу к суспензии из 28,1 г иодида меди(I) в 130 мл ТГФ при 0 С добавляют 51,2 г бромида лития,при этом внутренняя температура возрастает до 40 С. Затем без охлаждения добавляют 49,4 мл 1,3-диметил-3,4,5,6-тетрагидро-(1 Н)-пиримидин-2-она и перемешивают в течение 15 мин при 40 С. В результате получают прозрачный раствор, который по каплям добавляют к охлажденному до -50 С раствору реактивов Гриньяра. Затем в течение 15 мин перемешивают при-30 С и при -70 С смешивают, вводя по каплям,с раствором из 25 г 11 р-фторэстра-4,6-диен 3,17-диона в 260 мл ТГФ, 26 мл 1,3-диметил 3,4,5,6-тетрагидро-(1 Н)-пиримидин-2-она и 59 мл триметилхлорсилана таким образом, чтобы внутренняя температура не превышала -65 С. Далее в течение 30 мин перемешивают на холоде, после чего по каплям добавляют 34,7 мл ледяной уксусной кислоты, охлаждающую ванну удаляют и перемешивание продолжают еще в течение 1 ч при комнатной температуре. Для дальнейшей переработки реакционную смесь сливают на 1,5 л воды, разбавляют таким же количеством уксусного эфира, осадок отделяют через Целлит, промывают уксусным эфиром,водную фазу трижды экстрагируют уксусным эфиром, промывают раствором гидрокарбоната натрия и поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 22,1 г 7-(5-хлорпентил)-11-фторэстр-4-ен 3,17-диона. б) 7-(5-Хлорпентил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-он. К 22,1 г 7-(5-хлорпентил)-11-фторэстр 4-ен-3,17-диона в 160 мл безводного ацетонитрила при 80 С добавляют 25,4 г бромида меди(II) и 4,9 г бромида лития в 95 мл безводного ацетонитрила. По истечении 20 мин реакционную смесь охлаждают до 0 С и добавляют по каплям 200 мл насыщенного раствора гидрокарбоната натрия. Затем раствор сливают при перемешивании в 750 мл воды, 2 н. соляной кислотой устанавливают на рН 6, трижды экстрагируют уксусным эфиром, промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 14,7 г 7-(5-хлорпентил)-11-фтор-3-гидроксиэстра 1,3,5(10)-триен-17-она. в) 11-Фтор-3-гидрокси-7-(5-иодпентил) эстра-1,3,5(10)-триен-17-он. 5 г 7-(5-хлорпентил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она растворяют в 80 мл этилметилкетона, примешивают 5,7 г иодида натрия и в течение ночи перемешивают при температуре ванны 90 С. Для дальнейшей переработки реакционную смесь охлаждают до комнатной температуры, сливают при перемешивании в воду, трижды экстрагируют уксусным эфиром, промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. В результате получают 6,8 г 11-фтор-3-гидрокси-7-(5-иодпентил)эстра 1,3,5(10)-триен-17-она в виде сырого продукта,который без дальнейшей очистки используют на последующей стадии. г) 11-Фтор-3-гидрокси-7-[5-(метиламино)пентил]эстра-1,3,5(10)-триен-17-он. В раствор из 6,8 г 11-фтор-3-гидрокси 7-(5-иодпентил)эстра-1,3,5 (10)-триен-17-она в 35 мл безводного тетрагидрофурана при -78 С подают в конденсированном виде 5,1 г метиламина и в течение ночи перемешивают при комнатной температуре в реакторе, работающем под давлением. Открыв реактор при -20 С, смеси дают нагреться до комнатной температуры для испарения избыточного метиламина, после чего реакционный раствор сливают в насыщенный раствор гидрокарбоната натрия, трижды экстрагируют уксусным эфиром, сушат над сульфатом магния и концентрируют под вакуумом. В результате получают 6,7 г 11-фтор-3 гидрокси-7-[5-(метиламино)пентил]эстра-1,3,5(10)-триен-17-она в виде сырого продукта. д) 11-Фтор-3-гидрокси-7-5-[метилнониламино]пентилэстра-1,3,5(10)-триен-17-он. 526 мг 11-Фтор-3-гидрокси-7-[5-(метиламино)пентил]эстра-1,3,5(10)-триен-17-она и 127 мг иоднонана растворяют в 5 мл безводного 23 ДМФ и перемешивают в течение 4 ч при температуре ванны 100 С. Для дальнейшей переработки смесь сливают в полунасыщенный раствор гидрокарбоната натрия, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После препаративной хроматографии на колонке получают 85 мг 11-фтор-3-гидрокси-7-5[метилнониламино]пентилэстра-1,3,5(10)триен-17-она в виде пенистого вещества. е) 11-Фтор-7-5-[метилнониламино] пентилэстра-1,3,5(10)-триен-3,17-диол. 85 мг 11-Фтор-3-гидрокси-7-5-[метилнониламино]пентилэстра-1,3,5(10)-триен-17 она растворяют в 3 мл метанола и смешивают с 25 мг борогидрида натрия. После перемешивания в течение 30 мин при комнатной температуре большую часть растворителя отгоняют под вакуумом, к остатку примешивают раствор поваренной соли, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После препаративной тонкослойной хроматографии метиленхлоридом/метанолом (в соотношении 9:1) + 0,5% триэтиламина в качестве элюентов получают 33 мг 11-фтор-7-5-[метилнониламино]пентил эстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества. Пример 3. 11-Фтор-7-5-[метил-(9,9,10,10,10-пентафтордецил)амино]пентилэстра-1,3,5(10)-триен-3,17-диол. а) 11-Фтор-3-гидрокси-7-5-[метил-(9,9,10,10,10-пентафторде-цил)амино]пентил]эстра 1,3,5(10)-триен-17-он. Раствор из 260 мг 11-фтор-3-гидрокси 7-[5-(метиламино)пентил]эстра-1,3,5(10)-триен-17-она в 3 мл диметилформамида перемешивают в течение 1 ч при температуре ванны 100 С со 180 мг 9,9,10,10,10-пентафтордецилтозилата. Затем смесь сливают на полунасыщенный раствор гидрокарбоната натрия, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом/триэтиламином. В результате получают 92 мг 11-фтор-3-гидрокси 7-5-[метил(9,9,10,10,10-пентафтордецил) амино]пентилэстра-1,3,5(10)-триен-17-она в виде пенистого вещества, []D=+48 (с =1,0 в хлороформе). б) 11-Фтор-7-5-[метил-(9,9,10,10,10 пентафтордецил)амино]пентилэстра-1,3,5(10)триен-3,17-диол. 92 мг 11-Фтор-3-гидрокси-7-5-[метил(9,9,10,10,10-пентафтордецил)амино]пентил эстра-1,3,5(10)-триен-17-она растворяют в 2 мл метанола и к раствору примешивают 23 мг борогидрида натрия. После перемешивания в течение 1 ч при комнатной температуре большую часть растворителя отгоняют под вакуумом,остаток смешивают с раствором поваренной 24 соли, трижды экстрагируют метиленхлоридом,сушат над сульфатом магния и концентрируют под вакуумом. После препаративной тонкослойной хроматографии метиленхлоридом/метанолом (в соотношении 9:1) в качестве элюентов получают 42 мг 11 р-фтор-7-5-[метил(9,9,10,10,10-пентафтордецил)амино]пентил эстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+44 (с =1,0 в хлороформе). Пример 4. 11-Фтор-7-[6-[метил-(8,8,9,9,9-пентафторнонил)амино]гексил]эстра-1,3,5(10)-триен-3,17-диол. а) 7-(6-Хлоргексил)-11-фторэстр-4-ен 3,17-дион. К суспензии из 6,8 г магниевой стружки в 100 мл ТГФ в атмосфере азота сначала добавляют 30 мл раствора из 41 мл 1-бром-6 хлоргексана в 270 мл ТГФ. После начала реакции остальное количество раствора добавляют по каплям таким образом, чтобы внутренняя температура не превышала 35 С. Во вторую колбу к суспензии из 26,4 г иодида меди(I) в 120 мл ТГФ при 0 С добавляют 48,1 г бромида лития и при этом температура возрастает до 40 С. Затем без охлаждения добавляют 46,4 мл 1,3 диметил-3,4,5,6-тетрагидро-(1 Н)-пиримидин-2 она и перемешивают в течение 30 мин при 40 С. В результате образуется прозрачный раствор,который по каплям добавляют к охлажденному до -40 С раствору реактивов Гриньяра. Затем продолжают перемешивание еще в течение 30 мин при -30 С и при -50 С смешивают по каплям с раствором из 23,5 г 11-фторэстра-4,6 диен-3,17-диона в 230 мл ТГФ, 24,6 мл 1,3 диметил-3,4,5,6-тетрагидро-(1 Н)-пиримидин-2 она и 55 мл триметилхлорсилана таким образом,чтобы внутренняя температура не превышала-40 С. После перемешивания в течение 1 ч на холоде по каплям добавляют 32 мл уксусного эфира, охлаждающую ванну удаляют и в течение 1 ч перемешивают при комнатной температуре. Для дальнейшей переработки реакционную смесь сливают на 1,5 л воды, разбавляют таким же количеством уксусного эфира, осадок отделяют через Целлит, промывают уксусным эфиром, водную фазу трижды экстрагируют уксусным эфиром, промывают раствором гидрокарбоната натрия и поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 25,2 г 7-(6-хлоргексил)11-фторэстр-4-ен-3,17-диона. б) 7-(6-Хлоргексил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-он. К 25,2 г 7-(6-хлоргексил)-11-фторэстр 4-ен-3,17-диона в 175 мл безводного ацетонитрила добавляют при 80 С 28,1 г бромида меди(II) и 5,4 г бромида лития в 105 мл безводного ацетонитрила. По истечении 15 мин реакцион 25 ную смесь охлаждают до 0 С и по каплям добавляют 250 мл насыщенного раствора гидрокарбоната натрия. Затем раствор смешивают с 1 л воды, 2 н. соляной кислотой устанавливают на рН 6, трижды экстрагируют уксусным эфиром,промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 5,7 г 7-(6-хлоргексил)-11 фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она в виде пенистого вещества. в) 11-Фтор-3-гидрокси-7-(6-иодгексил)эстра-1,3,5(10)-триен-17-он. 2,7 г 7-(6-хлоргексил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она растворяют в 40 мл этилметилкетона, примешивают 3 г иодида натрия и в течение ночи перемешивают при температуре ванны 90 С. Для дальнейшей переработки реакционную смесь охлаждают до комнатной температуры, сливают при перемешивании в воду, трижды экстрагируют уксусным эфиром, промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. В результате получают 3,4 г 11-фтор-3-гидрокси-7-(6-иодгексил)-эстра 1,3,5(10)-триен-17-она в виде сырого продукта,который без дальнейшей очистки используют на последующей стадии. г) 11-Фтор-3-гидрокси-7-[6-(метиламино)гексил]эстра-1,3,5(10)-триен-17-он. В раствор из 960 мг 11-фтор-3-гидрокси 7-(6-иодгексил)-эстра-1,3,5(10)-триен-17-она в 9 мл безводного тетрагидрофурана при -78 С подают в конденсированном виде 718 мг метиламина и в течение ночи перемешивают при комнатной температуре в реакторе, работающем под давлением. Открыв реактор при -20 С, смеси дают нагреться до комнатной температуры для испарения избыточного метиламина. После этого реакционный раствор сливают в насыщенный раствор гидрокарбоната натрия, трижды экстрагируют уксусным эфиром, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 763 мг 11-фтор-3 гидрокси-7-[6-(метиламино)гексил]эстра-1,3,5(10)-триен-17-она в виде сырого продукта. д) 11-Фтор-3-гидрокси-7-6-[метил-(8,8,9,9,9-пентафторнонил)амино]гексилэстра 1,3,5(10)-триен-17-он. Раствор из 381 мг 11-фтор-3-гидрокси 7-[6-(метиламино)гексил]эстра-1,3,5(10)триен-17-она в 5 мл диметилформамида в течение 2 ч перемешивают с 200 мг 8,8,9,9,9 пентафторнонилтозилата при температуре ванны 100 С. Затем смесь сливают на полунасыщенный раствор гидрокарбоната натрия, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получа 002623 ют 90 мг 11-фтор-3-гидрокси-7-[6-[метил(8,8,9,9,9-пентафторнонил)амино]гексилэстра 1,3,5(10)-триен-17-она в виде пенистого вещества. е) 11-Фтор-7-6-[метил-(8,8,9,9,9-пентафторнонил)амино]гексилэстра-1,3,5(10)-триен 3,17-диол. 89 мг 11-Фтор-3-гидрокси-7-[6-[метил(8,8,9,9,9-пентафторнонил)амино]гексилэстра 1,3,5(10)-триен-17-она растворяют в 2 мл метанола и смешивают с 22 мг борогидрида натрия. После перемешивания в течение 1 ч при комнатной температуре большую часть растворителя отгоняют под вакуумом, остаток смешивают с раствором поваренной соли, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После препаративной тонкослойной хроматографии метиленхлоридом/метанолом (в соотношении 9:1) в качестве элюентов получают 53 мг 11 фтор-7-6-[метил-(8,8,9,9,9-пентафторнонил) амино]гексилэстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+32 (с=1,0 в хлороформе). Пример 5. 11-Фтор-7-6-[метил-(9,9,10,10,10-пентафтордецил)амино]гексилэстра-1,3,5(10)-триен-3,17-диол. а) 11-Фтор-3-гидрокси-7-6-[метил-(9,9,10,10,10-пентафторде-цил)амино]гексилэстра 1,3,5(10)-триен-17-он. Раствор из 381 мг 11-фтор-3-гидрокси 7-[6-(метиламино)гексил]эстра-1,3,5(10)триен-17-она в 5 мл диметилформамида в течение 2 ч перемешивают со 180 мг 9,9,10,10,10 пентафтордецилтозилата при температуре ванны 100 С. Затем смесь сливают на полунасыщенный раствор гидрокарбоната натрия, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом/триэтиламином. В результате получают 121 мг 11-фтор-3-гидрокси 7-6-[метил-(9,9,10,10,10-пентафтордецил) амино]гексил]эстра-1,3,5(10)-триен-17-она в виде пенистого вещества, []D=+59 (с =1,0 в хлороформе). б) 11-Фтор-7-6-[метил-(9,9,10,10,10 пентафтордецил)амино]гексилэстра-1,3,5(10)триен-3,17-диол. 120 мг 11-фтор-3-гидрокси-7-6-[метил(9,9,10,10,10-пентафтордецил)амино]гексил] эстра-1,3,5(10)-триен-17-она растворяют в 2,5 мл метанола и порциями смешивают с 29 мг борогидрида натрия. После перемешивания в течение 30 мин при комнатной температуре большую часть растворителя отгоняют под вакуумом, остаток смешивают с водой, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. В результате получают 106 мг 11-фтор 27 7-6-[метил-(9,9,10,10,10-пентафтордецил) амино]гексилэстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+38 (с =0,5 в хлороформе). Пример 6. 11-Фтор-7-(5-(метиламино) пентил)эстра-1,3,5(10)-триен-3,17-диол. 880 мг 11-фтор-3-гидрокси-7-(5-(метиламино)пентил)эстра-1,3,5(10)-триен-17-она растворяют в 15 мл метанола, порциями смешивают с 252 мг борогидрида натрия и перемешивают в течение 15 мин при комнатной температуре. Для дальнейшей переработки реакционную смесь сливают в насыщенный раствор поваренной соли, несколько раз экстрагируют метиленхлоридом, органические фазы промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. В результате получают 540 мг 11-фтор-7-(5-(метиламино)пентил)эстра 1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D= +63 (с =0,5 в хлороформе). Пример 7. 11-Фтор-7-(5-пирролидин-1 илпентил)эстра-1,3,5(10)-триен-3,17-диол. а) 11-Фтор-3-гидрокси-7-(5-пирролидин-1-илпентил)-1,3,5(10)-триен-17-он. Раствор из 1,0 г 11-фтор-3-гидрокси-7(5-иодпентил)эстра-1,3,5(10)-триен-17-она в 10 мл диметилформамида в течение 2 ч перемешивают с 0,24 мл пирролидина при температуре ванны 100 С. Затем смесь сливают на полунасыщенный раствор гидрокарбоната натрия,трижды экстрагируют метиленхлоридом, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом/триэтиламином. В результате получают 367 мг 11-фтор-3-гидрокси 7-(5-пирролидин-1-илпентил)-1,3,5(10)-триен 17-она в виде пенистого вещества. б) 11-Фтор-7-(5-пирролидин-1-илпентил)эстра-1,3,5(10)-триен-3,17-диол. 324 мг 11-Фтор-3-гидрокси-7-(5-пирролидин-1-илпентил)-1,3,5(10)-триен-17-она растворяют в 10 мл метанола и смешивают с 63 мг борогидрида натрия. После перемешивания в течение 1,5 ч при комнатной температуре смесь сливают на полунасыщенный раствор поваренной соли, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/метанол получают 192 мг 11-фтор 7-(5-пирролидин-1-илпентил)эстра-1,3,5(10)триен-3,17-диола с температурой плавления 95-118 С. Пример 8. 11-Фтор-7-[5-[метил-(4,4,5,5,5-пентафторпентил)амино]пентил]эстра-1,3,5 500 мг 11-Фтор-3-гидрокси-7-(5-(метиламино)пентил)эстра-1,3,5(10)-триен-17-она растворяют в 15 мл этилметилкетона, смешивают с 1,1 г карбоната калия и 1,5 мл 1,1,1,2,2 пентафтор-5-иодпентана и в течение 2,5 ч нагревают с обратным холодильником. Для дальнейшей переработки реакционную смесь охлаждают до комнатной температуры, вводят при перемешивании в насыщенный раствор поваренной соли, экстрагируют уксусным эфиром,сушат над сульфатом магния и концентрируют под вакуумом. После препаративной колоночной хроматографии на силикагеле градиентом метиленхлорид/метанол получают 397 мг 11 фтор-3-гидрокси-7-5-[метил-(4,4,5,5,5-пентафторпентил)амино]пентилэстра-1,3,5(10)триен-17-она. б) 11-Фтор-7-5-[метил-(4,4,5,5,5-пентафторпентил)амино]пентилэстра-1,3,5(10)-триен-3,17-диол. 380 мг 11-Фтор-3-гидрокси-7-5-[метил(4,4,5,5,5-пентафторпентил)амино]пентилэстра-1,3,5(10)-триен-17-она растворяют в 25 мл метанола и смешивают с 77 мг борогидрида натрия. После перемешивания в течение 30 мин при комнатной температуре смесь сливают в насыщенный раствор поваренной соли, экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/метанол получают 317 мг 11-фтор-7-5-[метил-(4,4,5,5,5-пентафторпентил)амино]пентилэстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества,[]D=+49 (с=0,5 в метаноле). Пример 9. 11-Фтор-7-5-[метил-(4,4,5,5,6,6,7,7,8,8,9,9,9-тридекафторнонил)амино]пентилэстра-1,3,5(10)-триен-3,17-диол. Раствор из 466 мг 7-(5-бромпентил)-11 фторэстра-1,3,5(10)-триен-3,17-диола в 10 мл 1 метил-2-пирролидинона перемешивают в течение 3 ч при температуре ванны 80 С с 1,17 г метил-(4,4,5,5,6,6,7,7,8,8,9,9,9-тридекафторнонил)амина. Для дальнейшей переработки смесь сливают на насыщенный раствор хлорида натрия, экстрагируют уксусным эфиром, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 625 мг 11-фтор-7-5-[метил-(4,4,5,5,6,6,7,7,8,8,9,9,9 тридекафторнонил)амино]пентил эстра 1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+35 (с=0,5 в СНСl3). Пример 10. 11-фтор-7-5-[(4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-гептадекафторундецил) метиламино]пентилэстра-1,3,5(10)-триен 3,17-диол. Раствор из 466 мг 7-(5-бромпентил)-11 фторэстра-1,3,5(10)-триен-3,17-диола в 10 мл 1 29 метил-2-пирролидинона перемешивают в течение 3 ч при температуре ванны 80 С с 1,47 г(4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-гептадекафторундецил)метиламина. Для дальнейшей переработки смесь сливают на насыщенный раствор хлорида натрия, экстрагируют простым эфиром,сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле уксусным эфиром/метанолом. В результате получают 524 г 11-фтор-7-5-[(4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-гептадекафторундецил)метиламино]пентилэстра-1,3,5(10)-триен 3,17-диола в виде пенистого вещества,[]D=+24 (с =0,5 в СНСl3). Пример 11. 11-Фтор-7-5-[метил-(3,3,4,4,5,5,6,6,6-нонафторгексил)амино]пентилэстра 1,3,5(10)-триен-3,17-диол. а) 11-Фтор-3-гидрокси-7-5-[метил-(3,3,4,4,5,5,6,6,6-нонафторгексил)амино]пентил эстра-1,3,5(10)-триен-17-он. 276 мг 11-Фтор-3-гидрокси-7-(5-(метиламино)пентил)эстра-1,3,5(10)-триен-17-она растворяют в 3 мл N-метилпирролидона, смешивают с 0,6 мл 1,1,1,2,2,3,3,4,4-нонафтор-5-иодгексана и нагревают в течение 1,5 ч при температуре ванны 80 С. Для дальнейшей переработки реакционную смесь охлаждают до комнатной температуры, сливают при перемешивании в насыщенный раствор поваренной соли, экстрагируют уксусным эфиром, органические фазы промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. После препаративной колоночной хроматографии на силикагеле градиентом метиленхлорид/метанол получают 176 мг 11-фтор-3-гидрокси-7-[5-[метил(3,3,4,4,5,5,6,6,6-нонафторгексил)амино]пентил эстра-1,3,5(10)-триен-17-она. б) 11-Фтор-7-5-[метил-(3,3,4,4,5,5,6,6,6-нонафторгексил)амино]пентилэстра-1,3,5(10)-триен-3,17-диол. 160 мг 11-Фтор-3-гидрокси-7-5-[метил(3,3,4,4,5,5,6,6,6-нонафторгексил)амино]пентил эстра-1,3,5(10)-триен-17-она растворяют в 5 мл метанола и смешивают с 28 мг борогидрида натрия. После перемешивания в течение 30 мин при комнатной температуре смесь сливают в насыщенный раствор поваренной соли, экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/МТБЭ и градиентом уксусный эфир/ацетон получают 105 мг 11 фтор-7-5-[метил-(3,3,4,4,5,5,6,6,6-нонафторгексил)амино]пентилэстра-1,3,5(10)-триен 3,17-диола в виде пенистого вещества,[]D=+43 (с =0,5 в CHCl3). Пример 12. 11-Фтор-7-5-[метил-(7,7,8,8,8-пентафтороктил)амино]пентилэстра-1,3,5 Раствор из 466 мг 7-(5-бромпентил)-11 фторэстра-1,3,5(10)-триен-3,17-диола в 10 мл 1 метил-2-пирролидинона перемешивают с 702 мг метил-(7,7,8,8,8-пентафтороктил)амина в течение 3 ч при температуре ванны 80 С. Для дальнейшей переработки смесь сливают в насыщенный раствор хлорида натрия, экстрагируют уксусным эфиром, сушат над сульфатом натрия,концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 595 мг 11-фтор-7-5[метил-(7,7,8,8,8-пентафтороктил)амино]пентилэстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+39 (с=0,5 в CHCl3). Пример 13. 11-Фтор-7-6-[метил-(7,7,8,8,8-пентафтороктил)амино]гексилэстра-1,3,5(10)-триен-3,17-диол. 611 мг 7-(6-Хлоргексил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она растворяют в 10 мл метанола и осторожно смешивают со 166 мг борогидрида натрия. После перемешивания в течение 15 мин при комнатной температуре смесь сливают в насыщенный раствор поваренной соли, экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. В результате получают 599 мг 7-(6-хлоргексил)-11-фторэстра-1,3,5(10)-триен-3,17-диола в виде сырого продукта, который без дальнейшей очистки используют на последующей стадии. б) 11-Фтор-7-(6-иодгексил)эстра-1,3,5(10)-триен-3,17-диол. 599 мг 7-(6-Хлоргексил)-11-фторэстра 1,3,5(10)-триен-3,17-диола растворяют в 10 мл этилметилкетона, смешивают с 675 мг иодида натрия и. в течение ночи перемешивают при температуре ванны 90 С. Для дальнейшей переработки реакционную смесь охлаждают до комнатной температуры, растворяют в уксусном эфире, один раз экстрагируют 10%-ным раствором тиосульфата натрия, промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. В результате получают 691 мг 11-фтор-7-(6 иодгексил)эстра-1,3,5(10)-триен-3,17-диола в виде сырого продукта, который без дальнейшей очистки используют на последующей стадии. в) 11-Фтор-7-6-[метил-(7,7,8,8,8-пентафтороктил)амино]гек-силэстра-1,3,5(10)-триен 3,17-диол. Раствор из 690 мг 11-фтор-7-(6-иодгексил)эстра-1,3,5(10)-триен-3,17-диола в 15 мл 1-метил-2-пирролидинона перемешивают в течение 3 ч при температуре ванны 80 С с 810 мг метил-(7,7,8,8,8-пентафтороктил)амина. Для дальнейшей переработки смесь сливают на насыщенный раствор хлорида натрия, экстрагируют простым эфиром, сушат над сульфатом 31 натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/ метанолом/аммиаком (25%-ным). В результате получают 576 мг 11-фтор-7-6-[метил-(7,7,8,8,8-пентафтороктил)амино]гексил]эстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+42 (с=0,5 в СНСl3). Пример 14. 11-Фтор-7-5-[метил-(7,7,8,8,9,9,10,10,10-нонафтордецил)амино]пентил эстра-1,3,5(10)-триен-3,17-диол. Раствор из 466 мг 7-(5-бромпентил)-11 фторэстра-1,3,5(10)-триен-3,17-диола в 10 мл 1 метил-2-пирролидинона перемешивают с 1,0 г метил-(7,7,8,8,9,9,10,10,10-нонафтордецил)амина в течение 3 ч при температуре ванны 80 С. Для дальнейшей переработки смесь сливают в насыщенный раствор хлорида натрия, экстрагируют простым эфиром, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле уксусным эфиром/метанолом. В результате получают 546 мг 11-фтор-7-[5-[метил-(7,7,8,8,9,9,10,10,10 нонафтордецил)амино]пентил]эстра-1,3,5(10)триен-3,17-диола в виде пенистого вещества,[]D=+39 (с =0,5 в СНСl3). Пример 15. 11-Фтор-7-5-[метил-(7,7,8,8,9,9,10,10,11,11,12,12,12-тридекафтордодецил) амино]пентилэстра-1,3,5(10)-триен-3,17-диол. Раствор из 466 мг 7-(5-бромпентил)-11 фторэстра-1,3,5(10)-триен-3,17-диола в 10 мл 1 метил-2-пирролидинона перемешивают с 1,3 г метил-(7,7,8,8,9,9,10,10,11,11,12,12,12-тридекафтордодецил)амина в течение 3 ч при температуре ванны 80 С. Для дальнейшей переработки смесь сливают в насыщенный раствор хлорида натрия, экстрагируют простым эфиром, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле уксусным эфиром/метанолом. В результате получают 628 мг 11-фтор-7-5-[метил-(7,7,8,8,9,9,10,10,11,11,12,12,12-тридекафтордодецил) амино]пентил]эстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+24 (с =0,5 в СНСl3). Пример 16. 11-Фтор-7-[5-[(7,7,8,8,9,9,10,10,11,11,12,12,13,13,14,14,14-гептадекафтортетрадецил)метиламино]пентилэстра-1,3,5(10)триен-3,17-диол. Раствор из 431 мг 7-(5-бромпентил)-11 фторэстра-1,3,5(10)-триен-3,17-диола в 10 мл 1 метил-2-пирролидинона перемешивают с 1,6 г(7,7,8,8,9,9,10,10,11,11,12,12,13,13,14,14,14 гептадекафтортетрадецил)метиламина в течение 3 ч при температуре ванны 80 С. Для дальнейшей переработки смесь сливают на насыщенный раствор хлорида натрия, экстрагируют простым эфиром, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле уксусным эфиром/метанолом. В результате получают 318 мг 11-фтор-7-5 002623[(7,7,8,8,9,9,10,10,11,11,12,12,13,13,14,14,14 гептадекафтортетрадецил)метиламино]пентил эстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+23 (с =0,5 в CHCl3). Пример 17. 11-Фтор-7-5-[(3,4,4,5,5,5 гексафторпент-2-енил)метиламино]пентилэстра-1,3,5(10)-триен-3,17-диол. а) 11-Фтор-7-[5-[(3,4,4,5,5,5-гексафторпент-2-енил)метилами-но]пентил-3-гидроксиэстра-1,3,5(10)-триен-17-он. 880 мг 11-Фтор-3-гидрокси-7-(5-иодпентил)эстра-1,3,5(10)-триен-17-она и 1,26 г (3,4,4,5,5,5-гексафторпент-2-енил)метиламина растворяют в 20 мл N-метилпирролидона и перемешивают в течение 3 ч при температуре ванны 80 С. После охлаждения реакционного раствора до комнатной температуры его сливают на насыщенный раствор поваренной соли, экстрагируют диэтиловым эфиром, сушат и концентрируют под вакуумом. В результате получают 1,86 г 11-фтор-7-5-[(3,4,4,5,5,5-гексафторпент-2 енил)метиламино]пентил]-3-гидроксиэстра-1,3,5(10)-триен-17-она в виде сырого продукта, который без дальнейшей очистки используют на последующей стадии. б) 11-Фтор-7-5-[(3,4,4,5,5,5-гексафторпент-2-енил)метилами-но]пентилэстра-1,3,5(10)-триен-3,17-диол. 1,86 г 11-Фтор-7-5-[(3,4,4,5,5,5-гексафторпент-2-енил)метиламино]пентил-3-гидроксиэстра-1,3,5(10)-триен-17-она растворяют в 15 мл метанола и осторожно смешивают с 222 мг борогидрида натрия. После перемешивания в течение 15 мин при комнатной температуре смесь сливают в насыщенный раствор поваренной соли, экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир и градиентом уксусный эфир/ацетон получают 241 мг 11-фтор-7-5[(3,4,4,5,5,5-гексафторпент-2-енил)метиламино] пентилэстра-1,3,5(10)-триен-3,17-диола с температурой плавления 122 С, []D=+47 (с =0,5 вCHCl3). Пример 18. 11-Фтор-7-[5-[метил-(3,4,4,5,5,6,6,6-октафторгекс-2-енил)амино]пентил эстра-1,3,5(10)-триен-3,17-диол. а) 11-Фтор-3-гидрокси-7-5-[метил-(3,4,4,5,5,6,6,6-октафторгекс-2-енил)амино]пентил эстра-1,3,5(10)-триен-17-он. 880 мг 11-Фтор-3-гидрокси-7-(5-иодпентил)эстра-1,3,5(10)-триен-17-она и 2,21 г метил(3,4,4,5,5,6,6,6-октафторгекс-2-енил)амина растворяют в 20 мл N-метилпирролидона и перемешивают в течение 1 ч при температуре ванны 80 С. После охлаждения реакционного раствора до комнатной температуры его сливают на насыщенный раствор поваренной соли, экстрагируют диэтиловым эфиром, сушат и концентрируют под вакуумом. В результате получают 1,69 г 11-фтор-3-гидрокси-7-5-[метил-3,4,4,5,5,6,6,6-октафторгекс-2-енил)амино]пентил]эстра 1,3,5(10)-триен-17-она в виде сырого продукта,который без дальнейшей очистки используют на последующей стадии. б) 11-Фтор-7-5-[метил-(3,4,4,5,5,6,6,6 октафторгекс-2-енил)амино]пентилэстра-1,3,5(10)-триен-3,17-диол. 1,7 г 11-Фтор-3-гидрокси-7-[5-[метил(3,4,4,5,5,6,6,6-октафторгекс-2-енил)амино]пентилэстра-1,3,5(10)-триен-17-она растворяют в 15 мл метанола и осторожно смешивают с 222 мг борогидрида натрия. После перемешивания в течение 15 мин при комнатной температуре смесь сливают в насыщенный раствор поваренной соли, экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле уксусным эфиром получают 84 мг 11-фтор-7-5-[метил-(3,4,4,5,5,6,6,6-октафторгекс-2-енил)амино]пентилэстра 1,3,5(10)-триен-3,17-диола с температурой плавления 130 С. Пример 19. 7-5-[(3,4,4,5,5,6,6,7,7,8,8,8 Додекафторокт-2-енил)метиламино]пентил 11-фторэстра-1,3,5(10)-триен-3,17-диол. а) 7-5-[(3,4,4,5,5,6,6,7,7,8,8,8-Додекафторокт-2-енил)метиламино]пентил-11-фтор 3-гидроксиэстра-1,3,5(10)-триен-17-он. 880 мг 11-фтор-3-гидрокси-7-(5-иодпентил)эстра-1,3,5(10)-триен-17-она и 2,23 г (3,4,4,5,5,6,6,7,7,8,8,8-додекафторокт-2-енил)метиламина растворяют в 20 мл N-метилпирролидона и перемешивают в течение 1 ч при температуре ванны 80 С. После охлаждения реакционного раствора до комнатной температуры его сливают на насыщенный раствор поваренной соли,экстрагируют диэтиловым эфиром, сушат и концентрируют под вакуумом. В результате получают 2,47 г 7-5-[(3,4,4,5,5,6,6,7,7,8,8,8 додекафторокт-2-енил)метиламино]пентил 11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17 она в виде сырого продукта, который без дальнейшей очистки используют на последующей стадии. б) 7-5-[(3,4,4,5,5,6,6,7,7,8,8,8-Додекафторокт-2-енил)метиламино]пентил]-11-фторэстра-1,3,5(10)-триен-3,17-диол. 2,4 г 7-5-[(3,4,4,5,5,6,6,7,7,8,8,8-Додекафторокт-2-енил)метилами-но]пентил-11 фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она растворяют в 15 мл метанола и осторожно смешивают с 222 мг борогидрида натрия. После перемешивания в течение 15 мин при комнатной температуре смесь сливают в насыщенный раствор поваренной соли, экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле уксусным эфиром в качестве элюента получают 319 мг 7-5-[(3,4,4,5,5,6,6,7,7,8,8,8-додекафторокт 2-енил)метиламино]пентил-11-фторэстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+37 (с =0,5 в СНСl3). Пример 20. 11-Фтор-7-5-[(3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-гексадекафтордец-2-енил) метиламино]пентилэстра-1,3,5(10)-триен 3,17-диол. а) 11-Фтор-7-5-[(3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-гексадекаф-тордец-2-енил)метиламино]пентил-3-гидроксиэстра-1,3,5(10)-триен-17 он. 880 мг 11-фтор-3-гидрокси-7-(5-иодпентил)эстра-1,3,5(10)-триен-17-она и 1,83 г (3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-гексадекафтордец-2 енил)метиламина растворяют в 20 мл Nметилпирролидона и перемешивают в течение 1 ч при температуре ванны 80 С. После охлаждения реакционного раствора до комнатной температуры его сливают на насыщенный раствор поваренной соли, экстрагируют диэтиловым эфиром, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле уксусным эфиром в качестве элюента получают 1,2 г 11-фтор-7-5-[(3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-гексадекафтордец-2-енил) метиламино]пентил-3-гидроксиэстра-1,3,5(10)триен-17-она. б) 11-Фтор-7-[5-[(3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-гексадека-фтордец-2-енил)метиламино]пентил]эстра-1,3,5(10)-триен-3,17-диол. 1,1 г 11-Фтор-7-5-[(3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-гексадекафтордец-2-енил)метиламино]пентил-3-гидроксиэстра-1,3,5(10)триен-17-она растворяют в 10 мл метанола и осторожно смешивают со 148 мг борогидрида натрия. После перемешивания в течение 15 мин при комнатной температуре смесь сливают в насыщенный раствор поваренной соли, экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир и градиентом уксусный эфир/ацетон получают 127 мг 11 фтор-7-5-[(3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10 гексадекафтордец-2-енил)метиламино]пентил] эстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, [a]D=+35 (с =0,5 в CHCl3). Получение исходных соединений(3,4,4,5,5,5-Гексафторпент-2-енил)метиламин. В раствор из 2,6 мл 1,1,1,2,2,3,3-гептафтор 5-иодпентана в 20 мл безводного тетрагидрофурана при -40 С подают в конденсированном виде 3,55 г метиламина и перемешивают в течение ночи в реакторе, работающем под давлением. После открывания реактора при -30 С смеси дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор смешивают с диэтиловым 35 эфиром, промывают насыщенным раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 1,26 г (3,4,4,5,5,5-гексафторпент-2 енил)метиламина в виде сырого продукта. Метил-(3,4,4,5,5,6,6,6-октафторгекс-2-енил)амин В раствор из 2,96 мл 1,1,1,2,2,3,3,4,4-нонафтор-6 иодгексана в 20 мл безводного тетрагидрофурана при -40 С подают в конденсированном виде 2,36 г метиламина и перемешивают в течение ночи в реакторе, работающем под давлением. После открывания реактора при -30 С смеси дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор смешивают с диэтиловым эфиром, промывают насыщенным раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 2,21 г метил-3,4,4,5,5,6,6,6-октафторгекс-2-енил)амина в виде сырого продукта.(3,4,4,5,5,6,6,7,7,8,8,8-додекафторокт-2-енил) метиламин В раствор из 2,82 мл 1,1,1,2,2,3,3,4,4,5,5,6,6-тридекафтор-8-иодоктана в 20 мл безводного тетрагидрофурана при -40 С подают в конденсированном виде 2,44 г метиламина и перемешивают в течение ночи в реакторе, работающем под давлением. После открывания реактора при -30 С смеси дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор смешивают с диэтиловым эфиром, промывают насыщенным раствором поваренной соли,сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 2,23 г(3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-Гексадекафтордец-2-енил)метиламин. В раствор из 2,86 г 1,1,1,2,2,3,3,4,4,5,5,6,6,7,7,8,8-гептадекафтор-10-иоддекана в 20 мл безводного тетрагидрофурана при -40 С подают в конденсированном виде 3,84 г метиламина и перемешивают в течение ночи в реакторе, работающем под давлением. После открывания реактора при -30 С смеси дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор смешивают с диэтиловым эфиром, промывают насыщенным раствором поваренной соли,сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 1,83 г 36 сливают при перемешивании в воду, экстрагируют дихлорметаном, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле градиентом гексан/уксусный эфир получают 3,86 г 4,4,5,5,6,6,7,7,8,8,9,9,9 тридекафторнонилтозилата в виде прозрачного масла. б) Метил-(4,4,5,5,6,6,7,7,8,8,9,9,9-тридекафторнонил)амин. В раствор из 3,86 г 4,4,5,5,6,6,7,7,8,8,9,9,9 тридекафторнонилтозилата в 10 мл абсолютного тетрагидрофурана при -20 С подают в конденсированном виде 4,44 г метиламина и в течение ночи перемешивают в автоклаве при комнатной температуре. Открыв автоклав при -20 С, раствору дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор растворяют с помощью дихлорметана, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 2,38 г метил(4,4,5,5,6,6,7,7,8,8,9,9,9-тридекафторнонил) амина в виде сырого продукта.(4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-Гептадекафторундецил)метиламин. а) 4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-Гептадекафторундецилтозилат. 4,78 г 4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11 Гептадекафторундекан-1-ола растворяют в 20 мл абсолютного пиридина, при 0 С смешивают с 2,48 г п-толуолсульфонилхлорида и в течение 3 ч перемешивают на холоде. Затем реакционную смесь сливают при перемешивании в воду,экстрагируют дихлорметаном, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле градиентом гексан/уксусный эфир получают 4,3 г 4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-гептадекафторундецилтозилата в виде прозрачного масла. б)(4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11 Гептадекафторундецил)метиламин. В раствор из 4,3 г (4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-гептадекафторундецил) тозилата в 10 мл абсолютного тетрагидрофурана при -20 С подают в конденсированном виде 3,95 г метиламина и в течение ночи перемешивают при комнатной температуре в автоклаве. Открыв автоклав при -20 С, раствору дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор растворяют с помощью дихлорметана, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 3,1 г (4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-гептадекафторундецил) метиламина в виде сырого продукта. Метил-(7,7,8,8,8-пентафтороктил)амин. а) 7,7,8,8,8-Пентафтороктилтозилат. 1,6 мл 7,7,8,8,8-Пентафтороктан-1-ола растворяют в 20 мл абсолютного пиридина, при 37 0 С смешивают с 2,48 г п-толуолсульфонилхлорида и в течение 3 ч перемешивают на холоде. Затем реакционную смесь сливают при перемешивании в воду, экстрагируют дихлорметаном, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле градиентом гексан/уксусный эфир получают 2,92 г 7,7,8,8,8-пентафтороктилтозилата в виде прозрачного масла. б) Метил-(7,7,8,8,8-пентафтороктил)амин. В раствор из 2,9 г 7,7,8,8,8-пентафтороктилтозилата в 10 мл абсолютного тетрагидрофурана при -20 С подают в конденсированном виде 4 г метиламина и в течение ночи перемешивают при комнатной температуре в автоклаве. Открыв автоклав при -20 С, раствору дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор растворяют с помощью дихлорметана, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 1,58 г метил-(7,7,8,8,8-пентафтороктил)амина в виде сырого продукта. Метил-(7,7,8,8,9,9,10,10,10-нонафтордецил)амин. а) 7,7,8,8,9,9,10,10,10-Нонафтордецилтозилат. 2,27 мл 7,7,8,8,9,9,10,10,10-Нонафтордекан-1-ола растворяют в 20 мл абсолютного пиридина, при 0 С смешивают с 2,48 г птолуолсульфонилхло-рида и в течение 3 ч перемешивают на холоде. Затем реакционную смесь сливают при перемешивании в воду, экстрагируют дихлорметаном, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле градиентом гексан/уксусный эфир получают 3,89 г 7,7,8,8,9,9,10,10,10 нонафтордецилтозилата в виде прозрачного масла. б) Метил-(7,7,8,8,9,9,10,10,10-нонафтордецил)амин В раствор из 3,89 г 7,7,8,8,9,9,10,10,10-нонафтордецилтозилата в 10 мл абсолютного тетрагидрофурана при -20 С подают в конденсированном виде 4,12 г метиламина и в течение ночи перемешивают при комнатной температуре в автоклаве. Открыв автоклав при-20 С, раствору дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор растворяют с помощью дихлорметана, промывают водой,сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 2,63 г метил-(7,7,8,8,9,9,10,10,10-нонафтордецил)амина в виде сырого продукта. Метил-(7,7,8,8,9,9,10,10,11,11,12,12,12-тридекафтордодецил)амин. а) 7,7,8,8,9,9,10,10,11,11,12,12,12-Тридекафтордодецилтозилат 2,76 мл 7,7,8,8,9,9,10,10,11,11,12,12,12-тридекафтордодекан-1-ола растворяют в 20 мл абсолютного пиридина, при 0 С 38 смешивают с 2,48 г п-толуолсульфонилхлорида и в течение 3 ч перемешивают на холоде. Затем реакционную смесь сливают при перемешивании в воду, экстрагируют дихлорметаном, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле градиентом гексан/уксусный эфир получают 4,33 г 7,7,8,8,9,9,10,10,11,11,12,12,12-тридекафтордодецилтозилата в виде прозрачного масла. б) Метил-(7,7,8,8,9,9,10,10,11,11,12,12,12 тридекафтордодецил)амин. В раствор из 4,33 г 7,7,8,8,9,9,10,10,11,11,12,12,12-тридекафтордодецилтозилата в 10 мл абсолютного тетрагидрофурана при -20 С подают в конденсированном виде 3,23 г метиламина и в течение ночи перемешивают при комнатной температуре в автоклаве. Открыв автоклав при -20 С, раствору дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор растворяют с помощью дихлорметана,промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 3,2 г метил-(7,7,8,8,9,9,10,10,11,11,12,12,12-тридекафтордодецил)амина в виде сырого продукта.-Гептадекафтортетрадецил)метиламин. а) 7,7,8,8,9,9,10,10,11,11,12,12,13,13,14,14,14-гептадекафтортетрадецилтозилат. 5,2 г 7,7,8,8,9,9,10,10,11,11,12,12,13,13,14,14,14-гептадекафтортетрадекан-1-ола растворяют в 20 мл абсолютного пиридина, при 0 С смешивают с 2,48 г п-толуолсульфонилхлорида и в течение 3 ч перемешивают на холоде. Затем реакционную смесь сливают при перемешивании в воду, экстрагируют дихлорметаном, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле градиентом гексан/уксусный эфир получают 5,72 г 7,7,8,8,9,9,10,10,11,11,12,12,13,13,14,14,14-гептадекафтортетрадецилтозилата в виде прозрачного масла. б)(7,7,8,8,9,9,10,10,11,11,12,12,13,13,14,14,14-Гептадекафтортетрадецил)метиламин. В раствор из 5,72 г 7,7,8,8,9,9,10,10,11,11,12,12,13,13,14,14,14-гептадекафтортетрадецилтозилата в 10 мл абсолютного тетрагидрофурана при -20 С подают в конденсированном виде 3,78 г метиламина и в течение ночи перемешивают при комнатной температуре в автоклаве. Открыв автоклав при -20 С, раствору дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор растворяют с помощью дихлорметана, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 4,29 г (7,7,8,8,9,9,10,10,11,11,12,12,13,13,14,14,14-гептадекафтортетрадецил)метиламина в виде сырого продукта.(10)-триен-3,17-диол 5 г 7-(5-хлорпентил)11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17 она растворяют в 100 мл метанола и порциями смешивают при 0 С с 0,96 г борогидрида натрия. После перемешивания в течение 30 мин при 0 С реакционную смесь сливают в полунасыщенный раствор хлорида натрия, трижды экстрагируют уксусным эфиром и один раз промывают насыщенным раствором поваренной соли. После сушки над сульфатом магния концентрируют под вакуумом. После очистки посредством препаративной колоночной хроматографии на силикагеле градиентом гексан/уксусный эфир получают 4,29 г 7-(5-хлорпентил)-11-фторэстра-1,3,5(10)-триен-3,17-диола. б) 11-Фтор-7-(5-иодпентил)эстра-1,3,5(10)-триен-3,17-диол. 4,29 г 7-(5-Хлорпентил)-11-фторэстра 1,3,5(10)-триен-3,17-диола растворяют в 60 мл этилметилкетона, смешивают с 4,91 г иодида натрия и перемешивают в течение ночи при 90 С. Для дальнейшей переработки реакционную смесь охлаждают до комнатной температуры, подают при перемешивании в воду, трижды экстрагируют уксусным эфиром, промывают раствором тиосульфата, сушат над сульфатом магния и концентрируют под вакуумом. В результате получают 5,16 г 11-фтор-7-(5 иодпентил)эстра-1,3,5(10)-триен-3,17-диола в виде сырого продукта, который без дальнейшей очистки используют на последующей стадии. в) 11-Фтор-7-5-[метил-(3-феноксипропил)амино]пентилэстра-1,3,5(10)-триен-3,17 диол. Раствор из 486 мг 11-фтор-7-(5 иодпентил)эстра-1,3,5(10)-триен-3,17-диола в 10 мл 1-метил-2-пирролидинона в течение 3 ч перемешивают при температуре ванны 80 С с 600 мг метил-(3-феноксипропил)амина. Затем смесь сливают на насыщенный раствор хлорида натрия, экстрагируют простым эфиром, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле метиленхлоридом/метанолом/аммиаком. В результате получают 443 мг 11-фтор-7-5-[метил(3-феноксипро-пил)амино]пентил]эстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+47 (с =0,5 в СНСl3). Пример 22. 7-5-[(3-Бензилоксипропил) метиламино]пентил-11-фторэстра-1,3,5(10)триен-3,17-диол. Раствор из 486 мг 11-фтор-7-(5-иодпентил)эстра-1,3,5(10)-триен-3,17-диола в 10 мл 1 метил-2-пирролидинона в течение 3 ч перемешивают при температуре ванны 80 С с 540 мг 40 сливают на насыщенный раствор хлорида натрия, экстрагируют простым эфиром, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле метиленхлоридом/метанолом/аммиаком. В результате получают 237 мг 7-5-[(3-бензилоксипропил)метиламино]пентил-11-фторэстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+48 (с =0,5 в СНСl3). Получение исходных соединений Метил-(3-феноксипропил)амин. В раствор из 1,6 мл 3-феноксипропилбромида в 15 мл безводного тетрагидрофурана при -78 С подают в конденсированном виде 3,57 г метиламина и в течение ночи перемешивают при комнатной температуре в реакторе,работающем под давлением. Открыв реактор при -20 С, раствору дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор сливают в насыщенный раствор хлорида натрия,экстрагируют простым эфиром, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 2,01 г метил-(3 феноксипропил) амина в виде сырого продукта,который без дальнейшей очистки используют на последующей стадии.(3-Бензилоксипропил)метиламин. В раствор из 1,8 мл (3-бромпропоксиметил)бензола в 15 мл безводного тетрагидрофурана при -78 С подают в конденсированном виде 3,57 г метиламина и в течение ночи перемешивают при комнатной температуре в реакторе, работающем под давлением. Открыв реактор при -20 С, раствору дают нагреться до комнатной температуры для испарения избыточного метиламина, Затем реакционный раствор сливают в насыщенный раствор хлорида натрия,экстрагируют простым эфиром, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 1,91 г (3 бензилоксипропил) метиламина в виде сырого продукта, который без дальнейшей очистки используют на последующей стадии. Пример 23. 11-Фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилокси)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диол. а) 11-Фтор-7-(5-бромпентил)-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-17 он. 8,4 г 11-Фтор-7-(5-бромпентил)-3-гид-роксиэстра-1,3,5(10)-триен-17-она в 90 мл тетрагидрофурана подвергают при комнатной температуре взаимодействию с 9,0 мл 3,4-дигидропирана и 805 мг гидрата п-толуолсульфокислоты. По истечении 7 ч добавляют 1 мл триэтиламина, разбавляют уксусным эфиром, промывают насыщенным раствором хлорида натрия до нейтрального состояния и сушат над сульфатом натрия. После хроматографии на силикагеле градиентом гексан/уксусный эфир получают 7,6 г 11-фтор-7-(5-бромпентил)-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-она в виде пенистого вещества. б) 11-Фтор-7-[5-[(3-трет-бутилдиметилсилилоксипропил)метиламино]пентил-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-он. 6,0 г 11-Фтор-7-(5-бромпентил)-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен 17-она в 130 мл диметилформамида подвергают при 100 С взаимодействию с 5,7 г 1-Nметиламино-3-трет-бутилдиметилсилилоксипропана (получают из 1-бром-3-гидроксипропана взаимодействием с трет-бутилдиметилсилилхлоридом с получением 1-бром-3-третбутилдиметил-силилоксипропана и последующей реакцией с метиламином). По истечении 7 ч разбавляют уксусным эфиром, промывают насыщенным раствором хлорида натрия и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/метанол получают 4,5 г 11 фтор-7-5-[(3-трет-бутилдиметилсилилоксипропил)метиламино]пентил-3-(тетрагидролиран-2 илокси)эстра-1,3,5(10)-триен-17-она в виде масла. в) 11-Фтор-7-5-[(3-гидроксипропил) метиламино]пентил]эстра-1,3,5(10)-триен-17-он. 2,3 г 11-Фтор-7-5-[(3-трет-бутилдиметилсилилоксипропил)метиламино]пентил-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-она в 23 мл тетрагидрофурана подвергают при комнатной температуре взаимодействию с 6 мл раствора фторида тетрабутиламмония (1 М в тетрагидрофуране). По истечении 2 ч разбавляют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/метанол получают 1,5 г 11 фтор-7-5-[(3-гидроксипропил)метиламино] пентилэстра-1,3,5(10)-триен-17-она в виде пенистого вещества. г) 11-Фтор-3-(тетрагидропиран-2-илокси)-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилокси)пропиламино]пентилэстра-1,3,5(10)-триен-17-он. К 710 мг 11-фтор-7-5-[(3-гидроксипропил)метиламино]пентил-эстра-1,3,5(10)триен-17-она в 10 мл толуола добавляют при комнатной температуре 1,8 г пентафторпентилиодида, 10 мл 40%-ного едкого натра и 465 мг гидросульфата тетрабутиламмония. По истечении 6 дней реакционную смесь подают на лед/воду, экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/метанол получают 123 мг 11-фтор-3-(тетрагидропиран-2 002623(10)-триен-17-ол. 120 мг 11-Фтор-3-(тетрагидропиран-2 илокси)-7-[5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилокси)пропиламино]пентилэстра 1,3,5(10)-триен-17-она подвергают при комнатной температуре реакции восстановления в смеси из 1 мл тетрагидрофурана, 0,6 мл этанола и 0,3 мл воды с использованием 20 мг борогидрида натрия. По истечении 1 ч разбавляют уксусным эфиром, промывают водой до нейтрального состояния, концентрируют под вакуумом и сушат. В результате получают 76 мг 11-фтор-3(тетрагидропиран-2-илокси)-7-5-[N-метил-N3-(4,4,5,5,5-пентафторпентилокси)пропиламино] пентил-эстра-1,3,5(10)-триен-17-ола в виде сырого продукта. е) 11-Фтор-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентилокси)пропиламино]пентил эстра-1,3,5(10)-триен-3,17-диол. 75 мг 11-Фтор-3-(тетрагидропиран-2 илокси)-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилокси)пропиламино]пентилэстра 1,3,5(10)-триен-17-ола подвергают в 1 мл метанола и 0,1 мл воды взаимодействию при комнатной температуре с 50 мг щавелевой кислоты. По истечении 2 ч разбавляют метиленхлоридом,промывают насыщенным раствором хлорида натрия до нейтрального состояния, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/метанол получают 25 мг 11-фтор-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилокси)пропиламино]пентилэстра 1,3,5(10)-триен-3,17-диола в виде пенистого вещества. Пример 24. 11-Фтор-7-[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]эстра-1,3,5(10)триен-3,17-диол. а) 3,11-Диацетоксиэстра-3,5-диен-17-он. К 100 г 11-гидроксиэстр-4-ен-3,17-диона в 1 л ангидрида уксусной кислоты добавляют при комнатной температуре 10 г п-толуолсульфокислоты. По истечении 5 ч раствор сливают при перемешивании в содержащую пиридин смесь льда и воды, выпавший продукт отфильтровывают с помощью вакуумфильтра и промывают водой до нейтрального состояния. К полученному влажному неочищенному продукту примешивают 200 мл метанола, перемешивают в течение 30 мин при -30 С, кристаллизат отфильтровывают с помощью вакуум-фильтра,промывают холодным метанолом и сушат под вакуумом при 50 С. В результате получают 115 г 3,11-диацетоксиэстра-3,5-диен-17-она. б) 11-Ацетоксиэстра-4,6-диен-3,17-дион. К 57 г 3,11-диацетоксиэстра-3,5-диен-17 она в 470 мл N-метил-2-пирролидинона при охлаждении льдом добавляют 48 мл 10%-ного водного раствора ацетата натрия и порциями 22,3 г 1,3-дибром-5,5-диметилгидантоина. По истечении 30 мин добавляют 16,7 г сульфита натрия, перемешивают в течение 15 мин при 0 С, после чего примешивают 20 г бромида лития и 16 г карбоната лития и перемешивают при 100 С. По истечении 2 ч реакционную смесь подают в ледяную воду, выпавший продукт отфильтровывают с помощью вакуум-фильтра,растворяют в метиленхлориде, промывают водой до нейтрального состояния и сушат. Затем сырой продукт перекристаллизовывают из 200 мл уксусного эфира, получив в результате 30 г 11-ацетоксиэстра-4,6-диен-3,17-диона с температурой плавления 246-248 С. в) 11-Ацетокси-7-(9-трет-бутилдиметилсилилоксинонил)эстр-4-ен-3,17-дион. К раствору реактивов Гриньяра из 2,2 г магниевой стружки и 34,2 г 1-бром-9-третбутилдиметилсилилоксинонана (полученного из 9-бром-1-нонанола и трет-бутилдиметилсилилхлорида) в 140 мл тетрагидрофурана примешивают при -30 С 8,8 г иодида меди(I). По истечении 30 мин при той же температуре -30 С добавляют по каплям раствор из 9 г 11 ацетоксиэстра-4,6-диен-3,17-диона в смеси из 64 мл тетрагидрофурана и 10,6 мл 1,3-диметил-2 оксогексагидропиримидина (ДМОП), перемешивают в течение 2 ч и затем смешивают с 6 мл ледяной уксусной кислоты. По истечении 15 мин реакционную смесь разбавляют уксусным эфиром, промывают насыщенным раствором хлорида аммония и водой до нейтрального состояния и сушат. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 6 г 11-ацетокси 7-(9-трет-бутилдиметилсилилоксинонил)эстр 4-ен-3,17-диона с температурой плавления 120122 С. г) 11-Ацетокси-7-(9-гидроксинонил) эстр-4-ен-3,17-дион. 19,9 г 11-Ацетокси-7-(9-трет-бутилдиметилсилилоксинонил)эстр-4-ен-3,17-диона в 90 мл метанола смешивают при комнатной температуре с 20 мл 8%-ной серной кислоты. По истечении 2,5 ч разбавляют уксусным эфиром,промывают насыщенным раствором гидрокарбоната натрия и водой до нейтрального состояния и сушат. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/ацетон получают 15,8 г 11-ацетокси-7-(9 гидроксинонил)эстр-4-ен-3,17-диона в виде пенистого вещества. д) 11-Ацетокси-7-(9-хлорнонил)эстр-4 ен-3,17-дион. 15,8 г 11-Ацетокси-7-(9-гидроксинонил)эстр-4-ен-3,17-диона подвергают в 65 мл 44 ацетонитрила при комнатной температуре взаимодействию со 184 мл тетрахлорметана и 17,9 г трифенилфосфина. По истечении 5 ч разбавляют метиленхлоридом, промывают насыщенным раствором гидрокарбоната натрия и водой до нейтрального состояния и сушат. Сырой продукт хроматографируют на силикагеле градиентом гексан/уксусный эфир. Выход: 7,8 г 11 ацетокси-7-(9-хлорнонил)эстр-4-ен-3,17-диона с температурой плавления 113-115 С. е) 7-(9-Хлорнонил)-11-гидроксиэстр-4 ен-3,17-дион. 6 г 11-Ацетокси-7-(9-хлорнонил) эстр-4 ен-3,17-диона при 60 С омыляют в смеси из 12 мл тетрагидрофурана и 12 мл метанола с помощью 17 мл 1 н. калийного щелока. По истечении 3 ч разбавляют уксусным эфиром, промывают насыщенным раствором хлорида натрия и водой до нейтрального состояния и сушат. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/ацетон получают 3,2 г 7-(9-хлорнонил)-11-гидроксиэстр-4-ен-3,17-диона в виде масла. ж) 7-(9-хлорнонил)-11-фторэстр-4-ен 3,17-дион. К 6,7 г 7-(9-хлорнонил)-11-гидроксиэстр-4-ен-3,17-диона в 35 мл уксусного эфира при 0 С добавляют 3,3 мл 1,8-диазабицикло[5,4,0]ундец-7-ена и по каплям - 4 мл фторида перфторбутан-1-сульфокислоты. По истечении 2 ч разбавляют уксусным эфиром, промывают несколько раз 2 н. соляной кислотой и нейтрализуют насыщенным раствором гидрокарбоната натрия и водой. Сырой продукт хроматографируют на силикагеле градиентом гексан/уксусный эфир. Выход: 6,2 г 7-(9-хлорнонил)-11 фторэстр-4-ен-3,17-диона в виде масла. з) 7-(9-Хлорнонил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-дион. К 5,6 г 7-(9-хлорнонил)-11-фторэстр-4 ен-3,17-диона в 55 мл ацетонитрила при 80 С добавляют по каплям раствор из 5,5 г бромида меди (II) и 1,1 г бромида лития в 55 мл ацетонитрила. По истечении 2 ч разбавляют уксусным эфиром, нейтрализуют раствором гидрокарбоната натрия, промывают водой, сушат и концентрируют под вакуумом. После хроматографии на силикагеле градиентом гексан/простой эфир получают 1,1 г 7-(9-хлорнонил)-11 фтор-3-гидроксиэстра-1,3,5(10)-триен-17-диона в виде пенистого вещества. и) 7-(9-Хлорнонил)-11-фтор-3-(тетрагидропиран-2-илокси) эстра-1,3,5(10)-триен-17 дион. 3 г 7-(9-Хлорнонил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-диона в 30 мл тетрагидрофурана подвергают при комнатной температуре взаимодействию с 2,9 мл 3,4-дигидропирана и 150 мг гидрата п-толуолсульфокислоты. По истечении 3 ч разбавляют уксусным эфиром, нейтрализуют насыщенным рас 45 твором гидрокарбоната натрия и водой, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 2,8 г 7-(9 хлорнонил)-11-фтор-3-(тетрагидропиран-2 илокси)эстра-1,3,5(10)-триен-17-диона в виде масла. к) 11-Фтор-7-(9-иоднонил)-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-17 дион. 2,6 г 7-(9-Хлорнонил)-11-фтор-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-17 диона в 20 мл этилметилкетона перемешивают при 80 С с 2,9 г иодида натрия. По истечении 20 ч разбавляют простым эфиром, промывают водой, сушат и концентрируют под вакуумом. Сырой продукт хроматографируют на силикагеле градиентом гексан/простой эфир. Выход: 1,2 г 11-фтор-7-(9-иоднонил)-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-диона в виде масла. л) 11-Фтор-[9-(4,4,5,5,5-пентафторпентилтио)нонил]-3-(тетрагидропиран-2-илокси) эстра-1,3,5(10)-триен-17-он. К 980 мг S-(4,4,5,5,5-пентафторпентил) тиоацетата в 10 мл метанола при охлаждении льдом добавляют по каплям 0,83 мл 30%-ного раствора метилата натрия в метаноле, после чего перемешивают в течение 30 мин при комнатной температуре. Затем добавляют раствор из 1,9 г 11-фтор-7-(9-иоднонил)-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-17-диона в 10 мл диметилформамида и перемешивают при 50 С. По истечении 18 ч разбавляют простым эфиром, промывают насыщенным раствором хлорида натрия и водой до нейтрального состояния, сушат и концентрируют под вакуумом. Сырой продукт хроматографируют на силикагеле градиентом гексан/простой эфир. В результате получают 1,3 г 11-фтор-[9-(4,4,5,5,5-пентафторпентилтио)нонил]-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-17-она в виде масла. м) 11-Фтор-[9-(4,4,5,5,5-пентафторпентилтио)нонил]-3-(тетрагидропиран-2-илокси) эстра-1,3,5(10)-триен-17-ол. 2,2 г 11-Фтор-[9-(4,4,5,5,5-пентафторпентилтио)нонил]-3-(тетрагидропиран-2-илокси) эстра-1,3,5(10)-триен-17-она в смеси из 45 мл метанола, 7 мл тетрагидрофурана и 4,5 мл воды смешивают порциями при 0 С с 450 мг борогидрида натрия. По истечении 45 мин разбавляют уксусным эфиром, промывают водой, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 1,8 г 11-фтор-[9-(4,4,5,5,5-пентафторпентилтио) нонил]-3-(тетрагидропиран-2-илокси)эстра-1,3,5 1,8 г 11-Фтор-[9-(4,4,5,5,5-пентафторпентилтио)нонил]-3-(тетрагидропиран-2-илокси) эстра-1,3,5(10)-триен-17-ола в 68 мл метанола и 6,8 мл воды подвергают при 60 С взаимодействию с 900 мг щавелевой кислоты. По истечении 2 ч разбавляют уксусным эфиром, нейтрализуют раствором гидрокарбоната натрия, промывают водой, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан/уксусный эфир получают 1,4 г 11-фтор-[9-(4,4,5,5,5 пентафторпентилтио)нонил]эстра-1,3,5(10)триен-3,17-ола в виде пенистого вещества. о) 11-Фтор-7-[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]-эстра-1,3,5(10)-триен 3,17-ол. К 300 мг 11-фтор-[9-(4,4,5,5,5-пентафторпентилтио)нонил]эстра-1,3,5(10)-триен-3,17 ола в 12 мл метанола и 2,4 мл воды при комнатной температуре примешивают 241 мг периодата натрия. По истечении 1,5 ч разбавляют уксусным эфиром, промывают насыщенным раствором хлорида натрия и водой до нейтрального состояния, сушат и концентрируют под вакуумом. Сырой продукт хроматографируют на силикагеле градиентом метиленхлорид/ацетон. Выход: 287 мг 11-фтор-7-[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]эстра-1,3,5(10)триен-3,17-ола в виде пенистого вещества. Пример 25. N-[4-(11-Фтор-3,17-дигидроксиэстра-1,3,5(10)-триен-7-ил)бутил]-N-пентилбензамид. а) 3-Бензилокси-7-(4-хлорбутил)-11 фторэстра-1,3,5(10)-триен-17-он. Раствор из 3,9 г 7-(4-хлорбутил)-11 фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она,полученного аналогично описанному в примере 4 б) 6-хлоргексильному соединению, в 100 мл ацетонитрила перемешивают в течение 24 ч при температуре ванны 80 С с 2,28 г карбоната калия и 2,11 г бензилбромида. Затем концентрируют досуха, смешивают с водой, дважды экстрагируют дихлорметаном, промывают водой и насыщенным раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/уксусным эфиром. В результате получают 5,14 г 3-бензилокси-7-(4-хлорбутил)11-фторэстра-1,3,5(10)-триен-17-она в виде пенистого вещества. б) 7-(5-Азадецил)-3-бензилокси-11 фторэстра-1,3,5(10)-триен-17-он. Раствор из 273 мг 3-бензилокси-7-(4 хлорбутил)-11-фторэстра-1,3,5(10)-триен-17 она в 7 мл диметилформамида перемешивают в течение 24 ч при 80 С с 262 мг иодида натрия и 0,5 мл н-пентиламина. Затем реакционную смесь сливают на лед/воду, экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат и концентрируют 47 под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/метанол получают 275 мг 7-(5-азадецил)-3-бензилокси-11-фторэстра-1,3,5(10)триен-17-она. в) N-[4-(3-Бензилокси-11-фторэстра-1,3,5(10)-триен-17-он-7-ил)бутил]-N-пентилбензамид. Раствор из 275 мг 7-(5-азадецил)-3 бензилокси-11-фторэстра-1,3,5(10)-триен-17 она в 7,8 мл диметилформамида перемешивают в течение 24 ч при комнатной температуре со 175 мг бензойной кислоты и 250 мг 1 гидроксибензотриазола, а также с 0,2 мл N,N'диизопропилкарбодиимида. Затем реакционную смесь сливают на лед/воду, экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид/метанол получают 197 г N-[4-(3 бензилокси-11-фторэстра-1,3,5(10)-триен-17 он-7-ил)бутил]-N-пентилбензамида. г)(10)-триен-17-он-7-ил)бутил]-N-пентилбензамид. Раствор из 197 г N-[4-(3-бензилокси-11 фторэстра-1,3,5(10)-триен-17-он-7-ил)бутил]N-пентилбензамида в 4,8 мл дихлорметана перемешивают в течение 3 ч при комнатной температуре с 2 мл тиоанизола и 1,2 мл трифторуксусной кислоты. Затем разбавляют дихлорметаном, промывают 1-молярным раствором едкого натра, промывают водой до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метил-трет-бутиловым эфиром. В результате получают 147 мг N[4-(11-фтор-3-гидроксиэстра-1,3,5(10)-триен 17-он-7-ил)бутил]-N-пентилбензамида. д) N-[4-(11-Фтор-3,17-дигидроксиэстра 1,3,5(10)-триен-17-он-7-ил)бутил]-N-пентилбензамид. К раствору из 110 мг N-[4-(11-фтор-3 гидроксиэстра-1,3,5(10)-триен-17-он-7-ил)бутил]-N-пентилбензамида в 1,5 мл дихлорметана и 4,5 мл метанола примешивают при комнатной температуре 110 мг борогидрида натрия и перемешивают в течение 0,5 ч. Затем разбавляют водой, экстрагируют 25 мл уксусного эфира,дважды промывают водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют гексаном/уксусным эфиром. В результате получают 112 мг чистого N-[4-(11 фтор-3,17-дигидроксиэстра-1,3,5(10)-триен-17 он-7-ил)бутил]-N-пентилбензамида в виде пенистого вещества, []D22=+42,3 (с =0,51% в хлороформе). За счет выбора соответственно одного из следующих -хлоридов для стадии а): 7-(4 002623 хлорбутил)-11-фтор-3-гидроксиэстра-1,3,5(10)триен-17-она,7-(5-хлорпентил)-11-фтор-3 гидроксиэстра-1,3,5(10)-триен-17-она (пример 26 и 7-(6-хлоргексил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она (пример 4 б, соответственно одного из следующих аминов для стадии б): аминометилциклогексана, бензиламина, 2-метоксиэтиламина, 3-фенилпропиламина, гексиламина и октиламина и соответственно одной из следующих кислот для стадии в): 4-ацетаминобензойной кислоты, 4-цианобензойной кислоты, 3-циклогексилпропионовой кислоты, 3,4-диметоксифенилуксусной кислоты,4-этоксибензойной кислоты, лауриновой кислоты, 2-нафтилуксусной кислоты, 4-фенилмасляной кислоты, пропионовой кислоты и 4 бифенилуксусной кислоты аналогичным проведением стадий а) -д), описанных в примере 25,получают соединения, представленные в нижеследующей таблице. Вместо взаимодействия с активированной кислотой на стадии в) такое взаимодействие можно осуществлять также с использованием алкилгалогенида (галоген представляет собой Сl, Вr), при этом в таких случаях вместо амида непосредственно получают амин. В таблице указаны пики [М]1 в массспектрах (МC) этих соединений;N-метилпирролидона, смешивают с 1,2 г метил(2-п-толилэтил)амина и в течение 3 ч перемешивают при температуре ванны 80 С. Для дальнейшей переработки смесь подают на насыщенный раствор хлорида натрия, экстрагируют уксусным эфиром, сушат над сульфатом натрия и концентрируют досуха под вакуумом. После очистки посредством колоночной хроматографии на силикагеле градиентом уксусный эфир/ метанол/аммиак и последующей кристаллизации из уксусного эфира/метиленхлорида/гексана получают 277 мг 11-фтор-7-5-[метил-(2 п-толилэтил)амино]пентилэстра-1,3,5(10)триен-3,17-диола с температурой плавления 142-143 С. Получение исходных соединений а) 2-п-Толилэтилтозилат. 2,8 мл 2-п-Толилэтанола при охлаждении ледяной ванной помещают в 40 мл пиридина,примешивают 4,96 г п-толуолсульфонилхлорида и в течение 30 мин перемешивают при 0 С и в течение 2 ч при комнатной температуре. Затем реакционную смесь медленно вводят при перемешивании в примерно 150 г льда/воды. Выпавший продукт отфильтровывают с помощью вакуум-фильтра, несколько раз промывают водой, растворяют в метиленхлориде, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 5,8 г 2-птолилэтилтозилата, который без дальнейшей очистки используют на последующей стадии. б) Метил- (2-п-толилэтил) амин. В раствор из 5,8 г 2-п-толилэтилтозилата в 15 мл абсолютного тетрагидрофурана при 20 С подают в конденсированном виде 9,2 г метиламина и в течение ночи перемешивают в автоклаве при комнатной температуре. Открыв автоклав при -20 С, смеси дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционный раствор растворяют с помощью простого эфира, промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют досуха под вакуумом. Таким путем получают 5,39 г метил-(2-п-толилэтил)амина,который в виде сырого продукта используют в последующей реакции. Пример 208. 7-(5-[2-(4-Этоксифенил) этил]метиламинопентил)-11-фторэстра-1,3,5 триен-3,17-диола с температурой плавления 94-95 С. Выход составляет 464 мг. Получение исходных соединений а) 2-(4-Этоксифенил)этилтозилат. 3,32 г 2-(4-Этоксифенил)этанола аналогично примеру 207 а) (получение исходных соединений) превращают в 5,61 г 2-(4-этоксифенил)этилтозилата в виде сырого продукта. б) [2-(4-Этоксифенил)этил]метиламин. 5,61 г 2-(4-Этоксифенил) этилтозилата аналогично примеру 207 б) (получение исходных соединений) превращают в 4,14 г [2-(4 этоксифенил)этил] метиламина в виде сырого продукта. Пример 209. 11-Фтор-7-5-[метил-(3-фенилпропил)амино]пентил]эстра-1,3,5(10)-триен 3,17-диол. 1,67 г 11-Фтор-7-[5-(метиламино) пентил]эстра-1,3,5(10)-триен-3,17-диола растворяют в 60 мл этилметилкетона, последовательно примешивают 1,64 г карбоната калия и 1,82 мл 3-фенилпропилбромида и в течение 2 ч нагревают с обратным холодильником. Для дальнейшей переработки реакционную смесь разбавляют уксусным эфиром, промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют досуха под вакуумом. После очистки посредством колоночной хроматографии на силикагеле градиентом метиленхлорид/метанол/аммиак и последующей кристаллизации из уксусного эфира/метиленхлорида/гексана получают 369 мг 11-фтор-7-5-[метил-(3-фенилпропил)амино] пентилэстра-1,3,5(10)-триен-3,17-диола с температурой плавления 123-124 С. Пример 210. 11-Фтор-7-5-[метил-(3 пиридин-3-илпропил)амино]пентилэстра-1,3,5(10)-триен-3,17-диол. 779 мг 11-Фтор-7-[5-(метиламино)пентил] эстра-1,3,5(10)-триен-3,17-диола аналогично примеру 209 подвергают взаимодействию с 778 мг 3-(3-хлорпропил) пиридина. В результате получают 207 мг 11-фтор-7-5-[метил(3-пиридин-3-илпропил)амино]пентилэстра 1,3,5(10)-триен-3,17-диола в виде пенистого вещества. Получение исходного соединения 3-(3-Хлорпропил)пиридин. 3,58 мл 3-(3-гидроксипропил)пиридина помещают в 50 мл абсолютного метиленхлорида и при 0 С по каплям смешивают с раствором из 4,4 мл тионилхлорида в 50 мл абсолютного метиленхлорида. По завершении процесса добавления перемешивают в течение 3 ч при комнатной температуре. Затем реакционный раствор осторожно вводят в смесь из 1 н. едкого натра и льда (1:1), несколько раз экстрагируют метиленхлоридом, промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют под вакуумом. 57 Таким путем получают 3,48 г 3-(3-хлорпропил) пиридина, который без дальнейшей очистки используют на последующей стадии. Пример 211. 11-Фтор-7-[5-[метил-(3-птолилпропил)амино]пентил]эстра-1,3,5(10)триен-3,17-диол. 486 мг 11-Фтор-7-(5-иодпентил)эстра 1,3,5(10)-триен-3,17-диола растворяют в 10 млN-метилпирролидона, примешивают 0,71 г метил-(3-п-толилпропил)амина и в течение 3 ч перемешивают при температуре ванны 90 С. Для дальнейшей переработки реакционную смесь сливают на насыщенный раствор хлорида натрия, экстрагируют уксусным эфиром, сушат над сульфатом натрия и концентрируют досуха под вакуумом. После колоночной хроматографии на силикагеле градиентом уксусный эфир/ метанол/аммиак получают 506 мг 11-фтор-75-[метил-(3-п-толилпропил)амино]пентил эстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества, []D=+44 (с=0,5 в СНСl3). Получение исходных соединений а) 3-п-Толилпропан-1-ол. 3,28 г 3-п-Толилпропионовой кислоты растворяют в 80 мл простого эфира и порциями смешивают при комнатной температуре с взятым трижды по 0,5 г алюмогидридом лития. После добавления каждого из указанных количеств в течение приблизительно 30 мин нагревают с обратным холодильником. Для дальнейшей переработки реакционную смесь охлаждают до -5 С и по каплям смешивают с 40 мл воды и 60 мл 1 н. серной кислоты. Затем разбавляют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют досуха под вакуумом. После препаративной колоночной хроматографии на силикагеле градиентом гексан/третбутилметиловый эфир получают 2,8 г 3-птолилпропан-1-ола в виде прозрачного масла. б) 3-п-Толилпропилтозилат. 2,8 г 3-п-Толилпропан-1-ола растворяют в 50 мл метиленхлорида и смешивают с 3,14 г 1,4 диазабицикло-2,2,2-октана. Далее при охлаждении ледяной ванной осторожно добавляют 4,62 г п-толуолсульфонилхлорида, перемешивают в течение 5 мин при 0 С, а затем продолжают перемешивание при комнатной температуре. Для дальнейшей переработки реакционную смесь подают на приблизительно 150 г льда и перемешивают в течение 30 мин. После этого трижды экстрагируют метиленхлоридом, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 4,74 г 3-п-толилпропилтозилата, который без дальнейшей очистки используют на последующей стадии. в) Метил-(3-п-толилпропил)амин. В раствор из 2,13 г 3-п-толилпропилтозилата в 15 мл абсолютного тетрагидрофурана при -20 С подают в конденсированном виде 58 3,34 г метиламина и в течение ночи перемешивают в автоклаве при комнатной температуре. Открыв автоклав при -20 С, смеси дают нагреться до комнатной температуры для испарения избыточного метиламина. Затем реакционную смесь растворяют с помощью простого эфира, промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют досуха под вакуумом. Таким путем получают 1,42 г метил-(3-птолилпропил) амина, который используют в виде сырого продукта в последующей реакции. Пример 212. 7-(5-[3-(4-Хлорфенил)пропил]метиламинопентил)-11-фторэстра-1,3,5(10)-триен-3,17-диол. 486 мг 11-Фтор-7-(5-иодпентил)эстра 1,3,5(10)-триен-3,17-диола аналогично примеру 211 подвергают взаимодействию с 0,89 г [3(4-хлорфенил)пропил] метиламина с получением в результате 343 мг 7-(5-[3-(4-хлорфенил) пропил]метиламинопентил)-11-фторэстра 1,3,5(10)-триен-3,17-диола, []D=+42,8 (с=0,5 в СНСl3). Получение исходных соединений а) 3-(4-Xлорфенил)пропан-1-ол. 5 г 3-(4-Xлорфенил) пропионовой кислоты аналогично примеру 211 а) (получение исходных соединений) превращают в 3,31 г 3-(4 хлорфенил)пропан-1-ола. б) 3-(4-Xлорфенил)пропилтозилат. 2,8 г 3-(4-Хлорфенил)пропан-1-ола аналогично примеру 211 б) (получение исходных соединений) превращают в 5,11 г 3-(4-хлорфенил) пропилтозилата в виде сырого продукта. в) [3-(4-Хлорфенил)пропил]метиламин. 2,27 г 3-(4-Хлорфенил)пропилтозилата аналогично примеру 211 в) (получение исходных соединений) превращают в 1,78 г [3-(4 хлорфенил)пропил]метиламина в виде сырого продукта. Пример 213. 7-(5-[3-(4-Этоксифенил) пропил]метиламинопентил)-11-фторэстра 1,3,5(10)-триен-3,17-диол. 486 мг 11-Фтор-7-(5-иодпентил)эстра 1,3,5(10)-триен-3,17-диола аналогично примеру 211 подвергают взаимодействию с 0,78 г [3(4-этоксифенил)пропилметиламина с получением в результате 345 мг 7-(5-[3-(4-этоксифенил)пропил]метиламино]пентил)-11-фторэстра-1,3,5(10)-триен-3,17-диола, []D=+43 (с=0,5 в СНСl3). Получение исходных соединений а) 3-(4-Этоксифенил)пропан-1-ол. 5 г 3-(4-Этоксифенил)пропионовой кислоты аналогично примеру 211 а) (получение исходных соединений) превращают в 5,08 г 3-(4 этоксифенил)пропан-1-ола в виде сырого продукта. 6) 3-(4-Этоксифенил)пропилтозилат. 5,08 г 3-(4-Этоксифенил)пропан-1-ола аналогично примеру 211 б) (получение исходных 59 соединений)превращают в 9,7 г 3-(4-этоксифенил)пропилтозилата в виде сырого продукта. в) [3-(4-Этоксифенил)пропил]метиламин. 2,34 г 3-(4-Этоксифенил)пропилтозилата аналогично примеру 211 в) (получение исходных соединений) превращают в 1,55 г [3-(4 этоксифенил)пропил]метиламина в виде сырого продукта. Пример 214. 11-Фтор-7-5-[метил-(4-метилпентил)амино]пентилэстра-1,3,5(10)-триен 3,17-диол. 486 мг 11-Фтор-7-(5-иодпентил)эстра 1,3,5(10)-триен-3,17-диола аналогично примеру 211 подвергают взаимодействию с 518 мг метил-(4-метилпентил)амина с получением в результате 263 г 11-фтор-7-5-[метил-(4-метилпентил)амино]пентилэстра-1,3,5(10)-триен 3,17-диола с температурой плавления 166 С. Получение исходных соединений а) 4-Метилпентилтозилат. 6,28 г 4-Метилпентан-1-ола аналогично примеру 211 б) (получение исходных соединений) превращают в 8,43 г 4-метилпентилтозилата. б) Метил-(4-метилпентил)амин. 1,65 г 4-Метилпентилтозилата аналогично примеру 211 в) (получение исходных соединений) превращают в 518 мг метил-(4 метилпентил) амина в виде сырого продукта. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 11-Галоген-7-замещенные эстратриены общей формулы IR3 обозначает атом водорода, углеводородный остаток с числом атомов углерода до 8 включительно или остаток субформулы R3'-С(О)-,где R3' обозначает атом водорода или углеводородный остаток с числом атомов углерода до 8 включительно либо фенильный остаток,R7 обозначает остаток формулы -A-B-Z-R20,где А обозначает прямую связь или бензилиденовый остаток, при этом метиленовая группа связана с углеродным атомом стероида в положении 7, либо обозначает фениленовый остаток,В обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с 3-14 атомами углерода иZ представляет собой -NR21-, где R21 обозначает С 1-С 3 алкильную группу, причем в этом случае R20 обозначает атом водорода, прямоцепочечную либо разветвленную алкильную, алкенильную или алкинильную группу с числом атомов углерода до 10 включительно либо пред 002623 60 ставляет собой одну из следующих группировок: -D-CnF2n+1, где D обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 8 включительно, а n обозначает целое число в пределах 1-8,-L-CH=CF-CpF2p+1, где L обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с 2-7 атомами углерода, а р обозначает целое число в пределах 2-7, -D-О-(СН 2)q-арил, где D имеет вышеуказанные значения, q обозначает 0, 1, 2 или 3, а арил представляет собой необязательно одно- или двукратно замещенный фенильный,1- либо 2-нафтильный или гетероарильный остаток, -D-О-(СH2)r-СnF2n+1, где D и n имеют вышеуказанные значения, а r обозначает целое число в пределах 1-5, илиR20 и R21 вместе с атомом азота, с которым они связаны, образуют насыщенный либо ненасыщенный гетероцикл с 5 или 6 звеньями цепи,который необязательно содержит еще один или два гетероатома, выбранных из группы, включающей азот, кислород и серу, и который также необязательно замещен, илиZ представляет собой -SOx-, где х обозначает 0, 1 или 2, причем в этом случае R20 обозначает прямоцепочечную либо разветвленную алкильную, алкенильную или алкинильную группу с числом атомов углерода до 10 включительно либо представляет собой одну из следующих группировок: -D-CnF2n+1, где D обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 8 включительно, а n обозначает целое число в пределах 1-8, -L-CH=CF-CpF2p+1, где L обозначает прямоцепочечную либо разветвленную алкиленовую, алкениленовую или алкиниленовую группу с 2-7 атомами углерода, а р обозначает целое число в пределах 2-7, -D-O-(CH2)q-арил,где D имеет вышеуказанные значения, q обозначает 0, 1, 2 или 3, а арил представляет собой необязательно одно- или двукратно замещенный фенильный, 1- либо 2-нафтильный или гетероарильный остаток, -D-O-(CH2)r-CnF2n+1, где D и n имеют вышеуказанные значения, а r обозначает целое число в пределах 1-5, илиZ представляет собой -NR31-, причем в этом случае R20 обозначает прямоцепочечный либо разветвленный алкильный, алкенильный или алкинильный остаток с числом атомов углерода до 14 включительно, который может быть разорван одним-тремя гетероатомами -Oи -S- и группировками -NR32-, где R32 представляет собой атом водорода или С 1-С 3 алкильный остаток, и/или может быть частично фторирован, или обозначает необязательно одно- либо двукратно замещенный арильный или гетероарильный остаток, необязательно одно- либо двукратно замещенный С 3-С 10 циклоалкильный остаток, необязательно одно- либо двукратно
МПК / Метки
МПК: A61K 31/565, C07J 41/00, A61P 5/30
Метки: фармацевтических, изготовления, замещенные, препаратов, галоген, эти, лекарственных, получения, средств, применение, 11&beta, 7&alpha, эстратриены, содержащих, способ
Код ссылки
<a href="https://eas.patents.su/30-2623-11beta-galogen-7alpha-zameshhennye-estratrieny-sposob-polucheniya-farmacevticheskih-preparatov-soderzhashhih-eti-11beta-galogen-7alpha-zameshhennye-estratrieny-i-ih-primenenie-dlya.html" rel="bookmark" title="База патентов Евразийского Союза">11&beta – галоген – 7&alpha – замещенные эстратриены, способ получения фармацевтических препаратов, содержащих эти 11&beta – галоген – 7&alpha – замещенные эстратриены, и их применение для изготовления лекарственных средств</a>
Предыдущий патент: Способ получения производных класса таксоидов
Следующий патент: Способ изменения проницаемости продуктивного пласта в прифильтровой зоне скважин
Случайный патент: Производные пиразола












