Бензотиофены, содержащие их фармацевтические композиции и способы лечения патологических состояний с их использованием
Номер патента: 1257
Опубликовано: 25.12.2000
Авторы: Эрбутнот Гордон Н., Стратфорд Роберт Е., Дэлдер Брайан В., Льюк Вейн Д., Хартауэр Керри Дж.
Формула / Реферат
1. Соединение формулы I
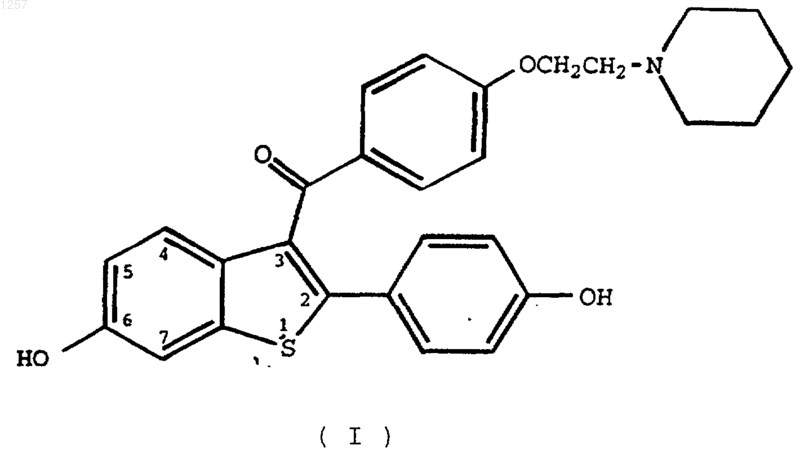
и его фармацевтически приемлемые соли и сольваты, характеризующееся тем, что оно находится в форме частиц, причем эти частицы имеют средний размер менее 25 микрон.
2. Соединение по п.1, где указанные частицы имеют средний размер в диапазоне примерно от 5 до 20 микрон.
3. Соединение по п.1 или 2, где, по меньшей мере, 90% указанных частиц имеют размер менее чем 50 микрон.
4. Соединение по п.3, где, по меньшей мере, 90% указанных частиц имеют размер менее 35 микрон.
5. Соединение по любому из пп. с 1 по 4, где соединение формулы I представляет собой гидрохлорид ралоксифена.
6. Соединение по п.5, которое представляет собой несольватированный кристаллический гидрохлорид, имеющий, по существу, следующую рентгенограмму, полученную с помощью Сu-излучения:
| Расстояние между d-линиями (ангстремы) | I/Io (x100) | |
| 13,3864 | 71,31 | |
| 9,3598 | 33,16 | |
| 8,4625 | 2,08 | |
| 7,3888 | 7,57 | |
| 6,9907 | 5,80 | |
| 6,6346 | 51,04 | |
| 6,1717 | 29,57 | |
| 5,9975 | 5,67 | |
| 5,9135 | 9,87 | |
| 5,6467 | 38,47 | |
| 5,4773 | 10,54 | |
| 5,2994 | 4,74 | |
| 4,8680 | 4,03 | |
| 4,7910 | 5,98 | |
| 4,6614 | 57,50 | |
| 4,5052 | 5,75 | |
| 4,3701 | 9,03 | |
| 4,2516 | 69,99 | |
| 4,2059 | 57,64 | |
| 4,1740 | 65,07 | |
| 4,0819 | 12,44 | |
| 3,9673 | 22,53 | |
| 3,9318 | 100,00 | |
| 3,8775 | 9,07 | |
| 3,7096 | 33,38 | |
| 3,6561 | 21,65 | |
| 3,5576 | 3,36 | |
| 3,5037 | 7,97 | |
| 3,4522 | 18,02 | |
| 3,4138 | 4,65 | |
| 3,2738 | 10,23 | |
| 3,1857 | 8,90 | |
| 3,1333 | 6,24 | |
| 3,0831 | 9,43 | |
| 3,0025 | 12,13 | |
| 2,9437 | 4,96 | |
| 2,8642 | 7,70 | |
| 2,7904 | 11,95 | |
| 2,7246 | 3,05 | |
| 2,6652 | 3,32 | |
| 2,5882 | 7,30 | |
7. Фармацевтическая композиция, включающая или полученная с использованием соединения по любому из пп.1-6, и одного или нескольких фармацевтически приемлемых носителей, разбавителей или наполнителей.
8. Способ повышения биологической доступности при лечении остеопороза ралоксифеном, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы I по любому из пп.1-6 или фармацевтической композиции по п.7.
9. Способ повышения биологической доступности яЁш снижении уровня липидов в сыворотке крови с помощью ралоксифена, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы I по любому из пп.1-6 или фармацевтической композиции по п.7.
10. Способ повышения биологической доступности при профилактике рака молочной железы с помощью ралоксифена, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы I по любому из пп.1-6 или фармацевтической композиции по п.7.
11. Изделие, включающее упаковочный материал, содержащий фармацевтическую композицию, причем этот упаковочный материал дополнительно имеет этикетку, указывающую на то, что эту композицию можно использовать для ингибирования патологии у человека, а фармацевтическая композиция включает или получена с использованием соединения по любому из пп.1-6.
Текст
1 Изобретение относится к области фармацевтической и органической химии и включает производное бензотиофена в форме частиц, которое можно использовать для лечения различных медицинских показаний, включая остеопороз и снижение уровня липидов. Более конкретно, заявленный диапазон размера частиц бензотиофена таков, что позволяет достигнуть повышенной биологической доступности лекарства и регулировать этот размер частиц в процессе производства. Остеопороз охватывает группу болезней,которые имеют разнообразную этиологию, но которые характеризуются потерей костной массы на единицу объема. Следствием этой потери костной массы и происходящего в результате разрушения кости является недостаточность скелета для того, чтобы обеспечить адекватную структурную опору тела. Одним из наиболее обычных типов остеопороза является остеопороз, ассоциированный с менопаузой. Большинство женщин теряет от около 20% до около 60% костной массы в трабекулярной части кости в пределах от 3 до 6 лет после прекращения менструаций. Эту быструю потерю обычно связывают с повышенной резорбцией и формированием костной массы. Однако, резорбционный цикл более доминантный, и результатом этого является потеря костной массы. Остеопороз является характерной и серьезной болезнью среди женщин в постклиматический период. Ралоксифен находится в стадии клинических исследований фазы III в случае остеопороза. До сих пор результаты этих исследований и другие данные свидетельствуют о возможности ралоксифена не только как средства для лечения остеопороза, но также о потенциальном использовании его для снижения уровня LDL (липиды сыворотки крови), ингибирования эндометриоза и фиброза матки и профилактики рака молочной железы. Продвижению ралоксифена до некоторой степени препятствуют его физические характеристики, как в отношении биологической доступности, так и в производстве. Например,он обычно нерастворим, и это может неблагоприятно влиять на биологическую доступность. Очевидно, что любое улучшение в физических характеристиках ралоксифена должно потенциально обеспечивать его более благотворную терапию и повышенные возможности производства. Это изобретение представляет соединение формулы I и его фармацевтически приемлемые соли и сольваты, характеризующиеся тем, что это соединение находится в форме частиц, причем эти 2 частицы имеют средний размер менее 25 микрон, предпочтительно примерно между 5 и 20 микронами. Кроме того, настоящее изобретение включает соединения формулы I, в котором, по меньшей мере, 90% частиц имеют размер примерно менее 50 микрон, предпочтительно менее 35 микрон. Настоящее изобретение далее относится к фармацевтическим композициям, содержащим или полученным с использованием одного или нескольких соединений формулы I, необязательно содержащим эстроген или прогестин, и использованию таких соединений, отдельно,или в комбинации с эстрогеном или прогестином, для облегчения симптомов остеопороза, снижения уровня липидов и ингибирования эндометриоза, фиброза матки и рака молочной железы. Обнаружено, что обработкой соединений формулы I для того, чтобы размер их частиц находился в пределах определенного узкого диапазона, можно получить фармацевтические композиции, которые обеспечивают активному ингредиенту как подходящий профиль растворения in vitro, так и биологическую доступностьin vivo. Кроме достижения этих желательных характеристик растворение/биологическая доступность, регулирование размера частиц в узком пределе приводит также к значительным усовершенствованиям производственных параметров. Средний размер частиц соединений формулы I, как представлено в изобретении, составляет менее 25 микрон, предпочтительно между 5 и 20 микрон. Кроме того, изобретение включает соединения формулы I, по меньшей мере,90% частиц которого имеют размер примерно менее 50 микрон, предпочтительно менее 35 микрон. Более предпочтительно, средний диапазон размера частиц находится между 5 и 20 микрон, причем, по меньшей мере, 90% частиц имеют размер примерно менее 35 микрон. Тем, кто хорошо знаком с методиками измельчения, должно быть ясно, что предел, установленный для размера в виде 90% или более частиц, является ограничением для дальнейшего отличия соединений в форме частиц данного изобретения от соединений, имеющих более широкое распределение по размеру, вследствие широкого колебания в размере частиц, встречающегося по всему веществу, размер частиц которого уменьшен измельчением или снижением размера частиц. Это может быть сделано путем измельчения с использованием различных видов стандартного оборудования для размалывания, например, молотковой дробилки,штифтовой дробилки или мельницы жидкого помола. Это изобретение предлагает также фармацевтические композиции, содержащие или полученные с использованием заявленного соеди 3 нения в форме частиц и одного или нескольких фармацевтически приемлемых наполнителей или носителей. Термин сольват представляет комплекс,который содержит одну или несколько молекул растворенного вещества, такого как соединение формулы I, с молекулой растворителя. Представительные сольваты получают с метиленхлоридом, 1,2-дихлорэтаном, хлороформом и 1,2,3 трихлорпропаном. Химическим названием ралоксифена является 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2 пиперидиноэтокси)бензоил]бензо[b]тиофен. Термин ралоксифен включает также его соли и сольваты, причем предпочтительна гидрохлоридная соль. Соединения данного изобретения можно получить по стандартным методикам, таким как методики, описанные в патентах США 4 133 814, 4 418 068 и 4 380 635. Предпочтительной формой гидрохлорида ралоксифена для использования в данном изобретении является несольватированная, кристаллическая форма, описанная в заявке на патент США 06/014167 и имеющая рентгенограмму с нижеследующими характеристиками. Рентгенограмма несольватированной кристаллической формы ралоксифена Расстояние между dлиниями Часто соединения, которые имеют низкую растворимость, могут обладать биологической доступностью, повышенной путем увеличения площади поверхности полученных частиц. Площадь поверхности на единицу объема обычно повышается, по мере того, как размер частиц уменьшается. Различные методики измельчения или размалывания лекарственного вещества хорошо известны, и каждую из этих методик обычно используют для уменьшения размера частиц и повышения их площади поверхности. Было бы разумно, чтобы наилучшим методом воздействия на любое слабо растворимое соединение было его измельчение до возможно самого малого размера; однако, это не всегда практично или желательно. Стоимость процесса измельчения включает не только прямую стоимость самого процесса, но также связана с другими факторами. Например, очень мелко измельченный материал вызывает трудности и дополнительные расходы при наполнении капсул или получении таблеток, поскольку этот материал не является сыпучим и слеживается в отделочной машине. Такие трудности при обработке вызывают неоднородность конечного продукта, которая неприемлема для лекарственного вещества. Кроме того процесс размалывания физически генерирует тепло и давление на материал, а такие условия ведут к химическому разложению соединения, поэтому методики размалывания обычно сводят до минимума. Следовательно, всегда имеется зависимость между свойствами, которые обеспечивают максимальную биологическую доступность(площадь поверхности частиц), и практическими ограничениями в производстве. Точка компромисса, которая дает наилучшее решение проблемы, уникальна для каждого случая и уникальна в отношении его определения. Способы определения размера частиц известны в данной области. Далее приводится описание одного из способов, что, однако, не предполагает ограничение только его использованием. Например, можно использовать общий метод из патента США 4 605 517. При получении соединения изобретения в форме частиц соединение формулы I в его исходном состоянии сначала характеризуют по размеру, используя инструмент, приспособлен 5 ный для измерения диаметра эквивалентного сферического объема, то есть анализатор распределения частиц по размеру по лазерному рассеянию Horiba LA900. Можно ожидать, что типичный образец соединения формулы I содержит в его исходном состоянии частицы,имеющие средний диаметр эквивалентного сферического объема приблизительно 110-200 микрон с широким распределением по размерам. После получения характеристики распределения по размерам в начальном состоянии исходное соединение затем размалывают, предпочтительно с использованием штифтовой дробилки, в подходящих условиях при определенной скорости вращения дробилки и скорости подачи сырья, чтобы довести размер частиц до указанного выше предела. Эффективность размалывания контролируют путем отбора проб с использованием анализатора распределения размеров частиц с лазерным рассеянием HoribaLA900 и окончательный размер частиц контролируют таким же образом. Если первое прохождение через мельницу не дает требуемое распределение размеров, то проводят одно или несколько дополнительных измельчений. Соединение формулы I в форме частиц,имеющих размеры в указанных выше пределах,можно затем смешать, при необходимости, с наполнителем или носителем и, например, прессовать в таблетки. Так, например, соединение в форме частиц можно смешать с безводной лактозой, моногидратом лактозы, сшитым повидоном, и гранулировать в водной дисперсии повидона и полисорбата 80. После сушки и дробления в гранулы материал можно в заключение смешать со стеаратом магния и прессовать в таблетки. Поскольку частицы в исходном состоянии,а также после размалывания или других способов уменьшения размера частиц имеют неправильную форму, необходимо характеризовать их не путем измерения действительного размера, такого как толщина или длина, а путем измерения свойства частиц, которое связано со свойством образца, имеющего теоретические сферические частицы. Таким образом, частицам приписывается эквивалентный сферический диаметр. Величины, найденные при исследовании большого числа неизвестных частиц, можно нанести на график зависимости частоты встречаемости от диаметра или, в других методах,зависимости массы от диаметра, обычно откладывая процентную долю частоты (количества) или массы частиц, имеющих величину меньше заданного размера. Это дает характеристическую кривую, представляющую распределение размера частиц образца, т.е. кумулятивную кривую процентного распределения частиц с размером меньше заданного. Величины из нее можно отсчитать непосредственно или можно нанести на вероятностную бумагу для логариф 001257 6 мически нормального распределения с получением соответствующей прямой линии. Средний диаметр эквивалентного сферического объема соответствует 50% частиц с размером меньше заданного. Найденный средний диаметр эквивалентного объема является, таким образом, статистическим представлением теоретической частицы,имеющей такие же свойства, что и неизвестная частица. Как указано выше, средний диаметр эквивалентного сферического объема частиц размолотого соединения формулы I можно оценить с использованием анализатора распределения размера частиц с лазерным рассеянием HoribaLA900. С использованием такого инструмента можно получить величины для суспензии частицы неизвестного размера, и инструмент можно регулировать с использованием контрольного образца, имеющего частицы в пределах ожидаемого диапазона размеров, основанного на статистическом анализе образца. Проведением многократных измерений контрольного образца установили, что стандартное отклонение в измерении в среднем составляет 1,3 микрон. Ниже представлено описание примеров получения композиции по изобретению. Во всех примерах соединение получали с использованием штифтовой дробилки из исходной формы,состоящей из частиц, имеющих средний диаметр эквивалентного сферического объема между 5 и 20 микронами, причем, по меньшей мере,90% частиц имели размер менее 35 микрон. Размер частиц измельченного солянокислого продукта (ралоксифен НСl) измеряли следующим образом. Анализ распределения размера частиц лазерным рассеянием проводили на небольшом образце измельченного материала,который суспендируют приблизительно в 180 мл раствора диспергатора. Образец добавляют к диспергатору до тех пор, пока не будет достигнут приемлемый уровень ослабления лазерного излучения, в этой точке измеряют распределение размеров частиц. До суспендирования образца раствор диспергатора получали добавлением 20 капель диспергатора Coulter 1A к насыщенному водному раствору гидрохлорида ралоксифена. Раствор диспергатора фильтровали через микропористый мембранный фильтр 0,2 микрон для получения необходимого суспендирующего диспергатора, не содержащего частицы. В пределах пяти минут получения дисперсии было проведено трехкратное измерение размера частиц. Трехкратное измерение проводили как минимальный контроль а) для получения более надежных измерений и б) для проверки воспроизводимости отбора эквивалентных проб суспендированного материала, т.е. не оседала ли суспензия. Результаты регистрировали автоматически и представляли графически, чтобы получить 7 процентную зависимость частоты от величины недостаточного размера и кривую кумулятивной процентной величины от недостаточного размера для этого образца. Была получена величина среднего диаметра эквивалентного сферического объема (50% от размера частиц меньше заданного) вместе со стандартным отклонением величины распределения, вычисленной как указано выше. Было исследовано несколько физических свойств гидрохлорида ралоксифена. Они включают размер частицы, площадь поверхности и объемную плотность порошка. Основным показателем возможного влияния таких свойств на активность лекарственного продукта является растворимость лекарственного вещества в воде. Гидрохлорид ралоксифена имеет растворимость в воде приблизительно 0,3 мг/мл при 25 С и значительно более низкие величины растворимости в моделированной желудочной жидкости, USP (0,003 мг/мл) и в моделированной кишечной жидкости, USP (0,002 мг/мл) при 37 С. Величина для водной среды соответствует классификации USP очень слабо растворим, тогда как по последнему руководству SUPAC (Industry Guidance ImmediateEvaluation and Research et the FDA) по твердым пероральным лекарственным формам с немедленным высвобождением данное соединение имеет низкую растворимость с объемом растворимости дозы выше, чем 250 мл. При условии низкой растворимости скорость, с которой лекарственная форма растворяется в желудочнокишечном тракте, может потенциально влиять на скорость и степень абсорбции активного соединения. Двумя близкими физическими свойствами нерасфасованного (насыпного) лекарственного средства, которые могут изменить скорость растворения лекарственной формы, являются размер и площадь поверхности частиц. Влияние площади поверхности, которая является функцией размера частицы, иллюстрируется в приведенном ниже уравнении Noyes-Whitney.dC/dt = (D/h )(S)(Cs-C) Здесь С обозначает концентрацию лекарственного средства во время t, D обозначает коэффициент диффузии лекарственного средства в среде, h обозначает толщину диффузионного слоя, Cs обозначает растворимость при насыщении лекарственного средства в диффузионном слое, и S обозначает эффективную площадь поверхности частиц лекарственного сред ства. Для установления влияния сочетания размер/площадь поверхности частицы ралоксифен 8 НСl на растворение in vitro были получены партии с изменяемым распределением размера частиц путем перекристаллизации и далее модифицированы посредством различных технологий размалывания. В следующей таблице содержатся соответствующие данные по четырем партиям насыпного ралоксифен НСl, полученным в этом случае, она включает данные по размеру частиц, полученные с использованием дифракции лазерного излучения, и данные площади поверхности, собранные путем абсорбции азота и анализированные посредством уравнения BET(Brunauer, Emmet, Teller) Площ. Насыпная Технология размаПоверхн.,партиялывания м 2/г Тонко измельчен 1 ный в штифтовой 6,09 дробилке 2 (конт Перекристаллизо 2,28 рольная ванный партия) Измельченный на 3 2,10 шаровой мельнице Измельченный как 0,45 3 суспензия Эти четыре насыпные партии были вручную помещены в капсулы для получения 60,0 мг гидрохлорида ралоксифена и были представлены для испытания на растворение в 0,1% водном растворе полисорбата 80 с использованием аппарата II USP со скоростью вращения лопастей 50 об/мин. Для получения профиля растворения собирали данные через 10,20,30 и 45 мин. Таблица 7 Партия 1 (тонкоизмельПартия 2 (контрольная) ченная) Время (мин) % растворе- Время (мин) % растворерастворения ния растворения ния 10 51 10 41 20 68 20 60 30 78 30 68 45 88 45 74 Партия 3 (измельченная на Партия 4 (измельченная в шаровой мельнице суспензии) 10 31 10 15 20 45 20 27 30 54 30 35 45 64 45 49 Было отмечено, что диапазон профиля растворения был результатом различных распределений частиц насыпного лекарственного вещества по размеру с величинами растворения, колеблющимися от 25% до приблизительно 80% при времени 30 мин. Как попытку оценить эти различия при абсорбции in vivo, проводили исследование на крысах Fisher 344. В этом исследовании крысам дозированно вводили те же самые четыре партии насыпного ралоксифена в их кормах (0,4%, масс/масс) в течение семи дней. Концентрацию в плазме неконъюгированного ралоксифена количественно определяли ВЭЖХ для четырех насыпных партий и строили кривую зависимости концентрации от времени. Общая площадь под этой кривой (AUC, "areaunder the curve"), является количественной оценкой абсорбции ралоксифена in vivo. В следующей таблице показаны превосходные линейные корреляции, полученные между процентом гидрохлорида ралоксифена, растворенного в момент времени 10 мин или 30 мин в испытании на растворение in vitro, и средними величинами площади под кривой (нг-ч/мл), полученными на крысах для каждой из партии насыпного лекарственного средства. Партия 1 - микроизмельченная 2 - перекристаллизованная 3 - размоло тая на шаровой мельнице 4 - размолотая в суспензии Эта корреляция результатов in vitro с результатами in vivo подтверждает дискриминационную способность способа растворения, а также придание особого значения необходимости контроля либо распределения частиц по размеру, либо площади поверхности насыпного лекарственного вещества. Дальнейшая оценка этих данных указывает на то, что данные размера частиц лучше коррелируют с различиями,указанными в данных растворения и абсорбцииin vivo. Это можно объяснить на основании уравнения Noyes-Whitney, которое связывает растворение с эффективной площадью поверхности. Предполагается, что площадь поверхности, измеряемая абсорбцией азота, для различных типов размолотого ралоксифена, не предсказывает эффективную площадь поверхности,доступную для среды растворения. Это демонстрируется при сравнении перекристаллизованной (контрольной) партии (партия 2) и партии, размолотой на шаровой мельнице (партия 3). Хотя они имеют очень близкие величины площади поверхности, 2,28 и 2,10 м 2/, соответственно, перекристаллизованная партия имеет более низкий средний размер частиц, 8,4 микрон по сравнению с 23,3 микрон для партии,размолотой на шаровой мельнице. Микрофотография SEM частиц, размолотых на шаровой мельнице, показывают очень неровные поверхности с различными трещинами и разрывами,которые могут обуславливать повышенную площадь поверхности, измеряемую адсорбцией азота, но не могут обеспечить площадь поверхности, доступную среде растворения, что приводит к снижению эффективной площади поверхности. Эта аргументация может объяснить 10 лучшую корреляцию различий в размере частиц с различиями в растворении in vitro и абсорбцииin vivo no сравнению со сходством площадей поверхности для этих двух партий. На основании этих открытий было принято решение рассматривать распределение частиц по размеру в качестве контрольного параметра для обеспечения стойкой эффективности лекарственного продукта с точки зрения высвобождения лекарственного компонента. Для дальнейшего исследования влияния размера частиц гидрохлорида ралоксифена на эффективность лекарственного продукта, измеряемую растворением in vitro и абсорбцией invivo разовой дозы, было запланировано изучение зависимости концентрации ралоксифена в плазме от времени на обезьянах cynomolgus. Такое исследование сравнивало абсорбцию двух насыпных партий ралоксифена, которые имели средние размеры частиц 48,1 и 9,0 микрон. Партии формовали в виде гранулированных матриц,типичных для гранул, которые прессуют в таблетки. Кроме того, насыпную партию со средним размером частиц 9,0 получали посредством размалывания на штифтовой дробилке, которая является желательным устройством для измельчения. В приведенной ниже таблице суммированы данные по размерам частиц двух насыпных партий.насыпная Технология 10% партия/ пар- размалыва- менее тия грануляния чем ции мкм Партия 5 А В суспензии 11,4 Партия 5 В Штифтовая 3,2 дробилка 50% менее чем мкм 44,1 8,6 Таблица 9 90% Средменее ний чем размер мкм частиц 90 48,1 15,1 9,0 Для целей получения профиля растворения гранулы были вручную заполнены в капсулы для обеспечения эквивалента 60 мг гидрохлорида ралоксифена. Данные по растворению, полученные в 1% водном растворе твина при скорости вращающихся лопастей при 50 об/мин, указываются ниже. Таблица 10. Партия 5 А (размолотая в суспензии) Время (мин)% растворения 10 63 20 91 30 95 45 97 Эти различия в распределении частиц по размерам снова вызывают значительные различия в профиле растворения в 0,1% растворе по 11 лисорбата 80 в водной среде растворения. В этом исследовании обезьяны получали каждую готовую препаративную форму в соответствии со схемой перекрестного исследования и включением повторяющегося периода для учета изменчивости самого объекта испытаний. В следующей таблице 11 показаны средние концентрации в плазме общего ралоксифена после введения обезьянам пероральной дозы 25 мг/кг. Таблица 11. Партия 5 А (размолотая в суспензии) нг общего ралоксифеВремя (часы) на/мл плазмы 1,4 78 3,6 67 8,2 81 12,1 60 24,3 45 30 32 36,4 22 48,6 14 Партия 5 В (размолотая штифтовой дробилкой) Время (часы) нг всего ралоксифена/мл плазмы 1,4 108 3,6 84 8,2 121 12,1 95 24,3 70 30 51 36,4 34 48,6 23 Как видно из зависимости концентрации ралоксифена в плазме от профиля времени, приведенных в таблице 11, готовая препаративная форма насыпного лекарственного средства с меньшим размером частиц обеспечивает более высокие концентрации всего ралоксифена в плазме во всех из указанных моментах времени отбора образца. Повышенная абсорбция готовой препаративной формы с частицами меньшего размера отражается как в скорости, так и в степени абсорбции, как видно из следующих фармакокинетических параметров, полученных при исследовании. Номер партии Сmax (нг/мл) AUC (нг-ч/мл) 5 А (9,0 микрон) 131 3608 5 В (48,1 микрон) 96 2357 Было обнаружено, что эти различия значимы при статистическом анализе (AUC,р 0,005 Сmах, р 0,02). Эти данные представляют дальнейшее доказательство влияния критического характера распределения частиц по размеру на биологическую доступность. Это исследование подтверждает также дискриминирующую способность способа растворения invivo. На основании вышеприведенной работы и полученных данных физических свойств была установлена спецификация частиц по размеру. Изобретение предусматривает, что средний размер частиц, определяемый дифракцией лазерного излучения, должен быть менее 25 микрон. Кроме того, 90% по объему частиц должны иметь размер ниже 50 микрон, что учитывает характеристику распределения. Предпочтителен размер между около 5 и около 20 микрон и 90% частиц имеют размер менее чем приблизительно 35 микрон. Для подтверждения этого диапазона насыпные партии были получены размалыванием штифтовой дробилкой, и приемлемые крайние образцы были изготовлены в виде формованных таблеток и испытаны на растворение invitro. В одном исследовании были получены шесть партий гидрохлорида ралоксифена (приблизительно 1 кг) и из них формованием были изготовлены таблетки с 60 мг гидрохлорида ралоксифена, причем одна из них была использована в клиническом испытании фазы III. Данные по размерам частиц для использованных партий суммированы в следующей таблице 12. Таблица 12(все размеры частиц в микронах)партии 10% менее 50% менее 90% менее чем чем чем 6 2 6 12 7 3 8 21 8 3 11 31 9 3 12 30 10 2 5 10 11 3 9 23 Профили растворения в 0,1% водном полисорбате 80 для всех этих 6 насыпных партий,изготовленных в форме таблеток, сравнимы во всех случаях. Кроме того, все партии показали профиль относительно быстрого растворения, с величинами выше, чем 90% растворенного в момент времени 20 мин. Эти данные представлены в таблице 13. Таблица 13. % Растворенного - гидрохлорид ралоксифена из таблеток с сердцевиной Номер партии Время Чтобы статистически оценить растворение как функцию размера частиц, использовали программное обеспечение JMP Statistical andGraphics Guide Software (SAS Institute, Inc., Cary,North Carolina) и строили график, где процентное растворение в момент времени 20 мин откладывали как функцию среднего размера частиц каждой партии. Разброс, наблюдаемый на графике, вместе с высокой величиной р (0,81) подтверждают заключение о незначительном влиянии размера частиц на растворение в диапазоне этого предела размеров частиц. Подобные анализы проводили при других моментах времени, 10, 30 и 45 мин, с вычисленными значениями вероятностей 0,11, 0,76 и 0,40 соответственно. Высокие р вместе с наблюдением как отрицательных, так и положительных наклонов в различный момент времени снова подтверждают пригодность этого диапазона размера частиц. Другое подобное исследование проводили с 7 различными распределениями частиц по размеру частиц для насыпного лекарственного средства, причем каждый раз лекарственное средство изготавливали в форме таблеток по 60 мг. Данные по размерам частиц для этих партий суммированы в таблице 14. Партия 70 В 70 Е 70F 71 В 71D 71G 71 Н(все размеры частиц в микронах) 10% менее 50% менее 90% менее чем чем чем 3,3 14,5 39,3 2,8 10,5 26,3 3,4 16,0 50,2 3,1 12,9 38,9 2,8 10,1 25,6 3,3 14, 6 42,1 2,9 11,1 28,2 Данные по растворению в 0,1% водном полисорбате 80, собранные для этих семи партий, изготовленных в форме таблеток, приводятся в следующей таблице. Таблица 15. % Растворенного - гидрохлорид ралоксифена Номер партии Время Как и в случае предыдущей серии распределений частиц по размеру сравниваемые профили растворения, полученные с этими распределениями, подтверждают диапазоны величин размеров, заявленные в этом изобретении. При наличии связи между растворением in vitro и абсорбцией in vivo следует, что диапазон распределения частиц по размеру, заявленный в настоящем изобретении должен обеспечивать согласующиеся характеристики абсорбция invivo/биологическая доступность. Помимо роли размера частицы в растворении in vitro и абсорбции in vivo, другим важным аспектом является его влияние на различные типовые операции технологического производства лекарственного продукта. Хотя размер частиц обеспечивает стойкую доставку молекулы лекарственного средства в места абсорбции в желудочно-кишечном тракте, он допускает также и лучший контроль на стадии мокрой грану 14 ляции при производстве таблеток. Кривую расхода энергии снижают путем регулирования размера частиц, количества воды, необходимой для достижения подходящего режима грануляции. Благодаря поддержанию размера частиц в пределах ранее указанных ограничений, установленные количества воды можно указать на производственном ярлыке для рутинного изготовления. Стадия грануляции является общей в производстве таблеток и капсул, ее проводят путем добавления воды для достижения желаемой конечной точки грануляции. Следующей по ходу типовой операцией в зависимости от конечной точки грануляции, является измельчение высушенных гранул и получение распределения частиц по размеру после грануляции. Было обнаружено, что размер поступающей частицы активного ингредиента также влияет на конечное распределение размеров частиц сухих размолотых агломератов, образованных во время гранулирования. Для фиксированного количества воды более грубое распределение будет приводить к распределению более мелких частиц сухих размолотых агломератов. Распределение с гранулами слишком малого размера может привести к слабому протеканию процесса гранулирования и плохому регулированию массы отдельной таблетки во время стадии прессования. Таким образом, узкие ограничения размеров частиц, упомянутые ранее, привели также к тому, что этот способ более поддается автоматизации путем уменьшения количества воды, требуемой в стадии гранулирования, и образованию сухих размолотых гранул с подходящим распределением частиц по размеру для предотвращения от браковки таблеток во время прессования из-за неприемлемой их массы. Настоящее изобретение предлагает также методы использования соединений формулы I для ингибирования различных заболеваний. Они включают ингибирование остеопороза, лечение или профилактику рака молочной железы,ингибирование фиброза матки, ингибирование эндометриоза и снижения содержания холестерина в сыворотке крови. Используемый здесь термин эффективное количество означает количество соединения формулы I, которое способно облегчить симптомы различных описанных здесь патологических состояний. Конкретная доза соединения,введенного по этому изобретению, будет, конечно, определяться конкретными обстоятельствами, включая, например, вводимое соединение, путь введения, состояние пациента и патологическое состояние, которое лечат. Типичная суточная доза будет содержать нетоксичный уровень дозы от около 10,0 мг до около 1000 мг/сут. соединения настоящего изобретения. Предпочтительные суточные дозы обычно будут от около 50 мг до около 150 мг/сут. Кроме гидрохлоридной соли соединения этого изобретения образуют фармацевтически 15 приемлемые кислотно- и основно-аддитивные соли с широким рядом органических и неорганических кислот и оснований и включают физиологически приемлемые соли, которые часто используют в фармацевтической химии. Такие соли также являются частью этого изобретения. Типичные неорганические кислоты, используемые для образования таких солей, включают бромисто-водородную,иодисто-водородную,азотную, серную, фосфорную, гипофосфорную кислоту и тому подобное. Можно также использовать соли, полученные из органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые и гидроксиалкандиовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты. Такие фармацевтически приемлемые соли, таким образом, включают ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, оацетоксибензоат, нафталин-2-бензоат, бромид,изобутират, фенилбутират, -гидроксибутират,бутин-1,4-диоат, гексин-1,4-диоат, капрат, каприлат, хлорид, циннамат, цитрат, формиат,фумарат, гликолят, гептеноат, гиппурат, лактат,малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат,оксалат, фталат, терефталат, фосфат, моногидрогенфосфат (вторичный кислый фосфат), дигидрогенфосфат (первичный кислый фосфат),метафосфат, пирофосфат, пропиолат, пропионат, фенилпропионат, салицилат, себацат, сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, п-бромфенилсульфонат, хлорбензолсульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, п-толуолсульфонат, ксилолсульфонат, тартрат и тому подобное. Конечно, предпочтительной солью является гидрохлоридная соль. Фармацевтически приемлемые кислотоаддитивные соли типично получают реакцией соединения формулы I с эквимолярным или избыточным количеством кислоты. Соединения этого изобретения можно вводить различными путями, включая пероральный, ректальный, чрескожный, подкожный,внутривенный, внутримышечный и интраназальный. Эти соединения до введения предпочтительно изготовляют в виде препаративной формы, выбор которой будет сделан штатным врачом больницы. Таким образом, другим аспектом настоящего изобретения является фармацевтическая композиция, содержащая эффективное количество соединения формулы I или его фармацевтически приемлемой соли, необязательно содержащая эффективное количество эстрогена или прогестина, и фармацевтически 16 приемлемый носитель, разбавитель или наполнитель. В таких готовых препаративных формах общее содержание активных ингредиентов составляет от 0,1% до 99,9 вес.%. от всей готовой препаративной формы. Термин фармацевтически приемлемый означает, что носитель, разбавитель, наполнители и соль должны быть совместимы с другими ингредиентами готовой препаративной формы и не вредны для их реципиента. Фармацевтические готовые препаративные формы настоящего изобретения можно получить методами, известными в данной области, с использованием хорошо известных и легко доступных ингредиентов. Например, соединения формулы I, с эстрогеновым или прогестиновым соединением или без него, можно изготовить с обычными наполнителями, разбавителями или носителями и формовать в таблетки, капсулы,суспензии, порошки и тому подобное. Примеры наполнителей, разбавителей и носителей, которые пригодны для таких готовых препаративных форм, включают следующие компоненты: наполнители и разбавители, такие как крахмал,сахара, маннит и кремниевые производные; связующие вещества, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажняющие агенты, такие как глицерин; дезинтегрирующие агенты, такие как карбонат кальция, бикарбонат натрия и сшитый повидон(кросс-повидон); агенты для замедления растворения, такие как парафин; ускорители резорбции, такие как четвертичные аммониевые соединения; поверхностно-активные вещества такие как цетиловый спирт, полисорбат 80, моностеарат глицерина; адсорбционные носители,такие как каолин и бентонит; и смазывающие вещества, такие как тальк, стеарат кальция и магния и твердые полиэтилгликоли. Эти соединения можно также изготовить в виде эликсиров или растворов для пригодного перорального введения, или в виде растворов,подходящих для парентерального введения,внутримышечными, подкожными или внутривенными путями. Дополнительно, эти соединения хорошо пригодны для получения готовой препаративной формы в виде лекарственных форм пролонгированного действия (с длительным высвобождением соединения) и тому подобное. Готовые препаративные формы можно составить таким образом, чтобы они высвобождали только активный ингредиент или предпочтительно в определенной физиологической точке, возможно на протяжении некоторого периода времени. Покрытия, оболочки и защитные матрицы могут быть выполнены, например, из полимерных веществ или восков. Соединения формулы I, отдельно или в комбинации с другим фармацевтическим сред 17 ством, вводят в подходящей препаративной форме. Следующие примеры препаративных форм носят только иллюстративный характер и не ограничивают объем настоящего изобретения. Готовые препаративные формы В следующих готовых препаративных формах ралоксифенНСl имеет размер частиц,заявленный в изобретении. Готовая препаративная форма 1. Желатиновые капсулы. Твердые желатиновые капсулы получают с использованием следующих ингредиентов: Ингредиент Количество(мг/капсула) Ралоксифен НСl 10,0-1000 Крахмал, NF 0-650 Сыпучий порошок крахмала 0-650 Силиконовая жидкость,вязкость 350 сантистокс 0-15 Вышеуказанную готовую препаративную форму можно изменить в соответствии с предусмотренными приемлемыми изменениями. Таблетированную готовую препаративную форму получают с использованием указанных ниже ингредиентов. Готовая препаративная форма 2. Таблетки. Ингредиент Количество(мг/таблетка) 2,5-1000 Ралоксифен НСl Целлюлоза, микрокри 200-650 сталлическая Диоксид кремния, коллоидальный 10-650 Стеариновая кислота 5-15 Компоненты смешивают и прессуют для образования таблеток. Альтернативно, таблетки, каждая из которых содержит 2,5-1000 мг ралоксифена, получают следующим образом: Готовая препаративная форма 3. Таблетки. Ингредиент Количество(мг/таблетка) Ралоксифен НСl 25-1000 Крахмал 45 Целлюлоза, микрокристаллическая 35 Поливинилпирролидон (в виде 10% раствора в воде) 4 Натриевая соль карбоксилметилцеллюлозы 4,5 Стеарат магния 0,5 Тальк 1 Ралоксифен, крахмал и целлюлозу пропускают через сито 45 меш по шкале США и тщательно перемешивают. Раствор поливинилпирролидона смешивают с полученными порошками, которые затем пропускают через сито 14 18 меш США. Таким образом полученные гранулы сушат при 50-60 и пропускают через сито 18 меш США. Натриевую соль карбоксиметилкрахмала, стеарат магния и тальк, предварительно пропущенные через сито 60 США,затем добавляют к гранулам, которые после смешивания прессуют на таблеточной машине,получая таблетки. Суспензии, каждая из которых содержит 0,1-1000 мг лекарственного средства на 5 мл дозу, получают следующим образом. Готовая препаративная форма 4. Суспензии. Ингредиент Количество(мг/5 мл) Ралоксифен НСl 0,1-1000 мг Натриевая соль карбоксиметилцеллюлозы 50 мг Сироп 1,25 мг Раствор бензойной кислоты 0,10 мл Отдушка Сколько угодно Краситель Сколько угодно Очищенная вода До 5 мл Лекарственное средство пропускают через сито 45 меш США и смешивают с натриевой солью карбоксиметилцеллюлозы и сиропом для образования гладкой пасты. Раствор бензойной кислоты, отдушку и краситель разбавляют некоторым количеством воды и добавляют при перемешивании. Затем добавляют достаточное количество воды для достижения требуемого объема. Получают аэрозольный раствор, содержащий следующие ингредиенты. Готовая препаративная форма 5. Аэрозоль. Ингредиент Количество(% по массе) 0,25 Ралоксифен НСl 25,75 Этанол Пропеллант 22 (хлордифторметан) 70,00 Ралоксифен смешивают с этанолом и смесь добавляют к части пропеллeнта 22, охлаждают до 30 С и переносят в наполняющее устройство. Требуемое количество затем подают в контейнер из нержавеющей стали и разбавляют оставшимся количеством пропеллeнта. Контейнер затем снабжают клапанным устройством. Суппозитории получают следующим образом. Готовая препаративная форма 6. Суппозитории. Ингредиент Количество(мг/суппозиторий) 250 Ралоксифен НСl Глицериды насыщенных жирных кислот 2000 Ралоксифен пропускают через сито 60 меш США и суспен-дируют в глицеридах насыщенных жирных кислот, предварительно расплав 19 ленных с использованием минимально необходимого тепла. Смесь затем выливают в форму для суппозитория с номинальной вместимостью 2 г и дают охладиться. Внутривенную готовую препаративную форму получают следующим образом: Готовая препаративная форма 7. Внутривенный раствор. Ингредиент Количество Ралоксифен НСl 50 мг Изотонический солевой раствор 1000 мл Раствор ралоксифена вводят внутривенно пациенту со скоростью около 1 мл в минуту. Готовая препаративная форма 8. Комбинированная капсула I. Ингредиент КоличествоCab-0-Sil 0,25 Готовая препаративная форма 9. Комбинированная капсула II. Ралоксифен НСl 50 Норэтилнодрел 5 Авицел рН 101 82,50 Крахмал 1500 90 Силиконовое масло 2 Твин 80 0,50 Готовая препаративная форма 10. Таблетка. ИнгредиентCab-0-Sil 0,50 Готовая препаративная форма 11. Ингредиент Количество (мг 20 Смесь ралоксифен НСl, лактозы и части сшитого поливинилпирролидона гранулируют с водным раствором поливинилпирролидона и полисорбата 80. Гранулы сушат, измельчают до подходящего размера и смешивают со стеариновой кислотой, стеаратом магния и оставшимся количеством сшитого поливинилпирролидона. Смесь прессуют в отдельные таблетки. Готовая препаративная форма 12. Ингредиент Количество(мг/капсула) Ралоксифен НСl 60-150 Поливинилпирролидон 15,75 Полисорбат 80 5,75 Безводная лактоза 132,06 Декстроза 132,06 Сшитый поливинилпирролидон 31,5 Стеариновая кислота 5,25 Стеарат магния 2,63 Смесь ралоксифен НСl, безводной лактозы, декстрозы и части сшитого поливинилпирролидона гранулируют со спиртовым раствором поливинилпирролидона и полисорбата 80. Гранулы сушат, измельчают до подходящего размера и смешивают со стеаратом магния, стеариновой кислотой и оставшимся количеством сшитого поливинилпирролидона. Смесь прессуют в отдельные таблетки. Готовая препаративная форма 13. Ингредиент Количество(мг/капсула) 60-150 Ралоксифен НСl 16,00 Гидроксипропилцеллюлоза 10,00 Лаурилсульфат натрия 154,00 Декстроза Сшитая натриевая соль карбоксиметилцеллюлозы 16,00 Стеарат магния 4,00 Смесь ралоксифен НСl, декстрозы и сшитой натриевой соли карбоксиметилцеллюлозы гранулируют с водным раствором гидроксипропилцеллюлозы и лаурилсульфатом натрия. Гранулы сушат, измельчают до подходящего размера и смешивают со стеаратом магния. Смесь прессуют в отдельные таблетки. Готовая препаративная форма 14. Ингредиент Количество(мг/капсула) Ралоксифен НСl 30,00 Безводная лактоза 144,00 Водная лактоза, высушенная Распылением 36,00 Поливинилпирролидон 12,00 Полисорбат 80 2,40 Сшитый поливинилпирролидон 14,40 Стеарат магния 1,20 Смесь ралоксифен НСl, безводной лактозы, высушенной распылением водной лактозы и 21 часть сшитого поливинилпирролидона гранулируют со спиртовым раствором поливинилпирролидона и полисорбата 80. Гранулы сушат,измельчают до подходящего размера и смешивают со стеаратом магния и оставшимся количеством сшитого поливинилпирролидона. Смесь прессуют в отдельные таблетки, получая таблетку с массой 240 мг. Готовая препаративная форма 15. Ингредиент Количество(мг/капсула) Ралоксифен НСl 30,00 Безводная лактоза 160,00 Гидроксипропилцеллюлоза 11,00 Полоксамер 7,00 Сшитая натриевая соль карбоксиметилцеллюлозы 23,00 Стеариновая кислота 2,00 Стеарат магния 4,00 Смесь ралоксифен НСl, безводной лактозы и сшитой натриевой соли карбоксиметилцеллюлозы гранулируют с водным раствором полоксамера и гидроксипропилцеллюлозы. Гранулы сушат, измельчают до подходящего размера и смешивают со стеариновой кислотой и стеаратом магния. Смесь затем прессуют в отдельные таблетки, получая таблетку с массой 240 мг. Готовая препаративная форма 16. Ингредиент Количество(мг/капсула) Ралоксифен НСl 30,00 Лактоза 89,00 Декстроза 89,00 Гидроксипропилметилцеллю 10,00 лоза Лаурилсульфат натрия 5,00 Сшитый натрийполивинилпир 12,00 ролидон Стеариновая кислота 5,00 Смесь ралоксифен НСl, лактозы, декстрозы и сшитого поливинилпирролидона гранулируют с водным раствором гидроксипропилметилцеллюлозы и лаурилсульфата натрия. Гранулы сушат, измельчают до подходящего размера и смешивают со стеариновой кислотой. Смесь затем прессуют в отдельные таблетки, получая таблетку с массой 240 мг. Готовая препаративная форма 17. Ингредиент Количество 22 с водным раствором поливинилпирролидона и полисорбата 80. Гранулы сушат, измельчают до подходящего размера и смешивают со стеаратом магния. Смесь затем прессуют в отдельные таблетки, получая таблетку с массой 240 мг. Готовая препаративная форма 18. Ингредиент Количество(мг/капсула) 60,00 Ралоксифен НСl 120,00 Лактоза безводная Лактоза водная, высушенная 30,00 распылением Поливинилпирролидон 12,00 Полисорбат 80 2,40 Сшитый натрийполивинилпирролидон 14,40 Стеарат магния 1,20 Смесь ралоксифен НСl, лактозы безводной, высушенной распылением водной лактозы и часть сшитого поливинилпирролидона гранулируют с водным раствором поливинилпирролидона и полисорбата 80. Гранулы сушат, измельчают до подходящего размера и смешивают со стеаратом магния и оставшимся количеством сшитого поливинилпирролидона. Смесь затем прессуют в отдельные таблетки, получая таблетку с массой 240 мг. Готовая препаративная форма 19. Ингредиент Количество(мг/капсула) Ралоксифен НСl 60,00 Маннит 77,00 Декстроза 73,00 Гидроксипропилметилцеллюлоза 7,00 Полисорбат 80 4,00 Натриевая соль гликолята Крахмала 14,00 Стеариновая кислота 4,00 Стеарат магния 1,00 Смесь ралоксифен НСl, маннита, декстрозы и натриевой соли гликолята крахмала гранулируют с водным раствором полисорбата 80 и гидроксипропилметилцеллюлозы. Гранулы сушат, измельчают до подходящего размера и смешивают со стеариновой кислотой и стеаратом магния. Смесь затем прессуют в отдельные таблетки, получая таблетку с массой 240 мг. Ингредиент Количество 23 Смесь ралоксифен НСl, безводной лактозы, водной, высушенной распылением лактозы и части сшитого поливинилпирролидона гранулируют с водным раствором поливинилпирролидона и полисорбата 80. Гранулы сушат, измельчают до подходящего размера и смешивают со стеаратом магния и оставшимся количеством сшитого поливинилпирролидона. Смесь затем прессуют в отдельные таблетки, получая таблетку с массой 230 мг. Готовая препаративная форма 21. Ингредиент Количество(мг/капсула) Ралоксифен НСl 150,00 Лактоза, водная, высушенная распылением 56,00 Поливинилпирролидон 7,00 Полисорбат 80 1,20 Сшитый натрийполивинилпирролидон 13,80 Стеарат магния 2,00 Смесь ралоксифен НСl, водной, высушенной распылением лактозы и части сшитого поливинилпирролидона гранулируют с водным раствором поливинилпирролидона и полисорбата 80. Гранулы сушат, измельчают до подходящего размера и смешивают со стеаратом магния и оставшейся частью сшитого поливинилпирролидона. Смесь затем прессуют в отдельные таблетки, получая таблетку с массой 230 мг. Готовая препаративная форма 22. Ингредиент Количество(мг/капсула) Ралоксифен НСl 150,00 Лактоза, безводная 52,40 Поливинилпирролидон 11,50 Полисорбат 80 4,60 Полиэтиленгликоль 8000 11,50 Смесь ралоксифен HCl и безводной лактозы гранулируют с водным раствором полисорбата 80 и поливинилпирролидона. Гранулы сушат, измельчают до подходящего размера и смешивают с полиэтиленгликолем 8000. Смесь затем прессуют в отдельные таблетки, получая таблетку с массой 230 мг. Капсулы можно получить с использованием ингредиентов и методик, как описано ниже. Готовая препаративная форма 23. Ингредиент Количество(мг/капсула) Ралоксифен HCl 30,00 Лактоза водная, высушенная распылением 178,30 Лаурилсульфат натрия 4,60 Сшитый поливинилпирролидон 9,20 Гидроксипропилметилцеллюлоза 6,90 Коллоидальный диоксид кремния 1,00 Смесь ралоксифен HCl, водной, высушенной распылением лактозы и сшитого поливи 001257 24 нилпирролидона гранулируют с водным раствором лаурилсульфата натрия и гидроксипропилметилцеллюлозы. Гранулы сушат, измельчают до подходящего размера и смешивают с коллоидальным диоксидом кремния. Эту смесь затем заполняют в желатиновые капсулы с твердой оболочкой размера 3 с использованием общепринятого капсулирующего оборудования,причем каждая капсула содержит 230 мг конечной смеси. Готовая препаративная форма 24. Ингредиент Количество(мг/капсула) Ралоксифен НСl 60,00 Лактоза водная, высушенная Распылением 148,30 Лаурилсульфат натрия 4,60 Сшитый поливинилпирролидон 9,20 Гидроксипропилметилцеллюлоза 6,90 Коллоидальный диоксид кремния 1,00 Смесь ралоксифен НСl, водной, высушенной распылением лактозы и сшитого поливинилпирролидона гранулируют с водным раствором лаурилсульфата натрия и гидроксипропилметилцеллюлозы. Гранулы сушат, измельчают до подходящего размера и смешивают с коллоидальным диоксидом кремния. Эту смесь затем заполняют в желатиновые капсулы с твердой оболочкой размера 3 с использованием общепринятого капсулирующего оборудования,причем каждая капсула содержит 230 мг конечной смеси. Готовая препаративная форма 25. Ингредиент Количество(мг/капсула) Ралоксифен НСl 150,00 Лактоза водная, высушенная 58,30 Распылением Лаурилсульфат натрия 4,60 Сшитый поливинилпирролидон 9,20 Гидроксипропилметилцеллюлоза 6,90 Коллоидальный диоксид кремния 1,00 Смесь гидрохлорида ралоксифена, водной,высушенной распылением лактозы и сшитого поливинилпирролидона гранулируют с водным раствором лаурилсульфата натрия и гидроксипропилметилцеллюлозы. Гранулы сушат, измельчают до подходящего размера и смешивают с коллоидальным диоксидом кремния. Смесь затем заполняют в желатиновые капсулы с твердой оболочкой размера 3 с использованием общепринятого капсулирующего оборудования,причем каждая капсула содержит 230 мг конечной смеси. и его фармацевтически приемлемые соли и сольваты, характеризующееся тем, что оно находится в форме частиц, причем эти частицы имеют средний размер менее 25 микрон. 2. Соединение по п.1, где указанные частицы имеют средний размер в диапазоне примерно от 5 до 20 микрон. 3. Соединение по п.1 или 2, где, по меньшей мере, 90% указанных частиц имеют размер менее чем 50 микрон. 4. Соединение по п.3, где, по меньшей мере, 90% указанных частиц имеют размер менее 35 микрон. 5. Соединение по любому из пп. с 1 по 4,где соединение формулы I представляет собой гидрохлорид ралоксифена. 6. Соединение по п.5, которое представляет собой несольватированный кристаллический гидрохлорид, имеющий, по существу, следующую рентгенограмму, полученную с помощью Сu-излучения: Расстояние между d-линиями 3,9673 22,53 3,9318 100,00 3,8775 9,07 3,7096 33,38 3,6561 21,65 3,5576 3,36 3,5037 7,97 3,4522 18,02 3,4138 4,65 3,2738 10,23 3,1857 8,90 3,1333 6,24 3,0831 9,43 3,0025 12,13 2,9437 4,96 2,8642 7,70 2,7904 11,95 2,7246 3,05 2,6652 3,32 2,5882 7,30 7. Фармацевтическая композиция, включающая или полученная с использованием соединения по любому из пп.1-6 и одного или нескольких фармацевтически приемлемых носителей, разбавителей или наполнителей. 8. Способ повышения биологической доступности при лечении остеопороза ралоксифеном, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы I по любому из пп.1-6 или фармацевтической композиции по п.7. 9. Способ повышения биологической доступности при снижении уровня липидов в сыворотке крови с помощью ралоксифена, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы I по любому из пп.1-6 или фармацевтической композиции по п.7. 10. Способ повышения биологической доступности при профилактике рака молочной железы с помощью ралоксифена, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы I по любому из пп.1-6 или фармацевтической композиции по п.7. 11. Изделие, включающее упаковочный материал, содержащий фармацевтическую композицию, причем этот упаковочный материал дополнительно имеет этикетку, указывающую на то, что эту композицию можно использовать для ингибирования патологии у человека, а фармацевтическая композиция включает или получена с использованием соединения по любому из пп.1-6.
МПК / Метки
МПК: A61K 31/381, C07D 333/56
Метки: фармацевтические, композиции, содержащие, состояний, использованием, способы, бензотиофены, патологических, лечения
Код ссылки
<a href="https://eas.patents.su/14-1257-benzotiofeny-soderzhashhie-ih-farmacevticheskie-kompozicii-i-sposoby-lecheniya-patologicheskih-sostoyanijj-s-ih-ispolzovaniem.html" rel="bookmark" title="База патентов Евразийского Союза">Бензотиофены, содержащие их фармацевтические композиции и способы лечения патологических состояний с их использованием</a>
Предыдущий патент: Устройство для потока текучей среды
Следующий патент: Регулятор напряжения генератора
Случайный патент: Способ получения производных камптотецина.












