Применение производных 7-(2-окса-5,8-диазабицикло[4,3,0]- нон-8-ил)-хинолонкарбоновой кислоты и -нафтиридонкарбоновой кислоты для лечения инфекций, вызванных helicobacter pylori, и связанных с ними гастродуоденальных заболеваний
Номер патента: 2477
Опубликовано: 27.06.2002
Авторы: Баазнер Бернд, Шаллер Клаус, Йетш Томас, Шенке Томас, Лабишински Харальд, Бартель Штефан, Петерсен Уве, Верлинг Ханс-Отто, Матцке Михаэль, Химмлер Томас
Формула / Реферат
1. Применение композиции, содержащей в качестве действующего вещества производные хинолинкарбоновой кислоты общей формулы (I)
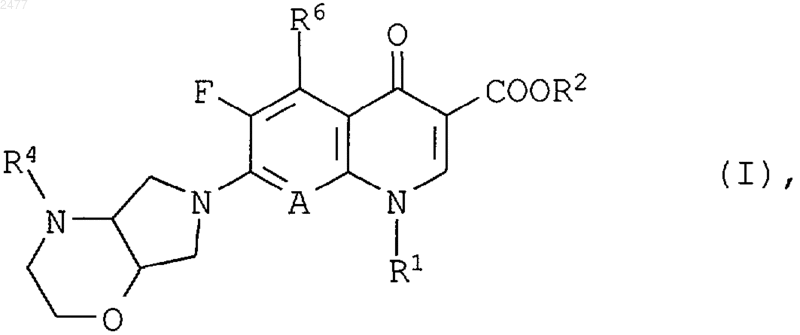
в которой
R1 означает алкил с числом атомов углерода от 1 до 4, при необходимости замещенный однократно или двухкратно галогеном, фенил, при необходимости замещенный одним или двумя атомами фтора, или циклопропил, при необходимости замещенный одним или двумя атомами фтора,
R2 означает водород, алкил с числом атомов углерода от 1 до 4, при необходимости замещенный гидрокси-, метокси-, амино-, метиламино- или диметиламиногруппой, или означает (5-метил-2-оксо-1,3-диоксол-4-ил)метил,
А означает N или C-R3, причем
R3 означает водород, галоген, метил, метокси-, дифторметокси- или цианогруппу или вместе с R1 образует мостик структуры -*O-СН2-СН-СН3 или -*О-СН2-N-СН3, причем атом, помеченный значком *, связан с атомом углерода А,
R4 означает водород, бензил, (С1-С3)алкил, (5-метил-2-оксо-1,3-диоксол-4-ил)метил, радикалы со структурой -CH=CH-COOR5, -CH2CH2COOR5, -CH2CH2CN, -СН2СН2СОСН3, -CH2СОСН3, в которых
R5 означает метил или этил,
R6 означает водород, амино-, гидроксигруппу, метил или галоген в форме рацематов, смеси диастереомеров или в виде чистого энантиомера или диастереомера или их фармацевтически применимого гидрата и/или соли в эффективном количестве в качестве средства для лечения Helicobacter pylori-инфекций и связанных с ними гастродуоденальных заболеваний.
2. Применение фармацевтической композиции по п.1, содержащей в качестве действующего вещества соединение формулы (I), в которой
R1 означает трет-бутил, при необходимости замещенный однократно или двухкратно фтором, или циклопропил, при необходимости замещенный одним атомом фтора,
R2 означает водород, алкил с числом атомов углерода от 1 до 4 или означает (5-метил-2-оксо-1,3-диоксол-4-ил)метил,
А означает C-R3, причем R3 означает водород, фтор, метокси-, дифторметокси- или цианогруппу или вместе с R1 образует мостик структуры -*O-СН2-СН-СН3 или -*O-СН2-N-СН3, причем атом, помеченный значком *, связан с атомом углерода А,
R4 означает водород, (С1-С3)алкил, радикалы со структурой -СН2СН2СООR5, -CH2CH2CN, -CH2СОСН3, в которых
R5 означает метил или этил,
R6 означает водород, аминогруппу или метил,
или его фармацевтически применимый гидрат и/или соль.
3. Применение фармацевтической композиции по п.1, содержащей в качестве действующего вещества соединение формулы (I), в которой
R1 означает трет-бутил, при необходимости замещенный однократно или двухкратно фтором, или циклопропил,
R2 означает водород, метил или этил,
А означает C-R3, причем
R3 означает водород, метокси-, дифторметокси- или цианогруппу или вместе с R1 образует мостик структуры -*O-СН2-СН-СН3 или -*O-СН2-N-СН3, причем атом, помеченный значком *, связан с атомом углерода А,
R4 означает водород или метил,
или его фармацевтически применимый гидрат и/или соль.
4. Применение фармацевтической композиции по пп.1-3, содержащей в качестве действующего вещества диастереомерно чистое и энантиомерно чистое соединение формулы (I).
5. Применение фармацевтической композиции по п.1, содержащей в качестве действующего вещества 8-циано-1-циклопропил-6-фтор-7-((1S,6S)-2-окса-5,8-диазабицикло[4,3,0]нон-8-ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты или ее фармацевтически применимый гидрат и/или соль.
6. Применение фармацевтической композиции по п.1, содержащей в качестве действующего вещества диастереомерно чистое и энантиомерно чистое соединение формулы (I) из группы, состоящей из 8-циано-1-циклопропил-6-фтор-7-(2-окса-5,8-диазабицикло-[4,3,0]нон-8-ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 1-циклопропил-8-дифторметокси-6-фтор-1,4-дигидро-7-(2-окса-5,8-диазабицикло [4,3,0]нон-8-ил)-4-оксо-3-хинолинкарбоновой кислоты и их фармацевтически применимых гидратов и/или солей.
7. Применение фармацевтической композиции по п.6, содержащей в качестве действующего вещества 8-циано-1-циклопропил-6-фтор-7-((1S,6S)-2-окса-5,8-диазабицикло[4,3,0]-нон-8-ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту или ее фармацевтически применимый гидрат и/или соль.
8. Производные хинолинкарбоновой кислоты общей формулы (II)
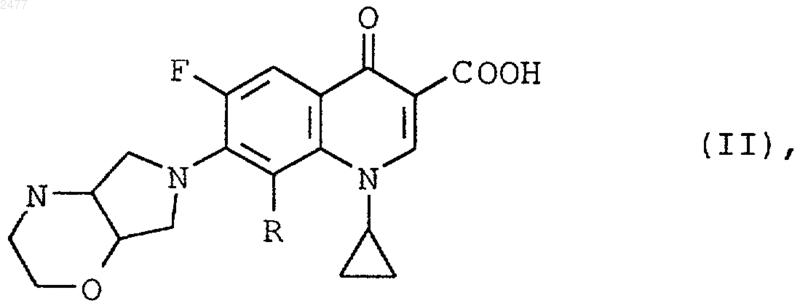
в которой R означает циано- или дифторметоксигруппу,
их диастереомеры, энантиомеры и фармацевтически применимые гидраты и соли.
9. Производное хинолинкарбоновой кислоты формулы (II), согласно п.8, отличающееся тем, что оно представляет собой 8-циано-1-циклопропил-6-фтор-7-((1S,6S)-2-окса-5,8-диазабицикло[4,3,0]нон-8-ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту и ее фармацевтически применимые гидраты и/или соли.
Текст
1 Изобретение относится к применению производных хинолон- и нафтиридонкарбоновой кислот, которые замещены в 7-положении радикалом 2-окса-5,8-диазабицикло-[4,3,0]-нон 8-ил, а также их солей для лечения Helicobacterpylori-инфекций и связанных с ними гастродуоденальных заболеваний. В результате открытия заново Helicobacterpylori (H. Pylori, ранее Campylobacter pylori) Уорреном и Маршаллом в 1983 году в последующие годы удалось дальше основательно продвинуть патофизиологические представления о возникновении гастродуоденальных заболеваний человека.H. pylori считается возбудителем гастрита типа Б и кажется играет определяющую роль в непрерывности пептической язвенной болезни. Эпидемиологические и патологические исследования также показывают связь между длительной колонизацией слизистой оболочки желудка этими бактериями и возникновением определенных форм рака желудка. Поэтому H.pylori в 1994 г. отнесен к канцерогенам первого класса (опаснейшая категория возбудителей рака). Очень редкий вид рака желудка, MALTлимфома(mucosa-associated lymphoid tissue), повидимому, вызван этим же инфекционным началом. В первых исследованиях, действительно,после полного уничтожения H. pylori исчезли не только реактивные инфильтраты, но также и небольшие MALT-липомы. Обсуждается также взаимосвязь с грубо складчатым гастритом. Роль H. pylori при раздраженом желудке (неязвенной диспепсии) пока не ясна. Различные эпидемиологические исследования привели к выводу, что половина населения земного шара инфицирована этими бактериями. Вероятность заселения желудка бактериями Helicobacter возрастает с возрастом. Оптимальное приспособление бактерий Helicobacter к условиям жизни исключительно, мало конкурентное заселение желудка кажется является предварительным условием для развития хронической инфекции и для широкого распространения этого патогенного вида бактерий. Возбудители со своими жгутиками очень подвижны не только в жидкой среде, но и в вязкой среде слизистой оболочки желудка, адгезируют на клетках желудочного эпителия и лучше всего размножаются при содержании кислорода 5 %, такие условия господствуют в слизи стенки желудка. Кроме того, бактерии вырабатывают большое количество энзима уреазы, который расщепляет мочевину на аммиак и двуокись углерода. Возможно, что образующееся "аммиачное облако" помогает им нейтрализовать кислую среду в микроокружении и таким образом защититься от агрессивной кислоты желудочного сока. Пептическое язвенное заболевание Обнаружение в 70 х годах антагонистов гистамин-Н 2-рецепторов сыграло выдающуюся 2 роль в лечении пептических язвенных заболеваний. Частота хирургических вмешательств при лечении язвенных страданий в мире существенно упала. Этот прием кислотной блокады был еще более улучшен в результате создания ингибиторов удаления протонов. С помощью кислотнотормозящей терапии можно повлиять во всяком случае только на симптомы язвенного заболевания, которое характеризуется наступлением рецидивов, поэтому речь должна идти о лечении с уничтожением инфекционного начала. Так как практически все пациенты с язвой двенадцатиперстной кишки и подавляющая часть пациентов с язвой желудка обнаруживают Н. pylori инфекцию желудка, все они, таким образом, страдают инфекционным заболеванием. Только язвенные заболевания,которые вызваны нестероидальными противовоспалительными средствами, не связаны с Н.pylori инфекцией. Поэтому по рекомендации согласительной конференции, которая была проведена в 1994 году американской организацией здравоохранения (NIH), предложено при положительном результате анализа на наличие инфекционного начала все пациенты с пептическими язвами должны пройти курс терапии по уничтожению инфекции, направленной против Н. pylori (NIHConsensus Statement 1:1-23; 1994). Аргументы для этого получены при контрольных терапевтических исследованиях, в которых было показано, что после успешного уничтожения инфекционного начала рецидивы язвы резко снизились (0-29% по сравнению с 61-95%). Н. pylori -терапия В современных условиях уничтожение инфекции Н. pylori трудно осуществимо на практике. Не существует простой и в то же время надежно действующей терапии. Инфекционное начало надежно защищено и к нему трудно подобраться через слой слизи. Н. pylori чувствителен in vitro ко многим антибиотикам. Однако эти антибиотики при монотерапии in vivo не эффективны. Сюда относятся среди других пенициллин, амоксициллин, тетрациклин, эритромицин, ципрофлоксацин, метронидазол и кларитромицин. И висмутовые соли и, в меньшей мере, даже ингибиторы удаления протонов (омепразол, ланзопразол) действуют антибактериально in vitro, но не invivo. Среди всех модификаций терапии, применяемых до настоящего времени для уничтожения инфекции Н. pylori, достаточно действенными оказались только следующие тройные терапии: 1) классическая висмутовая тройная терапия (соль висмута плюс два антибиотика) и 2) модифицированная тройная терапия(кислотный ингибитор плюс два антибиотика). Однако эти режимы обстоятельных способов уничтожения инфекции имеют плохое по 3 следействие и до 35% из них сопровождаются побочными явлениями (боли в животе, тошнота,понос, сухость во рту, расстройство вкуса и аллергические реакции на коже). Поэтому их широкое применение затруднено. Другим существенным недостатком является большое число принимаемых ежедневно лекарств (12-16 таблеток в день). Этот недостаток особенно отчетливо проявляется при четверной терапии, при которой одновременно с классической тройной терапией принимается замедлитель кислотной секреции. Применяемая в Германии лучше переносимая двойная терапия (комбинация амоксициллина с омепразолом), однако, слабо действует и создается впечатление, что она не действует у курильщиков и предварительно пролеченных омепразолом. При тройной терапии в качестве антибиотиков принимают, как правило, амоксилин, нитроимидазольные соединения (метронидазол,тинидазол), тетрациклин, а также, с недавних пор, макролиды (кларитромицин) [в 3-4 частичных дозах]. В мире достигают эффектов уничтожения инфекции 70-90%. Различные факторы влияют на эффект уничтожения инфекции: 1. На первом месте стоит устойчивость инфекционного начала (развивающиеся страны: до 60%, Германия: до 10%) по отношению к метронидазолу, наиболее часто применяемому антибиотику при тройной терапии. И при лечении кларитромицином указывают на недостаток, связанный с развитием устойчивости до 10%. 2. В качестве другого фактора следует назвать вышеупомянутое последействие, характерное для отдельных пациентов. Животные модели В качестве подходящей модели животных описана Н. felis модель мыши [A.Lee и др., Gastroentrology 99, 1315-1323 (1990)], модифицированная нами таким образом, что она очень хорошо подходит для скрининга и сравнимой оценки вышеназванных веществ. Бактерия Н. felis, похожая на штопор и вырабатывающая уреазу, несмотря на большие морфологические отличия от бактерии Н. pylori,находится в близком родстве с ней. Н. felis является естественным жителем слизистой оболочки желудка у собак и кошек. После орального высева возбудители колонизируют желудок мыши, аналогично тому, как Н. pylori колонизируют желудок человека. Созданная хроническая длительная инфекция приводит у мышей к активному гастриту и индуцирует соответствующую имунную реакцию. Терапевтическая эффективность испытательных препаратов, установленная на Н. felis модели мыши рассматривается в литературе как хорошая для соответствующего клинического действия. 4 Несмотря на очень хорошую in vitro активность антибиотиков (например, амоксициллин или эритромицин) против Н. pylori, они не обнаруживают после монотерапевтического применения клинически никакого значительного терапевтического действия. Этот факт подтверждается с помощью Н. felis модели мыши. Соответственно, клинически признанное действие по уничтожению инфекционного начала классической тройной терапии подтверждено и на Н. felis модели мыши. Из ЕР-А-350733 и ЕР-А-550903 (Байер) известны антибактериально действующие производные 7-(2-окса-5,8-диазабицикло[4,3,0]нон 8 ил)хинолон- и -нафтиридонкарбоновых кислот. В JP 8048629 (Дейниппон) описано, что такие соединения, как 8-хлор-1-циклопропил-7-([S,S]2,8-диазабицикло[4,3,0]нон-8-ил)6-фтор-1,4 дигидро-4-оксо-3-хинолинкарбоновая кислота(BAY Y 3118) проявляет антибактериальное действие против Н. pylori. Известно, что ряд высокодейственных хинолонов, как например,ципрофлоксацин, ломефлоксацин или офлоксацин (Journal of Antimicrobial Chemotherapy 22,631-636 [1988], Antimicrobial Agents and Chemotherapy 33, 108-109, [1989]) проявляют in vitro действие против Helicobacter spp. Однако оказалось, что на модели животных (Helicobacter felis, мыши) эти клинически используемые антибактериально действующие хинолоны в терапевтически применяемых дозах не в состоянии привести к уничтожению инфекционного начала. Даже при монотерапевтическом лечении с помощью высокодейственных хинолонов, которые еще не поступили на рынок, например, уже упомянутый BAY Y 3118, не удается добиться уничтожения Н. felis на моделях животных без того, чтобы в связи с высокой токсичностью вещества, часто не погибала большая часть животных. Применение тровафлоксацина или его производных в комбинации с другими антибиотиками, такими как амоксициллин или тетрациклинами или ингибиторами откачки протонов, такими как омепразол, для лечения Н. pylori описано в ЕР-А-0676199 и GB-A-2289674(Пфицер). Поэтому задачей, лежащей в основе изобретения, было найти относительно хорошо переносимые вещества, которые в состоянии эти высоко специфичные бактерии уничтожить при помощи простой монотерапии. Было обнаружено, что соединения общей формулы (I)R1 означает алкил с числом атомов углерода от 1 до 4, при необходимости замещенный 5 однократно или двухкратно галогеном, фенил,при необходимости замещенный одним или двумя атомами фтора, или циклопропил, при необходимости замещенный одним или двумя атомами фтора,R2 означает водород, алкил с числом атомов углерода от 1 до 4, при необходимости замещенный гидрокси-, метокси-, амино-, метиламино- или диметиламиногруппой, или означает (5-метил-2-оксо-1,3-диоксол-4-ил)-метил,А означает N или C-R3, причемR3 означает водород, галоген, метил, метокси-, дифторметокси- или цианогруппу или вместе с R1 образует мостик структуры-O-СН 2-СН-СН 3 или -O-СН 2-N-СН 3,причем атом, помеченный значком , связан с атомом углерода А,R4 означает водород, бензил, (C1-С 3)-алкил,(5-метил-2-оксо-1,3-диоксол-4-ил)-метил, радикалы со структурой -CH=CH-COOR5,-CH2CH2COOR5, -CH2CH2CN, -СН 2 СН 2 СОСН 3,-СН 2 СОСН 3, в которыхR5 означает метил или этил, R6 означает водород, амино-, гидроксигруппу, метил или галоген,в форме рацематов, смесей диастереомеров или в виде энантиомерно чистых или диастереомерно чистых веществ, фармацевтически применимые гидраты и/или соли которых, такие как соли присоединения к кислоте, а также соли щелочных, щелочно-земельных металлов, серебра и гуанидиния с лежащими в основе карбоновыми кислотами, проявляют сильное антибактериальное действие по отношению к Helicobacter ssp. и могут быть использованы для полного уничтожения этих возбудителей. Предпочтительны соединения общей формулы (I), в которойR1 означает трет-бутил, при необходимости замещенный однократно или двухкратно фтором, или циклопропил, при необходимости замещенный одним атомом фтора,R2 означает водород, алкил с числом атомов углерода от 1 до 4 или означает (5-метил-2 оксо-1,3-диоксол-4-ил)-метил,А означает C-R3, причемR3 означает водород, фтор, метокси-, дифторметокси- или цианогруппу или вместе с R1 образует мостик структурыR5 означает метил или этил, R6 означает водород, аминогруппу или метил,и их фармацевтически применимые гидраты и/или соли, такие как соли присоединения к кислоте, а также соли щелочных, щелочно 002477 6 земельных металлов, серебра и гуанидиния с лежащими в основе карбоновыми кислотами. Особо предпочтительны соединения общей формулы (I), в которойR1 означает трет-бутил, при необходимости замещенный однократно или двухкратно фтором, или циклопропил,R2 означает водород, метил или этил,А означает C-R3, причемR3 означает водород, метокси-, дифторметокси- или цианогруппу или вместе с R1 образует мостик структуры-O-СН 2-СН-СН 3 или -O-СН 2-N-СН 3,причем атом, помеченный значком , связан с атомом углерода А,R4 означает водород, метил, R6 означает водород,и их фармацевтически применимые гидраты и/или соли, такие как соли присоединения к кислоте, а также соли щелочных, щелочноземельных металлов, серебра и гуанидиния с лежащими в основе карбоновыми кислотами. Предметом данного изобретения являются также новые вещества 8-циано-1-циклопропил 6-фтор-7-(2-окса-5,8-диазабицикло[4,3,0]нон-8 ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота и 1-циклопропил-8-дифторметокси-6 фтор-1,4-дигидро-7-(2-окса-5,8-диазабицикло[4,3,0]нон-8-ил)-4-оксо-3-хинолинкарбоновая кислота, особенно в диастереомерно чистой или в энантиомерно чистой форме и их фармацевтически применимые гидраты и/или соли, такие как соли присоединения к кислоте, а также соли щелочных, щелочно-земельных металлов, серебра и гуанидиния с лежащими в основе карбоновыми кислотами. Особо предпочтительна 8-циано-1-циклопропил-6-фтор-7-1S,6S)-2 окса-5,8-диазабицикло[4,3,0]нон-8-ил)-1,4 дигидро-4-оксо-3-хинолинкарбоновая кислота. Вещества, которые пригодны для применения, согласно изобретению частично известны из ЕР-А-0350733, ЕР-А-0550903, а также изDE-А-4329600 или могут быть получены по описанным там способам. Например, при применении 9,10-дифтор 3,8-диметил-7-оксо-2,3-дигидро-7 Н-пиридо[1,2,3-d,e][1,3,4]бензоксадиазин-6-карбоновой кислоты и 2-окса-5,8-диазабицикло[4,3,0]нонана протекание реакции можно описать с помощью следующей схемы: Производные 7-галоген-хинолонкарбоновой кислоты, применяемые для получения соединений формулы (I), соответствующей изобретению, известны или могут быть получены по известным методам. Так 7-хлор-8-циано-1 циклопропил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота, соответственно, эти 7 ловый эфир 7-хлор-8-циано-1-циклопропил-6 фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты описан в ЕР-А-0276700. Соответствующие 7-фторпроизводные получают, например, при следующей последовательности реакции: Альтернативный способ для получения промежуточного продукта 2,4-дихлор-3-циано 5-фтор-бензоилхлорида, который служит исходным продуктом для получения 7-хлор-8 циано-1-циклопропил-6-фтор-1,4-дигидро-4 оксо-3-хинолинкарбоновой кислоты (ЕР-А 0276700) и который может быть переведен в 3 циано-2,4,5-трифторбензоилфторид исходит из 5-фтор-1,3-ксилола: 5-фтор-1,3-ксилол в присутствии катализатора при ионных условиях хлорируют двухкратно в цикле до 2,4-дихлор-5 фтор-1,3-диметилбензола и в заключение при радикальных условиях хлорируют в боковых цепях до 2,4-дихлор-5-фтор-3-дихлорметил-1 трихлорметилбензол. Его переводят при омылении 2,4-дихлор-5-фтор-3-дихлорметилбензойной кислоты в 2,4-дихлор-5-фтор-3-формилбензойную кислоту и в заключение превращают в 2,4-дихлор-5-фтор-3-N-гидроксииминометилбензойную кислоту. При обработке тионилхлоридом получают 2,4-дихлор-3-циано-5-фторбензоилхлорид, который при реакции хлор/ фтор-обмена превращают в 3-циано-2,4,5 трифторбензоилфторид. Амины, используемые для получения соединений формулы (I), известны из ЕР-А 0550903, ЕР-А-0551653, а также из DE-A4309964. Альтернативный путь для синтеза дигидробромида 1S,6S-2-окса-5,8-диазабицикло[4,3,0] нонана, соответственно, свободного основания 1S,6S-2-окса-5,8-диазабицикло [4,3,0] нонана, а также соответствующих 1R,6R-энантиомеров представлен ниже. 8 Исходным продуктом для этого синтеза является цис-1,4-дигидрокси-2-бутен, который при мезилировании переводят в бис-мезилат,при посредстве тозиламида превращают в 1 тозилпирролидин. Это соединение переводят с помощью м-хлорпербензойной кислоты в эпоксид. Раскрытие эпоксидного цикла происходит при нагревании с этаноламином в изопропаноле с образованием транс-3-гидрокси-4-(2-гидроксиэтиламино)-1-(толуол-4-сульфонил)пирролидин с выходом более 80%. В заключение превращают в пиридин/тетрагидрофуране с тозилхлоридом при охлаждении в трис-тозилат, который в виде сырого продукта в смеси с небольшим количеством тетра-тозилпроизводного при щелочных условиях реакции циклизуют в рацемический транс-5,8-бис-тозил-2-окса-5,6-диазабицикло[4,3,0]нонан. На этой стадии осуществляют с высокой селективностью хроматографическое расщепление рацематов на связанном с силикагелем поли(N-метакрилоил-L-леуцин-dментиламиде) в качестве стационарной фазы. Желательный энантиомер,(1S,6S)-5,8-бистозил-2-окса-5,6-диазабицикло[4,3,0]нонан, получают с чистотой 99%. Отщепление птозильных защитных групп осуществляют НВrледяной уксусной кислотой, при этом образуется дигидробромид (1S,6S)-2-окса-5,8-диазабицикло[4,3,0]нонана, который можно с помощью щелочи, например гидроокиси натрия или калия, или с помощью ионообменника перевести в свободное основание. Аналогичная последовательность реакций может быть использована для получения дигидробромида 1R,6R-2-окса 5,8-диазабицикло[4,3,0]нонана.[4,3,0]нонана. В качестве примеров соединений, соответствующих изобретению, наряду с приведенными в табл. 1 примерами полученных соединений, можно также назвать рацемические формы, 9 Соединения, соответствующие изобретению, могут в форме их бетаинов или в форме солей кристализоваться с одной или двумя молекулами воды. Соединения, соответствующие изобретению, действуют сильно антибиотически и обнаруживают при низкой токсичности широкий антибактериальный спектр по отношению к грамположительному и грамотрицательному инфекционному началу, прежде всего по отношению к Heliobacter ssp. Эти важные свойства определяют их применение в качестве химико-терапевтических средств для лечения Helicobacter pyloriинфекций и связанных с ними гастродуоденальных заболеваний, которым с помощью веществ,соответствующих изобретению, можно помешать, улучшить и/или вылечить. Соединения, соответствующие изобретению, применяют в различных фармацевтических формах. Предпочтительными фармацевтическими формами являются таблетки, драже,капсулы, пилюли, грануляты, растворы, суспензии или эмульсии. Хотя соединения, соответствующие изобретению, вводятся как монотерапевтическое средство, их можно при необходимости применять в комбинации с другими лекарствами. В качестве комбинационного партнера можно,например, назвать производные нитроимидазола, например метронидазол, ингибиторы выведения протонов, например омепразол, пантопразол или ланзопразол, антагонисты Н 2-рецептора, например, циметидин, ранитидин, фамотидин или ницатидин, соединения висмута, на 10 пример, висмутсалицилат или CBS (коллоидальный висмут субцитрат), другие антибиотики, например, амоксициллин, азлоциллин или кларитромицин, антацида. Минимальные подавляющие концентрации(МПК), которые приведены в табл. 2 для соединений, соответствующих изобретению, в качестве примера для сравнения с ципрофлоксацином, были определены при агар-разбавительном тесте на колумбиа-агар, соответственно, базис 2 агар (оксоид) с 10 % лизированной кровью лошади или при рН 7 или рН 5 с 1 г/л мочевины. Испытываемые субстанции тестировались в реплика-чашках, которые каждый раз содержали в два раза разбавленные уменьшающиеся концентрации действующего вещества. Для прививки использовали свежие Helicobacterкультуры из жидкой культуры или суспензии микроорганизмов с агаровых пластин. Агаровые пластины, которым была сделана прививка, при 37 С и в атмосфере с 5-10% СO2 инкубировали в течение 48-72 ч. Считанное значение МПК(мг/л) дает минимальную концентрацию действующих веществ, при которой невооруженным глазом не обнаружено никакого роста. Были использованы следующие Helicobacter-изоляты: Н. felis ATCC 49179, Н. pylori NCTC 11637, Н.pylori клинический изолят 008. Таблица 2. Величина МПК (мг/л) некоторых соединений, соответствующих изобретению,(агар-разбавительный тест) МПК(мг/л) Пример Н.pylori 008 H.pylori 1637 1 А 0,06 Н.д. 2 0,06 Н.д. 4 0,25 0,06 6 0,06 0,06 8 0,06 0,06 13 0,125 0,06 Ципрофлоксацин 0,125 0,125 Для исследования на животных моделях брались женские особи Swiss мышей (в возрасте от 8 до 12 недель, SPF-выращивание), которые содержали на имеющихся в продаже кормах и воде. Для колонизации использовали определенный Н. felis штамм (АТСС 49179). Бактерии высевали в виде суспензии (0,1 мл с 108-109 бактерий) 4 раза в течение 7 дней с помощью желудочного зонда. Альтернативно этому для инфицирования использовали и желудочные гомогенаты ранее инфицированных мышей. Через 3-5 суток после проведения инфицирования начато лечение испытательными препаратами. В качестве первого результата эффективности лечения измерены уменьшения числа возбудителей инфекции как клиренс через 24 ч после последнего лечения (например, 3, 7, 10,14 суток, 1-3 раза в день). В некоторых случаях установлено и полное уничтожение возбудите 11 лей инфекции через 2-4 недели после окончания лечения. По аналогии с применяемым в клинической диагностике "CLO"-тестом (максимально переносимые концентрации) проводят уреаза-тест на основе микротитрования. Проверяли определенные биопсаты желудка на изменение окраски в течение 24 ч. В табл. 3 в качестве примера удивительно высокой эффекивности действия in vivo соединений, соответствующих изобретению, приведен терапевтический результат после семидневного лечения инфицированных мышей с помощью 8-циано-1-циклопропил-6-фтор-7-1S,6S)2-окса-5,8-диазабицикло[4,3,0]нон-8-ил)-1,4 дигидро-4-оксо-3-хинолинкарбоновой кислоты(пример 1 А), а также с помощью 9-фтор-3 метил-10-1S,6S)-2-окса-5,8-диазабицикло[4,3,0]нон-8-ил)-7-оксо-2,3-дигидро-7 Нпиридо[1,2,3-d,e][1,3,4]бензоксадиазин-6 карбоновой кислоты (пример 2) по сравнению с лечением ципрофлоксацином, в то время как с помощью ципрофлоксацина при этих условиях опыта никакого клиренса не достигнуто, он достигает у соединений, соответствующих изобретению, 100%. Десятидневное лечение мышей дозами 2 х 10 мг/кг 8-циано-1-циклопропил-6 фтор-7-1S,6S)-2-окса-5,8-диазабицикло[4,3,0] нон-8-ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты привело даже к полному уничтожению возбудителей инфекции. Таблица 3. Терапевтические результаты после семидневного лечения инфицированных (Н. felis% 1 А 2 х 10 5/5 100 2 2 х 10 5/5 100 Ципроф 2 х 10 0/5 0 локсацин Примеры Получение промежуточных продуктов. Пример П 1. Этиловый эфир 8-циано-1 циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3 хинолиновой кислоты. а. Метиловый эфир 3-бром-2,4,5-трифторбензойной кислоты. К смеси 1460 мл метанола и 340 г триэтиламина добавляют каплями при охлаждении льдом 772 г 3-бром-2,4,5-трифторбензоилфторида. После этого 1 ч перемешивают при комнатной температуре. Отгоняют растворитель из реакционной смеси, остаток растворяют в воде и метиленхлориде и водную фазу еще раз встряхивают с метиленхлоридом. После высушивания органической фазы над сульфатом натрия отгоняют растворитель и остаток перего 002477 12 няют в вакууме. Получают 752,4 г метилового эфира 3-бром-2,4,5-трифторбензойной кислоты с температурой кипения 122 С/20 мбар. б. Метиловый эфир 3-циано-2,4,5-трифторбензойной кислоты. 269 г Метилового эфира 3-бром-2,4,5 трифторбензойной кислоты и 108 г цианида меди нагревают в 400 мл диметилформамида в течении 5 ч с обратным холодильником. После этого отгоняют в вакууме все летучие составные части реакционной смеси. Затем дистиллят фракционируют на колонне. Получают 133 г метилового эфира 3-циано-2,4,5-трифторбензойной кислоты с температурой кипения 8889 С/0,01 мбар. в. 3-Циано-2,4,5-трифторбензойная кислота. Раствор 156 г метилового эфира 3-циано 2,4,5-трифторбензойной кислоты в 960 мл ледяной уксусной кислоты, 140 мл воды и 69 мл концентрированной серной кислоты 8 ч нагревают с обратным холодильником. Затем большую часть уксусной кислоты отгоняют в вакууме и к остатку добавляют воду. Выпадающее в осадок твердое вещество отсасывают, промывают водой и сушат. Получают 118,6 г 3-циано 2,4,5-трифторбензойной кислоты в виде белого твердого вещества с температурой плавления 187-190 С. г. Хлорид 3-циано-2,4,5-трифторбензойной кислоты. 111 г 3-Циано-2,4,5-трифторбензойной кислоты и 84 г оксалилхлорида в 930 мл сухого метиленхлорида при добавлении нескольких капель диметилформамида перемешивают 5 ч при комнатной температуре. Затем метиленхлорид отсасывают и остаток перегоняют в вакууме. Получают 117,6 г 3-циано-2,4,5-трифторбензоилхлорида в виде желтого масла. д. Этиловый эфир 2-(3-циано-2,4,5 трифторбензоил)-3-диметиламиноакриловой кислоты. К раствору 36,5 г этилового эфира 3 диметиламина-акриловой кислоты и 26,5 г триэтиламина в 140 мл толуола добавляют каплями раствор 55 г хлорида 3-циано-2,4,5-трифторбензойной кислоты в 50 мл толуола таким образом, что температура сохраняется в интервале 50 и 55 С. После этого еще 2 ч перемешивают при 50 С. Растворитель отгоняют в вакууме и остаток без дальнейшей переработки используют в следующей стадии. д. Этиловый эфир 2-(3-циано-2,4,5 трифторбензоил)-3-циклопропиламиноакриловой кислоты. К реакционному продукту стадии г добавляют каплями 30 г ледяной уксусной кислоты при 20 С. В заключение добавляют каплями раствор 15,75 г циклопропиламина в 30 мл толуола. Смесь перемешивают в течение одного часа при 30 С. Затем добавляют 200 мл воды,перемешивают 15 мин, отделяют органическую 13 фазу и протряхивают ее еще один раз со 100 мл воды. После этого органическую фазу сушат над сульфатом натрия и в вакууме отгоняют растворитель. Сырой продукт, полученный таким образом, используют без дальнейшей переработки в следующей стадии. е. Этиловый эфир 8-циано-1-циклопропил 6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Реакционный продукт стадии д и 27,6 г карбоната калия перемешивают в 80 мл диметилформамида 16 ч при комнатной температуре. После этого реакционную смесь выливают в 750 мл ледяной воды, твердое вещество отсасывают и промывают 80 мл холодного метанола. После высушивания получают 47 г этилового эфира 8 циано-1-циклопропил-6,7-дифтор-1,4-дигидро 4-оксо-3-хинолинкарбоновой кислоты с температурой плавления 209-211 С. Пример П 2. 2,4-Дихлор-5-фтор-1,3-диметилбензол. а) В отсутствии растворителя. В 124 г 3,5-диметилфторбензола вводят 1 г безводного хлорида железа(III) и вводят со скоростью хлор (около 4 ч), с которым протекает реакция. Она вначале немного экзотермична(возрастание температуры от 24 до 32 С) и ее поддерживают охлаждая ниже 30 С. После введения 120 г хлора реакционная смесь становится твердой. Согласно хроматографическому анализу образуется 33,4% монохлорсоединения,58,4% желаемого продукта и 5% соединений с большим числом атомов хлора. Хлороводород отсасывают и реакционную смесь в заключение при вакууме, создаваемом струйным водяным насосом, перегоняют в колонне. В первом отгоне получают при 72-74 С/22 мбар 49 г 2-хлор-5-фтор-1,3-диметилбензол. После промежуточного отгона в 5 г выделяют при 105 С/22 мбар 75 г 2,4-дихлор-5-фтор-1,3 диметилбензола, температура плавления 6465 С. б) В дихлорметане. 1 кг 3,5 диметилфторбензола с 15 г безводного хлорида железа(III) растворяют в 1,2 дихлорэтане и вводят хлор по мере хода реакции(около 4 ч). Она вначале немного экзотермична(возрастание температуры от 24 до 32 С) и ее поддерживают, охлаждая ниже 30 С. После введения 1200 г хлора, согласно газовохроматографическому анализу образуется 4% монохлорсоединения, 81,1% желаемого продукта и 13,3% соединений с большим числом атомов хлора. После отгонки растворителя и хлороводорода остаток при вакууме, создаваемом струйным водяным насосом, перегоняют в колонне. 14 В первом отгоне получают 40 г 2-хлор-5 фтор-1,3-диметилбензола. После небольшого промежуточного отгона выделяют при 127128 С/50 мбар 1115 г 2,4-дихлор-5-фтор-1,3 диметилбензола. Пример П 3. 2,4-Дихлор-5-фтор-3-дихлорметил-1-трихлорметилбензол. В аппаратуру для фотохлорирования с вводом для хлора и отводом для хлорводорода к газоочистителю, а также с источником света вблизи трубки, по которой вводится хлор, загружают 1890 г 2,4-дихлор-5-фтор-1,3-диметилбензола и при 140-150 С вводят дозированно хлор. В течение 30 ч вводят 3850 г хлора. Количество желаемого продукта составляет, согласно газовой хроматографии, 71,1%, доля менее хлорированных соединений 27,7%. Перегонка в 60 см колонне со спиралями Вильсона дает 1142 г в первом отгоне, который повторно используют для хлорирования. Главный погон при 160-168 С дает 2200 г 2,4 дихлор-5-фтор-3-дихлорметил-1-трихлорметилбензола с температурой плавления 74-76 С. После перекристаллизации пробы из метанола температура плавления составляет 81-82 С. Пример П 4. 2,4-Дихлор-5-фтор-3-формилбензойная кислота. В аппаратуру для перемешивания с газоотводом загружают 2500 мл 95%-ной серной кислоты при 70 С и вводят каплями 500 г расплавленного 2,4-дихлор-5-фтор-3-дихлорметил 1-трихлорметилбензола. Через небольшое время начинает образовываться хлористый водород. В течение 2 ч проводят дозировку и перемешивают до прекращения газовыделения. После охлаждения до 20 С реакционную смесь выливают на 4 кг льда и выпадающее твердое вещество отсасывают. Продукт промывают водой и сушат. Выход: 310 г. Температура плавления: 172174 С. Пример П 5. 2,4-Дихлор-5-фтор-3-N-гидроксииминометилбензойная кислота. В аппаратуру для перемешивания загружают 80 г хлорида гидроксиламмония в 500 мл этанола и вводят каплями 45%-ный натровый щелок и в заключение при 40-45 С вводят 200 г 2,4-дихлор-5-фтор-3-формилбензойной кислоты. Реакция слегка экзотермична и 5 ч при температуре 60 С перемешивают. После охлаждения продукта до комнатной температуры введе 15 нием каплями соляной кислоты доводят до рН 3, продукт растворяют в трет-бутилметиловом эфире, органическую фазу отделяют и растворитель отгоняют. Остаток содержит 185 г 2,4 дихлор-5-фтор-3-N-гидроксииминометилбензойной кислоты, температура плавления: 190194 С. Пример П 6. 2,4-Дихлор-3-циано-5-фторбензоилхлорид. В аппаратуру для перемешивания с дозировочным устройством и газоотводом через противоточный холодильник к газоочистителю загружают 600 мл тионилхлорида и при 20 С вводят 210 г 2,4-дихлор-5-фтор-3-N-гидроксииминометилбензойной кислоты по мере образования хлороводорода и двуокиси серы. После добавления смесь до окончания газообразования нагревают при обратной перегонке. В заключение проводят перегонку и в области температур кипения 142-145 С/10 мбар получают 149 г 2,4 дихлор-3-циано-5-фторбензоилхлорида (содержание, согласно ГХ, 98,1%). Температура плавления: 73-75 С. Пример П 7. 3-Циано-2,4,5-трифторбензоилфторид. 50 г Фторида калия суспендируют в 120 мл тетраметиленсульфона и при 15 мбар для сушки перегоняют (около 20 мл). В завершение добавляют 50,4 г 2,4-дихлор-3-циано-5-фторбензоилхлорида и в отсутствии влажности перемешивают 12 ч при внутренней температуре 180 С. При вакуумной перегонке получают 32,9 г 3 циано-2,4,5-трифторбензоилфторида в области температуры кипения 98-100 С/12 мбар. Пример П 8. 3-Циано-2,4,5-трифторбензоилхлорид. 76,6 г 3-Циано-2,4,5-трифторбензоилфторида загружают с 1 г безводного хлорида алюминия при 60-65 С, а затем в ходе газовыделения добавляют каплями 25 г тетрахлорида кремния. После окончания газовыделения при 65 С проводят перегонку в вакууме. В области температуры кипения 120-122 С/14 мбар получают 73,2 г 3-циано-2,4,5-трифторбензоилхлорида. Пример П 9. 1-(Толуол-4-сульфонил)пирролин. 16 12 л дихлорметана и при внутренней температуре -10 С при сильном охлаждении (-34 С) добавляют каплями раствор 705 г (8,0 моль) 2 бутен-1,4-диола в 1,944 кг (2,68 л, 19,2 моль) триэтиламина в течение 30 мин. Получают желтую суспензию, которую перемешивают еще один час при -10 С, и затем добавляют 4 л воды,причем температура возрастает до 0 С. Суспензию нагревают до комнатной температуры, 10 мин перемешивают при комнатной температуре и затем всасывают в 30-литровую разделительную грушу. Фазы разделяют (хорошее разделение) и водную фазу перемешивают с 2 л дихлорметана. Объединенные дихлорметановые фазы помещают в предварительно охлажденный 20 л котел НС 4 и выдерживают при температуре 0 С. В другой 20 л котел НС 4 с дистилляционным мостиком загружают 1,37 кг (8,0 моль) амид толуолсульфоновой кислоты в 6 л толуола. Добавляют 3,2 кг 45 %-ного натрового щелока,0,8 л воды и 130,5 г гидросульфата тетрабутиламмония, нагревают максимально до 40 С внутренней температуры и создают вакуум. После этого полученный ранее дихлорметановый раствор (15,2 л) вводят каплями в течение 1,5 ч,при этом дихлорметан отгоняют при 450 мбар(температура бани: 60 С). При перегонке происходит пенообразование. В конце получают раствор при внутренней температуре 33-40 С. После окончания введения продолжают отгонять дихлорметан до тех, пока почти не прекратится образование дистиллята (продолжительность: около 85 мин, внутренная температура 40 С и температура бани в конце 60 С). Содержимое котла в теплом состоянии переводят в разделительную грушу и котел промывают 5 л воды и 2 л толуола при 50 С. Перед разделением фаз твердые частицы отсасывают в промежуточной фазе и промывают 0,5 л толуола. Органическую фазу перемешивают с 2,4 л воды, отделяют и выпаривают до сухой на ротационном испарителе. Твердый остаток (1758 г) суспендируют в 1,6 л метанола, переводят в 10-литровую планшлифколбу и колбу промывают 2,4 л диизопропилового эфира. Нагревают при обратной перегонке (59 С) и перемешивают еще 30 мин при обратной перегонке. Суспензию охлаждают до 0 С, перемешивают 1 ч при 0 С, отсасывают и промывают 0,8 л холодной смеси метанол/диизопропиловый эфир (1:1,5). Кристаллизат сушат в атмосфере азота при 50 С/400 мбар. Выход: 1456 г (81,5 % от теор.). Пример П 10. 3-(Толуол-4-сульфонил)-6 окса-3-аза-бицикло[3,1,0]гексан. 334,5 г 1-(толил-4-сульфонил)пирролина растворяют в 1,5 л дихлорметана при комнатной температуре и в течение 15 мин добавляют суспензию 408 г (около 1,65-1,77 моль) 70-75%-ной 17 м-хлорпербензойной кислоты в 900 мл дихлорметана (охлаждается при получении). Нагревают 16 ч при обратной перегонке (тест на перекись с помощью KJ/крахмал бумаги показывает еще содержание перекиси), суспензию охлаждают до 5 С, отсасывают выпавшую м-хлорбензойную кислоту и промывают 300 мл дихлорметана (тест на перекись с осадком: отрицательный, осадок выбрасывают). Фильтрат для разрушения избыточной перекиси промывают дважды каждый раз 300 мл 10 %-ного раствора сульфата натрия (тест на перекись теперь отрицательный), экстрагируют 300 мл насыщенного раствора бикарбоната натрия, промывают водой, сушат над сульфатом натрия и отгоняют растворитель до четверти объема. Еще один тест на перекись: отрицательный. Отгоняют растворитель из смеси и твердый остаток при охлаждении льдом перемешивают с 400 мл изопропанола, осадок отсасывают и сушат в вакууме при 70 С. Выход: 295 г (82,3 %). Температура плавления: 136-139 С. ТСХ (дихлорметан/метанол 98:2): 1 НК 643,7 г (2,65 моль) 3-(толил-4-сульфонил)6-окса-3-азабицикло-[3,1,0]гексан с 318,5 г этаноламина в 4 л изопропанола кипятят 16 ч с обратным холодильником. После ТСХ контроля добавляют еще 35,1 мл (всего 5,86 моль) этаноламина и снова кипятят до следующего утра. Исходную смесь в горячем виде отсасывают и фильтрат уменьшают в объеме до 3,5 л на ротационном испарителе. После введения затравки и перемешивания при комнатной температуре добавляют 3,5 л диизопропилового эфира и перемешивают 6 ч при 0 С. Выпавший кристаллизат отсасывают, промывают 250 мл смеси изопропанол/диизопропиловый эфир (1:1) и два раза промывают 300 мл диизопропилового эфира и в течение ночи сушат в высоком вакууме. Выход: 663,7 г (83% от теор.). Содержание: 96,1% (в % площади, согласно жидкостной хроматограмме HP). Пример П 12. Транс-толуол-4-сульфоновая кислота-2-4-гидрокси-1-(толуол-4-сульфонил)пирролидин-3-ил]-(толуол-4-сульфонил) амино]этиловый эфир. 18 552 г (1,837 моль) транс-3-гидрокси-4-(2 гидроксиэтиламино)-1-(толуол-4-сульфонил) пирролидин растворяют под аргоном с 1,65 л пиридина и 0,8 л тетрагидрофурана и при -10 С добавляют порционно всего 700 г (3,675 моль) п-толуолсульфонилхлорида. Реакционную смесь затем перемешивают 16 ч при этой температуре. Переработку осуществляют при добавлении 4,3 л 18,5 %-ного водного раствора соляной кислоты, двухкратной экстракцией дихлорметаном(3 л, 2 л), промывкой объединенных органических фаз насыщенным раствором гидрокарбоната натрия (3 л, 2 л), сушкой над сульфатом натрия, отсасыванием и отгонкой растворителя в вакууме. Остаток сушат в течение ночи при откачке масляным насосом и в сыром виде используют в следующей реакции. Получено 1093 г в виде твердой пены (содержание [в % площади на жидкостной хроматограмме HP] : 80% трис-тозил-продукта и 13% тетра-тозилпродукта, выход смотри в следующей стадии). Пример П 13. Рац. транс-5,8-бис-тозил-2 окса-5,6-диазабицикло[4,3,0]нонан. 1092 г Сырого транс-толуол-4-сульфоновая кислота-2-4-гидрокси-1-(толуол-4-сульфонил)пирролидин-3-ил]-(толуол-4-сульфонил) амино]этилового эфира растворяют в 9,4 л тетрагидрофурана и при 0-3 С превращают с 1,4 л 1,43 молярного раствора гидроокиси натрия в метаноле. Через полчаса при этой температуре к реакционной смеси добавляют 2,1 л воды и 430 мл разбавленной уксусной кислоты (2:1) и добавляют в качестве затравки ранее выделенные кристаллы транс-толуол-4-сульфоновая кислота-2-4-гидрокси-1-(толуол-4-сульфонил)пирролидин-3-ил](толуол-4-сульфонил)амино]этилового эфира. Суспензию перемешивают в течение ночи при 0 до -4 С. На следующее утро кристаллы отсасывают, дважды промывают каждый раз в 400 мл холодной смеси тетрагидрофуран/вода (4:1) и при 3 мбар и при 50 С сушат в течение ночи. Выход: 503 г белых кристаллов (62,7 % от теор. в ходе двух стадий), содержание: 99,7 % (в% площади на жидкостной хроматограмме HP). Пример П 14. Разделение рацематов рац. транс-5,8-бис-тозил-2-окса-5,6-диазабицикло[4,3,0]нонана с помощью препаративной хроматографии. Хроматография рацематов происходит при комнатной температуре на колонке (внутренний диаметр 75 мм), которая набита 870 г хиральной стационарной фазы (связанный с силикагелем поли(N-метакрилоил-L-леуцин-d-ментиламид) 19 на основе меркапто-модифицированного силикагеля полигозил 100, 10 м, смотри ЕР-А 0379917) (высота набивки: 38 см). Детектирование осуществляется с помощью УФ-детектора при 254 нм. В качестве пробы берут раствор с концентрацией 100 г рац. транс-5,8-бис-тозил-2 окса-5,6-диазабицикло[4,3,0]нонана в 3000 мл тетрагидрофурана. Разделительный цикл осуществляют при следующих условиях: с помощью насоса в течение 2 мин подают в колонку со скоростью потока 50 мл/мин часть раствора пробы и одновременно со скоростью потока 50 мл/мин чистый н-гептан. После этого элюируют в течение 18 мин смесью н-гептан/тетрагидрофуран (3/2 об./об.) при потоке 100 мл/мин. Затем элюируют в течение 3 мин потоком 100 мл/мин чистым тетрагидрофураном. После этого элюируют н-гептан/тетрагидрофураном (3/2 об./об.). Этот цикл многократно повторяют. Энантиомер,элюированный первым,(1R,6R)-5,8-бис-тозил-2-окса-5,6-диазабицикло[4,3,0]нонан, который выделяют при отгонке растворителя. Элюат энантиомера с большим удерживанием сильно упаривают в вакууме,выпавший кристаллизат отсасывают и сушат. При разделении рацематов таким способом получают из 179 г рацемата 86,1 г (96,2% от теор.) энантиомера (1S,6S)-5,8-бис-тозил-2-окса-5,6 диазабицикло[4,3,0]нонана с чистотой 99%. Пример П 15. Дигидробромид (1R,6R)-2 окса-5,6-диазабицикло[4,3,0]нонана. 38,3 г (87 ммоль) (1R,6R)-5,8-Бис-тозил-2 окса-5,6-диазабицикло-[4,3,0]нонана в 500 мл 33%-ной НВr/ледяной уксусной кислоты превращают с 70 г анизола и 4 ч нагревают при 60 С (баня). После выстаивания в течение ночи суспензию охлаждают, осадок отсасывают,промывают 100 мл абсолютного этанола и при 70 С сушат в высоком вакууме. Выход: 23,5 г (93 %) белого твердого продукта. Температура плавления: 309-310 С (разл.). ТСХ(дихлорметан/метанол/17% водн.аммиак 30:8:1):1 НК.(1R,6R)-2-окса-5,8-диазабицикло[4,3,0]нонана суспендируют в 100 мл изопропанола, добавляют 2,4 г (42,9 ммоль) порошкообразной гидроокиси калия и примерно на 1 ч оставляют в ультразвуковой бане. Суспензию охлаждают в ледяной бане, фильтруют, нерастворенную соль промывают изопропанолом и фильтрат после отгонки растворителя перегоняют в трубчатой печи при температуре печи 150-230 С и 0,7 мбар. Получают 2,25 г (87,9 % от теор.) вязкого масла, которое кристаллизуется. []D:-21,3(с=0,92, СНСl3). Соответственно, это превращение можно проводить в этаноле. 2 Метод: гомогенизованную смесь из дигидробромида (1R,6R)-2-окса-5,8-диазабицикло[4,3,0]нонана и 620 мг (11 ммоль) порошкообразной гидроокиси калия в сухом виде помещают в аппаратуру с трубчатой печью и перегоняют при возрастающей до 250 С температуре печи и 0,2 мбар. Получают 490 мг (76,6 % от теор.)(1R,6R)-2-окса-5,8-диазабицикло[4,3,0] нонана в виде вязкого масла, которое медленно кристаллизуется. 3 Метод: 100 г влажного предварительно обработанного катионного ионообменника(Dowex 50WX, Н+-форма, 100-200 меш, емкость 5,1 мэкв/г сухой или 1,7 мэкв/мл) набивают в колонку, активируют 200 мл 1 н. НСl и промывают до нейтральной 3 л воды. Раствор 2,9 г (10 ммоль) дигидробромида (1R,6R)-2-окса-5,8 диазабицикло[4,3,0]-нонана в 15 мл воды подают на ионообменник и затем промывают 2 л воды и элюируют 1 л примерно 1 н. раствора аммиака. Растворитель элюата отгоняют в вакууме. Выход: 1,3 г вязкого масла (колич.). ТСХ(1S,6S)-2-окса-5,8-диазабицикло-[4,3,0] нонана получают свободное основание (1S,6S)2-окса-5,8-диазабицикло[4,3,0]нонан. Пример П 19. Этиловый эфир 2-(2,4 дихлор-3-циано-5-фторбензоил)-3-диметиламиноакриловой кислоты 21 К раствору 626 г (4,372 моль) этилового эфира 3-диметиламиноакриловой кислоты и 591 г (4,572 моль) этилдиизопропиламина (основание Хюнига) в 1060 мл дихлорметана добавляют каплями вначале при комнатной температуре раствор 1075 г 2,4-дихлор-3-циано-5-фторбензоилхлорида (около 94 %-ного, соответственно, 1010,5 г = 4,00 моль) в 850 мл дихлорметана. При этом возрастает температура до 5055 С (капают в течение 90 мин). После этого перемешивают 2 ч при температуре 50 С и реакционную смесь без дальнейшей переработки используют в следующей стадии. Пример П 20. Этиловый эфир 2-(2,4 дихлор-3-циано-5-фторбензоил)-3-циклопропиламиноакриловой кислоты. К реакционной смеси вышеприведенной стадии добавляют каплями при охлаждении при 15 С 306 г (5,1 моль) ледяной уксусной кислоты. Затем при дальнейшем охлаждении до 1015 С добавляют каплями 267,3 г (4,68 моль) циклопропиламина. Сразу после этого в реакционную смесь, охлаждаемую льдом, добавляют 1300 мл воды и 15 мин хорошо перемешивают. Дихлорметановую фазу отделяют и используют в следующей стадии. Пример П 21. Этиловый эфир 7-хлор-8 циано-1-циклопропил-6-фтор-1,4-дигидро-4 оксо-3-хинолинкарбоновой кислоты(2,554 моль) карбоната калия в 850 мл Nметилпирролидона добавляют каплями дихлорметановую фазу из предыдущей стадии (около 90 мин). Во время добавления одновременно отгоняют дихлорметан из реакционной смеси. В заключение реакционную смесь хорошо перемешивают еще 5,5 ч при 60-70 С. Охлаждают до 50 С и отгоняют при вакууме 250 мбар остаточный дихлорметан. Затем при комнатной температуре при охлаждении льдом добавляют каплями 107 мл 30%-ной соляной кислоты, благодаря чему устанавливают рН-величину 5-6. После этого при охлаждении льдом добавляют 2200 мл воды. Реакционную смесь хорошо перемешивают 15 мин, твердое вещество отсасывают и промывают на нутч-фильтре два раза 1000 мл воды и три раза 1000 мл этанола, а в заключение сушат в вакуумном сушильном шкафу при 60 С. Выход: 1200 г (89,6 % от теор.). 22 Этот продукт, при необходимости, можно еще почистить, при этом твердое вещество в 2000 мл этанола 30 мин перемешивают с обратным холодильником. Отсасывают в горячем состоянии, промывают 500 мл этанола и сушат при 60 С в вакууме. Температура плавления: 180-182 С. 1 Н-ЯМР (400 MHz, СDСl3) := 1,2-1,27 33,8 г (0,1 моль) этилового эфира 7-хлор-8 циано-1-циклопропил-6-фтор-1,4-дигидро-4 оксо-3-хинолинкарбоновой кислоты в смеси с 100 мл уксусной кислоты, 20 мл воды и 10 мл концентрированной серной кислоты нагревают 3 ч при обратной перегонке. После охлаждения выливают на 100 мл ледяной воды, выпавший осадок отсасывают, промывают водой и при 60 С сушат в вакууме. Выход: 29,6 г (96 % от теор.). Температура плавления: 276-277 С (разл.). Получение действующих веществ Пример 1.[4,3,0]нонана и 0,9 мл триэтиламина в 30 мл ацетонитрила в течение 25 ч в атмосфере аргона при 40-45 С. Все летучие компоненты удаляют в вакууме и остаток перекристаллизовывают из этанола. Выход: 1,22 г (94 %). Температура плавления: 294 С (разл.). Б) Гидрохлорид 8-циано-1-циклопропил-6 фтор-7-1S,6S)-2-окса-5,8-диазабицикло[4,3,0] нонан-8-ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. 200 мг (0,63 ммоль) Этилового эфира 8 циано-1-циклопропил-6,7-дифтор-1,4-дигидро 4-оксо-3-хинолинкарбоновой кислоты перемешивают с 97 мг (0,75 ммоль) 1S,6S)-2-окса-5,8 диазабицикло[4,3,0]нонана и 0,17 мл триэтиламина в 3 мл ацетонитрила в течение 2 ч в атмо 23 сфере аргона при 40-45 С. Все летучие компоненты удаляют в вакууме, к остатку добавляют воду, нерастворимые частицы отфильтровывают и фильтрат экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом натрия и отгоняют растворитель в вакууме. Полученный остаток растворяют в 6 мл тетрагидрофурана и 2 мл воды и добавляют 30 мг (0,72 ммоль) моногидрата гидроокиси лития. После 16 ч перемешивания при комнатной температуре подкисляют разбавленной соляной кислотой и получающийся осадок отсасывают и сушат. Выход: 153 мг (57 %). Температура плавления: 300 С. В) Гидрохлорид 8-циано-1-циклопропил-6 фтор-7-1S,6S)-2-окса-5,8-диазабицикло[4,3,0] нон-8-ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. 1 г (2,5 ммоль) 8-циано-1-циклопропил-6 фтор-7-1S,6S)-2-окса-5,8-диазабицикло[4,3,0] нон-8-ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты суспендируют с 20 мл воды, к суспензии добавляют 10 мл 1 н. соляной кислоты, перемешивают 3 ч при комнатной температуре. Полученный осадок отсасывают, промывают этанолом и сушат при 80 С в высоком вакууме. Выход: 987 мг (90,6 % от теор.). Температура плавления: 314-316 С (разл.). Г) Гидрохлорид 8-циано-1-циклопропил-6 фтор-7-1S,6S)-2-окса-5,8-диазабицикло[4,3,0] нон-8-ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. 86,4 г (217 ммоль) 8-Циано-1-циклопропил-6-фтор-7-1S,6S)-2-окса-5,8-диазабицикло[4,3,0]нон-8-ил)-1,4-дигидро-4-оксо-3 хинолинкарбоновой кислоты растворяют при комнатной температуре в 963 мл воды и 239 мл 1 н. водного натрового щелока. После фильтрования и последующего промывания 200 мл воды добавляют 477 мл 1 н. водной соляной кислоты и выпавший кристаллизат при 95 до 100 С переводят в раствор. Раствор оставляют на ночь для охлаждения, выпавший кристаллизат отсасывают и три раза промывают каждый раз 500 мл воды, после этого сушат в вакууме. Выход: 90 г (94,7 % от теор.). Содержание: 99 % (площадь в % ЖХ HP),99,6% ее. 24 100 мг (0,354 ммоль) 9,10-дифтор-3-метил 7-оксо-2,3-дигидро-7 Н-пиридо[1,2,3-d,e]-[1,3,4] бензоксадиазин-6-карбоновой кислоты нагревают с 91 мг (0,71 ммоль) (1S,6S)-2-окса-5,8 диазабицикло-[4,3,0]нонана в 3 мл ДМСО в течение одного часа в атмосфере аргона при 120 С. Растворитель из смеси отгоняют в вакууме, а остаток перекристаллизовывают из этанола и сушат. Выход: 106 мг (77 % от теор.). Температура плавления: 205 С (разл.). Пример 3.[2,2,2]октана (141 мг, 1,26 ммоль) в абсолютном ацетонитриле (20 мл) нагревают в течение ночи с обратным холодильником. После охлаждения реакционной смеси до комнатной температуры выпавшие кристаллы отфильтровывают и промывают ацетонитрилом. Выход: 392 мг (73 % от теор.). Температура плавления: 245 С. Пример 4. 1-(1-Фторметил-1-метил-2-фторэтил)-6 фтор-7-[(1R,6S)-2-окса-5,8-диазабицикло[4,3,0] нон-8-ил]-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота. Титульное соединение получают аналогично прописи для примера 3 при реакции превращения[4,3,0]нон-8-ил]-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Титульное соединение получают аналогично прописи для примера 3 при реакции превращения[4,3,0]-нонана. Сырой продукт очищают на хроматографической колонкеAcOH, 10:5:0,5), причем продукт выпадает в виде ацетатной соли. После добавления метанола и 1 н. НСl и отгонки растворителя в вакууме получают кристаллический гидрохлорид. Выход: 67% от теор. Температура плавления: 250 С. Пример 6. Гидрохлорид 1-циклопропил-6-фтор-8-метокси-7-[(1R,6S)-2-окса-5,8-диазабицикло[4,3,0] нон-8-ил]-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Титульное соединение получают аналогично прописи для примера 5 при реакции превращения[4,3,0]нон-8-ил]-4-оксо-3-хинолинкарбоновая кислота. Смесь 3,6 г (12 ммоль) 1-(цис-2-фторциклопропил)-6,7,8-трифтор-1,4-дигидро-4 оксо-3-хинолинкарбоновой кислоты в 50 мл ацетонитрила и 25 мл диметилформамида с 3,36 г (30 ммоль) 1,4-диазабицикло[2,2,2]октана и 3,7 г (12,8 ммоль) дигидробромида (1S,6S)-2-окса 5,8-диазабицикло[4,3,0]нонана нагревают 1 ч с обратным холодильником. Из смеси отгоняют растворитель, к остатку добавляют немного воды и 30 мин обрабатывают в ультразвуковой бане. Нерастворенный осадок отсасывают, промывают водой и сушат при 80 С при высоком вакууме. Выход: 4,2 г (86 % от теор.). Температура плавления: 274-276 С (разл.). Пример 8.[4,3,0]нон-8-ил]-4-оксо-3-хинолинкарбоновая кислота. Смесь из 166 мг (0,5 ммоль) 1-циклопропил-8-дифторметокси-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты в 1,5 мл ацетонитрила и 0,75 мл диметилформамида с 73 мг (0,65 ммоль) 1,4-диазабицикло[2,2,2]октана и 100 мг (0,78 ммоль) 1S,6S-2-окса-5,8 диазабицикло[4,3,0]нонана нагревают 1 ч с обратным холодильником. После этого из смеси отгоняют растворитель, к остатку добавляют немного воды и 20 мин обрабатывают в ультразвуковой бане. Нерастворенный осадок отсасывают, промывают водой и сушат при 80 С в глубоком вакууме. Выход: 164 мг (75 % от теор.). Температура плавления: 209-211 С (разл.). []D25: -250[4,3,0]нон-8-ил]-4-оксо-3-хинолинкарбоновая кислота, которую получают аналогично примеру 8. Температура плавления: 181-182 С (разл.). 1-трет-Бутил-6-фтор-1,4-дигидро-7[(1S,6R)-2-окса-5,8-диазабицикло[4,3,0]нон-8 ил]-4-оксо-3-хинолинкарбоновая кислота, которую получают аналогично примеру 8. Температура плавления: 224-226 С (разл.). 6-Фтор-1-(фтор-трет-бутил)-1,4-дигидро-7[(1S,6R)-2-окса-5,8-диазабицикло[4,3,0]нон-8 ил]-4-оксо-3-хинолинкарбоновая кислота, которую получают аналогично примеру 8. Температура плавления: 243-244 С (разл.). А) 8-Циано-1-циклопропил-6-фтор-7-[(1R,6R)-2-окса-5,8-диазабицикло[4,3,0]нон-8-ил]1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота. 1 Метод: 310 мг (1 ммоль) 7-хлор-8-циано 1-циклопропил-6-фтор-1,4-дигидро-4-оксо-3 хинолинкарбоновой кислоты с 300 мг (1,05 ммоль) дигидробромида (1R,6R)-2-окса-5,8 диазабицикло[4,3,0]-нонана и 610 мг (6 ммоль) триэтиламина в смеси из 4 мл ацетонитрила и 2 мл ДМФ нагревают 1 ч с обратным холодильником. После ТСХ и ЖХ HP не удается обнаружить следы 7-хлор-8-циано-1-циклопропил-6 фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Смесь оставляют на ночь в холодильнике для кристаллизации, осадок отсасывают,промывают водой и сушат при 80 С и при высоком вакууме. Выход: 335 мг (84 % от теор.). Температура плавления: 295-296 С (разл.). 2 Метод: 920 мг (3 ммоль) 7-Хлор-8-циано 1-циклопропил-6-фтор-1,4-дигидро-4-оксо-3 хинолинкарбоновой кислоты с 480 мг (3,75 ммоль) (1R,6R)-2-окса-5,8-диазабицикло[4,3,0]нонана и 0,9 мл триэтиламина в 25 мл ацетонитрила в атмосфере азота перемешивают 4 ч при 45 С, добавляют еще 0,5 мл триэтиламина и после этого перемешивают еще 16 ч при 60 С. Суспензию охлаждают на ледяной бане, осадок отсасывают, промывают этанолом и при 70 С сушат в вакууме. Выход: 1,05 г (88 %). Температура плавления: 294 С (разл.).(площади). Б) Гидрохлорид 8-циано-1-циклопропил-6 фтор-7-[(1R,6R)-2-окса-5,8-диазабицикло[4,3,0] нон-8-ил]-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Его получают аналогично примеру 1 В при реакции взаимодействии 8-циано-1-циклопропил-6-фтор-7-[(1R,6R)-2-окса-5,8-диазабицикло[4,3,0]нон-8-ил]-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты с соляной кислотой. Пример 13. 28 Титульное соединение получают аналогично прописи примера 5 при реакции превращения с (1S,6S)-2-окса-5,8-диазабицикло[4,3,0]нонаном. Сырой продукт чистят хроматографически на колонке (CH2Cl2/MeOH/AcOH, 10:5: 0,5), причем продукт выпадает в виде ацетатной соли. После добавления метанола и 1 Н соляной кислоты, откачки растворителя в вакууме получают кристаллический гидрохлорид. Температура плавления:250 С. Пример 14. 6-Фтор-1-1R,2S)-2-фторциклопропил)-7[(1S,6S)-2-окса-5,8-диазабицикло[4,3,0]нонан-8 ил]-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота. Титульное соединение получают аналогично прописи примера 8 при реакции превращения 6,7-дифтор-1-[(1R,2S)-2-фторциклопропил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты с[4,3,0]нонаном. Температура плавления: 250 С. Примеры 15-21. Аналогично примеру 8 при применении (1R,6S)-2-окса-5,8-диазабицикло[4,3,0]нонана получают следующие соединения, которые частично при растворении в полуконцентрированной соляной кислоте, упаривании и обработке этанолом были выделены в виде гидрохлоридов: 29 Пример 19. 6-Фтор-1-(транс-2-фторциклопропил)-1,4-дигидро-7-[(1R,6S)-2-окса-5,8-диазабицикло[4,3,0]нон-8-ил]-4-оксо-3-хинолинкарбоновая кислота (А = СН). Температура плавления: 270-274 С (разл.). Пример 20. 8-Хлор-6-фтор-1-(транс-2 фторциклопропил)-1,4-дигидро-7-[(1R,6S)-2 окса-5,8-диазабицикло[4,3,0]нон-8-ил]-4-оксо-3 хинолинкарбоновая кислота (А = ССl). Температура плавления: 160-164 С (разл.). Пример 21. 6-Фтор-1-(транс-2-фторциклопропил)-1,4-дигидро-7-[(1R,6S)-2-окса-5,8-диазабицикло[4,3,0]нон-8-ил]-4-оксо-1,8-нафтиридин-3-карбоновая кислота (А = N). Температура плавления: 310-314 С (разл.). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение композиции, содержащей в качестве действующего вещества производные хинолинкарбоновой кислоты общей формулыR1 означает алкил с числом атомов углерода от 1 до 4, при необходимости замещенный однократно или двухкратно галогеном, фенил,при необходимости замещенный одним или двумя атомами фтора, или циклопропил, при необходимости замещенный одним или двумя атомами фтора,R2 означает водород, алкил с числом атомов углерода от 1 до 4, при необходимости замещенный гидрокси-, метокси-, амино-, метиламино- или диметиламиногруппой, или означает (5-метил-2-оксо-1,3-диоксол-4-ил)метил,А означает N или C-R3, причемR3 означает водород, галоген, метил, метокси-, дифторметокси- или цианогруппу или вместе с R1 образует мостик структурыR5 означает метил или этил,R6 означает водород, амино-, гидроксигруппу, метил или галоген в форме рацематов,смеси диастереомеров или в виде чистого энантиомера или диастереомера или их фармацевтически применимого гидрата и/или соли в эффективном количестве в качестве средства для лечения Helicobacter pylori-инфекций и связанных с ними гастродуоденальных заболеваний. 30 2. Применение фармацевтической композиции по п.1, содержащей в качестве действующего вещества соединение формулы (I), в которойR1 означает трет-бутил, при необходимости замещенный однократно или двухкратно фтором, или циклопропил, при необходимости замещенный одним атомом фтора,R2 означает водород, алкил с числом атомов углерода от 1 до 4 или означает (5-метил-2 оксо-1,3-диоксол-4-ил)метил,А означает C-R3, причем R3 означает водород, фтор, метокси-, дифторметокси- или цианогруппу или вместе с R1 образует мостик структуры -O-СН 2-СН-СН 3 или -O-СН 2-N-СН 3,причем атом, помеченный значком , связан с атомом углерода А,R4 означает водород, (С 1-С 3)алкил, радикалы со структурой -СН 2 СН 2 СООR5, -CH2CH2CN,-CH2 СОСН 3, в которыхR5 означает метил или этил,R6 означает водород, аминогруппу или метил,или его фармацевтически применимый гидрат и/или соль. 3. Применение фармацевтической композиции по п.1, содержащей в качестве действующего вещества соединение формулы (I), в которойR1 означает трет-бутил, при необходимости замещенный однократно или двухкратно фтором, или циклопропил,R2 означает водород, метил или этил,А означает C-R3, причемR3 означает водород, метокси-, дифторметокси- или цианогруппу или вместе с R1 образует мостик структуры -O-СН 2-СН-СН 3 или-O-СН 2-N-СН 3, причем атом, помеченный значком , связан с атомом углерода А,R4 означает водород или метил,или его фармацевтически применимый гидрат и/или соль. 4. Применение фармацевтической композиции по пп.1-3, содержащей в качестве действующего вещества диастереомерно чистое и энантиомерно чистое соединение формулы (I). 5. Применение фармацевтической композиции по п.1, содержащей в качестве действующего вещества 8-циано-1-циклопропил-6-фтор 7-1S,6S)-2-окса-5,8-диазабицикло[4,3,0]нон-8 ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты или ее фармацевтически применимый гидрат и/или соль. 6. Применение фармацевтической композиции по п.1, содержащей в качестве действующего вещества диастереомерно чистое и энантиомерно чистое соединение формулы (I) из группы, состоящей из 8-циано-1-циклопропил 6-фтор-7-(2-окса-5,8-диазабицикло-[4,3,0]нон-8 ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты,1-циклопропил-8-дифторметокси-6 фтор-1,4-дигидро-7-(2-окса-5,8-диазабицикло[4,3,0]нон-8-ил)-4-оксо-3-хинолинкарбоновой кислоты и их фармацевтически применимых гидратов и/или солей. 7. Применение фармацевтической композиции по п.6, содержащей в качестве действующего вещества 8-циано-1-циклопропил-6-фтор 7-1S,6S)-2-окса-5,8-диазабицикло[4,3,0]-нон-8 ил)-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту или ее фармацевтически применимый гидрат и/или соль. 8. Производные хинолинкарбоновой кислоты общей формулы (II) в которой R означает циано- или дифторметоксигруппу,их диастереомеры, энантиомеры и фармацевтически применимые гидраты и соли. 9. Производное хинолинкарбоновой кислоты формулы (II), согласно п.8, отличающееся тем, что оно представляет собой 8-циано-1 циклопропил-6-фтор-7-1S,6S)-2-окса-5,8 диазабицикло[4,3,0]нон-8-ил)-1,4-дигидро-4 оксо-3-хинолинкарбоновую кислоту и ее фармацевтически применимые гидраты и/или соли.
МПК / Метки
МПК: A61K 31/4709, A61P 1/04
Метки: нафтиридонкарбоновой, 7-(2-окса-5,8-диазабицикло[4,3,0, инфекций, связанных, нон-8-ил)-хинолонкарбоновой, pylori, гастродуоденальных, кислоты, производных, helicobacter, применение, заболеваний, вызванных, лечения, ними
Код ссылки
<a href="https://eas.patents.su/17-2477-primenenie-proizvodnyh-7-2-oksa-58-diazabiciklo430-non-8-il-hinolonkarbonovojj-kisloty-i-naftiridonkarbonovojj-kisloty-dlya-lecheniya-infekcijj-vyzvannyh-helicobacter-pylori-i-svya.html" rel="bookmark" title="База патентов Евразийского Союза">Применение производных 7-(2-окса-5,8-диазабицикло[4,3,0]- нон-8-ил)-хинолонкарбоновой кислоты и -нафтиридонкарбоновой кислоты для лечения инфекций, вызванных helicobacter pylori, и связанных с ними гастродуоденальных заболеваний</a>












