Замещённые тетралины и инданы
Номер патента: 9553
Опубликовано: 28.02.2008
Авторы: Мэттьюз Джей М., Демарест Кит Т., Ли Джанг, Рибжински Филип, Чен Сяоли
Формула / Реферат
1. Соединение формулы I
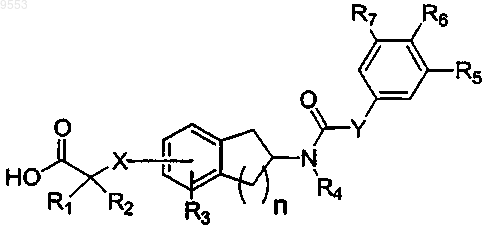
Формула I
или его фармацевтически приемлемая соль, C1-6сложный эфир или C1-6амид, где
каждый из R1 и R2 независимо представляет собой Н, C1-6алкил, или R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, представляют собой С3-7циклоалкил;
n равно 1 или 2;
X представляет собой О или S; в котором X находится в 5 или 6 положении, когда n равно 1; и в котором X находится в 6 или 7 положении, когда n равно 2;
R3 представляет собой Н, C1-6алкил, С1-3алкокси, галоген, фенил; и R3 находится в орто- или мета-положении по отношению к X;
R4 представляет собой Н или -(C1-5алкилен)R15, где R15 представляет собой Н, C1-7алкил, C1-6алкокси, С3-7алкенил, С3-6циклоалкил, [ди(C1-2алкил)амино](C1-6алкилен);
Y представляет собой NH или О;
каждый из R5 и R7 независимо выбран из Н, C1-6алкила, галогена, нитро, С1-4алкокси;
R6 выбран из C1-6алкила, галогена, гидрокси, C1-4алкокси, C1-4алкилтио, фенила, NR13R14; каждый из R13 и R14 независимо представляет собой Н или C1-6алкил;
либо R5 и R6 могут быть взяты вместе, чтобы представлять собой двухвалентный насыщенный остаток -(-CH2)3-;
где каждый из указанных выше гидрокарбильных остатков может быть замещен заместителями, в количестве, находящемся в пределах между 1 и 3, независимо выбранными из F, Cl, Br, I, амино, метила, этила, гидрокси, нитро, циано и метокси.
2. Соединение по п.1, в котором один из R1 и R2 представляет собой метил или этил.
3. Соединение по п.2, в котором каждый из R1 и R2 представляет собой метил.
4. Соединение по п.1, в котором R1 и R2, взятые вместе, представляют собой циклобутил или циклопентил.
5. Соединение по п.1, в котором R3 представляет собой Н.
6. Соединение по п.1, в котором R3 представляет собой С1-3алкокси, галоген, C1-6алкил.
7. Соединение по п.1, в котором R4 представляет собой Н или С2-7алкил.
8. Соединение по п.7, в котором R4 представляет собой Н или С2-5алкил.
9. Соединение по п.8, в котором R4 представляет собой этил.
10. Соединение по п.8, в котором R4 представляет собой Н.
11. Соединение по п.1, в котором n равно 1.
12. Соединение по п.1, в котором n равно 2.
13. Соединение по п.1, в котором Y представляет собой NH.
14. Соединение по п.1, в котором X представляет собой S.
15. Соединение по п.1, в котором X представляет собой О.
16. Соединение по п.1, в котором по меньшей мере один из R5 и R7 представляет собой Н.
17. Соединение по п.16, в котором R6 представляет собой C1-4алкил, галогенметокси, галогенметилтио или ди(С1-3алкил)амино.
18. Соединение по п.17, в котором R6 представляет собой трифторметокси, дифторметокси, трифторметил, трифторметилтио, трет-бутил, изопропил или диметиламино.
19. Соединение по п.3, в котором R3 представляет собой Н, R4 представляет собой С2-7алкил и Y представляет собой NH.
20. Соединение по п.19, в котором X представляет собой S.
21. Соединение по п.19, в котором n равно 1.
22. Соединение по п.19, в котором n равно 2.
23. Соединение по п.19 в котором R4 представляет собой С2-5алкил.
24. Соединение по п.23, в котором R4 представляет собой этил.
25. Соединение по п.19, в котором R6 представляет собой трифторметокси, дифторметокси, трифторметил, трифторметилтио, трет-бутил, изопропил или диметиламино.
26. Соединение по п.1, в котором
каждый из R1 и R2 независимо представляет собой Н, C1-6алкил;
n равно 1 или 2;
X представляет собой О или S; в котором X находится в 5 или 6 положении, когда n равно 1; и в котором X находится в 6 или 7 положении, когда n равно 2;
R3 представляет собой Н, фенил, С1-3алкокси, галоген, C1-6алкил, и R3 находится в орто- или мета-положении по отношению к X;
R4 представляет собой Н или -(C1-5алкилен)R15, в котором R15 представляет собой Н, C1-7алкил,
C1-6алкокси, С3-7алкенил, С3-6циклоалкил, [ди(С1-2алкил)амино](C1-6алкилен);
Y представляет собой NH;
каждый из R5 и R7 независимо выбран из Н, C1-6алкила, галогена, C1-4алкокси;
R6 выбран из C1-6алкила, галогена, C1-4алкокси, C1-4алкилтио, фенила, NR13R14;
каждый из R13 и R14 независимо представляет собой Н или C1-6алкил;
в котором каждый из указанных выше гидрокарбильных остатков может быть замещен заместителями в количестве, находящемся в пределах между 1 и 3, независимо выбранными из F, Cl, амино, метила, этила, гидрокси и метокси.
27. Соединение по п.1, выбранное из
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[1-этил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-пентил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил}пропионовой кислоты;
2-{2-[1-этил-3-(4-изопропилфенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-пентил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[3-(4-диметиламинофенил)-1-этилуреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-(3-метилбутил)-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[3-(4-изопропилфенил)-1-(3-метилбутил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-пент-4-енил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}пропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метокси-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-фтор-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-хлор-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-бром-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метил-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты и
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-трифторметокси-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты.
28. Соединение по п.1, выбранное из
2-метил-2-{2-[1-гексил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил}пропионовой кислоты;
2-{2-[3-(4-диметиламинофенил)-1-пентилуреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}пропионовой кислоты;
2-метил-2-{2-[1-пропил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}пропионовой кислоты;
2-метил-2-{2-[1-бутил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил}пропионовой кислюты;
2-{2-[3-(4-изопропилфенил)-1-(3-пентил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[3-(4-трет-бутилфенил)-1-(3-пентил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-[2-(3-(бифенил-4-ил-1-пентил)уреидо)индан-5-илсульфанил]-2-метилпропионовой кислоты;
2-{2-[3-(4-изопропилфенил)-1-(3-гексил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-бутил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}пропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метокси-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-фтор-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-хлор-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-бром-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метил-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты и
2-метил-2-{2-[1-гексил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}пропионовой кислоты.
29. Соединение по п.1, выбранное из
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-фтор-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метил-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[1-этил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты и
2-метил-2-{2-[1-пропил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}пропионовой кислоты.
30. Соединение по п.1, выбранное из
2-{2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[1-этил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-пропил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}пропионовой кислоты и
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-фтор-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты.
31. Фармацевтическая композиция, обладающая PPAR агонистической активностью, содержащая соединение по пп.1, 19, 26, 27, 29 или 30.
32. Способ лечения или ингибирования развития заболевания, опосредуемого АППР альфа, включающий введение пациенту, нуждающемуся в лечении, фармацевтически эффективного количества композиции, содержащей соединение по пп.1, 19, 26, 27 или 30.
33. Способ по п.32, где указанное заболевание, опосредуемого АППР альфа, выбирают из дислипидемии и сердечно-сосудистых заболеваний.
34. Способ по п.33, в котором указанным заболеванием является дислипидемия.
35. Способ по п.34, в котором указанную дислипидемию выбирают из гиперлипидемии I стадии, предклинической гиперлипидемии, гиперлипидемии II стадии, гиперхолестеринемии, гипо-ЛПВП-холестеринемии и гипертриглицеридемии.
36. Способ по п.33, в котором указанным сердечно-сосудистым заболеванием является атеросклероз, болезнь коронарной артерии, коронарная болезнь сердца или гипертензия.
37. Способ по пп.32, 34 или 35, дополнительно включающий стадию введения пациенту совместно-эффективного количества агента, снижающего жиры.
38. Способ по пп.32, 34, 35 или 37, дополнительно включающий стадию введения пациенту совместно-эффективного количества агента, снижающего кровяное давление.
Текст
009553 Перекрестные ссылки на родственные заявки Заявка на данное изобретение представляет собой непредварительную заявку на патент предварительной заявки на патент США 60/419935, поданной 21 октября 2002 г., и предварительной заявки на патент США 60/495270, поданной 15 августа 2003 г., озаглавленную Замещенные тетралины и инданы. Область техники, к которой относится изобретение Данное изобретение относится к замещенным производным тетралина и индана, содержащим их композициям и способам их применения. Уровень техники Член семейства ядерных рецепторов, группы активированных лигандом транскрипционных факторов, активированный пролифератором пероксима рецептор альфа (АППР альфа) является необходимым транскрипционным фактором, регулирующим гены, относящиеся к метаболизму жирных кислот и действию инсулина. АППР альфа рецепторы находят преимущественно в печени. Гены, регулируемые АППР альфа,включают ферменты, вовлеченные в бета-окисление жирных кислот, транспортного белка жирных кислот печени, и аро А 1, важного компонента липопротеинов высокой плотности (ЛПВП). Селективно,агонисты АППР альфа с высоким сродством увеличивают окисление жирных кислот печени, что, в свою очередь, снижает циркуляцию триглицеридов и свободных жирных кислот. Снижение циркуляции триглицеридов может медиировать видимое снижение, или улучшение, устойчивости к инсулину у устойчивых к инсулину или диабетических животных при лечении агонистами АППР альфа. Такое лечение в моделях ожирения у животных связано с потерей веса. Фибраты, которые известны как лекарственные средства, применяемые при гиперлипидемии, являются слабыми агонистами АППР альфа. Примеры известных агонистов АППР альфа, применяемые при гиперлипидемии, диабете или атеросклерозе, включают фибраты, такие как фенофибрат (Fournier), гемфиброзил (Parke-Davis/Pfizer, Mylan, Watson), клофибрат (Wyeth-Ayerst, Novopharm), безафибрат и ципрофибрат и уреидофибраты, такие как GW 7647, GW 9578 и GW 9820 (GlaxoSmithKline). Сущность изобретения Изобретение относится к соединениям формулы (I) ниже Формула (I) или к их фармацевтически приемлемой соли, их C1-6 сложному эфиру или C1-6 амиду, где каждый из R1 и R2 независимо является Н, C1-6 алкилом, (CH2)mNRaRb, (CH2)mOR8, (CH2)mNH(CO)R8 или (CH2)mCO2R8, где каждый из Ra, Rb и R8 независимо является Н или C1-6 алкилом, илиR3 является Н, фенилом, С 1-3 алкокси, С 1-3 алкилтио, галогеном, циано, C1-6 алкилом, нитро, NR9R10,NHCOR10, CONHR10 и COOR10; и R3 находится в положении орто или мета относительно X;R4 является Н или -(С 1-5 алкилен)R15, где R15 является Н, С 1-7 алкилом, [ди(С 1-2 алкил)амино](С 1-6 алкиленом), (С 1-3 алкоксиацил)(C1-6 алкиленом), С 1-6 алкокси, С 3-7 алкенилом или С 3-8 алкинилом, где R4 содержит не более чем 9 атомов углерода; R4 может также быть -(С 1-5 алкилен)R15, где R15 является С 3-6 циклоалкилом, фенилом, фенил-О-, фенил-S- или 5-6-членным гетероциклилом, содержащим 1 или 2 гетероатома, выбранных из N, О и S;Y является NH, NH-CH2 или О; каждый из R5 и R7 независимо выбирают из Н, С 1-6 алкила, галогена, циано, нитро, COR11, COOR11,С 1-4 алкокси, С 1-4 алкилтио, гидрокси, фенила, NR11R12 и 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранных из N, О и S;N, О и S; кроме того, либо R5 и R6, либо R6 и R7 могут быть взяты вместе с образованием двухвалентной группы, насыщенной или ненасыщенной, выбранной из -(СН 2)3-, -(СН 2)4- и (СН 1-2)pN(CH1-2)q,р равно 0-2 и q равно 1-3, где сумма (p+q) составляет по крайней мере 2; каждый из R9 и R10 независимо является С 1-6 алкилом;-1 009553 каждый из R11, R12, R13 и R14 независимо является Н или C1-6 алкилом; где каждая из указанных выше гидрокарбильных и гетерокарбильных групп может быть замещена 1-3 заместителями, независимо выбранными из F, Cl, Br, I, амино, метила, этила, гидрокси, нитро, циано и метокси. Изобретение также относится к композициям, которые включают одно или более соединений формулы (I) и фармацевтический носитель или наполнитель. Эти соединения и способы, представленные ниже, также могут включать дополнительные фармацевтически приемлемые агенты, такие как агенты, снижающие уровень липидов, или агенты, понижающие кровяное давление, или оба. Другой аспект данного изобретения включает способы применения описанных соединений или композиций в различных методах профилактики, лечения или ингибирования развития заболеваний, медиированных АППР альфа. Примеры заболеваний, медиированных АППР альфа, включают дислипидемию и атеросклероз. Дислипидемия включает гипертриглицеридемию, гиперхолестеринемию, смешанную гиперлипидемию и гипо-ЛПВП-холестеринемию. Например, дислипидемия может включать одну или более из следующих характеристик: низкое содержание ЛПВП (35 или 40 мг/дл), высокий уровень триглицеридов (200 мг/дл) и высокий уровень ЛПНП (150 мг/дл). Дополнительные характеристики и преимущества данного изобретения будут видны из представленных ниже подробного описания, примеров и формулы изобретения. Подробное описание А. Термины. Ниже даны определения терминов и их применения в описании. Алкил включает необязательно замещенные углеводороды с прямой и разветвленной цепью, содержащие по крайней мере один атом водорода, удаленный для образования радикальной группы. Алкильные группы включают метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, 1-метилпропил,пентил, изопентил, втор-пентил, гексил, гептил, октил и так далее. Алкил включает циклоалкил, такой как циклопропил, циклобутил, циклопентил и циклогексил. Алкенил включает необязательно замещенные углеводороды с прямой и разветвленной цепью,такие как описаны выше, содержащие по крайней мере одну двойную связь углерод-углерод (sp2). Алкенилы включают этенил (или винил), проп-1-енил, проп-2-енил (или аллил), изопропенил (или 1 метилвинил), бут-1-енил, бут-2-енил, бутадиенилы, пентенилы, гекса-2,4-диенил и так далее. Углеводородные радикалы, содержащие смесь двойных связей и тройных связей, такие как 2-пентен-4-инил,представлены как алкинилы. Алкенил включает циклоалкенил. В данное изобретение также включены цис и транс, или (Е) и (Z) формы. Алкинил включает необязательно замещенные углеводороды с прямой и разветвленной цепью,такие как описаны выше, содержащие по крайней мере одну тройную связь углерод-углерод (sp). Алкинилы включают этинил, пропинилы, бутинилы и пентинилы. Углеводородные радикалы, содержащие смесь двойных связей и тройных связей, такие как 2-пентен-4-инил, представлены как алкинилы. Алкинил не включает циклоалкинил. Алкокси включает необязательно замещенные алкильные группы с прямой и разветвленной цепью, содержащие на конце атом кислорода, связывающий алкильную группу с остальной молекулой. Алкокси включает метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, пентокси и так далее. Аминоалкил, тиоалкил и сульфонилалкил являются аналогами алкокси, где конечный атом кислорода алкокси заменен на, соответственно, NH (или NR), S и SO2. Гетероалкил включает алкокси, аминоалкил, тиоалкил и так далее. Арил включает фенил, нафтил, бифенилил, тетрагидронафтил, инденил и так далее, любой из которых может быть необязательно замещен. Арил также включает арилалкильную группу, такую как бензил, фенетил и фенилпропил. Арил включает кольцевые системы, содержащие необязательно замещенное 6-членное карбоциклическое ароматическое кольцо, где указанная система может быть бициклической, мостиковой и/или конденсированной. Система может включать кольца, которые являются ароматическими или частично или полностью насыщенными. Примеры кольцевых систем включают инденил,пенталенил, 1-4-дигидронафтил, инданил, бензимидазолил, бензотиофенил, индолил, бензофуранил, изохинолинил и так далее. Гетероциклил включает необязательно замещенные ароматические и неароматические кольца,содержащие в кольце атомы углерода и по крайней мере один гетероатом (О, S, N) или группу с гетероатомом (SO2, CO, CONH, COO). Если не указано иначе, гетероциклический радикал может иметь валентность, связывающую его с остальной молекулой через атом углерода, такую как 3-фурил или 2 имидазолил, или через гетероатом, такую как N-пиперидил или 1-пиразолил. Предпочтительно моноциклический гетероциклил содержит от 5 до 7 атомов в кольце или от 5 до 6 атомов в кольце; может быть от 1 до 5 гетероатомов или групп, включающих гетероатом, в кольце и предпочтительно от 1 до 3 или 1-2. Гетероциклил может быть насыщенным, ненасыщенным, ароматическим (например, гетероарил), неароматическим или конденсированным. Гетероциклил также включает конденсированные, например, бициклические кольца, такие как не-2 009553 обязательно конденсированные с необязательно замещенным карбоциклическим или гетероциклическим пяти- или шестичленным ароматическим кольцом. Например, гетероарил включает необязательно замещенное шестичленное гетероароматическое кольцо, содержащее 1, 2 или 3 атома азота, конденсированное с необязательно замещенным пяти- или шестичленным карбоциклическим или гетероциклическим ароматическим кольцом. Такие гетероциклические пяти- или шестичленные ароматические кольца,конденсированные с указанными пяти- или шестичленными ароматическими кольцами, могут содержать 1, 2 или 3 атома азота, если это шестичленное кольцо, или 1, 2 или 3 гетероатома, выбранных из кислорода, азота и серы, если это пятичленное кольцо. Примеры гетероциклилов включают тиазолил, фурил, тиенил, пиранил, изобензофуранил, пирролил, имидазолил, пиразолил, изотиазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолизинил, изоиндолил, индолил, индазолил, пуринил, хинолил, фуразанил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидил, пиперазинил, индолинил и морфолинил. Например, предпочтительные гетероциклилы или гетероциклические радикалы включают морфолинил, пиперазинил, пирролидинил, пиридил, циклогексилимино, тиенил и, более предпочтительно, пиперидил или морфолинил. Примеры, иллюстрирующие гетероарил, включают тиенил, фуранил, пирролил, имидазолил, оксазолил, тиазолил, бензотиенил, бензофуранил, бензимидазолил, бензоксазолил, бензотиазолил. Ацил относится к карбонильной группе, присоединенной либо к атому водорода (т.е. формильной группе), либо к необязательно замещенной алкильной или алкенильной цепи, либо к гетероциклилу. Галоген включает фтор, хлор, бром и йод, и предпочтительно фтор или хлор, в качестве заместителя алкильной группы, включающей один или более атомов галогена, такой как трифторметил, трифторметокси, трофторметилтио, дифторметокси или фторметилтио. Алкандиил или алкилен включают необязательно замещенные двухвалентные алкановые радикалы с прямой или разветвленной цепью, такие как, например, метилен, этилен, пропилен, бутилен, пентилен или гексилен. Алкендиил включает, аналогично описанным выше, необязательно замещенные двухвалентные алкеновые радикалы с прямой или разветвленной цепью, такие как, например, пропенилен, бутенилен,пентенилен или гексенилен. В таких радикалах атом углерода, связанный с атомом азота, предпочтительно не должен быть ненасыщенным. Ароил относится к карбонильной группе, присоединенной к необязательно замещенной арильной или гетероарильной группе, где арил и гетероарил такие, как определены выше. В частности, бензоил является фенилкарбонилом. Как определено выше, два радикала вместе с атомом (атомами), к которому они присоединены, могут образовывать необязательно замещенные 4-7-, 5-7- или 5-6-членные кольца, карбоциклические или гетероциклические кольца, где такие кольца могут быть насыщенными, ненасыщенными или ароматическими. Указанные кольца могут быть такими, как определены выше в разделе Сущность изобретения. Конкретные примеры таких колец представлены в следующем разделе. Фармацевтически приемлемые соли, сложные эфиры и амиды включают карбоксилатные соли,кислотно-аддитивные соли аминокислот, сложные эфиры и амиды, которые, в пределах разумного соотношения польза/риск, являются фармакологически эффективными и подходят для контакта с тканями пациента, не вызывая токсичности, раздражения или аллергической реакции. Такими солями, эфирами и амидами могут быть, например, С 1-8 алкильные, С 3-8 циклоалкильные, арильные, С 2-10 гетероарильные или С 2-10 неароматические гетероциклические соли, сложные эфиры и амиды. Соли, свободные кислоты и сложные эфиры являются более предпочтительными, чем амиды, образованные по концевой группе карбоксилата/карбоновой кислоты в левой части формулы (I). Примеры солей включают гидробромид, гидрохлорид, сульфат, бисульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат,бензоат, лактат, фосфат, тозилат, цитрат,малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактиобионат и лаурилсульфонат. Они могут включать катионы щелочных металлов и щелочно-земельных металлов, таких как натрий, калий, кальций и магний, а также нетоксичный аммоний, четвертичный аммоний, и катионы амина, такие как тетраметиламмоний, метиламин, триметиламин и этиламин. См., например, S.M. Berge, et al., "Pharmaceuticals Salts", J. Pharm. Sci., 1977, 66: 1-19, которая включена сюда в качестве ссылки. Примеры фармацевтически приемлемых амидов в соответствии с данным изобретением включают амиды, производные аммиака, первичных C1-6 алкиламинов и вторичных ди(C1-6 алкил)аминов. Вторичные амины включают 5- или 6-членные гетероциклические или гетероароматические кольца, содержащие по крайней мере один атом азота и необязательно от 1 до 2 дополнительных гетероатомов. Предпочтительные амиды получают из аммиака, С 1-3 алкил первичных аминов и ди(С 1-2 алкил)аминов. Примеры фармацевтически приемлемых сложных эфиров в соответствии с данным изобретением включают C1-7 алкил, С 5-6 циклоалкил, фенил и фенил(C1-6)алкиловые эфиры. Предпочтительными сложными эфирами являются метиловый и этиловый эфиры. Пациент или объект относится к млекопитающим, таким как человек и животные (собаки,кошки, лошади, крысы, кролики, мыши, нечеловекообразные приматы), у которых имеется необходимость наблюдения, эксперимента, лечения или профилактики релевантных заболеваний или состояний.-3 009553 Предпочтительно пациентом или объектом является человек. Композиция включает продукт, содержащий определенные ингредиенты в определенных количествах, а также любой продукт, который получается при сочетании определенных ингредиентов в определенных количествах. Терапевтически эффективное количество означает такое количество активного соединения или фармацевтического агента, которое вызывает биологический или медицинский ответ в системе тканей животных или человека, который ожидается исследователем, ветеринаром, врачом или другим клиницистом, который включает облегчение симптомов лечимого состояния или расстройства. Что касается различных радикалов, представленных в данном описании и в формуле изобретения,необходимо внести три основных замечания. Первое замечание касается валентности. Как и со всеми углеводородными радикалами, являются ли они насыщенными, ненасыщенными или ароматическими,или являются ли они нециклическими, прямыми или разветвленными, а также как и со всеми гетероциклическими радикалами, каждый радикал включает замещенные радикалы этого типа и одновалентные,двухвалентные и многовалентные радикалы, как отмечено в контексте формулы изобретения. В контексте сказано, что заместителем является алкилен или углеводородный радикал по крайней мере с двумя удаленными атомами водорода (двухвалентный) или большим количеством удаленных атомов водорода(многовалентный). Примером двухвалентного радикала, связывающего две части молекулы, является Y в формуле (I),который связывает фенил, замещенный R5, R6 и R7 с остальной частью молекулы. Во-вторых, считают, что радикалы или фрагменты структуры, такие как описаны здесь, включают замещенные радикалы или фрагменты структуры. Гидрокарбилы включают одновалентные радикалы,содержащие атомы углерода и атомы водорода, такие как алкил, алкенил, алкинил, циклоалкил и циклоалкенил (ароматический или ненасыщенный), а также соответствующие двухвалентные (или многовалентные) радикалы, такие как алкилен, алкенилен, фенилен и т.д. Гетерокарбилы включают одновалентные и двухвалентные (или многовалентные) радикалы, содержащие углерод, необязательно, водород и по крайней мере один гетероатом. Примеры одновалентных гетерокарбилов включают ацил, ацилокси,алкоксиацил, гетероциклил, гетероарил, ароил, бензоил, диалкиламино, гидроксиалкил и т.д. Если в качестве примера используется алкил, считается, что алкил включает замещенный алкил, имеющий один или более заместитель, например от 1 до 5, от 1 до 3 и от 2 до 4 заместителей. Заместители могут быть одинаковые (дигидрокси, диметил), подобные (хлорфтор) или различные (хлорбензил- или аминометилзамещенные). Примеры замещенного алкила включают галогеналкил (такой как фторметил, хлорметил, дифторметил, перхлорметил, 2-бромэтил, трифторметил и 3-йодциклопентил), гидроксиалкил(такой как гидроксиметил, гидроксиэтил, 2-гидроксипропил), аминоалкил (такой как аминометил, 2 аминоэтил, 3-аминопропил и 2-аминопропил), нитроалкил, алкилалкил и т.д. Ди(C1-6 алкил)аминогруппа включает независимо выбранные алкильные группы, которые образуют, например, метилпропиламино и изопропилметиламино, а также диалкиламиногруппы, имеющие две одинаковые алкильные группы, такие как диметиламино или диэтиламино. В-третьих, включены только стабильные соединения. Например, если имеется группа NR11R12 и R может быть алкенильной группой, двойная связь отделена от атома азота по крайней мере одним атомом углерода, для исключения образования енамина. Также если -(СН 2)p-N-(CH2)q- является ненасыщенной, соответствующий атом(ы) водорода включен или исключен, как показано в -(СН 2)-N=(СН)-(СН 2)- или -(СН 2)-NH-(СН)=(СН)-. Соединения в соответствии с данным изобретением описаны в следующем разделе. В. Соединения. Данное изобретение представляет композиции и способы применения соединений формулы (I),описанной в разделе Сущность изобретения выше. Примеры включают соединения, в которых: (а) один из R1 и R2 является метилом или этилом; (b) каждый из R1 и R2 является метилом; (с) R1 и R2, взятые вместе, образуют циклобутил или циклопентил; (d) R3 является Н; (е) R4 является Н или С 2-7 алкилом;Y является NHCH2; (k) Y является NH; (l) X является S; (m) X является О; (n) по крайней мере один из R5 и R7 является Н; (о) R6 является С 1-4 алкилом, галогенметокси или галогентиометокси; (р) R6 является трет-бутилом, изопропилом, трифторметилом, трифторметокси, трифтортиометокси, дифторметокси или диметиламино; (q) R3 является Н, R4 является С 2-7 алкилом и Y является NH; (r) R4 является С 2-5 алкилом;(S) энантиомер в положении С-2 индана или тетралина; (u) (R) энантиомер в положении С-2 индана или тетралина; (v) R15 является С 1-7 алкилом, [ди(C1-2 алкил)амино](С 1-6 алкиленом), (С 1-3 алкоксиацил)(C1-6 алкиленом), C1-6 алкокси, С 3-7 алкенилом или С 3-8 алкинилом; (w) R6 является трифторметилтио или трифторметокси; или (х) сочетания указанных выше. Дополнительные предпочтительные соединения включают сложный этиловый эфир 3-(1-карбокси-1-метилэтилсульфанил)-7-[1-этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты; 2-6-[этил-(4-трифторметоксифеноксикарбонил)амино]-3-фтор-5,6,7,8-тетрагидронафталин-2 илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метокси-5,6,7,8-тетрагидронафталин-2 илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-хлор-5,6,7,8-тетрагидронафталин-2 илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-бром-5,6,7,8-тетрагидронафталин-2 илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метил-5,6,7,8-тетрагидронафталин-2 илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-трифторметокси-5,6,7,8-тетрагидронафталин-2 илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-гидроксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2 метилпропионовую кислоту; 2-6-[(4-аминофенил)-1-этилуреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2 метилпропионовую кислоту. Наиболее предпочтительные соединения выбирают из 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2 метилпропионовой кислоты; 2-6-[3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2 метилпропионовой кислоты; 2-2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовой кислоты; 2-2-[1-этил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил-2 метилпропионовой кислоты; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-фтор-5,6,7,8-тетрагидронафталин-2 илсульфанил-2-метилпропионовой кислоты и 2-метил-2-2-[1-пропил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилпропионовой кислоты.-5 009553 Родственные соединения. В данном изобретении представлены описанные соединения и близкородственные фармацевтически приемлемые формы описанных соединений, такие как соли, сложные эфиры, амиды, кислоты, гидраты или сольватированные формы; маскированные или защищенные формы; и рацемические смеси или энантиомерно или оптически чистые формы. Родственные соединения также включают соединения в соответствии с данным изобретением, которые были модифицированы для обнаружения, например, меченые изотопами 18F для применения в качестве зонда в позитронной эмиссионной томографии (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ). Данное изобретение также включает соединения, имеющие одну или более функциональных группand Wuts, Protective Groups in Organic Synthesis, 3rd ed., (1999) John WileySons, NY. Некоторые из таких маскированных или защищенных соединений являются фармацевтически приемлемыми; другие применяются в качестве промежуточных соединений. Синтетические промежуточные соединения и способы,описанные здесь, и их незначительные модификации также включены в объем данного изобретения. Защитные группы для гидроксила Защита гидроксильной группы включает метиловые эфиры, замещенные метиловые эфиры, замещенные этиловые эфиры, замещенные бензиловые эфиры и силиловые эфиры. Замещенные метиловые эфиры. Примеры замещенных метиловых эфиров включают метилоксиметил, метилтиометил, третбутилтиометил, бензилоксиметил, п-метоксибензилоксиметил, (4-метоксифенокси)метил, третбутоксиметил. Замещенные этиловые эфиры. Примеры замещенных этиловых эфиров включают 1-этоксиэтил, 1-метил-1-метоксиэтил, 1-метил 1-бензилоксиэтил, 2,2,2-трихлорэтил, трет-бутил, аллил, п-хлорфенил, п-метоксифенил и бензил. Замещенные бензиловые эфиры. Примеры замещенных бензиловых эфиров включают п-метоксибензил, 3,4-диметоксибензил, пгалогенбензил, 2,6-дихлорбензил, п-цианобензил, п-фенилбензил, дифенилметил. Сложные эфиры. В дополнение к эфирам, гидроксильная группа может быть защищена сложным эфиром. Примеры сложных эфиров включают формиат, бензоилформиат, ацетат, трихлорацетат, трифторацетат, метоксиацетат, феноксиацетат, п-хлорфеноксиацетат, бензоат. Сульфонаты. Примеры сульфонатов включают сульфат, метансульфонат (мезилат), бензилсульфонат и тозилат. Защитные группы для аминогруппы Защита аминогрупп включает карбаматы, амиды и специальные -NH защитные группы. Примеры карбаматов включают метил- и этилкарбаматы, замещенные этилкарбаматы, карбаматы,способствующие расщеплению, карбаматы фотолитического расщепления, производные типа мочевины и разнообразные карбаматы. Карбаматы. Примеры метил- и этилкарбаматов включают метил и этил, 9-флуоренилметил и 4-метоксифенацил. Замещенный этил. Примеры замещенных этилкарбаматов включают 2,2,2-трихлорэтил, 2-фенилэтил, трет-бутил, винил, аллил, 1-изопропилаллил, бензил, п-метоксибензил, п-нитробензил, п-бромбензил, п-хлорбензил,2,4-дихлорбензил и дифенилметил. Фотолитически отщепляемая защита. Примеры фотолитически отщепляемой защиты включают м-нитрофенил, 3,5-диметоксибензил, онитробензил, 3,4-диметокси-6-нитробензил и фенил(о-нитрофенил)метил. Амиды. Примеры амидов включают N-формил, N-ацетил, N-трихлорацетил, N-трифторацетил, Nфенилацетил, N-3-фенилпропионил, N-пиколиноил, N-3-пиридилкарбоксамид, N-бензоил, N-пфенилбензоил и фталоил. Защита карбонильной группы Циклические ацетали и кетали. Примеры циклических ацеталей и кеталей включают 1,3-диоксаны и 5-метилен-1,3-диоксан. Защита карбоксильной группы Сложные эфиры. Замещенные метиловые эфиры. Примеры замещенных метиловых эфиров включают 9-флуоренилметил, метоксиметил, метилтиометил, метоксиэтоксиметил, 2-(триметилсилил)этоксиметил, бензилоксиметил, фенацил, п-бромфенацил,-метилфенацил и п-метоксифенацил. Примеры сложных эфиров также включают прямые или разветвленные алкиловые эфиры, такие как трет-бутиловый, этиловый, пропиловый, изопропиловый и бутиловый.-6 009553 Замещенные бензиловые эфиры. Примеры замещенных бензиловых эфиров включают трифенилметил, дифенилметил, 9 антрилметил, 2,4,6-триметилбензил, п-бромбензил, о-нитробензил, п-нитробензил, п-метоксибензил, 2,6 диметоксибензил, пиперонил, 4-пиколил и п-Р-бензил. Силиловые эфиры. Примеры силиловых эфиров включают триметилсилил, триэтилсилил, трет-бутилдиметилсилил,изопропилдиметилсилил, фенилдиметилсилил и ди-трет-бутилметилсилил. С. Методы синтеза. В данном изобретении представлены способы получения описанных соединений согласно традиционным методам органического синтеза, а также матричным или комбинаторным методам. На схемах 1-10 представлены предлагаемые методы синтеза. Применяя эти схемы, прилагаемые пояснения и примеры,специалист в данной области техники может разработать аналогичные или подобные методы для данных соединений, которые не выйдут за рамки данного изобретения. Специалист в данной области техники поймет, что синтез соединений в соответствии с данным изобретением может проводиться с применением коммерчески доступных промежуточных соединений или защищенных промежуточных соединений, описанных на любой из представленных здесь схем. Специалист в данной области техники также поймет, что во время любого процесса получения соединений в соответствии с данным изобретением, может быть необходимо и/или желательно защищать чувствительные или реакционноспособные группы любых вовлеченных молекул. Это может быть достигнуто применением обычных защитных групп, таких как описаны в Protective Groups in Organic Synthesis, JohnWileySons, 1991. Такие защитные группы могут быть удалены на соответствующей стадии с применением методов, известных в данной области техники. Примеры описанных способов синтеза включают примеры синтеза 1-57. Соединения, аналогичные целевым соединениям данных примеров, могут быть, и во многих случаях, получены подобными методами. Описанные соединения применяют в базовых исследованиях и в качестве фармацевтических агентов, описанных в следующем разделе. Общее руководство. Предпочтительный синтез соединения формулы 14, если X является S (и R3 является Н), представлен на схемах 1-5. Аббревиатуры или акронимы, применяемые ниже, включают: АсОН (ледяная уксусная кислота); Согласно схеме 1 тетралины могут быть получены превращением соединения 1 в соединение 2. Например, метокси-2-тетралон, такой как 6-метокси-2-тетралон, может быть обработан реагентом, таким как ацетат аммония, или аммиак, или гидроксиламин. Соответствующий имин может быть восстановлен соответствующим восстанавливающим агентом, таким как боргидрид натрия, цианоборгидрид натрия,триацетоксиборгидрид натрия, и полученный оксим может быть восстановлен каталитическим методом с применением палладия или платины в полярном протонном растворителе, таком как метанол, этанол или этилацетат, с получением рацемического соединения 2. Получение гидрохлорида может быть легко проведено специалистом в данной области техники. Согласно схеме 2 инданы могут быть получены превращением соединения 3 в соединение 5. Например, когда метоксиинданон, такой как 5-метокси-1-инданон, обрабатывают ацилирующим агентом,таким как бутилнитрит или изоамилнитрит, в присутствии каталитического количества кислоты, такой как хлористо-водородная кислота или бромисто-водородная кислота, в полярном растворителе, таком как метанол или эфир, получают кето-оксим 4. Восстановление соединения 4 может быть достигнуто с применением соответствующего восстанавливающего агента (агентов), такого как алюмогидрид лития или водород, и катализатора, такого как палладий или платина, в соответствующем растворителе, таком как уксусная кислота-серная кислота, ТГФ или метанол, при подходящей температуре. Выбор метода получения соли определяет специалист в данной области техники. Схема 3 Согласно схеме 3 соединение 2 или 5 может быть превращено в соединение 12. Например, когда рацемический гидрохлорид амина обрабатывают основанием, таким как гидрид натрия или гидрид лития, в полярном апротонном растворителе, таком как ДМФА или ТГФ, и подвергают взаимодействию с ангидридом, таким как фталевый ангидрид, при повышенных температурах, получают циклический имид 6. Расщепление метилариловых эфиров формулы 6 до соединения формулы 7 может проводиться с применением кислоты Льюиса, такой как трибромид бора, трихлорид бора, хлорид алюминия или триметилсилилйодид, в неполярном апротонном растворителе, таком как толуол, дихлорметан или дихлорэтан,с или без охлаждения. Ацилирование фенолов формулы 7 до соединения формулы 8 может проводиться с применением хлоридов тиокарбамоила, таких как хлорид диметиламинотиокарбамоила или хлорид диэтилтиокарбамоила, и нереакционноспособного третичного амина, такого как триэтиламин, 1,8 диазабицикло[5.4.0]ундек-7-ен или 1,4-диазабицикло[2.2.2]октан, в апротонном растворителе, таком как дихлорметан, ДМФА или ТГФ, с или без охлаждения. Соединения формулы 8 могут быть термически перегруппированы в соединения формулы 9 при температурах от 180 до 350 С, либо в чистом виде, либо в расплаве, или с применением растворителей с высокой температурой кипения, таких как DOWTHERM А (смесь бифенила и бифенилового эфира, коммерчески доступная от, например, Fluka Chemical Corp., Milwaukee, WI USA), N,N-диметиланилин, дифениловый эфир или декалин. Соединения формулы 10 могут быть получены из соединений формулы 9 обработкой подходящим нуклеофилом, таким как гидразин, динатрийсульфид или метиламин, в соответствующем полярном растворителе, таком как этанол или ТГФ, при повышенных температурах. Превращение соединения формулы 10 в соединения формулы 11 проводится с применением соответствующего реагента, такого как гидроксид калия, в спир-8 009553 товом растворителе, таком как этанол или метанол, или такого как алюмогидрид лития в ТГФ или эфире,с последующим алкилированием с применением соответствующим образом замещенного алкилгалогенида, такого как трет-бутил-2-бромизобутират, этилбромацетат или этил-2-бромбутират, и восстанавливающего агента, такого как боргидрид лития или боргидрид натрия. Соединения формулы 11 могут быть замещены с получением соединений формулы 12 с применением карбоновой кислоты или хлорангидрида, и соответствующего восстанавливающего агента, такого как боран-ТГФ или боран-диметилсульфид,с применением апротонного растворителя, такого как ТГФ, дихлорметан или гексан. Альтернативно,замещение может проводиться с применением альдегида и восстанавливающего агента, такого как цианоборгидрид натрия или триацетоксиборгидрид натрия, в подходящем апротонном растворителе, таком как ТГФ, дихлорметан или дихлорэтан. Схема 4 Согласно схеме 4 соединения формулы 13 могут быть получены из соединений формулы 12 ацилированием вторичного амина арилуксусной кислотой, с применением тионилхлорида или оксалилхлорида, чистого или в толуоле или дихлорметане, с или без каталитического ДМФА. Альтернативно, сочетание может быть проведено с применением стандартных пептидных условий, таких как EDC, DCC илиDIC в дихлорметане. Если Y равно NH или О, может применяться арилизоцианат или арилхлорформиат,соответственно, в неполярном апротонном растворителе, таком как ТГФ, дихлорметан или гексан, с получением соединений формулы 13. Выбор метода снятия защиты для получения соединений формулы 14 легко определяется специалистом в данной области техники. Схема 5 Также, соединения формулы 16 могут быть получены из соединений формулы 11 ацилированием первичного амина, как показано на схеме 5, с получением соединений формулы 15. Выбор методов снятия защиты легко определит специалист в данной области техники и получит соединения формулы 16. Соединение формулы 18 может быть получено из соединения формулы 10, как показано на схеме 6. Например, соединение формулы 10 может быть обработано этилформиатом или формиатом аммония,чистым или в присутствии подходящего растворителя, такого как дихлорметан или дихлорэтан, при нагревании или без такового, с получением соединения формулы 17. Соединения формулы 17 могут быть превращены в соединения формулы 18 с помощью подходящего реагента, такого как алюмогидрид лития, в подходящем растворителе, таком как ТГФ или эфир, с последующим алкилированием с применением соответствующим образом замещенного алкилгалогенида, такого как трет-бутил-2 бромизобутират, этилбромацетат или этил-2-бромбутират, и восстанавливающего агента, такого как боргидрид лития или боргидрид натрия. Схема 7 Предпочтительный синтез соединений формулы 21, когда X является О (и R3 является Н), представлен на схеме 7. Например, когда соединения формулы 2 или 5 ацилируют с карбоновой кислотой или хлорангидридом, как описано выше, получают соединения формулы 19. Расщепление метилариловых эфиров формулы 19 до соединений формулы 20 может быть проведено с применением кислоты Льюиса,такой как трибромид бора, трихлорид бора, хлорид алюминия или триметилсилилйодид, в неполярном апротонном растворителе, таком как толуол, дихлорметан или дихлорэтан, с или без охлаждения. Соединения формулы 20 могут быть превращены в соединения формулы 21 обработкой соответствующим основанием, таким как карбонат калия, карбонат цезия или гидроксид калия, и соответствующим образом замещенным алкилгалогенидом, таким как трет-бутил-2-бромизобутират, этилбромацетат или этил-2 бромбутират, в подходящем растворителе, таком как ДМФА или метанол. Схема 8 Соединения формулы 24 могут быть получены из соединений формулы 22, как показано на схеме 8. Например, соединение формулы 22 может быть обработано соответствующим основанием, таким как бутиллитий или втор-бутиллитий, в соответствующем растворителе, таком как эфир или ТГФ, с использованием TMEDA и охлаждения или без него, и соответствующим электрофилом, таким как алкилгалогениды, альдегиды или дисульфиды, с получением соединений формулы 23. Соединения формулы 23 могут быть превращены в соединения формулы 24 по методике, описанной на схеме 3, для превращения соединения 8 в соединение 9. Альтернативный синтез соединений формулы 32 описан на схеме 9. Например, когда 4 метилтиофенилуксусную кислоту, формула 26, обрабатывают оксалилхлоридом или тионилхлоридом в присутствии метанола, получают соединение формулы 27. Обработка соединений формулы 27 кислотой Льюиса, такой как хлорид алюминия, в хлорированном растворителе, таком как хлороформ или дихлорэтан, в присутствии алкена, такого как этилен, дает тетралоны формулы 28. Применяя методику, описанную на схеме 1, могут быть получены тетралины формулы 29. Соединения формулы 29 могут быть замещены с получением соединений формулы 30, применяя карбоновую кислоту, в условиях сочетания,описанных выше, или хлорангидрид с третичным амином, таким как диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как дихлорметан или дихлорэтан. Соединение формулы 30 может быть превращено в соединение формулы 31 с применением окисляющего агента, такого какmCPBA или перекись водорода, в подходящем растворителе, таком как метиленхлорид, с последующей обработкой соединений формулы 30 трифторуксусным ангидридом, с или без растворителя, такого как хлороформ, с последующей обработкой третичным амином, таким как триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как метанол, что дает соединения формулы 31. Альтернативно, снятие защиты тиоэфира в соединениях формулы 30 может быть достигнуто с применением основания, такого как сульфид трет-бутилнатрия, натрий, метилтиол натрия, в подходящем растворителе,таком как ДМФА, N-метил-2-пирролидон или аммиак, с получением соединений формулы 31. Применяя методику, аналогичную описанной на схеме 3 для превращения соединения 10 в соединение 11, соединения формулы 31 могут быть легко превращены в соединения формулы 32. Схема 10 Согласно схеме 10 соединения формулы 22 могут быть легко превращены в соединения формулы 32 а, где R3 равно OCH3. Например, соединения формулы 22 могут быть обработаны соответствующим основанием, таким как бутиллитий или втор-бутиллитий, в подходящем растворителе, таком как эфир или ТТФ, с использованием TMEDA и охлаждения или без него, и соответствующим дисульфидом, таким как диметилдисульфид или дибензилдисульфид, с получением соединений формулы 33. Удаление диметиламинотиокарбамата из соединений формулы 33 может быть проведено с применением гидроксида натрия, в подходящем растворителе, таком как вода, метанол или этанол, с или без нагревания, с получением соединений формулы 34. Соединения формулы 34 могут быть метилированы с получением соединений формулы 19 а, с применением метилйодида, диметилсульфата или диазометана, в подходящем растворителе, таком как ДМФА, метанол или дихлорметан, с или без основания, такого как карбонат цезия или карбонат калия. Применяя методику, аналогичную описанной на схеме 9 для превращения- 11009553 соединений формулы 30 в соединения формулы 32, соединения формулы 32 а могут быть легко получены из соединений формулы 19 а. Метод 1. 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафтал-2-илсульфанил-2 метилпропионовая кислота. Соединение 1.0 (пример 1). А. 6-Метокси-1,2,3,4-тетрагидронафталин-2-иламина гидрохлорид. Схема 1. К раствору 6-метокси-2-тетралона (10,0 г; 56,7 ммоль), растворенного в MeOH (400 мл),добавляют ацетат аммония (65 г; 0,84 моль), и реакционную смесь перемешивают в течение 30 мин при комнатной температуре. К реакционной смеси затем добавляют цианоборгидрид натрия (17,8 г; 0,28 моль) и реакционную смесь кипятят с обратным холодильником в течение 1-2 ч. Реакционную смесь охлаждают, растворитель удаляют при пониженном давлении, остаток разбавляют EtOAc и добавляют 1 н. NaOH для остановки реакции. Водную фазу отделяют и органическую фазу промывают Н 2 О, насыщенным раствором соли, сушат над Na2SO4, фильтруют и растворитель удаляют при пониженном давлении с получением неочищенного остатка, который очищают флэш-хроматографией (SiO2), элюируяCH2Cl2/MeOH:NH4OH (10%) с получением 5,0 г (50%) 6-метокси-1,2,3,4-тетрагидронафталин-2-иламина в виде темного масла. В раствор указанного в заголовке соединения в эфире (100 мл), охлажденному до 0 С, барботируют HCl (л) до тех пор, пока раствор не станет насыщенным. Суспензию перемешивают еще в течение 30 мин при комнатной температуре и растворитель выпаривают при пониженном давлении. Оставшееся твердое вещество растирают с эфиром, фильтруют, промывают эфиром и сушат при пониженном давлении с получением 4,9 г 6-метокси-1,2,3,4-тетрагидронафталин-2-иламина гидрохлорида в виде белого твердого вещества. ЖХ/МС: C11H15NO: m/z 178 (M+1). В. 2-(6-Метокси-1,2,3,4-тетрагидронафталин-2-ил)изоиндол-1,3-дион. Схема 3. К перемешиваемой суспензии 60% NaH (6 г; 0,182 ммоль) в ДМФА (400 мл) добавляют 6 метокси-1,2,3,4-тетрагидронафталин-2-иламин (30 г; 0,140 моль) порциями при 0 С. Реакционную смесь нагревают до комнатной температуры и перемешивают еще 1 ч. Добавляют фталевый ангидрид (20,7 г; 0,139 моль) одной порцией при комнатной температуре, при этом реакционную смесь перемешивают в течение еще 1 ч, с последующим перемешиванием в течение 18 ч при 120 С. Реакционную смесь охлаждают до комнатной температуры, разбавляют Н 2 О и экстрагируют несколько раз EtOAc. Объединенные органические экстракты промывают водой, насыщенным раствором соли, сушат над Na2SO4 и растворитель удаляют при пониженном давлении. Неочищенное твердое вещество растирают с MeOH, фильтруют и сушат в вакууме с получением 29,1 г (67%) 2-(6-метокси-1,2,3,4-тетрагидронафталин-2 ил)изоиндол-1,3-диона в виде беловатого твердого вещества. 1H-ЯМР (300 МГц, CDCl3):7,83-7,86 (м, 2 Н), 7,70-7,73 (м, 2 Н), 6,96-6,99 (д, 1 Н), 6,67-6,72 (м, 2 Н),4,50-4,59 (м, 1 Н), 3,78 (с, 3H), 3,52-3,61 (м, 1 Н), 2,95-2,98 (м, 2 Н), 2,81-2,88 (м, 1 Н), 2,65-2,76 (м, 1 Н),1,97-2,01 (м, 1 Н). ЖХ/МС: C19H17NO3: m/z 308 (M+1). С. 2-(6-Гидрокси-1,2,3,4-тетрагидронафталин-2-ил)изоиндол-1,3-дион. Схема 3. К 2-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)изоиндол-1,3-диону (29 г; 94,3 ммоль),растворенному в безводном CH2Cl2 (500 мл), охлажденному до -60 С, добавляют 1,0 М раствор трибромида бора-CH2Cl2 (471 мл) по каплям, поддерживая температуру реакции от -50 до -60 С. По завершении добавления реакционную смесь нагревают до комнатной температуры и перемешивают в течение еще 4 ч. Реакционную смесь охлаждают до 0 С, гасят насыщенным NaHCO3 (400 мл) и перемешивают в течение еще 0,5 ч при комнатной температуре. Осадок фильтруют, тщательно промывают H2O, суспендируют в эфире, фильтруют и сушат в вакууме с получением 25,4 г (92%) 2-(6-гидрокси-1,2,3,4 тетрагидронафталин-2-ил)изоиндол-1,3-диона в виде не совсем белого твердого вещества. 1D. Сложный О-[6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-5,6,7,8-тетрагидронафталин-2-иловый] эфир диметилтиокарбаминовой кислоты. Схема 3. К 2-(6-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)изоиндол-1,3-диону (25,4 г; 86,5 ммоль),растворенному в безводном ДМФА (200 мл), добавляют 1,4-диазабицикло[2.2.2]октан (48,5 г; 4,32 моль),с последующей обработкой диметиламинотиокарбамоилхлоридом (53,4 г; 4,32 моль), и раствор перемешивают при комнатной температуре в течение 4 ч. Реакционную смесь выливают в ледяную воду (1 л) и- 12009553 перемешивают в течение 18 ч. Осадок фильтруют, промывают H2O и сушат в вакууме. Неочищенное твердое вещество очищают флэш-хроматографией (SiO2), элюируя градиентом гексан-EtOAc с получением 30 г (91%) сложного О-[6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-5,6,7,8-тетрагидронафталин-2 илового] эфира диметилтиокарбаминовой кислоты в виде белого твердого вещества. 1E. Сложный S-[6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-5,6,7,8-тетрагидронафталин-2-иловый] эфир диметилтиокарбаминовой кислоты. Схема 3. В 50-мл круглодонную колбу, оборудованную обратным холодильником и мешалкой,предварительно разогретую до 330 С на песчаной бане, добавляют сложный О-[6-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)-5,6,7,8-тетрагидронафталин-2-иловый] эфир диметилтиокарбаминовой кислоты(5,32 г; 13,9 ммоль) одной порцией. Расплав перемешивают в течение 7-8 мин при 330 С, затем быстро охлаждают до комнатной температуры потоком N2. Неочищенный остаток очищают флэшхроматографией (SiO2), элюируя градиентом гексан-EtOAc с получением 3,1 г (58%) сложного S-[6-(1,3 диоксо-1,3-дигидроизоиндол-2-ил)-5,6,7,8-тетрагидронафталин-2-илового] эфира диметилтиокарбаминовой кислоты в виде белого твердого вещества. 1F. Сложный S-[6-амино-5,6,7,8-тетрагидронафталин-2-иловый] эфир диметилтиокарбаминовой кислоты. Схема 3. В трехгорлую колбу, оборудованную обратным холодильником и механической мешалкой, загружают EtOH (115 мл) и сложный S-[6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-5,6,7,8 тетрагидронафталин-2-иловый] эфир диметилтиокарбаминовой кислоты (8,7 г; 23,5 ммоль). Добавляют гидразин (6,6 мл; 2,11 моль) одной порцией при комнатной температуре и реакционную смесь кипятят с обратным холодильником при механическом перемешивании в течение 40 мин. Реакционную смесь охлаждают до комнатной температуры и студенистое белое твердое вещество фильтруют и тщательно промывают эфиром. Эфирные промывные фракции объединяют, выпаривают при пониженном давлении и неочищенный остаток растирают с эфиром, фильтруют и эфир выпаривают при пониженном давлении с получением 6,1 г (100%) сложного S-[6-амино-5,6,7,8-тетрагидронафталин-2-илового] эфира диметилтиокарбаминовой кислоты в виде желтого масла. ЖХ/МС: C13H18N2OS: m/z 251 (M+1).G. Сложный трет-бутиловый эфир 2-(6-амино-5,6,7,8-тетрагидронафталин-2-илсульфанил)-2 метилпропионовой кислоты. Схема 3. К сложному S-(6-амино-5,6,7,8-тетрагидронафталин-2-иловому) эфиру диметилтиокарбаминовой кислоты (6,1 г; 24,4 ммоль), растворенному в MeOH (25 мл), добавляют раствор KOH (4,1 г; 73,2 ммоль) в MeOH (25 мл) при комнатной температуре. Раствор перемешивают при температуре кипения с обратным холодильником в течение 5 ч и охлаждают до комнатной температуры. К раствору добавляют трет-бутил-2-бромизобутират (16,3 г; 73,2 ммоль) и перемешивают в течение 16 ч при комнатной температуре. Добавляют NaBH4 (9,2 г; 2,44 моль) и реакционную смесь перемешивают в течение еще 48 ч при комнатной температуре. Реакционную смесь гасят H2O, растворитель выпаривают при пониженном давлении и неочищенный остаток разделяют между H2O и CH2Cl2. Водную фазу экстрагируютCH2Cl2 и объединенные органические экстракты сушат над Na2SO4, фильтруют и выпаривают при пониженном давлении с получением 4,7 г (60%) сложного трет-бутилового эфира 2-(6-амино-5,6,7,8 тетрагидронафталин-2-илсульфанил)-2-метилпропионовой кислоты в виде коричневого масла. ЖХ/МС: C181H27NO2S: m/z 266 (M+1). Н. Сложный трет-бутиловый эфир 2-(6-ацетиламино-5,6,7,8-тетрагидронафталин-2-илсульфанил)-2 метилпропионовой кислоты. Схема 3. К сложному трет-бутиловому эфиру 2-(6-амино-5,6,7,8-тетрагидронафталин-2 илсульфанил)-2-метилпропионовой кислоты (4,7 г; 14,6 ммоль), растворенному в CH2Cl2 (25 мл), добавляют DIEA (3,3 мл; 18,9 ммоль) и реакционную смесь охлаждают до 0 С. Ацетилхлорид (1,25 мл; 17,5 ммоль) добавляют по каплям с такой скоростью, чтобы сохранять температуру от 0 до 5 С. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 16 ч. Реакционную смесь разбавляют CH2Cl2, промывают H2O, сушат над Na2SO4 и выпаривают при пониженном давлении. Неочищенное масло очищают флэш-хроматографией (SiO2), элюируя градиентом гексан-EtOAc с получением 1,7 г (32%) сложного трет-бутилового эфира 2-(6-ацетиламино-5,6,7,8-тетрагидронафталин-2 илсульфанил)-2-метилпропионовой кислоты в виде рыжевато-коричневого твердого вещества. 1I. Сложный трет-бутиловый эфир 2-(6-этиламино-5,6,7,8-тетрагидронафталин-2-илсульфанил)-2 метилпропионовой кислоты. Схема 3. К раствору сложного трет-бутилового эфира 2-(6-ацетиламино-5,6,7,8 тетрагидронафталин-2-илсульфанил)-2-метилпропионовой кислоты (1,7 г; 4,64 ммоль) в ТГФ (42 мл) добавляют раствор 1,0 М борана-ТГФ (42 мл) по каплям, при комнатной температуре. Реакционную смесь перемешивают в течение 18 ч при комнатной температуре, осторожно гасят MeOH и растворитель выпаривают при пониженном давлении. Остаточное масло подвергают азеотропной перегонке с MeOH(3) с получением 1,9 г (100%) смеси сложного трет-бутилового эфира 2-(6-этиламино-5,6,7,8 тетрагидронафталин-2-илсульфанил)-2-метилпропионовой кислоты и его боранового комплекса в виде масла. ЖХ/МС: C20H31NO2SBH3: m/z 308 М+ВН 3)+1).CH2Cl2 (15 мл), добавляют 4-трифторметоксифенилизоцианат (1,6 г; 7,8 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Растворитель удаляют при пониженном давлении и неочищенный остаток очищают флэш-хроматографией (SiO2), элюируя градиентом гексанEtOAc с получением 1,66 г (58%) сложного трет-бутилового эфира 2-6-[1-этил-3-(4 трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовой кислоты в виде белой пены. ЖХ/МС: C28H35F3N2O4S: m/z 497 М-С 4 Н 8)+1).K. 2-6-[1-Этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2 метилпропионовая кислота. Схема 4. К сложному трет-бутиловому эфиру 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовой кислоты (1,66 г; 3,0 ммоль), растворенному в CH2Cl2 (15 мл), добавляют TFA (15 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч. Растворитель удаляют при пониженном давлении и остаток очищают флэшхроматографией (SiO2), элюируя градиентом гексан-EtOAc с получением 0,643 г (43%) 2-6-[1-этил-3-(4 трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафтал-2-илсульфанил-2-метилпропионовой кислоты в виде белого твердого вещества. 1A. 5-Метоксииндан-1,2-дион-2-оксим. Схема 2. К раствору 5-метоксииндан-1-она (75,8 г; 0,467 моль) в MeOH (1,4 л) при 45 С добавляют бутилнитрит (81 мл; 0,693 моль) по каплям в течение 45 мин. Затем к горячему раствору добавляют концентрированную HCl (45 мл) в течение 20 мин и реакционную смесь перемешивают при 45 С в течение еще 1,5-2 ч. Реакционную суспензию охлаждают, осадок фильтруют, промывают несколько раз холодным MeOH и сушат в вакууме с получением 55,8 г (62%) 5-метоксииндан-1,2-дион-2-оксима в виде бежевого твердого вещества. 1B. 5-Метоксииндан-2-иламина гидрохлорид. Схема 2. К 5-метоксииндан-1,2-дион-2-оксиму (55,7 г; 0,291 моль), суспендированному в ледяной уксусной кислоте (0,99 л), добавляют концентрированную H2SO4 (67 мл) с последующим добавлением 10% Pd-C (27 г) и реакционную смесь перемешивают в аппарате Парра в атмосфере Н 2 при давлении 60 фунт/дюйм 2 в течение 18 ч. Реакционную смесь продувают N2, фильтруют через слой целита и про- 14009553 мывают АсОН. Растворитель удаляют при пониженном давлении до 1/5 объема и оставшийся растворитель разбавляют H2O (500 мл), охлаждают до 0 С и нейтрализуют до рН 10 добавлением 50% водногоNaOH. Водную фазу экстенсивно экстрагируют CHCl3 несколько раз и экстракты объединяют, промывают H2O, насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают при пониженном давлении с получением 77,3 г (66%) неочищенного масла. Масло очищают флэш-хроматографией (SiO2),элюируя 40:2,2:0,2 CHCl3:MeOH:NH4OH, с получением 43,8 г (37%) темного масла. Масло растворяют в эфире (1 л), охлаждают до 0 С и раствор насыщают HCl (л). Растворитель удаляют при пониженном давлении и твердое вещество растирают с эфиром, фильтруют и промывают эфиром с получением 43,8 г(30%) 5-метоксииндан-2-иламина гидрохлорида в виде белого твердого вещества. 1C. 2-(5-Метоксииндан-2-ил)изоиндол-1,3-дион. Схема 3. К суспензии 60% NaH (8 г; 0,240 моль) в ДМФА (250 мл), охлажденной до 0 С, добавляют 5-метоксииндан-2-иламина гидрохлорид (40,0 г; 0,2 моль) и суспензию перемешивают в течение 1 ч при комнатной температуре. Добавляют фталевый ангидрид (30 г; 0,2 моль) одной порцией и суспензию перемешивают еще 1-1,5 ч при комнатной температуре, с последующим перемешиванием при 120 С в течение 96 ч. Реакционную смесь охлаждают и разбавляют EtOAc. Органическую фазу промывают H2O,полученный осадок фильтруют, промывают EtOAc, MeOH и сушат в вакууме с получением 25,2 г (43%) 2-(5-метоксииндан-2-ил)изоиндол-1,3-диона в виде белого твердого вещества. Органическую фазу промывают H2O, выпаривают при пониженном давлении и твердое вещество растирают с MeOH, фильтруют и сушат с получением еще 19,7 г (33%) 2-(5-метоксииндан-2-ил)изоиндол-1,3-диона в виде белого твердого вещества. 1(340 мл) по каплям с такой скоростью, чтобы поддерживать температуру реакционной массы от -50 до-60 С. Реакционную смесь нагревают до комнатной температуры и перемешивают еще 5 ч. Реакционную смесь охлаждают до 0 С, гасят насыщенным NaHCO3 (500 мл) и перемешивают в течение еще 0,5 ч при комнатной температуре. Осадок фильтруют, промывают H2O, суспендируют в эфире, фильтруют и сушат в вакууме с получением 14,8 г (79%) 2-(5-гидроксииндан-2-ил)изоиндол-1,3-диона в виде бежевого твердого вещества. 1F. Сложный О-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)индан-5-иловый] эфир диметилтиокарбаминовой кислоты. Схема 3. К 2-(5-гидроксииндан-2-ил)изоиндол-1,3-диону (31 г; 0,11 моль), растворенному в безводном ДМФА (400 мл), добавляют 1,4-диазабицикло[2.2.2]октан (62 г; 0,55 моль) с последующей обработкой диметиламинотиокарбамоилхлоридом (68 г; 0,55 моль) и раствор перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь выливают в ледяную воду (1 л) и перемешивают в течение 18 ч. Осадок фильтруют, промывают H2O и сушат в вакууме с получением 41,6 г (100%) сложного О[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)индан-5-илового] эфира диметилтиокарбаминовой кислоты в виде бежевого твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3):7,82-7,87 (м, 2 Н), 7,69-7,75 (м, 2 Н), 7,17-7,24 (д, 1 Н), 6,87-6,93 (м, 2 Н),5,13-5,25 (м, 1 Н), 3,53-3,68 (м, 2 Н), 3,46 (с, 3H), 3,34 (с, 3H), 3,09-3,23 (м, 2 Н).G. Сложный S-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)индан-5-иловый] эфир диметилтиокарбаминовой кислоты. Схема 3. В 50-мл круглодонную колбу, оборудованную обратным холодильником и мешалкой,предварительно разогретую до 330 С на песчаной бане, добавляют сложный О-[2-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)индан-5-иловый] эфир диметилтиокарбаминовой кислоты (6,30 г; 18,7 ммоль) одной порцией. Расплав перемешивают в течение 12 мин при 338 С, затем быстро охлаждают до комнатной температуры потоком N2 и неочищенный остаток очищают флэш-хроматографией (SiO2), элюируя градиентом гексан-EtOAc с получением 3,88 г (61%) сложного S-[2-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)индан-5-илового] эфира диметилтиокарбаминовой кислоты в виде беловатого твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3):7,81-7,87 (м, 2 Н), 7,69-7,74 (м, 2 Н), 7,22-7,36 (м, 3H), 5,10-5,22 (м, 1 Н),- 15009553 3,59-3,67 (м, 2 Н), 3,06-3,23 (м, 9 Н). ЖХ/МС: C20H18N2O3S: m/z 367 (M+1). Н. Сложный S-(2-аминоиндан-5-иловый) эфир диметилтиокарбаминовой кислоты. Схема 3. В трехгорлую колбу, оборудованную обратным холодильником и механической мешалкой, загружают EtOH (98 мл) и сложный S-[6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)индан-5-иловый] эфир диметилтиокарбаминовой кислоты (6,9 г; 20,6 ммоль). Добавляют гидразин (5,8 мл; 186 ммоль) одной порцией при комнатной температуре и реакционную смесь кипятят с обратным холодильником при механическом перемешивании в течение 30 мин. Реакционную смесь охлаждают до комнатной температуры и студенистое белое твердое вещество фильтруют и промывают эфиром несколько раз. Эфирные промывные фракции объединяют, выпаривают при пониженном давлении и неочищенный остаток растирают с эфиром, фильтруют и эфир выпаривают при пониженном давлении с получением 4,6 г (95%) сложного S-(2-аминоиндан-5-илового) эфира диметилтиокарбаминовой кислоты в виде коричневого масла. 1 Н-ЯМР (300 МГц, CDCl3):7,15-7,33 (м, 3H), 3,80-3,88 (м, 1 Н), 3,05-3,22 (м, 8 Н), 2,64-2,72 (м, 1 Н),2,17 (шир.с, 2 Н). ЖХ/МС: C12H16N2OS: m/z 237 (M+1).I. Сложный трет-бутиловый эфир 2-(2-аминоиндан-5-илсульфанил)-2-метилпропионовой кислоты. Схема 3. К сложному S-(2-аминоиндан-5-иловому) эфиру диметилтиокарбаминовой кислоты (4,9 г; 20,9 ммоль), растворенному в MeOH (60 мл) добавляют раствор KOH (11,8 г; 0,210 моль) в MeOH (110 мл) при комнатной температуре. Раствор перемешивают при температуре кипения с обратным холодильником в течение 5 ч и охлаждают до комнатной температуры. К раствору добавляют трет-бутил-2 бромизобутират (7,0 г; 31,3 ммоль) и перемешивают в течение 18 ч при комнатной температуре. Растворитель выпаривают при пониженном давлении и неочищенный остаток разделяют между H2O и EtOAc. Водную фазу экстрагируют EtOAc и объединенные органические экстракты промывают H2O, насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают при пониженном давлении с получением 4,9 г (76%) сложного трет-бутилового эфира 2-(2-аминоиндан-5-илсульфанил)-2 метилпропионовой кислоты в виде коричневого масла. ЖХ/МС: C17H25NO2S: m/z 308 (М+1).(8,6 мл; 61,7 ммоль) и реакционную смесь охлаждают до 0 С. Ацетилхлорид (4,1 мл; 57,6 ммоль) добавляют по каплям с такой скоростью, чтобы поддерживать температуру от 0 до 5 С. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 16 ч, разбавляют CH2Cl2, промываютH2O, сушат над Na2SO4 и выпаривают при пониженном давлении. Неочищенное масло очищают флэшхроматографией (SiO2), элюируя градиентом гексан-EtOAc с получением 11,7 г (71%) сложного третбутилового эфира 2-(2-ацетиламиноиндан-5-илсульфанил)-2-метилпропионовой кислоты в виде бежевого твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3):7,31-7,35 (м, 2 Н), 7,15-7,18 (д, 1 Н), 5,73 (м, 1 Н), 4,68-4,78 (м, 1 Н), 3,253,39 (дд, 2 Н), 2,74-2,80 (д, 2 Н), 1,94 (с, 3H), 1,43 (с, 15 Н). ЖХ/МС: C19H27NO3S: m/z 294 (М+1).(226 мл) по каплям, при комнатной температуре. Реакционную смесь перемешивают в течение 5 ч при комнатной температуре, охлаждают до 0 С, гасят MeOH (100 мл) и выпаривают при пониженном давлении. Остаточное масло подвергают азеотропной перегонке с MeOH (3) с получением 11 г (100%) смеси сложного трет-бутилового эфира 2-(2-этиламиноиндан-5-илсульфанил)-2-метилпропионовой кислоты и его боранового комплекса в виде масла. ЖХ/МС: C19H29NO2SBH3: m/z 336 ( (М+ВН 3)+1).L. Сложный трет-бутиловый эфир 2-2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан-5 илсульфанил-2-метилпропионовой кислоты. Схема 4. К смеси сложного трет-бутилового эфира 2-(2-этиламиноиндан-5-илсульфанил)-2 метилпропионовой кислоты и боранового комплекса (11,0 г; 33 ммоль), растворенной в CH2Cl2 (100 мл),добавляют 4-трифторметоксифенилизоцианат (10,2 г; 50,2 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Растворитель удаляют при пониженном давлении и неочищенный остаток очищают флэш-хроматографией (SiO2), элюируя градиентом гексан-EtOAc с получением 11,2 г (62%) сложного трет-бутилового эфира 2-2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан 5-илсульфанил-2-метилпропионовой кислоты в виде белой пены.(15 мл), добавляют TFA (15 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Растворитель удаляют при пониженном давлении и остаток очищают флэш-хроматографией(SiO2), элюируя градиентом гексан-EtOAc с получением 3,13 г (73%) 2-2-[1-этил-3-(4 трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовой кислоты в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3):7,29-7,35 (м, 4 Н), 7,15-7,17 (д, 1 Н), 7,08-7,11 (д, 2H), 6,45 (с, 1 Н), 4,945,04 (м, 1 Н), 3,18-3,36 (м, 4 Н), 2,98-3,07 (м, 2 Н), 1,48 (с, 6 Н), 1,19-1,28 (т, 3H). ЖХ/МС: C23H25F3N2O4S: m/z 483 (М+1). Т.пл.=73-77 С. Представленные ниже 14 соединений получают по методикам, представленным на схемах 3 и 4 и в стадиях J, K, L и М метода 2, заменяя реагенты и корректируя условия реакции при необходимости. Промежуточное соединение L (11 г) метода 2 разделяют хиральной хроматографией (Chiralpak AD колонка; изократический градиент гексан/метанол/этанол: 92/4/4) с получением (S)-промежуточного соединения L (4,8 г). По методике стадии М метода 2 получают соединение 2.1 (3,1 г). ЖХ/МС: C23H25F3N2O4S: m/z 483 (М+1). 2-2-[1-Этил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил-2 метилпропионовая кислота. Соединение 2.2 (пример 4). Соединение 2.3 (0,22 г; 32% с двух стадий; белое твердое вещество) получают методом 2 с применением соединения 2.2, заменяя ацетилхлорид на валерилхлорид. 1 Соединение 2.6 (0,29 г; 77% с двух стадий; белое твердое вещество) получают методом 2, заменяя ацетилхлорид на валерилхлорид. 1 Соединение 2.7 (0,25 г; 36% с двух стадий; белое твердое вещество) получают методом 2 с приме- 18009553 нением соединения 2.5, заменяя ацетилхлорид на валерилхлорид. 1 Н-ЯМР (CD3OD):0,869-0,915 (т, 3H), 1,17-1,31 (м, 4 Н), 1,44 (с, 6 Н), 1,57-1,65 (м, 2 Н), 2,91 (с, 6 Н),3,12-3,29 (м, 6 Н), 4,94-5,02 (м, 1 Н), 6,80-6,83 (д, 2 Н), 7,17-7,23 (м, 3H), 7,32-7,38 (м, 2 Н). ЖХ/МС: C27H37N3O3S: m/z 484 (М+1). 2-2-[3-(4-Изопропилфенил)-1-(3-пентил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота. Соединение 2.8 (пример 10). Соединение 2.8 (5 мг; 14% с двух стадий; белое твердое вещество) получают методом 2 с применением соединения 2.4, заменяя ацетилхлорид на валерилхлорид. ЖХ/МС: C28H38N2O3S: m/z 483 (М+1). 2-2-[3-(4-трет-Бутилфенил)-1-(3-пентил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота. Соединение 2.9 (пример 11). Соединение 2.11 (13 мг; 44% с двух стадий; масло) получают методом 2 с применением соединения 2.4, заменяя валерилхлорид на капроилхлорид. ЖХ/МС: C29H40N2O3S: m/z 497 (М+1). 2-Метил-2-2-[1-гексил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилпропионовая кислота. Соединение 2.12 (пример 14). Соединение 2.12 (18 мг; 54% с двух стадий; белое твердое вещество) получают методом 2, заменяя валерилхлорид на капроилхлорид. ЖХ/МС: C27H33F3N2O4S: m/z 539 (M+1). 2-Метил-2-2-[1-гексил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанилпропионовая кислота. Соединение 2.13 (пример 15). Соединение 2.13 (14 мг; 36% с двух стадий; белое твердое вещество) получают методом 2 с применением соединения 2.2, заменяя валерилхлорид на капроилхлорид. ЖХ/МС: C27H33F3N2O3S2: m/z 555 (М+1). 2-Метил-2-2-[1-пропил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилпропионовая кислота. Соединение 2.14 (пример 16). Соединение 2.14 (1,2 мг; 3% с двух стадий; масло) получают методом 2, заменяя ацетилхлорид на пропионилхлорид. ЖХ/МС: C24H27F3N2O3S: m/z 4 97 (М+1). 2-Метил-2-2-[1-бутил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанилпропионовая кислота. Соединение 2.15 (11 мг; 32% с двух стадий; масло) получают методом 2 с применением соединения 2.2, заменяя ацетилхлорид на бутирилхлорид. ЖХ/МС: C25H29F3N2O3S2: m/z 527 (M+1). 2-Метил-2-2-[3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилпропионовая кислота. Соединение 2.16 (пример 18). К сложному трет-бутиловому эфиру 2-(2-аминоиндан-5-илсульфанил)-2-метилпропионовой кислоты (0,220 г; 0,72 ммоль), растворенному в DCE (4 мл), добавляют пент-4-енал (0,060 мг; 0,72 ммоль) с последующим добавлением триацетоксиборгидрида натрия (0,21 г; 1,0 ммоль) и реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Реакционную смесь разбавляют CH2Cl2, промывают Н 2 О, насыщенным раствором соли, сушат над Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении с получением сложного трет-бутилового эфира 2-метил-2-(2-пент-4 ениламиноиндан-5-илсульфанил)пропионовой кислоты в виде неочищенного масла. Соединение 3.0 (0,149 мг; 40% с трех стадий; белое твердое вещество) получают методом 2, стадииL и М, ацилируя 4-трифторметоксифенилизоцианатом. ЖХ/МС: C26H29F3N2O4S: m/z 522 (M+1). Представленные ниже 2 соединения получают по методикам, представленным на схемах 3 и 4, способ 3, стадиях L и М метода 2, заменяя реагенты и корректируя условия реакции при необходимости: 2-Метил-2-2-[1-(3-метилбутил)-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2 метилпропионовая кислота. Соединение 3.1 (пример 20).H-ЯМР (CD3OD):0,877-0,895 (дд, 6 Н), 1,19-1,22 (дд, 6 Н), 1,42-1,53 (м, 9 Н), 2,80-2,89 (м, 1 Н),2,99-3,08 (м, 2 Н), 3,17-3,48 (м, 4 Н), 4,98-5,03 (м, 1 Н), 6,26 (с, 1 Н), 7,10-7,22 (м, 5 Н), 7,32-7,35 (м, 2 Н). ЖХ/МС: C28H38N2O3S: m/z 483 (М+1). Представленные ниже 3 соединения получают по методикам, представленным на схемах 1 и 3, стадиях J и K метода 1, заменяя реагенты и корректируя условия реакции при необходимости. 2-6-[1-Бутил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2 метилпропионовая кислота. Соединение 1.1 (пример 22). Соединение 1.1 (41 мг; 68% с двух стадий; белое твердое вещество) получают методом 1, заменяя ацетилхлорид на бутирилхлорид. ЖХ/МС: C26H31F3N2O4S: m/z 525 (М+1). 2-6-[1-Бутил-3-(4-трифторметилсульфанилфенил)уреидо]-5,6,7,8-тетрагидронафталин-2 илсульфанил-2-метилпропионовая кислота. Соединение 1.2 (пример 23). Соединение 1.2 (23 мг; 34% с двух стадий; белое твердое вещество) получают методом 1 с применением соединения 1.1, заменяя ацетилхлорид на бутирилхлорид и 4-трифторметоксифенилизоцианат на 4-трифтортиофенилизоцианат. ЖХ/МС: C26H31F3N2O3S2: m/z 541 (М+1). 2-6-[1-Гексил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2 метилпропионовая кислота. Соединение 1.3 (пример 24). Соединение 1.3 (36 мг; 57% с двух стадий; белое твердое вещество) получают методом 1, заменяя ацетилхлорид на капроилхлорид. ЖХ/МС: C28H35F3N2O4S: m/z 553 (М+1). Представленные ниже 2 соединения получают по методикам, представленным на схемах 3 и 4 и стадиях L и М метода 2, заменяя реагенты и корректируя условия реакции при необходимости. 2-2-[3-(3-Бром-4-трифторметоксифенил)-1-этилуреидо]индан-5-илсульфанил-2 метилпропионовая кислота. Соединение 2.17 (0,018 г; 19% с трех стадий; белое твердое вещество) получают методом 2, заменяя 4-трифторметоксифенилизоцианат на 3-бром-4-трифторметоксифенилизоцианат. К 3-бром-4 трифторметоксианилину (0,214 г; 0,836 ммоль) в ТГФ (1 мл) добавляют ди-трет-бутилдикарбонат (0,255 г; 1,17 ммоль) с последующим добавлением 4-диметиламинопиридина (0,102 г; 0,835 ммоль). После прекращения бурного вспенивания (30 мин) добавляют раствор сложного трет-бутилового эфира 2-(2 этиламиноиндан-5-илсульфанил)-2-метилпропионовой кислоты (0,058 г; 0,167 ммоль) в ТГФ (1 мл) и реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Указанное в заголовке соединение получают по методикам стадий K и L метода 2. ЖХ/МС: C23H24BrF3N2O4S: m/z 563 (M+1). 2-2-[1-Этил-3-(3-трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота. Соединение 2.18 (пример 26). Соединение 2.18 (13 мг; 12% с трех стадий; белое твердое вещество) получают по методике примера 2.0, заменяя 4-трифторметоксифенилизоцианат на 3-трифторметоксифенилизоцианат. К раствору карбонилдиимидазола (0,454 г; 2,8 ммоль) в ТГФ (2 мл), нагретому до 50 С, добавляют 3 трифторметоксианилин (0,522 г; 2,94 ммоль) по каплям. Через 15 мин реакционную смесь охлаждают и добавляют к раствору сложного трет-бутилового эфира 2-(2-этиламиноиндан-5-илсульфанил)-2 метилпропионовой кислоты (0,077 г; 0,22 ммоль) в ТГФ (1 мл). ЖХ/МС: C23H25F3N2O4S: m/z 483 (M+1). 2-2-[3-(4-Диметиламинофенил)-1-метилуреидо]индан-5-илсульфанил-2-метилпропионовая кислота. Соединение 2.19 (пример 27).A. Сложный S-(2-формиламиноиндан-5-иловый) эфир диметилтиокарбаминовой кислоты. Схема 6. К сложному S-[2-аминоиндан-5-иловому) эфиру диметилтиокарбаминовой кислоты (2,0 г; 8,46 ммоль) в CHCl3 (10 мл) добавляют этилформиат (50 мл) и реакционную смесь нагревают до 55 С в течение 24 ч. Реакционную смесь охлаждают, растворитель удаляют при пониженном давлении и неочищенное масло очищают флэш-хроматографией (SiO2), элюируя градиентом этилацетат-метанол с получением 0,77 г (35%) сложного S-(2-формиламиноиндан-5-илового) эфира диметилтиокарбаминовой кислоты в виде белого твердого вещества. ЖХ/МС: C13H16N2O2: m/z 264 (M+1).B. Сложный трет-бутиловый эфир 2-метил-2-(2-метиламиноиндан-5-илсульфанил)пропионовой кислоты. Схема 6. К сложному S-(2-формиламиноиндан-5-иловому) эфиру диметилтиокарбаминовой кислоты (0,772 г; 2,9 ммоль) в ТГФ (9 мл) в атмосфере N2 добавляют раствор 1,0 М алюмогидрида лития (9 мл) при 0 С. Реакционную смесь нагревают до комнатной температуры, затем перемешивают при температуре кипения с обратным холодильником в течение 24 ч. Реакционную смесь охлаждают до 0 С, гасятH2O и растворитель удаляют при пониженном давлении. Остаток растворяют в MeOH (4 мл), к которому добавляют Cs2CO3 (0,304 г; 0,93 ммоль), трет-бутил-2-бромизобутират (0,311 мл; 1,39 ммоль) и NaBH4(2,0 г; 52,8 ммоль). Реакционную смесь перемешивают в течение 18 ч, удаляют при пониженном давлении и остаток разделяют между EtOAc и H2O. Слои разделяют, водную фазу экстрагируют EtOAc, органические экстракты объединяют, промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают при пониженном давлении. Неочищенный остаток очищают флэш-хроматографией Соединение 2.20 (39 мг; 49% с двух стадий; белое твердое вещество) получают методом 2, заменяя ацетилхлорид на 3-циклопентилпропионилхлорид. ЖХ/МС: C29H35F3N2O4S: m/z 565 (M+1). 2-[2-(3-Индан-5-ил-1-пентилуреидо)индан-5-илсульфанил]-2-метилпропионовая кислота. Соединение 2.21 (пример 29). Соединение 2.21 (9,3 мг; 24% с двух стадий; белое твердое вещество) получают методом 2 с применением соединения 2.3, заменяя ацетилхлорид на валерилхлорид и 4-трифторметоксифенилизоцианат на инданилизоцианат. ЖХ/МС: C28H36N2O3S: m/z 481 (М+1). 2-Метил-2-2-[3-(4-метил-3-нитрофенил)-1-пентилуреидо]индан-5-илсульфанилпропионовая кислота. Соединение 2.22 (пример 30). Соединение 2.25 (7,0 мг; 16% с двух стадий; масло) получают методом 2 с применением соединения 2.2, заменяя ацетилхлорид на метоксиацетилхлорид. ЖХ/МС: C24H27F3N2O4S2: m/z 529 (М+1). 2-Метил-2-2-[1-пропил-3-(4-трифторметилфенил)уреидо]индан-5-илсульфанилпропионовая кислота. Соединение 2.26 (пример 35). Соединение 2.27 (10 мг; 26% с двух стадий; масло) получают методом 2 с применением соединения 2.0, заменяя ацетилхлорид на трифторметилбутирилхлорид. ЖХ/МС: C25H26F6N2O3S: m/z 564 (M+1). 2-2-[1-(3-Циклопентилпропил)-3-фенилуреидо]индан-5-илсульфанил-2-метилпропионовая кислота. Соединение 2.28 (пример 37). Соединение 2.28 (38 мг; 56% с двух стадий; масло) получают методом 2 с применением соединения 2.0, заменяя ацетилхлорид на циклопентилпропионилхлорид и 4-трифторметоксифенилизоцианат на фенилизоцианат. ЖХ/МС: C28H36N2O3S: m/z 481 (М+1). Сложный метиловый эфир 6-[1-[5-(1-карбокси-1-метилэтилсульфанил)индан-2-ил]-3-(4 изопропилфенил)уреидо]гексановой кислоты. Соединение 2.29 (пример 38). Соединение 2.29 (12 мг; 38% с двух стадий; белое твердое вещество) получают методом 2 с применением соединения 2.4, заменяя ацетилхлорид на сложный метиловый эфир 5-хлоркарбонилпентановой кислоты. ЖХ/МС: C30H40N2O5S: m/z 541 (М+1). 2-Метил-2-[2-(3-нафталин-2-ил-1-пентилуреидо)индан-5-илсульфанил]пропионовая кислота. Соединение 2.30 (пример 39). Соединение 2.31 (15 мг; 25% с двух стадий; белое твердое вещество) получают методом 2 с применением соединения 2.0, заменяя ацетилхлорид на циклогексилацетилхлорид. ЖХ/МС: C28H33F3N2O4S: m/z 551 (М+1). 2-2-[1-Изобутил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота. Соединение 3.5 (пример 41). Соединение 2.32 (6,7 мг; 12% с двух стадий; масло) получают методом 2 с применением соединения 2.0, заменяя ацетилхлорид на гептаноилхлорид и 4-трифторметоксифенилизоцианат на 3,4 дихлорфенилизоцианат. ЖХ/МС: C27H34Cl2N2O3S: m/z 538 (М+1). 2-2-[1-(2-Диметиламиноэтил)-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил 2-метилпропионовая кислота. Соединение 2.33 (пример 43). Соединение 2.33 (1,9 мг; 4% с двух стадий; масло) получают методом 2 с применением соединения 2.2, заменяя ацетилхлорид на диметиламиноацетилхлорид и 4-трифторметоксифенилизоцианат на 4 трифторметилтиофенилизоцианат. ЖХ/МС: C25H30F3N3O3S2: m/z 542 (М+1). 2-2-[3-(3-Хлорфенил)-1-гептилуреидо]индан-5-илсульфанил-2-метилпропионовая кислота. Соединение 1.4 (53 мг; 25% с двух стадий; масло) получают методом 1 с применением соединения 1.0, заменяя ацетилхлорид на пропионилхлорид. ЖХ/МС: C25H29F3N2O4S: m/z 511 (М+1). Представленные ниже 2 соединения получают по методикам, представленным на схемах 10 и 4 и стадиях I, J и K метода 1, заменяя реагенты и корректируя условия реакции при необходимости. 2-6-[1-Этил-3-(4-трифторметоксифенил)уреидо]-3-метокси-5,6,7,8-тетрагидронафтал-2 илсульфанил-2-метилпропионовая кислота. Соединение 1.5 (пример 47). 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илокси-2- 28009553 метилпропионовая кислота Соединение 4.0 (пример 48).A. N-(6-Метокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамид. Схема 7. К перемешиваемой суспензии 6-метокси-1,2,3,4-тетрагидронафталин-2-иламина (2,54 г; 14,3 ммоль) в CH2Cl2 (20 мл) добавляют DIEA (3,4 мл) и реакционную смесь охлаждают до 0 С. Добавляют ацетилхлорид (1,22 мл; 17,1 ммоль) по каплям при 0 С и реакционную смесь нагревают до комнатной температуры и перемешивают в течение 18 ч. Реакционную смесь разбавляют CH2Cl2, промываютH2O, сушат над Na2SO4, фильтруют и растворитель удаляют при пониженном давлении с получением неочищенного твердого вещества. Очистка флэш-хроматографией (SiO2), элюируя гексаном-EtOAc, дает 1,57 г (50%) N-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамида в виде белого твердого вещества. ЖХ/МС: C13H17NO2: m/z 220 (M+1).B. N-(6-Гидрокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамид. Схема 7. К суспензии N-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамида (1,57 г; 7,2 ммоль) в CH2Cl2 (70 мл), охлажденной до -60 С, добавляют раствор трибромида бора-CH2Cl2 (36 мл) по каплям,поддерживая температуру реакции от -50 до -60 С. Желеобразную суспензию нагревают до комнатной температуры и перемешивают в течение 30 мин. Реакционную смесь охлаждают до 0 С, гасят насыщенным NaHCO3 и перемешивают в течение 30 мин при комнатной температуре. Смесь экстрагируютCH2Cl2 (2), экстракты объединяют, сушат над Na2SO4, фильтруют и выпаривают при пониженном давлении с получением неочищенного твердого вещества, которое очищают флэш-хроматографией (SiO2),элюируя градиентом CH2Cl2-MeOH, с получением 1,13 г (76%) N-(6-гидрокси-1,2,3,4 тетрагидронафталин-2-ил)ацетамида в виде бежевого твердого вещества. ЖХ/МС: C12H15NO2: m/z 206 (M+1).C. Сложный трет-бутиловый эфир 2-(6-ацетиламино-5,6,7,8-тетрагидронафталин-2-илокси)-2 метилпропионовой кислоты. Схема 7. К суспензии N-(6-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамида (0,439 г; 2,1 ммоль) в ДМФА (6 мл) добавляют Cs2CO3 (1,7 г; 5,2 ммоль) и трет-бутил-2-бромизобутират (2,1 мл; 9,4 ммоль) и реакционную смесь перемешивают при 100 С в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют EtOAc, промывают Н 2 О, насыщенным раствором соли, сушат над Na2SO4, фильтруют и растворитель удаляют при пониженном давлении с получением неочищенного масла, которое очищают флэш-хроматографией (SiO2), элюируя градиентом гексан-EtOAc, с получением 0,51 г (69%) сложного трет-бутилового эфира 2-(6-ацетиламино-5,6,7,8-тетрагидронафталин-2-илокси)-2 метилпропионовой кислоты в виде масла. 1 Н-ЯМР (300 МГц, CDCl3):6,89-6,92 (д, 1 Н), 6,58-6,65 (м, 2 Н), 5,85-5,88 (м, 1 Н), 4,24-4,30 (м, 1 Н),2,99-3,06 (дд, 1 Н), 2,76-2,86 (м, 2 Н), 2,51-2,59 (дд, 1 Н), 2,04 (с, 2 Н), 1,98-2,02 (м, 1 Н), 1,74-1,79 (м, 1 Н),1,54 (с, 6 Н), 1,46 (с, 9 Н). ЖХ/МС: C20H29NO4: m/z 292 (M+1). Представленные ниже соединения получают по методикам, представленным на схемах 3 и 4 и стадиях I, J и K метода 1, заменяя реагенты и корректируя условия реакции при необходимости. Соединение 4.0 (0,0168 г; 23% с двух стадий; масло) получают методом 1 с применением соединения 1.0. ЖХ/МС: C24H27F3N2O5: m/z 481 (М+1). 2-6-[3-(4-трет-Бутилфенил)-1-этилуреидо]-3-метокси-5,6,7,8-тетрагидронафталин-2-илсульфанил 2-метилпропионовая кислота. Соединение 1.6 (пример 49).
МПК / Метки
МПК: C07C 275/28, A61P 3/06, A61P 9/12, C07C 275/34, A61P 9/10, C07C 323/52, A61K 31/196
Метки: тетралины, инданы, замещённые
Код ссылки
<a href="https://eas.patents.su/30-9553-zameshhyonnye-tetraliny-i-indany.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые тетралины и инданы</a>
Предыдущий патент: Устройство, способ и система для обеспечения эксплуатации и технического обслуживания в реальном масштабе времени
Следующий патент: Замещённые тетралины и инданы и их применение
Случайный патент: Гидроизолирующий элемент с регулируемыми угловыми частями












