Производные пиразоло[1,5-а]пиримидинов, способ их получения и используемые в нем промежуточные соединения (варианты), лекарственное средство (варианты) и способ лечения или профилактики заболеваний, связанных с модуляцией рецептора гамка (варианты)
Номер патента: 9519
Опубликовано: 28.02.2008
Авторы: Англада Луис, Паломер Альберт, Гугльетта Антонио, Принсеп Марта
Формула / Реферат
1. Производные пиразоло[1,5а]пиримидинов общей формулы (I)
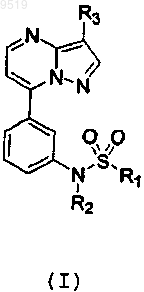
и их фармацевтически приемлемые соли, где
R1 представляет собой радикал, выбранный из группы, включающей (С1-С6)алкил, (С2-С6)алкенил, w,w,w-трифтор(С1-С6)алкил, циклоалкил(С3-С6), циклоалкил(С3-С6)алкил(С1-С6), -О-(С1-С6)алкил, -NH-(С1-С6)алкил, -N(ди(С1-С6)алкил), (С1-С6)алкил-О-(С1-С6)алкил, (С1-С6)алкил-NH-(С1-С6)алкил, (С1-С6)алкил-N(ди(С1-С6)алкил), фенил, необязательно замещенный 1 или 2 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; фенил(С1-С6)алкил, фенил(С2-С6)алкенил, фурил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -O-(C1-С6)алкил, галоген, CN и NO2; изоксазолил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; пиразолил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; тиенил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; тиазолил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; пиридил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2;
R2 представляет собой радикал, выбранный из группы, включающей водород, (С1-С6)алкил, (С2-С6)алкенил, (С2-С6)алкинил и циклоалкил(С3-С6); или
R1 и R2 вместе представляют цикл
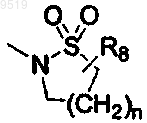
где n равно 1, 2 или 3;
R3 представляет собой радикал, выбранный из группы, включающей водород, галоген, (С1-С6)алкил, циклоалкил(С3-С6), (С2-С6)алкенил, (С2-С6)алкинил, -О-(С1-С6)алкил, галоген(С1-С6)алкил, -CN, SO2-R4,
-NH-R4, -NR4R5, -COR6, -CO-NHR6, -COOR6, -C(NR7)R6, фенил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; гетероарил, выбранный из группы, включающей пиридил, пиримидинил, триазинил, пирролил, тиенил, фурил, оксазолил, тиазолил, имидазолил, оксадиазолил, пиразолил или изоксазолил, которые в свою очередь необязательно замещены 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2;
при этом R4 и R5 независимо представляют собой радикал, выбранный из группы, включающей (С1-С6)алкил, циклоалкил(С3-С6)арил, который, в свою очередь, выбран из группы, включающей циклоалкил(С3-С6)нафтил и циклоалкил(С3-С6)фенил; гетероарил, выбранный из группы, включающей пиридил, пиримидинил, триазинил, пирролил, тиенил, фурил, оксазолил, тиазолил, имидазолил, оксадиазолил, пиразолил или изоксазолил;
R6 представляет собой радикал, выбранный из группы, включающей водород, (С1-С6)алкил, (С2-С6)алкенил, (С2-С6)алкинил, циклоалкил(С3-С6), фенил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; фурил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; тиенил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; тиазолил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; пиридил, необязательно замещенный 1, 2 или 3 радикалами, независимо выбранными из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2;
R7 представляет собой радикал, выбранный из группы, включающей (С1-С6)алкил, циклоалкил(С3-С6), -ОН, -О-(С1-С6)алкил, (С1-С6)алкил-О-(С1-С6)алкил, (С1-С6)алкил-NH-(С1-С6)алкил, (С1-С6)алкил-N(ди(С1-С6)алкил), фенил, необязательно замещенный радикалом, выбранным из группы, включающей (С1-С6)алкил, -О-(С1-С6)алкил, галоген, CN и NO2; фурил, тиенил, тиазолил и пиридил и
R8 представляет собой радикал, выбранный из группы, включающей водород, (С1-С6)алкил, циклоалкил(С3-С6), арил, выбранный из группы, включающей нафтил и фенил; и гетероарил, выбранный из группы, включающей пиридил, пиримидинил, триазинил, пирролил, тиенил, фурил, оксазолил, тиазолил, имидазолил, оксадиазолил, пиразолил или изоксазолил, которые, в свою очередь, необязательно замещены 1, 2 или 3 радикалами, выбранными из группы, включающей циклоалкил(С3-С6)нафтил и циклоалкил(С3-С6)фенил;
при условии, что одновременно R1, R2 и R3 не означают паратолил, метил, бензоил соответственно или паратолил, этил, фурил-2-карбонил соответственно.
2. Производные по п.1, отличающиеся тем, что R1 и R2 независимо имеют значения, указанные для формулы I, a R3 представляет собой цианогруппу.
3. Производные по п.2, отличающиеся тем, что R1 представляет собой радикал, выбранный из группы, включающей метил, этил, н-пропил, изопропил, н-бутил, фенил и 4-метоксифенил, и R2 представляет собой радикал, выбранный из группы, включающей метил, этил, н-пропил, изопропил, н-бутил, циклопропил и 2-пропинил.
4. Производные по п.2, отличающиеся тем, что R1 и R2 вместе представляют собой группу 1,3-пропилен.
5. Производные по п.1, отличающиеся тем, что R1 и R2 независимо имеют значения, указанные для формулы I, a R3 представляет собой тиофен-2-карбонил.
6. Производные по п.5, отличающиеся тем, что R1 представляет собой радикал, выбранный из группы, включающей метшы, этил, н-пропил, изопропил, н-бутил, 2-фенилэтенил, 2,2,2-трифторэтил, фенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2,4-дихлорфенил, 3,4-дихлорфенил, 2-цианофенил, 3-цианофенил, 4-цианофенил, 4-метоксифенил, 3-нитрофенил, 4-нитрофенил, 2-тиенил, 5-метил-4-изоксазолил, 5-метил-2-трифторметил-3-фурил, 4-(4-морфолинил)-3-пиридил, 2,4-диметил-5-тиазолил, циклопропил, бензил, винил, 3,5-диметил-4-изоксазолил, 1,3,5-триметил-4-пиразолил и циклопентилметил, a R2 представляет собой радикал, выбранный из группы, включающей водород, метил, этил, н-пропил, изопропил, н-бутил, циклопропил и 2-пропинил.
7. Производные по п.5, отличающиеся тем, что R1 и R2 вместе представляют собой группу 1,3-пропилен.
8. Производные по п.1, отличающиеся тем, что R1 и R2 независимо имеют значения, указанные для формулы I, a R3 представляет собой бензоил.
9. Производные по п.8, отличающиеся тем, что R1 представляет собой радикал, выбранный из группы, включающей метил и этил, a R2 представляет собой радикал, выбранный из группы, включающей метил, этил и 2-пропинил.
10. Производные по п.1, отличающиеся тем, что R1 и R2 независимо имеют значения, указанные для формулы I, a R3 представляет собой 4-фторбензоил.
11. Производные по п.10, отличающиеся тем, что R1 представляет собой радикал, выбранный из группы, включающей метил и этил, a R2 представляет собой радикал, выбранный из группы, включающей метил, этил и 2-пропинил.
12. Производные по п.1, отличающиеся тем, что R1 и R2 независимо имеют значения, указанные для формулы I, a R3 представляет собой 4-метилбензоил.
13. Производные по п.12, отличающиеся тем, что R1 представляет собой радикал, выбранный из группы, включающей метил и этил, a R2 представляет собой радикал, выбранный из группы, включающей метил, этил и 2-пропинил.
14. Производные по п.1, отличающиеся тем, что R1 и R2 независимо имеют значения, указанные для формулы I, a R3 представляет собой 4-метоксибензоил.
15. Производные по п.14, отличающиеся тем, что R1 представляет собой радикал, выбранный из группы, включающей метил и этил, a R2 представляет собой радикал, выбранный из группы, включающей метил, этил и 2-пропинил.
16. Производные по п.1, отличающиеся тем, что R1 и R2 независимо имеют значения, указанные для формулы I, a R3 представляет собой 5-метил-1,2,4-оксадиазол-3-ил.
17. Производные по п.16, отличающиеся тем, что R1 представляет собой метил, a R2 представляет собой радикал, выбранный из группы, включающей водород и этил.
18. Производные по п.1, отличающиеся тем, что R1 и R2 независимо имеют значения, указанные для формулы I, a R3 представляет собой пиридил-2-карбонил.
19. Производные по п.18, отличающиеся тем, что R1 представляет собой радикал, выбранный из группы, включающей метил и этил, a R2 представляет собой радикал, выбранный из группы, включающей метил, этил и 2-пропинил.
20. Производные по п.1, отличающиеся тем, что R1 и R2 независимо имеют значения, указанные для формулы I, a R3 представляет собой пиридил-4-карбонил.
21. Производные по п.20, отличающиеся тем, что R1 представляет собой радикал, выбранный из группы, включающей метил и этил, a R2 представляет собой радикал, выбранный из группы, включающей метил, этил и 2-пропинил.
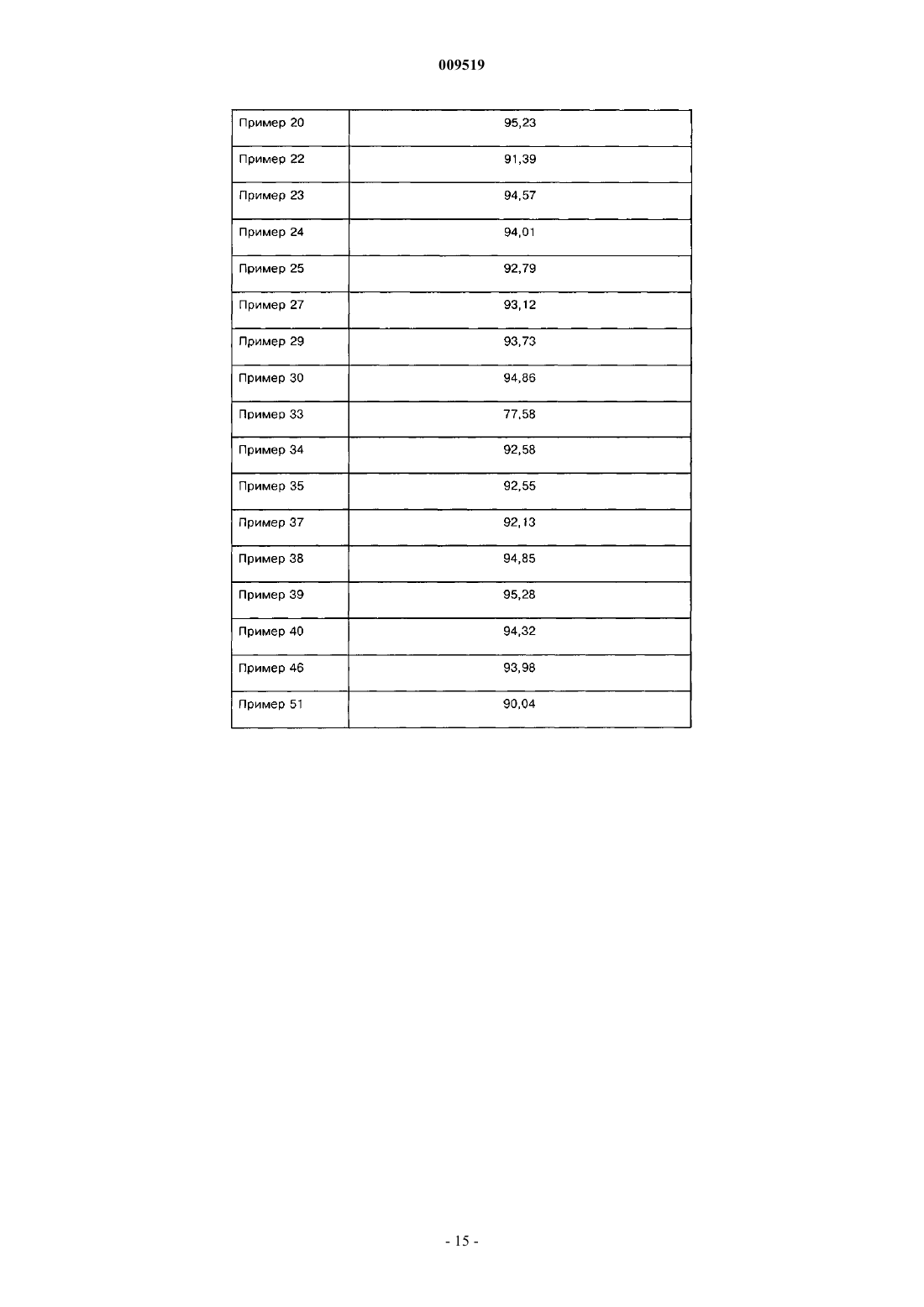
22. Производные по п.2 или 3, отличающиеся тем, что представляют собой соединения, выбранные из группы, включающей
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-метилметансульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-этилметансульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-метилбензолсульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-этилбензолсульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-проп-2-инилметансульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-пропилэтансульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-этилэтансульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-проп-2-инилпропан-2-сульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-метилэтансульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-бутилэтансульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-метил-2-пропансульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-этил-2-пропансульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-бутил-2-пропансульфонамид,
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-пропил-2-пропансульфонамид и
N-[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-проп-2-инилэтан-2-сульфонамид.
23. Производные по п.4, отличающиеся тем, что представляют соединение 7-(3-(2-изотиазолидинил-1,1-диоксид)фенил)-3-цианопиразоло[1,5-а]пиримидин.
24. Производные по п.5 или 6, отличающиеся тем, что представляют собой соединения, выбранные из группы, включающей
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-этил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}бензолсульфонамид,
N-этил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}бензолсульфонамид,
N-проп-2-инил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-пропил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-этил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-проп-2-инил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2-пропансульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-бутил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2-пропансульфонамид,
N-этил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2-пропансульфонамид,
N-пропил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2-пропансульфонамид,
N-бутил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2-пропансульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2-фенилэтенсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2,2,2-трифторэтансульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2-хлорбензолсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-3-хлорбензолсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-4-хлорбензолсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2,4-дихлорбензолсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-3,4-дихлорбензолсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2-цианобензолсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-3-цианобензолсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-4-цианобензолсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-3-нитробензолсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-4-нитробензолсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2-тиофенсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразолю[1,5-а]пиримидин-7-ил]фенил}-5-метил-4-изоксазолилсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2-трифторметил-5-метил-3-фурилсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-6-(морфолин-4-ил)-3-пиридилсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-2,4-диметил-5-тиазолилсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}циклопропилсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}бензилсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}винилсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-3,5-диметил-4-изоксазолилсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}-1,3,5-триметил-4-пиразолилсульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}пропансульфонамид,
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}бутансульфонамид и
N-метил-N-{3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}циклопентилметансульфонамид.
25. Производные по п.7, отличающиеся тем, что представляют соединение 7-(3-(2-изотиазолидинил-1,1-диоксид)фенил)-3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин.
26. Производные по п.8 или 9, отличающиеся тем, что представляют собой соединения, выбранные из группы, включающей
N-метил-N-{3-[3-(бензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-этил-N-{3-[3-(бензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-метил-N-{3-[3-(бензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-этил-N-{3-[3-(бензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-проп-2-инил-N-{3-[3-(бензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид и
N-проп-2-инил-N-{3-[3-(бензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид.
27. Производные по п.10 или 11, отличающиеся тем, что представляют собой соединения, выбранные из группы, включающей
N-метил-N-{3-[3-(фторбензол-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-этил-N-{3-[3-(фторбензол-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-метил-N-{3-[3-(фторбензол-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-этил-N-{3-[3-(фторбензол-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-проп-2-инил-N-{3-[3-(фторбензол-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид и
N-проп-2-инил-N-{3-[3-(фторбензол-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид.
28. Производные по п.12 или 13, отличающиеся тем, что представляют собой соединения, выбранные из группы, включающей
N-метил-N-{3-[3-(4-метилбензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-этил-N-{3-[3-(4-метилбензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-метил-N-{3-[3-(4-метилбензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-этил-N-{3-[3-(4-метилбензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-проп-2-инил-N-{3-[3-(4-метилбензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид и
N-проп-2-инил-N-{3-[3-(4-метилбензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид.
29. Производные по п.14 или 15, отличающиеся тем, что представляют собой соединения, выбранные из группы, включающей
N-метил-N-{3-[3-(4-метоксибензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-этил-N-{3-[3-(4-метоксибензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-метил-N-{3-[3-(4-метоксибензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-этил-N-{3-[3-(4-метоксибензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-проп-2-инил-N-{3-[3-(4-метоксибензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид и
N-проп-2-инил-N-{3-[3-(4-метоксибензоил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид.
30. Производные по п.16 или 17, отличающиеся тем, что представляют собой соединения, выбранные из группы, включающей
N-{3-[3-(5-метил[1,2,4]оксадиазол-3-ил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид и
N-этил-N-{3-[3-(5-метил[1,2,4]оксадиазол-3-ил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид.
31. Производные по п.18 или 19, отличающиеся тем, что представляют собой соединения, выбранные из группы, включающей
N-метил-N-{3-[3-(пиридин-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-этил-N-{3-[3-(пиридин-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-проп-2-инил-N-{3-[3-(пиридин-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-метил-N-{3-[3-(пиридин-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-этил-N-{3-[3-(пиридин-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид и
N-проп-2-инил-N-{3-[3-(пиридин-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид.
32. Производные по п.20 или 21, отличающиеся тем, что представляют собой соединения, выбранные из группы, включающей
N-метил-N-{3-[3-(пиридин-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-этил-N-{3-[3-(пиридин-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид,
N-метил-N-{3-[3-(пиридин-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-этил-N-{3-[3-(пиридин-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид,
N-проп-2-инил-N-{3-[3-(пиридин-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}этансульфонамид и
N-проп-2-инил-N-{3-[3-(пиридин-4-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил}метансульфонамид.
33. Способ получения производных пиразоло[1,5а]пиримидинов или их фармацевтически приемлемых солей, отличающийся тем, что осуществляют взаимодействие промежуточного соединения (II)
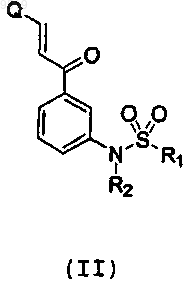
где R1 и R2 независимо имеют значения, указанные для формулы I, и
Q представляет собой уходящую группу, выбранную из группы, включающей N(ди(С1-С6)алкил), (С1-С6)алкилтио и (С1-С6)алкокси,
с промежуточным соединением (III)
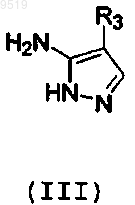
где R3 имеет значения, указанные для формулы I,
и обработку полученных соединений кислотой в случае получения их солей.
34. Способ по п.33, отличающийся тем, что осуществляют взаимодействие промежуточного соединения формулы (II), где Q представляет собой уходящую группу, выбранную из группы, включающей диметиламино, метилтио и метокси.
35. Способ лечения или профилактики заболеваний, связанных с модуляцией рецептора ГАМКА у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
36. Способ лечения или профилактики заболеваний, связанных с модуляцией рецептора a1-ГАМКА у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
37. Способ лечения или профилактики заболеваний, связанных с модуляцией рецептора a2-ГАМКА у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
38. Способ лечения или профилактики состояния тревоги у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
39. Способ лечения или профилактики эпилепсии у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
40. Споёюс лечения или профилактики расстройств сна у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
41. Способ лечения или профилактики бессонницы у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
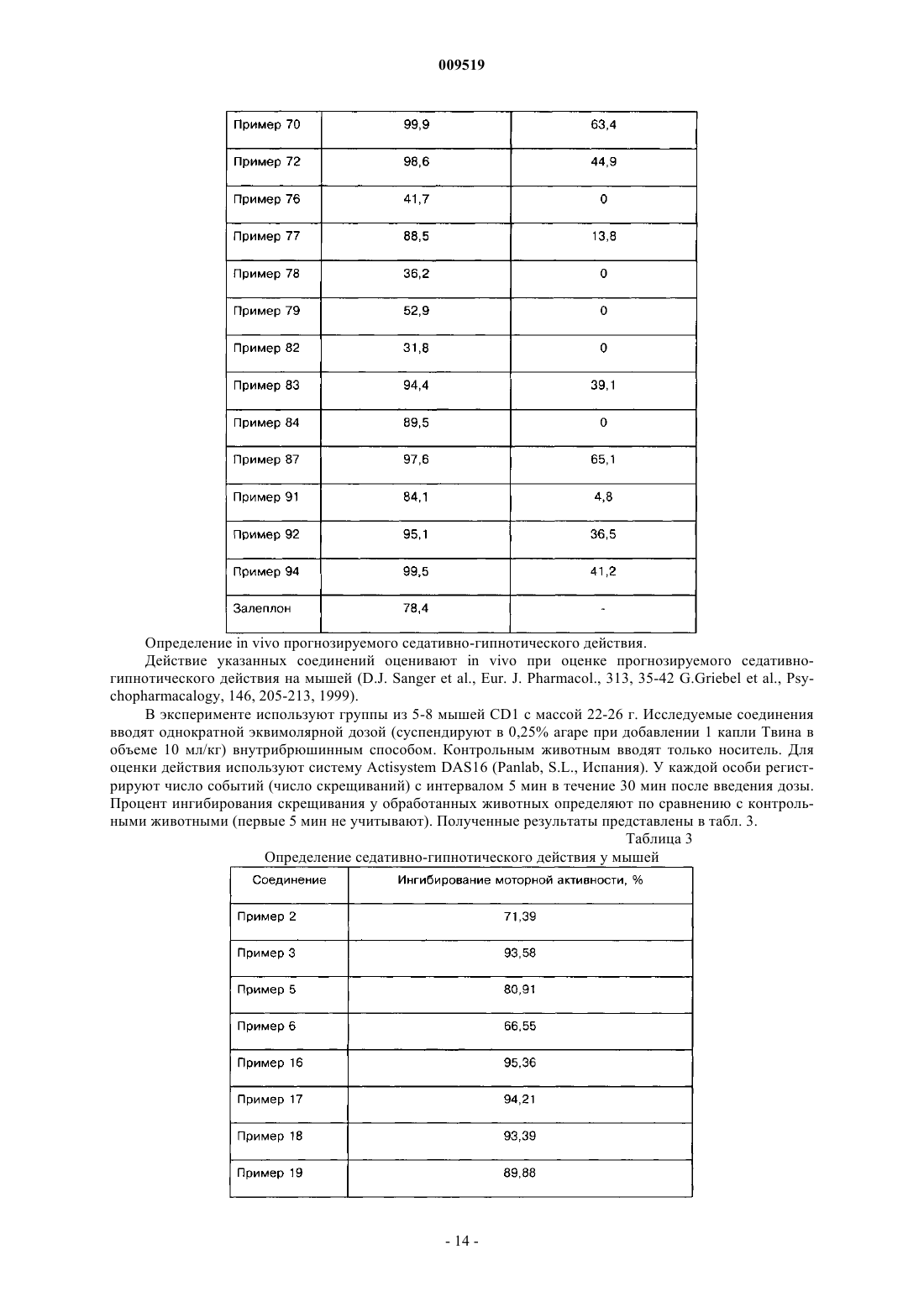
42. Способ индукции седативно-гипнотического эффекта у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
43. Способ индукции анестезии у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
44. Способ модуляции периода времени для засыпания и продолжительности сна у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
45. Способ индукции мышечной релаксации у млекопитающих, отличающийся тем, что млекопитающему вводят эффективное количество производных пиразоло[1,5-а]пиримидинов по п.1.
46. Композиция для лечения и профилактики заболеваний, связанных с модуляцией рецептора ГАМКА, содержащая производное пиразоло[1,5-а]пиримидинов, отличающаяся тем, что в качестве последнего используют соединение по п.1 в эффективном количестве в смеси с терапевтически инертным носителем.
47. Применение производных по п.1 для получения лекарственного средства, предназначенного для лечения или профилактики заболеваний, связанных с модуляцией рецептора ГАМКА.
48. Применение по п.47, при котором заболевание связано с модуляцией рецептора a1-ГАМКА или a2-ГАМКА.
49. Применение производных по п.1 для получения лекарственного средства, предназначенного для лечения или профилактики состояния тревоги, эпилепсии, расстройств сна, бессонницы, для индукции седативно-гипнотического эффекта, анестезии или мышечной релаксации или для модуляции необходимого периода времени для засыпания и продолжительности сна.
50. Способ получения промежуточного соединения формулы (VII)

где R1 имеет значения, указанные для формулы (I),
включающий взаимодействие промежуточного соединения (IV)
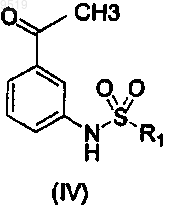
где R1 имеет значения, указанные для формулы (I),
с диметилацеталем N,N-диметилформамида.
51. Способ получения промежуточного соединения формулы (VII)
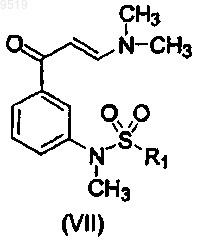
где R1 имеет значения, указанные для формулы (I),
включающий взаимодействие N-(3-ацетилфенил)-2,2,2-трифторацетамида (VIII)
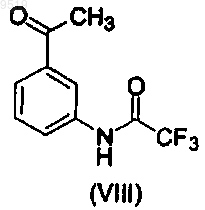
и N,N-диметилформамид диметилацеталя и последующее взаимодействие продукта реакции с соответствующим хлорангидридом сульфоновой кислоты с получением сульфонамида.
Текст
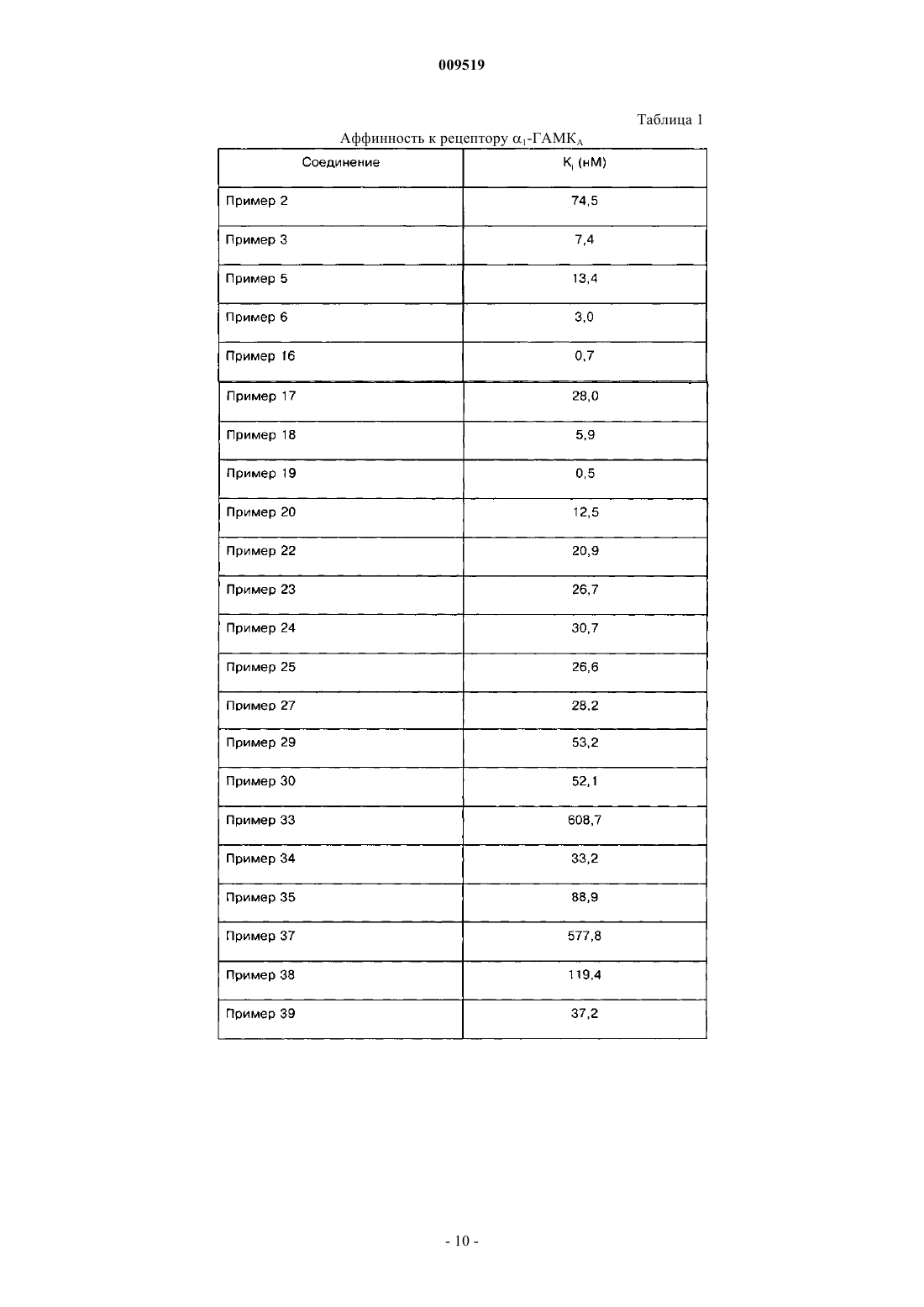
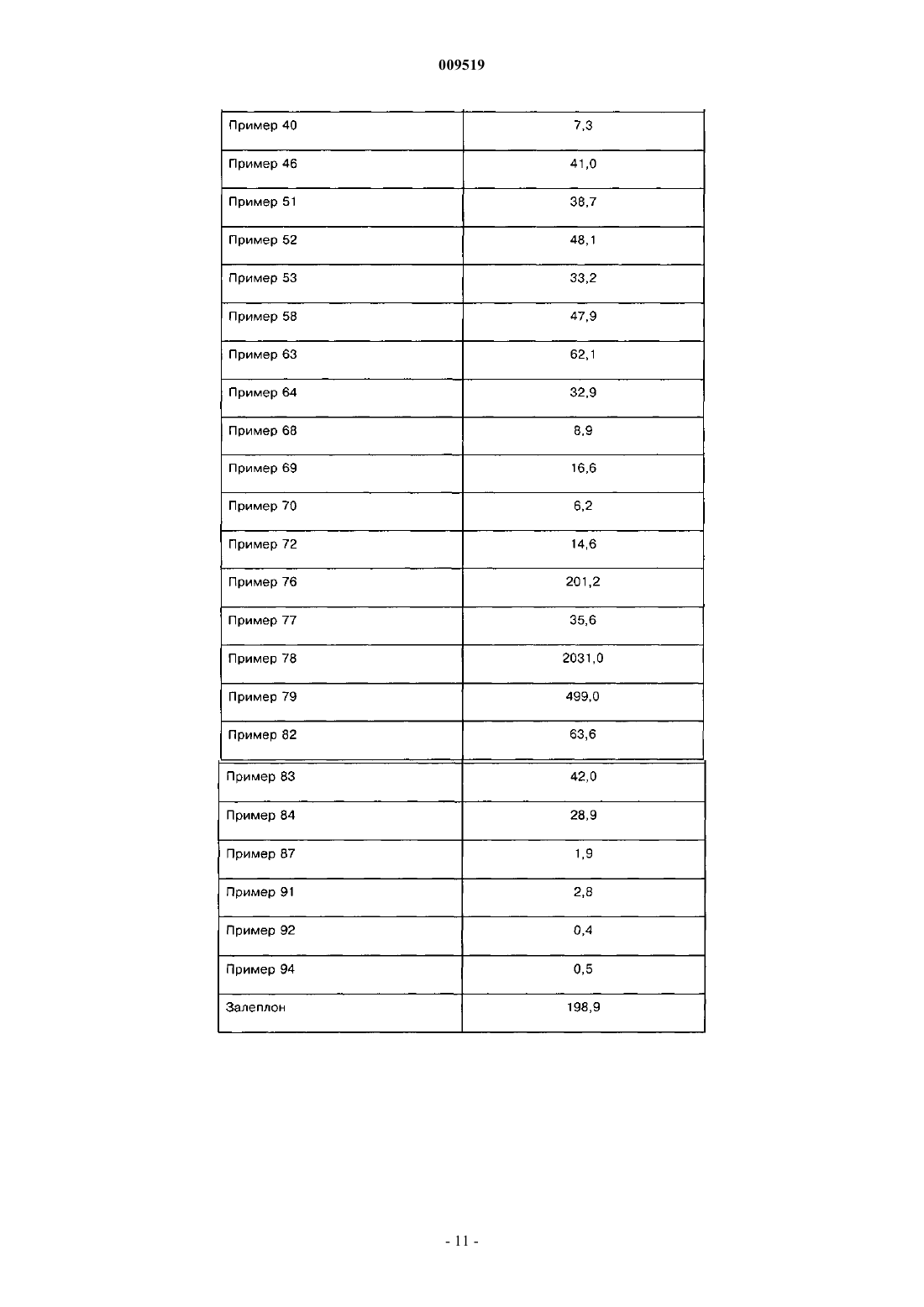
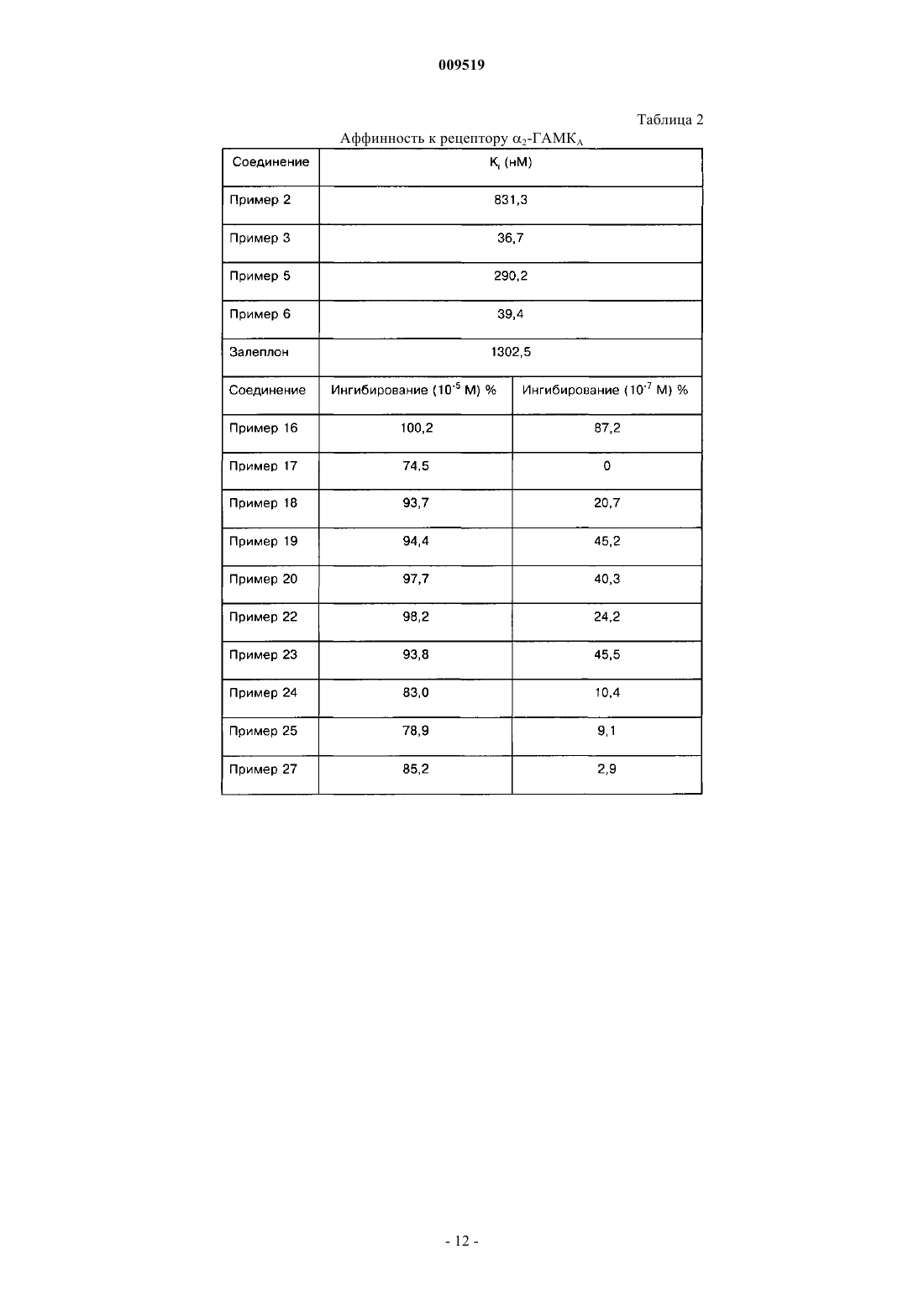
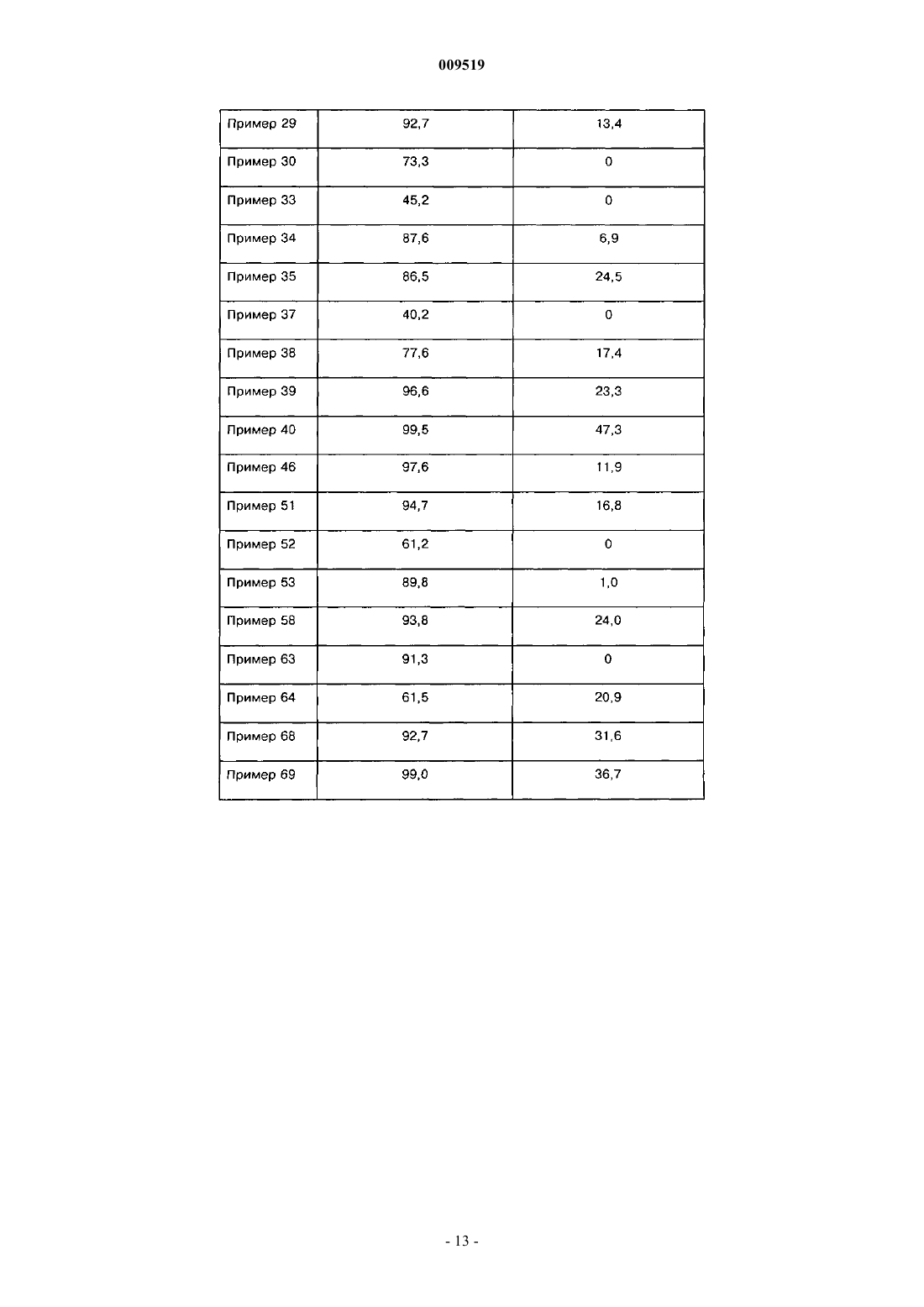
009519 Область техники, к которой относится изобретение Настоящее изобретение относится к области органической химии, фармацевтике и медицине, конкретно к агентам, проявляющим аффинность к рецептору ГАМКА, более подробно, к пиразоло[1,5 а]пиримидинам, которые можно использовать для лечения и профилактики всех заболеваний, опосредованных 1- и 2-субъединицами рецептора ГАМКА. К таким заболеваниям относятся, например, расстройства сна, бессонница, состояние тревоги и эпилепсия. Сведения о предшествующем уровне техники Рецептором ГАМКА (-аминомасляной кислотыА) является пентамерный белок, из которого состоят мембраны ионного канала. Рецептор ГАМКА включен в процессы регуляции седативного эффекта, тревоги, мышечного тонуса, эпилептогенной активности и памяти. Эти процессы регулируются с участием определенных субъединиц рецептора ГАМКА, прежде всего 1- и 2-субъединиц. Седативный эффект модулируется 1-субъединицей. Зольпидем характеризуется высокой аффинностью к 1-рецепторам, а его седативное и гипнотическое действие опосредуется указанными рецепторами in vivo. Аналогичным образом гипнотическое действие залеплона также опосредуется 1 рецепторами. Анксиолитическое действие диазепама опосредуется при усилении ГАМК-ергической трансмиссии в популяции нейронов, экспрессирующих 2-рецепторы. Этот факт означает, что 2-рецепторы являются высокоспецифичной мишенью для лечения тревоги. Мышечная релаксация при действии диазепама в основном опосредуется 2-рецепторами, так как указанные рецепторы характеризуются высокоспецифичной экспрессией в спинном мозге. Противосудорожное действие диазепама частично связано с 1-рецепторами. При действии диазепама, который считается улучшающим память соединением, наблюдается антероградная амнезия, которая опосредуется 1-рецепторами. Рецептор ГАМКА и его 1- и 2-рецепторы подробно описаны в литературе (см. статьи Н. Mohler etal. (J. Pharmacol. Exp. Ther, 300, 2-8, 2002); H. Mohler et al. (Curr. Opin. Pharmacol., 1, 22-25, 2001); U. Rudolph et al. (Nature, 401, 796-800, 1999) и D. J. Nutt et al. (Br. J. Psychiatry, 179, 390-396, 2001). Диазепам и другие классические бензодиазепины широко используются в качестве анксилитиков,гипнотических агентов, противосудорожных средств и мышечных релаксантов. Их побочное действие включает антероградную амнезию, снижение моторной активности и усиление действия этанола. В связи с этим в настоящем изобретении предлагаются соединения по изобретению, которые являются лигандами 1- и 2-рецепторов ГАМКА, и их применение в клинике для лечения расстройств сна,предпочтительно бессонницы, тревоги и эпилепсии. Бессоница является широко распространенным заболеванием. Хроническое проявление бессонницы наблюдается у 10% населения, а у 30% населения наблюдается транзиторная бессонница. При бессоннице наблюдаются проблемы при засыпании или неспособность спать длительное время, а ее последствиями на следующий день являются слабость, снижение энергии, снижение способности концентрировать внимание и раздражительность. Борьба с этим заболеванием в социальной сфере и в здравоохранении имеет большое значение и определяет социально-экономические показатели в стране. В прошлом лечение бессонницы проводили барбитуратами и хлоральгидратами, однако эти лекарственные средства характеризуются рядом известных побочных действий, например токсичность при передозировке, изменение метаболизма и повышенные зависимость и привыкание. Кроме того, указанные лекарственные средства действуют на структуру сна прежде всего за счет уменьшения продолжительности и числа стадий быстрого сна. Позднее важными и перспективными лекарственными средствами считались бензодиазепины в связи с их низкой токсичностью, но при их применении также наблюдались серьезные проблемы с зависимостью, мышечной релаксацией, амнезией и возобновлением симптомов после отмены лечения, из-за которых лечение не было непрерывным. Самый современный из известных терапевтических подходов включает введение небензодиазепиновых гипнотических средств, таких как пирроло[3,4-b]пиразинов (зопиклон), имидазо[1,2 а]пиридинов (зольпидем), и наконец, пиразоло[1,5-а]пиримидинов (залеплон). Позднее были предложены два новых пиразоло[1,5-а]пиримидина, индиплон и оцинаплон, причем последний обладал некоторой анксиолитической активностью. Все указанные лекарственные средства вызывают быструю индукцию сна и характеризуются меньшими последствиями на следующий день,меньшим злоупотреблением и снижением риска возобновления симптомов при отмене лечения по сравнению с бензодиазепинами. Механизм действия этих соединений заключается в аллостерической активации рецептора ГАМКА за счет связывания с участком связывания бензодиазепинов (С. F. P. George, The Lancet, 358, 1623-1626,2001). В отличии от бензодиазепинов, которые являются неспецифическими лигандами участка связывания рецептора ГАМКА, зольпидем и залеплон проявляют более высокую селективность к 1 субъединице.-1 009519 К недостаткам этих лекарственных средств относится действие на структуру сна и развитие зависимости при продолжительном лечении. В патентах США 4626538 (залеплон),4654347,6399621 (индиплон) и в европейском патенте 129847 (оцинаплон) описаны гипнотические пиразоло[1,5-а]пиримидины (любой из аналогов может быть принят как прототип). В настоящее время все еще существует потребность в новых активных соединениях для лечения бессонницы, так как даже самые перспективные гипнотические средства влияют на структуру сна и могут вызвать привыкание при продолжительном применении. Следовательно, существует необходимость в разработке новых гипнотических агентов с меньшим риском побочных действий. Сущность изобретения Таким образом, настоящее изобретение относится к новым N-[3-(3-замещенным-пиразоло[1,5 а]пиримидин-7-ил)фенил]сульфанамидам, которые проявляют активность в отношении рецептора ГАМКА и прежде всего в отношении его 1- и 2-субъединиц. Соединения по изобретению можно использовать для лечения и профилактики всех заболеваний,опосредованных 1- и 2-субъединицами рецептора ГАМКА. Примеры таких заболеваний включают, без ограничения перечисленным, расстройства сна, предпочтительно бессонницу, состояние тревоги и эпилепсию. Примеры соответствующих показаний для соединений по настоящему изобретению включают,без ограничения перечисленным, все заболевания или состояния, такие как бессонница или анестезия,при которых требуется индукция сна, индукция седативного эффекта или индукция мышечной релаксации. Настоящее изобретение относится к новым N-[3-(3-замещенным-пиразоло[1,5-а]пиримидин-7 ил)фенил]сульфамидам формулы (I) и к их фармацевтически приемлемым солям, гдеR2 выбирают из группы, включающей водород, (С 1-С 6)алкил, (С 2-С 6)алкенил, (С 2-С 6)алкинил и цикло(С 3-С 6)алкил; или в другой варианте заместители R1 и R2 образуют цикл, характеризующийся структурой где n равно простому числу 1, 2 или 3 включительно;R4 и R5 независимо выбирают из группы, включающей (С 1-С 6)алкил, цикло(С 3-С 6)алкиларил и гетероарил;R8 выбирают из группы, включающей водород, (С 1-С 6)алкил, цикло(С 3-С 6)алкил, арил и замещенный или незамещенный гетероарил; при условии, что одновременно R1 не означает паратолил, R2 не означает метил и R3 не означает бензоил, и-2 009519 одновременно R1 не означает паратолил, R2 не означает этил и R3 не означает фурил-2-карбонил. В патенте США 4654347 (пример 80) описан N-[3-(3-бензоилпиразоло[1,5-а]пиримидин-7 ил)фенил]-N,4-диметилбензолсульфонамид, а в европейском патенте 129847 (пример 166) описан Nэтил-N-[3-[3-(2-фурилкарбонил)пиразоло[1,5-а]пиримидин-7-ил]фенил]-4-метилбензолсульфонамид. В указанных патентах данные соединения упоминаются только в качестве синтетических промежуточных соединений и их фармакологическая активность не обсуждается. В связи с этим нельзя предположить,что аналоги этих соединений, как описано в настоящем изобретении, могут представлять интерес в виде терапевтически ценных соединений, как было неожиданно установлено авторами настоящего изобретения. Эти соединения, включенные в общую формулу (I), не включены в объем настоящего изобретения.R1 предпочтительно выбирают из группы, включающей (С 1-С 6)алкил, -трифтор(С 1-С 6)алкил,фенил, фенил, замещенный 1 или 2 группами, которые независимо выбирают из группы, включающей галоген (прежде всего, фтор или хлор), циано, NO2, О-(С 1-С 6)алкил и (С 1-С 6)алкил; фенил(С 2-С 6)алкенил,цикло(С 3-С 6)алкил, цикло(С 3-С 6)алкил(С 1-С 6)алкил, фенил(С 1-С 6)алкил, (С 2-С 6)алкенил, изоксазолил,замещенный 1 или 2 группами (С 1-С 6)алкил; фурил, замещенный 1 или 2 группами (С 1-С 6)алкил; фурил,замещенный 1 группой (С 1-С 6)алкил и 1 группой трифторметил; триазолил, замещенный 1 или 2 группами (С 1-С 6)алкил; пиразолил, замещенный 1, 2 или 3 группами (С 1-С 6)алкил; тиенил, замещенный 1 или 2 группами (С 1-С 6)алкил, и пиридил, замещенный 1 или 2 группами 4-морфолинил; или R1 и R2 вместе образуют упомянутый выше цикл, где n и R8 определены выше.R2 предпочтительно выбирают из группы, включающей Н, алкил(С 1-С 6), циклоалкил(С 3-С 6) и алкинил(С 2-С 6), или R2 и R1 вместе образуют упомянутый выше цикл, где n и R8 определены выше.R3 предпочтительно выбирают из группы, включающей Н, CN и COR6, где R6 выбирают из группы,включающей фенил, замещенный 1 или 2 группами, которые независимо выбирают из группы, включающей галоген (прежде всего, фтор или хлор), (С 1-С 6)алкил и О-(С 1-С 6)алкил; тиенил, пиридил и оксадиазолил, замещенный группой (С 1-С 6)алкил. Предпочтительный вариант воплощения настоящего изобретения относится к соединениям формулы I, где R3 означает циано, R1 выбирают из группы, включающей (С 1-С 6)алкил, фенил и фенил, замещенный группой О-(С 1-С 6)алкил, a R2 выбирают из группы, включающей (С 1-С 6)алкил, (С 3 С 6)циклоалкил и (С 2-С 6)алкинил. Еще один предпочтительный вариант настоящего изобретения относится к соединениям формулы I,где R3 означает тиофенкарбонил, прежде всего тиофен-2-карбонил, R1 выбирают из группы, включающей (С 1-С 6)алкил, (С 2-С 6)фенилалкенил, -(С 1-С 6)трифторалкил, фенил, фенил, замещенный 1 или 2 группами, которые независимо выбирают из группы, включающей галоген (прежде всего, фтор или хлор), циано, О-(С 1-С 6)алкил и нитро; (С 1-С 6)фенилалкил, (С 3-С 6)циклоалкил, (С 2-С 6)алкенил, цикло(С 3 С 6)алкил(С 1-С 6)алкил, изоксазолил, замещенный 1 или 2 группами (С 1-С 6)алкил; фурил, замещенный 1 или 2 группами, которые независимо выбирают из группы, включающей (С 1-С 6)алкил и трифтор(С 1-С 6)алкил; тиазолил, замещенный 1 или 2 группами (С 1-С 6)алкил; пиридил, замещенный группой 4-морфолинил; тиенил и пиразолил, замещенный 1, 2 или 3 группами (С 1-С 6)алкил, a R2 выбирают из группы, включающей водород, (С 1-С 6)алкил, (С 3-С 6)циклоалкил и (С 2-С 6)алкинил. Другой предпочтительный вариант настоящего изобретения относится к соединениям формулы I,где R3 выбирают из группы, включающей бензоил, в котором фенильная группа замещена группой галоген (прежде всего, фтор или хлор), (С 1-С 6)алкил и О-(С 1-С 6)алкил; оксадиазолил, замещенный группами(С 1-С 6)алкил и пиридилкарбонил; R1 означает (С 1-С 6)алкил, R2 означает Н, (С 1-С 6)алкил или (С 1 С 6)алкинил. Настоящее изобретение предпочтительно относится к новым N-[3-(3-замещенным-пиразоло[1,5 а]пиримидин-7-ил)фенил]сульфонамидам формулы (I), где R1 выбирают из группы, включающей метил,этил, н-пропил, изопропил, н-бутил, 2-фенилэтенил, 2,2,2-трифторэтил, фенил, 2-хлорфенил, 3 хлорфенил, 4-хлорфенил, 2,4-дихлорфенил, 3,4-дихлорфенил, 2-цианофенил, 3-цианофенил, 4 цианофенил, 4-метоксифенил, 3-нитрофенил, 4-нитрофенил, 2-тиенил, 5-метил-4-изоксазолил, 5-метил-2 трифторметил-3-фурил, 4-(4-морфолинил)-3-пиридил, 2,4-диметил-5-тиазолил, циклопропил, бензил,винил, 3,5-диметил-4-изоксазолил, 1,3,5-триметил-4-пиразолил и циклопентилметил; R2 выбирают из группы, включающей водород, метил, этил, н-пропил, изопропил, н-бутил, циклопропил и 2-пропинил,или R1 и R2 вместе с группой -N-SO2- образуют изотиазолидин-1,1-диоксидное кольцо, в котором заместители R1 и R2 образуют группу 1,3-пропилен, и R3 выбирают из группы, включающей группы циано,бензоил, 4-фторбензоил, 4-метилбензоил, 4-метоксибензоил, 5-метил-1,2,4-оксадиазол-3-ил, пиридил-2 карбонил, пиридил-4-карбонил и тиофен-2-карбонил. Термин "гетероарил" означает 5- и 6-членные ароматические гетероциклические группы, содержащие 1, 2 или 3 гетероатома, которые независимо друг от друга выбирают из группы, включающей N, О иS. Примеры гетероарильных групп включают пиридил, пиримидинил,триазинил, пирролил, тиенил, фурил, оксазолил, тиазолил, имидазолил, оксадиазолил. Термин "арил" означает предпочтительно фенил или нафтил. Термин "галоген" означает F, Cl, Br или I, предпочтительно F или Cl. Термин "циклоалкил(С 3-С 6)" предпочтительно означает циклопропил, циклопентил или циклогек Термин "замещенный" (включая моно- и дизамещение) означает, что описываемая группа содержит 1, 2 или 3 заместителя, которые независимо друг от друга выбирают из группы, включающей алкил(С 1 С 6), О-алкил(С 1-С 6), галоген, CN и NO2. В случае гетероарильных групп заместитель может быть присоединен к гетероатому, такому как атом азота. Алкильные группы (также в составе -О-алкил, -NH-алкил и т.п.) включают прямые или разветвленные группы и предпочтительно содержат от 1 до 4 атомов углерода. Термин "фармацевтически приемлемая соль", использованный в данном контексте, включает любую соль органических и неорганических кислот, таких как бромисто-водородная, хлористо-водородная,фосфорная, азотная, серная, уксусная, адипиновая, аспарагиновая, бензолсульфоновая, бензойная, лимонная, этансульфоновая, муравьиная, фумаровая, глутаминовая, молочная, малеиновая, яблочная, малоновая, миндальная, метансульфоновая, 1,5-нафталиндисульфоновая, щавелевая, пиваловая, пропионовая, паратолуолсульфоновая, янтарная, винная и т.п. Предпочтительные соединения по настоящему изобретению перечислены нижеN-этил-N-3-[3-(5-метил[1,2,4]оксадиазол-3-ил)пиразоло[1,5-а]пиримидин-7-ил]фенилметансульфонамид. В другом варианте воплощения настоящего изобретения предлагается способ получения соединений формулы (I) и их фармацевтически приемлемых солей. В одном варианте воплощения настоящего изобретения предлагается способ лечения или профилактики заболеваний, связанных с модуляцией рецептора ГАМКА у млекопитающих, который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом варианте предлагается способ лечения или профилактики заболеваний, связанных с модуляцией рецептора 1-ГАМКА у млекопитающих, который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В одном варианте предлагается способ лечения или профилактики заболеваний, связанных с модуляцией рецептора 2-ГАМКА у млекопитающих, который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом варианте предлагается способ лечения или профилактики состояний тревоги у млекопитающих, который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В одном варианте предлагается способ лечения или профилактики эпилепсии у млекопитающих,который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом варианте предлагается способ лечения или профилактики расстройства сна у млекопитающих, который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В одном варианте предлагается способ лечения или профилактики бессонницы у млекопитающих,который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом варианте предлагается способ индукции млекопитающих в седативно-гипнотическое состояние, который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В одном варианте предлагается способ индукции анестезии у млекопитающих, который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом варианте предлагается способ модуляции необходимого периода времени для засыпания и продолжительности сна у млекопитающих, который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В одном варианте предлагается способ индукции мышечной релаксации у млекопитающих, который включает введение указанному млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом варианте предлагается фармацевтическая композиция, содержащее соединение формулы(I) или его фармацевтически приемлемую соль в смеси с терапевтически инертным носителем.-6 009519 Сведения, подтверждающие возможность осуществления изобретения Композиции включают композиции, пригодные для перорального, ректального и парентерального(включая подкожное, внутримышечное и внутривенное) введения, однако наиболее пригодный способ введения зависит от природы и тяжести состояния, предназначенного для лечения. Наиболее предпочтительным способом введения по настоящему изобретению является пероральное введение. Композиции обычно получают в виде стандартной лекарственной формы по известным методикам. Активное соединение смешивают с фармацевтическим носителем по стандартным методикам получения фармацевтических составов. Носитель может присутствовать в виде множества форм в зависимости от способа введения, например, перорального или парентерального способов (включая внутривенные инъекции или вливания). При получении композиций для перорального введения используют любые стандартные фармацевтические среды. Стандартные фармацевтические среды включают, например, воду, гликоли, масла, спирты, летучие агенты, консерванты, красители и т.п. в случае получения жидких композиций для орального введения (таких как, например, суспензии, растворы, эмульсии и эликсиры); или носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, замасливатели, связующие агенты, дезинтегрирующие агенты и т.п., в случае получения твердых композиций для перорального введения (таких как, например, порошки, капсулы и таблетки),причем предпочтительными являются твердые композиции для орального введения по сравнению с жидкими композициями для перорального введения. Таблетки и капсулы представляют собой самую предпочтительную лекарственную форму для перорального введения, при этом используют твердые фармацевтические носители. При необходимости на таблетки наносят покрытия по стандартным методикам с использованием водных и неводных растворов. Пригодный интервал дозировок включает от приблизительно 0,01 до приблизительно 100,00 мг в сутки, причем дозу можно вводить один раз в сутки или в виде разделенных доз. Соединения общей формулы (I) получают по реакции, показанной на схеме 1. Схема 1 Заместители R1, R2 и R3 описаны выше, а заместитель Q означает соответствующую уходящую группу, содержащую N(ди(С 1-С 6)алкил), (С 1-С 6)алкилтио и (С 1-С 6)алкокси. Предпочтительно Q выбирают из группы, включающей диметиламино, метилтио или метокси. Реакцию аминопиразола общей формулы (III) с соответственно замещенным 1-арил-2-пропен-1 оном (II) проводят в инертном полярном протонном или апротонном растворителе, таком как ледяная уксусная кислота, этанол, метанол, диметилформамид или диметилсульфоксид при температуре от 50 С до 130 С. Через несколько часов (время протекания реакции) растворитель удаляют и полученный остаток распределяют между водным раствором бикарбоната натрия и дихлорметаном. Неочищенное вещество, полученное после упаривания органического слоя досуха, очищают одним из следующих методов:(а) хроматографией на силикагеле (элюент: этилацетатилидихлорметан/метанол) или (б) кристаллизацией из пригодного растворителя (этилацетат, этанол, метанол и т.п.). Промежуточное соединение формулы (II), где Q означает диметиламино (промежуточное соединение (VI, получают с использованием последовательности реакций, показанных на схеме 2. Схема 2Chem. 9, 88-96, 1966). Алкилирование сульфонамидов (IV) с образованием промежуточных соединений формулы (V) проводят по методике, известной специалистам в органической химии при образовании аниона и последующей реакции с алкилгалогенилом. Енаминоны формулы (VI) получают по стандартным методикам синтеза енаминов, описанным в работе J.M. Domagala et al. (J. Heterocyclic Chem., 26(4), 1147-58, 1989) и K. Sawada et al. (Chem. Pharm.Bull., 49(7), 799-813, 2001) при взаимодействии ацетофенона с диметилацеталем N,N-диметилформамида(ДМА/ДМФ) или реагентом Бредерока (трет-бутоксибис(диметиламино)метаном). В другом варианте промежуточные соединения формулы (II), где Q означает диметиламино, a R2 означает метил (VII), получают по схеме 3. Схема 3 Превращение соединения формулы (IV) в соединение формулы (VII) приводит к образованию енаминона и одновременно к образованию N-метилсульфонамида в результате использования диметилацеталя N,N-диметилформамида в качестве метилирующего агента. Промежуточное соединение (VII) получают также по схеме 4. Схема 4 Преимущество данного метода заключается в том, что сульфонамиды образуются на последней стадии синтеза. В результате при масштабировании синтеза продукта снижается общее число стадий реакций. Более того, как показано на схеме, при превращении соединения (VIII) в соединение (IX) происходят три следующие реакции, протекающие в одном сосуде: (а) образованием анаминона, (б) метилирование трифторацетамида и (в) дезацилирование с образованием N-метилированного амина. На следующей стадии при взаимодействии соединения (IX) с соответствующим хлорангидридом сульфоновой кислоты получают промежуточные соединения (VII). Получение производных соединений (VII) при взаимодействии промежуточных соединений (VI) и диметилацеталя N,N-диметилформамида не описано в литературе и является еще одним вариантом воплощения настоящего изобретения. Аналогично, получение промежуточных соединений (VII) при взаимодействии N-(3-ацетилфенил)2,2,2-трифторацетамида (VIII) с диметилацеталем N,N-диметилформамида, за которым следует образование сульфонамида при реакции соответствующего хлорида сульфоновой кислоты, не описано в литературе и является другим вариантом воплощения настоящего изобретения. Из соединений общей формулы (I) при обработке соответствующими кислотами получают их фармацевтически приемлемые соли. Авторы заявки неожиданно установили, что соединения по настоящему изобретению характеризуются высокой афинностью к рецепторам 1 и 2-ГАМКА, как показано в табл. 1 и 2. Эти результаты, полученные при испытании in vitro, согласуются с результатами испытаний in vivo при тестировании седативно-гипнотического действия (табл. 3). Согласно полученным результатам определенные соединения по изобретению неожиданно проявляют фармакологическую активность при испытании in vitro и in vivo, причем указанная активность равна или выше активности соединений, описанных в предшествующем уровне техники. Полученные ре-8 009519 зультаты подтверждают возможность использования этих соединений для лечения заболеваний или состояний, опосредованных 1- и 2-рецепторами ГАМКА, таких как бессонница или анестезия, при которых требуется индукция сна, индукция седативного эффекта или индукция мышечной релаксации. Фармакологическую активность соединений по настоящему изобретению определяют, как описано ниже. Анализ связывания лигандов. Определение аффинности исследуемых заболеваний в отношении 1 и 2-рецепторов ГАМКА. В эксперименте используют самцов крыс Sprague-Dawley массой 200-250 г. После обезглавливания животных из них извлекают мозжечок (ткань, в которой наблюдается наибольшее содержание 1 рецептора ГАМКА) и спинной мозг (ткань, в которой наблюдается наибольшее содержание 2-рецептора ГАМКА). Из тканей получают мембранную фракцию по методике, как описано в статье J. Lameh et al.(Prog. Neuro-Psychopharmacol. Biol. Psychiatry, 24, 979-991, 2000). Ткань взвешивают и суспендируют в 50 мМ буферном растворе трис-HCl, pH 7,7 (1:40, об./об.), гомогенизируют и центрифугируют при 20000g в течение 10 мин при 7 С. Полученный осадок ресуспендируют в указанных условиях и снова центрифугируют. Полученный осадок ресуспендируют в минимальном объеме и хранят при -80 С в течение ночи. На следующий день процесс повторяют и получают конечный осадок, который ресуспендируют в соотношении 1:10 (об./об.). Аффинность соединений определяют с использованием конкурентного анализа и радиоактивно меченного флумазенила в качестве лиганда. Использованные методики описаны в статьях S. Arbilla et al.(Eur. J. Pharmacol., 130, 257-263, 1986) и Y. Wu et al. (Eur. J. Pharmacol., 278,125-132, 1995). Затем инкубируют смесь мембранной фракции, содержащей исследуемые рецепторы, флумазенил (радиоактивно меченный лиганд при концентрации 1 нМ) и возрастающие концентрации исследуемых соединений (в конечном объеме 500 мкл 50 нМ буферного раствора трис-HCl, pH 7,4). Одновременно инкубируют только мембранную фракцию в смеси с радиоактивно меченным флумазенилом (общее связывание, 100%) и в присутствии возрастающих концентраций немеченного флумазенила (неспецифическое связывание, оценка радиоактивно меченного лиганда в %). Реакцию индуцируют при добавлении радиоактивно меченного лиганда и смесь инкубируют в течение 60 мин при 0 С. При завершении инкубационного периода содержимое пробирок фильтруют через сборщик клеток Brandel Mod. M-48R harvester и затем три раза промывают холодным буферным раствором для анализа. В сборщик клеток устанавливают фильтр GF/B, который удерживает содержащую мембранные рецепторы фракцию, связанные с радиоактивно меченным лигандом. Фильтры извлекают и сушат на воздухе. Затем сухие фильтры разрезают, помещают во флаконы с сцинтилляционной жидкостью и инкубируют при перемешивании в течение ночи. На следующий день определяют радиоактивность фильтров на счетчике радиоактивности Packard Mod. Tricarb scintillation counter. Затем определяют процент специфического связывания для каждой концентрации исследуемого соединения по следующей формуле:% специфического связывания=(Х-N/T-N)100 где X означает количество связанного лиганда для каждой концентрации соединения,Т означает общее связывание, т.е. максимальное количество соединения, связанного с радиоактивным лигандом,N означает неспецифическое связывание, т.е. количество радиоактивного лиганда, неспецифически связанное с мембранами независимо от использованного рецептора. Эксперимент для каждой концентрации соединения проводят в двух повторах и используют средние значения для определения зависимости экспериментальной величины специфического связывания в% от концентрации соединения. Полученные данные анализируют с использованием уравнений для оценки конкурентного анализа с использованием программного обеспечения SigmaPlot, SPSS Inc., затем рассчитывают величины IC50 (концентрация соединения, необходимая для ингибирования специфического связывания на 50%). По данным IC50 рассчитывают величины константы ингибирования (Ki) по уравнению Ченга-Прусова (Y. Cheng and W. H. Prusoff, Biochem. Pharmacol., 22 (23), 3099-3108, 1973). В другом варианте данные аффинности к 2-субъединице выражают в виде ингибирования в % при концентрации 10-5 М и 10-7 М. Полученные результаты представлены в табл. 1 и 2. Определение in vivo прогнозируемого седативно-гипнотического действия. Действие указанных соединений оценивают in vivo при оценке прогнозируемого седативногипнотического действия на мышей (D.J. Sanger et al., Eur. J. Pharmacol., 313, 35-42 G.Griebel et al., Psychopharmacalogy, 146, 205-213, 1999). В эксперименте используют группы из 5-8 мышей CD1 с массой 22-26 г. Исследуемые соединения вводят однократной эквимолярной дозой (суспендируют в 0,25% агаре при добавлении 1 капли Твина в объеме 10 мл/кг) внутрибрюшинным способом. Контрольным животным вводят только носитель. Для оценки действия используют систему Actisystem DAS16 (Panlab, S.L., Испания). У каждой особи регистрируют число событий (число скрещиваний) с интервалом 5 мин в течение 30 мин после введения дозы. Процент ингибирования скрещивания у обработанных животных определяют по сравнению с контрольными животными (первые 5 мин не учитывают). Полученные результаты представлены в табл. 3. Таблица 3 Определение седативно-гипнотического действия у мышей Следующие примеры представлены для иллюстрации сущности настоящего изобретения и не ограничивают его объем. Пример 1. N-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]-N-метилметансульфонамид. 1,58 г (6,96 ммоль) N-(3-ацетилфенил)-N-метилметансульфонамида растворяют в 15 мл N,Nдиметилацеталя диметилформамида и полученный раствор кипятят с обратным холодильником в течение 18 ч. Избыток летучего реагента удаляют перегонкой при пониженном давлении, при этом получают неочищенный продукт, который очищают хроматографией на силикагеле (элюент: градиент этилацетат/метанол). При этом получают 1,12 г N-[3-[3-(диметиламино)-1-оксо-2-пропенил]фенил]-Nметилметансульфонамида в виде твердого вещества желтовато-белого цвета (выход 88,6%). 1 Н ЯМР (400 МГц, ДМСО-d6):2,91 (3 Н, s), 2,94 (3 Н, s), 3,14 (3 Н, s), 3,26 (3 Н, s), 5,79 (1 Н, d, J=12,4 Гц), 7,44 (1 Н, t, J=7,6 Гц), 7,49-7,52 (1 Н, m), 7,71 (1 Н, d, J=12,4 Гц), 7,78-7,81 (2 Н, m),МС (ES): m/z 283 (МН+), ВЭЖХ: 99,2%. Пример 2. N-[3-(3-Цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-метилметансульфонамид. Смесь 0,1 г (0,93 ммоль) 4-циано-2 Н-пиразол-3-иламина и 0,26 г (0,93 ммоль) N-[3-[3(диметиламино)-1-оксо-2-пропенил]фенил]-N-метилметансульфонамида в 10 мл ледяной уксусной кислоты кипятят с обратным холодильником в течение 8 ч и затем растворитель удаляют перегонкой при пониженном давлении. К полученному остатку добавляют 10 мл дихлорметана и 10 мл насыщенного раствора бикарбоната натрия. Два слоя разделяют и водный слой промывают 10 мл дихлорметана. Органический слой промывают 10 мл воды и сушат над сульфатом магния. Слой дихлорметана упаривают досуха, при этом получают масло, из которого перекристаллизацией из этилацетата получают 217 мг N- 16009519[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-метилметансульфонамида в виде твердого вещества желтого цвета (выход 71%, tпл. 193-195C). 1 Н ЯМР (400 МГц, ДМСО-d6):3,01 (3 Н, s), 3,30 (3 Н, s), 7,60 (1 Н, d, J=4,8 Гц), 7,65-7,67 (2 Н, m),8,00-8,02 (1 Н, m), 8,09 (1 Н, s), 8,85 (1 Н, s), 8,91 (1 Н, d, J=4,8 Гц),МС (ES): m/z 328 (МН+), ВЭЖХ: 95,9%. Пример 3. N-Метил-N-3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенилметансульфонамид. Смесь 0,1 г (0,52 ммоль) (5-амино-1H-пиразол-4-ил)тиофен-2-илметанона и 0,146 г (0,93 ммоль) N[3-(3-(диметиламино)-1-оксо-2-пропенил)фенил]-N-метилметансульфонамида (полученного, как описано в примере 2) в 10 мл ледяной уксусной кислоты кипятят с обратным холодильником в течение 8 ч и затем растворитель удаляют перегонкой при пониженном давлении. К полученному остатку добавляют 10 мл дихлорметана и 10 мл насыщенного раствора бикарбоната натрия. Два слоя разделяют, водный слой промывают 10 мл дихлорметана. Органический слой промываю 10 мл воды и сушат над сульфатом магния. Слой дихлорметана упаривают досуха, при этом получают масло, из которого перекристаллизацией из этилацетата получают 178 мг N-метил-N-3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7 ил]фенилметансульфонамида в виде твердого вещества желтого цвета (выход 83%, tпл. 169-170C). 1 Н ЯМР (400 МГц, ДМСО-d6):3,02 (3 Н, s), 3,32 (3 Н, s), 7,29 (1 Н, t, J=6 Гц), 7,54 (1 Н, d, J=4,4 Гц),7,62-7,67 (2 Н, m), 8,02-8,04 (2 Н, m), 8,11 (1 Н, s), 8,20 (1 Н, d, J=6 Гц), 8,80 (1 Н, s), 8,89 (1 Н, d, J=4,4 Гц),МС (ES): m/z 413 (МН+), ВЭЖХ: 99,2%. Пример 4. N-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]-N-этилметансульфонамид. 1,1 г (4,56 ммоль) N-(3-ацетилфенил)-N-этилметансульфонамида растворяют в 10 мл диметилацеталя N,N-диметилформамида и полученный раствор кипятят с обратным холодильником в течение 18 ч. Избыток летучего реагента удаляют перегонкой при пониженном давлении, при этом получают неочищенный продукт, который очищают хроматографией на силикагеле (элюент: градиент этилацетат/метанол). При этом получают 1,2 г N-[3-[3-(диметиламино)-1-оксо-2-пропенил]фенил]-Nэтилметансульфонамида в твердого вещества желтовато-белого цвета (выход 88,6%). 1 Н ЯМР (400 МГц, CDCl3):1,23 (3 Н, t, J=7,2 Гц), 2,88 (3 Н, s), 2,94 (3 Н, s), 3,16 (3 Н, s), 3,76 (2 Н, q,J=7,2 Гц), 5,66 (1 Н, d, J=12 Гц), 7,41-7,44 (2 Н, m), 7,79 (1 Н, d, J=12 Гц), 7,80-7,84 (2 Н, m),ВЭЖХ: 95,6%. Пример 5. N-[3-(3-Цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-этилметансульфонамид. Смесь 0,196 г (1,82 ммоль) 4-циано-2 Н-пиразол-3-иламина и 0,54 г (1,82 ммоль) N-[3-[3(диметиламино)-1-оксо-2-пропенил]фенил]-N-этилметансульфонамида в 10 мл ледяной уксусной кислоты кипятят с обратным холодильником в течение 8 ч и затем растворитель удаляют перегонкой при пониженном давлении. К полученному остатку добавляют 10 мл дихлорметана и 10 мл насыщенного раствора бикарбоната натрия. Два слоя разделяют, и водный слой промывают 10 мл дихлорметана. Органический слой промывают 10 мл воды и сушат над сульфатом магния. Слой дихлорметана упаривают досуха, при этом получают масло, из которого перекристаллизацией из этилацетата получают 324 мг N-[3-(3 цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-этилметансульфонамида в виде твердого вещества желтого цвета (выход 52,4%). 1 Н ЯМР (400 МГц, CDCl3):1,21 (3 Н, t, J=7,2 Гц), 2,95 (3 Н, s), 3,81 (2 Н, q, J=6,8 Гц), 7,21 (1 Н, d,J=4,4 Гц), 7,58-7,60 (1 Н, m), 7,64 (1 Н, t, J=7,6 Гц), 7,98 (1 Н, d, J=7,2 Гц), 8,06 (1 Н, s), 8,41 (1 Н, s), 8,78 (1 Н,d, J=4 Гц),МС (ES): m/z 342 (МН+), ВЭЖХ: 98,9%. Пример 6.N-Этил-N-3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенилметансульфонамид. Смесь 0,36 г (1,86 ммоль) (5-амино-1 Н-пиразол-4-ил)тиофен-2-илметанона и 0,55 г (1,86 ммоль) N[3-[3-(диметиламино)-1-оксо-2-пропенил]фенил]-N-этилметансульфонамида в 10 мл ледяной уксусной кислоты кипятят с обратным холодильником в течение 8 ч. Затем реакционную смесь охлаждают, образующийся осадок отфильтровывают, промывают сначала уксусной кислотой, затем насыщенным раствором бикарбоната натрия и наконец водой. При этом получают 472 мг N-этил-N-3-[3-(тиофен-2 карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенилметансульфонамид в виде твердого вещества желтого цвета (выход 59,5%). 1 Н ЯМР (400 МГц, CDCl3):1,23 (3 Н, t, J=7,6 Гц), 2,97 (3 Н, s), 3,82 (2 Н, q, J=6,8 Гц), 7,17 (1 Н, d,J=4,4 Гц), 7,18-7,20 (1 Н, m), 7,57-7,60 (2 Н, m), 7,62 (1 Н, t, J=7,2 Гц), 7,69 (1 Н, dd, J=4,8 и 1,2 Гц), 7,99-8,02(1 Н, m), 8,07-8,1 (3 Н, m), 8,69 (1 Н, s), 8,80 (1 Н, d, J=4,4 Гц),МС (ES): m/z 427 (МН+), ВЭЖХ: 98,3%. Пример 7. N-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]-N-метилбензолсульфонамид. 1,25 г (4,32 ммоль) N-(3-ацетилфенил)-N-метилбензолсульфонамида растворяют в 10 мл диметилацеталя N,N-диметилформамида и полученный раствор кипятят с обратным холодильником в течение 18 ч. Избыток летучего реагента удаляют перегонкой при пониженном давлении, при этом получают неочищенный продукт, который очищают хроматографией на силикагеле (элюент: градиент этилаце- 17009519 тат/метанол). При этом получают 1,25 г N-[3-[3-(диметиламино)-1-оксо-2-пропенил]фенил]-Nметилбензолсульфонамида в виде твердого вещества желтовато-белого цвета (выход 84%). 1 Н ЯМР (400 МГц, CDCl3):2,92 (3 Н, s), 3,15 (3 Н, s), 3,19 (3 Н, s), 5,58 (1 Н, d, J=12 Гц), 7,21-7,23(1 Н, m), 7,33 (1 Н, t, J=8 Гц), 7,41-7,46 (2 Н, m), 7,52-7,58 (4 Н, m), 7,76 (1 Н, d, J=12 Гц), 7,77-7,80 (1 Н, m),ВЭЖХ: 100%. Пример 8. N-[3-(3-Цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-метилбензилсульфонамид. Смесь 0,134 г (1,24 ммоль) 4-циано-2 Н-пиразол-3-иламина и 0,43 г (1,24 ммоль) N-[3-[3(диметиламино)-1-оксо-2-пропенил]фенил]-N-метилбензолсульфонамида в 10 мл ледяной уксусной кислоты кипятят с обратным холодильником в течение 8 ч и затем растворитель удаляют перегонкой при пониженном давлении. К полученному остатку добавляют 10 мл дихлорметана и 10 мл насыщенного раствора бикарбоната натрия. Два слоя разделяют, и водный слой промывают 10 мл дихлорметана. Органический слой промывают 10 мл воды и сушат над сульфатом магния. Слой дихлорметана упаривают досуха, при этом получают масло, из которого перекристаллизацией из этилацетата получают 205 мг N[3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-метилбензолсульфонамида в виде твердого вещества желтого цвета (выход 42%). 1 Н ЯМР (400 МГц, CDCl3):3,23 (3 Н, s), 7,13 (1 Н, d, J=4,8 Гц), 7,25-7,30 (1 Н, m), 7,45-7,63 (6 Н, m),7,83 (1 Н, s), 7,93-7,97 (1 Н, m), 8,37 (1 Н, s), 8,75 (1 Н, d, J=4,5 Гц),МС (ES): m/z 390 (МН+), ВЭЖХ: 99,0%. Пример 9. N-Метил-N-3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенилбензолсульфонамид. Смесь 0,43 г (2,23 ммоль) (5-амино-1H-пиразол-4-ил)тиофен-2-илметанона и 0,8 г (2,23 ммоль) N[3-[3-(диметиламино)-1-оксо-2-пропенил]фенил]-N-метилметансульфонамида в 10 мл ледяной уксусной кислоты кипятят с обратным холодильником в течение 8 ч и затем растворитель удаляют перегонкой при пониженном давлении. К полученному остатку добавляют 10 мл дихлорметана и 10 мл насыщенного раствора бикарбоната натрия. Два слоя разделяют и водный слой промывают 10 мл дихлорметана. Органический слой промывают 10 мл воды и сушат над сульфатом магния. Слой дихлорметана упаривают досуха, при этом получают масло, из которого перекристаллизацией из этилацетата получают 872 мг Nметил-N-3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенилбензолсульфонамида в виде твердого вещества желтого цвета (выход 82,3%). 1 Н ЯМР(400 МГц, CDCl3):3,24 (3 Н, s), 7,07 (1 Н, d, J=4,4 Гц), 7,19 (1 Н, t, J=4 Гц), 7,28-7,31 (1 Н, m),7,46-7,62 (6 Н, m), 7,7 (1 Н, d, J=5,2 Гц), 7,82 (1 Н, t, J=2 Гц), 7,97 (1 Н, d, J=6,8 Гц), 8,09 (1 Н, d, J=3,6 Гц),8,66 (1 Н, s), 8,79 (1 Н, d, J=4,4 Гц),МС (ES): m/z 475 (МН+), ВЭЖХ: 97,9%. Пример 10. N-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]-N-этилбензолсульфонамид. 1,05 г (3,46 ммоль) N-(3-ацетилфенил)-N-этилбензолсульфонамида растворяют в 10 мл диметилацеталя N,N-диметилформамида и полученный раствор кипятят с обратным холодильником в течение 18 ч. Избыток летучего реагента удаляют перегонкой при пониженном давлении, при этом получают неочищенный продукт, который очищают хроматографией на силикагеле (элюент: градиент этилацетат/метанол). При этом получают 1,2 г N-[3-[3-(диметиламино)-1-оксо-2-пропенил]фенил]-Nэтилбензолсульфонамида в твердого вещества желтовато-белого цвета (выход 96%). 1 Н ЯМР (400 МГц, CDCl3):1,06 (3 Н, t, J=7,2 Гц), 2,92 (3 Н, s), 3,15 (3 Н, s), 3,62 (2 Н, q, J=7,6 Гц),5,56 (1 Н, d, J=12,4 Гц), 7,14-7,17 (1 Н, m), 7,35 (1 Н, t, J=7,6 Гц), 7,42-7,49 (3 Н, m), 7,52-7,60 (3 Н, m), 7,76(1 Н, d, J=12,4 Гц), 7,81 (1 Н, d, J=8 Гц),ВЭЖХ: 100%. Пример 11. N-[3-(3-Цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-этилбензолсульфонамид. Смесь 0,15 г (1,38 ммоль) 4-циано-2 Н-пиразол-3-иламина и 0,50 г (1,38 ммоль) N-[3-[3(диметиламино)-1-оксо-2-пропенил]фенил]-N-этилбензолсульфонамида в 10 мл ледяной уксусной кислоты кипятят с обратным холодильником в течение 8 ч и затем растворитель удаляют перегонкой при пониженном давлении. К полученному остатку добавляют 10 мл дихлорметана и 10 мл насыщенного раствора бикарбоната натрия. Два слоя разделяют и водный слой промывают 10 мл дихлорметана. Органический слой промывают 10 мл воды и сушат над сульфатом магния. Слой дихлорметана упаривают досуха, при этом получают масло, из которого перекристаллизацией из этилацетата получают 260 мг N-[3-(3 цианопиразоло[1,5-а]пиримидин-7-ил)фенил]-N-этилбензолсульфонамида в виде твердого вещества желтого цвета (выход 47%). 1 Н ЯМР (400 МГц, CDCl3):1,14 (3 Н, t, J=6,8 Гц), 3,66 (2 Н, q, J=7,2 Гц), 7,12 (1 Н, d, J=4,8 Гц), 7,26- 18009519 кислоты кипятят с обратным холодильником в течение 8 ч и затем растворитель удаляют перегонкой при пониженном давлении. К полученному остатку добавляют 10 мл дихлорметана и 10 мл насыщенного раствора бикарбоната натрия. Два слоя разделяют и водный слой промывают 10 мл дихлорметана. Органический слой промывают 10 мл воды и сушат над сульфатом магния. Слой дихлорметана упаривают досуха, при этом получают масло, из которого перекристаллизацией из этилацетата получают 535 мг Nэтил-N-3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенилбензолсульфонамида в виде твердого вещества желтого цвета (выход 64,4%). 1 Н ЯМР (400 МГц, CDCl3):1,15 (3 Н, t, J=7,6 Гц), 3,67 (2 Н, q, J=7,6 Гц), 7,07 (1 Н, d, J=4,4 Гц), 7,187,21 (1 Н, m), 7,27-7,30 (1 Н, m), 7,51 (2 Н, d, J=7,6 Гц), 7,56 (1 Н, t, J=7,6 Гц), 7,60-7,67 (4 Н, m), 7,69 (1 Н, dd,J=5,2 и 1,2 Гц), 7,75 (1 Н, t, J=2 Гц), 8,06 (1 Н, d, J=7,6 Гц), 8,09 (1 Н, t, J=7,6 Гц), 8,67 (1 Н, s), 8,79 (1 Н, d,J=4,4 Гц),МС (ES): m/z 489 (МН+), ВЭЖХ: 97,9%. Пример 13. Общая методика получения N-метиленаминсульфонамидов общей формулы (VI) по схеме 2.N-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]-N-этилэтансульфонамид. 2 г (8,8 ммоль) N-(3-ацетилфенил)этансульфонамида растворяют в 15 мл диметилацеталя N,Nдиметилформамида и нагревают при 150 С в течение 12 ч. Растворитель удаляют перегонкой при пониженном давлении, при этом получают неочищенный продукт, который очищают хроматографией на силикагеле (элюент: этилацетат/метанол). При этом получают 1,4 г N-[3-[3-(диметиламино)-1-оксо-2 пропенил]фенил]-N-этансульфонамида (выход 56%). 0,25 г (0,89 ммоль) N-[3-[3-(диметиламино)-1-оксо-2-пропенил]фенил]этансульфонамида растворяют в 6 мл сухого N,N-диметилформамида. К раствору, полученному при 0 С и в инертной атмосфере,добавляют 0,043 г (1,08 ммоль) гидрида натрия. После перемешивания в течение 30 мин добавляют 0,15 г(0,98 ммоль) этилиодида и перемешивание продолжают при комнатной температуре в течение 5 ч. К реакционной смеси добавляют 1 мл воды и 20 мл 0,5 М раствора гидроксида натрия. Продукт экстрагируют 325 мл дихлорметана и органические слои промывают 25 мл воды, сушат над безводным сульфатом натрия, фильтруют и упаривают досуха перегонкой при пониженном давлении. При этом получают 0,25 г (выход 90%) N-[3-[3-(диметиламино)-1-оксо-2-пропенил]фенил]этансульфонамида в виде масла. 1 Н ЯМР (400 МГц, CDCl3):1,12 (3 Н, t, J=6,8 Гц), 1,37 (3 Н, t, J=7,6 Гц), 2,94 (3 Н, s), 3,01 (2 Н, q,J=7,6 Гц), 3,15 (3 Н, s), 4,79 (2 Н, q, J=8,2 Гц), 5,66 (1 Н, d, J=12,4 Гц), 7,39-7,46 (2 Н, m), 7,77-7,84 (3 Н, m),ВЭЖХ: 99%. Следующие соединения получают по описанной выше общей методике.N-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]-N-пропаргилизопропансульфонамид. 1 Н ЯМР (400 МГц, CDCl3):1,4 (6 Н, d, J=6,4 Гц), 2,37 (1 Н, t, J=2,4 Гц), 2,94 (3 Н, s), 3,17 (3 Н, s),3,34-3,41 (1 Н, m), 4,49 (2 Н, d, J=2,8 Гц), 5,66 (1 Н, d, J=12,4 Гц), 7,40-7,44 (1H, m), 7,59-7,62 (1 Н, m), 7,787,87 (2 Н, m), 7,99-8,00 (1 Н, m),ВЭЖХ: 81%. Пример 14. Основная методика получения N-метиленаминосульфонамидов общей формулы (VII) согласно схеме 3.N-(3-Ацетилфенил)-1-пропансульфонамид. 3-Аминоацетофенон (1 г, 7,4 ммоль) растворяют в 35 мл безводного дихлорметана. Полученный раствор охлаждают до 0 С и добавляют 0,89 мл (11,09 ммоль) безводного пиридина и 1,26 г (8,87 ммоль) хлорангидрида 1-пропансульфоновой кислоты. После перемешивания реакционной смеси в инертной атмосфере при комнатной температуре в течение 20 ч к смеси добавляют 15 мл воды. Два слоя разделяют, и водный слой промывают 2 раза по 15 мл дихлорметана. Органические слои промывают 30 мл воды и сушат над безводным сульфатом натрия. Слой дихлорметана упаривают досуха, при этом получают 1,8 г (выход 100%) N-(3-ацетилфенил)-1-пропансульфонамида в виде твердого вещества желтого цвета,который непосредственно используют на следующей стадии.N-(3-Ацетилфенил)-1-пропансульфонамид (1 г, 4,14 ммоль) растворяют в 10 мл N,Nдиметилформамида. В полученный раствор добавляют 2,77 мл (20,74 ммоль) диметилацеталя N,Nдиметилформамида и нагревают при 150 С в течение 2 ч. После удаления растворителя упариванием при пониженном давлении получают масло, которое обрабатывают смесью этилацетат/этиловый эфир. Небольшое количество осадка удаляют. Фильтрат упаривают досуха, растворяют в дихлорметане, органический слой промывают 4 раза по 50 мл воды и упаривают досуха, при этом получают 1,23 г (выход 96%)N-[3-[3-(диметиламино)-1-оксо-2-пропенил]фенил]-N-метил-1-пропансульфонамида. 1 Н ЯМР (400 МГц, CDCl3):0,99 (3 Н, t, J=7,6 Гц), 1,75-1,90 (2 Н, m), 2,91-2,97 (5 Н, m), 3,15 (3 Н, а),3,35 (3 Н, s), 5,66 (1 Н, d, J=12,5 Гц), 7,36-7,52 (2 Н, m), 7,73-7,88 (3 Н, m). Следующие соединения получают по описанной выше основной методике.N-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]-N-метилциклопентилметансульфонамид. 1 Н ЯМР (400 МГц, CDCl3):1,22-1,3 (2 Н, m), 1,55-1,63 (4 Н, m), 1,91-1,98 (2 Н, m), 2,27-2,4 (1 Н, m),2,86-2,93 (5 Н, m), 3,15 (3 Н, а), 3,34 (3 Н, s), 5,67 (1 Н, d, J=12,5 Гц), 7,37-7,52 (2 Н, m), 7,44-7,98 (3 Н, m). Пример 15. Основная методика получения N-метиленаминосульфонамидов общей формулы (VII) согласно схеме 4.N-(3-Ацетилфенил)-2,2,2-трифторацетамид. 3-Аминоацетофенон (5 г, 37 ммоль) растворяют в 30 мл безводного дихлорметана. В полученный раствор при 0 С добавляют 3,15 мл (38,84 ммоль) безводного пиридина и 5,5 мл (38,84 ммоль) ангидрида трифторуксусной кислоты. Реакционную смесь перемешивают при той же температуре в течение 30 мин и выливают в 100 мл смеси воды со льдом, затем добавляют 100 мл насыщенного раствора хлорида натрия и экстрагируют 2 раза по 70 мл дихлорметана и 3 раза по 50 мл этилацетата. Органические слои промывают водой, сушат над безводным сульфатом натрия и упаривают досуха при пониженном давлении, при этом получают 8,7 г (выход 100%) N-(3-ацетилфенил)-2,2,2-трифторацетамида в виде твердого вещества. 1 Н ЯМР(400 МГц, CDCl3):2,64 (3 Н, s), 7,53 (1 Н, t, J=7,6 Гц), 7,82 (1 Н, d, J=7,6 Гц), 8,15 (1 Н, d,1N-(3-Ацетилфенил)-2,2,2-трифторацетамид (8,37 г, 36,21 ммоль) растворяют в 80 мл N,Nдиметилформамида. В полученный раствор добавляют 24,23 мл (181,02 ммоль) диметилацеталя N,Nдиметилформамида и нагревают при 150 С в течение 2 ч. Растворитель удаляют упариванием при пониженном давлении, при этом получают масло, которое обрабатывают 50 мл воды и экстрагируют 3 раза по 100 мл дихлорметана. Органические слои промывают 2 раза по 200 мл насыщенного раствора хлорида натрия, сушат над безводным сульфатом натрия и упаривают досуха при пониженном давлении. При осаждении смесью этанол/этиловый эфир получают 4,1 г (выход 55%) 3-(диметиламино)-1-[3(метиламино)фенил]проп-2-ен-1-она в виде твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):2,85 (3 Н, s), 2,87 (3 Н, s), 3,11 (3 Н, s), 3,85 (1 Н, а), 5,68 (1 Н, d, J=12,2 Гц), 6,67-6,72 (1 Н, m), 7,16-7,24 (3 Н, m), 7,77 (1 Н, d, J=12,2 Гц).N-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]-N-метил-2-фенилэтиленсульфонамид. 3-(Диметиламино)-1-[3-(метиламино)фенил]проп-2-ен-1-он (0,4 г, 1,96 ммоль) растворяют в 15 мл безводного дихлорметана. В полученный раствор добавляют 0,24 мл (2,01 ммоль) безводного пиридина и 0,48 г (2,37 ммоль) хлорангидрида 2-фенилэтенсульфоновой кислоты. После перемешивания реакционной смеси в инертной атмосфере при комнатной температуре в течение 17 ч к смеси добавляют 15 мл воды. Два слоя разделяют, и водный слой промывают 2 раза по 15 мл дихлорметана. Органические слои промывают 30 мл воды и сушат над безводным сульфатом натрия. Слой дихлорметана упаривают досуха, при этом получают неочищенное вещество, которое очищают хроматографией на силикагеле с использованием в качестве элюента смеси дихлорметан/метанол, при этом получают 0,53 (выход 73%) N[3-[3-(диметиламино)-1-оксо-2-пропенил]фенил]-N-метил-2-фенилэтиленсульфонамида в виде твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):2,9 (3 Н, а), 3,16 (3 Н, а), 3,31 (3 Н, s), 5,65 (1 Н, d, J=12,5 Гц), 6,7 (1 Н, d,J=15,5 Гц), 7,38-7,5 (8 Н, m), 7,77-7,85 (3 Н, m). Следующие соединения получают по описанной выше основной методике.N-[3-[3-(Диметиламино)-1-оксо-2-пропенил]фенил]-N-метил-1,3,5-триметил-4 пиразолсульфонамид. 1 Н ЯМР (400 МГц, CDCl3):1,96 (3 Н, s), 2,84 (3 Н, а), 3,16 (3 Н, а), 3,2 (3 Н, а), 3,68 (3 Н, s), 5,63 (1 Н,d, J=12,5 Гц), 7,34-7,37 (2 Н, m), 7,63 (1 Н, m), 7,76-7,82 (2 Н, m). Пример 16. Основная методика получения пиразоло[1,5-а]пиримидинов общей формулы (I) согласно схеме 1.N-Проп-2-инил-N-3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенилметансульфонамид. 4-Тиофен-2-карбонил-2 Н-пиразол-3-иламин (0,1 г, 0,33 ммоль) и N-[3-[3-(диметиламино)-1-оксо-2 пропенил]фенил]-N-проп-2-инилметансульфонамид (0,063 г, 0,33 ммоль) растворяют в 10 мл ледяной уксусной кислоты. После кипячения с обратным холодильником в течение 8 ч растворитель удаляют упариванием при пониженном давлении. К полученному остатку добавляют 10 мл дихлорметана и 10 мл насыщенного раствора бикарбоната натрия. Два слоя разделяют, и водный слой промывают 10 мл дихлорметана. Органические слои промывают 10 мл воды и сушат над сульфатом магния. Слой дихлорметана упаривают досуха, при этом получают масло, из которого в присутствии этилацетата получают 111 мгN-проп-2-инил-N-3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7 ил]фенилметансульфонамида в виде твердого вещества желтого цвета. 1 Н ЯМР (400 МГц, CDCl3):2,54 (1 Н, s), 3,12 (3 Н, s), 4,54 (2 Н, s), 7,15 (1 Н, d, J=4 Гц), 7,19-7,21 (1 Н,m), 7,65 (1 Н, t, J=7,6 Гц), 7,69-7,71 (1 Н, m), 7,84-7,87 (1 Н, m), 8,03-8,06 (1 Н, m), 8,08-8,10 (1 Н, m), 8,31(1 Н, t, J=2 Гц), 8,71 (1 Н, s), 8,82 (1 Н, d, J=4,4 Гц),MC (ES): m/z 437 (MH+), ВЭЖХ: 100%. Следующие соединения получают по основной методике, описанной в примере 16. Пример 17. N-Пропил-N-3-[3-(тиофен-2-карбонил)пиразоло[1,5-а]пиримидин-7-ил]фенилэтансульфонамид. 1 Н ЯМР (400 МГц, CDCl3):0,94 (3 Н, t, J=7,6 Гц), 1,42 (3 Н, t, J=7,6 Гц), 1,54-1,63 (2 Н, m), 3,08-3,31
МПК / Метки
МПК: C07D 487/04, A61P 25/00, A61K 31/505
Метки: модуляцией, способ, варианты, производные, лекарственное, заболеваний, рецептора, используемые, профилактики, связанных, лечения, получения, пиразоло[1,5-а]пиримидинов, соединения, нем, гамка, промежуточные, средство
Код ссылки
<a href="https://eas.patents.su/30-9519-proizvodnye-pirazolo15-apirimidinov-sposob-ih-polucheniya-i-ispolzuemye-v-nem-promezhutochnye-soedineniya-varianty-lekarstvennoe-sredstvo-varianty-i-sposob-lecheniya-ili-profilakti.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиразоло[1,5-а]пиримидинов, способ их получения и используемые в нем промежуточные соединения (варианты), лекарственное средство (варианты) и способ лечения или профилактики заболеваний, связанных с модуляцией рецептора гамка (варианты)</a>