Производные 6-[2-(фосфонометокси)алкокси]пиримидинов, обладающие антивирусной активностью, способ их получения (варианты) и способ лечения вирусной инфекции
Номер патента: 6020
Опубликовано: 25.08.2005
Авторы: Де Клерк Эрик Десире Алиса, Бальзарини Ян М.Р., Голи Антонин
Формула / Реферат
1. Соединение формулы I
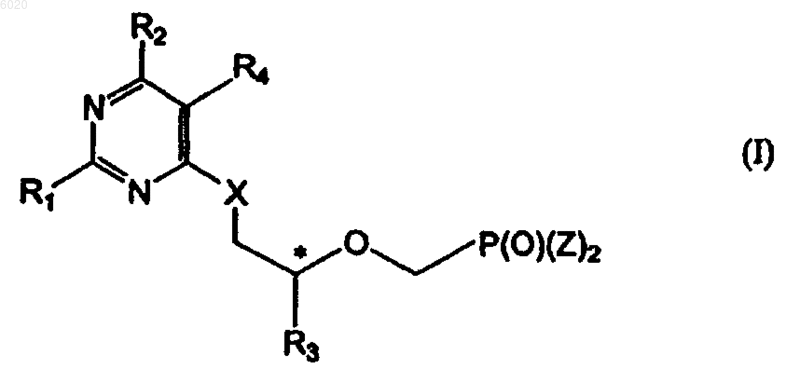
где R1 означает водород, амино или метилсульфанил,
R2 означает водород, метил, галоген, -N(R5)2, гидрокси, защищенную гидроксигруппу или группу формулы Ia
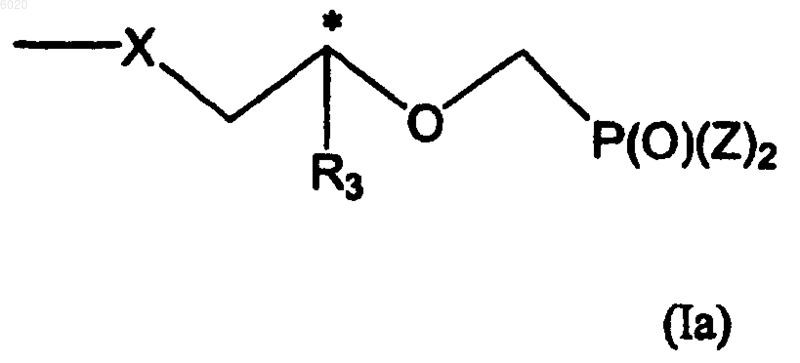
R3 независимо означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,
R4 означает водород или галоген,
X независимо означает кислород, серу или связь,
Z независимо означает гидрокси, сложный эфир или амид,
R5 независимо означает водород, C1-C8алкил или защитную группу и
* означает хиральный атом углерода;
и его соли и сольваты.
2. Соединение по п.1, в котором R1 и R2 означают амино, R3 означает водород, а X означает кислород.
3. Соединение по п.1, в котором R1 и R2 одновременно означают амино, R3 означает метил, X означает кислород, а R3 находится в конфигурации (R).
4. Соединение по п.1, в котором R1 и R2 одновременно означают амино, R3 означает гидроксиметил, X означает кислород, а R3 находится в конфигурации (R).
5. Соединение по п.1, в котором R1 и R2 одновременно означают амино, R3 означает водород, а X означает серу.
6. Соединение по п.1, в котором R1 означает амино, R2 означает гидрокси, R3 означает водород, а X означает кислород.
7. Соединение по п.1, которое имеет кристаллическую структуру.
8. Соединение по п.1, которое является практически чистым энантиомером по хиральному атому углерода.
9. Соединение по п.8, которое находится в (R) конфигурации.
10. Соединение по п.8, которое находится в (S) конфигурации.
11. 2,4-Диамино-6-[2-(фосфонометокси)этокси]пиримидин.
12. 2,4-Диамино-6-(R)-[2-(фосфонометокси)пропокси]пиримидин.
13. 2-Амино-4-гидрокси-6-[2-(фосфонометокси)этокси]пиримидин.
14. 2,4-Диамино-6-[(S)-3-гидрокси-2-(фосфонометокси)пропокси]пиримидин.
15. 2,4-Диамино-6-[(RS)-3-гидрокси-2-(фосфонометокси)пропокси]пиримидин.
16. 2-Амино-4-гидрокси-6-[(R)-2-(фосфонометокси)пропокси]пиримидин.
17. 2-Амино-4-гидрокси-6-[(RS)-3-гидрокси-2-(фосфонометокси)пропокси]пиримидин.
18. 2-Амино-4-гидрокси-6-[(S)-3-гидрокси-2-(фосфонометокси)пропокси]пиримидин.
19. 2,4-Диамино-5-бром-6-[2-(фосфонометокси)этокси]пиримидин.
20. 2-Амино-5-бром-4-гидрокси-6-[2-(фосфонометокси)этокси]пиримидин.
21. Композиция, содержащая фармацевтически приемлемый наполнитель и соединение по п.1.
22. Способ получения соединений формулы I
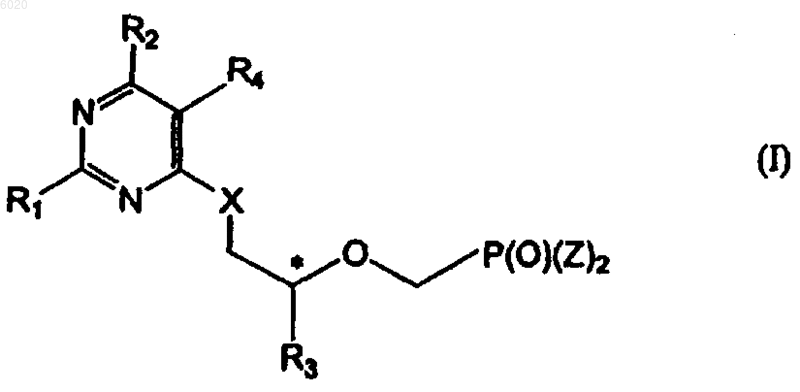
где R1 означает водород, амино или метилсульфанил,
R2 означает водород, метил, галоген, -N(R5)2, гидрокси, защищенную гидроксигруппу или группу формулы Ia
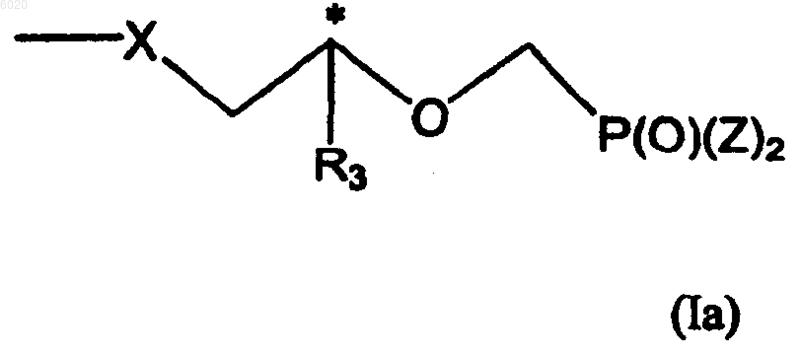
R3 независимо означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,
R4 означает водород или галоген,
X независимо означает кислород, серу или связь,
Z независимо означает гидрокси, сложный эфир или амид,
R5 независимо означает водород, C1-C8алкил или защитную группу и
* означает хиральный атом углерода,
отличающийся тем, что осуществляют взаимодействие соединения формулы II
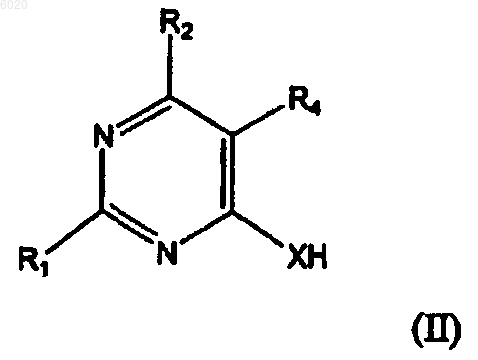
где R2 означает водород, метил, галоген, -N(R5)2, гидрокси или защищенную гидроксигруппу, а
X означает O или S;
с соединением формулы III
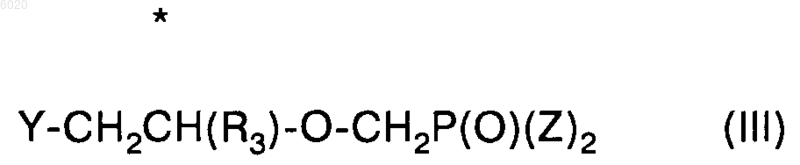
где Z означает сложный эфир или амид,
* означает хиральный атом углерода,
R3 означает водород, метил, галогенметил или защищенный гидроксиметил, а
Y означает уходящую группу, в диполярном апротонном растворителе в присутствии основания.
23. Способ по п.22, отличающийся тем, что дополнительно проводят выделение полученного соединения формулы I.
24. Способ по п.22, отличающийся тем, что Z означает сложный эфир или амид, при этом дополнительно осуществляют гидролиз одной или обеих групп Z с образованием соединения формулы I, где по крайней мере одна группа Z означает гидрокси.
25. Способ по п.22, отличающийся тем, что Z означает (OR4)2, а R4 означает изопропил.
26. Способ по п.22, отличающийся тем, что R3 означает метил, а Y означает п-толуолсульфонилокси.
27. Способ получения соединений формулы I
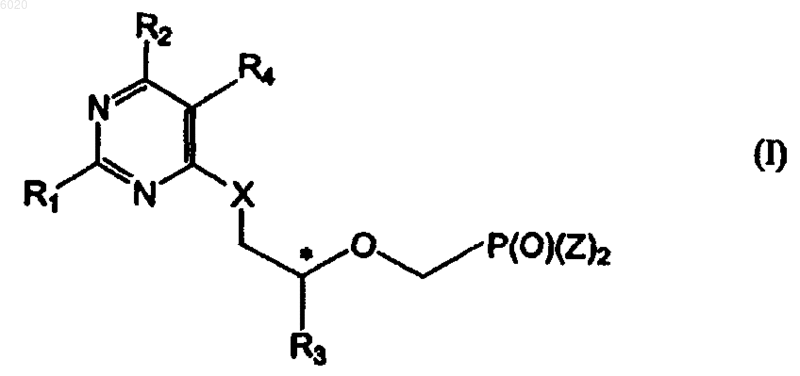
где R1 означает водород, амино или метилсульфанил,
R2 означает -N(R5)2,
R3 независимо означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,
R4 означает водород или галоген,
X означает кислород или серу,
Z независимо означает гидрокси, сложный эфир или амид,
R5 независимо означает водород, C1-C8алкил или защитную группу и
* означает хиральный атом углерода,
отличающийся тем, что осуществляют взаимодействие соединения формулы IV
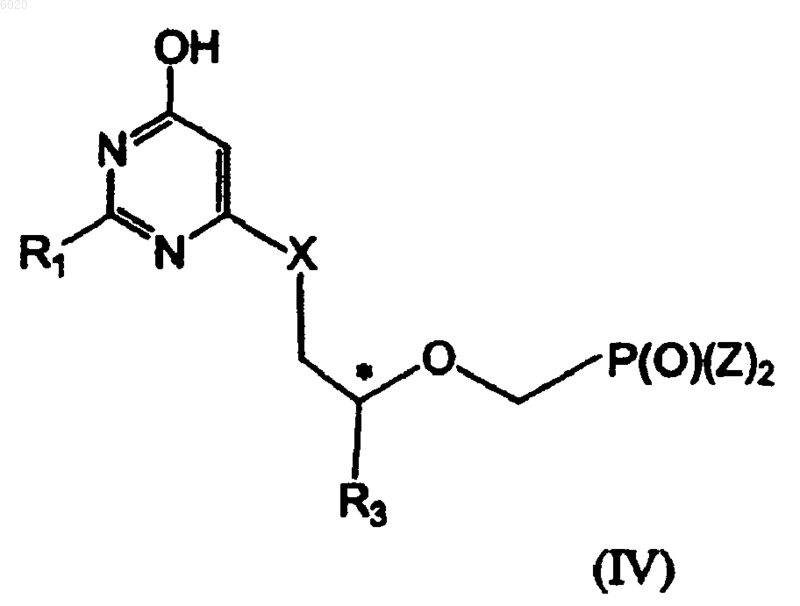
где R3 означает водород, метил, галогенметил или защищенный гидроксиметил,
X означает O или S, а
Z означает амидат или сложный эфир;
с N(R5)2.
28. Способ по п.27, отличающийся тем, что дополнительно проводят гидролиз одной или обеих групп Z с образованием соединения формулы I, где одна или обе группы Z означают гидрокси.
29. Способ получения соединений формулы (V)
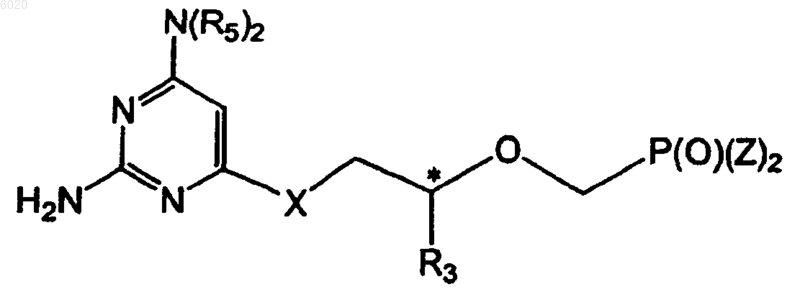
где R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,
R5 независимо означает водород, C1-C8алкил или защитную группу, X означает кислород или серу,
Z независимо означает гидрокси, сложный эфир или амид, а
* означает хиральный атом углерода,
отличающийся тем, что осуществляют взаимодействие соединения IVa
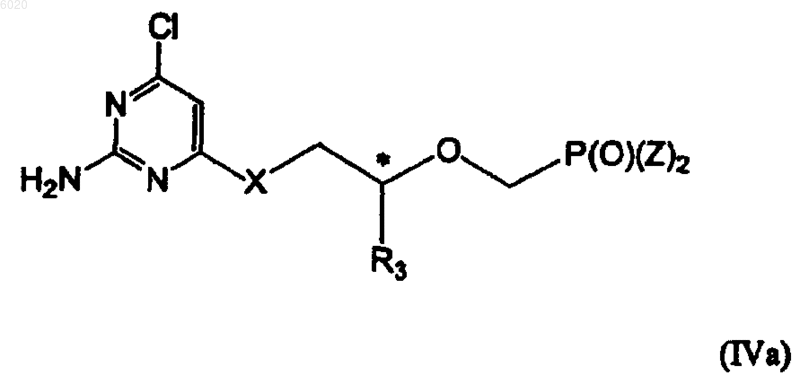
с N(R5)2 в безводном растворителе в присутствии гидроксида щелочного металла или карбоната щелочного металла в водном растворителе.
30. Способ получения соединений формулы (VI)
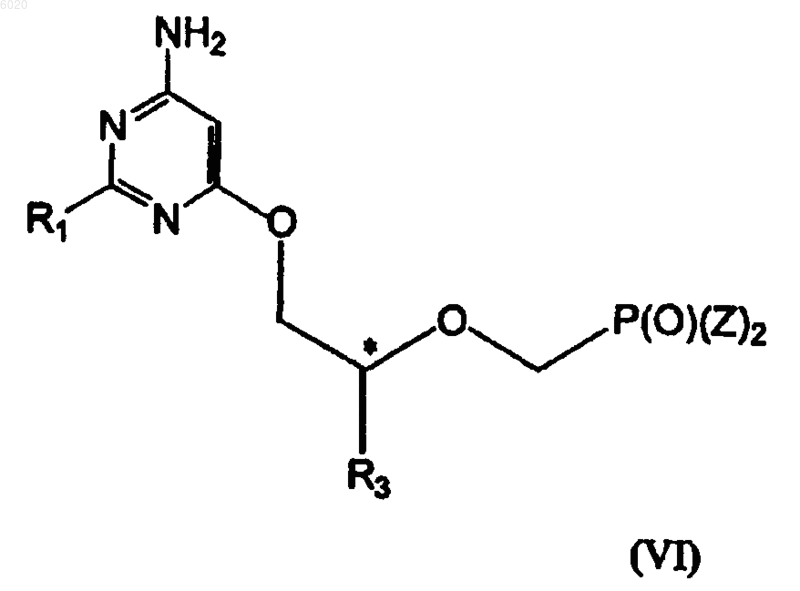
где R1 означает водород, амино или метилсульфанил,
R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,
Z независимо означает гидрокси, сложный эфир или амид, а
* означает хиральный атом углерода,
отличающийся тем, что осуществляют взаимодействие соединения VII
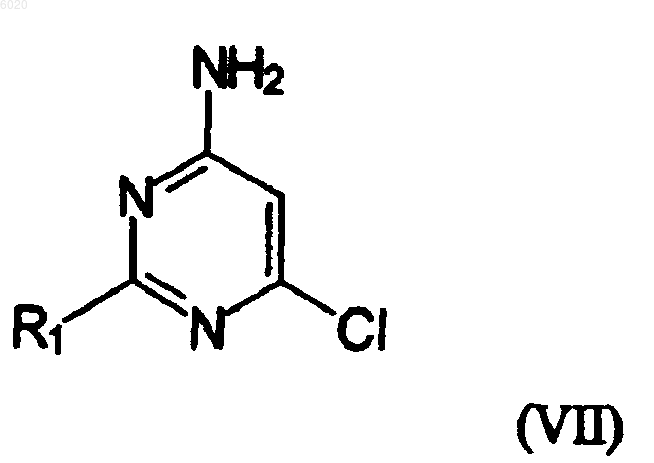
где R1 означает водород, амино или метилсульфанил, с соединением формулы VIII
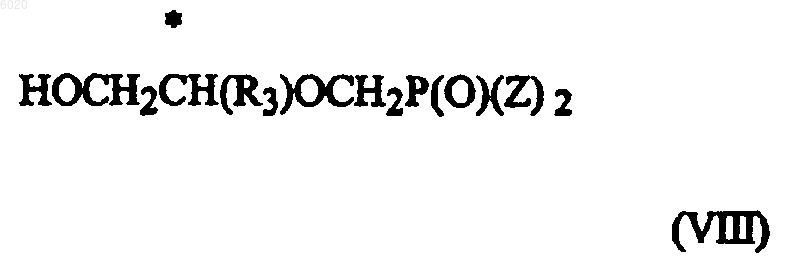
где Z означает амид или сложный эфир, в присутствии основания.
31. Способ по п.30, отличающийся тем, что проводят гидролиз группы Z с образованием соединения формулы (VI), где одна или две группы Z означают гидрокси.
32. Способ получения соединений формулы (XIII)
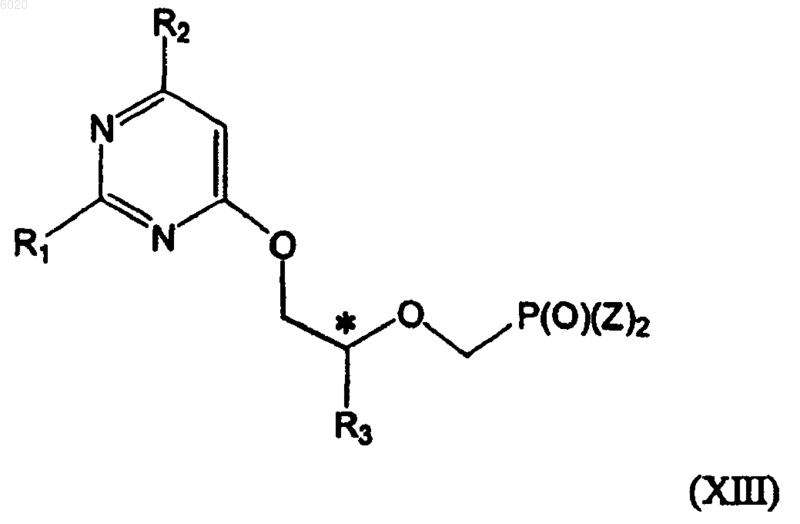
где R1 означает водород, амино или метилсульфанил,
* означает хиральэыщ атом углерода
R2 означает водород, хлор, гидрокси или амино,
R3 означает водород, метил, галогенметил или гидрокси метил, а
Z означает амид или сложный эфир,
отличающийся тем, что осуществляют взаимодействие соединения формулы IX
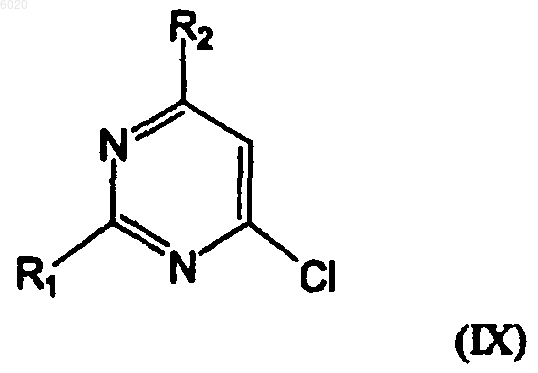
где R1 означает водород или метилсульфанил,
R2 означает водород, хлор или амино,
с соединением формулы X

где R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,
* означает хиральный атом углерода,
R6 означает гидрокси или защищенную гидроксигруппу
или R3 и R6 соединены через циклическую ацеталь- или кетальзащитную группу,
в присутствии основания и отсутствии растворителя или в присутствии апротонного растворителя с образованием соединения формулы XI
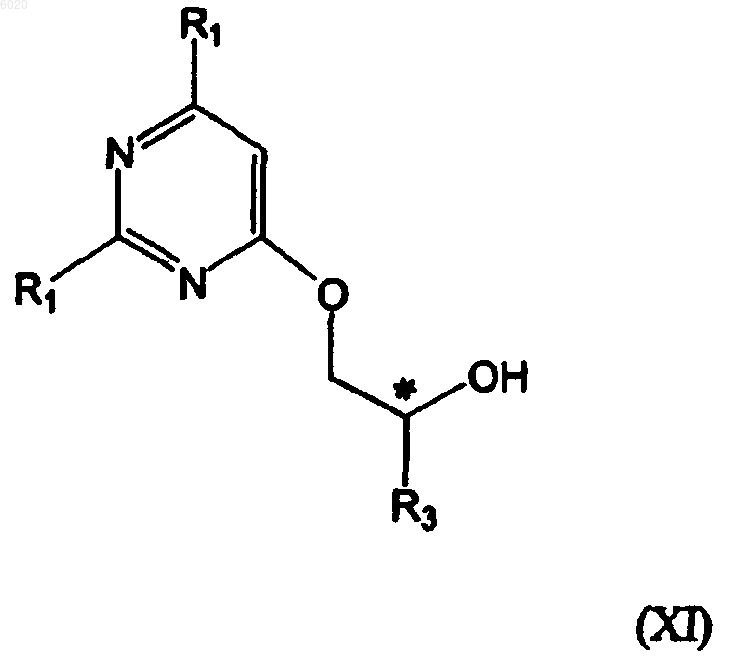
где R1 означает водород, амино или метилсульфанил,
* означает хиральный атом углерода,
R2 означает водород, хлор или амино и
R3 означает водород, метил, галогенметил или защищенный гидроксиметил;
и проводят взаимодействие соединения XI с соединением формулы XII
Y-CH2P(O)(OZ)2 (XII),
где Y означает уходящую группу,
Z означает амид или сложный эфир,
в присутствии основания в диметилформамиде или тетрагидрофуране с образованием соединения формулы XIII.
33. Способ по п.32, отличающийся тем, что дополнительно осуществляют гидролиз группы Z с образованием соединения формулы XIII, где одна или две группы Z означают гидрокси.
34. Способ получения соединения формулы I
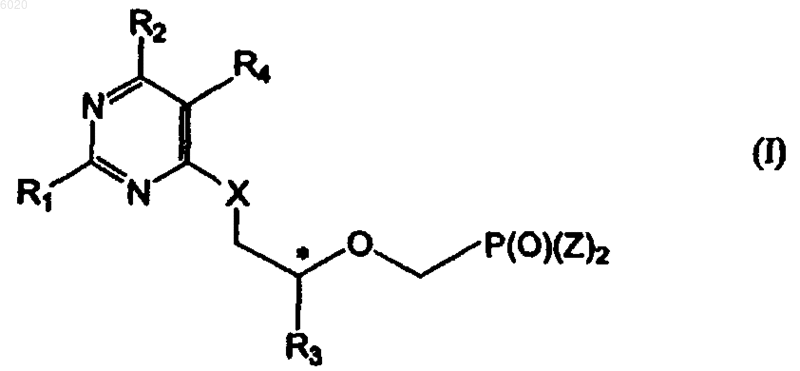
где R1 означает водород, амино или метилсульфанил,
R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,
R4 означает галоген,
X означает кислород,
Z независимо означает гидрокси, сложный эфир или амид, а
* означает хиральный атом углерода,
отличающийся тем, что осуществляют взаимодействие соединения формулы VI
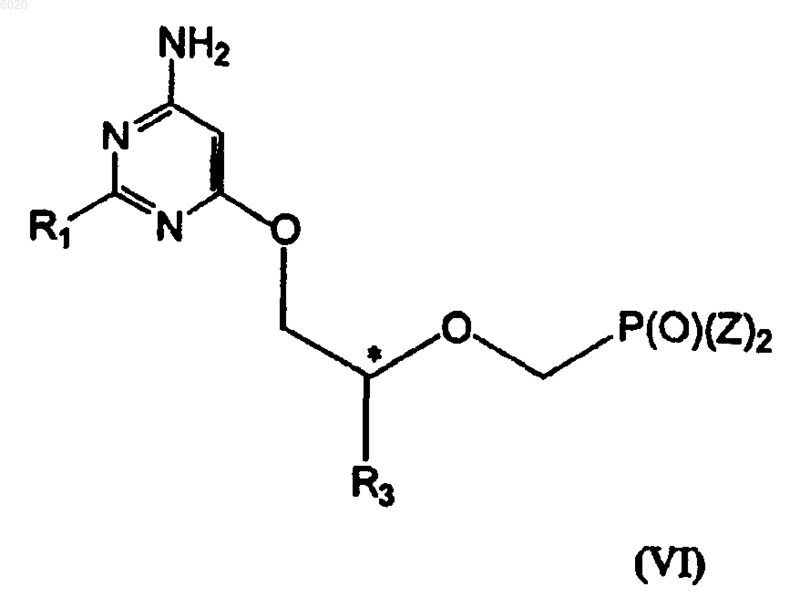
где R1 означает водород, амино или метилсульфанил,
R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,
Z независимо означает сложный эфир, а
* означает хиральный атом углерода,
с хлором в инертном растворителе с образованием соединения формулы I.
35. Способ по п.34, отличающийся тем, что дополнительно осуществляют гидролиз группы Z с образованием соединения формулы I, где одна или две группы Z означают гидрокси.
36. Способ лечения вирусной инфекции, отличающийся тем, что пациенту, нуждающемуся в таком лечении, вводят терапевтически эффективное количество соединения по п.1.
37. Способ по п.36, отличающийся тем, что вирусом является ДНКвирус.
38. Способ по п.37, отличающийся тем, что вирусом является ретровирус или гепаднавирус.
Текст
006020 Область техники, к которой относится изобретение Данное изобретение относится к медицине и фармации, а именно к соединениям, обладающим антивирусной активностью, прежде всего, в отношении РНК или ДНК вирусов. Предшествующий уровень техники Ациклические аналоги нуклеотидов, содержащие фосфонатные группы, описаны, например, в патентах США 4659825, 4808716, 4724233, 5142051, 5302585, 5208221, 5352786, 5356886, в европейских патентах ЕР 269947, 481214, 630381, 369409, 454427, 468119, 434450, 618214 и 398231, а также в заявках WO 95/07920, WO 94/03467 и WO 96/33200. В описания этих патентов включены соединения, в которых фосфонатная группа присоединена к определенному пуриновому или пиримидиновому основанию, в основном в положении 1 или 9 пиримидинового или пуринового основания соответственно, например, через 2-(метокси)пропильную группу, 2-(метокси)этильную группу, 2-метокси-3 гидроксипропильную группу или 2-метокси-3-фторпропильную группу, причем такие производные пурина или пиримидина известны под следующими названиями РМР, РМЕ, НРМР и FPMP соответственно. Такие соединения обладают антивирусной и цитостатической активностью.Daluge et al. (34th Interscience Conference on Antimicrobial Agents and Chemotherapy, Oct. 4-7, 1994) описывают производные карбовира, в которых пурин замещен в положении 6 циклопропиламино-, Nциклопропил-N-метиламино- или N-азиридиновой группами.Holy et al. ("ACS Symp. Ser." 401:57-71 (1989 и Holy (Kem. Ind. 38(10):457-462 (1989 описывают антивирусную активность определенных N6-замещенных аналогов нуклеотидов. Другие аналоги фосфонат-замещенных пиримидинов описаны Holy et al. (Collect. Czech. Chem.Commun. 64:242-256(1999, Eger et al. (J. Med. Chem. 37:3057-3061 (1994, Wormstadt et al. (J. Heterocyclic Chem. 37:1187-1191 (2000 и Franchetti et al. (NucleosidesNucleotides 14(3-5):607-610 (1995. В последних трех публикациях описана фосфонатсодержащая боковая цепь, присоединенная через 6-Nзаместитель 2,4-дизамещенного пиримидина. Сущность изобретения Целью изобретения является разработка соединений, обладающих антивирусной активностью,прежде всего, в отношении РНК или ДНК вирусов, таких как вирус иммунодефицита человека ВИЧ(HIV), папилломавирус HPV или вирус герпеса HSV. Дополнительной целью изобретения является синтез соединений, пригодных для получения ионообменных смол или хиральных сред. Другой целью изобретения являются промежуточные соединения и способы получения таких соединений. Эти и другие цели изобретения более подробнее раскрыты ниже. Согласно изобретению получены новые соединения формулы I где R1 означает водород, амино или метилсульфанил,R2 означает водород, метил, галоген, -N(R5)2, гидрокси, защищенную гидроксигруппу или группу формулы IаR3 независимо означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R4 означает водород или галоген,Х независимо означает кислород, серу или связь,Z независимо означает гидрокси, сложный эфир или амид,R5 независимо означает водород, С 1-С 8 алкил или защитную группу иозначает хиральный атом углерода; и их соли и сольваты. Задачи изобретения достигаются также посредством способа получения соединений формулы I где R1, R2, R3, R4, X, Z, R5 иопределены выше, причем способ включает взаимодействие соединения формулы II где R1 и R5 определены выше,R2 означает водород, метил, галоген, -N(R5)2, гидрокси или защищенную гидроксигруппу, а Х означает О или S; с соединением формулы III(III),где Z означает сложный эфир или амид, означает хиральный атом углерода,R3 означает водород, метил, галогенметил или защищенный гидрокси,Y означает уходящую группу; в диполярном апротонном растворителе в присутствии основания с образованием соединения формулы I,где Z означает сложный эфир или амид; по выбору (необязательно) превращение одной или обеих группZ с образованием соединения формулы I, где по крайней мере одна группа Z означает гидрокси. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы I, гдеR1 означает водород, амино или метилсульфанил,R2 означает -N(R5)2,R3 независимо означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R4 означает водород или галоген,Х означает кислород или серу,Z независимо означает гидрокси, сложный эфир или амид,R5 независимо означает водород, С 1-С 8 алкил или защитную группу иозначает хиральный атом углерода; причем способ включает взаимодействие соединения формулы IV где R3 означает водород, метил, галогенметил или защищенный гидроксиметил,Х означает О или S, аZ означает амид или сложный эфир, с N(R5)2. По выбору одну или обе группы Z превращают с образованием соединения формулы I, где по крайней мере одна группа Z означает гидрокси. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (V) где R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R5 независимо означает водород, С 1-С 8 алкил или защитную группу,Х означает кислород или серу,Z независимо означает гидрокси, сложный эфир или амид, означает хиральный атом углерода; причем способ включает взаимодействие соединения IVa с N(R5)2 в безводном растворителе, в присутствии гидроксида щелочного металла или карбоната щелочного металла и по выбору превращение Z в соединение формулы V, где одна или две группы Z означают гидрокси. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (VI) где R1 означает водород, амино или метилсульфанил,R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,Z независимо означает гидрокси, сложный эфир или амид, означает хиральный атом углерода; причем способ включает взаимодействие соединения VII(VIII),где Z означает амид или сложный эфир; в присутствии основания. По выбору одну или обе группы Z превращают с образованием гидроксигруппы. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (XIII)-3 006020 где R1 означает водород, амино или метилсульфанил, означает хиральный атом углерода,R2 означает водород, хлор, гидрокси или амино,R3 означает водород, галогенметил или гидроксиметил, аZ означает амид или сложный эфир,причем способ включает(а) взаимодействие соединения формулы IX где R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил, означает хиральный атом углеродаR6 означает гидрокси или защищенную гидроксигруппу,или R3 или R6 соединены через циклическую ацеталь- или кетальзащитную группу; в присутствии основания в отсутствии растворителя или в присутствии апротонного растворителя с образованием соединения формулы XI где R1 означает водород, амино или метилсульфанил, означает хиральный атом углерода,R2 означает водород, хлор или амино иR3 означает водород, метил, галогенметил или защищенный гидроксиметил; и(ХII),где Y означает уходящую группу,Z означает амид или сложный эфир; в присутствии основания в диметилформамиде или тетрагидрофуране с образованием соединения формулы XIII; и(в) по выбору гидролиз Z группы в соединении XIII с образованием соединения формулы VI, где одна или две группы Z означают гидрокси, а Х означает атом кислорода. В другом варианте воплощения настоящего изобретения разработан способ получения соединений формулы (I), гдеR1 означает водород, амино или метилсульфанил,R3 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,R4 означает галоген,Х означает кислород,Z независимо означает гидрокси, сложный эфир или амид, иозначает хиральный атом углерода; причем способ включает(а) взаимодействие соединения формулы VI, гдеR1 означает водород, амино или метилсульфанил,R2 означает водород, метил, гидроксиметил, галогенметил или защищенный гидроксиметил,Z независимо означает сложный эфир и-4 006020 означает хиральный атом углерода; с галогеном в инертном растворителе с образованием соединения формулы I. По выбору одну или обе группы Z превращают в гидроксигируппу. Другие цели настоящего изобретения относятся к способу, включающему введение терапевтически эффективного количества соединения формулы I пациенту, нуждающемуся в таком лечении. Сведения, подтверждающие возможность осуществления изобретения Термин "алкил", использованный в данном описании, если не указано иное, означает разветвленные, линейные или циклические насыщенные углеводороды и включает метил, этил, пропил, циклопропил, циклобутил, изопропил, н-, втор-, изо- и трет-бутил, пентил, изопентил, 1-метилбутил, 1 этилпропил, неопентил и трет-пентил. Галоген обычно означает хлор, но включает бром, фтор или иод.R1 обычно означает водород или амино, но также может означать метилсульфанил (то есть метилтио).R2 обычно означает гидрокси или -N(R5)2, где R5 независимо означает водород или С 1-С 8 алкил.R3 обычно означает водород или метил, но может означать гидроксиметил (обычно в(S)конфигурации, причем соединение в основном не содержит (R)энантиомер) или галогенметил, и еслиR3 означает метил или галогенметил, то соединение предпочтительно находится в (2R)конфигурации и в основном не содержит (2S)энантиомер). Галогенметил в основном означает фторметил.R5 в основном означает водород, но может также означать низший (С 1-С 3)алкил (один или оба варианта). Как описано ниже, Z означает любой сложный эфир или амид, использованные ранее для получения фосфонатов нуклеотидов. Если Z означает сложный эфир, он означает структуру OR7.R7 обычно означает водород (то есть Z означает гидрокси) в соединениях, которые сами по себе проявляют антивирусную активность, однако, подходящими являются другие сложноэфирные группыR7, описанные ниже, для использования в качестве защитных групп или для модификации при получении вариантов пролекарств. Х предпочтительно означает О.Z означает сложный эфир или амин, если требуется защитить функциональные группы соединений по изобретению от участия в нежелательных реакциях, или если целью изобретения является получение пролекарства, действующего in vivo. В другом случае Z означает ОН. Сложные эфиры или амиды используют в качестве защищенных промежуточных производных при синтезе соединений по изобретению, в которых Z означает ОН. В данном варианте воплощения изобретения выбор эфира или амида не имеет существенного значения, и зависит от природы используемой реакции. Единственным необходимым условием является устойчивость заместителя Z до стадии завершения реакции, в которой требуется защита, и Z легко можно выбрать с помощью стандартного эксперимента, если его выбор не очевиден с теоретической точки зрения. Например, сложные эфиры, прежде всего, используют для защиты гидроксильных групп фосфонатов от алкилирования. Если Z служит в качестве функциональной группы в пролекарстве, сложный эфир или амид отщепляется из фосфонатной группы in vivo. Подходящие сложные эфиры или амидаты в качестве пролекарств выбирают в зависимости от субстратной специфичности эстераз и/или карбоксипептидаз, которые предположительно присутствуют в клетках, где будет происходить гидролиз предшественника. В связи с тем,что специфичность таких ферментов до настоящего времени не известна, авторы исследовали множество аналогов нуклеотидов по настоящему изобретению до тех пор, пока не была найдена требуемая субстратная специфичность. Указанную специфичность определяли по наличию свободного фосфоната или по антивирусной активности. В основном соединения отбирали по следующим признакам: (i) отсутствие гидролиза или относительно медленный гидролиз в верхнем отделе кишечника, (ii) проницаемость через кишечник и клетки, а также (iii) гидролиз в клеточной цитоплазме и/или при системной циркуляции. Множество клеток из различных тканей использовали для выявления предшественников, которые высвобождаются в органах, чувствительных к исследуемой вирусной или микробной инфекции, например в случае печени, предшественники лекарственных средств гидролизуются в печени. Другие инфекции,например, вызванные вирусами герпеса CMV и ВИЧ, по выбору лечат предшественником, который гидролизуется в основном при одной и той же скорости и с той же степенью гидролиза во всех тканях. Для указанных целей пригодными являются известные методы анализа, включая методы анализа стабильности кишечного просвета, проницаемости клеток, стабильности гомогената клеток печени и стабильности плазмы. Указанные методы анализа используют для определения характеристик биодоступности предшественников. Типичные примеры сложных эфиров и амидов в качестве группы Z можно найти в заявках на выдачу патента WO 95/07920, WO 98/04569 и ЕР 481214 А 1. В качестве группы Z можно использовать любые сложноэфирные или амидные группы, описанные в указанных публикациях (и в том же порядке предпочтительности, как указано в этих публикациях). Обычно обе группы Z означают гидрокси или обе группы означают сложный эфир и/или амид, то есть обычно две группы Z или ни одна Z-группа не означают гидрокси. В основном, если не одна группаZ не означает ОН, то одна группа Z означает амид, а другая сложный эфир. Предпочтительными являются амиды природных аминокислот и фениловые эфиры. Свободная карбоксильная группа (группы) в составе аминокислотных остатков Z в основном этерифицированы С 1-С 8 алкильными группами. В основном, Z означает гидрокси в соединениях, предназначенных для использования непосредственно в качестве антивирусных агентов, то есть при использовании таких соединений не требуется обеспечение гидролиза in vivo сложного эфира или амида. Защитные группы гидроксильных групп включают ацетали, кетали или С 1-С 8 алкил. Типичной защитной группой для аминогрупп является тритил. Известны другие стандартные защитные группы (см. книгу Greene et al., "Protecting Groups in Organic Synthesis", 2nd Ed. 1991, стр. 10-142 и 309-405). Использование Соединения по изобретению используют для лечения вирусных заболеваний или в качестве промежуточных производных при получении таких соединений. Примеры вирусных инфекций, предназначенных для лечения или для определения чувствительности к соединениям по настоящему изобретению,включают инфекции, вызванные ДНКилиРНКвирусами, такими как вирусы герпеса (CMV, HSV 1, HSV 2, EBV), вирус ветряной оспы (VZV), вирус герпеса крупного рогатого скота, тип 1, вирус лошадиного герпеса, тип 1, HHV-6, папилломавирусы (HPV, типы 1-55, включая карциногенный HPV), флавивирусы(включая вирус желтой лихорадки, вирус африканской лихорадки свиней, вирус японского энцефалита),тогавирусы (включая вирус венесуельского энцефаломиелита свиней), вирусы гриппа (типы А-С), ретровирусы (ВИЧ-1, ВИЧ-2, HTLV-I, HTLV-II SIV, FeLV, FIV, MoMSV), аденовирусы (типы 1-8), поксвирусы (вирус коровьей оспы), энтеровирусы (полиовирус, тип 1-3, вирус Коксаки, вирус гепатита А, вирусECHO) и вирусы гастроэнтерита (вирусы Норфолк, ротавирусы), хантавирусы (вирус Хантаана), полиомавирус, паповавирусы, риновирусы, вирусы парагриппа, типы 1-4, вирус бешенства, респираторносинцитиальный вирус (RSV), вирусы гепатита А, В, С и Е и т.п. Предпочтительными соединениями по настоящему изобретению, используемыми для лечения инфекций, вызванных вирусами герпеса, гепаднавирусами и ВИЧ, являются соединения, в которых R1 означает NH2, R2 означает NH2 или ОН, Х означает О, R3 означает Н или метил. Активность соединений по настоящему изобретению в отношении других вирусов определяли стандартными методами анализа антивирусной активности с использованием анализов ингибирования ферментов, анализов клеточных культур, моделей животных и т.п., которые известны для специалистов в данной области техники. Новые соединения по настоящему изобретению используют также непосредственно или в качестве промежуточных производных для получения полимеров, находящих широкое применение в диагностике,терапии и промышленности. Соединения по настоящему изобретению пригодны для получения аффинно-сорбционных сред, содержащих заместители, которые обладают свойствами сорбировать определенные соединения из смесей. Такие сорбенты получают и используют стандартными способами, известными для ионнообменных сред, содержащих аналогичные заместители, например фосфонатные или аминогруппы. Например, соединения по изобретению ковалентно связывают с нерастворимой матрицей через фосфонатные группы,а свободные аминозаметители R1 в составе гетероциклического основания являются ионообменными участками. В другом варианте соединения связывают с матрицей через аминогруппы гетероциклического основания, а свободные фосфонатные группы используют для хроматографической сорбции положительно заряженных молекул. В другом варианте воплощения иммобилизованные соединения по изобретению используют для очистки белков, например ферментов, которые могут связываться с соединениями по настоящему изобретению, например транспортные белки (см. выше статью Cihlar). Подходящие способы включения соединений по настоящему изобретению в нерастворимую матрицу, такую как полимерные смолы, представляются очевидными для специалистов в данной области техники. Соединения по настоящему изобретению могут быть иммобилизованы за счет образования поперечных связей амино- или гидроксигрупп пиримидинового основания с нерастворимой матрицей. Аналогичным образом, соединения по настоящему изобретению включают в нерастворимые смолы за счет ковалентного связывания матрицы или смолы с гидроксигруппами фосфонатного фрагмента или гидроксиметильной группой R3 с использованием известных конденсирующих агентов. Подходящие методы конденсации описаны в статье Cihlar, указанной выше. Соединения по настоящему изобретению могут быть также использованы в качестве сшивателей или спейсеров при получении аффинно-сорбционных матриц (в отличии от их использования непосредственно в качестве аффинных фрагментов, как описано выше в предыдущих абзацах). Соединения по изобретению включают множество функциональных групп, которые можно использовать в качестве участков для связывания необходимых веществ. Известны стандартные способы для связывания аффинных лигандов, таких как гормоны, пептиды, антитела, ферменты, лекарственные средства и т.п., с нерастворимыми субстратами. Такие нерастворимые материалы используют известным способом для сорбции веществ из промышленных препаратов, диагностических образцов и других смесей. Аналогичным образом используют иммобилизованные ферменты для каталитических превращений, причем фермент легко отделяется от продукта.-6 006020 В некоторых вариантах воплощения нет необходимости в связывании соединений по настоящему изобретению с нерастворимыми материалами. Например, они могут быть использованы для связывания анализируемых веществ с детектируемыми группами при получении растворимых диагностических реагентов. Методы связывания заместителей в составе соединений по изобретению известны в данной области техники. Например, фосфоновую кислоту используют для образования сложных эфиров при взаимодействии со спиртами или для образования амидов при взаимодействии с аминами. Аналогичным образом можно использовать амино, галоген, гидроксигруппы и другие реакционные участки в составе остатка пиримидина. Естественно при необходимости многостадийного синтеза иммобилизованного реагента следует использовать защиту реакционноспособных групп. В основном соединения по изобретению присоединяют с помощью связывания фосфоновой кислоты с гидроксильными или аминогруппами связывающего материала и ковалентно присоединяют к другому связывающему материалу через другой заместитель соединения по изобретению. Например, первый связывающий материал, такой как стероидный гормон, этерифицируют фосфоновой кислотой по настоящему изобретению, а затем полученный конъюгат присоединяют через гидроксиметильные группы R3 к бромциан-активированной сефарозе, при этом получают иммобилизованный стероид. Известны другие химические способы получения конъюгатов. См., например, книгу Maggio, "Enzyme-Immunoassay" (CRC, 1988, стр.71-135) и другие публикации, цитированные в данном описании. Фармацевтические композиции Соединения по настоящему изобретению, их физиологически приемлемые соли и сольваты (далее в тексте названные активными компонентами) используют при получении составов для введения любым способом, соответствующим состоянию, которое подвергается лечению. Соединения и композиции предпочтительно должны быть стерильными. Активные ингредиенты включают в фармацевтические композиции. Составы для использования в ветеринарии и в медицине содержат по крайней мере один активный ингредиент, как описано выше, в смеси с одним или более приемлемыми носителями и необязательно (по выбору) с другими терапевтическими компонентами. "Приемлемый" носитель (носители) означает, что он совместим с другими ингредиентами композиции и не оказывает отрицательного действия на реципиента. Обычно композиции представлены в форме однократной дозы и могут быть получены любым методом, известным в области фармацевтики. В основном, составы готовят при равномерном и тщательном перемешивании активного ингредиента с жидкими носителями или с тонко измельченными твердыми носителями или и с теми и другими, а затем при необходимости формуют в продукт. Композиции по настоящему изобретению, пригодные для перорального приема, могут быть представлены в виде дискретных форм, таких как капсулы, облатки или таблетки, каждая из которых содержит предварительно определенное количество активного компонента в виде порошка или гранул, раствора или суспензии в водной жидкости или неводной жидкости, в виде жидкой эмульсии типа масло-вводе или эмульсии типа вода-в-масле. Активный компонент может быть также представлен в виде болюса (шарика), электуария или пасты. Для лечения наружных инфекций глаза или других наружных тканей, например рта и кожи, композиции предпочтительно наносят в виде мази или крема для наружного применения, содержащих активный ингредиент(ы) в количестве, например, от 0,075 до 20% мас./мас. (включая активный ингредиент(ы) в диапазоне от 0,1 до 20% с приращением по 0,1% мас./мас., таким как 0,6, 0,7% мас./мас. и т.д.), обычно от 0,2 до 15% мас./мас. и наиболее предпочтительно от 0,5 до 10% мас./мас. Если композиция представляет собой мазь, то активные ингредиенты можно использовать в смеси с парафиновой или смешиваемой с водой основой мази. В другом варианте активные ингредиенты можно включать в крем с основой типа масло-в-воде. При необходимости водная фаза основы крема может включать, например, по крайней мере 30% мас./мас. многоатомного спирта, то есть спирта, содержащего две или более гидроксильных групп, такого как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин или полиэтиленгликоль (включая ПЭГ 400) или их смеси. Композиции для наружного применения могут при необходимости включать соединение, которое повышает впитывание или проникновение активного ингредиента через кожу или другие поверхности, на которые оказывается действие. Примеры таких усилителей проникновения через кожу включают диметилсульфоксид и родственные аналоги. Масляная фаза эмульсий по настоящему изобретению может состоять из известных ингредиентов,полученных известным способом. Такая фаза включает один эмульгатор или смесь по крайней мере одного эмульгатора с жиром или маслом или с обоими ингредиентами. Гидрофильный эмульгатор предпочтительно включают в состав в смеси с липофильным эмульгатором, который действует в качестве стабилизатора. Предпочтительно также включать масло и жир. Стабилизаторы эмульсий, пригодные для использования в составах по настоящему изобретению, включают Твин 60, Спан 80, цетилстеариловый спирт, бензиловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия. Подходящие масла или жиры включают линейные или разветвленные моно- или диосновные алкиловые эфиры,такие как диизоадипат, изоцетилстеарат, пропиленгликолевый диэфир жирных кислот из кокосового-7 006020 масла, изпропилмиристат, децилолеат, изопротилпальмитат, бутилстеарат или 2-этилгексилпальмитат. Указанные ингредиенты могут быть использованы в отдельности или в комбинации в зависимости от требуемых свойств. В другом варианте можно использовать высокоплавкие липиды, такие как мягкий бесцветный парафин и/или вазелиновое масло или другие минеральные масла. Составы, пригодные для наружного применения при лечении глаз, включают также глазные капли,в которых активный ингредиент растворен или суспендирован в подходящем носителе, прежде всего, в водном растворителе для активного ингредиента. Активный ингредиент обычно присутствует в таких составах в концентрации от 0,01 до 20 мас.%. Составы, пригодные для введения в нос и в которых носителем является твердое вещество, включают порошок грубого помола с размером частиц в диапазоне от 20 до 500 мкм (включая частицы размером в диапазоне от 20 до 500 мкм с приращением в 5 мкм, таким как 30, 35 мкм и т.д.), который вводят путем быстрой ингаляции через носовой ход из контейнера с порошком. Подходящие составы, содержащие жидкий носитель, для введения в виде, например, назального спрея или назальных капель, включают водные или масляные растворы активного ингредиента. Составы, пригодные для аэрозольного введения, можно получить с использованием известных методов и такие составы могут быть доставлены в смеси с другими терапевтическими агентами, такими как пентамидин для лечения пневмоцистной пневмонии. Составы, пригодные для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, составов в виде пены или спрея, содержащие кроме активного ингредиента соответствующие носители, известные в данной области техники. Составы, пригодные для парентерального введения, включают водные и неводные стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферные вещества, бактериостатические агенты и растворимые вещества, которые придают составу изотонические свойства, аналогичные крови реципиента, нуждающегося в лечении, и водные или неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Составы могут быть представлены в виде контейнеров с однократной или многократной дозой, например, запаянные ампулы или флаконы; могут храниться в замороженном (лиофилизированном) виде, и перед использованием которых требуется только добавить стерильный жидкий носитель, например воду для инъекций. Растворы и суспензии для инъекций для немедленного введения можно приготовить из стерильных порошков, гранул и таблеток, описанных выше. Предпочтительными составами с однократной дозой являются составы, содержащие суточную дозу или суточную поддозу, как описано выше, или соответствующую часть активного ингредиента. Настоящее изобретение относится также к ветеринарным композициям, включающим по крайней мере один активный ингредиент, как определено выше, в смеси с ветеринарным носителем. Ветеринарными носителями являются материалы для введения композиции, которые могут быть твердыми, жидкими или газообразными и которые в любом случае считаются инертными или приемлемыми в ветеринарии и совместимы с активным ингредиентом. Такие ветеринарные композиции можно вводить пероральным, парентеральным или любым другим требуемым способом. Описанные в настоящем изобретении соединения по выбору используют в фармацевтических композициях с контролируемым высвобождением активного ингредиента, содержащих одно или более активных соединений, причем в такой композиции контролируется и регулируется высвобождение активного ингредиента, чтобы обеспечить менее частую дозировку или улучшить фармакокинетические или токсические свойства данного соединения. В основном, соединения вводят с использованием систем с контролируемым высвобождением, таких как имплантат, описанный в заявке WO 92/14450 или патенте США 5098443, или матриц, описанных в патентах США 4740365 или 5141752. Подходящим является множество других известных систем. Терапевтическое использование Пригодные пути введения включают пероральный, ректальный, назальный, местный (включая глазной, буккальный и подъязычный), вагинальный и парентеральный (включая подкожный, внутримышечный, введение в стекловидное тело, внутривенный, интрадермальный, интратекальный и эпидуральный пути). Предпочтительный способ введения зависит от состояния пациента, токсичности соединения и участка инфекции, а также других факторов, известных врачам-клиницистам. Требуемое количество активного ингредиента (как описано выше) в каждом случае выше упомянутых терапевтических показаний зависит от ряда факторов, включающих тяжесть состояния, подвергающегося лечению, инфицирующего агента, профилактические цели или лечение острой инфекции, участок инфекции или патологического процесса и другие факторы на усмотрение лечащего терапевта или ветеринара. Однако, в основном подходящая доза, определенная врачом-клиницистом, находится в диапазоне доз, известных для аналогичных метоксифосфонатов (см. выше), причем учитывается различие в активности, определенной при испытаниях in vitro, в основном от 0,1 до 250 мг/кг массы тела реципиента на дозу (включая активный ингредиент (ингредиенты) в диапазоне от 0,1 мг до 400 мг/кг/доза с приращением в 0,5 мг/кг/доза, например 2,5, 3,0, 3,5 мг/кг/доза и т.п.), в типичном случае в диапазоне от 0,5 до 50 мг/кг/доза и наиболее часто в диапазоне от 1 до 300 мг/кг/доза. Требуемую дозу вводят через соответствующие интервалы в форме однократных доз, обычно вводят инициирующую, относительно более высокую дозу, а затем более низкие поддерживающие дозы,-8 006020 вводимые менее часто. Соединения можно также вводить с профилактической целью, например, в определенный период до инфекции приблизительно от 1 до 7 дней. Опухоли или новообразования полиомавирусов (HPV) и поражения герпесом в большинстве случаев лечат местным способом, или локальной инъекцией, или гелями, мазями и т.п. для наружного применения. Соединения по настоящему изобретению используют необязательно (по выбору) в комбинации с другими терапевтическими агентами для лечения или профилактики инфекций или состояний, упомянутых выше. Примеры таких дополнительных терапевтических агентов в ключа ют агенты, эффективные для лечения или профилактики вирусных инфекций. Такие агенты включают, без ограничения перечисленным, NRTI, 3'-азидо-3'-дезокситимидин (зидовудин, AZT), 2'-дезокси-3'-тиацитидин (3 ТС), 2',3'дидезокси-2',3'-дидегидротимидин (D4T), карбовир (карбоциклический 2',3'-дидезокси-2',3'-дидегидрогуанозин), абакавир (АВС), 2',3'-дидезоксиинозин (ddI), диданозин, 2',3'-дидезоксицитидин (ddc, зальцитабин), 3'-азидо-2',3'-дидезоксиуридин,(Е)-5-(2-бромвинил)-2'-дезоксиуридин (BVDU), 2-хлор-2'-дезоксиаденозин, 2-дезоксикоформицин, 5-фторурацил, 5-фторуридин, 5-фтор-2'-дезоксиуридин, 5-трифторметил-2'-дезоксиуридин, 6-азауридин, 5-фтороротовая кислота, метотрексат, триацетилуридин, 1-(2'дезокси-2'-фтор-1D-арабинозил)-5-иодцитидин (FIАС), тетрагидроимидазо(4,5,1-jk)-(1,4)-бензодиазепин-2(1 Н)-тион (TIBO) или другие ненуклеозидные ингибиторы обратной транскриптазы (например,невирапин, делавиридин, эфавирены, дапаривин и т.п.), ингибиторы протеаз (например, саквинавир, индинавир, ритоновир, ампренавир и т.п.), 2'-нециклический ГМФ, 6-метоксипуринарабинозид (ара-М), 2'O-валерат 6-метоксипуринарабинозида, цитозинарабинозид (ара-С), ациклические нуклеозиды, такие как ацикловир, валацикловир, пенцикловир, фамцикловир, ганцикловир, ациклические аналоги нуклеотидов,такие как НРМРС, РМЕА, PMEG, РМРА, PMPDAP, FPMPA, НРМРА и HPMPDAP, (2R,5R)-9[тетрагидро-5-(фосфонометокси)-2-фуранил]аденин,(2R,5R)-1-[тетрагидро-5-(фосфонометокси)-2 фуранил]тимин, другие антивирусные агенты, включая рибавирин (аденинарабинозид), 2-тио-6 азауридин, туберцидин, ауринтрикарбоновая кислота, 3-деазанеопланоцин, неопланоцин, римантидин,адамантин и фоскарнет (тринатрия фосфоноформиат). Способы синтеза Соединения формулы I синтезируют алкилированием соответствующего 6-гидроксипиримидинового основания диалкиловым эфиром 2-хлорэтоксиметилфосфоновой кислоты (или его аналогами,содержащими другие группы R3) в присутствии NaH, Сs2 СО 3 или DBU (1,8-диазабицикло[5.4.0]ундец-7 ена) в диполярном апротонном растворителе, обычно ДМФ, по выбору с последующим удалением защитных групп, например, с помощью бромтриметилсилана и последующего гидролиза. Образование продукта формулы I сопровождается образованием различного количества соответствующего N1 изомера, то есть 2,4-дизамещенного 1-[2-(фосфонометокси)этил]пиримидин-6-она. Последний можно удалить хроматографическим методом в виде нейтрального диэфира перед стадией обработки бромтриметилсиланом. Другой способ получения соединений формулы I включает превращение 2-замещенных производных 4-хлор-6-[2-(фосфонометокси)этокси]пиримидина (и его R3-аналогов) при взаимодействии с первичными или вторичными аминами в безводных растворителях (например, этаноле), в присутствии гидроксида щелочного металла или карбоната щелочного металла в воде. Эту реакцию можно проводить в присутствии катализатора, например, 1,3,5-триазола, имидазола или предпочтительно в присутствииDABCO (диазабициклооктана). Затем по выбору удаляют защитные группы, например, обработкой бромтриметилсиланом и гидролизом. Соединения формулы I можно также получить при взаимодействии 2,4-замещенных 6 галогенпиримидинов с натрий алкоксидом диалкилового эфира 2-гидроксиэтилфосфоновой кислоты(или его аналогами, содержащими другие группы R3), и по выбору с последующим удалением защитных групп. Преимущество этой методики заключается в образовании только требуемого O-6-изомера. Выбор подходящего метода синтеза зависит от имеющегося в наличии гетероциклического производного пиримидина, используемого в качестве исходного соединения. Соединения формулы I можно также получить при взаимодействии 2,4-дизамещенных 6-(2 гидроксиалкил)пиримидинов с диалкиловым эфиром п-толуолсульфонилоксиметилфосфоновой кислоты в присутствии NaH. Исходные материалы получают обработкой соответствующего 6-хлорпиримидина защищенным или незащищенным диолом в присутствии основания. Соединения формулы I, кроме того, можно получить замещением в ряде положений пиримидинового кольца. Таким образом, 5-галогенпроизводные можно получить при взаимодействии галогена или с помощью галогенанионнообменных реакций. Группы Z в амидах или эфирах превращают в гидроксильные группы с помощью гидролиза. Моноэфиры легко получить из диэфира или смеси ди- и моноэфиров с помощью обработки азидом лития или натрия в ДМФ (см. статью A.Holy, "Synthesis 1998), 381-385 (1998. Все цитируемые документы включены в данное описание в качестве ссылок. Настоящее изобретение более подробно описано в следующих примерах.(а) 2,4-Диамино-6-[2-(фосфонометокси)этокси]пиримидин и 2,4-диамино-1-[2-(фосфонометокси) этил]пиримидин-6(1 Н)-он. Смесь 2,4-диамино-6-гидроксипиримидина (2,52 г, 20 ммоль), карбоната цезия (3,25 г, 10 ммоль) в диметилформамиде (40 мл) перемешивают в течение 30 мин при 80 С и затем добавляют диизопропил-2 хлорэтоксиметилфосфонат (3,5 мл, 23,4 ммоль). Смесь перемешивают в течение 16 ч при 100 С и отфильтровывают от солей. Фильтрат отгоняют в вакууме и остаток хроматографируют на колонке с силикагелем (300 мл) в хлороформе. После элюирования получают продукт, который кристаллизуют из смеси этилацетат/петролейный эфир, при этом получают 1,2 г (17,2%) 2,4-диамино-6-[2-(диизопропилфосфонилметокси)этокси]пиримидина, т.пл. 159 С. Элементный анализ: рассч. для C13H25N4O5P (348,3): С 44,83, Н 7,23, N 16,08, Р 8,89,найд. С 44,99, Н 7,28, N 16,18, Р 9,03. МС: 349,3 (МH+) (100), 265,1 (MH+-2xiPr) (6), 139 (26), 127,1 (Основание H+) (37). 1H ЯМР (CD3SOCD3): 1,24 d, 6H и 1,24 d, 6H, J(СН 3,СН)=6,2 (4 хСН 3); 3,74 m, 2 Н (Н-2'); 3,78 d,J(CH2-P)=8,2(CH2-P); 4,22 m, 2H (Н-1'); 4,59 dh, 2 Н, J(CH, P)=8,2, J(СН,СН 3)=6,2 (2 хСН); 5,02 s, 1 Н (Н-6); 5,85 bs, 2 Н и 6,00 bs, 2H (2xNH2). 13 С ЯМР (СD3SОСD3) 23,85 d, J(СН 3, Р)=4,6 (2 хСН 3); 23,99 d, J(СН 3, Р)=4,1 (2 хСН 3); 63,65 (С-1'); 65,02 d, J(CH2-P)=164,4 (CH2P); 70,32 d, J(CH,P)=6,0 (2xCH-O); 71,05d, J(2', P)=11,9(C-2'); 76,35 (C-5); 163,01, 166,15 и 169,92 (С-2, С-4 и С-6). Полученное соединение (1,0 г, 2,9 ммоль) обрабатывают ВrSiMe3 (4 мл) в ацетонитриле (40 мл) в течение ночи. Растворители отгоняют в вакууме, остаток перегоняют совместно с ацетонитрилом (225 мл) и к остатку добавляют воду (50 мл). Раствор подщелачивают с помощью концентрированного водного раствора аммиака и упаривают в вакууме. Остаток в виде водного раствора наносят на колонку (100 мл) Dowex 50 Х 8 (Н+ форма) и колонку элюируют водой (3 мл/мин), при элюировании непрерывно регистрируют поглощение при 254 нм. После удаления фракции, не поглощающей в УФ-диапазоне, колонку элюируют 2,5%-ным водным раствором аммиака и собирают фракцию, поглощающую в УФ-диапазоне. Фракцию концентрируют в вакууме, повторно растворяют в воде (20 мл), доводят до рН 9-10 с помощью концентрированного водного раствора аммиака и наносят на колонку (70 мл) Dowex 1 Х 2 (в ацетатной форме), предварительно тщательно промытую водой. После элюирования водой получают продукт, который кристаллизуют из воды, при этом получают 2,4-диамино-6-[2-(фосфонометокси)этокси] пиримидин (0,60 г, 78,3 %), т.пл. 279 С (вода). ЕUр 0,80. Элементный анализ: рассч. для C7H13N4O5P (264,2): С 31,83, Н 4,96, N 21,21, Р 11,72,найд. С 31,52, Н 5,04, N 20,96, Р 11,53. УФ-спектр: [max (max)] (рН 2): 276 (9100), (рН 7): 265 (7500).- 10006020 Полученные данные соответствуют УФ-спектрам, опубликованным для 2,4-диамино-6 метоксипиримидина (max 263 и 275 соответственно). 1H ЯМР (D2O) 3,69 d, 2H, J(CH2,P)=8,7 (СH2 Р); 3,91 m, 2H (Н-2'); 4,30 m, 2 Н (Н-1'); 5,45s, 1 Н (Н-5). 13 С ЯМР (D2O): 69,30 (С-1'); 70,28 d, J(CH2-P)=151,3 (CH2P); 73,35 d, J(2',P)=10,3 (C-2'); 79,63 (C-5); 165,46, 169,35 и 171,08 (С-2, С-4 и С-6). Положение сигнала атома углерода С-1' при низких величинах поля в о-изомерах (диэфирный и свободный фосфонат) ( 63,65 и 69,30, соответственно) указывает на то,что группа РМЕ связана с атомом кислорода при С-6. Затем колонку с силикагелем элюируют хлороформом, при этом получают 1,8 г (26%) аморфного 2,4-диамино-1-[2-(диизопропилфосфонилметокси)этил]пиримидин-6(1 Н)-она (RF 0,35, S1), который сушат в вакууме над P2O5, т.пл. 196-197 С. Остаток (5,17 ммоль) обрабатывают бромтриметилсиланом (6 мл) в ацетонитриле (60 мл) в течение ночи и обрабатывают, как описано для о-изомера. Обессоленную смесь очищают на колонке Dowex 1 (элюирование водой), при этом получают продукт, который кристаллизуют из воды и получают 0,95 г (65%) 2,4-диамино-1-[2-(фосфонометокси)этил]пиримидин-(1 Н)она, т.пл. 228 С (вода). EUp 0,90. Элементный анализ: рассч. для С 7 Н 13N4 О 5 Р-Н 2 О (282,2): С 29,72, Н 5,36, N 19,85, Р 10,98,найд. С 29,76, Н 5,22, N 20,01, Р 10,92. МС: 349,2 (МН+) (100), 265,1 (MH+-2xiPr) (35), 126 (BH+) (26). УФ-спектр: [max (max)] (рН 2): 264 (18000), (рН 7): 267 (12200). Полученные величины max соответствуют величинам, опубликованным для 2,4-диамино-1 метилпиримидин-6(1 Н)-она (268 нм). 1C ЯМР (D2O): 45,15 (С-1'); 70,41 d, J(CH2-P)=154,7 (CH2P); 74,09 d, J(2',P)=11,8 (C-2'); 81,05 (C-5); 159,73, 166,79 и 168,04 (С-2, С-4 и С-6). Положение сигнала атома углерода С-1' при высоких величинах поля ( 45,15) свидетельствует о N-замещении. Два сигнала NH2-групп ( 6,61 и 5,88), наблюдаемые в спектре 1H ЯМР в ДМСО, свидетельствуют о невозможности замещения в экзо-положении 2-NH2 и/или 4-NH2 и соответствуют ожидаемому замещению в положении N(1). Пример 2.(3 х 50 мл) в вакууме и остаток обрабатывают ДМФ (50 мл), DBU (3,8 мл) и дииизопропил-2- 11006020 хлорэтоксиметилфосфонатом (7 мл). Смесь перемешивают в течение 16 ч при 100 С и летучие вещества удаляют упариванием при 50 С/2 кПа. Остаток переносят в хлороформ (200 мл), фильтруют и промывают насыщенным NaCl (100 мл). Водный слой экстрагируют хлороформом (550 мл), объединенные экстракты сушат над сульфатом магния и упаривают. Проводят разделение на колонке с силикагелем (150 мл) в хлороформе в градиенте хлороформ/этанол, при этом получают 2-амино-4-хлор-6-[2(диизопропилфосфонилметокси)этокси]пиримидин, выход 27,2%, т.пл. 89 С. Элементный анализ: рассч. для C13H23ClN3O5P (367,77): С 42,46, Н 6,30, CI 9,64, N 11,43, Р 8,42,найд. С 42,34, Н 6,34, Cl 9,79, N 11,30, Р 8,23. МС: 368,3 (МН+) (100). 1(P-C); 65,15 (С-1'); 70,35 d, 2C, J(P,C)=6,7(P-OC); 70,52 d, 2C, J(P,C)=11,7 (C-2'); 94,46 (C-5); 160,12 (C-2); 162,97 (C-4); 170,56 (C-6). Затем проводят элюирование и кристаллизацию из смеси этилацетат/эфир, при этом получают 2 амино-4-хлор-1-[2-(диизопропилфосфонилметокси)этил]пиримидин-6(1 Н)-он, выход 52,4%, т.пл.95 С. Элементный анализ: рассч. для С 13 Н 23ClN3 О 5 Р (367,77): С 42,46, Н 6,30, Сl 9,64, N 11,43, Р 8,42,найд. С 42,28, Н 6,22, Cl 9,65, N 11,50, Р 8,27. МС: 368,4 (МH+) (100). 1(б) 2-Амино-4-гидрокси-6-[2-(фосфонометокси)этокси]пиримидин. Смесь 2-амино-4-хлор-6-[2-(диизопропилфосфонилметокси)этокси]пиримидина (5,7 г), ДАБКО (3,6 г) и K2 СО 3 (9,0 г) в воде (100 мл) кипятят с обратным холодильником в течение 150 мин при перемешивании, охлаждают и подкисляют добавлением смолы Dowex 50 Х 8 (в Н+ форме). Суспензию подщелачивают конц. раствором аммиака и после перемешивания в течение 5 мин фильтруют и смолу промывают 50%-ным водным раствором метанола (200 мл). Фильтрат упаривают досуха, добавляют этанол (50 мл) и смесь упаривают досуха. Остаток очищают хроматографией на колонке с силикагелем (150 мл) в градиенте хлороформ/этанол, при этом получают кристаллический 2-амино-6-[2-(диизопропилфосфонилметокси)этокси]-4-гидроксипиримидин, т.пл. 154 С, выход 78%. Элементный анализ: рассч. для С 13H24N3O6P (349,3): С 44,70, Н 6,92, N 12,03, Р 8,37,найд. С 44,58, Н 7,02, N 11,95, Р 8,53. 1(P-C); 65,04 (С-1'); 70,37 d, 2C, J(P,C)=6,3(P-OC); 70,87 d, J(P,C)=11,7 (C-2'); 79,95 (C-5); 155,68 (C-4); 164,25 (C-2); 171,01 (C-6). Полученный продукт обрабатывают бромтриметилсиланом (10 мл) в ацетонитриле (80 мл) в течение ночи, упаривают в вакууме и остаток обрабатывают водой (50 мл). Через 10 мин добавляют концентрированный водный раствор аммиака до щелочной реакции и смесь упаривают. Остаток деионизируют на колонке (100 мл) со смолой Dowex 50 Х 8 и поглощающий в УФ аммонийный элюат упаривают досуха. Остаток растворяют в минимальном количестве горячей воды добавлением конц. водного раствора аммиака и подкисляют конц. HCl до рН 3-3,5. Осадок собирают, промывают водой, этанолом и сушат в вакууме. Выход 0,7 г, т.пл. 227 С. Элементный анализ: рассч. для С 7 Н 12N3O6P (265,16): С 31,71, Н 4,56, N 15,85, Р 11, 68,найд. С 31,55, Н 4,62, N 16,15, Р 11,51. Пример 3. а) 2,4-Диамино-6-(S)-[2-(фосфонометокси)пропокси]пиримидин (Н-3560). Диизопропиловый эфир (S)-2-(4-толуолсульфонилокси)пропилоксиметилфосфоновой кислоты (25,7 г, 63 ммоль) в ДМФ (40 мл) при 90 С добавляют к перемешиваемой смеси 2,4-диамино-6 гидроксипиримидина (60 ммоль), ДМФ (40 мл) и DBU (10,6 мл, 60 ммоль). Реакционную смесь перемешивают при 100 С в течение 24 ч и упаривают в вакууме. Остаток переносят в хлороформ (200 мл),- 12006020 фильтруют и промывают насыщенным NaCl (100 мл). Водный слой экстрагируют хлороформом (550 мл), объединенные экстракты сушат над сульфатом магния и упаривают. Остаток разделяют на колонке с силикагелем (150 мл) в хлороформе в градиенте хлороформ/этанол, при этом получают основной продукт (O6-изомер) в виде маслообразного остатка, который сушат в вакууме над пятиокисью фосфора в течение ночи. Затем добавляют ацетонитрил (80 мл) и бромтриметилсилан (20 мл), раствор выдерживают в закрытом сосуде в течение ночи. Летучие вещества отгоняют в вакууме и остаток обрабатывают водой(100 мл). Через 10 мин добавляют конц. водный раствор аммиака до щелочной реакции и смесь упаривают. Остаток деионизируют на колонке (100 мл) со смолой Dowex 50 Х 8 и поглощающий в УФ аммонийный элюат упаривают досуха. Раствор полученного продукта в воде (20 мл) подщелачивают с помощью конц. водного раствора аммиака и наносят на колонку (200 мл) со смолой Dowex 1 Х 2 (в ацетатной форме), предварительно промытую водой. Проводят элюирование водой и затем линейным градиентом концентрации уксусной кислоты (0-0,5 М, каждого раствора по 1,5 л), при этом получают основную поглощающую в УФ фракцию, которую упаривают, остаток перегоняют совместно с водой (350 мл) и кристаллизуют из воды. Выход составляет 3,5 г (19,7%), т.пл. 281 С. Элементный анализ: рассч. для моногидрата CHNOPH2O (296,22): С 32,44, Н 5,78, N 18,91, Р 10,46,найд. С 32,67, Н 5,86, N 19,40, Р 10,60. 1(R)-2-(4-толуолсульфонилокси)пропилоксиметилфосфоновой кислоты (50 ммоль), 2,4-диамино-6 гидроксипиримидина (60 ммоль) и DBU (60 ммоль) в ДМФ (70 мл). Реакционную смесь перемешивают при 100 С в течение 24 ч. Дальнейшая методика обработки описана в примере 4. Выход составляет 24%,вещество устойчиво до 290 С. Элементный анализ: рассч. для моногидрата С 8 Н 15N4O5PН 2O (296,22): С 32,44, Н 5,78, N 18,91, Р 10,46,найд. С 32,54, Н 5,90, N 19,10, Р 10,65. 1H ЯМР и 13 С ЯМР спектры аналогичны спектрам S-энантиомера. Пример 4. 2,4-Диамино-6-[2-(фосфонометокси)этилсульфанил]пиримидин. Суспензию полусульфата 2,4-диамино-6-сульфанилпиримидина (2,616 г, 13,7 ммоль) в ДМФ (40 мл) обрабатывают гидридом натрия (1,0855 г, 27 ммоль, 60%-ная дисперсия в парафиновом масле) в течение 1 ч при перемешивании, затем к смеси добавляют диизопропиловый эфир 2-хлорэтоксиметилфосфоновой кислоты (9 мл, 17,2 ммоль). Смесь перемешивают в течение 8 ч при 80 С, фильтруют через слой целита и упаривают в вакууме. Остаток в хлороформе очищают на колонке с силикагелем(150 мл) с использованием в качестве элюента смеси хлороформ/этанол (49:1), при этом получают 2,4 диамино-6-[2-(диизопропилфосфонилметокси)этилсульфанил]пиримидин (4.0 г, 80%), т.пл. 109 С. Элементный анализ: рассч. для C13H25N4O4PS (364,40): С 42,85, Н 6,91, N 15,38, Р 8,50, S 8,80,найд. С 42,48, Н 6,94, N 15,50, Р 8,63, S 9,01. 1- 13006020 Полученный продукт в ацетонитриле (50 мл) обрабатывают бромтриметилсиланом (5 мл) в течение ночи и летучие вещества упаривают в вакууме. Остаток обрабатывают водой (100 мл). Через 10 мин добавляют конц. водный раствор аммиака до щелочной реакции и смесь упаривают. Остаток деионизируют на колонке (100 мл) со смолой Dowex 50 Х 8 и поглощающий в УФ аммонийный элюат упаривают досуха. Раствор полученного продукта в воде (20 мл) подщелачивают конц. водным раствором аммиака и наносят на колонку (100 мл) со смолой Dowex 1 Х 2 (в ацетатной форме), предварительно промытую водой. Проводят элюирование водой и затем линейным градиентом концентрации уксусной кислоты (0-0,5 M,каждого раствора по 1,5 л), при этом получают основную поглощающую в УФ фракцию, которую упаривают, остаток перегоняют совместно с водой (350 мл) и остаток кристаллизуют из воды. Выход 2,4 диамино-6-[2-(фосфонометокси)этилсульфанил]пиримидина составляет 2,8 г (91%), т.пл. 246 С. Элементный анализ: рассч. для C7H13N4O4PS (280,24): С 30,00, Н 4,68, N 19,99, Р 11,05, S 11,44,найд. С 30,27, Н 4,80, N 19,74, Р 10,98, S 11,60. 1 4-Амино-6-[2-(фосфонометокси)этокси]пиримидин и 4-амино-1-[2-(фосфонометокси)этил]пиримидин-6(1 Н)-он. 4-Амино-6-гидрокси-2-сульфанилпиримидин (20 г) в кипящем этаноле (300 мл) при перемешивании обрабатывают никелем Рэнея до потребления исходных веществ. Суспензию фильтруют в горячем состоянии, осадок промывают горячим этанолом (300 мл) и фильтрат упаривают досуха. Остаток перекристаллизовывают из этанола (эфир добавляют для повышения мутности), при этом получают 4-амино-6 гидроксипиримидин, т.пл. 272 С, выход 10,0 г (64,4%). Элементный анализ: рассч. для C4H5N3O (111,10): С 43,24, Н 4,54, N 37,82,найд. С 43,40, Н 4,65, N 38,01. МС: 112 (MH+). 1H ЯМР (СD3SOCD3): 4,97 s, 1 Н (Н-5); 6,42 brs, 2H (NH2), 7,77 s, 1 Н (Н-2); 11,41 brs, 1H (ОН). Полученное соединение (3,6 г, 33,6 ммоль) в ДМФ (70 мл) обрабатывают NaH (1,36 г, 34 ммоль,60%-ная дисперсия в парафиновом масле) в течение 0,5 ч при перемешивании, затем к смеси добавляют диизопропиловый эфир 2-хлорэтоксиметилфосфоновой кислоты (9,4 мл, 40,5 ммоль). Смесь перемешивают в течение 8 ч при 80 С, фильтруют через слой целита и упаривают в вакууме. Остаток в хлороформе очищают на колонке с силикагелем с использованием в качестве элюента смеси хлороформ/этанол(97,5:2,5), при этом получают 4-амино-6-[2-(диизопропилфосфонилметокси)этокси]пиримидин, который кристаллизуют из смеси этилацетат/петролейный эфир, выход 3,0 г (26,8%), т.пл. 112 С. Элементный анализ: рассч. для C13H24N3O5P (333,32): С 46,84, Н 7,26, N 12,61, Р 9,29,найд. С 46,69, Н 7,38, N 12,45, Р 9,40. 1H ЯМР (CD3SOCD3): 1,22 d, 6H и 1,23 d, 6H, J(CH3,CH)=6,1 (4 хСН 3); 3,78 brt, 2H, J(2',1')=4,5 (H-2'); 3,78 d, J(CH2-P)=8,4 (CH2-P); 4,31 brt, 2H, J(1',2')=4,5 (Н-1'); 4,59 m, 2H (Р-ОСН); 5,67 s, 1 Н (Н-5); 6,62 bs,2H (NH2); 8,07 s, 1H (Н-2). 13 С ЯМР (СD3SOCD3): 64,42 (С-1'). Полученный продукт обрабатывают бромтриметилсиланом (10 мл) в ацетонитриле (70 мл) в течение ночи при комнатной температуре. После упаривания в вакууме остаток обрабатывают водой (100- 14006020 мл). Через 10 мин добавляют конц. раствор аммиака до щелочной реакции и смесь упаривают. Остаток деионизируют на колонке (100 мл) со смолой Dowex 50 Х 8 и поглощающий в УФ аммонийный элюат упаривают досуха. Раствор полученного продукта в воде (20 мл) подщелачивают с помощью конц. водного раствора аммиака и наносят на колонку (150 мл) со смолой Dowex 1 Х 2 (в ацетатной форме), предварительно промытую водой. Проводят элюирование водой и затем линейным градиентом концентрации уксусной кислоты (0-1 M, каждого раствора по 1 л), при этом получают основную поглощающую в УФ фракцию, которую упаривают, остаток перегоняют совместно с водой (350 мл) и кристаллизуют из воды. Выход 4-амино-6-[2-(фосфонометокси)этокси]пиримидина составляет 1,8 г (80%), т.пл. 254 С. Элементный анализ: рассч. для С 7 Н 12N3O5P (249,16): С 33,74, Н 4,85, N 16,86, Р 12,43,найд. С 34,02, Н 4,80, N 16,88, Р 12,58. Неочищенную реакционную смесь элюируют с колонки с силикагелем с использованием в качестве элюента смеси хлороформ/этанол (95:5), при этом получают маслообразный 4-амино-1-[2(диизопропилфосфонилметокси)этил]пиримидин-6(1 Н)-он, который сушат в вакууме, выход 4,6 г(41,1%). Полученный продукт обрабатывают бромтриметилсиланом (10 мл) в ацетонитриле (70 мл) в течение ночи при комнатной температуре. После упаривания в вакууме остаток обрабатывают водой(100 мл). Через 10 мин добавляют конц. водный раствор аммиака до щелочной реакции и смесь упаривают. Остаток наносят на колонку (100 мл) со смолой Dowex 50 Х 8 и элюируют водой. Основную поглощающую в УФ фракцию упаривают и остаток кристаллизуют из 70%-ного водного растора этанола 2-Амино-4-диметиламино-6-[2-(фосфонометокси)этокси]пиримидин и 2-амино-4-диметиламино-1[2-(фосфонометокси)этил]пиримидин-6(1 Н)-он. Моногидрат 2-амино-4-хлор-6-гидроксипиримидина (5,0 г) перемешивают с 30%-ным диметиламином в этаноле (180 мл) при 100 С в автоклаве в течение 16 ч. Кристаллический продукт отфильтровывают, промывают водой, ацетоном, эфиром и сушат вакууме, при этом получают 2-амино-4-диметиламино 6-гидрокси-пиримидин, устойчивый до 300 С, выход составляет 4,3 г (81%). Элементный анализ: рассч. для C6H10N4O (154,17): С 46,34, Н 6,54, N 36,34,найд. С 46,38, Н 6,65, N 36,68. 1H ЯМР (СD3SOCD3): 2,89 s, 6 Н (N-СН 3); 4,51 s, 1 Н (Н-5); 6,18 brs, 2H (NH2); 9,75 brs, 1H (ОН). Полученное соединение (4,0 г, 26 ммоль) и карбонат цезия (4,22 г, 13 ммоль) в ДМФ (60 мл) перемешивают при 100 С в течение 1 ч и затем добавляют диизопропиловый эфир 2-хлорэтоксиметилфосфоновой кислоты (8 мл). Смесь перемешивают при 100 С в течение 24 ч, фильтруют в горячем состоянии и упаривают в вакууме. Остаток экстрагируют горячим хлороформом (100 мл),фильтруют и очищают хроматографией на колонке с силикагелем (200 мл) с использованием в качестве элюента хлороформа, при этом получают 2-амино-4-диметиламино-6-[2-(диизопропилфосфонил- 15006020 метокси)этокси]пиримидин в виде вязкого масла (4,6 г). Полученный продукт обрабатывают бромтриметилсиланом (5 мл) и ацетонитрилом (50 мл) в течение ночи при комнатной температуре. После упаривания в вакууме остаток обрабатывают водой (100 мл). Через 10 мин добавляют конц. водный раствор аммиака до щелочной реакции и смесь упаривают. Остаток деионизируют на колонке (100 мл) со смолойDowex 50 Х 8 и поглощающий в УФ аммонийный элюат упаривают досуха. Раствор полученного продукта в воде (20 мл) подщелачивают с помощью конц. водного раствора аммиака и наносят на колонку (150 мл) со смолой Dowex 1 Х 2 (в ацетатной форме), предварительно промытую водой. Проводят элюирование водой и затем линейным градиентом уксусной кислоты (0-0,4 М, каждого раствора по 1 л), при этом получают основную поглощающую в УФ фракцию, которую упаривают, остаток перегоняют совместно с водой (350 мл) и кристаллизуют из воды. Выход 2-амино-4-диметиламино-6-[2-(фосфонометокси) этокси]пиримидина составляет 1,1 г, т.пл. 168 С. Элементный анализ: рассч. для C9H17N4O5P (292,23): С 36,99, Н 5,86, N 19,17, Р 10,60,найд. С 37,05, Н 5,80, N 18,98, Р 10,51. 1(N(СН 3)2). Полученное вещество элюируют с колонки с силикагелем с использованием в качестве элюента смеси хлороформ/этанол, при этом получают 2-амино-4-диметиламино-1-[2-(диизопропилфосфонилметокси)этил]пиримидин-6(1 Н)-он в виде вязкого масла (2,0 г), который обрабатывают бромтриметилсиланом (5 мл) и ацетонитрилом (50 мл) в течение ночи, далее обрабатывают, как описано выше. После хроматографии на колонке со смолой Dowex 1 и кристаллизации из воды получают 2-амино-4 диметиламино-1-[2-(фосфонометокси)-этил]пиримидин-6(1 Н)-он, т.пл. 235 С. Элементный анализ: рассч. для C9H17N4O5P (292,23): С 36,99, Н 5,86, N 19,17, Р 10,60,найд. С 37,15, Н 5,92, N 19,28, Р 10,66. 1 2-Амино-4-циклопропиламино-6-[2-(фосфонометокси)этокси]-пиримидин и 2-амино-4-циклопропиламино-1-[2-(фосфонометокси)этил]пиримидин-6(1 Н)-он. Моногидрат 2-амино-4-хлор-6-гидроксипиримидина (5,0 г) кипятят с обратным холодильником в этаноле (150 мл) в смеси с циклопропиламином в течение 12 ч. Смесь упаривают в вакууме, перегоняют с этанолом (350 мл), сорбируют из метанола на силикагель и наносят на колонку с силикагелем (200 мл) в хлороформе с использованием в качестве элюента градиента хлороформ/этанол, при этом получают кристаллический продукт, который переносят в эфир, отфильтровывают и сушат в вакууме, при этом получают 2-амино-4-циклопропиламино-6-гидроксипиримидин, т.пл. 229 С, выход 3,0 г. Элементный анализ:H ЯМР (DMSO): 9,73 brs, 1H (ОН); 6,55 bs, 2H (NH); 6,08 brs, 2H (NH2); 4,66 s, 1H (Н-5); 2,30 m, 1H и 0,62 m, 2H и 0,40 m, 2H (С-СН 2, N-СН). Смесь полученного соединения (3,0 г, 18 ммоль) и карбоната цезия (2,92 г, 9 ммоль) в ДМФ (50 мл) перемешивают при 100 С в течение 1 ч и затем добавляют диизопропиловый эфир 2-хлорэтоксиметилфосфоновой кислоты (6 мл). Реакционную смесь перемешивают при 100 С в течение 24 ч, фильтруют в горячем состоянии и упаривают в вакууме. Остаток экстрагируют горячим хлороформом (100 мл), фильтруют, концентрируют в вакууме и очищают хроматографией на колонке с силикагелем (2200 мл) с использованием в качестве элюента хлороформа, при этом получают 2-амино-4-циклопропиламино-6-[2-(диизопропилфосфонилметокси)этокси]пиримидин в виде вязкого масла (1,8 г). Полученный продукт обрабатывают бромтриметилсиланом (5 мл) и ацетонитрилом (50 мл) в течение ночи при комнатной температуре. После упаривания в вакууме остаток обрабатывают водой (100 мл). Через 10 мин добавляют конц. водный раствор аммиака до щелочной реакции и смесь упаривают. Остаток деионизируют на колонке (100 мл) со смолой Dowex 50 Х 8 и поглощающий в УФ аммонийный элюат упаривают досуха. Раствор полученного продукта в воде (20 мл) подщелачивают с помощью конц. водного раствора аммиака и наносят на колонку (150 мл) со смолой Dowex 1 Х 2 (в ацетатной форме), предварительно промытую водой. Проводят элюирование водой и затем линейным градиентом концентрации уксусной кислоты (0-0,4 М, каждого раствора по 1 л), при этом получают основную поглощающую в УФ фракцию, которую упаривают, остаток перегоняют с водой (350 мл) и кристаллизуют из воды. Выход 2-амино-4-циклопропиламино-6-[2-(фосфонометокси)этокси]пиримидина составляет 1,0 г,т.пл. 244 С. Элементный анализ: рассч. для C10H17N4O5P (304,24): С 39,48, Н 5,63, N 18,42, Р 10,18,найд. С 39,65, Н 5,70, N 18,59, Р 10,11. 1(CH2,P); 3,91 m, 2H (H-2'); 4,32 m, 2H (Н-1'); 5,61 s, 1H (H-5). Полученное вещество элюируют с колонки с силикагелем с использованием в качестве элюента градиента хлороформ/этанол, при этом (после кристаллизации из смеси этанол/эфир) получают 2-амино 4-циклопропиламино-1-[2-(диизопропилфосфонилметокси)этил]пиримидин-6(1 Н)-он в виде твердого вещества желтого цвета (1,6 г), который обрабатывают бромтриметилсиланом (5 мл) и ацетонитрилом(50 мл) в течение ночи, далее обрабатывают, как описано выше. После хроматографии на колонке со смолой Dowex 50 продукт элюируют водой и упаривают в вакууме. Остаток перекристаллизовывают из воды, при этом получают 2-амино-4-циклопропиламино-1-[2-(фосфонометокси)этил]пиримидин-2-он,устойчивый до 290 С, выход 0,90 г. Элементный анализ: рассч. для C10H17N4O5P (304,24): С 39,48, Н 5,63, N 18,42, Р 10,18,найд. С 39,70, Н 5,78, N 18,69, Р 10,32. 13- 17006020 2-Амино-4-метил-6-[2-(фосфонометокси)этокси]пиримидин и 2-амино-4-метил-1-[2-(фосфонометокси)этил]пиримидин-6(1 Н)-он. Диизопропиловый эфир 2-хлорэтоксиметилфосфоновой кислоты (15 мл, 62,5 ммоль) добавляют к смеси 2-амино-6-гидрокси-4-метилпиримидина (6,25 г, 50 ммоль) и карбоната цезия (11,3 г, 25 ммоль) в ДМФ (70 мл), которую предварительно перемешивают при 100 С в течение 1 ч. Реакционную смесь перемешивают при 100 С в течение 14 ч, фильтруют в горячем состоянии и упаривают в вакууме. Остаток экстрагируют хлороформом и очищают на колонке с силикагелем (250 мл), при этом получают 2-амино 4-метил-6-[2-(диизопропилфосфонилметокси)этокси]пиримидин, который затем кристаллизуют из смеси этилацетат/петролейный эфир, выход 5,75 г, т.пл. 72-73 С. Элементный анализ: рассч. для С 14H26N3O5 Р (347,35): С 48,41, Н 7,54, N 12,10, Р 8,92,найд. С 48,70, Н 7,60, N 12,32, Р 9,14. 1H ЯМР (CDCl3): 5,95 q, 1H, J=0,6 Гц (Н-5); 4,90 b, 2H (NH2), 4,76 dh, 2H, J(H,P)=7,6 Гц и J(H,H)=6,2 Гц (2xOCH(iPr, 4,42 m, 2H (2 хН-1'); 3,90 m, 2H (2 хН-2'), 3,82 d, 2H, J(H,P)=8,2 Гц (P-CH2); 2,26 d, 3H,J=0,6 Гц (СН 3); 1,34 d, 6H, J=6,2 Гц и 1,33 d, 6H, J=6,2 Гц (4 хСН 3(iРr. 13 ЯМР (CDCl3): 170,36, 168,27 и 162,48 (С-2, С-4 и С-6); 97,03 (С-5); 71,17 d, J(C,P)=10,8 Гц (С-2'); 71,06 d, J(C,P)=6,8 Гц (OCHiPr; 65,99 d, J(C,P)=167,6 Гц (Р-СН 2); 64,60 (С-1'); 24,04 d, J(C,P)=3,9 Гц и 23,90 d, J(C,P)=4,9 Гц (4 хСН 3(iРr; 23,61 (СН 3). Полученный продукт обрабатывают бромтриметилсиланом (5 мл) в ацетонитриле (50 мл) в течение ночи при комнатной температуре и летучие вещества упаривают в вакууме. Остаток растворяют в воде(100 мл), добавляют конц. раствор аммиака до щелочной реакции и смесь упаривают. Остаток деионизируют на колонке (100 мл) со смолой Dowex 50 Х 8 и поглощающий в УФ аммонийный элюат упаривают досуха. Раствор полученного продукта в воде (20 мл) подщелачивают с помощью конц. водного раствора аммиака и наносят на колонку (150 мл) со смолой Dowex 1 Х 2 (в ацетатной форме), предварительно промытую водой. Проводят элюирование водой и затем линейным градиентом концентрации уксусной кислоты (0-0,4 М, каждого раствора по 1 л), при этом получают основную поглощающую УФ-излучение фракцию, которую упаривают, остаток перегоняют с водой (350 мл) и кристаллизуют из воды. Выход 2 амино-4-метил-6-[2-(фосфонометокси)этокси]пиримидина составляет 3,67 г, т.пл. 245 С. Элементный анализ: рассч. для С 8 Н 14N3O5P (263,19): С 36,51, Н 5,36, N 15,97, Р 11,77,найд. С 36,65, Н 5,60, N 15,69, Р 11,92. 1(С-2'); 72,06 d, J(C,P)=149,4 Гц (P-CH2); 68,85 (С-1'); 25,42 (СН 3). Затем элюируют с колонки с силикагелем и кристаллизуют из смеси этилацетат/петролейный эфир,при этом получают 2-амино-4-метил-1-[2-(диизопропилфосфонилметокси)этил]пиримидин-6(1 Н)-он (4,2 г), т.пл. 88 С. Элементный анализ: рассч. для C14H26N3O5P (347,35): С 48,41, Н 7,54, N 12,10, Р 8,92,найд. С 48,49, Н 7,62, N 12,30, Р 9,08. 1H ЯМР (СDCl3): 5,79 q, 1H, J=0,8 Гц (Н-5); 5,62 b, 2H, (NН 2); 4,72 dh, 2H, J(H,P)=7,6 Гц и J(H,H)=6,2 Гц (2xOCH(iPr; 4,20 m, 2H (2 хН-1'); 3,90 m, 2H (2 хН-2'); 3,74 d, 2H, J(H,P)=8,6 Гц (P-CH2); 2,12 d, 3H,J=0,8 Гц (СН 3); 1,32d, 6H, J=6,2 Гц и 1,29 d, 6H, J=6,2 Гц (4 хСН 3(iРr. 13 С ЯМР (CDCl3): 164,33, 162,93 и 156,37 (С-2, С-4 и С-6); 102,22 (С-5); 72,88 d, J(C,P)=11,7 Гц (С-2'), 71,27 d, J(C,P)=6,8 Гц (OCH(iPr; 66,17 d, J(C,P)=168,1 Гц (P-CH2); 43,06 (С-1'); 23,97 d, J(C,P)=3,9 Гц и 23,91 d, J(C,P)=4,9 Гц (2 хСН 3(iРr; 23,64 (СН 3). Полученный продукт обрабатывают аналогичным образом бромтриметилсиланом (5 мл) в ацетонитриле (50 мл), дионизированную реакционную смесь очищают хроматографией на колонке со смолойDowex 1 Х 2 и кристаллизуют из воды, при этом получают 2-амино-4-метил-1-[2(фосфонометокси)этил]пиримидин-6(1 Н)-он, выход 2,3 г, т.пл. 283 С. Элементный анализ: рассч. для C8H14N3O5P (263,19): С 36,51, Н 5,36, N 15,97, Р 11,77,найд. С 36,40, Н 5,23, N 15,77, Р 12,00. 1 4-Амино-2-метилсульфанил-6-[2-(фосфонометокси)этокси]пиримидин. Диэтиловый эфир 2-гидроксиэтилфосфоновой кислоты (5,3 г, 25 ммоль) в ДМФ (40 мл) обрабатывают при 0 С NaH (1,0 г, 60%-ная дисперсия в парафиновом масле) и после перемешивания при 0 С в течение 1 ч одной порцией добавляют 4-амино-6-хлор-2-метилсульфанилпиримидин (3,5 г, 20 ммоль). Смесь перемешивают при 100 С в течение 16 ч, упаривают в вакууме досуха и экстрагируют горячим хлороформом (300 мл). Экстракт упаривают в вакууме и остаток обрабатывают бромтриметилсиланом(10 мл) в ацетонитриле (50 мл) при комнатной температуре в течение ночи. Смесь упаривают в вакууме досуха и остаток деионизируют на колонке (100 мл) со смолой Dowex 50 Х 8 и поглощающий в УФ аммонийный элюат упаривают досуха. Полученный продукт растворяют в воде (20 мл) при добавлении конц. водного раствора аммиака и подкисляют с помощью HCl до рН 3-3,5. Осадок собирают, промывают водой,этанолом и сушат в вакууме. Выход 4-амино-2-метилсульфанил-6-[2-(фосфонометокси)этокси]пиримидина составляет 0,8 г, т.пл. 210-211 С. Элементный анализ: рассч. для C8H14N3O5PS (263,19): С 32,54, Н 4,78, N 14,23, Р 10,49, S 10,86,найд. С 32,42, Н 4,93, N 14,07, Р 10,62, S 11,04. 1 2-Амино-4,6-бис[2-(фосфонометокси)этокси]пиримидин и 2-амино-4-[2-(фосфонометокси)этокси]1-[2-(фосфонометокси)этил]пиримидин-6(1 Н)-он. 2-Амино-4,6-дигидроксипиримидин (12,7 г, 0,1 моль) и карбонат цезия (27,8 г, 85 ммоль) в ДМФ (200 мл) перемешивают при 100 С в течение 1 ч и затем добавляют диизопропиловый эфир 2-хлорэтоксиметилфосфоновой кислоты (30 мл). Смесь перемешивают при 100 С в течение 16 ч, фильтруют в горячем состоянии и упаривают в вакууме. Остаток очищают хроматографией на колонке с силикагелем (200 мл), при этом получают 2,8 г маслообразного остатка, который затем обрабатывают бромтриметилсиланом (7 мл) в ацетонитриле (50 мл) в течение ночи. Остаток растворяют в воде (100 мл), добавляют конц. раствор аммиака до щелочной реакции и смесь упаривают. Остаток деионизируют на колонке (100 мл) со смолой Dowex 50 Х 8 и поглощающий в УФ аммонийный элюат упаривают досуха. Продукт перегоняют с этанолом и отфильтровывают от этанола. Выход 2-амино-4,6-бис[2-(фосфонометокси)этокси]пиримидин составляет 1,4 г, т.пл. 127 С. Элементный анализ: рассч. для С 10 Н 19N3O10P2 (403,22): С 29,79, Н 4,75, N 10,42, Р 15,36,найд. С 29,90, Н 4,87, N 10,24, Р 16,54. 1C ЯМР (DMSO): 171,30 (С-4, С-6); 162,76 (С-2); 78,60 (С-5); 70,70 d, J(C,P)=11,7 Гц (С-2'); 66,86 d,J(C,P)=160,2 Гц (Р-СН 2); 64,81 (С-1'). Затем элюируют с колонки с силикагелем, при этом получают вязкое масло (4,8 г), которое обрабатывают бромтриметилсиланом (10 мл) в ацетонитриле (70 мл) в течение ночи и упаривают в вакууме. Остаток пропускают через колонку со смолой Dowex 50 Х 8 (в Н+ форме) (150 мл) и колонку элюируют водой. После промывания от неорганических солей продукт элюируют (с удерживанием). Содержащие продукт фракции упаривают и остаток перемешивают со смесью этанол/ацетон (1:1, 100 мл). Продукт желтоватого цвета фильтруют, промывают эфиром и сушат. Выход 2-амино-4-[2-(фосфонометокси)этокси]-1-[2-(фосфонометокси)этил]пиримидин-6(1 Н)-она составляет 1,8 г, т.пл. 108 С. Элементный анализ: рассч. для C10H19N3O10P2 (403,22): С 29,79, Н 4,75, N 10,42, Р 15,36,найд. С 29,90, Н 4,87, N 10,24, Р 15,64.(а) 2,4-Диамино-6-[2-(фосфонометокси)этокси]пиримидин. Гидрид натрия (60%-ная суспензия в парафиновом масле) (2,4 г, 60 ммоль) осторожно порциями добавляют к перегнанному этиленгликолю (50 мл) при отсутствии влаги до растворения. Затем одной порцией добавляют 2,4-диамино-6-хлорпиримидин (2,89 г, 20 ммоль) и смесь перемешивают при 80 С в течение 6 ч. Реакционную смесь охлаждают, разбавляют водой (200 мл) и пропускают через колонку(200 мл) со смолой Dowex 50 Х 8 в кислой форме. Колонку промывают водой (1 л) и смолу суспендируют в воде (300 мл). Суспензию подщелачивают конц. водным раствором аммиака, фильтруют и смолу промывают кипящей водой (1 л). Объединенные фильтраты упаривают досуха и остаток кристаллизуют из воды, при этом получают 2,4-диамино-6-(2-гидроксиэтокси)пиримидин, т.пл. 190 С, выход 2,3 г (79,4%). Элементный анализ: рассч. для C6H10N4O2 (170,18): С 42,34, Н 5,92, N 30,37,найд. С 42,09, Н 5,89, N 30,63. МС: 171,3 (МН+). 1(3,5 г, 3,5 экв.). Смесь перемешивают при температуре окружающей среды в течение 3 сут. и затем по каплям добавляют уксусную кислоту (4 мл). Растворитель удаляют в вакууме и остаток экстрагируют хлороформом. Продукт реакции очищают хроматографией на колонке с силикагелем, кристаллизуют из смеси этилацетат/петролейный эфир, при этом получают 2,4-диамино-6-[2-(диизопропилфосфонилметокси)этокси]пиримидин, т.пл. 159 С, выход 6,45 г (74%). Элементный анализ: рассч. для С 13H25N4O5P (348,3): С 44,83, Н 7,23, N 16,08, Р 8,89,найд. С 44,86, Н 7,15, N 16,21, Р 9,05. МС: 349,3 (МН+). 1H ЯМР спектр (СD3SOCD3) аналогичен спектру, описанному в примере 1. Превращение данного соединения в 2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидин проводят в основном, как описано в примере 1, при этом получают соединение, идентичное описанному материалу, на основании ЯМР- и масс-спектров.(б) 2,4-Диамино-6-[2-(фосфонометокси)этокси]пиримидин. Реакцию проводят, в основном, как описано в п.(а), за исключением того, что вместо гидрида натрия используют такое же мольное количество трет-бутоксида калия. Выход 2,4-диамино-6-(2 гидроксиэтокси)пиримидина составляет 81%. Далее методику проводят, как описано выше.(а) 2,4-Диамино-6-[(RS)-3-гидрокси-2-(фосфонометокси)пропокси]пиримидин. 4-Гидроксиметил-2,2-диметил-1,3-диоксолан (13,2 г, 0,1 моль) в свежеперегнанном тетрагидрофуране (100 мл) добавляют по каплям в суспензию NaH (0,2 моль) в тетрагидрофуране (400 мл). Смесь перемешивают до растворения и затем добавляют 2,4-диамино-6-хлорпиримидин (14,46 г, 0,1 моль). Реакционную смесь кипятят с обратным холодильником при перемешивании в атмосфере аргона в течение 12 ч и нейтрализуют уксусной кислотой. Суспензию фильтруют, промывают тетрагидрофураном и фильтратупаривают досуха в вакууме. Остаток очищают на колонке с силикагелем (300 мл) в хлороформе,кристаллизуют из смеси этилацетат/петролейный эфир, при этом получают 2,4-диамино-6-[2,2-диметил 1,3-диоксоланил-4-метокси]пиримидин, т.пл. 128 С, выход 16,0 г (66,6%). Элементный анализ: рассч. для С 10 Н 16N4 О 3 (240,3): С 49,99, Н 6,71, N 23,32, найд. С 49,95, Н 6,84, N 23,05. МС: 241,3 (MH+). 1(CiPr); 163,23 и 166,38 и 170,11 (С-6, С-2, С-4). Полученное соединение (14,4 г, 60 ммоль) в 0,25 М растворе H2SO4 (250 мл) выдерживают в течение ночи при комнатной температуре. Смесь нейтрализуют насыщенным раствором гидроксида бария,фильтруют и фильтрат упаривают досуха. Остаток перекристаллизовывают из 90%-ного раствора этанола (для мутности добавляют эфир), при этом получают 2,4-диамино-6-(2,3-дигидроксипропокси)пиримидин, т.пл. 160 С, выход 10,0 г (83,3%). Элементный анализ: рассч. для С 7 Н 12N4 О 3 (200,2): С 42,00, Н 6,04, N 27,99,найд. С 41,84, Н 6,24, N 28,06. МС: 201,2 (MH+). 1- 22006020 Смесь полученного соединения (8,0 г, 40 ммоль), тритилхлорида (36,4 г, 131 ммоль) и 4 диметиламинопиридина (2 г) в пиридине (160 мл) перемешивают в течение 15 ч при 50 С и медленно при перемешивании выливают в воду (2 л). Суспензию перемешивают в течение 1 ч, декантируют и после перемешивания с новой порцией воды (2 л) фильтруют и промывают водой. Осадок переносят в хлороформ (600 мл), сушат над MgSO4, упаривают и перегоняют с толуолом в вакууме (3 порции по 100 мл). Полученную смолу растворяют в минимальном объеме эфира и при интенсивном перемешивании по каплям добавляют в петролейный эфир (1 л). Осадок отфильтровывают, промывают петролейным эфиром и сушат, при этом получают 6-[2-гидрокси-3-(тритилокси)пропокси]-2,4-бис-(тритиламино) пиримидин, т.пл. 138 С, выход 33,4 г (91,5%). Элементный анализ: рассч. для C64H54N4O2 (911,1): N 6,15,найд. N 5,96. Полученное тритилпроизводное (27,3 г, 30 ммоль) и диизопропиловый эфир п-толуолсульфонилоксиметилфосфоновой кислоты (15,75 г, 45 ммоль) в тетрагидрофуране (300 мл) обрабатывают 60%-ным NaH (5,4 г, 3,5 экв.). Смесь перемешивают при температуре окружающей среды в течение 3 сут. и нейтрализуют уксусной кислотой. Растворитель удаляют в вакууме, остаток растворяют в этилацетате (800 мл) и экстрагируют водой (3200 мл). Органическую фазу упаривают досуха и остаток кипятят с обратным холодильником в 80%-ном водном растворе уксусной кислоты (300 мл) в течение 30 мин,охлаждают и упаривают в вакууме. Добавляют воду (300 мл) и смесь экстрагируют эфиром (4100 мл). Летучие вещества из водной фазы удаляют в вакууме и наносят на колонку со смолой Dowex 50 Х 8 (200 мл) в кислой форме. Колонку промывают водой до снижения кислотности и поглощения в УФ, а затем элюируют 2,5%-ным водным раствором аммиака. Поглощающий в УФ аммонийный элюат собирают,упаривают досуха в вакууме, остаток перегоняют с этанолом (3100 мл) и сушат над P2O5 в вакууме в течение ночи. Затем добавляют ацетонитрил (100 мл) и бромтриметилсилан (30 мл), смесь выдерживают без доступа влаги в течение ночи. После упаривания летучих веществ в вакууме к остатку добавляют воду (200 мл) и конц. водный раствор аммиака до щелочной реакции. Полученный раствор упаривают досуха и остаток деионизируют на колонке со смолой Dowex50X8 (200 мл) практически в аналогичных условиях. Поглощающий в УФ аммонийный элюат упаривают в вакууме, остаток растворяют в минимальном количестве воды и подщелачивают до рН 10 с помощью аммиака. Полученный раствор наносят на колонку (200 мл) Dowex 1 Х 2 (ацетатная форма), предварительно промытую водой. Колонку промывают водой до снижения поглощения в УФ и затем элюируют линейным градиентом концентрации уксусной кислоты (0-0,3 М, по 1,5 л каждого раствора). Основную поглощающую в УФ фракцию собирают,упаривают в вакууме и остаток перегоняют с водой (2100 мл). Остаток кристаллизуют из воды, при этом получают 2,4-диамино-6-[(RS)-3-гидрокси-2-(фосфонометокси)пропокси]пиримидин в форме моногидрата, выход 3,8 г (40,6%), игольчатые кристаллы белого цвета, т.пл. 213 С. Элементный анализ: рассч. для C8H15N4O6PH2O (312,2): С 30,78, Н 5,49, N 17,94, Р 9,92,найд. С 30,98, Н 5,52, N 17,99, Р 9,82. МС: 295,0 (MH+). 1(S)-2,2-Диметил-4-гидроксиметил-1,3-диоксолан (40 г, 0,3 моль), свежеприготовленный из 1,2:5.6 диизопропилиден-D-маннита и перегнанный в вакууме, по каплям добавляют в суспензию NaH (0,3 моль) в тетрагидрофуране (600 мл). Смесь перемешивают в течение 30 мин и затем добавляют 2,4 диамино-6-хлорпиримидин (36,2 г, 0,25 моль). Реакционную смесь кипятят с обратным холодильником при перемешивании в атмосфере аргона в течение 12 ч и нейтрализуют уксусной кислотой. Суспензию фильтруют, промывают тетрагидрофураном и фильтрат упаривают досуха в вакууме. Остаток очищают на колонке с силикагелем (600 мл) в хлороформе, кристаллизуют из смеси этилацетат/петролейный эфир,при этом получают 2,4-диамино-6-(S)-(2,2-диметил-1,3-диоксолан-4-илметокси)пиримидин, выход 46,0 г(76,6%). Полученное соединение (43,3 г, 0,18 моль) в 0,25 М растворе H2SO4 (800 мл) выдерживают в течение ночи при комнатной температуре. Смесь нейтрализуют насыщенным раствором гидроксида бария, фильтруют и фильтрат упаривают досуха. Остаток перекристаллизовывают из 90%-ного раствора этанола (для мутности добавляют эфир), при этом получают 2,4-диамино-6-(S)-(2,3-дигидроксипропокси)пиримидин, т.пл. 149 С, выход 32,0 г (89%). Элементный анализ: рассч. для С 7 Н 12N4O3 (200,2): С 42,00, Н 6,04, N 27,99,- 23006020 найд. С 41,94, Н 6,35, N 27,75. МС: 201,2 (МH+). Спектр ЯМР идентичен ЯМР спектру рацемического соединения. Смесь полученного соединения (32,0 г, 0,16 ммоль), тритилхлорида (140 г, 0,5 моль) и 4 диметиламинопиридина (3 г) в пиридине (500 мл) перемешивают в течение 24 ч при 80 С и медленно при перемешивании выливают в воду (5 л). Суспензию перемешивают в течение 1 ч, декантируют и после перемешивания с новой порцией воды (2 л) фильтруют и промывают водой. Осадок переносят в хлороформ (2 л), сушат над МgSO4, упаривают и перегоняют с толуолом в вакууме (3 порции по 200 мл). Полученную смолу растворяют в минимальном объеме эфира и при интенсивном перемешивании по каплям добавляют в петролейный эфир (2,5 л). Осадок отфильтровывают, промывают петролейным эфиром и сушат на воздухе в течение ночи. После сушки в вакууме получают 99,5 г (69%) 6-(S)-[2-гидрокси 3-(тритилокси)пропокси]-2,4-бис(тритиламино)пиримидина. Элементный анализ: рассч. для C64H54N4O2 (911,1): N 6,15,найд. N 5,96. Полученное производное тритила (99,5 г, 0,11 моль) и диизопропиловый эфир птолуолсульфонилоксиметилфосфоновой кислоты (42 г, 0,12 моль) в свежевысушенном тетрагидрофуране(600 мл) обрабатывают 60%-ным NaH (14,4 г, 0,36 моль). Смесь перемешивают при температуре окружающей среды в течение 3 сут., фильтруют через слой целита и фильтрат обрабатывают этанолом (20 мл). Растворитель удаляют в вакууме, остаток кипятят с обратным холодильником в 80%-ном водном растворе уксусной кислоты (500 мл) в течение 30 мин, и выдерживают в течение ночи при комнатной температуре. Кристаллический продукт отфильтровывают, промывают 80%-ной уксусной кислотой и фильтрат упаривают в вакууме. Добавляют воду (700 мл) и смесь экстрагируют эфиром (4200 мл). Водную фазу концентрируют в вакууме и наносят на колонку со смолой Dowex 50 Х 8 (250 мл) в кислой форме. Колонку промывают 20%-ным раствором метанола в воде до снижения кислотности и поглощения в УФ, а затем элюируют 2,5%-ным раствором аммиака в 20%-ном растворе метанола в воде. Поглощающий в УФ аммонийный элюат собирают, упаривают досуха в вакууме, остаток перегоняют с этанолом(3100 мл) и сушат над Р 2 О 5 в вакууме в течение ночи. Затем добавляют ацетонитрил (200 мл) и бромтриметилсилан (50 мл), смесь выдерживают без доступа влаги в течение ночи. После упаривания летучих веществ в вакууме к остатку добавляют воду (300 мл) и конц. водный раствор аммиака до щелочной реакции. Полученный раствор упаривают досуха и остаток деионизируют на колонке со смолой Dowex 50 Х 8 (250 мл) практически в аналогичных условиях. Поглощающий в УФ аммонийный элюат упаривают в вакууме, остаток растворяют в минимальном количестве воды и подщелачивают до рН 10 с помощью аммиака. Полученный раствор наносят на колонку (250 мл) Dowex 1 Х 2 (ацетатная форма), предварительно промытую водой. Колонку промывают затем водой до снижения поглощения элюата в УФ и элюируют линейным градиентом концентрации уксусной кислоты (0-0,3 М, по 2 л каждого раствора). Основную поглощающую в УФ фракцию упаривают в вакууме и остаток перегоняют с водой (2100 мл). Остаток перекристаллизовывают из воды, при этом получают 2,4-диамино-6-(S)-[3-гидрокси-2(фосфонометокси)пропокси]пиримидин в форме моногидрата, выход 13,8 г (40%), игольчатые кристаллы белого цвета. Элементный анализ: рассч. для C8H15N4O6PH2O (312,2): С 30,78, Н 5,49, N 17,94, Р 9,92,найд. С 31,00, Н 5,70, N 17,79, Р 9,75. МС: 295,0 (МН+). Спектр ЯМР идентичен спектру ЯМР для рацемического соединения. 2-Амино-4-гидрокси-6-[2-(фосфонометокси)этокси]пиримидин. 4-Гидроксиметил-2,2-диметил-1,3-диоксолан (15 мл, 0,12 моль) по каплям добавляют в течение 30 мин к перемешиваемой суспензии NaH (60%-ная дисперсия в парафиновом масле, 4,8 г, 0,12 моль) в тетрагидрофуране (250 мл). После перемешивания в течение 1 ч при комнатной температуре добавляют 2 амино-4,6-дихлорпиримидин (16,4 г, 0,1 моль) и смесь кипятят с обратным холодильником до практически полного потребления исходных веществ (ТСХ на пластинах с силикагелем, система метанол/хлороформ, 1:9). Смесь охлаждают, нейтрализуют добавлением уксусной кислоты, фильтруют через целит, промывают тетрагидрофураном и упаривают в вакууме. Остаток дважды декантируют из эфира(каждый раз по 100 мл), растворяют в хлороформе (100 мл) и фильтруют через короткую колонку с силикагелем (промывая 1 л хлороформа). Фильтрат упаривают в вакууме и остаток растворяют в горячем этилацетате, к теплому раствору осторожно добавляют равный объем эфира, и затем петролейный эфир до появления мутности. Продукт кристаллизуют в холодильнике, собирают фильтрованием, промывают смесью эфир/петролейный эфир (1:1) и сушат в вакууме, при этом получают 20,5 г (79%) 2-амино-4 хлор-6-[2,2-диметил-1,3-диоксолан-4-илметокси]пиримидина, т.пл. 152 С. Элементный анализ: рассч. для С 10 Н 14 СlN3O3 (259,7): С 46,25, Н 5,43, Сl 13,65, N 16,18,найд. С 46,45, Н 5,46, Cl 13,90, N 15,95. 1(СiPr); 160,21 (С-2); 162,95 (С-4), 170,48 (С-6). Смесь полученного соединения (13 г, 50 ммоль), ДАБКО (12 г) и K2 СО 3 (21,5 г) в воде (300 мл) кипятят с обратным холодильником при перемешивании в течение 3 ч. После охлаждения до комнатной температуры смолу Dowex 50 Х 8 (в кислой форме) добавляют порциями при перемешивании до рН приблизительно 6,0 для разложения карбоната и нейтрализации ДАБКО. Затем суспензию подщелачивают добавлением небольшого количества конц. водного раствора аммиака, фильтруют, промывают водой и фильтрат упаривают в вакууме. Смолу ресуспендируют в разбавленном (1:20) водном растворе аммиака(300 мл), фильтруют и смолу последовательно промывают кипящей водой (4200 мл). Фильтрат и про- 25006020 мывные фракции упаривают в вакууме. Оба остатка сушат перегонкой с этанолом и экстрагируют хлороформом. Полукристаллическое твердое вещество отфильтровывают, промывают хлороформом, наносят из раствора в метаноле на силикагель(50 мл). Материал наносят на короткую колонку (150 мл) в хлороформе и продукт элюируют смесью хлороформ/метанол (9:1). Вещество кристаллизуют из этанола(эфир добавляют до появления мутности), при этом получают 2-амино-4-гидрокси-6-[(2,2-диметил-1,3 диоксолан-4-ил)метокси]пиримидин, т.пл. 258 С, выход 8,2 г (68%). Элементный анализ: рассч. для С 10 Н 15N3O4 (241,2): С 46,25, Н 5,43, CI 13,65, N 16,18,найд. С 46,45, Н 5,46, CI 13,90, N 15,95. МС: 242 (М+Н). 1(3,6 г) и K2 СО 3 (9,0 г) в воде (100 мл) кипятят с обратным холодильником при перемешивании в течение 150 мин, охлаждают и подкисляют добавлением смолы Dowex 50 Х 8 (в H+ форме). Суспензию подщелачивают конц. водным раствором аммиака, после 5 мин перемешивания фильтруют и смолу промывают 50%-ным водным раствором метанола (200 мл). Фильтрат упаривают досуха, добавляют этанол (50 мл) и смесь упаривают досуха. Остаток очищают хроматографией на колонке с силикагелем (150 мл) с использованием в качестве элюента градиента хлороформ/метанол, при этом получают кристаллический 2 амино-6-[2-(диизопропилфосфонилметокси)этокси]-4-гидроксипиримидин, т.пл. 154 С, выход 78%. Элементный анализ: рассч. для С 13 Н 24N3O6P (349,3): С 44,70, Н 6,92, N 12,03, Р 8,37,найд. С 44,58, Н 7,02, N 11,95, Р 8,53. 1(P-C); 65,04 (С-1'); 70,37 d, 2C, J(P,C)=6,3 (P-OC); 70,87 d, J(P,C)=11,7 (С-2'); 79,95 (С-5); 155,68 (С-4); 164,25 (С-2); 171,01 (С-6). Полученный продукт обрабатывают бромтриметилсиланом (10 мл) в ацетонитриле (80 мл) в течение ночи, упаривают в вакууме и остаток обрабатывают водой (50 мл). Через 10 мин добавляют конц. водный раствор аммиака до щелочной реакции и смесь упаривают. Остаток деионизируют на колонке со смолой (100 мл) Dowex 50 Х 8 и поглощающий в УФ аммонийный элюат упаривают досуха. Остаток растворяют в минимальном количестве горячей воды при добавлении конц. водного раствора аммиака и подкислением конц.HCl до рН 3-3,5. Осадок собирают, промывают водой, этанолом и сушат в вакууме, при этом получают 2 амино-6-[2-(диизопропилфосфонилметокси)этокси]-4-гидроксипиримидин, выход 0,7 г, т.пл. 227 С. Элементный анализ: рассч. для С 7 Н 12N3O6P (265,16): С 31,71, Н 4,56, N 15,85, Р 11,68,найд. С 31,55, Н 4,62, N 16,15, Р 11,51. Пример 15.- 26006020 2,4-Диамино-5-бром-6-[2-(фосфонометокси)этокси]пиримидин. 2,4-Диамино-6-[2-(диизопропилфосфонилметокси)этокси] пиримидин (4,3 г, 12,3 ммоль) в ДМФ (40 мл) перемешивают в смеси с раствором брома в CCl4 (0,3 М, 50 мл) в течение 3 ч при температуре окружающей среды, подщелачивают триэтиламином и упаривают. Неочищенный продукт очищают на колонке с силикагелем (150 мл) в системе хлороформ/этанол и кристаллизуют из смеси этилацетат/петролейный эфир. Получают 3,9 г (11,9 ммоль) диэфира, который обрабатывают бромтриметилсиланом (20 мл) в ацетонитриле (50 мл) в течение ночи, упаривают в вакууме и проводят гидролиз в смеси аммиак/вода. После деионизации на смоле Dowex 50 (на колонке объемом 100 мл) остаток, элюированный аммиаком, очищают на колонке с Dowex 1 х 2 объемом 100 мл в градиенте концентрации уксусной кислоты (0-0,5 М, 1 л каждого раствора). Основную фракцию упаривают и кристаллизуют из воды, при этом получают 3,1 г (84%) указанного в заголовке соединения, т.пл. 218 С. Элементный анализ: рассч. для C7H12BrN4O5P (343,07): С 24,51, Н 3,53, Br 23,29, N 16,33, Р 9,03,найд. С 24,56, Н 3,55, Br 23,51, N 16,07, Р 8,89. Для получения 5-галогенаналога указанную реакцию проводят с использованием 2-амино-6-[2(диизопропилфосфонилметокси)этокси]-4-гидроксипиримидина. Пример 16. Антивирусную активность соединений по настоящему изобретению определяют по основной методике, описанной J. Balzarini et al. "9-(2-phosphonylmethoxyethyl)adenine (PMEA) effectively inhibits retrovirus replication in vitro and simian immunodeficiency virus infection in rhesus monkeys" (9-(2 фосфонилметоксиэтил)аденин (РМЕА) эффективно ингибирует репликацию ретровируса in vitro и вируса иммунодефицита обезьян у макак-резус) AIDS 5:21-28, 1991, и J. Balzarini et al. "Differential antiherpesvirus and antiretrovirus effects of the (S) and (R) enantiomers of acyclic nucleoside phosphonates: potent and(Различное антивирусное действие в отношении вируса герпеса и ретровируса (R) и (S) энантиомеров ациклических фосфонатов нуклеозидов: высокоэффективная и селективная антивирусная активность (R)9-(2-фосфонометоксипропил)-2,6-диаминопурина in vitro и in vivo в отношении ретровирусов. Antimicrobial Agents and Chemotherapy, 37:332-338, 1993). Полученные результаты представлены в табл. 1 а, в которой более высокой активности соответствуют более низкие абсолютные величины. Пример 17. Вирусы Источники вирусов MSV, ВИЧ тип 1 (ВИЧ-1) (штаммы, IIIB и Ва-L), ВИЧ-2 (штамм ROD) и FIVChem. Chemother. 5:13-19, 1994; Popovic et al., Science 224:497-500,1984). Исходные штаммы вирусов ВИЧ-1(IIIB) и ВИЧ-2(ROD) получают из супернатантов вирус-инфицированных культуральных клеток МТ-4. Вирус ВИЧ-1BaL культивируют в первичных макрофагах М/М человека, супернатант которых собирают, фильтруют и хранят при -80 С. Характеристики исходных штаммов вирусов, использованных в данном исследовании, определяют методом титрования в других первичных культуральных макрофагах М/М: 2,1108 РНК-ВИЧ геномов/мл (соответствует 35 нг антигена р 24) и 5000 инфекционных культуральнотканевых доз, 50% на мл (TCID50/мл). Выделение и характеристика клинических изолятов ВИЧ-1Van Laethem et al., AIDS 15:563-561, 2001). Клинический изолят ВИЧ-1/L1S получали от пациента, не прошедшего курс лечения NRTI (нуклеозидными ингибиторами обратной транскриптазы) или препаратами ациклических фосфонатов нуклеозидов (АНФ), и культивировали без селективной обработки какими-либо лекарственными средствами. Таким образом, изоляты не содержали заметных мутаций, которые характерны для пациентов, прошедших курс лечения NRTI или АНФ. Клинический изолят ВИЧ-1/L6S получали от пациента, прошедшего курс лечения лекарственными средствами, и изолят культивировали без селективной обработки какими-либо лекарственными средствами. Изолят, полученный от пациентов,прошедших курс лечения NRTI, характеризуется содержанием в обратной транскриптазе мутаций S68G,K7OТ, V75I, F77L, F116Y и Q151M. Изолят ВИЧ-1/L6S/PMEA выделяли из клинического изолята ВИЧ 1/L6S после культивирования вируса с помощью 11 пассажей в присутствии возрастающих концентраций РМЕА (адефовира). В результате кроме упомянутых мутаций получают характерную для РМЕА мутацию K65R в обратной транскриптазе. Радиоактивные реагенты.[Метил-3 Н]тимидин (удельная радиоактивность 42 Ки/ммоль), [5-3H]уридин (удельная радиоактивность 26 Ки/ммоль) и [4,5-3H]лейцин (удельная радиоактивность 52 Ки/ммоль) получают на фирме Amersham Pharmacia Biotech (Buckingamshire, Великобритания). Соединения. В данном исследовании используют следующие соединения: 1. 2,4-диамино-6-[2-(фосфонометокси)этокси]пиримидин,- 27006020 2. 2,4-диамино-6-[2-(фосфонометокси)этил]сульфанилпиримидин,3. 4-амино-6-[2-(фосфонометокси)этокси]пиримидин,4. 2-амино-4-гидрокси-6-[2-(фосфонометокси)этокси]пиримидин,5. 2-амино-4-гидрокси-6-[2-(фосфонометокси)этил]сульфанилпиримидин,6. 2-амино-4-диметиламино-6-[2-(фосфонометокси)этокси]пиримидин,7. 2-амино-4-циклопропиламино-6-[2-(фосфонометокси)этокси]пиримидин,8. 4-амино-2-метилсульфанил-6-[2-(фосфонометокси)этокси]пиримидин,9. 2-амино-4-метил-6-[2-(фосфонометокси)этокси]пиримидин,10. 2,4-диамино-6-(S)-[2-(фосфонометокси)пропокси]пиримидин,11. 2,4-диамино-6-(R)-[2-(фосфонометокси)пропокси]пиримидин,РМЕА, 9-[(2-фосфонометокси)этил]аденин,(R)-PMPA, (R)-9-[(2-фосфонометокси)пропил]аденин. Определение антивирусной активности in vitro. Антивирусную активность в отношении цитопатогенности, индуцированной ВИЧ-1 и ВИЧ-2, определяют в клеточных культурах МТ-4 на 5-й день после инфицирования с использованием детектирования живых клеток проявлением трипановым голубым или в клеточных культурах СЕМ на 4-й или 5-й день после инфицирования с помощью исследования индуцированного вирусом образования гигантоцитов методом микроскопии. В клеточные культуры добавляют ВИЧ-1 и ВИЧ-2 в дозе 100 CCID50. Мононуклеары из периферической крови (РВМС) выделяют из крови здоровых доноров центрифугированием в градиенте плотности (фирмы Lymphoprep, Nycomed Pharma, AS Diagnostics, Осло, Норвегия) и стимулируют фитогемагглютинином (РНА) (фирмы Sigma Chemical Co., Bornem, Бельгия) в течение 3 сут. Активированные клетки (стимулированные РНА бластные клетки) промывают фосфатносолевым буферным раствором (ФСБ) и инфицируют вирусом, как описано в методике для групповых клинических испытаний СПИД (AIDS). Краткое описание методики: клетки РВМС добавляют в лунки планшет (2105/200 в лунку) в присутствии серийных разведений исследуемого соединения и инфицируют исходным штаммом ВИЧ в дозе 1000 CCID50 в мл. На 4-й день после инфицирования 125 мкл супернатанта инцицированной культуры удаляют и заменяют на 150 мкл свежей среды, содержащей исследуемые соединения в соответствующей концентрации. На 7-й день после добавления клеток в планшет в супернатанте культуральных клеток определяют содержание антигена р 24 с помощью иммуноферментного анализа (фирмы NEN, Париж, Франция). Первичные макрофаги человека (М/М) выделяют и очищают по следующей методике. РВМС получали от здоровых, неинцицированных ВИЧ-1 доноров, выделяли с помощью центрифугирования в градиенте фикола и высеивали в 48-луночных планшетах в концентрации по 1,8106 клеток в лунке в 1 мл среды RPMI 1640, содержащей 20% инактивированной нагреванием бычьей фетальной сыворотки, несодержащей эндотоксин и микоплазму (фирмы Hyclone Laboratories, Inc., Logan, UT), 4 мМ L-глютамина(далее названная полной средой). Через пять дней после добавления клеток в планшет и культивирования РВМС при 37 С во влажной атмосфере, обогащенной 5% CO2, адгезионные клетки осторожно удаляют повторной промывкой теплой средой RPMI-1640, оставляя в лунках монослой адгезионных клеток,который затем инкубируют в полной среде. Как показано ранее методом цитофлуориметрического анализа, клетки, обработанные в указанных условиях, представляют собой 97% макрофагов М/М. Макрофаги обрабатывают соединениями в течение 30 мин, затем инфицируют вирусом ВИЧ-1Bal, в концентрации 300 TCID50/мл. Через 2 ч после инфицирования вирусом М/М промывают для удаления вирусного инокулята, при необходимости заменяют полную среду, содержащую соответствующую концентрацию соединения, и затем М/М культивируют для продолжения эксперимента. Каждую концентрацию соединения испытывают в трех повторных опытах, а положительные контрольные образцы в шести повторных опытах. Соединения заменяют каждый раз при замене среды. Супернатанты собирают на 14-й день после инфицирования и определяют продуцирование вируса с помощью анализа антигена ВИЧ-1-р 24. Для анализа антивирусной активности в отношении ретровируса FIV, 105 клеток CrFK культивируют в 24-луночных планшетах для культивирования клеток. Клетки культивируют в 2 мл культуральной среды на лунку, содержащей 2,5% фетальной сыворотки теленка в присутствии различных концентраций лекарственных средств. Анализ каждого образца повторят три раза. Через 1 ч инкубирования при 37 С клетки инфицируют вирусом FIV. Клетки инкубируют в присутствии вируса в течение 1 сут., затем среду удаляют и добавляют новую порцию среды, содержащую соответствующую концентрацию лекарственного средства. Через 6 сут. присутствие антигена FIV р 24 определяют с использованием анализа связывания антигена. Ингибирующее действие исследуемых соединений на индуцированную вирусом MSV трансплантацию культуральных клеток эмбриональных фибробластов мыши С 3H/3 Т 3 определяли методом микроскопии на 6-й день после инфицирования. Вирус MSV добавляют в клеточные культуры в количестве 75 бляшкообразующих единиц. Методики для определения антиретровирусной активности подробно опи- 28006020 сано ранее (Balzarini et al., AIDS 5:21-28, 1991; Balzarini et al., Antimicrob. Agents Chemother. 37:332-338,1993; De Clercq et al., Proc. Soc. Exp. Biol. Med. 137:590-594, 1971). Определение антивирусной активности in vivo в отношении вируса MSV. Ингибирующее действие соединений на инициирование образования индуцированной вирусом MSV опухоли и на выживание инфицированных вирусом MSV мышей определяют, как описано ранее (Balzarini et al., Proc. Natl. Acad. Sci.USA 86:332-336, 1989; Balzarini et al., Proc. Natl. Acad. Sci. USA 88:4961-4965, 1991; Balzarini et al., Antimicrob. Agents Chemother. 37:332-338, 1993). Краткое описание анализа: 2- или 3-дневных мышей NMRI инфицировали MSV в левую заднюю ногу (подкожным способом) и лечили внутрибрюшинным введением однократной дозы исследуемого соединения за 4 ч до инфицирования вирусом (1-й день), затем вводили однократную дозу исследуемого соединения на 2-й, 3-й, 4-й и 5-й дни. Дозы лекарственных средств составляли 50, 20, 8, 4 и/или 2 мг/кг/сут. для тенофовира R)-PMPA, для адефовира (РМЕА), соединения 1 (PMEO-2,4-di-NH2-Pym), соединения 2 (PMES-2,4-di-NH2-Pym) и соединения 11 R)-PMPO-2,4-diNH2-Pym). Для самой высокой дозы исследуемого соединения токсичность не наблюдается. Появление и рост индуцированных MSV опухолей в участках инфицирования вирусом, а также выживание мышей в течение периода вплоть до 30 сут. после инфицирования регистрируют ежедневно. Цитостатическое и антиметаболитическое действие ациклических фосфонатов нуклеозидов in vitro. Определение ингибирования роста клеток СЕМ исследуемыми соединениями описано ранее (Balzarini etal., AIDS 5:21-28, 1991). 50% от величины цитостатической концентрации (СС 50) определяют как концентрацию соединения, при которой наблюдается снижение числа живых клеток на 50%. Для определения токсичности исследуемых соединений в отношении клеток МТ-4 5 х 104 клеток МТ-4, инкубируют в лунках 96-луночного микропланшета в присутствии или отсутствии различных концентраций исследуемых соединений в течение 5 сут. при 37 С. Величину СС 50 рассчитывают по числу живых клеток, которое определяют под микроскопом методом исключения с использованием проявления трипаном голубым. Включение [метил-3H]тимидина, [3H]уридина и [3H]лейцина в нерастворимую в метаноле фракцию клеток СЕМ также определяют в микропланшетах. В каждую лунку добавляют по 105 клеток СЕМ, 5,9 пмоль (0,25 мкКи) [метил-3H]тимидина, 38 пмоль (1,0 мкКи) [3H]уридина и 19 пмоль (1,0 мкКи) [4,53H]лейцина и определенное количество исследуемого соединения. Клетки пролиферируют в течение 20 ч при 37 С во влажной атмосфере, содержащей регулируемое количество СО 2. После завершения инкубационного периода содержимое лунок (200 мкл) наносят на стекловолоконные фильтры размером 25 мм(тип A/G, фирмы Gelman Instrument Co., Ann Arbor, MI), установленные в прибор для анализа проб фирмы Millipore. Фильтры дважды промывают холодным ФБР, дважды холодным 10%-ным раствором трихлоруксусной кислоты, дважды холодным 5%-ным раствором трихлоруксусной кислоты, один раз холодным этанолом и один раз холодным эфиром. Затем фильтры высушивают в течение 10 мин при 60 С и измеряют радиоактивность в сцинтилляционной жидкости на основе толуола. Антивирусная активность ациклических аналогов фосфонатов пиримидина в отношении ВИЧ-1 с использованием клеточных культур СЕМ Необходимым условием для проявления антиретровирусной активности является наличие аминогруппы в положении С-2 пиримидинового кольца с одновременным наличием аминогруппы в положении С-4 (то есть соединения 1,2, 11) или гидроксильной группы в положении С-4 (т.е. соединение 4) (табл. 1b). Указанные замещенные пиримидины РМЕО и РМРО обладают анти-ВИЧ-активностью, причем величины ЕС 50 составляют диапазон от 0,80 до 2,0 мкг/мл. Отсутствие аминогруппы в положении С-2 (т.е. соединение 3 или 8) или наличие диметиламино-, или метил-, или циклопропиламиногруппы в положении С-4 (т.е. соединения 6, 9 и 7 соответственно) приводит к полному отсутствию антиретровирусной активности (табл. 1b). Производные тиоэфиров, как правило, характеризуются снижением активности от 5 до 10 раз по сравнению с соответствующими эфирными производными (например, сравни соединение 2 с соединением 1) или активность полностью отсутствует (т.е. соединение 5). Интересно отметить, что антиретровирусная активность новых новых ациклических фосфонатов пиримидина характеризуется значительной энантиоспецифичностью при их действии на вирус ВИЧ-1. (R)-6-PMPO производное пиримидина 11 проявляет значительно более высокую ингибирующую активность в отношении указанных вирусов по сравнению с соответствующим (S)-6-РМРО производным пиримидина 10 (табл. 1b). Остаточную антивирусную активность, определенную для (S)-энантиомера, можно объяснить за счет примеси(R)-энантиомера, наличие которой связано с исходным хиральным материалом (1-2%). Большинство соединений характеризуются низкой цитотоксичностью или полным ее отсутствием при концентрации 100 мкг/мл за исключением соединения 4 (CC50 составляет 2,5 мкг/мл для клеток СЕМ). Производное 6-РМЕО-2,4-сП-NН 2-пиримидина (соединение 1), обладающее самой высокой антивирусной активностью, характеризуется величиной CC50 11 мкг/мл для клеток СЕМ, в то время как соответствующий тиоэфирный аналог 2 и производное (R)-6-РМРО-2,4-di-NН 2-пиримидина 11 характеризуются величинами СС 50 приблизительно 60 мкг/мл (табл. 1b). Интересно отметить, что 5 бромпроизводное 1 активно в отношении ВИЧ-1 в культуре клеток СЕМ при концентрации 2,5 мкг/мл и не токсично при концентрации 100 мкг/мл. Ни одно из соединений 1, 2 или 11 не ингибируют включение[3H]dThd, [3H]Urd и [3H]leu в нерастворимый в трихлоруксусной кислоте материал из клеток СЕМ при- 29006020 инкубации в течение 12 ч при концентрации 200 мкг/мл. Производные РМЕА и (R)-PMPA при той же концентрации также не ингибируют макромолекулярный синтез (данные не показаны). Антиретровирусная активность ациклических аналогов фосфонатов пиримидинов в различных системах вирус/клетки Ингибирующую активность производных 6-РМЕО 1 и 4, 6-РМЕ тиоэфира (6-PMES) 2 и производного (R)-6-PMPO 11 определяли in vitro с использованием нескольких моделей ретровируса (табл. 2). Как правило, антивирусная активность исследуемых соединений, определенная для вирусов ВИЧ-1(IIIB) в культурах клеток СЕМ (табл. 1b), очень близка по величине антивирусной активности, определенной дляBИЧ-2(ROD) в клетках СЕМ, для вирусов ВИЧ-1 и ВИЧ-2 в культурах клеток МТ-4 и для вирусов FIV в клетках почек семейства кошачьих Crandell. Таким образом, соединение 1 характеризуется величинойEC50 для вируса ВИЧ в диапазоне от 0,29 до 0,80 мкг/мл, а соединение 11 в диапазоне от 1,3 до 3,0 мкг/мл. Эти величины близки к наблюдаемым для контрольных соединений РМЕА (адефовир) (EC50 0,96-2,0 мкг/мл) и (R)-6-РМРА (тенофовир) (EC50 0,35-0,52 мкг/мл). Если производные 6-РМЕО и 6-(R)РМРО испытывают в отношении ВИЧ-1 в первичных клетках (ВИЧ-1(IIIB) в PBL и ВИЧ-1 (Ba-L) в системе моноциты/макрофаги (М/М, то антиретровирусная активность проявляется еще сильнее. Действительно, соединения 1 и 11 ингибируют вирус в PBL при величине ЕС 50 0,07 и 0,12 мкг/мл соответственно по сравнению с величинами 1,9 и 0,33 мкг/мл для контрольных соединений РМЕА и (R)-PMPA. Производные 6-РМЕО и (R)-6-PMPO проявляют еще более высокую ингибирующую активность в отношении ВИЧ-1 (Ba-L) в системе М/М по сравнению с наблюдаемой активностью для РМЕА и (R)-PMPA. Как правило, соединения являются менее токсичными в системе МТ-4 по сравнению с клетками СЕМ и не токсичны при концентрации 100 мкг/мл в системе М/М. В связи с тем, что ранее была обнаружена повышенная ингибирующая активность соединений РМЕА и (R)-PMPA в отношении мышиного вируса саркомы Молони (MSV) в клеточных культурах и у новорожденных мышей, новые производные 6-РМЕО и (R)-6-PMPO были также исследованы для определения активности in vitro в отношении вируса MSV. Соединения 1,11 и 4 проявляют высокую ингибирующую активность в отношении индуцированной MSV трансформации клеток С 3H. Величины EC50 равны менее 0,05-0,15 мкг/мл (табл. 2). Действие природных нуклеозидов и нуклеиновых оснований на анти-ВИЧ активность ациклических аналогов фосфонатов пиримидинов в клеточных культурах Известно, что на анти-ВИЧ активность аналогов пиримидиновых нуклеозидов, таких как 3'-азидо 3'-дезокситимидин (AZT, зидовудин) и 2',3'-дидезоксицитидин (ddC, зальцитабин), можно влиять (то есть снизить) в присутствии природных нуклеозидов, таких как dThd и dCyd (Balzarini et al., Textbook of AIDSand Wilkins, Baltimore, Maryland, стр.751-772, 1994; Balzarini et al., Antimicrob.Agents Chemother. 37:332338, 1993). Следовательно, для определения влияния природных нуклеозидов и нуклеиновых оснований на анти-ВИЧ активность новых производных пиримидина 6-РМЕО и (R)-6-PMPO было исследовано действие субтоксичных концентраций пиримидиновых нуклеозидов тимидина (dThd) и 2'-дезоксицитидина(dCyd), пуриновых нуклеозидов аденозина (Ado) и гуанозина (Quo), а также нуклеинового основания аденина (Ade) (табл. 3). Ни один из исследованных природных нуклеозидов и нуклеиновых оснований не оказывал заметного влияния на анти-ВИЧ активность исследованных соединений в клеточных культурах СЕМ. Во всех случаях антиретровирусная активность соединений полностью сохраняется, как и в случае контрольных соединений РМЕА, (R)-PMPA и PMEG (табл. 3). Эффективность ациклических аналогов фосфонатов пиримидиновых нуклеозидов в отношении индуцированного вирусом MSV образования опухоли у новорожденных мышей NMRI Данные по ингибирующему действию производных 6-РМЕО 1, его тиоэфирного аналога 2 и производного (R)-6-PMPO 11 на индуцированное вирусом MSV образование опухоли или связанные с этим летальные исходы у новорожденных мышей NMRI приведены в табл. 4. В качестве контрольных соединений были использованы РМЕА (адефовир) и (R)-PMPA (тенофовир). Показано, что среди новых производных 6-РМЕО и (R)-6-PMPO, соединение 1 является наиболее эффективным для предотвращения индуцированного вирусом MSV образования опухоли и связанных с этим летальных исходов у новорожденных мышей MNRI (табл. 4). По крайней мере 80% мышей были защищены от образования опухоли при введении дозы 50 и 20 мг/кг, а остальные мыши с развитой опухолью выживали в течение более 30 сут. после инфицирования. Соединение 1 в дозе менее 2 мг/кг еще предотвращает образование опухоли у 5% мышей, при этом наблюдается 15% мышей с длительным выживанием. Соединение 1 проявляет способность предотвращения образования опухоли и связанных с этим летальных исходов у животных, сопоставимую с активностью РМЕА и (R)-PMPA (табл. 4). И наоборот, соответствующее тиоэфирное производное 2 не проявляет способность к предотвращению образования опухоли во всех исследованных дозах, при этом наблюдается 20% мышей с длительным выживанием в дозе 8-50 мг/кг. Способность производного (R)-6-PMPO 11 к предотвращению образования опухоли и связанных с этим летальных исходов по величине занимает среднее положение между величинами, определенными для соединений 1 и 2. Все лекарственные средства замедляют индуцированное вирусом MSV образование опухоли по дозозависимому механизму. Соединение 1 проявляет ингибирующее действие, сопоставимое с действием (R)- 30
МПК / Метки
МПК: A61K 31/675, C07F 9/6512
Метки: антивирусной, лечения, инфекции, производные, вирусной, активностью, варианты, обладающие, 6-[2-(фосфонометокси)алкокси]пиримидинов, получения, способ
Код ссылки
<a href="https://eas.patents.su/30-6020-proizvodnye-6-2-fosfonometoksialkoksipirimidinov-obladayushhie-antivirusnojj-aktivnostyu-sposob-ih-polucheniya-varianty-i-sposob-lecheniya-virusnojj-infekcii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6-[2-(фосфонометокси)алкокси]пиримидинов, обладающие антивирусной активностью, способ их получения (варианты) и способ лечения вирусной инфекции</a>
Предыдущий патент: Производные 1-фенилсульфонил-1, 3-дигидро-2н-индол-2-она, их получение и их терапевтическое применение
Случайный патент: Кабель и способ его получения












