Соединения-ингибиторы липазы поджелудочной железы, их синтез и применение
Формула / Реферат
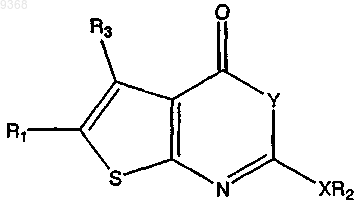
1. Соединение, имеющее следующую структуру:
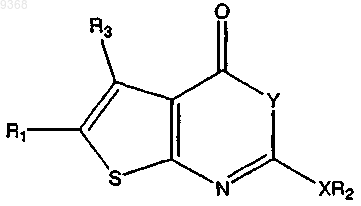
где X представляет собой О, S или СН2;
Y представляет собой О;
R1 представляет собой Н, замещенный C1-C15алкил, незамещенный С2-С15алкил С1-С8алкиларил, -C(O)OR4, -C(O)NR4R5, -CR6R6'OR4, -CR6R6'OC(O)R4, -CR6R6'OC(O)NHR7, -С(О)NR8R9NR8R9, -N(R5)С(О)NHR5 или CH2R4;
R2 представляет собой замещенный или незамещенный неразветвленный C1-C30алкил или разветвленный С3-С30алкил, арил, алкиларил, арилалкил, гетероарилалкил или циклоалкил; и
R3 представляет собой Н, -CH3, -СН3ОСН3 или C3-C10циклоалкил, где
R4 представляет собой Н или замещенный или незамещенный неразветвленный или разветвленный C6-C30алкил, арил, -CH2арил, арил-С1-С30алкил, гетероарил-С1-С30алкил или С3-С10циклоалкил;
R5 представляет собой Н или замещенный или незамещенный неразветвленный или разветвленный С6-С30алкил, арил C1-C30алкил, гетероарилалкил или циклоалкил;
каждый из R6 и R6' независимо представляет собой Н, замененный или незамещенный C1-C6алкил, C1-C6диалкил или C3-C10циклоалкил или вместе образуют 3-7-членную циклоалкильную или арильную группу;
R7 представляет собой Н, или замещенный или незамещенный С1-С12алкил, или C3-C10циклоалкил; и
каждый из R8 и R9 независимо представляет собой Н, замещенный или незамещенный C1-C6алкил, C1-C6алкокси, C1-C6алкиларил, или NR8R9 вместе образуют замещенное пиперазиновое или пиперидиновое кольцо или систему дигидро-1Н-изохинолиновых колец, где арил представляет собой бензол, пиррол, фуран, тиофен, имидазол, бензоксазол, бензотиазол, триазол, тетразол, пиразол, пиридин, пиразин, пиридазин, пиримидин, нафтил, хинолил или индолил, где любой заместитель, если присутствует, представляет собой галоген, гидроксил, прямой (C1-30)алкил, разветвленный (С3-30)алкил, (С3-10)циклоалкил, прямой (C1-30)алкилкарбонилокси, разветвленный (C3-30)алкилкарбонилокси, арилкарбонилокси, прямой (C1-30)алкоксикарбонилокси, разветвленный (C3-30)алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, прямой (C1-30)алкилкарбонил, разветвленный (C3-30)алкилкарбонил, прямой (C1-30)алкоксикарбонил, разветвленный (C3-30)алкоксикарбонил, аминокарбонил, прямой (C1-30)алкилтиокарбонил, разветвленный (C3-30)алкилтиокарбонил, прямой (C1-30)алкоксил, разветвленный (C1-30)алкоксил, фосфат, фосфанат, циано, амино, прямой (C1-30)алкиламино, разветвленный (С3-30)алкиламино, прямой (C1-30)диалкиламино, разветвленный (C1-30)диалкиламино, ариламино, диариламино, прямой (C1-30)алкилариламино, разветвленный (C3-30)алкилариламино, прямой (C1-30)алкилкарбониламино, разветвленный (C3-30)алкилкарбониламино, арилкарбониламино, карбамоил, уреидо, амидино, имино, сульфгидрил, прямой (C1-30)алкилтио, разветвленный (C3-30)алкилтио, арилтио, тиокарбоксилат, сульфат, сульфонат, сульфонамидо, нитро, трифторметил, азидо, 4-10-членный гетероциклил, прямой (C1-30)алкиларил, разветвленный (C3-30)алкиларил, бензо (1,3)диоксол или ароматическая или 5-6 членная гетероароматическая группа, причем заместитель может быть дополнительно замещен любым вышеупомянутым заместителем;
или его отдельный энантиомер, или отдельный таутомер, или его фармацевтически приемлемая соль.
2. Соединение по п.1, имеющее следующую структуру:
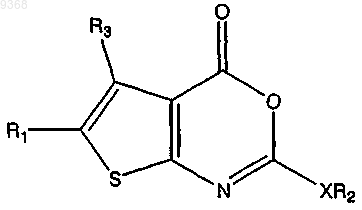
где X представляет собой О или S;
R1 представляет собой Н, -C(O)OR4, -C(O)NR4R5, -CR6R6'OR4, -CR6R6'OC(O)R4, -CR6R6'OC(O)NHR7 или CH2R4;
R2 представляет собой замещенный или незамещенный, неразветвленный или разветвленный С6-С30алкил, арилалкил, гетероарилалкил или циклоалкил; и
R3 представляет собой Н, -CH3, -СН3ОСН3 или C3-C10циклоалкил, где
R4 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленный C6-C30алкил, арилалкил, гетероарилалкил или циклоалкил;
R5 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленный C6-C30алкил, арилалкил, гетероарилалкил или циклоалкил;
каждый из R6 и R6' независимо представляет собой Н, замещенный или незамещенный C1-C6алкил, C1-C6диалкил или С3-С10циклоалкил или вместе образуют 3-7-членную циклоалкильную или арильную группу; и
R7 представляет собой Н или замещенный или незамещенный С1-С12алкил или циклоалкил;
где арил представляет собой бензол, пиррол, фуран, тиофен, имидазол, бензоксазол, бензотиазол, триазол, тетразол, пиразол, пиридин, пиразин, пиридазин, пиримидин, нафтил, хинолил или индолил, где любой заместитель, если присутствует, представляет собой галоген, гидроксил, прямой (C1-30)алкил, разветвленный (C3-30)алкил, (С3-30)циклоалкил, прямой (C1-30)алкилкарбонилокси, разветвленный (C3-30)алкилкарбонилокси, арилкарбонилокси, прямой (C1-30)алкоксикарбонилокси, разветвленный (C3-30)алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, прямой (C1-30)алкилкарбонил, разветвленный (C3-30)алкилкарбонил, прямой (C1-30)алкоксикарбонил, разветвленный (C3-30)алкоксикарбонил, аминокарбонил, прямой
(C1-30)алкилтиокарбонил, разветвленный (C3-30)алкилтиокарбонил, прямой (C1-30)алкоксил, разветвленный (C1-30)алкоксил, фосфат, фосфанат, циано, амино, прямой (C1-30)алкиламино, разветвленный (С3-30)алкиламино, прямой
(C1-30)диалкиламино, разветвленный (C1-30)диалкиламино, ариламино, диариламино, прямой (C1-30)алкилариламино, разветвленный (C3-30)алкилариламино, прямой (C1-30)алкилкарбониламино, разветвленный (C3-30)алкилкарбониламино, арилкарбониламино, карбамоил, уреидо, амидино, имино, сульфгидрил, прямой (C1-30)алкилтио, разветвленный (C3-30)алкилтио, арилтио, тиокарбоксилат, сульфат, сульфонат, сульфонамидо, нитро, трифторметил, азидо, 4-10-членный гетероциклил, прямой (C1-30)алкиларил, разветвленный (C3-30)алкиларил, бензо (1,3)диоксол или ароматическая или 5-6-членная гетероароматическая группа, причем заместитель может быть дополнительно замещен любым вышеупомянутым заместителем.
3. Соединение по п.2, имеющее следующую структуру:
X представляет собой О;
R1 представляет собой -С(О)О-(С6-С30)алкшы, -С(O)NH-(С6-С30)алкил или -С(О)ОСН2(С6Н5);
R2 представляет собой С6-С30алкил; и
R3 представляет собой -СН3, -СН3ОСН3.
4. Соединение по п.2, где R3 представляет собой Н или CH3.
5. Соединение по п.3, где X представляет собой О.
6. Соединение по п.5, где R3 представляет собой метил.
7. Соединение по п.1, имеющее следующую структуру:
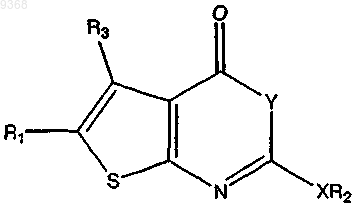
где Y представляет собой О;
R1 представляет собой Н, -(CH2)rCH3, -СН(СН3)2, -СН(СН3)СН2С(СН3)3, -CH(СН3)(СН2)3С(=СН2)СН3,
-СН(CH3)(СН2)3С(СН3)2ОС(O)CH3, -СН(СН3)[СН2]3С(СН3)2ОСН3, -CHS(C6H5), -С(О)ОН, -C(O)NH(CH2)tCH3,
-C(O)O(CH2)uCH3, -С(O)ОСН[(СН2)3СН3]2, -C(O)NH(CH2)vCH3, -C(O)N(CH3)2, -C(O)NHCH2(C6H5),
-C(O)NHCH2(C5H4N), -С(О)N[(СН2)3СН3]2, -C(O)N[(CH2)5CH3]2, -C(O)N[(CH2)7CH3]2, -С(О)NH(С6Н11),
-С(О)(NC4H8N)СН2(С6Н5), -С(О)(NC5H9)CH2(С6Н5), -С(О)(NH(СН2)3O(С6Н5), -С(О)NHCH[(СН2)3СН3]2,
-С(О)NH(CH2)3N(CH3)2, -С(О)NHCH2C(О)ОСН2(С6Н5), -С(О)N(СН3)СН2(C5H3N[СН3]),
-C(O)NH(CH2)2(C5H4N), -C(O)N(CH2CH3)(CH2)2(C5H4N), -C(O)NHCH2(C4H3O), -С(О)(NC4H8N)[CH2]2(NC5H10),
-С(О)NHCH2CH(CH3)2, -С(О)NHCH2(C5H4N), -С(О)NHCH2C(CH3)3, -С(О)(NC4H8N)CH2C(O)NHCH(CH3)2,
-С(O)(NC9H8)[OCH3]2, -С(O)NHCH2(C6H3[OCH3]2), -C(O)NHCH2(C7H5O2), -C(O)NH(CH2)2O(C6H5),
-C(O)NH(CH2)2OCH3, -C(O)NH(CH2)3OCH3, -С(О)NH(CH2)4(C6H5) или -С(O)NH(СН2)3(С6Н5);
r представляет собой целое число от 1 до 15;
s представляет собой целое число от 0 до 6;
t представляет собой целое число от 0 до 6;
u представляет собой целое число от 3 до 8;
v представляет собой целое число от 5 до 15;
XR2 представляет собой -(CH2)nCH3, -O(CH2)mCH3, -ОСН(СН3)2, -ОСН(CH3)(СН2)5СН3,
-ОСН2СН(СН3)2, -O(СН2)2ОСН3, -O(СН2)2ОСН2(С6Н5), -O(СН2)р(С6Н5), -ОСН2(С6Н4[(СН2)3СН3]),
-O(С6Н4[(СН2)3СН3]), -O(СН2)2(С6Н4[СН3]), -O(СН2)3ОСН2(С6Н5), -O(СН2)4ОСН2(С6Н5);
n представляет собой целое число от 6 до 15;
m представляет собой целое число от 1 до 15;
р представляет собой целое число от 0 до 6; и
R3 представляет собой Н, -СН3 или -CH2OCH3.
8. Соединение по п.7, имеющее следующую структуру:
где Y представляет собой О;
R1 представляет собой Н, -(СН2)3СН3, -(CH2)5CH3, -(СН2)6СН3, -(СН2)7СН3, -(СН2)9СН3, -(СН2)11СН3,
-СН(СН3)2, -СН(СН3)СН2С(CH3)3, -СН(СН3)(СН2)3С(=СН2)СН3, -СН(СН3)(СН2)3С(СН3)2ОС(О)СН3,
-СН(СН3)[СН2]3С(СН3)2ОСН3, -СН2(С6Н5), -(СН2)2(С6Н5), -(СН2)3(С6Н5), -(СН2)4(С6Н5), -(СН2)5(С6Н5), -С(О)ОН,
-C(O)NHCH3, -C(O)NHCH2CH3, -C(O)NH(CH2)3CH3, -C(O)OCH2(C6H5), -C(O)O(CH2)5CH3, -C(O)O(CH2)6CH3, C(O)O(CH2)7CH3, -C(O)OCH[(СН2)3СН3]2, -C(O)NH(CH2)5CH3, -C(O)NH(CH2)7CH3, -С(О)NH(СН2)9CH3,
-C(O)NH(CH2)11CH3, -C(O)NH(CH2)15CH3, -С(О)N(СН3)2, -C(C)NHCH2(C6H5), -C(O)NHCH2(C5H4N),
-С(О)N[(СН2)3СН3]2, -C(O)N[(CH2)5CH3]2, -C(O)N[(CH2)7CH3]2, -С(О)NH(С6Н11), -С(О)(NC4H8N)CH2(С6Н5),
-С(О)(NC5H9)CH2(С6Н5), -С(О)NH(СН2)3О(С6Н5), -С(О)NHCH[(СН2)3СН3]2, -С(О)NH(CH2)3N(CH3)2,
-С(О)NHCH2C(О)ОСН2(С6Н5), -С(О)N(СН3)СН2(C5H3N[СН3]), -C(O)NH(CH2)2(C5H4N),
-C(O)N(CH2CH3)(CH2)2(C5H4N), -C(O)NHCH2(C4H3O), -С(О)(NC4H8N)[CH2]2(NC5H10), -С(О)NHCH2CH(CH3)2,
-С(О)NHCH2(C5H4N), -С(О)NHCH2C(CH3)3, -С(О)(NC4H8N)CH2C(O)NHCH(CH3)2, -С(O)(NC9H8)[OCH3]2,
-C(O)NHCH2(C6H3[OCH3]2), -C(O)NHCH2(C7H5O2), -С(О)NH(CH2)2O(C6H5), -C(O)NH(CH2)2OCH3,
-C(O)NH(CH2)3OCH3, -С(О)NH(CH2)4(С6Н5) или -C(O)NH(CH2)3(C6H5);
XR2 представляет собой -(СН2)6СН3, -(СН2)10СН3, -(CH2)14CH3, -O(СН2)3СН3, -O(СН2)5СН3,
-O(СН2)6СН3, -O(СН2)7СН3, -O(СН2)9СН3, -O(СН2)11СН3, -O(СН2)15СН3, -OCH(СН3)2,
-ОСН(CH3)(СН2)5СН3, -ОСН2СН(СН3)2, -O(СН2)2ОСН3, -O(СН2)2ОСН2(С6Н5), -O(СН2)4(С6Н5),
-O(СН2)3(С6Н5), -O(СН2)2(С6Н5), -O(С6Н5), -ОСН2(С6Н5), -ОСН2(С6Н4[(СН2)3СН3]),
-О(С6Н4[(СН2)3СН3]), -O(СН2)2(С6Н4[СН3]), -O(СН2)3ОСН2(С6Н5), -O(СН2)4ОСН2(С6Н5) и
R3 представляет собой Н, -СН3 или -СН2ОСН3.
9. Соединение по п.1, где указанное соединение выбрано из группы, содержащей
6-гептил-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
6-гексил-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
2-октилокси-6-(1,3,3-триметилбутил)тиено[2,3-d][1,3]оксазин-4-он;
6-бутил-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
6-гептил-2-октиламинотиено[2,3-d][1,3]оксазин-4-он;
6-бутил-2-октиламинотиено[2,3-d][1,3]оксазин-4-он;
6-бензил-2-октиламинотиено[2,3-d][1,3]оксазин-4-он;
6-гептил-2-ундецилтиено[2,3-d][1,3]оксазин-4-он;
6-(5-метокси-1,5-диметилгексил)-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
6-(1,5-диметилгекс-4-енил)-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
6-(1,5-диметилгекс-5-енил)-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
1,1-диметил-5-(2-октилокси-4-оксо-4Н-тиено[2,3-d][1,3]оксазин-6-ил)гексиловый эфир трифторуксусной кислоты;
2-(2-бензилоксиэтокси)-6-децилтиено[2,3-d][1,3]оксазин-4-он;
6-гептил-5-метил-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
6-метил-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
2-октилокси-6-фенэтилтиено[2,3-d][1,3]оксазин-4-он;
2-октилокси-6-(3-фенилпропил)тиено[2,3-d][1,3]оксазин-4-он;
2-октилокси-6-(4-фенилбутил)тиено[2,3-d][1,3]оксазин-4-он;
2-октилокси-6-(5-фенилпентил)тиено[2,3-d][1,3]оксазин-4-он;
6-децил-2-(2-метоксиэтокси)тиено[2,3-d][1,3]оксазин-4-он;
2-(4-бутилфенокси)-6-децилтиено[2,3-d][1,3]оксазин-4-он;
2-(3-бензилоксипропокси)-6-децилтиено[2,3-d][1,3]оксазин-4-он;
2-(3-бензилоксибутилокси)-6-децилтиено[2,3-d][1,3]оксазин-4-он;
6-изопропил-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
6-октил-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
6-додецил-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
2-бензилокси-6-децилтиено[2,3-d][1,3]оксазин-4-он;
2-(4-бутилбензилокси)-6-децилтиено[2,3-d][1,3]оксазин-4-он;
6-децил-2-(2-п-толилэтокси)тиено[2,3-d][1,3]оксазин-4-он;
6-децил-2-фенэтилокситиено[2,3-d][1,3]оксазин-4-он;
6-бензил-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
6-децил-2-октилокситиено[2,3-d][1,3]оксазин-4-он;
6-децил-2-(1-метилгептилокси)тиено[2,3-d][1,3]оксазин-4-он;
6-гептил-2-(1-метилгептилокси)тиено[2,3-d][1,3]оксазин-4-он;
6-децил-2-(4-фенилпропокси)тиено[2,3-d][1,3]оксазин-4-он и
6-децил-2-(4-фенилбутокси)тиено[2,3-d][1,3]оксазин-4-он.
10. Фармацевтическая композиция для лечения ожирения, содержащая соединение по любому из пп.1, 2, или 8 и фармацевтически приемлемый носитель.
11. Фармацевтическая композиция для лечения диабета, содержащая соединение по любому из пп.1, 2, 7 или 8 и фармацевтически приемлемый носитель.
12. Фармацевтическая композиция по п.10 или 11, предназначенная для перорального, местного, парентерального или назального введения.
13. Способ получения фармацевтической композиции, предусматривающий смешивание соединения по любому из пп.1, 2, 3, 7 или 8 с фармацевтически приемлемым носителем.
14. Изделие, содержащее упаковочный материал; фармацевтическую композицию по п.10 или 11; и инструкции по применению фармацевтической композиции для лечения ожирения.
15. Способ получения соединения, имеющего структуру
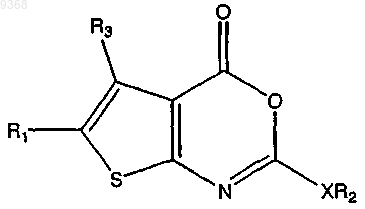
где X представляет собой О или CH2;
R1 представляет собой Н, замещенный С1-С15алкил, незамещенный С2-С15алкил С1-С8алкиларил,
-C(O)OR4, -C(O)NR4R5, -CR6R6'OR4, -CR6R6'OC(O)R4, -CR6R6'OC(O)NHR7, -C(O)NR8R9, -C(O)NR8R9NR8R9, -N(R5)C(O)NHR5 или CH2R4;
R2 представляет собой замещенный или незамещенный, неразветвленный C1-C30алкил или разветвленный С3-С30алкил, арил, алкиларил, арилалкил, гетероарилалкил или циклоалкил;
R3 представляет собой Н или замещенный или незамещенный C1-С6алкил или циклоалкил;
R4 представляет собой Н, -CH3, -СН2ОСН3 или циклоалкил;
R5 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленный С6-С30алкил, арилалкил, гетероарилалкил или циклоалкил;
каждый из R6 и R6' независимо представляет собой Н, замещенный или незамещенный C1-C6алкил, C1-C6диалкил или циклоалкил, или вместе они образуют 3-7-членную циклоалкильную или арильную группу;
R7 представляет собой Н или замещенный или незамещенный С1-С12алкил или циклоалкил;
каждый из R8 и R9 независимо представляет собой Н, замещенный или незамещенный C1-C6алкил, C1-C6алкокси, C1-C6алкиларил, или NR8R9 вместе образуют замещенное пиперазиновое или пиперидиновое кольцо или систему дигидро-1Н-изохинолиновых колец, где любой заместитель, если присутствует, представляет собой галоген, гидроксил, прямой(C1-30)алкил, разветвленный(C3-30)алкил, (С3-10)циклоалкил, прямой(C1-30)алкилкарбонилокси, разветвленный(C3-30)алкилкарбонилокси, арилкарбонилокси, прямой (C1-30)алкоксикарбонилокси, разветвленный(С3-30)алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, прямой(C1-30)алкилкарбонил, разветвленный(C3-30)алкилкарбонил, прямой(C1-30)алкоксикарбонил, разветвленный(C3-30)алкоксикарбонил, аминокарбонил, прямой(C1-30)алкилтиокарбонил, разветвленный(C3-30)алкилтиокарбонил, прямой(C1-30)алкоксил, разветвленный(C1-30)алкоксил, фосфат, фосфанат, циано, амино, пряьющ (C1-30)алкиламино, разветвленный (С3-30)алкиламино, прямой(C1-30)диалкиламино, разветвленный(C1-30)диалкиламино, ариламино, диариламино, прямой (C1-30)алкилариламино, разветвленный(C3-30)алкилариламино, прямой(C1-30)алкилкарбониламино, разветвленный(C3-30)алкилкарбониламино, арилкарбониламино, карбамоил, уреидо, амидино, имино, сульфгидрил, прямой
(C1-30)алкилтио, разветвленный(C3-30)алкилтио, арилтио, тиокарбоксилат, сульфат, сульфонат, сульфонамидо, нитро, трифторметил, азидо, 4-10-членный гетероциклил, прямой(C1-30)алкиларил, разветвленный(C3-30)алкиларил, бензо(1,3)диоксол или ароматическая или 5-6-членная гетероароматическая группа, причем заместитель может быть дополнительно замещен любым вышеупомянутым заместителем, предусматривающий
(а) взаимодействие
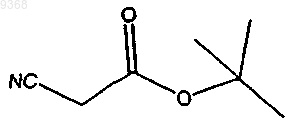
и
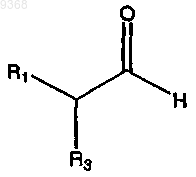
в присутствии серы, основания и растворителя с получением

(b) взаимодействие продукта стадии (а) с
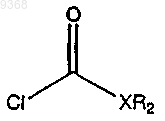
в присутствии основания с получением
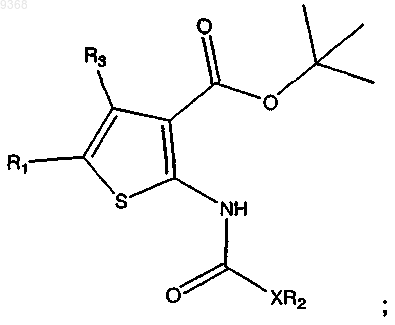
(с) взаимодействие продукта стадии (b) с трифторуксусной кислотой (ТФУ) в присутствии растворителя с получением
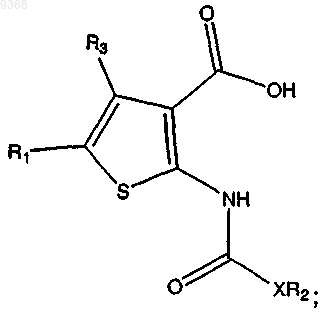
(d) взаимодействие продукта стадии (с) с SOCl2 в присутствии растворителя с получением соединения.
16. Способ по п.15, где основание на стадии (а) представляет собой триэтиламин, а растворитель представляет собой диметилформамид.
17. Способ по п.16, где растворитель на стадии (с) представляет собой дихлорметан.
18. Способ по п.17, где растворитель на стадии (d)представляет собой пиридин CH2Cl2.
19. Применение соединения по п.1 при получении лекарственного препарата для лечения ожирения у субъекта.
20. Применение соединения по п.1 при получении лекарственного препарата для лечения диабета у субъекта.
21. Применение соединения по п.1 при получении лекарственного препарата для ингибирования гидролитической активности липаз поджелудочной железы в клетке.
22. Соединение по п.1, где любое гетероциклическое или гетероарильное кольцо, если таковое присутствует, представляет собой пиперазиновое, пиперидиновое, (1,4)диазепановое, пиразиновое, пиридиновое, пирролидиновое, пиразоловое, пиримидиновое, тиофеновое, имидазоловое, азетидиновое, пирроловое, бензотиазоловое, бензодиоксолановое, дитиолановое, оксатииновое, имидазолидиновое, хинолиновое, изохинолиновое, дигидроизохинолиновое, индоловое, изоиндоловое, триазаспиро[4.5]декановое, морфолиновое, фурановое или анизотиазоловое кольцо.
23. Соединение, имеющее структуру
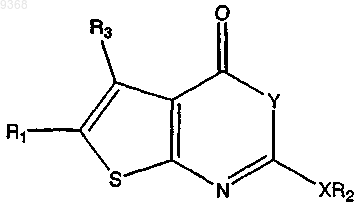
где Y - это О;
XR2 представляет собой -N([CH2]7CH3)C(O)NH(CH2)7CH3, -N([СН2]6СН3)С(О)NH(CH2)6CH3,
-NH(CH2)qCH3, -NH(C6H4)O(C6H5), -N(CH3)(CH2)5CH3, -NHCH[(CH2)3CH3]2, -NHCH(CH3)[CH2]5CH3 или
-N([CH2]7CH3)2;
q целое число от 6 до 15;
R1 представляет собой Н, замещенный C1-C15алкил, незамещенный С2-С15алкил С1-С8алкиларил,
-C(O)OR4, -C(O)NR4R5, -CR6R6'OR4, -CR6R6'OC(O)R4, -CR6R6'OC(O)NHR7, -С(O)NR8R9NR8R9,
-N(R5)С(О)NHR5 или CH2R4;
R3 представляет собой H, -CH3, -СН2ОСН3, С3-С10циклоалкил;
R4 представляет собой Н, или замещенный или незамещенный прямой или разветвленный С6-С30алкил, арил, -CH2-арил, арил-C1-С30алкил, гетероарил-С1-С30алкил или C3-C10 циклоалкил;
каждый из R6 и R6' независимо представляет собой Н, замещенный или незамещенный C1-C6алкил, C1-C6диалкил или C3-C10циклоалкил, или вместе они образуют 3-7-членную циклоалкильную или арильную группу;
R7 представляет собой Н или замещенный или незамещенный С1-С12алкил или C3-C10циклоалкил;
каждый из R8 и R9 независимо представляет собой Н, замещенный или незамещенный C1-C6алкил, C1-C6алкокси, С1-С6алкиларил, или NR8R9 вместе образуют замещенное пиперазиновое или пиперидиновое кольцо или систему дигидро-1Н-изохинолиновых колец, где арил представляет собой бензол, пиррол, фуран, тиофен, имидазол, бензоксазол, бензотиазол, триазол, тетразол, пиразол, пиридин, пиразин, пиридазин, пиримидин, нафтил, хинолил или индолил, где любой заместитель, если присутствует, представляет собой галоген, гидроксил, прямой(C1-30)алкил, разветвленный(C3-30)алкил, (С3-10)циклоалкил, прямой(C1-30)алкилкарбонилокси, разветвленный(С3-30)алкилкарбонилокси, арилкарбонилокси, прямой (C1-30)алкоксикарбонилокси, разветвленный(C3-30)алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, прямой(C1-30)алкилкарбонил, разветвленный(C3-30)алкилкарбонил, прямой(C1-30)алкоксикарбонил, разветвленный(C3-30)алкоксикарбонил, аминокарбонил, прямой(C1-30)алкилтиокарбонил, разветвленный(C3-30)алкилтиокарбонил, прямой(C1-30)алкоксил, разветвленный(C1-30)алкоксил, фосфат, фосфанат, циано, амино, прямой(C1-30)алкиламино, разветвленный(С3-30)алкиламино, прямой(C1-30)диалкиламино, разветвленный(C1-30)диалкиламино, ариламино, диариламино, прямой (C1-30)алкилариламино, разветвленный(C3-30)алкилариламино, прямой(C1-30)алкилкарбониламино, разветвленный(C3-30)алкилкарбониламино, арилкарбониламино, карбамоил, уреидо, амидино, имино, сульфгидрил, прямой(C1-30)алкилтио, разветвленный(C3-30)алкилтио, арилтио, тиокарбоксилат, сульфат, сульфонат, сульфонамидо, нитро, трифторметил, азидо, 4-10-членный гетероциклил, прямой(C1-30)алкиларил, разветвленный(C3-30)алкиларил, бензо(1,3)диоксол или ароматическая или 5-6-членная гетероароматическая группа, причем заместитель может быть дополнительно замещен любым вышеупомянутым заместителем
или его отдельный энантиомер, или отдельный таутомер, или его фармацевтически приемлемая соль.
24. Соединение по п.23, имеющее следующую структуру:
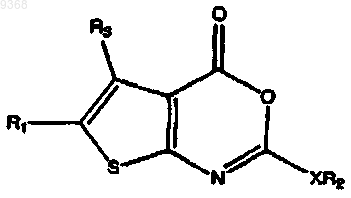
где R1 представляет собой Н, -(CH2)rCH3, -СН(CH3)2, -СН(СН3)СН2С(СН3)3,
-СН(СН3)(СН2)3С(=СН2)СН3, -СН(СН3)(СН2)3С(CH3)2ОС(О)СН3, -СН(СН3)[СН2]3С(СН3)2ОСН3,
-CHS(C6H5), -С(О)ОН, -C(O)NH(CH2)tCH3, -C(O)O(CH2)uCH3, -С(O)ОСН[(СН2)3СН3]2, -C(O)NH(CH2)vCH3, -С(О)N(СН3)2, -C(O)NHCH2(C6H5), -C(O)NHCH2(C5H4N), -С(О)N[(СН2)3СН3]2, -C(O)N[(CH2)5CH3]2,
-C(O)N[(СН2)7СН3]2, -С(О)NH(С6Н11), -С(С)(NC4H8N)CH2(С6Н5), -С(О)(NC5H9)CH2(С6Н5),
-С(O)(NH(CH2)3O(C6H5), -C(O)NHCH[(CH2)3CH3]2, -С(О)NH(СН2)3N(CH3)2, -C(O)NHCH2C(O)OCH2(C6H5),
-C(O)N(CH3)CH2(C5H3N[CH3]), -C(O)NH(CH2)3(C5H4N), -C(O)N(CH2CH3)(CH2)2(C5H4N),
-C(O)NHCH2(C4H3O), -C(O)(NC4H8N)[CH2]2(NC5H10), -C(O)NHCH2CH(CH3)2, -С(О)NHCH2(C5H4N),
-C(O)NHCH2C(CH3)3, -C(O)(NC4H8N)CH2C(O)NHCH(CH3)2, -C(O)(NC9H8)[OCH3]2,
-C(O)NHCH2(C6H3[OCH3]2), -C(O)NHCH2(C7H5O2), -C(O)NH(CH2)2O(C6H5), -C(O)NH(CH2)2OCH3,
-C(O)NH(CH2)3OCH3, -C(O)NH(CH2)4(C6H5) или -C(O)NH(CH2)3(C6H5);
r представляет собой целое число от 1 до 15;
s представляет собой целое число от 0 до 6;
t представляет собой целое число от 0 до 6;
u представляет собой целое число от 3 до 8;
v представляет собой целое число от 5 до 15;
XR2 представляет собой -N([СН2]7CH3)C(O)NH(CH2)7CH3, -N([СН2)6СН3)С(О)NH(СН2)6СН3,
-NH(CH2)qCH3, -NH(C6H4)O(C6H5), -N(CH3)(CH2)5CH3, -NHCH[(СН2)3СН3]2, -NHCH(CH3)[CH2]5CH3 или
-N([СН2]7СН3)2;
q представляет собой целое число от 6 до 15; и
R3 представляет собой Н, -CH3 -CH2OCH3 или C3-C10циклоалкил.
25. Соединение по п.24, имеющее следующую структуру:
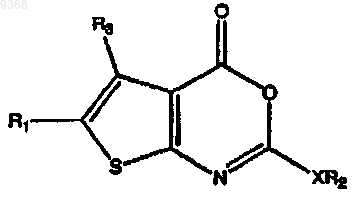
R1 представляет собой Н, -(СН2)3СН3, -(СН2)5СН3, -(СН2)6СН3, -(СН2)7СН3, -(СН2)9СН3, -(СН2)11СН3,
-СН(СН3)2, -СН(СН3)СН2С(СН3)3, -СН(СН3)(СН2)3С(=СН2)СН3, -СН(CH3)(СН2)3С(CH3)2ОС(О)СН3,
-СН(СН3)[СН2]3С(СН3)2ОСН3, -СН2(С6Н5), -(СН2)2(С6Н5), -(СН2)3(С6Н5), -(СН2)4(С6Н5), -(СН2)5(С6Н5),
-С(О)ОН, -C(O)NHCH3, -C(O)NHCH2CH3, -C(O)NH(CH2)3CH3, -C(O)OCH2(C6H5), -C(O)O(CH2)5CH3,
-С(O)O(СН2)6СН3, С(O)O(СН2)7СН3, -С(O)ОСН[(СН2)3СН3]2, -C(O)NH(CH2)5CH3, -C(O)NH(CH2)7CH3,
-С(О)NH(CH2)9CH3, -C(O)NH(CH2)11CH3, -C(O)NH(CH2)15CH3, -С(О)N(СН3)2, -C(O)NHCH2(C6H5),
-C(O)NHCH2(C5H4N), -С(О)N[(СН2)3СН3]2, -C(O)N[(CH2)5CH3]2, -C(O)N[(CH2)7CH3]2, -С(О)NH(С6Н11),
-С(O)(NC4H8N)СН2(С6Н5), -С(О)(NC5H9)CH2(С6Н5), -С(O)NH(СН2)3O(С6Н5), -С(О)NHCH[(СН2)3СН3]2,
-С(О)NH(CH2)3N(CH3)2, -C(O)NHCH2C(O)OCH2(C6H5), -C(O)N(CH3)CH2(C5H3N[CH3]),
-C(O)NH(CH2)2(C5H4N), -C(O)N(CH2CH3)(CH2)2(C5H4N), -C(O)NHCH2(C4H3O),
-C(O)(NC4H8N)[CH2]2(NC5H10), -C(O)NHCH2CH(CH3)2, -С(О)NHCH2(C5H4N), -C(O)NHCH2C(CH3)3,
-C(O)(NC4H8N)CH2C(O)NHCH(CH3)2, -C(O)(NC9H8)[OCH3]2, -C(O)NHCH2(C6H3[OCH3]2),
-C(O)NHCH2(C7H5O2), -C(O)NH(CH2)2O(C6H5), -C(O)NH(CH2)2OCH3, -C(O)NH(CH2)3OCH3,
-C(O)NH(CH2)4(C6H5) или -C(O)NH(CH2)3(C6H5);
XR2 представляет собой -N([CH2]7CH3)С(О)NH(CH2)7CH3, -N([СН2]6СН3)С(О)NH(СН2)6СН3,
-NH(CH2)6CH3, -NH(CH2)7CH3, -NH(СН2)11СН3, -NH(CH2)13CH3, -NH(CH2)15CH3, -NH(C6H4)O(C6H5),
-N(CH3)(CH2)5CH3, -NHCH[(CH2)3CH3]2, -NHCH(CH3)[СН2]5СН3 или -N([CH2]7CH3)2; и
R3 представляет собой Н, -СН3 или -CH2OCH3.
26. Способ получения соединения, имеющего структуру
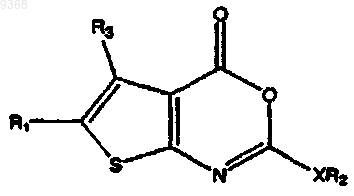
где XR2 представляет собой -N([СН2]7СН3)С(О)NH(СН2)7СН3, -N([СН2]6СН3)С(О)NH(СН2)6СН3,
-NH(CH2)qCH3, -NH(C6H4)O(C6H5), -N(CH3)(CH2)5CH3, -NHCH[(СН2)3СН3]2, -NHCH(CH3)[CH2]5CH3 или
-N([СН2]7СН3)2; и
R1 представляет собой Н, замещенный или незамещенный C1-C15алкил, незамещенный С2-С15алкил С1-С8алкиларил, -C(O)OR4, C(O)NR4R5, -CR6R6'OR4, -CR6R6'OC(O)R4, -CR6R6'OC(O)NHR7, -C(O)NR8R9,
-C(O)NR8R9NR8R9, -N(R5)С(О)NHR5 или CH2R4;
R2 представляет собой замещенный или незамещенный, прямой С1-С30алкил или разветвленный С3-С30алкил, арил, алкиларил, арилалкил, гетероарилалкил или циклоалкил;
R3 представляет собой Н или замещенный или незамещенный C1-C6алкил-CH3, -СН2ОСН3 или циклоалкил;
R4 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленный С6-С30алкил, арил, -СН2-арил, арилалкил, гетероарилалкил или циклоалкил;
каждый из R6 и R6' независимо представляет собой Н, замещенный или незамещенный С1-С6алкил, C1-C6диалкил или циклоалкил, или вместе они образуют 3-7-членную циклоалкильную или арильную группу;
R7 представляет собой Н или замещенный или незамещенный С1-С12алкил или циклоалкил;
каждый из R8 и R9 независимо представляет собой Н, замещенный или незамещенный C1-C6алкил, C1-C6алкокси, C1-C6алкиларил, или NR8R9 вместе образуют замещенное пиперазиновое или пиперидиновое кольцо или систему дигидро-1Н-изохинолиновых колец, включающий
(а) взаимодействие
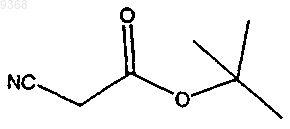
и
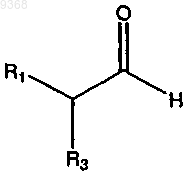
в присутствии серы, основания и растворителя с получением
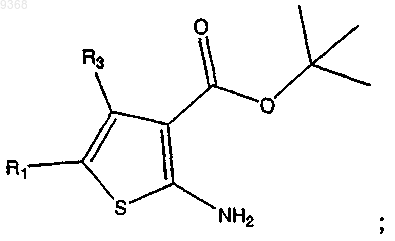
(b) взаимодействие продукта стадии (а) с
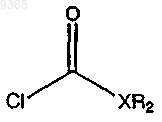
в присутствии основания с получением

(с) взаимодействие продукта стадии (b) с трифторуксусной кислотой (ТФУ) в присутствии растворителя с получением
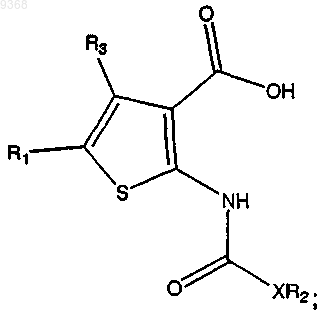
(d) взаимодействие продукта стадии (с) с SOCl2 в присутствии растворителя с получением соединения.
Текст
009368 В соответствии с данной заявкой испрашивается приоритет по предварительной заявке на выдачу патента США 60/342617, поданной 20 декабря 2001 г., и предварительной заявке на выдачу патента США 60/357015, поданной 13 февраля 2002 г., которые в полном объеме включены в настоящее описание посредством ссылок. В данной заявке ссылаются на различные публикации путем полного цитирования. Описания данных публикаций в полном объеме включены в настоящую заявку посредством ссылок для более полного описания уровня техники, известного специалисту в данной области на дату, когда настоящее изобретение было раскрыто и заявлено. Предпосылки изобретения За последние 20 лет ожирение стало все шире распространяющейся проблемой среди населения развитых стран. Повышенная встречаемость ожирения имеет место отчасти из-за перехода во многих развитых странах на европеизированный рацион, в который входит множество блюд с высоким содержанием жира и низким содержанием клетчатки, и отчасти из-за стиля жизни западного общества. Известно,что ожирение увеличивает риск ограничивающих заболеваний, таких как диабет, сердечно-сосудистые заболевания и гипертония. Фармакологические подходы к лечению ожирения основаны либо на попытке повышения расходования организмом энергии для того, чтоб сжигать больше жира, либо на сокращении притока энергии в организм. Последний подход привел к разработке ряда лекарственных средств, целью которых является снижение способности организма к всасыванию жира. Действие таких лекарственных средств направлено на ферменты, ответственные за расщепление жира в пищеварительном тракте человека. Наиболее важными ферментами в расщеплении жира являются гидролитические ферменты. Наиболее значимыми из этих ферментов являются липазы, в частности липаза поджелудочной железы. Орлистат, производное липстатина, ингибитор липазы, раскрыт в качестве лекарственного средства против ожирения в заявке на выдачу европейского патентаЕР 129748. Другие ингибиторы липазы раскрыты соответственно в международных публикациях РСТWO 00/40569 и WO 00/40247. Сущность изобретения Настоящее изобретение относится к соединению, имеющему следующую структуру:R1 представляет собой Н, замещенный или незамещенный C1-C15 алкил, С 1-С 8 алкиларил, -C(O)OR4,-C(O)NR4R5, -CR6R6'OR4, -CR6R6'OC(O)R4, -CR6R6'OC(O)NHR7, -С(O)NR10R11, -С(О)NR8R9NR8R9,-N(R5)C(O)NHR5 или CH2R4;R2 представляет собой замещенный или незамещенный неразветвленный C1-С 30 алкил или разветвленный С 3-С 30 алкил, арил, алкиларил, арилалкил, гетероарилалкил или циклоалкил; иR3 представляет собой Н или замещенный или незамещенный C1-C6 алкил или C3-C10 циклоалкил,гдеR4 представляет собой Н или замещенный или незамещенный неразветвленный или разветвленный С 6-С 30 алкил, арил, -CH2-арил, арил-С 1-С 30 алкил, гетероарил-С 1-С 30 алкил или С 3-С 10 циклоалкил;R5 представляет собой Н или замещенный или незамещенный неразветвленный или разветвленныйC6-C30 алкил, арил C1-C30 алкил, гетероарилалкил или циклоалкил; каждый из R6 и R6' независимо представляет собой Н, замещенный или незамещенный C1-C6 алкил,диалкил или C3-C10 циклоалкил или вместе образуют 3-7-членную систему колец;R7 представляет собой Н или замещенный или незамещенный С 1-С 12 алкил или C3-C10 циклоалкил; и каждый из R8 и R9 независимо представляет собой Н, замещенный или незамещенный C1-C6 алкил,C1-C6 алкокси, С 1-С 6 алкиларил, или NR8R9 вместе образуют замещенное пиперазиновое или пиперидиновое кольцо или систему дигидро-1 Н-изохинолиновых колец,или к его отдельному энантиомеру, или отдельному таутомеру, или к его фармацевтически приемлемой соли. Настоящее изобретение также относится к соединению, имеющему следующую структуру: где R10 представляет собой Н или замещенный или незамещенный С 1-С 15 алкил, С 1-С 15 алкиларил или-C(O)R14,где R14 представляет собой гидроксил или замещенный или незамещенный C1-C30 алкил, алкиламино, диалкиламино, алкокси, бензилокси, циклоалкил, алкилгетероарил, алкиларил или гетероциклическое, гетероарильное или арильное кольцо;R11 представляет собой водород или метил;R12 представляет собой водород или трет-бутил; иR13 представляет собой водород или -C(O)ZR15,где Z представляет собой СН 2, О или N, и R15 представляет собой замещенный или незамещенныйC1-C15 алкил или арил. Настоящее изобретение также относится к способу лечения нуждающегося в таком лечении больного ожирением, предусматривающему введение указанному больному терапевтически эффективного количества соединения по настоящему изобретению с тем, чтобы провести лечение больного ожирением. Настоящее изобретение также относится к способу лечения нуждающегося в таком лечении больного диабетом, предусматривающему введение указанному больному терапевтически эффективного количества соединения по настоящему изобретению с тем, чтобы провести лечение больного диабетом. Настоящее изобретение также относится к способу ингибирования гидролитической активности липаз поджелудочной железы в клетке, предусматривающему взаимодействие клетки с количеством соединения по настоящему изобретению, эффективным для ингибирования гидролитической активности липаз поджелудочной железы. Подробное описание изобретения Настоящее изобретение относится к соединениям, имеющим следующую структуру:R1 представляет собой Н, замещенный или незамещенный С 1-С 15 алкил, С 1-С 8 алкиларил, -C(O)OR4,-C(O)NR4R5, -CR6R6'OR4, -CR6R6'OC(O)R4, -CR6R6'OC(O)NHR7, -С(O)NR10R11, -С(О)NR8R9NR8R9,-N(R5)C(O)NHR5 или CH2R4;R2 представляет собой замещенный или незамещенный, неразветвленный С 1-С 30 алкил или разветвленный С 3-С 30 алкил, арил, алкиларил, арилалкил, гетероарилалкил или циклоалкил; иR3 представляет собой Н или замещенный или незамещенный С 1-С 6 алкил или С 3-С 10 циклоалкил,гдеR4 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленный,С 6-С 30 алкил, арил, -CH2-арил, арил-С 1-С 30 алкил, гетероарил-С 1-С 30 алкил или С 3-С 10 циклоалкил;R5 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленный,С 6-С 30 алкил, арил C1-C30 алкил, гетероарилалкил или циклоалкил; каждый из R6 и R6' независимо представляет собой Н, замещенный или незамещенный C1-C6 алкил,диалкил или C3-C10 циклоалкил или вместе образуют 3-7-членную систему колец;R7 представляет собой Н или замещенный или незамещенный С 1-С 12 алкил или C3-C10 циклоалкил; и каждый из R8 и R9 независимо представляет собой Н, замещенный или незамещенный C1-C6 алкил,C1-C6 алкокси, C1-C6 алкиларил, или NR8R9 вместе образуют замещенное пиперазиновое или пиперидиновое кольцо или систему дигидро-1 Н-изохинолиновых колец, или к их отдельному энантиомеру, или отдельному таутомеру, или к их фармацевтически приемлемой соли. В одном воплощении соединение имеет структуру:R2 представляет собой замещенный или незамещенный, неразветвленный или разветвленный C6C30 алкил, арилалкил, гетероарилалкил или циклоалкил; иR3 представляет собой Н, или замещенный или незамещенный C1-C6 алкил, или циклоалкил, гдеR4 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленныйR5 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленныйC6-C30 алкил, арилалкил, гетероарилалкил или циклоалкил; каждый из R6 и R6' независимо представляет собой Н, замещенный или незамещенный C1-C6 алкил,диалкил или циклоалкил или вместе образуют 3-7-членную систему колец; иR7 представляет собой Н, или замещенный или незамещенный C1-С 12 алкил, или циклоалкил. В следующем воплощении соединение имеет структуру:R2 представляет собой замещенный или незамещенный, неразветвленный или разветвленный С 6 С 30 алкил, арилалкил, гетероарилалкил или циклоалкил; иR3 представляет собой Н, или замещенный или незамещенный C1-С 6 алкил, или циклоалкил, гдеR4 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленный С 6-С 30 алкил, арилалкил, гетероарилалкил или циклоалкил;R5 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленныйC6-С 30 алкил, арилалкил, гетероарилалкил или циклоалкил; каждый из R6 и R6' независимо представляет собой Н, замещенный или незамещенный C1-C6 алкил,диалкил или циклоалкил или вместе образуют 3-7-членную систему колец; иR7 представляет собой Н, или замещенный или незамещенный С 1-С 12 алкил, или циклоалкил. В следующем воплощении указанного выше соединенияR3 представляет собой C1-C6 алкил. В следующем воплощении R3 представляет собой H или CH3. В следующем воплощении X представляет собой O. В следующем воплощении R3 представляет собой метил. В следующем воплощении X представляет собой N. В следующем воплощении R3 представляет собой метил. В следующем воплощении соединение имеет структуруr представляет собой целое число от 1 до 15;s представляет собой целое число от 0 до 6;t представляет собой целое число от 0 до 6;u представляет собой целое число от 3 до 8;v представляет собой целое число от 5 до 15;n представляет собой целое число от 6 до 15;m представляет собой целое число от 1 до 15; р представляет собой целое число от 0 до 6;q представляет собой целое число от 6 до 15; иR3 представляет собой Н, -СН 3 или -СН 2 ОСН 3. В следующем воплощении соединение имеет структуруR3 представляет собой Н, -СН 3 или -СН 2 ОСН 3. В следующем воплощении соединение выбрано из группы, включающей 6-гептил-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 6-гексил-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 2-октилокси-6-(1,3,3-триметилбутил)тиено[2,3-d][1,3]оксазин-4-он; 6-бутил-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 6-гептил-2-октиламинотиено[2,3-d][1,3]оксазин-4-он; 6-бутил-2-октиламинотиено[2,3-d][1,3]оксазин-4-он; 6-бензил-2-октиламинотиено[2,3-d][1,3]оксазин-4-он;-4 009368 6-гептил-2-ундецилтиено[2,3-d][1,3]оксазин-4-он; 6-(5-метокси-1,5-диметилгексил)-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 6-(1,5-диметилгекс-4-енил)-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 6-(1,5-диметилгекс-5-енил)-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 1,1-диметил-5-(2-октилокси-4-оксо-4 Н-тиено[2,3-d][1,3]оксазин-6-ил)гексиловый эфир трифторуксусной кислоты; 2-(2-бензилоксиэтокси)-6-децилтиено[2,3-d][1,3]оксазин-4-он; 6-гептил-5-метил-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 6-метил-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 2-октилокси-6-фенэтилтиено[2,3-d][1,3]оксазин-4-он; 2-октилокси-6-(3-фенилпропил)тиено[2,3-d][1,3]оксазин-4-он; 2-октилокси-6-(4-фенилбутил)тиено[2,3-d][1,3]оксазин-4-он; 2-октилокси-6-(5-фенилпентил)тиено[2,3-d][1,3]оксазин-4-он; 6-децил-2-(2-метоксиэтокси)тиено[2,3-d][1,3]оксазин-4-он; 2-(4-бутилфенокси)-6-децилтиено[2,3-d][1,3]оксазин-4-он; 2-(3-бензилоксипропокси)-6-децилтиено[2,3-d][1,3]оксазин-4-он; 2-(3-бензилоксибутилокси)-6-децилтиено[2,3-d][1,3]оксазин-4-он; 6-изопропил-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 6-октил-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 6-додецил-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 2-бензилокси-6-децилтиено[2,3-d][1,3]оксазин-4-он; 2-(4-бутилбензилокси)-6-децилтиено[2,3-d][1,3]оксазин-4-он; 6-децил-2-(2-п-толилэтокси)тиено[2,3-d][1,3]оксазин-4-он; 6-децил-2-фенэтилокситиено[2,3-d][1,3]оксазин-4-он; 3-метил-6-октил-2-октилокси-5 Н-тиено[2,3-b]пиридин-4-он; 2-бутокси-6-октил-5 Н-тиено[2,3-b]пиридин-4-он; 2-гексилокси-6-октил-5 Н-тиено[2,3-b]пиридин-4-он; 2-додецилокси-6-октил-5 Н-тиено[2,3-b]пиридин-4-он; 6-децил-2-фенокси-5 Н-тиено[2,3-b]пиридин-4-он; 2-децилокси-6-октил-5 Н-тиено[2,3-b]пиридин-4-он; 6-бензил-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 6-децил-2-октилокситиено[2,3-d][1,3]оксазин-4-он; 6-децил-2-(1-метилгептилокси)тиено[2,3-d][1,3]оксазин-4-он; 6-гептил-2-(1-метилгептилокси)тиено[2,3-d][1,3]оксазин-4-он; 6-децил-2-(4-фенилпропокси)тиено[2,3-d][1,3]оксазин-4-он и 6-децил-2-(4-фенилбутокси)тиено[2,3-d][1,3]оксазин-4-он. Настоящее изобретение также относится к соединениям, имеющим структуру где R10 представляет собой Н или замещенный или незамещенный C1-C15 алкил, С 1-С 15 алкиларил или-C(O)R14,где R14 представляет собой гидроксил или замещенный или незамещенный С 1-С 30 алкил, алкиламино, диалкиламино, алкокси, бензилокси, циклоалкил, алкилгетероарил, алкиларил или гетероциклическое, гетероарильное или арильное кольцо;R11 представляет собой водород или метил;R12 представляет собой водород или трет-бутил; иR13 представляет собой водород или -C(O)ZR15,где Z представляет собой СН 2, О или N, и R15 представляет собой замещенный или незамещенный С 1-С 15 алкил или арил. Настоящее изобретение также относится к способу лечения нуждающегося в таком лечении больного ожирением, предусматривающему введение указанному больному терапевтически эффективного количества соединения по настоящему изобретению с тем, чтобы провести лечение больного ожирением. Настоящее изобретение также относится к способу лечения нуждающегося в таком лечении больного диабетом, предусматривающему введение указанному больному терапевтически эффективного количества соединения по настоящему изобретению с тем, чтобы провести лечение больного диабетом. Настоящее изобретение также относится к способу ингибирования гидролитической активности-5 009368 липаз поджелудочной железы в клетке, предусматривающему взаимодействие клетки с количеством соединения по настоящему изобретению, эффективным для ингибирования гидролитической активности липаз поджелудочной железы. Указанный выше способ может предусматривать взаимодействие клетки либо in vitro, либо in vivo. Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение по настоящему изобретению и фармацевтически приемлемый носитель. В одном воплощении фармацевтическую композицию готовят для перорального, местного, парентерального или назального введения. Настоящее изобретение также относится к способу получения фармацевтической композиции, предусматривающему смешивание соединения по настоящему изобретению и фармацевтически приемлемым носителем. Настоящее изобретение также относится к изделию, содержащему упаковочный материал; указанную выше фармацевтическую композицию и инструкции по применению фармацевтической композиции для лечения ожирения. Настоящее изобретение также относится к способу получения соединения, имеющего структуруR1 представляет собой Н, замещенный или незамещенный С 1-С 15 алкил, C1-С 8 алкиларил, -C(O)OR4,-C(O)NR4R5, -CR6R6'OR4, -CR6R6'OC(O)R4, -CR6R6'OC(O)NHR7, -C(O)NR8R9, -C(O)NR8R9NR8R9,-N(R5)C(O)NHR5 или CH2R4;R2 представляет собой замещенный или незамещенный, неразветвленный C1-C30 алкил или разветвленный С 3-С 30 алкил, арил, алкиларил, арилалкил, гетероарилалкил или циклоалкил;R3 представляет собой Н, или замещенный или незамещенный С 1-С 6 алкил, или циклоалкил;R4 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленный С 6-С 30 алкил, арил, -СН 2-арил, арилалкил, гетероарилалкил или циклоалкил;R5 представляет собой Н или замещенный или незамещенный, неразветвленный или разветвленный С 6-С 30 алкил, арилалкил, гетероарилалкил или циклоалкил; каждый из R6 и R6' независимо представляет собой Н, замещенный или незамещенный C1-C6 алкил,диалкил или циклоалкил или вместе они образуют 3-7-членную систему колец;R7 представляет собой Н, или замещенный или незамещенный С 1-С 12 алкил, или циклоалкил; каждый из R8 и R9 независимо представляет собой Н, замещенный или незамещенный С 1-С 6 алкил,C1-C6 алкокси, C1-C6 алкиларил или NR8R9 вместе образуют замещенное пиперазиновое или пиперидиновое кольцо или систему дигидро-1 Н-изохинолиновых колец, предусматривающий(b) взаимодействие продукта стадии (а) с(с) взаимодействие продукта стадии (b) с трифторуксусной кислотой (ТФУ) в присутствии растворителя с получением(d) взаимодействие продукта стадии(с) с SOCl2 в присутствии растворителя с получением соедине В одном воплощении указанного выше способа основание на стадии (а) представляет собой триэтиламин, а растворитель представляет собой диметилформамид (ДМФ). В следующем воплощении растворитель на стадии (с) представляет собой дихлорметан. В следующем воплощении растворитель на стадии (d) представляет собой пиридин:CH2Cl2. Настоящее изобретение также относится к соединению, полученному в соответствии с указанным выше способом. Настоящее изобретение также относится к применению соединений по настоящему изобретению при получении лекарственного препарата для лечения ожирения у субъекта. Настоящее изобретение также относится к применению соединений по настоящему изобретению при получении лекарственного препарата для лечения диабета у субъекта. Настоящее изобретение также относится к применению соединений по настоящему изобретению при получении лекарственного препарата для ингибирования гидролитической активности липаз поджелудочной железы в клетке. Ингибирование клетки может быть проведено либо in vitro, либо in vivo. Настоящее изобретение также относится к указанным выше соединениям, где любое гетероциклическое или гетероарильное кольцо, если таковое присутствует, представляет собой пиперазиновое, пиперидиновое, (1,4)диазепановое, пиразиновое, пиридиновое, пирролидиновое, пиразоловое, пиримидиновое, тиофеновое, имидазоловое, азетидиновое, пирроловое, бензотиазоловое, бензодиоксолановое, дитиолановое, оксатииновое, имидазолидиновое, хинолиновое, изохинолиновое, дигидроизохинолиновое,индоловое, изоиндоловое, триазаспиро[4.5]декановое, морфолиновое, фурановое или анизстиазоловое кольцо. Настоящее изобретение также относится к любому из указанных выше соединений, где любой заместитель, если таковой присутствует, представляет собой галоген, гидроксил, неразветвленный (C1 С 30)алкил, разветвленный (С 3-С 30)алкил,(C3-C10)циклоалкил, неразветвленный (C1-C30)алкилкарбонилокси, разветвленный (С 3-С 30)алкилкарбонилокси, арилкарбонилокси, неразветвленный (C1-C30)алкоксикарбонилокси, разветвленный (С 3-С 30)алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, неразветвленный (C1-C30)алкилкарбонил, разветвленный (С 3-С 10)алкилкарбонил, неразветвленный (C1C30)алкоксикарбонил, разветвленный (С 3-С 30)алкоксикарбонил, аминокарбонил, неразветвленный (C1C30)алкилтиокарбонил, разветвленный (С 3-С 30)алкилтиокарбонил, неразветвленный (C1-C30)алкоксил,разветвленный(C1-C30)алкоксил, фосфат, фосфонато, циано, амино, неразветвленный (C1-C30)алкиламино,разветвленный (С 3-С 30)алкиламино, неразветвленный (C1-C30)диалкиламино, разветвленный(С 3-7 009368 С 30)диалкиламино, ариламино, диариламино, неразветвленный (C1-C30)алкилариламино, разветвленный(С 3-С 30)алкилариламино, ациламино, неразветвленный (C1-C30)алкилкарбониламино, разветвленный (С 3 С 30)алкилкарбониламино, арилкарбониламино, карбамоил, уреидо, амидино, имино, сульфгидрил, неразветвленный(C1-C30)алкилтио, разветвленный (С 3-С 30)алкилтио, арилтио, тиокарбоксилат, сульфаты,сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, азидо, 4-10-членный гетероциклил, неразветвленный (C1-C30)алкиларил, разветвленный (С 3-С 30)алкиларил, бензо(1,3)диоксол или ароматический или 5-6-членный гетероароматический радикал, причем указанный заместитель может быть далее замещен любым из вышеперечисленного. Число атомов углерода, обозначенное как "(C1-C30)" или "(С 3-С 30)", означает любое возрастающее целое число от 1 и 3 до 30, например 1, 2, 3, 4, 5, , 30. Дополнительные воплощения соединений по данному изобретению описаны ниже. Величины "k" и "Ymax" в приведенной выше таблице соответствуют значениям переменных в уравнении, приведенном в примере 23 далее. Все соединения, указанные как масла, представляли собой масла при комнатной температуре. Выражение терапевтически эффективное количество в отношении описанных ниже соединений по настоящему изобретению относится к такому количеству лекарственного соединения, которое является необходимым или достаточным для выполнения предназначенной для него функции в организме млекопитающего. Эффективное количество лекарственного соединения может варьировать в зависимости от ряда факторов, таких как количество уже находящегося в организме млекопитающего болезнетворного агента, возраста, пола и массы млекопитающего, и способности лекарственных соединений по настоящему изобретению приводить к желаемому результату в организме млекопитающего. Средний специалист в данной области техники способен оценить вышеупомянутые факторы и определить эффективное- 19009368 количество лекарственного соединения без постановки дополнительных экспериментов. Для определения эффективного количества описанных ниже лекарственных соединений могут применяться методы анализа in vitro и in vivo. Средний специалист в данной области техники может подобрать подходящее количество лекарственного соединения для применения в вышеупомянутом методе анализа или для терапевтического лечения. Терапевтически эффективное количество предпочтительно ослабляет по меньшей мере один симптом или эффект, ассоциированный с подвергаемым лечению нарушением, по меньшей мере на 20%(более предпочтительно по меньшей мере приблизительно на 40%, еще более предпочтительно по меньшей мере приблизительно на 60% и еще более предпочтительно по меньшей мере приблизительно на 80%) относительно не подвергаемых лечению больных. Для оценки ослабления подобных симптомов и/или эффектов специалистом в данной области техники могут быть разработаны различные методы анализа. Подразумевается, что любой известный из уровня техники метод анализа, позволяющий измерить такие параметры, является частью настоящего изобретения. Термин животное включает любой организм, имеющий аденозиновые рецепторы. Примеры животных включают дрожжи, млекопитающих, пресмыкающихся и птиц. Указанный термин также включает трансгенных животных. Подразумевается, что известный из уровня техники термин млекопитающее включает в себя любое животное, более предпочтительно теплокровное животное, наиболее предпочтительно крупный рогатый скот, овец, свиней, лошадей, собак, кошек, крыс, мышей и людей. Млекопитающие, подверженные ассоциированным с ожирением нарушениям, также охватываются настоящим изобретением. Термин алкил относится к радикалу насыщенных алифатических групп, включая алкильные группы с неразветвленной цепью, алкильные группы с разветвленной цепью, циклоалкильные (алициклические) группы, замещенные алкилом циклоалкильные группы и замещенные циклоалкилом алкильные группы. В предпочтительных воплощениях алкил с неразветвленной или разветвленной цепью содержит 30 или менее атомов углерода в своем скелете (например, C1-C30 для неразветвленной цепи, С 3 С 30 для разветвленной цепи) и более предпочтительно 20 или менее. Также предпочтительные циклоалкилы содержат 4-10 атомов углерода в своей кольцевой структуре и более предпочтительно 5, 6 или 7 атомов углерода в кольцевой структуре. Термин замещенный алкил относится к алкильным радикалам, содержащим заместители, замещающие водород при одном или нескольких атомах углерода углеводородного остова. Такие заместители могут включать, например, галоген, гидроксил, алкилкарбонилоксигруппу, арилкарбонилоксигруппу,алкоксикарбонилоксигруппу, арилоксикарбонилоксигруппу, карбоксилат, алкилкарбонил, алкоксикарбонил, аминокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонатогруппу, фосфинатогруппу, цианогруппу, аминогруппу (включая алкиламиногруппу, диалкиламиногруппу, ариламиногруппу, диариламиногруппу и алкилариламиногруппу), ациламиногруппу (включая алкилкарбониламиногруппу, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппу, иминогруппу, сульфгидрил, алкилтиогруппу, арилтиогруппу, тиокарбоксилат, сульфаты, сульфонатогруппу, сульфамоил, сульфонамидогруппу, нитрогруппу, трифторметил, цианогруппу, азидогруппу, гетероциклил, алкиларил или ароматический или гетероароматический радикал. Специалисту в данной области техники понятно, что замещающие радикалы в углеводородной цепи сами могут быть подходящим образом замещены. Циклоалкилы могут быть дополнительно замещены, например, описанными выше заместителями. Алкиларильный радикал представляет собой алкил, замещенный арилом (например, фенилметилбензил). Термин алкил также включает ненасыщенные алифатические группы, аналогичные по своей длине и возможному замещению с описанными выше алкилами, но содержащие по меньшей мере одну двойную или тройную связь соответственно. Используемый в этом документе термин арил относится к радикалу арильных групп, включая 5 и 6-членные однокольцевые ароматические группы, которые могут содержать от нуля до четырех гетероатомов, например, бензол, пиррол, фуран, тиофен, имидазол, бензоксазол, бензотиазол, триазол, тетразол, пиразол, пиридин, пиразин, пиридазин и пиримидин и тому подобное. Арильные группы также включают полициклические конденсированные ароматические группы, такие как нафтинил, хинолинил,индолил и тому подобное. Такие арильные группы, содержащие гетероатомы в кольцевой структуре,могут также называться арильными гетероциклами, гетероарилами или гетероароматическими соединениями. Ароматическое кольцо может быть замещено в одном или нескольких положениях описанными выше заместителями, например, галогеном, гидроксилом, алкоксигруппой, алкилкарбонилоксигруппой, арилкарбонилоксигруппой, алкоксикарбонилоксигруппой, арилоксикарбонилоксигруппой, карбоксилатом, алкилкарбонилом, алкоксикарбонилом, аминокарбонилом, алкилтиокарбонилом, фосфатом,фосфонатогруппой, фосфинатогруппой, цианогруппой, аминогруппой (включая алкиламиногруппу, диалкиламиногруппу, ариламиногруппу, диариламиногруппу и алкилариламиногруппу), ациламиногруппой (включая алкилкарбониламиногруппу, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппой, иминогруппой, сульфгидрилом, алкилтиогруппой, арилтиогруппой, тиокарбоксилатом,сульфатами, сульфонатогруппой, сульфамоилом, сульфонамидогруппой, нитрогруппой, трифтормети- 20009368 лом, цианогруппой, азидогруппой, гетероциклилом, алкиларилом или ароматическим или гетероароматическим радикалом. Арильные группы также могут быть конденсированы или соединены мостиковой связью с не являющимися ароматическими алициклическими или гетероциклическими кольцами, образуя тем самым полицикл (например, тетралин). Термины алкенил и алкинил относятся к ненасыщенным алифатическим группам, аналогичным по своей длине и возможному замещению с описанными выше алкилами, но содержащим по крайней мере одну двойную или тройную связь соответственно. Например, настоящее изобретение предусматривает цианогруппу и пропаргил. Если количество атомов углерода не определено иначе, используемый в этом документе термин низший алкил означает определенную выше алкильную группу, но содержащую от одного до десяти атомов углерода, более предпочтительно от одного до шести атомов углерода в своем остове, еще более предпочтительно от одного до трех атомов углерода в своем скелете. Более того, низший алкенил и низший алкинил имеют сходную длину цепи. Термины алкоксиалкил, полиаминоалкил и тиоалкоксиалкил относятся к описанным выше алкильным группам, которые дополнительно содержат атомы кислорода, азота или серы, замещающие один или несколько атомов углерода в углеводородном остове, например, атомы кислорода, азота или серы. Термины полициклил или полициклический радикал относятся к радикалу, состоящему из двух или более циклических колец (например, радикалу циклоалкилов, циклоалкенилов, циклоалкинилов, арилов и/или гетероциклилов), в котором два или более атомов являются общими для двух прилегающих колец, например кольца представляют собой конденсированные кольца. Кольца, которые объединены через неприлегающие атомы, обозначают как соединенные мостиковой связью кольца. Каждое из колец полицикла может быть замещено описанными выше заместителями, например, галогеном,гидроксилом, алкилкарбонилоксигруппой, арилкарбонилоксигруппой, алкоксикарбонилоксигруппой,арилоксикарбонилоксигруппой, карбоксилатом, алкилкарбонилом, алкоксикарбонилом, аминокарбонилом, алкилтиокарбонилом, алкоксилом, фосфатом, фосфонатогруппой, фосфинатогруппой, цианогруппой, аминогруппой (включая алкиламиногруппу, диалкиламиногруппу, ариламиногруппу, диариламиногруппу и алкилариламиногруппу), ациламиногруппой (включая алкилкарбониламиногруппу, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппой, иминогруппой, сульфгидрилом, алкилтиогруппой, арилтиогруппой, тиокарбоксилатом, сульфатами, сульфонатогруппой, сульфамоилом, сульфонамидогруппой, нитрогруппой, трифторметилом, цианогруппой, азидогруппой, гетероциклилом, алкилом, алкиларилом, или ароматическим, или гетероароматическим радикалом. Используемый в этом документе термин гетероатом означает атом или другой элемент, отличный от атома углерода или водорода. Предпочтительные гетероатомы представляют собой атомы азота, кислорода, серы и фосфора. Подразумевается, что используемый в этом документе термин гетероцикл или гетероциклическая система обозначает стабильное 5-, 6- или 7-членное моноциклическое или 7-, 8-, 9-, 10- или 11 членное бициклическое гетероциклическое кольцо, которое является насыщенным или частично ненасыщенным. Термины карбоциклический или гетероциклический дополнительно включают спиросоединения, которые означают бициклическое соединение, в котором два кольца имеют один общий атом, и этот атом может являться атомом углерода или гетероатомом. Термин аминокислоты включает встречающиеся и не встречающиеся в природе обнаруженные в белках аминокислоты, такие как глицин, аланин, валин, цистеин, лейцин, изолейцин, серии, треонин,метионин, глутаминовую кислоту, аспарагиновую кислоту, глутамин, аспарагин, лизин, аргинин, пролин,гистидин, фенилаланин, тирозин и триптофан. Аналоги аминокислот включают аминокислоты с удлиненными или укороченными боковыми цепями, или различными боковыми цепями с подходящими функциональными группами. Аминокислоты также включают D- и L-стереоизомеры аминокислоты, если строение аминокислоты допускает существование стереоизомерных форм. Термин дипептид включает две или более аминокислоты, связанные вместе. Предпочтительно дипептиды представляют собой две аминокислоты, связанные через пептидную связь. Особенно предпочтительные дипептиды включают,например, аланин-аланин и глицин-аланин. Следует отметить, что строение некоторых соединений по настоящему изобретению включает асимметричные атомы углерода, а потому наблюдается образование рацематов и рацемических смесей,отдельных энантиомеров, диастереоизомерных смесей и индивидуальных диастереоизомеров. Все подобные изомерные формы этих соединений специально включены в настоящее изобретение. Каждый атом углерода, способный образовывать стереоизомеры, может иметь R- или S-конфигурацию. Соответственно следует понимать, что изомеры, являющиеся результатом такой асимметрии (например, все энантиомеры и диастереоизомеры), включены в объем настоящего изобретения, если не определено иначе. Такие изомеры могут быть получены, по существу, в чистой форме путем классических методик разделения и путем стереохимически контролируемого синтеза. Настоящее изобретение дополнительно относится к фармацевтическим композициям для лечения- 21009368 ожирения и ассоциированных с ожирением нарушений у млекопитающего. Фармацевтическая композиция включает терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый носитель. Следует понимать, что все описанные ниже соединения предназначены для терапевтического применения. Дополнительно следует понимать, что соединения по настоящему изобретению могут применяться по отдельности или в комбинации с другими соединениями по настоящему изобретению или в комбинации с другими применяемыми в терапии соединениями, такими как, например, антибиотики, противовоспалительные средства или противораковые средства. Подразумевается, что известный из уровня техники термин антибиотик включает в себя те продуцируемые растущими микроорганизмами вещества и их синтетические производные, которые устраняют или ингибируют рост болезнетворных организмов и обладают избирательной токсичностью в отношении болезнетворного организма, оказывая при этом минимально вредные эффекты в отношении инфицированного организма или не обладая ими. Подходящие примеры антибиотиков включают без ограничения химические классы аминогликозидов, цефалоспоринов, хлорамфениколов, фусцидиновых кислот, макролидов, пенициллинов, полимиксинов, тетрациклинов и стрептомицинов. Подразумевается, что известный из уровня техники термин противовоспалительный относится к тем средствам, которые воздействуют на механизмы организма без прямого антагонистического действия в отношении вызывающего воспаления агента, такие как глюкокортикоиды, аспирин, ибупрофен,нестероидные противовоспалительные препараты и так далее. Подразумевается, что известный из уровня техники термин противораковое средство включает в себя те средства, которые ослабляют, устраняют или предупреждают рост опухолевых клеток, предпочтительно без побочного нарушения других физиологических функций. Характерные примеры включают цисплатин и циклофосфамид. Если соединения по настоящему изобретению вводят людям и млекопитающим в виде фармацевтических препаратов, они могут вводиться per se или в виде фармацевтической композиции, содержащей,например, от 0,1 до 99,5% (более предпочтительно от 0,5 до 90%) активного ингредиента в комбинации с фармацевтически приемлемым носителем. Используемое в этом документе выражение фармацевтически приемлемый носитель означает фармацевтически приемлемый материал, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, наполнитель, растворитель или материал для заключения в капсулу, который участвует в доставке или транспортировке соединения (соединений) по настоящему изобретению внутри организма или к нему, выполняя, таким образом, предназначенную для него функцию. Обычно такие соединения доставляются или транспортируются от одного органа или части тела к другому органу или части тела. Каждый носитель должен быть приемлемым в смысле совместимости с другими ингредиентами состава и не являться вредным для организма. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; измельченный трагакант; солод; желатин; тальк; наполнители, такие как масло какао и воски для суппозиториев; масла,такие как арахисовое масло, хлопковое масло, саффлоровое масло, кунжутное масло, оливковое масло,кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; забуферивающие средства, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы; и другие совместимые нетоксичные вещества, применяемые в фармацевтических составах. Как представлено выше в конкретных воплощениях настоящего изобретения, соединения могут содержать основную функциональную группу, такую как аминогруппу или алкиламиногруппу, и потому способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми кислотами. В этом смысле термин фармацевтически приемлемые соли относится к относительно нетоксичным солям добавления неорганических и органических кислот соединений по настоящему изобретений. Эти соли могут быть получены in situ во время окончательного выделения и очистки соединений по настоящему изобретений или путем отдельного осуществления взаимодействия очищенного соединения по настоящему изобретению в форме свободного основания с подходящей органической или неорганической кислотой и выделения полученной таким образом соли. Типичные примеры солей включают гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, валерат, олеат, пальмитат, стеарат,лаурат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат,глюкогептилат, лактобионат и лаурилсульфонат и тому подобное (см., например, Berge et al. (1977)"Pharmaceutical Salts", J. Pharm. Sci. 66: 1-19). В других случаях соединения по настоящему изобретению могут содержать одну или несколько кислотных функциональных групп и потому способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми основаниями. В этом смысле термин фармацевтически приемлемые соли относится к относительно нетоксичным солям добавления неорганических и органических оснований соединений по настоящему изобретений. Эти соли могут быть также получены in situ во время- 22009368 окончательного выделения и очистки соединений, или путем отдельного осуществления взаимодействия очищенного соединения по настоящему изобретению в его свободной кислотной форме с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, с аммиаком или с фармацевтически приемлемым первичным, вторичным или третичным органическим амином. Типичные примеры солей щелочных или щелочно-земельных металлов включают соли лития, натрия, калия, кальция, магния и алюминия и тому подобное. Типичные примеры органических аминов, применимых для образования солей добавления оснований, включают этиламин, диэтиламин,этилендиамин, этаноламин, диэтаноламин, пиперазин и тому подобное. Термин фармацевтически приемлемые сложные эфиры относится к относительно нетоксичным продуктам этерификации соединений по настоящему изобретению. Такие сложные эфиры могут быть получены in situ во время окончательного выделения и очистки соединений, или путем отдельного осуществления взаимодействия очищенного соединения в форме свободной кислоты или гидроксила, с подходящим этерифицирующим агентом. Карбоновые кислоты могут быть преобразованы в сложные эфиры путем обработки спиртом в присутствии катализатора. Производные, содержащие гидроксил, могут быть преобразованы в сложные эфиры путем обработки этерифицирующим агентом, таким как алканоилгалогениды. Дополнительно подразумевается, что термин включает в себя низшие углеводородные группы, способные сольватироваться в физиологических условиях, например, алкильные сложные эфиры, метиловый, этиловый и пропиловый сложные эфиры.(См., например, цитируемую выше работу Berge et al.). Настоящее изобретение также относится к применению пролекарств, которые превращаются in vivo в терапевтические соединения по настоящему изобретению(см., например, R.B. Silverman, 1992, "TheOrganic Chemistry of Drug Design and Drug Action", Academic Press, Chapter 8). Такие пролекарства могут применяться для изменения биораспределения (например, позволяют применять соединения, которые обычно не достигают активного центра протеазы) или фармакокинетики терапевтического соединения. Например, группа карбоновой кислоты может быть этерифицирована, например, метильной группой или этильной группой с получением сложного эфира. Когда сложный эфир вводят больному, он разрушается,ферментативно или неферментативно, восстановительно или гидролитически, с открытием анионной группы. Анионная группа может быть этерифицирована радикалами (например, ацилоксиметиловыми сложными эфирами), которые при расщеплении открывают промежуточное соединение, которое впоследствии разрушается с получением активного соединения. В другом воплощении пролекарство представляет собой восстановленную форму сульфата или сульфоната, например, тиол, который окисляетсяin vivo до терапевтического соединения. Более того, анионный радикал может быть этерифицирован до группы, которая активно транспортируется in vivo или которая избирательно потребляется органамимишенями. Сложный эфир может быть отобран для проведения специфического мечения терапевтическим радикалом конкретных сайтов реакции, как описано ниже для радикала носителя. Соединения по настоящему изобретению могут включать растворимые в воде пролекарства, которые описаны в заявке на выдачу патента WO 99/33815, заявке на выдачу международного патентаWO 99/33815 специально включено в этот документ в виде ссылки. Растворимые в воде пролекарства преобразовываются в ходе метаболизма in vivo в активное лекарство, например, посредством катализируемого эстеразой гидролиза. В композициях также могут содержаться смачивающие вещества, эмульгаторы и смазки, такие как лаурилсульфат натрия и стеарат магния, а также красители, антиадгезивные агенты, покрывающие агенты, подсластители, корригенты и отдушки, консерванты и антиоксиданты. Примеры фармацевтически приемлемых антиоксидантов включают водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия,сульфит натрия, и тому подобное; жирорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидроскитолуол (ВНТ), лецитин, пропилгаллат,-токоферол, и тому подобное; и средства-хелаторы металлов, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и тому подобное. Составы по настоящему изобретению включают составы для перорального, назального, местного,чрескожного, трансбуккального, подъязычного, ректального, вагинального и/или парентерального введения. Составы могут быть подходящим образом представлены в виде единичных дозированных форм и могут быть приготовлены в соответствии с любыми способами, известными в фармацевтике. Количество активного ингредиента, которое может быть объединено с материалоносителем для получения разовых дозированных форм, обычно представляет собой количество соединения, оказывающее терапевтический эффект. Как правило, почти в ста процентах случаев, это количество активного ингредиента находится в диапазоне приблизительно от 1 приблизительно до 99%, предпочтительно приблизительно от 5 приблизительно до 70%, более предпочтительно приблизительно от 10 приблизительно до 30%. Способы приготовления данных составов или композиций включают стадию приведения соединения по настоящему изобретению в контакт с носителем и, необязательно, одним или несколькими вспомогательными ингредиентами. В общем, составы получают путем однообразного и однородного приве- 23009368 дения соединения по настоящему изобретению в контакт с жидкими носителями или с мелкодисперсными твердыми носителями, или обоими, а затем, при необходимости, придания продукту формы. Составы по настоящему изобретению, пригодные для перорального введения, могут находиться в форме капсул, крахмальных капсул, пилюль, таблеток, лепешек (применяя ароматизированную основу,обычно сахарозу и аравийскую камедь или трагакант), порошков, гранул, или в виде раствора или суспензии в водной или неводной жидкости, или в виде эмульсии масла в воде или водомасляной эмульсии,или в виде эликсира или сиропа, или в виде пастилок(применяя инертную основу, такую как желатин и глицерин, или сахарозу и аравийскую камедь), и/или в виде жидкости для полоскания рта и тому подобное, каждая из которых содержит заранее определенное количество соединения по настоящему изобретению в качестве активного ингредиента. Соединение по настоящему изобретению могут также вводиться в виде болюса, лекарственной кашки или пасты. В твердых дозированных формах для перорального введения (капсулах, таблетках, пилюлях, драже,порошках, гранулах и тому подобное), активный ингредиент смешивают с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия, или дикальцийфосфат, и/или любыми следующими ингредиентами: наполнителями или сухими разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон и/или аравийская камедь; увлажнителями, такими как глицерин; разрыхляющими средствами, такими как агар-агар, карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия; добавками, замедляющими процесс растворения, такими как парафин; ускорителями всасывания, такими как четвертичные аммониевые соединения; смачивающими веществами, такими как,например, ацетиловый спирт или моностеарат глицерина; абсорбентами, такими как каолин и бентонитовая глина; смазками, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли,лаурилсульфат натрия, и их смесями; и окрашивающими веществами. В случае таблеток, капсул и пилюль, фармацевтические композиции могут также включать забуферивающие вещества. Твердые композиции сходного типа могут также применяться в качестве наполнителей для мягких и твердых желатиновых капсул, с применением таких носителей, как лактоза или молочные сахара, а также полиэтиленгликоли с высокой молекулярной массой и тому подобное. Таблетки могут быть получены путем прессования или формования, необязательно с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки могут быть получены с применением связующего вещества (например, желатина или гидроксипропилметилцеллюлозы), смазки, инертного разбавителя, консерванта, разрыхлителя (например, натрийкрахмалгликолята или поперечносшитой натрийкарбоксиметилцеллюлозы), поверхностно-активного или диспергирующего вещества. Формованные таблетки могут быть получены путем формования в подходящей установке смеси измельченного соединения, смоченного инертным жидким разбавителем. На таблетки и другие твердые дозированные формы фармацевтических композиций по настоящему изобретению, такие как драже, капсулы, пилюли и гранулы, может быть необязательно нанесена бороздка, или они могут быть получены с применением покрытий и оболочек, таких как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области приготовления фармацевтических составов. Они могут также входить в такой состав, который обеспечивает медленное и контролируемое высвобождение применяемого активного ингредиента, например, для обеспечения желаемого профиля высвобождения включают гидроксипропилметилцеллюлозу в различных пропорциях, другие полимерные основы,липосомы и/или микросферы. Они могут быть подвергнуты стерилизации, например, путем фильтрации через задерживающий бактерии фильтр, или путем включения в состав стерилизующих веществ в форме стерильных твердых композиций, которые могут быть растворены в стерильной воде или какой-либо другой стерильной инъекционной среде непосредственно перед применением. Эти композиции могут также необязательно содержать вещества, делающие материал непрозрачным, и могут представлять собой композицию, которая высвобождает активный ингредиент (ингредиенты) только, или главным образом, определенной порцией в желудочно-кишечном тракте, необязательно, замедленным путем. Примеры имплантируемых композиций, которые могут применяться, содержат полимерные вещества и воски. Активный ингредиент может также находиться в микрокапсулированной форме, если подходит, с одним или несколькими описанными выше наполнителями. Жидкие дозированные формы для перорального введения соединений по настоящему изобретению включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активного ингредиента жидкие дозированные формы могут содержать обычно применяемые в данной области техники инертные разбавители, такие как, например, вода и другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт,этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (конкретно, хлопковое, арахисовое, кукурузное, масло из жмыха зародыша кукурузы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и жирнокислые эфиры сорбита, и их смеси. Кроме инертных разбавителей композиции для перорального приема могут также включать адъю- 24009368 ванты, такие как смачивающие вещества, эмульгирующие и суспендирующие вещества, подслащивающие вещества, корригенты, красители, отдушки и консерванты. В дополнение к активному ингредиенту суспензии могут содержать суспендирующие вещества, такие как, например, этоксилированные изостеариловые спирты, полиэтоксиленсорбит и сложные эфиры сорбита, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант и их смеси. Составы для ректального или вагинального введения, содержащие фармацевтические композиции по настоящему изобретению, могут представлять собой суппозитории, которые могут быть получены путем смешивания одного или нескольких соединений по настоящему изобретению с одним или несколькими подходящими не вызывающими раздражения наполнителями или носителями, включая, например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, и которые являются твердыми при комнатной температуре, но жидкими при температуре тела и поэтому могут плавиться в просвете прямой кишки или во влагалище и высвобождать активное соединение. Составы по настоящему изобретению, которые являются пригодными для вагинального введения,также включают пессарии, тампоны, составы в виде кремов, гелей, паст, пен, кремов, содержащие такие известные в данной области техники носители, которые являются подходящими. Дозированные формы для местного или чрескожного введения соединения по настоящему изобретению включают порошки, аэрозоли, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и летучие препараты. Активное соединение может быть смешано в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферными растворами или пропеллентами, которые могут потребоваться. Мази, пасты, кремы и гели могут в дополнение к активному соединению по настоящему изобретению содержать наполнители, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и оксид цинка или их смеси. Порошки и аэрозоли могут в дополнение к соединению по настоящему изобретению содержать наполнители, такие как лактозу, тальк, кремниевую кислоту, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси этих веществ. Аэрозоли могут дополнительно содержать обычные пропелленты, такие как фторхлоруглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан. Пластыри для чрескожного введения обладают дополнительным преимуществом контролируемой доставки соединения по настоящему изобретению в организм. Такие дозированные формы могут быть получены путем растворения или диспергирования соединения в подходящей среде. Для увеличения проникновения соединения через кожу также могут применяться усилители всасывания. Скорость такого проникновения может контролироваться либо путем применения контролирующей скорость проникновения мембраны, либо путем диспергирования активного соединения в полимерной основе или геле. Подходящая буферная система (например, фосфат натрия, ацетат натрия и борат натрия) может быть добавлена для предотвращения сдвига рН в условиях хранения. Фармацевтические композиции по настоящему изобретению, подходящие для парентерального введения, включают одно или несколько соединений по настоящему изобретению в комбинации с одним или несколькими фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями, или стерильными порошками, которые могут быть преобразованы в стерильные инъецируемые растворы или дисперсии непосредственно перед применением, которое могут содержать антиоксиданты, буферы, бактериостатические факторы, растворенные вещества, которые приводят состав в состояние, изотоничное по отношению к крови имеющего показания реципиента, или суспендирующие агенты или загустители. Примеры подходящих водных и неводных носителей, которые могут применяться в фармацевтических композициях по настоящему изобретению, включают воду, этанол, полиолы (такие как глицерин,пропиленгликоль, полиэтиленгликоль и тому подобное), и их подходящие смеси, растительные масла,такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Надлежащая текучесть может поддерживаться, например, путем применения материалов покрытия, таких как лецитин, путем поддержания требуемого размера частиц в случае применения суспензий, и путем применения поверхностно-активных веществ. Указанные композиции могут также содержать адъюванты, такие как консерванты, смачивающие вещества, эмульгирующие агенты и диспергирующие вещества. Профилактика действия микроорганизмов может быть обеспечена путем применения различных противобактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенолсорбиновой кислоты и тому подобное. Также может быть желательным включение в состав композиции обеспечивающих изотоничность веществ, таких как сахара, хлорид натрия, и тому подобное. В дополнение инъецируемая фармацевтическая форма для пролонгированного всасывания может быть получена путем включения в состав веществ, пролонгирующих всасывание, таких как моностеарат алюминия и желатин. В некоторых случаях для пролонгации действия лекарства является желательным замедление вса- 25009368 сывания лекарства при подкожных и внутримышечных инъекциях. Это может быть достигнуто путем применения жидкой суспензии кристаллического или аморфного вещества с плохой растворимостью в воде. Тогда скорость всасывания лекарства зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и формы кристаллов. Альтернативно, замедленное всасывание формы лекарства для парентерального введения может быть достигнуто путем растворения или суспендирования лекарства в несущем масле. Инъецируемые формы с образованием депо лекарства могут быть получены путем образования микрокапсульных матриц соединений по настоящему изобретению в биологически распадающихся полимерах, таких как полилактид-полигликолид. Скоростью высвобождения можно управлять в зависимости от соотношения количества лекарства и полимера и природы конкретно применяемого полимера. Примеры других биологически распадающихся полимеров включают полиортоэфиры и полиангидриды. Инъецируемые формы с образованием депо лекарства могут быть также получены путем заключения лекарства в липосомы или микроэмульсии, совместимые с тканями организма. Препараты по настоящему изобретению могут вводиться перорально, парентерально, местно или ректально. Без сомнения, они вводятся в формах, подходящих для каждого пути введения. Например, их вводят в виде таблеток или капсул, путем инъекции, ингаляции, путем применения лосьона для глаз, мази, суппозиториев и так далее, вводят путем инъекции, инфузии или ингаляции; наносят местно при помощи лосьона или мази и вводят ректально в виде суппозиториев. Предпочтительным является пероральное введение. Используемые в этом документе выражения парентеральное введение и вводят парентерально означают способы введения, отличные от энтерального и местного введения, обычно путем инъекции, и включают без ограничения внутривенную, внутримышечную, внутриартериальную, внутриоболочечную,внутрикапсульную, внутриглазничную, внутрисердечную, интрадермальную, интраперитонеальную,транстрахеальную, подкожную, субэпителиальную, внутрисуставную, субкапсульную, субарахноидальную, интраспинальную и внутригрудинную инъекцию и инфузию. Используемые в этом документе выражения системное введение, вводят системно, периферическое введение и вводят периферически означают такое введение соединения, лекарства или другого вещества, отличное от введения непосредственно в центральную нервную систему, при котором оно попадает в организм больного и поэтому подвергается метаболизму и другим подобным процессам, например подкожное введение. Такие соединения могут вводиться для терапии людям и другим животным посредством любого подходящего пути введения, включая введение перорально, назально, как, например, путем применения аэрозоля, ректально, интравагинально, парентерально, внутригрудинно и местно, как путем применения порошков, мазей или капель, включая трансбуккально и сублигвально. Вне зависимости от выбранного пути введения соединения по настоящему изобретению, которые могут применяться в подходящей гидратированной форме, и/или фармацевтические композиции по настоящему изобретению, заключают в состав фармацевтически приемлемых дозированных форм путем общепринятых способов, известных специалистам в данной области техники. Для того чтобы получить содержание активного ингредиента, при котором эффективно достигается желаемый терапевтический эффект для конкретного пациента, можно варьировать фактическими дозировками активных ингредиентов в фармацевтических композициях по настоящему изобретению, композицией и способом введения, не являющимся токсичным для пациента. Выбранная дозировка будет зависеть от различных факторов, включая активность конкретного применяемого соединения по настоящему изобретению или его сложного эфира, соли или амида, пути введения, времени введения, скорости выведения конкретного применяемого соединения, продолжительности лечения, других лекарств, соединений и/или веществ, применяемых в комбинации с конкретным применяемым соединением, возраста, пола, веса, состояния, общего состояния здоровья и анамнеза подвергаемого лечению больного и похожих факторов, хорошо известных в медицине. Врач или ветеринар, обладающие средней квалификацией в своей области техники, может легко определить и прописать эффективное количество требуемой фармацевтической композиции. Например,врач или ветеринар может начать с дозировки применяемых в фармацевтической композиции соединений по настоящему изобретению меньшей, чем это требуется для достижения терапевтического эффекта,и постепенно увеличивать дозировку до тех пор, пока желаемый эффект не будет достигнут. Обычно подходящей суточной дозой соединения по настоящему изобретению является то количество соединения, которое представляет собой минимальную дозу, эффективно вызывающую терапевтический эффект. Такая эффективная доза обычно зависит от описанных выше факторов. Как правило, при применении с целью достижения у пациента указанных аналгезирующих эффектов внутривенная и подкожная дозировки соединений по настоящему изобретению варьируют приблизительно от 0,0001 приблизительно до 200 мг/кг массы тела в сутки, более предпочтительно приблизительно от 0,01 приблизительно до 150 мг/кг в сутки и еще более предпочтительно приблизительно от 0,2 приблизительно до 140 мг/кг в сутки. При желании эффективная суточная дозировка активного соединения может вводиться в виде двух,- 26009368 трех, четырех, пяти, шести или более субдоз, вводимых в течение суток по отдельности с подходящими интервалами, необязательно, в виде однократных дозированных форм. Несмотря на то, что соединение по настоящему изобретению может быть введено отдельно, соединение предпочтительно вводить в виде фармацевтической композиции. Настоящее изобретение также относится к упакованным фармацевтическим композициям для лечения у млекопитающего ожирения или связанных с ожирением нарушений. Упакованные фармацевтические композиции включают емкость с терапевтически эффективным количеством по крайней мере одного соединения по настоящему изобретению, описанного ниже, и инструкции по применению соединения для лечения у млекопитающего ожирения или связанных с ожирением нарушений. Характерные признаки и другие детали настоящего изобретения будут далее особенно подробно описаны и указаны в формуле изобретения. Следует понимать, что конкретные воплощения настоящего изобретения представлены с целью иллюстрации, а не в качестве ограничений настоящего изобретения. Принципиальные признаки настоящего изобретения могут быть использованы в различных воплощениях без отступления от объема настоящего изобретения. Настоящее изобретение дополнительно проиллюстрировано последующими примерами, которые ни в коем случае не должны истолковываться как дополнительно ограничивающие. Содержание всех ссылок, заявок на выдачу патента, находящихся на рассмотрении, и опубликованных заявок на выдачу патента, цитируемых на всем протяжении настоящей заявки, включая приведенных в качестве ссылок в описании предпосылок создания настоящего изобретения, включены, таким образом, в этот документ в качестве ссылки. Следует понимать, что модели, применяемые на всем протяжении примеров настоящего изобретения, являются принятыми моделями и что демонстрация эффективности этих моделей предсказывает их эффективность у людей. Настоящее изобретение станет более понятно из последующего раздела Подробности экспериментов. Однако специалист в данной области техники должен с готовностью принимать во внимание, что конкретные обсуждаемые способы и результаты являются просто иллюстрациями настоящего изобретения, как описано более полно в следующей за ними формуле изобретения. Соединения в примерах обозначены целыми числами, если соединение встречается в приведенной выше таблице, и как X.Y, где X представляет собой номер примера, a Y представляет собой индекс, начиная с 1 в каждом примере, если они не указаны в приведенной выше таблице. Подробности экспериментов Все реакции, проводимые в неводной среде, требующие безводных условий, проводили при положительном давлении азота (N2) в просушенной в печи посуде, охлажденной в атмосфере N2. Все растворители для безводных реакций приобретали у Aldrich. Удаление растворителей означает выпаривание в вакууме с помощью роторного испарителя с последующим вакуумированием до постоянной массы образца (0,1 мм рт.ст.). Растворители для хроматографии имели степень чистоты ВЭЖХ. Все реагенты имели степень чистоты, предписанную Американским химическим обществом (ACS), или выше. Чувствительные к воздуху реагенты хранили в атмосфере сухого N2. По возможности после всех реакций проводили тонкослойную хроматографию (ТСХ) и визуализировали с использованием УФ флуоресценции, окрашивания 3% KMnO4 (водным) и/или додекамолибдофосфорной кислотой. Коммерческие планшеты для тонкослойной и препаративной хроматографии представляли собой, соответственно, Si250F и Si500F от J.T. Baker. Флэш-хроматографию проводили с использованием 40 мкм 'Baker' силикагеля от J.T. Baker. Все смеси растворителей указаны в соотношении по объему. Точки плавления представлены неоткорректированными и определены на аппарате Mel-Temp II(Laboratory Devices, USA) с использованием открытых капиллярных трубок. Масс-спектры (MS) регистрировали с помощью прибора Platform 2 Micromass. Спектры ядерного магнитного резонанса (ЯМР) регистрировали с помощью прибора Varian 200 в указанном растворителе с использованием тетраметилсилана (TMS) в качестве внутреннего стандарта для 1 Н-ЯМР. Для спектров 13 С-ЯМР пик дейтерированного растворителя использовали в качестве контроля его положения относительно TMS. Методы LCMS: Метод А = метод LC1; Метод В = полярный метод; Метод С = метод PolarShort; Метод D = StrongNonpolar. Общая методика. Амиды/сложные эфиры. а. Путь А. Аминотиофен синтезировали, используя известную методику (McKibben, В.P., Cartwell,C.H., Castelhano, A.L. Tetrahedron Lett. 1999, 40, 5471-5474). Амидная защита трифторуксусным ангидридом с последующими снятием защиты ТФУ и обработкой карбонатом натрия позволяли получить аминокислоту. Попытки снятия защиты ТФУ без амидной защиты приводят к декарбоксилированию. Проводили реакции аминокислоты с различными хлорангидридами кислот и хлорформиатами с получением умеренных выходов тиеноксазинонов (схема 1).b. Путь В. Обычно взаимодействие защищенной трет-Bu аминокислоты непосредственно с хлорформиатом или изоцианатом с последующим снятием с помощью ТФУ защиты с трет-Bu эфира и обработка тионилхлоридом позволяют получить соответствующие тиеноксазиноны с более высокими выходами (схема 2). Схема 2 Получение производных по 5 положению осуществляли либо путем переэтерификации метилацетоацетата различными спиртами перед образованием тиофена, либо путем снятия бензильной защиты со сложного диэфира с последующим связыванием EDC с различными спиртами и аминами с получением сложных эфиров и амидов соответственно. Пример 1. Общая методика получения аминотиофенов.(1.1). К суспензии бензилацетоацетата (20,0 г, 104,1 ммоль), трет-бутилцианоацетата (14,7 г, 104,1 ммоль), серы (3,5 г, 109,3 ммоль) и пиридина (120 мл) по каплям добавляли диэтиламин. Через 2 суток черный раствор концентрировали в условиях пониженного давления, растворяли в Et2O и фильтровали через силикагель. Элюент затем концентрировали. Хроматография (силикагель, 7:1 гексан/EtOAc) позволяла получить 25,58 г (71%) оранжевого масла, которое медленно кристаллизовалось при стоянии: 1 Н ЯМР (CDCl3) 1,58 (с, 9 Н), 2,70 (с, 3H), 5,27 (с, 2 Н), 7,38 (м, 5 Н). Данные 1 Н-ЯМР соответствовали опубликованным сведениям.(1.2). Использовали тот же способ, что и для получения 4-трет-бутилового эфира 2-бензилового эфира 5 амино-3-метилтиофен-2,4-дикарбоновой кислоты. Так, циклизация трет-бутилцианоацетата (10,3 мл, 72,0 ммоль), гептилацетоацетата (13,7 г, 68,0 ммоль) и серы (4,4 г, 0,14 моль) в пиридине (80 мл) с добавленным диэтиламином (7,1 мл, 68,0 ммоль) позволяла получить 18,4 г тиофена (76%) в виде масла после колоночной хроматографии (10:1; гексан: EtOAc): 1 Н ЯМР (CDCl3)6,47 (ушир.с, 2 Н), 4,19 (т, 2 Н, J=6,6 Гц), 2,67 (с, 3H), 1,80-1,50 (м, 2 Н), 1,57 (с, 9 Н), 1,30 (ушир.с, 8 Н), 0,89 (т, 3H, J=6,6 Гц). 4-трет-Бутиловый эфир 2-октиловый эфир 5-амино-3-метилтиофен-2,4-дикарбоновой кислоты (1.3). Использовали тот же способ, что и для получения 4-трет-бутилового эфира 2-бензилового эфира 5 амино-3-метилтиофен-2,4-дикарбоновой кислоты. Так, циклизация трет-бутилцианоацетата (6,2 мл, 43,0 ммоль), октилацетоацетата (8,5 г, 41,0 ммоль) и серы (2,6 г, 82,0 ммоль) в пиридине (50 мл) с добавленным диэтиламином (4,3 мл, 41,0 ммоль) позволяла получить 10,3 г тиофена (68%) в виде масла после колоночной хроматографии (10:1; гексан:EtOAc): 1 Н ЯМР (CDCl3)6,63 (с, 2 Н), 4,14 (т, 2 Н, J=6,6 Гц),2,63 (с, 3H), 1,72-1,50 (м, 2 Н), 1,52 (с, 9 Н), 1,22 (ушир.с, 10 Н), 0,83 (т, 3H, J=6,8 Гц), 13 С ЯМР (CDCl3)165,9, 165,4, 163,0, 147,9, 109,6, 108,0, 81,0, 64,4, 31,7, 29,1, 28,6, 28,4, 25,9, 22,5, 16,2, 14,0. Пример 2. Общая методика циклизации из хлорформиата и аминокислоты. Бензиловый эфир 2-додецилокси-5-метил-4-оксо-4 Н-тиено[2,3-d][1,3]оксазин-6-карбоновой кислоты (6). К перемешиваемому раствору 2-бензилового эфира 5-амино-3-метилтиофен-2,4-дикарбоновой кислоты (1,00 г, 3,43 ммоль) в пиридине (20 мл) добавляли додецилхлорформиат (2,80 мл, 2,56 г, 10,3 моль). Реакционную смесь перемешивали при 0 С в течение 0,5 ч, затем растворитель удаляли в условиях пониженного давления. Продукт очищали по методу колоночной хроматографии (10:1; гексан:EtOAc) с получением 169 мг (10%) твердого вещества: 1 Н ЯМР (CDCl3)7,50-7,25 (м, 5 Н), 5,35 (с, 2 Н), 4,17 (т,2 Н, J=6,6 Гц), 2,87 (с, 3H), 1,70-1,40 (м, 2 Н), 1,40-1,00 (м, 18 Н), 0,88 (т, 3H, J=6,4 Гц), МС (ЭИ): 486,4(5). Использовали тот же способ, что и для получения бензилового эфира 2-додецилокси-5-метил-4-оксо 4 Н-тиено[2,3-d][1,3]оксазин-6-карбоновой кислоты: 1 Н ЯМР (CDCl3)7,53-7,25 (м, 5 Н), 5,33 (с, 2 Н), 4,44 Бензиловый эфир 2-гексадецилокси-5-метил-4-оксо-4 Н-тиено[2,3-d][1,3]оксазин-6-карбоновой кислоты (7). Использовали тот же способ, что и для получения бензилового эфира 2-додецилокси-5-метил 4-оксо-4 Н-тиено[2,3-d][1,3]оксазин-6-карбсновой кислоты: 1 Н ЯМР (CDCl3)7,50-7,25 (м, 5 Н), 5,34 (с,2 Н), 4,44 (т, 2 Н, J=6,6 Гц), 2,83 (с, 3H), 1,80 (квинт., 2 Н, J=6,6 Гц), 1,26 (ушир.с, 26 Н), 0,88 (т, 3H, J=6,6 Гц). Пример 3. Общая методика циклизации из ацилхлорида и аминокислоты.(200 мг, 0,69 ммоль)в пиридине (5 мл) добавляли октаноилхлорид (352 мкл, 2,56 г, 10,3 ммоль). Реакционную смесь перемешивали при 0 С в течение 0,5 ч, затем ей давали нагреться до комнатной температуры и перемешивали в течение 3,5 ч. Растворитель удаляли в условиях пониженного давления. Смесь разбавляли EtOAc, промывали H2O. Органическую фракцию сушили (MgSO4) и концентрировали в вакууме. Продукт очищали по методу колоночной хроматографии (9:1; гексан:EtOAc) с получением 48 мг (18%) твердого вещества: 1 Н ЯМР (CDCl3)7,32-7,48 (м, 5 Н), 5,35 (с, 2 Н), 2,86 (с, 3H), 2,69 (т, 2 Н, J=7,2 Гц),1,90-1,70 (м, 2 Н), 1,45-1,20 (м, 8 Н), 0,98-0,80 (м, 3H).(3). Использовали тот же способ, что и для получения бензилового эфира 2-гептил-5-метил-4-оксо-4 Нтиено[2,3-d][1,3]оксазин-6-карбоновой кислоты. Так, циклизация с гексадеканоилхлоридом (476 мкл,2,06 ммоль) позволяла получить 56 мг продукта (16%) в виде масла после колоночной хроматографии Бензиловый эфир 2-ундецил-5-метил-4-оксо-4 Н-тиено[2,3-d][1,3]оксазин-6-карбоновой кислоты (2). Использовали тот же способ, что и для получения бензилового эфира 2-гептил-5-метил-4-оксо-4 Нтиено[2,3-d][1,3]оксазин-6-карбоновой кислоты. Так, циклизация с додеканоилхлоридом (476 мкл, 2,06 ммоль)позволяла получить 77 мг продукта (24%) в виде масла после колоночной хроматографии (9:1; гексан:EtOAc): 1 Н ЯМР (CDCl3)7,30-7,50 (м, 5 Н), 5,35 (с, 2 Н), 2,86 (с, 3H), 2,69 (т, 2 Н, J=7,2 Гц), 1,901,70 (м, 2 Н), 1,50-1,20 (м, 16 Н), 1,00-0,90 (м, 3H). Пример 4. Общая методика ацилирования сложного диэфира хлорформиатом. 4-трет-Бутиловый эфир 2-бензилового эфира 3-метоксиметил-5-октилоксикарбониламинотиофен 2,4-дикарбоновой кислоты (4.1). К перемешиваемому раствору 4-трет-бутилового эфира 2-бензилового эфира 5-амино-3-метоксиметилтиофен-2,4-дикарбоновой кислоты (1,16 г, 3,06 ммоль) в пиридине (15 мл)добавляли октилхлорформиат (0,9 мл, 886 мг, 4,6 ммоль). Реакционную смесь перемешивали при 0 С в течение 1 ч, затем растворитель удаляли в условиях пониженного давления. Продукт очищали по методу колоночной хроматографии (10:1; гексан:EtOAc) с получением 1,27 г (78%) твердого вещества: 1 Н ЯМР (CDCl3)10,51 (с, 1 Н), 7,32 (м, 5 Н), 5,12 (с, 2 Н), 4,19 (т, 2 Н, J=6,6 Гц), 3,81 (с, 3H), 3,76 (с, 2 Н), 1,68 4-трет-Бутиловый эфир 2-октилового эфира 3-метил-5-октилоксикарбониламинотиофен-2,4 дикарбоновой кислоты (4.2). Использовали тот же способ, что и для получения 4-трет-бутилового эфира 2-бензилового эфира 3-метоксиметил-5-октилоксикарбониламинотиофен-2,4-дикарбоновой кислоты. Так, ацилирование октилхлорформиатом (0,171 мл, 168 мг, 0,87 ммоль)позволяла получить 80 мг твердого вещества (26%) после колоночной хроматографии (9:1; гексан: EtOAc): 1 Н ЯМР (CDCl3)10,86 (с,1 Н), 4,23 (т, 2 Н, J=6,6 Гц), 2,67 (с, 3H), 1,80-1,40 (м, 4 Н), 1,57 (с, 9 Н), 1,42-1,08 (м, 20 Н), 0,89 (т, 3H, J=6,6 Гц). МС (ЭИ): 526,0 (m+). 2-Гептиловый эфир 4-трет-бутилового эфира 3-метил-5-гептилоксикарбониламинотиофен-2,4 дикарбоновой кислоты (4.3). К перемешиваемому раствору 4-трет-бутилового эфира 2-гептилового эфира 5-амино-3-метилтиофен-2,4-дикарбоновой кислоты (5,0 г, 14,0 ммоль) и DBU (5,3 мл, 5,4 г, 35,0 ммоль) в CH2Cl2 (100 мл) добавляли гептилхлорформиат (5,0 мл, 5,0 г, 28,0 моль). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч, затем растворитель удаляли в условиях пониженного давления. Продукт очищали по методу колоночной хроматографии (9:1; гексан:EtOAc) с получением 3,1 г (45%)твердого вещества: 1 Н ЯМР (CDCl3)10,86 (с, 1 Н), 4,23 (т, 2 Н, J=6,6 Гц), 2,67 (с, 3H),- 30
МПК / Метки
МПК: C07D 265/12, A61K 31/5365, C07D 279/08, A61P 3/10, A61P 3/04, A61K 31/542, A61P 3/06
Метки: железы, соединения-ингибиторы, липазы, поджелудочной, применение, синтез
Код ссылки
<a href="https://eas.patents.su/30-9368-soedineniya-ingibitory-lipazy-podzheludochnojj-zhelezy-ih-sintez-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения-ингибиторы липазы поджелудочной железы, их синтез и применение</a>
Предыдущий патент: Производные 5-тиа-5-диоксо-4b-азаиндено[2,1-a]индена, обладающие аффинностью к рецептору серотонина
Следующий патент: Производные гидроксизамещенного 1,3,8-триазинспиро[4,5]декан-4-она, полезные для лечения расстройств, опосредованных orl-рецептором
Случайный патент: Новый способ получения рофлумиласта