Замещенные производные 1-пиперидин-4-ил-4-пирролидин-3-илпиперазина и их применение в качестве антагонистов нейрокининов
Номер патента: 9078
Опубликовано: 26.10.2007
Авторы: Соммен Франсуа Мария, Ленартс Йозеф Элизабет, Янссенс Франс Эдуард, Де Бук Бенуа Кристиан Альберт Гилейн
Формула / Реферат
1. Соединение общей формулы (I)
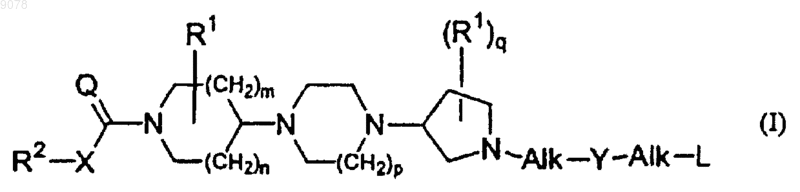
где n и m каждый равен 1;
р представляет собой целое число, равное 1 или 2;
q представляет собой целое число, равное 0 или 1;
Q представляет собой О или NR3;
X представляет собой ковалентную связь;
каждый R3 независимо друг от друга представляет собой водород или алкил;
каждый R1 независимо друг от друга выбирают из группы, состоящей из Ar1, Ar1-алкила и ди(Ar1)алкила;
R2 представляет собой Ar2, Ar2-алкил, ди(Ar2)алкил, Het1 или Het1-алкил;
Y представляет собой ковалентную связь или двухвалентный радикал формулы -С(=O)-, -SO2-, >C=CH-R или >C=N-R, где R представляет собой Н, CN или нитро;
каждый Alk представляет независимо друг от друга ковалентную связь; двухвалентный линейный или разветвленный насыщенный или ненасыщенный углеводородный радикал с 1-6 атомами углерода или циклический насыщенный или ненасыщенный углеводородный радикал с 3-6 атомами углерода; каждый радикал, необязательно, замещен по одному или нескольким атомам углерода одним или несколькими фенильными, галогено-, циано-, гидрокси-, формильными и аминорадикалами;
L выбирают из группы, состоящей из водорода, алкила, алкилокси, алкилоксиалкилокси, алкилкарбонилокси, алкилоксикарбонила, моно- и ди(алкил)амино, моно- и ди(алкилоксикарбонил)амино, моно- и ди(алкилкарбонил)амино, моно- и ди(Ar3)амино, моно- и ди(Ar3-алкил)амино, моно- и ди(Het2)амино, моно- и ди(Het2-алкил)амино, алкилсульфанила, адамантила, Ar3, Ar3-окси, Ar3-карбонила, Het2, Het-окси и Het2-карбонила;
Ar1 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбирают из группы, состоящей из галогена, алкила, циано, аминокарбонила и алкилокси;
Ar2 представляет собой нафталинил или фенил, необязательно замещенный каждый 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбирают из группы, состоящей из галогена, нитро, амино, моно- и ди(алкил)амино, циано, алкила, гидрокси, алкилокси, карбоксила, алкилоксикарбонила, аминокарбонила и моно- и ди(алкил)аминокарбонила;
Ar3 представляет собой нафталинил или фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбирают из группы, состоящей из алкилокси, Ar1-карбонилоксиалкила, Ar1-алкилоксикарбонила, Ar1-алкилоксиалкила, алкила, галогена, гидрокси, пиридинила, морфолинила, пирролидинила, имидазо[1,2-а]пиридинила, морфолинилкарбонила, пирролидинилкарбонила, амино и циано;
Het1 представляет собой моноциклический гетероциклический радикал, выбранный из группы, состоящей из пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклический гетероциклический радикал, выбранный из группы, состоящей из хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила, бензотиенила, инданила и хроменила; каждый гетероциклический радикал может быть, необязательно, замещен по любому атому одним или несколькими радикалами, выбранными из группы, состоящей из галогена, оксо и алкила;
Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, состоящей из пирролидинила, диоксолила, имидазолидинила, пиразолидинила, пиперидинила, морфолинила, дитианила, тиоморфолинила, пиперазинила, тетрагидрофуранила, 2Н-пирролила, пирролинила, имидазолинила, пиразолинила, пирролила, имидазолила, пиразолила, тиазолила, фуранила, тиенила, оксазолила, диоксазолила, оксазолидинила, изоксазолила, тиазолила, тиадиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила, пиридазинила и триазинила;
или бициклический гетероциклический радикал, выбранный из группы, состоящей из 2,3-дигидробензо[1,4]диоксина, октагидробензо[1,4]диоксина, бензопиперидинила, хинолинила, хиноксалинила, индолила, изоиндолила, хроманила, бензимидазолила, имидазо[1,2-а]пиридинила, бензоксаэолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила или бензотиенила;
или трициклический гетероциклический радикал 8,9-дигидро-4Н-1-окса-3,5,7а-триазациклопента [f] азуленил; каждый радикал может быть, необязательно, замещен одним или несколькими радикалами, выбранными из группы, состоящей из Ar1, Ar1-алкила, Ar1-алкилоксиалкила, галогена, гидрокси, алкила, пиперидинила, пирролила, тиенила, оксо, алкилокси, алкилкарбонила, Ar1-карбонила, моно- и ди(алкил)аминоалкила, алкилоксиалкила и алкилоксикарбонила;
алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал с 1-6 атомами углерода или циклический насыщенный углеводородный радикал с 3-6 атомами углерода, необязательно замещенный по одному или нескольким атомам углерода одним или несколькими радикалами, выбранными из группы, состоящей из фенила, галогена, циано, оксо, гидрокси, формила и амино;
его фармацевтически приемлемые соли присоединения кислот или оснований, его стереохимически изомерные формы, его N-оксид и пролекарство.
2. Соединение по п.1, где
n представляет собой целое число, равное 1;
m представляет собой целое число, равное 1;
р представляет собой целое число, равное 1 или 2;
q представляет собой целое число, равное 0;
Q представляет собой О;
X представляет собой ковалентную связь;
R1 представляет собой Ar1-алкил;
R2 представляет собой Ar2, Ar2-алкил, ди(Ar2)алкил или Het1;
Y представляет собой ковалентную связь или двухвалентный радикал формулы -С(=O)-, -SO2-, >C=CH-R или >C=N-R, где R представляет собой CN или нитро;
каждый Alk представляет независимо друг от друга ковалентную связь; двухвалентный линейный или разветвленный насыщенный углеводородный радикал с 1-6 атомами углерода или циклический насыщенный углеводородный радикал с 3-6 атомами углерода; каждый радикал, необязательно, замещен по одному или нескольким атомам углерода одним или несколькими фенильными, галогено- и гидроксирадикалами;
L выбирают из группы, состоящей из водорода, алкила, алкилокси, алкилоксиалкилокси, алкилкарбонилокси, моно- и ди(алкил)амино, моно- и ди(алкилоксикарбонил)амино, моно- и ди(алкилкарбонил)амино, моно- и ди(Ar3)амино, моно- и ди(Ar3-алкил)амино, моно- и ди(Het2-алкил)амино, алкилсульфанила, адамантила, Ar3, Het2 и Het2-карбонила;
Ar1 представляет собой фенил, необязательно замещенный 1 или 2 галогенорадикалами;
Ar2 представляет собой нафталинил или фенил, необязательно замещенный каждый 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбирают из группы, состоящей из галогена, алкила и алкилокси;
Ar3 представляет собой нафталинил или фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбирают из группы, состоящей из алкилокси, Ar1-алкилоксикарбонила, Ar1-алкилоксиалкила, алкила, галогена и циано;
Het1 представляет собой пиридинил или бициклический гетероциклический радикал, выбранный из группы, состоящей из хиноксалинила, индолила, бензотиенила, инданила и хроменила; каждый гетероциклический радикал может быть, необязательно, замещен по любому атому одним или несколькими радикалами, выбранными из группы, состоящей из оксо и алкила;
Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, состоящей из пирролидинила, диоксолиыр, пиперидинила, морфолинила, пиперазинила, тетрагидрофуранила, пирролила, имидазолила, пиразолила, фуранила, тиенила, диоксазолила, оксазолидинила, изоксазолила, тиазолила, тиадиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила;
или бициклический гетероциклический радикал, выбранный из группы, состоящей из 2,3-дигидробензо[1,4]диоксина, октагидробензо[1,4]диоксина, хиноксалинила, индолила, хроманила, бензимидазолила, имидазо[1,2-а]пиридинила, бензизоксазолила, бензотиазолила, бензофуранила и бензотиенила;
или трициклический гетероциклический радикал 8,9-дигидро-4Н-1-окса-3,5,7а-триазациклопента-[f]азуленил; каждый радикал может быть, необязательно, замещен одним или несколькими радикалами, выбранными из группы, состоящей из Ar1, Ar1-алкилоксиалкила, галогена, алкила, оксо, алкилокси, алкилкарбонила, Ar1-карбонила, моно- и ди(алкил)аминоалкила, алкилоксиалкила и алкилоксикарбонила;
алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал с 1-6 атомами углерода или циклический насыщенный углеводородный радикал с 3-6 атомами углерода, необязательно замещенный по одному или нескольким атомам углерода одним или несколькими радикалами, выбранными из группы, состоящей из фенила, галогена и гидрокси.
3. Соединение по любому из пп.1, 2, отличающееся тем, что R1 представляет собой Ar1-метил и присоединяется в положении 2 или R1 представляет собой Ar1 и присоединяется в положении 3.
4. Соединение по любому из пп.1-3, отличающееся тем, что группа R2-X-C(=Q)- представляет собой 3,5-ди(трифторметил)фенилкарбонил.
5. Соединение по любому из пп.1-4, отличающееся тем, что р равен 1.
6. Соединение по любому из пп.1-5, отличающееся тем, что Y представляет собой -С(=O)-.
7. Соединение по любому из пп.1-6, отличающееся тем, что Аlk представляет собой ковалентную связь.
8. Соединение по любому из пп.1-3, отличающееся тем, что L представляет собой Het2.
9. Соединение, выбранное из группы соединений, представляющих собой соединения:
(4) [2R-транс]-{2-бензил-4-[4-(1-пиразин-2-ил-пирролидин-3-ил)пиперазин-1-ил]пиперидин-1-ил}-(3,5-бис-трифторметилфенил)метанон,
(306) [2R-[2a,4b(S)]]-1-(3-{4-[2-бензил-1-(3,5-бис-трифторметилбензоил)пиперидин-4-ил]пиперазин-1-ил}пирролидин-1-ил)-2,2-диметилпропан-1-он,
(71) [2R-[2a,4b(S*)]-{2-бензил-4-[4-(1-циклопропанкарбонилпирролидин-3-ил)пиперазин-1-ил]-пиперидин-1-ил}-(3,5-бис-трифторметилфенил)метанон,
(72) [2R-транс]энантиомер, [2R-[2a,4b(S*)]-{2-бензил-4-[4-(1-циклопропанкарбонилпирролидин-3-ил)пиперазин-1-ил]пиперидин-1-ил}-(3,5-бис-трифторметилфенил)метанона,
(31) 2R-транс-(2-бензил-4-{4-[1-(тетрагидрофуран-3-карбонил)пирролидин-3-ил]пиперазин-1-ил}-пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон,
(219) ([2R-[2a,4b(R(R))]]-энантиомер,2R-транс-(2-бензил-4-{4-[1-(тетрагидрофуран-3-карбонил)-пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон,
(218) [2R-[2a,4b(S(R))]]-энантиомер,2R-транс-(2-бензил-4-{4-[1-(тетрагидрофуран-3-карбонил)-пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанона,
(32) [2R-транс,R*]-(2-бензил-4-{4-[1-(фуран-3-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон,
(321) [2R-[2a,4b(R)]]-(2-бензил-4-{4-[1-(5-метилтиофен-2-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил]-(3,5-бис-трифторметилфенил)метанон,
(308) [2R-транс]-(2-бензил-4-{4-[1-(3-гидроксиметилтиофен-2-сульфонил)пирролидин-3-ил]пиперазин-1-ил}-пиперидин-1-ил)-(3,5-бис-трифторметилфенил)метанон,
(393) [2R-[2a,4b(S)]]-(3,5-бис-трифторметилфенил)-(2-(3,4-дихлорбензил)-4-{4-[1-(4-гидрокси-бутил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(313) [(2R-транс),(S)]-1-(3-{4-[1-(3,5-бис-трифторметилбензоил)-2-(3,4-дихлорбензил)пиперидин-4-ил]пиперазин-1-ил}пирролидин-1-ил)-2,2-диметилпропан-1-он,
(164) транс-(3,5-бис-трифторметилфенил)-[4-{4-[1-(2-хлорбензоил)пирролидин-3-ил]пиперазин-1-ил}-2-(3,4-дихлорбензил)пиперидин-1-ил]метанон,
(318) [(2R-транс),(S)]-(3,5-бис-трифторметилфенил)-(2-(3,4-дихлорбензил)-4-{4-[1-(тиофен-2-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(287) [(2R-транс),(R)]-(3,5-бис-трифторметилфенил)-(2-(3,4-дихлорбензил)-4-{4-[1-(тиофен-3-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(267) [(2R-транс),(R)]-(3,5-бис-трифторметилфенил)-(2-(3,4-дихлорбензил)-4-{4-[1-(фуран-2-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(317) [(2R-транс),(S)]энантиомер,[(2R-транс),(R)]-(3,5-бис-трифторметилфенил)-(2-(3,4-дихлор-бензил)-4-{4-[1-(фуран-2-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанона,
(331) [(2R-транс),(S),(R)]-(3,5-бис-трифторметилфенил)-(2-(3,4-дихлорбензил)-4-{4-[1-(тетрагидро-фуран-3-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(286) [(2R-транс),(R)]-(3,5-бис-трифторметилфенил)-(2-(3,4-дихлорбензил)-4-{4-[1-(пиразин-2-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(366) [2R-[2a,4b(R*)]]-(3,5-бис-трифторметилфенил)-(2-(3,4-дифторбензил)-4-{4-[1-(1-метил-1Н-пиррол-2-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(269) [2R-[2a,4b(R*(S*))]]-(3,5-бис-трифторметилфенил)-(2-(3,4-дифторбензил)-4-{4-[1-(тетрагидрофуран-3-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(281) [2R-[2a,4b(S*(S*))]]энантиомер,[2R-[2a,4b(R*(S*))]]-(3,5-бис-трифторметилфенил)-(2-(3,4-дифторбензил)-4-{4-[1-(тетрагидрофуран-3-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанона,
(285) [2R-[2a,4b(S*(R*))]]энантиомер,[2R-[2a,4b(R*(S*))]]-(3,5-бис-трифторметилфенил)-(2-(3,4-дифторбензил)-4-{4-[1-(тетрагидрофуран-3-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанона,
(270) [2R-[2a,4b(R*(R*))]]энантиомер,[2R-[2a,4b(R*(S*))]]-(3,5-бис-трифторметилфенил)-(2-(3,4-дифторбензил)-4-{4-[1-(тетрагидрофуран-3-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанона,
(258) [2R-[2a,4b(S*)]]-(3,5-бис-трифторметилфенил)-(2-(3,4-дифторбензил)-4-{4-[1-(фуран-3-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(259) [2R-[2a,4b(S*)]]-(3,5-бис-трифторметилфенил)-(2-(3,4-дифторбензил)-4-{4-[1-(пиразин-2-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(253) [2R-[2a,4b(S*)]]-(3,5-бис-трифторметилфенил)-(2-(3,4-дифторбензил)-4-{4-[1-(4-метил-[1,2,3]-тиадиазол-5-карбонил)пирролидин-3-ил]пиперазин-1-ил}пиперидин-1-ил)метанон,
(408) цис-(3,5-бис-трифторметилфенил)-(3-фенил-4-{4-[1-(тиофен-2-карбонил)пирролидин-3-ил]-пиперазин-1-ил}пиперидин-1-ил)метанон.
10. Применение соединения по любому из пп.1-9 для получения лечебного средства для лечения состояний, опосредуемых тахикининрьш.
11. Применение соединения по любому из пп.1-9 для получения лечебного средства для лечения шизофрении, рвоты, тревоги, депрессии, синдрома раздраженной толстой кишки (IBS), нарушений циркадного ритма, боли, нейрогенного воспаления, астмы, расстройств мочеиспускания, таких как недержание мочи, и ноцицепции.
12. Фармацевтическая композиция, обладающая антагонистической активностью в отношении нейрокининов, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-9.
13. Способ получения фармацевтической композиции по п.12, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-9.
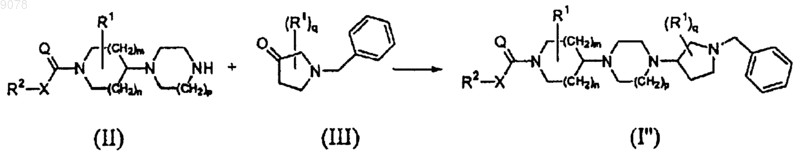
14. Способ получения соединения формулы (I"), включающий взаимодействие промежуточного соединения формулы (II) с промежуточным соединением формулы (III), где радикалы R2, X, Q, R1, m, n, p и q имеют значения, указанные в п.1
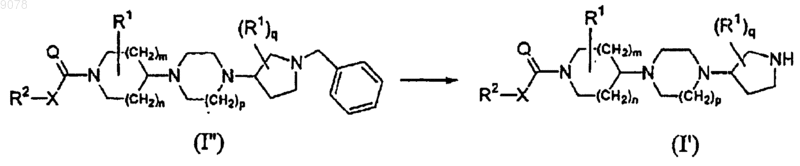
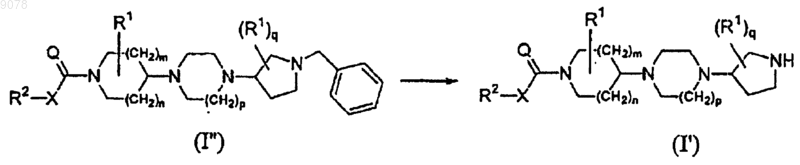
15. Способ получения соединения формулы (I'), включающий восстановительное гидрирование соединения формулы (I"), где радикалы R2, X, Q, R1, m, n, p и q имеют значения, указанные в п.1
16. Способ получения соединения формулы (I'), включающий следующие последовательные стадии:
взаимодействие промежуточного соединения формулы (II) с промежуточным соединением формулы (III), где радикалы R2, X, Q, R1, m, n, p и q имеют значения, указанные в п.1, с получением соединения I''
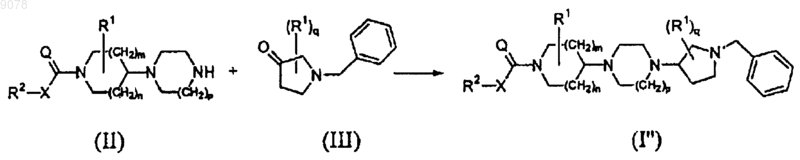
и последующее восстановительное гидрирование соединения формулы (I"), где радикалы R2, X, Q, R1, m, n, p и q имеют значения, указанные в п.1
Текст
009078 Данное изобретение относится к замещенным производным 1-пиперидин-4-ил-4-пирролидин-3 илпиперазина, обладающим антагонистической активностью в отношении нейрокининов, в частности антагонистической активностью в отношении NK1, комбинированной антагонистической активностью в отношении NK1/NK3 и комбинированной антагонистической активностью в отношении NK1/NK2/NK3, их получению, композициям, содержащим их, и к их применению в качестве лечебного средства, в частности, для лечения шизофрении, рвоты, тревоги и депрессии, синдрома раздраженной толстой кишки (IBS),нарушений циркадного ритма, висцеральной боли, нейрогенного воспаления, астмы, расстройств мочеиспускания, таких как недержание мочи, и ноцицепции. Тахикинины принадлежат к семейству коротких пептидов, которые широко распространены в центральной и периферической нервной системе млекопитающих (Bertrand and Geppetti, Trends Pharmacol.Sci., 17:255-259 (1996); Lundberg, Can. J. Physiol. Pharmacol., 73:908-914 (1995); Maggi, Gen. Pharmacol.,26:911-944 (1995); Regoli et al., Pharmacol. Rev., 46 (1994. Они содержат обычную С-концевую последовательность Phe-Xaa-Gly-Leu-Met-NH2. Полагают, что тахикинины, высвобожденные из периферических чувствительных нервных окончаний, вовлекаются в нейрогенное воспаление. В спинном мозге/центральной нервной системе тахикинины могут играть некую роль в переносе/перцепции боли и в некоторых автономных рефлексах и поведенческих реакциях. Тремя основными тахикининами являются вещество Р (SP), нейрокинин A (NKA) и нейрокинин В (NKB) с преимущественной аффинностью к трем различным подтипам нейрокининовых рецепторов, называемых NK1, NK2 и NK3 соответственно. Однако функциональные исследования на клонированных рецепторах приводят к мысли о сильном функциональном перекрестном взаимодействии между 3 тахикининами и их соответствующими нейрокининовыми рецепторами (Maggi and Schwartz, Trends Pharmacol. Sci., 18:351-355 (1997. Видовые различия в структуре рецепторов NK1 ответственны за связанные с видом различия в силе антагонистов NK1 (Maggi, Gen. Pharmacol., 16:911-944 (1995); Regoli et al., Pharmacol. Rev., 46(4):551-599(1994. Человеческий рецептор NK1 весьма напоминает рецептор NK1 морских свинок и песчанок, но заметно отличается от рецептора NK1 грызунов. Разработка антагонистов нейрокининов привела в результате к ряду пептидов, которые, как можно ожидать, метаболически слишком лабильны, чтобы использовать их в качестве фармацевтически активных веществ (Longmore J. et al., DNP, 8(l):5-23 (1995. Тахикинины учтвуют в шизофрении, депрессии, состояниях тревоги (связанных со стрессом), рвоте, воспалительных реакциях, сокращении гладких мышц и болевой перцепции. Антагонисты нейрокининов разрабатываются для таких показаний, как рвота, тревога и депрессия, синдром раздраженной толстой кишки (IBS), нарушения циркадного ритма, висцеральная боль, нейрогенное воспаление, астма,расстройства мочеиспускания и ноцицепция. В частности, антагонисты NK1 имеют высокий терапевтический потенциал при лечении рвоты и депрессии, а антагонисты NK2 - при лечении астмы. Оказывается,что антагонисты NK3 играют некую роль при лечении боли/воспаления (Giardina G. et al., Exp. Opin. Ther.Patents, 10(6):939-960 (2000 и шизофрении. Шизофрения. Недавно показано, что антагонист NK3 SR142801 (Sanofi) обладает антипсихотической активностью для больных шизофрении, без воздействия на отрицательные симптомы (Arvantis L., ACNP Meeting, December 2001). Активация рецепторов NK1 вызывает тревогу, стрессовые события повышают содержание вещества Р (SP) в плазме, и сообщается, что антагонисты NK1 являются анксиолитиками на некоторых животных моделях. Антагонист NK1 от Merck MK-869 показывает действие антидепрессанта при главной депрессии, но результаты не стали решающими из-за высокой степени реакции на плацебо. Кроме того, показано, что антагонист NK1 от Glaxo-Welcome (S)-GR205171 усиливает высвобождение дофамина в лобной коре, но не в неостриатуме (Lejeune et al., Soc. Neurosci., November 2001). Также выдвинута гипотеза, что антагонизм к NK3 в сочетании с антагонизмом к NK1 может быть благоприятным против как положительных, так и отрицательных симптомов шизофрении. Тревога и депрессия. Депрессия является одним из наиболее обычных аффективных расстройств в современном обществе с высокой и все еще возрастающей распространенностью, особенно среди молодой части населения. В настоящее время распространенность главной депрессии (MDD, DSM-IV) на протяжении жизни оценивается 10-25% у женщин и 5-12% у мужчин, из которых примерно у 25% MDD на протяжении жизни рецидивирует, без выздоровления в периоды между приступами, и накладывается на дистимическое расстройство. Существует высокая распространенность заболеваемости депрессией одновременно с другими психическими расстройствами и, особенно у более молодой части населения, в заметной связи с злоупотреблением лекарственными средствами и алкоголем. В свете того факта, что депрессия поражает,главным образом, население в возрасте 18-44 лет, например наиболее продуктивную часть населения,очевидно, что это становится тяжелым грузом для отдельных людей, семей и всего общества. В числе возможных способов лечения наиболее эффективна, бесспорно, терапия с антидепрессантами. За последние 40 лет разработано и представлено на рынке большое число антидепрессантов. Тем не менее, ни один из имеющихся сегодня антидепрессантов не удовлетворяет всем критериям идеального лекарственного средства (высокая лечебная и профилактическая эффективность, быстрое начало действия, полностью удовлетворительная кратковременная и длительная безопасность, простая и благоприят-1 009078 ная фармакокинетика) или не обладает побочным действием, что так или иначе ограничивает применение антидепрессантов во всех группах и подгруппах больных депрессией. Так как лечение причины депрессии в настоящее время не существует, не предвидится и отсутствуют антидепрессанты, эффективные для 60-70% пациентов, оправдана разработка новых антидепрессантов, которые смогут обойти недостатки доступных лекарственных средств. Некоторые данные показывают участие SP в стрессовых состояниях тревоги. Центральная инъекция SP вызывает сердечно-сосудистую реакцию, напоминающую классическую реакцию "бороться или убежать", характеризуемую физиологически расширением сосудов в скелетных мышцах и снижением мезентерального и ренального кровотока. Такая сердечно-сосудистая реакция сопровождается поведенческой реакцией, наблюдаемой у грызунов после повреждающего стимула или стресса (Culman andUnger, Can. J. Physiol. Pharmacol., 73:885-891 (1995. Для мышей введенные центрально агонисты и антагонисты NK1 являются анксиогенными средствами и анксиолитиками соответственно (Teixeira et al., Eur.J. Pharmacol., 311:7-14 (1996. Способность антагонистов NK1 ингибировать удар, вызванный SP (или электрическим шоком; Ballard et al., Trends Pharmacol. Sci., 17:255-259 (2001, может соответствовать такой атидепрессантной/анксиолитической активности, так как у песчанок удар играет роль сигнала тревоги или предупреждения для животных этого вида. Рецептор NK1 широко распространен в лимбической системе и в путях появления страха головного мозга, включая миндалевидное тело, гиппокамп, перегородку, гипоталамус и периакведуктальное серое вещество. Кроме того, вещество Р высвобождается центральной нервной системой в ответ на травматический или повреждающий стимул, и связанная с веществом Р нейротрансмиссия может вносить вклад или быть вовлеченной в тревогу, страх и эмоциональные расстройства, сопровождающие аффективные расстройства, такие как депрессия и тревога. В поддержку такой точки зрения в дискретных учтках головного мозга можно наблюдать изменения содержания вещества Р в ответ на стрессовый стимул (Brodinet al., Neuropeptides, 26:253-260 (1994. Центральная инъекция веществ, имитирующих вещество Р (агонистов), вызывает ряд защитных поведенческих реакций и сердечно-сосудистые изменения, включая условное отвращение к месту (Elliott,Exp. Brain. Res., 73:354-356 (1988, потенциированный звуковой старт-рефлексо (Krase et al., Behav.Brain. Res., 63:81-88 (1994, дистресс-звуковые сигналы, реакцию выскальзывания (Kramer et al., Science,281:1640-1645 (1998 и тревогу в приподнятом плюс-лабиринте (Aguiar and Brandao, Physiol. Behav.,60:1183-1186 (1996. Такие соединения не модифицируют двигательную активность и координацию на вращающемся (rotarod) аппарате или передвижение в активной клетке. Даун-регуляция биосинтеза вещества Р происходит в ответ на введение известных анксиолитических лекарственных средств и антидепрессантов (Brodin et al., Neuropeptides, 26:253-260 (1994); Shirayama et al., Brain. Res., 739:70-78 (1996. Подобным образом, звуковая реакция у морских свинок, вызванная введенным центрально агонистомNK1, может быть антагонизирована антидепрессантами, такими как имипрамин и флуоксетин, а также L733060 как антагонистом NK1. Такие исследования ясно показывают, что блокада рецепторов NK1 в центральной нервной системе может ингибировать психический стресс, напоминая антидепрессанты и анксиолититки (Rupniak and Kramer, Trends Pharmacol. Sci., 20:1-12 (1999, но без побочного действия существующих лекарственных препаратов. Рвота. Тошнота и рвота относятся к числу наиболее болезненных побочных действий противораковой химиотерапии. Они снижают качество жизни и могут вызвать у пациентов откладывание приема или отказ от потенциально полезных лекарственных средств (Kris et al., J. Clin. Oncol., 3:1379-1384 (1985. Частота, интенсивность и картина рвоты определяются различными факторами, такими как химиотерапевтическое средство, дозировка и способ введения. Типично ранняя или острая рвота начинается в течение первых 4 ч после приема химиотерапии, достигая пика в интервале 4-10 ч, и ослабевает через 12-24 ч. Поздняя рвота (развивающаяся через 24 ч и продолжающаяся до 3-5 суток после химиотерапии) наблюдается в случае большинства "вызывающих сильную рвоту" химиотерапевтических лекарственных средств (уровень 4 и 5 по Hesketh et al., J. Clin. Oncol., 15:103 (1997. У людей такие "вызывающие сильную рвоту" противораковые средства, включая цис-платин, вызывают острую рвоту у 98% и позднюю рвоту у 60-90% больных раком. Животные модели химиотерапии, такие как рвота у хорьков, вызванная цис-платином (Rudd andNaylor, Neuropharmacology, 33:1607-1608 (1994); Naylor and Rudd, Cancer. Surv., 21:117-135 (1996, успешно предсказывают клиническую эффективность антагонистов рецепторов 5-НТ 3. Хотя такое открытие привело к успешной терапии в случае лечения болезненности, вызываемой у больных раком химиотерапией и лучевой терапией, антагонисты рецепторов 5-НТ 3, такие как ондасетрон и гранисетрон (в сочетании с дексаметазоном или без него), являются эффективными при борьбе с острой фазой рвоты (первые 24 ч), но могут только ослабить развитие поздней рвоты (24 ч) с низкой эффективностью(De Mulder et al., Annals of Internal Medicine, 113:834-840 (1990); Roila, Oncology, 50:163-167 (1993. Несмотря на такие наиболее эффективные на сегодня методы лечения для предупреждения как острой, так и поздней рвоты, все еще 50% пациентов страдают от поздней рвоты и/или тошноты (Antiemetic Subcommittee, Annuals Oncol., 9:811-819 (1998.-2 009078 Показано, что в отличие от антагонистов 5-НТ 3 антагонисты NK1, такие как СР-99994 (Piedimonte et(1999, ингибируют у животных не только острую, но также позднюю фазу рвоты, вызванной цисплатином (Rudd et al., Br. J. Pharmacol., 119:931-936 (1996); Tattersall et al., Neuropharmacology, 39:652-663(2000. Также показано, что антагонисты NK1 ослабляют "позднюю" рвоту у людей в отсутствие сопутствующей терапии (Cocquyt et al., Eur. J. Cancer, 37:835-842 (2001); Navari et al., N. Engl. L. Med., 340:190195 (1999. Кроме того, показано, что при введении вместе с дексаметазоном и антагонистами 5-HT3,антагонисты NK1 (такие как МК-869 и CJ-11974, также известный как эзлопитант) оказывают дополнительные эффекты в предупреждении острой рвоты (Campos et al., J. Clin. Oncol., 19:1759-1767 (2001);Hesketh et al., Clin. Oncol., 17:338-343 (1999. Рецепторы NK1 центральной нервной системы играют главную роль в регуляции рвоты. Антагонисты NK1 активны против широкого ряда стимулов рвоты (Watson et al., Br. J. Pharmacol., 115:84-94(1995); Tattersall et al., Neuropharmacol., 35:1121-1129 (1996); Megens et al., J. Pharmacol. Exp. Ther.,302:696-709 (2002. Предполагается, что соединения действуют, блокируя рецепторы NK1 центральной нервной системы в одиночном пути ядра. Независимо от антагонизма к NK1 проникание в ЦНС является,таким образом, предпосылкой для противорвотной активности таких соединений. Рвоту у хорьков, вызванную лоперамидом, можно использовать как быструю и надежную модель скрининга на противорвотную активность антагонистов NK1. Другая оценка их лечебной полезности при лечении как острой,так и поздней фаз рвоты, вызванной цис-платином, показана на признанной хорьковой модели (Rudd etal., Br. J. Pharmacol., 119:931-936 (1994. На данной модели исследуют как "острую", так и "позднюю" рвоту после приема цис-платина, и она признана в смысле чувствительности к антагонистам рецепторов 5-HT3, глюкокортикоидам (Sam et al., Eur. J. Pharmacol., 417:231-237 (2001 и другим фармакологическим провокационным пробам. Маловероятно, что какое-нибудь противорвотное средство в будущем найдет клиническое признание, если не будет успешно лечить как "острую", так и "позднюю" фазы рвоты. Синдром разраженной толстой кишки (IBS). Пациенты с синдромом разраженной толстой кишки (IBS) испытывают ухудшенное качество жизни и интенсивно используют ресурсы здравоохранения, так как они стремятся к лучшим "решениям" (включая отсутствие необходимости повторных исследований или даже хирургического вмешательства). Хотя такие пациенты страдают от "неопасного" расстройства (иными словами, они никогда не умрут от этого и у них не будет тяжелых осложнений), тем не менее, они несут существенную экономическую нагрузку за счет интенсивного использования ресурсов здравоохранения и отсутствия на рабочих местах. Опубликовано умеренное число предклинических публикаций о роли рецепторов NK1 в висцеральной боли. С использованием рецепторов NK1 усыпленных мышей и антагонистов NK1 на животных моделях разными коллективами показана важная роль, которую играет рецептор NK1 в гипералгезии и висцеральной боли. Распределение рецепторов NK1 и вещества Р благоприятствует главной роли в висцеральной, а не в соматической боли. Действительно, более 80% висцеральных привносящих содержат вещество Р по сравнению с только 25% кожных привносящих. Рецепторы NK1 также вовлекаются в желудочно-кишечную подвижность (Tonini et al., Gastroenterol., 120:938-945 (2001); Okano et al., J. Pharmacol.Exp. Ther., 298:559-564 (2001. Вследствие такой двойной роли как в желудочно-кишечной подвижности, так и в ноцицепции считается, что антагонисты NK1 имеют потенциал для облегчения симптомов у пациентов с IBS. Уровень техники Соединения, содержащие 1-пиперидин-4-илпиперазинильную группу, описаны в WO 97/16440-A1,опубликованной 9 мая 1997 г., Janssen Pharmaceutica N.V., для применения в качестве антагонистов вещества Р, в WO 02/32867, опубликованной 25 апреля 2002 г., Glaxo Group Ltd., за их преимущества как антагонистов нейрокининов (конкретнее, описаны производные амида 4-пиперазин-1-илпиперидин-1 карбоновой кислоты), в WO 01/30348-А 1, опубликованной 3 мая 2001 г., Janssen Pharmaceutica N.V., для применения в качестве антагонистов вещества Р для воздействия на систему циркадного ритма и в WO 02/062784-A1, опубликованной 15 августа 2002 г., Hoffmann-La Roche AG, для применения в качестве антагонистов нейрокининов-1. Соединения настоящего изобретения отличаются от соединений известного уровня техники замещением пиперазинильной группы, будучи замещенными пирролидинильной группой, а также своей улучшенной возможностью как эффективных перорально и центрально активных антагонистов нейрокининов, имеющих лечебную ценность, в особенности для лечения шизофрении, рвоты, тревоги и депрессии, синдрома разраженной толстой кишки (IBS), нарушений циркадного ритма, висцеральной боли,нейрогенного воспаления, астмы, расстройств мочеиспускания, таких как недержание мочи, и ноцицепции.-3 009078 Настоящее изобретение относится к новым замещенным производным 1-пиперидин-4-ил-4 пирролидин-3-илпиперазина общей формулы (I) где n представляет собой целое число, равное 0, 1 или 2;m представляет собой целое число, равное 1 или 2, при условии, что если m равен 2, тогда n равен 1; р представляет собой целое число, равное 1 или 2;q представляет собой целое число, равное 0 или 1;X представляет собой ковалентную связь или двухвалентный радикал формулы -O-, -S- или -NR3-; каждый R3 независимо друг от друга представляет собой водород или алкил; каждый R1 независимо друг от друга выбирают из группы, состоящей из Ar1, Ar1-алкила и ди(Ar1)алкила;Y представляет собой ковалентную связь или двухвалентный радикал формулы -С(=O)-, -SO2-,C=CH-R или C=N-R, где R представляет собой Н, CN или нитро; каждый Alk представляет независимо друг от друга ковалентную связь; двухвалентный линейный или разветвленный насыщенный или ненасыщенный углеводородный радикал с 1-6 атомами углерода или циклический насыщенный или ненасыщенный углеводородный радикал с 3-6 атомами углерода; каждый радикал, необязательно, замещен по одному или нескольким атомам углерода одним или несколькими фенильными, галогено-, циано-, гидрокси-, формильными и аминорадикалами;Ar1 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбирают из группы, состоящей из галогена, алкила, циано, аминокарбонила и алкилокси;Ar2 представляет собой нафталинил или фенил, необязательно замещенный, каждый, 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбирают из группы, состоящей из галогена,нитро, амино, моно- и ди(алкил)амино, циано, алкила, гидрокси, алкилокси, карбоксила, алкилоксикарбонила, аминокарбонила и моно- и ди(алкил)аминокарбонила;Ar3 представляет собой нафталинил или фенил, необязательно замещенный 1, 2 или 3 заместителями,каждый из которых независимо друг от друга выбирают из группы, состоящей из алкилокси, Ar1 карбонилоксиалкила, Ar1-алкилоксикарбонила, Ar1-алкилоксиалкила, алкила, галогена, гидрокси, пиридинила, морфолинила, пирролидинила, имидазо[1,2-]пиридинила, морфолинилкарбонила, пирролидинилкарбонила, амино и циано;Het1 представляет собой моноциклический гетероциклический радикал, выбранный из группы, состоящей из пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклический гетероциклический радикал, выбранный из группы, состоящей из хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила,бензотиенила, инданила и хроменила; каждый гетероциклический радикал может быть, необязательно,замещен по любому атому одним или несколькими радикалами, выбранными из группы, состоящей из галогена, оксо и алкила;Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, состоящей из пирролидинила, диоксолила, имидазолидинила, пиразолидинила, пиперидинила, морфолинила, дитианила, тиоморфолинила, пиперазинила, тетрагидрофуранила, 2 Н-пирролила, пирролинила, имидазолинила, пиразолинила, пирролила, имидазолила, пиразолила, тиазолила, фуранила, тиенила, оксазолила, диоксазолила, оксазолидинила, изоксазолила, тиазолила, тиадиазолила, изотиазолила, пиридинила,пиримидинила, пиразинила, пиридазинила и триазинила; или бициклический гетероциклический радикал, выбранный из группы, состоящей из 2,3 дигидробензо[1,4]диоксина, октагидробензо[1,4]диоксина, бензопиперидинила, хинолинила, хиноксалинила, индолила, изоиндолила, хроманила, бензимидазолила, имидазо[1,2-]пиридинила, бензоксазолила,бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила и бензотиенила; или трициклический гетероциклический радикал 8,9-дигидро-4 Н-1-окса-3,5,7 а-триазациклопента[f]-4 009078 азуленил; каждый радикал может быть, необязательно, замещен одним или несколькими радикалами,выбранными из группы, состоящей из Ar1, Ar1-алкила, Ar1-алкилоксиалкила, галогена, гидрокси, алкила,пиперидинила, пирролила, тиенила, оксо, алкилокси, алкилкарбонила, Ar1-карбонила, моно- и ди(алкил)аминоалкила, алкилоксиалкила и алкилоксикарбонила; и алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал с 16 атомами углерода или циклический насыщенный углеводородный радикал с 3-6 атомами углерода,необязательно замещенный по одному или нескольким атомам углерода одним или несколькими радикалами, выбранными из группы, состоящей из фенила, галогена, циано, оксо, гидрокси, формила и амино; их фармацевтически приемлемым солям присоединения кислот или оснований, их стереохимически изомерным формам, их N-оксидам и их пролекарствам. В частности, изобретение относится к соединению общей формулы (I),где n представляет собой целое число, равное 1;m представляет собой целое число, равное 1; р представляет собой целое число, равное 1 или 2;q представляет собой целое число, равное 0;X представляет собой ковалентную связь;Y представляет собой ковалентную связь или двухвалентный радикал формулы -С(=O)-, -SO2-,C=CH-R или C=N-R, где R представляет собой CN или нитро; каждый Alk представляет независимо друг от друга ковалентную связь; двухвалентный линейный или разветвленный насыщенный углеводородный радикал с 1-6 атомами углерода или циклический насыщенный углеводородный радикал с 3-6 атомами углерода; каждый радикал, необязательно, замещен по одному или нескольким атомам углерода одним или несколькими фенильными, галогено- и гидроксирадикалами;Ar2 представляет собой нафталинил или фенил, необязательно замещенный, каждый, 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбирают из группы, состоящей из галогена,алкила и алкилокси;Ar3 представляет собой нафталинил или фенил, необязательно замещенный 1, 2 или 3 заместителями,каждый из которых независимо друг от друга выбирают из группы, состоящей из алкилокси, Ar1 алкилоксикарбонила, Ar1-алкилоксиалкила, алкила, галогена и циано;Het1 представляет собой пиридинил или бициклический гетероциклический радикал, выбранный из группы, состоящей из хиноксалинила, индолила, бензотиенила, инданила и хроменила; каждый гетероциклический радикал может быть, необязательно, замещен по любому атому одним или несколькими радикалами, выбранными из группы, состоящей из оксо и алкила;Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, состоящей из пирролидинила, диоксолила, пиперидинила, морфолинила, пиперазинила, тетрагидрофуранила, пирролила, имидазолила, пиразолила, фуранила, тиенила, диоксазолила, оксазолидинила, изоксазолила, тиазолила, тиадиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклический гетероциклический радикал, выбранный из группы, состоящей из 2,3-дигидробензо[1,4]диоксина, октагидробензо[1,4]диоксина, хиноксалинила, индолила, хроманила, бензимидазолила, имидазо[1,2-а]пиридинила, бензизоксазолила, бензотиазолила, бензофуранила и бензотиенила; или трициклический гетероциклический радикал 8, 9-дигидро-4 Н-1-окса-3,5,7 а-триазациклопента[f]азуленил; каждый радикал может быть, необязательно, замещен одним или несколькими радикалами, выбранными из группы, состоящей из Ar1, Ar1-алкилоксиалкила, галогена, алкила, оксо, алкилокси, алкилкарбонила, Ar1-карбонила, моно- и ди(алкил)аминоалкила, алкилоксиалкила и алкилоксикарбонила; алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал с 16 атомами углерода или циклический насыщенный углеводородный радикал с 3-6 атомами углерода,необязательно замещенный по одному или нескольким атомам углерода одним или несколькими радикалами, выбранными из группы, состоящей из фенила, галогена и гидрокси; и его фармацевтически приемлемым солям присоединения кислот или оснований, его стереохимически изомерным формам, его N-оксиду и его пролекарству. В частности, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям присоединения кислот или оснований, его стереохимически изомерным формам, его Nоксиду и его пролекарству, где R1 представляет собой Ar-метил и присоединяется в положении 2 или R1-5 009078 представляет собой Ar и присоединяется в положении 3, например, в любом соединении формулы (I), гдеm и n равны 1, и Ar1 представляет собой незамещенный фенил. Предпочастительно Ar1-метил представляет собой бензильный радикал В частности, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям присоединения кислот или оснований, его стереохимически изомерным формам, его N-оксиду и его пролекарству, где группа R2-X-C(=Q)- представляет собой 3,5-ди(трифторметил)фенилкарбонил. В частности, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям присоединения кислот или оснований, его стереохимически изомерным формам, его Nоксиду и пролекарству, где р равен 1. В частности, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям присоединения кислот или оснований, его стереохимически изомерным формам, его Nоксиду и пролекарству, где Y представляет собой -С(=O)-. В частности, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям присоединения кислот или оснований, его стереохимически изомерным формам, его Nоксиду и пролекарству, где Alk представляет собой ковалентную связь. В частности, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям присоединения кислот или оснований, его стереохимически изомерным формам, его Nоксиду и пролекарству, где L представляет собой Het2. В частности, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям присоединения кислот или оснований, его стереохимически изомерным формам, его Nоксиду и пролекарству, где соединение является соединением под номером 219, 270, 269, 281, 408, 393,72, 164, 253, 258, 267, 286, 317, 318, 313, 308, 331, 366, 31, 32, 4, 71, 218, 259, 287, 285, 306 и 321, указанным далее в любой из табл. 1-6. В объеме данного изобретения термин "алкил" является определением одновалентного линейного или разветвленного насыщенного углеводородного радикала с 1-6 атомами углерода, например такого как метил, этил, пропил, бутил, 1-метилпропил, 1,1-диметилэтил, пентил, гексил; алкил также является определением одновалентного циклического насыщенного углеводородного радикала с 3-6 атомами углерода, например такого как циклопропил, метилциклопропил, циклобутил, циклопентил и циклогексил. Определение алкила также включает алкильный радикал, необязательно замещенный по одному или нескольким атомам углерода одним или несколькими галогено-, циано-, оксо-, гидрокси-, формильными и аминорадикалами, как, например гидроксиалкил, в частности гидроксиметил и гидроксиэтил и полигалогеноалкил, в частности дифторфенил и трифторметил. В объеме данного изобретения термин "галоген" является общим обозначением фтора, хлора, брома и йода. В объеме данного изобретения термин "соединение по изобретению" обозначает соединение общей формулы (I), его фармацевтически приемлемые соли присоединения кислот или оснований, его стереохимически изомерные формы, его N-оксид и пролекарство. В объеме данного изобретения, в частности, в группе Alka-Y-Alkb в формуле (I) , когда два или большее число следующих друг за другом элементов указанной группы обозначают ковалентную связь,тогда обозначается одна ковалентная связь. Например, когда Аlkа и Y обозначают ковалентную связь, aAlkb представляет собой -CH2-, тогда группа Alka-Y-Alkb обозначает -CH2-. Подобным образом, если каждый из Alka, Y и Alkb обозначает ковалентную связь, a L обозначает Н, тогда группа Alka-Y-Alkb-L обозначает -Н. Фармацевтически приемлемые соли определяются как соли, включающие терапевтически активные нетоксичные формы солей присоединения кислот, которые способны образовывать соединения формулы (I). Указанные соли можно получить обработкой формы основания соединений формулы (I) соответствующими кислотами, например неорганическими кислотами, такими как галоидоводородная кислота, в частности хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическими кислотами, такими как уксусная кислота, гидроксиуксусная кислота,пропановая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, птолуолсульфоновая кислота, цикламовая кислота, салициловая кислота, п-аминосалициловая кислота и памовая кислота.-6 009078 Соединения формулы (I), содержащие кислотные протоны, также могут быть превращены в формы их терапевтически активных нетоксичных солей металлов или присоединения амина обработкой соответствующими органическими и неорганическими основаниями. Соответствующие формы солей оснований включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, в частности литиевые, натриевые, калиевые, магниевые и кальциевые соли, соли с органическими основаниями,такими как, например бензатин, N-метил-D-глюкамин, соли гидрамина, и соли с аминокислотами, например аргинином и лизином. Наоборот, указанные формы солей можно превратить в свободные формы обработкой соответствующим основанием или кислотой. Термин "соль присоединения", используемый в объеме данного изобретения, также включает сольваты, которые могут образовывать соединения формулы (I), а также их соли. Такими сольватами являются, например, гидраты и алкоголяты. Формы N-оксидов соединений формулы (I) включают такие соединения формулы (I), где один или несколько третичных атомов азота (например, пиперазинильного или пирролидинильного радикала) являются N-окисленными. Такие N-оксиды может легко получить специалист в данной области техники без дополнительных исследований, и они являются очевидной альтернативой соединений формулы (I),так как такие соединения являются метаболитами, образующимися в организме человека после поглощения путем окисления (Textbook of Organic Medicinal and Pharmaceutical Chemistry, 1977, pages 70-75). Известно, что метаболитные формы соединения также можно вводить человеку вместо соединения самого по себе, возможно, с таким же эффектом. Соединения по изобретению содержат по меньшей мере 2 окисляемых атома азота (третичные аминогруппы). Поэтому весьма вероятно, что при метаболизме в организме человека будут образовываться их N-оксиды. Соединения формулы (I) можно превратить в соответствующие N-оксиды, следуя процедурам, известным в технике для превращения атома азота в его N-оксидную форму. Указанную реакцию Nокисления, как правило, можно осуществить взаимодействием исходного вещества формулы (I) с соответствующим органическим или неорганическим пероксидом. Соответствующими неорганическими пероксидами являются, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать пероксикислоты, такие как, например пероксибензойная кислота или галогензамещенная пероксибензойная кислота, например 3-хлорпероксибензойная кислота, пероксоалкановые кислоты, такие как, например перуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие алканолы, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенсодержащие углеводороды, например дихлорметан, и смеси таких растворителей. Термин "стереохимически изомерные формы", используемый в данном описании, определяет все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не упоминается или не указывается иное, химическое название соединений обозначает смесь всех возможных стереохимически изомерных форм, имеющих такое название, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. В частности, стереогенные центры могут иметь R- илиS-конфигурацию; заместители двухвалентных циклических (не полностью) насыщенных радикалов могут иметь или цис- или транс-конфигурацию. Соединения, содержащие двойные связи, могут иметь Еили Z-стереохимию при указанной двойной связи. Очевидно, подразумевается, что стереохимически изомерные формы соединений формулы (I) входят в объем данного изобретения. Следуя соглашениям CAS по номенклатуре, когда в молекуле присутствуют два стереогенных (хиральных) центра известной абсолютной конфигурации, дескриптор R или S приписывают (на основании правила последовательности Кана-Инголда-Прелога) хиральному центру с наименьшим номером - референтному центру. R и S определяют, каждый, оптически чистые стереогенные центры с неопределенной абсолютной конфигурацией. Если используются и , то положение самого старшего заместителя у асимметричного атома углерода в циклической системе с наименьшим номером в цикле всегда является "-положением главной плоскости, определяемой циклической системой. Положение самого старшего заместителя у референтного атома обозначают , если он находится с той же стороны главной плоскости, определяемой циклической системой, или , если он находится с другой стороны главной плоскости, определяемой циклической системой. Соединения формулы (I) и некоторые промежуточные соединения имеют по меньшей мере два стереогенных центра в своей структуре. Изобретение также относится к производным (обычно называемым "пролекарства") фармакологически активных соединений по изобретению, которые разлагаются in vivo с образованием соединений по изобретению. Пролекарства, как правило (но не всегда), имеют более низкую эффективность у целевого рецептора, чем соединения, до которых они разлагаются. Пролекарства особенно пригодны, когда нужное соединение имеет химические или физические свойства, которые затрудняют его введение или де-7 009078 лают его неэффективным. Например, целевое соединение может быть только плохо растворимым, оно может плохо переноситься через эпителий слизистой оболочки, или оно может иметь нежелательно короткий полупериод существования в плазме. Дополнительные сведения о пролекарствах можно найти вStella V.J. et al., "Prodrugs", Drug Delivery Systems, 1985, pp. 112-176 и в Drugs, 1985, 29, pp. 455-473. Пролекарственные формы фармакологически активных соединений по изобретению, как правило,будут представлять собой соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот или оснований, их стереохимически изомерные формы и N-оксиды, содержащие кислотную группу, которая этерифицирована или амидирована. К числу таких этерифицированных кислотных групп относятся группы формулы -COORx, где Rx представляет собой C1-6-алкил, фенил, бензил или одну из групп Амидированные группы включают группы формулы -CONRyRz, где Ry представляет собой Н, C1-6 алкил, фенил или бензил, и Rz представляет собой -ОН, Н, C1-6-алкил, фенил или бензил. Соединения по изобретению, содержащие аминогруппу, могут быть преобразованы с помощью кетона или альдегида,таким как формальдегид, в основании Манниха. Такое основание будет гидролизоваться в водном растворе с кинетикой первого порядка. Соединения формулы (I), полученные способами, описанными ниже, можно синтезировать в форме рацемической смеси энантиомеров, которые можно отделить один от другого, следуя процедурам, известным в технике. Рацемические соединения формулы (I) можно превратить в соответствующие формы диастереомерных солей взаимодействием с подходящей хиральной кислотой. Затем указанные диастереомерные соли разделяют, например, селективной или фракционной кристаллизацией и высвобождают их энантиомеры щелочью. Другой способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стерехимически чистые изомерные формы также можно получить из соответствующих стерехимически чистых изомерных форм соответствующих исходных соединений при условии, что взаимодействие происходит стереоспецифически. Предпочастительно, если нужен специфический стереоизомер, указанное соединение следует синтезировать стереоспецифическим способом. В таких способах преимущественно будут использоваться энантиомерно чистые исходные вещества. Фармакология. Вещество Р и другие тахикинины учтвуют во многих биологических действиях, таких как передача боли (ноцицепция), нейрогенное воспаление, сокращение гладких мышц, экстравазация белков плазмы,вазодилатация, секреция, дегрануляция тучных клеток, а также в активации иммунной системы. Полагают, что ряд заболеваний вызывается активацией нейрокининовых рецепторов, в частности рецептораNK1, путем избыточного высвобождения вещества Р и других нейрокининов в определенных клетках,таких как клетки в нейронном сплетении желудочно-кишечного тракта, немиелинизированных первичных чувствительных афферентных нейронах, симпатических и парасимпатических нейронах и ненейронных типах клеток (DNP, 8(1):5-23 (1995), и Longmore J. et al., "Neurokinin Receptors", Pharmacological Reviews, 46(4):551-599 (1994. Соединения настоящего изобретения являются сильными ингибиторами действий, опосредуемых нейрокининами, в частности опосредуемых рецепторами NK1, NK2 и NK3, и поэтому их можно описывать как антагонистов нейрокининов, в особенности как антагонистов вещества Р, что можно показать invitro на опосредуемой веществом Р релаксации коронарных артерий свиньи. Аффинность связывания соединений настоящего изобретения в отношении нейрокининовых рецепторов человека, морской свинки и песчанки также можно определить in vitro при испытании на связывание рецепторов с использованием в качестве лиганда 3 Н-вещества Р. Обсуждаемые соединения также показывают антагонистическую активность против вещества Р in vivo, что может подтвердить, например, антагонизм в отношении вызываемой веществом Р экстравазации плазмы у морских свинок или антагонизм в отношении вызываемой лекарственными средствами рвоты у хорьков (Watson et al., Br. J. Pharmacol., 115:84-94 (1995. Ввиду их способности антагонизировать действия тахикининов блокированием нейрокининовых рецепторов и, в частности, блокированием рецепторов NK1, NK2 и NK3 соединения по изобретению пригодны в качестве лекарственного средства, в частности, при профилактике и лечении состояний, опосредуемых тахикининами. В частности, соединения по изобретению пригодны в качестве действующих при пероральном приеме лекарственных средств, проникающих в центральную нервную систему, при профилактике и лечении состояний, опосредуемых тахикининами. В частности, обнаружено, что некоторые соединения проявляют комбинированную антагонистическую активность в отношении NK1/NK2 или комбинированную антагонистическую активность в отношении NK1/NK2/NK3, как можно видеть из таблицы в экспериментальном разделе.-8 009078 Поэтому изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым солям присоединения кислот или оснований, его стереохимически изомерным формам, его Nоксиду и пролекарству для применения в качестве лекарственного средства. Изобретение также относится к применению соединения по изобретению для получения лекарственного средства для лечения или профилактики, или того и другого, состояний, опосредуемых тахикининами. Соединения по изобретению пригодны при лечении расстройств ЦНС, в частности шизоаффективных расстройств, депрессии, состояний тревоги, расстройств, связанных со стрессом, расстройств сна, расстройств познавательной способности, личностных расстройств, расстройств, связанных с приемом пищи, нейродегенеративных болезней, расстройств аддикции, расстройств настроения, половой дисфункции, боли и других связанных с ЦНС состояний; воспаления; аллергических расстройств; гастроинтестинальных расстройств, в частности синдрома раздраженной толстой кишки (IBS); кожных расстройств; ангиоспастических заболеваний; фиброзных и коллагеновых болезней; расстройств, связанных с усилением или подавлением иммунной системы, и ревматических болезней и регуляции массы тела. В частности, соединения по изобретению пригодны при лечении или предупреждении шизоаффективных расстройств, возникающих по разным причинам, в том числе шизоаффективных расстройств маниакального типа, депрессивного типа, смешанного типа; параноидной, дезорганизованной, кататонической, недифференцированной и резидуальной шизофрении; расстройства шизофренической формы; бредового расстройства; краткого психотического расстройства; разделенного психотического расстройства; психотического расстройства, вызванного веществом, и психотического расстройства, по-другому точно не определенного. В частности, соединения по изобретению пригодны при лечении или предупреждении депрессии, в том числе, но без ограничения, главных депрессивных расстройств, включая биполярную депрессию; униполярную депрессию; одиночные или повторяющиеся главные депрессивные эпизоды с психотическими признаками или без них, кататонических признаков, меланхолических признаков, атипичных признаков или сразу же после родов и в случае повторяющихся эпизодов с сезонной картиной или без нее. Другие расстройства настроения, охватываемые термином "главное депрессивное расстройство",включают дистимическое расстройство с ранним или поздним началом и с атипическими признаками или без них, биполярное расстройство I, биполярное расстройство II, циклотимическое расстройство, повторяющееся короткое депрессивное расстройство, аффективное расстройство смешанного типа, невротическую депрессию, посттравматическое стрессовое расстройство и социальную фобию; деменцию типа болезни Альцгеймера с ранним или поздним началом с депрессивным настроением; сосудистую деменцию с депрессивным настроением; расстройства настроения, вызванные веществами, такие как расстройства настроения, вызванные алкоголем, амфетаминами, кокаином, галлюциногенами, летучими препаратами, опиоидами, фенциклидином, седативными средствами, снотворными средствами, анксиолитиками и другими веществами; шизоаффективное расстройство депрессивного типа и регулируемые расстройства с депрессивным настроением. Главные депрессивные расстройства также могут являться результатом общего состояния здоровья,включая, но не ограничиваясь перечисленным, инфаркт миокарда, диабет, выкидыш или аборт и т.д. В частности, соединения по изобретению пригодны при лечении или предупреждении расстройств тревоги, включая, но не ограничиваясь перечисленным,паническую атаку; агорафобию; паническое расстройство без агорафобии; агорафобию без анамнеза панического расстройства; специфическую фобию; социальную фобию; обсессивно-компульсивное расстройство; посттравматическое стрессовое расстройство; острое стрессовое расстройство; расстройство генерализованной тревоги; расстройство тревоги из-за общих условий лечения; расстройство тревоги, вызванное веществами, и расстройство тревоги, по-другому точно не определенное. В частности, соединения по изобретению пригодны при лечении или предупреждении расстройств,связанных со стрессом, ассоциируемых с депрессией и/или тревогой, включая, но не ограничиваясь перечисленным, острую стрессовую реакцию; регулируемые расстройства, такие как короткая депрессив-9 009078 ная реакция, продолжительная депрессивная реакция, смешанная реакция страха и депрессивная реакция, регулируемое расстройство с предоминантным нарушением других эмоций, регулируемое расстройство с предоминантным нарушением проводимости, регулируемое расстройство со смешанным нарушением эмоций и проводимости и регулируемые расстройства с другими специфическими предоминантными симптомами, и другие реакции на сильный стресс. В частности, соединения по изобретению пригодны при лечении или профилактике расстройств сна, включая, но не ограничиваясь перечисленным,дисомнию и/или парасомнию как основные расстройства сна; инсомнию; апноэ во сне; нарколепсию; нарушения циркадного ритма; расстройства сна, связанные с другим психическим расстройством; расстройство сна из-за общего состояния лечения и расстройство сна, вызванное веществами. В частности, соединения по изобретению пригодны при лечении или предупреждении расстройств познавательной способности, включая, но не ограничиваясь перечисленным,деменцию; амнезийные расстройства и расстройства познавательной способности, по-другому точно не определенные, в особенности деменцию, вызванную дегенеративными расстройствами, повреждениями,травмой, инфекционными болезнями, васкулярными расстройствами, токсинами, гипоксией, дефицитом витаминов или эндокринными расстройствами; деменцию по типу Альцгеймера и с ранним или поздним началом с депрессивным настроением; деменцию, связанную с AIDS, или амнезийные расстройства, вызванные алкоголем или другими причинами из числа дефицита тиамина, двустороннего повреждения височных долей головного мозга изза герпетического энцефалита и других лимбических энцефалитов, нейронной потери, вторичной к гипоксии/гипогликемии/сильным судорогам и хирургическому вмешательству, дегенеративных расстройств или патологии вблизи желудочка III. Кроме того, соединения по изобретению также пригодны как средства, улучшающие память и/или познавательную способность у здоровых людей, не страдающих от нарушения познавательной способности и/или памяти. В частности, соединения по изобретению также пригодны при лечении или предупреждении личностных расстройств, включая, но не ограничиваясь перечисленным,параноидные личностные расстройства; шизотипичное личностное расстройство; антисоциальное расстройство; пограничное личностное расстройство; тканевое личностное расстройство; личностное расстройство нарциссизма; личностное расстройство избегания; личностное расстройство зависимости; обсессивно-компульсивное личностное расстройство и личностное расстройство, по-другому точно не определенное. В частности, соединения по изобретению также пригодны при лечении или предупреждении расстройств, связанных с потреблением пищи, в том числе нервно-психической анорексии; атипичной нервно-психической анорексии; нервно-психической булимии; атипичной нервно-психической булимии; переедания, связанного с другими психическими расстройствами; рвоты, связанной с другими психическими расстройствами, и расстройств, связанных с потреблением пищи, точно не определенных. В частности, соединения по изобретению также пригодны при лечении или предупреждении нейродегенеративных болезней, включая, но не ограничиваясь перечисленным,болезнь Альцгеймера; хорею Гентингтона; болезнь Крейтцфельда-Якоба; болезнь Пика; демиелинизирующие расстройства, такие как рассеянный склероз и ALS; другие невропатии и невралгии; рассеянный склероз; боковой амиотрофический склероз; удар и травму головы.- 10009078 В частности, соединения по изобретению также пригодны при лечении или предупреждении расстройств аддикции, включая, но не ограничиваясь перечисленным, зависимость от веществ или злоупотребление с или без физиологической зависимости, в частности, где веществом является алкоголь, амфетамины, амфетаминоподобные вещества, кофеин, кокаин, галлюциногены, летучие вещества, никотин,опиоиды (такие как гашиш, героин и морфин), фенциклидин, фенциклидиноподобные соединения, седативные и снотворные средства, бензодиазепины и/или другие вещества, в частности пригодные для лечения синдрома отмены от перечисленных выше веществ и делириозного синдрома отмены алкоголя. В частности, соединения по изобретению также пригодны при лечении или предупреждении расстройств настроения, вызванных, в частности, алкоголем, кофеином, гашишем, кокаином, галлюциногенами, летучими веществами, никотином, опиоидами, фенциклидином, седативные средствами, снотворные средствами, анксиолитиками и другими веществами. В частности, соединения по изобретению также пригодны при лечении или предупреждении половой дисфункции, включая, но не ограничиваясь перечисленным,расстройства полового влечения; расстройства полового возбуждения; оргазмические расстройства; половые болевые расстройства; половую дифункцию из-за общих условий лечения; половую дисфункцию, вызванную веществами, и половую дисфункцию, по-другому точно не определенную. В частности, соединения по изобретению также пригодны при лечении или предупреждении боли,включая, но не ограничиваясь перечисленным,травматическую боль, такую как послеоперационная боль; травматическую авульсионную боль, такую как в плечевом сплетении; хроническую боль, такую как артритная боль, имеющая место при остео-, ревматоидном или псориатическом артрите; невропатическую боль, такую как постгерпетическая невралгия, тригеминальная невралгия, сегментная или межреберная невралгия, фибромиалгия, каузалгия, периферическая невропатия, диабетическая невропатия, невропатия, вызванная химиотерапией, невропатия, связанная со СПИДом, затылочная невралгия, невралгия при синдроме коленчатого ганглия, глоссофарингеальная невралгия, рефлекторносимпатическая дистрофия и фантомная боль; различные формы головной боли, такие как мигрень, острая или хроническая головная боль напряжения, височно-нижнечелюстная боль, боль в верхнечелюстной пазухе и мигрень; одонталгия; боль при раке; висцеральная боль; гастроинтестинальная боль; боль при ущемлении нерва; боль при спортивной травме; дисменорея; менструальная боль; менингит; арахноидиты; боль в скелетных мышцах; боль в нижней части спины, такая как спинальный стеноз, при выпадении диска, ишиалгия, стенокардия, анкилозидирующий спондилит; подагра; ожоги; боль при образовании рубцов; зуд и таламическая боль, такая как таламическая боль после удара. В частности, соединения по изобретению также пригодны при лечении или предупреждении других расстройств, связанных с ЦНС: акинезии, акинетических-ригидных синдромов, дискинезии и паркинсонизма, вызванного лечением, синдрома Жиль де ля Туретта и его сиптомов, тремора, хореи, миоклонуса,тиков и дистонии, дефицита внимания/гиперактивности (ADHD), болезни Паркинсона, паркинсонизма,вызванного лекарственными средствами, постэнцефалитного паркинсонизма, прогрессирующего супрануклеарного паралича, множественной системной атрофии, кортикобазальной дегенерации, комплекса паркинсонизм-ALS-деменция и кальцификации базальных ядер, поведенческих нарушений и расстройств проводимости при деменции и психически заторможенных, включая беспокойство и возбуждение, внепирамидальных расстройств движения, синдрома Дауна и акатизии.- 11009078 В частности, соединения по изобретению также пригодны при лечении или предупреждении воспаления, включая, но не ограничиваясь перечисленным,воспалительные состояния при астме, гриппе, хроническом бронхите и ревматоидном артрите; воспалительные состояния желудочно-кишечного тракта, такие как болезнь Крона, неспецифический язвенный колит, воспалительное заболевание кишечника и повреждение, вызванное нестероидными противовоспалительными лекарственными средствами, и др.; воспалительные состояния кожи, такие как герпес и экзема; воспалительные состояния мочевого пузыря, такие как цистит и недержание; воспаление глаз и зубов и панкреатит, в частности хронический и острый панкреатит. В частности, соединения по изобретению также пригодны при лечении или предупреждении аллергических расстройств, включая аллергические расстройства кожи, такие как крапивница и др.; и аллергические расстройства дыхательных путей, такие как ринит и др., и другие аллергические расстройства. В частности, соединения по изобретению также пригодны при лечении или предупреждении рвоты,т.е. тошноты, позывов на рвоту и рвоты, включая, но не ограничиваясь перечисленным,острую рвоту, позднюю рвоту и рецидивирующую рвоту; рвоту, которую вызывают лекарственные средства, такие как противораковые химиотерапевтические средства, такие как алкилирующие средства, например циклофосфамид, кармустин, ломустин и хлорамбуцил; цитотоксические антибиотики, например дактиномицин, доксорубицин, митомицин-С и блеомицин; антиметаболиты, например цитарабин, метотрексат и 5-флуороурацил; винкаалкалоиды, например этопозид, винбластин и винкристин; и другие лекарственные средства, такие как цис-платин, дакарбазин, прокарбазин и гидроксимочевина; и их сочетания; лучевая болезнь, лучевая терапия, как, например, при лечении рака; яды; токсины, такие как токсины, появившиеся вследствие метаболических расстройств или инфекции,таких как гастрит, или высвобожденные во время бактериальной или вирусной желудочно-кишечной инфекции; беременность; вестибулярные расстройства, такие как болезнь движения, вертиго, головокружение и болезнь Меньера; послеоперационная болезнь; желудочно-кишечная обструкция; пониженная гастроинтестинальная подвижность; висцеральная боль, такая как инфаркт миокарда или перитонит; мигрень; повышенное внутричерепное давление; пониженное внутричерепное давление (например, высотная болезнь); опиоидные аналгетики, такие как морфин; гастроэзофагеальный рефлюкс; изжога; злоупотребление пищевыми продуктами или напитками;"кислый" желудок; изжога/регургитация; изжога, такая как эпизодическая изжога, ночная изжога и изжога, вызванная приемом пищи; диспепсия. В частности, соединения по изобретению также пригодны при лечении или предупреждении желудочно-кишечных расстройств, включая, но не ограничиваясь перечисленным,синдром разраженной толстой кишки (IBS), кожных расстройств, таких как псориаз, зуд и солнечная эритема; ангиоспастических болезней, таких как стенокардия, васкулярная головная боль и болезнь Рейно,церебральная ишемия, такая как церебральный вазоспазм с последующим субарахноидальным кровоизлиянием; фиброзных и коллагеновых болезней, таких как склеродермия и эозинофильный фасциолез; расстройств, связанных с усилением или подавлением иммунной системы, таких как системная красная волчанка, и ревматических болезней, таких как фиброзит; кашля и при борьбе с массой тела,включая ожирение. Настоящее изобретение также относится к способу лечения и/или профилактики болезней, опосредуемых тахикининами, в частности лечения и/или профилактики шизофрении, депрессии, расстройств тревоги, рвоты и синдрома разраженной толстой кишки (IBS), включающему введение человеку, нуж- 12009078 дающемуся в таком введении, эффективного количества соединения по изобретению, в частности, соединения формулы (I), его фармацевтически приемлемых солей присоединения кислот или оснований,его стереоизомерных форм, его N-оксидов, а также его пролекарств. Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по изобретению, в частности соединения формулы (I), его фармацевтически приемлемых солей присоединения кислот или оснований, его стереоизомерных форм, его N-оксидов и пролекарства. Соединения по изобретению, в частности соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот или оснований, их стереоизомерные формы, их N-оксиды и их пролекарства, или их любую подгруппу или комбинацию можно включать в состав различных фармацевтических форм для целей введения. В качестве подходящих композиций можно назвать все композиции,обычно используемые для системного введения лекарственных средств. Для того чтобы получить фармацевтические композиции данного изобретения, эффективное количество определенного соединения,необязательно, в форме соли присоединения, как активного ингредиента объединяют при тщательном перемешивании с фармацевтически приемлемым носителем, самой разной формы, в зависимости от формы препарата, нужного для введения. Такие фармацевтические композиции, желательно, находятся в стандартной лекарственной форме, подходящей, в частности, для введения перорально, ректально, чрескожно, парентеральной инъекцией или ингаляцией. Например, при получении композиций в пероральной лекарственной форме можно использовать любые обычные фармацевтические среды, такие как, например вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин,разбавители, смазывающие вещества, связующие вещества, вещества, способствующие сыпучести, и т.п.,в случае порошков, пилюль, капсул и таблеток. Из-за простоты введения таблетки и капсулы представляют наиболее удобные пероральные стандартные лекарственные формы, в которых обычно используют твердые фармацевтические носители. Для парентеральных композиций носитель, как правило, будет включать стерильную воду, по меньшей мере, большей частью, хотя могут быть включены и другие ингредиенты, например, способствующие растворению. Можно получить, например, растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получить суспензии для инъекций, в которых можно использовать подходящие жидкие носители, суспендирующие агенты и т.п. Также включаются твердые препараты, предназначенные для превращения в препараты жидкой формы непосредственно перед применением. В композициях, подходящих для чрескожного введения, носитель, необязательно, содержит вещество, усиливающее проникание, и/или подходящее смачивающее вещество, необязательно, в сочетании с подходящими добавками любого характера в небольших количествах, которые не оказывают значительного вредного действия на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезны при получении нужных композиций. Такие композиции могут вводиться разными способами, например с помощью трансдермального пластыря, в виде точек, в виде мази. Особенно выгодно получать вышеуказанные фармацевтические композиции в стандартной лекарственной форме для облегчения введения и равномерности дозировки. Стандартная лекарственная форма в данном описании обозначает физически дискретные единицы, подходящие в качестве единичных дозировок, причем каждая единица содержит предварительно установленное количество активного ингредиента, рассчитанное на получение нужного лечебного эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (в том числе таблетки с насечками или с покрытием), капсулы, пилюли, пакетики с порошком, облатки, суппозитории, растворы или суспензии для инъекций и т.п., и множества таких изолированных форм. Так как соединения по изобретению являются сильными пероральными, активными, главным образом, в отношении центральной нервной системы антагонистами NK1, NK1/NK3 и NK1/NK2/NK3, фармацевтические композиции, содержащие указанные соединения, особенно выгодны для перорального введения. Синтез. Соединения по изобретению можно получить, как правило, осуществляя ряд стадий, каждая из которых известна специалистам в данной области техники. Конечные соединения формулы (I) удобно получать восстановительным N-алкилированием промежуточного соединения формулы (II) промежуточным соединением формулы (III). Указанное восстановительное N-алкилирование можно осуществлять в инертном растворителе, таком как, например дихлорметан, этанол или толуол или их смесь, и в присутствии соответствующего восстановителя, такого как,например, борогидрид, например борогидрид натрия, цианоборогидрид или триацетоксиборогидрид натрия. В случае использования борогидрида в качестве восстановителя может быть удобным использование комплексообразователя, такого как, например, изопропилат титана(IV), как описано в J. Org. Chem.,1990, 55, 2552-2554. Использование указанного комплексообразователя также может привести к улучшенному соотношению цис/транс с преимущественным образованием транс-изомера. Также подходящим может быть использование водорода в качестве восстановителя в сочетании с подходящим катали- 13009078 затором, таким как, например палладий-на-угле или платина-на-угле. В случае использования водорода в качестве восстановителя может оказаться подходящим добавление к реакционной смеси дегидратирующего агента, такого как, например, трет-бутоксид алюминия. Для того чтобы предотвратить также нежелательное гидрирование некоторых функциональных групп в реагентах и продуктах реакции, также может быть выгодно добавление к реакционной смеси соответствующего каталитического яда, например тиофена или хинолин-серы. Перемешивание и, необязательно, повышенные температуры и/или давление могут увеличить скорость реакции В данном и последующих способах получения продукты реакции можно выделить из реакционной среды и при необходимости дополнительно очистить методами, известными в технике, такими как, например экстракция, кристаллизация, тритурирование и хроматография. Особенно выгодным является способ получения конечного соединения формулы (I) согласно ранее указанной схеме реакций, когда группа Alk-Y-Alk-L представляет собой бензил, причем таким образом получают соединение формулы (I), в котором группа Alk-Y-Alk-L представляет собой бензил. Указанное конечное соединение является фармакологически активным и может быть превращено в конечное соединение по изобретению, в котором группа Alk-Y-Alk-L представляет собой водород, восстановительным гидрированием с использованием, например, водорода в качестве восстановителя в сочетании с подходящим катализатором, таким как, например палладий-на-угле или платина-на-угле. Затем полученное конечное соединение по изобретению можно превратить в другое соединение формулы (I) путем превращений, известных в технике, например ацилированием и алкилированием. В частности, конечные соединения формулы (Iа) можно получить взаимодействием конечного соединения формулы (I') с промежуточным соединением формулы (V), где W1 представляет собой соответствующую удаляемую группу, например метансульфонилокси или бензолсульфонилокси. Взаимодействие можно осуществить в инертном растворителе, таком как, например хлорированный углеводород,например дихлорметан, или кетон, например метилизобутилкетон, и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может увеличить скорость реакции. Реакцию можно осуществить подходящим образом при температуре в интервале от комнатной температуры до температуры образования флегмы С другой стороны, конечные соединения формулы (Iа) также можно получить взаимодействием конечного соединения формулы (I') с карбоновой кислотой формулы (VI). Взаимодействие можно осуществить в инертном растворителе, таком как, например хлорированный углеводород, например дихлорметан, в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин, и в присутствии активатора, такого как, например, DCC (дициклогексилкарбодиимид), CDI (карбонилдиимидазол) и EDCI (гидрохлорид 1-(3-диметиламинопропил)-3 этилкарбодиимида). Перемешивание может увеличить скорость реакции. Реакцию можно осуществить подходящим образом при температуре в интервале от комнатной температуры до температуры образования флегмы В частности, конечные соединения формулы (Ib) можно получить взаимодействием конечного соединения формулы (I') с соединением формулы (VII), где W2 представляет собой соответствующую удаляемую группу, такую как, например галоген, например хлор или бром, или удаляемую сульфонилоксигруппу, например метансульфонилокси или бензолсульфонилокси. Взаимодействие можно осуществить в инертном растворителе, таком как, например хлорированный углеводород, например дихлорметан, спирт, например этанол, или кетон, например метилизобутилкетон,и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия- 14009078 или триэтиламин. Перемешивание может увеличить скорость реакции. Реакцию можно осуществить подходящим образом при температуре в интервале от комнатной температуры до температуры образования флегмы Конечные соединения формулы (Ic) или формулы (Id) можно получить или алкилированием, или восстановительным аминированием конечного соединения формулы (I') соединением формулы (VIII) или (IX), где W3 в формуле (VIII) представляет собой соответстующую удаляемую группу, такую как,например галоген, например хлор или бром, или удаляемую сульфонилоксигруппу, например метансульфонилокси или бензолсульфонилокси, и где Alk в формуле (Id) имеет значение -CH2-Alk. Взаимодействие можно осуществить в инертном растворителе, таком как, например хлорированный углеводород,например дихлорметан, спирт, например этанол, или кетон, например метилизобутилкетон, и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может увеличить скорость реакции. Реакцию можно осуществить подходящим образом при температуре в интервале от комнатной температуры до температуры образования флегмы Исходные вещества и некоторые промежуточные соединения являются известными соединениями и коммерчески доступны или их можно получить подходящими процедурами, как правило, известными в технике. Например, промежуточные соединения формулы (II) можно получить восстановительным Nалкилированием промежуточного соединения формулы (XI) промежуточным соединением формулы(XII), в котором W4 представляет собой бензильный радикал, после чего полученное соединение затем восстанавливают и получают промежуточное соединение формулы (II). Указанное восстановительное Nалкилирование можно осуществить в инертном растворителе, таком как, например хлорированный углеводород, например дихлорметан, этанол, толуол или их смесь, и в присутствии подходящего восстановителя, например борогидрида, например борогидрида натрия, цианоборогидрида или триацетоксиборогидрида натрия. В случае использования борогидрида в качестве восстановителя может быть удобным использование комплексообразователя, такого как, например, изопропилат титана(IV), как описано вJ. Org. Chem., 1990, 55, 2552-2554. Использование указанного комплексообразователя также может привести к улучшенному соотношению цис/транс с преимущественным образованием транс-изомера. Также подходящим может быть использование водорода в качестве восстановителя в сочетании с подходящим катализатором, таким как,например палладий-на-угле или платина-на-угле. В случае использования водорода в качестве восстановителя может быть выгодным добавление к реакционной смеси дегидратирующего агента, такого как,например, трет-бутоксид алюминия. Для того чтобы предотвратить также нежелательное гидрирование некоторых функциональных групп в реагентах и продуктах реакции, также может быть выгодно добавление к реакционной смеси соответствующего каталитического яда, например тиофена или хинолинсеры. Перемешивание и необязательно повышенные температуры и/или давление могут увеличить скорость реакции Получение промежуточных соединение (XI) и (XII) и других промежуточных соединений описывается в WO 97/16440-A1, опубликованной 9 мая 1997 г., Janssen Pharmaceutica N.V., включенной в данное описание в качестве ссылки, а также в других публикациях, указанных в WO 97/16440-А 1, таких как,например, ЕР-0532456-А. Приведенные далее примеры предназначаются для пояснения, но не для ограничения объема настоящего изобретения. Экспериментальная часть. Далее в настоящем описании"RT" обозначает комнатную температуру,"ТГФ" обозначает тетрагидрофуран,"DIPE" обозначает диизопропиловый эфир,"ДМФА" обозначает N,N-диметилформамид. А. Получение промежуточных соединений. Пример А 1. а. Получение промежуточного соединения 1 К смеси 7-(фенилметил)-1,4-диокса-8-азаспиро[4,5]декана (0,5 моль) в толуоле (1500 мл) при перемешивании добавляют Et3N (0,55 моль). Добавляют в течение 1 ч (реакция экзотермическая) 3,5-бис(трифторметил)бензоилхлорид (0,5 моль). Смесь перемешивают при комнатной температуре в течение 2 ч, оставляют стоять в течение уикенда и три раза промывают водой (500 мл, 2250 мл). Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Выход 245 г (100%). Часть полученной фракции кристаллизуют из петролейного эфира. Выпавшее в осадок вещество отфильтровывают и сушат. Получают 1,06 г промежуточного соединения 1.b1. Получение промежуточного соединения 2 К смеси промежуточного соединения 1 (0,5 моль) в этаноле (300 мл) и H2O (300 мл) добавляют НСl,cp (300 мл). Реакционную смесь перемешивают при 60 С в течение 20 ч. Выпавшее в осадок вещество отфильтровывают, измельчают, перемешивают с H2O, отфильтровывают, промывают петролейным эфиром и сушат. Получают 192 г промежуточного соединения 2 +-)-1-[3,5-бис-(трифторметил)бензоил]-2(фенилметил)-4-пиперидинона) (89,4%) (смесь R- и S-энантиомеров).b2. Получение промежуточного соединения 10 и промежуточного соединения 11 Промежуточное соединение 2 расщепляют на его оптические изомеры хиральной колоночной хроматографией на Chiralpak (CHIRALPAK AS 1000 , 20 мм (DAICEL); элюент гексан/2-пропанол, 70/30). Собирают две фракции продукта и из каждой выпаривают растворитель. Получают фракцию 1 - 32,6 г промежуточного соединения 10 (R) и фракцию 2 - 30,4 г промежуточного соединения 11 (S).- 16009078 с. Получение промежуточного соединения 3. Смесь промежуточного соединения 10 (0,046 моль), 1-(фенилметил)пиперазина (0,051 моль) и изопропоксида Ti (0,056 моль) перемешивают в течение 2 ч при 40 С. Реакционную смесь охлаждают до комнатной температуры. Добавляют этанол, p.a. (350 мл). Добавляют NaBH4 (0,138 моль). Полученную реакционную смесь перемешивают в течение 1 ч при комнатной температуре и в течение 1 ч при 50 С. Затем добавляют еще NaBH4 (5,2 г) и реакционную смесь перемешивают в течение 2 ч при 50 С. Снова добавляют NaBH4 и реакционную смесь перемешивают в течение ночи при комнатной температуре и в течение 2 ч при 50 С. Добавляют воду (10 мл). Смесь перемешивают в течение 15 мин. ДобавляютCH2Cl2 (200 мл) и смесь перемешивают в течение 15 мин. Органическую фазу отделяют, сушат (MgSO4),добавляют дикалит, смесь фильтруют через дикалит и фильтрат упаривают. Полученную фракцию разделяют на (цис) и (транс) колоночной хроматографией на силикагеле. Нужные (транс)фракции собирают, выпаривают растворитель и получают 14,8 г остатка I), 1,06% (цис и 4,9 г остатка II),6% (цис. Расщепление и очистку полученных (транс)фракций (в целом 20 г) осуществляют хроматографией на неподвижной фазе Chiracel OD (1900 г) на насадке Prochrom LC11035 (элюент гексан/этанол, 90/10). Нужные фракции собирают и растворитель выпаривают. Получают 9,5 г промежуточного соединения 3 (2R-транс)-1-[3,5-бис-(трифторметил)бензоил]-2-(фенилметил)-4-[4-(фенилметил)1-пиперазинил]пиперидина. Нет необходимости говорить, что такое же взаимодействие можно осуществить для соединения 11 для получения S-изомера, а также любой их смеси. Также нет необходимости говорить, что можно использовать цис-изомер во всех реакциях, приведенных в данном изобретении в качестве примеров для транс-изомера или для смеси цис- и транс-изомеров. d. Получение промежуточного соединения 4 Смесь промежуточного соединения 3 (0,288 моль) и метанола (700 мл) гидрируют при 40 С с Pd/C,10% (5 г), в качестве катализатора. После поглощения H2 (1 экв.) катализатор отфильтровывают и фильтрат упаривают. Получают 141,2 г промежуточного соединения 4 (+)-(2R-транс)-1-[3,5-бис(трифторметил)бензоил]-2-(фенилметил)-4-(1-пиперазинил)пиперидина. Пример А 2. а. Получение промежуточного соединения 5 Смесь конечного соединения 1 (полученного согласно b1 а) (0,03 моль) в изо-PrOH (150 мл) и KOH(0,3 мл) перемешивают и кипятят с обратным холодильником в течение 18 ч. Растворитель выпаривают и остаток растворяют в CH2Cl2/H2O. Слои разделяют. Органический слой сушат и фильтруют. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2Cl2/(МеОН/NH3), 95/5-90/10). Фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Получают 12 г промежуточного соединения 5.b. Получение промежуточного соединения 6 Смесь промежуточного соединения 5 (0,029 моль) и эфира бис-(1,1-диметилэтил)дикарбоновой кислоты (0,035 моль) перемешивают в течение 18 ч при комнатной температуре. Растворитель выпаривают в течение 30 мин при 50-60 С. Остаток растворяют в CH2Cl2/H2O и NaOH. Органический слой отделяют,промывают водой, сушат и выпаривают растворитель. Остаток суспендируют в толуоле и выпаривают растворитель. Получают 15,5 г промежуточного соединения 6. с. Получение промежуточного соединения 7. Перемешивают смесь промежуточного соединения 6 (0,03 моль), Pd/C, 10% (2 г) и Н 2 (1 экв.) в метаноле (250 мл). После поглощения H2 (1 экв.) катализатор отфильтровывают и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование,CH2Cl2/(МеОН/NH3), 90/10-85/15). Фракции, содержащие продукт реакции, собирают, суспендируют в петролейном эфире, отфильтровывают и сушат. Получают 11,6 г промежуточного соединения 7.d. Получение промежуточного соединения 8 Смесь 3-фуранилкарбоновой кислоты (0,033 моль) в СН 2 Сl2 (100 мл) и 1,1'-карбонил-бис-1 Нимидазола (0,033 моль) перемешивают в течение 3 ч при комнатной температуре. Добавляют промежуточное соединение 7 (0,027 моль) в CH2Cl2 (100 мл) и перемешивают в течение ночи при комнатной температуре. Реакционную смесь промывают водным раствором NaOH и H2O, сушат и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование,CH2 Сl2/МеОН, 98/2-90/10). Фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Остаток кристаллизуют из DIPE. Твердое вещество сушат. Получают 7,83 г промежуточного соединения 8. с. Получение промежуточного соединения 9 К смеси промежуточного соединения 8 (1 г) и изо-PrОН (30 мл) добавляют изо-PrOH.HCl (3 мл). Смесь перемешивают при 65 С в течение 90 мин. Растворитель выпаривают. Остаток суспендируют вDIPE. Выпавшее в осадок вещество отфильтровывают и промывают DIPE. Получают 0,93 г промежуточного соединения 9 (НСl).- 18009078 Пример A3. а. Получение промежуточного соединения 12(50 мл) перемешивают при комнатной температуре в токе N2. При температуре менее 10 С добавляют по каплям этиловый эфир хлоруксусной кислоты (0,03 мл). Перемешивание продолжают в течение ночи. Добавляют воду и реакционную смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток очищают на силикагеле на стеклянном фильтре (элюент CH2Cl2/CH3OH, 98/2). Чистые фракции собирают и выпаривают растворитель. Получают 2 г промежуточного соединения 12 (42%).b. Получение промежуточного соединения 13 Смесь промежуточного соединения 12 (0,0084 моль) и 2-пропанона (30 мл) перемешивают при охлаждении на ледяной бане. При комнатной температуре добавляют по каплям избыток реагента Джонса(полученного согласно способу, описанному ниже). Реакционную смесь все время перемешивают. Добавляют воду (50 мл) и полученную смесь подщелачивают K2 СО 3. Полученную смесь упаривают. Остаток перемешивают с СН 3 ОН. Соли удаляют фильтрацией через дикалит. Фильтрат упаривают. Остаток перемешивают с CH2Cl2. Органический слой декантируют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают на силикагеле на стеклянном фильтре (элюент CH2Cl2/CH3OH, 95/5). Чистые фракции собирают и выпаривают растворитель. Остаток (0,56 г) перемешивают с DIPE, отфильтровывают и сушат. Получают 0,32 г промежуточного соединения 13 (25%). Получение реагента Джонса. CrO3 (26,72 г) растворяют в H2O (50 мл). При охлаждении добавляют по каплям H2SO4 (98%; 23 мл). Добавляют воду до получения общего объема 100 мл. с. Получение промежуточного соединения 14 Смесь промежуточного соединения 13 (0,0176 моль) в H2O (10 мл) и НОАс (3 мл) перемешивают при 50 С. Добавляют по частям в течение 5 мин NaNO2 (1,35 г) и смесь перемешивают при 50 С в течение 1 ч. Смесь охлаждают на ледяной бане и отфильтровывают. Выпавшее в осадок вещество промывают ледяной водой и сушат в эксикаторе. Получают 1,25 г промежуточного соединения 14 (35,8%).d. Получение промежуточного соединения 15 Смесь промежуточного соединения 14 (0,045 моль) в НОАс (90 мл) и уксусного ангидрида (9 мл) перемешивают на масляной бане при 85 С. Добавляют по каплям в течение 30 мин ацетилхлорид(13,7 мл) и смесь перемешивают при 85 С в течение 1 ч. Смесь охлаждают, выливают в смесь лед/K2CO3 и экстрагируют СНСl3. Органический слой сушат и упаривают. Остаток кипятят в CH3CN и охлаждают. Выпавшее в осадок вещество отфильтровывают и сушат. Получают 14,32 г промежуточного соединения 15 (47,3%). Пример А 4. а. Получение промежуточного соединения 16- 19009078 К раствору 3-тиофенэтанола (0,078 моль) в ТГФ при 5 С добавляют по частям NaH (0,086 моль). Смесь перемешивают в течение 1 ч при 5 С. Добавляют Bu4NI (0,001 моль) и (бромметил)бензол(0,080 моль). Смесь перемешивают при комнатной температуре в течение 3 ч, растворяют в H2O и экстрагируют AcOEt. Органический слой отделяют, сушат (MgSO4) и растворитель выпаривают. Концентрат 1 (18 г) очищают колоночной хроматографией на силикагеле (градиентное элюирование, циклогексан/AcOEt, 100/0-80/20). Чистые фракции собирают и выпаривают растворитель. Получают 9,9 г промежуточного соединения 16 (58%).b. Получение промежуточного соединения 17 К раствору промежуточного соединения 16 (0,023 моль) в ТГФ (50 мл) при -50 С в атмосфере N2 добавляют по частям BuLi [1,6 М] (0,025 моль). Температуру постепенно поднимают до 0 С. Смесь перемешивают при 0 С в течение 1 ч и охлаждают до -40 С. При -40 С добавляют раствор SO2Cl2(0,046 моль) в пентане (50 мл). Смесь перемешивают при -40 С в течение 1 ч. Концентрат гидролизуют,экстрагируют AcOEt, экстракт промывают насыщенным раствором NaCl, сушат над MgSO4, концентрируют и получают 9 г. Концентрат очищают колоночной хроматографией на силикагеле (градиентное элюирование, циклогексан/AcOEt, 100/0-80/20). Получают 1,2 г промежуточного соединения 17 (16%). Пример А 5. а. Получение промежуточного соединения 18 К раствору 2-(2-тиенил)этанола (0,078 моль, 10 г) в ТГФ (150 мл) при 5 С в токе N2 добавляют по частям NaH (60% в масле) (0,086 моль, 3,4 г). Смесь перемешивают при 5 С в течение 1 ч. К раствору последовательно добавляют йодид тетрабутиламмония (0,001 моль, 0,3 г) и (бромметил)бензол(0,080 моль, 9,5 мл). Смесь перемешивают при комнатной температуре в течение 3 ч, выливают в воду,экстрагируют этилацетатом, экстракт сушат над MgSO4 и концентрируют. Сырой продукт реакции (18 г) очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2 Сl2/циклогексан,0/100-20/80) и фракции, содержащие продукт реакции, концентрируют. Получают 11,4 г (66%) промежуточного соединения 18b. Получение промежуточного соединения 19 К раствору промежуточного соединения 18 (0,014 моль, 3 г) в ТГФ (30 мл) при -40 С в токе N2 добавляют по частям н-BuLi (1,6 М) (0,015 моль, 9,45 мл). Реакционную смесь постепенно нагревают до 0 С и охлаждают до -70 С. Добавляют сухой лед (2 г). Температуру постепенно повышают до комнатной. Добавляют NaOH (1 моль на 1 л, 30 мл) и смесь промывают диэтиловым эфиром. Водный слой подкисляют НСl (1 N) и экстрагируют CH2Cl2. Органический слой сушат над MgSO4, концентрируют и получают 2,6 г (71%) промежуточного соединения 19. Пример А 6. а. Получение промежуточного соединения 20 Смесь этилового эфира 2-[(3,4-дихлорфенил)метил]-4-оксо-1-пиперидинкарбоновой кислоты(0,3 моль), 1,2-этандиола (1,5 моль) и 4-метилбензолсульфоновой кислоты (2 г) в толуоле (750 мл) перемешивают и кипятят с обратным холодильником в течение 68 ч с использованием водоотделителя. Растворитель выпаривают. Остаток обрабатывают водой и толуолом. Органический слой отделяют, промывают водой, сушат, фильтруют и выпаривают растворитель. Получают 113,5 г промежуточного соединения 20.b. Получение промежуточного соединения 21 Смесь промежуточного соединения 20 (0,1 моль) и KOH (0,9 моль) в 2-пропаноле (500 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают. Остаток растворяют в CH2Cl2 и промывают небольшим количеством H2O. Органический слой сушат, фильтруют и выпаривают растворитель. Получают 33 г промежуточного соединения 21. с. Получение промежуточного соединения 22 Промежуточное соединение 21 (0,139 моль) растворяют в CH2Cl2 (420 мл). Добавляют по каплям 3,5-бис-(трифторметил)бензоилхлорид (0,15 моль) (реакция экзотермическая). Добавляют Et3N (30 мл). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Реакционную смесь промывают раствором основания NaOH, сушат, фильтруют и выпаривают растворитель. Остаток очищают на силикагеле на стеклянном фильтре (градиентное элюирование, CH2Cl2/CH3OH, от 100/0 до 95/5). Фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Остаток кристаллизуют из DIPE, отфильтровывают и сушат. Получают 56,3 г фракции 1. Фильтрат упаривают. Остаток суспендируют в петролейном эфире, отфильтровывают и сушат. Получают 9 г фракции 2. Все полученное вещество (65,3 г) указанных фракций разделяют и очищают хиральной колоночной хроматографией (насадка AD, элюент гептан/этанол, 95/5). Собирают две группы фракций с продуктом реакции и выпаривают из них растворитель. Каждый остаток кристаллизуют из DIPE, отфильтровывают и сушат. Получают 23,9 г промежуточного соединения 22 (оптически чистого).d. Получение промежуточного соединения 23 Смесь промежуточного соединения 22 (0,0424 моль) и HCl (6 N) (230 мл) перемешивают и кипятят с обратным холодильником в течение 4 ч. Реакционную смесь перемешивают в течение ночи и экстрагируют CH2Cl2. Органический слой отделяют, промывают водой, сушат и выпаривают растворитель. Получают 20 г промежуточного соединения 23 (S-изомер). Пример А 7. а. Получение промежуточных соединений 24, 25 и 26(0,2 моль) и 1-(фенилметил)пиперазина (0,2 моль) в метаноле (250 мл) перемешивают и гидрируют при 50 С с Pd/C,10% (3 г), в качестве катализатора в присутствии раствора тиофена (3 мл). После поглощения H2 (1 экв.) катализатор отфильтровывают и фильтрат упаривают. Получают промежуточное соединение 24 (рацемическая смесь). Фракцию разделяют и очищают колоночной хроматографией (DAICEL; набивка AD,2000 г, 750 мл/мин; элюент гептан/этанол/метанол, 90/5/5). Собирают две группы фракций, содержащих продукт реакции, и выпаривают из них растворитель. Получают 30 г промежуточного соединения 25 (Sизомер) (ее 99%) и 26 г промежуточного соединения 26 (R-изомер) (ее 99%).b. Получение промежуточного соединения 27 Смесь промежуточного соединения 26 (0,078 моль) в метаноле (250 мл) гидрируют при комнатной температуре с Pd/C, 10% (2 г), в качестве катализатора. После поглощения H2 (1 экв.) катализатор отфильтровывают и фильтрат упаривают. Остаток растворяют в CH2Cl2 и промывают H2O. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Получают 16,3 г промежуточного соединения 27 (82%) (R-изомер). с. Получение промежуточного соединения 28. Раствор промежуточного соединения 27 (0,02 моль) в небольшом количестве CH2Cl2 добавляют к 3-фенил-1-(фенилметил)-4-пиперидинону (0,02 моль), смесь перемешивают, добавляют толуол и реакционную смесь упаривают. К оставшемуся маслу добавляют тетракис(2-пропанолато)титан (0,025 моль) и смесь перемешивают в течение 3 ч при 50 С, добавляют EtOH, p.a. (30 мл) и полученную смесь перемешивают в течение 15 мин при комнатной температуре. Наконец, добавляют NaBH3CN (0,04 моль) и реакционную смесь перемешивают в течение 20 ч при комнатной температуре. Смесь промывают раствором основания NaOH и добавляют CH2Cl2. Полученную смесь перемешивают в течение 15 мин и после добавления дикалита смесь фильтруют через дикалит. Органический слой отделяют, сушат (MgSO4),фильтруют и выпаривают растворитель. Остаток очищают на силикагеле на стеклянном фильтре (градиентное элюирование, CH2Cl2/CH3OH, 100/0-90/10). Фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Получают 6,4 г промежуточного соединения 28.d. Получение промежуточного соединения 29. Смесь промежуточного соединения 28 (0,13 моль) в СН 3 ОН (150 мл) гидрируют при 50 С с Pd/C,10% (2 г), в качестве катализатора. После поглощения H2 (1 экв.) катализатор отфильтровывают и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование,СН 2Cl2/ (CH3OH/NH3) , 100/0-80/20). Фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Получают 2 г промежуточного соединения 29. Пример А 8. а. Получение промежуточного соединения 30 Промежуточное соединение 30 получают тем же способом, какой описан в А 7b, но вместо промежуточного соединения 26 используют промежуточное соединение 25. В. Получение конечных соединений. Пример В 1. а) Получение конечного соединения 1(2 мл). После поглощения H2 (1 экв.) катализатор отфильтровывают и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, СН 2 Сl2/МеОН, 100/0; 99/1; 98/2; 96/4). Нужные фракции собирают и выпаривают растворитель. Полученную фракцию перекристаллизовывают из DIPE. Выпавшее в осадок вещество отфильтровывают, промывают DIPE и сушатb) Получение конечного соединения 2(вакуум; 50 С; 3 суток). Получают 11,58 г (92%) конечного соединения 2. Пример В 2. Получение конечного соединения 3. Смесь конечного соединения 2 (0,0016 моль), бензоилхлорида (0,0018 моль) и Et3N (0,0018 моль) вCH2Cl2 (50 мл) перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь промывают водн. разбавленным раствором NaOH. Отделенный органический слой сушат (MgSO4), фильтруют и выпаривают растворитель. Фракцию очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2 Сl2/МеОН, 100/0-90/10). Нужные фракции собирают и выпаривают растворитель. Остаток сушат (вакуум; 50 С). Получают 0,410 г конечного соединения 3. Пример В 3. Получение конечного соединения 80 Смесь конечного соединения 2 (0,0017 моль) и метилакрилата (0,0019 моль) в метаноле (50 мл) перемешивают в течение ночи при комнатной температуре. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2 Сl2/МеОН, 100/0-90/10). Нужные фракции собирают и выпаривают растворитель. Остаток сушат (вакуум; 50 С). Получают 0,266 г конечного соединения 80. Пример В 4. Получение конечного соединения 5 Смесь конечного соединения 2 (0,003 моль), 2-хлорпиримидина (0,0033 моль) и Na2CO3(0,004 моль) в этаноле, p.a. (50 мл), перемешивают и кипятят с обратным холодильником в течение 8 ч. Растворитель выпаривают и остаток растворяют в H2O/CH2Cl2. Слои разделяют, водный слой экстрагируют CH2Cl2 и органический слой промывают H2O, сушат (MgSO4) и фильтруют. Выпаривают растворитель и остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование,- 23009078CH2Cl2/CH3OH, от 100/0 до 90/10). Фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Получают 1,378 г конечного соединения 5. Пример В 5. Получение конечного соединения 79 Смесь конечного соединения 2 (0,002 моль), 3,5-диметилизоксазол-4-сульфонилхлорида(0,002 моль), Na2CO3 (0,005 моль) и CH2Cl2 (50 мл) перемешивают при комнатной температуре в течение ночи. Реакционную смесь очищают колоночной хроматографией на силикагеле (элюент CH2 Сl2/МеОН,95/5). Нужные фракции собирают и выпаривают растворитель. Остаток сушат при 50 С. Получают 0,98 г конечного соединения 79. Пример В 6. Получение конечного соединения 81 Смесь промежуточного соединения 9 (полученного согласно А 2 е) (0,0005 моль) в СН 2 Сl2 (25 мл),3,4,5-триметоксибензоилхлорида (0,0006 моль) и Et3N (1 мл) перемешивают в течение 3 ч. Реакционную смесь промывают разбавленным раствором NaOH в течение 30 мин, промывают H2O, сушат и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2 Сl2/МеОН, 98/2; 90/10). Нужные фракции собирают и выпаривают растворитель. Получают 0,114 г конечного соединения 81. Пример В 7. Получение конечного соединения 104(0,01 моль) и смесь перемешивают в течение 18 ч при комнатной температуре. Реакционную смесь промывают водным раствором Na2CO3. Органический слой отделяют, сушат и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2 Сl2/МеОН, 100/0-90/10). Нужные фракции собирают и выпаривают растворитель. Получают 6 г конечного соединения 104. Пример В 8. Получение конечного соединения 108- 24009078 Смесь конечного соединения 104 (полученного согласно В 7) (0,001 моль) и пирролидина (0,5 г) перемешивают в течение ночи при температуре бани 85 С. Избыток пирролидина выпаривают. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2 Сl2/МеОН,100/0-80/20). Нужные фракции собирают и выпаривают растворитель. Получают 0,194 г конечного соединения 108. Пример В 9. Получение конечного соединения 109 Конечное соединение 104 (полученное согласно В 7) (0,001 моль) растворяют в метаноле (5 мл). Добавляют NaOCH3 (0,002 моль) и смесь перемешивают и кипятят с обратным холодильником в течение 48 ч. После 24 ч перемешивания и кипячения добавляют еще NaOCH3 (0,002 моль). Реакционную смесь упаривают. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование,CH2 Сl2/МеОН, 100/0-90/10). Нужные фракции собирают и выпаривают растворитель. Получают 0,310 г конечного соединения 109. Пример В 10. Получение конечного соединения 110 К 2-метилимидазолу (0,002 моль) в ДМФА (10 мл) добавляют NaH (0,002 моль). К смеси добавляют конечное соединение 104 (полученное согласно В 7) (0,001 моль), разведенное в ДМФА (5 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. Смесь перемешивают в течение 18 ч при температуре 100 С. Растворитель выпаривают. Остаток растворяют в H2O/CH2Cl2. Органический слой отделяют, сушат и упаривают. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2 Сl2/МеОН, 100/0-80/20). Нужные фракции собирают и выпаривают растворитель. Остаток суспендируют в петролейном эфире, отфильтровывают и сушат. Получают 0,190 г конечного соединения 110. Пример В 11. а. Получение конечного соединения 230 К раствору конечного соединения 2 (полученного согласно B1b) (0,01 моль) в CH2Cl2 (70 мл) добавляют хлорацетилхлорид (0,01 моль), добавляют Et3N (3 мл) и реакционную смесь перемешивают в течение 4 ч при комнатной температуре. Смесь промывают раствором основания NaOH, сушат и выпаривают растворитель (35 С). Добавляют DIPE и снова выпаривают растворитель. Получают 5 г конечного соединения 230 (77,5%).b. Получение конечного соединения 196(1 мл) и реакционную смесь перемешивают в течение 2 ч при 60 С, выпаривают растворитель и остаток очищают колоночной хроматографией (градиентное элюирование, СН 2 Сl2/(CH3OH/NH3), 100/0-90/10). Фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Получают 0,257 г конечного соединения 196. Пример В 12. Получение конечного соединения 209. К раствору 2-метилимидазола (0,001 моль) в ДМФА (20 мл) добавляют NaH (0,001 моль) и полученную смесь перемешивают в течение 1 ч и нагревают до 40 С. Добавляют конечное соединение 230(полученное согласно B11a) (0,001 моль) и реакционную смесь перемешивают в течение 18 ч при 50 С. Растворитель выпаривают досуха и остаток растворяют в CH2Cl2/H2O. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией(градиентное элюирование, CH2Cl2/CH3OH, 100/0-85/15). Фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Получают 0,305 г конечного соединения 209. Пример В 13. Получение конечного соединения 207 Конечное соединение 230 (полученное согласно B11a) (0,001 моль) и Na2CO3 (0,5 г) добавляют к смеси 2-аминобензолметанола (0,001 моль) и ДМФА (20 мл) и реакционную смесь перемешивают в течение 18 ч при 50 С. Растворитель выпаривают досуха и остаток растворяют в CH2Cl2/H2O. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией (градиентное элюирование, СН 2 Сl2/СН 3 ОН, 100/0-85/15). Нужные фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Получают 0,343 г конечного соединения 207. Пример В 14. а. Получение конечного соединения 206 К раствору эфира 1-(1,1-диметилэтил)-1,2-пиперидиндикарбоновой кислоты (0,004 моль) в CH2Cl2,p.a. (50 мл), добавляют 1-гидрокси-1 Н-бензотриазол (0,004 моль) и Et3N (0,004 моль) и смесь перемешивают при комнатной температуре. Добавляют N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамин(0,004 моль) и реакционную смесь перемешивают в течение 10 мин при комнатной температуре. Добавляют смесь конечного соединения 2 (полученного согласно B1b) (0,003 моль) и CH2Cl2, p.a. (20 мл) и реакционную смесь перемешивают в течение ночи при комнатной температуре. Смесь промываютH2O/NaHCO3 и H2O. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование,- 26009078b. Получение конечного соединения 294 К раствору конечного соединения 206 (полученного согласно В 14 а) (0,0017 моль) в 2-пропаноле(30 мл) добавляют 2-пропанол/HCl (3 мл) и реакционную смесь перемешивают и кипятят с обратным холодильником в течение 2 ч. Растворитель выпаривают и остаток суспендируют в DIPE. Полученное выпавшее в осадок вещество отфильтровывают, растворяют в H2O и промывают DIPE. Водный слой подщелачивают и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Получают 1,0 г конечного соединения 294. с. Получение конечного соединения 295 К раствору конечного соединения 294 (полученного согласно В 14b) (0,0004 моль) в CH2Cl2, p.a.(15 мл) добавляют 2-хлорбензоилхлорид (0,0004 моль), добавляют Na2CO3 (0,3 г) и реакционную смесь перемешивают в течение ночи. Сырую смесь фильтруют через силикагель (градиентное элюирование,CH2Cl2/CH3OH, 100/0-90/10). Фракции, содержащие продукт реакции, собирают, выпаривают растворитель и остаток сушат. Получают 0,250 г конечного соединения 295. Пример В 15. Получение конечного соединения 167 К раствору конечного соединения 2 (полученного согласно B1b) в CH2Cl2 (25 мл) добавляют 2,2-диметилпропаноилхлорид (0,001 моль) и Na2CO3 (0,5 г) и реакционную смесь перемешивают в течение 2 ч. Смесь фильтруют через стеклянный фильтр (градиентное элюирование, CH2Cl2/CH3OH, 100/090/10). Фракции, содержащие продукт реакции, собирают, выпаривают растворитель и остаток сушат. Получают 0,448 г конечного соединения 167. Пример В 16. а. Получение конечного соединения 216 К тетрагидро-3-фуранкарбоновой кислоте (0,0012 моль) добавляют CH2Cl2 (50 мл) и 1,1'-карбонил-бис-1 Н-имидазол (0,0012 моль). Смесь перемешивают в течение 45 мин при 40 С и в течение 3 ч при комнатной температуре. Добавляют конечное соединение 2 (0,001 моль) и реакционную смесь перемешивают в течение ночи при комнатной температуре. Смесь промывают раствором основания NaOH, органический слой отделяют, промывают H2O, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией (градиентное элюирование,CH2Cl2/CH3OH, 100/0-80/20). Фракции, содержащие продукт реакции, собирают, выпаривают растворитель и остаток сушат. Получают 0,480 г конечного соединения 216.b. Получение конечного соединения 195 2-Цианобензойную кислоту (0,001 моль) растворяют в CH2Cl2 (30 мл) и добавляют 1,1'-карбонил-бис-1 Н-имидазол (0,001 моль). Полученную смесь перемешивают в течение 2 ч при 40 С и охлаждают до комнатной температуры. Добавляют конечное соединение 2 (полученное согласно B1b)(0,001 моль), реакционную смесь перемешивают в течение ночи при комнатной температуре и оставляют стоять в течение уикенда. Смесь промывают раствором основания NaOH, органический слой отделяют,сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток фильтруют через силикагель (градиентное элюирование, CH2Cl2/CH3OH, 100/0-90/10). Фракции, содержащие продукт реакции, собирают,выпаривают растворитель и остаток сушат. Получают 0,272 г конечного соединения 195. Пример В 17. Получение конечного соединения 203 К раствору конечного соединения 2 (полученного согласно B1b) (0,001 моль) в CH2Cl2 (15 мл) добавляют ангидрид трифторметанкарбоновый кислоты (0,001 моль) и Na2CO3 (0,5 г) и реакционную смесь перемешивают в течение 2 ч. Смесь фильтруют на стеклянном фильтре через силикагель (градиентное элюирование, CH2 Сl2/СН 3 ОН, 100/0-90/10). Фракции, содержащие продукт реакции, собирают, выпаривают растворитель и остаток сушат. Получают 0,276 г конечного соединения 203. Пример В 18. Получение конечного соединения 166 Смесь метилового эфира 4-[(ацетилокси)метил]-1,2,3-тиадиазол-5-карбоновой кислоты (0,002 моль) и конечного соединения 2 (полученного согласно B1b) (0,004 моль) в СН 3 ОН (25 мл) перемешивают в течение уикенда при комнатной температуре и реакционную смесь фильтруют через силикагель (градиентное элюирование, CH2Cl2/CH3OH, 100/0-90/10). Фракции, содержащие продукт реакции, собирают,выпаривают растворитель и остаток сушат. Получают 0,600 г конечного соединения 166. Пример В 19. Получение конечного соединения 375 Смесь конечного соединения 2 (полученного согласно B1b) (0,001 моль), промежуточного соединения 15 (полученного согласно A3d) (0,001 моль) и тетракис(2-пропанолато)титана (1 мл) в СН 3 ОН(0,1 мл). После поглощения H2 (1 экв.) катализатор отфильтровывают и фильтрат упаривают. Остаток растворяют в H2O/CH2Cl2, добавляют дикалит и полученную смесь фильтруют через дикалит. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией (градиентное элюирование, CH2Cl2/(CH3OH/NH3), 99/1-80/20). Фракции, содержащие продукт реакции, собирают, выпаривают растворитель и остаток сушат. Получают 0,017 г конечного соединения 375.- 28009078 Пример В 20. а. Получение конечного соединения 205 К раствору N-[(1,1-диметилэтокси)карбонил]-2-метиламина (0,004 моль) в CH2Cl2 (50 мл) добавляют 1-гидрокси-1 Н-бензотриазол (0,004 моль) и Et3N (0,004 моль), смесь перемешивают при комнатной температуре, добавляют N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамин (0,004 моль) и реакционную смесь перемешивают в течение 10 мин при комнатной температуре. Добавляют смесь конечного соединения 2 (полученного согласно B1b) (0,003 моль) и CH2Cl2 (20 мл) и реакционную смесь перемешивают в течение ночи при комнатной температуре. Смесь промывают H2O/NaHCO3 и H2O. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2Cl2/CH3OH, 100/0-80/20). Фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Получают 0,414 г конечного соединения 205.b. Получение конечного соединения 304 К раствору конечного соединения 205 (полученного согласно В 20 а) (0,0013 моль) в ДМФА, p.a.(25 мл), добавляют 50% NaH (0,0015 моль) и полученную смесь постепенно (35 мин) нагревают до 45 С. Добавляют СН 3I (0,0015 моль) и реакционную смесь перемешивают в течение 4 ч при 50 С и в течение ночи при комантной температуре. Растворитель выпаривают, остаток растворяют в H2O и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (над MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией (градиентное элюирование, CH2Cl2/CH3OH, 100/090/10). Фракции, содержащие продукт реакции, собирают, выпаривают растворитель и остаток сушат. Получают 0,47 г конечного соединения 304. с. Получение конечного соединения 309. К раствору конечного соединения 304 (полученного согласно В 20b) (0,00061 моль) в 2-пропаноле(20 мл) добавляют 2-пропанол/HCl (2 мл) и реакционную смесь перемешивают и кипятят с обратным холодильником в течение 90 мин. Выпаривают растворитель, остаток растворяют в H2O и промываютDIPE. Водный слой подщелачивают и экстрагируют CH2Cl2. Органический слой отделяют, сушатd. Получение конечного соединения 310 К раствору конечного соединения 309 (полученного согласно В 20c) (0,00048 моль) в СН 2 Сl2 (20 мл) добавляют циклопропанкарбонилхлорид (0,0005 моль), добавляют Na2CO3 (0,5 г) и реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Сырую смесь очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2Cl2/CH3OH, 100/0-90/10). Нужные фракции, содержащие продукт реакции, собирают, выпаривают растворитель и остаток сушат. Получают 0,080 г конечного соединения 310.- 29009078 Пример В 21. Получение конечного соединения 147(10 мл) и смесь перемешивают до получения раствора (I). Раствор (I) (10 мл) добавляют к (RS)-2,3(Novabiochem 01-64-0211) дигидро-1-Н-инден-1-карбоновой кислоте (0,000266 моль),(0,000531 моль; 1,90 ммоль/г) и 1-гидрокси-1 Н-бензотриазолу (0,000407 моль) и реакционную смесь перемешивают в течение 16 ч при комнатной температуре. Добавляют(PS-TsCl) (0,000266 моль; 1,97 ммоль/г) и смесь перемешивают в течение 16 ч при комнатной температуре. Поглотители отфильтровывают и фильтрат упаривают. Получают конечное соединение 147. Пример В 22. а. Получение конечного соединения 130 Смесь конечного соединения 2 (полученного согласно B1b) (0,002 моль) и CH2Cl2, p.a. (50 мл),перемешивают при комнатной температуре. Добавляют по каплям раствор эфира бис-(1,1-диметилэтил)дикарбоновой кислоты (0,002 моль) в CH2Cl2 и реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, CH2Cl2/CH3OH, от 100/0 до 90/10). Фракции,содержащие продукт реакции, собирают и выпаривают растворитель. Получают 1,039 г конечного соединения 130 (78%).b. Получение конечного соединения 150 и 151 Смесь промежуточного соединения 4 (полученного согласно A1d) (0,15 моль) и эфира 1,1-диметилэтил-1-пирролидинкарбоновой кислоты (0,165 моль) в СН 3 ОН (500 мл) гидрируют в течение ночи при 50 С с Pd/C, 10% (5 г), в качестве катализатора в присутствии тиофена (4 мл). После поглощения H2 (1 эквив.) катализатор отфильтровывают и фильтрат упаривают. Остаток кристаллизуют из DIPE,полученное выпавшее в осадок вещество отфильтровывают, получая твердое вещество S и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование,CH2Cl2/CH3OH, от 100/0 до 95/5). Фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Полученный остаток и твердый S объединяют. Полученную фракцию расщепляют на ее энантиомеры хиральным разделением (AD, элюент гексан/2-пропанол, 90/10). Две фракции, содержащие продукт реакции, собирают и выпаривают растворитель. Получают фракцию 1-46 г конечного соединения 150 ([2R-[2,4(S (46%) и фракцию 2-39 г конечного соединения 151 ([2R-[2,4(R (39%).
МПК / Метки
МПК: C07D 401/14, A61K 31/454, C07D 409/14, C07D 405/14, C07D 401/12, C07D 417/14, A61P 25/00
Метки: антагонистов, применение, замещенные, качестве, 1-пиперидин-4-ил-4-пирролидин-3-илпиперазина, нейрокининов, производные
Код ссылки
<a href="https://eas.patents.su/30-9078-zameshhennye-proizvodnye-1-piperidin-4-il-4-pirrolidin-3-ilpiperazina-i-ih-primenenie-v-kachestve-antagonistov-nejjrokininov.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные 1-пиперидин-4-ил-4-пирролидин-3-илпиперазина и их применение в качестве антагонистов нейрокининов</a>
Предыдущий патент: Индазоламиды с аналгетической активностью
Следующий патент: Жидкие составы фактор некроза опухоли – связывающих белков
Случайный патент: Аминотетрагидропираны в качестве ингибиторов дипептидилпептидазы-iv для лечения или предупреждения диабета


































